Исследование загрязнения почв на территории месторождения Кульдурских минеральных вод
МИНОБРНАУКИ
РОССИИ
Федеральное
государственное бюджетное образовательное учреждение
высшего
профессионального образования
«Приамурский
государственный университет имени Шолом-Алейхема»
Факультет
Таможенного дела и геосреды
Кафедра
Экологии и биологии
направление
022000.62 Экология и природопользования
КУРСОВАЯ
РАБОТА
на
тему «Исследование загрязнения почв на территории месторождения Кульдурских
минеральных вод»
студент(ка) 2 курса
Д.С. Борохова
г.
Биробиджан
год
Содержание
Введение
Глава 1. Общая характеристика почв и
их загрязнения (обзор литературы)
.1 Понятие и структура почвы
.2 Виды загрязнения почв
.3 Основные загрязнители почв и их
характеристика
.4. Источники загрязнения территории
пос. Кульдур
.5 Методы контроля основных
загрязнений почв
.6 Характеристики основных
загрязнителей почв
.6.1 Кислотность
.6.2 Нитраты
.6.3 Железо
.6.4 Кальций
Глава 2. Район исследования,
материалы и методики.
.1 Еврейская автономная область
.2 Облученский район
.3 Кульдур
.4 Материалы и методики
.4.1 Взятие почвенных образцов
.4.2 Подготовка почвы к анализу
.4.3 Почвенная вытяжка
.4.4 Определение железа
.4.4.1 Применение тест-комплекта
«Железо»
.4.5 Определение кальция
.4.5.1 Применение тест-комплекса
«Кальций»
.4.6 Определение потенциальной
кислотности
.4.7 Определение гидролитической
кислотности
.4.8 Определение нитратов
Глава 3. Результаты и их обсуждения
Заключение
Список литературы
Введение
В настоящее время проблема взаимодействия
человеческого общества с природой приобрела особую остроту.
Почвенный покров Земли представляет собой
важнейший компонент биосферы Земли. Именно почвенная оболочка определяет многие
процессы, происходящие в биосфере.
Почва - особое природное образование, обладающие
рядом свойств, присущих живой и неживой природе, сформировавшееся в результате
длительного преобразования поверхностных слоев литосферы под совместным
взаимообусловленным взаимодействием гидросферы, атмосферы, живых и мертвых
организмов.
Почвенный покров - важнейшее природное
образование. Его роль в жизни общества определяется тем, что почва представляет
собой источник продовольствия, обеспечивающий 95-97 % продовольственных
ресурсов для населения планеты.
Почвенный покров является естественной базой для
поселения людей, служит основой для создания рекреационных зон. Он позволяет
создать оптимальную экологическую обстановку для жизни, труда и отдыха людей.
От характера почвенного покрова, свойств почвы, протекающих в почвах химических
и биохимических процессов, зависят чистота и состав атмосферы, наземных и подземных
вод. Почвенный покров - один из наиболее мощных регуляторов химического состава
атмосферы и гидросферы. Почва была и остается главным условием жизнеобеспечения
наций и человечества в целом.
Площади земельных ресурсов мира составляет 129
млн. км2, или 86,5% площади суши. Под пашней и многолетними
насаждениями в составе сельскохозяйственных угодий занято около 15 млн. км2
(10% суши), под сенокосами и пастбищами - 37,4 млн. км2 (25%). Общая
площадь пахотнопригодных земель оценивается различными исследователями
по-разному: от 25 до 32 млн. км2.
Земельные ресурсы планеты позволяют обеспечивать
продуктами питания больше населения, чем имеется в настоящее время. Вместе с
тем, в связи с ростом населения, особенно в развивающихся странах, деградацией
почвенного покрова, загрязнения, эрозии и т.д.; а также вследствие отвода
земель под застройку городов, поселков и промышленных предприятий количество
пашни на душу населения резко сокращается.
Воздействие человека на почву - составная часть
общего влияния человеческого общества на земную кору и ее верхний слой, на
природу в целом, особенно возросшее в век научно-технической революции. При
этом не только усиливается взаимодействие человека с землей, но и меняются
основные черты взаимодействия. Проблема «почва - человек» осложняется
урбанизацией, все большим использованием земель, их ресурсов для
индустриального и жилищного строительства, ростом потребностей в продуктах
питания. По воле человека изменяется характер почвы, меняются факторы
почвообразования - рельеф, микроклимат, появляются новые реки и т.д.
(#"732421.files/image001.gif">
Рис 1. Кислотность различных бытовых веществ и
продуктов.
На кислотность почв (pH) может влиять множество
факторов. Их условно можно разделить на естественные (природные) и
антропогенные (т.е. деятельность человека). В областях, где климат довольно
влажный, часто идут дожди формируются почвы с кислой реакцией среды. В зонах с
сухим климатом почвы имеют более щелочную реакцию.
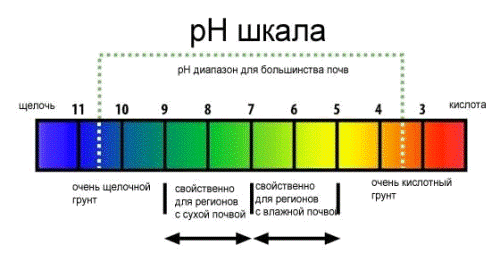
Рис. 2 Шкала кислотности почв. Фото
rastenievodstvo.info
Наиболее кислую реакцию имеют верховые болотные
почвы и подзолы (неокультуренные). Кислой реакцией почвенного раствора
характеризуются подзолистые и дерново-подзолистые почвы (рН 4-6). Нейтральной
реакцией обладают многие дерново-глеевые, выщелоченные, дерново-карбонатные
почвы (рН 6-7). Нейтральная реакция часто свойственна почвам центральной и
притеррасной пойм. Слабощелочная реакция (рН 7-8,2) наблюдается у
дерново-карбонатных, а также у низинных торфяных почв, если они заболочены
жесткими волами.
Баланс может смещаться под воздействием
человеческой деятельности. Например, при перемещении пластов почвы при
строительстве или при выравнивании участка, сильно подкисляют почву многие
минеральные удобрения (аммиачная селитра, хлористый калий и др.). При регулярном
внесении в почву больших доз физиологически кислых удобрений почвы так же
становятся более кислыми (#"732421.files/image003.gif">(1)
где:
Стест - концентрация железа по тесту,
мг;
Vпипетки
- объем пипетки, см3;
Vвытяжки
- объем кислотной вытяжки, см3;
m2
- масса стаканчика с почвой, г;
m1
- масса стаканчика, г;
(Коган, 2007).
.4.4.1 Применение тест-комплекта «Железо»
.Отберите в склянку анализируемую воду до метки
«10мл», предварительно ополоснув ее 2-3 раза той же водой.
Используя универсальную индикаторную бумагу и
пипетку-капельницу, а также, в зависимости от рН среды, растворы гидроксида
натрия либо соляной кислоты, доведите рН пробы до рН 4-5.
. В склянку пипеткой-капельницей добавьте 4-5
капель раствора солянокислого гидроксиламина (около 0,2 мл). Склянку закройте
пробкой и встряхните для перемешивания раствора.
. Раствор в склянке оставьте не менее чем на
15-20 минут для полного развития окраски.
. Проведите визуальное колориметрирование пробы.
.4.5 Определение кальция
Фильтрат водной вытяжки в количестве 3см3
наливают в пробирку, подкисляют 1-2 каплями 1 %-ной HCl
и добавляют 1-2см3 4 %-ного раствора оксалата натрия (или щавелевой
кислоты). В присутствии ионов калия протекает реакция:
Ca2++
C2O42-=
CaC2O4↓
По виду осадка оксалата кальция можно сделать
вывод о содержании ионов кальция в водной вытяжке почвы (Табл. 2.3.).
Таблица 2.3
Характеристика осадка оксалата кальция
|
осадок
|
Содержание
ионов Cl-
|
|
Мг/100
см3 вытяжки
|
г/100
г почвы, %
|
|
Большой
хлопьевидный Сильная муть опалесценция
|
˃10
5-10 1-0,1
|
Десятые
доли Сотые доли Тысячные доли
|
(Коган, 2007).
.4.5.1 Применение тест-комплекса «Кальций»
. Налейте анализируемую воду в склянку до метки
«10», предварительно ополоснув ее 2-3 раза анализируемую воду.
. Прибавьте пипеткой-капельницей к пробе по
каплям раствор соляной кислоты при перемешивании стеклянной палочкой до рН =
4-5. Величину рН контролируйте с помощью универсальной индикаторной бумаги.
. Прибавьте пипеткой-капельницей 13-14 капель
(около 0,5 мл) раствора гидроксида натрия и содержимое одной капсулы (0,02 г)
индикатора мурексина. Раствор перемешайте стеклянной палочкой.
. Проведите титрование раствором трилона Б с
помощью шприца и градуированной пипетки до перехода окраски в точке
эквивалентности из розово-оранжевой в сине-фиолетовую на белом фоне при
достаточной освещенности. Периодически встряхивайте склянку для перемешивания
пробы. Определите объем раствора трилона Б, израсходованный на титрование
кальция (Vmp).
. Рассчитайте концентрацию эквивалента кальция
(Сэк) в моль/л эквивалента и (Ск) в мг/л по уравнениям: Сэк=
Vmp
*5
и Ск = Vmp
*100,2
соответственно.
.4.6 Определение потенциальной кислотности
Реакция почвы оказывает большое влияние на
развитие растений и почвенных микроорганизмов, на скорость и направления
происходящих в ней биологических процессов. В природных условиях pHпочвенного
раствора колеблется от 3 (сфагмовых торфах) до 10 (в солонцовых почвах). Чаще
всего кислотность не выходит за пределы 4-8. В зависимости от значения pH
различают почвы по степени кислотности (Табл. 2.4).
Таблица 2.4
Зависимость кислотности почв от pH
|
№
п/п
|
pH
|
Степень
кислотности почв
|
|
1
2 3 4 5 6
|
˂4,5
4,5-5,0 5,1-5,5 5,6-6,0 6,1-7,0 ˃7,1
|
Сильнокислые
Среднекислые Слабокислые Близкие к нейтральным Нейтральные Щелочные
|
Различают два вида кислотности почв - активную и
потенциальную.
Активная кислотность обусловлена ионами
водорода, которые находятся в почвенном растворе, и определяется в водной
вытяжки. Она зависит от наличия в почвенном растворе минеральных, органических
кислот, гидролизующихся солей, и степени их диссоциации. Активная кислотность
оказывает непосредственное действие на корни растений и почвенные
микроорганизмы.
Потенциальная кислотность, связанная с ионами
водорода и алюминия, поглощенными почвенными комплексами. Данные ионы не
извлекаются водой, но они могут быть вытеснены из почвы катионами растворимых
солей.
В зависимости от того, какая соль была
использована для вытеснения ионов из почвенных комплексона, различают обменную
и гидролитическую кислотность.
Обменную кислотность определяют при воздействии
на почву раствором нейтральной соли (например, хлорида калия), а
гидролитическую - раствором соли сильного основания и слабой кислоты (например,
уксуснокислый натрий).
По той части поглощенных почвой ионов водорода,
которая может быть вытеснена растворами нейтральных солей (NaCl
или KCl), можно
определить необходимость известкования почвы (Табл. 2.5).
Таблица 2.5
Определение необходимости известкования по
значениям pH вытяжки
|
№
п/п
|
pH солевой вытяжки
|
Необходимость
известкования
|
|
1
2 3 4 5 6 7
|
˂4,5
4,6 4,8 5,0 5,2 5,4 ˃5,5
|
Острая
Сильная Средняя Средняя Слабая Слабая Не требуется
|
При изменении кислотности почв меняется также
подвижность катионов металлов, что влияет на растительность, поскольку растения
усваивают только подвижные катионы (Табл. 2.6).
Таблица 2.6
|
Реакция
почвы
|
Подвижность
микроэлементов
|
|
Pb
|
Cr
|
Ni
|
V
|
Cu
|
Zn
|
S
|
|
Кислая
|
СП
|
СП
|
СП
|
СП
|
П
|
П
|
П
|
|
Нейтральная
|
ПН
|
СП
|
СП
|
П
|
П
|
П
|
|
Щелочная
|
ПН
|
ПН
|
ПН
|
П
|
СП
|
СП
|
П
|
Подвижность микроэлементов в зависимости от
кислотности почв
Примечание: ПН - практически неподвижны; СП -
слабоподвижные; П - подвижные.
Кислотность почв оценивают по величине pH
в нейтральной и соляной вытяжках или в суспензии. При их приготовлении
соотношения почва: вода должно быть 1:5. Нейтральная вытяжка и суспензия
создается дистиллированной водой, а соляная 1Н раствором KCl.
Измерение pH
проводят методом визуальной колориметрии (цвет раствора сравнивают со шкалой,
проградуированной в единицах pH)
или потенциометрическим методом с использованием лабораторных pH
- метров. Метод основан на измерении электродвижущей силы (ЭДС), возникающей
при опускании двух электродов в исследуемой раствор или суспензию. В качестве
измерительного электрода чаще всего использую стекляный, а электродом сравнения
служит хлорсеребряный или каломельный. Перед работой стеклянный электрод
необходимо выдержать не менее 3 суток в 0,1Н растворе соляной кислоты. pH
- метр перед работой необходимо настроить по 3 буферным растворам.
Приборы и реактивы: В химической лаборатории:
стаканчик для взвешивания, весы технические, колбы вместимостью 250 см3,
колбы плоскодонные с пробками, цилиндр мерный вместимостью 500 см3,
воронки для фильтрования, фильтры или фильтровальная бумага, pH
- метр или контрольная шкала образцов окраски растворов для определения pH,
универсальная индикаторная бумага.
В полевых условиях: из комплекса «Пчелка -
у/хим»: пипетка, капельница (0,1 см3), пробирки колориметрические с
отметкой «5 мл», 1Н раствор KCl.
Проведение работы.
В химической лаборатории: пробу, доводят до
воздушно-сухого состояния. Для этого необходимо разложить пробу тонким слоем -
2 см на фильтрованную бумагу или газету и выдержать в течение суток. Почву
следует считать подготовленной к анализу, если она сухая на ощупь и легко
рассыпается. Влагосодержание такой почвы составляет около 2-5 %.
Для приготовления соляной вытяжки на технических
весах взвешивают стаканчик или бюкс (m1),
добавляют 50г почвы и еще раз взвешивают (m2).
Масса пробы равна разности между m2
и m1.
Пробу количественно переносят в коническую колбу вместимостью 250 см3,
добавляют мерным цилиндром 125 см3 1Н раствора KCl,
предварительно сполоснув этим раствором стаканчик для взвешивания. Колбу
закрывают пробкой и энергично встряхивают 3 мин. Суспензию оставляют на сутки,
потом отфильтровать через воронку с фильтром в сухую колбу.
Предварительное значение pH
солевой вытяжки определяют, поместив каплю раствора на полоску индикаторной
бумаги и сравнив ее цвет со шкалой.
Тонное значение pH
определяют одним из 2 способов:
. Наливают в стаканчик вместимостью 100см3
на 2/3 его объема солевую вытяжку, помещают в pH
- метр, выдерживают несколько минут и записывают по шкале прибора значения pH.
. Колориметрическую пробирку из комплекта
«Пчелка у/хим» ополаскивают несколько раз солевым раствором и заполняют этим же
раствором до метки «5 мл». в пробирку добавляют пипеткой-капельницей 3-4 капли
универсального индикатора. Пробирку встряхивают для перемешивания раствора и
помещают на лист белой бумаги. Окраску раствора в пробирке сравнивают с
контрольной шкалой, выбрав ближайший по окраске образец шкалы. Окраску
наблюдают сверху через отверстие пробирки при хорошем освещении (Коган, 2007).
.4.7 Определение гидролитической кислотности
По величине гидролитической кислотности обычно
определяют количество извести, необходимое для нейтрализации кислотности почв.
Определение основано на том, что при
взаимодействии раствора CH3COONa
с почвой образуется уксусная кислота, которую можно оттитровать щелочью.
Приборы и реактивы: в химической лаборатории:
технохимические весы, почвенное сито с отверстиями 1 мм, конические колбы на
100-200 см3, прибор для взбалтывания, колба и воронка для фильтрования,
пипетка, коническая колба на 100 см3, 1Н раствор уксуснокислого
натрия, 0,1н гидроксида натрия, фенолфталеин.
Выполнение работы:
В химической лаборатории на технохимических
весах взвешивают 20г воздушно-сухой почвы, предварительно просеянной через сито
с отверстиями 1 мм. Навеску помещают в коническую колбу на 100-200 см3,
приливают пипеткой 50 см3 0,1н СН3СООNa,
взбалтывают содержимое на приборе для взбалтывания в течении часа ,
отфильтровывают через плотный фильтр. Если фильтрат окажется мутным, его еще
раз пропускают через тот же фильтр. Пипеткой отбирают 50 см3,
переносят в коническую колбу на 100 см3, прибавляют 1-2 капли
фенолфталеина и титруют 0,1н раствором гидроксида натрия до слаборозовой
окраски раствора, неисчезающей в течении 1 минуты.
Гидролитическую кислотность рассчитывают по
формуле (2):
H=(a*CH*100*1,75)/C,
(2)
где:
Н - гидролитическая кислотность, мг-экв на 100г
почвы;
а - количество 0,1Н NaOH,
пошедшего на титрование фильтрата, см3;
- коэффициент для пересчета на 100 г почвы;
,75 - поправка на полноту вытеснения ионов
водорода;
С - навеска почвы, содержащаяся в 50 см3
фильтрата (Коган, 2007).
.4.8 Определение нитратов
Применение тест-комплекта «нитраты»
. Градуированную пробирку ополосните несколько
раз анализируемой водой. В пробирку отберите 6 мл анализируемой воды, прибавьте
дистиллят до метки «11», перемешайте.
. К содержимому пробирки добавьте 2,0 мл
свежеприготовленного реактива на нитрат-анионы, закройте пробирку пробкой и
перемешайте раствор.
3. Прибавьте в пробирку около 0,2 г порошка
восстановителя, используя шпатель (0,2 г порошка заполняет шпатель на ½
глубины
не образуя «горки»). Закройте пробирку пробкой и тщательно перемещайте раствор.
. Оставьте пробирку на 5 минут для полного
протекания реакции, периодически встряхивая содержимое пробирки.
. В склянку для колориметрирования перелейте
раствор из пробирки до метки «10», стараясь не допустить попадания осадка в
склянку.
. Проведите визуальное колориметрирование пробы.
Для этого мерную склянку поместите на белое поле контрольной шкалы и, освещая
склянку рассеянным светом достаточной интенсивности, определите ближайшее по
окраске поле контрольной шкалы и соответствующее ему значение концентрации
нитрат -анионов в мг/л.
Глава 3. Результаты и их обсуждение
Описание результатов определения общих
характеристик почв: кальций, нитраты, кислотность, железо.
Раствор при определении кальций имел очень
слабую муть, отсюда следует, что содержание кальция в почве составляет тысячные
доли г/100 почвы.
По контрольной шкале образцов окраски проб для
визуального колориметрирования на нитрат-анионы, концентрация NO3,
мг/л составила 5,0 и имеет розовый оттенок. Это говорит о том, что нитраты в
почве пос. Кульдур присутствуют.
При анализе почвы на кислотность было
обнаружено, что кислотность рН=6,00, это означает, что среда является близкая к
нейтральным.
Раствор при определении железа имел слегка
светло-коричневый оттенок, следовательно, концентрация железа (Fe2+
+
Fe3+)
составила 0,1 мг/л., т.е. железо есть в почве, но очень в малой концентрации.
Заключение
· Подготовлен
тематический обзор по факторам, обуславливающим загрязнения и биологическое
действие загрязнения на почвы и показана необходимость исследований почв на
территорий месторождения Кульдурских минеральных вод.
· Проведён анализ
исследований почв в пос. Кульдур по содержанию в них кислотности, железа,
нитратов и кальция.
· Показано, что в
почвах на территории пос. Кульдур кислотность составляет 6,0 - это говорит о
том, что почва является близкая к нейтральной; железо содержится в почвах в
очень маленьких количествах; нитраты-анионы присутствуют в малом количестве,
что не являются вредным для здоровья; кальций так же присутствует в почвах пос.
Кульдур и это требует известкование почвы.
Список литературы
1. Что такое кислотность
почвы.
. Облученский район.
. Почвы и химия почв.
. Облученский муниципальный
район. Официальный сайт органов местного самоуправления.
. Нитраты и нитриты.
Влияние на организм человека.
. Проблемы загрязнения почв
и пути их решения.
. Географическое положение
Облученского района.
. Нитраты.
. Железо справочник
пестициды.ру.
. Кальций справочник
пестициды.ру.
. Железо в почвах.
. Амурские сезоны.
. Андриевский Б.П.,
Антонова Г.Л., Энциклопедический словарь ЕАО. Хабаровск: ИКАРП ДВО РАН,
Издательство «РИОТИП» 1999. С. 131.
. Белобров В.П., Замотаев
И.В., Овечкин С.В. География почв с основами почвоведения. М.: Издательский
центр Академия 2004. С. 363.
. Коган Р.М. Анализ
экологического состояния объектов окружающей среды ЕАО. Биробиджан: ДВГСГА
2006. С. 216.
. Коган Р.М. Химический
анализ объектов окружающей среды. Часть 2. Анализ почв. Биробиджан: ДВГСГА
2007. С. 217.
. Колесников С.И.
Почвоведение с основами геологии. Учебное пособие, М: РИОР 2005. С. 150.
. Орлов Д.С., Садовникова
Л.К., Суханова Н.И., Трофимова С.Я. Биосфера: загрязнение, деградация, охрана.
Краткий толковый словарь. М: Высшая школа 2003. С. 126.
. Розанов Б.Г. Морфология
почв. Учебник для высшей школы. М: Академический Проект 2004. С. 432.
. Фрисман Е.Я., Комарова
Т.М., Рубцова Т.М., Ахмадулин В.П. Природные ресурсы ЕАО. Биробиджан: ИКАРП ДВО
РАН, Издательство «РИОТИП» 2004. С. 112.