Сравнительная оценка методов качественного и количественного анализа субстанции сульфацил-натрия
Курсовая
работа
Тема
курсовой работы «Сравнительная оценка методов качественного и количественного
анализа субстанции сульфацил-натрия»
Содержание
Введение
I.Теоретическая
часть
.Фармакопейная статья
. Описание и синтез
. Испытания на подлинность
. Количественное определение
. Хранение и применение
II.Экспериментальная
часть
.Испытания на подлинность
. Количественное определение
Заключение
Список литературы
Введение
Сульфацетамид натрия - один из представителей
группы сульфаниламидов, группа антимикробных лекарственных средств -
производных сульфаниловой кислоты. Их антибактериальные свойства обнаружены
немецким учёным Г. Домагком в 1934. В 1935 году ученые Пастеровского института
(Франция) установили, что антибактериальным действием обладает именно
сульфаниламидная часть молекулы пронтозила(красный стрептоцид), а не структура,
придающая ему окраску.
Сульфаниламидные препараты близки по химической
структуре парааминобензойной кислоте (ПАБК) - необходимому фактору роста
микроорганизмов, при отсутствии которого они не могут размножаться. Основной
механизм действия сульфаниламидных препаратов - конкуренция с ПАБК за
связывание с определёнными ферментами в микробной клетке. В результате
соединения сульфаниламидных препаратов с ферментами бактерии теряют способность
синтезировать необходимый им витамин - фолиевую кислоту и осуществлять другие
превращения веществ, которые в норме протекают с участием ПАБК. Поскольку эти
ферменты обладают более высоким сродством с ПАБК, чем с сульфаниламидными препаратами
терапевтический эффект достигается при достаточно больших дозах препаратов.
Приём сульфаниламидных препаратов в недостаточных дозах или досрочное
прекращение лечения могут привести к появлению устойчивых штаммов возбудителей,
не поддающихся в дальнейшем действию сульфаниламидных препаратов.
Цель: провести сравнительную оценку реакций
идентификации и методов количественного определения субстанции
сульфацил-натрия.
Задачи:
провести обзор литературы, содержащей методики
качественного и количественного анализа субстанции;
провести качественное определение субстанции
сульфацил - натрия;
провести количественное определение субстанции
сульфацил - натрия;
провести статистическую обработку методов
количественного определения субстанции сульфацил - натрия;
сделать заключение о возможности использования
методов качественного и количественного анализа сульфацил-натрия в
фармацевтическом анализе;
. Теоретическая часть
. Фармакопейная статья
ГФ X
ФС № 641natrium
Сульфацил-натрий
Сульфацил растворимый (Sulfacylum
solubile)
п-Аминобензолсульфонилацетамид-натрий (Albucid-natrium
Sulfacetamidum
Natricum *)
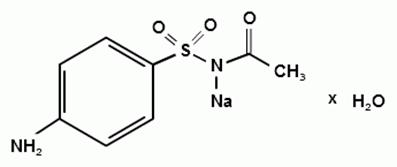
H9N2Na2O3S • H2O. в. 254,24
Описание. Белый кристаллический порошок без
запаха.
Растворимость. Легко растворим в воде,
практически нерастворим в спирте, эфире, хлороформе и ацетоне.
Подлинность. Препарат дает характерную реакцию
на ароматические первичные амины и реакцию Б на натрий.
,1 г препарата растворяют в 3 мл воды и
прибавляют 1 мл раствора сульфата меди; образуется осадок
голубовато-зеленоватого цвета, который не изменяется при стоянии (отличие от
других сульфамидных препаратов).
Прозрачность и цветность раствора. Раствор 1,5 г
препарата в 5 мл воды должен быть прозрачным; окраска раствора не должна быть
интенсивнее эталона № 5а.
Щелочность. рН 8,5-9,5 (5% водный раствор).
Хлориды. Раствор 0,2 г препарата в 10 мл воды
должен выдерживать испытание на хлориды (не более 0,01% в препарате).
Сульфаты. Раствор 0,5 г препарата в 10 мл воды
должен выдерживать испытание на сульфаты (не более 0,02% в препарате).
Тяжелые металлы. 1 г препарата растворяют в 17,5
мл воды, добавляют 2,5 мл разведенной уксусной кислоты, взбалтывают в течение 5
минут и выпавший осадок отфильтровывают. 10 мл фильтрата должны выдерживать
испытание на тяжелые металлы (не более 0,001% в препарате).
Количественное определение. Около 0,3 г
препарата (точная навеска) растворяют в 10 мл воды и 10 мл разведенной соляной
кислоты и далее поступают, как указано в статье «Нитритометрия» (стр. 799). В
случае применения внутренних индикаторов используют нейтральный красный.
мл 0,1 мол раствора нитрита натрия соответствует
0,02542 г C8H9N2Na2O3S • H2O, которого в препарате должно быть не менее 99,0%.
Хранение. Список Б. В таре, предохраняющей от
действия влаги и света.
Высшая разовая доза внутрь 2,0 г.
Высшая суточная доза внутрь 7,0 г.(При лечении
инфекционных глазных заболеваний применяют 10- 20-30% растворы и
мази).Антибактериальное средство.
.Описание и синтез
Сульфацил-натрий - это амфотерное соединение.
Наличие амидной группы в структуре сульфацила натрия будет обусловливает его
кислотные свойства, которые выражены сильнее основных. Этим объясняется
относительная устойчивость и возможность применения как самостоятельного
лекарственного средства. Основные свойства обусловлены наличием ароматической
аминогруппы. Сульфацил натрия хорошо растворим в воде, водные растворы имеют
щелочную реакцию среды вследствие гидролиза ( соль сильного основания и слабой
органической кислоты ).
В натриевых солях сульфаниламидов щелочность
регламентируется как примесь, остающаяся после их синтеза, а также образующаяся
при хранении растворов вследствии гидролиза. Как правило, щелочность в этих
лекарственных средствах допускается в определенных пределах. В сульфациле
натрия она устанавливается по pH
раствора. Наличие амидной группы в структуре будет обусловливать его кислотные
свойства.
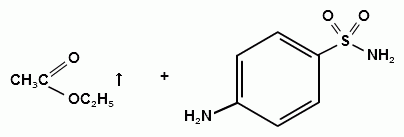
Синтез сульфацетамида натрия осуществляют из
ацилированного сульфаниламида по следующей схеме:
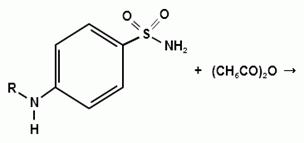
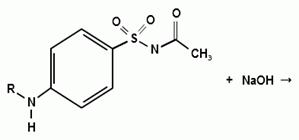
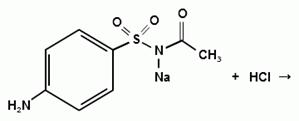
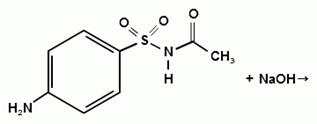
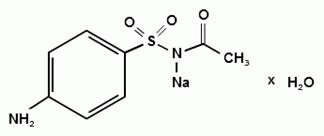
. Испытания на подлинность
Для испытаний подлинности сульфацила - натрия
используют общие и частные реакции, обусловленные наличием тех или иных
функциональных групп в молекуле.
На первичную ароматическую аминогруппу, проводят
реакцию образования азокрасителя, лигниновую пробу, реакцию конденсации:
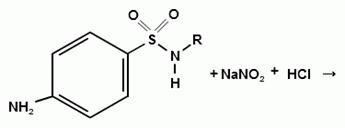
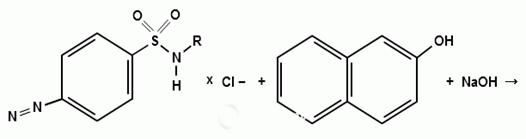
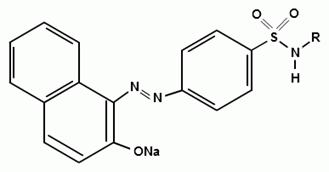
) Реакция образования азокрасителя
Общим свойством первичных ароматических аминов
является способность к образованию соли диазония и азокрасителей. Ионы
диазония, обладающие электрофильными свойствами, вступают в реакцию
электрофильного замещения.
Реакция основана на образовании хлорида диазония
в результате действия раствором нитрита натрия и разведенной хлороводородной
кислотой. Последующее сочетание хлорида диазония в щелочной среде с фенолами
приводит к образованию азокрасителя. Известно очень большое число
азосоставляющих. ГФ рекомендует для выполнения этой реакции щелочной раствор
в-нафтола. В результате реакции появляется вишнево-красное окрашивание или
образуется осадок оранжево-красного цвета.
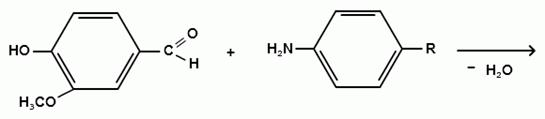
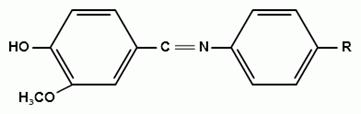
) Лигниновая проба
Эта своеобразная разновидность реакции
образования шиффовых оснований. Она выполняется на древесине или газетной
бумаге, при нанесении на которую сульфацил-натрия и капли разведенной соляной
кислоты появляется оранжево - желтое окрашивание. Сущность происходящего
химического процесса в том, что образуется ароматический альдегид. Альдегиды
взаимодействуют с первичными ароматическими аминами, образуя шиффовые
основания:
) Реакция конденсации
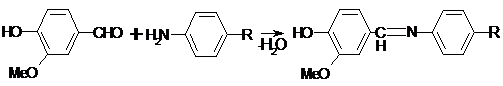
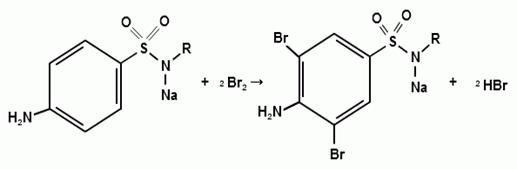
4) Реакция галогенирования ( на
ароматический цикл)
Эта реакция основаны на наличии донорной группы
в ароматическом ядре молекулы сульфаниламида (заместитель первого рода).
Реакции галогенирования могут быть использованы как для качественного анализа
(образование осадков дибром- или дийодпроизводных), так и для количественного
(броматометрического, йодометрического, йодхлорометрического) определения
сульфаниламидов.
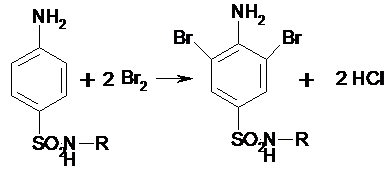
Сульфацил натрий обладает кислотными свойствами,
соответственно взаимодействует с металлами:
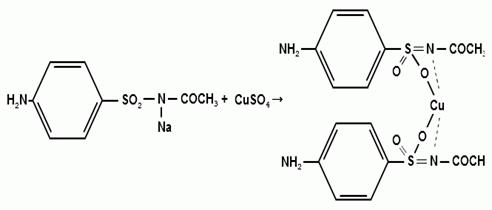
) Реакция образования комплексных солей
Образование окрашенных, нерастворимых в воде
комплексных солей сульфаниламидов является общей реакций, характеризующей их
кислотные свойства, и в то же время позволяющей различить судьфаниламиды внутри
группы, поскольку осадки отличаются характером и устойчивостью окраски. Окраска
и устойчивость комплексных соединений зависят от химической структуры вещества,
в частности от силы кислотности. В ГФ XI
рекомендуется проводить реакцию образования комплексных солей с меди сульфатом.
Реакция среды должна быть нейтральной во избежание образования осадка меди (II)
гидроксида. Сульфацил-натрия образует комплекс голубовато - зеленого цвета.
) Реакция окисления
При окислении сульфаниламидов как ароматических
аминов образуются окрашенные соединения. Окисление может происходить под
действием кислорода воздуха, особенно в растворах. Так быстрое пожелтение
раствора сульфацила-натрия свидетельствует о появлении окрашенных продуктов
окисления. Степень окисления сульфаниламидов регламентируется ГФ XI
путем определения цветности раствора. Так, при анализе сульфацил - натрия
проводится определение степени окраски его раствора определенной концентрации,
которая не должна превышать окраску эталона цветности № 6б.
) Реакция обнаружения серы (в
сульфамидной группе)
Наличие серы в молекуле сульфаниламидов, как и в
других содержащих серу соединениях, можно установить после окисления органической
части молекулы концентрированной азотной кислотой или сплавления: с 10-кратным
количеством нитрата калия до сульфат-иона. Последний затем обнаруживают с
помощью раствора хлорида бария - белый осадок
+ + SO42- → BaSO4↓
) Реакция и нитропруссидом натрия.
Растворы сульфаниламидов в присутствии едких
щелочей при добавлении 1% раствора нитропруссида натрия (Na2[Fe(CN)5NO])
и последующем подкислении минеральной кислотой образуют окрашенные в красный
или красно-коричневый цвет раствор или осадок.
) УФ-, ИК- спектрофотоместрия
В ФС включены способы идентификации
сульфаниламидов по УФ-спектрам поглощения. Выбор этих методик основан на
проведении предварительных исследований. В.Е. Чичиро, А.П. Арзамасцевым с
сотрудниками унифицированы условия получения УФ-спектров 14 сульфаниламидов для
их идентификации. Растворителями служили 0,1 М растворы гидроксида натрия и
хлороводородной кислоты. УФ-спектры были сняты в области 210-360 нм.
Установлено, что идентифицировать тот или иной сульфаниламид можно по форме УФ-спектра,
удельному показателю поглощения или на основании вторых производных
УФ-спектров.
УФ-спектр 0,001%-ного раствора сульфацетамида
натрия имеет максимум поглощения при 256 нм и минимум - при 227 нм.
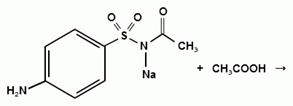
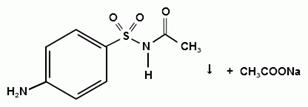
Частная реакция определения сульфацил - натрия.
При действии на сульфацил-натрий уксусной
кислотой выделяется бурый осадок сульфацетамида, который после высушивания
должен иметь температуру плавления около 183° С:
При растворении осадка в этаноле и добавлении
конц. серной кислоты образуется этилацетат, имеющий характерный запах:
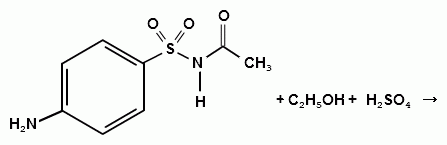
Для отличия натриевых солей от соответствующих
сульфаниламидов выполняют реакцию на ион натрия (окраска пламени горелки в
желтый цфет), а также реакцию с цинкуранилацетатом - желтое окрашивание.
Na+ + Zn(UO2)3(CH3COO)8 + CH3COO- +
9H2O → NaZn(UO2)3(CH3COO)9 9H2O↓
4.Количественное определение
сульфацил натрий соль реакция
1)Нитритометрия.
Этот метод рекомендован НД для количественного
определения сульфаниламидов, являющихся первичными ароматическими аминами.
Определение основано на способности первичных ароматических аминов образовывать
в кислой среде диазосоединения:
В качестве титранта используют нитрит натрия
(0,1 М раствор). Титруют в присутствии бромида-калия при 18-200С или при
0-100С. Бромид калия катализирует процесс диазотирования, а охлаждение
реакционной смеси позволяет избежать потерь азотистой кислоты и предотвратить
разложение соли диазония. Точку эквивалентности можно установить одним из трех
способов: с помощью внутренних индикаторов (тропеолин 00, нейтральный красный,
смесь тропеолина 00 с метиленовым синим); внешних индикаторов (йодкрахмальная
бумага) или потенциометрически.
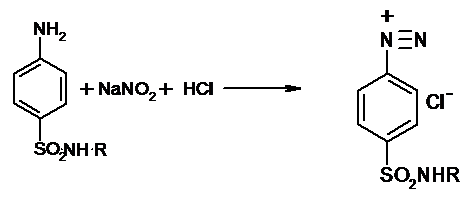
)Нейтрализация.
Поскольку образующаяся натриевая соль легко
подвергается гидролизу, то результаты определения получаются заниженные.
Поэтому чрезвычайно важен выбор оптимального растворителя, который следует
осуществлять с учетом констант диссоциации сульфаниламидов. Сульфаниламиды с
константой диссоциации 10-7-10-8 можно титровать в водно-ацетоновом растворе
или в этаноле (индикатор тимолфталеин), а с константой диссоциации 10-9 титруют
только в неводных растворителях.
Натриевые соли сульфаниламидов можно титровать
кислотой в спирто-ацетоновой среде (индикатор метиловый оранжевый):
)Броматометрия
Метод основан на реакции галогенирования
сульфаниламидов. Титруют раствором бромата калия в кислой среде в присутствии
бромида калия. Конечную точку устанавливают при прямом титровании по
обесцвечиванию (бромом) индикатора метилового оранжевого, а при обратном
титровании -йодометрически:
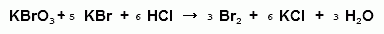
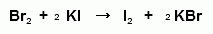
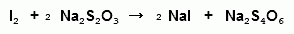
) Метод Кьельдаля
Используют для количественного определения азота
в органических веществах. Определение проводят с помощью прибора, состоящего из
колбы Кьельдаля, парообразователя, холодильника, приемника.
Навеску анализируемого вещества кипятят с
концентрированной серной кислотой. При этом углерод органических веществ
окисляется до диоксида углерода, водород - до воды; азот (отрицательно
заряженный трехвалентный) превращается в аммиак, который с серной кислотой,
взятой в избытке, образует сульфат аммония. Минерализованную пробу затем
подщелачивают, аммиак отгоняют в раствор кислоты борной, где определяют
титрованием 0,1 М НCL.
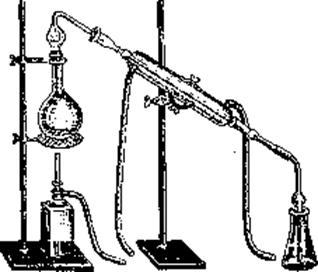
.Хранение и применение
Хранят сульфаниламиды как сильнодействующие
средства, в хорошо укупоренной таре (стеклянных банках с притертыми крышками) в
защищенном от света месте. Сульфацил-натрия при несоблюдении условий хранения
постепенно теряет воду, что может привести к изменению физических свойств. Срок
проверочного анализа 5 лет.
Сульфаниламиды относятся к химиотерапевтическим
средствам широкого антибактериального спектра действия, так как они подавляют
жизнедеятельность многих видов грамположительных и грамотрицательных бактерий:
стрептококков, стафилококков, менингококков, гонококков, бактерий
кишечно-тифозно-дизентерийной группы и многих других. Они активны в отношении
крупных вирусов (возбудителей трахомы, пахового лимфогранулематоза), кокцидий,
плазмодий малярии и токсоплазм, актиномицет и т д.
Сульфацил-натрий по антимикробному действию и
особенностям фармакокинетики сходен с сульфацилом. Применяют при пиелитах,
циститах, колитах и послеродовом сепсисе. Назначают внутрь в дозах: лошадям и
крупному рогатому скоту 3-10 г, мелкому рогатому скоту и свиньям 1-2, собакам
0,3-0,5 г 3-4 раза в сутки.
Наружно сульфацил-натрий применяют при лечении
ран, язв роговицы, конъюнктивитов, маститов, эндометритов. Употребляют в форме
присыпки, мази или растворов 10, 20 или 30 %-ной концентрации. Особенно хорошие
результаты получены при применении сульфацил-натрия в глазной практике.
Противопоказания к применению: острый гепатит,
агранулоцитоз, гемолитическая анемия.
. Экспериментальная часть
. Испытания на подлинность
) Реакция комплексообразования
,1 г сульфацил-натрия растворяют в 3 мл воды и
прибавляют 1 мл раствора сульфата меди, образуется осадок голубовато зеленого
цвета, который не меняется при стоянии. Реакция проводилась со следующими
металлами:
|
Металл
|
Окрашивание
|
|
Cu
|
Зеленое
|
|
Co
|
Розово
- красное
|
|
Ag
|
Белый
↓
|
) Реакция образования азокрасителя
,05 г сульфацил-натрия растворяют в 1 мл
разведенной кислоты хлористоводородной, прибавляют 2 мл 1% раствора натрия
нитрата; полученный раствор прибавляют к 1 мл щелочного раствора β-нафтола,
содержащего 0,5г натрия ацетата. Образуется коричнево-красный осадок. Реакция
проводилась со следующими веществами:
|
Вещество
|
Окрашивание
|
|
α-нафтол
|
|
β-нафтол
|
Кирпично-красное
окрашивание
|
|
Фенол
|
Желтое
окрашивание
|
|
Тимол
|
Оранжевое
окрашивание
|
|
Резорцин
|
Желто-бурое
окрашивание
|
) Реакция окисления
К 0,05 г сульфацил-натрия прибавляют 1 мл
гидроксида натрия. К полученному раствору прибавляют 6-8 капель хлорамина и 6
капель 1% раствора фенола. Нагревают на водяной бане, появляется синее
окрашивание.
4) Реакция
конденсации
К 0,05 г сульфацил-натрия прибавляют 1 мл
гидроксида натрия. К полученному раствору прибавляют 0,05 г ванилина.
Образуется раствор желтого цвета.
5) Реакция
обнаружения серы
,05 г препарата растворяют в 2-3 мл
концентрированной азотной кислоты, нагреваю на водяной бане. После охлаждения
добавляют 1-2 мл бария хлорида, образуется белый осадок.
.Количественное определение
)Броматометрия
,05 г препарата растворяют в 50 мл воды,
добавляют 25 мл 0,1М раствора бромата калия; 2,5 г калия бромида и 10 мл
соляной кислоты. Оставляют на 15 минут. Затем прибавляют 1 г калия йодида,
растворенного в 5 мл волы и титруют 0,1 М раствором тиосульфата натрия.
Индикатор крахмал.
мл 0,1М раствора тиосульфата натрия соответствует
0,01271 г сульфацила натрия.
|
№
взвешивания
|
а,
г Навеска
|
V, мл Объем
теоретический
|
V, мл Объем
практический
|
|
1
|
0,0501
|
21,3
|
21,4
|
|
2
|
0,0489
|
21,4
|
21,6
|
|
3
|
0,0511
|
21,2
|
21,3
|
|
4
|
0,0502
|
21,3
|
21,5
|
|
5
|
0,0499
|
21,3
|
21,5
|
|
6
|
0,0503
|
21,3
|
21,4
|
Т = 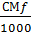 =
=
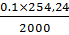 =
0,01271 ; f =
=
0,01271 ; f = 
V1(теор) = 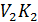 -
-
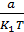 =25×1,01
-
=25×1,01
-
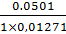 =
21,3; V = 21,4
=
21,3; V = 21,4
V2(теор) = 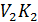 -
-
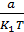 =25×1,01
-
=25×1,01
-
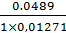 =
21,4; V = 21,6
=
21,4; V = 21,6
V3(теор) = 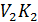 -
-
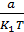 =25×1,01
-
=25×1,01
-
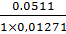 =
21,2; V = 21,3
=
21,2; V = 21,3
V4(теор) = 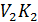 -
-
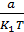 =25×1,01
-
=25×1,01
-
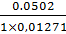 =
21,3; V = 21,5
=
21,3; V = 21,5
V5(теор) = 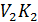 -
-
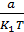 =25×1,01
-
=25×1,01
-
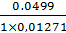 =
21,3; V = 21,5
=
21,3; V = 21,5
V6(теор) = 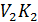 -
-
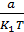 =25×1,01
-
=25×1,01
-
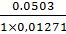 =
21,3; V = 21,4
=
21,3; V = 21,4
g,% (1) = 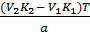 х
100% =
х
100% = 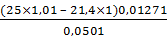 ×
100% = 97,7%
×
100% = 97,7%
g,% (2) = 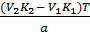 х
100% =
х
100% = 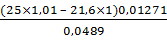 ×100%
= 94,9%
×100%
= 94,9%
g,% (3) = 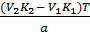 х
100% =
х
100% = 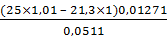 ×100%
= 98,2%
×100%
= 98,2%
g,% (4) = 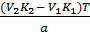 х
100% =
х
100% = 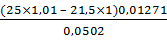 ×100%=
95,0%
×100%=
95,0%
g,% (5) = 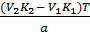 х
100% =
х
100% = 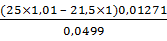 ×
100% = 95,5%
×
100% = 95,5%
g,% (6) = 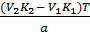 х
100% =
х
100% = 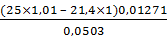 ×100%
=
97,3%
×100%
=
97,3%
|
№
|
g,% (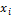 ) )
|
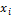 - -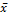
|
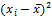
|
Метрологическая
обработка
|
|
1
|
97,7
|
1,3
|
1,69
|
S = 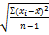 = =
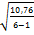 =
1, 47 =
1, 47  =
2,16 =
2,16 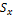 = =
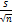 = =
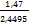 =
0,6 Δx
= =
0,6 Δx
= 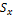 × ×
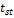 =
0,6×2,21
=1, 326 E
= =
0,6×2,21
=1, 326 E
= 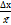 = =
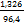 ×100%
= 1,4% ×100%
= 1,4%
|
|
2
|
1,5
|
2,25
|
|
|
3
|
98,2
|
1,8
|
3,24
|
|
|
4
|
95,0
|
1,4
|
1,96
|
|
|
5
|
95,5
|
0,9
|
0,81
|
|
|
6
|
97,3
|
0,9
|
0,81
|
|
|
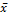 =
96,4 =
96,4
|
|
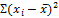 =
10,76 =
10,76
|
|
Ошибка метода составила 1,4%
)Нитритометрия
,05 г препарата (т.н.) растворяют в 2 мл воды и
2 мл разведенной соляной кислоты, добавляют 20-25 мл воды, 0,5 г бромида калия,
2-3 капли раствора индикатора нейтрального красного и при постоянном
перемешивании титруют 0,1 М раствором нитрита натрия до изменения окраски от
малиновой к синей. Титровать следует медленно, в конце титрования выдержку
увеличивают до 2 мин.
мл 0,1М раствора нитрита натрия соответствует
0,02542 г сульфацила натрия.
|
№
взвешивания
|
а,
г Навеска
|
V, мл Объем
теоретический
|
V, мл Объем
практический
|
|
1
|
0,0502
|
2,01
|
2,0
|
|
2
|
0,0502
|
2,01
|
2,0
|
|
3
|
0,0498
|
1,99
|
2,0
|
|
4
|
0,0501
|
2,01
|
2,0
|
|
5
|
0,0499
|
2,00
|
2,0
|
|
6
|
0,0487
|
1,96
|
1,9
|
Т = 0,02542 ; f
= 1
Vтеор(1)=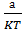 =
= 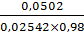 =
2,01;
=
2,01;
Vтеор(2)=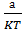 =
= 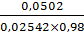 =
2,01;
=
2,01;
Vтеор(3)=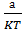 =
= 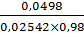 =
1,99;
=
1,99;
Vтеор(4)=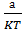 =
= 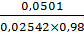 =
2,01;
=
2,01;
Vтеор(5)=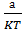 =
= 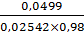 =
2,00;
=
2,00;
Vтеор(6)=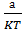 =
= 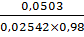 =
1,96;
=
1,96;
g,% (1) = 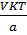 х
100% =
х
100% = 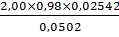 ×
100% = 99,2%
×
100% = 99,2%
g,% (2) = 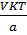 х
100% =
х
100% = 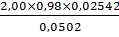 ×100%
= 99,2%
×100%
= 99,2%
g,% (3) = 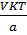 х
100% =
х
100% = 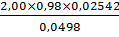 ×100%
=100,0%
×100%
=100,0%
g,% (4) = 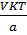 х
100% =
х
100% = 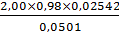 ×100%
= 99,4%
×100%
= 99,4%
g,% (5) = 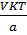 х
100% =
х
100% = 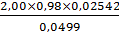 ×
100% = 99,8%
×
100% = 99,8%
g,% (6) = 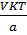 х
100% =
х
100% = 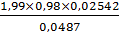 ×100%
=
97,2%
×100%
=
97,2%
|
№
|
g,% (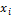 ) )
|
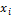 - -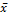
|
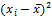
|
Метрологическая
обработка
|
99,2
|
0,1
|
0,01
|
S = 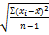 = =
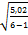 =
1,0 =
1,0  =
1 =
1 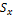 = =
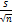 = =
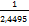 =
0,4 Δx = =
0,4 Δx = 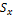 × ×
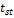 =
0,4×2,21 = 0,88 E = =
0,4×2,21 = 0,88 E = 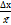 = =
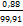 ×100%
= 0,89% ×100%
= 0,89%
|
|
2
|
99,2
|
0,1
|
0,01
|
|
|
3
|
100,0
|
0,9
|
0,81
|
|
|
4
|
99,4
|
0,3
|
0,09
|
|
|
5
|
99,8
|
0,7
|
0,49
|
|
|
6
|
97,2
|
1,9
|
3,61
|
|
|
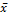 =
99,1 =
99,1
|
|
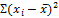 =
5,02 =
5,02
|
|
Ошибка метода составила 0,89%
Вывод: ошибка определение сульфацила-натрия в
методе нитритометрии составила 0, 89%, ошибка определения в методе
броматометрия - 1,4%.
На основании проведенной статистической
обработки результатов, сравним методы количественного определения по
воспроизводимости. Для этого необходимо вычислить критерий Фишера F:
= 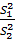 ,
,
где 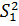 и
и
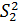 -
это дисперсии методов нитритометрии и броматометрии соответственно.
-
это дисперсии методов нитритометрии и броматометрии соответственно.
Критерий Фишера характеризует при 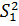 >
>
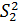 достоверность
различия между
достоверность
различия между 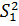 и
и 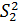
F = 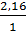 =
2,16
=
2,16
Вычисленное значение F
сравнивают с табличным значением F
(P; f1;
f2), найденном при
Р=99%. (f = n-1 = 5).
Табличное значение F
(99%; 5; 5) = 10,97
F < F
(99%; 5; 5), следовательно различие дисперсий 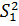 и
и
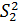 признается
признается
Заключение
В результате проведенной практической работы по
сравнительной характеристике качественных и количественных методов определения
сульфацил-натрия, была изучена литература, а также различные методики
качественного и количественного определения. Установлено, что большинство
методов качественного определения воспроизводимы и дают ярко выраженный
аналитический эффект. В качестве количественных методов определения субстанции
сульфацил-натрия, были приведены методы нитритометрии и броматометрии. Данные
методы были проведены практически и затем прошли статистическую обработку: в
методе нитритометрии ошибка составила 0,89%. В методе броматометрии ошибка
составила 1,4%. Оба метода имеют достаточно низкий процент ошибки, что
подтверждает их состоятельность. Это свидетельствует о том что данные методы
количественного и качественного определения сульфацил-натрия могут быть
использованы в фармацевтическом анализе.
Список литературы
1. Арзамасцев
А.П. (ред.). Руководство к лабораторным занятиям по фармацевтической химии.
Учебное пособие. -3-е изд, перераб. и доп. - М.: Медицина, 2011. - 348 с.
. Беликов
В.Г., Вергейчик Е.Н., Годяцкий В.Е. и др. Лабораторные работы по
фармацевтической химии. Практические указания к лабораторным работам по
фармацевтической химии. - М.: Высш. шк., 1989. - 375 с.
. Беликов
В.Г. Фармацевтическая химия. Учебное пособие . - М.: МЕДпресс-информ, 2008. -
309с.
. Государственная
фармакопея СССР. - 10-е издание. - М.: Медицина, 1968 г.
. Семенова
П.Л. Руководство к лабораторным занятиям по фармацевтической химии , 1978.
. Максютина
Н.П., Каган Ф. Е., Митченко Ф.А. и др. Анализ фармацевтических препаратов и
лекарственных форм. - Киев: Здоровье, 2010.