Потенціометрія як один з найпростіших електроаналітичних методів
План
Вступ
.
Електродний потенціал
.
Досліджуваний гальванічний елемент
.
Індикаторні електроди
.
Електроди порівняння
.
Дифузійний потенціал
.
Пряма потенціометрія
.1
Визначення рН
.2
Визначення активності (концентрації) іона (рА)
.
Потенціометричне титрування
.
Визначення точки еквівалентності
.
Іон-селективні електроди
.1
Тверді іон-селективні електроди
.2
Рідинні іон-селективні електроди
.
Газові електроди
Висновок
Список
використаних джерел
Тестові
завдання
ph іонний електрод
потенціометрія
Вступ
Потенціометрія - один з найпростіших
електроаналітичних методів. Насамперед він використовується для вимірювань рН,
а також для встановлення іонного складу біологічних рідин (кров, сеча). Це
також спосіб перетворення селективних взаємодій в аналітичний сигнал в
молекулярних сенсорних пристроях або в процесі хімічної реакції.
Потенціометрія заснована на
вимірюванні потенціалу комірки, тобто різниці потенціалів між двома електродами
(індикаторним електродом і електродом порівняння) при відсутності струму в зовнішньому
ланцюзі. Це дозволяє отримати інформацію про хімічний склад розчини. Потенціал
і область застосування індикаторного електрода залежать від його природи і
селективності. [1]
У потенціометрії використовують два
прийоми:
вимірювання потенціалу електрода як
функції активності до (концентрації) визначуваного компонента - пряма
потенціометрія;
вимірювання потенціалу електрода як
функції обсягу реагенту, доданого до проби - потенціометричне титрування.
1. Електродний потенціал
Потенціометричні методи основані на
вимірювані електрорушійних сил (ЕРС):
Е = Е1 - Е2
де Е - електрорушійна сила; Е1
та Е2 - потенціали електродів досліджуваного ланцюга.
Потенціал електроду Е пов’язаний з
активністю і концентрацією речовин, що беруть участь в електродному процесі,
рівнянням Нернста:
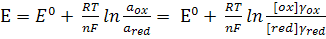 , (1)
, (1)
де 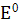 -
стандартний потенціал редокс-системи; R - універсальна газова стала, що
дорівнює 8,312 Дж/(моль∙К); Т - абсолютна температура, К; F - стала
Фарадея, дорівнює 96500 Кл/моль; n - число електронів, що приймають участь в
електродній реакції; аох, аred - активності відповідно
окисненої та відновленої форми редокс-системи; [ox], [red] - їх молярні
концетрації;
-
стандартний потенціал редокс-системи; R - універсальна газова стала, що
дорівнює 8,312 Дж/(моль∙К); Т - абсолютна температура, К; F - стала
Фарадея, дорівнює 96500 Кл/моль; n - число електронів, що приймають участь в
електродній реакції; аох, аred - активності відповідно
окисненої та відновленої форми редокс-системи; [ox], [red] - їх молярні
концетрації; 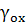 ,
, 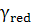 -
коефіцієнти активностей. [2]
-
коефіцієнти активностей. [2]
Е = Е0 при аох
= аred =1, при чому мається на увазі гіпотетичний стандартний 1М
розчин, в якому коефіцієнт активності кожної розчиненої речовини дорівнює 1,
чисті речовини знаходяться в найбільш стійкому фізичному стані при даній
температурі і нормальному атмосферному тиску.
Підставляючи Т= 298,15 і числові
значення констант у рівняння (1), отримуємо для 25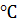 :
:
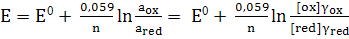 , (2)
, (2)
Окисно-відновну систему
представляють також більшість металів ( Ag, Zn, Cd, Hg, Sn, Pb, та ін.),
занурені в розчин їх солей, наприклад, металічний цинк в розчині:
Zn2+ + 2eˉ = Zn
Електродний потенціал металу в такій
системі також підпорядковується рівнянню Нернста.
Потенціометричні методи аналізу
відомі з кінця минулого століття, коли Нернст вивів (1889) відоме рівняння (1),
а Беренд повідомив (1883) про перше потенціометричне титрування. Інтенсивний
розвиток потенціометрії в останні роки пов’язано, головним чином, з появою
різноманітних типів іоноселективних електродів, що дозволяють проводити прямі
визначення концентрацій багатьох іонів в розчині, і успіхами в конструюванні і
масовому випуску приборів для потенціометричних
вимірювань. [1]
Потенціометричні методи аналізу
розділять на пряму потенціометрію (іонометрію) і потенціометричне титрування.
Методи прямої потенціометрії основані на прямому застосуванні рівняння Нернста
(1) для знаходження активності або концентрації учасника електродної реакції за
експериментально виміряної ЕРС ланцюга або потенціалу відповідного електроду.
При потенціометричному титруванні точку еквівалентності визначають за різкою
зміною (скачком) потенціалу у районі точки еквівалентності.
2. Досліджуваний гальванічний
елемент
Досліджуваний гальванічний елемент
зазвичай складається з індикаторного електроду і електроду порівняння.
Індикаторним називають електрод, потенціал якого залежить від концентрації
(активності) визначуваного іону. Потенціал електроду порівняння повинен
залишатися постійним незалежно від протікання будь-яких реакцій в аналізованому
розчині.[2] Електрорушійна сила досліджуваного елемента виражається як різниця
між потенціалом електрода порівняння (Еср) та потенціалом
індикаторного потенціалу (Еінд):
Е = Еср - Еінд
+ Ед,
де Ед - дифузійний
потенціал, або потенціал рідинного з’єднання.
3. Індикаторні електроди
Потенціал індикаторного електроду
пов'язаний рівнянням Нернста (1) з концентрацією (активністю)визначуваного
іону. Індикаторний електрод повинен задовольняти ряд вимог.
Необхідно, щоб його потенціал був
відтворюваним і визначався досить швидко. Іноді, коли, наприклад, досліджується
потенціал металічного електроду в розчині його солі і при досліджені інших систем,
індикаторний електрод повинен бути зворотним. Зворотним електродом є такий
електрод, у котрого в місці контакту електроду з електролітом, при зміні
напряму струму, здійснюється хімічне перетворення зворотне, тому що відбувалося
при початковому напрямі струму. Електрод повинен володіти також певною хімічною
стійкістю, щоб не реагувати з іншими компонентами аналізованого розчину. [2]
В потенціометрії в якості
індикаторних використовують металічні і мембрані електроди.
Металічні електроди першого роду представляють
собою металічну пластинку або дріт, занурений в розчин добре розчинної солі
цього металу. Електроди зі срібла, ртуті, кадмію та деяких інших металів
зворотні і дають відтворювані результати. Однак для багатьох металів таких, як
хром, кобальт та інших, це не характерно і електроди з цих металів в якості
індикаторних не використовуються, так як не дають досить відтворюваних
результатів. У багатьох електродів відтворюваність значно покращується, якщо
використовувати не просто метал, а його амальгаму. Це амальгамні електроди.
Особливе місце серед індикаторних електродів займають редокс-електроди, що
слугують для вимірювання окисно-відновного потенціалу системи. В якості
редокс-електродів використовують благородні метали: платина, золото, іридій або
графіт. Потенціал таких електродів залежить від відношення концентрацій
(активностей) окисненої та відновленої форм редокс-пари.
Електроди другого роду складаються з
металу, вкритого шаром малорозчинної сполуки цього металу і зануреного в розчин
добре розчинного з’єднання цього металу з тим же аніоном. До них відносять хлор
срібний, каломельний і деякі інші електроди. Електроди другого роду зазвичай
використовують як електроди порівняння.
В роботі мембранних електродів
використовують не електрохімічна реакція з переносом електрона, а різниця
потенціалів, що виникає на межі розділу фаз, і рівновага обміну іонів між
мембраною та розчином. В звичайних конструкціях мембранних електродів мембрана
розділяє досліджуваний розчин і допоміжний внутрішній розчин. Найбільш вживаним
електродом цього типу є скляний електрод. Відомі також фторидний, сульфідний і
багато інших мембранних електродів. [1]
4. Електроди порівняння
Електроди порівняння повинні мати
стійкий у часі відтворюваний потенціал, що не змінюється при проходженні через
нього невеликого струму. Частіше всього в якості електродів порівняння
використовують електроди другого роду: хлорсрібний та каломельний. [2]
Хлорсрібний електрод являє собою
срібний дріт або пластинку, вкриту шаром AgCl і розміщений в розчині KCl.
Активність іонів срібла в такому розчині дорівнює
аAg+=  .
.
Підставляємо цю величину в рівняння
Нернста для срібного електроду:
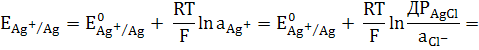
= 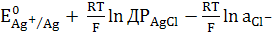 .
(3)
.
(3)
Перші два доданки в рівнянні (3)
залежать тільки від температури:
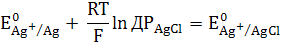
При поєднанні цього рівняння з (3)
отримаємо:

Як видно, потенціал хлор срібного
електроду визначається активністю іона хлору в розчині. Зазвичай використовують
насичений розчин KCl. Потенціал електроду другого роду загалом залежить від
активності аніону малорозчинної речовини, що входить до складу електроду.
Каломельний електрод складається з
металічної ртуті, каломелі та розчину KCl. Його потенціал також залежить від
активності хлорид-іонів. Потенціали хлор срібного, каломельного і ряду інших
електродів порівняння вивчені при різних концентраціях та температурах, і їх
величини по відношенню до стандартного водневого електроду добре відомі.
Точне значення потенціалу порівняння
для багатьох потенціометричних вимірювань часто не потрібні, важливо лише його
постійність. Однак його значення необхідне при виконанні таких вимірювань, коли
становить інтерес не тільки ЕРС, але і потенціал індикаторного електроду. Якщо
немає особливих застережень, потенціал індикаторного електроду зазвичай
перераховується і відноситься до стандартного водневого електроду. Ця величина,
звичайно, вже не залежить від вибраного електроду порівняння.[3]
5. Дифузійний потенціал
Дифузійний потенціал, або потенціал
рідинного з’єднання, виникає на межі між розчинами двох різних електролітів чи
розчинів різної концентрації одного електроліту. Виникнення дифузійного
потенціалу обумовлено нерівномірним розподілом катіонів та аніонів уздовж межі
розподілу розчинів внаслідок різниці у швидкостях дифузії іонів через поверхню
розподілу. Різниця у швидкостях дифузії спричиняється різницею в рухливості
іонів або градієнтом концентрації. В найпростіших випадках, наприклад, при
дотику розчинів одного електроліту різних концентрацій, дифузійний потенціал
може бути приблизно розрахований, якщо відомі рухливості іонів і концентрації
розчинів. Однак в практичних умовах аналізу склад аналізованого розчину буває
невідомим (в іншому випадку аналіз буде непотрібний) і теоретична оцінка
дифузійного потенціалу неможлива. [2]
В залежності від заряду іонів, їх
рухливості,концентрації розчину, природи розчинника та інших факторів
дифузійний потенціал змінюється в дуже широких межах: від часток мілівольт до
десятків мілівольт і більше. На практиці дифузійний потенціал намагаються
елімінувати за допомогою так званого сольового містка. Основним призначенням
його є здійснення електрохімічного контакту, однак з метою елімінування
потенціалу для сольового містка застосовують концентрований розчин електроліту
з приблизно однаковими рухливостями катіону і аніону. Дуже часто в якості
електроліту для сольового містка використовують насичений розчин KCl,
використовують також розчини NH4NO3, KNO3 та
ін. сольовий місток розміщують між розчинами, щоб замінити таким чином межу
розділу і суттєво зменшити дифузійний потенціал. При роботі з невідомими
розчинами для сольового містка використовують спиртові розчини NaI та KSCN. [1]
6. Пряма потенціометрія
.1 Визначення рН
Через неможливість вимірювання
активності індивідуального іона, як і потенціалу ізольованого електроду,
значення рН на підставі концентрації або активності іонів водню
експериментально визначити не можна. Вимірювані значення рН є фактично
"робочими" - величинами, обумовленими на підставі значень рН,
постульованих для стандартних розчинів:
= pH (р-ну) + 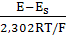
де рН (р-ну) - постулював значення
рН стандартного розчину; Еs - відповідний потенціал комірки; Е -
потенціал комірки , виміряний в розчині з невідомим рН.
Робоча шкала рН заснована на
використанні загальноприйнятих значень рН ряду стандартних розчинів відомого
складу, виміряних в потенціометричній комірці без рідинного з'єднання, так
званий осередок Гарнеда:
| H2 (1 атм) H+
(aH+ = 1), Cl- | AgCl | Ag
Визначення поняття " робоче
значення рН " прийнято Національним інститутом стандартів і технології
США, аналогічними організаціями в ряді інших країн і ІЮПАК. [4]
Потенціометричне визначення рН зі
скляним электродом
Скляний електрод, без сумніву є
найбільш важливим індикаторним електродом для іонів водню, що майже повністю
витіснив всі інші електроди для вимірювання рН. Він зручний в роботі і в меншій
ступені, ніж інші електроди, піддається впливу сторонніх домішок. [3]
Є скляні електроди відносно низької
вартості, різних форм і розмірів. Типовий скляний електрод представлений на
рис.1, в якому зазвичай використовують в якості електроду порівняння насичений
каломельний електрод.
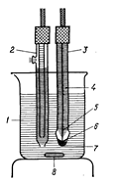
Рис.1. Типова схема електродів для
вимірювання рН. 1 - розчин з невідомим рН; 2 - насичений каломельний електрод;
3 - скляний електрод; 4 - ізоляція з парафіну; 5 - срібний дріт; 6 - 0,1М
розчин HCl, насичений AgCl; 7 - тонка скляна мембрана; 8 - магнітна мішалка.
Система електродів
скляний-каломельний є чудовим універсальним інструментом для вимірювання рН в
різних умовах. Електрод можна використовувати, не боячись заважаючого впливу
присутніх в розчині сильних окисників, відновників, білкових речовин і газів,
для визначення рН в’язких або навіть напівтвердих рідин. Є електроди
спеціального призначення. Серед них є маленькі електроди для визначення рН в
краплі (або в малому об’ємі) розчину, мікроелектроди, що дозволяють визначити
рН в клітині, а також маленькі скляні електроди для визначення кислотності
шлунку і т.д. [2]
У більшості випадків градуювання
скляного електрода проводять по двох точках. Визнання поняття
"робочого" рН означає, що електрохімічно виміряний рН не цілком
дорівнює значенню, що визначається активністю або концентрацією іона водню, а
скоріше є результатом застосування загальноприйнятої процедури.
.2 Визначення активності
(концентрації) іона (рА)
• з використанням градуйованого
графіка
Методом прямої потенціометрії
концентрацію або активність іона при наявності іон-селективного електрода можна
знайти за градуювальним графіком. Залежність потенціалу іон - селективного
електрода від активності іона може відхилятися від нернстовського. Її можна
наближено описати рівнянням:
= const ± S lg aA
де Е - потенціал електрода; const -
постійна, що залежить від природи мембрани; S - кутовий коефіцієнт електродної
функції, теоретично рівний 59,16 мВ / рА для однозарядного іона (позитивна для
катіонів, негативна величина для аніонів), аА - активність
досліджуваного іона А.
Зазначена залежність дозволяє в
досить широкому діапазоні активності отримати лінійний градуювальний графік. Для
побудови калібрувального графіка використовують серію стандартних розчинів з
відомою концентрацією визначуваних іонів. [3]
Стандартні розчини готують
послідовним розведенням вихідного розчину (наприклад, 0,1 М), приготованого за
точною наважкою солі визначуваного іона. Вимірюють електродний потенціал при
зануренні електроду в ці розчини і будують графік залежності в системі
координат Е (мВ) - lnС іонів. Потім вимірюють потенціал досліджуваного розчину
і за графіком визначають його концентрацію.
• метод добавок
Метод добавок застосовують для
знаходження концентрації визначуваної речовини в пробах зі складною або
невідомою основою. Метод заснований на вимірюванні зміни потенціалу електрода
при додаванні відомого обсягу стандартного розчину до відомого обсягом проби.
Обсяг стандартного розчину повинен бути малим щоб уникнути зміни іонної сили,
концентрації визначуваного іона і потенціалу рідинного з'єднання.
Рекомендується додавати визначуваний іон в кількості приблизно 100% від
початкового. [4]
Методом множинних добавок можна не
тільки знайти концентрацію визначуваного іона, але й оцінити величину S
для відгуку електрода.
7. Потенціометричне титрування
Потенціометричне титрування
засновано на визначенні точки еквівалентності за результатами потенціометричних
вимірювань. Поблизу точки еквівалентності відбувається різка зміна (скачок)
потенціалу індикаторного електроду. Це спостерігається, звичайно, лише тоді,
коли хоча б один з учасників реакції титрування є учасником електродного
процесу. Так, наприклад, титрування за методом кислотно-основної взаємодії може
бути виконано зі скляним електродом, визначення хлориду - з хлорсрібним і т.д.
Також, як і в інших титриметричних методах, реакції потенціометричного
титрування повинні протікати строго стехіометрично, мати високу швидкість і йти
до кінця. [1]
Потенціометричне титрування буває:
кислотно-основним, комплексонометричним, за методом осадження, окисно-відновним
та автоматичним.
Широко використовуване
потенціометричне фіксування кінцевої точки по суті дає більш точні дані, ніж
відповідний індикаторний метод. Воно особливо зручне при титруванні забарвлених
або непрозорих розчинів і для знаходження в розчині речовин, про існування яких
не припускали. На жаль, цей метод є більш трудомістким, ніж титрування з індикатором.
Для потенціометричного титрування
збирають ланцюг з індикаторного електроду в аналізованому розчині і електроду
порівняння. В якості електродів порівняння частіше всього застосовують
каломельний або хлорсрібний. [5]
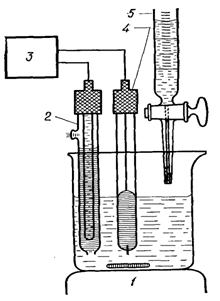
Рис. 2.Установка для
потенціометричного титрування: 1 - магнітна мішалка; 2 - насичений каломельний
електрод; 3 - рН-метр з міліметровою шкалою; 4 - індикаторний електрод; 5 -
бюретка.
8. Визначення точки еквівалентності
На рис. 3 представлена крива
титрування соляної кислоти гідроксидом натрію. Вона майже точно відтворює
теоретичну криву титрування сильної кислоти сильною основою. Як видно, в точці
еквівалентності відбувається різкий скачок ЕРС, викликаний різкою зміною
потенціалу індикаторного електроду. За цим скачком можна визначити точку
еквівалентності і потім розрахувати вміст соляної кислоти. [2]
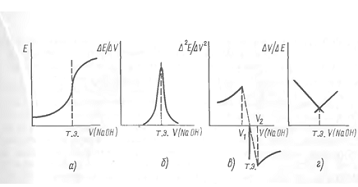
Рис.3. Криві потенціометричного
титрування: а - звичайна крива; б - диференційна крива; в - крива титрування за
другою похідною; г - крива Грана
Для знаходження точки
еквівалентності часто будують диференціальну криву в координатах 𝛥Е/𝛥V
- V(рис.3б). На точку еквівалентності вказує максимум отриманої кривої,
а відлік на осі абсцис, відповідний цьому максимуму, дає об’єм титранту, що був
витрачений на титрування до точки еквівалентності. Визначення точки
еквівалентності за диференціальною кривою значно точніше, ніж за простою
залежністю Е - V.
Оскільки похідна функція, що має
максимум, в точці максимуму дорівнює нулю, друга похідна потенціалу за об’ємом
(𝛥2Е/𝛥2V)
в точці еквівалентності буде дорівнювати нулю. Цю властивість використовують
також для знаходження точки еквівалентності (рис.3в).
За простим та зручним методом Грана
точку еквівалентності визначають за графіком в координатах
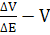 .
.
Перед точкою еквівалентності і після
неї крива Грана лінійна, а сама точка еквівалентності знаходиться як точка
перетину цих прямих (рис.3г). Перевага та зручність методу Грана
особливо помітні при аналізі розбавлених розчинів, що дозволяють визначити
точку еквівалентності з достатньою точністю внаслідок лінійності графіку.
Також нерідко в потенціометричному
титруванні використовують його нові варіанти: некомпенсаційні методи та методи
титрування під дією струму.
В некомпенсаційному методі
потенціометричного титрування вимірюють не ЕРС, а струм, що виникає в
гальванічному елементі. В початковий момент титрування ЕРС елементу
компенсується зовнішньою ЕРС і струм в ланцюзі відсутній. В процесі титрування
компенсація порушується, в ланцюзі виникає електричний струм, причому в області
точки еквівалентності струм різко підвищується пропорційно скачку ЕРС в доній
області. Точку еквівалентності можна фіксувати безпосередньо за різким
підвищенням струму або знайти графічно за залежністю
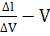 ,
,
де 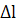 -
приріст сили струму при додаванні в розчин
-
приріст сили струму при додаванні в розчин 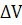 титранту.[1]
титранту.[1]
До некомпенсаційних методів можна
віднести і потенціометричне титрування з біметалічною парою електродів. Цей
метод заснований на тому, що деякі інертні метали з різною швидкістю
відкликаються на зміну потенціалу системи. Цей метод заснований на тому, що
деякі інертні метали з різною швидкістю відкликаються на зміну потенціалу
системи. Наприклад, платина швидко реагує на зміну відношення концентрацій
окисленої та відновленої форм, а вольфрам повільно. Тому, якщо занурити
платиновий і вольфрамовий електроди в титрований розчин, що містить окисно-відновну
систему, і виміряти різницю потенціалів між ними під час титрування, то до
точки еквівалентності вона буде близька до нуля, а в точці еквівалентності
різко зростає.
Швидкість деяких окисно-відновних
реакцій, особливо з участю органічних речовин, виявляється недостатньою для
використання їх в титриметричних методах. В таких випадках електроди
поляризують шляхом пропускання невеликого струму (10-5 А), що різко
підвищує швидкість встановлення рівноважних потенціалів і суттєво - скачок
титрування. Титрування під дією електричного струму дозволяє проводити аналіз
систем, які при відсутності струму потенціометрично не титруються. [2]
9. Іон-селективні електроди
Вирішальний вплив на розвиток і
успіхи іонометричного методу аналізу вплинуло вдале конструювання
іон-селективних електродів на основі різних мембран. Скляні іоноселективні
електроди чутливі до іонів лужних металів Li+, Na+, K+,
Rb+, Cs+, а також Ag+, Tl+, NH4+.
Їх будова і принцип дії такі ж, як і у скляного рН-електроду. Найбільш суттєвою
відмінністю є склад скла, з котрого виготовляються мембрани. Встановлено,
зокрема, що введення Al2O3 в скло позитивно впливає на
селективність мембрани щодо іонів металів, а не до Н+.[3]
Селективний електрод, наприклад, з натрієвою функцією знаходиться в рівновазі з
іонами натрію в розчині:
+(скло)
 Na+(р-н)
Na+(р-н)
В кислому середовищі ця рівновага
може ускладнюватися за рахунок взаємодії з іонами водню:
+(скло)
+ Н+(р-н)  Na+(р-н)
+ Н+(скло)
Na+(р-н)
+ Н+(скло)
Тому в кислих розчинах покази такого
електроду спотворюються.
Важливою характеристикою
іон-селективного електроду є його коефіцієнт селективності, що показує, в
скільки разів електрод більш чутливий до даних іонів, ніж до сторонніх
(заважаючих) іонів. Наприклад, якщо коефіцієнт селективності натрієвого
електроду по відношенню до іонів калію складає 1000, тобто КNa+, K+
= 103, то це означає, що даний електрод в 1000 разів чутливі ший
щодо іонів натрію, ніж до іонів калію. [4] Скляні іон-селективні електроди
широко використовують для визначення катіонів лужних металів в різних
біологічних пробах - крові, плазмі і т.д., в об’єктах довкілля - водах,
рослинах, різних екстрактах і т.д.
9.1 Тверді іон-селективні електроди
В твердих мембранних електродах
іоночутливий елемент виготовляється з малорозчинної кристалічної речовини з
іонним характером провідності. Перенос заряду в такому кристалі відбувається за
рахунок дефектів кристалічної решітки. Вакансії можуть займатися іоном тільки
певного розміру і заряду, що обумовлює високу селективність кристалічних
мембран. Конструктивно такі електроди схожі зі скляними: в обох електродах
мембрана розділяє досліджуваний розчин і розчин порівняння, в якому знаходиться
електрод порівняння (зазвичай хлорсрібний).[1]
З електродів цього типу широко
застосовується фторидний електрод, в якому мембраною є монокристал EuF3,
що має чисто фторидну провідність, з додаванням EuF2 для збільшення
електричної провідності.
.2 Рідинні іон-селективні електроди
В електродах з рідинною мембраною
розчин порівняння відокремлений від аналізованого розчину тонким шаром
органічної рідини, що містить рідкий іоніт, що не змішується з водою, але
селективно реагує з визначуваним іоном. Шар іоночутливої органічної рідини
виходить просочуванням цієї рідини пористої гідрофобної мембрани з пластику.
Схема рідинного іон-селективного
електроду показано на рис.4, де 1 - внутрішній хлорсрібний електрод занурений в
розчин MCl2, де М - визначуваний катіон. Пориста мембрана 3 одним
боком торкається з розчином порівняння хлорсрібного електроду, іншим - з
аналізованим розчином. Іоночутлива рідина в резервуарі 2, що просочила
мембрану, складається з рідкого іоніту, що має кислотні, основні або
хелатоутворюючі функціональні групи, розчиненого в прийнятному розчиннику,
котрий не змішується з водою. [2]
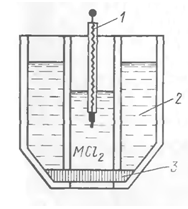
Рис.4. Схема рідинного
іон-селективного електроду
10. Газові електроди
Газовий електрод включає
іон-селективний електрод і порівняльний електрод, що контактують з невеликим
обсягом допоміжного розчину, який відділений від досліджуваного розчину газовим
прошарком або гідрофобною газонепроникною мембраною. [1]
Існує два види газових електродів:
Перший - іон-селективний та
порівняльний електрод занурені у невеликий обсяг розчину певного складу, відокремленого
від досліджуваного розчину гідрофобною газонепроникною мембраною. Для цього
виду електродів використовують два види мембран - гомогенні, що представляють
собою плівку полімеру, в якій розчиняється дифузійний газ, і гетерогенні,
мікропористі, в яких газ дифундує фактично через повітря, що заповнює пори. В
якості мембран використовують - силіконовий каучук, тефлон, поліпропілен.
Мікропористі мембрани володіють кращими дифузійними характеристиками в
порівнянні з гомогенними.
Другий тип - у ньому газопроникна
мембрана замінена газовим прошарком. У цьому електроді для утримання
електроліту на поверхні індикаторного електрода і створення стандартної по
товщині плівки в електроліт вводять ПАР або весь розчин вбирається шаром гелю.
У електроді з гідрофобною мембраною
не потрібно оновлювати шар електроліту на мембрані індикаторного електрода
після кожного виміру; електрод можна використовувати в умовах протоки; на
показання електрода практично не впливають механічні перешкоди (наприклад,
струс); полімерна плівка захищає електрод від впливу повітря.
У електроді з газовим зазором можна
змінювати товщину шару електроліту, змінюючи тиск головки електрода на
полімерну мембрану; шар електроліту на індикаторному електроді дуже тонкий, це
значно скорочує час відгуку електроду; дифузія газу в повітряному прошарку
відбувається набагато швидше, ніж в мембрані з полімеру; через відсутність
прямого контакту електрода з зразком значно зростає термін життя електрода. [3]
Висновок
Головна перевага
потенціометричного методу в порівнянні з іншими методами аналізу - швидкість і
простота проведення вимірювань. Час встановлення рівноважного потенціалу
індикаторних електродів мало, що зручно для вивчення кінетики реакцій і
автоматичного контролю технологічних процесів. Використовуючи мікроелектроди,
можна проводити визначення в пробах об'ємом до десятих часток, см3.
Потенціометричний метод дає можливість проводити визначення в каламутних і
забарвлених розчинах, в'язких пастах, при цьому виключаючи операції фільтрації
і перегонки. Потенціометричні вимірювання відносять до групи неруйнуючих
способів контролю, і аналізований розчин може бути використаний для подальших
досліджень. Похибка визначення при прямому потенциометрическом вимірі становить
2-10%, при проведенні потенціометричного титрування - 0,5-1,0%. Інтервал
визначення вмісту компонентів потенціометричним методом у різних природних і
промислових об'єктах - в межах від 0 до 14 рН для скляних електродів, і від 10
до 10-5 (10-7) М визначається іона для інших типів
іоноселектівних електродів.
Одною з
переваг методу потенціометричного титрування є можливість повної або часткової
його автоматизації. Автоматизувати можна подачу титранта, запис кривої
титрування, відключення подачі титранта в заданий момент титрування,
відповідний точці еквівалентності.
Список використаних джерел
1. Скуд
Д., Основи Основы аналитической химии / Д. Скуд., Д. Вест; [перекл. З англ.] -
Москва: "Мир". - 1979. С. 415-459.
. Васильев
В.П. Аналитическая химия. В 2 ч. Ч. 2. Физико-химические методы анализа: Учеб.
Для химико-технол. спец. вузов. - М.: Высш. шк., 1989. - С. 188-214.
. Шарло
Г. Методи аналітичної хімії. Кількісний аналіз неорганічних сполук. / Гастон
Шарло; [пер. з франц.
П.Агасян]. - Москва: Хімія, 1965. - С. 371-400.
. Отто
М. Современные методы в аналитической химии. / Отто М.; [пер. з нем. яз. под
ред. А.В. Гармаша]. Москва:Техносфера. - 2003. - С.357-374.
. Основи
аналитической химии. Общие вопросы. Методы розделения: учеб. для вузов
[Ю.А.
Золотов, О.Н. Дорохова, В.И.Фадеева и др.; под ред. Ю.А. Золотова]. - [3-е
изд., перераб. и доп.] - Москва: Висшая школа, 2004. - Т.1 - С.132-147.
Тестові завдання
. До потенціометричних методів
аналізу відносять:
а)пряму потенціометрію
б)кондуктометрію в)кулонометрію
. Потенціометричні методи засновані
на вимірювані:
а)об’єму доданого реагенту
б)температури в)електрорушійних сил
. Яке рівняння відомого вченого
застосовується в потенціометрії:
а) Кіргофа б) Нернста в)
Менделеєва-Капейрона
. Електрод, потенціал якого залежить
від концентрації (активності) визначуваного іону, називають:
а)порівняння б)іонообмінним
в)індикаторним
5. Електрод, у котрого в місці
контакту електроду з електролітом, при зміні напряму струму, здійснюється
хімічне перетворення зворотне, тому що відбувалося при початковому напрямі
струму, називається:
а)порівняння б)зворотним
в)незворотним
. В потенціометрії в якості
індикаторних використовують електроди:
а) металічні і мембрані б)мембрані і
іонообміні в)металічні і неметалічні
7.
Частіше всього в якості електродів порівняння використовують електроди:
а) з благородних металів
б)малоактивних металів в) хлорсрібний та каломельний
.Як інакше можна назвати потенціал
рідинного з’єднання:
а)концентраційний б)дифузійний
в)температурний
. Який з методів прямої
потенціометрії знайшов найбільше поширення?
а)визначення рН
б)визначення точної концентрації
реагенту
в)визначення стандартного потенціалу
. Який електрод, в якості індикаторного,
найчастіше використовують для визначення рН розчину?
а)хлорсрібний б)скляний
в)каломельний
. Який метод використовують для
знаходження концентрації визначуваної речовини в пробах зі складною або
невідомою основою?
а)метод добавок б)метод осадження в)метод
кислотно-основного титрування
. При використані яких речовин
особливо зручно використовувати потенціометричне титрування:
а)прозорих розчинів б)колоїдних
розчинів в) забарвлених або непрозорих розчинів
. Що вимірюють в некомпенсаціних
методах потенціометричного титрування?
а) струм, що виникає в гальванічному
елементі
б)різницю потенціалів системи
в)активності іонів
14. Коефіцієнт, що показує, в
скільки разів електрод більш чутливий до даних іонів, називається:
а)коефіцієнтом селективності
б)коефіцієнтом вибірковості
в) індивідуальним коефіцієнтом
. В твердих мембранних електродах
іоночутливий елемент виготовляють з:
а)скла б)благородного металу в)
малорозчинної кристалічної речовини
. Як в рідинних іон-селективних
електродах відокремлюють розчин порівняння від аналізованого:
а)за допомогою металічної перетинки
б)тонким шаром органічної рідини
в)зовсім не змішують
. За допомогою чого в газових
електродах відокремлюють розчин порівняння від аналізованого:
а)газового прошарку або гідрофобної
газонепроникної мембрани
б)гідрофільної газонепроникної
мембрани
в)суміші сірководневого і чадного
газів
. Виберіть головні переваги
потенціометричного методу в порівнянні з іншими:
а)швидкість і простота
б)точність і необхідність в малій
кількості реагентів
в)дешевизна та малі похибки
визначення
. Що є важливою перевагою
потенціометричного титрування?
а)швидкість б)дешевизна в)можливість
автоматизації
. До яких методів відносять
потенціометрію?
а)фізико-хімічних б)фізичних
в)електрохімічних
|
1
|
2
|
3
|
4
|
5
|
6
|
7
|
8
|
10
|
11
|
12
|
13
|
14
|
15
|
16
|
17
|
18
|
19
|
20
|
|
а
|
в
|
б
|
в
|
б
|
а
|
в
|
б
|
а
|
б
|
а
|
в
|
а
|
а
|
в
|
б
|
а
|
а
|
в
|
в
|