|
Подслой под никелирование,
хромирование
|
6-30
|
|
Защита от науглероживания
при цементации
|
48-50
|
|
Получение медной электролитической
фольги
|
10-70
|
|
Улучшение пайки черных
металлов
|
6-30
|
|
Восстановление изношенных
деталей
|
до 3000
|
|
Покрытие валов для глубокой
печати
|
до 3000
|
|
Получение медных деталей
сложного профиля
|
1000 и более
|
|
Получение металлических
копий с художественных изделий
|
1000 и более
|
|
Получение копий при
производстве грампластинок и клише
|
1000 и более
|
Целью данного курсового проекта является расчёт напряжения на ванне
гальванического меднения. Задачей является выбор выпрямительного агрегата.
меднение гальванический электролит
1. Теоретическая часть
Медь - металл розового цвета с атомной массой 63,5,
плотностью 8,9 г/см3, температурой плавления 1083°С, удельным
электросопротивлением 0,017 Ом мм. Медь пластична, твердость медных покрытий
2,5 - 3,0 ГПа. Медь интенсивно растворяется в аэрированных аммиачных и
цианидных растворах, азотной кислоте, медленнее - в хромовой, слабо - в серной
и почти не взаимодействует с соляной кислотой. На воздухе медь легко реагирует
с влагой, углекислыми н сернистыми соединениями, окисляется и темнеет.
Стандартный потенциал меди по отношению к ее одновалентным нонам +0,52 В,
двухвалентным ионам +0,34 В.
В жестких условиях эксплуатации медь и ее сплавы не
должны контактировать с хромом, оловом, сталями, цинком, кадмием, алюминием и
магнием. Пластичность меди, высокая электропроводность привели к широкому
использованию медных покрытий в промышленности.
Медные покрытия широко применяются в основном в
качестве подслоя при нанесении многослойных покрытиях, а также для улучшения
пайки, создания электропроводных слоёв, местной защиты стальных деталей при
цементации [1].
Электролиты меднения
Для электролитического осаждения меди разработано
большое количество электролитов, которые, обычно, разделяют на две группы:
кислые и щелочные [8].
Кислые электролиты меднения
К кислым электролитам относятся сульфатные и
фторборатные электролиты. Их основные достоинства - простота состава и
устойчивость в эксплуатации, но они обладают низкой рассеивающей способностью.
Также из них невозможно непосредственно меднить сталь из-за выпадения
контактной меди, а, следовательно, плохое сцепление со сталью слоя меди.
Вследствие этого меднение осуществляется после предварительного осаждения
медного слоя (3-4 мкм) из щелочных электролитов или после осаждения никелевого слоя
(3-5 мкм).
Из кислых электролитов наиболее распространен
сульфатный электролит. Основными компонентами сульфатных электролитов являются
сульфат меди и серная кислота.
Предполагается, что на катоде разряд двухвалентных
ионов меди протекает в две стадии: Cu2+ -› Cu+ -› Cu0,
причем замедленной стадией является
2+ + e- -› Cu+.
Доля каждой стадии зависит от состава электролита и
режима электролиза: плотности тока, температуры перемешивания.
Электропроводность нейтральных растворов сульфата меди невелика, поэтому в них
добавляют серную кислоту, которая значительно повышает электропроводность
растворов температуры перемешивания.
Выход меди по току около 100 %, так как выделения
водорода на катоде не происходит, поскольку потенциалы выделения меди имеют
более положительные значения, чем потенциалы выделения водорода.
Повышение кислотности электролита способствует
уменьшению растворимости сульфата меди, что приводит к снижению верхнего
предела допустимой плотности тока. Для увеличения концентрации ионов меди в катодном
слое применяют перемешивание. В этом случае кислотность электролитов можно
увеличивать. Чем интенсивнее перемешивание, тем выше может быть содержание
серной кислоты. Повышение температуры способствует увеличению растворимости
сульфата меди: при 25 °С - 23,05 г CuSO4 на 100 г воды; при 100 °С -
73,6 г. Повышенная кислотность способствует получению более
мелкокристаллических осадков.
Вблизи анодов наряду с ионами Cu2+ в
растворе могут находиться в незначительном количестве ионы одновалентной меди,
образующиеся в результате протекания реакции:
+ Cu2+ -› 2Cu+.
При накоплении в растворе ионов Cu+
равновесие будет сдвигаться влево, и металлическая медь будет выпадать в виде
осадка.
При недостаточной кислотности раствора сульфат
одновалентной меди будет гидролизоваться с образованием Сu(ОН)2 или
СuО2
2SO4 + H2O ‹-› Cu2O +
H2SO4.
В результате в электролите будут взвешенные частицы
металлической меди и оксида меди, которые, включаясь в катодный осадок, делают
его темным, шероховатым, а иногда - рыхлым.
Присутствие серной кислоты способствует протеканию
реакций окисления одновалентной меди:
Cu2SO4 + H2SO4
+ 1/2О2 -› 2CuSO4 + Н2О; Cu2O + 2H2SO4 + 1/2O2
-› 2CuSO4 + 2H2O.
Таким образом, серная кислота прежде всего нужна для
предупреждения накопления ионов Cu+ и гидролиза ее солей.
В сульфатные электролиты иногда вводят
поверхностно-активные вещества. Эти вещества вводят для повышения катодной
поляризации, что способствует получению более мелкозернистых плотных, иногда
блестящих, осадков. Благоприятное действие этих добавок сказывается в том, что
они предупреждают образование наростов на краях и выступающих частях деталей.
Наилучшими добавками являются декстрин (не более 1 г/л) и фенол или его
сульфосоединения (1-10 г/л) [8].
Для получения блестящих медных покрытий предложено
большое количество блескообразующих добавок, обеспечивающих зеркальный блеск
покрытий, придающих им пластичность и снижающих внутренние напряжения.
При работе с электролитами для получения блестящих
покрытий особое внимание следует уделять анодам. Используют аноды марки АМФ, не
дающие шлама и содержащие 0,03-0,06 % фосфора. В остальных случаях применяют
аноды из чистой рафинированной меди (99,9 %), содержащей не более 0,1 %
примесей.
Взвешенные частицы шлама обычно являются причиной
грубого шероховатого осадка. Для предотвращения попадания шлама в электролит
рекомендуется аноды помещать в чехлы из кислотостойкого материала и вести
непрерывную фильтрацию электролита.
На качество получаемых блестящих покрытий большое
влияние оказывает концентрация ионов Сl-. При пониженной
концентрации снижается блеск покрытий и образуются прижоги на острых кромках
деталей, при повышенном содержании образуются полосы на покрытиях [5]
Вредными примесями в медных сульфатных электролитах
являются мышьяк, сурьма, некоторые органические вещества, образующие коллоидные
растворы, анодный шлам.
Кроме сульфатных, используют фторборатные электролиты.
Эти электролиты обладают высокой устойчивостью; получающиеся покрытия плотные и
мелкокристаллические, рассеивающая способность электролитов примерно такая же,
как у сульфатных. Большая растворимость фторбората меди позволяет применять
повышенные плотности тока. Из этих электролитов осаждать медь непосредственно
на стальные детали нельзя; необходим подслой никеля или меди из цианидных
электролитов [7]
Щелочные электролиты меднения
К щелочным электролитам относятся цианидные,
пирофосфатные и этилендиаминовые электролиты. Основные достоинства: высокая
рассеивающая способность, получение мелкокристаллических осадков, возможность
непосредственно меднить стальные детали.
Довольно распространены цианидные электролиты. Условия
осаждения меди из цианидных электролитов существенно отличаются от условий
осаждения в кислых электролитах.
В цианидных электролитах медь находится в составе
комплексных ионов, степень диссоциации, а, следовательно, и активность ионов
меди очень мала. Поэтому потенциал выделения меди в них примерно на 0,9-1,2 В
отрицательнее, чем в сульфатных растворах.
При малом количестве цианида аноды пассивируются. При
недостаточном количестве свободного цианида, когда происходит пассивация анодов
и на них разряжаются ионы ОН- с выделением кислорода, то не весь
образующийся кислород выделяется в виде газа, а часть его расходуется на
окисление цианида в цианит. Уменьшение содержания цианидов происходит также
из-за взаимодействия их с углекислотой воздуха и образования карбонатов (NaCN→
Na2CO3 ).
Содержание свободного цианида оказывает на катодный и
анодный процессы противоположное влияние: для катодного процесса требуется
минимальное содержание цианидов, для анодного - максимальное. При недостатке
свободного KCN на анодах образуется зеленоватая пленка CuCN из-за того, что
ионы меди не в состоянии перейти в комплексное соединение. Свободная
поверхность анода уменьшается, плотность тока растет, и анодное растворение
происходит с образованием ионов двухвалентной меди, которые в виде
нерастворимого гидрата осаждаются на аноде. При этом аноды пассивируются и
наблюдается интенсивное выделение кислорода [8].
Основными компонентами медных цианидных электролитов
являются комплексный цианид меди и свободный цианид натрия. Из приведенных
данных видно, что степень диссоциации комплексных ионов очень мала и
уменьшается с увеличением содержания CN- в комплексе. Этим,
по-видимому, объясняется повышение катодной поляризации при увеличении
содержания свободного цианида в электролите.
Постоянным компонентом цианидных электролитов является
карбонат. Он накапливается в результате окисления цианида кислородом воздуха,
особенно при нагревании:
NaCN + 2Н2О + 2NaOH + О2 = 2Na2CO3
+ 2NH3.
Присутствие карбонатов в небольших количествах
полезно, поскольку при этом повышается электропроводность электролитов. Однако
при их накоплении свыше 70 г/л, а в концентрированных - до 140 г/л аноды
проявляют склонность к пассивированию, а покрытия получаются пористыми.
Карбонаты можно удалять при помощи хлорида бария и вымораживанием, охлаждая
электролит до -5 °С. Следует отметить, что карбонаты натрия легче выпадают в
осадок, чем калиевые. Сульфаты существенного влияния на процесс электролиза не
оказывают.
Введение в электролит депассиваторов, в качестве
которых применяют сегнетову соль KNaC4H4O6·4H2O
и роданид калия KCNS, позволяет повысить рабочую плотность тока и устранить
пассивацию анодов, но при этом следует одновременно повышать температуру
электролита.
Высококонцентрированные по меди электролиты,
содержащие депассиваторы, позволяют применять высокие плотности тока (до 10
А/дм2) при повышенной температуре и перемешивании. При этом возможно
получить выход по току, близкий к 100 % [8].
Сульфиды, вводимые в электролит, играют роль
восстановителя, предупреждая накопление в ванне ионов меди Cu2+.
Для замены ядовитых цианидных электролитов применяют
пирофосфатные и этилендиаминовые электролиты.
Из пирофосфатных электролитов получают медные осадки с
мелкозернистой структурой. При нанесении тонких слоев осадки получаются
гладкими, блестящими или полублестящими. Преимущества пирофосфатных
электролитов перед кислыми заключаются в высокой рассеивающей способности и
возможности непосредственно проводить меднение стальных деталей в разбавленном
пирофосфатном электролите.
Основные компоненты пирофосфатных электролитов: CuSO4
или Сu2Р2О7 и К4Р2О7
или Na4P2O7. В растворах в присутствии
Na4P2O7 образуется комплексная соль Na6[Cu(P2O7)2];
при избытке свободного пирофосфата может образовываться Na2[Cu(P2O7)2].
Константы нестойкости комплексов [Сu(Р2О7)2]6-
и [Сu(Р2О7)2]2- соответственно
равны 3·10-3 и 2·10-9.
В щелочных растворах при рН 8 и достаточном избытке
свободных ионов Р2О74- медь находится
преимущественно в виде шестизарядных комплексных ионов [Сu(Р2О7)2]6-.
В пирофосфатные электролиты вводят NH4NO3,
который способствует повышению допустимой катодной и анодной плотностей тока и
улучшает качество осадков. Из пирофосфатных электролитов можно получать
блестящие осадки. В качестве блескообразующих добавок вводят Na2SeO3
совместно с лимонной или триоксиглутаровой кислотой, 2-меркаптотиазол и другие
вещества.
При повышенных плотностях тока может происходить
пассивация анодов за счет образования на их поверхности труднорастворимой
оксидной или солевой пленки. Введение в электролит NH4OH, Na2HPO4·12H2O,
NH4NO3, сегнетовой соли, лимонной кислоты и других
добавок улучшает работу анодов и повышает допустимую анодную плотность тока.
Катодный потенциал меди в пирофосфатных электролитах
имеет более отрицательное значение, чем в кислых.
Большая катодная поляризация объясняется
пассивированием поверхности катода вследствие адсорбции ионов Р2О74-
или образования оксидных (Сu2О8) и труднорастворимых
соединений (Сu2Р2О7) в виде фазовой пленки.
Предполагают, что выделение меди на катоде из
пирофосфатных растворов происходит в результате восстановления двухзарядных
комплексов:
2O72- + 2e- -› Cu + Р2О74-,
образующихся при диссоциации шестизарядных комплексов:
(P2O7)26-
‹-› CuP2O72- + Р2О74-.
С повышением температуры ускоряется выделение меди,
что связано как с ускорением диффузии комплексных анионов к катоду, так и с
облегчением их разряда.
Анодный выход по току в этих электролитах несколько
выше катодного, поэтому при корректировке нет необходимости добавлять медные
соли. Анодную плотность тока рекомендуется поддерживать в пределах 2-4 А/дм2.
При более низкой плотности тока растворение идет недостаточно быстро, при более
высокой - на поверхности анодов образуется труднорастворимая оксидная пленка.
Для предотвращения пассивации анодов должно быть
достаточное количество свободных анионов Р2О74-
и достаточно высокое рН раствора. Повышение температуры способствует отводу
продуктов реакции и, следовательно, уменьшению пассивации анодов. Для этой же
цели в электролиты вводят депассиваторы, которые способствуют снижению
активности ионов Cu2+ в прианодном слое.
При работе пирофосфатных ванн рекомендуется проводить
фильтрацию электролита: для полублестящих осадков - периодически или
непрерывно, для блестящих - непрерывно [8].
Особенностью этилендиаминовых электролитов меднения
является возможность непосредственного меднения стальных деталей. Детали в
ванну загружают под током плотностью в 3-5 раз превышающей рабочую. Составы
большинства электролитов меднения приведены в таблице.
Составы электролитов меднения [5].
|
Тип
|
Номер состава
|
Состав электролита
|
Режим обработки
|
Дополнительные указания
|
|
|
Компонент
|
Количество, г/дм3
|
Температура, 0С
|
Плотность тока, А/дм2
|
|
|
Кислые электролиты
|
1
|
CuSO4∙5H2O H2SO4
|
150-250 50-70
|
18-25
|
1-3
|
При плотности тока более 2
А/дм2 обработку проводят барботажом сжатым воздухом
|
|
2
|
CuSO4∙5H2O H2SO4
NaCl Блескообразователь
|
180-220 45-65 0,05-0,15 4-6
|
20-30
|
0,8-9
|
Обработку проводят
перемешиванием электролита сжатым воздухом и фильтрацией электролита;
ia=0,4-5 А/дм2; аноды - медные с фосфором
|
|
3
|
Cu(BF4) HBF4 H3BO3
|
200-225 5-20 20-35
|
15-30
|
2-6
|
|
|
Щелочные электролиты
|
4
|
CuCN NaCN NaOH
|
20-30 5-10 5-10
|
15-55
|
0,3-2
|
Допускается наличие
углекислого натрия до 80 г/дм3
|
|
5
|
CuSO4∙5H2O
K4P2O7 NH4OH 25%p-p H4P2O7 Аммоний
лимонно-кислый
|
75-100 300-375 2-15 1-10
15-25
|
50-75
|
0,5-5
|
|
|
6
|
CuSO4∙5H2O
Этилендиамин (NH4)2SO4
|
180-250 90-125 60
|
20-40
|
0,5-3
|
2. Расчет габаритных размеров гальванической ванны
Выбор детали
В качестве детали выбрали стальную втулку габаритными
размерами 280х130 мм с круглым отверстием диаметром 160 мм. Медное покрытие из
сульфатного электролита выступает в роли подслоя под никелевое покрытие, с
целью повышения коррозионной стойкости покрытия в целом. Так как из-за разности
потенциалов железа и меди, медное покрытие из сульфатного электролита на сталь
осадить нельзя. Поэтому предварительно на втулку было осаждено медное покрытие,
толщиной 3мкм, из пирофосфатного электролита меднения.
Найдем площадь одной детали:
Sдет= Sве.п+Sн.п+Sб.п+Sвн.п
где Sве.п - площадь верхней поверхности
Sн.п - площадь нижней поверхности
Sб.п
- площадь боковой
поверхности
Sвн.п
- площадь
внутренней поверхности
Sб.п=2πrh
Sв.п=2πrh
где π=3.14
r -
радиус, мм;
h -
высота цилиндра, мм;
Sб.п= Sб.п.1+ Sб.п.2
Sб.п.1=2·3.14·140·100=87920 мм2
Sб.п.2=2·3.14·122.5·30=23079 мм2
Sв.п=2·3.14·80·130=65312 мм2
Sве.п= Sн.п=πr2
Sве.п=3.14·1402-3.14·802=61544-20096=41448мм2
Sдет=41448+41448+110999+65312=259207мм2~0.25м2.
Исходные данные для расчета электрического баланса
Исходные данные для расчета электрического баланса ванны меднения
представлены в таблицах 1 и 2.
Таблица1 - Состав электролита нанесения медного покрытия
|
Компоненты электролита, г/л
|
|
CuSO4∙5H2O
|
200
|
|
H2SO4
|
80
|
Таблица 2 - Параметры технологического процесса
|
Элементы ванны
|
Режим электролиза
|
Показатели
|
|
Площадь одной детали, м2
|
0,25
|
Плотность тока, А/м2
|
300
|
Толщина, мкм
|
9
|
|
Количество деталей, шт.
|
6
|
Температура, К
|
308
|
Выход по току, %
|
100
|
|
Площадь всех деталей, м2
|
1,5
|
Сила тока, А
|
450
|
|
|
Расчет габаритных размеров ванны
Электролизер выполнен из стали толщиной 4 мм, футерованной винипластом
толщиной 10 мм. Ванна ящичного типа, ванна находится на изоляторах.
Расчет длины ванны
Длина ванны определяется по формуле:
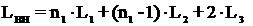
где
n1 - число загружаемых на одну штангу подвесок, 3 подвески;1
- размер подвески по длине ванны, 280 мм;2 - расстояние между
подвесками, 50 мм;3 - расстояние между торцевой стенкой и краем
подвески, 70 мм.
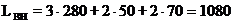 мм
мм
Внутренняя длина ванны составляет 1080 мм.
Расчет высоты ванны
Внутренняя высота ванны равна:
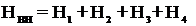
где
Н1 - высота подвески, 280 мм;
Н2 - расстояние от дна ванны до нижнего края детали, 50 мм;
Н3 - высота электролита над верхним краем подвески,150 мм;
Н4 - расстояние от поверхности зеркала электролита до верхнего
края бортов ванны, 50 мм.
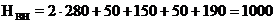 мм
мм
Внутренняя высота ванны составляет 1000 мм.
Расчет размеров и количества анодов
Принимаем толщину анодов 15 мм, расстояние от стенки ванны до боковой
поверхности анода 50 мм. Максимальная длина, на которой могут быть расположены
аноды, равна внутренней длине ванны, т. е. 1080 мм. Каждую анодную штангу
завешиваем 3 анодами каждый шириной 320 мм.
Расстояние от днища ванны до нижнего края анода 200 мм, а расстояние от
верхнего края ванны до верхней части анода 100 мм.
Высота анода составляет:
Hа = Hвн - 200 - 100 = 1000 - 200 - 100 =700 мм.
SA=2(0,32·0,01+0,32·0,7+0,01·0,7)=0,4684 м2
Sобщ.A= 0,4684·6=2,8104 м2
ma = La·Ba·Ha·ρa,
где La - длина анода, 320 мм;
Ba - толщина анода, 15 мм;
Ha - высота анода, 700 мм;
ρa - плотность материала анода (меди),
8900 кг/м3.
ma = 0,320·0,010·0,700·8900 = 19,936 кг.
Один анод имеет массу 19,936 кг.
Откорректировав рассчитанные внутренние размеры ванн, в соответствии с
ГОСТ 23738-85 [2] выбираем нормализованную ванну с размерами 1120×710×1000
мм с полной вместимостью
795 л.
3. Электрический баланс гальванической ванны
Расчет электрического баланса необходим для определения напряжения на
ванне гальванического меднения и дальнейшего выбора необходимого источника
постоянного тока.
Общее уравнение электролитического напряжения на электролизере:
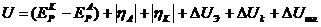 ,
,
где
U- напряжение на электролизере;
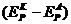 -
разность равновесных электродных потенциалов анодной и катодной реакции;
-
разность равновесных электродных потенциалов анодной и катодной реакции;
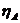 ,
, 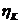 - перенапряжения для катодной и анодной реакций;
- перенапряжения для катодной и анодной реакций;
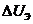 -
падение напряжения в электролите;
-
падение напряжения в электролите;
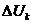 -
падение напряжения в контактах, а также в токоподводящих шинах до источника
питания постоянным током;
-
падение напряжения в контактах, а также в токоподводящих шинах до источника
питания постоянным током;
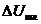 -
падения напряжения в шламе.
-
падения напряжения в шламе.
Расчет
электрохимических составляющих падения напряжения
Реакция
на катоде: 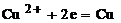
Реакция
на аноде: 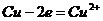
Разность
равновесных электродных потенциалов анодной и катодной реакции
На
катоде в ходе электролиза восстанавливается тот же продукт, который образуется
на аноде, выхода по току принимаем одинаковыми, равновесные потенциалы этих
реакций равны между собой и обратимое напряжение на электролизере равно нулю.
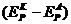 = 0
= 0
Расчет
катодного и анодного перенапряжений по уравнениям электрохимической кинетики
В
отсутствии литературных данных рекомендуется следующие методы расчета:
по
уравнению замедленного разряда для электрохимических реакций, ток обмена
которых меньше 1А/м2 (1*10-4 А/см2)
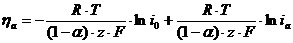 ;
;
по
уравнению смешанной кинетики при 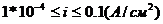
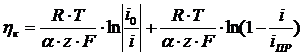 ,
,
где
R - газовая постоянная, равна 8,314;
T - температура,
К;
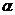 - число
переноса;
- число
переноса;
z - заряд иона;
F - постоянная
Фарадея, 96500, Кл/моль;
i - плотность
тока, А/м2;
io -
ток обмена, А/м2.
Ток
обмена определяется следующим образом:
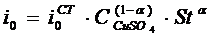
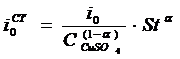 ,
,
где
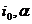 могут быть найдены в справочнике [3].
могут быть найдены в справочнике [3].
,8М
CuSO4+1M H2SO4
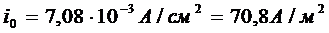 ,
, 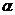 =0.32, тогда
=0.32, тогда
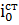
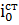 =
=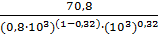
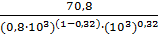 = 8,2·10-2
А·м/моль.
= 8,2·10-2
А·м/моль.
Рассчитаем концентрацию используемого электролита:
С(CuSO4)= 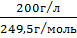
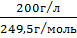 = 0,802
моль/л и С(H2SO4)=
= 0,802
моль/л и С(H2SO4)= 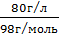
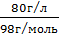 = 0,816
моль/л.
= 0,816
моль/л.
Пересчитаем
ток обмена на концентрацию 0,802 моль/л
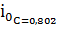
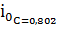 =8,2·10-2
=8,2·10-2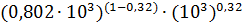
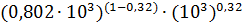 = 70,58
А/м2.
= 70,58
А/м2.
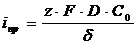 ,
,
где D - коэффициент диффузии ионов меди, D = 7,2·10-8 м2/с;
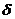 -
толщина диффузионного слоя, которая для условий естественной конвекции может
быть принята равной 1·
-
толщина диффузионного слоя, которая для условий естественной конвекции может
быть принята равной 1·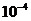 м.
м.
Для
катодного процесса, где 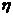 <0, i>0, расчет ведем по уравнению смешанной кинетики.
<0, i>0, расчет ведем по уравнению смешанной кинетики.

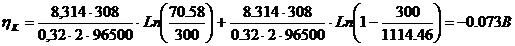
Рассчитаем катодный ток, исходя из того что на одной подвеске
располагается 3 деталей, в ванне 2 подвески:
I = 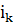
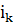 ·
·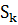
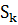 ,
,
=
300·1,5= 450 А.
Затем
при помощи формулы посчитаем 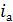
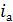 :
:
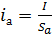
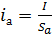
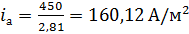
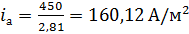
Для расчета анодного перенапряжения воспользуемся уравнением замедленного
разряда
ηА = 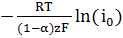
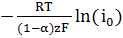 +
+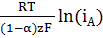
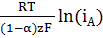 .
.
Анодное
перенапряжение для разряда ионов меди составляет:
ηa = 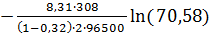
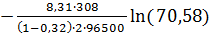 +
+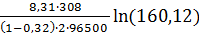
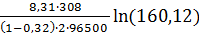 = 0,0159
В.
= 0,0159
В.
Расчет электропроводности электролита по уравнению
Для плоскопараллельных электродов падение напряжения в электролите
рассчитывается по закону Ома:
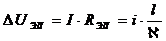 ,
,
где
i - плотность тока, А/м2;
l- расстояние
между электродами, м;
 -удельная
электропроводность электролита, См*м-1
-удельная
электропроводность электролита, См*м-1
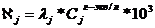 ,
,
где
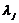 - эквивалентные электропроводимость j
компонента;
- эквивалентные электропроводимость j
компонента;
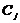 -
концентрация j компонента.
-
концентрация j компонента.
Расчет
производится в следующей последовательности:
1. Суммарную концентрацию компонентов в растворе, моль/л
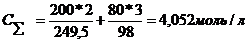
По
справочнику [3] находим эквивалентные электропроводимости компонентов для
концентрации 4,052моль/л. Так как в справочнике для CuSO4 сразу не указана нужная нам концентрация, определяем
уравнение зависимости удельной электропроводности от концентрации и в него
подставляем 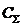 .
.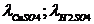
Таблица
3 - Эквивалентная электропроводимость сульфата меди [3]
|
С, моль/л
|
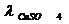 , Ом*м*моль/л , Ом*м*моль/л
|
|
0,1
|
43,86
|
|
0,5
|
31
|
|
1
|
25,83
|
|
2
|
20,15
|
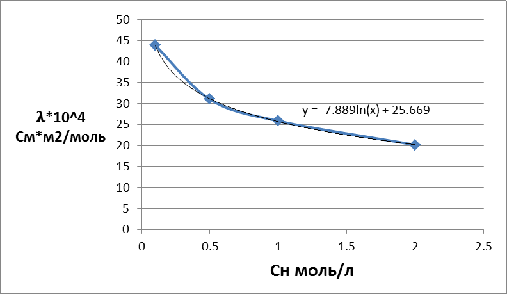
Рисунок 2 - Зависимость эквивалентной электропроводности от концентрации
сульфата меди.
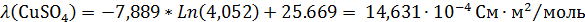
Находим
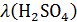
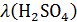
|
ω,
%
|
ρ,
г/см3
|
Сн моль/л
|
𝛌*10^4, См*м2/моль
|
ρ, г/л
|
|
7
|
1,045
|
14,93
|
206,9
|
1045
|
|
10
|
1,065
|
21,73
|
196,4
|
1065
|
|
14,56
|
1,1
|
32,69
|
180
|
1100
|
|
19,8
|
1,135
|
45,86
|
156,5
|
1135
|
|
25,31
|
1,18
|
60,95
|
131,4
|
1180
|
|
29,47
|
1,215
|
73,07
|
113,5
|
1215
|
|
34,28
|
1,255
|
87,80
|
93,65
|
1255
|
|
39,1
|
1,295
|
103,34
|
75,85
|
1295
|
Плотность находим по справочнику [4].
Затем по формуле определяем нормальную концентрацию
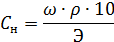
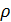
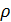 -
плотность
-
плотность 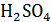
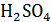 ;
;
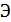
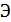 -
эквивалент
-
эквивалент 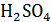
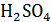 .
.
Построим
зависимость эквивалентной электропроводности от нормальной концентрации,
найденной по формуле:
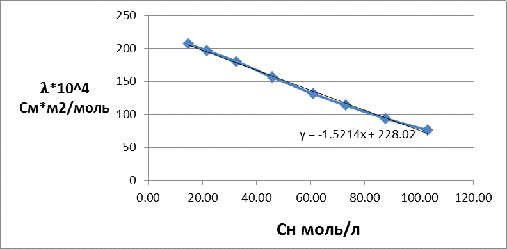
Рисунок 3 - Зависимость удельной электропроводности от концентрации
По зависимости находим уравнение линии тренда, где вместо х подставляем
суммарную концентрацию:
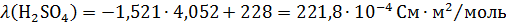
2. Определим удельные электропроводимости компонентов в смешанном
растворе, См*м
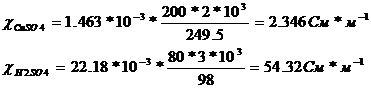
Суммарная электропроводность раствора электролита составляет
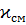
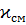 = 54,32 +
2,346= 56,666 См/м.
= 54,32 +
2,346= 56,666 См/м.
Расчет
напряжения на ванне
Падение напряжения в электролите:
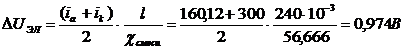
где l - межэлектродное расстояние;
ia, ik - плотность тока анодная, катодная;
 -
удельная электропроводность электролита.
-
удельная электропроводность электролита.
Расчет
напряжение на ванне
При
расчете напряжения на ванне, необходимо учитывать падение напряжения в
контактах, а также в шинах от выпрямителя до ванны. Эта величина оценивается
увеличением расчетного напряжения на 10%.
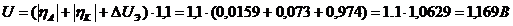
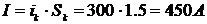
.
Выбор выпрямительного агрегата
Для
питания ванны выбираем тиристорный выпрямительный агрегат ТЕ1-800/12Т-0УХЛ4 с
естественным охлаждением, с номинальным выпрямленным напряжением 12 В и
номинальной силой тока 800 А.
Заключение
В данном курсовом проекте было рассчитано напряжение на ванне
гальванического меднения, которое составило 1,169 В при токовой нагрузке 450 А.
По полученным данным был выбран тиристорный выпрямительный агрегат
ТЕ1-800/12Т-0УХЛ4.
Библиографический список
1. Дасоян М.А., Пальмская И.Я., Сахарова Е.В. Технология
электрохимических покрытий: Учеб. для средних специальных учебных заведений. -
Л.: Машиностроение. 1989. - 391 с.
. Технологические расчеты оборудования электрохимических
производств. /Рудой В.М., Останина Т.Н., Мурашова И.Б. и др. - Екатеринбург:
УГТУ-УПИ, 2006. - 80 с.
. Справочник по электрохимии/ под ред. А.М. Сухотина - Л.:
Химия 1981. - 488 с.
. Справочник химика, том 3. - Л: Химия, 1965. - 1008 с.
. Беленький М.А., Иванов А.Ф. Электроосаждение металлических
покрытий: Справочник. - М.: Металлургия, 1985.- 288 с.
. Ямпольский А.М., Ильин В.А. Краткий справочник
гальванотехника. Л.: Машиностроение, 1981.- 269 с.
. Лайнер В.И., Кудревцев Н.Т. Основы гальваностегии. М.-Л.:
Металлургия, 1936. - 368 с.
. Гальванические покрытия в машиностроении: Справочник в 2-х
томах / под ред. М.А. Шлугера - М.: Машиностроение, 1985. - 240 с.