Підвищення збереженості живців смородини чорної та малини червоної після їх перебування при низьких температурах
ЗМІСТ
Вступ
.
Аналітичний огляд літературних джерел
.1
Обґрунтування вибору біооб’єкта
.2
Технології зберігання статевих клітин рослин
.3
Біологічні фактори, які визначають відтворюваність рослин після довгострокового
зберігання їх генетичного матеріалу
.3.1
Фактори, які впливають на приживлюваність живців після їх довготривалого
зберігання
.3.2
Значення стимуляторів та вітамінів для живцювання та їх застосування
.3.3
Фактори, що впливають на життєздатність живців рослин після їх тривалого
зберігання
.3.3.1
Значення вікового стану живців
.3.3.2
Фізіологічна й біохімічна природа зимостійкості
.3.4
Фактори, які впливають на збереженість рослинних об’єктів після їх
довгострокового зберігання
.3.4.1
Фізіологічний механізм морозостійкості рослин
.3.4.2
Виникнення студню під час періоду спокою
.3.4.3
Зміни у вмісті клітин під час проходження фази загартовування
.3.4.4
Стан води в тканинах при дії низьких температур
.4
Технологічні фактори, які визначають виживаність живців після їх довготривалого
зберігання
.5
Довгострокове зберігання рослинних об’єктів під впливом низьких температур
.6
Кріоконсервування як альтернативний спосіб зберігання генофонду рослин
.6.1
Технології довгострокового зберігання пилка і насіння за азотних температур
.6.2
Кріоконсервування верхівкових меристем клітин рослин
.6.3
Зберігання здерев’янілих живців рослин за наднизьких температур
.7
Відновлення повноцінних рослин після їх довготривалого зберігання
.
Матеріали та методи
.1
Методи перевірки збереженості
.2
Методи визначення життєздатності живців рослин
.3
Методи визначення приживлюваності живців
.4
Порядок проведення експерименту
.
Експериментальна частина
.1
Умови та тривалість зберігання живців ягідних культур за субнульових температур
.2
Визначення оптимальних умов охолодження та строку зберігання живців рослин за
низьких температур
.3
Визначення умов кріоконсервування живців за наднизьких температур, що
забезпечують їх максимальну життєздатність
.4
Порівняльний аналіз досліджених способів зберігання
.5
Визначення впливу стимуляторів росту на активність коренеутворення та
подальшого розвитку деконсервованих живців
.
Охорона праці та навколишнього середовища
.1
Загальні положення про охорону праці
.2
Управління охороною праці на підприємстві
.3
Промислова санітарія
.3.1
Шкідливі речовини, які зустрічаються у лабораторії
.3.2
Метеорологічні умови
.3.3
Вентиляція
.3.4
Освітлення
.3.5
Шум
.3.6
Водопостачання і каналізація
.4
Електробезпека
.5
Пожежна безпека
.6
Охорона навколишнього середовища
.7
Індивідуальне завдання
.
Економічна ефективність науково-дослідної роботи
.1
Розрахунок собівартості та ціни науково-технічної продукції
.1.1
Визначення матеріальних витрат
.1.2
Витрати на оплату праці та відрахування на соціальні заходи
.1.3
Розрахунок амортизації основних фондів
.1.4
Розрахунок витрат за пунктом «інші витрати»
.1.5
Калькуляція собівартості НДР
.1.6
Визначення договірної ціни
.2
Розрахунок ефективності НДР теоретичного характеру
.2.1
Розрахунок науково-технічного ефекту НДР
.2.2
Оцінка долі творчої праці за типовими етапами НДР
.
Цивільна оборона
Висновки
та рекомендації
Перелік
джерел інформації
зберігання насіння стимулятор ріст
ВСТУП
За останні роки клімат на планеті
дуже змінився. Влітку багато цінних сортів рослин висихає, їх пошкоджують
хвороби та паразити. Неодмінно це несе великі збитки як для землеробів, так і
для країни в цілому. Тому постає питання збереження генетичного матеріалу тих
сортів рослин, що поширені та дають добрий врожай в умовах нашого регіону.
Необхідність розвитку національного
генетичного банка рослин України полягає у довготривалому збереженні генетичної
розмаїтості сільськогосподарських культур і у забезпеченні вихідним матеріалом
селекційних, наукових, освітніх та інших програм. У зв’язку з постійним
скороченням світових рослинних ресурсів, гостро стоїть питання збереження
генофонду культурних і дикоростучих видів рослин. Особливо актуальною є
проблема збереження генплазми ягідних культур у вигляді живців, бруньок,
насіння, пилку, меристем та культурі in vitro, яка вирішується в даній науковій
роботі шляхом удосконалення способів зберігання органів рослин з метою їх
подальшого відтворення.
Мета: здійснити порівняльний аналіз
існуючих способів зберігання живців ягідних культур рослин: за субнульових (0±5
ºС),
низьких (близько -30 ºС)
та наднизьких (-196 ºС)
температур.
Завдання наукової роботи:
визначити строк зберігання живців за
субнульових температур (0±5 ºС),
що забезпечує їх максимальну життєздатність;
визначити вплив ступеня вологості
живців рослин, швидкості і кінцевої температури охолодження на збереженість,
життєздатність та приживлюваність зразків;
визначити умови охолодження та строк
зберігання живців за низьких температур (близько -30 ºС),
що забезпечує їх максимальну життєздатність;
визначити умови кріоконсервування
живців за наднизьких температур (-196 ºС),
що забезпечує їх максимальну життєздатність;
визначити вплив стимуляторів росту
на активність коренеутворення та подальшого розвитку деконсервованих живців.
Використана методика дослідження:
аналітичний огляд літератури, побудова гіпотези, планування майбутнього
експерименту, фізичні, біологічні, біофізичні і кріобіологічні методи, методи
вимірювання, обробки результатів дослідів.
Об’єкт дослідження - процес
зберігання живців ягідних культур рослин.
Предмет дослідження - живці чорної
смородини (Ribes nigrum L.) Дачниця та малини червоної (Rubus idaeus L.) Новина
Кузьмина.
1. АНАЛІТИЧНИЙ ОГЛЯД ЛІТЕРАТУРНИХ
ДЖЕРЕЛ
.1 Обґрунтування вибору біооб’єкта
На протязі останніх років,
завдячуючи традиційній селекційній роботі кількох поколінь вчених, створені
сорти ягідних культур рослин, зокрема чорної смородини та малини, які мають
цілий комплекс позитивних якостей: вони крупноплідні, смачні та ароматні,
відрізняються підвищеним вмістом корисних речовин та стійкі одразу до кількох
хвороб й шкідників.
«Без смородини немає здоров’я»,
казали наші пращури. Сторіччями входила смородина до числа засобів первинної
допомоги при кишково-інфекційних та простудних захворюваннях, падінні імунітету
та життєвих сил. Сучасні медики рекомендують її в якості одного з найефективніших
засобів для нормалізації обміну речовин та зміцнення імунітету, що, власне, й
допомагає протистояти будь-якій напасті [1].
Якісне оновлення сортименту ягідних
культур відбувалося шляхом віддаленої гібридизації, тобто об’єднання геномів
різних видів, що дозволило отримати надзвичайно великий генетично різноманітний
матеріал та відібрати необхідні високо адаптовані генотипи. Сучасний етап
селекції спеціалісти називають «адаптивним», тобто спрямованим на створення
сортів, пристосованих до еколого-кліматичних катаклізмів та інших стресів.
Поряд із традиційними методами (віддалена та міжсортова гібридизація,
самоопилення, мутагенез, поліплоїдія) в сьогоднішній селекції все ширше
застосовують генні технології.
За всіх часів однією з головних
задач селекціонерів був відбір рослин за стійкістю до шкідників. Для багатьох
сільськогосподарських культур ця проблема, здавалося б, назавжди була вирішена
в кінці минулого тисячоліття, коли з’явилися генно-модифіковані рослини.
Економічний виграш від застосування таких рослин складає близько 2,7 млрд.
доларів. Таким чином, вирощування генетично модифікованих культур видається
принаймні на 10 % рентабельнішим, ніж звичайних, нетрансгенних, та вони
поширюються все більше.
До нещодавно переможного руху
ГМ-сортів протистояли лише обережні попередження екологів про їх можливий
негативний вплив на оточуюче середовище та здоров’я людини. Прихильники
трансгенних рослин відповідали на це, що і лабораторні тести і досвід
вирощування трансгенних сільгоспкультур в природних умовах показали їх повну
безпечність. Лише зараз, через десятиліття після початку промислового
вирощування трансгенних рослин, стає більш-менш зрозуміло, яку шкоду може
нанести оточуючому середовищу промислове вирощування таких культур. Перед тим
як рослини та тварини, генетично модифіковані для виробництва лікарських
субстанцій - антибіотиків, вакцин, гормонів, ферментів - та інших біологічно
активних речовин, потраплять із лабораторій в менш контрольовані умови
промислового виробництва, необхідно вдаватися до особливих застережних заходів,
адже мішенями нових утворених сполук можуть стати не комахи, а люди та інші
ссавці. Оскільки практично всі ці речовини відносяться до ксенобіотиків, їх
здатність зберігатися в оточуючому середовищі мало досліджена, а тому
потенціальний шкідливий вплив неможливо оцінити навіть приблизно. Крім того,
виявилося, що деякі методики, котрі застосовували в лабораторних експериментах,
та тест-об’єкти не завжди були адекватними до поставлених задач. І нарешті,
зараз накопичилося достатньо даних про те, що популяції шкідників сільського
господарства виробили імунітет та вже починають живитися трансгенними рослинами
[2,3].
Серед найважливіших досягнень
традиційної селекції чорної смородини та малини називають створення сортів з
імунітетом до хвороб та шкідників. А це, без перебільшення, прорив у селекції.
Помітно змінився розмір ягід, збільшилась врожайність. Але набагато важливішим
є не розмір ягід, а їх смак, аромат, та вміст вітамінів. Середній показник
вмісту вітаміну С в нових сортах чорної смородини 160 мг/100 г ягід.
Високовітамінних, нажаль, зовсім небагато. За кількістю Р-активних речовин, що
впливають на укріплення судин, закономірність така ж сама: переважають сорти
чорної смородини з помірним вмістом - по 400 мг/100 г ягід. Так, розмір ягід
виявляється обернено пропорційним наявності вітаміну С: чим крупніше ягода, тим
вітаміну менше.
Як показали дослідження
співробітників Всеросійського інституту рослинництва та вчених Горно-Алтайської
дослідної станції НДІ садівництва Сибірі, не менш важлива й вітамінна цінність
листя чорної смородини. За вмістом вітамінів С та Р вони перевищують ягоди на
кущах будь-якого сорту. Мабуть, настав час розпочати селекцію зі створення
сортів смородини з вітамінним листям. Тим паче, що гурманів корисного
ароматного чаю мільйони [1].
.2 Технології зберігання статевих
клітин рослин
Розрізняють дві породи ягідних
культур: насіннєві та кісточкові.
Вид - це реально існуюча генетично
неподільна одиниця живого світу, основна структурна одиниця в системі
організмів. Це таксономічна, систематична одиниця, група особин із загальними
морфологічними, біохімічними та іншими ознаками, здатними до взаємного
схрещування, яке дає в ряду поколінь родючих нащадків, що закономірно
розповсюджені в межах певного ареалу та подібно змінюються під впливом факторів
навколишнього середовища.
Сорт - це група культурних рослин,
які в результаті селекції мають певний набір характеристик (корисних чи
декоративних), котрий відрізняє групу рослин від інших рослин того ж виду. Кожен
сорт рослин має власну назву [4].
Серед різноманіття способів
розмноження найпоширеніший - статевий, тобто розмноження насінням. Однак певні
рослини взагалі не утворюють насіння, у інших воно повільно та важко проростає.
Іншим рослинам потрібно кілька років для досягнення цвітіння, а існують і такі,
що не відтворюють ознак сорту. Насіння рослин має гаплоїдний набір хромосом.
Оскільки під час розмноження
насінням у нащадків змінюється генотип вихідного сортотипа рослини, в практиці
садівництва в основному удаються до вегетативних способів розмноження.
Вегетативний - це нестатевий спосіб розмноження рослин, тобто утворенням нового
організму з частини материнського. Такими органами можуть слугувати: спори,
стеблясті живці, цибулини, бульбоцибулини, бульби, кореневища, нащадки та вуса,
листкові зародки, листкові живці, відгалуження, кореневі живці, бульбо-подібні
корені, бруньки, частини пагону, гілки [5].
Найкращий спосіб збереження
генофонду рослин, що розмножуються вегетативно, - це кріоконсервування верхівкових
меристем пагонів. Даний спосіб має багато переваг, але пов'язаний із
необхідністю створення спеціальної лабораторної бази, значними затратами
робочого часу кваліфікованих спеціалістів, складністю виконання процедури
регенерації меристем. Однак через сучасний матеріальний та фінансовий стан
діяльності Національного генбанка України, забезпечити зберігання таких зразків
наразі неможливо.
В 1959р. І.І. Туманов із соавт.
встановили, що гілки добре загартованих деревних та чагарникових морозостійких
рослин можна успішно заморожувати до температури рідкого азоту. Пізніше цей
факт підтвердив A.Sakai. Після відтавання живці берези, чорної смородини,
вишні, яблуні відновлювали ріст, розкривали листя та вкорінювались [6].
Таким чином, бачимо що для тривалого
(необмеженого у часі) підтримання стабільності генетичної інформації рослин
придатні насіння, меристеми, пилок, ембріоїди і інші рослинні об’єкти, які
несуть генетичну інформацію (рис. 1.1).
Серед великої кількості технологій
зберігання можна виділити три, мета в яких одна - збереження біологічного
матеріалу. Різниця ж полягає в способах здійснення поставленої задачі та
специфіці кожного з об’єктів.

Рисунок 1.1 - Технології зберігання
статевих клітин рослин
Перший етап: відбирають зразки та
обов’язково проводять оцінку їх збереженості, життєздатності та
приживлюваності, виміряють вологість. Нежиттєздатні зразки відкидають.
Другий етап: підготовка біооб’єкта
до заморожування для попередження внутрішньоклітинного кристалоутворення. У
випадку з насінням та живцями - це сушіння, а для меристемальних клітин -
еквілібрація з кріопротектором. Насіння повинно мати вологість (10-12) %.
Меристемальні клітини із додаванням кріопротектора можна ліофілізувати, а для
живців ступінь вологості не повинна бути меншою за 30 %. Для збереження в них
вологи, доцільно вкривати кінці воском чи парафіном. Зниження вологості
призводить до ефекту плазмолізу, а перевищення - до внутрішньоклітинного
кристалоутворення.
Третій етап: після досягнення
заданого рівня вологості, зразки охолоджують та направляють на зберігання. Для
насіння рентабельними температурами є +5 та -30 0С. Меристеми та живці доцільно
зберігати в рідкому азоті (-196 0С) або його парах (-150<-196 0С) на протязі
необмеженого інтервалу часу чи за температур -30 0С протягом декількох років з
подальшою перезакладкою.
Четвертий етап: за необхідністю
отримання потомства чи перезакладки, зразки відігрівають, відновлюють нормальну
вологість та пророщують.
.3 Біологічні фактори, які визначають
відтворюваність рослин після довгострокового зберігання їх генетичного
матеріалу
Розмноження за допомогою
здерев’янілих живців, мабуть, є одним з найлегших способів вегетативного
розмноження. Зберігання живців рослин є набагато дешевшим за зберігання
меристемальних клітин, хоча й потребує розробки спеціальних технологій їх
довготривалого зберігання через їх невисоку життєздатність у зв’язку з впливом
багатьох факторів як біологічного, так і технічного характеру.
.3.1 Фактори, що впливають на приживлюваність
живців рослин після їх довгострокового зберігання
Приживлюваність - це властивість
рослин утворювати за певних умов придаткові корені на вегетативних органах
(живцях), перетворюючись на самостійну рослину. Укорінюваність стеблистих
живців заснована на біологічній властивості деревних рослин відновлювати чи
регенерувати втрачені органи. Під час живцювання різко порушується цілісність
рослини. Перерваний процес розвитку призводить до перебудови тканин стебла як у
фізіологічному, так і у структурному відношенні. В тканинах стебла живця
виникають осередки дрібних клітин, які швидко діляться, що дають початок новим
тканинам, зазвичай не виникаючим в них. Формування нових тканин, а згодом й
органів - коренів пов’язане з підвищенням фізіологічної активності. Ця
здатність виникла та сформувалась у процесі еволюції як спосіб збереження виду
рослин за мінливих умов навколишнього середовища та є біологічною ознакою виду
[7].
Формування та ріст коренів й пагонів
залежить як від зовнішніх факторів (субстрат, вологість субстрату та оточуючого
повітря, світла, температури, достатнього доступу кисню), так і від
фізіологічного стану тканин живців, які укорінюють [8]. Той чи інший
фізіологічний стан тканин пов'язаний зі зростанням материнської рослини та
пагонів, з котрих відрізують живці, від походження та умов поширення
материнських рослин.
За властивістю живців утворювати
корені, рослини поділяють на легко-, середньо- та важкоукорінювані. Тобто одні
рослини легко та швидко утворюють придаткові корені, другі повільно та в
невеликій кількості, а треті практично зовсім не розмножуються таким способом.
Тривалість укорінення коливається в залежності від виду та сорту рослини.
На думку одних дослідників,
укорінюваність живців залежить від тривалості вегетації: у рослин, які важко
укорінюються - короткий період вегетації, пагони деревеніють швидше, ніж у
видів з довготривалим вегетаційним періодом, котрі виявляють найкращу
регенераційну здатність. Інші спеціалісти вважають, що здатність до
укорінювання не має закономірної відповідності з темпами росту рослин та
систематичним положенням видів. В кожному роді є види, які укорінюються краще
або гірше. Укорінюваність живців залежить від умов живлення маточної рослини.
Для утворення придаткового коріння в живці має бути певний запас поживних
речовин. В дуже розвинутих пагонах цих речовин відкладається більше, тому живці
з них укорінюються краще, ніж взяті зі слабко розвинутих пагонів [7,9].
Як і для інших способів
розмножування, найважливішим фактором успішного укорінення живців є, мабуть,
підготовка маточної рослини, що полягає у короткому обрізанні за рік до
живцювання. В результаті такого обрізання на рослині утворюються пагони, які
здатні до інтенсивного утворення коренів [10].
Цікаво, що здатність рослин давати
живці, які укорінюються, залежить від живлення материнської рослини. Якщо воно
в надлишку отримувало азот, коріння на живцях утворюється дуже погано. Важко
утворюються корені і у рослин, які «голодували». Для максимально активного
утворення коріння, материнська рослина повинна бути повністю забезпечена
калієм, фосфором і трішки недоодержувати азот. Всі умови, які сприяють доброму
росту маточників з утворенням сильних та соковитих пагонів, чинять ефективний
вплив на успішне укорінення зрізаних з них живців.
Важливо й те, з яких пагонів взяті
живці. Пагони, що жирують та потужно ростуть вгору, дають живці поганої якості.
Отже, не треба націлюватись на міць та розмір, набагато краще вкорінюються
живці з бокових гілок, котрі ростуть не дуже сильно.
Щоб стимулювати інтенсивне утворення
пагонів у маточної рослини, під час спокою її піддають короткому обрізуванню.
Коли листя починає опадати, сікачем вирізають дерев’янисті пагони поточного
року.
Зліва стебловий живець. Зріз
посередині міжвузля роблять, як правило, під час нарізання живців зі зрілих
здерев’янілих пагонів.
Має значення і те з якої частини
пагона взятий живець. Часто для живцювання беруть дуже довгі пагони, з яких
сікачем нарізають велику кількість живців. Чим нижче знаходиться відрізок
стебла, з якого взятий живець, тим краще у більшості рослин він укорінюється
[10,11].
Під час нарізання на живці
дерев’янистих пагонів малини, рекомендовано верхню частину пагону відкинути,
оскільки вона недостатньо визріває й часто має слабо розвинуті бруньки. Нижній
зріз роблять косим під самою брунькою, до того ж ніж прикладають зі сторони
протилежної нижній бруньці; верхній зріз - на певній відстані від бруньки, щоб
неминуче відсихання верхівки живця не торкнулося бруньки, що проростає. У добре
вкорінюваних рослин, таких як верба, тополя, смородина, однаково високу
здатність до утворення пагонів має будь-яка частина пагона [8,10].
В якості дерев’янистих живців
частіше за все беруть однорічні пагони із деревиною, що добре визріла. Живці,
взяті з дворічних та старших пагонів, гірше утворюють корені. Для рослин, що
легко укорінюються, вік материнської рослини ролі не відіграє, але для тих
рослин, які важко живцюються, це дуже важливо. У живців, що беруть з молодих за
віком рослин, не тільки вище процент приживлюваності, а й процес
коренеутворення проходить більш інтенсивно. Вік материнської рослини, окремого
пагону, його частин є дуже важливим фактором, який необхідно враховувати
особливо під час живцювання рослин, що важко укорінюються. В молодому віці
живцюються навіть такі рослини, які живцювати не прийнято, наприклад, яблуні та
груші, у яких після обробки препаратом гетероауксин (стимулятором утворення
коренів) легко вкорінюються верхівкові живці, взяті з однорічних сіянців. Проте
легкість утворення коренів у живців, заготовлених з однорічних гілок, падає із
збільшенням віку дерева, навіть при обробці стимуляторами. Більш за те, деякі
рослини із віком взагалі втрачають здатність до вегетативного розмноження.
Пагони молодих маточників мають великий період росту, більшу довжину та більш
багаті на запасні поживні речовини, тому живці з них краще укорінюються та
швидше ростуть. Для кущів, у яких постійно оновлюється крона, вік на
укорінюваність живців не чинить істотного впливу [7,8,11].
.3.2 Значення стимуляторів росту та
вітамінів для живцювання та їх застосування
Використовуючи дерев’янисті живці
зазвичай розмножують рослини, що легко укорінюються та за наявності достатньої
кількості маточних екземплярів. До таких рослин відносяться чорна смородина,
малина, аґрус, багато верб, виноград та інші рослини.
З метою пришвидшення, стимуляції
утворення коренів, підвищення відсотку приживаності та посилення подальшого
зростання підготовлені стовбурові, кореневі та листкові живці обробляються
стимуляторами росту або стимуляторами росту у поєднанні з вітамінами та іншими
хімічними препаратами. Багатолітньою практикою підібрані заходи та умови
укорінення рослин, проте залишається необхідність використання стимуляторів
росту, таких як гетероауксин, бета-індолілмасляна та альфа-нафтилоцтова
кислоти, під час розмноження рослин живцями [8].
Під впливом стимуляторів росту
значно підвищується процент укорінення у живців рослин, що важко укорінюються,
тоді як у багатьох з них необроблених цими речовинами коріння не виникає
зовсім. Живці рослин, які укорінюються середньо та легко, в результаті обробки
стимуляторами починають утворювати корені значно швидше, ніж без такої обробки;
у тих, котрі укорінюються середньо також підвищується відсоток приживлюваності
після обробки. Часто трапляється, що у живців рослин, які легко укорінюються,
коріння з’являється одночасно як у оброблених, так і в контрольних, проте
стимулятори росту сприяють утворенню більш сильної кореневої системи. Коріння
після оброблення утворюється нормальне. Живці, оброблені стимуляторами, на
початку зростають значно швидше за необроблені.
Але стимулятори росту чинять
ефективну дію на коренеутворення тільки у тому випадку, коли враховується вік
та фізіологічний стан живця, температура, світло, вологість, субстрат й інші
фактори, які впливають на утворення коріння.
Стимулятори росту ефективні для
пришвидшення утворення коренів у живців та сіянців, підвищенні енергії
проростання та схожості насіння. В інших випадках їх застосування може
призвести до негативних наслідків. Наприклад, штучне стимулювання пробудження
бруньок та поява додаткових пагонів за слабкої кореневої системи, коли поживні
речовини не потрапляють до ростучих органів, призводить до послаблення та
висихання рослин. При обробці заражених рослин стимуляторами росту позитивного
результату також не буде. Адже стійкість рослин до хвороб пов’язана з
нормальним ростом та розвитком рослин, що досягається додержанням всіх
агротехнічних вимог культури, використанням якісного посадкового матеріалу та
своєчасним застосуванням засобів захисту від патогенних організмів (хімічні
препарати чи ЕМ-культури). І жоден стимулятор росту не відновить рослини, які
страждають від нестачі поживних речовин в ґрунті, порушення світлового режиму
чи водного балансу [12].
Як зазначалося, для стимулювання
коренеутворення використовують гетероауксин (бета-індолілоцтова кислота), або
калієву сіль гетероауксину, бета-індолілмасляну кислоту (ІМК) та
альфа-нафтилоцтову кислоту (НУК), чи калієву сіль нафтилоцтової кислоти (КАНУ).
Перевага препаратів у вигляді солей перед кислотами полягає у тому, що вони
легкорозчинні у воді за кімнатної температури. Із самого початку для стимуляції
коренеутворення використовували саме фітогормон гетероауксин (індол-3-оцтова
кислота), котрий управляє цим процесом в рослині. На сьогодні широко поширені
також його похідні. Так, діюча речовина препарату «Корневин»
4-(індол-3-іл)масляна кислота (ІМК), в рослині поступово перетворюється на
фітогормон гетероауксин, що забезпечує найкращий ефект (в тому числі м’якішу та
тривалішу дію) у найнижчих, в порівнянні з іншими ауксинами, дозах.
Застосування стимуляторів росту у
суміші з вітамінами С (аскорбінова кислота) та В (тіамін) поруч з добрим та
швидшим укоріненням живців пришвидшує й процес утворення пагонів в укорінених
живців. Самі по собі вітаміни без стимуляторів росту не чинять впливу на
утворення та ріст коренів і пагонів.
Обробка кореневої системи під час
пересаджування рослин та полив заселеного корінням шару ґрунту вже посаджених
деревних та трав’янистих рослин стимуляторами росту сприяють більш швидшому та
сильнішому розростанню коренів, що забезпечує добру приживлюваність, більш
інтенсивний ріст надземних органів і підвищує врожайність. Стимулятори росту
прискорюють зростання прищеп й підвищують процент їх виходу. Застосування
стимуляторів росту та вітамінів за вегетативного розмноження не замінює
необхідні рослині мінеральні та органічні добрива. Стимулятори росту
виявляються особливо ефективними в посиленні ростових процесів у рослин та
підвищенні врожайності при дотриманні всіх правил агротехніки. Вплив (дія)
стимуляторів росту зводиться до пришвидшення та посилення тих нормальних
фізіологічних процесів, що притаманні цілій рослині або живцю під час утворення
та росту коренів та пагонів [8].
Методи обробки стимуляторами росту.
Основу живців (але не саме стебло) обробляють порошком чи замочують на певний
час у розчині регулятору росту, який стимулює утворення коренів, висаджують та
помічають етикетками. Концентрація, наприклад, індолілмасляної кислоти для
обробки здерев’янілих живців повинна складати 0,8 %. Якщо живцювання проводять
у сприятливий час та з використанням найбільш придатних для цього пагонів,
необхідність у застосуванні регуляторів росту може відпасти, за виключенням
випадків розмноження порід, що важко укорінюються [11].
Можлива також обробка посівного
матеріалу пробіотичними препаратами, спеціально підібраними для рослин. Так,
наприклад, передпосівна обробка насіння біопрепаратом «Байкал ЕМ-1 В» в 10 %-й
концентрації з водою або 1 %-й концентрації з 2 %-м розчином
плівкоутворювального регулятора росту «Марс-1» забезпечує істотні збільшення
врожаю, у середньому до (10÷15)
% і є екологічно безпечною технологією. При передпосівній обробці насіння їхня
вологість повинна підвищитися не більше ніж на 1 %. Для присадибного
рослинництва - замочування насіння в ЕМ-розчині 1:1000 на 1-2 години (6 крапель
ЕМ-препарату на склянку води). Для зручності висіву, насіння можна просушити в
затемненому місці.
.3.3 Фактори, що впливають на
життєздатність живців рослин після їх тривалого зберігання
Річний цикл деревних рослин в умовах
помірного клімату П.Г. Шмітт поділяє на чотири періоди [13]: 1) вегетації; 2)
переходу від вегетації до відносного спокою; 3) відносного спокою; 4) переходу
від відносного спокою до вегетації.
.3.3.1 Значення вікового стану
живців
Швидкість росту пагона змінюється
протягом року. Максимальна навесні, вона поступово знижується до осені, коли
ріст зупиняється зовсім. Навіть в кінці періоду вегетації основа річного пагону
має найбільш виражену здатність до утворення коренів, і це варто враховувати
під час нарізання здерев’янілих живців. (Це стосується не всіх рослин.
Наприклад, у червоної смородини краще укорінюються живці з верхівкового
пагону).
Дуже важко встановити правильний
строк живцювання для різних рослин. Але не можна для різних років встановити
один і той же календарний строк живцювання. Ріст пагонів деревних та кущових
порід залежить від ходу метеорологічних явищ минулого та поточного років. Отже,
час заготовлення дерев’янистих живців залежить від кліматичних умов даної
місцевості. Багато рослин краще розмножуються в період спокою. Після початку
руху соків не рекомендовано нарізати пагони на живці, оскільки на цей час
значний запас живильних речовин, відкладений у пагонах з осені, починає
витрачатися на подальші процеси росту й живці з таких пагонів укорінюються
погано або зовсім не укорінюються. Так, висаджені восени в ґрунті живці чорної
смородини та малини укорінюються набагато краще, ніж весняні, які майже
повністю гинуть [8,10,11].
Здерев’янілі живці можна заготовляти
протягом всього періоду спокою, однак успішніше за все живцювання відбувається
під час листопаду та незадовго до розпускання листових бруньок. Найменша
здатність до утворення коренів відмічається всередині зими. У листопадних порід
використовуються повністю визрілі пагони. Оскільки їх живці в цей час не мають
листя, необхідний для успішного розмноження контроль за умовами навколишнього
середовища мінімальний.
В процесі розвитку кожного окремого
пагону визрівання його тканин починається з нижньої частини, потім охоплює
середню та закінчується у верхній. Тому якщо почати живцювання раніше, то
більшу здатність до укорінення матимуть відрізки пагону, або живці, з нижньої
його частини. У середні строки живцювання нижня частина встигає задерев'яніти
та знизити здатність до укорінення, а верхня частина пагону ще продовжуватиме
ріст та знаходитиметься у трав’янистому стані з дуже малою здатністю до
укорінення. Якісні живці будуть нарізані в цьому випадку з середньої частини
пагону. Під час запізнілого живцювання кращі живці отримують з верхньої частини
пагону, гірші - з середньої, а нижню частину пагону, як перезрілу і нездатну
укорінюватися, доводиться викидати. Ця обставина визначає кращі строки для
живцювання.
Таким чином, оптимальні строки
живцювання будуть різними в різноманітних ґрунтово-кліматичних зонах. Проведені
певні дослідження, що підтверджують залежність укорінюваності живців від їх
видової приналежності, строків та умов живцювання [7,9].
.3.3.2 Фізіологічна й біохімічна
природа зимостійкості
У багаторічних рослин в умовах
помірного клімату спостерігається сезонна періодичність морфофізіологічних
явищ, що визначає ступінь їхнього пристосування до умов середовища в тім або
іншому природному районі. Для глибокого розуміння зимостійкості деревних рослин
необхідно вивчати їх річну морфофізіологічну ритміку в конкретних кліматичних
умовах. Це дозволить з'ясувати багато явищ, пов'язаних із зимостійкістю.
Дослідження фізіологічних і
біохімічних річних ритмів у різних за зимостійкістю деревних рослин показало,
що своєчасне й досить інтенсивне перетворення речовин й енергії має вирішальне
значення для їхньої зимостійкості. Кожен період розвитку деревної рослини
характеризується фізіолого-біохімічними ритмами, які строго узгоджуються із
сезонними ритмами навколишнього середовища. Порушення одного річного життєво
важливого ритму, ослаблення темпів необхідних процесів, що спостерігається в
недостатньо зимостійких і незимостійких порід, створюють біологічну аритмію з
її небажаними наслідками [13].
Стійкість організмів до
несприятливих факторів середовища, зокрема зимостійкість деревних рослин, є
головною проблемою сучасної біології. Життєдіяльність деревного організму являє
собою дуже складну систему морфофізіологічних явищ, біохімічних реакцій й
їхньої саморегуляції. Без чіткої ритмічності фізіологічних і біохімічних
процесів не можна представити існування складної саморегулюючої системи, якою є
живий організм [14].
Велику роль у метаболізмі й динаміці
клітинних структур грають ферменти. Зміни в метаболізмі, що обумовлюють перехід
організму на новий етап розвитку, пов'язані із синтезом ферментів, зміною
активності останніх, переходом їх з одного стану в інше. Здійснення всього
складного комплексу біохімічних реакцій і змін біологічної структури в
організмі повинне бути строго погоджене в часі, тому що життя йде в ритмі
навколишнього середовища.
Питання стійкості рослин не можна
розглядати у відриві від вмісту й стану води в тканинах. Вода - найбільш
поширена й необхідна речовина в природі, вона виконує виняткову роль в
організмах. Це обумовлено її фізико-хімічними властивостями. Вода це не просто
важливий розчинник, компонент біоколоїдів, але й загальна матриця життя, дуже
необхідна складова частина організмів.
Відомо, що вода в тканинах рослин
перебуває у вільному й зв'язаному станах. Причиною рухливості молекул води, її
трансляційної дифузії в живих тканинах є "енергетичні бар'єри", які
визначають відмінності стану води в біологічних системах від чистої води. Ряд
дослідників вважає, що довжина вільного пробігу молекули води в значній мірі
визначається наявністю такого роду бар'єрів. Насамперед передбачається
існування води (гідратної), взаємодіючої з біополімерами й низькомолекулярними
сполуками, а також кооперативна взаємодія водних і неводних компонентів у
біологічних системах.
Основними сполуками, що з’єднують
воду, є білки. Молекулярні структури й зокрема білки, функціонують у водному
оточенні. Біохімічні механізми клітини - синтез білка, ферментативний каталіз й
інші - формувалися в природі стосовно до водного середовища. Відомо, що вода в
значній мірі визначає конформацію макромолекул білка. Ця властивість залежить
від структури води, що змінюється при впливі різних факторів. Також і вплив
макромолекул біополімеру на воду досить складний, що викликає різноманітні
зміни її стану. Структурованість води й характер її зв'язку з біополімерами
охороняє органоїди клітини від пошкодження морозом. Захисні речовини, які
конкурують із молекулами води, блокують поверхні й впливають на структуру
льоду. Такими речовинами є деякі полісахариди, які містяться в клітинних
стінках.
Захисні речовини, зокрема цукри,
відіграють велику роль у морозостійкості клітин. Цукри стабілізують ламеллярні
структури, з'єднуючись із білками ламелл. Однак моносахариди не корелюють із
зимостійкістю й далеко не завжди підвищують її у модельних експериментах.
Динаміка моносахаридів у річному циклі розвитку деревних рослин показує, що
вони є будівельним й енергетичним матеріалом для синтезу різних сполук, які змінюють
структуру протоплазми клітини й підвищують її стійкість.
Олігосахариди класу рафінози й різні
полісахариди перебувають у прямій кореляції зі стійкістю клітин. Перші можуть
також входити до складу глікозидів і гетероглікозидів, поширених у світі рослин.
Олігосахариди, особливо класу рафінози, придушують різні фізіологічні процеси,
у результаті чого відбувається інгібування росту. Досить імовірно, що
рістінгібуюча дія олігосахаридів і багатьох полісахаридів пов'язана з тим, що
вони утворюють комплексні сполуки з білками, у тому числі з ферментами.
Придушення ростової спрямованості фізіологічних і біохімічних процесів
супроводжується зміною метаболізму й структури протоплазми убік підвищення
стійкості останньої.
Відомо, що вуглеводно-білкові
комплекси досить стійкі до різних несприятливих факторів й їхнє утворення
пов'язане з поглинанням великої кількості води. Істотну роль у стійкості тканин
до замерзання грають фізичні й фізико-хімічні властивості протоплазми [14].
В умовах низької температури в
клітинах утворюється більш стабільна структура протоплазми. Про це свідчать
підвищення впорядкованості й зміна структури води, упорядкування
міжмолекулярних і внутрішньо-молекулярних зв'язків, зниження активності
фізіологічних процесів й ущільнення протоплазми.
Звести явища морозо- і зимостійкості
до одного якого-небудь внутрішнього фактору неможливо. В основі
морфофізіологічної річної періодичності деревних рослин лежать біохімічні ритми
метаболізму найважливіших речовин і змін у субклітинних структурах. Ці зміни
пов'язані із впливами зовнішніх несприятливих факторів.
.3.4 Фактори, які впливають на
збереженість рослинних об’єктів після їх довгострокового зберігання
Одна з основних проблем кріобіології
- з’ясування процесів, які супроводжують охолодження живих систем та тих, що
ведуть до необоротних пошкоджень. Зміна властивостей матеріалів під час
заморожування обумовлена в першу чергу кристалоутворенням та явищами,
пов’язаними з фазовим переходом вода-лід. Причин, які їх викликають багато.
Розмір, кількість та розподіл кристалів залежать від глибини та швидкості
заморожування [15].
Заморожування - це один з
найважливіших етапів, від якого залежить успіх кріоконсервування. Умови
заморожування впливають на якісні показники висушених матеріалів та тривалість
процесу висушування, що нарешті пов’язано з енергозатратами та собівартістю
продукції. В результаті численних досліджень встановлено, що не тільки для
кожного виду, але і для сорту одного й того ж виду рослин необхідно у ряді
випадків підбирати оптимальні швидкості або встановлювати оптимальний діапазон
швидкостей заморожування-відігрівання.
Дослідники бачать головну причину
пошкодження живих тканин при замерзанні в утворенні в клітинах кристаликів
льоду. На думку І.І.Туманова, особливо шкідливий внутрішньоклітинний лід. Він
вважає повільне зневоднювання в морозостійких видів сприятливим для рослин.
Вчені думають, що кристалики льоду
вносять дезорганізацію й деструкцію в субклітинні структури. Ступінь
пошкодження клітин залежить від швидкості утворення кристаликів льоду, їхнього
розміру, скупчення й проникнення в різні ділянки клітини [14].
Під час швидкого заморожування
утворюються дрібні, рівномірно розподілені кристали та міграція води у
міжклітинному просторі незначна. Швидке заморожування дозволяє добре зберегти
гістологічну структуру та колоїдні властивості матеріалу. З іншого боку, при
повільному заморожуванні клітини мають можливість адаптуватися до нових умов.
Особливості процесу заморожування.
Важливими режимними параметрами, які визначають ефективність процесу є наступні
параметри: швидкість заморожування, кінцева температура замороження і
тривалість зберігання зразків у замороженому стані.
Експериментальні дані, що стосуються
швидкості заморожування на виживаність рослин часто дуже суперечливі та не
дають чіткої відповіді на питання про оптимальні режими, необхідні для
практичного використання.
При кріоконсервуванні рослин дуже
часто виникає необхідність зберігання препаратів, попередньо заморожених у
холодильних апаратах та пристроях, протягом декількох годин, а інколи і кількох
днів. При цьому оптимальна температура та припустима тривалість зберігання може
варіюватись в залежності від породи та виду рослин.
При зберіганні заморожених рослин
слід мати на увазі, що навіть короткочасне підвищення їх температури, яке
виходить за певні межі, може викликати зниження виживаності живців.
.3.4.1 Фізіологічний механізм
морозостійкості рослин
Низькі температури самі по собі не є
причиною вимерзання рослин. Сухе насіння виносить без шкоди будь-які низькі
температури, у тому числі й наднизькі, тим часом навіть короткочасне нагрівання
такого насіння призводить до втрати схожості. Рослини витримують при
переохолодженні такі морози, які для них виявляються згубними при замерзанні
наявної в них води. Усе це доводить, що рослинні клітини можуть виносити
надзвичайно щільне впакування молекул, якщо останні не піддаються взаємному
різкому зсуву.
Сакаі й Отакуа [16] вітрифікували
взимку зрізи кори паренхіми шовковиці. Вони виявилися здатними витримати
занурення в рідкий азот і в ізопентан. За допомогою електронного мікроскопу
автори показали відсутність льоду у вітрифікованих клітинах у вигляді порожнин.
Якщо такі зрізи перебували при температурах від -20 ºС
до -40 ºС,
коли вітрифікація не могла проходити, то при збільшенні в 15 тис. раз виявляли
наявність у клітинах при температурі -30 ºC великих
порожнин, заповнених льодом. Такі клітини були вбиті, органели в них не були
помітні, але вакуоль і клітинні стінки розрізнялися. Якщо лід утвориться
спочатку в міжклітинному просторі, а потім у протопласті, то порожнини в ньому
дрібні, але більш численні.
Калориметричні визначення
переохолодженої замерзлої води в рослинах при різних температурах показали,
яким чином рослини можуть захищати себе від утворення льоду всередині
протопласту. Найбільш ефективним способом є відтік води із клітин у
міжклітинний простір, де вона перетворюється в лід. У цьому випадку в замерзлій
рослині може бути велика кількість льоду, але клітини зберігаються
незамерзлими, хоча сильно зневодненими.
Морозостійкість рослин основана на
зміні властивостей самого протопласту. Структурна перебудова вмісту клітин
протікає повільно протягом тривалого часу восени й узимку. Цей процес
починається під час входження рослин у період спокою, потім підсилюється під
час першої й другої фаз загартовування [17].
.3.4.2 Виникнення студню під час
періоду спокою.
Щоб стати морозостійкими, рослини
повинні послідовно пройти три етапи підготовки: увійти в стан спокою, пройти
першу, а потім і другу фази загартовування. Під час входження деревних у період
спокою створюються умови для застуднювання протопласта. По даним Симиновича й
Четера [18], у цей час відбувається надходження амінокислот з листя у зимуючі
клітини. За рахунок цього матеріалу за допомогою РНК синтезуються певні фракції
водорозчинних білків. Вважають, що після цього з них утворюються агрегати й
вміст клітин переходить із золю в гель.
У клітинах навіть незагартованих
рослин перебуває не дистильована вода, а розчин багатьох речовин, що, будучи
розподілений у холодці, повинен ще сильніше понизити температуру замерзання
рідини. Таким чином, перехід золю в гель під час входження рослин у стан спокою
може при повільному охолодженні забезпечити порівняно невелике підвищення
морозостійкості рослин. Можливо, що ця властивість підсилюється внаслідок
зменшення в клітинах вмісту ауксинів, а також збільшення кількості інгібіторів
росту. Це впливає на стан протопласта. Сприятливу дію може робити й збільшення
проникності протопласта для води.
По даним Туманова І.І і Красавцевої
О.А. [19], властивості протопласта помітно змінюються під час входження рослин
у стан спокою. У цей же час у деревних підвищувалася здатність до вітрифікації.
Застуднювання сприяє вітрифікації води. У гелях рухливість молекул рідини при
швидкому й сильному зниженні температури різко послабляється. За таких умов
система легше переходить у склоподібний стан.
.3.4.3 Зміни у вмісті клітин під час
проходження фази загартовування
Після входження рослини в період
спокою холодець у клітинах виходить пухким. Більш досконалим його будова стає
після впливу знижених температур. Це приводить до зменшення розмірів комірок
просторової сітки, що викликає подальше зниження точки замерзання рідини в
студнях. Під час першої фази загартовування протопласт поліпшує свої фізичні
властивості шляхом удосконалювання структури гелю. Він стає еластичним і досить
міцним.
Період спокою прискорює наступне
вдосконалювання структури гелю при температурах близьких до нуля. Очевидно,
процес застуднювання в клітинах протікає дуже повільно. У протопласті, крім
високоагрегованих розчинних білків, перебуває ще багато інших інертних щодо
цього речовин. Останні заважають з'єднанню високо агрегованих розчинних білків
між собою.
Під час першої фази загартовування
має місце ще один важливий фізіологічний процес: нагромадження захисних
речовин. Розподіл захисних речовин у всьому об’ємі клітини сприяє подальшому
підвищенню морозостійкості рослин. Якщо структура гелю помітно знижує точку
замерзання навіть дистильованої води, то заповнення проміжків у твердому кістяку
холодцю концентрованим розчином захисних речовин дає в багато разів кращий
ефект.
У міру посилення морозів
відбувається подальше зниження точки замерзання вмісту клітини внаслідок
відтоку води в міжклітинний простір. Це буде тривати доти, поки розчин не стане
насиченим. Таким чином, при повільному охолодженні досягається захист
протопласту від утворення в ньому льоду. Відповідно до цього перебуває факт
більш високої морозостійкості рослин при дії захисних розчинів на загартовані
об'єкти в порівнянні з незагартованими.
Захисні розчини не тільки знижують
температуру замерзання рідкої фази гелю, але вони грають ще роль
пластифікатора. Наявність незамерзаючої рідини в просторовій сітці служить наче
змащенням при механічних деформаціях. Воно сприяє збереженню еластичності при
негативних температурах. Низькомолекулярна незамерзаюча рідина зменшує
взаємодію білкових агрегатів і тим самим перешкоджає надмірному ущільненню
холодцю внаслідок небажаного подальшого зростання локальних зв'язків між
елементами в просторовій сітці, підвищуючи таким чином стійкість клітини до
зневоднювання.
Виживаність живців рослин залежить
не тільки від режимів заморожування, але й від кількості залишеної
внутрішньоклітинної води та рівномірності зневоднення. Було встановлено, що зворотна
втрата здатності до дихання клітин наступає після видалення 80 % води. Суттєві
зміни властивостей клітин спостерігаються в точках, які відповідають 10-ти та
5-ти відсотковому вмісту води. Як відомо, приблизно 5 % всієї води у
біоструктурах знаходиться у міцно зв’язаному стані. Тому видалення з клітин до
80 % води практично, вірогідно, безпечне. При швидкому видаленні більше 80 %
води стабільний стан не встигає установитися та клітини можуть загинути. При
повільному видаленні з клітин до 95 % води можна отримати досить оборотні
зміни. Відсоток виживаності висушених таким чином клітин буде дуже високим за
умови повільного зволоження сухого препарату. Видалення міцно зв’язаної води
призводить до невідновної втрати життєздатності рослинних клітин.
.3.4.4 Стан води в тканинах при дії
низьких температур
У високо гідратованих тканинах вода
в клітинах розподіляється неоднорідно. Водні домени найчастіше розділені
мембранами з обмеженою проникністю для води й інших низькомолекулярних речовин.
Як і слід було сподіватися, домени реагують на температури нижче 0 °С у
залежності від розмірів, концентрації розчинених речовин і присутності
потенційних центрів кристалізації льоду.
До параметрів, що визначають
функціональну виживаність об'єктів при низьких температурах, відносяться режим
охолодження й відігрівання, кінцева температура (звичайно -196 °С) і хімічне
оточення (рН і хімічні добавки). Цим і відрізняється лабораторна кріобіологія
від природної стійкості біологічних об'єктів до заморожування. В останньому
випадку швидкості заморожування й відігрівання незмірно нижче, і будь-які
речовини, які можуть підсилити стійкість клітин, повинні створюватися шляхом
біосинтезу й регулюванням метаболізму.
Якщо замерзання не відбувається
одночасно в клітині й у позаклітинному середовищі, то основними критичними
параметрами виживаності будуть: по-перше, швидкість потоку води через
плазматичну мембрану; по-друге, температура виникнення переохолодження, що
повинно відбутися перше ніж відбудеться нуклеація й, імовірно, рекристалізація.
Ці процеси у свою чергу впливають на осмотичний статус усередині й поза
клітиною, імовірність виникнення механічних напруг, а також фізіологічні й
метаболітичні зміни. І, нарешті, при відтаванні клітина може піддаватися
концентраційному шоку. При дії на рослинні об'єкти швидкого заморожування до
-196 ºС, попередження
впливів, що ушкоджують, можливо тільки у випадку знаходження рослин у стані
вимушеного або органічного спокою.
У літературі описаний ряд шляхів
попередження стресів, що виникають при дії низьких і наднизьких температур.
) Запобігання заморожування шляхом
висушування. Спосіб придатний тільки для спочиваючих структур (насіння,
бруньки, пилок) вищих рослин, клітини яких практично повністю заповнені
цитоплазмою й у них відсутні великі вакуолі.
) Запобігання заморожування
внаслідок переохолодження. Відомо, що переохолодження забезпечує виживання при
заморожуванні тканин деяких деревних культур, що перебувають у стані спокою.
Глибоке переохолодження води в рослинах є метастабільним станом, що стає
нестійким, коли починається гомогенна нуклеація, у результаті чого при зниженні
температури випадають кристали льоду. Запобігання заморожування при глибокому
переохолодженні підвищує стійкість, але тільки до певної межі, і вона ніколи не
буває нижче температури гомогенної нуклеації клітинного соку (приблизно -41
°С). Однак переохолодження клітинного вмісту не дозволяє клітинам зберігати
життєздатність при швидкому заморожуванні.
) Запобігання утворення льоду
усередині клітин рослин може бути способом збереження життєздатності лише в
тому випадку, якщо вони стійкі до позаклітинного замерзання. У літературі поки
немає єдиної думки із приводу виникнення стійкості до утворення льоду поза
клітиною. Загальноприйнятим уважається думка, що при позаклітинному замерзанні
води відбувається зневоднювання клітин. При такому зневоднюванні заморожування
рослин зі збереженням життєздатності може здійснюватися двома способами: а)
запобіганням летального зневоднювання при заморожуванні в результаті зменшення
кількості льоду. Воно може бути зумовлене коллигативною дією нагромадження
метаболітів. Деякі розходження в ступені виживаності рослин при дії
зневоднювання під час заморожування, імовірно, пояснюються кількісним рівнем
вмісту розчинних речовин у клітині; б) стійкістю до зневоднювання при
заморожуванні, що не пов'язана з нагромадженням розчинних речовин, що виконують
функцію кріопротекторних сполук. Механізми цих явищ багато в чому неясні, однак
показано, що тканини більше стійких рослин мають здатність виживати навіть у випадку
утворення в них великої кількості льоду.
На підставі всього викладеного можна
зробити висновок, що зимостійкість визначається не яким-небудь одним фактором
або речовиною, а цілим комплексом процесів і реакцій, що відбуваються усередині
клітин й у цілому в рослині. У результаті цих складних внутрішньоклітинних
процесів формується стійка до несприятливих агентів структура.
.4 Технологічні фактори, які
визначають виживаність живців після їх довгострокового зберігання
До технологічних факторів відносять:
1) довжину та діаметр нарізаних живців; 2) час нарізання; 3) початковий та
подальший рівень вологості біооб’єкту після сушіння; 4) режим заморожування та
відтавання; 5) кінцеву температуру зберігання; 6)упакування; 7) наявність
достатньої кількості води під час пророщування; 8) наявність необхідних
поживних речовин; 9) доступ кисню; 10) кількість живців у склянці; 11)
освітленість; 12) додавання стимуляторів росту та ін..
Упакування. Спосіб упаковки та вибір
тари визначається особливостями властивостей біоматеріалів та характером їх
змін в процесі зберігання. Упаковка й тара мають забезпечити збереженість
якісних показників біологічного матеріалу в умовах зберігання та
транспортування.
Швидкість заморожування-відтавання.
Вважають, що при повільному заморожуванні матеріалів, які мають клітинну
будову, спочатку утворюються одиничні грубі кристали у позаклітинному просторі.
В цьому випадку можливе значне дифузійне переміщення речовин внаслідок
виникаючої різниці їх концентрацій, що зумовлено виділенням частини води у
вигляді льоду в зонах матеріалу, температура котрих нижча за кріоскопічну.
Вказане явище порушує звичайне співвідношення компонентів в тканинах і деякі
клітини внаслідок цього гинуть. Для того, щоб зберегти живими клітини рослин і
певні тканини тварин, необхідне дуже повільне охолодження, під час якого не
відбувається різкого перепаду концентрації речовин в клітині.
Під час швидкого охолодження (більше
10 ºС за 1хв) часто
відмічається поява внутрішньоклітинних кристалів. Після завершення процесу охолодження,
за температур вище -120 ºС,
починається ріст кристалів (перекристалізація, рекристалізація). Збільшення їх
розмірів найбільш помітне при відігріванні. В разі утворення кристалів льоду
всередині клітини, вона зазвичай гине.
Під час надшвидкого охолодження зі
швидкістю кількасот градусів за 1 сек. (таке охолодження можливе лише у живих
об'єктів, які мають мікроскопічні розміри), більша частина води перетворюється
на аморфний лід, структура котрого мало чим відрізняється від структури води.
Завдяки цьому клітини не пошкоджуються і виживають незалежно від своєї природи.
Проте після надшвидкого охолодження, клітини зберігають життєздатність лише при
дуже швидкому відігріванні (за 3-10 сек.), що дозволить уникнути
рекристалізації. На практиці цей метод збереження клітин майже не
використовують, бо більш-менш великі об’єкти неможливо охолодити та відігріти
зі вказаними швидкостями [15].
1.5 Довгострокове зберігання
рослинних об’єктів під впливом низьких температур
Низькі температури споконвіку
застосовувались як ефективний спосіб довгострокового зберігання різноманітних
об’єктів рослинного та тваринного походження, частіше за все продуктів
харчування або сировини. В усіх цих випадках за допомогою простого охолодження
або заморожування за помірно низьких температур вдавалось зберігати лише окремі
властивості неживих об’єктів. Однак збереження в життєздатному стані клітин і
тканин рослинного й тваринного походження виявилося вкрай важким завданням.
Тільки деякі бактерії та більшість вірусів вдалося зберігати за допомогою
звичайного заморожування. Ядерні клітини під впливом процесу заморожування й
відтавання гинули. В той же час необхідність розробки методів їх
довгострокового зберігання зростала із розвитком різноманітних галузей
біології, медицини, сільського господарства, промисловості [20].
Розглянемо процеси, що відбуваються
в клітині при охолодженні. Точка замерзання чистої води 0 °С, але її можна
остудити до більш низьких температур (аж до -38 °С), при цьому льоду не
утвориться. Така вода називається переохолодженою. Знизити точку замерзання
можна додаванням речовин, що розчиняються, наприклад хлориду натрію, або
кріопротекторів (гліцерин, диметилсульфоксид (ДМСО), поліетиленгліколь (ПЕГ)).
При охолодженні водяного розчину
відбувається поступове утворення чистого льоду. У результаті поступового
видалення з розчину води (за рахунок переходу її в лід) всі розчинені речовини
концентруються в розчині, що залишився, внаслідок чого помітно знижується його
температура замерзання. У міру подальшого охолодження вода з розчину буде
продовжувати відділятися доти, поки, нарешті, не буде досягнута температура
плавлення, за якої і цей концентрований розчин твердіє.
Інтенсивність шкідливого ефекту
кристалів льоду, безумовно залежить від активності процесів кристалізації та
властивостей утворених кристалів. Було встановлено, що за помірно низьких
температур кристали льоду збільшуються в об’ємі на 10 %. Із подальшим зниженням
температур відбувається стискання структур льоду. Вже при -20 ºС
об’єм льоду дорівнює вихідному об’єму води, а за температури -183 ºС
його об’єм складає 2,6 % первинного. Кристали льоду можуть мати різну форму й
розміри - дендрити, сфероліти, крупно- та дрібнокристалічні структури та ін.
Утворення кристалів відмічалося не тільки поза, але й всередині клітин [20].
Як клітинна стінка, так і
плазматична мембрана виступають як бар'єри для росту льоду. Оскільки цитоплазма
клітини стосовно позаклітинного середовища гіпертонічна, то лід спочатку
утвориться поза клітиною. Позаклітинні розчини стають концентрованими, і
осмотичний градієнт через мембрану клітини міняє свій напрямок. У результаті
клітини починають втрачати воду, поступово зневоднюючись, а розчини усередині
клітини стають більш концентрованими, що є однією з головних причин ушкодження
клітин у процесі охолодження (осмотичний стрес). Іншою причиною є утворення
внутрішньоклітинного льоду. Повністю ріст і перебудова кристалів льоду
припиняється в чистій воді тільки при температурі поблизу -140 °С. От чому
тривале впевнене зберігання можливо тільки при наднизьких температурах. Таким
чином, ушкодження клітин при заморожуванні й наступному відтаванні залежить, з
одного боку, від утворення льоду усередині них (механічний стрес), а з іншого
боку - від їхнього зневоднювання (осмотичний стрес).
Враховуючи розглянуті фізико-хімічні
фактори, реалізовані на етапах низькотемпературної консервації, в залежності
від часу їх виникнення можна розподілити наступним чином: перший етап - перехід
в стан анабіозу - відведення тепла (зміна активності перебігу всіх енергозалежних
процесів); другий етап - заморожування - утворюються поза- та
внутрішньоклітинні кристали льоду, гіперконцентровані розчини солей, змінюється
рН середовища, зменшується об’єм клітин; третій етап - відігрівання (підведення
тепла), відбуваються процеси рекристалізації, плавлення кристалів льоду,
утворення в суспензіях клітин ділянок з розчинами солей нефізіологічних
концентрацій, порушення балансу поза- та внутрішньоклітинних розчинів солей,
створюються умови для гіпотонічного шоку, зневоднення й розриву клітин [20].
Немає необхідності описувати всі
можливі негативні зміни, котрі можуть викликати в клітинах кристали в тих
випадках, коли вони утворюються. Інтенсивність шкідливого впливу
внутрішньоклітинних кристалів залежить від їх форми, розмірів, кількості,
швидкості кристалізації та ін.. Однак дослідники неодноразово відмічали, що
внутрішньоклітинні кристали можуть викликати як необоротні, летальні,
пошкодження в клітинах, так і оборотні, несмертельні.
Вплив низьких температур викликає
зміну у вмісті клітинних ліпідів рослинних біологічних об’єктів.
Спостерігається помітне збагачення цитоплазми клітин ліпідними глобулами за
температури, близької до нуля, як позитивної, так і негативної. Зміни, що
спостерігаються в хімічному складі компонентів мембран призводять до підвищення
виживаності клітин за низьких температур: в препаратах літнього сезону при -10,
-15 ºС виживає 50 %
клітин, тоді як в зимовий сезон цей же факт спостерігається за температури
нижче -196 ºС.
Вважається, що ліпіди, зокрема фосфоліпіди, виконують важливі функції у
відновленні клітинних структур після холодового стресу. Їх локалізація, щільний
контакт з мембранами пластид, мітохондрій, вакуолей, ядра свідчить про участь
ліпідів у відновленні мембран клітинних органел [21].
В теперішній час є достатній арсенал
способів, за допомогою яких можна максимально знизити негативну дію
фізико-хімічних факторів на клітини або ж повністю уникнути виникнення деяких з
них на етапах низькотемпературної консервації. До таких способів слід віднести
варіювання швидкостей охолоджування та заморожування біологічних об’єктів, що
дозволяє змінювати в потрібному напрямі швидкість утворення кристалів льоду й
характер кристалізації. Однак навіть за дотримання оптимальних швидкостей
заморожування не вдається досягти високої збереженості клітин біологічних
об’єктів після довгострокового зберігання.
Другим способом, за допомогою якого
можна регулювати процеси кристалізації, досягти стану переохолодження,
понижуючи температуру початку кристалізації в біологічних системах, є введення
в біологічні системи кріопротекторів. До кріопротекторів відносяться речовини,
які безпосередньо або опосередковано взаємодіють з біологічними структурами,
тим самим захищаючи клітини від згубного впливу деяких фізико-хімічних
факторів, що реалізуються на етапах заморожування [20].
Зберігання пилка та насіння за
знижених температур. Рентабельним є зберігання пилка та насіння за невеликих
знижених температур. У цей час є конкретні рекомендації для зберігання насіння.
Так, наприклад, для насіння картоплі оптимальною зниженою температурою
зберігання є -14 °С, для насіння сорго -12 °С. Однак таке зберігання навряд чи
доцільно. Це пов'язане з тим, що біохімічні процеси при таких температурах не
повністю подавлені; крім того зберігання насіння за таких умов вимагає
додаткового захисту від високої вологості й додаткових заходів запобігання
відмов електричних систем охолодження.
Крім того, багато рослин
розмножуються тільки вегетативним шляхом (черешками, відводками, бульбами). До
того ж насіння несе в собі лише гаплоїдний набір хромосом, тому на практиці в
основному вдаються до вегетативних способів розмноження, бо такі клітини мають
диплоїдний набір хромосом і несуть повну інформацію про генотип вихідного
сортотипа рослини. На сьогоднішній день для рослин, що розмножуються
вегетативно, найкращим способом збереження їхнього генофонду є зберігання
верхівкових меристем пагонів.
Здатність до регенерації багатьох
рослин із маси неорганізованих тканин (калюсів), що проліферують in vitro, та з
культур органів і пазушних бруньок є надзвичайно ефективною [22]. Після того,
як встановили, що диференціювання клітин та розвиток рослин, в основному,
контролюються рівнями рослинних гормонів, було продемонстровано можливість
створення умов in vitro, що викликають клітинний ріст, морфогенез та
регенерацію рослин з окремих клітин чи недиференційованих калюсів. Рослинні
клітини та культура тканин - основні об’єкти клітинної біології, яка надає
можливості регенерації рослин з протопластів, клітин і тканин, які, в свою
чергу, можуть бути трансформовані чи відібрані за специфічними генетичними
ознаками.
Культура рослинних клітин дозволяє
відносно швидко отримувати численні популяції за регульованих та контрольованих
умов середовища на обмеженому просторі й ідентифікувати лінії рослин з
підвищеною біологічною продуктивністю. Рослинні клітини можна культивувати як
на рідких, так і на твердих середовищах. Прийоми, які при цьому застосовують,
аналогічні культивуванню мікроорганізмів.
Найзручнішою моделлю, яка
відрізняється високою чутливістю до змін умов існування та дії
найрізноманітніших факторів хімічної та фізичної природи є клітинна культура.
Лінії клітин, що перевивають, характеризуються морфологічною однотипністю
клітинних елементів, значною подібністю метаболізму та цитофізіологічних
показників. Таким чином, вивчення впливу низьких температур безпосередньо на
клітину, котре проводять на культурі клітин, дозволяє виявити зміни клітинних
та субклітинних структур, встановити, яким чином ядерний апарат реагує на умови
кріоконсервування, як змінюється темп проліферації, з’являються аномалії мітозу
та ін. [21].
Процес починають із взяття в
асептичних умовах шматків тканини від молодої здорової рослини, як правило,
використовують листя чи стебло. Тканину поміщають у підібране поживне середовище
за відповідних фізико-хімічних факторів середовища. Після отримання калюсу
можливо продовжити його вирощування на твердому середовищі чи отримати
суспензію клітин. Суспендовані рослинні клітини у порівнянні з клітинами калюсу
більш гомогенні, швидше ростуть та мають більш високі адаптивні можливості.
Протягом багатьох років для
збереження вихідних культур використовувалося постійне вирощування рослин при
оптимальних умовах. Загальними недоліками цього методу розмноження є: низькі
швидкості зростання рослинних клітин, висока частота інфекції, генетична
нестабільність. Крім того, в суспензії клітин спостерігається їх агрегування,
диференціювання, в результаті чого знижується активність [22]. До того ж для
підтримки культури тканин звичайно потрібні регулярні пересадження на свіже
живильне середовище через кожні 2-4 тижні, що виявляється досить трудомістким і
дорогим процесом.
У цей час існують два основні
підходи до зберігання культур клітин та тканин рослин: уповільнений ріст
колекції й кріозбереження.
Уповільнений ріст колекції. Для
вповільнення росту більшості культур необхідні фактори, що обмежують ріст.
Найчастіше використовується зниження температури культивування. Помістивши
колекції в умови низьких температур (1-10 °С у залежності від холодостійкості
виду рослин), період без пересаджень можна подовжити до 6-24 місяців.
Ріст рослин можна затримати
додаванням до живильних середовищ сумішей, здатних сповільнювати ріст. Вони
можуть чинити осмотичну дію (манніт) або бути речовинами гормональної природи
(абсцизова кислота).
Ще один спосіб - зміна складу
атмосферного повітря, з яким контактує культура, найчастіше зниження в ньому
вмісту кисню (гіпоксія), наприклад, вирощування в атмосфері, що складається із
суміші азоту (90 %) і кисню (10 %). Крім того, затримку росту можна викликати,
знижуючи атмосферний тиск до 0,014 мм ртутного стовпа або комбінуючи знижений
тиск і гіпоксію.
Звичайний час зберігання культур з
обмеженим ростом становить близько року. Зниження швидкості росту нижче певної
межі призводить до загибелі культури. Таким чином, якщо повністю відмовитися
від пересаджування культури, необхідно використовувати такий спосіб зберігання,
при якому відбувається повна зупинка метаболізму.
Традиційні способи зберігання живців
рослин.
Давно відомо, що зберігати живці в
домашніх умовах краще за все у холодильнику чи в льосі у ящику із вологим
піском. Відомий ще один спосіб - живці втикають у звичайні бульби картоплі,
обгортають в папір та кладуть в поліетиленовий пакет з дірками [11]. Так
зберігають живці за субнульових температур. Він придатний для домашнього
господарства, але строк зберігання живців в життєздатному стані за таких умов
не перевищує 1 року.
Тому
вдаються до більш низьких температур.
Доцільно зберігати живці за
температур -30 0С протягом декількох років з подальшою їх перезакладкою.
Основна ознака анабіозу - це різної
інтенсивності зворотне інгібування обмінних та біохімічних процесів [15].
Холодовий анабіоз індукується в клітинах гіпотермією та заморожуванням до
помірно низьких температур. Однак у цьому випадку в клітинах відбуваються
комплексоутворюючі взаємодії, хімічні реакції з малими енергіями активації,
оскільки зберігається рідка фаза. Переважають процеси дисиміляції, що веде до
загибелі клітин на протязі обмеженого інтервалу часу від декількох тижнів до
кількох місяців.
Описані вище головні фізико-хімічні
фактори низькотемпературної консервації, слід приділити увагу одному, можливо,
найголовнішому з них, який призводить до виникнення всіх наступних факторів, -
відводі енергії у вигляді тепла. У певних клітин тваринного та рослинного
походження й ряду мікроорганізмів зниження температури нижче оптимальної в ряді
випадків викликало летальні ефекти. Цей стан було названо холодовим шоком [20].
У міру продовження відводу тепла й
зниження температури оточуючого середовища реалізуються всі вищезазначені
фактори. Оскільки теплова енергія в клітинах перетворюється на механічну
енергію, енергію фізико-хімічних, біохімічних та інших реакцій, то в ході охолодження
характер і активність протікання всіх енергозалежних процесів змінюватимуться.
Зокрема, вже на етапі гіпотермії уповільнюється швидкість руху всіляких молекул
й органел в клітинах, змінюється в’язкість і деякі фізико-хімічні властивості
розчинів білків, білок-ліпідних, білок-полісахаридних, нуклеопротеїдних та
інших комплексів, які є основними компонентами ядра, цитоплазми й мембран
клітин, знижується швидкість проходження біохімічних реакцій, відбувається
розбалансування ензиматичних реакцій, змінюється регуляція внутрішньоклітинних
обмінних процесів. Таким чином, під впливом охолодження в клітинах відбуваються
порушення зазвичай впорядкованих, взаємопов’язаних та взаємообумовлених життєво
важливих процесів. В цьому відношенні, хоча прийнято, що клітини, котрі
знаходяться у стані анабіозу, краще переносять подальше заморожування, слід
приділити увагу значенню швидкості відводу тепла вже на етапі переводу їх в цей
стан [20].
Тільки у стані глибокого анабіозу,
коли повністю зупиняються обмінні та біохімічні реакції, відсутня рідка фаза,
створюються умови для довготривалого зберігання біологічної системи з повним
наступним поверненням її до вихідного стану в умовах нормотермії. Перехід
клітин до стану штучного глибокого холодового анабіозу, перебування їх в цьому
стані та наступне переведення їх до стану нормотермії представляють собою
технологічний процес кріоконсервування.
1.6 Кріоконсервування як
альтернативний спосіб зберігання генофонду рослин
До останнього часу, здавалось,
тільки у рослинництві не було необхідності у застосуванні методів
кріоконсервування. Однак в ході розробки й удосконалення способів культивування
рослинних клітин, вдосконалення методів гібридизації та ін. виникла
необхідність у довготривалому збереженні рослинних клітин і статевих продуктів
рослинного походження.
Єдиним можливим у теперішній час
прийомом, який забезпечує довготривале зберігання стабільності геному,
вважається консервація в умовах глибокого заморожування.
Кріоконсервування - це спосіб
збереження властивостей біологічних об’єктів, одним з важливіших, але не єдиним
етапом якого є використання низьких температур. Дослідники, котрі намагались
застосовувати низькі температури з метою консервування, одразу ж зіштовхнулись
із необхідністю захисту біологічних об’єктів від дії низьких температур,
необхідно було не лише виявити всі фактори, що впливають на біологічні об’єкти,
а й усебічно вивчити механізми їх дії [20].
Процес кріоконсервування, для
реалізації всіх етапів якого необхідні певна апаратура, розроблені методики,
середовища, захисні речовини, постійна наявність холодоагенту [15].
.6.1 Технологія довготривалого
зберігання пилка і насіння за азотних температур
Найбільш проста техніка
кріозбереження пилка. Для цього підсушений пилок поміщають у пластмасові ампули,
запечатують та переносять у рідкий азот. Кріобанк пилка унеможливлює
схрещування сортів рослин, що різняться за часом цвітіння або ж мають пилок з
коротким періодом фертильності.
Вода зберігає рухливість у досить
широкому інтервалі температур. Її інтегральна інтенсивність міняється слабко
при зниженні температури й практично однакова для сухих і гідратованих
зародків. Незамерзлою залишається вода, що безпосередньо пов'язана з
гідрофільними центрами молекул й може бути прирівняна до міцно зв’язаних форм води
[18]. Різке зниження кількості слабко зв’язаної води обумовлено інтенсивними
процесами кристалоутворення льоду. Лід, що утворився при заморожуванні,
викликаючи ушкодження клітин, призводить до загибелі зародка як найбільш
гідратованої тканини насіння. У той же час необхідно відзначити, що загибель
зародка при вологості 25 % відбувається тільки при стресових режимах
заморожування, тобто коли температура знижується з дуже великою швидкістю. При
цьому вода кристалізується в найбільш гідратованих компартментах і практично
відсутня її міграція в інші зони. При повільних режимах заморожування, коли
можлива дегідратація тканин або створюються умови для виходу води із тканини,
заморожування до -196 °С не викликає загибель зародка й насіння витримують
будь-які режими заморожування. Однак у цьому випадку можливі інші ефекти,
оскільки відомо, що при набряканні насіння при вологості близько 30 % майже
подвоюється інтенсивність дихання, активізуються процеси гідролізу й ряд
метаболічних реакцій.
Отже, успіхи кріоконсервування
насіння значною мірою залежать від ступеня його вологості, верхньою границею
якої є 10-15 %, а нижньою - 4-7 %. Таке насіння може бути збережено в рідкому
азоті шляхом прямого занурення після попереднього висушування у вакуумі. Це
пов'язане з тим, що в досить сухому насінні вода є зв'язаною, не здатною
замерзати. Як тільки при намочуванні й набряканні насіння з'являється вільна
вода, в ньому утворюється лід при заморожуванні, що призводить до механічних
ушкоджень клітин та до їхньої загибелі. При висушуванні насіння нижче 4 %
спостерігаються ушкодження, пов'язані з аутоокисненням ліпідів у
меристематичних зонах зародка.
У цей час при глибинному
заморожуванні насіння використовують методику японських дослідників Сакан і
Ноширо (1975), які рекомендують висушувати насіння до 8-15 %, упаковуючи їх у
пакети з фольги або ампули із щільними кришками, які потім занурюють в рідкий
азот, і після зберігання поступово розморожують їх на повітрі.
Однак насіння інших рослин (такі
тропічні культури, як кава, какао, гевея) не можуть проростати, якщо їхня
вологість знижується нижче 31-12 % (залежно від виду). Які-небудь рекомендації
з їх кріоконсервування відсутні, однак у цьому випадку може виявитися корисним
попередній досвід кріоконсервування. Так, Г.А. Самігину (1960) вдалося зберегти
схожість жита й пшениці на рівні 71 % після заморожування в рідкому азоті й
навіть рідкому водні (-253 °С) набряклого насіння, що містять 70-80 % води.
Успіх був досягнутий завдяки поступовому щотижневому східчастому заморожуванню насіння
шляхом зниження температури в холодильних шафах до -60 °С з наступним їхнім
зануренням у рідкий азот. Відтавання проводилося в цих же шафах з періодичним
підвищенням температури через кожні два дні. Передбачається, що при невеликих
швидкостях охолодження відбувається перерозподіл води усередині насіння і лід
утвориться в ендоспермі, викликаючи зневоднення зародка й запобігаючи тим самим
його механічним ушкодженням.
Вивчено вплив одноразового та
повторного заморожування-відтаювання на морфологію насіннєвої оболонки,
ультраструктуру зародку та схожість насіння [21]. Насіння заморожували у
рідкому азоті, витримували 4 хв. та потім відтаювали на повітрі при 24 ºС
на протязі 1 год. Повторне заморожування-відтавання здійснили за тих самих
умов. Встановлено, що одноразове заморожування-відтавання підвищує схожість
насіння на 40-70 %, повторне - знижує на 30 % до рівня, перевищуючого
контрольний (рис. 1.2).
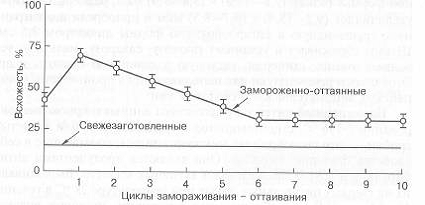
Рисунок 1.2 - Вплив одноразового та
повторного заморожування (-196 ºС)
на схожість насіння Setaria lutescence [21].
Виявлено експресію специфічних генів
холодової адаптації (ГХА), регульовану на транскрипційному рівні, та
встановлена закономірність успадковування холодостійкості. Ці дані наглядно
демонструють селективну властивість наднизьких температур, яка забезпечує
переведення рослинних біологічних об’єктів на більш високий рівень
функціонування (гомеостазу). Інші автори помітили стимулюючий вплив низьких
температур (-196 ºС)
на культури салату, кропу, цибулі, томатів, який проявляється на етапі
проростання. У ряду видів (Daanthus jische) заморожування насіння сприяло
пришвидшенню переводу рослин у генеративний стан.
Наднизькі температури (близько
-196 ºС) за певних режимів обробки
дозволяють спрямовано змінювати морфофізіологічні властивості та отримувати
мутанти з корисними біотехнічними та фізіологічними властивостями. Отримані
дані пов’язують з активною діяльністю клітинного геному, спрямованої на
«вмикання» механізмів програмованого життя охолодженої та кріоконсервованої
клітини.
Підвищення схожості насіння
зумовлено явищем раннього «сплеску» в структурних компонентах клітини. Воно
проявляється в ранньому та потужному (високоамплітудному) підвищенні
функціональної активності біооб’єктів, зниженні її в період функціонування до
рівня, що перевищує вихідний та контрольний [21].
Безумовно, зберігання насіння рослин
шляхом глибинного заморожування найбільш простий і дешевий спосіб збереження
генетичних ресурсів.
.6.2 Кріоконсервування верхівкових
меристем клітин рослин
Головна перевага зберігання при дуже
низьких температурах складається в значному вповільненні й навіть зупинці
метаболізму й біологічного руйнування. Завдяки цьому широко використовуваному
способу зберігаються мутантні, гібридні, трансформовані, здатні до морфогенезу
клітини: меристеми й кінчики пагонів, зиготичні й соматичні клітини. Крім того,
добре налагоджене кріозбереження менш трудомістке, ніж підтримання й зберігання
живої колекції.
Слід зазначити, що даний спосіб може
виявитися єдино придатним для довгострокового зберігання рослин, тому що має
більшу перевагу в порівнянні з іншими об'єктами, що культивуються в даних
умовах. Це пояснюється насамперед тим, що меристеми після кріозбереження
відразу розвиваються в цілу рослину, тобто в цьому випадку немає необхідності
проводити додаткові процедури, пов'язані з регенерацією рослин. Меристемальні
клітини рослин завжди однорідні за диплоїдністю, і регенеровані з них рослини
відповідають вихідному генотипу, цим забезпечується більша генетична
стабільність. Крім того, меристемальні клітини рослин дуже дрібні, майже
невакуолізовані, а у зв'язку із цим вони набагато легше переносять глибоке
заморожування й відтавання.
Успіх низькотемпературного
кріоконсервування залежить від цілого ряду факторів: генетичних і морфологічних
особливостей клітин, складу середовища консервування, виду й концентрації
кріопротектора, режиму охолодження й умов відтавання, здатності до
загартовування й рівня проникності кріопротектора.
При заморожуванні відбувається
утворення льоду усередині й зовні клітин. При повільному охолодженні
відбувається утворення позаклітинного льоду, що призведе до зневоднювання й
ушкоджень клітин до того, як буде досягнута температура замерзання цитоплазми.
Швидке охолодження викликає більш раннє заморожування клітин зсередини й менше
зневоднювання; ушкодження клітин викликається при цьому кристалами льоду, що
утворяться усередині клітин.
Безпосереднє механічне травмування
клітин позаклітинними кристалами льоду вченими не спостерігалося. Клітини
можуть пошкоджуватися внаслідок деформації їх під час захвату зростаючими
кристалами, а також затискання в каналах, котрі виникають між кристалами.
Кристалізація води у позаклітинному просторі неодмінно призводить до утворення
на певних етапах кріоконсервування гіперконцентрованих розчинів солей та зміни
рН середовища. При цьому відбувається зневоднення клітин. Клітини втрачають не
тільки вільну воду, але й воду, зв’язану з білковими макромолекулами. Все це
призводить, з одного боку, до зменшення загального об’єму клітин, а з іншого -
до порушення структури й функції біомакромолекул. Якщо зменшення об’єму клітин
нижче критичної величини не є, на думку певних дослідників, згубним для клітин,
то ушкодження макромолекул внаслідок їх денатурації, неодмінно, відіграє
важливу роль у комплексі негативних реакцій, які призводять до загибелі клітин
після кріоконсервування [20].
Кріобіолог Пітер Мейзур та його учні
описали процеси, які відбуваються під час програмного заморожування, з точки
зору математики та біології. Це теоретичне обґрунтування того, що вже
застосовували практики, отримало назву «двофакторної теорії Мейзура». Згідно
цієї теорії, основні пошкоджуючи фактори під час швидкого заморожування - це
утворення внутрішньоклітинних кристалів льоду та експозиція клітин у гіперосмотичних
розчинах (тобто в розчинах з високою концентрацією солей, котрі виникають, коли
вода у рідкій фазі навколо клітин починає перетворюватись на лід. Звідси
випливають важливі для практиків висновки: ступінь пошкодження клітин залежить
від проникності мембрани клітин та швидкості охолоджування. Із врахуванням
цього були розроблені оптимальні програми заморожування, котрі відрізнялись як
для різних типів заморожуваних об’єктів, так і для різних видів та сортів
рослин. Таким чином, оптимальні умови заморожування зазвичай підбирають
експериментально, при цьому, звичайно, враховуючи основні положення теорії
Мейзура [23].
Коли програмне заморожування,
засноване на двофакторній теорії Мейзура спробували застосувати для більш
великих об’єктів, результати заморожування були у більшості випадків
негативними. Органи складаються із різних типів клітин, до того ж між ними є
складні міжклітинні контакти. Кожен тип клітин має свої власні кріобіологічні
характеристики, і програма охолодження, розрахована для одних клітин, може
виявитися зовсім непридатною для інших. Найчастіше пошкоджуються міжклітинні
контакти.
Альтернативний підхід до
заморожування біологічних об’єктів отримав назву «вітрифікація». Теоретичні
основи вітрифікації із застосуванням досить складного математичного апарату
розробляв ще в 1930-х рр. Безіл Льюе з учнями та колегами. Відповідно до
теоретичних передбачень Льюе, при дуже високих концентраціях кріопротекторів у
середовищі і дуже швидкому зниженні температури, об’єкт переходить у
склоподібний стан, минаючи фазу кристалізації. Певний час цей підхід залишався
на другому плані, через успіхи програмного заморожування. Окрім того,
здавалося, що виконати рекомендації Льюе технічно важче, ніж ті, що пропонує
теорія Мейзура.
Тим не менш коли кріобіологи зіткнулися
із проблемами, які виникають під час консервування органів, вони згадали про
вітрифікацію. В наш час цей метод вважається перспективним не тільки для
заморожування дрібних біологічних об’єктів, таких як ембріони, сперматозоїди та
клітинні суспензії, але й для заморожування зрізів органів і тканин, а також
цілих органів [23].
У практиці кріозбереження
використовують метод двоступеневого охолодження, що полягає в попереднім
заморожуванні клітин швидким охолодженням до температури нижче нуля й короткочасному
витримуванні їх при цій температурі перед швидким охолодженням до температури
зберігання. Переривання швидкого охолодження й витримування протягом певного
часу при температурі, вище критичної, викликає стиск клітин, у результаті чого
клітини стають здатними пережити охолодження й відтавання. Високі концентрації
позаклітинних розчинів, що створюються під час періоду попереднього
охолодження, очевидно, забезпечують стискання, достатнє для захисту клітин від
ушкодження. Оптимальна температура й тривалість періоду попереднього
заморожування залежать від типу клітин і пов'язані з кінетикою руху води через
клітинну мембрану. На цьому етапі в середовище додають кріопротектори -
речовини, які зменшують ушкодження клітин від осмотичного й механічного стресу
при заморожуванні й відтаванні, змінюють проникність клітин і температуру
замерзання. Кріопротектори - це речовини, що володіють здатністю попередити
розвиток кріопошкоджень біологічних об’єктів та забезпечити їх збереженість в
життєздатному стані після заморожування [20]. Це можливо в разі зниження
кількості льоду, що утворився, і, отже, концентрації інших розчинених речовин.
Кріопротекторами є або проникаючі в клітини речовини - диметилсульфоксид (ДМСО)
і гліцерин, або не проникаючі високомолекулярні - полівініл, піролідон,
декстран, поліетиленгліколь. Найчастіше використовують ДМСО або самостійно, або
з додаванням сахарози, гліцерину. В теперішній час кріозахисна речовина, її
концентрація у середовищі, а також склад кріоконсерванту підбираються індивідуально
для кожної клітинної фракції, при цьому передбачується створення пропису
консерванту, що забезпечує кращий з досягнутих результатів низькотемпературного
зберігання. В цьому плані кріобіологи набули певного досвіду. Однак механізм
захисного впливу кріопротекторів вивчений ще недостатньо, тому немає
універсальних рекомендацій з їх використання для різних видів клітин. Звідси
випливає, що під час розробки методу низькотемпературної консервації для нового
виду клітин, в першу чергу, необхідно вибрати найбільш оптимальний
кріопротектор й встановити його ефективну концентрацію. Ідеальний кріопротектор
не повинен бути токсичним ані для клітин, ані для організму [20].
Таким чином, низькотемпературне
консервування біологічних об’єктів являє собою технологічних процес, який
складається із доволі конкретних етапів. Для здійснення цього процесу необхідна
спеціальна кріоапаратура: заморожувачі, розморожувачі, сховища, переносні
ємності, контейнери для заморожування біологічних об’єктів, кріопротектор,
суспензійні середовища необхідного складу.
Кріоконсервація культур рослин у
багатьох випадках починається з етапу спеціальної підготовки, хоча існують
культури, які досить просто брати для заморожування на початку або в середині
експонентної фази росту, коли вони збагачені меристемоїдними клітинами в
результаті інтенсивних розподілів. Один зі способів попереднього культивування
- додавання в середовище манніта або сорбіту в концентрації 2-6 % на період від
декількох діб до 2-3 пасажів. Такий спосіб зменшував розмір клітин і, що
важливіше, їхню вакуолезованість.
При другому способі попереднього
культивування використовують амінокислоти й серед них у першу чергу пролін, чиє
значення для зв'язування води в клітині широко відомо. Його концентрацію
поступово піднімали для ряду клітин до 1 М (11,5 %) на строк до 4 діб (великий
період предкультивування приводив до дегенеративних змін у клітинах). Крім
проліну використовують низькі концентрації аланіну, серину й аспарагіну
протягом 4-6 діб; найкращі результати були отримані з аспарагіном. У результаті
в клітинах зменшується кількість зерен крохмалю і їхні розміри, збільшується
(приблизно в 2 рази) вміст цукрів. Підвищується й виживання клітин після
відтавання.
Третій спосіб попереднього
культивування застосовували спочатку тільки для апексів пагонів - щільних
організованих структур без міжклітинників, розміром близько 500 нм. Проникнення
у внутрішні клітини апексів навіть легко проникаючого ДМСО і їхнє утворення
утруднені. ДМСО додавали в концентрації від 2,5 до 10 % (частіше 5 % на строк
до 48 годин).
Четвертий спосіб здійснюється в
умовах штучного загартовування до холоду, він застосовний тільки для зимуючих
рослин помірного клімату. Суть загартовування зводиться до імітації природного
осіннього процесу підготовки рослин до періоду зимового спокою. При роботі із
клітинними суспензійним або каллусними культурами звичайно їх (так само як і
рослини) або відразу поміщають в умови з температурою від 2 до 5 °С на строк
від 1 до 6 тижнів, або спочатку протягом декількох діб витримують при температурі
8-10 °С. Більш ефективне загартовування в присутності сахарози (до 12-15 %).
Після підготовки, перед додаванням
кріопротекторів, клітинні суспензії концентрують. Оскільки центрифугування
ушкоджує багато рослинних клітин, то застосовують відстоювання в циліндрі або
прямо в колбі, які встановлюють у посудину з льодом. Тривалість осадження 15-30
хв. залежно від розміру клітин і їхніх агрегатів. Невеликі агрегати із дрібними
найбільш життєздатними й стійкими клітинами осідають останніми. Після осадження
надосадову рідину відсмоктують.
Заморожені культури необхідно
зберігати при низькій температурі, принаймні, при -100 °С. На практиці для
цього зручніше за все використовувати рідкий азот (-196 °С) або його пари (-150
°С).
Піддаючи кріоконсервуванню меристеми,
можна не тільки зберегти даний генотип, але й одержати згодом шляхом
мікроклонального розмноження необхідну кількість рослин.
1.6.3 Зберігання живців рослин за
наднизьких температур
Під впливом безпосередньої дії
факторів низькотемпературної консервації у клітин виникають первинні
пошкодження: зміна форми, об’єму, порушення цілісності мембран, конформації
макромолекул та ін.. Ці пошкодження можуть стати причиною вторинних пошкоджень,
які розвиваються в клітинах в різний час після кріоконсервації. Якщо метод
низькотемпературного консервування достатньо ефективний, інтенсивність
негативного впливу вказаних факторів на клітини зведено до мінімуму, або ж
виникнення окремих із них можна цілком уникнути. Однак результати досліджень
свідчать про те, що універсального способу кріоконсервування ядерних клітин не
існує. Це зумовлено неоднаковою стійкістю різних видів клітин до впливу
факторів низькотемпературної консервації. Причини різної чутливості клітин до
впливу даних факторів поки вивчені недостатньо [20].
Технологія зберігання живців рослин
за наднизьких температур здійснюється в кілька стадій. Перший етап: відбирають
зразки та обов’язково проводять оцінку їх збереженості, життєздатності та
приживлюваності, виміряють вологість. Нежиттєздатні зразки відкидають. Другий
етап: проводять підготовку біооб’єкта до заморожування для попередження
внутрішньоклітинного кристалоутворення - сушіння. Для живців ступінь вологості
у більшості випадків не повинна бути меншою за 30 %. Для збереження в них
вологи, доцільно вкривати кінці воском чи парафіном. Зниження вологості
призводить до ефекту плазмолізу, а перевищення - до внутрішньоклітинного
кристалоутворення. Третій етап: після досягнення заданого рівня вологості,
зразки охолоджують та направляють на зберігання. В парах рідкого азоту (-196
0С) можливе збереження життєздатних зразків на протязі необмеженого інтервалу
часу. Четвертий етап: за необхідністю отримання потомства зразки відігрівають,
відновлюють нормальну вологість та пророщують у воді а потім переносять в ґрунт.
Можна додатково застосовувати стимулятори росту.
Для зберігання кріоархіву потрібно
лише невелике приміщення, а єдиний компонент, необхідний для підтримання життя
в кріобанку, - рідкий азот. Саме про нього слід серйозно подбати. В сховищі
мають бути передбачені системи автоматичного поповнення азотом, індикатори,
котрі передають сигнал на випадок падіння рівня рідини, та багато іншого.
Корисно розподіляти матеріал у двох чи більше сховищах, на випадок, якщо в
одному з них виникне аварійна ситуація. Звісно, переведення лінії в кріобанк та
її відновлення потребують роботи кваліфікованих біотехнологів, купівлі дорогих
програмних заморожувачів та ін.. Тим не менш Карлісл Лендел, один з головних
творців кріобанку Джексонівської лабораторії (США), вважає, що затрати по
переведенню тієї чи іншої лінії в кріобанк у будь-якому випадку є набагато
меншими, ніж підтримання цієї лінії в розсадниках у живому вигляді [23].
Найбільші труднощі тут пов'язані із процесом заморожування, тому що клітини
рослин мають свою специфіку та їх виживаність навіть у кращих випадках не
перевищує 69-70 %.
.7 Відновлення повноцінних рослин
після їх довгострокового зберігання за низьких та наднизьких температур
Важливим етапом процесу
кріоконсервування є відігрівання. Однак характер й механізми впливу
фізико-хімічних факторів на клітини на цьому етапі вивчені недостатньо. Це
зумовлено цілим рядом причин: відсутністю необхідної апаратури (програмних
розморожувачів), ефективних способів підводу тепла. Окрім того,
дослідники-кріобіологи досить довго не приділяли належної уваги цьому етапу
кріоконсервування [20].
При занадто повільному відтаванні
клітин у них відбувається повторне утворення льоду, що чинить пошкоджувальну
дію. Тому переважніше використовувати швидке відтавання. Для цього ампули
струшують у воді з температурою 40 °С, іноді 60 °С. Але як тільки в ампулі
починає зникати останній кришталик льоду, її переносять у посудину з льодом.
Відмивання від кріопротектора
застосовується тільки у випадку використання речовин, токсичних для даних
клітин. Вміст ампули розбавляють в 3-4 прийоми з 15-ти хвилинними інтервалами
більшим обсягом холодного живильного середовища або 3-15 %-ним сахарози.
Підвищена концентрація сахарози корисна для вповільнення деплазмоліза, якщо
кріопротектор його викликав. Потім клітини відстоюють, а надосадову рідину
замінюють живильним середовищем, обсяг якої приблизно дорівнює вихідному обсягу
суспензії. Поновлення росту культур вимагає 2-3 тижнів.
Таким чином, як на етапі
заморожування, так і відігрівання клітини піддаються негативному впливу
фізико-хімічних факторів.
2. МАТЕРІАЛИ ТА МЕТОДИ
.1 Методи перевірки збереженості
Величина збереженості є критерієм,
за яким визначається температура внутрішньоклітинного кристалоутворення
(критична температура), критична вологість після висушування при підготовці до
зберігання.
Показник збереженості оцінювали за
допомогою проведення гістологічних зрізів бруньок і живців яка визначалась за
морфо-анатомічними зрізами з використанням бінокуляру (розтин бруньок та
деревини з визначенням їх пошкоджень за кольором).
Пошкодження бруньок і деревини
визначали за шкалою запропонованою [24]. Бали 5 і 4 (чорна або чорно-коричнева
кора або деревина) - це цілком вимерзлі тканини. Бал 3 характеризує
світло-коричневу або сіро-коричневу деревину і жовто-, червоно- або ж
світло-коричневу (але не темну) кору. Бал 2 - це слабке і середнє потемніння
деревини, кора світло-жовто-оранжевих тонів. Бал 1 для деревини - це невелике
сіре відхилення від природного світло-зеленого кольору.
Оцінка пошкодження вегетативних
бруньок в балах: 5 - бруньки чорні; 4 - бруньки темно-коричневі; 3 - підбрунька
коричнева, всі зачатки листя жовто-коричневі з переважно світлих
жовто-коричневих тонів; 2 - жива центральна частина майже світло-зелена, але
окремі листочки наполовину або частково мають мертві уражені ділянки у верхній
частині, які коричневого кольору; 1 - жива брунька, живі світло-зелені зачатки
листочків, але жовто-коричнева частина під брунькою (подушка), зовнішні частини
листочків при цьому бувають забарвлені в темно-коричневий колір; 0,5 - все
живе, але під брунькою її підстава має помітний і чіткий жовтий колір на
загальному світло-зеленому фоні; 0 - все живе.
Значення збереженості, виражене у
відсотках, оцінювали за допомогою перекладу напівкількісних показників
пошкодження бруньок і деревини, оцінених в балах, в кількісні при застосуванні
наступної формули:
S=100-20·n (2.3);
де: S - збереженість зразка (%);
n - номер показника відповідний
ступеню пошкодження зразка (бал).
Визначення критичної температурної
зони можна здійснити двома способами. Перший виражається через співвідношення
збереженості біооб'єкту після охолоджування до заданої температури (формула
2.4), і другий - через відношення збереженостей після заморожування Sz і до So
(формула 2.5):
Lо=(1- Sо/Sс)100% , (2.4);
де Lо - відносний показник зниження
збереженості охолоджених зразків від -5 до - 70 оС;- схожість охолоджених
зразків до заданої температури з подальшим відігріванням до 25 оС;с - схожість
зразків в контролі при 25 оС;
Lz=(1- Sz/Sо)100%, (2.5)
де Lz - відносний показник зниження
збереженості охолоджених зразків від -5 до -70 оС з подальшим заморожуванням в
рідкому азоті;- збереженість заморожених зразків з подальшим відігріванням до
25 оС.
Отримане значення Lо вказує на
критичні температурні діапазони для рослин, в яких відбувається неповна
дегідратація клітин, і як наслідок, ріст внутрішньоклітинних кристалів льоду.
Таким чином, даний методичний прийом дає можливість визначати критичні
температурні зони рослинних клітин за рівнем їх збереженості.
.2 Методи визначення життєздатності
живців рослин
Для дослідження впливу вологості,
кількості ступенів охолодження, кінцевої температури і часу витримки на
життєздатність різних сортів ягідних культур встановлено вплив сили і
спрямованості параметрів, що визначають життєздатність деконсервованих живців.
Для визначення життєздатності,
перевіряють здатність до укорінення. Утворення коренів у живця відбувається
вздовж стебла та на зрізі в основі. Корені, що утворилися на стеблі, поступово
зникають, та коренева система нової рослини формується в основному з базальних
коренів, які знаходяться в основі живця. Прискореному відростанню базальних
коренів сприяє обробка зрізу живця регулятором росту, а також добра
забезпеченість повітрям [10].
Найпростіший спосіб укорінення - у
банці з водою. За певних умов ним можна користуватися навіть для рослин, які
вважають погано укорінюваними. Але поряд зі всією простотою цього методу є купа
дрібниць від яких залежить успіх.
Наприклад, не всі рослини виносять
зміну води. Для уникнення можливої невдачі краще не змінювати воду, а лише
доливати її при випаровуванні. Мабуть, в ній накопичуються певні необхідні
рослині продукти обміну (навіть якщо вода була добре відстояна, не містила
жодних шкідливих домішок).
Важливий і рівень води у склянці.
Якщо води надто багато, поблизу дна кисню недостатньо, а це може викликати
загнивання нижньої частини живців: адже коріння виникає тільки на межі води й
повітря. Досліди англійців показали, що коріння виникає набагато швидше та по
всій довжині живців, що знаходяться у склянці, в тому випадку, коли здійснювали
аерацію води [11]. Не менш важлива й кількість живців у банці. Жимолость,
наприклад, не бажає укорінюватися, якщо на 200 мл води приходиться більше трьох
живців, а от поодинці в баночці меншого об’єму ті ж живці чудово дають корені.
Великий вплив на укорінення живців
чинить світло. Живець, що не має листя, краще утворює корені в темряві. Для
укорінення живця, у якого залишилася хоча б частина листа, необхідне світло.
Але навіть при світлі в непрозорому посуді корені утворюються набагато краще,
ніж у світлій банці. Вважається, що живець, заготовлений з гілки в період, коли
листя вже нема, вже містить певну кількість гетероауксину, який, мабуть,
розкладається під дією світла. Якщо листя є, то саме воно виробляє стимулятор
коренеутворення гетероауксин. Можна було б залишати на живцях все листя, але,
знаходячись у воді, а тим більш під час укорінення в субстраті, коли
надходження води обмежено, зайве листя висушує живці і вони можуть загинути.
.3 Методи визначення приживлюваності
живців
Здерев’янілі живці, навіть якщо у
них немає листя, втрачають воду через випаровування з усієї поверхні пагону.
Найпростішим поясненням відсутності новоутворених коренів у таких рослин є їх
пересихання. Для зниження втрат води живці необхідно висаджувати глибше, щоб
над землею була їх невелика частина. Але за дуже глибокої посадки може
порушитись розпускання бруньок. На практиці живці частіше за все висаджують на
таку глибину, щоб третя брунька знаходилась в землі, але у самої її поверхні -
ріст у цьому випадку не уповільнюється. Тому для більшості культур достатньо
залишати над землею відрізок живця довжиною 2 - 3 см.
Найбільш сприятливий повітряний
режим утворюється у верхньому 5-см шарі ґрунту. Однак заглиблений в ґрунті на 5
см живець з виступаючою над поверхнею 3-см частиною все ж надто короткий, щоб
вижити за несприятливих умов: він може швидко висохнути, невелика довжина не
дозволить йому досить міцно закріпитися в ґрунті, нарешті, запасу поживних
речовин в такому живці явно недостатньо для того, щоб він зміг успішно
проіснувати в період спокою [10].
Температура є одним з вирішальних
факторів коренеутворення у живців. Існують рослини, які полюбляють теплу чи
холодну температуру. Живці однієї і тієї ж рослини укорінюються з різною
швидкістю в залежності від температури. Межі оптимальних температур, за яких
відбувається коренеутворення у живців більшості рослин, знаходяться приблизно
між 18 і 30 °С. В разі підвищення температури вище 30° у парнику слід
влаштовувати провітрювання.
Позитивний вплив на укорінювання
живців чинить температура субстрату в перші 15-20 днів після садіння, якщо вона
вища за температуру повітря на 4-5 °С. Така диференційована температура
позитивно відбивається на укорінюванні як зелених, так і дерев’янистих живців.
За таких умов у живців коренеутворення розпочинається раніше за розпускання
бруньок або одночасно. Коли ж температура субстрату нижча за температуру
повітря, то пагони утворюються раніше, ніж корені, тому відбувається втрата
багатьох живців, а ті, що укоріняться дають великий процент нежиттєздатних
рослин.
Ще один цікавий метод живцювання,
розповсюджений останнім часом серед садоводів-любителів. Беруть крупну бульбу
картоплі й ретельно видаляють з неї всі глазки. Живці втикають прямісінько в
бульбу, закопують її в землю та накривають скляною банкою для створення
парникового ефекту. За регулярного поливу живці швидко дають корені, а
посаджені в саду молоді рослини добре розвиваються. Так вдається укорінити навіть
ті рослини, що погано утворюють корені. Метод цілком обґрунтований, оскільки
замість води живці отримують відразу велику кількість готових поживних речовин,
зокрема вуглеводів, а також крохмалю.
Гетероауксин, індолілмасляна кислота
чи інший стимулятор росту сприяють 100 % приживлюваності дерев’янистих живців
винограду, чорної смородини та малини червоної і викликає активну появу коренів
на живцях.
Застосовано спосіб визначення
критичних зон внутрішньоклітинного кристалоутворення живців рослин, заснований на
зміні рівня виживаності клітин залежно від кінцевої температури їх
охолоджування в діапазоні від 0 до -70 °С
з подальшим відігріванням [25]. У даному методичному прийомі величина
збереженості є критерієм, за яким визначається температура внутрішньоклітинного
кристалоутворення.
Вивчення впливу ефектів
низькотемпературної сублімації внутрішньоклітинної води і плазмолізу проводили
на основі дослідження параметрів збереженості і життєздатності живців. Контроль
життєздатності та збереженості живців проводили після кожного етапу висушування
та заморожування. Для цього живці ставили на гідратацію в ексикатор з
дистильованою водою і витримували на протязі 12 днів при температурі 5 °С, а
потім пророщувати в умовах in vitro (в склянках з водою за температури 20-25 °С)
та in vivo (укорінення в ґрунті). Набухання і розвиток бруньок характеризувало
життєздатність досліджуваного зразка. Відсоток життєздатності зразка оцінювали
як відношення кількості розкритих бруньок живця в умовах in vitro, до загальної
їх кількості у зразку. Приживлюваність зразків оцінювали як відношення
кількості укорінених живців в умовах in vivo, до загальної їх кількості у
зразку.
.4 Порядок проведення експерименту
Живці нарізали з однорічних пагонів
та розподіляли на окремі зразки по 10±2 шт., довжиною від 5 до 12 см та
діаметром 0,4-0,8 см. Живці мали від 2 до 5 вегетативних бруньок. При різанні
дерев'янистих пагонів на живці верхню частину пагону обрізали, оскільки вона
недостатньо визріває і часто має слабо розвинені бруньки. Нижній зріз робили
навскіс під самою брунькою, до того ж ніж прикладали із сторони протилежної
нижній бруньці; верхній зріз - на деякій відстані від бруньки, щоб неминуче
висихання верхівки живця не торкнулося бруньки, що проростає. Після нарізки
частину живців зберігали в холодильнику при -5 °С, а іншу частину - в сушильній
камері при 4 °С. Перед висушуванням зразків, перевіряли їх життєздатність та
початкову вологість. Для дослідження відбирали зразки з життєздатністю не менше
100 %.
Ступінь вологості живців визначали після
висушування, кріоконсервування, регідратації шляхом зважування і висушування
зразків до постійної маси за температури 80 оС та розрахунку за вказаними
формулами:
ŋ і = ((m0 -mk)/ m0)·100%,
(2.1)
де ŋi - вологість зразка (%):
i=0 нативного; i=1 після висушування; i=2 кріоконсервування; i=3 регідратації;
m0 - початкова маса нативного зразка
(г);
mk- кінцева маса зразка після
зневоднення до постійної маси (г).
ŋs = (ms /m0 ) ŋ0 , (2.2)
де ŋs - вологість зразка на
одному з етапів у процесі висушування (%);
ms - маса зразка на одному з етапів
в процесі висушування (г).
Стан біооб’єкту на кожному етапі
визначали за збереженістю, життєздатністю та приживлюваністю досліджуваних
зразків.
Висушування живців до потрібного
рівня вологості можна здійснити кількома способами: "активним",
"напівактивним", "пасивним". Ступінь вологості для нативних
живців змінювали від 50 до 30 %, застосовуючи вказані режими сушки: №1
"активний" - сушильна камера, температура 20±2 ˚С з вологістю
повітря 25±5 % на протязі 3-х діб; №2 "напівактивний" - сушильна
камера, температура 5±2 ˚С з вологістю активного потоку повітря, 75±5 % та
№3 "пасивний" - за температури -2±2 ˚С, вологості повітря 85±5
%, без примусового обдування. Ступінь вологості живців також змінювали від 50
до 20 %, витримуючи їх в холодильнику при температурі -5±2 °C і -10±2 °C від 14
до 60 діб.
Для збереження остаточної вологості,
живці перед охолодженням обробляли воском чи парафіном з обох кінців або
повністю. Далі їх витримувати за різних низьких температур: від -7 ˚С
(морозильна камера) до -28 ˚С впродовж 10 днів і більше та перевіряли на
життєздатність.
Отримання різних швидкостей
заморожування-відігрівання, необхідних для кріоконсервування живців ягідних
культур, можна здійснити у декілька етапів. Режими охолодження, що засновані на
ступінчастому охолодженні із швидкістю 0,01−0,1 °C/год до температур -5−-30
°С з інтервалом 5 °С і витримкою одну, три та сім діб, відповідно, при
переміщенні зразків, розміщених в побутових термосах місткістю 2 л, до
рефрижераторів. Для зміни швидкостей заморожування досліджуваних живців в
діапазоні 0,1−0,5 °C/год застосовують спеціальні насадки (що мають різний
ступінь відкритості) на побутові термоса (місткістю 1,5 і 2 л). Для швидкостей
0,5−1,5 °C/год - на основі застосування термостатуючого пристрою з
регуляцією режиму охолодження за допомогою зміни напруги від 25 до 0 вольт і
опору нагрівального елементу 70 і 30 Ом. Охолодження від температури -30 до
-196 °С реалізовували безпосереднім зануренням зразка в рідкий азот із швидкістю
100 °C/хв − 200°C/хв.
Різні швидкості відігрівання
біооб'єкту реалізовують переміщенням зразків в рідкі і газоподібні теплоносії.
Відтавання в повітрі: із швидкістю 10 °C/хв − 30 °C/хв, проводили при
безпосередньому переміщенні зразка в холодильник при температурі 5 °С;
ступінчасте відтавання із швидкістю 0,1 °C/год до температур -30 °С з
інтервалом 5 °С і витримкою у продовж доби, відповідно, при розміщенні зразків,
що знаходяться в побутових термосах місткістю 2 л, в рефрижератори; у
приміщеннях при температурі 10 і 20 °С. В якості рідкого теплоносія
використовували водяну баню, що має різну температуру від 20 до 80 °С з кроком
10 °С.
Живці чорної смородини та малини
червоної нарізали взимку після морозів з однорічних пагонів та розподіляли на
окремі зразки по 10 шт., довжиною від 5 до 12 см та діаметром 0,4 - 0,8 см.
Живці мали від 2 до 5 вегетативних бруньок (рис 2.1). Перед початком дослідів
перевіряли життєздатність та початкову вологість зразків. Для роботи відбирали
зразки із життєздатністю не менше 100 %. Під час нарізання на живці дерев’яних
пагонів малини, верхню частину пагону обрізали, оскільки вона недостатньо
визріває і часто має слабо розвинені бруньки.
Рисунок 2.1 - Процес нарізання
зразків необхідної довжини з довгих однорічних пагонів та визначення ступеня
початкової вологості.
Після визначення початкового рівня
вологості живців, яку визначали ваговим методом, здійснювали їх охолодження за
різними режимами. Охолодження живців проводили шляхом ступінчастого охолодження
зі швидкостями 0,1 та 0,01 °С/хв. до температур -5 ÷
-30 °С з інтервалом 5 °С. Так, частину живців
зберігали в холодильнику при 5 °С. Для адаптування до більш низьких температур,
зразки витримували на кожному етапі протягом семи діб шляхом переміщення
зразків, розміщених у побутових термосах місткістю 2 л, до рефрижераторів (рис.
2.2).
Рисунок 2.2 - Процес зберігання
зразків в рефрижераторах .
Для зміни швидкостей заморожування
досліджуваних живців в діапазоні 0,1÷0,01 °C/год.
застосовували кристалічний силікагель. Охолодження від температури -30 до -196
°С реалізовували безпосереднім зануренням зразка в рідкий азот із швидкістю 600÷800°C/хв.
Відігрівання здійснювали в повітрі із швидкістю 10÷30
°С/хв. Безпосередньо у приміщенні за температури
20 °С.
Вивчення впливу ефектів
низькотемпературної сублімації внутрішньоклітинної води і плазмолізу проводили
на основі дослідження параметрів збереженості, життєздатності і приживлюваності
живців. Контроль вказаних параметрів здійснювали після кожного етапу
висушування та заморожування.
Показник збереженості оцінювали за
допомогою проведення гістологічних зрізів бруньок і живців (рис 2.3), яка
визначалась за морфо-анатомічними зрізами з використанням мікроскопу при
збільшенні у 28 раз. Ступінь пошкодження бруньок і деревини визначали за площею
потемнілої поверхні за шкалою запропонованою Соловйовою [24].
Рисунок 2.3 - Препарування бруньок
та деревини живців із визначенням площі пошкодженої поверхні за кольором [24].
Для визначення життєздатності живці
ставили в ексикатор над дистильованою водою і витримували на протязі 5-7 днів
при температурі 5 °С, а потім пророщували в умовах in vitro (у склянках з
водою) за температури навколишнього середовища 18÷20
°С (рис. 2.4). Набухання і розвиток бруньок
характеризувало життєздатність досліджуваного зразка. Відсоток життєздатності
зразка оцінювався як відношення кількості живців з розкритими брунькам, до
загальної їх кількості у зразку.
Рисунок 2.4 - Процес регідратації та
визначення життєздатності зразків після зберігання їх за низьких температур.
Приживлюваність зразків визначали в
умовах in vitro з наступним перенесенням в ґрунт (умови in vivo). Це
відображено на рис. 2.5. Показник приживлюваності оцінювали як відношення
кількості укорінених живців до їх загальної кількості у зразку.
Рисунок 2.5 - Процес пророщування
живців та їх укорінення в ґрунті.
Результати дослідів обробляли
статистично за загальновживаними методами. Підвищення ефективності
кріоконсервування живців ягідних культур здійснювали завдяки урахуванню
індивідуальних особливостей різних видів ягідних культур, застосовуючи
запропоновані [26] показники на етапах: сушіння і температурної адаптації;
заморожування; зберігання при температурі рідкого азоту; відігрівання;
регідратації; контролю збереженості і життєздатності.
Чисельна обробка і аналіз одержаних
результатів проводилися за формулами, запропонованими [25].
3. ЕКСПЕРИМЕНТАЛЬНА ЧАСТИНА
Про ефективність
низькотемпературного консервування судять по збереженості основних властивостей
біологічних об’єктів. Для її визначення зазвичай застосовують комплекс різноманітних
методів. У зв’язку з цим слід розмежовувати методи, які слід застосовувати для
оцінки стану біологічних об’єктів, кріоконсервованих за оптимально розробленими
режимами, і методи, які застосовуються на етапі розробки технології
низькотемпературної консервації. Основна відмінність полягає в тому, що для
оцінки властивостей клітин, кріоконсервованих за оптимальною програмою,
застосовується значно менший набір тестів, переважно простіших за ті, що
застосовують для оцінки властивостей клітин на етапах розробки нових способів
консервації. Всі методи слід розділити на дві категорії: експресні, за
допомогою яких визначають лише кількість збережених клітин, та методи, котрі
дозволяють найбільш повно оцінити стан клітин після кріоконсервації.
Враховуючи той факт, що клітини
після кріоконсервування повинні бути життєздатними, тобто в повному обсязі
виконувати притаманні їм функції, основні тести повинні бути вибрані таким
чином, щоб з їх допомогою можна було провести детальну інтегральну оцінку стану
клітин після кріоконсервації. Найбільш інформативними слід визнати методи, за
допомогою яких можна визначити стан функціональної активності життєздатних
клітин [20].
Таким чином, в процесі
низькотемпературного консервування в клітинах виникають пошкодження в результаті
безпосереднього та опосередкованого впливу фізико-хімічних факторів, які
реалізуються на етапах кріоконсервування. Швидкість та повнота відновлення
функціональної активності клітин після кріоконсервації визначають ефективність
методу кріоконсервування.
Мета експериментальних досліджень -
здійснити порівняльний аналіз існуючих способів зберігання живців ягідних
культур рослин: за субнульових (0±5 ºС),
низьких (близько -30 ºС)
та наднизьких (-196 ºС)
температур.
Дослідження проведені на базі
біотехнологічного центру (відділ біотехнології репродукції
сільськогосподарських тварин) Інституту тваринництва УААН.
Об’єкт дослідження - процес
зберігання генофонду ягідних культур рослин. Предмет дослідження - живці
ягідних культур: чорної смородини (Ribes nigrum L.) Дачниця, малини (Rubus
idaeus L.) Новина Кузьмина.
Підвищення рівня життєздатності
деконсервованого об’єкта - один з аспектів вирішення задачі відтворюваності
результатів експерименту, що базується на оптимізації множини взаємозалежних
біологічних та фізико-хімічних параметрів. Висока варіація параметрів, котрі
впливають на збереженість деконсервованого об’єкту, є основною причиною
низького рівня відтворюваності результатів експерименту. Коефіцієнт варіації
життєздатності деконсервованих живців рослин сягає 100 %. Отже, для отримання
достовірних результатів необхідне неодноразове повторення дослідів, що потребує
великих витрат біологічного матеріалу. Послідовна оптимізація технологічних
параметрів на кожному етапі кріоконсервування біооб’єкта дає можливість зменшити
їх кількість.
Статистичну обробку результатів
здійснювали із застосуванням критерію Стьюдента-Фішера [27]. Індивідуальні
особливості біооб’єкта враховували за середньою різницею життєздатності живців
на заданому та попередньому етапах кріоконсервування, а для вирахування цих
особливостей, визначали середнє відношення їх життєздатності при оцінці
ефективності етапу [28].
3.1 Умови та тривалість зберігання
живців ягідних культур за субнульових температур
З літературних джерел [29] відомо,
що швидкість зневоднення живців різних видів ягідних культур не впливає на їх
життєздатність, тоді як мінімальний рівень вологості живців після сушки, дуже
впливає на їх життєздатність (табл. 3.1). У зв'язку з вищевказаним недоцільно
використовувати фіксовані схеми сушки живців різних видів культур. Можна
використовувати алгоритм сушки конкретного зразка одним з вищевказаних способів
сушки (відповідно до розділу 2), або їх комбінацією, з використанням контролю
вологості певної культури до мінімально допустимого рівня вологості для
конкретної культури та сортотипу.
|
Вид живця; ηо-
початкова вологість (%); довжина ℓ±1(см), діаметр d±0,2(см),
|
Життєздатність V, %
|
Вологість живця після сушки η,
%
|
|
смородина чорна; ηо=49,8÷51,7
ℓ=8;
d=3
|
100±0
|
48,3
|
|
100±0
|
47,2
|
|
100±0
|
45,5
|
|
100±0
|
41,6
|
|
100±0
|
40,6
|
|
малина; ηо=40,0; ℓ=6;
d=4
|
100±0
|
38,3
|
|
100±0
|
36,6
|
|
85,3±12,2
|
35,0
|
Аналіз табличних даних показує, що
життєздатність живців після зневоднення до мінімально допустимого рівня
вологості складає: для смородини чорної 40,6 % та малини 35,0 %.
Таблиця 3.2 - Вплив різних ступенів
висушування на тривалість зберігання живців чорної смородини та малини за
субнульових температур
|
Вид живця
|
ηо- початкова вологість (%)
|
Температура зберігання, °С
|
Тривалість зберігання, місяць
|
Вологість після сушки η, %
|
Життє-здатність зразків, %
|
|
смородина чорна
|
ηо=49,8
|
+5
|
6
|
40,9
|
100
|
|
ηо=51,7
|
0
|
3,5
|
45,5
|
100
|
|
ηо=49,8
|
-5
|
6
|
32
|
70÷80
|
|
малина
|
ηо=40,0
|
+5
|
0,5
|
40,1
|
100
|
|
|
0
|
3
|
38,7
|
100
|
|
|
-5
|
6÷10
|
35,0
|
80÷100
|
Тривалість зберігання живців малини
упродовж 6÷10
місяців не викликала суттєвого зниження життєздатності зразків при їх витримці
при температурі 0±5 °C (табл. 3.2), разом з тим життєздатність чорної смородини
знижується до 70÷80
%.
.2 Визначення оптимальних умов
охолодження та строку зберігання живці рослин за низьких температур
Виявлення значущих факторів за
допомогою дисперсійного чи регресійного аналізу дозволяє зменшити кількість
проб [30], це здійснюється за рахунок врахування індивідуальних властивостей
біооб’єкта та підвищення ефективності його використання в ході досліджень.
Застосовано спосіб визначення
критичних зон внутрішньоклітинного кристалоутворення живців рослин, заснований
на зміні рівня виживаності клітин залежно від кінцевої температури їх
охолоджування в діапазоні від +5 до -70 °С з подальшим відігріванням. Цей
показник виражається як співвідношення збереженості біооб'єкту після
охолоджування до заданої температури до початкової. У даному методичному
прийомі величина збереженості є критерієм, за яким визначається температура
внутрішньоклітинного кристалоутворення.
Зберігання зразків протягом 6
місяців за низьких температур не супроводжувалося зниженням їх життєздатності
(табл. 3.3).
Таблиця 3.3 - Вплив низьких
температур і тривалості зберігання живців чорної смородини та малини червоної
на їх життєздатність
|
Вид живця
|
Температура зберігання, °С
|
Тривалість зберігання, місяць
|
Вологість після відігрівання, %
|
Життєздатність зразків, %
|
|
смородина чорна
|
-15
|
6
|
32
|
80
|
|
-20
|
5-10
|
34
|
80-100
|
|
малина
|
-20
|
6-10
|
20
|
80-100
|
|
-30
|
6-10
|
23
|
60-100
|
.3 Визначення умов кріоконсервування
живців за наднизьких температур, що забезпечують їх максимальну життєздатність
Для збереження генофонду клітин
рослин необхідно вивчити відтворюваність результатів кріоконсервування живців
різних видів та сортотипів й визначити оптимальні показники варійованих
параметрів, котрі забезпечують максимальну життєздатність деконсервованих
зразків.
Для вивчення необхідності проведення
температурної адаптації ягідних культур нами проведено комплекс досліджень. Для
виведення і часткового зв’язування внутрішньоклітинної води застосовано спосіб
ступінчастого охолоджування, який спрощує процедуру пошуку оптимального режиму
заморожування-відтавання різних типів зразків. Як контроль застосовували живці
берези рівень життєздатності, яких для всіх апробованих режимів
заморожування-відтавання склав - 100 %.
Максимальні показники життєздатності
живців отримані після їх температурної адаптації від -10 °С протягом 14 діб,
ступінчастого охолодження зі швидкістю 0,1 °С/год. до -20÷-30
°С із шагом 5° (із витримкою 7÷10
діб
на кожному етапі) та наступному охолодженні зі швидкістю 800 °С/год. до -196 °С
шляхом прямого занурення в рідкий азот,

Рисунок 3.1 - Деконсервовані живці
чорної смородини після зберігання в рідкому азоті
зберігання строком від 1 до 30 діб
та відігрівання зі швидкістю 70 °C/хв. При цьому час витримки за температур -20
та -28 °С варіював від 10 діб до кількох місяців. Здійснення повільного
відігрівання (0,1 °С/год.) знижувало рівень збереженості та життєздатності 0÷50
% у зразків, охолоджених до -20 та -196 °С.
Вологість деконсервованих зразків, що мали життєздатність на рівні 100 %,
варіювала від 34 до 43 %.
Таблиця 3.4 - Вплив ступінчастого
охолоджування живців чорної смородини на їх життєздатність при охолоджуванні зі
швидкістю 0,1 °C/год до температури -20 °С і 150 °C/хв. до -196 °С
|
Вологість після сушки, %
|
Охолодження до темпера-тури, °С
|
Швидкість відігрівання °C/хв (°C/год)
|
Вологість після відігрівання, %
|
Вологість після регідратації, %
|
Життєздатність, %
|
|
40,2
|
-20 і -196
|
20
|
-
|
-
|
100
|
|
41,9
|
-20 і -196
|
20
|
33,7
|
36÷46
|
100
|
|
45,3
|
-20 і -196
|
20
|
-
|
33,3
|
100
|
|
48,3
|
-20 і -196
|
20
|
-
|
37,3
|
100
|
|
42,6
|
-20 і -196
|
(0,1)
|
-
|
39,6÷45,7
|
100
|
|
45,7
|
-20 і -196
|
(0,1)
|
35,8
|
-
|
54
|
|
32,3
|
-20 і -196
|
(0,1)
|
-
|
-
|
0
|
Примітка: початкова вологість живців
складає ηо=49,8
%, життєздатність Vо=100; довжина ℓ =8±1(см), діаметр 4±1 (мм).
Розподіл рівнів життєздатності
декосервованих живців чорної смородини після заморожування до температури
рідкого азоту -196 0С склав 100 % для швидкого відтавання (20 °C/хв), і 0÷54
% для повільного (0,1 °C/год), при вологості
зразків після сушки 40÷48 % (табл.
3.4). Вологість після відтавання знизилася до 34÷36
%, а після регідратації досягла 36÷46
%.
Максимальна життєздатність живців
малини, після охолоджування до температури -196 °С (70 %), одержана при
початковій вологості зразка 38 % (табл. 3.5). При вологості 34 % рівень
життєздатності знизився до 57 % у зв'язку з тим, що мінімально допустимий
рівень після сушки, складає 37 %. Розкид значень вологості зразків після
відтавання склав 24÷40 % і
подальшої регідратації 26÷40
%.
Таблиця 3.5 - Вплив ступінчастого
охолоджування живців малини на їх життєздатність зі швидкістю 0,1 °C/год до
температури -20 °С і зі швидкістю 150 °C/хв до -196 °С
|
Вологість після сушки, %
|
Охолоджу-вання до температу-ри, °С
|
Швидкість відігрівання °C/хв (°C/год)
|
Вологість після відігрівання, %
|
Вологість після регідратації, %
|
Життєздат-ність, %
|
|
34,4
|
-20 і -196
|
20
|
-
|
29,8
|
57,1
|
|
38,3
|
-20 і -196
|
20
|
-
|
-
|
70
|
|
34,3
|
-20 і -196
|
20
|
24 ¸ 29
|
-
|
62,5
|
|
40,0
|
-20 і -196
|
20
|
-
|
29,9
|
62
|
|
42,0
|
-20 і -196
|
20
|
37,6
|
26,2
|
0
|
|
-
|
-20 і -196
|
(0,1)
|
37 ¸ 40
|
-
|
0
|
Примітка: початкова вологість живців
складає зо=40,0%, життєздатність Vо=100; довжина ℓ =12±1(см), діаметр 6±2
(мм).
Вірогідно, що загибель зразків при
охолодженні нижче -20 °С з вологістю 44 % зумовлена надлишком води, що
призводить до внутрішньоклітинного утворення льоду. При рівні вологості нижче
24÷37 % життєздатність
досліджуваних зразків раптово знижується внаслідок надмірного зневоднення
клітин (ефект плазмолізу).
.4 Порівняльний аналіз досліджених
способів зберігання
Для деконсервованих живців малини
початкова життєздатність на рівні 100 % зберігається при охолодженні до -30 °С.
Нижчі температури призводять до зниження показників збереженості та
життєздатності внаслідок зростання внутрішньоклітинних кристалів льоду.
Зберігання живців малини упродовж 6÷10
місяців
не викликало зниження життєздатності зразків при їх витримці при температурі -5
°C і -30 °C (табл. 3.6). Використання ж нижчих температур (-196 °С) призводило
до зниження життєздатності зразків до 50%.
Таблиця 3.6 - Вплив температури,
рівня вологості і тривалості зберігання живців малини на їх життєздатність
|
Температура зберігання, °С
|
Тривалість зберігання, місяць
|
Вологість після відігрівання, %
|
Життєздатність зразків, %
|
|
5
|
0,5
|
40
|
100
|
|
-5
|
7-10
|
35
|
80-100
|
|
-20
|
6-10
|
20
|
80-100
|
|
-30
|
6-10
|
23
|
60-100
|
|
-196
|
0,1
|
48
|
50
|
Зберігання живців малини в рідкому азоті
до 1 місяця призводило до проникнення азоту всередину живця та супроводжувалося
руйнуванням структури живця при відігріванні. Вірогідно, азот не встигає вийти
з клітин при досить швидкому нагріванні та розриває живець (рис. 3.2).

Рисунок 3.2 - Руйнування живців
малини після тривалого зберігання в рідкому азоті.
Разом з тим життєздатність чорної
смородини залишається без змін забезпечуючи 100 % за наднизьких температур -196
°С (табл. 3.7) і знижується до 70÷80
% для низьких температур зберігання -5÷-15
°C впродовж 5÷10
місяців. Зберігання живців смородини в рідкому азоті тривалістю до 6 місяців
також призводить до руйнування внутрішньої структури живців.
Таблиця 3.7 - Вплив температури і
тривалості зберігання живців чорної смородини на їх життєздатність
|
Температура зберігання, °С
|
Тривалість зберігання, місяць
|
Вологість після відігрівання, %
|
Життєздатність зразків, %
|
|
-5
|
6
|
32
|
70
|
|
-15
|
6
|
32
|
80
|
|
-20
|
5-10
|
34
|
80-100
|
|
-196
|
0,5
|
48
|
100
|
Таким чином, життєздатність
деконсервованих живців ягідних культур залежить від комплексу зв'язаних
чинників. Найбільш значним, з яких є сортотип рослини. При одному й тому самому
способі кріоконсервування (охолоджування із швидкістю 0,1 °C/год до температури
-20 °C і відтавання 20 °C/хв.) рівень життєздатності має розкид від 0 до 100 %.
На життєздатність так само значно впливає вологість зразка до його
охолоджування. Початкова вологість зразка має своє оптимальне значення яке
визначається з одного боку його мінімальним рівнем, який забезпечує можливість
процесу регідратації після відтавання і максимальним - який перешкоджає
зростанню внутрішньоклітинних кристалів. Очевидно, що дане оптимальне значення
є індивідуальним для кожного сорту і виду рослини, як це показано в роботі.
Величини швидкостей охолоджування і
відтавання, кінцеві температури охолоджування так само значно впливають.
Максимальні значення життєздатності деконсервованих зразків, після їх
глибинного заморожування, одержані при швидкості охолоджування 0,1 °C/год до
температури -20 °C і 150 °C/хв. до -196 °C, з подальшим відтаванням зі
швидкістю 20 °C/ хв. до 5 °C. Технологія ступінчастого охолоджування зразків в
термосах від температури -5 °C до -20 °C, з витримкою близько 7 діб на кожній
ступені, і подальшим зануренням в рідкий азот, дала добрі результати.
Слід зазначити, що ступінчате
охолоджування дає можливість усунути необхідність попередньої сушки зразків, за
рахунок низькотемпературної сублімації внутрішньоклітинної води. Вологість
зразків після їх відтавання зменшилася на 4÷18
% склавши розкид 24÷40
%. Після регідратації вологість варіювала, для життєздатних зразків від 18 до
52 % і нежиттєздатних 19÷45
%. Розкид вологості в окремому зразку складав від 1 до 10%, що пов'язано з
нерівномірністю розподілу вологи по довжині живця, а саме між його кінцями і
серединою. Такий значний розкид показників вологості зразків після їх
відтавання указує на необхідність вивчення можливості тривалого зберігання
живців при низьких температурах, і регідратації як критерію їх життєздатності.
На основі проведених досліджень
визначено строки низькотемпературного зберігання живців чорної смородини та
малини при температурі -20 °С та -30 °С на протязі 6¸10
місяців, а при температурі близько -196 °С впродовж тривалого проміжку часу.
Доцільнішим буде зберігання живців ягідних культур рослин не в рідкій фазі
азоту за температури (-196 °С), а в його парах (близько -150 °С), щоб
перешкодити його потраплянню всередину живця.
.5 Визначення впливу стимуляторів
росту на активність коренеутворення та подальшого розвитку деконсервованих
живців
Утворення та ріст пагонів поряд з
інтенсивним утворенням коріння має важливе значення для швидкого розвитку живця
в цілу рослину.
Існує три найчастіше застосовуваних
методи обробки живців стимуляторами росту: 1) занурення живців нижніми
кінчиками у водні розчини стимуляторів росту; 2) занурення нижніх кінців живців
у спиртові розчини стимуляторів росту; 3) обробка живців ростовою пудрою, яку
готують із суміші талька чи товченого вугілля із стимулятором росту.
Найпоширенішим є спосіб обробки
живців водними розчинами стимуляторів росту. Індолілмасляна кислота та
гетероауксин - це дрібнокристалічний порошок білого, рожевого чи блідо-жовтого
кольору (в залежності від ступеня очищення), які добре розчиняються у воді.
Також дуже зручно користуватися порошками для опудрювання, наприклад
«Корневином», оскільки висока адгезія до поверхні живця дозволяє активізувати
проникнення діючої речовини в клітини рослини, значно підвищити ефективність та
спростити технологію застосування препарату.
В даній роботі досліджувалась дія
стимуляторів росту «Гетероауксин» та «Корневин». Враховуючи різницю методів
обробки, визначали приживлюваність живців за таких умов: 1) у воді за
температури +18 °С в якості контролю; 2) у воді після витримування в розчині
«Гетероауксину»; 3) одразу в ґрунті в якості контролю; 4) в ґрунті після
обробки «Гетероауксином»; 5) в ґрунті після обробки «Корневином».
В ході експерименту визначали
кількість розкритих бруньок на живцях, час появи коренів та їх довжину (рис.
3.3).
Вплив стимуляторів росту на
деконсервовані зразки зображено у вигляді таблиці (табл. 3.8).


Рисунок 3.3 - Визначення
приживлюваності живців у воді із застосуванням стимуляторів росту
Таблиця 3.8 - Вплив стимуляторів
росту на деконсервовані зразки чорної смородини після зберігання впродовж 1÷2
місяців
|
загальна кількість бруньок
|
день та кількість розкритих бруньок (%)
|
день та кількість живців з корінням (%)
|
|
після зберігання за субнульових температур
|
|
контроль у воді
|
24
|
4 (29); 6 (80); 11 (100)
|
17 (40)
|
|
з гетероауксином у воді
|
22
|
2 (41); 6 (77); 14 (100)
|
17 (50)
|
|
контроль в ґрунті
|
20
|
4 (10); 6 (25)
|
(10)
|
|
з гетороауксином в ґрунті
|
19
|
3 (58); 6 (68); 14 (100)
|
(10)
|
|
з "Корневином" в ґрунті
|
21
|
2 (10); 7 (24); 10 (30)
|
(25)
|
|
після зберігання за низьких температур
|
|
контроль у воді
|
13
|
6 (38); 14 (62)
|
17 (20)
|
|
з гетероауксином у воді
|
11
|
6 (57); 14 (64)
|
17 (20)
|
|
контроль в ґрунті
|
20
|
14 (15)
|
0
|
|
з гетероауксином в ґрунті
|
10
|
14 (30)
|
0
|
|
з "Корневином" в ґрунті
|
14
|
2 (10); 14 (30)
|
(30)
|
Після зберігання живців чорної
смородини за температури -20 °С впродовж 2 місяців отримано життєздатність на
рівні 100 % та приживлюваність на рівні 40 %.


Рисунок 3.4 - Визначення
приживлюваності живців в ґрунті
В результаті роботи порівняно вплив
хімічних стимуляторів росту «Корневин» і «Гетероауксин» на швидкість
укорінювання. В лабораторних умовах найкращі показники при висадці у ґрунт дає
«Корневин». При пророщуванні у воді живців, попередньо оброблених розчином
гетероауксину бруньки на живцях розпускалися швидше в порівнянні з контролем, а
також відмічений пришвидшений ріст коренів, хоча їх поява спостерігалась через
однаковий період.
4. ОХОРОНА ПРАЦІ ТА НАВКОЛИШНЬОГО
СЕРЕДОВИЩА
.1 Загальні положення про охорону
праці
Державна політика у галузі охорони
праці базується на принципах [31]:
пріоритету життя і здоров’я
працівника, повної відповідальності роботодавця за створенням належних,
безпечних і здорових умов праці;
підвищення рівня промислової безпеки
шляхом забезпечення суцільного технологічного контролю за станом виробництва,
технології та продукції, а також сприяння підприємствам у створенні безпечних
та нешкідливих умов праці;
комплексного розв’язання завдань
охорони праці на основі загальнодержавної, галузевих, регіональних програм з
цього питання та з урахуванням інших напрямів економічної і соціальної
політики, досягнень у галузі науки і техніки та охорони довкілля;
соціального захисту працівників,
повного відшкодування шкоди особам, які потерпіли від нещасних випадків на
виробництві та професійних захворювань;
встановлення єдиних вимог з охорони
праці для всіх підприємств та суб’єктів підприємницької діяльності залежно від
форм власності та видів діяльності;
адаптації трудових процесів до
можливостей працівника з урахуванням його здоров’я та психологічного стану;
використання економічних методів
управління охорони праці, участі держави у фінансуванні заходів щодо охорони
праці, залученні добровільних внесків та інших надходжень на цілі, отримання
яких не суперечить законодавству;
інформування населення, проведення
навчання, професійної підготовки та підвищення кваліфікації працівників з
питань охорони праці;
забезпечення координації діяльності
органів державної влади, установ, організацій, об’єднань громадян, що
розв’язують проблеми охорони здоров’я, гігієни та безпеки праці, а також
співробітництва і проведення консультації між роботодавцями та їх працівниками
між усіма соціальними групами під час прийняття рішень з охорони праці на
місцевому та державному рівнях;
використання світового досвіду
організації роботи щодо поліпшення умов і підвищення безпеки праці на основі
міжнародного співробітництва.
.2 Управління охороною праці на
підприємстві
Відповідно до Ст. 13 закону України
„Про охорону праці” [31] роботодавець зобов’язаний створити на робочому місці в
кожному структурному підрозділі умови праці відповідно до нормативно-правових
актів, а також забезпечити додержання вимог законодавства щодо прав працівників
у галузі охорони праці.
З цією метою роботодавець забезпечує
функціонування системи управління охороною праці, а саме:
створює відповідні служби і
призначає посадових осіб, які забезпечують вирішення конкретних питань охорони
праці, затверджує інструкції про їх обов’язки, права та відповідальність за
виконання покладених на них функцій, а також контролює їх додержання;
розробляє за участю сторін
колективного договору і реалізує комплексні заходи для досягнення встановлених
нормативів та підвищення існуючого рівня охорони праці;
забезпечує виконання необхідних
профілактичних заходів відповідно до обставин, що змінюються;
впроваджує прогресивні технології,
досягнення науки і техніки, засоби механізації та автоматизації виробництва,
вимоги ергономіки, позитивний досвід з охорони праці тощо;
забезпечує належне утримання
будівель і споруд, виробничого обладнання та устаткування, моніторинг за їх
технічним станом;
забезпечує усунення причин, що
призводять до нещасних випадків, професійних захворювань, та здійснення
профілактичних заходів, визначених комісіями за підсумками розслідування цих
причин;
організовує проведення аудиту
охорони праці, лабораторних досліджень, умов праці, оцінку технічного стану
виробничого обладнання та устаткування, атестацій робочих місць на
відповідність нормативно-правовим актам з охорони праці в порядку і строки, що
визначаються законодавством, та за їх підсумками вживає заходів до усунення
небезпечних і шкідливих для здоров’я виробничих факторів;
розробляє і затверджує положення,
інструкції, інші акти з охорони праці, що діють у межах підприємства (далі -
акти підприємства), та встановлюють правила виконання робіт і поведінки
працівників на території підприємства, у виробничих приміщеннях, на будівельних
майданчиках, робочих місцях відповідно до нормативно-правових актів з охорони
праці, забезпечує безоплатно працівників нормативно-правовими актами та актами
підприємства з охорони праці;
здійснює контроль за додержанням
працівником технологічних процесів, правил поводження з машинами, механізмами,
устаткування та іншими засобами виробництва, використанням засобів колективного
та індивідуального захисту, виконанням робіт відносно до вимог з охорони праці;
організовує пропаганду безпечних
методів праці та співробітництво з працівниками у галузі охорони праці;
вживає термінових заходів для
допомоги потерпілим, залучає за необхідності професійні аварійно-рятувальні
формування у разі виникнення на підприємстві аварій та нещасних випадків.
Роботодавець несе безпосередню
відповідальність за порушення зазначених вимог.
Рисунок 4.1 - Схема управління
охорони праці в науково-дослідному інституті проблем кріобіології та
кріомедицини НАН України
Витяги з типового Положення про
службу охорони праці.
Служба охорони праці вирішує задачі:
забезпечення безпеки виробничих
процесів, устаткування, будівель і споруд;
забезпечення працюючих засобами
індивідуального і колективного захисту;
професійної підготовки і підвищення
кваліфікації працівників з питань охорони праці, пропаганди безпечних методів
роботи;
вибору оптимальних режимів праці і
відпочинку працюючих;
професійного відбору виконавців для
певних видів робіт.
Служба охорони праці входить в
структуру підприємства, установи, організації як одна з основних
виробничо-технічних служб.
Ліквідація служби охорони праці
допускається тільки у разі ліквідації підприємства.
Служба охорони праці залежно від
чисельності працюючих може функціонувати як самостійний структурний підрозділ
так і у вигляді групи фахівців або одного фахівця, в тому числі і за
сумісництвом.
Служба охорони праці комплектується
фахівцями, що мають вищу освіту і стаж роботи за профілем виробництва не менше
3-х літ. Фахівці з середньою спеціальною освітою приймаються в службу охорони
праці у виняткових випадках. Обмеження не стосуються: за виробничим стажем -
осіб, що мають спеціальну освіту по охороні праці; по рівню освіти - осіб, які
прийняті на посаду до затвердження даного Типового положення.
Перевірка знань по охороні праці
працівників служби охорони праці проводиться в установленому порядку до початку
виконання ними своїх функціональних обов'язків і періодично, один раз в три
роки.
На підставі даного Типового
положення з урахуванням специфіки виробництва розробляються і затверджуються
власником Положення про службу охорони праці підприємств, установ і
організацій.
Працівники служби охорони праці не
можуть притягуватися до виконання функції, не передбачених Законом «Про охорону
праці» і даним Типовим положенням.
У формі таблиці 4.1 надано перелік
шкідливих та небезпечних чинників, які виникають у лабораторії [32].
Таблиця 4.1 - Перелік основних
шкідливих і небезпечних виробничих чинників, які мають місце в умовах
експлуатації пристроїв
|
Шкідливі та небезпечні чинники
|
Джерела виникнення
|
|
Токсичні речовини - азот рідкий
|
Лабораторія
|
|
Шум
|
Вентиляційна система, лабораторне обладнання
|
|
Електрична напруга (380, 220 В)
|
Щит управління, електроприлади
|
|
Низька температура - азот рідкий tкип = - 196
0С
|
Кріогенне сховище, лабораторія
|
4.3 Промислова санітарія
.3.1 Шкідливі речовини, які
зустрічаються у лабораторії.
Характеристика шкідливих речовин,
які використовуються у лабораторії при проведенні експерименту наведено у
таблиці 4.2 [31 - 34].
Таблиця 4.2 - Характеристика шкідливих
речовин, які використовуються у лабораторії при проведенні експерименту
|
Речовина
|
Токсичність
|
ГДК, мг/м3
|
Клас небезпеки
|
|
1
|
2
|
3
|
4
|
|
Азот рідкий та оксиди азоту
|
Впливає на ЦНС, серцево - судинну систему,
систему травлення, органи дихання та шкіру.
|
2
|
3
|
.3.2 Метеорологічні умови
Параметри мікроклімату відповідно
ГОСТ 12.1.005 - 88 [33], вибирають з урахуванням категорії робіт, що
виконуються, за енергозатратами організму та пори року. Категорії робіт, що
виконуються по енерговитратам - легка-1б.
Допустимі та оптимальні значення
параметрів метрологічних умов наведені в таблиці 4.3.
Таблиця 4.3 - Значення параметрів
метеорологічних умов
|
Період року
|
Категорія робіт по енерговитратам
|
Температура, 0С
|
Відносна вологість, %
|
Швидкість руху повітря, м/с
|
|
Холодний
|
Легка - 1б
|
допустимі
|
|
|
20 - 24
|
не більше 75
|
0,2
|
|
Теплий
|
Легка - 1б
|
оптимальні
|
|
|
21 - 23
|
40 - 60
|
0,1
|
4.3.3 Вентиляція
Для забезпечення нормованих
параметрів мікроклімату [33], треба передбачити в основних виробничих умовах
систему вентиляції та опалення. При виборі вентиляції вибрано вид вентиляції:
по способу подачі повітря - природна
та штучна;
по об’єму обхвату приміщення -
загальнообмінна;
по напрямку руху повітряного потоку
- витяжна ;
за часом дії - постійно діюча.
Вид опалення за об’ємом обхвату
приміщень - центральне.
Освітлення.
У відповідності до [31, 33, 34], у
лабораторії передбачене природне та штучне освітлення. Залежно від розряду
зорової роботи, який визначається найменшим розміром об’єкту розрізнення, виду
освітлення, вибрано нормативне значення коефіцієнта природної освітленості
(КПО) високої точності.
Характеристика зорової роботи
високій точності - III розряд зорової роботи[36, 37].
Вікна в фізико-хімічній лабораторії
орієнтовані на північ. Коефіцієнт природної освітленості (КПО) для IV поясу
світлового клімату розраховується за формулою:
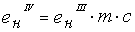 , (4.1)
, (4.1)
де: енIV - коефіцієнт
природної освітленості (КПО) для IV пояса світлового клімату, %;
eнIII - коефіцієнт природної
освітленості для III пояса світлового клімату(2);- коефіцієнт світлового
клімату (0,9);- коефіцієнт сонячного клімату (1)
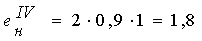 (%)
(%)
Характеристика зорової роботи
у фізико - хімічній лабораторії наведена в таблиці 4.3
Таблиця 4.3 - Характеристика
освітлення
|
Найме-нування примі-щення
|
Площа підлоги м2
|
Розряд зорової роботи
|
Підрозряд зорової роботи
|
Контраст об’єкта Розрізнен-ня з фоном
|
Освітлення
|
|
|
|
|
|
природне
|
штучне
|
|
|
|
|
|
Вид освітлення (бокове, верхнє)
|
КПО, %
|
Загальна освітленість, Е, лк
|
|
Лабораторія
|
12
|
III
|
в
|
високий
|
бокове
|
1,8
|
300
|
Джерела світла: тип світильника -
ЛСПО 1В, тип ламп - ЛБ-40, ЛТБ-65, ЛХБ-40.
.3.5 Водопостачання і каналізація
Характер системи проектованого
водопроводу [39]. Джерело постачання водою - міський водопровід. Вид діючої
каналізації - господарсько-побутова.
.3.6 Шум
Наявні джерела шуму: термостат,
холодильник, система вентиляції [35].
Допустимі рівні звукового тиску та
звуку представлені у таблиці 4.5.
Таблиця 4.5 - Допустимі рівні
звукового тиску та звуку [38]
|
Види трудової діяльності, приміщення, робочі
місця
|
Рівні звукового тиску в дБ в октавних смугах
із середнє-геометричними частотами, Гц
|
Рівні звукового тиску та еквівалентні рівні
звуку, дБА
|
|
31,5
|
63
|
125
|
250
|
500
|
1000
|
2000
|
4000
|
8000
|
|
|
Крайні частоти в октавних смугах, Гц
|
22 45
|
45 90
|
90 180
|
180 360
|
360 720
|
720 1440
|
1440 2880
|
2880 5760
|
5760 11520
|
22-11520
|
|
Вимірювальні та аналітичні роботи в
лабораторії
|
93
|
79
|
70
|
63
|
58
|
55
|
52
|
50
|
49
|
60
|
.4 Електробезпека
Параметри електричної мережі в
фізико - хімічній лабораторії:
род струму (змінний)
напруга в мережі (220 В);
частота (50 Гц);
режим нейтралі живлячої мережі
(трифазна трьохпровідна мережа з ізольованою нейтраллю).
Приміщення за ступенем небезпеки
ураження електричним струмом відноситься до приміщення без підвищенної небезпеки,
характеризуються відсутністю умов, що створюють підвищену) або особливу
небезпеку[40].
.5 Пожежна безпека
Пожежна безпека забезпечується
системою запобігання пожежі, системою пожежного захисту [41] і
організаційно-технічними заходами.
Приміщення по вибухо-пожежонебезпеці
відноситься до категорії В [42] ступінь вогнестійкості, яку повинна мати
будівля, II [43].
Із можливих елементів системи
пожежного захисту обов’язковими є первинні засоби пожежогасіння [41]. Перелік
обов'язкових засобів пожежогасіння для фізико - хімічної лабораторії наведено в
таблиці 4.6.
Лабораторія, в якій проводиться
дослідження відноситься до класу зони П-ІІ по пожежонебезпечності [40].
Таблиця 4.6 - Перелік обов'язкових
засобів пожежегасіння.
|
Приміщення
|
Площа, м2
|
Первинні засоби пожежегасіння (тип)
|
Кількість, шт.
|
|
Лабораторія
|
8
|
Вуглекислотні: ВВ-2
|
1
|
Будівлі і споруди підлягають
блискавкозахисту у відповідності з [44]. Категорія устрою блискавкозахисту,
виходячи з масштабів можливих руйнувань або збитків - III.
.6 Охорона навколишнього середовища
Можливі джерела забруднення
навколишнього середовища в даній організації відсутні.
.7 Індивідуальне завдання
Розрахувати штучне (визначити число
світильників) освітлення (зробити ескіз розташування світильників)
У процесі виконання розрахункової
частини необхідно:
) вибрати систему освітлення,
джерело світла, тип світильника для заданої ділянки робочого приміщення;
) зробити розрахунок загального
освітлення робочого приміщення.
Кількість світильників визначається
за формулою:
N = Emin ·K ·S ·z / Ф ·n ·ŋ(4.1)
де Emin - мінімальна нормована
освітленість, лк, для третього розряду зорової роботи (IIIв) = 300 лк;
К- коефіцієнт запасу запасу, (К =
1,2);- освітлювана площа, м2 (S = 12 м2);- коефіцієнт мінімальної освітленості
(коефіцієнт нерівномірності освітлення), (z= 1,1);
ŋ - коефіцієнт використання
світлового потоку в частках одиниці (ŋ= 0,49);
Фл - світовий потік однієї лампи, лм
(Фл= 1995);- кількість світильників;- кількість ламп у світильнику, (N = 2).
Вибір системи освітлення.
Залежить від точності виконання
зорових робіт (найменший розмір об'єкта розрізнення). Відповідно до чинних норм
при виконанні робіт I-IV розрядів слід застосовувати систему комбінованого
освітлення.
Вибір нормованої освітленості.
Характеристика освітленості залежить
від розряду зорових робіт, фону, контрасту фона з об'єктом, а також від системи
освітлення. Для точних робіт IIIв розряду Emin = 300-500 лк.
Вибір джерела світла.
Лампи люмінесцентні - мають високу
світловіддачу до 75 лм/Вт, термін служби до 10 тис. год., гарна передача
кольору, низька температура. У приміщеннях висотою до 6 м рекомендується
застосовувати люмінесцентні лампи. У виробничих приміщеннях висотою 7-12 м
доцільно застосовувати лампу ДРЛ, оскільки вони більш потужні і мають високу
світловіддачу до 90 лм/Вт.
В даному випадку використовуються
люмінесцентні лампи типу ЛДЦ 40-4, Фл=1995 лм.
4) Вибір світильника.
Існує класифікація світильників за
світлорозподілом: прямого, переважно прямого, розсіяного, переважно відбитого і
відбитого. Відповідно до Держстандарту № 14254-69 світильники класифікують за
ступенем захисту від пилу та води. За конструктивним завданням згідно зі СНіП
II-4-79 розрізняють сім експлуатаційних груп світильників.
В даному випадку використовується
друга група світильників.
) Коефіцієнт запасу.
Враховує залежність приміщення,
зниження світлового потоку ламп у процесі експлуатації.
) Коефіцієнт мінімальної
освітленості.
Характеризує нерівномірність
освітлення. Рекомендується брати z= 1,1 - для люмінесцентних ламп, і z= 1,15 -
для ламп розжарювання і ламп типу ДРЛ.
) Коефіцієнт використання світлового
потоку.
Для визначення коефіцієнту знаходять
індекс приміщення і, й передбачувані коефіцієнти відбиття поверхонь приміщення:
стелі ρс, стін ρст,
підлоги ρп.
Для освітлення адміністративних приміщень ρс
= 70%, ρст
= 50 % , ρп
= 30 %.
Індекс приміщення і визначають за
формулою:
і = А· В / h·(А+В)(4.2)= Н - hсв -
hс.р. = 4,5- 0,2 - 0,7 = 3,6 (м)
і = 6·9/ 3,6 · (6+9) = 1
ŋ = 49 % = 0,49= 300· 1,2 · 12
· 1,1 / 1995·2·0,49 = 2,4 ≈ 4 лампи
Схема розміщення світильників у
приміщенні зображена на рис. 4.1.
 Рисунок 4.1
- Схема розміщення світильників у приміщенні
Рисунок 4.1
- Схема розміщення світильників у приміщенні
Висновок: для рівномірного
освітлення приміщення необхідно встановити 4 лампи типу ЛД 40-4 [36].
5. Економічна ефективність
науково-дослідної роботи
В даному розділі дипломної роботи
розглянута економічна ефективність вивчення можливостей кріобіотехнології при
тривальму зберігання ягідних культур.
Актуальність ціеї теми пов'язана з
можливістю створення генетичного банку рослин для подальшого відновлення
чисельності генофонду рідких і зникаючих видів рослин в природних біотипах за
рахунок реінтродукції, а також щоб забезпечити зберігання рослин в природних
ценопопуляціях або натуралізованих ценозах (в ботанічних садах і розплідниках),
джерелом матеріалу для яких можуть слугувати генетичні банки і природні
популяції.
.1 Розрахунок собівартості та ціни
науково-технічної продукції
Витрати, які входять у собівартість
НДР, групуються у відповідності з їх економічним змістом за наступними
елементами:
матеріальні витрати;
витрати на оплату праці;
відрахування на соціальні заходи;
амортизація основних фондів та
нематеріальних активів;
інші витрати.
.1.1 Визначення матеріальних витрат
До складу матеріальних витрат
відносять: вартість сировини та матеріалів, покупних виробів та
напівфабрикатів, вартість робіт та послуг виробничого характеру, виконувані
іншими організаціями, вартість придбання енергії усіх видів, витраченої на
технологічні потреби організацій, зв’язані з виконанням даної НДР та інші
витрати згідно [45].
До вартості матеріалів входять
витрати, пов’язані з транспортуванням матеріальних ресурсів, в тому числі
завантажо-розвантажувальні роботи, які виконуються власними силами організації.
Кількість матеріалів, що
затрачуються на виконання НДР, (Рі) встановлюється виходячи з кількості
дослідів, які проведено протягом всієї експериментальної частини дипломної
роботи, та необхідного розходу сировинних компонентів на один дослід.
Розрахунок вартості матеріалів
здійснюється за формулою:
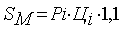 , (5.1)
, (5.1)
де Рі - витрати і - го
компонента на весь об`єм робіт;
Ці - вартість і - го
компонента, грн/од;
1,1 - коефіцієнт, який
враховує транспортні витрати.
Розрахунок витрат на
матеріали зведено до таблиці 5.1
Ціни на матеріали встановлено
за даними інституту.
Таблиця 5.1 - Розрахунок
витрат на матеріали для виконання НДР
|
Найменування сировини
|
Одиниці вимірювання
|
Кількість, Рі
|
Ціна одиниці грн/од. Ці
|
Сума, грн.
|
|
Азот рідкий
|
л
|
50
|
37
|
1850
|
|
Пакувальний матеріал
|
шт.
|
50
|
0,10
|
5,00
|
|
Стакани пластикові
|
шт.
|
100
|
0,25
|
25
|
|
Всього
|
|
|
|
1880
|
Витрати на малоцінні товари наведені
у таблиці 5.2:
Таблиця 5.2 - Витрати на малоцінні
товари
|
Найменування сировини
|
Одиниці вимірювання
|
Кількість, Рі
|
Ціна одиниці грн/од. Ці
|
Сума, грн.
|
|
Термостатуючий пристрій
|
шт.
|
2
|
50
|
100
|
|
Всього
|
|
|
|
100
|
Витрати на електроенергію, пов’язану
із технологією проведення НДР, розраховуюється за формулою (5.2):
Si = Nвстj·tj·kпоп·Це·nj, (5.2)
де Nвстj - потужність j-го обладнання,
кВт ;
nj - кількість j-го обладнання, шт;
tj - час роботи j-го обладнання,
годин;
kпоп - коефіцієнт попиту, який
дорівнює 0,72 ;
Це - вартість 1 кВт·год
електроенергії, грн./кВт·год.
Результати розрахунків витраченої
електроенергії наведені в таблиці 5.3.
Таблиця 5.3 - Споживана
електроенергія
|
Найменування обладнання
|
Кількість, шт.
|
Встановлена потужність N кВт
|
Час роботи, год
|
Kпоп
|
Витрачена потужність кВт год
|
|
Дистилятор
|
1
|
1,8
|
680
|
0,72
|
881,28
|
|
Шафа сушильна
|
1
|
1,2
|
680
|
0,72
|
587,52
|
|
Мікроскоп світловий
|
1
|
0,1
|
680
|
0,72
|
48,96
|
|
Холодильник
|
1
|
1,5
|
680
|
0,72
|
734,40
|
|
Всього
|
|
|
|
|
2252,16
|
Знаючи вживану сумарну потужність
електроустаткування та тариф за 1 кВт-годину електроенергії, згідно з формулою
5.2 визначаємо витрати на електроенергію.
S = N·Ці = 2252,16 · 0,48 = 1081,04
(грн.). (5.3)
Витрати на електроенергію складають
1081,04 грн.
.1.2 Витрати на оплату праці та
відрахувань на соціальні заходи
Для даної конкретної НДР витрати на
оплату праці (Sоп) розраховуються за формулою:
оп = [O1·T1·n1·1,12]·1,2
= (O3 · 1,12)·1,2 (5.4)
деО1 - оклад 1-го співробітника,
грн. /міс;
Т1 - час роботи 1-го виконавця під
час виконання даної НДР, місяці;
,12 - коефіцієнт, який враховує
доплати до основної заробітної плати;
,2 - коефіцієнт доплат до основної
та додаткової заробітної плати, який виплачується за рахунок прибутку;
ОЗ - основна заробітна плата
виконавців НДР, грн.
Результати розрахунків наведені у
таблиці 5.4.
Таблиця 5.4 - Витрати на оплату
праці виконавців.
|
Склад виконавців
|
Кількість чол. (n1)
|
Оклад грн./міс (О1)
|
Час роботи, міс (Т1)
|
Основна та додаткова з/п, грн.
|
Оплата праці, (Sоп)
|
|
1
|
2
|
3
|
4
|
5
|
6
|
|
Керівник проекту
|
1
|
1750
|
4
|
7000
|
7840
|
|
Ст. науковий співробітник
|
1
|
1400
|
4
|
5600
|
6272
|
|
Мол. Науковий співробітник
|
1
|
980
|
4
|
3920
|
4390,4
|
|
Всього
|
3
|
|
|
Σ 16520
|
Σ 18502,4
|
До елементу “Відрахування на
соціальні заходи” відносять здійснювані за порядком та у розмірах, які
враховуються законодавством:
а) відрахування на державне
(обов’язкове) пенсійне страхування (до Пенсійного фонду) у розмірі 33,2 % від
витрат на оплату праці (6142,80 грн.);
б) відрахування у фонд захисту
безробіття у розмірі 1,6 % від витрат на оплату праці (296,04 грн.);
в) відрахування у фонд на випадок
непрацездатності у розмірі 1,4 % від витрат на оплату праці (259,03 грн.);
г) відрахування на обов’язкове
державне соціальне страхування від нещасного випадку на виробництві та
професійного захворювання, які спровокували втрату працездатності у розмірі 2 %
від витрат на оплату праці (370,05 грн.).
.1.3 Розрахунок амортизації основних
фондів
Елемент „амортизація основних
фондів” включає суму амортизаційних відрахувань основних виробничих фондів,
вирахувану за їх балансовою вартістю згідно з установленими законом нормами
амортизації.
Амортизаційні відрахування основних
фондів розраховуються за формулою:
= Naj·Цсбj·tj/ 100·F,
(5.5)
де Naj - річна норма амортизації для
j - го обладнання групи L; при використанні пристроїв та лабораторного
обладнання складає 24 %;
Цсбj - балансова вартість j - го
обладнання, грн.;
tj - час роботи j - го обладнання,
години ;
F - фонд часу для однозмінної
роботи, годин/ рік; приймається рівним 2000 годин/рік.
Розрахунки наведено у таблиці 5.5.
Таблиця 5.5 - Розрахунок
амортизаційних витрат
|
Найменування обладнання
|
Час роботи, години tj
|
Балансова вартість,грн. Цсбj
|
Норма амортизації, %, Naj
|
|
1
|
2
|
3
|
4
|
5
|
|
Дистилятор
|
680
|
1200
|
24
|
97,92
|
|
Шафа сушильна
|
680
|
3050
|
24
|
248,88
|
|
Мікроскоп світловий
|
680
|
8000
|
24
|
652,8
|
|
Холодильник
|
680
|
2600
|
24
|
212,16
|
|
Сосуди Дьюара
|
680
|
1200
|
24
|
97,92
|
|
Ваги аналітичні
|
680
|
800
|
24
|
65,28
|
|
Разом:
|
|
|
|
Σ 1374,96
|
.1.4 Розрахунок витрат за пунктом
«інші витрати»
До даного елементу відносять:
* витрати на службові відрядження у
межах норм, визначених законодавством;
* витрати на вартість інформації та
консультаційні роботи;
* вартість сертифікації продукції;
* витрати на обчислювальні роботи;
* витрати на рекламу;
* витрати на ярмарки, виставки;
* інші витрати відповідно.
.1.5 Калькуляція собівартості НДР
Витрати, пов’язані із розробкою НДР
та розглянуті у розділах 5.1.1 - 5.1.6 даної роботи, з метою планування, обліку
та калькуляції собівартості згруповано за статтями в таблиці 5.6
Таблиця 5.6. Калькуляція кошторисної
вартості НДР
|
Статті витрат
|
Сума, грн
|
Частина, %
|
|
Оплата праці
|
18502,4
|
58,69
|
|
Відрахування на соціальні заходи
|
7067,92
|
22,42
|
|
Сировина та матеріали
|
1980,00
|
6,28
|
|
Паливо та енергія
|
1081,04
|
3,43
|
|
Амортизаційні витрати
|
1374,96
|
4,36
|
|
Комунальний податок
|
20,4
|
0,06
|
|
Інші витрати
|
1501,34
|
4,76
|
|
Загальна собівартість НДР
|
31528,06
|
100
|
Комунальний податок розраховується
за формулою (5.6):
Hком = r·0,1·Hmin·t, (5.6)
де r- кількість виконавців, людей;
Hmin - мінімальний налогооблагаємий
мінімум, грн. (01.2002 - 17грн.)
T - час проведення НДР, місяців.
Hком= 3·0,1·17·4=20,4 (грн.)
Інші витрати приймаємо у розмірі 5 %
від суми статей всіх витрат.
.1.6 Визначення договірної ціни.
Договірна ціна НДР встановлюється
виходячи з калькуляції собівартості та рівню рентабельності, що задається.
Таким чином розраховується мінімальний рівень ціни, яка визначається за
формулою:
Цmin=C + Пн, (5.7)
де С - собівартість НДР, грн.;
Пн - нормативний прибуток, грн.
визначається за формулою (5.8):
Пн = С·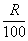 , (5.8)
, (5.8)
де R - заданий рівень
рентабельності, % , R=35 % .
Окрім нормативного прибутку
до ціни можливо додати додатковий прибуток, який враховує складність та
науково-технічний рівень НДР.
Додатковий попит розраховують
за формулою (5.9) :
Пдод =КНТР·Пн , (5.9)
де КНТР- коефіцієнт, який
враховує науково-технічний рівень розробки (розраховується у розділі 5.2.1),
звідки
Цдог = Цmin+Пдод (5.10)
Крім цього слід врахувати
витрати на виробництво експериментальної партії продукції, 40 % від
собівартості НДР:
Кпредв = С×0,4
(5.11)
Таким чином:
Пн = 31528,06·35/100 =
11034,82 (грн.)
Цmin = 31528,06 +11034,82 =
42562,88 (грн.)
Пдод = 0,64·11034,82 =
7062,28 (грн)
Звідки:
Цдог = 42562,88 + 7062,88 =
49625,16 (грн.)
Кпредв = 31528,06·0,4 =
12611,22 (грн.)
Для розрахунку економічного
ефекту НДР необхідно визначити передпідприємницькі витрати:
Кпред =С/0,4, (5.12.)
де С - витрати на проведення
НДР (її собівартість)
Кпред = 31528,06 /0,4 =
78820,15 (грн)
У зв’язку з досить великим
рівнем рентабельності (35%), робота є перспективною для впровадження .
.2 Розрахунок ефективності
НДР теоретичного характеру
Для НДР даного виду корисний
ефект від проведення може визначатися у двох напрямках:
а)науково - технічний ефект;
б) супутній ефект (
соціальний, екологічний).
.2.1 Розрахунок
науково-технічного ефекту НДР
Таблиця 5.6 - Критерії та їх
бальна оцінка
|
Критерії оцінки
|
Шкала критеріїв
|
Бальна шкала
|
|
Час, необхідний для проведення експерименту
|
1-2 роки та менше
|
+2
|
|
Технологічні показники
|
на рівні світових зразків
|
0
|
|
Можливість отримання авторських свідоцтв на
винахід
|
Частинні можливості
|
0
|
Результати позитивні, К = 2, тобто
розробки вельми перспективні.
Розрахунок коефіцієнта
науково-технічного рівню НДР здійснюється за формулою:
К ндр= Іn · Tсл · Rp / 100,
(5.11)
Важливість роботи (І) оцінюють за її
призначенням; вирішення проблемних питань. Числове значення І приймаємо рівним
4.
Показник використання результатів
НДР (n) приймаємо рівним 2, оскільки результати досліджень можуть бути
використані у подальших розробках.сл - складність виконання роботи у порівнянні
з подібними. Tсл = 2.
Результативність НДР (Rp) визначається
за повнотою вирішення поставлених задач: отриманий результат задовільний; Rp =
2.
Кндр= 42·2·2 / 100 = 0,64
< 1 - дослідження перспективні та можуть бути використані у подальших
розробках.
.2.2 Оцінка долі творчої праці за
типовими етапами НДР [46]
Типові стадії проведення НДР:
планування конкретних розробок;
збір та обробка інформації;
економічний розрахунок;
експеримент;
використання математичних методів та
ЕРМ;
прийняття та виконання рішення;
упровадження;
оформлення, обговорення та здача.
У даному експерименті доля творчої
праці представлена таким чином:
етап - 10%, 2 етап - 16%, 3 етап -
6%, 4 етап - 30%; 5 етап - 8%; 6 етап - 12%; 7 етап - 10%; 8 етап - 8% (рис.
5.1).
Рисунок 5.1 - Оцінка долі
творчої праці при виконанні даної роботи за типовими етапами НДР.
Таким чином, проведені
економічні розрахунки підтверджують доцільність проведення даної дослідницької
роботи та перспективність впровадження її результатів.
6. Цивільна оборона
«Цивільна оборона України є
державною системою органів управління, сил і засобів, що створюється для
організації і забезпечення захисту населення від наслідків надзвичайних
ситуацій техногенного, екологічного, природного та воєнного характеру» [47].
В даному розділі розглянуто
вплив низьких температур на організм людини та надання першої допомоги.
Актуальність цієї теми
пов'язана з використанням в даній дипломній роботі наднизьких температур.
Якщо людина тривалий час
перебуває на холоді, в неї може виникнути переохолодження всього організму, або
загальне замерзання. У розвитку загального переохолодження виділяють кілька
фаз:
людина відчуває втому,
скутість, сонливість, байдужість до навколишнього;
за подальшого зниження
температури тіла спостерігається запаморочення;
зупинка кровообігу, серцевої
діяльності.
Якщо переохолодження
організму незначне, непогані результати дає зігрівання потерпілого власним
тілом того, хто подає допомогу. Так доцільно робити, коли немає можливості
зігріти потерпілого іншими засобами.
Після зігрівання слід
визначити, чи не відбулося обмороження кінцівок та інших частин тіла. Якщо такі
ознаки є, треба вжити заходів щодо обробки обморожених місць.
Обмороження - це ушкодження
тканин у результаті дії низьких температур [48]. Може виникнути навіть за температури,
вищої за 0 °С. При температурі нижче 0 °С найближчі до шкіри кровоносні судини
звужуються для того, щоб зберегти температуру всередині організму. При дуже
низькій температурі або тривалому перебуванні на холоді, в результаті захисної
реакції організму, потік крові до деяких частин тіла може знизитися до
небезпечно низького рівня. Обморожують головним чином ніс, вуха, кінчики
пальців рук і ніг, які при важких обмороженнях можна навіть втратити.
Симптоми обмороження
розвиваються під час перебування на холоді. По-перше, виникає відчуття холоду.
Потім людина відчуває поколювання, її шкіра набуває блідого відтінку, втрачає
чутливість. Пізніше німіє і набуває синюшного відтінку. Втрата чутливості
робить непомітною подальшу дію низької температури і часто є причиною тяжких
незворотних змін у тканинах. Справжню глибину обмороження можна встановити
тільки після припинення дії холоду, інколи через кілька днів (на ураженій
ділянці з’являється набряк,запалення чи змертвіння тканин).
За тяжкістю та глибиною
розрізняють чотири ступені обмороження.
І ступінь (легкий)
характеризується ураженням шкіри, що супроводжується запаленням, набряком,
болем. Такий стан триває кілька днів, потім поступово проходить. Уражена
ділянка надовго залишається дуже чутливою для холоду.
ІІ ступінь (середньої
тяжкості) проявляється некрозом поверхневих шарів шкіри. Після відігрівання
уражене місце синіє. В зоні обмороження утворюються пухирці, наповнені прозорою
чи білуватою рідиною. З’являється сильний біль. Серед загальних симптомів спостерігається
підвищення температури тіла, погані сон та апетит.
ІІІ ступінь (тяжкий) -
відбувається поступовий некроз тканин на значну глибину. В перші дні
спостерігається поява пухирців, заповнених темною рідиною. Через кілька днів
з’являються ділянки вологої мертвої тканини. Хворі відчувають нестерпний біль.
Захворювання супроводжується виділенням поту та оздобами, апатією. ступінь
(вкрай тяжкий) характеризується змертвінням тканини до кістки. Ця частина тіла
залишається холодною та абсолютно нечутливою. Шкіра вкривається пухирцями,
заповненими чорною рідиною. Через кілька днів уражена ділянка швидко чорніє і
висихає. Відбувається муміфікація тканин. Процес загоєння такої рани
надзвичайно тривалий (1,5-2 місяці).
Перша допомога при
обмороженні. Якщо обмороження незначні, можна зігріти пальці рук, сховавши їх
під пахви, якщо обморожений ніс, достатньо теплих рук, щоб зігріти його. Не
дозволяйте зігрітій ділянці шкіри змерзнути знову. Чим частіше тканина замерзає
й зігрівається, тим серйозніші можуть бути ушкодження. Легкі обмороження
проходять самі по собі через 1-2 години. Якщо після розтирання нерухомість
ділянки шкіри не зникає, зверніться до лікаря.
Потерпілого для зігрівання
потрібно занести в тепле приміщення, звільнити від взуття й одягу. Не слід
класти хворого біля джерела тепла (батареї, обігрівача, каміна, вогню, гарячої
груби) або використовувати фен: потерпілий не відчуває обморожену тканину й
може легко отримати ще й опік. Теплої ковдри, гарячого чаю або молока буде
досить. Якщо на обмороженій ділянці немає пухирів або набряку, протріть його
горілкою або спиртом і чистими руками зробіть масаж відмороженої частини тіла,
рухаючись в напрямку до серця. З появою пухирів робити масаж не можна, інакше
можна занести інфекцію й заподіяти непотрібний біль. Дуже часто до появи
чутливості шкіру розтирати потрібно довго, поки вона не стане червоною, м’якою
й теплою. Масаж потрібно робити дуже обережно, щоб не пошкодити судини [49].
Якщо обморожені щоки або ніс,
відігрівання можна зробити, розтираючи їх на морозі, і потім віднести
потерпілого в приміщення. Не рекомендується розтирати обморожені ділянки
снігом, це може призвести до погіршення стану потерпілого. Сніг сприяє ще
більшому охолодженню, а гострі крижинки можуть поранити шкіру.
При обмороженнях чи загрозі
обмороження кінцівок, після того як пацієнт доставлений у тепле місце, потрібно
одразу ж зробити життєво важливу для нього процедуру - ізолювати замерзлу
кінцівку від зовнішнього тепла (обкласти її ватою або яким-небудь іншим тепло
ізолюючим матеріалом) і тільки після цього приступити до загального зігрівання
тіла. Суть цього полягає в тому, що життя окремих клітин тіла може зберігатися
і в умовах глибокого охолодження (від +2 до -3 °С). при підвищенні температури
активне протікання життєвих процесів у клітинах відновлюється і клітини можуть
виконувати свої функції. Якщо почати відігрівання обмороженої кінцівки ззовні,
то відігріті першими клітини шкіри, підшкірної клітковини, судини і нервові
закінчення «вимагатимуть» для своєї життєдіяльності звичної для них кількості
кисню і поживних речовин. Однак, доки кінцівка не відігрілась до нормальної
температури на повну глибину і кровообіг у ній не відновився повністю,
відігріті першими поверхневі клітини виявляються без доступу необхідних для них
речовин і гинуть. У результаті можна втратити обморожену кінцівку і залишитися
калікою. Якщо ж відігрівання обмороженої кінцівки починається зсередини,
першими відновлюються життєві функції клітин і тканин, що безпосередньо
контактують із кровоносними судинами і в момент відновлення їхніх функцій
клітини отримують все необхідне. І так поступово це відбувається з усією
кінцівкою, включаючи і поверхневі клітини. В результат можна зберегти
обморожену кінцівку і залишитися здоровим.
Зігрівання можна проводити й
у теплій воді кімнатної температури, обережно розтираючи шкіру. Вода не повинна
бути ні дуже теплою, ні дуже холодною. Температуру води слід підвищувати
поступово, починаючи з кімнатної 18-20 °С, і доводити її до температури тіла 37
°С.у цей же час хворому дають гаряче питво. Процес зігрівання може
супроводжуватись гострим пекучим болем, появою пухлин, зміною кольору шкіри.
Зігрівання продовжують доти, поки шкіра не стане м’якою й чутливою.
Після теплої ванни необхідно
акуратно витерти хворого, відморожену ділянку, якщо відсутні пухирці, протерти
спиртом і накласти стерильну пов’язку й тепло вкутати. Не рекомендується
використовувати мазі, тому що вони можуть ускладнити подальший огляд ушкоджених
ділянок лікарем. Після надання першої допомоги хворого необхідно якомога швидше
доставити в лікарню.
При обмороженнях ІІІ та IV
ступенів потрібно хірургічне лікування з приводу пересадки шкіри або ампутації
кінцівок. При обмороженнях верхніх кінцівок хвороба загрожує втратою руки,
обличчя - здебільшого втратою вух, носа (потрібно робити пластичні операції),
нижніх кінцівок (до середини гомілки) - хворий може померти. Процес лікування
проходить у стаціонарі: протягом двох-трьох тижнів - при обмороженні ІІ стадії,
35-40 днів при хворобі ІІІ стадії, до 2-2,5 місяці - при IV стадії.
Запобіжні заходи. Уберегти
себе від обмороження дуже просто, головне пам’ятати кілька важливих правил
[50]. Якщо ви знаєте, що ви довгий час будете перебувати на холоді, візьміть із
собою гарячу їжу й напої. Якщо вологість повітря підвищена, уникайте тривалого
перебування в холодних сирих приміщеннях. Не варто перебувати на холоді
утомленому, спітнілому або в нетверезому стані. Алкоголь знижує процес
теплоутворення в організмі, хоча людина відчуває тепло. Одягайтеся тепло й
зручно, взуття не повинно бути вологим, тісним, інакше це може порушити
кровообіг. Беріть із собою рукавиці, а не рукавички - саме пальці рук є одними
з найуразливіших місць обмороження. Час від часу слід перевіряти стан відкритих
частин тіла і голови, щоб вчасно запобігти обмороженню й повернутися в
приміщення.
Таким чином, надання
своєчасної допомоги потерпілим при обмороженні внаслідок низьких температур є
запорукою збереження життя людини.
ВИСНОВКИ ТА РЕКОМЕНДАЦІЇ
В ході роботи проведено
комплексні дослідження, що спрямовані на підвищення збереженості живців
смородини чорної та малини червоної після їх перебування при низьких
температурах. Визначено, що різні способи зберігання: при субнульових
температурах + 4
÷ -5
°С, низьких -15÷-30
°С і наднизьких -196 °С дають значні відмінності в показниках життєздатності
біооб'єкта. Показано, що спосіб зберігання живців при +4 °С протягом одного
року знижує показник їх життєздатності від 100 до 0 %, при -5 °С - від 100 до
50 %, при -15÷-25
°С - від 100 до 60 %, тоді як при -196 °С життєздатність повинна залишатися на
одному рівні.
На підставі пошукових
дослідів встановлено, що зберігання живців смородини чорної та малини червоної
може бути рентабельним при наднизьких температурах (в парах рідкого азоту -
близько -150 °С).
Області допустимих значень
параметрів, які забезпечують максимальну життєздатність досліджених живців:
чорної смородини; малини відповідають вологості 32÷41 %;
35÷40 %
у діапазоні позитивних температур і 34 ÷ 48 %, 23
÷ 38
% за знижених температур.
Вірогідність розвитку деконсервованих
живців смородини чорної та малини значно залежить від їх сортотипа і способу
кріоконсервування. Максимальні показники життєздатності досліджених сортів
деконсервованих живців одержано за допомогою їх температурної адаптації при
температурі -10 °С протягом 14 ÷ 60 діб,
ступінчастого охолодження зразків із швидкістю 0,1 ÷ 0,5
°C/год. до -30 °С, з витримкою 3 ÷ 7 діб,
прямим зануренням в рідкий азот, зберіганням в продовж від 1 до 30 діб і
відігріванням із швидкістю 70 °C/хв.
Порівняно вплив хімічних
стимуляторів росту «Корневин» і «Гетероауксин» на швидкість укорінювання. В
лабораторних умовах найкращі показники при висадці у ґрунт дає «Корневин». При
пророщуванні у воді живців, попередньо оброблених розчином гетероауксину
бруньки на живцях розпускалися швидше в порівнянні з контролем, зокрема
відмічений пришвидшений ріст коренів, хоча їх поява спостерігалась через
однаковий період.
Дані результати можуть бути
використані у науково-дослідних та учбових закладах в сфері сільського
господарства, а також для наукових і виробничих програм.
ПЕРЕЛІК ДЖЕРЕЛ ІНФОРМАЦІЇ
Дадыкин,
В. Смородина на пути к идеалу [текст] / В. Дадыкин // Наука и жизнь. - 2010. -
№10. С. 119 - 125.
Викторов,
А.Г. Невыдуманные риски транс генних растений [текст] / А.Г. Викторов // Химия
и жизнь. - 2009. - №4.
Викторов,
А.Г. Влияние Bt-растений на почвенную биоту и плейотропный эффект δ-эндотоксин-кодирующих
генов [текст] / А.Г. Викторов // Физиология растений. - 2008. - Т.55, №6.
Джефри,
Чарлз. Биологическая номенклатура: Пер. с англ. - М.: Мир, 1980. - с. 17,
26-27.
Титчмарш,
А. Технология садоводства: Пер. с англ. [електронний ресурс] / А. Титчмарш. -
М.: Мир, 1988.
Туманов
И.И., Красавцев О.А. Физиология растений, 1966.
7 Размножение растений: Одревесневшие черенки
[електронний ресурс] // интернет-журнал «Гуманное садоводство». - Режим
доступа: <http://humangarden.ru/bd/mmb/mmb.php?id_glav=36>. -
Последний доступ: март 2011.
Турецкая, Р.Х. Инструкция по применению
стимуляторов роста при вегетативном размножении растений [текст] / Р.Х.
Турецкая. - М.: Издательство Академии наук СССР, 1963. - 69 с.
Вегетативное размножение черенкованием
[електронний ресурс] // интернет-журнал. - Режим доступа: <http://www.picea.ru/vegetativnoe-razmnozhenie.html>.
- Последний доступ: февраль 2011.
Размножение древесных растений стеблевыми
черенками [електронний ресурс] // интернет-журнал. - Режим доступа: <http://www.artsad.ru/>.
- Последний доступ: март 2011.
Замятина, Н. Черенки в банке [електронний
ресурс] / Н. Замятина // Наука и жизнь. - 2003. - №1.
Трейвайс Л. Обойдемся без самолечения // Сад
своими руками. - 2007. - № 6. с. 13
Кандарова И.В. Cб. «Физиология зимостойкости
древесных растений». - М.: «Наука», 1964.
Туманов И.И. //Физиол. раст. - 1967. - 14, вып.
3.
Криобиология и биотехнология / Цуцаева А.А.,
Попов В.Г., Сытник К.М. и др.; Под общ. ред. Цуцаевой А.А. - Киев: Наук. думка,
1987. - 216с.
Sakai A., Otsuka K. Plant physiology. - 1967.
Туманов И.И. Физиология закаливания и
морозостойкость растений. - М.: Наука, 1979. - 350 с.
Siminovitch D., Chater A.B.J. - In: Physiology
of forest trees. Symp. Harvard Forest. - New York: Ronald Press Co..- 1958 -
p.219.
Туманов И.И., Красавцев О.А. Физиология
растений.- 1959. c. 654.
Криоконсервирование клеточных суспензий /
Цуцаева А.А., Аграненко В.А., Федорова Л.И. и др.; Под общ. ред. Цуцаевой А.А.
- Киев: Наук. думка, 1983. - 240 с.
Грищенко В.І., Алєксєєвська Е.І. Кріооновлення,
його роль у збереженні здоров’я та довголіття. Рос.мовою (текст). Київ, Наук.
Думка, 2009, 289с.
Волова, Т.Г. Биотехнология [електронний ресурс]
/ Т.Г. Волова. - Новосибирск: Изд-во Сибирского отделения Российской Академии
наук, 1999. - 252с.
Амстиславский, С.Я. О живой и мертвой воде
[текст] / С.Я. Амстиславский, М.П. Мошкин // Химия и жизнь. - 2009. - №4, с. 35
- 41.
Соловьева М.А. Методы определения зимостойкости
плодово-ягодных культур: Метод. рук-во.- Ленинград: Гидрометеоиздат, 1982.- 35
с.
Горбунов Л.В., Бучацкий Л.П. Криоконсервация
половых клеток и эмбрионов животных: Монография - К.: «Киевский университет», -
2005. - 325 с.
Пат. 47845 Україна, МПК A01F 25/00. Патент.
Спосіб довгострокового збереження живців плодово-ягідних культур / Горбунов
Л.В., Рябчун В.К., Шиянова Т.П., Саліна А.С.; заявник та патентовласник
Інститут рослинництва ім. В.Я. Юр’єва УААН та інститут тваринництва УААН. - №
u2009 09222; заявл. 07.09.2009; опубл. 25.02.2010; Бюл. №4. - 8 с.
Лакин Б.Ф. Биометрия.- М.: Высш. шк., 1990.- 254
с.
Горбунов Л.В., Бугров А.Д., Горбунова Н.І.
Спосіб оцінки ефективності проведення біотехнологічних операцій, які пов’язані
з кріоконсервацією сперматозоїдів та ембріонів ссавців // Вісник
Білоцерківського держ. аграр. ун-ту.- 2000.- Т. 3, №14.- С. 178-183.
Горбунов Л.В., Шиянова Т.П., Рябчун В.К.
Оптимізація умов дегідратації живців плодово-ягідних культур // Генетичні ресурси
рослин.- 2008.- №5.- С. 182-187.
Горбунов, Л.В. Воспроизводимость результатов
криоконсервирования черенков различных сортов семечковых плодових деревьев
[текст] / Л.В. Горбунов // Проблемы криобиологии. - 2009. - Т.19, №4
Закон України «Про охорону праці», листопад 2002
р.
ГОСТ 12.0.003 - 74 ССБТ. Опасные и вредные
производственные факторы. Классификация. - Введ. 01.01.76
ГОСТ 12.1. 005-88 ССБТ. Общие
санитарно-гигиенические требования к воздуху рабочей зоны. - Введ. 01.01.89
Долин П. А. Справочник по технике безопасности.
- Энергоатомиздат, 1984-324с
СНиП 2.04.05-91 Нормы проектирования. Отопление,
вентиляция и кондиционирование воздуха. - М.: Стройиздат, 1991 г.
СНиП II-4-79. Естественное и искусственное
освещение. Нормы проектирования. - М.: Стройиздат, 1980. - 110 с.
Макаров Г. В. И др. Охрана труда в химической
промышленности. М.: - Химия, 1980. - 568 с.
ГОСТ 12.1.003-83* ССБТ. Шум. Общие требования
безопасности. - Введ. 01.01.1989.
17.1.3.03-77. Правила выбора и оценка качества
источников централизованного хозяйственно-питьевого водоснабжения. -
Введ.01.01.78.
Правила устройства электроустановок.
Энергоатомиздат, 1987.
ГОСТ 12.1.004-91 ССБТ. Пожарная безопасность.
Общие требования. - Введ. 01.07.92
НАП Б Б.03-002-2007 . Нормативний акт пожежної
безпеки.Норми ви-значення категорій приміщень, будинків та зовнішніх установок
за вибухопожежною та пожежною набезпекою. Наказ МНС №633 від 03.12.2007.
ДБН В.1.1 - 7 - 2002 Пожежна безпека об’єктів.
ДСТУ Б В.2.5.-38:2008. Інженерне обладнання
будинків і споруд. Улаштування блискавкозахисту будівель і споруд.-К.; Діє з
01.01.2009р.
Розрахунки з питань охорони праці та безпеки
життєдіяльності: Навчальний посібник / За ред. проф. В.В.Березуцького - Харків;
НТУ “ХПІ”, 2004 - 77 с.
Методичні вказівки по техніко-економічному
обґрунтуванню дипломних робіт для студентів спеціальностей ІТ, О денної та
заочної форми навчання. Бішеф Д.Н., Верютіна В.Ю. - Х.: НТУ „ХПІ”, 2010.
„Типові положення по плануванню, обліку та
калькуляції собівартості науково-дослідних та дослідно-конструкторських робіт”.
Постанова КМУ від 20.07.96 № 830.
Закон України "Про цивільну оборону"
від 3 лютого 1993 року N2974-XII
Депутат О.П. и др. Цивільна оборона: Навч.
посібник / О.П. Депутат, І.В. Коваленко, І.С. Мужик; За ред. В.С. Франчука. -
Львів: Афіша, 2000.
Стеблюк М. І. Цивільна оборона. Підручник. 2-е
вид., переробл. і доп., К.: Знання-Прес, 2003г. - 455с.
Кулаков М.А., Ляпун В.О. Цивільна оборона: навч.
посіб. Кулаков М. А., Ляпун В. О., та ін. - Харків: НТУ ―ХПІ,
2005 - 312 с.
Перелік джерел, на які нема посилань у тексті
Методы исследований и организация экспериментов
/ Под ред. К.П. Власова. - Харьков: «Гуманитарный центр», 2002. - 256с.
Горбунов Л.В., Бугров А.Д., Горбунова Н.І.
Спосіб оцінки ефективності проведення біотехнологічних операцій, які пов’язані
з кріоконсервацією сперматозоїдів та ембріонів ссавців // Вісник
Білоцерківського держ. аграр. ун-ту. - 2000. - Т.3, №14. - с. 178-183
Горбунов Л.В. Криоконсервирование черенков
плодово-ягодных культур [текст] / Л.В. Горбунов, Т.П. Шиянова // Проблемы
криобиологии. - 2009. - Т.13, №3. - с.338 - 348.
Вержук В.Г., Филиппенко Г. И., Тихонова Н.Г.,
Жестков А.С. Способы криосохранения генплазмы плодовых культур на примере
смородины, жимолости и крыжовника // Биофизика живой клетки.- 2008.- Т. 9, №1.-
С. 35-36.