Использование ВЭЖХ в анализе антибиотиков
Государственное
Бюджетное Общеобразовательное Учреждение
Высшего
Профессионального Образования
Курский
Государственный Медицинский Университет
Кафедра
фармацевтической, токсикологической и аналитической химии
Курсовая
работа по фармацевтической химии
Тема
работы:
«
Использование ВЭЖХ в анализе антибиотиков»
Выполнила:
студентка 4 курса,
3 группы
фармацевтического
факультета
Дорутова Анастасия
Александровна
Руководитель:
Ст. преподаватель
Кукурека Александр
Владимирович
Курск
2013
Содержание
Введение
Глава
1. Общая характеристика метода ВЭЖХ
.1
Высокоэффективная жидкостная хроматография
.2
Состав жидкостного хроматографа
.3
Насосные системы и инжекторы
.4
Хроматографические колонки
Детекторы
и устройства для сбора данных
Глава
2. Антибиотики и их классификация
.1
Антибиотики
.2
Классификация антибиотиков
Глава
3. Применение высокоэффективной жидкостной хроматографии в анализе антибиотиков
.1
Применение ВЖЭХ в анализе антибиотиков группы цефалоспоринов и гликопептидов
.2
Применение ВЭЖХ в анализе антибиотиков группы хинолонов и фторхинолонов
.3
Применение ВЭЖХ в анализе противоопухолевых антибиотиков
.4
Применение ВЭЖХ в анализе антибиотиков группы пенициллина
.5
Использование ВЭЖХ в анализе антибиотиков группы гликопептидов и рифамицинов
.6
Анализ препарата Рулид и Азитромицина с помощью ВЭЖХ
.7
Определение концентрации антибактериальных глазных капель
Заключение
Список
литературы
Введение
В настоящее время ВЭЖХ занимает ведущие позиции
среди других методов хроматографии. Современная высокоэффективная жидкостная
хроматография реализована в различных вариантах: обращенно фазовая,
нормально
фазовая,
нормально  фазовая,
эксклюзионная, экстракционная, ионообменная и другие, что позволяют разделять различные
смеси лекарственных средств. ВЭЖХ является одним из наиболее важных методов
исследования антибиотиков. К тому же бурное развитие жидкостной хроматографии
обусловлено, главным образом, интенсивной разработкой теоретических основ и
практическим использованием ее высокоэффективного варианта, а также созданием и
промышленным выпуском необходимых сорбентов и аппаратуры.
фазовая,
эксклюзионная, экстракционная, ионообменная и другие, что позволяют разделять различные
смеси лекарственных средств. ВЭЖХ является одним из наиболее важных методов
исследования антибиотиков. К тому же бурное развитие жидкостной хроматографии
обусловлено, главным образом, интенсивной разработкой теоретических основ и
практическим использованием ее высокоэффективного варианта, а также созданием и
промышленным выпуском необходимых сорбентов и аппаратуры.
Сегодня ВЭЖХ представляет собой хорошо
оформленный инструментальный метод, который широко применяют в самых различных
областях науки и техники. Особенно велико его значение в таких важнейших
областях, как биохимия, молекулярная биология, контроль загрязнений окружающей
среды, а также в химической, нефтехимической, пищевой и фармацевтической
промышленности.
Цель: изучить применение высокоэффективной
жидкостной хроматографии в анализе антибиотиков.
Глава 1. Общая характеристика метода ВЭЖХ
.1 Высокоэффективная жидкостная хроматография
Высокоэффективная жидкостная хроматография или
жидкостная хроматография высокого давления является одним из вариантов
колоночной жидкостной хроматографии[4]. Высокоэффективная жидкостная
хроматография - метод разделения с использованием твердой неподвижной фазы и
жидкой подвижной фазы. Разделение достигается за счет распределения, адсорбции
или ионообменного процесса, в зависимости от используемого типа подвижной фазы.
Высокоэффективная жидкостная хроматография имеет определенные преимущества
перед газовой хроматографией. Анализируемые соединения растворяются в
подходящем растворителе, и большинство разделений происходит при комнатной
температуре. Таким образом, большинство нелетучих или термически нестабильных
соединений, могут хроматографироваться без разложения или без необходимости
получения летучих производных[26].
.2 Состав
жидкостного хроматографа
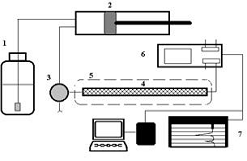
Рис.1 Блок-схема жидкостного хроматографа: 1 -
резервуар для подвижной фазы; 2 - насос; 3 - инжектор; 4 - колонка; 5 -
термостат; 6 - детектор; 7 - регистрирующая система.
Жидкостный хроматограф состоит из резервуара, содержащего
подвижную фазу, насоса для пропускания подвижной фазы через систему под высоким
давлением, инжектора для введения образца в подвижную фазу, хроматографические
колонки, детектора и устройства для сбора данных (например, компьютера,
интегратора или самописца). Кроме того дополнительно могут использовать
компьютеры для контроля хроматографических настроек и операций, обеспечивая тем
самым длительные периоды автоматической работы[6].
.3 Насосные системы и инжекторы
антибиотик жидкостная хроматография
рулид
Насосные системы высокоэффективной жидкостной
хроматографии используют для дозированной подачи подвижной фазы из резервуаров
с растворителем в колонку через трубки и соединения с высоким давлением.
Рабочее давления составляют обычно до 1500 psi (350 кг/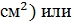 выше,
скорость до 10 мл/мин. Насосы, используемые для количественного анализа, должны
быть изготовлены из материалов, устойчивых к компонентам подвижной фазы, и
обладать способностью подачи подвижной фазы с постоянной скоростью и
минимальным отклонениями в течение длительного периода времени.
выше,
скорость до 10 мл/мин. Насосы, используемые для количественного анализа, должны
быть изготовлены из материалов, устойчивых к компонентам подвижной фазы, и
обладать способностью подачи подвижной фазы с постоянной скоростью и
минимальным отклонениями в течение длительного периода времени.
После растворения в подвижной фазе
хроматографируемые соединения вводят в подвижную фазу, вручную шприцем или
петлевым дозатором, или автоматически при помощи автодозатора. Автодозатор
состоит из штатива для помещения образцов, верхние части которых имеют
прокалываемую прокладку или пробку и устройства ввода для переноса образца из
флаконов в петлю, откуда образец загружается в хроматограф. Для некоторых
автодозаторов можно программировать контроль объема образца, число введений и
циклов промывания петли, интервал между введениями и прочие рабочие параметры.
Шприц может использоваться для введения образцов
вручную через прокладку, если давление на входе колонки менее 70 атм( около
1000 psi). При более высоких давлениях необходим пробоотборный клапан.
Некоторые клапанные системы включают калиброванную петлю, заполняемую
испытуемым раствором для переноса на колонку в подвижной фазе. В других
системах, испытуемый раствор переносится шприцем в полость, а затем
перенаправляется в подвижную фазу[26].
.4 Хроматографические колонки
Хроматографические колонки представляют собой
снабженные торцевыми соединениями трубки, заполненные тонкозернистыми
упаковочным материалом (насадкой). Большинство колонок изготавливают из
нержавеющей стали марки 316- стального сплава, который соответствует стандарту
США. Этот сплав обладает отличительной устойчивостью к коррозии. Все
металлические детали хроматографической системы, контактирующие с жидкостью,
должны быть сделаны из этого сплава. Качество обработки внутренних стенок
должна отвечать определенным требованиям. Например, степень шероховатости
стенок должна быть меньше одной десятой среднего размера частиц материала,
заполняющего колонку (шероховатость должна быть меньше 0,5 мкм, если колонка
заполнена носителем с размером частиц 5мкм). Чтобы уменьшить шероховатость
трубок, их футеруют стеклом или полимерами. В последнее время используют
стеклянные трубки, которые имеют очень высокое качество поверхности трубок.
Некоторые фирмы (Waters) используют для изготовления радиально сжимаемых
колонок полиэтиленовые трубки. Эти колонки помещают в рубашку, в которой на них
подается внешнее давление, что вызывает радиальное сжатие колонок, улучшающее
их разрешающую способность и повышающее стабильность[2]. В зависимости от
области применения используют колонки с различными диаметрами внутренних
стенок, например для аналитического разделения используют колонки с внутренним
диаметром от 2 до 5 мм, а колонки большого диаметра используются для
препаративной хроматографии.
В фармацевтическом анализе разделение
достигается распределением соединений испытуемого раствора между подвижной и
неподвижной фазами.В зависимости от полярности неподвижной и подвижной фаз
различают нормальнофазовую и обращенно-фазовую хроматографию. В
нормальнофазовой хроматографии используют полярный адсорбент и неполярные
подвижные фазы, в обращенно-фазовой - неполярный адсорбент и полярные подвижные
фазы[16]. Распределительная хроматография почти всегда используется для
растворимых углеводородных соединений с молекулярной массой менее 1000.
Сродство соединений к неподвижной фазе и его время удерживания на колонке
контролируется изменением полярности фаз. Полярность подвижной фазы может
изменяться добавлением второго, а иногда и третьего компонента.
Неподвижные фазы для современной
обращенно-фазовой жидкостный хроматографии обычно состоит из органической фазы,
химически связанной с кремнеземом или иным материалом. Частицы обычно имеют
диаметр от 3 до 10 мкм, но размер может изменяться до 50 мкм или более для
препаративных колонок. Небольшие частицы, покрытые тонким слоем органической
фазы, обеспечивают малое сопротивление массопереносу, а следовательно, быстрому
переносу соединений между неподвижной и подвижной фазами. Полярность колонки
зависит от полярности функциональных групп. Жидкие, не связанные неподвижные
фазы не должны смешиваться с подвижной фазой. Тем не менее обычно необходимо
предварительно насытить подвижную фазу неподвижной фазой для предотвращения
выдавливания неподвижной фазы из колонки. Полимерные стационарные фазы,
покрывающие носитель, более износостойкие.
Ионообменная хроматография используется для
разделения водорастворимых ионизируемых соединений с молекулярной массой менее
1500. Неподвижные фазы - это обычно синтетические смолы. Катионобменные смолы
содержат отрицательно заряженные активные участки и используются для разделения
основных веществ, таких как амины, в то время как анионообменные смолы имеют
положительно заряженные активные участки для разделения соединений с
отрицательно заряженными группами, такими как фосфат, сульфонат или
карбоксильная группа. Водорастворимые ионные или ионизируемые соединения
притягиваются смолами, а разница в сродстве обуславливает хроматографическое
разделение. Значение рH подвижной фазы, температура, тип иона, ионная
концентрация и органические модификаторы влияют на равновесие. Для получения
желаемой степени разделения данные параметры можно корректировать.
В эсклюзионной хроматографии колонки набиваются
пористой неподвижной фазой. Молекулы хроматографируемых соединений фильтруются
в соответствии с размером. Молекулы, которые слишком большие для проникновения
в поры, проходят через колонку без задержки. Меньшие молекулы попадают в поры и
удерживаются тем дольше, чем меньше размер молекул. Эти колонки обычно
используют для измерения агрегации и разложения больших молекул.
.5 Детекторы и устройства для сбора данных
Многие фармакопейные методики высокоэффективной
жидкостной хроматографии требуют использования спектрофотометрических
детекторов. Такой детектор состоит из проточной кюветы, закрепленной на конце
колонки. Пучок ультрафиолетового света проходит через кювету и попадает на
детектор. По мере элюирования соединений из колонки они проходят через кювету и
поглощают излучение, приводя к измеряемому изменению уровню энергии.
Широко доступны детекторы с фиксированной,
переменной и множественной длиной волны. Детекторы с фиксированной длиной волны
работают при одиночной длине волны, обычно 254 нм, испускаемой ртутной лампой
низкого давления. Детекторы с переменной длиной волны содержат непрерывный
источник, такой как дейтериевая или ксеноновая лампа высокого давления, и
монохроматор или интерференционный фильтр для получения монохроматического излучения
с длиной волны, выбранной оператором. Точность длины волны детектора с
переменной длиной волны, оснащенного монохроматором, необходимо проверять по
рекомендованной производителем методике. Если наблюдаемые длины волн отличаются
более чем на 3 нм от истинных значений, необходима перекалибровка прибора.
Современные детекторы с переменной длиной волны могут программироваться на
изменение длины волны по ходу анализа. Детекторы с множественными длинами волн
измеряют поглощение при двух или более длинах волн одновременно. В детекторах
на диодной матрице непрерывное излучение пропускается через кювету с образцом,
затем разрешается на составные длины волн, которые индивидуально детектируются
фотодиодной матрицей. Эти детекторы получают данные на всем интервале УФ и
видимого света, обеспечивая, таким образом, аналитика хроматограммами при
множественных выбираемых длинах волн и спектрами элюируемых пиков. Детекторы на
диодной матрице обычно имеют меньшее отношение сигнал/ шум, чем детекторы с
фиксированной или переменной длиной волны, а следовательно, менее пригодны для
анализа соединений, присутствующих в низких концентрациях.
Дифференциальные рефрактометрические детекторы
измеряют разность между показателем преломления чистой подвижной фазы и
показателем преломления подвижной фазы, содержащей хроматографируемые
соединения, по мере ее выхода из колонки. Рефрактометрические детекторы
используют для детекции соединений, не поглощающих в УФ - области, но они мене
чувствительны, чем УФ - детекторы. Они чувствительны к малым изменениям в
составе растворителя, скорости потока и температуре, поэтому для получения
удовлетворительной базовой линии может понадобиться колонка сравнения.
Флуориметрические детекторы чувствительны к
соединениям, которые по своей природе флуоресцируют или могут быть превращены
во флуоресцирующие производные либо химической трансформацией вещества, либо
соединением с флуоресцентными реактивами по специфическим функциональным
группам. Если необходима дериватизация, то ее можно провести непосредственно
перед хроматографическим разделением или реактив можно ввести в подвижную фазу
непосредственно перед его попаданием в детектор.
Потенциометрический вольтаметрический или
полярографический электрохимические электроды используют для количественного
определения веществ, которые могут окисляться или восстанавливаться на рабочем
электроде. Эти детекторы селективны, чувствительны и надежны, но необходимо
применение подвижной фазы, не содержащей растворенного кислорода и
восстанавливаемых ионов металлов. Должен использоваться непульсирующий насос и
необходимо следить за обеспечением постоянства значения рH, ионной силы и
температуры подвижной фазы. Рабочие электроды чувствительны к загрязнению
продуктами реакции с соответственно изменяющимся откликом.
Электрохимические детекторы с угольными
пастовыми электродами могут успешно применяться для измерения нанограммовых
количеств легко окисляемых соединений, в особенности фенолов и кетонов.
Продолжают разрабатываться новые детекторы для
преодоления недостатков используемых детекторов.
Современные станции обработки данных получают и
сохраняют сигнал детектора и распечатывают хроматограммы вместе с площадями,
высотами пиков, идентификацией образцов и параметрами хроматографирования.
Станции обработки данных используют также для программирования жидкостного
хроматографа, контролируя большинство рабочих параметров и обеспечивая
длительные периоды автоматической работы.
Данные также могут собираться на простых
самописцах для ручного измерения или на независимых интеграторах, возможности
которых колеблются от обеспечения распечатки площадей пиков до предоставления
хроматограмм с рассчитанными площадями и высотами пиков и сохраненными данными
для возможного перерасчета[26].
Глава 2 . Антибиотики и их классификация
.1 Антибиотики и их классификация
Антибиотические вещества в процессе развития их
продуцентов могут выделяться и накапливаться в окружающей организм среде, они
могут образовываться в виде летучих продуктов или накапливаться внутри клеток
организма и освобождаться от них в результате экстракции или при разрушении
клеток. В соответствии с определением понятия « антибиотик » к этим веществам
относятся также химические или биологические модификации молекул природных
соединений антибиотиков путем замены в них тех или иных свободных группировок.
В результате химической модификации молекул пенициллина, цефалоспорина,
тетрациклина и некоторых других продуктов жизнедеятельности микроорганизмов,
образующихся в процессе биосинтеза, получены новые соединения с более ценными
свойствами.
Выражение величин биологической активности
антибиотиков производят в условных единицах, содержащихся в 1 мл раствора
(ед/мл) или в 1 г препарата (ед/мг)[7].
.2 Классификация антибиотиков
Пенициллины (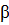 -лактамные
антибиотики)
-лактамные
антибиотики)
а) природные пенициллины: бензилпенициллин и его
соли, феноксиметил-пенициллин;
б) полусинтетические пенициллины:
пенициллиназоустойчивые с преимущественной
активностью в отношении стафилококков: оксациллин, клоксациллин,
флуклоксациллин;
широкого спектра действия (аминопенициллины):
ампициллин, амокси-циллин, пивампициллин;
широкого спектра действия, особенно
высокоактивные в отношении си-негнойной палочки и других грамотрицателъных
бактерий (карбокси - и уреи-допенициллины): карбенициллин, тикаришин,
азлоциллин, мезлоциллин, пиперациллин;
Цефалоспорины (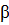 -лактамные
антибиотики)
-лактамные
антибиотики)
а) первое поколение: цефалоридин, цефазолин,
цефалексин и др.;
б) второе поколение: цефамандол, цефуроксим,
цефаклор и др.;
в) третье поколение: цефотаксим, цефтазидим,
цефтриаксон и др.;
г) четвертое поколение: цефпиром, цефепим и
другие[25];
Монобактамы (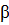 -лактамные
антибиотики): азтреонам;
-лактамные
антибиотики): азтреонам;
Карбапенемы (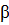 -лактамные
антибиотики): имипенем, меронем, тиенам;
-лактамные
антибиотики): имипенем, меронем, тиенам;
Макролиды:
а) природные - джозамицин, мидекамицин,
олеандомицин, эритромицин;
б)полусинтетические - азитромицин, диритромицин, кларитромицин, рокситромицин,
спирамицин;
Аминогликозиды:
а) первое поколение: стрептомицин, мономицин,
канамицин;
б) второе поколение: гентамицин, нетилмицин,
тобрамицин;
в) третье поколение: тобрамицин, сизомицин,
амикацин;
г) четвертое поколение: левомицетин;
Тетрациклины:
а) естественные: тетрациклин, окситетрациклин,
хлортетрациклин;
б) полусинтетические: метациклин, доксициклин,
миноциклин, морфоцик-лин;
Рифамицины: рифоцин, рифамид, рифампицин;
Гликопептидные антибиотики: ванкомицин,
тейкопланин;
Хинолоны: налидиксовая кислота, оксолиновая
кислота;
Фторхинолоны :
а) препараты первого - пефлоксацин
<#"704755.files/image006.gif"> и
 .
.
Аппаратура
Хроматограммы регистрировали на жидкостном
хроматографе «Стайер» фирмы «Аквилон» с флуориметрическим детектором.
Антибиотики разделяли на ОФ колонке Phenomenex Luna 5u C18(150×4.60
мм,
5мкм), снабженной предколонкой с защитным картриджем Phenomenex C18, 5мкм при
температуре 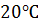 в изократическом
режиме. Для записи и обработки хроматограмм использовали программу
«Мультихром-2.4». Детектирующее устройство: источник возбуждения- кварцевая
галогеновая лампа с дихроическим рефлектором, фотоэлектронный умножитель,
диапазон длин волн 200-600 нм.
в изократическом
режиме. Для записи и обработки хроматограмм использовали программу
«Мультихром-2.4». Детектирующее устройство: источник возбуждения- кварцевая
галогеновая лампа с дихроическим рефлектором, фотоэлектронный умножитель,
диапазон длин волн 200-600 нм.
При изучение влияния природы и концентрации ПАВ,
а также циклодекстринов на разделение и чувствительность определения флюмеквина
и ципрофлоксацина в смеси с другими антибиотиками выяснили, что среди
исследованных ПАВ различных классов наилучшее разделение и определение
флюмеквина и ципрофлоксацина достигается в подвижной фазе, содержащей
неионогенный ПАВ Тритон Х-100, который способствует увеличению площади
хроматографического пика фторхинолонов в 1,9 раз, а образование комплексов
включения фторхинолонов с γ-циклодекстрином
увеличивает площадь хроматографического пика флюмеквина и ципрофлоксацина в 2,3
и1,5 раза и пределы обнаружения уменьшает в 4,2 и 9 раз, соответственно[23].
Показано, что при анализе спарфлоксацина и
моксифлоксацина методом ВЭЖХ, добавление в подвижную фазу ион парного
реагента существенно повышает эффективность колонки и симметричность пиков
анализируемых соединений. Установлено, что в условиях обращенно
парного
реагента существенно повышает эффективность колонки и симметричность пиков
анализируемых соединений. Установлено, что в условиях обращенно фазовой
ВЭЖХ оптимальные значения хроматографических параметров наблюдаются в подвижной
фазе ацетонитрил
фазовой
ВЭЖХ оптимальные значения хроматографических параметров наблюдаются в подвижной
фазе ацетонитрил 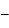 вода при
температуре колонки 40
вода при
температуре колонки 40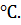 Разработанные
методики могут быть использованы при анализе субстанций и лекарственных
препаратов спарфлоксацина и моксифлоксацина по разделам нормативной
документации « подлинность» и « количественное определение»[14].
Разработанные
методики могут быть использованы при анализе субстанций и лекарственных
препаратов спарфлоксацина и моксифлоксацина по разделам нормативной
документации « подлинность» и « количественное определение»[14].
3.3 Применение ВЭЖХ в анализе противоопухолевых
антибиотиков
Доксорубицин - антибиотик широкого спектра
действия. Он является антибиотиком антрациклинового ряда и обладает
противоопухолевым действием.
Согласно ВФС 42-1796-88, содержание
доксорубицина определяют микробиологическим методом диффузии в агар с использованием
тест-культуры Bac.cereus var. mycoides 537 (споры), который отличается большой
трудоемкостью, длительностью и неспецифичностью. Из-за недостатков
микробилогического метода, доксорубицин определяли с помощью высокоэффективной
жидкостной хроматографии.
Во время экспериментальной части, принимали во
внимание результаты исследования хроматографической активности доксорубицина в
тонких слоях нормальнофазного (пластины "Silufol UV-254") и обращеннофазного
(пластины "Silufol UV-254", обработанные вазелиновым маслом)
сорбентов с применением подвижных фаз различной полярности, в качестве
неподвижной фазы использовали обращеннофазный сорбент "Новопак
Т-18", а в качестве элюента - систему растворителей изопропанол-ацетатный
буфер (рН=4,5) в соотношении 3:7 (по объему). Определения проводили на
хроматографе "Water Alian" (USA) с детектором фотодиодной матрицы на
колонке размером 150x3,9 мм. Скорость подачи элюента составляла 0,7 мл/мин при
температуре колонки 37°С.
На основании результатов методик определения
получили, что разработанный вариант определений доксорубицина по методу ВЭЖХ, в
отличие от фармакопейной (микробиологический метод диффузии в агар),
характеризуется более высокой чувствительностью, селективностью и
воспроизводимостью. Относительная ошибка среднего результата (n=5;P=0,95) при
определении исследуемого вещества в субстанции и лекарственных формах по
предлагаемой методике в 2-2,5 раза ниже, чем при использовании фармакопейной
методики. Разработанная методика упрощает процесс анализа, сокращая в 35 раз
его продолжительность (с 18 ч до 30 мин) и позволяет проводить определение
Доксорубицина в присутствии других компонентов лекарственных форм[3]
Также высокоэффективную жидкостную хроматографию
использовали для определения противоопухолевого препарата митомицина С (ММС) в
образцах ткани мочевого пузыря методом обращенно-фазовой высокоэффективной
жидкостной хроматографии со спектрофотометрическим (365 нм) и
масс-спектрометрическим детектированием с пределами обнаружения (отношение
сигнал/шум = 3) 50 и 10 нг/мл соответственно. Образцы ткани гомогенизировали и
проводили процедуру твердофазной экстракции на патроне DSC-18. Методика
применена для сравнения эффективности проникновения ММС в ткань мочевого пузыря
за счет пассивной диффузии и внутриполостного лекарственного электрофореза.
Внутриполостной лекарственный электрофорез повышает степень проникновения
митомицина в стенки мочевого пузыря в 3-5 раз по сравнению с пассивной
диффузией[17].
.4 Применение ВЭЖХ в анализе антибиотиков группы
пенициллина
Бициллин-3 является пенициллином
пролонгированного действия и представляет собой смесь натриевой, новокаиновой и
бензатиновой солей бензилпенициллина. По действующей ВФС 42-3034-98
определение бензилпенициллина в препарате проводят с помощью высокоэффективной
жидкостной хроматографии, новокаин определяют спектрофотометрически, а бензатин
экстрагируют эфиром из водного раствора, насыщенного хлоридом натрия. После
выпаривания эфира бензатин определяют титрованием хлорной кислотой. В
Европейской Фармакопее содержание бензилпенициллина и бензатина в бензатиновой
соли бензилпенициллина определяют с помощью градиентной высокоэффективной
жидкостной хроматографии в смеси метанола с раствором фосфата натрия при рН
3,5.
Характеристика антибиотика
Использовали бициллин-3 производства АКО
"Синтез" (Курган).
Аппаратура
Исследование проводили на хроматографе фирмы
"Waters" (США) с насосом модели 510, УФ-детектором модели 481 и инжектором
модели 7125 (Rheodyne) с дозирующей петлей вместимостью 50 мкл. Для
детектирования использовали длину волны 214 нм, при которой хорошо
детектируются все анализируемые соединения. Регистрацию хроматограмм и расчет
площадей пиков и основных параметров удерживания проводили с помощью
персонального компьютера с аналого-цифровым преобразователем и программой
"Мультихром".
Был изучен обращенно-фазный вариант метода ВЭЖХ
на колонке "Luna С18(2)" размером 250 х 4,6 мм фирмы
"Phenomenex" (США), поскольку колонка зарекомендовала себя ранее как
относительно дешевая с улучшенной симметрией выхода пиков органических аминов.
С этой же целью в качестве подвижной фазы использовали смесь ацетонитрила с
буферным раствором, содержащим в качестве одного из компонентов триэтиламин,
имеющим рН= 5,0[18].
Также с помощью высокоэффективной жидкостной
хроматографии был изложен комплексный подход к конструированию
высокоэффективной технологии получения полусинтетических  антибиотиков,
включающей не только стадию ферментативного синтеза, но и стадии разделения
компонентов реакционной смеси.
антибиотиков,
включающей не только стадию ферментативного синтеза, но и стадии разделения
компонентов реакционной смеси.
Характеристика антибиотиков
В работе использовали образцы антибиотиков -
ампициллина, амоксициллина, цефалексина, цефадроксила и цефаклора, ацилирующие
агенты - метиловый эфир Д- фенилглицина и метиловый эфир п - гидрокси - Д-
фенилглицина.
В качестве биокатализатора использовали
иммобилизованную аминоцефалоспоринсинтетазу их Xanthomonas rubrilineans, штамм
ВКМ-629[24], полученную так, как это описано в работе[11,12].
Аппаратура
Применяли хроматограф фирмы « Waters Associates
Inc.» (США) с УФ- детектором с переменной длинной волны и колонкой из
нержавеющей стали, заполненной носителем « Sylasorb C18» с размером частиц 4,5
мкм. Скорость подачи подвижной фазы 1 мл/мин.
В качестве подвижной фазы использовали смеси
метанола с фосфатно-аммиачным буфером 0,05М, pH 2,05 в различных
соотношениях[13].
.5 Использование ВЭЖХ в анализе антибиотиков
группы гликопептидов и рифамицинов
С помощью высокоэффективной жидкостной
хроматографии проводили качественный и количественный анализ ряда
антибиотиков-гликопептидов и грамицидина S на отечественном жидкостном
микроколоночном хроматографе Милихром А-02. Кроме того можно также проводить
химическую идентификацию антибиотиков в неочищенных образцах, что важно для
лабораторий, ведущих скрининг природных или полусинтетических антибиотиков[30].
При изучения условия десорбции антибиотиков
группы гликопептидов, такие как: эремомицин, ванкомицин, ристомицин А и
тейкопланин А2 определили, что они могут быть элюированы с ультрадисперсного
углеродного сорбента при использовании органических растворителей (ТГФ, т-БС,
ИП, ДМСО) в смеси с 0,5 М уксусной кислотой. Оптимальный растворитель и его
концентрацию, обеспечивающую наиболее эффективную элюцию, подбирали
индивидуально для каждого антибиотика. Показано, что для ристомицина А,
ванкомицина и эремомицина наиболее эффективна элюирующая смесь, содержащая
т-БС, а для тейкопланина А2 - TГФ. После десорбции физико-химические
(молекулярная масса, УФ спектры, время удерживания при ВЭЖХ) и антимикробные
свойства антибиотиков оставались неизменными[10].
При изучении антибиотиков группы рифамицины были
получены продукты деструкции и окисления рифампицина, которые охарактеризованы
методом ВЭЖХ и идентифицированы методом масс-спектрометрии. Изучена
стабильность рифампицина в водной фазе и в составе липосом при 4 и 25 °C.
Показано, что при хранении основным продуктом деструкции в липосомах является
3-формилрифамицин SV. Установлено, что антибактериальная активность антибиотика
в составе липосом не отличается от его активности в водной фазе и не изменяется
при хранении[22].
.6 Анализ препарата Рулид и Азитромицина с
помощью ВЭЖХ
Для анализа двух препаратов были разработаны
методики определения:
разрабатывали методику определения антибиотика
Рокситромицина в сыворотке крови методов ВЭЖХ с масс-спектрометрическим
детектированием с использованием Кларитромицина в качестве внутреннего
стандарта. Методику использовали для исследования фармакокинетики
лекарственного препарата “Рулид”. Рокситромицин и Кларитромицин из образцов
сыворотки извлекали методом твердофазной экстракции на патроне с полярным
сорбентом - цианопропилсилилсиликагелем. Абсолютная степень извлечения
составила 89.6 и 92.5%, соответственно. Хроматографическое разделение проводили
на колонке Nucleodur C18 Isis с подвижной фазой вода-метанол-
ацетонитрил-муравьиная кислота (499 : 250 : 250 : 1 по объему). Регистрировали
в режиме мониторинга отдельных ионов с m/z 837.7 Рокситромицина и m/z 748.7
Кларитромицина соответственно[19].
разрабатывали метод количественного определения
азитромицина ВЭЖХ с масс-спектрометрическим детектированием. Предел обнаружения
препарата составляет 0,5 нг/мл. Метод был применен для изучения фармакокинетики
и биоэквивалентности препарата Азитромицин (капсулы по 250 мг отечественного
производства) в сравнении с препаратом Сумамед® (аналогичная лекарственная
форма производства компании "Плива", Хорватия). Фармакокинетическое
исследование проводилось открытым перекрестным рандомизированным методом. В
исследование были включены 18 добровольцев. Были рассчитаны фармакокинетические
параметры, необходимые для оценки биоэквивалентности изучаемого препарата.
Статистический анализ параметров фармакокинетики показал биоэквивалентность
препаратов Азитромицин и Сумамед[20].
.7 Определение концентрации антибактериальных
глазных капель
С помощью метода ВЭЖХ-МС/МС определяли
концентрацию антибактериальных глазных капель Сигницеф, Офтаквикс и Вигамокс в
содержимом влаги передней камеры глаза (ВПКГ). В исследование включены 90
пациентов, которые были распределены на три группы по 30 человек. Пациентам
первой группы закапывали 0,5% раствор моксифлоксацина (Вигамокс), пациентам
второй и третьей группы 0,5% раствор левофлоксацина, соответственно, Офтаквикс
и Сигницеф. Пациентам всех трех групп антибактериальные капли закапывали за
один час до начала факоэмульсификации, четырехкратно по 1 капле с интервалом 15
минут. В результате, средняя концентрация глазных капель Офтаквикс и Вигамокс
во ВПКГ была одинаковой и составляла, соответственно, 一
0,9 мкг/мл и 1,0 мкг/мл. В группе пациентов, которым в качестве профилактики
послеоперационных осложнений назначали Сигницеф, средняя концентрация препарата
равнялась -1,5 мкг/мл. Средняя концентрация всех исследуемых препаратов,
которые принадлежат к фторхинолонам III-IV поколения, была в несколько раз
выше, чем средняя МПК90 для выделенных от пациентов штаммов, что должно
способствовать безопасному течению послеоперационного периода и профилактике
инфекционных осложнений[21].
Заключение
Метод ВЭЖХ имеет широкую область применения. С
помощью него проводят качественный и количественный анализ антибиотиков
различных групп, разрабатывают новые методики определения. Кроме того методом
высокоэффективной жидкостной хроматографии был изложен комплексный подход к
конструированию высокоэффективной технологии получения полусинтетических 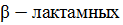 антибиотиков,
а также проводили анализы с полученными продуктами декструкции и окисления
антибиотиков.
антибиотиков,
а также проводили анализы с полученными продуктами декструкции и окисления
антибиотиков.
Высокоэффективная жидкостная хроматография кроме
медицины используется и в пищевой промышленности, там определяют остаточное
количество антибиотиков, например тетрациклина и левомицетина в сыром и
пастеризованном молоке.
Список литературы
Антибактериальные
лекарственные средства. Методы стандартизации препаратов. М.:
ОАО « Издательство Медицина», 2004.
М.:
ОАО « Издательство Медицина», 2004. 944с.
944с.
Высокоэффективная
жидкостная хроматография в анализе доксорубицина / В. К. Шарманов, Е.Н.
Карпенко, Л.Е. Сипливая и др. // Журнал Фармация. 2004.
2004. №3.
№3. С.8
С.8 10.
10.
Государственная
Фармакопея СССР: Вып. 1. Общие методы анализа / МЗ СССР. - 11-е изд., доп. М.: Медицина, 1987.
М.: Медицина, 1987. 336с.
336с.
ГОСТ4214-78.
Реактивы. Кислота кремневая водная. Технические условия.
Грушка,
Э. Количественный анализ хроматографическими методами. / Грушка Э., Йенсен Э.,
Хатиб С., Левин С. и др.; Под ред. Кэц: Пер. с англ. М.: Мир, 1990.
М.: Мир, 1990. 320с.
320с.
Егоров,
Н.С. Основные учения об антибиотиках: Учеб. для студентов биолог. спец. ун-тов.
 4-е
изд., перераб. и доп.
4-е
изд., перераб. и доп. М.: Высш. шк., 1986
М.: Высш. шк., 1986 448с.
448с.
Земнухова,
Л.А., Федорищева, Г.А., Егоров, А.Г., Сергиенко, В.И. // Журнал прикладной
химии. 2005.
2005. Т. 78, № 2.
Т. 78, № 2. С. 324 - 328.
С. 324 - 328.
Земнухова,
Л.А., Егоров, А.Г., Федорищева, Г.А., Баринов, Н.Н., Сокольницкая, Т.А., Боцул,
А.И. // Неорганические материалы. 2006.
2006.  Т.
42, №1.
Т.
42, №1.  С.
27 - 32.
С.
27 - 32.
Изучение
сорбции антибиотиков - гликопептидов на ультрадисперсном углеродном сорбенте
/А. В. Тимофеева, В.Н. Буравцев
и др. // Журнал Биотехнология. 2010.
2010. №
2.
№
2. С.
70
С.
70 80.
80.
Курочкина
В. Б., Ныс П. С., Антибиотики и химиотерапия, 44(5), 12 - 16 (1999).
Курочкина
В. Б. , Ныс П. С. , Антибиотики и химиотерапия, 44(8), 6 -11 (1999).
Курочкина,
В. Б. Ферментативный синтез аминобеталактамов. Физико- химические основы
процессов разделения компонентов реакционных смесей / В. Б. Курочкина, П. С.
Ныс // Химико- фармацевтический журнал. 2003.
2003. Т.
35, № 12.
Т.
35, № 12. С.30
С.30 37.
37.
Коновалов,
А.А. ,Дорофеев, В.Л., Арзамасцев, А. П. / Фармацевтический анализ лекарственных
средств группы фторхинолонов с использованием метода ВЭЖХ // Вестник. Серия:
Химия. Биология. Фармация. 2004.
2004. №2.
№2. С.216-221.
С.216-221.
Машкова,
С.А., Разов, В.И., Тонких, И.В., Жамская, Н.Н. и др. // Химия и химическая
технология.  2005.
2005.  Т.
48, Вып. 6.
Т.
48, Вып. 6. С. 149-152.
С. 149-152.
Основы
аналитической химии. В 2 т. Т. 1: учеб. Для студ. Учреждений высш. Проф.
Образования / Т.А. Большова, Г.Д. Брыкина, С.Г. Дмитриенко и др.; Под ред. Ю.
А. Золотова. 5-е изд., стер.-
М.: Издательский центр « Академия», 2012.
5-е изд., стер.-
М.: Издательский центр « Академия», 2012. 384с.
384с.
Определение
митомицина С в тканях мочевого пузыря методом обращенно фазовой
высокоэффективной жидкостной хроматографии /
фазовой
высокоэффективной жидкостной хроматографии /
А. А. Сидорова
<#"704755.files/image001.gif"> 2010. Т. 65, № 8.
Т. 65, № 8. С. 856
С. 856 860.
860.
Определение
компонентов препарата « Бициллин  3» методом высокоэффективной
жидкостной хроматографией / М. А. Казьмин, А. В. Михалев, А. П. Арзамасцев //
Журнал Фармация.
3» методом высокоэффективной
жидкостной хроматографией / М. А. Казьмин, А. В. Михалев, А. П. Арзамасцев //
Журнал Фармация. 2002.
2002. №3.
№3. С.9
С.9 11.
11.
Определение
рокситромицина в сыворотке крови методом жидкостной хроматографии с масс  спектрометрическим
детектированием / И. В. Семак, А. Н. Алексеев и др. // Журнал аналитической
химии.
спектрометрическим
детектированием / И. В. Семак, А. Н. Алексеев и др. // Журнал аналитической
химии. 2011.
2011. Т. 66, № 2.
Т. 66, № 2. С. 199
С. 199 205.
205.
Определение
азитромицина в плазме крови методом ВЭЖХ с масс  спектрометрическим детектированием
/ В. В. Писарев, Л. Б. Смирнова, Н. Е. Москалева и др. // Журнал
Клин.фармакокинетика.
спектрометрическим детектированием
/ В. В. Писарев, Л. Б. Смирнова, Н. Е. Москалева и др. // Журнал
Клин.фармакокинетика. 2004.
2004. №1.
№1. С. 23
С. 23 26.
26.
Определение
концентрации глазных капель левофлоксацина и моксифлоксацина в содержимом влаги
передней камеры глаза методом ВЭЖХ  МС / И. Н. Околов, Ю. В. Тахтаев, А.
И. Мяжитова и др. // Журнал Катарактальная и рефракционная хирургия.
МС / И. Н. Околов, Ю. В. Тахтаев, А.
И. Мяжитова и др. // Журнал Катарактальная и рефракционная хирургия. 2012.
2012. Т. 12, № 4.
Т. 12, № 4. С. 44
С. 44 51.
51.
Продукты
деструкции и бактериостатическая активность рифампицина в водном растворе и в
составе липосом / Г. М. Сорокоумова, В. В. Востриков, А. А. Селищева и др. //
Химико-фармацевтический журнал. 2008.
2008. Т. 42, № 8.
Т. 42, № 8. С. 35
С. 35  38.
38.
Смирнова,Т.Д.
Обращено-фазовая ВЭЖХ флюмеквина и ципрофлоксацина в организованных средах / Т.
Д. Смирнова,С. Н. Штыков, Н. В. Неврюева // Сорбционные и хроматографические
процессы. 2010.
2010.  Т. 10, Вып.
1.
Т. 10, Вып.
1. С. 142
С. 142  149.
149.
Уваров,
Н. Н.,Крестьянова, И. Н., Дмитриева С. Д. , Антибиотики и химиотерапия, 37(4),
16-19 (1992).
Фармакология
/ Под ред. Проф. Р.Н. Аляутдина. 4-е изд.; перераб. и доп.
4-е изд.; перераб. и доп. М.: ГЭОТАР -
Медиа, 2008.
М.: ГЭОТАР -
Медиа, 2008. 832с.
832с.
Фармакопея
США: USP 29; Национальный формуляр : NF 24 : в 2 т. : [ пер. с англ.]. М.: ГЭОТАР
М.: ГЭОТАР Медиа, 2009.
Медиа, 2009. Т.2
Т.2  С. 2504
С. 2504 2511.
2511.
Чучалина,
И.В. Концентрирование цефалоспориновых антибиотиков на природных сорбентах //
электронный научный журнал «Исследовано в России». 2006
2006 С.
С. 1842-1851[Электронный
ресурс]. URL: <#"704755.files/image001.gif">2002.
1842-1851[Электронный
ресурс]. URL: <#"704755.files/image001.gif">2002.  Т. 45, вып.
2.
Т. 45, вып.
2. С. 101-106.
С. 101-106.
Штыков
С.Н. Химический анализ в нанореакторах. Основные понятия и применение // Журн.
аналит. химии.  2002.
2002.  Т.57, №10.
Т.57, №10. С.1018-1028.
С.1018-1028.
Экспресс анализ
антибиотиков пептидной группы на микроколоночном хроматографе Милихром А
анализ
антибиотиков пептидной группы на микроколоночном хроматографе Милихром А  02 / А. В.
Тимофеева, М. В. Серебрякова, Л. А. Баратова, Г. С. Катруха // Журнал
Биотехнология.
02 / А. В.
Тимофеева, М. В. Серебрякова, Л. А. Баратова, Г. С. Катруха // Журнал
Биотехнология. 2009.
2009. № 1.
№ 1. С.90
С.90
 95.L. A.,
Abba M., Hussain B. and Donnelly J. The simultaneous separation and
determination of five quinolone antibotics using isocratic reversed-phase HPLC:
Application to stability studies on an ofloxacin tablet formulation // J.
Pharm. Biomed. Anal. 2005. V. 39. №3-4. P.769-775.
95.L. A.,
Abba M., Hussain B. and Donnelly J. The simultaneous separation and
determination of five quinolone antibotics using isocratic reversed-phase HPLC:
Application to stability studies on an ofloxacin tablet formulation // J.
Pharm. Biomed. Anal. 2005. V. 39. №3-4. P.769-775.
Inês M., Santoro R.M., Kassab N.
M., Singh A.l K., Kedor-Hackmam E. M. Quantitative
determination of gatifloxacin, levofloxacin, lomefloxacin and pefloxacin
fluoroquinolonic antibiotics in pharmaceutical preparations by high-performance
liquid chromatography // J. Pharm. Biomed. Anal. 2006. V. 40. №1. P.179-184.
S., Giequel M., Lanrentie M. Simultaneous determination of enrofloxacin and
ciprofloxacin in animal biomedical fluidsby high-performance liquid
chromatography. Application in pharmacokinetic studies in pig and rabbit // J.
Chromatogr. B: Biomed. Sci. Appl. 1999. V.726. №1-2. P.175-178. S., Dogaru
M.T., Vari C.E., MunteanT., Kelemen L. Validation of an HPLC method for the
determination of ciprofloxacin inhuman plasma // J. Pharm. Biomed. Anal. 2003.
V. 33. №1. P.125-130. M., Aranda A., Garcia E., Reuvers T., Hooghuis H. Simple
and senstive determination of five quinolones in food by liquid chromatography
with fluorescence detection // J. Chromatogr. B. 2003. V. 789. №2. P.373-381.
A., Miltiadou N. Sensitive LCdetermination of ciprofloxacin in pharmaceutical
preparations and biological fluidswith fluorescence detection // J. Pharm.
Biomed. Anal. 2002.V. 28. №3-4. P.559-568. Kemary M., Dauhal A. Photochemistry
and photophysics of cyclodeхtrin caged drugs: relevance to their
stability and efficiency // Cyclodeхtrin
materials in photochemictry, photoph. Ed. by Douhal A. - Elsevier. 2006. V.1.
P.79-105.