Оценка растворимости азота в мнокомпонентных сплавах на основе железа
Министерство
образования и науки Российской Федерации
ФГАОУ
ВПО «УрФУ имени первого Президента России Б.Н.Ельцина»
Институт
«Материаловедения и металлургии»
Кафедра
«Металлургия железа и сплавов»
Реферат
на тему: Оценка растворимости азота в мнокомпонентных сплава на основе железа
Руководитель
проф., д.т.н.
Бурмасов С.П.
Студент
гр. МтМ-130102
Панков Д.А.
Содержание
Введение
Влияние
давления
Влияние
температуры
Прогнозирование
растворимости азота
Методы
диффузионного насыщения азотом
Заключение
Введение
Интерес к исследованию сталей и сплавов вызван
широким использованием их в промышленности. Многообразие фаз, которые
образуются в этих сплавах (феррит, аустенит, 5-фаза, карбиды), определяет
возможность управления свойствами этих сталей. Например, присутствие
остаточного аустенита в ферритной структуре способствует повышению ударной
вязкости. Эффективным стабилизатором аустенита является азот, который имеет
более высокую растворимость в а-, Ɣ -, 8-железе по сравнению с углеродом,
однородно распределяется в Ɣ-твердом растворе сплавов Fе-Сг. При этом
процесс изотермического распада азотистого аустенита при всех температурах идет
значительно медленнее, чем углеродистого, и продукты распада в сталях с азотом
имеют высокую степень дисперсности. Все это определяет перспективы разработки
сталей, легированных азотом.
При исследовании растворимости азота в двойных и
многокомпонентных сплавах обычно используется азотная атмосфера.
Влияние давления
Равновесие двухфазной системы Fe-N может быть
представлено реакцией:
N2 (газ)-» 2 Na6c (в Fe),(1.1)
где Na6c - обозначают абсорбированные атомы
азота
Сивертс, измеряя при различных давлениях
растворимость азота в твердом и жидком железе, установил, что растворимость
азота в металлах при постоянной температуре прямопропорциональна корню
квадратному из величины его парциального давления :
CN=K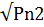 ,(1.2)
,(1.2)
где СN - концентрация азота в металле, К -
константа Генри, Pn2 - давление азота.
Влияние давления на растворимость азота в железе
изучалось многими авторами . Все исследователи подтвердили строгое соблюдение
закона Сивертса в двухфазной системе газ-металл, за исключением случая, когда
содержание хрома в сплаве было более 60 % . Растворимость азота при разных давлениях
может быть определена по закону Сивертса, но рассматриваемые давления не должны
быть высокими, чтобы поведение газа не отклонялось значительно от поведения
идеального газа. Установлено, что для чистого железа закон Сивертса выполняется
в диапазоне давлений азота до 16 атм .
Влияние температуры
Авторы работ исследовали растворимость азота в
a-Fe при разных температурах с использованием как метода внутреннего трения,
так и классических методов и предложили следующее уравнение для описания
растворимости в a-Fe:
CN (ОЦК)
- -1575/Т
- 1,009% N ,(1.1)
где CN - концентрация, Т - температура (К), % -
массовый процент.
Растворимость газообразного азота при 1
атмосфере в Ɣ-Fe изучалась авторами работ. Показано, что растворимость
азота в гранецентрированной решетке Ɣ-железа (910°С - 1400°С) значительно
выше, чем в объемно-центрированной, и уменьшается с повышением температуры, для
описания растворимости азота в y-Fe предложено уравнение:
CN (ГЦК)
= 450/Т
- 1,955 % N ,(1.2)
Процесс растворения азота в ГЦК-железе является
экзотермичным и сопровождается выделением теплоты 2060 кал/г-атом азота.
Растворимость азота в чистом жидком железе при
1600°С и давлении 1 атмосфера составляет 0,044% ,в зависимости от температуры
растворимость азота в жидком железе описывается следующим уравнением:
CN (жид)
= -188/Т
- 1,248 % N.(1.3)
Растворимость азота при 1 атм в а-, Ɣ-, 5-
и жидком железе в соответствии с уравнениям (1.1), (1.2) и (1.3) как функция от
температуры представлена на рис. 2.1 Видно, что при температурах структурных
превращений и в точке плавления абсорбционная способность железа скачкообразно
изменяется.
Влияние легирующих элементов
На термодинамическое равновесие системы железо -
легирующий элемент- газ, влияют не только температура и парциальное давление
растворенного газа, но и концентрация легирующего элемента (R). Процесс
растворения газа в сплаве Fe-R характеризуется тем же уравнением реакции (1.1),
что и для чистого железа. Тождественны и термодинамические условия равновесия
этих систем, поэтому в сравнимых условиях(р, Т) активность газа, растворенного
в сплаве,равна активности этого газа, растворенного в чистом железе, т. е.
[См
%] Fe = fNR [Cn %] Fe-R (3.1)
где fNR - коэффициент активности растворенного
азота в бинарном металлическом сплаве Fe-R при Т = const и Р = const,
описывающий влияние определенного содержания компонента R на растворимость
азота в железе.
Коэффициент активности характеризует отклонение
растворимости от закона Сивертса при данном содержании азота в металле.
Уравнение изотермы абсорбции азота в металлах (2.1) в этом случае принимает
следующий вид:
fN[CN%] = K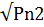 (3.2)
(3.2)
Вагнер выразил влияние элементов сплава на
коэффициент активности
(fN ) через параметр взаимодействия eNR ,
который является функцией температуры. В таблице 1.1 приведены рекомендуемые
значения eNR для некоторых элементов в жидких бинарных сплавах при температуре
1600°С и в твердом у-растворе при 1200°С по данным.
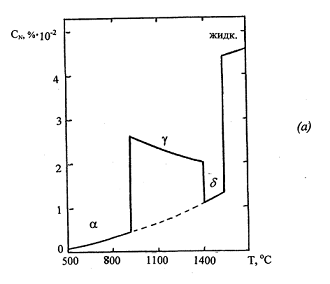
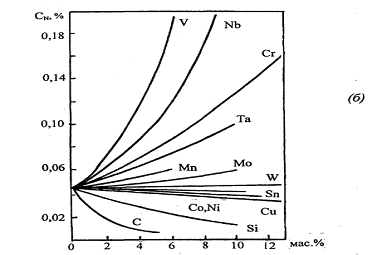
Рис.1.1 Растворимость азота при 1 атм в
различных модификациях железа в зависимости от температуры [1] (а), в жидких
бинарных железных сплавах при 1600°С [17] (б)
Параметры взаимодействия первого порядка Таблица
1.1.
|
Элемент
|
eNR
(1600°С )
|
eNR(1200°C)
|
|
Углерод
|
0,13
|
0,11
|
|
Кислород
|
0,00
|
0,00
|
|
Кремний
|
0,048
|
0,044
|
|
Титан
|
-0,45
|
|
|
Хром
|
-0,045
|
-0,095
|
|
Марганец
|
-0,020
|
-0,035
|
0,010
|
0,015
|
Используя табличные значения eNR, можно
вычислить по формуле коэффициент активности азота в соответствующих сплавах
Fe-R:
= eNR (% R).(1.8)
Влияние элементов сплава на растворимость азота
в жидком железе при 1600°С проведено по данным [17] приведено на рис. 1.7 б.
Показано, что растворимость азота в жидком железе уменьшается в ряду В, С, Si,
Со, Си, Ni, Р, S, и Sn и увеличивается в ряду Al, V, Nb, Сг, Та, Mn, Mo, Ti, W.
При сравнении значений eNR для жидких и твердых
сплавов обнаруживается одинаковый характер зависимости параметров
взаимодействия. Растворенные элементы, которые имеют большее сродство к азоту,
чем к железу, уменьшают коэффициент активности (fNR) и увеличивают
растворимость азота. Следовательно, растворимость азота в Ɣ-Fe подчиняется
закону Сивертса.
Вероятно, из-за низкой растворимости азота в
a-твердом растворе мало исследований влияния элементов сплава на растворимость
азота в этой фазе. Как в жидком железе, растворимость в a-Fe уменьшается в
присутствии Si и Р [17] и увеличивается при добавлении Сг, Mn, V.
Влияние хрома. Исследованию растворимости азота
в расплавах Fe-Cr посвящено много работ.Величина еNСr в жидких железохромовых
сплавах при 1600°С близка к -0,045. Влияние малых количеств хрома (до 10%) на
растворимость азота в аустените можно оценить по результатам работ. Среднее
значение eNR при 1200°С, по данным [17], равно -0,095, при 1250°С равно -0,098
и соответственно -0,121 и -0,135 при 1150°С и 1050°С. Коэффициент активности
азота, теплота и энтропия растворения азота при абсорбции уменьшаются с
увеличением содержания хрома в сплавах Fe-Cr.
Исследования [16] показали, что в стали,
выплавленной в промышленных условиях, содержание азота может составлять:
0,017-0,17% при 12-14% хрома; 0,020-0,22% при 16-18% хрома; 0,07-0,57% при
27-30% хрома. В сталях с 18% хрома при высокотемпературной обработке в богатых
азотом атмосферах или в чистом азоте высокого давления происходит поглощение
азота до 0,2%. В технической жаростойкой стали с 19% хрома и 2,3% кремния или
30% хрома и 0,5% кремния после нагревания ее на воздухе при 1100- 1200°С в
течение 200- 1000 часов наблюдалось насыщение азотом до 0,5% [1].
Температурная зависимость (900°С -1400°С)
растворимости азота в сплавах Fe- Cr представлена на рис. 1.8 а [17].
Растворимость азота как функция содержания хрома и температуры при 1 атм.
приведена на рис. 1.8 б по данным [123]. Видно, что под влиянием растворенного
азота в сплавах Fe-Cr увеличивается область у-фазы, как показано на рис. 1.2 б
и 1.3 б.
Влияние никеля. В работах исследовано влияние Ni
на растворимость азота, показано, что никель уменьшает растворимость азота в
железе. С увеличением содержания никеля в сплаве растворимость азота
уменьшается. При содержаниях Ni более 70 % растворимость становится менее
0,0005 %.
Влияние хрома и никеля. Растворимость азота в
Fe-Cr-Ni сплаве была исследована авторами работ. Полученные данные
свидетельствуют о невозможности предсказания растворимости азота в сплаве
Fe-Cr-Ni, используя растворимости бинарных сплавов Fe-Cr и Fe-Ni, что вызвано
взаимодействием между никелем и хромом.
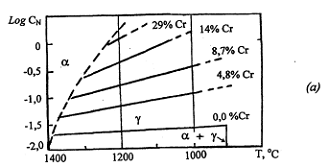
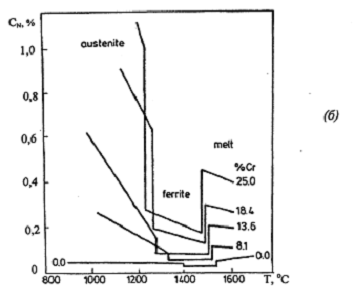
Рис.1.8. Температурные зависимости растворимости
азота в сплавах Fe-Cr при 1 атм азота [17] (а), [123] (б)
Влияние углерода. Углерод снижает растворимость
азота в железе. Параметр взаимодействия eNR при 1600±50°С колеблется в пределах
значений 0,125 - 0,135, а при 1200°С может быть принят равным 0,11 [99]. В
области аустенитного состояния (до 0,8% С) растворимость азота возрастает с
повышением температуры. В железоуглеродистых расплавах, отвечающих по составу
химическому соединению БезС (6,7%С), азот практически не растворяется.
Влияние кислорода. Авторами работ показано, что
кислород уменьшает растворимость азота в железе. Значения параметра
взаимодействия eNR колеблются от 1,9 до 0,05 , такое различие данных
объясняется сложностью проведения эксперимента. Растворимость азота в железе,
содержащем 0,1% кислорода, при температуре 1600°С в 1,5 раза ниже, чем в чистом
железе.
Таким образом, анализ представленных
исследований о влиянии различных легирующих элементов на растворимость азота в
жидком и твердом железе показал, что в хромсодержащих сплавах растворимость
азота наибольшая.
Прогнозирование растворимости азота
Изучение растворимости азота в сплавах
необходимо для практического применения и прогнозирования его растворимости.
Экспериментальным путем невозможно установить значения коэффициентов активности
для бесчисленного количества сталей и сплавов. Многие исследователи предлагали
уравнения для предсказания растворимости азота в многокомпонентных жидких
сплавах железа. Теоретическое решение для разбавленных растворов было дано
Вагнером, которое основано на разложении f>jR в ряд Тейлора и усечении этого
ряда при использовании параметров взаимодействия только первого порядка.
Так как большинство данных о бинарных сплавах
даны для температуры 1600°С, то предсказание растворимости проводили для
сплавов при этой температуре. Лангенберг развил графический метод для
предсказания растворимости азота в многокомпонентных сплавах при 1600°С из
логарифмов коэффициента активности. Чипман [39] показал, что для жидких
бинарных железных сплавов теплота растворения пропорциональна первому параметру
взаимодействия. Он использовал эту пропорциональность как основу метода для
предсказания растворимости азота при любой температуре, если известен параметр
взаимодействия при 1600°С или, если известна растворимость при любой другой
температуре, в соответствии с уравнением:
(%CN)= -188/Т
- 1,25 - [3280/Т
-0,75]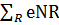 (%R)
(1.9)
(%R)
(1.9)
Метод является ограниченным и пригодным только
для относительно разбавленных сплавов.
В работе приведена методика Нелсона, где он
постулировал более простое решение модели для расчета растворимости при других
температурах, используя данные коэффициентов активности при температуре 1600°С.
Он предложил, что коэффициент активности обратнопропорционален абсолютной
температуре, как это следует из теории “регулярных” растворов:
lgfi=(T,/T2)lgf2.(1.10)
Таким образом, при известном составе сплава
растворимость азота может быть теоретически рассчитана различными методами.
Методы диффузионного насыщения азотом
растворимость азот давление сплав
Для осуществления диффузионного насыщения
поверхностного слоя стали азотом при нагреве в соответствующей среде
используется широкая гамма газовых атмосфер. Изменяя состав и давление газовой
атмосферы, регулируют фазовый состав азотированного слоя. Наиболее часто
применяют чистый аммиак, смеси аммиака и углеродсодержащих газов, аммиака и
диссоциированного аммиака Однако в таких средахсталь может насыщаться
водородом, чтонеблагоприятновлияет на свойстваматериала. Кроме того, при
высоких температурахаммиачные среды малоэффективны, и в качестве газовой
атмосферы используют азот.
Недостатком азотирования является большая
длительность процесса. Для повышения эффективности поверхностного насыщения
азотом проводят предварительную пластическую деформацию, за счет формирования
дислокационной структуры диффузия в этом случае идет преимущественно по
дефектам.
Для интенсификации процесса насыщения азотом
используют разные способы очистки поверхности от органических и неорганических соединений.
Так восстановление поверхностных оксидов проводят при добавлении к аммиаку NF3
или газообразного фосфора, однако, эти газы токсичны и, следовательно,
предлагаемая технология не отвечает требованиям экологии. В последние годы для
активации азотирования широко применяется предварительное оксидирование или
совместное оксиазотирование (оксикарбоазотирование) , когда в
аммиачно-водородную атмосферу добавляют кислород или воздух. Образующиеся
оксидные пленки легко восстанавливаются в водородсодержащей среде в процессе
азотирования, образуя чистую поверхность с хорошей адсорбционной способностью.
Добавление кислорода в среду аммиака увеличивает скорость насыщения азотом в 2
раза.
Высокая скорость процесса достигается при
использовании пониженных давлений аммиачной атмосферы , при этом расход аммиака
уменьшается в ~ 10 раз, по сравнению со стандартным азотированием, и появляется
возможность регулирования глубины слоя. В зависимости от давления насыщающей
атмосферы можно получить различное строение диффузионного слоя .
Сократить продолжительность обработки в 2-3 раза
позволяет технология циклического насыщения азотом. Также сокращается
продолжительность процесса азотирования в пульсирующем потоке газа, при
использовании “кипящего слоя” и при ионном азотировании. Одним из перспективных
способов насыщения азотом в последнее время является химико-термическая
обработка в замкнутом объеме. По сравнению с азотированием в потоке насыщающего
газа указанная обработка обеспечивает эффективное регулирование фазового состава
диффузионного слоя, при этом максимально используется насыщающая способность
газа.
Заключение
Обработка металла многокомпонентными реагентами
позволяет достигать более высокой степени рафинирования от оксидных
неметаллических включений, более равномерного распределения в слитке оставшихся
или вновь образовавшихся выделений. Этот эффект связан с тем, что возникновение
комплексных зародышей оксидной фазы в расплавах железа вследствие их более
низкого межфазного натяжения может происходить при более низких пресыщениях,
вследствие чего формирование крупных и в дальнейшем полнее удаляемых из
расплава первичных продуктов раскисления идет более активно.
Список литературы:
1.
Гуляев А.П., Чаадаева М.С. Стабилизация остаточного аустенита // ЖТФ. -1953.
-Т.23. -Вып.2. -С.252-264.
.
Мирзаев Д.А., Тайзетдинова А.Г. Ближний порядок и стабилизация аустенита в
сплавах Fe-C // Изв. вуз. Черная металлургия. -1984. -№ 6. -С.88-91.