Микромир. Строение атома. Элементарные частицы
Контрольная работа
по дисциплине: «Концепции
современного естествознания»
Тема
Микромир. Строение атома.
Элементарные частицы
Введение
периодический элемент атом
Создание атомно-молекулярной теории, открытие новых химических элементов
способствовали дальнейшему развитию учения об элементе. Вполне закономерными
были попытки исследователей выявить взаимосвязь между химическими элементами
как с качественной, так и с количественной стороны. Рост числа открытых
химических элементов во второй половине XIX века обусловили крайнюю необходимость систематизации
их физических и химических свойств, а также объяснения известных к тому времени
типов химических взаимодействий. Создание такой системы позволило бы
классифицировать все элементы и предсказывать химические и физические свойства
еще неоткрытых элементов. Эта задача была успешно решена выдающимся российским
ученым Д.И. Менделеевым в 1869 г.
Развитие квантовой механики и открытие важнейших элементарных частиц
(электрона, протона, нейтрона) привело к разработке модели строения атома Бора,
дальнейшему развитию модели разрешенных энергетических состояний атома. Принцип
«запрета» Паули, лежащий в основе данной модели, не только позволил объяснить
многие открытые физические явления, но также обосновать и по-новому
интерпретировать периодическую систему химических элементов.
Целью настоящего реферата является: 1) изучение значения создания и
основных закономерностей периодической системы химических элементов во второй
половине XIX века; 2) квантово-механической
модели атома и, в частности, принципа Паули как базиса дальнейшего развития в
понимании периодического закона Д.И. Менделеева.
1.
Открытие периодического закона элементов
1.1 Первые попытки классификации свойств элементов
В конце XVIII - начале XIX вв. химики пытались создавать классификации
химических элементов в соответствии с их физическими и химическими свойствами,
в частности на основе агрегатного состояния элемента, удельного веса
(плотности), электропроводности, металличности - неметалличности, основности -
кислотности и т.д. [1,2]
В 1805 г. Дж.Дальтон определил атомные веса нескольких элементов, приняв
за единицу атомную массу водорода, а Й.Берцелиус в 1815 г. значительно уточнил
величины атомных весов. Ученые пытались установить простые (целочисленные)
соотношения между атомными весами элементов. У.Праут в 1815 г. предположил, что
атомные веса всех элементов связаны простыми кратными отношениями с атомным
весом водорода.
Дж.Ньюлендс в 1864 г., анализируя все известные триады и расширяя по возможности
их в семейства по 4-5 элементов, получил общую таблицу, что позволило ему
предположить существование одного или двух неоткрытых элементов. Затем он
перестроил классификацию элементов в порядке увеличения атомного веса и
обнаружил периодическую повторяемость свойств у каждого восьмого элемента [2].
Все это подготавливало открытие в будущем периодического закона. Большую
роль также сыграл и международный химический съезд в г. Карлсруэ (1860). К
этому времени уже было известно 63 химических элемента [2].
.2 Создание периодической системы
Как и его предшественники, Д.И. Менделеев в качестве основной
характеристики, однозначно определяющей химический элемент, выбрал атомную
массу. Но в отличие от них Д.И. Менделеев искал закономерности в изменении атомных
масс не только у химически сходных элементов, внутри одной естественной группы,
но и между несходными элементами. Сопоставив крайне противоположные в
химическом отношении, но близкие по атомным массам такие члены группы, как
щелочные металлы и галогены, и написав первые под вторыми, Д.И. Менделеев
расположил под и над ними и другие группы сходных элементов в порядке изменения
атомных масс. При этом обнаруживается, что распределение элементов по их
атомной массе не только не противоречит их сходству, а, наоборот, прямо на него
указывает [1].
Менделеев расположил элементы в порядке увеличения их атомного веса и в
1869 предложил таблицу размещения семейств элементов (табл.1). Модифицированная
форма таблицы, в которой семейства (группы) элементов расположены в колонках,
была предложена им в 1871 г. и существует до настоящего времени [1].
Таблица 1. Периодическая таблица элементов, опубликованная Менделеевым в
1869 г.(первая версия)
|
|
|
Ti = 50
|
Zr = 90
|
? = 180
|
|
|
|
V = 51
|
Nb = 94
|
Ta = 182
|
|
|
|
Cr = 52
|
Mo = 96
|
W = 186
|
|
|
|
Mn = 55
|
Rh = 104,4
|
Pt = 197,4
|
|
|
|
Fe = 56
|
Ru = 104,4
|
Ir = 198
|
|
|
Ni =
|
Co = 59
|
Pd = 106,6
|
Os = 199
|
|
H = 1
|
|
|
Cu = 63,4
|
Ag = 108
|
Hg = 200
|
|
Be = 9,4
|
Mg = 24
|
Zn = 65,2
|
Cd = 112
|
|
|
B = 11
|
Al = 27,4
|
? = 68
|
Ur = 116
|
Au = 197?
|
|
C = 12
|
Si = 28
|
? = 70
|
Sn = 118
|
|
|
N = 14
|
P = 31
|
As = 75
|
Sb = 122
|
Bi = 210?
|
|
O = 16
|
S = 32
|
Se = 79,4
|
Te = 128?
|
|
|
F = 19
|
Cl = 35,5
|
Br = 80
|
I = 127
|
|
|
Li = 7
|
Na = 23
|
K = 39
|
Cs = 133
|
Tl = 204
|
|
|
Ca = 40
|
Sr = 87,6
|
Ba = 137
|
Pb = 207
|
|
|
? = 45
|
Ce = 92
|
|
|
|
|
?Er = 56
|
La = 94
|
|
|
|
|
?Yt = 60
|
Di = 95
|
|
|
|
|
?In = 75,6
|
Th = 118
|
|
|
1.3 Формулировка периодического закона
Система элементов позволила Д.И. Менделееву сделать основные выводы из
нее: 1) у элементов, расположенных по возрастанию атомных масс, проявляется
периодичность свойств, т. е. атомная масса определяет свойства элемента; 2)
элементы с малыми атомными массами типические, они наиболее распространены в
природе и характеризуются ярко выраженными свойствами; 3) можно ожидать
открытия еще многих неизвестных элементов; 4) следует иметь в виду дальнейшее
уточнение атомных масс элементов. На основании этих выводов был сформулирован
периодический закон:
«свойства простых тел, а также формы и свойства соединений, элементов
находятся в периодической зависимости от величины атомных масс (весов)
элементов.»
Был установлен главный принцип, гласивший, что физические и химические
свойства простых веществ и соединений составляют периодическую функцию атомной
массы всех элементов [1,2].
Уверенность Менделеева в правильности периодического закона была так
велика, что он не колеблясь исправил известные значения атомных весов на
основании открытого закона. Он предсказал существование и довольно точно описал
свойства трех новых, еще неизвестных тогда элементов, которые были открыты
через несколько лет: галлия (1875), скандия (1879) и германия (1886).
В модифицированной таблице элементы располагаются в колонки, образуя
группы, нумеруемые цифрами 0, I, II,..., VIII. Предполагается, что элементы
внутри каждой группы проявляют сходные общие химические свойства. Еще большее
сходство наблюдается у элементов в подгруппах (A и B), которые образуются из
элементов всех групп, кроме 0 и VIII. Подгруппа А называется главной, а В -
побочной. Некоторые семейства имеют названия, например, щелочные металлы (группа
IA), щелочноземельные металлы (группа IIA), галогены (группа VIIA) и
благородные газы (группа 0). В группе VIII находятся переходные металлы: Fe, Co
и Ni; Ru, Rh и Pd; Os, Ir и Pt. Находящиеся в середине длинных периодов, эти
элементы более сходны друг с другом, чем с элементами, стоящими до и после них.
В нескольких случаях порядок увеличения атомных весов (точнее, атомных масс)
нарушается. Это «нарушение» необходимо для сохранения сходства элементов в
подгруппах.
Диагональ от водорода к радону примерно делит все элементы на металлы и
неметаллы, при этом неметаллы находятся выше диагонали. Вдоль этой линии
располагаются элементы, которые обладают некоторыми свойствами металлов и
неметаллов (металлоиды - устаревшее название таких элементов). При рассмотрении
свойств по подгруппам сверху вниз наблюдается увеличение металлических свойств
и ослабление неметаллических свойств [2,3].
2. Развитие представлений о сложном строении атома
В 1895г. В. Рентген (1845-1923) открыл новый вид излучения, названный рентгеновским.
Затем Беккерель установил, что все соединения урана обладают способностью
испускать лучи, по свойствам идентичные рентгеновским. Тогда жеПьер Кюри и
Мария Склодовская-Кюри приступили к детальному изучению открытого Беккерелем
явления. Исследуя урановую руду в 1898 г., они сообщили об открытии нового
элемента - полония. Несколько позже ими же был открыт радий, который обладал
радиоактивностью, во много раз большей, чем уран. Свойство веществ давать
самопроизвольное излучение было названо радиоактивностью.
Э. Резерфорд показал, что под влиянием магнитного поля радиоактивное
излучение дифференцируется на a-, b- и g-излучение. Неоспоримым фактом было
то, что радиоактивное излучение связано со сложным процессом - расщеплением
атомов. Это свидетельствовало о том, что атом неделим только химически,
физически же делим и имеет дискретную структуру.
В 1924 г. Луи де Бройль высказал гипотезу, что все объекты микромира
характеризуются двойственной природой, обладая одновременно свойствами частицы
и волны. Волновой характер электрона был доказан экспериментально: пучок
электронов, рассеиваемый кристаллом, дает такую же дифракционную картину, как и
рентгеновское излучение [5].
2.1 Определение физического смысла атомного номера на основе модели атома
Бора
В 1913 г. Н. Бор использовал ядерную модель строения атома для объяснения
спектра атома водорода, наиболее легкого и поэтому наиболее простого атома. Бор
предположил, что атом водорода состоит из одного протона, составляющего ядро
атома, и одного электрона, вращающегося вокруг ядра. В том же году А. ван ден
Брук предположил, что порядковый номер элемента - его атомный номер - должен
идентифицироваться с числом электронов, вращающихся вокруг ядра нейтрального
атома, и с положительным зарядом ядра атома в единицах заряда электрона. Однако
необходимо было экспериментальное подтверждение идентичности заряда атома и
атомного номера. Бор далее постулировал, что характеристическое рентгеновское
излучение элемента должно подчиняться такому же закону, что и спектр водорода.
Так, если атомный номер Z идентифицируется с зарядом ядра в единицах заряда
электрона, то частоты (длины волн) соответствующих линий в рентгеновских
спектрах различных элементов должны быть пропорциональны Z2, квадрату атомного
номера элемента [4].
Атомные массы, как и массовые числа, должны иметь целочисленные значения.
В 1910 г. Ф. Содди (1877-1956) было установлено, что при естественной
радиоактивности могут образоваться атомы одного и того же элемента, имеющие
одинаковый заряд ядер, но различные атомные массы. Поэтому в процессе
постепенного уточнения таблицы периодической системы элементов Д.И. Менделеева
приходилось в одни и те же клетки помещать уже несколько видов атомов одного и
того же элемента, имеющих различные массы. Такие атомы-близнецы, имеющие один и
тот же заряд ядра, но различные атомные массы, называются изотопами. Отсюда
понятно, что, говоря об атомной массе, подразумевают среднее значение всех
атомных масс изотопов данного элемента. Поэтому в таблицах атомных масс они не
выражаются целыми числами. Из этого следует, что ядра изотопов одного и того же
элемента имеют одинаковое число протонов (заряд ядра), но различное число
нейтронов. Следовательно:
химический элемент - это вид атомов, имеющих одинаковый заряд ядер.
2.2 Квантово-механическая модель строения атома
В 1926 г. Э. Шредингер (1887-1961), исходя из представления о наличии
волновых свойств у электрона, показал, что движение электрона может быть
описано с помощью волновой функции размытого распределения отрицательного
заряда в виде "электронного облака". Согласно квантовой механике
вероятность нахождения электрона далеко от ядра очень мала, хотя и существует
[5].
.2.1 Квантовые числа и атомные орбитали
Область в пространстве, в которой вероятность пребывания электрона
максимальна, называется орбиталью.
Следовательно, орбиталь - это волновая функция, характеризующая состояние
электрона. Поэтому для каждой заданной волновой функции существует граничная
поверхность, внутри которой сосредоточена определенная доля электронного заряда.
Максимальная электронная плотность отвечает наибольшей вероятности нахождения
электрона. Следовательно, понятие "орбиталь" подразумевает форму
электронного облака, которая меняется в зависимости от плотности отрицательного
заряда. Орбитали могут отличаться одна от другой энергией, необходимой для
удаления отрицательного заряда, формой электронного облака и ориентацией
электронного облака относительно центра симметрии - ядра атома. В этом
проявляется дискретность характеристик электрона, квантованность его свойств.
Характеристики орбитали - энергию, форму, ориентацию в пространстве - можно
задать определенными числами, которые получили название квантовых чисел [4].
Главное квантовое число n связано со средним расстоянием электрона от
ядра, т. е. характеризует размер электронного облака, определяет энергетический
уровень электрона в атоме. Электроны, имеющие одинаковое значение главного
квантового числа, находятся на одном и том же энергетическом уровне. Главное
квантовое число может принимать значения целых чисел: 1, 2, 3, 4 и т. д. Вместо
понятия "энергетический уровень" иногда употребляется термин
"электронный слой". Энергетические уровни, характеризующиеся
значениями 1, 2, 3, 4 и т. д., иногда обозначают как К, L, М, N и т. д. уровни.
Слой со значением n = 1 соответствует самому низкому уровню энергии [5,6].
Орбитальное (побочное) квантовое число l определяет пространственную
форму орбитали; принимает значения от 0 до (n - 1), т. е. l = 0, 2, 3, ...,
(n-1). Так, если n=3, то l может принимать только значения 0, 1 и 2. Различные
значения побочного квантового числа l = 0, 1, 2, 3 соответствуют различным формам орбиталей, которые
обозначаются как s-, p-, d- и f-орбитали.
В табл. 2 показаны соотношения между значениями n и l, из которых видно,
что для каждого значения n имеется только одна s-орбиталь. При n=2 существует
еще и три р-орбитали; при n=3 - еще пять d-орбиталей и при n=4 - семь
f-орбиталей.
Таблица 2. Допустимые значения квантовых чисел.
|
n
|
L
|
обозначение орбиталей
|
число орбиталей
|
|
1
|
0
|
1s
|
1
|
|
2
|
0 1 0
|
2s 2p 3s
|
1 3 1
|
|
3
|
1 2
|
3p 3d
|
3 5
|
|
4
|
0 1 2 3
|
4s 4p 4d 4f
|
1 3 5 7
|
Таким образом, каждый энергетический уровень имеет набор орбиталей с
одинаковым значением главного квантового числа.
Орбитали одинаковой формы, размещенные на одном энергетическом уровне,
образуют подуровень. Различают, таким образом, s-, p-, d-, f-подуровни. При n=1
орбиталь, соответствующая самому низкому уровню энергии, обозначается
ls-орбиталь. Любая s-орбиталь имеет сферическую форму (рис. 1). Если n=2, то
s-орбиталь этого уровня обозначается как 2s-орбиталь и т. д.

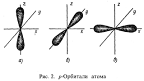
За 2s-орбиталью на втором уровне располагаются три орбитали (px, py, pz)
с равной энергией, называемые 2р-орбиталями. Каждая 2p-орбиталь имеет форму
объемной восьмерки ("вытянутой гантели"), расположенной на оси,
перпендикулярной осям двух других 2p-орбиталей.
В третьем от ядра энергетическом уровне (n=3) должно .быть три подуровня:
3s, Зр и 3d; d-подуровень состоит из пяти орбиталей. Четвертый энергетический
уровень (n=4) имеет уже четыре подуровня: 4s, 4p, 4d и 4f; f-подуровень состоит
из семи орбиталей.
Кроме формы орбитали важна ориентация орбитали в пространстве, которая
определяется магнитным квантовым числом mi. Оно связано с побочным квантовым
числом l, меняясь от +l через 0 до -l. Следовательно, магнитное квантовое число
является вектором, т. е. ему соответствует не только определенное числовое
значение, но и направление, отображаемое знаками "+" и "-".
Значения mi характеризуют "разрешенные" ориентации электронного
облака в пространстве, а число "разрешенных" ориентаций
непосредственно связано с формой электронного облака, определяемой значением
побочного квантового числа l. При l=0 может быть только одна ориентация
электронного облака, так как она обладает сферической формой. Если l=1, то
возможны три разрешенные ориентации облака: mi= -1; 0; +1. При l=2 число mi
имеет пять разрешенных ориентации: -2; -1; 0; +1; +2.
Спиновое квантовое число ms характеризует веретенообразное вращение
электрона вокруг собственной оси (от англ. spin - верчение). Каждый электрон
может совершать такое вращение в одном из двух противоположных направлений,
поэтому ms принимает два возможных значения: +½ и -½. Иначе спины обозначают стрелками,
направленными в противоположные стороны:↑↓ .
.2.2 Энергетические состояния атома и принцип запрета Паули
При описании электронного строения многоэлектронных атомов очень важно
знать закономерности застройки электронами энергетических уровней атомов. Если
атом находится в основном (невозбужденном) состоянии, то электроны расселены на
самых низких по энергии орбиталях [5].
Принцип Паули можно также сформулировать с использованием понятия набора
квантовых чисел: в атоме не может быть двух электронов, обладающих одинаковым
набором всех четырех квантовых чисел: n, l, mi и ms.
Если один электрон имеет, например, значения квантовых чисел n=1, l=0,
mi=0 и ms= +1/2, то второй электрон должен характеризоваться значениями n=1,
l=0, mi=0 и ms= -1/2. Следовательно, на любой атомной орбитали с заданными
значениями n, l, mi может находиться не более двух электронов, причем каждый из
них должен иметь противоположное значение спинового квантового числа. Это
значит, что максимальная емкость любой орбитали равна 2. Когда на одной
орбитали находятся два электрона со спинами +1/2 и -1/2, то говорят, что они
спарены.
При заполнении энергетических уровней электроны стремятся занять разные
орбитали, так как при этом уменьшаются силы взаимного отталкивания их как
одноименно заряженных частиц. Находясь на отдельных орбиталях, электроны имеют
параллельные спины, т. е. одинаковое направление спина. Эти особенности свидетельствуют
о том, что наиболее устойчивой конфигурацией на одном и том же подуровне
является та, которая содержит наибольшее число неспаренных электронов (правило
Гунда) [4].
Следовательно, при заполнении ячеек вначале в каждой из них размещается
один электрон, после чего происходит достраивание оставшимися электронами, но
так, чтобы образовались парные электроны с противоположными спинами. Два
электрона с противоположными спинами, находящимися в одном энергетическом
состоянии, называются спаренными, а одиночные - неспаренными:

Последовательность заполнения орбиталей электронами определяет
электронную конфигурацию атома. Число энергетических уровней в атоме
соответствует номеру периода, в котором находится данный элемент.
3. Квантово-механическая интерпретация периодического закона
Принцип Паули - знаменитый «принцип запрета», согласно которому в атоме
не может быть двух электронов, у которых бы все квантовые числа были
одинаковые, позволил по-новому рассмотреть закономерности, отраженные в
периодическом законе. Когда этот принцип применили к электронным конфигурациям
атомов, периодическая таблица приобрела физическое обоснование. Так как атомный
номер Z, т.е. положительный заряд ядра атома, возрастает, то и количество
электронов должно возрастать для сохранения электронейтральности атома. Эти
электроны определяют химическое «поведение» атома. Согласно принципу Паули, по
мере увеличения значения квантового числа электроны заполняют электронные слои
(оболочки) начиная с ближайших к ядру. Завершенный слой, который заполнен всеми
электронами в соответствии с принципом Паули, является наиболее стабильным.
Поэтому благородные газы, такие, как гелий и аргон, имеющие полностью
завершенные электронные структуры, устойчивы к любому химическому воздействию
[2,7].
.1 Периоды таблицы как отражение «застройки» электронных оболочек атома
Низшая полностью завершенная электронная оболочка (орбиталь) обозначается
1s и реализуется у гелия. Следующие уровни - 2s и 2p - соответствуют застройке
оболочек атомов элементов 2-го периода и при полной застройке, у неона,
содержат в сумме 8 электронов. С увеличением значений главного квантового числа
энергетическое состояние низшего орбитального числа для большего главного может
оказаться ниже энергетического состояния наиболее высокого орбитального
квантового числа, соответствующего меньшему главному. Так, энергетическое
состояние 3d выше, чем 4s, поэтому у элементов 3-го периода происходит
застройка 3s- и 3p-орбиталей, заканчиваясь формированием устойчивой структуры
благородного газа аргона. Далее происходит последовательная застройка 4s-, 3d-
и 4p-орбиталей у элементов 4-го периода, вплоть до завершения внешней
устойчивой электронной оболочки из 18 электронов у криптона. Это и приводит к
появлению первого длинного периода. Аналогично происходит застройка 5s-, 4d- и
5p-орбиталей атомов элементов 5-го (т.е. второго длинного) периода, завершаясь
электронной структурой ксенона [4].
.2 Лантаноиды и актиноиды
Последовательное заполнение электронами 6s-, 4f-, 5d- и 6p-орбиталей у
элементов 6-го (т.е. третьего длинного) периода приводит к появлению новых 32
электронов, которые формируют структуру последнего элемента этого периода -
радона. Начиная с 57 элемента, лантана, последовательно располагаются 14
элементов, мало отличающихся по химическим свойствам. Они образуют серию
лантаноидов, или редкоземельных элементов, у которых застраивается 4f-оболочка,
содержащая 14 электронов [3].
Серия актиноидов, которая располагается за актинием (атомный номер 89),
характеризуется застройкой 5f-оболочки; она также включает 14 элементов, весьма
близких по химическим свойствам. Элемент с атомным номером 104 (резерфордий),
следующий за последним из актиноидов, уже отличается по химическим свойствам:
он является аналогом гафния. Для элементов за резерфордием приняты названия:
105 - дубний (Db), 106 - сиборгий (Sg), 107 - борий (Bh), 108 - хассий (Hs),
109 - мейтнерий (Mt).
Заключение
Открытие периодического закона химических элементов позволило провести
классификацию элементов и открыть связь их физических и химических свойств с
атомным весом элемента. Необходимо отметить, что периодический закон создавался
в то время, когда представление об атоме как едином и неделимом элементе
считалось незыблемым, по этой причине он отражал лишь количественную сторону
реакционной способности данного элемента к химическому взаимодействию с другими
элементами, а также сходство химических и физических свойств соседних элементов
таблицы. Кроме того, он показывал связь металлов и галогенов и указывал на
единую природу всех существующих видов атомов. В то же время, давая
качественную классификацию элементов, периодический закон оставлял открытым
вопрос о причинах различия свойств разных по атомному весу элементов. Квантовая
теория Бора строения атома, основанная на понятии «квантового числа», стала
основой новых представлений об энергетических состояниях атома. Принцип Паули,
согласно которому в атоме не может быть двух электронов, у которых бы все
квантовые числа были одинаковые, позволил по-новому рассмотреть закономерности,
отраженные в периодическом законе. Электронные конфигурации атомов придали
периодической таблице физическое обоснование. При этом основную роль в
структуре электронных состояний стал играть положительный заряд ядра атома
,т.е. атомный номер Z. Количество электронов Z определяет химическое
«поведение» атома. По мере увеличения значения квантового числа электроны
заполняют электронные слои (оболочки) начиная с ближайших к ядру. Значение
принципа Паули состоит и в том, что он позволил объяснить химическую природу
каждого элемента, его реакционной способности, степень возбуждения и пр. с
квантово-механической точки зрения.
Список литературы
1.
Менделеев Д.И.
Периодический закон. Основные статьи. М., 1958.
2.
Химия и периодическая
таблица. М., 2002.
3.
Мельников В.П.,
Дмитриев И.С. Дополнительные виды периодичности в периодической системе
Д.И.Менделеева. М., 2004.
4.
Детлаф А.А.,
Яворский Б.Н. Курс физики. - М.,2006.
5.
Орир Дж.
Популярная физика. - М., 2001.
6.
Трофимова Т.И.
Курс физики. - М., 2004.
7.
Оганесян Э.Т.
Руководство по химии поступающим в ВУЗы - М, 2006.