Некоторые показатели качества ливневых сточных вод г. Гомеля
МИНИСТЕРСТВО
ОБРАЗОВАНИЯ РЕСПУБЛИКИ БЕЛАРУСЬ
Учреждение
образования
«Гомельский
государственный университет
имени
Франциска Скорины»
Заочный
факультет
Кафедра
химии
Некоторые
показатели качества ливневых сточных вод г. Гомеля
Дипломная
работа
Исполнитель:
студентка группы
Б-62
Баланчук Валентина
Викторовна
Научный
руководитель:
доцент кафедры
химии,
к.х.н., доцент
Пролесковский Юлиан
Антонович
Гомель
2012
Реферат
Дипломная работа: 64 страницы, 15 таблиц, 13
рисунков, 35 источников.
Ключевые слова: ливневые сточные воды,
классификация, физико-химические показатели, рН, железо общее, марганец, азот
аммонийный, хлориды, фосфаты, предельно-допустимые концентрации веществ, методы
анализа качества ливневых сточных вод
Объект исследования: ливневые сточные воды с
территории г. Гомеля.
Методы исследования: Исследования проводились на
коллекторах ливневой канализации г. Гомеля ежемесячно в течение 2010 и 2011 гг.
Для проведения работы использовались
фотометрический, титриметрический и атомно-абсорбционный методы. В работе
проведён ряд статистических анализов, для чего использовалась программа
Statistica 6.0.
Цель исследования: изучить формирование
поверхностного стока с городской территории и площадок промышленных предприятий
г. Гомеля, особенности химического состава и его влияние на состояние водных
объектов.
Результаты исследований:
В ходе работы был проведен анализ неорганических
показателей качества ливневых сточных вод за 2010-2011 гг.
Проведен ряд статистических анализов. Расчеты
показали, что установленные нормативы ПДК регулярно превышаются по такому
показателю как железо общее, и эпизодически превышаются по азоту аммонийному и
фосфатам.
По данным дисперсионного анализа содержание
железа общего в коллекторах Прудковский, Хатаевичский, Новый мост в 2010 и 2011
годах остается на одном уровне. В коллекторе Киевский спуск содержание железа
общего в 2011 г. снизилось на 23 %, а в коллекторе Лещинский, наоборот,
увеличилось на 64 %.
Содержание фосфатов в коллекторах Киевский спуск
и Лещинский в 2010 и 2011 годах не изменилось. В Прудковском и Хатаевичском
коллекторах в 2011 г. содержание фосфатов увеличилось на 62 % и 69 %
соответственно, а в коллекторе Новый мост - уменьшилось на 42 %. А содержание
азота аммонийного во всех коллекторах в 2010 и 2011 годах не изменилось.
Установлено, что за исследуемый период наиболее
загрязненными являлись сточные воды, отводимые через коллектора Хатаевичский и
Лещинский.
Содержание
Введение
1
Обзор литературы
1.1
Сточные воды, их классификация, предъявляемые требования,
предельно-допустимые
концентрации химических веществ
.2
Методы очистки сточных вод
.2.1
Коагуляция
.2.2
Адсорбция
.2.3
Химические методы очистки сточных вод
.2.4
Механическая очистка
.3
Физико-химические методы анализа сточных вод
.3.1
Водородный показатель рН
.3.2
Железо общее
.3.3
Марганец
.3.4
Аммонийные ионы и аммиак
.3.5
Фосфаты
.3.6
Хлориды
.
Объект, программа и методика исследований
.1
Общая характеристика городской застройки и ливневой канализации
.2
Методика отбора проб
.3
Методики количественного определения неорганических показателей в ливневых
сточных водах
.3.1
Железо общее
.3.2
Марганец
.3.3
Аммонийные ионы и аммиак
.3.4
Фосфаты
.3.5
Хлориды
.4
Методика выполнения измерений содержания марганца, железа методом
атомно-абсорбционной спектроскопии
.
Результаты исследований и их обсуждение
.1
Характеристика поверхностного стока с территории г. Гомеля
.1.1
Анализ содержания железа общего в коллекторах
.1.2
Анализ содержания марганца в коллекторах
.1.3
Анализ содержания азота аммонийного в коллекторах
.1.4
Анализ содержания фосфатов в коллекторах
.1.5
Анализ содержания хлоридов в коллекторах
.1.6
Анализ уровня рН в коллекторах
.2
Нормирование сбросов сточных вод в поверхностные водные объекты
.2.1
Расчет допустимых концентраций загрязняющих веществ
.2.2
Причины загрязнения поверхностного стока
Заключение
Список
использованных источников
загрязняющий сток качество водный
Введение
Воды, находящиеся на поверхности планеты
(материковые и океанические), образуют геологическую оболочку, называемую гидросферой.
Гидросфера находится в тесной связи с другими сферами Земли: литосферой,
атмосферой и биосферой. Водные пространства - акватории - занимают значительно
большую часть поверхности земного шара по сравнению с сушей. По современным
данным, акватория Мирового океана составляет 70,8 %, однако 95 % ее
сосредоточено в морях и океанах, 4 % - во льдах Арктики и Антарктики, 1 %
составляет пресная вода рек и озер. Кроме того, большие запасы воды имеются в
толще земли - это так называемые подземные воды.
Вода - ценнейший природный ресурс. Она играет
исключительную роль в процессах обмена веществ, составляющих основу жизни.
Огромное значение вода имеет в промышленном и сельскохозяйственном
производстве. Общеизвестна необходимость ее для бытовых потребностей человека,
всех растений и животных. Для многих живых существ она служит средой обитания.
Рост городов, бурное развитие промышленности, интенсификация сельского
хозяйства, значительное расширение площадей орошаемых земель, улучшение
культурно-бытовых условий и ряд других факторов все больше усложняет проблемы
обеспечения водой.
Потребности в воде огромны и ежегодно
возрастают. Много воды потребляют химическая и целлюлозно-бумажная
промышленность, черная и цветная металлургия. Развитие энергетики также
приводит к резкому увеличению потребности в воде. Значительное количество воды
расходуется для потребностей отрасли животноводства, а также на бытовые
потребности населения. Большая часть воды после ее использования для
хозяйственно-бытовых нужд возвращается в реки в виде сточных вод [1].
Вода постоянно находится в движении, перемещаясь
с течениями рек и морей, а также испаряясь с поверхности водоемов и выпадая
затем в виде атмосферных осадков. Она аккумулирует тепло, влияет на
распределение солнечной энергии на земле и образование различных по
климатическим особенностям районов. Вода водоемов способна самоочищаться и
обеззараживаться. Это сложный физико-химический процесс.
В последние годы во всех странах мира все более
пристальное внимание уделяется рассредоточенным источникам загрязнения, влияние
которых на качество водных объектов сопоставимо, а в отдельных случаях
превышает нагрузку от сосредоточенных сбросов сточных вод промышленных и
коммунально-бытовых предприятий [2, 3].
Поверхностный сток с урбанизированных территорий
- серьезный источник загрязнений. В короткий промежуток времени, когда
происходит вынос загрязняющих веществ с талыми, дождевыми, поливомоечными
водами, масса этих веществ может превышать массу веществ, поступающих в водные
объекты от сосредоточенных выпусков сточных вод. Кроме того, ливневые
коллектора, как правило, имеют выпуски в водные объекты в черте города, т.е.
практически в створе водопользования, что усугубляет экологическую ситуацию и
часто приводит к превышению установленных нормативов качества воды для
водотоков и водоемов соответствующего назначения [4, 5].
На балансе Коммунального унитарного предприятия
по содержанию дорог «ГорСАП» г. Гомеля находится преобладающая часть (19 из 21)
выпусков ливневых вод города.
Целью работы изучение формирования
поверхностного стока с городской территории и площадок промышленных предприятий
г. Гомеля, особенностей его химического состава и влияние на санитарное
состояние водных объектов.
Актуальность темы: Нормирование предельно
допустимых сбросов и концентраций загрязняющих веществ в сточных водах
водопользователей является одной из наиболее эффективных мер охраны водных
объектов от загрязнения. Оно способствует рациональному использованию водных
ресурсов, внедрению экологически чистых технологических процессов,
строительству эффективных очистных сооружений.
Практическое значение работы заключается в том,
что полученные данные могут быть использованы при разработке бассейновых
очистных сооружений ливневой канализации в прибрежной полосе озера Дедно. Результаты
исследований могут быть применены при преподавании химических дисциплин
(экологическая химия).
1. Обзор литературы
.1 Сточные воды, их классификация, предъявляемые
требования, предельно-допустимые концентрации химических веществ
Вода сточная - это вода, отводимая после
использования в хозяйственно-бытовой и производственной деятельности (кроме
карьерной, дренажной, шахтной, рудничной), а также отводимая с застроенной
территории, на которой она образовалась в результате выпадения атмосферных осадков.
Сточные воды, отводимые с территории
промышленных предприятий, условно разделяют на три вида:
) производственные - использованные в
технологическом процессе производства или получающиеся при добыче полезных
ископаемых (угля, нефти, руд); Бывают загрязненные и незагрязненные (условно
чистые);
) бытовые - от санитарных узлов производственных
и непроизводственных корпусов и зданий, а также от душевых установок, имеющихся
на территории предприятия;
) атмосферные - дождевые и от таяния снега.
Атмосферные осадки, называемые часто ливневыми
стоками, отводятся отдельной системой канализации или объединяются с
незагрязненными производственными сточными водами и могут в определенных
случаях сбрасываются в водоем без очистки. На химических предприятиях часто необходимо
предусматривать системы очистки и для ливневых стоков.
Выпуск производственных сточных вод в городскую
канализацию регламентируется следующими условиями:
) производственные сточные воды не должны
нарушать работу коммунальных сетей и сооружений;
) в них не должно содержаться более 500 мг/л
взвешенных и всплывающих веществ;
) они не должны содержать вещества, способные
засорять трубы канализационных сетей или отлагаться на стенках труб;
) не должны оказывать разрушающее действие на
материал труб и элементы сооружений канализации;
) не должны содержать горючие примеси и
растворенные газообразные вещества, способные образовывать взрывоопасные смеси
в канализационных сетях и сооружениях;
) не должны содержать вредных веществ в
концентрациях, препятствующих биологической очистке сточных вод или сбросу их в
водоем.
) производственные сточные воды должны иметь
температуру не выше 40°.
Производственные сточные воды, не
удовлетворяющие указанным требованиям, следует предварительно очищать,
охлаждать или разбавлять до требуемых сформулированными условиями параметров
[6, 7].
Характеристики бытовых и промышленных сточных
вод приведены в таблице 1.
Таблица 1 - Характеристика бытовых и
промышленных сточных вод [8]
|
Показатели
|
Бытовые
сточные воды
|
Промышленные
сточные воды
|
|
Происхождение
|
Образуются
в результате хозяйственно-бытовой деятельности и физиологических выделений
людей
|
Образуются
в результате технологических процессов на производстве, сопровождающихся
удалением отходов, потерей сырья и реагентов или готовой продукции
|
|
Количество
|
Ограничено
пределами водопотребления населения для физиологических и культурно-бытовых
нужд
|
Определяется
потребностями технологических процессов и характеризуется значительными
колебаниями
|
|
Внешний
вид
|
Однообразный
|
Крайне
различный
|
|
Режим
спуска
|
Ограниченная
степень неравномерности, определяющаяся бытовыми условиями жизни населения
|
Различный
- соответственно технологическому процессу; может быть весьма неравномерным
|
|
Взвешенные
вещества
|
Обнаруживают
постоянство по количеству и качеству
|
Крайне
разнообразны по количеству и качеству
|
|
Реакция
|
Нейтральная
или слабощелочная
|
От
резкощелочной до резко кислой, нередко меняющейся во времени
|
|
Химический
состав
|
Однообразный,
преобладают органические соединения животного или растительного происхождения
|
Различный,
могут преобладать органические синтетические вещества или минеральные
соединения
|
|
Токсичность
и бактерицидность
|
Не
свойственна
|
Может
обнаруживаться в различной степени
|
|
Типичность
состава и свойств
|
Заметно
выражена, колебания концентрации зависят от уровня водопотребления
|
Выражена
лишь для одинаковых производств
|
|
Показатели
|
Бытовые
сточные воды
|
Промышленные
сточные воды
|
|
Гигиеническое
значение
|
Преимущественно
эпидемиологическое значение, всегда общесанитарное
|
Преимущественно
общесанитарное значение, иногда эпидемиологическое, часто токсилогическое
|
|
Методы
обезвреживания
|
Биологические
на типовых сооружениях с дезинфекцией
|
Самые
разнообразные, часто химико-механические, дезинфекция исключена
|
Поверхностный сток с урбанизированных территорий
существенно отличается от сточных, сбросных и дренажных вод. Для поверхностного
стока характерны нестационарность воздействия при относительно высокой
интенсивности в течение коротких промежутков времени (половодные и паводковые
периоды), смещение высоких концентраций загрязняющих веществ к началу дождя или
к началу снеготаяния, повышенная загрязненность поливомоечных вод в маловодный
период, возможность выклинивания загрязненных подземных вод (вследствие
антропогенного воздействия в течение предыдущего, иногда многолетнего периода),
поступление в ливневую канализацию стоков различного химического состава с
территорий промышленных предприятий и т.п.
Промышленные предприятия, организации,
учреждения и другие субъекты хозяйствования г. Гомеля производят сброс промдождевых
сточных вод со своих территорий в городскую сеть ливневой канализации с
количеством загрязняющих веществ, превышающих установленные нормативы, при этом
нарушается работа канализационных сетей и сооружений, происходит загрязнение
окружающей среды.
Поверхностный сток с урбанизированных территорий
включает три качественно и количественно разнородных составляющих - дождевые
воды, талые воды и поливомоечные воды [9, 10].
Перечень загрязняющих веществ, выносимых
поверхностным стоком с урбанизированных территорий, весьма широк и сильно
отличается для талых, дождевых и поливомоечных вод. Здесь сказываются как
природные, так и антропогенные факторы. К последним относятся: благоустройство
территории, транспортные нагрузки, производственная ориентация промышленных
предприятий и т.д. По условиям формирования загрязненного поверхностного стока
его можно разделить на две основные категории:
сток с селитебной территории;
сток с площадок промышленных предприятий.
Сток с селитебных территорий (как дождевой, так
и талый) характеризуется повышенным содержанием взвешенных веществ,
нефтепродуктов и растворимых примесей в виде солей органического происхождения,
особенно азота и фосфора. Поверхностный сток с промплощадок по своему составу
может существенно отличаться в зависимости от технологии производства,
организации складского хозяйства, наличия локальных очистных сооружений и
других производственных факторов. Диапазон загрязняющих веществ в этом стоке
чрезвычайно широк. Следовательно, выбор лимитирующих ингридиентов более сложен.
Поверхностный сток г. Гомеля представляет собой
смесь стока с селитебной территории и стока с промплощадок [11].
Предельно-допустимая концентрация (ПДК)
химического вещества в воде водных объектов хозяйственно-питьевого и
культурно-бытового водопользования - гигиенический норматив, утверждаемый
постановлением Главного государственного санитарного врача Республики Беларусь.
ПДК - максимальная концентрация вещества в воде,
которая при поступлении в организм в течение всей жизни не должна оказывать
прямого или опосредованного влияния на здоровье населения в настоящем и
последующих поколениях, в том числе в отдаленные сроки жизни, а также не
ухудшать гигиенические условия водопользования.
Разработка ПДК веществ проводится в
подразделениях научных учреждений, высших учебных заведений, центрах гигиены и
эпидемиологии, получивших аккредитацию Министерства здравоохранения Республики
Беларусь.
Величины ПДК приведены в мг на 1 л воды (мг/л).
Наряду с величинами ПДК учитывают класс опасности, и лимитирующий показатель
вредности по которому установлена ПДК. Лимитирующий показатель вредности
учитывается при одновременном содержании нескольких веществ в воде. В случае
присутствия в воде нескольких веществ 1-2 классов опасности сумма отношений
фактических концентраций каждого из них (С1, С2,...,Сп) к их ПДК не должна
превышать единицы:
С1/ПДК1 + С2/ПДК2 + Сп/ПДКп ≤ 1
Вещества разделены на четыре класса опасности:
класс - чрезвычайно опасные;
класс - высоко опасные;
класс - опасные;
класс - умеренно опасные.
В основу классификации положены показатели,
характеризующие различную степень опасности для человека химических соединений,
загрязняющих воду, в зависимости от токсичности, кумулятивности, способности
вызывать отдаленные эффекты, лимитирующего показателя вредности.
Классы опасности веществ учитывают:
) при выборе соединений, подлежащих
первоочередному контролю в воде в качестве индикаторных веществ;
) при установлении последовательности
водоохранных мероприятий, требующих дополнительных капиталовложений;
) при обосновании рекомендаций о замене в
технологических процессах высоко опасных веществ на менее опасные;
) при определении очередности в разработке
чувствительных методов аналитического определения веществ в воде [6].
Гигиенические нормативы загрязняющих веществ
представлены в таблице 2.
Таблица 2 - Гигиенические нормативы загрязняющих
веществ [6]
|
Наименование
вещества
|
Величина
ПДК (мг/л)
|
Лимитирующий
показатель вредности
|
Класс
опасности
|
|
Марганец
|
0,1
|
органолептический,
придает воде окраску
|
3
|
|
Железо
|
0,3
|
органолептический,
придает воде окраску
|
3
|
|
Азот
аммонийный
|
2,0
|
санитарно-токсилогический
|
3
|
|
Хлориды
|
350
|
органолептический,
придает воде привкус
|
4
|
|
Фосфор
общий
|
0,0001
|
санитарно-токсилогический
|
1
|
.2 Методы очистки сточных вод
Очистка сточных вод является вынужденным и
дорогостоящим мероприятием, обусловленным тем, что в настоящее время
технологические процессы на промышленных предприятиях еще недостаточно
совершенны в отношении использования воды. Сегодня очистка сточных вод
рассматривается как основной способ охраны вод от загрязнения.
Вода обладает чрезвычайно ценным свойством
непрерывного самовозобновления под влиянием солнечной радиации и самоочищения.
Оно заключается в перемешивании загрязненной воды со всей ее массой и в
дальнейшем процессе минерализации органических веществ и отмирании внесенных
бактерий. Агентами самоочищения являются бактерии, грибы и водоросли.
Установлено, что в ходе бактериального самоочищения через
часа остается не более 50 % бактерий, через 96
часов - 0,5 %. Однако следует учитывать, что для обеспечения самоочищения
загрязненных вод необходимо их многократное разбавление чистой водой. При
сильном загрязнении самоочищения воды не происходит. В этих случаях необходимы
специальные методы и средства для улучшения качества воды, очистки загрязнений,
поступающих со сточными водами.
Основные способы улучшения качества воды для
хозяйственно-питьевых целей - осветление, обесцвечивание и обеззараживание.
Осветление воды - удаление из нее взвешенных
веществ. В зависимости от требуемой степени осветления применяют: отстаивание
воды в отстойниках, в гидроциклонах, осветление воды, пропуская ее через слой
ранее образованного взвешенного осадка, в осветлителях со взвешенным осадком,
фильтрование воды через слой зернистого или порошкообразного фильтрующего
материала в фильтрах или фильтрование через ткани и сетки.
Обесцвечивание воды - устранение или
обесцвечивание различных окрашенных коллоидов или истинно растворенных веществ.
Для этого воду подвергают коагулированию, используют различные окислители
(хлор, перманганат калия, озон) и сорбенты (активный уголь).
Обеззараживание воды проводят для уничтожения
содержащихся в ней болезнетворных бактерий и вирусов. Применяют чаще всего
хлорирование воды, бактерицидное облучение, озонирование и другие способы
обеззараживания. Используют и специальные способы обработки как
хозяйственно-питьевой, так и производственной воды, такие, как дезодорация -
удаление привкусов и запахов. При высоком содержании в воде железа или фтора
может потребоваться обезжелезивание. Нередко с обезжелезиванием воды проводят
удаление марганца [12, 13].
Очистных сооружений на ливневую канализацию в
городе Гомеле нет.
Методы очистки сточных вод в искусственных
условиях многообразны, но они могут быть подразделены на четыре основных вида:
механическую, химическую, физико-химическую и биохимическую очистку.
Использование физико-химических методов для
очистки сточных вод по сравнению с биохимическими имеет ряд преимуществ:
) возможность удаления из сточных вод токсичных,
биохимически неокисляемых органических загрязнений;
) достижение более глубокой и стабильной степени
очистки;
) меньшие размеры сооружений;
) меньшая чувствительность к изменениям
нагрузок;
) возможность полной автоматизации;
) более глубокая изученность кинетики некоторых
процессов, а также вопросов моделирования, математического описания и
оптимизации, что важно для правильного выбора и расчета аппаратуры;
) методы не связаны с контролем за деятельностью
живых организмов;
) возможность рекуперации различных веществ.
Выбор того или иного метода очистки производят с
учетом санитарных и технологических требований, предъявляемых к очищенным
производственным сточным водам с целью дальнейшего их использования, а также с
учетом количества сточных вод и концентрации загрязнений в них, наличия
необходимых материальных и энергетических ресурсов и экономичности процесса
[14].
1.2.1 Коагуляция
Коагуляция - процесс укрупнения дисперсных
частиц в результате их взаимодействия и объединения в агрегаты. В очистке
сточных вод ее применяют для ускорения процесса осаждения тонкодисперсных
примесей и эмульгированных веществ. Коагуляция наиболее эффективна для удаления
из воды коллоидно-дисперсных частиц, т.е. частиц размером 1-100 мкм. Коагуляция
может происходить самопроизвольно или под влиянием химических и физических
процессов. В процессах очистки сточных вод коагуляция происходит под влиянием
специальных веществ - коагулянтов. Коагулянты в воде образуют хлопья
гидроксидов металлов, которые быстро оседают под действием силы тяжести. Хлопья
обладают способностью улавливать коллоидные и взвешенные частицы и агрегировать
их. Так как коллоидные частицы имеют слабый отрицательный заряд, а хлопья
коагулянтов слабый положительный заряд, то между ними возникает взаимное
притяжение.
Для очистки производственных сточных вод
применяют различные минеральные коагулянты: соли алюминия, железа, магния,
известь, отработанные растворы отдельных производств.
Вместо коагулянтов можно применять водные
растворы полимеров, в молекуле которых содержаться полярные функциональные
группы (-ОН,
SO3H, -NH2). Их называют флокулянтами, а метод
очистки - флокуляцией. Флокуляция - вид коагуляции, при которой частицы,
содержащиеся в сточной воде, образуют рыхлые хлопьевидные агрегаты (флокулы).
Коагуляцию можно осуществить также, пропуская
сточные воды через электролизер с анодом, изготовленным из алюминия или железа.
Металл анода под действием постоянного тока переходит в сточную воду, образуя
труднорастворимые гидроксиды алюминия или железа, которые вызывают коагуляцию
частиц сточной воды. Метод электрохимического коагулирования может быть
применен для обработки сточных вод, содержащих эмульгированные частицы масел,
жиров и нефтепродуктов, хроматы, фосфаты. Эффективность очистки достигает 99 %
[15, 16].
1.2.2 Адсорбция
Адсорбционные методы широко применяют для
глубокой очистки сточных вод от растворенных органических веществ после
биохимической очистки, а также в локальных установках, если концентрация этих
веществ в воде невелика и они биологически не разлагаются или являются
сильнотоксичными. Применение локальных установок целесообразно, если вещество
хорошо адсорбируется при небольшом удельном расходе адсорбента.
Адсорбционная очистка вод может быть
регенеративной, т.е. с извлечением вещества из адсорбента и его утилизацией, и
деструктивной, при которой извлеченные из сточных вод вещества уничтожаются
вместе с адсорбентом. Эффективность адсорбционной очистки достигает 80 - 95 % и
зависит от химической природы адсорбента, величины адсорбционной поверхности и
ее доступности, от химического строения вещества и его состояния в растворе.
В качестве сорбентов используются активные угли,
синтетические сорбенты и некоторые отходы производства (золу, шлаки, опилки и
др.).
Скорость процесса адсорбции зависит от
концентрации, природы и структуры растворенных веществ, температуры воды, вида
и свойств адсорбента.
В общем случае процесс адсорбции складывается из
трех стадий [15, 16]: переноса веществ из сточной воды к поверхности зерен
адсорбента (внешне диффузионная область), собственно адсорбционный процесс,
перенос вещества внутри зерен адсорбента (внутри диффузионная область).
1.2.3 Химические методы очистки сточных вод
Нейтрализация.Сточные воды, содержащие
минеральные кислоты или щелочи, перед сбросом их в водоемы или перед использованием
в технологических процессах нейтрализуют. Практически нейтральными считаются
воды, имеющие рН=6,5-8,5.
Нейтрализацию можно проводить различным путем:
смешением кислых и щелочных вод, добавлением реагентов, фильтрованием кислых
вод через нейтрализующие материалы, абсорбцией кислых газов щелочными водами
или абсорбцией аммиака кислыми водами. Выбор метода нейтрализации зависит от
объема и концентрации сточных вод, от режима их поступления, наличия и
стоимости реагентов. В процессе нейтрализации могут образовываться осадки,
количество которых зависит от концентрации и состава сточных вод, а также от
вида и расхода используемых реагентов.
Нейтрализация путем добавления реагентов. Для
нейтрализации кислых вод могут быть использованы: NaOH, KOH, Na2CO3, NH4OH
(аммиачная вода), СаСО3, МgCO3, доломит (CaCO3*MgCO3), цемент. Однако наиболее
дешевым реагентом является гидроксид кальция (известковое молоко) с содержанием
активной извести Са(ОН)2 5-10 %. Соду и гидроксид натрия следует использовать,
если они являются отходами производства.
Нейтрализация кислыми газами. Для нейтрализации
щелочных сточных вод в последнее время начинают использовать отходящие газы,
содержащие СО2, SO2, NO2, N2O3 и другие. Применение кислых газов позволяет не
только нейтрализовать сточные воды, но и одновременно производить
высокоэффективную очистку самих газов от вредных компонентов.
Нейтрализация щелочных вод дымовыми газами
является примером ресурсосберегающей технологии, позволяющей исключить
использование кислот, создать бессточную схему водопотребления. При этом
ликвидируется сброс сточных вод, сокращается потребление свежей воды, а также
очищаются дымовые газы от кислых компонентов (СО2, SО2 и др.) и пыли.
Озонирование. Окисление озоном позволяет
одновременно обеспечить обесцвечивание воды, устранение привкусов и запахов и
обеззараживание. Озонированием можно очищать сточные воды от фенолов,
нефтепродуктов, сероводорода, соединений мышьяка, ПАВ, цианидов, красителей,
канцерогенных ароматических углеводородов, пестицидов и др.
Озон подают в сточную воду в виде
озоно-воздушной или озоно-кислородной смеси. Концентрация озона в смеси около 3
%. Озонирование представляет собой процесс абсорбции, сопровождаемый химической
реакцией в жидкой фазе.
Процесс очистки сточных вод значительно сокращается
при совместном использовании ультрозвука и озона, ультрофиолетового облучения и
озона. Ультрофиолетовое облучение ускоряет окисление в 102 -104 раз.
Удаление ионов тяжелых металлов. Во многих
отраслях промышленности перерабатывают или применяют различные соединения
ртути, хрома, кадмия, цинка, свинца, меди, никеля, мышьяка и другие вещества,
что ведет к загрязнению ими сточных вод.
Для удаления этих веществ из сточных вод в
настоящее время наиболее распространены реагентные методы очистки, сущность
которых заключается в переводе растворимых в воде веществ в нерастворимые при
добавлении различных реагентов с последующим отделением их от воды в виде
осадков.
Недостатком реагентных методов очистки является
безвозвратная потеря ценных веществ с осадками.
В качестве реагентов для удаления из сточных вод
ионов тяжелых металлов используют гидроксиды кальция и натрия, карбонат натрия,
сульфиды натрия, различные отходы (феррохромовый шлак). Наиболее широко
используется гидроксид кальция. Осаждение металлов происходит в виде
гидроксидов. Процесс проводится при различных значениях рН.
Значения рН, соответствующие началу осаждения
гидроксидов различных металлов и полному осаждению зависят от природы металлов,
концентрации их в растворе, температуры, содержания примесей.
Очистка от солей железа. В природных водах
содержание железа колеблется от 0,01 до 26 мг/л3 . Кроме того, железо
содержится в сточных водах химических, металлургических, машиностроительных,
нефтехимических, металлообрабатывающих, текстильных, химико-фармацевтических и
других производств. При содержании железа более 1 мг/л вода приобретает бурый
цвет. При движении такой воды по трубопроводам на их стенках откладываются
соединения железа и железобактерии, уменьшая сечение трубопровода.
В водоемах ПДК солей железа в пересчете на Fe2+
равняется 0,5 мг/л. В то же время, в некоторых производствах технологическая
вода и вода, находящаяся в обороте, не должна содержать соединений железа более
,05 мг/л, например в производстве капрона,
нейлона, целлофана, натурального и вискозного шелка, кинопленки, электроники,
полупроводников и др. Для указанных производств требуется глубокая очистка
природных сточных вод от соединений железа.
Для обезжелезивания вод применяют аэрацию,
реагентные методы, электродиализ, адсорбцию, обратный осмос.
В процессе аэрирования происходит окисление
двухвалентного железа в трехвалентное. Реакция окисления в водном растворе
протекает по схеме
4Fe2++O2+2H2O=4Fe3++4OH-;Fe3++3H2O=Fe(OH)3+3H+
или суммарно 4Fe2++O2+10H2O= Fe(OH)3+8H+.
В присутствии гидрокарбонатных ионов в воде
окисление двухвалентного железа и гидролиз трехвалентного железа протекает по
реакции 4Fe2++8HCO3-+2H2O=4Fe(OH)3¯+8CO2.
На окисление 1 мг двухвалентного железа
расходуется 0,143 мг кислорода. Для обеспечения высокой скорости химической
реакции содержание кислорода в воде должно быть 0,5-0,9 мг на 1 мг железа.
После аэрирования необходимо отделить осадок
гидроксида железа. Для этой цели используют процессы отстаивания и
фильтрования.
При высоком содержании железа в воде аэрационным
методом его полностью удалить нельзя, поэтому применяют реагентные методы. Для
этой цели используют хлор, хлорат кальция (хлорную известь), перманганат калия,
озон, оксид кальция (известь), карбонат натрия (соду) и др.
При взаимодействии с хлором протекает следующая
реакция:
Fe(HCO3)2+Cl2+Ca(HCO3)2 ®
2Fe(OH)3¯+CaCl2+6CO2.
Скорость этой реакции увеличивается с повышением
рН. На окисление
мг двухвалентного железа расходуется 0,64 мг Cl2
. В случае использования хлората кальция его используют в виде 1-2 % раствора,
который дозируют непосредственно в сточную воду.
Если железо содержится в воде в виде
органических соединений или коллоидных частиц, применяют озонирование. При этом
на 1 масс. ч. железа требуется 1 масс. ч. озона.
Очистка от соединений марганца.Соединения
марганца содержатся в сточной воде металлургических, машиностроительных и
химических производств. При концентрации марганца более 0,05 мг/л вода
окрашивается в темный цвет. Удаление из воды марганца может быть достигнуто следующими
методами: 1) обработкой воды перманганатом калия; 2) аэрацией, совмещенной с
известкованием; 3) фильтрованием воды через марганцевый песок или марганцевый
катионит; 4) окисление озоном, хлором или диоксидом хлора.
Наиболее эффективным является метод обработки
перманганатом калия. Он не требует сложного оборудования и просто
контролируется. При обработке воды перманганатом калия достигается
одновременная очистка от марганца и от железа [14, 17].
.2.4 Механическая очистка
Механическая очистка применяется [12], прежде
всего, для отделения твердых и взвешенных веществ.
Процеживание - первичная стадия очистки сточных
вод - вода пропускается через специальные металлические решетки с шагом 5-25
мм, установленные наклонно. Периодически они очищаются от осадка с помощью
специальных поворотных приспособлений.
Отстаивание происходит в специальных емкостях,
которые по направлению движения воды делят на горизонтальные, вертикальные,
радиальные и комбинированные. Общими для них являются выход очищенной воды в верхней
части отстойника и гравитационный принцип осаждения частиц, которые собираются
внизу. Разновидностью отстойника являются песколовки.
Инерционное разделение осуществляется в
гидроциклонах. Различают открытые и напорные гидроциклоны. Обладают большой производительностью,
но проигрывают в эффективности очистки (особенно мелких частиц).
Фильтрование осуществляется чаще всего через
пористые связанные или несвязанные материалы. Как правило, фильтры очищают воду
от тонкодисперсных примесей даже при небольших концентрациях. Фильтроматериалы
достаточно разнообразны: кварцевый песок, гравий, антрацит, частички металлов и
др. Песчаные фильтры - основные очистители при водоподготовке.
1.3 Физико-химические методы анализа сточных вод
.3.1 Водородный показатель рН
В большинстве природных вод концентрация
водородных ионов обусловлена лишь отношением концентраций свободной двуокиси
углерода и бикарбонат-ионов. В этих случаях рН колеблется от 4,5 до 8,3. На
величину рН может оказать влияние повышенное содержание гуминовых веществ,
основных карбонатов и гидроокисей, возникающих вследствие поглощения СО2 в
процессе фотосинтеза, а в отдельных случаях - также и повышенное содержание
солей, подверженных гидролизу, и прочие. В сточных и загрязненных поверхностных
водах, кроме того, могут содержаться и сильные кислоты и основания.
В результате происходящих в воде реакций рН
часто может изменяться, поэтому рекомендуется проводить определение немедленно
после отбора пробы. Если это невыполнимо, следует доставлять пробу к месту анализа
в особой бутылке (полимер или стекло), предохраняя ее от нагревания. Обработку
следует проводить лишь в кратчайший срок.
Результаты определений выражаются в рН и лишь в
исключительных случаях - в миллиграмм-эквивалентах водородных или гидроксильных
ионов в 1 литре.
Электрометрическое определение рН.
Электрометрическое определение рН со стеклянным
электродом основано на том, что изменение значения рН на единицу в определенной
области рН вызывает изменение потенциала электрода на 58,1 мв при 20°С.
Пределы линейной зависимости потенциала электрода от рН обусловлены свойствами
стеклянного электрода.
Мешающие влияния. Результат определения зависит
от температуры пробы. Влияние температуры компенсируется специальным
устройством, вмонтированным в прибор. Если такой прибор отсутствует, то пробу
можно нагреть или охладить до требуемой температуры (20 °С).
Электрометрическому измерению не мешают:
окраска, мутность, взвесь, свободный хлор, присутствие окисляющих или
восстанавливающих веществ или повышенное содержание солей в пробе.
Некоторые помехи возникают при повышенном
содержании солей натрия и при рН больше 10. В таких случаях необходимо
пользоваться специальным электродом или же вводить поправки, указанные в
инструкции, приложенной к электроду.
Точность электрометрического определения
снижается при пользовании загрязненными электродами. Для обезжиривания
электрода пользуются куском тонкой материи, смоченной эфиром или раствором
моющего средства. Затем несколько раз промывают электрод дистиллированной водой
и вытирают его каждый раз для удаления обезжиривающего вещества. При
необходимости электрод регенерируют, погружая его на 2 ч. в 2 %-ный раствор
соляной кислоты, и тщательно промывают дистиллированной водой. В нерабочее
время электрод следует хранить в дистиллированной воде [18].
1.3.2 Железо общее
В некоторых сточных водах железо встречается в
больших концентрациях, например в сточных водах травильных цехов, производства
солей железа, иногда в сточных водах цехов крашения тканей и т.д. В больших
концентрациях железо может содержаться также и в шахтных водах. В
профильтрованных природных поверхностных водах концентрация железа редко
достигает 1 мг/дм3.
Железо в водах может быть во многих формах: в
истинно растворенном состоянии и в виде коллоидного раствора вследствие
пептизации гидроксида железа органическими веществами; в виде комплексных
соединений с неорганическими и органическими лигандами, в различных
суспендированных в воде твердых частицах. Наконец оно может быть в
трехвалентном и в двухвалентном состояниях. При рН >
3,5 железо (ІІІ) может быть в одной фазе только в виде комплекса, а при рН >
8 не может существовать в растворе в виде свободных ионов, несвязанных в
комплекс, и железо (ІІ). Надо также учитывать то, что в воде, содержащей
кислород, железо (ІІ) легко переходит в железо (ІІІ) и осаждается в виде
гидроксида. Железо (ІІ) достаточно устойчиво в водном растворе только в
сильнокислой среде.
Таким образом точные результаты могут быть
получены только при определении суммарного содержания железа во всех его
формах. Раздельное определение растворенного и нерастворенного железа, а также
железа (ІІ) и железа (ІІІ) дает менее достоверные результаты.
Фотометрический метод с сульфосалицилатом натрия
[19].
Сущность метода. Метод основан на том, что
сульфосалициловая кислота или ее натриевая соль образуют с солями железа
окрашенные комплексные соединения, причем в слабокислой среде сульфосалициловая
кислота реагирует только с солями железа (ІІІ) (красное окрашивание), а в
слабощелочной среде - с солями железа (ІІІ) и (ІІ) (желтое окрашивание).
1.3.3 Марганец
Фотометрический метод
Сущность метода. Метод основан на количественном
окислении ионов марганца (II) до перманганат-ионов в
азотнокислой среде действием персульфата аммония в присутствии катализатора - ионов
серебра.
Оптическую плотность полученного
красно-фиолетового раствора измеряют при l= 525 нм, e
=24×103.
Метод дает возможность определять марганец в
концентрациях от 0,05 до 5 мг/л. При большей или меньшей концентрации марганца
в пробе ее соответственно предварительно упаривают или разбавляют.
Мешающие вещества. Мешают определению
органические вещества при большой их концентрации ( ХПК превышает 16 мг/л),
хлорид-ионы и железо, если его концентрация превышает 5 мг/л. Для устранения
мешающего действия хлорид-ионов, если концентрация их не превышает 300 мг/л,
предлагается вводить раствор соли ртути (II), образующей с
хлорид-ионами мало диссоциированное соединение.
При более высоком содержании хлорид-ионов, а
также при высоком содержании органических веществ проводят предварительную
обработку азотной и серной кислотами. При меньшем содержании органических
веществ можно ограничиться кипячением пробы
-10 мин с добавлением 10 мл концентрированной
азотной кислоты на 100 мл.
Мешающее влияние железа устраняют добавлением 1
мл концентрированной фосфорной кислоты в пробу до окисления персульфатом [20].
1.3.4 Аммонийные ионы и аммиак
Анализируемую сточную воду приводят к рН=7,4,
прибавляя соответствующую фосфатную буферную смесь, и отгоняют аммиак,
присутствовавший в этой воде, как в свободном виде, так и в виде ионов аммония.
В приемник помещают раствор борной кислоты и по окончании отгонки аммиака отгон
титруют 0,02 н раствором серной кислоты, проводят колориметрическое
определение.
Применение сильной щелочи для отгонки аммиака
недопустимо при анализе вод, содержащих белковые или другие вещества,
разлагающиеся в этих условиях с выделением аммиака. При анализе сточных вод,
содержащих относительно большие количества фенолов, требуется более сильное
подщелачивание для связывания фенолов, что достигается прибавлением едкой
щелочи.
В водах, подвергавшихся обработке хлором или
гипохлоритом, наряду с ионами аммония могут присутствовать хлор-амины. Их
следует восстановить до ионов аммония и хлорид-ионов добавлением тиосульфата
или арсенита и, определив отдельно, пересчитать на NН4+ и вычесть из результата
определения аммонийных ионов.
Мешают определению сульфид-ионы. При их
присутствии в пробу перед отгонкой вводят немного карбоната свинца.
Колориметрическому определению мешают
алифатические и ароматические амины, ацетон, альдегиды и спирты. Они вызывают
появление желтоватых или зеленоватых окрасок или же образование мути. Все
нейтральные летучие соединения, мешающие определению, надо предварительно
удалить подкислением анализируемой воды и отгонкой [21].
1.3.5 Фосфаты
В сточных водах, как и в природных водах, фосфор
может присутствовать в различных видах. В жидкой фазе анализируемой воды он
может быть в виде ортофосфорной кислоты и ее ионов (Н3РО4, Н2РО4-, НРО42-,
РО43-), в виде мета-, пиро- и полифосфатов (эти вещества используют для
предупреждения образования накипи, они входят в состав многих моющих средств в
смеси с синтетическими поверхностно-активными веществами) и в виде
разнообразных фосфоросодержащих органических соединений (нуклеиновые кислоты,
нуклеопротеиды, фосфолипиды и др.).
В твердой фазе сточной воды фосфор может быть в
виде различных труднорастворимых фосфатов, включая природные минералы, и в виде
многих других фосфорсодержащих органических веществ. Все виды фосфора надо
определять по возможности непосредственно после отбора пробы. Часть пробы
фильтруют, желательно через самый плотный мембранный фильтр, в крайнем случае
через плотный бумажный фильтр, и в фильтрате определяют содержание растворимых
форм фосфора. Другую часть пробы гомогенизируют и находят в ней суммарное
содержание всех форм фосфора - «общий фосфор». В некоторых случаях особенно при
большом содержании органических веществ, находят «общий фосфор» в
профильтрованной части пробы, в ее жидкой фазе. Биохимические процессы в пробе
можно приостановить прибавлением 2 -4 мл хлороформа на 1 л пробы.
Консервирование пробы подкислением недопустимо.
Фотометрический метод определения растворенных
ортофосфатов [20].
Сущность метода. При взаимодействии ортофосфат-ионов
с молибдатом в кислой среде образуется желтая гетерополикислота, которая под
действием восстановителей превращается в интенсивно окрашенное синее
соединение. Были предложены различные восстановители, но из них наиболее
устойчивые, постоянные по составу продукты реакции дает лишь аскорбиновая
кислота. Однако восстановление аскорбиновой кислотой, сравнительно слабым
восстановителем, происходит только при повышенной температуре, т.е. в условиях,
когда полифосфаты и органические эфиры фосфорной кислоты гидролизуются с
образованием ортофосфорной кислоты, поэтому результаты получаются повышенными.
Введение в раствор соли сурьмы в соотношении : P = 1:1. Реакция тогда
происходит быстро и при комнатной температуре, повышается интенсивность
окраски, а полифосфаты и сложные эфиры фосфорной кислоты в этих условиях в
реакцию не вступают, результаты показывают лишь содержание ортофосфат-ионов в
пробе.
Оптическую плотность измеряют при λ=880
нм
или, если это невозможно, при наибольшей длине волны, которую допускает
использовать применяемый фотометр.
Мешающие вещества. Сильнокислые и сильнощелочные
пробы предварительно нейтрализуют. Определению мешают сульфиды и сероводород в
концентрациях, превышающих 3 мг/л S2- . Мешающее влияние можно устранить,
прибавляя несколько миллиграммов KMnO4 на 100 мл пробы и встряхивая 1-2 мин;
раствор должен оставаться розовым. Затем прибавляют требуемые для определения
реактивы, но в обратном порядке: сначала приливают раствор молибдата. В
предлагаемом варианте метода такой измененный порядок прибавления реактивов на
результате не отражается.Определению мешают также хроматы в концентрациях,
превышающих 2 мг/л CrO42-. Это мешающее влияние также устраняется прибавлением
реактивов в обратном порядке, как и в предыдущем случае. Мешают определению
арсенаты. Обычно в водах арсенаты отсутствуют или находятся в количествах,
значительно меньших, чем фосфаты, и содержанием их можно пренебречь. В
противном случае надо определять отдельно и вычесть полученный результат из
результата определения фосфатов. Мешающее влияние нитритов устраняют
сульфаминовой кислотой, которую вводят в состав применяемого реактива. При
большом содержании железа следует ввести эквивалентное количество ЭДТА.
.3.6 Хлориды
Меркуриметрический метод [20, 21].
Сущность метода. Хлорид-ионы образуют с ионами
ртути (II) чрезвычайно мало диссоциированный хлорид ртути (II):+ + 2Cl- →
HgCl2
В качестве индикатора применяют дифенилкарбазон,
который в конце титрования образует с избыточными ионами ртути (II) окрашенное
в фиолетовый цвет комплексное соединение. Титрование проводят в азотнокислой
среде при рН=2,5±0,1.
Прямым титрованием можно определять хлорид-ионы
в концентрациях от 5 до 100 мг/л. При концентрациях ниже 10 мг/л все же
рекомендуется предварительное упаривание пробы, при концентрациях выше 100 мг/л
- разбавление.
Резкость перехода окраски индикатора в
значительной мере зависит от соблюдения правильного значения рН раствора. При
рН=2,0 индикатор не окрашивается, при рН=3,0 появление окраски запаздывает.
Мешающие вещества. Вместе с хлоридами титруются
бромиды и иодиды. Их можно определить отдельно соответствующими методами и
содержание их вычесть из результатов титрования. Сульфит-, тиосульфат-,
сульфид-, роданид- и цианид-ионы, мешающие определению, следует предварительно
окислить кипячением с пероксидом водорода в щелочной среде. Органические
вещества в большой концентрации мешают определению. Их следует предварительно
удалить или окислить перманганатом калия в щелочной среде с последующим
восстановлением пероксидом водорода и отфильтровыванием осадка водного диоксида
марганца. Мешает железо (III) в концентрациях, превышающих 10 мг/л; его следует
связать добавлением нескольких капель 5%-ного раствора фосфата натрия. Мешают
ионы цинка, свинца, алюминия, никеля и хрома (III) в концентрациях, превышающих
100 мг/л, а хромат ионы в концентрациях выше 2 мг/л.
2. Объект, программа и методика исследований
Объектом исследований являются ливневые сточные
воды в коллекторах Прудковский, Хатаевичский, Киевский спуск, Новый мост,
Лещинский.
Предметом исследований качественный состав
ливневых сточных вод, отводимых выше указанными коллекторами в реку Сож.
Программа исследований включала в себя следующие
задачи:
) теоретическое изучение проблемы по
литературным источникам и ознакомление с методикой исследований;
) проведение плановых экспериментальных
исследований по определению неорганических показателей качества воды;
) математическая обработка данных и оценка
качества ливневых сточных вод;
) оформление дипломной работы.
Исследования проводились в период 2010−2011
гг. в г. Гомеле.
Полученные результаты были статистически
обработаны с помощью общепринятых методов с помощью пакетов прикладных программ
Statistica 6 и MS Excel [22].
2.1 Общая характеристика городской застройки и
ливневой канализации
Город Гомель расположен на юго-востоке
Республики Беларусь. Площадь города составляет 11,3 тыс. км2. Население - 498,7
тыс. человек (по данным на 01.01.2010 г.). В городе 4 административных района:
Железнодорожный, Новобелицкий, Советский и Центральный.
Застройка территории города относительно
дождевой канализации не однородна. В кварталах старой застройки, как правило,
организованный сток дождевых вод отсутствует. Поверхностный сток по
спланированной территории отводится на улицы и проезды и далее в водостоки либо
в сеть дождевой канализации. Новая жилая застройка имеет сеть дождевой
канализации, оборудованной дождеприемниками внутри кварталов и микрорайонов.
Для городской застройки г. Гомеля характерно
преобладание техногенных и техногенно-природных ландшафтов, что уменьшает
самоочистительную способность природного комплекса на территории города.
Промышленные предприятия, как правило, имеют
сеть дождевой канализациии на своих промплощадках с подключением ее к
общегородским сетям и магистральным коллекторам.
Общая протяженность сетей дождевой канализации
г. Гомеля составляет 274,7 км, из которых чуть более 230 км - сети дождевой
канализации, находящиеся на балансе КАУП «ГорСАП», а 45,3 км - сети дождевой
канализации на балансе предприятий и ведомств (по данным БТИ).
В настоящее время сеть ливневой канализации
Гомеля имеет 21 выпуск в бассейне реки Сож, 19 из которых контролируется КАУП
по содержанию дорог «ГорСАП». В зависимости от места выпусков все коллектора
дифференцированы по 4 группам:
Выпуски в р. Сож - 12 коллекторов: Прудковский,
Хатаевичский, Речной порт, ул. Билецкого, Киевский спуск, Лебяжье озеро, Лесной
склад «Монастырек», Лещинский, ул. Международная - 11 Июля, Новый мост, 5а -
5-ый микрорайон, ул. Ченковская - Зайцева.
Выпуски в р. Уза - 1 коллектор: Мильчанский.
Выпуски в озеро Шапор - 1 коллектор: ФСК.
Выпуски в болото - 2 коллектора: ул. Дорожная,
Областная больница.
Выпуски в мелиоративные канавы, не достигающие
речной сети -
коллектора: ул. 8-я Техническая, Кристалл,
АвтоВАЗ.
Наиболее крупными выпусками дождевой канализации
являются
коллектора: Мильчанский, Прудковский и
Хатаевичский.
Поверхностные воды г. Гомеля представлены более
чем 30 водными объектами: реками, озерами, прудами. Крупнейшим водным объектом
на территории города является р. Сож, левый приток Днепра. В восточной части
города в р. Сож впадает левый приток - р. Ипуть. В пределах пригородной зоны
Гомеля в 5 км к югу от города справа в р. Сож впадает р. Уза.
В пойме р. Сож в пределах городской черты
расположено несколько старичных озер. В северо-восточной части города на
протоке Волотова выделяются 2 старичных озера (площадь 22 и 18 га), к западу от
них расположено озеро Дедно. В южной части, с правого берега Сожа, протянулось
длинное Любенское озеро (площадь 14 га), на левобережье находятся 2 не совсем
отчленившихся от русла Сожа старицы, которые называются так же, как и рядом
расположенное озеро Шапор.
В пределах городской черты расположены
многочисленные пруды. В возвышенной правобережной части города они образовались
в карьерах, возникших в результате выемки сырья для кирпичных заводов, в
пойменной части - на местах добычи песка для сооружения оснований под жилые и
общественно-культурные здания (жилой массив Волотова, микрорайоны в
юго-западной части города). В Гомельском парке находится старейший в Гомеле
пруд «Лебяжье озеро».
На территории города значительное количество
каналов и канав. Крупнейшим каналом является Гребной канал, образовавшийся при
добыче песка и гравия в пойме Сожа. В настоящее время Гребной канал используется
для занятий спортивной греблей. Крупнейшие канавы - Мильчанская, Лещинская. На
территории города существует развитая сеть мелиоративных каналов. В настоящее
время эти гидротехнические сооружения являются элементами сети дождевой
канализации.
Река Сож является самым крупным водотоком на
территории г. Гомеля. Сож делит город на возвышенную правобережную и низменную
левобережную (Новобелицкий район) части.
Качество вод реки в пределах города Гомеля
формируется под воздействием отведения сточных вод через систему дождевой
канализации, поскольку выпуски производственных сточных вод в русло реки в
черте города (РУП «Гомсельмаш», ТЭЦ-1 и ДОК ОАО «Гомельдрев») не оказывают
существенного влияния на качество вод.
Ряд природных водоемов в пределах г. Гомеля также
испытывают значительную антропогенную нагрузку вследствие отведения в них
поверхностных сточных вод. Наибольший антропогенный пресс приходится на озеро
Дедно, которое фактически выполняет функции природного отстойника
поверхностного стока [23].
Схема расположения коллекторов г. Гомеля
представлена на рисунке 1. На рисунке представлены все 19 коллекторов,
находящихся на балансе КАУП «ГорСАП», с соответствующей нумерацией:
Коллектор Прудковский;
Коллектор Хатаевичский;
Коллектор Речной порт;
Коллектор с улицы Билецкого;
Коллектор Киевский спуск;
Коллектор Лебяжье озеро;
Коллектор с улицы Дорожная;
Коллектор Лесной склад «Монастырек»;
Коллектор с улиц Международная - Зайцева;
Коллектор ФСК;
Коллектор Новый мост;
Коллектор 5а-5 микрорайон;
Коллектор Областная больница;
Коллектор с улицы 8-я Техническая;
Коллектор Кристалл;
Коллектор АвтоВАЗ;
Коллектор с улиц Ченковская - Зайцева;
Коллектор Мильчанский.
2.2 Методика отбора проб
Отбор проб. Целью отбора проб является получение
дискретной пробы, отражающей качество исследуемой воды.
Отбор проб проводят для:
) исследования качества воды для принятия
корректирующих мер при обнаружении изменений кратковременного характера;
) исследования качества воды для установления
программы исследований или обнаружения изменений долгосрочного характера;
) определения состава и свойств воды по
показателям, регламентированным в нормативных документах;
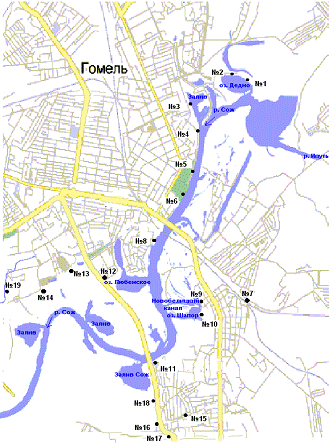
Рисунок 1 - Схема расположения коллекторов в г.
Гомеле
) идентификация источников загрязнения водного
объекта.
Все процедуры проб должны быть строго
документированы. Записи должны быть четкими, осуществлены надежным способом,
позволяющим провести идентификацию пробы в лаборатории без затруднений.
При отборе проб должны строго соблюдаться
требования безопасности, отвечающие действующим нормам и правилам. К местам
отбора проб должен быть свободный доступ. Места отбора проб должны быть
стационарно оборудованы водопользователями и обеспечить безопасный отбор проб в
любое время года.
Пробы сточных вод следует отбирать в
турбулентных, хорошо перемешанных потоках на прямолинейных участках
водоотводящих устройств вне зон действия подпора. Если нет возможности
обеспечить турбулентное перемешивание жидкости, следует производить отбор в нескольких
местах по сечению потока и составлять среднюю пробу.
При сборе сточных вод в водные объекты через
глубинные выпуски отбор проб следует проводить в последнем колодце вне зон
действия подпора. Если сточные воды поступают в водоем через сливное устройство,
то проба отбирается непосредственно из падающей струи.
Место отбора сточных вод, отводимых в водный
объект, выбирается у выпуска сточных вод в водный объект. Пробу отбирают
пробоотборником на глубине 0,3-0,5 м от поверхности, а в зимний период у нижней
кромки льда. Не допускается отбор проб стоячей воды, в изгибах, глухих рукавах
и т.п.
Устройства для отбора проб должны удовлетворять
требования: материалы пробоотборного устройства, контактирующие с отбираемой
пробой, не должны искажать ее состава и свойства; иметь гладкие поверхности;
минимизировать время контакта между пробой и пробоотборником. Перед отбором
проб посуду, в которую ее набирают надо 2-3 раза ополоснуть анализированной
водой.
Транспортировка проб сточной воды осуществляется
любым видом транспорта, обеспечивающим сохранность проб и их быструю доставку,
кроме общественного. Транспортировка должна быть организована таким путем,
чтобы исключить перегрев и переохлаждение пробы [24, 25].
2.3 Методики количественного определения
неорганических показателей в ливневых сточных водах
.3.1 Железо общее
Фотометрический метод с сульфосалицилатом натрия
Ход определения. Определение общего содержания
железа.В коническую колбу вместимостью 50 мл наливают 10 мл анализируемой воды.
В этом объеме должно содержаться от 1 до 10 мкг железа, что соответствует
концентрациям от 0,1 до 1 мг/л. Более концентрированные по содержанию железа
сточные воды предварительно разбавляют в мерной колбе так, чтобы содержание
железа в
мл полученного раствора было указанных пределах.
Затем в пробирку приливают 5 мл раствора сульфосалицилата натрия или
сульфосалициловой кислоты, 5 мл раствора аммиака и перемешивают.
Измеряют оптическую плотность полученного
раствора при
l = 420-430 нм по отношению к холостому раствору.
Молярный коффициент поглощения равен 5,5 × 103 .
Содержание железа находят по калибровочной
кривой, для построения которой наливают из микробюретки 0,1; 0,2; ..., 1,0 мл
стандартного раствора железа, разбавляют до 10 мл дистиллированной водой и
продолжают, как при анализе пробы.
Определение железа (III).
Это определение можно проводить только в тех случаях, когда пробу специально не
обрабатывают с целью разрушения органических комплексных соединений, потому что
при такой обработке железо (II) переходит в железо (III).
Определение проводят также, как и определение
общего содержания железа, за исключением того, что анализируемый раствор
предварительно нейтрализуют, определив необходимое количество щелочи
титрованием отдельной порции пробы, и вместо раствора аммиака вводят в
анализируемый раствор 0,1 мл соляной кислоты. Оптическую плотность измеряют при
l= 520 нм. Калибровочную кривую строят в таких же
условиях [19].
Реактивы.Сульфосалициловая кислота, 10 % раствор
или сульфосалицилат натрия, насыщенный раствор. Сульфосалицилат натрия можно
приготовить в лаборатории из салициловой кислоты следующим способом. При
нагревании и перемешивании 138 г салициловой кислоты обрабатывают 56 мл серной
кислоты пл. 1,84 г/см3, прибавляя ее осторожно небольшими порциями. Когда масса
приобретает однородный желто-розовый цвет, нагревание прекращают. По охлаждении
к полученной сульфосалициловой кислоте приливают двукратный объем насыщенного
раствора хлорида натрия. Образовавшийся сульфосалицилат натрия отделяют на
фарфоровой воронке (воронке Бюхнера) и промывают сначала насыщенным раствором
хлорида натрия, потом 2-3 раза холодной водой, после чего высушивают в
сушильном шкафу при 60-70 °С.
Аммиак, разбавленный раствор. Смешивают 200 мл
концентрированного аммиака с 300 мл воды.
Стандартный раствор соли железа. Растворяют
0,8634 г железоаммонийных квасцов в дистиллированной воде, к раствору добавляют
мл серной кислоты пл. 1,84 г/см3 и разбавляют в
мерной колбе водой до 1 л. Отбирают 100 мл полученного раствора, разбавляют
водой в мерной колбе снова до 1 л. В 1 мл раствора содержится 0,01 мг железа.
Соляная кислота, разбавленный (3:2) раствор.
2.3.2 Марганец
Фотометрический метод
Ход определения. К 100 мл пробы, если надо
предварительно разбавленной или упаренной, приливают 3 мл концентрированной
азотной кислоты и такой объем 0,1 н раствора нитрата ртути (II),
чтобы он был эквивалентен содержанию хлорид-ионов во взятой пробе, и сверх того
еще
мл. Добавляют, если надо фосфорную кислоту,
нагревают до кипения, прибавляют 5 мл раствора персульфата аммония, 2 капли
раствора нитрата серебра и кипятят 5 мин.
По охлаждении раствора переносят его в мерную
колбу вместимостью 200 мл, разбавляют дважды перегнанной дистиллированной водой
до метки и перемешивают.
Оптическую плотность полученного раствора измеряют
при l
= 525 нм по отношению к дистиллированной воде в кювете толщиной слоя 5 см при
содержании марганца в пробе ниже 0,3 мг/л, или 1 см при более высоком его
содержании.
Содержание марганца находят по калибровочному
графику, для построения которого помещают в мерные колбы вместимостью 100 мл
0,5 ;1,0; 2,0; 5,0;...; 50 мл стандартного раствора перманганата, разбавляют
каждый раствор до метки дважды перегнанной водой и перемешивают. Концентрации
полученных растворов будут равны соответственно 0,05; 0,10; 0,20,...; 5,0 мг/л
марганца. Измеряют оптическую плотность этих растворов в тех же условиях, в
каких находили оптическую плотность анализируемого раствора [21].
Реактивы. Азотная кислота чда, пл. 1,44 г/см3
Фосфорная кислота чда, пл. 1,7 г/см3
Нитрат ртути (II), 0,1 н.
раствор. Растворяют 17,131 г Hg(NO3)2. H2O в дистиллированной воде, смочив
сначала 1 мл концентрированной азотной кислоты, и разбавляют до 1 л; 1 мл
полученного раствора эквивалентен 3,54 мг хлорид-ионов.
Персульфат аммония, раствор. Растворяют 20 г
персульфата аммония (NH4)2S2O8 чда в 80 мл дистиллированной воды.
Нитрат серебра, 0,1 н раствор. Растворяют
16,9874 г AgNO3 чда в дистиллированной воде и разбавляют до 1 л.
Перманганат калия, 0,1 н раствор.
Стандартный раствор перманганата. Приготовляют
непосредственно перед применением. В мерную колбу вместимостью 1 л наливают,
пользуясь бюреткой, 9,1 мл 0,1 н раствора перманганата, разбавляют до метки
дважды дистиллированной (с добавлением KMnO4)водой и перемешивают. В 1 мл
полученного раствора содержится 0,01 мг (10 мкг) марганца в виде
перманганат-ионов.
2.3.3 Аммонийные ионы и аммиак
Колориметрическое определение с применением
реактива Несслера
Ход определения. Определения проводят в комнате,
где в воздухе нет аммиака. В колбу для перегонки емкостью 800 мл помещают такой
объем анализируемой сточной воды, чтобы в нем содержалось 2-6 мг азота в виде
аммиака или солей аммония, нейтрализуют до рН= 7 (необходимое для нейтрализации
количество кислоты или щелочи находят титрованием другой порции сточной воды),
приливают 25 мл фосфатного буферного раствора, разбавляют, если надо, до 400 мл
безаммиачной дистиллированной водой и отгоняют 200 мл жидкости, поместив в
приемник 50 мл раствора борной кислоты. По окончании отгонки содержимое колбы
разбавляют безаммиачной водой до метки. Отобрав аликвотную порцию, содержащую
5-60 мкг NН4+, если измерение оптической плотности будут проводить в кювете
толщиной
см (или 25-300 мкг NН4+ , если пользуются
кюветой с толщиной слоя 1 см), разбавляют безаммиачной водой до 50 мл,
приливают 1 мл реактива Несслера и дают постоять не меньше 10 мин.
Оптическую плотность полученного окрашенного
раствора измеряют при l = 400-425 нм (синие светофильтры),
поместив во вторую кювету фотоколориметра раствор холостого опыта с одними
реактивами.
Расчет. Содержание аммиака в пробе находят по
калибровочной кривой, для приготовления которой пользуются раствором, для
приготовления которой пользуются раствором х.ч. хлорида аммония в безаммиачной
воде [21].
Реактивы. Фосфатный буферный раствор. Растворяют
в дистиллированной воде, не содержащей аммонийных солей и аммиака, 14,3 г
безводного КН2РО4 и 68,8 г безводного К2НРО4 и разбавляют раствор такой же
водой до 1 л.
Реактив Несслера. Растворяют в небольшом
количестве безаммиачной воды 100 г безводного иодида ртути (II)
и 70 г безводного иодида калия. Полученную смесь медленно, при непрерывном
перемешивании переносят в охлажденный раствор 160 г едкого натра в 500 мл
безаммиачной воды. Затем полученную смесь разбавляют безаммиачной водой до 1 л.
Хранят в темноте в склянке, закрытой корковой пробкой; при употреблении
отбирают пипеткой прозрачную жидкость, не взмучивая осадка со дна склянки.
2.3.4 Фосфаты
Фотометрический метод определения растворенных
ортофосфатов
Ход определения. К 50 мл пробы, профильтрованной
в день отбора (на месте отбора или в лаборатории) через мембранный фильтр №1
или через плотный бумажный фильтр (или к меньшему объему пробы, но
разбавленному до 50 мл дистиллированной водой), приливают 2 мл смешанного
раствора и через короткое время - 0,5 мл раствора аскорбиновой кислоты (как
было сказано выше, в присутствии некоторых мешающих веществ реактивы приливают
в обратном порядке). Смесь перемешивают. Одновременно проводят холостое
определение с 50 мл дистиллированной воды. Если анализируемая проба содержит
полифосфаты или органические соединения фосфора, измеряют оптическую плотность
раствора в промежутке времени от 5 до 15 мин. Если легко гидролизующихся
соединений нет, этот промежуток времени может быть увеличен до 60 мин.
Оптическую плотность измеряют по отношению к
холостому раствору. Если сама проба была окрашенной или мутной, надо вычесть
оптическую плотность раствора, получаемого после добавления молибдата, но перед
введением аскорбиновой кислоты. Измерение проводят при λ=880
нм
или при максимально возможном для данного прибора значения λ.
Результат определения находят по калибровочному
графику, для построения которого отбирают 0; 1,0; 2,5; 5,0,…,50,0 мл рабочего
стандартного раствора II фосфата калия, разбавляют каждый раствор до 50 мл
дистиллированной водой и далее продолжают как в ходе определения [20].
Реактивы. Серная кислота, разбавленная. В 900 мл
дистиллированной воды осторожно вливают 140 мл концентрированной серной кислоты
и перемешивают.
Молибдат аммония, раствор. Растворяют 3 г
молибдата аммония (NH4)6Мо7О24*4Н2О чда в 100 мл дистиллированной воды. Хранят
в склянке из полиэтилена.
Аскорбиновая кислота, раствор. Растворяют 2,16 г
аскорбиновой кислоты в 100 мл дистиллированной воды. Раствор хранят в
холодильнике, он устойчив в течение трех недель.
Антимонилтартрат калия, раствор. Растворяют
0,345 г антимонилтартрата калия KSbH4O6*0,5 H2O в 500 мл дистиллированной воды.
Сульфаминовая кислота NH2SO3H чда, 10 %-ный
раствор.
Смешанный раствор. Смешивают 125 мл разбавленной
серной кислоты, 50 мл раствора молибдата аммония, 50 мл раствора аскорбиновой
кислоты, 25 мл раствора антимонилтартрата калия и, если предполагают
присутствие нитритов, добавляют 10 мл раствора сульфаминовой кислоты. Смешанный
реактив приготавляют непосредственно перед его использованием.
Фосфат калия, однозамещенный, стандартный
раствор.
Основной раствор. Растворяют 0,7165 г К2НРО4
чда, высушенного в течение 2 ч при 105 °С, в дистиллированной воде, прибавляют
2 мл хлороформа и разбавляют дистиллированной водой до 1 л. В 1 мл этого
раствора содержится 0,50 мг РО43-.
Рабочий раствор I. Разбавляют 10,00 мл основного
раствора до 1 л дистиллированной водой; применяют всегда свежеприготовленный
раствор. 1 мл этого раствора содержит 0,005 мг РО43-.
Рабочий раствор II. Разбавляют 50 мл рабочего
раствора l до 250 мл дистиллированной водой; применяют всегда
свежеприготовленный раствор;
1
мл его содержит 0,001 мг РО43-.
2.3.5 Хлориды
Меркуриметрический метод
Ход определения. Для определения берут 100 мл
профильтрованной пробы (или меньший ее объем, разбавив до 100 мл
дистиллированной водой), содержащей в этом объеме 0,5-10 мг хлорид-ионов, и
прибавляют 0,3 мл раствора индикатора. Затем для установления рН=2,5 вводят по
каплям 0,2 н азотную кислоту до тех пор, пока цвет раствора не перейдет из
синего в желтый цвет, тогда приливают по каплям 0,1 н раствор едкого натра до
перехода окраски в сине-зеленую и после этого вводят 1,0 мл 0,2 н раствора
азотной кислоты. Установив требуемое значение рН, титруют 0,05 н раствором нитрата
ртути (II) до перехода желтой окраски в фиолетовую.
Если требуется очень точное определение
хлорид-ионов, проводят холостой опыт с 100 мл дистиллированной воды.
Расчет. Содержание хлорид-ионов х, мг/л,
рассчитывают по формуле
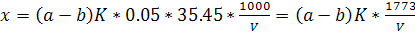
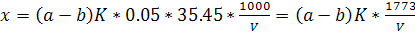 , (1)
, (1)
где 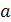
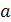 - объем 0,05 н раствора нитрата
ртути, израсходованного на титрование пробы, мл;
- объем 0,05 н раствора нитрата
ртути, израсходованного на титрование пробы, мл;
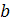
 - объем того же раствора,
израсходованного в холостом опыте, мл;
- объем того же раствора,
израсходованного в холостом опыте, мл;
К - поправочный коэффициент для
приведения концентрации раствора нитрата ртути (II) к точно 0,05 н;- объем
пробы, взятой для определения, мл.
Реактивы. Нитрат ртути (II), 0,05 н
раствор. Растворяют 8,12 г Hg(NО3)2 или 8,57 г Hg(NО3)2*Н2О или 8,34 г
Hg(NО3)2*0,5Н2О в небольшом количестве дистиллированной воды, прибавив 1 мл
концентрированной азотной кислоты чда, и разбавляют водой до 1 л. Можно также
приготовить этот раствор, используя оксид ртути (II):5,5 г HgO чда растворяют в
концентрированной азотной кислоте, вводя небольшой ее избыток, и также
разбавляют водой до 1 л. Во всех случаях следует найти поправку титра
приготовленного раствора к точно 0,05 н. Для этого 10 мл 0,05 н раствора
хлорида натрия разбавляют дистиллированной водой до 100 мл и титруют
приготовленным раствором нитрата ртути (II), как описано в ходе анализа.
Хлорид натрия, 0,05 н раствор.
Растворяют в дистиллированной воде 2,9222 г NaCl чда, предварительно
высушенного при 105 °С, и доводят объем дистиллированной водой до 1 л при 20
°С.
Азотная кислота, приблизительно 0,2
н. Разбавляют 12,7 мл концентрированной HNO3 чда до 1 л дистиллированной водой.
Едкий натр, приблизительно 0,1 н.
Растворяют 4,0 г NaOH чда в 1 л дистиллированной воды.
Смешанный индикатор; растворяют 0,5
г дифенилкарбазона и 0,05 г бромфенолового синего в 100 мл 96 %-ного этилового
спирта. Раствор хранят в склянке из темного стекла [20, 21].
.4 Методика выполнения измерений содержания
марганца, железа методом атомно-абсорбционной спектроскопии
Достоинство атомно-абсорбционного
анализа - простота, высокая селективность и малое влияние состава пробы на
результаты анализа. Ограничения метода - невозможность одновременного определения
нескольких элементов при использовании линейчатых источников излучения и, как
правило, необходимость переведения проб в раствор.
Метод измерения. Метод основан на
измерении резонансного поглощения световой энергии атомами определяемого
элемента. Включает электротермическую атомизацию образца в потоке инертного
газа и регистрацию поглощения анализируемым образцом светового излучения
резонансной длины волны соответствующего элемента. Степень поглощения
пропорциональна концентрации данного элемента в анализируемой пробе. Реактивы.
Вода деионизированная (удельное
сопротивление ³ 18,0
Мом/см)
Кислота азотная концентрированная с
соднржанием основного вещества не менее 65 %
Водорода пероксид (30 %)
-Стандартные растворы индивидуальных элементов
концентрации 1000 мг/л в 2 % HNO3 с погрешностью не более 5 %
Лабораторный контрольный образец - любой
сертифицированный мультиэлементный стандартный раствор с погрешностью не более
5 %
Модификаторы матрицы:
раствор палладия: 1 % Pd(NO3)2 в 15 % HNO3
раствор нитрата магния: 1 % Mg(NO3)2 в 2 % HNO3
либо соль Mg(NO3)2 . 6Н2О
раствор гидрофосфата аммония: 10 % (NH4)HPO4 в 2
% HNO3
Приготовление раствора модификатора матрицы (0,1
% Pd + 0,06 % Mg(NO3)2) В мерную колбу вместимостью 50 см3 , в которую налито
немного деионизированной воды, добавляется 500 мкг концентрированной азотной
кислоты, 5 мл 1 % раствора палладия, 3 мл 1 % раствора нитрата магния и
содержимое доводится до метки деионизированной водой.
Приготовление раствора модификатора матрицы (1 %
(NH4)2HPO4 + 0,06 % Mg(NO3)2) В мерную колбу вместимостью 50 см3 , в которую
налито немного деионизированной воды, добавляется 500 мкг концентрированной
азотной кислоты, 5 мл 10 % раствора гидрофосфата аммония, 10 мл 1 % раствора
нитрата магния и содержимое доводится до метки деионизированной водой.
Приготовление раствора модификатора матрицы 0,3
% Mg(NO3)2) В мерную колбу вместимостью 50 см3 , в которую налито немного
деионизированной воды, добавляется 500 мкг концентрированной азотной кислоты,
навеска 0,26 г нитрата магния Mg(NO3)2) . 6Н2О и содержимое доводится до метки
деионизированной водой.
Приготовление основного многоэлементного
калибровочного стандартного раствора. Основной многоэлементный калибровочный
раствор готовится путем смешивания соответствующих объемов одноэлементных
стандартных растворов либо разбавлением мультиэлементного стандартного
раствора. В пропиленовую мерную колбу вместимостью 50 см3 добавляются аликвоты
соответствующих стандартов индивидуальных элементов и раствор доводится до
метки раствором азотной кислоты 1:100. Хранить приготовленный раствор 6
месяцев.
Приготовление рабочих многоэлементных
стандартных растворов Рабочие калибровочные растворы готовятся в мерных
полипропиленовых колбах объемом 50 см3 путем разбавления аликвот основного
многоэлементного калибровочного раствора азотной кислотой. Рабочие
калибровочные растворы используются только свежеприготовленными.
Приготовление образца проверки калибровки.
Образец проверки калибровки готовится из мультиэлементного стандартного
раствора путем разбавления азотной кислотой 1:100 в мерной полипропиленовой
колбе объемом 50 см3 аликвоты этого раствора. Концентрация элементов в образце
проверки калибровки должна соответствовать среднему значению рабочего диапазона
концентраций каждого элемента.
Приготовление лабораторного контрольного образца
Лабораторный контрольный образец готовится из мультиэлементного стандартного
раствора другой партии аналогично образцу проверки калибровки с условием, что
его концентрация должна входить в рабочий диапазон методики.
Подготовка проб. При определении растворенных
металлов в водных матрицах отобранная проба анализируется без пробоподготовки.
При определении общего содержания металлов в
водных матрицах образец встряхивается и 50 мл образца переносится в стакан
объемом 150 см3, затем добавляется 1,5 мл концентрированной НNO3 и стакан
накрывается часовым стеклом. Стакан с пробой помещается на электроплитку и
содержимое концентрируется при температуре 90-95 °С до
влажного сухого остатка (обязательно без кипения). Затем проба охлаждается, к
ней прибавляется 1,5 мл концентрированной НNO3 и стакан накрывается часовым
стеклом и содержимое вновь упаривается до влажного сухого остатка. Пары должны
конденсироваться на стекле. Время упаривания приблизительно. Стакан с пробой
снимается с плитки, прибавляется 10 мл деионизированной воды, содержимое
перемешивается и нагревается еще 10-15 минут, чтобы растворить остаток. Затем
проба охлаждается, стенки стакана и часовое стекло смываются деионизированной
водой, образец переносится в мерную колбу объемом 50 см3 и объем раствора
доводится до метки деионизированной водой. При необходимости проба фильтруется
либо центрифугуется для удаления силикатов и других нерастворенных соединений.
Образец готов к анализу.
Расчет концентраций элементов производится
автоматически с помощью компьютерной программы прибора. Значения концентраций
элементов ниже их предела обнаружения считаются равными нулю [20, 21].
3. Результаты исследований и их обсуждение
.1 Характеристика поверхностного стока с
территории города
Поверхностные сточные воды (дождевые и талые),
стекающие с застроенных территорий, до недавнего времени считались не
представляющими серьезной опасности для водных объектов. Отведение их
представлялось необходимым лишь по соображениям благоустройства города. Но
дождевые и талые воды значительно загрязнены и не могут сбрасываться в водные
объекты без ограничений. Поэтому организованный отвод с последующим
обезвреживанием дождевых и талых вод в настоящее время является не только
инженерной, но и санитарной необходимостью.
Качество поверхностного стока обусловлено
множеством одновременно действующих факторов, которые можно разделить на две
большие группы: к первой группе относятся все источники загрязнения и факторы,
влияющие на санитарное состояние водосбора к моменту образования стока, ко
второй - факторы, от которых зависит скорость и степень смыва накопленных
загрязнений. Факторы первой группы, определяющие состояние водосбора, пока
плохо изучены. Закономерности влияния каждого из них на качественную характеристику
стока практически не установлены. Решение этого вопроса требует длительных
экспериментальных исследований на характерных водосборах. Скорость и степень
выноса загрязнений определяется гидродинамическими условиями на поверхности
водосбора и в дождевой сети, т.е. в конечном счете транспортирующей
способностью формирующихся в бассейнах водосбора потоков воды [5, 26].
На территории г. Гомеля КАУП «ГорСАП» проводятся
регулярные наблюдения за качественным составом поверхностного стока на
коллекторах ливневой канализации, т.к. очистные сооружения на коллекторах
отсутствуют. Отбор проб осуществляется в соответствии с установленными точками
аналитического контроля, согласно схемы выпусков коллекторов ливневой
канализации. Для городских ливневых сточных вод в перечень исследуемых веществ
включаются только обобщенные показатели, характерные для бытовых сточных вод.
Специфические загрязнения производственных сточных вод жестко нормируются и
контролируется их выполнение на самих предприятиях.
Наиболее крупными выпусками ливневой канализации
являются два коллектора: Прудковский и Хатаевичский.
Прудковский коллектор с площадью водосбора
1843,2 га и Хатаевичский коллектор с площадью водосбора 930,5 га дренируют
центральную и северную часть города, отводя поверхностные сточные воды в озеро
Дедно, являющееся заливом реки Сож. Оба коллектора закрытого типа. Выпуск
Хатаевичского коллектора в озеро представляет собой трубу диаметром 2000 мм,
оголовком которой является железобетонный лоток, по которому вода следует в открытый
земляной канал шириной 12-15 метров и далее в озеро Дедно. Выпуск Прудковского
коллектора имеет аналогичное строение.
Хатаевичский коллектор обслуживает такие
предприятия как Рембыттехника, 8 Марта, фабрика мороженого, кондитерская
фабрика «Спартак» и другие.
Прудковский коллектор обслуживает предприятия в
северной части города: Горэлектротранспорт Депо №1, Ратон, Гидропривод,
Гомелькабель, Автобусный парк №6, Северная котельная, Металлополимер и другие.
Лещинский коллектор является приемником поверхностного
стока с северной и юго-западной части Центрального района. Вдоль канавы
проложен коллектор диаметром 1500 мм. Лещинская канава обслуживает Завод
торгового оборудования, Мотороремонтный завод, Автобусный парк №1, мебельная
фабрика «Прогресс», «Молочные продукты» и другие.
Сток ливневых вод, формирующийся в районах
старой капитальной застройки, отводится непосредственно в р. Сож коллектором
Киевский спуск диаметром 1000 мм.
Коллектор Новый мост расположен в Новобелицком
районе и осуществляет отвод сточной воды с селитебной территории индивидуальных
застроек. Диаметр коллектора составляет 1000 мм [27].
Характеристика водосборных площадей основных
коллекторов представлена в таблице 3 [23].
Таблица 3 - Характеристика водосборных площадей
основных коллекторов
|
Объект
выпуска
|
Название
коллектора
|
Общая
площадь водосбора коллектора, га
|
Площадь
предприятий на коллекторе, га
|
Количество
предприятий на коллекторе, шт
|
|
р.
Сож
|
Прудковский
|
1843,2
|
197
|
87
|
|
Хатаевичский
|
930,5
|
43,1
|
48
|
|
Киевский
спуск
|
263,2
|
4,3
|
11
|
|
Новый
мост
|
292,4
|
0
|
0
|
|
Лещинский
|
748,7
|
235
|
108
|
.1.1 Анализ содержания железа общего в
коллекторах
Данные о содержании железа общего в коллекторах
г. Гомеля в 2010 году сведены в таблицу 4. Для того чтобы сделать вывод о
содержании железа общего в исследуемых коллекторах, был проведён однофакторный
дисперсионный анализ. F-критерий показывает, что различие между средними
статистическими значимо. Поскольку различие между средними значениями значимо,
нулевая гипотеза отвергается и принимается альтернативная гипотеза о
существовании различия между средними. Критерий Фишера составляет 80,4, при
силе значимости значительно меньше, чем критическое значение р=0,05, то есть
данные достоверны. Таким образом, содержание железа общего в коллекторах
статистически достоверно отличается.
Для визуального представления полученного
результата дисперсионного анализа построен график, изображённый на рисунке 2.
Таблица 4 - Содержание железа общего в
коллекторах в 2010 г В мг/дм3
|
Месяц
|
Коллектор
|
ПДК
|
|
Прудковский
|
Хатаевичский
|
Киевский
спуск
|
Новый
мост
|
Лещинский
|
|
|
январь
|
1,582
|
1,147
|
3,634
|
0,931
|
0,88
|
0,6
|
|
февраль
|
1,489
|
1,388
|
3,971
|
0,986
|
0,883
|
|
|
март
|
1,234
|
2,114
|
3,898
|
0,582
|
0,892
|
|
|
апрель
|
1,232
|
2,321
|
3,866
|
0,326
|
0,651
|
|
|
май
|
1,122
|
2,244
|
3,231
|
0,876
|
0,58
|
|
|
июнь
|
0,986
|
2,148
|
3,212
|
2,983
|
0,426
|
|
|
июль
|
0,991
|
0,885
|
3,802
|
0,875
|
0,315
|
|
|
август
|
0,848
|
0,572
|
3,485
|
0,337
|
0,695
|
|
|
сентябрь
|
0,573
|
0,986
|
3,748
|
0,652
|
0,645
|
|
|
октябрь
|
0,61
|
1,363
|
3,371
|
1,182
|
0,362
|
|
|
ноябрь
|
0,867
|
1,101
|
3,382
|
1,122
|
0,456
|
|
|
декабрь
|
1,122
|
1,247
|
3,476
|
1,114
|
0,798
|
|
|
Среднее
значение
|
1,055±
0,197
|
1,460±0,378
|
3,590±
0,169
|
0,997±
0,438
|
0,632±
0,132
|
|
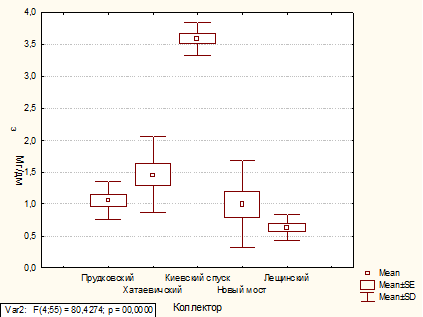
Рисунок 2 - Дисперсионный анализ содержания
железа общего
в
коллекторах в 2010 году
Уровень железа общего во всех коллекторах
превышает норму ПДК. Наибольшее количество приходится на коллектор Киевский
спуск, наименьшее - на Лещинский.
Данные о содержании железа общего в коллекторах
г. Гомеля в 2011 году сведены в таблицу 5. Для того чтобы сделать вывод о
содержании железа общего в исследуемых коллекторах, был проведён однофакторный
Таблица 5 - Содержание железа общего в
коллекторах в 2011 г.
В мг/дм3
|
Месяц
|
Коллектор
|
ПДК
|
|
Прудковский
|
Хатаевичский
|
Киевский
спуск
|
Новый
мост
|
Лещинский
|
|
|
январь
|
2,217
|
1,458
|
3,625
|
0,785
|
1,236
|
0,6
|
|
февраль
|
2,182
|
1,426
|
3,584
|
0,562
|
1,696
|
|
|
март
|
1,644
|
1,562
|
3,451
|
0,685
|
1,642
|
|
|
апрель
|
1,352
|
1,324
|
3,578
|
0,786
|
1,321
|
|
|
май
|
1,637
|
1,412
|
3,199
|
0,458
|
0,641
|
|
|
июнь
|
1,212
|
0,998
|
3,142
|
1,335
|
1,171
|
|
|
июль
|
0,815
|
0,798
|
1,121
|
1,114
|
0,984
|
|
|
август
|
0,841
|
0,645
|
2,211
|
1,234
|
0,813
|
|
|
сентябрь
|
0,787
|
1,112
|
2,256
|
0,997
|
0,654
|
|
|
октябрь
|
0,856
|
0,962
|
2,145
|
0,896
|
0,956
|
|
|
ноябрь
|
1,124
|
1,138
|
2,388
|
0,985
|
0,845
|
|
|
декабрь
|
1,215
|
1,214
|
2,322
|
0,788
|
0,476
|
|
|
Среднее
значение
|
1,324±
0,320
|
1,171±
0,179
|
2,752±
0,502
|
0,885±
0,166
|
1,036±
0,246
|
|
дисперсионный анализ. F-критерий показывает, что
различие между средними статистическими значимо. Поскольку различие между
средними значениями значимо, нулевая гипотеза отвергается и принимается
альтернативная гипотеза о существовании различия между средними. Критерий
Фишера составляет 29,02, при силе значимости значительно меньше, чем критическое
значение р=0,05, то есть данные достоверны. Таким образом, содержание железа
общего в коллекторах статистически достоверно отличается.
Для визуального представления полученного
результата дисперсионного анализа построен график, изображённый на рисунке 3.
Уровень железа общего во всех коллекторах
превышает норму ПДК. Наибольшее количество приходится на коллектор Киевский
спуск, наименьшее - на коллектор Новый мост.
Таким образом, по данным дисперсионного анализа
содержание железа общего в коллекторах Прудковский, Хатаевичский, Новый мост в
2010 и 2011 годах остается на одном уровне. В коллекторе Киевский спуск
содержание железа общего в 2011 г. снизилось на 23 %, а в коллекторе Лещинский,
наоборот, увеличилось на 64 %.
Содержание железа в городской воде колеблется на
уровне 0,3 - 3,9 мг/л. Превышение ПДК железа общего в городской воде
наблюдаются постоянно и во всех коллекторах без исключения. Значительные
количества железа поступают в коллектора со сточными водами предприятий
металлургической, металлообрабатывающей, текстильной, лакокрасочной
промышленности и с сельскохозяйственными стоками. Возможно, наличие железа в
сточной ливневой воде связано еще и с особенностями почв Полесья. Почвы данного
региона болотистые, богатые торфом, гуминовыми и фульвокислотами, благодаря
которым водоносные почвенные слои обогащаются ионами железа.
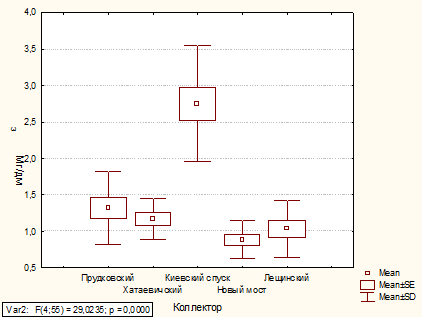
Рисунок 3 - Дисперсионный анализ содержания
железа общего
в
коллекторах в 2011 году
Так в коллекторе Прудковском в среднегодовой
концентрации за 2010 г. содержание железа общего превысило норму ПДК в 1,76
раз, в Хатаевичском - в 2,43 раза, в Новый мост - в 1,66 раз, в Лещинском - в
1,05 раз, в коллекторе Киевский спуск - в 5,98 раз.
В коллекторе Прудковском в среднегодовой
концентрации за 2011 г. содержание железа общего превысило норму ПДК в 2,21
раз, в Хатаевичском - в 1,95 раз, в Новый мост - в 1,48 раз, в Лещинском - в
1,73 раз, в коллекторе Киевский спуск - в 4,59 раз.
Содержащая железо вода сперва прозрачна и чиста
на вид. Однако даже при непродолжительном контакте с кислородом воздуха железо
окисляется, придавая воде желтовато-бурую окраску. Уже при концентрациях железа
выше 0,3 мг/л такая вода способна вызывать появление ржавых потеков на
сантехнике и пятен на белье при стирке. При содержании железа выше 1 мг/л вода
становится мутной, окрашивается в желтовато-бурый цвет, у нее ощущается
характерный металлический привкус. Высокое содержание железа приводит к
неблагоприятному воздействию на кожу. При умывании жесткой водой на коже образуется
пленка нерастворимой кальциевой соли, вызывающей раздражение. Все это делает
такую воду практически неприемлемой как для технического, так и питьевого
применения [27].
3.1.2 Анализ содержания марганца общего в
коллекторах
2010
году сведены в таблицу 6. Для того чтобы сделать вывод о содержании марганца в
исследуемых коллекторах, был проведён однофакторный дисперсионный анализ.
Критерий Фишера составляет 1,89, что ниже критического значения 2,54,
следовательно, нулевая гипотеза сопоставляемых данных подтвердилась и различий
нет. Это говорит о том, что содержание марганца в коллекторах статистически
достоверно не отличается.
Таблица 6 - Содержание марганца в коллекторах г.
Гомеля в 2010 г.
В мг/дм3
|
Месяц
|
Коллектор
|
ПДК
|
|
Прудковский
|
Хатаевичский
|
Киевский
спуск
|
Новый
мост
|
Лещинский
|
|
|
январь
|
0,0238
|
0,0345
|
0,0344
|
0,0591
|
0,0167
|
0,1
|
|
февраль
|
0,0235
|
0,0348
|
0,0472
|
0,0348
|
0,0202
|
|
|
март
|
0,0149
|
0,0321
|
0,0420
|
0,0164
|
0,1053
|
|
|
апрель
|
0,0186
|
0,0382
|
0,0398
|
0,0089
|
0,0863
|
|
|
май
|
0,0342
|
0,0296
|
0,0403
|
0,0137
|
0,0428
|
|
|
июнь
|
0,0301
|
0,0360
|
0,0340
|
0,0278
|
0,0581
|
|
|
июль
|
0,0228
|
0,0328
|
0,0236
|
0,0364
|
0,0124
|
|
|
август
|
0,0199
|
0,0341
|
0,0398
|
0,0233
|
0,0254
|
|
|
сентябрь
|
0,0373
|
0,0452
|
0,0153
|
0,0298
|
0,0397
|
|
|
октябрь
|
0,0543
|
0,0699
|
0,0002
|
0,0347
|
0,0457
|
|
|
ноябрь
|
0,0974
|
0,0674
|
0,0023
|
0,0342
|
0,0560
|
|
|
декабрь
|
0,0846
|
0,0582
|
0,0152
|
0,0294
|
0,0472
|
|
|
Среднее
значение
|
0,0385±
0,017
|
0,0427±0,009
|
0,0278±
0,010
|
0,0290±
0,008
|
0,0463±
0,018
|
|
Для визуального представления полученного
результата дисперсионного анализа построен график, изображённый на рисунке 4.
Уровень марганца во всех коллекторах не
превышает норму ПДК. Наибольшее количество приходится на коллектор Лещинский,
наименьшее - на Киевский спуск.
Данные о содержании марганца общего в
коллекторах г. Гомеля в
2011
году сведены в таблицу 7. Для того чтобы сделать вывод о содержании марганца в
исследуемых коллекторах, был проведён однофакторный дисперсионный анализ.
Критерий Фишера составляет 1,47, что ниже критического значения 2,54,
следовательно, нулевая гипотеза сопоставляемых данных подтвердилась и различий
нет. Это говорит о том, что содержание марганца в коллекторах статистически
достоверно не отличается.
Уровень марганца во всех коллекторах не
превышает норму ПДК. Наибольшее количество приходится на коллектор
Хатаевичский, наименьшее - на Прудковский.
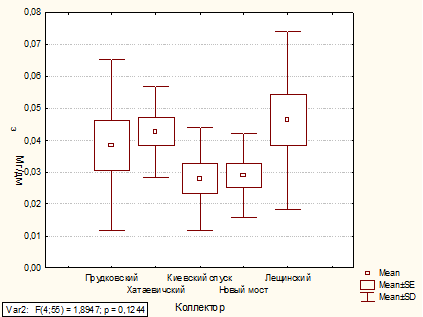
Рисунок 4 - Дисперсионный анализ
содержания марганца в коллекторах в 2010 году
Таблица 7 - Содержание марганца в
коллекторах в 2011 г.
В мг/дм3
|
Месяц
|
Коллектор
|
ПДК
|
|
Прудковский
|
Хатаевичский
|
Киевский
спуск
|
Новый
мост
|
Лещинский
|
|
|
январь
|
0,0356
|
0,0403
|
0,0339
|
0,0293
|
0,0123
|
0,1
|
|
февраль
|
0,0348
|
0,0458
|
0,0329
|
0,0287
|
0,0115
|
|
|
март
|
0,0364
|
0,0386
|
0,0231
|
0,0236
|
0,0138
|
|
|
апрель
|
0,0141
|
0,0310
|
0,0142
|
0,0248
|
0,0221
|
|
|
май
|
0,0043
|
0,0241
|
0,0046
|
0,0378
|
0,0245
|
|
|
июнь
|
0,0183
|
0,0256
|
0,0091
|
0,0277
|
0,0393
|
|
|
июль
|
0,0167
|
0,0237
|
0,0145
|
0,0348
|
0,0358
|
|
|
август
|
0,0178
|
0,0169
|
0,0287
|
0,0294
|
0,0247
|
|
|
сентябрь
|
0,0084
|
0,0178
|
0,0231
|
0,0321
|
0,0312
|
|
|
октябрь
|
0,0172
|
0,0283
|
0,0312
|
0,0256
|
0,0348
|
|
|
ноябрь
|
0,0164
|
0,5612
|
0,0197
|
0,0248
|
0,0241
|
|
|
декабрь
|
0,0053
|
0,0671
|
0,0246
|
0,0214
|
0,0237
|
|
|
Среднее
значение
|
0,0187±
0,007
|
0,0767±
0,097
|
0,0216±
0,006
|
0,0283±
0,003
|
0,0248±
0,006
|
|
Для визуального представления полученного результата
дисперсионного анализа построен график, изображённый на рисунке 5.
Превышения ПДК марганца единичны. В марте 2010
г. в Лещинском коллекторе содержание марганца превысило норму ПДК в 1,05. В
ноябре 2011 г в Хатаевичском коллекторе содержание марганца превысило норму ПДК
в 5,6 раз.
По данным дисперсионного анализа содержание
марганца в коллекторах Хатаевичский, Киевский спуск, Новый мост в 2010 и 2011
годах остается на одном уровне. В коллекторах Прудковский, Лещинский содержание
марганца в 2011 г. снизилось на 51 % и 46 % соответственно.
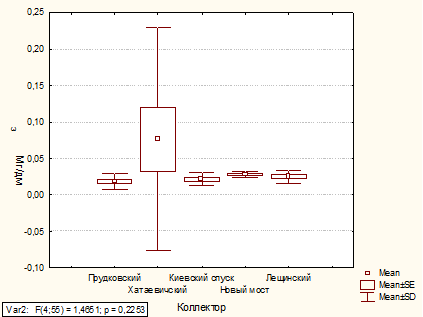
Рисунок 5 - Дисперсионный анализ
содержания марганца в коллекторах в 2011 году
Большое количество марганца и его соединений
содержится в сточных водах металлургических, химических заводов. В воде
марганец присутствует в растворенной форме и в виде нерастворимых гидроокисей.
В концентрации
,1 - 0,5 мг/л марганец изменяет
органолептические свойства воды, придавая ей металлический вкус.
Тяжелые металлы (железо общее и марганец)
чрезвычайно ядовиты. Они подавляют огромное количество ферментов - основных
исполнителей биохимических функций в нашем организме. Малые количества тяжелых
металлов способны привести к серьезным нарушениям физиологии, особенно уязвима
нервная и репродуктивная системы, чрезвычайно велика угроза пренатальных
заболеваний и мутаций [19, 28].
Форма, в которой присутствуют в природных водах
железо и марганец, зависит от величины рН и содержания кислорода. Окисление
железа в воде с максимальной скоростью происходит при рН > 7, а марганца при
рН > 9. Гидрат окиси железа, образовавшегося в результате гидролиза и
окисления двухвалентного железа, малорастворимый и благодаря защитному действию
гумусовых веществ может присутствовать в природных водах в коллоидном состоянии.
Обычно содержание железа и марганца не превышает нескольких десятков
миллиграммов в 1 л воды. Вода, содержащая высокие количества этих ионов все же
для питьевых, промышленных и хозяйственных целей непригодна, поскольку имеет
неприятный, чернильный или железистый привкус.
Наличие в воде железа и марганца может приводить
к развитию в трубопроводах железистых и марганцевых бактерий. Продукты
жизнедеятельности бактерий накапливаются в таких количествах, могут значительно
уменьшить сечение водопроводных труб, а иногда и полностью их закупорить [29].
3.1.3 Анализ содержания азота аммонийного в
коллекторах
Данные о содержании азота аммонийного в
коллекторах г. Гомеля в
2010
году сведены в таблицу 8. Для того чтобы сделать вывод о содержании фосфатов в
исследуемых коллекторах, был проведён однофакторный дисперсионный анализ.
Критерий Фишера составляет 1,64, что ниже критического значения 4,55,
следовательно, нулевая гипотеза сопоставляемых данных подтвердилась и различий
нет. Это говорит о том, что содержание азота аммонийного в коллекторах
статистически достоверно не отличается.
Таблица 8 - Содержание азота аммонийного в
коллекторах в 2010 г.
В мг/дм3
|
Месяц
|
Коллектор
|
ПДК
|
|
Прудковский
|
Хатаевичский
|
Киевский
спуск
|
Новый
мост
|
Лещинский
|
|
|
январь
|
1,746
|
2,632
|
1,145
|
1,099
|
1,248
|
2,0
|
|
февраль
|
1,815
|
2,234
|
1,102
|
0,998
|
1,354
|
|
|
март
|
1,563
|
1,856
|
0,812
|
0,982
|
1,956
|
|
|
апрель
|
1,689
|
1,405
|
0,645
|
0,426
|
1,848
|
|
|
май
|
1,082
|
1,235
|
0,882
|
0,453
|
2,038
|
|
|
июнь
|
0,948
|
0,904
|
0,516
|
1,536
|
1,965
|
|
|
июль
|
0,313
|
0,894
|
0,386
|
0,863
|
18,328
|
|
|
август
|
0,865
|
0,819
|
0,416
|
0,109
|
2,286
|
|
|
сентябрь
|
1,446
|
0,969
|
0,522
|
0,540
|
1,342
|
|
|
октябрь
|
1,238
|
1,373
|
2,194
|
1,182
|
0,592
|
|
|
ноябрь
|
0,689
|
1,246
|
1,311
|
1,110
|
0,682
|
|
|
декабрь
|
0,996
|
1,102
|
0,846
|
0,784
|
0,676
|
|
|
Среднее
значение
|
1,199±
0,296
|
1,389±0,363
|
0,898±
0,321
|
0,840±
0,252
|
2,860±
3,117
|
|
Для визуального представления полученного
результата дисперсионного анализа построен график, изображённый на рисунке 8.
Превышения нормы ПДК наблюдается эпизодично.
Уровень ПДК был значительно превышен (в 9,16 раз) в июле 2010 г. в Лещинском
коллекторе.
Наибольшее количество приходится на коллектор
Лещинский, наименьшее - на Новый мост.

Рисунок 8 - Дисперсионный анализ
содержания азота аммонийного в коллекторах в 2010 году
Данные о содержании азота аммонийного в
коллекторах г. Гомеля в
2011
году сведены в таблицу 9.
Таблица 9 - Содержание азота аммонийного в
коллекторах в 2011 г.
В мг/дм3
|
Месяц
|
Коллектор
|
ПДК
|
|
Прудковский
|
Хатаевичский
|
Киевский
спуск
|
Новый
мост
|
Лещинский
|
|
|
январь
|
2,013
|
0,683
|
1,138
|
4,256
|
1,341
|
2,0
|
|
февраль
|
1,945
|
0,995
|
0,964
|
2,120
|
1,718
|
|
|
март
|
1,648
|
0,936
|
0,867
|
1,645
|
1,220
|
|
|
апрель
|
1,756
|
1,430
|
0,721
|
1,148
|
1,224
|
|
|
май
|
2,410
|
3,072
|
0,876
|
0,846
|
1,115
|
|
|
июнь
|
1,960
|
2,856
|
0,671
|
0,811
|
1,358
|
|
|
июль
|
1,781
|
3,112
|
0,381
|
0,693
|
1,146
|
|
|
август
|
1,246
|
0,346
|
0,695
|
1,223
|
|
|
сентябрь
|
0,769
|
1,214
|
0,278
|
0,538
|
0,948
|
|
|
октябрь
|
0,642
|
0,945
|
0,298
|
0,469
|
0,676
|
|
|
ноябрь
|
0,781
|
0,932
|
0,362
|
0,481
|
0,994
|
|
|
декабрь
|
0,888
|
0,84
|
0,348
|
0,562
|
1,034
|
|
|
Среднее
значение
|
1,487±0,378
|
1,595±0,593
|
0,604±
0,193
|
1,189±
0,693
|
1,166±
0,162
|
|
Для того чтобы сделать вывод о содержании
фосфатов в исследуемых коллекторах, был проведён однофакторный дисперсионный
анализ. Критерий Фишера составляет 3,47, что ниже критического значения 4,55,
следовательно, нулевая гипотеза сопоставляемых данных подтвердилась и различий
нет. Это говорит о том, что содержание азота аммонийного в коллекторах
статистически достоверно не отличается.
Уровень азота аммонийного во всех коллекторах не
превышает норму ПДК. Наибольшее количество приходится на коллектор
Хатаевичский, наименьшее - на Киевский спуск.
Для визуального представления полученного
результата дисперсионного анализа построен график, изображённый на рисунке 9.
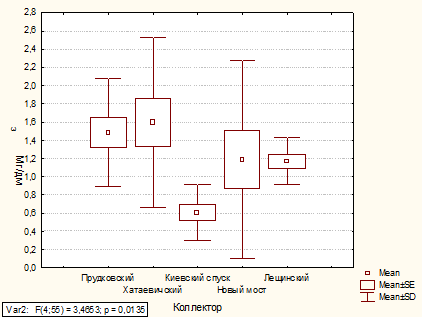
Рисунок 9 - Дисперсионный анализ
содержания азота аммонийного в коллекторах в 2011 году
Таким образом, по данным дисперсионного анализа
содержание азота аммонийного во всех коллекторах в 2010 г. и 2011 г. не
изменилось.
Азотсодержащие вещества (ионы аммония, нитритные
и нитратные ионы) образуются в воде в результате разложения белковых
соединений, попадающих в нее почти всегда со сточными бытовыми водами. Белковые
вещества под действием микроорганизмов подвергаются распаду, конечный продукт
которого аммиак. Наличие последнего свидетельствует о загрязнении воды сточными
водами. Иногда в воде присутствуют ионы аммония неорганического происхождения,
образующиеся в результате восстановления нитрата и нитритов гумусовыми
веществами, сероводородом, железом и т. п.
Наличие в воде ионов, образовавшихся таким
путем, не опасен в санитарном отношении. Если появление в воде азотсодержащих
соединений происходит вследствие гниения белковых веществ, то такие воды
непригодны для питья [30].
В природной воде ионы аммония неустойчивые и при
окислении кислородом воздуха под действием бактерий постепенно превращаются в
нитритные и нитратные ионы. Образование нитратов и нитритов в воде может быть
не только результатом описанных выше процессов. Нитраты, например, образуются
при растворении нитратных солей грунтовыми водами. Восстанавливаясь, нитраты
служат источником обогащения воды нитритами. По наличию тех или иных
азотсодержащих соединений судят о времени загрязнение воды стоками. Так,
наличие в воде ионов аммония, и отсутствие нитритов указывает на недавнее загрязнение
воды. Одновременное присутствие их свидетельствует о том, что с момента
первичного загрязнения прошел уже какой-то промежуток времени. Отсутствие ионов
аммония при наличии нитритов и особенно нитратов, говорит о том, что
загрязнение произошло уже давно и вода за это время самоочистилась.
Соединения азота и фосфора, которые содержатся в
продуктах горения органического и минерального топлива, в неочищенных
промышленных и коммунальных стоках, могут попадать в коллектора как со стоком
воздушным путем от транспорта и стационарных промышленных установок, так со
стоком разнообразных вод. Повышенное содержание аммонийного азота отрицательно
сказывается на состоянии водной флоры и фауны. Рост его концентрации в водоемах
стимулирует процесс эвтрофикации.
Эвтрофикацией называют избыточное поступление в
водоемы биогенных элементов. К биогенным относятся элементы, непосредственно
воздействующие на рост и развитие растений, в первую очередь это азот и фосфор.
Высокое содержание фосфатов и нитратов в воде способствует усиленному росту
фитопланктона, размножению зоопланктона и высшей фауны, которые употребляют
кислород при дыхании. С ростом числа живых организмов, особенно планктона,
имеющего короткий жизненный цикл, увеличивается количество детрита (мертвого
органического вещества), для аэробного разрушения которого также необходим
кислород. В таких условиях расход кислорода не восполняется его продукцией в
процессе фотосинтеза. Происходит переход от аэробного состояния водоема к
анаэробному. В отсутствие кислорода разложение органического вещества
происходит в процессе жизнедеятельности анаэробных микроорганизмов. В
результате взаимосвязанных процессов брожения образуется метан, углекислый газ,
вода, аммиак и сероводород. При этом фосфор, содержавшийся в детрите, вновь
выделяется в воду в виде фосфатов. В результате эвтрофикации происходит
заболачивание водоемов, нарушение и изменение видового разнообразия водных
экосистем, уменьшение площади зеркала воды, снижение потребительских качеств
вод [8, 29].
3.1.4 Анализ содержания фосфатов в коллекторах
Данные о содержании фосфатов в коллекторах г.
Гомеля в 2010 году сведены в таблицу 10. Для того чтобы сделать вывод о
содержании фосфатов в исследуемых коллекторах, был проведён однофакторный
дисперсионный анализ. F-критерий показывает, что различие между средними
статистическими значимо (значимо на уровне р=0,007, то есть меньше, чем
критическое значение 0,05). Поскольку различие между средними значениями
значимо, нулевая гипотеза отвергается и принимается альтернативная гипотеза о
существовании различия между средними. Это говорит о том, что содержание
фосфатов в коллекторах статистически достоверно отличается.
Таблица 10 - Содержание фосфатов в коллекторах в
2010 г.
В мг/дм3
|
Месяц
|
Коллектор
|
ПДК
|
|
Прудковский
|
Хатаевичский
|
Киевский
спуск
|
Новый
мост
|
Лещинский
|
|
|
январь
|
1,125
|
1,191
|
0,185
|
0,897
|
0,624
|
1,0
|
|
февраль
|
1,110
|
1,158
|
0,142
|
0,854
|
0,612
|
|
|
март
|
0,982
|
0,487
|
0,235
|
0,997
|
0,718
|
|
|
апрель
|
0,754
|
0,315
|
0,254
|
1,964
|
0,945
|
|
|
май
|
0,267
|
0,562
|
0,885
|
1,542
|
0,866
|
|
|
июнь
|
0,158
|
0,524
|
0,640
|
0,796
|
2,138
|
|
|
июль
|
0,152
|
0,475
|
0,536
|
0,674
|
4,610
|
|
|
август
|
0,249
|
0,385
|
0,489
|
0,444
|
1,772
|
|
|
сентябрь
|
0,346
|
0,347
|
0,511
|
0,479
|
1,114
|
|
|
октябрь
|
0,424
|
0,338
|
0,321
|
0,504
|
0,593
|
|
|
ноябрь
|
0,452
|
0,367
|
0,347
|
0,538
|
0,623
|
|
|
декабрь
|
0,786
|
0,496
|
0,366
|
0,621
|
0,710
|
|
|
Среднее
значение
|
0,567±
0,233
|
0,554±0,191
|
0,409±
0,136
|
0,860±
0,294
|
1,277±
0,737
|
|
Для визуального представления полученного
результата дисперсионного анализа построен график, изображённый на рисунке 6.
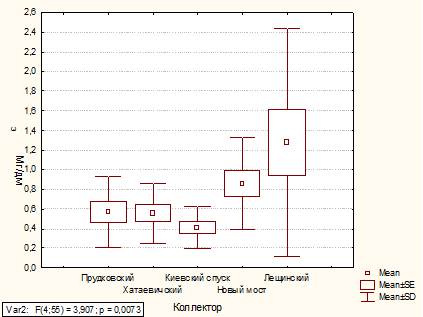
Рисунок 6 - Дисперсионный анализ содержания
фосфатов в коллекторах в 2010 году
Уровень фосфатов превышает норму ПДК эпизодично.
Наибольшее количество приходится на коллектор Лещинский, наименьшее - на
Киевский спуск.
Данные о содержании фосфатов в коллекторах г.
Гомеля в 2011 году сведены в таблицу 11. Для того чтобы сделать вывод о
содержании фосфатов в исследуемых коллекторах, был проведён однофакторный
дисперсионный анализ. F-критерий показывает, что различие между средними
статистическими значимо (значимо на уровне р=0,000006, то есть меньше, чем
критическое значение 0,05). Поскольку различие между средними значениями
значимо, нулевая гипотеза отвергается и принимается альтернативная гипотеза о
существовании различия между средними. Это говорит о том, что содержание
фосфатов в коллекторах статистически достоверно отличается.
Таблица 11 - Содержание фосфатов в коллекторах в
2011 г.
В мг/дм3
|
Месяц
|
Коллектор
|
ПДК
|
|
Прудковский
|
Хатаевичский
|
Киевский
спуск
|
Новый
мост
|
Лещинский
|
|
|
январь
|
0,450
|
0,553
|
0,183
|
0,386
|
0,572
|
1,0
|
|
февраль
|
0,458
|
0,523
|
0,234
|
0,209
|
0,532
|
|
|
март
|
0,578
|
0,642
|
0,241
|
0,356
|
0,570
|
|
|
апрель
|
0,620
|
0,865
|
0,365
|
0,384
|
0,365
|
|
|
май
|
1,403
|
1,464
|
0,122
|
0,468
|
0,391
|
|
|
июнь
|
1,241
|
1,243
|
0,411
|
0,622
|
0,169
|
|
|
июль
|
1,532
|
1,414
|
0,532
|
0,635
|
0,294
|
|
|
август
|
1,144
|
1,113
|
0,573
|
0,626
|
0,819
|
|
|
сентябрь
|
0,975
|
0,964
|
0,598
|
0,786
|
0,942
|
|
|
октябрь
|
0,980
|
0,784
|
0,632
|
0,578
|
0,688
|
|
|
ноябрь
|
0,922
|
0,780
|
0,591
|
0,541
|
0,622
|
|
|
декабрь
|
0,754
|
0,865
|
0,612
|
0,423
|
1,018
|
|
|
Среднее
значение
|
0,921±
0,230
|
0,934±0,200
|
0,425±
0,120
|
0,501±
0,101
|
0,582±
0,164
|
|
Для визуального представления полученного
результата дисперсионного анализа построен график, изображённый на рисунке 7.
Уровень фосфатов превышает норму ПДК эпизодично.
Наибольшее количество приходится на коллектор Хатаевичский, наименьшее - на
Киевский спуск.
Таким образом, по данным дисперсионного анализа
содержание фосфатов в коллекторах Киевский спуск и Лещинский в 2010 г. и 2011
г. не изменилось. В Прудковском и Хатаевичском коллекторах в 2011 г. содержание
фосфатов увеличилось на 62 % и 69 % соответственно, а в коллекторе Новый мост -
уменьшилось на 42 %.
Фосфаты - это соли фосфорной кислоты. Источником
их поступления в водоемы являются деятельность промышленных предприятий, а
также химизация сельского хозяйства. Основным источником дополнительного
поступления фосфатов в природные воды служат бытовые сточные воды, содержащие
фосфаты моющих средств и конечных продуктов жизнедеятельности животных и
человека [29, 30].
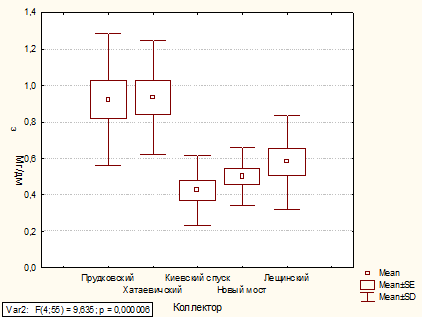
Рисунок 7 - Дисперсионный анализ содержания
фосфатов в коллекторах в 2011 году
Фосфор в повышенных концентрациях - это
токсичный элемент для всех живых организмов. Именно фосфор и его производные
являются ключевыми элементами, стимулирующими процесс эвтрофикации в водоемах
республики.
3.1.5 Анализ содержания хлоридов в коллекторах
Данные о содержании хлоридов в коллекторах г.
Гомеля в 2010 году сведены в таблицу 12. Для того чтобы сделать вывод о
содержании хлоридов в исследуемых коллекторах, был проведён однофакторный
дисперсионный анализ. Критерий Фишера составляет 3,86, что ниже критического
значения 4,55, следовательно, нулевая гипотеза сопоставляемых данных
подтвердилась и различий нет. Это говорит о том, что содержание хлоридов в
коллекторах статистически достоверно не отличается.
Практически во всех коллекторах наблюдается
повышенное содержание хлоридов, но превышений среднегодового значения нет.
Наибольшее количество приходится на коллектор Хатаевичский, наименьшее - на
Киевский спуск.
Для визуального представления полученного
результата дисперсионного анализа построен график, изображённый на рисунке 10.
Таблица 12 - Содержание хлоридов в коллекторах
г. Гомеля в 2010 г.
В мг/дм3
|
Месяц
|
Коллектор
|
ПДК
|
|
Прудковский
|
Хатаевичский
|
Киевский
спуск
|
Новый
мост
|
Лещинский
|
|
|
январь
|
135,46
|
253,82
|
60,42
|
83,66
|
29,99
|
350
|
|
февраль
|
28,01
|
240,71
|
42,37
|
88,92
|
22,69
|
|
|
март
|
34,37
|
50,34
|
48,63
|
64,58
|
35,52
|
|
|
апрель
|
19,21
|
36,87
|
45,28
|
24,46
|
28,32
|
|
|
май
|
15,62
|
40,11
|
42,64
|
76,34
|
24,47
|
|
|
июнь
|
20,23
|
20,02
|
50,89
|
29,54
|
17,37
|
|
|
июль
|
20,21
|
24,13
|
58,36
|
28,12
|
113,44
|
|
|
август
|
40,16
|
115,92
|
40,11
|
51,93
|
53,71
|
|
|
сентябрь
|
111,67
|
117,32
|
42,36
|
58,36
|
58,91
|
|
|
октябрь
|
105,81
|
123,37
|
49,24
|
64,87
|
61,33
|
|
|
ноябрь
|
117,69
|
150,61
|
50,36
|
71,18
|
70,11
|
|
|
декабрь
|
120,11
|
151,21
|
52,48
|
78,64
|
70,28
|
|
|
Среднее
значение
|
64,05±
30,94
|
110,37±
50,92
|
48,60±
4,09
|
60,05±
14,15
|
48,85±
17,75
|
|
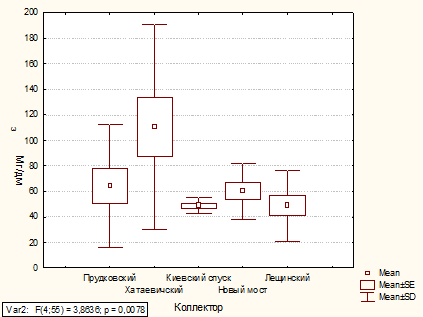
Рисунок 10 - Дисперсионный анализ
содержания хлоридов в коллекторах в 2010 году
Данные о содержании хлоридов в коллекторах г.
Гомеля в 2011 году сведены в таблицу 13. Для того чтобы сделать вывод о
содержании хлоридов в исследуемых коллекторах, был проведён однофакторный
дисперсионный анализ. Критерий Фишера составляет 3,6, что ниже критического
значения 4,55, следовательно, нулевая гипотеза сопоставляемых данных
подтвердилась и различий нет. Это говорит о том, что содержание хлоридов в
коллекторах статистически достоверно не отличается.
Уровень хлоридов во всех коллекторах не
превышает норму ПДК. Наибольшее количество приходится на коллектор
Хатаевичский, наименьшее - на Новый мост.
Таблица 13 - Содержание хлоридов в коллекторах в
2011 г.
В мг/дм3
|
Месяц
|
Коллектор
|
ПДК
|
|
Прудковский
|
Хатаевичский
|
Киевский
спуск
|
Новый
мост
|
Лещинский
|
|
|
январь
|
155,98
|
180,79
|
60,26
|
69,12
|
240,11
|
350
|
150,14
|
247,19
|
19,23
|
17,70
|
279,16
|
|
|
март
|
110,36
|
130,42
|
28,40
|
27,61
|
112,78
|
|
|
апрель
|
69,71
|
86,30
|
11,30
|
20,36
|
86,14
|
|
|
май
|
32,26
|
35,09
|
42,18
|
17,83
|
64,12
|
|
|
июнь
|
38,12
|
35,10
|
46,21
|
35,81
|
40,59
|
|
|
июль
|
33,60
|
66,82
|
58,49
|
30,69
|
38,04
|
|
|
август
|
45,61
|
51,41
|
49,11
|
28,52
|
45,73
|
|
|
сентябрь
|
48,21
|
40,38
|
42,13
|
20,73
|
101,30
|
|
|
октябрь
|
46,11
|
40,21
|
42,18
|
24,81
|
70,54
|
|
|
ноябрь
|
57,29
|
48,94
|
40,33
|
40,80
|
50,36
|
|
|
декабрь
|
60,40
|
49,23
|
45,67
|
42,67
|
42,14
|
|
|
Среднее
значение
|
70,65±
12,64
|
84,32±
19,57
|
40,46±
4,18
|
31,39±
4,20
|
97,58±
23,087
|
|
Для визуального представления полученного
результата дисперсионного анализа построен график, изображённый на рисунке 11.
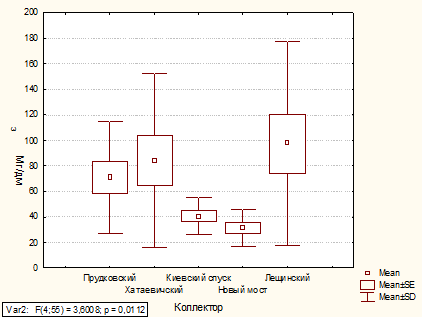
Рисунок 11 - Дисперсионный анализ
содержания хлоридов в коллекторах в 2011 году
Таким образом, по данным дисперсионного анализа
содержание хлоридов в коллекторах Прудковский, Хатаевичский, Лещинский,
Киевский спуск в 2010 и 2011 годах остается на одном уровне. В коллекторе Новый
мост содержание хлоридов в 2011 г. снизилось на 48 %.
Наличие хлоридов в ливневых сточных водах
обусловлено широким применением этих солей в городе для ускорения таяния снега.
Содержание хлоридов в значительной степени меняется в зависимости от сезона.
Необходимо отметить, что концентрация 40-50 мг/л уже отрицательно сказывается
на органолептических свойствах водопроводной воды. Хлор помог покончить с
эпидемиями холеры. Но хлор вступает в реакцию с органическими веществами, в
результате чего образуются химические соединения, известные как тригалометаны.
Например, одним таким соединением является хлороформ. Хлороформ при высокой
концентрации вызывает рак печени даже у крыс. Хлорированная питьевая вода
практически удваивает риск заболевания раком мочевого пузыря.
С хлором связаны заболевания печени, желудка,
прямой и ободочной кишки, а также заболевания сердца, атеросклероз, особенно
артериальный, анемия, высокое давление и аллергические реакции. Хлор оказывает
отрицательное воздействие на обоняние, световую чувствительность глаз, вызывает
нарушение ритмики дыхания. Есть также свидетельства, что хлор способен
разрушать белки нашего организма и оказывать неблагоприятное влияние на кожу и
волосы [27, 28].
Повышенное содержание хлоридов в совокупности с
присутствием в воде аммиака может свидетельствовать о загрязненности бытовыми сточными
водами.
3.1.6Анализ уровня рН в коллекторах
Данные об уровне рН в коллекторах г. Гомеля в
2010 году сведены в таблицу 14. Для того чтобы сделать вывод об уровне рН в
исследуемых коллекторах, был проведён однофакторный дисперсионный анализ. F-критерий
показывает, что различие между средними статистическими значимо. Поскольку
различие между средними значениями значимо, нулевая гипотеза отвергается и
принимается альтернативная гипотеза о существовании различия между средними.
Критерий Фишера составляет 9,2, при силе значимости значительно меньше, чем
критическое значение р=0,05, то есть данные достоверны. Таким образом, уровень
рН в коллекторах статистически достоверно отличается.
Для визуального представления полученного
результата дисперсионного анализа построен график, изображённый на рисунке 12.
Таблица 14 - Уровень рН в коллекторах в 2010 г.
|
Месяц
|
Коллектор
|
ПДК
|
|
Прудковский
|
Хатаевичский
|
Киевский
спуск
|
Новый
мост
|
Лещинский
|
|
|
январь
|
7,32
|
7,20
|
7,86
|
7,64
|
7,58
|
6,5- 8,5
|
|
февраль
|
7,35
|
7,25
|
8,06
|
7,56
|
7,53
|
|
|
март
|
7,31
|
7,22
|
7,88
|
7,55
|
7,56
|
|
|
апрель
|
7,28
|
6,86
|
7,84
|
7,58
|
7,58
|
|
|
май
|
7,11
|
7,15
|
7,77
|
7,46
|
7,39
|
|
|
июнь
|
7,24
|
7,73
|
7,74
|
7,37
|
7,62
|
|
|
июль
|
7,31
|
7,48
|
7,72
|
7,36
|
7,98
|
|
|
август
|
8,08
|
7,56
|
7,58
|
7,31
|
7,59
|
|
|
сентябрь
|
8,03
|
7,35
|
7,60
|
7,33
|
7,58
|
|
|
октябрь
|
7,38
|
7,06
|
7,56
|
7,33
|
7,67
|
|
|
ноябрь
|
7,40
|
7,26
|
7,61
|
7,38
|
7,64
|
|
|
декабрь
|
7,35
|
7,34
|
7,64
|
7,36
|
7,58
|
|
|
Среднее
значение
|
7,43±0,19
|
7,29±0,15
|
7,74±0,10
|
7,44±
0,07
|
7,61±0,09
|
|
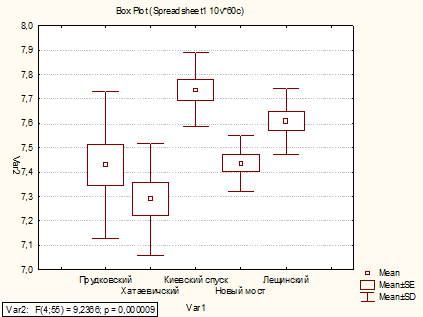
Рисунок 12 - Уровень рН в коллекторах в 2010
году
Уровень рН во всех коллекторах не превышает
норму ПДК. Наибольшее количество приходится на коллектор Киевский спуск,
наименьшее - на Хатаевичский.
Данные об уровне рН в коллекторах г. Гомеля в
2011 году сведены в таблицу 15. Для того чтобы сделать вывод об уровне рН в
исследуемых коллекторах, был проведён однофакторный дисперсионный анализ.
F-критерий показывает, что различие между средними статистическими значимо.
Поскольку различие между средними значениями значимо, нулевая гипотеза
отвергается и принимается альтернативная гипотеза о существовании различия
между средними. Критерий Фишера составляет 9,2, при силе значимости значительно
меньше, чем критическое значение р=0,05, то есть данные достоверны. Таким
образом, уровень рН в коллекторах статистически достоверно отличается.
Таблица 15 - Уровень рН в коллекторах в 2011 г.
|
Месяц
|
Коллектор
|
ПДК
|
|
Прудковский
|
Хатаевичский
|
Киевский
спуск
|
Новый
мост
|
Лещинский
|
|
|
январь
|
7,34
|
7,21
|
7,81
|
7,62
|
7,58
|
6,5- 8,5
|
|
февраль
|
7,32
|
7,24
|
7,89
|
7,50
|
7,54
|
|
|
март
|
7,32
|
7,26
|
7,84
|
7,52
|
7,51
|
|
|
апрель
|
7,32
|
7,12
|
7,81
|
7,45
|
7,39
|
|
|
май
|
7,14
|
7,20
|
7,75
|
7,42
|
7,28
|
|
|
июнь
|
7,26
|
7,76
|
7,64
|
7,38
|
7,59
|
|
|
июль
|
7,36
|
7,46
|
7,46
|
7,38
|
7,94
|
|
|
август
|
7,86
|
7,51
|
7,54
|
7,34
|
7,36
|
|
|
сентябрь
|
7,68
|
7,39
|
7,56
|
7,34
|
7,44
|
|
|
октябрь
|
7,42
|
7,19
|
7,58
|
7,35
|
7,55
|
|
|
ноябрь
|
7,41
|
7,39
|
7,69
|
7,45
|
7,64
|
|
|
декабрь
|
7,32
|
7,34
|
7,62
|
7,38
|
7,55
|
|
|
Среднее
значение
|
7,39±0,12
|
7,34±0,11
|
7,68±0,09
|
7,43±
0,05
|
7,53±0,11
|
|
Для визуального представления полученного
результата дисперсионного анализа построен график, изображённый на рисунке 13.
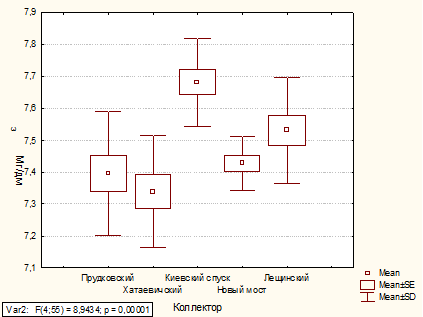
Рисунок 13 - Уровень рН в коллекторах в 2011
году
Уровень рН во всех коллекторах не превышает
норму ПДК. Наибольшее значение приходится на коллектор Киевский спуск,
наименьшее - на Хатаевичский.
По данным дисперсионного анализа уровень рН во
всех коллекторах в 2010 г. и 2011 г. не изменился.
Превышений ПДК по рН нет ни в одном коллекторе.
Водородный показатель (рН) - это ионы водорода, концентрация которых выражена
через показатель рН = - lg [H +], определяет кислотно-щелочное равновесие
водных растворов, определяется концентрацией водородных ионов, точнее их
активностью.
От рН зависит развитие водных растений, характер
протекания продуктивных процессов. Обычно для большинства природных вод
величина рН изменяется в пределах 6,5-8,5. На величину рН воды влияет
повышенная концентрация гумусных кислот, загрязнение водоема стоками
промышленных предприятий и т.д. Изменение реакции воды всего на одну единицу рН
по сравнению с оптиумом приводит в большинстве случаев к стрессу, а нередко к
гибели организмов. Подкисление озер и рек влияет и на сухопутных животных, т.к.
многие птицы и звери входят в состав пищевых цепей, начинающихся в водных экосистемах
[13, 27].
3.2 Нормирование сбросов сточных вод в
поверхностные водные объекты
.2.1 Расчет допустимых концентраций загрязняющих
веществ
В 2011 году экологическая ситуация несколько
улучшилась в сравнении с 2010 годом. Это связано с более жестким контролем
промышленных предприятий, тщательной уборкой улиц и застроенной территории
города.
Канализирование населенных пунктов позволяет
предотвратить загрязнение водных объектов неорганизованным стоком.
Организованный сток из канализационных сетей, как правило, направляется на
очистные сооружения. При отсутствии очистных сооружений снижение негативного
воздействия на качество воды водных объектов может быть достигнуто за счет
использования специальных конструкций выпусков сточных вод, которые обеспечивают
более эффективное разбавление сточных вод [33].
Нормирование предельно-допустимых сбросов и
концентраций загрязняющих веществ в сточных водах водопользователей является
одной из наиболее эффективных мер охраны водных объектов от загрязнения. Оно
способствует рациональному использованию водных ресурсов, внедрению
экологически чистых технологических процессов, строительству эффективных
очистных сооружений.
Согласно статьи 61 Водного кодекса Республики
Беларусь «пользование водными объектами для отведения сточных вод может
осуществляться только на основании разрешений на специальное водопользование».
Разрешение на специальное водопользование составляет важную основу управления
водными ресурсами, поскольку регламентирует объемы забора свежей воды и отведения
сточных вод, как промышленными предприятиями, так и различными коммунальными
службами; предусматривает взимание платежей за забор воды и загрязнение водных
объектов. Разрешение выдается Гомельским городским комитетом природных ресурсов
и охраны окружающей среды.
Расчет допустимых концентраций выполняется с
учетом необходимости поддержания качества воды в водоприемнике,
соответствующего требованиям к водным объектам культурно-бытового назначения
после поступления поверхностного стока. Полученные при таком расчете результаты
следует рассматривать как ориентировочные. Отведение поверхностного стока в р.
Сож осуществляется в черте города, поэтому согласно Инструкции о порядке
установления нормативов допустимых сбросов химических и иных веществ в
поверхностные водные объекты «допустимые концентрации загрязняющих веществ
отводимых вод, принимаемые для расчета нормативов допустимых сбросов, не должны
превышать нормативы качества воды культурно-бытового водного объекта, если для
этого водного объекта не применяются более жесткие нормативы качества воды»
[31].
ПДК азота аммонийного по гигиеническим
нормативам [6] составляет 1 мг/дм3, ПДК железа общего составляет 0,3 мг/дм3.
Исходя из нормативных требований к составу и
свойствам воды водного объекта в контрольном створе, при отведении сточных вод
в водотоки допустимые концентрации загрязняющих консервативных веществ для
отдельного выпуска должны рассчитываться по формуле:
ДК=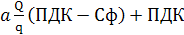
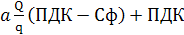 ,
,
где ПДК - предельно-допустимая
концентрация загрязняющих веществ в воде водотока, мг/дм3,
Сф - фоновая концентрация того же
загрязняющего вещества в воде водотока до выпуска сточных вод, мг/дм3,и q -
соответственно расходы воды в водотоке и отводимых сточных вод, м3/с,
а - коэффициент смешения сточных вод
с водой водотока, определяемый по формуле:
= 1-2,72-10α /
1+(Q/q)*2,72-10α,
где α - коэффициент,
учитывающий гидравлические факторы смешения, определяемый по формуле:
α=φ ξ 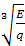
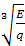 ,
,
где φ - коэффициент,
извилистости реки, м,
ξ - коэффициент, принимаемый в
зависимости от типа выпуска (ξ=1 при береговом типе выпуска),
Е - коэффициент турбулентной
диффузии, определяемый по формуле:
Е=Vср*Нср/200,
где Vср и Нср - соответственно
средняя скорость потока и средняя глубина водотока на участке между выпуском
сточных вод и контрольным створом, м/с, м.- расход сточных вод, м3/с.
Гидравлические и гидрологические
характеристики р. Сож в створе выше г. Гомеля:
Расход воды в реке выше города Q34,4
м3/с;
Средняя скорость течения Vср0,3
м3/с;
Средняя глубина Нср1,6 м;
Коэффициент извилистости φ1,09;
Коэффициент, принимаемый в
зависимости от типа выпуска
(береговой)1;
Расход сточных вод q0,98 м3/с;
Фоновая концентрация
в р. Сож азота аммонийного0,61
мг/дм3;
Фоновая концентрация
в р. Сож железа общего0,19 мг/дм3
[23, 32].
Коэффициент турбулентной диффузии:
Е=Vср*Нср/200 = 0,3*1,6/200=0,0024;
Коэффициент, учитывающий
гидравлические факторы смешения:
α = φ ξ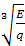
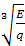 = 1,09*1
= 1,09*1 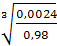
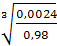 = 0,147;
= 0,147;
Коэффициент смешения сточных вод с
водой водотока:
= 1-2,72-10*0,147 /
1+(34,4/0,98)*2,72-10*0,147 = 0,084.
Исходя из этих предпосылок
допустимая концентрация
для азота аммонийного получается:
ДК=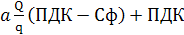
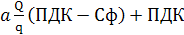 = 0,084*34,4/0,98(1-0,61)+1 = 2,15
= 0,084*34,4/0,98(1-0,61)+1 = 2,15 
 2 мг/дм3
2 мг/дм3
для железа общего:
ДК=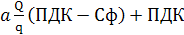
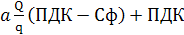 = 0,084*34,4/0,98(0,3-0,19)+0,3 =
0,62
= 0,084*34,4/0,98(0,3-0,19)+0,3 =
0,62 
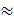 0,6 мг/дм3.
0,6 мг/дм3.
3.2.2 Причины загрязнения поверхностного стока
В Беларуси более 90% сточных вод отводится в
водотоки.В результате производственной и хозяйственной деятельности человека 15
% сточных вод сбрасываются недостаточно очищенными и 5 % − неочищенными.
Основное загрязнение водоемов и водотоков происходит за счет поверхностного
стока. Большинство промышленных центров республики не имеет системы ливневой
канализации, поэтому при выпадении осадков и с паводковыми водами мусор и
другие загрязнения поступают в реки и озера. Опасным источником загрязнения вод
является сельское хозяйство.
Качество воды поверхностных водоемов в
значительной степени ухудшает и смыв почв, содержащих различные загрязняющие
вещества, с территорий, примыкающих к рекам и озерам. Практически все пахотные
земли страны, где применяются удобрения и ядохимикаты, территории
животноводческих ферм и комплексов, поля, где используется орошение
животноводческими стоками, становятся интенсивными источниками загрязнения
поверхностных водотоков.
В отраслевой структуре водоотведения 60 %
сточных вод приходится на ЖКХ и бытовое обслуживание, на промышленность - 16 %
и на сельское хозяйство − 24%.
Для нашего города с развитой промышленностью с
целью предотвращения попадания стоков не только с городской территории, но и с
промышленных площадок, эффективной мерой является очистка дождевого стока
совместно с коммунально-бытовыми и промышленными сточными водами на городских
очистных сооружениях. На территории города грунтовые воды залегают близко к
поверхности и поэтому возможен их переток в ливневую сеть, увеличивая при этом
поверхностный сток. Весьма радикальной мерой защиты является проектирование и
строительство сборного коллектора, опоясывающего все городские коллекторы,
имеющие выпуски в черте города с выводом его ниже города на очистные
сооружения. Для наиболее надежной меры охраны окружающей среды необходимо
разработать проект об использовании поверхностного стока с городских территорий
для целей обеспечения водой промышленных предприятий.
По ливневой канализации отводятся не только
дождевые, талые и поливомоечные стоки, но и условно-чистые воды промышленных
предприятий, что часто приводит к негативным последствиям. В период выпадения
осадков накопившиеся на городской территории загрязнения смываются дождевой
водой и через выпуски ливневой канализации поступают в реку. Очистные
сооружения на коллекторах отсутствуют, поэтому поверхностный сток,
формирующийся на территории города Гомеля, оказывает существенное влияние на
водоемы и водотоки в пределах города.
Без сомнения, нельзя принижать и роль
промышленных предприятий в загрязнении водных объектов и в нарушении работы
коммунальных очистных сооружений, особенно предприятий пищевой промышленности
(мясокомбинаты, молочные заводы и др.). Они должны быть оснащены эффективными
локальными очистными сооружениями. Не менее интенсивно загрязняет гидросферу и
современное сельское хозяйство с массовым содержанием скота, интенсивным
внесением удобрений в почву и использованием средств защиты растений от
вредителей. Значительная часть водосборной площади, охватываемой ливневой
канализацией, относится к селитебной или приравненной к ней территории.
Следовательно, даже при самых жестких требованиях к предприятиям (по
концентрациям загрязняющих веществ, поступающих в ливневую канализацию)
гарантировать стабильную экологическую обстановку на водных объектах в черте
города не представляется возможным. Для этого потребуется осуществление
комплекса водоохранных мероприятий в течение относительно длительного
промежутка времени.
Справедливости ради следует отметить, что нельзя
возлагать всю меру ответственности за критическое состояние водоемов на
предприятия водопроводно-канализационного хозяйства. Ведь они, не продуцируя ни
одного грамма загрязнений, обеспечивают очистку основного количества
образующихся сточных вод, практически решая задачу охраны водоемов от
загрязнения ими. Для этого они используют построенные более 25-30 лет тому
назад очистные сооружения, реализующие разработанные до тех пор технологии,
основанные на удалении основной массы легкоокисляемой органики (БПК) и
взвешенных веществ. Никакого удаления биогенных веществ (азота и фосфора) в ту
пору не предусматривалось. Эти новые технологии начали использоваться в мировой
практике только в начале 90-х годов прошлого века. Поэтому, без коренной
реконструкции действующих и строительства новых очистных сооружений с
реализацией современных технологий денитрификации и дефосфатирования,
достигнуть необходимого уровня очистки сточных вод невозможно. И никакое
директивное ужесточение норм не может обеспечить их выполнение. Существующие
очистные сооружения далеко не всегда обеспечивают выполнение даже норм,
заложенных в проектах. Это относится как к крупным очистным сооружениям, так и
к большинству малых. Это связано как с низким качеством проектирования и
строительства, так и крайне низким уровнем эксплуатации в связи с острой
нехваткой квалифицированных специалистов. Не приняв серьезных практических мер
по модернизации существующих и строительству новых очистных сооружений с
реализацией современных технологий удаления органических загрязнений и биогенных
соединений азота и фосфора, невозможно решить основную проблему охраны водных
объектов − уменьшение их загрязнения и улучшение экологического
состояния.
Напряженное качественное состояние водных
ресурсов связано с тем, что содержание ряда загрязнителей в исходных сточных
водах превышает установленные показатели из-за неэффективной работы локальных
очистных сооружений. С помощью строительства очистных сооружений сохранить
водные ресурсы невозможно, поскольку даже самая высокая очистка на очистных сооружениях
не в состоянии утилизировать отходы в полном объеме. Поэтому самое
прогрессивное - экономия воды в коммунальном хозяйстве на 15-20 % за счет
сокращения потерь на единицу продукции, внедрение прогрессивных технологических
процессов с замкнутым циклом и оборотным водоснабжением, что вполне может быть
решено в целях будущего [34, 35].
На концентрацию загрязняющих веществ в дождевых
и талых водах существенное влияние оказывают технологические процессы
производства. Вынос загрязняющих веществ с территории основного производства в
1,5 - 2,5 раза выше, чем с территории вспомогательных производств. Поэтому во
многих случаях более эффективной оказывается раздельная схема отведения с
территории основного производства ливневых вод с более глубокой очисткой поверхностного
стока. Поверхностный сток с площадок промышленных предприятий имеет, как
правило, более сложный состав, чем с селитебной территории города. Например,
качество ливневых вод с территории предприятий машиностроения в значительной
степени зависит от следующих факторов:
. вида выпускаемой продукции;
наличия разнородных производств: цветное и
чугунное литье, горячая и холодная обработка металла, окрасочное, сварочное
производства, изготовление тары и т.д.;
организации хранения готовой продукции на открытых
складах предприятия с забетонированными площадками;
реализации раздельного отведения дождевых и
талых вод с территории основного производства и с основной принадлежащей
предприятию территории, на которой расположены склады готовой продукции,
подсобные здания и сооружения [26] .
Заключение
Ливневые сточные воды, стекающие с застроенных
территорий, до недавнего времени считались не представляющими серьезной
опасности для водных объектов. Отведение их представлялось необходимым лишь по
соображениям благоустройства города.
Исследования качества ливневых сточных вод в
последние годы, однако, показали, что дождевые и талые воды значительно
загрязнены и не могут сбрасываться в водные объекты без ограничений. Поэтому
организованный отвод с последующим обезвреживанием дождевых и талых вод в
настоящее время является не только инженерной, но и санитарной необходимостью.
Для определения качественного состава вод
проводят лабораторный анализ образцов фотометрическим, титриметрическим и
атомно-абсорбционным методами.
Анализ качественных характеристик поверхностного
стока по коллекторам, отводящим сточные воды в реку Сож показывает, что за
исследуемый период наиболее загрязненными являлись воды коллекторов
Хатаевичский и Лещинский. Приоритетными загрязнителями являются железо общее,
азот аммонийный и фосфаты. По таким показателям качества как хлориды, рН
нарушений норм ПДК не обнаружено. Повышенное содержание марганца было
обнаружено в марте 2010 г. в Лещинском коллекторе и в ноябре 2011 г. в
Хатаевичском коллекторе.
Содержание железа в городской воде колеблется на
уровне 0,3 - 3,9 мг/л при норме ПДК 0,6 мг/дм3. Превышение ПДК железа общего в
городской воде наблюдаются постоянно и во всех коллекторах без исключения.
Возможно, это связано с особенностями почв Полесья. Почвы данного региона
болотистые, богатые торфом, гуминовыми и фульвокислотами, благодаря которым
водоносные почвенные слои обогащаются ионами железа. Значительное количество
железа поступает в коллектора со сточными водами предприятий металлообрабатывающей,
текстильной, лакокрасочной промышленности.
По данным дисперсионного анализа содержание
железа общего в коллекторах Прудковский, Хатаевичский, Новый мост в 2010 и 2011
годах остается на одном уровне. В коллекторе Киевский спуск содержание железа
общего в 2011 г. снизилось на 23 %, а в коллекторе Лещинский, наоборот,
увеличилось на 64 %.
Источником поступления в водоемы фосфатов и
азота аммонийного является деятельность промышленных предприятий, а также
химизация сельского хозяйства. Именно фосфор и его производные являются
ключевыми элементами, стимулирующими процесс эвтрофикации в водоемах
республики. Азотсодержащие вещества образуются в воде в результате разложения
белковых соединений, попадающих в нее почти всегда со сточными бытовыми водами.
Содержание фосфатов в городской воде колеблется
на уровне 0,1 - 4,6 мг/л при норме ПДК 1,0 мг/дм3. По данным дисперсионного
анализа содержание фосфатов в коллекторах Киевский спуск и Лещинский в 2010 г.
и 2011 г. не изменилось. В Прудковском и Хатаевичском коллекторах в 2011 г.
содержание фосфатов увеличилось на 62 % и 69 % соответственно, а в коллекторе
Новый мост - уменьшилось на 42 %. А содержание азота аммонийного во всех
коллекторах в 2010 г. и 2011 г. не изменилось. Содержание азота аммонийного в
городской воде колеблется на уровне 0,1 - 18 мг/л при норме ПДК 2,0 мг/дм3.
С целью поддержания самоочищающей способности
водных объектов и обеспечения различных видов водопользования объем внешних
воздействий не должен превышать установленных норм ПДК. Основными организационно-техническими
мероприятиями, применяемыми в этих целях, являются:
) изменение технологии производства;
) канализирование и санитарная очистка города;
) повторное использование сточных вод;
) очистка сточных вод.
По результатам проведенных исследований можно
сделать следующие выводы:
поверхностный сток, формирующийся на территории
г. Гомеля, оказывает определенное влияние на водоемы и водотоки в пределах
города;
необходимо строительство локальных очистных
сооружений поверхностного стока на территории крупных промпредприятий города,
отводящих поверхностные сточные воды в городскую ливневую канализацию;
значительная часть водосборной площади,
охватываемой ливневой канализацией, относится к селитебной или приравненной к
ней территории. Следовательно, даже при самых жестких требованиях к
предприятиям гарантировать стабильную экологическую обстановку на водных
объектах в черте города не представляется возможным. Для этого потребуется
осуществление комплекса водоохранных мероприятий в течение относительно
длительного промежутка времени.
Список использованных источников
Степановских,
А.С. Прикладная экология: охрана окружающей среды: учебник для вузов. - М.:
ЮНИТИ-ДАНА, 2003. - 751 с.
Агаджанян,
Н.Э. Экология, здоровье и перспективы выживания // Зеленый мир. - 2004. -
№13-14. - С.10-14.
Новиков,
Ю.В. Экология, окружающая среда и человек / Ю.В. Новиков. - М.: ФАИР-ПРЕСС,
2002. - 560 с.
Белоусова,
А.П. Экологическая гидрогеология: учебник для вузов / Белоусова А.П., И.К.
Гавич, А.Б. Лисенков, Е.В. Попов. - М.: ИКЦ «Академкнига», 2006. - 397 с.
Гигиенические
нормативы 2.1.5.10-21-2003 «Предельно-допустимые концентрации (ПДК) химических
веществ в воде водных объектов хозяйственно-питьевого и культурно-бытового
водопользования» / Министерство здравоохранения РБ, Республиканские санитарные
правила, нормы и гигиенические нормативы, Минск, - 2004. - 96 с.
СТБ
ГОСТ Р 51592-2001 Вода. Общие требования к отбору проб. - Введ. 30.05.01. -
Минск: Госстандарт, - 2001. - 35 с.
Охрана
окружающей среды: учебник для вузов / А.С. Степановских. - М.: ЮНИТИ-ДАНА,
2001. - 559 с.
Санитарные
правила для систем водоотведения населенных пунктов 2.1.5.12-43-2005. - Введ.
16.12.05. - Минск: Министерство здравоохранения Республики Беларусь, 2005. - 14
с.
Санитарные
правила и нормы «Гигиенические требования к охране поверхностных вод от
загрязнения» 2.1.2.12-33-2005. - Введ. 28.11.05. - Минск: Министерство
здравоохранения Республики Беларусь, 2005. - 18 с.
Денисов,
В.В. Экология города / В.В. Денисов, А.С. Курбатова, И.А. Денисова, В.Л.
Бондаренко, В.А. Грачев, В.В. Гутенев, Б.А. Нагнибеда. - М.: ИКЦ «Март», 2008.
- 832 с.
Гарин,
В.М. Экология для технических вузов: учебник для технических вузов / В.М.
Гарин, И.А. Кленова, В.И. Колесников,- Ростов н/Д: Феникс, 2001. - 384 с.
Охрана
окружающей среды: учебник для технических вузов / С.В. Белов, Ф.А. Барбинов,
А.Ф. Козьяков. - М.: Высшая школа, 1991. - 319 с.
Владимиров,
А.М. Охрана окружающей среды: учебник для вузов / А.М. Владимиров, Ю.И Ляхин,
Л.Т. Матвеев, В.Г. Орлов. - Ленинград: «Гидрометеоиздат», 1991. - 426 с.
Путилов,
А.В. Охрана окружающей среды / А.В. Путилов, А.А. Копреев, Н.В. Петрухин. - М.:
Химия, 1991. - 224 с.
Родионов,
А.И. Техника защиты окружающей среды / А.И. Родионов, В.Н. Клушин, Н.С.
Торочешников. - М.: Химия, 1989. - 512 с.
Родькин,
О.Н. Охрана окружающей среды: учебное пособие / О.Н. Родькин, В.Н. Копиця. -
Минск: Беларусь, 2010. - 166 с.
Лурье,
Ю.Ю. Унифицированные методы анализа вод. - Москва: Химия, 1973. - 180 с.
Новиков,
Ю.В. Методы исследования качества воды водоемов / Ю.В. Новиков, К.О.
Ласточкина, З.Н. Болдина. - М.: Медицина, 1990. - 400 с.
Лурье,
Ю.Ю. Аналитическая химия промышленных сточных вод. - М.: Химия, 1984. - 448 с.
Лурье,
Ю.Ю. Химический анализ производственных сточных вод / Ю.Ю. Лурье, А.И.
Рыбникова. - М.: Химия, 1974. - 336 с.
Жученко,
Ю.М. Статистическая обработка информации с применением персональных
компьютеров: Практическое пособие для студентов 6 курса специальности
«Биология» (научно-педагогическая деятельность) / Ю.М. Жученко. - Гомель: Мин.
обр. РБ, УО «ГГУ им. Ф. Скорины», 2007. - 103 с.
Отчет
о работе по договору №101/2010. «Разработать научно обоснованные предложения по
нормированию загрязняющих веществ для ливневых коллекторов предприятия «ГорСАП»
г. Гомеля / Пеньковская, А.М.. - Минск: ЦНИИКИВР, 2010. - 45 с.
Сборник
нормативных документов по вопросам окружающей среды. Выпуск 14 / Р.К.
Кожевникова. - Минск: Химия, 1996. - 216 с.
Сборник
нормативных документов по вопросам окружающей среды. Выпуск 10 / Р.К.
Кожевникова, В.Н. Счисленок. - Минск: Химия, 1995. - 181 с.
Колобаев,
А.Н. Использование закономерностей формирования качества дождевых и талых вод с
территории предприятий при их отведении и очистке // Строительная наука и
техника. - 2009. - № 4 - С. 67-71.
Логинов,
В.Ф. Состояние природной среды Беларуси: Экологический бюллетень. 2009 г./ В.Ф.
Логинова. - Минск, 2010. - 397 с.
Вредные
вещества в промышленности. Справочник для химиков, инженеров и врачей. В трех
томах. Том 3. Неорганические элементы и органические соединения / Н.В. Лазарев,
И.Д. Гадаскина. - Л.: «Химия», 1977. - 660 с.
Трифонова,
Т.А. Прикладная экология: учебное пособие для вузов / Т.А. Трифонова, Н.В.
Селиванова, Н.В. Мищенко. - М.: Академический проект: Традиция, 2005. - 384 с.
Гигиена
и экология человека: учебник для студ. средних проф. учеб. заведений / Н.А.
Матвеева, А.В. Леонов, М.П. Грачева. - М.: Издательский центр «Академия», 2005.
- 304 с.
Кодекс
Республики Беларусь о земле. Воздушный кодекс Республики Беларусь. Водный
кодекс Республики Беларусь. - Мн.: Амалфея, 2001. - 256 с.
Караушев,
А.В. Методика расчета предельно-допустимых сбросов сточных вод в реки и водоемы
/ А.В. Караушев, Л.П. Алексеев // Научные основы рационального использования,
охраны и управления водными ресурсами. Ч. 2. - М.: изд. МГУ, 1988. - 48 с.
Седлухо,
Ю.П. Состояние, проблемы и перспективы охраны поверхностных водоемов от
загрязнения сточными водами // Вода. - 2010. - №9. - С. 5-9.
Ясаманов,
Н.А. Основы геоэкологии: учебное пособие для эк. спец. вузов/ Н.А. Ясаманов. -
М.: изд. Центр «Академия», 2003. - 352 с.
Сергейчик,
С.А. Экология: учебное пособие / С.А. Сергейчик. - Минск: Современная школа,
2010. - 400 с.