Влияние солей тяжелых металлов на некоторых пресноводных гидробионтов
МИНИСТЕРСТВО
ОБРАЗОВАНИЯ И НАУКИ РОССИЙСКОЙ ФЕДЕРАЦИИ
Федеральное
государственное бюджетное образовательное учреждение
высшего
профессионального образования
«КУБАНСКИЙ
ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ»
(ФГБОУ ВПО
«КубГУ»)
Кафедра
зоологии
ДОПУСТИТЬ
К ЗАЩИТЕ В ГАК
Заведующий
кафедрой
д-р
биол. наук, проф.
___________Т.Ю.
Пескова
____________2013
г.
ВЫПУСКНАЯ
КВАЛИФИКАЦИОННАЯ (ДИПЛОМНАЯ)
РАБОТА
ВЛИЯНИЕ
СОЛЕЙ ТЯЖЁЛЫХ МЕТАЛЛОВ НА НЕКОТОРЫХ ПРЕСНОВОДНЫХ ГИДРОБИОНТОВ
Работу
выполнила _______________________________________И.А. Лунева
Факультет
биологический
Специальность
020201 Биология
Научный
руководитель, д-р биол. наук, проф. ________________ Т.Ю. Пескова
Нормоконтролёр,
д-р биол. наук, проф. _____________________ Г.К. Плотников
Краснодар
2013
РЕФЕРАТ
Дипломная работа выполнена на
55 страницах машинописного текста, в обзоре литературы представлено 49
источников, в том числе 9 из них иностранные статьи. Работа содержит 10 таблиц,
5 рисунков и 1 приложение. Состоит из введения, трех глав, заключения, списка литературы
и приложения.
Ключевые слова: ВЫСШАЯ ВОДНАЯ РАСТИТЕЛЬНОСТЬ,
ГУППИ, СОЛИ ТЯЖЕЛЫХ МЕТАЛЛОВ, ОКСИДЫ МЕТАЛЛОВ В НАНОФОРМЕ, СМЕРТНОСТЬ,
ВЫЖИВАЕМОСТЬ, ЧИСЛЕННОСТЬ.
Цель дипломной работы - оценка характера
воздействия солей тяжелых металлов в ионной форме и их оксидов в молекулярной
форме на некоторых пресноводных гидробионтов.
Материал исследования - высшие водные растения и
аквариумные рыбы гуппи.
В результате лабораторных
исследований выяснено, что оксиды тяжёлых металлов оказывают отрицательное воздействие
на показатели выживаемости гуппи. Различий в длине и массе тела гуппи в
контроле и вариантах опытов не выявлено, поэтому предположено, что оксиды
металлов в наноформе на данные показатели онтогенеза не влияют. В опытах с
солями тяжелых металлов и высшими водными растениями также было установлено,
что соли тяжелых металлов отрицательно влияют и вызывают задержку роста и
развития высших водных растений. У растений, выращенных в присутствии раствора
соли Co(NO3)2
побеги росли медленнее и их прирост был незначительным. Можно предположить, что
Cо(NO3)2 оказывал больше
отрицательного влияния на все процессы.
СОДЕРЖАНИЕ
Введение
1. Аналитический
обзор
.1 Тяжелые металлы
в водной среде
.2 Действие оксидов
тяжелых металлов на организм некоторых пресноводных животных
.3 Поглощение и
распределение тяжелых металлов в гидрофитах
. Материал и методы
исследований
3. Влияние солей тяжелых металлов на
некоторых пресноводных гидробионтов
3.1 Влияние оксидов тяжелых металлов
в наноформе на показатели роста и смертности гуппи (Poecilia
lebistes
reticulata)
3.2 Особенности
ответных реакций погруженных и плавающих гидрофитов на действие солей тяжелых
металлов в ионной форме
Заключение
Библиографический список
Приложение А
ВВЕДЕНИЕ
Еще более полувека назад, когда
масштабы промышленного производства отличались от современных, В.И. Вернадский
обратил внимание на человеческое общество, как на мощную «геологическую силу»
планеты [Вернадский, 1989]. В настоящий момент, стремительно нарастающая
геохимическая деятельность человека создает техногенную миграцию элементов
[Христофорова, 1989].
Охрана окружающей среды на
сегодняшний день - это многоплановая и актуальная задача современности.
Природная среда не справляется
с возросшим потоком химических веществ, в результате чего происходит их
чрезмерное накопление в биосфере. По существу, все антропогенные воздействия -
затрагивают ли они литосферу, атмосферу, почву или урбанизированную среду - так
или иначе, выходят на гидросферу через атмосферные осадки, почвенный сток,
миграцию подземных вод и другие процессы, связанные с круговоротом воды.
Поэтому важнейшим показателем качества среды обитания является степень чистоты
поверхностных вод и их компонентов [Брагинский, 1998].
Тяжелые металлы являются на
сегодняшний день одними из самых распространенных и опасных загрязнителей
окружающей среды. В значительной мере это связано с биологической активностью
многих из них [Будников, 1998]. Особо острой проблемой является загрязнение
природных пресных вод тяжелыми металлами, для которых в воде не существует
надежных механизмов самоочищения: они лишь перераспределяются в экосистемах,
взаимодействуя с организмами разных трофических уровней и оставляя видимые или
невидимые последствия. Изучение элементного состава гидробионтов позволяет
решить ряд вопросов экологического, физиологического и практического характера
[Перевозников, Понаморенко, 1991].
Безусловно, степень токсичности
того или иного металла может быть установлена лишь путем биотестирования.
Однако результаты многочисленных исследований показывают, что данные
биотестирования и прямого определения концентрации свободных (гидратированных)
ионов нередко совпадают или весьма близки. Последнее свидетельствует о том, что
токсичность металлов в водной среде определяется главным образом этой формой их
нахождения [Линник, Щербань, 1999].
Гидрофиты интенсивно поглощают
биогенные элементы, минеральные и органические вещества, накапливают ионы
тяжелых металлов и радионуклиды, выступают в роли минерализаторов и
детоксикантов, а также биофильтров пестицидов и нефтепродуктов. Способность
высших водных растений накапливать вещества в концентрациях, превышающих
фоновые значения, зафиксированные в окружающей среде, обусловила их
использование в системе мониторинга и контроля состояния окружающей среды [Власов,
Гигевич, 2002] .
Рыбы занимают верхний уровень в
трофической системе водоемов. Ионы меди, цинка, кадмия поступают в их организм
преимущественно с пищей, однако в условиях дефицита микроэлементов в пище и
высокой концентрации тяжелых металлов в воде поступление с водой также играет
значительную роль [Bury,
2003].
Цель дипломной работы - оценка характера
воздействия солей тяжелых металлов в ионной форме и их оксидов в молекулярной
форме на некоторых пресноводных гидробионтов.
Задачи данной работы следующие:
1. Оценить характер воздействия трех оксидов
тяжелых металлов в наноформе (FeO,
CoO, NiO)
на показатели роста и смертности аквариумных рыб гуппи,
. Выявить изменение биологических параметров
высших водных растений при действии на них солей тяжелых металлов,
3. По результатам полученных
данных сравнить степень токсического воздействия различных солей тяжелых
металлов на гидробионтов.
1.
Аналитический обзор
.1 Тяжелые металлы
в водной среде
Тяжелые металлы - это группа наиболее
распространенных и опасных для биоты минеральных загрязняющих веществ. Строение
электронных оболочек атомов тяжелых металлов обуславливает их высокую
реакционную способность, склонность к комплексообразованию и, как следствие,
высокую биохимическую и физиологическую активность [Светашева, 2008].
Тяжелые металлы и их соли - широко
распространенные промышленные загрязнители. В водоемы они поступают из
естественных источников (горных пород, поверхностных слоев почвы и подземных
вод), со сточными водами многих промышленных предприятий и атмосферными
осадками, которые загрязняются дымовыми выбросами. Тяжелые металлы как
микроэлементы постоянно встречаются в естественных водоемах и органах
гидробионтов. В экспериментальной токсикологии рыб главным критерием
токсичности веществ является выживаемость, количественным и качественным
выражением которой является физиолого-биохимические показатели, отражающие
степень повреждающего действия токсиканта на функции и структуру различных
систем организма. Стойкие токсиканты, по мере накопления их в водоемах,
оказывают все более глубокое влияние на биологические процессы в водной среде,
это влияние носит в основном скрытый характер и проявляется в виде внезапных
заморов и «беспричинной» гибели водных животных [Сергеева, Лукьяненко, 2008].
Большинство из них являются жизненно
необходимыми для организмов в качестве регуляторов метаболизма. Однако,
накопленные высокие концентрации тяжелых металлов оказывают токсическое
воздействие в результате замещения других элементов в разнообразных
биоструктурах, нарушение обменных процессов и полное подавление многих
важнейших функций животных [Немова, 2005].
Тяжелые металлы по-прежнему
остаются одной из приоритетных групп загрязняющих веществ, имеющих как
локальное и региональное, так и глобальное распространение. Их поступление в
водную среду связано с природными и антропогенными источниками [Адамова, Босин,
1949].
В организм водных животных
металлы попадают в основном с пищей. Для водных растений через поверхность,
путем непосредственного проникновения в ткани. Токсичность металлов зависит от
концентрации, продолжительности действия, температуры, насыщенности воды
кислородом и других факторов. Особенности токсического действия металлов
заключаются в их универсальном влиянии на живые организмы как
общеплазматических ядов и способности к образованию комплексов с компонентами
клеток, белков, аминокислот и других радикалов [Флеров, 1989].
В настоящее время общеизвестно,
что токсичность металлов в природной водной среде зависит не от их общей
концентрации, а от форм нахождения [Моисеенко, 2006]. Наибольшую токсичность
для водных организмов проявляют свободные (гидратированные) ионы металлов и их
гидрокомплексы, составляющие так называемую лабильную фракцию. К ней часто
относят еще и слабоустойчивые комплексы металлов с природными органическими
лигандами, способные к диссоциации в приэлектродном пространстве при
определении металлов полярографическими методами [Rozan,
1999].
Ионы металлов являются
непременными компонентами природных водоемов. В зависимости от условий среды
(pH, окислительно-восстановительный потенциал, наличие лигандов) они существуют
в разных степенях окисления и входят в состав разнообразных неорганических и
металлорганических соединений, которые могут быть истинно растворенными,
коллоидно-дисперсными или входить в состав минеральных и органических взвесей.
Истинно растворенные формы металлов, в свою очередь, весьма разнообразны, что
связано с процессами гидролиза, гидролитической полимеризации (образованием
полиядерных гидроксокомплексов) и комплексообразования с различными лигандами.
Соответственно, как каталитические свойства металлов, так и доступность для
водных микроорганизмов зависят от форм существования их в водной экосистеме.
Многие металлы образуют довольно прочные комплексы с органикой; эти комплексы являются
одной из важнейших форм миграции элементов в природных водах. Большинство
органических комплексов образуются по хелатному циклу и являются устойчивыми.
Комплексы, образуемые почвенными кислотами с солями железа, алюминия, титана,
урана, ванадия, меди, молибдена и других тяжелых металлов, относительно хорошо
растворимы в условиях нейтральной, слабокислой и слабощелочной средах. Поэтому
металлорганические комплексы способны мигрировать в природных водах на весьма
значительные расстояния. Особенно важно это для маломинерализованных и в первую
очередь поверхностных вод, в которых образование других комплексов невозможно
[Мур, Рамамурти, 1987].
Природная водная среда обладает
уникальной способностью «нейтрализации» токсического действия металлов. Такая
«нейтрализация» достигается, прежде всего, за счет процессов адсорбции и
комплексообразования, происходящих в водоемах. Детоксикация металлов происходит
вследствие снижения концентрации их свободных ионов. Следует заметить, что эта
форма металлов намного активнее сорбируется взвешенными частицами, чем
комплексные соединения с природными органическими лигандами [Линник, Зубко,
2005].
1.2
Действие оксидов тяжелых металлов на организм некоторых пресноводных животных
Высокий уровень загрязнения
водной cреды тяжелыми
металлами приводит к снижению видового разнообразия гидробионтов [Брень,1998].
Использование гидробионтов в качестве биоиндикаторов позволяет судить о
значении этих токсикантов [Христофорова,1989].
На протяжении эволюционного
развития каждая группа водных животных адаптировалась к определенному диапазону
концентраций того или иного металла. Поступая в водоем, тяжелые металлы могут
находиться в водной среде в ионной форме, в виде комплексов с органическими и
неорганическими соединениями. Значение тяжелых металлов для гидробионтов
неоднозначно. Большинство из них (Cu,
Zn, Ni,
Cr, Co
и другие) являются необходимыми микроэлементами для осуществления нормальной
жизнедеятельности. При повышенной концентрации эти же металлы могут
ингибировать ферментативные процессы и оказывать на них многоплановое
негативное действие. В отличие от загрязняющих веществ органического
происхождения, большая часть которых с течением времени подвергается
деструкции, тяжелые металлы сохраняют биологическую активность довольно долго.
Поэтому опасность многих металлов заключается не только в их высокой
токсичности, но и в способности аккумулироваться в живых организмах и
мигрировать по пищевым путям [Нахшина, 1985].
Достаточно хорошо известно о
способности тяжелых металлов оказывать мутагенное и тератогенное действие на
водные организмы. Однако оценить все многообразие процессов и нарушений,
возникающих под влиянием тяжелых металлов и определяющих жизнеспособность как
отдельной особи, так и популяции в целом сложно. Первичное восприятие животными
химических раздражителей, в том числе и тяжелых металлов, осуществляется
хеморецепторами - специализированными клетками, в которых происходит
преобразование энергии раздражающего стимула в сигналы, несущие нервным центрам
информацию о действующем агенте. В процессе эволюции хеморецепторы приобрели
особую чувствительность к восприятию отдельных свойств веществ, что позволяет
животным тонко анализировать и своевременно реагировать на химические изменения
в среде обитания. Нарушение поведенческих реакций является обычно наиболее
явным показателем токсичности, свидетельствующим о негативных последствиях
воздействия поллютантов. Даже малозаметные при визуальном наблюдении, но
статистически достоверные изменения поведения предшествуют многим другим аномалиям
и могут оказаться решающими для дальнейшего существования популяции
гидробионтов [Флеров, 1989].
Высокой токсичностью обладают
металлорганические соединения, так называемые продукты метилирования,
свойственные таким металлам, как Hg,
Pb, Sn.
Металлорганические соединения растворимы в липидах, поэтому легко проникают
через клеточную мембрану в организмы гидробионтов [Линник, Набиванец, 1986].
Наиболее токсичны для организма
тяжелые металлы в свободной ионной форме, но существует мнение, что более доступными
для гидробионтов являются их комплексные соединения с органическими веществами
с низкой и средней молекулярной массой [Линник, Набиванец, 1986]. Токсичность
поливалентных металлов зависит от степени их окисления в водной среде. Чаще
всего, металлы с более высокой степенью окисления токсичнее других [Линник,
Васильчук, 2008]. Проявление токсических свойств металлов меняется в
зависимости от факторов среды обитания, стадий онтогенеза животных, видовых
особей и таксономического положения водных организмов [Фисенко, Хоботьев,
1986]. Водные животные являются уникальной природной моделью для исследования
механизмов повреждений, вызванных токсическими агентами, то есть нарушения
субклеточных процессов, возникающих в момент воздействия, в результате развития
эмбриона быстро визуализируется и могут быть зарегистрированы морфометрически
(изменение скорости и остановка развития) [Мелехова, 1994].
1.3
Поглощение и распределение тяжелых металлов в организме гидрофитов
оксид тяжелый
металл пресноводный
Водная среда по условиям
обитания относительно постоянна. Однако в последние десятилетия ее стабильность
нарушается антропогенными воздействиями, прежде всего, в виде различных
поллютантов органического и неорганического происхождения. Среди них особое
положение занимают ионы тяжелых металлов. В небольших количествах они
необходимы для нормальной жизнедеятельности высших водных растений. Такие
металлы, как медь, цинк, никель, входят в состав многих ферментативных систем,
обеспечивающих практически все основные функции организма [Чернавская, 1989].
Гидрофиты, группа вторично
водных цветковых растений, в зависимости от степени контакта с водой
подразделяются на воздушно-водные (гелофиты), плавающие (плейстофиты) и
погруженные (гидатофиты) [Лукина, 1988]. Гидрофиты являются важными
компонентами водных экосистем. Способность водных растений накапливать тяжелые
металлы в значительных количествах, образуя нетоксичные комплексы,
свидетельствует об их высокой устойчивости к повышенным концентрациям металлов
в среде обитания и открывает широкие перспективы для их использования при
мониторинге и фиторемедиации [Nekrasova,
2009].
Проблема устойчивости высших
растений к антропогенному загрязнению является одной из приоритетных в
современной биологии. Среди многочисленных загрязнителей особое место занимают
тяжелые металлы. В небольших количествах многие из них необходимы для
нормальной жизнедеятельности растений, например, медь, цинк, марганец и никель
являются кофакторами ферментов различных биохимических реакций или входят в
состав биологических комплексов [Улахович, 1997].
Изучение способности
погруженных и плавающих гидрофитов накапливать отдельные элементы, а также
выявление токсического действия тяжёлых металлов и механизмов детоксикации
представляют не только научный интерес, но и имеют большое практическое
значение для решения задач мониторинга водных экосистем и фиторемедиации.
Перспективным в теоретическом плане и для практического использования
представляется изучение видоспецифичных ответных реакций водных растений на
действие тяжёлых металлов. В то же время избыток тяжёлых металлов подавляет
рост и влияет на жизнеспособность гидрофитов, нарушая физиолого-биохимические
процессы в клетках [Золотухина, 1989].
Известно, что стрессовые
условия вызывают образование повышенных количеств активных форм кислорода (АФК)
и как следствие окислительное повреждение жизненно важных биополимеров и
клеточных мембран [Чиркова, 2002]. Развитие окислительного стресса при действии
тяжёлых металлов и основные механизмы защиты клеточного уровня изучены более
детально у высших наземных растений [Gallego,
1996]. Выявлены компоненты антиоксидантной системы, включающей каротиноиды,
небелковые тиолы (глутатион), ферменты (супероксиддисмутаза, каталаза,
глутатионредуктаза и др.) [Blokhina,
2003], а также SH-обогащенные
белки,
которые устраняют не только избыток тяжёлых металлов, но и токсичные радикалы [Cobbett,
2002].
В литературе имеются сведения,
что некоторые виды гидрофитов проявляют повышенную устойчивость к загрязнению
среды тяжёлыми металлами [Микрякова, 2002]. Водные растения обладают
способностью аккумулировать тяжелые металлы в достаточно больших количествах
[Артамонов, 1986].
Защитные механизмы водных
растений почти не исследованы. Изучение особенностей адаптивных механизмов у
гидрофитов, прошедших длительный эволюционный путь приспособления к водной
среде, представляется актуальным и может быть полезным не только в
теоретическом плане, но и для практического использования в мониторинге и
фиторемедиации. Биогидроботанический способ находит все более широкое
применение в очистке производственных сточных вод, при которой основную функцию
очистки выполняет высшая водная растительность [Полевой, 1989].
В последние годы
гидроботанические исследования получили большую направленность в сторону
изучения экологических возможностей водной растительности и их сообществ,
расширились экспериментальные исследования влияния макрофитов на качество вод,
предложены новые типы водоохранных сооружений с использованием водной
растительности [Матвеев, 2005]. В то же время большинство современных
исследований сводится к анализу содержания накопленных элементов растениями. В
меньшей степени уделяется внимание физиологическому и биохимическому состоянию
самих макрофитов. При изучении действия ионов металлов особое значение имеют
молекулярные механизмы регуляции, так как физиологические реакции являются
результатом каскада биохимических перестроек в клетках растений [Ипатова, 2005]
.
По современным представлениям
состояние мембранной системы, активность ферментных комплексов, определяющих
жизнедеятельность организмов, зависят от состава и содержания липидов
[Демидчик, 2001]. В клетках водных растений, культивированных в среде с
тяжелыми металлами, наблюдаются отличия по сравнению с клетками контрольных
растений, состоящие в образовании двойной концентрической мембранной системы и
изменением толщины мембран и величины клеток [Грубинко, Костюк, 2011]. Реакции
клетки на воздействие токсикантов в значительной мере сводится к изменениям в
ее мембранных образованиях, что является первичным компенсаторно-защитным
адаптивным механизмом [Костюк, Грубинко, 2012]. Устойчивость растений к
стрессовым факторам в значительной степени определяется их антиоксидантным
статусом, т.е. способностью поддерживать баланс между прооксидантными и антиоксидантными
реакциями, протекающими в клетке. Под действием тяжелых металлов содержание
активных форм кислорода (АФК) в клетке может резко увеличиваться, что приводит
к нарушению равновесия и развитию окислительного стресса [Schutzendubel
, 2002].
Существующие в настоящее время
фильтры с водными растениями (биоплато) разработаны в соответствии с
конкретными условиями регионов и на базе конкретных предприятий. Исторически
биоплато представлены водно-воздушными растениями (рогоз, тростник, камыш и
т.д.), корневая система которых находится в грунте. Такие биоплато используются
на мелководьях, в непосредственной близости с населенными пунктами, часто в
зоне подтопления водами водохранилищ или рек. Однако недостаточно очищенные
сбрасываемые сточные воды в черте городов часто попадают в русловые участки
рек, загрязняя их. Эта проблема может быть решена с помощью
биогидроботанического метода на основе использования погруженных видов высшей
водной растительности. Выбор видов погруженных макрофитов, способных участвовать
в процессах очистки загрязненных производственных сточных вод является в
настоящее время актуальной задачей [Гусева, 2000].
Все металлы в высоких
концентрациях подавляют рост и влияют на жизнеспособность растений, нарушая
физиолого-биохимические процессы в клетках [Деви, 2005]. Размеры хлоропластов
под действием тяжелых металлов в клетках элодеи изменяются неоднозначно.
Добавление Ni вызывает достоверное уменьшение объема хлоропластов (более чем в
2,5 раза относительно контроля). Не исключено, что при этом происходит
частичное разрушение хлорофилла, что было заметно по бледной окраске листьев.
Эффекты тяжелых металлов на некоторые физиологические характеристики растений
элодеи в кратковременных экспериментах показали, что листья в течение 4 суток
активно аккумулируют тяжелые металлы из водной среды. Отдельные ионы по
интенсивности накопления заметно различаются: на 1 г сухого веса приходится
637,3 мкг Mn; 350,5 мкг Cu; 311,2 мкг Cd; 301,6 мкг Zn и 242,4 мкг Ni [Серегин,
2006].
Известно, что многие тяжелые металлы
могут выступать как антагонисты, препятствуя поступлению других ионов в клетки
растений. В частности, было показано, что Cd часто выступает антагонистом Zn,
Cu, Ni и Mn [Hernandez
, 1998].
Анализ накопления фитомассой
макрофитов техногенных элементов показал, что наибольшей способностью к
накоплению химических элементов отличаются погруженные гидрофиты. Причем на
первом месте по интенсивности накопления стоят харовые водоросли, далее следуют
элодея, роголистник, рдесты, уруть. Наибольшее содержание тяжелых металлов
отмечается в водных растениях водотоков и водоемов, расположенных вблизи
крупных промышленных узлов. В водоемах, не подверженных прямому загрязнению,
содержание поллютантов в гидрофитах находится на уровне фоновых величин или
незначительно их превышает. Это касается таких элементов как хром, никель,
титан, цинк, медь, свинец. Содержание этих же поллютантов в гидрофитах вблизи
крупных агломераций, где существуют источники эмиссий, намного превышает
естественные фоновые величины. Для гидроэкосистем, испытывающих антропогенное
эвтрофирование, особое значение имеет способность высших водных растений
поглощать биогенные вещества. Натурные и экспериментальные исследования
показали, что гидрофиты аккумулируют в среднем 50 г азота, 3 г фосфора, 45 г калия
из расчета на 1 кг сухого вещества. Биогенные элементы определяют рост растений
и более других накапливаются в листьях и генеративных органах. К концу
вегетации содержание биогенов и других элементов минерального питания в зеленых
органах высших водных растений снижается, значительная часть элементов остается
в отмерших остатках растений. Структурную перестройку сообществ гидрофитов и
количественную оценку изменения качества воды может отражать индекс
сапробности. Индекс, рассчитанный с учетом только погруженной растительности,
лучше согласуется с лимническими показателями и доказывает, что именно
погруженная растительность более полно характеризует общее состояние водоема и
изменение экологических условий в нем. Способность высших водных растений к накоплению,
утилизации, трансформации многих веществ сточных вод делает их незаменимыми в
общем процессе самоочищения водоёмов. Наряду с очисткой отработанных сточных
вод от загрязнений органического происхождения часто необходимо извлечь из них
различные солевые компоненты (ионы тяжёлых и лёгких металлов, хлориды, азот,
фосфор и др.). Биологические пруды, засеянные высшими водными растениями, один
из наиболее перспективных способов деминерализации промышленных сточных вод
[Власов, Гигевич, 2002].
Гидрофиты характеризуются
видоспецифичными различиями по концентрации поглощенных химических элементов.
Проявляются эти различия даже на уровне органов и частей одного и того же
растения, а зависят они и от сезона года, фазы развития растения,
продолжительности его вегетации и т. п. Свободноплавающие гидрофиты (ряска,
водокрас, трехдольница, многокоренник и др.) получают элементы минерального
питания преимущественно из воды, поэтому интенсивность накопления того или
иного элемента в них зависит в первую очередь от концентрации данного элемента
в воде, а также от pH среды. Высокая поглотительная способность водных растений
делает их идеальными тестовыми объектами для количественного и качественного
определения антропогенных химических нагрузок на водоем, происходящих во время
всего вегетационного цикла. Обобщенно можно утверждать, что растения одного
вида накапливают в тканях тем больше химических элементов, чем больше их
содержится в воде в доступном для растения виде.
Таким образом, из приведенного
обзора литературы видно, что тяжелые металлы имеют свойство накапливаться до
высоких концентраций, вызывая при этом нарушение обменных процессов и полное
подавление важнейших жизненно важных функций, как животных, так и растений.
Проявление токсических свойств металлов меняется в зависимости от факторов
среды обитания, стадий онтогенеза животных, видовых особей и таксономического
положения водных организмов. Способность высших водных растений к накоплению,
утилизации, трансформации многих веществ сточных вод делает их незаменимыми в
общем процессе самоочищения водоёмов, что делает подробное изучение и
проведение исследований по данной теме необходимым, особенно в период все
большей урбанизации и загрязнения окружающей среды.
2.
Материал и методы исследований
В дипломной работе в качестве
материала для исследования влияния тяжелых металлов были взяты три вида высших
водных растений разных экологических групп и 1 вид аквариумных рыб. Это
роголистник погружённый, или темно-зеленый (Ceratophyllum
demersum), сальвиния
плавающая (Salvinia
natans), элодея
густолиственная (Elodea (Egeria) densa), а также рыбы гуппи (Poecilia
lebistes
reticulate).
Эксперимент проводился с 8 июля
по 30 июля 2011года и с 11 июня по 31 июля 2012 года с целью изучения реакции
растительных и животных объектов на загрязнение водной среды.
В первом опыте гуппи в
количестве 40 штук были доставлены в лабораторию и помещены в один общий
аквариум для акклимации, далее распределены по четырём аквариумам по 10 штук в
каждый, ёмкость каждого аквариума - 5 л. Подача кислорода постоянно
осуществлялась работой компрессоров, кормили их специализированным кормом для
гуппи. В данном опыте мы использовали оксиды тяжелых металлов в наноформе: NiO,
CoO, FeO
(концентрации всех оксидов по 0,5 мг/л). Ежедневно подсчитывали количество
погибших особей и удаляли их из аквариума. Растворы менялись 1 раз в неделю.
Контрольная и опытная серии в отношении температуры, света, корма, объемов
аквариумов, плотности посадки, качества воды находились в максимально сходных
условиях. Проводилось периодическое взвешивание особей гуппи на технических
весах с набором грузов.
Во втором опыте изучалось
влияние тяжелых металлов на водные растения. Отобранные растения были помещены
отдельно в сосуды с водой по 10 штук в каждый. Привезенные с водоёма элодею и
роголистник разместили в лаборатории в большие, широкие, но не глубокие
емкости, где они свободно плавали. Сальвинию поместили в небольшие
кристаллизаторы. В таких условиях при комнатной температуре в течение 5 дней
растения проходили период акклимации. Через 10 суток у элодеи образовались
боковые отростки и корни, что, видимо, ослабляло рост основного побега,
отбираемого в опыт. У элодеи и роголистника отбирали зеленые верхушечные побеги
длиной 8-10 см, без видимых повреждений и не имеющие боковых отростков и
корней. При отборе сальвинии обращали внимание на цвет растений и использовали
зеленые популяции без видимых повреждений и имеющие лопасти и корни.
Воду для проведения опытов
брали из артезианского источника, её можно использовать только через 4-5 дней
после осаждения органического вещества.
Для проведения опыта отрезали
лезвием верхнюю часть побега элодеи длиной 10 см без боковых отростков и
корней. У сальвинии отбирали зелёные растения, имеющие одну сформировавшуюся и
одну развивающуюся лопасть и корень с неповрежденным корневым чехликом и
одинаковой длиной. Побеги элодеи в количестве 10 штук помещали в
кристаллизаторы с растворами исследуемого вещества и с чистой водой. Сосуды
располагали у окон на дневном рассеянном свету с южной стороны. Сальвинию в
количестве 10 штук рассаживают в стаканы объемом 500 мл, которые устанавливают
при рассеянном свете. Опыты продолжались 50 суток, при температуре 19-25оС.
Смену опытных растворов проводили в зависимости от стабильности вещества, через
каждые трое суток, одновременно меняли воду в контроле. Для измерения
температуры растворов рядом ставили стакан с водой и термометром.
Учет параметров проводили через
каждые пять суток. У элодеи учитывали общее состояние растений (изменение
окраски, повреждение точек роста, прирост основного побега, число и длину
боковых отростков), у роголистника - число растений (выживаемость), прирост
основного побега, число боковых отростков, длину боковых отростков. У сальвинии
отмечали общее состояние растений (изменение окраски, размер лопастей,
состояние корней), число растений, число лопастей и корней, длину корней.
Прирост основного побега элодеи
и роголистника вычисляли путем вычитания из длины растения исходных 10 см. Все
измерения проводили с помощью линейки. Среднее значение показателей
рассчитывали на одно растение. Прирост основного побега, длину боковых
отростков, суммарный прирост элодеи и роголистника выражают в сантиметрах,
число боковых отростков, лопастей и корней - в штуках.
В опытные сосуды добавляли соли
тяжелых металлов в ионной форме: Ni(NO3)2,
Cо(NO3)2, FeNO3
концентраций 1 и 2 мг/л. Эта концентрация была подобрана экспериментальным
путем, поскольку в модельных условиях не оказывала сильного токсического
действия на растения. Контролем служил вариант без добавления металлов.
Все изменения в числовых
показателях приведены в Приложении А.
Полученные данные были
обработаны стандартными статистическими методами, определены пределы измерений,
вычислены средние значения с ошибкой и рассчитаны коэффициенты вариации. [Лакин,
1980] .
3. Влияние солей
тяжелых металлов на некоторых пресноводных гидробионтов
.1 Влияние оксидов
тяжелых металлов в наноформе на показатели роста и смертности гуппи (Poecilia lebistes reticulata)
оксид тяжелый
металл пресноводный
Результаты воздействия оксидов тяжелых металлов
на размерно-весовые показатели гуппи приведены в таблицах 1 и 2.
Таблица 1 - Изменение длины тела гуппи (см) под
влиянием оксидов тяжёлых металлов в наноформе (lim,
x.± m)
|
Вариант
опыта
|
Концен-трация
вещества, мг/л
|
День
наблюдения
|
|
|
1
|
5
|
10
|
15
|
20
|
|
Контроль
|
0
|
3,0-3,6
3,3±0,21
|
3,0-3,5
3,2±0,20
|
3,0-3,7
3,2±0,31
|
2,8-3,3
3,0±0,24
|
2,8-3,5
3,0±0,30
|
|
FeO
|
0,5
|
3,0-3,7
3,2±0,32
|
2,5-3,5
3,0±0,41
|
2,4-3,1
2,8±0,33
|
2,2-3,0
2,6±0,45
|
2,7-3,4
3,0±0,34
|
|
NiO
|
0,5
|
2,7-3,7
3,2±0,46
|
2,7-3,5
3,1±0,34
|
2,4-3,4
2,9±0,42
|
2,3-3,2
2,7±0,34
|
2,3-3,4
2,8±0,44
|
|
CoO
|
0,5
|
2,6-3,4
3,0±0,36
|
2,4-3,2
2,0±0,31
|
2,3-2,8
2,6±0,21
|
2,9-3,1
2,5±0,30
|
-
|
|
Примечание:
«-» - отсутствие значений из-за гибели всех особей в данном варианте опыта
|
Проведенные исследования
показали, что оксид кобальта действует наиболее угнетающе на показатели роста
гуппи уже на начальных этапах опыта. Из исследованных нами оксидов тяжёлых
металлов, менее токсичным является оксид железа, а наиболее токсическими
свойствами для живых организмов обладает оксид кобальта. При добавлении оксида
никеля мы наблюдаем гибель 50% животных на 17 день. При добавлении оксида
железа 50% гибель наступает на 20 день. При добавлении оксида кобальта 50%
гибель гуппи начинается на 15 день. Таким образом, в большинстве случаев
добавление оксидов тяжелых металлов не вызывало улучшения выживаемости гуппи, а
добавление оксида кобальта привело к 100% смертности. Результат данного явления
может объяснять следующий, предположенный нами факт, что оксид кобальта в
наноформе каким-то образом влияет на репродуктивную функцию рыб гуппи, угнетая
её и не давая им возможности дать потомство.
Нами проводилось также наблюдение по выявлению
изменений длины и массы гуппи под воздействием этих же токсикантов. Сравнение
длин тела гуппи в разных вариантах опыта с помощью критерия Стьюдента показало,
что различий ни в одном варианте не выявлено, это объясняется отсутствием
влияния оксидов кобальта, никеля и железа на длину и массу тела гуппи ( t
= 0,36; 0; 0,56; 0,26; 0,56- для контроля, 0,61; 1,21; 0,61; 0,48; 0,61- для FeO,
0,30; 0,61; 0,30; 0,70; 0,61- для NiO,
0,48; 0,56; 0,18; 0,19 - для CoO)
при tст = 2,10 для Р =
0,05. Таким образом, можно предположить, что на скорость роста гуппи оксиды
тяжелых металлов не влияют.
В таблице 2 приведены изменения массы тела гуппи
под воздействием оксидов тяжелых металлов в наноформе.
Таблица 2 - Масса тела гуппи (мг) под влиянием
оксидов тяжелых металлов в наноформе (lim,
x ± m)
|
Вариант
опыта
|
Коцентрация
вещества, мг/л
|
День
наблюдения
|
|
|
1
|
5
|
10
|
15
|
20
|
|
Контроль
|
0
|
250-390
335±48,2
|
260-350
310±34,4
|
240-350
300±42,3
|
250-340
297±33,2
|
260-380
322±49,2
|
|
FeO
|
0,5
|
320
-440 383±52,4
|
300-390
348±32,2
|
280-380
337±41,2
|
290-400
350±42,4
|
290-450
372±68,3
|
|
NiO
|
0,5
|
320-430
378±43,4
|
320-400
360±30,1
|
300-390
346±34,4
|
300-380
349±28,3
|
320-390
353±20,2
|
|
CoO
|
0,5
|
300-400
354±36,3
|
300-370
341±28,5
|
260-360
312±34,3
|
220-320
270±32,3
|
-
|
|
Примечание:
«-» - отсутствие значений из-за гибели всех особей
|
Сравнение массы тела гуппи в разных вариантах
опыта с помощью критерия Стьюдента показало, что различий ни в одном варианте
не выявлено
( t
= 0,43; 0,18; 0,06; 0,41; 0,19 - для контроля, 0,57; 0,21; 0,22; 0,28; 0,65-
для FeO, 0,35;
0,31; 0,07; 0,12; 0,53- для NiO,
0,24; 0,66; 0,91; 1,75- для CoO)
tст = 2,10 для Р =
0,05.
Изначальная масса гуппи была неодинаковой в
каждом варианте опыта, что можно объяснить погрешностями в измерении на
технических весах с набором грузиков. Но дальнейшее исследование показывает,
что даже с такими неточностями в измерении, масса тела гуппи изменяется
незначительно в каждом варианте опыта, что свидетельствует о слабом воздействии
используемых нами токсикантов на параметры массы данного вида рыб.
Из таблицы видно, что в отличие от других
опытных вариантов, только при исследовании, проводимом с использованием оксида
кобальта в наноформе, масса гуппи стремительно падает. В опытах же с
применением оксида железа и в контроле с 15-го дня исследования мы наблюдаем
незначительный прирост массы приблизительно на 50 грамм. В варианте с
использованием оксида никеля в наноформе, начиная с 10-го дня наблюдения,
изменений в массе тела гуппи не выявлено.
Таким образом, различий в длине и массе тела
гуппи в контроле и вариантах опытов не обнаружено, следовательно, оксиды
металлов в наноформе на данные показатели онтогенеза не влияют.
К 5-му дню опыта процесс живорождения гуппи
остановился, их численность стала падать.
Таким образом, можно сделать предположение, что
масса тела гуппи, как и их длина, также не зависит от воздействия оксидов
тяжелых металлов.
Выживаемость гуппи в контроле и в растворах
оксидов тяжелых металлов представлена в таблице 3.
Таблица 3 - Выживаемость гуппи в контроле и при
действии оксидов тяжелых металлов (в штуках)
|
Вариант
опыта
|
Концентрация
оксида, мг/л
|
День
наблюдения
|
|
|
1
|
5
|
10
|
15
|
20
|
|
Контроль
|
0
|
10
|
13
|
13
|
12
|
9
|
|
Fe O
|
0,5
|
10
|
9
|
9
|
8
|
5
|
|
Ni O
|
0,5
|
10
|
12
|
10
|
7
|
3
|
|
Co O
|
0,5
|
10
|
9
|
8
|
5
|
0
|
В контроле выживаемость гуппи была наивысшей,
она составила 9 особей из десяти, в то время как в опытном растворе Co
O в живых не
осталось ни одной особи. 50% выживаемость к концу опыта наблюдалась только при
исследовании с применением раствора Fe
O. Сравнение своих
данных с данными похожей работы А.А. Шиян [2011] показало, что при развитии
головастиков в сточных водах сахарных заводов при добавлении оксидов металлов в
наноформе, наблюдается другая картина. Так, добавление нанопорошков трех
исследованных оксидов металлов снижает смертность головастиков во всех случаях
по сравнению с раствором стоков без нанопорошков. Особенно сильно (на 30-35%)
снижение происходит при действии оксида кобальта, что может объяснить его
наибольшей площадью удельной поверхности по сравнению с другими изученными нами
оксидами металлов. Добавление оксидов нанопорошков кобальта, никеля и железа
ускорило темпы роста головастиков в сточных водах во всех вариантах опытов.
Самый высокий прирост длины тела обнаружен при добавлении к растворам сточных
вод нанопорошка оксида железа (на 59-66% выше, чем в растворах сточных вод без
добавления нанопорошка). Отмеченное ускорение роста длины тела головастиков в
сточных водах сахарных заводов при добавлении наночастиц оксидов металлов,
говорит о том, что данные вещества могут выступать в качестве адаптогенов,
повышающих резистентность личинок амфибий к некоторым загрязнителям, в
частности к сточным водам сложного состава, имеющим в своем составе большое
количество взвешенных веществ. В работах А.А. Шиян [2011] предположено, что в
качестве веществ, вызывающих повышение устойчивости организма к воздействию
токсических веществ, могут выступить оксиды тяжелых металлов в наноформе, которые
обладают высокой абсорбционной способностью по отношению к органическим
загрязнителям. Было установлено, что добавление нанопорошков оксидов кобальта,
железа, меди и никеля не влияет на выживаемость икры озерной лягушки в высоких
концентрациях сточных вод (50 и 100%) сахарных заводов. В низких концентрациях
сточной воды (10 и 25%) и в чистой воде смертность икры уменьшается в 1,5 - 2
раза при добавлении оксида кобальта по сравнению с контролем.
В исследованиях, проведенных мною, были получены
данные, проиллюстрированные на рисунке 1. На нём графически изображена
выживаемость гуппи в контроле и растворах оксидов тяжелых металлов в наноформе
для каждого дня исследования.
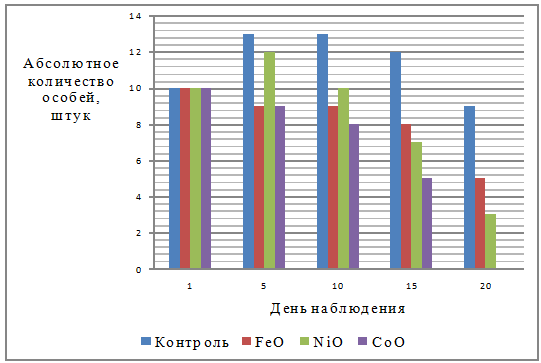
Рисунок 1 - Выживаемость гуппи в
контроле и растворах оксидов тяжелых металлов в наноформе
Изменение численности гуппи также
связано и с тем, что они являются живородящими, поэтому к пятому дню количество
особей увеличилось в контроле и оксиде никеля в наноформе. В остальных же
вариантах опыта увеличение численности не наблюдалось. Это говорит о том, что NiO в наноформе
не изменял репродуктивные способности гуппи, в отличие от других,
использованных в опыте, оксидов тяжелых металлов в наноформе. В варианте с
использованием CoO мы наблюдаем стремительное снижение
численности гуппи, начиная с пятого дня исследования, и уже к концу опыта в
живых не остается ни одной особи, поэтому предположено, что данный оксид
тяжелого металла в наноформе действует более угнетающе на выживаемость гуппи.
К десятому дню живорождение
завершилось, далее численность особей снижается.
Процентные показатели гибели гуппи в
контроле и в растворах оксидов тяжелых металлов представлены в таблице 4.
Таблица 4 - Показатели гибели гуппи
в растворах оксидов тяжелых металлов и в контроле
|
Вариант
опыта
|
Концентрация
вещества, мг/л
|
День
начала гибели
|
День
наступления 50% гибели
|
День
наступления 100% гибели
|
|
Контроль
|
0
|
15
|
0
|
0
|
|
Fe O
|
0,5
|
5
|
20
|
0
|
|
Ni O
|
0,5
|
15
|
17
|
0
|
|
Co O
|
0,5
|
5
|
15
|
20
|
При добавлении оксида никеля гибель гуппи
начинается на 15-е сутки, как и в контроле, следовательно, можно предположить,
что данный оксид тяжёлого металла в наноформе на выживаемость гуппи влияет
медленнее остальных. При использовании оксида железа и оксида кобальта гибель
гуппи начинается на 5-е сутки, что говорит о более активном токсическом
воздействии этих веществ на организм рыб.
В контроле выживаемость гуппи была максимальной.
Только добавление оксида кобальта привело к 100% смертности, остальные же
варианты опыта оставили за собой численное преимущество особей.
Таким образом, в большинстве случаев добавление
оксидов тяжёлых металлов не вызывало улучшения выживаемости гуппи, а в случае с
добавлением раствора Co
O даже ухудшило её,
и привело к 100%-й гибели особей на двадцатый день исследования. Следовательно,
распределив результаты, полученные во время опыта, можно предположить, что
более агрессивно на организм рыб воздействовал оксид кобальта в наноформе,
менее активное действие проявил оксид никеля в наноформе и цепочку по
негативному воздействию на выживаемость гуппи замыкает оксид железа в
наноформе, проявивший себя слабее остальных. Данные результаты исследования
хорошо видны на рисунке 2.
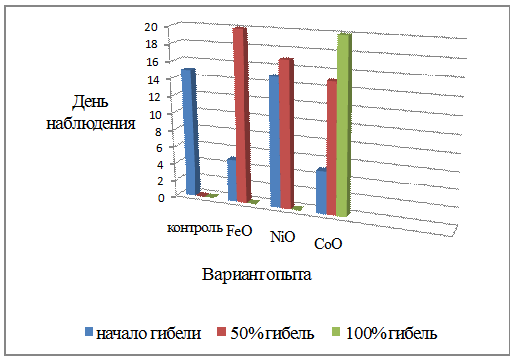
Рисунок 2 - Показатели гибели гуппи
в растворах оксидов тяжелых металлов и в контроле
В курсовой работе А.В. Калямовой
[2010] при добавлении нанометаллов в концентрациях 0,5 мг/л определяются другие
показатели выживаемости головастиков озёрной лягушки, в отличие от гуппи. При
добавлении NiO, CoO, CuO к FeSO4 в
концентрации 5,0 мг/л гибель головастиков начинается на 3 день, 50% гибель
наступает на 10-25 дни, 100% смертность с добавлением CoO наступает
на 40 день, а с NiO и FeO на 30 день.
По заключению вышеприведенного автора, нанооксиды CoO и NiO оказывали
положительное воздействие, а FeO и CuO оказывали
отрицательное воздействие на головастиков.
В результате наших лабораторных
исследований выяснено, что оксиды тяжёлых металлов оказывают отрицательное
воздействие на показатели выживаемости. Однако оксид кобальта наиболее активен
в своем воздействии по сравнению с другими, использованными в исследовании
оксидами тяжелых металлов. Именно добавление оксида кобальта в наноформе
привело к 100%-ной смертности.
3.2
Особенности ответных реакций погруженных и плавающих гидрофитов на действие
соли тяжелых металлов в ионной форме
При дальнейших исследованиях
уже на высших водных растениях, учитывая высокую изменчивость их
морфо-физиологических показателей и затрату значительного времени для получения
информации об их нарушении, в качестве надежных показателей были выбраны
выживаемость и прирост основного побега. Показатели вегетативного развития
растений (развитие боковых отростков и корней) также могут служить в качестве
дополнительных тестовых показателей, способных свидетельствовать о наличии
специфического действия токсиканта.
Выживаемость сальвинии, элодеи
и роголистника проиллюстрирована на рисунках 5, 6, 7. По рисунку 5 можно
проследить, как меняется процентное количество сальвинии в зависимости от
применяемого нами вещества и контроле и в какой день изменения более выражены.
Так в 5-й день исследования в
каждом варианте опыта остаётся 100% количество сальвинии. Уже к 10-му дню
картина меняется, и выглядит так: максимальное значение наблюдается в растворе
Cо(NO3)2 концентрацией 1
мг/л и составляет 80%-ную выживаемость, таким образом можно предположить, что в
данный раствор соли менее опасен на начальной стадии опыта по сравнению с
имеющимися. В вариантах с использованием Ni(NO3)2
1 мг/л и FeNO3 2 мг/л мы
видим одинаковый результат. Как и в контроле, он равен 70%. И на протяжении
всего опыта данные у этих контрольных групп совпадают между собой, исключая
25-й день проведения опыта, где в растворе Ni(NO3)2
1 мг/л остается 30% особей, а в растворе FeNO3
2 мг/л уже нет выживших. Следовательно, предположено, что данные соли тяжелых
металлов схожи по действию на выживаемость высших водных растений. Однако,
данные, полученные при использовании раствора Ni(NO3)2
2 мг/л, отличаются от предыдущих более опасным воздействием на выживаемость
сальвинии и составляют 50% уже к 15-му дню исследования. Раствор соли Cо(NO3)2
2 мг/л проявил себя наиболее выражено, и на 15-й день мы наблюдаем полное
угнетение выживаемости данного растения. Данные результаты продемонстрированы
ниже на рисунке 5.
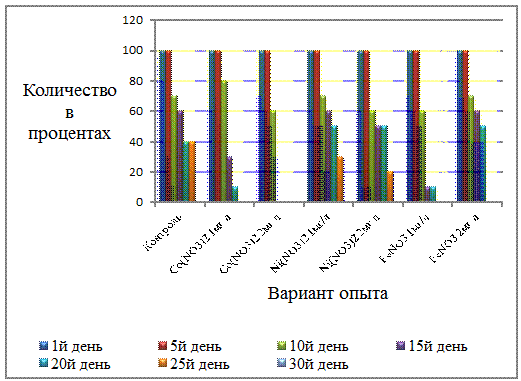
Рисунок 3 - Выживаемость сальвинии в
растворах солей тяжелых металлов и в контроле (%)
Таким образом можно предположить,
что при действии на выживаемость сальвинии наиболее опасным в своем воздействии
был раствор соли Cо(NO3)2 2 мг/л, а наименее растворы
солей Ni(NO3)2 1 мг/л и
FeNO3 2 мг/л.
Данные с 5-го по 10-й день
выживаемости элодеи в эксперименте проиллюстрированы на рисунке 4. Они имеют
абсолютно одинаковое значение равное 100%. Далее показатели меняются, и
выглядят так: с 15-го дня наблюдается максимальная выживаемость сальвинии
только в растворе соли Cо(NO3)2 1 мг/л и контроле,
составив при этом 80%, следовательно этот раствор соли тяжелого металла
проявляет себя менее выражено. В целом похожие между собой данные мы наблюдаем
в растворах солей Ni (NO3)2 1 мг/л и 2 мг/л, а также FeNO3 1мг/л и
2мг/л. Хотя, к концу исследования в данных опытных группах растворы солей с
большей концентрацией ведут себя более агрессивно по отношению к выживаемости.
Что же касается контроля и растворов солей Cо(NO3)2 1мг/л и
2мг/л, здесь показатели большей частью схожи почти до середины опыта, затем
происходит более активное снижение численности сальвинии в растворе соли
большей концентрации. Данные наблюдения проиллюстрированы ниже на рисунке 4.
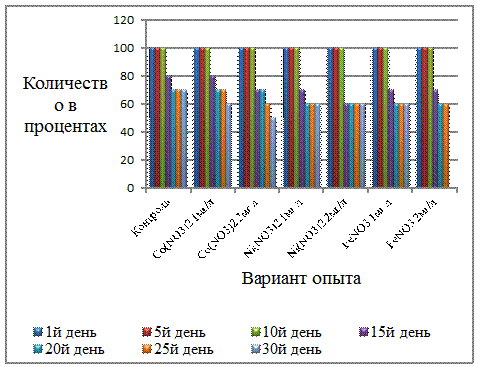
Рисунок 4 - Выживаемость элодеи в
растворах солей тяжелых металлов и в контроле (%)
Следуя из данных наблюдений, можно
предположить, что растворы солей тяжелых металлов Cо(NO3)2 1 мг/л и
2 мг/л менее опасны для сальвинии, чем соли Ni(NO3)2 и FeNO3 тех же
концентраций. А также то, что с увеличение концентрации солей выживаемость
сальвинии начинает снижаться стремительнее. Выживаемость роголистника в
эксперименте представлена на рисунке 5. В данном варианте, как и в случае с
элодеей мы наблюдаем 100% выживаемость до 10-го дня исследования во всех
емкостях. Начиная с 15-го дня ситуация меняется и выглядит иначе: в контроле и
растворах Cо(NO3)2 1мг/л,
Ni(NO3)2 1 мг/л, FeNO3 2 мг/л
выживаемость составила 90%, таким образом сроки начала действия этих солей
тяжелых металлов схожи между собой. Однако, роголистник оказался более устойчив
к воздействию использованных солей тяжелых металлов и выживаемость менялась
слабо. К концу опыта она оказалась максимальной в варианте с применением солей Ni(No3)2 1мг/л, FeNo3 2мг/л и
контроле, а минимальной оказалась в растворе солей Co(No3)2 1мг/л, Co(No3)2
2мг/л, Ni(No3)2 2мг/л, FeNo31мг/л,
составив при этом 60%.
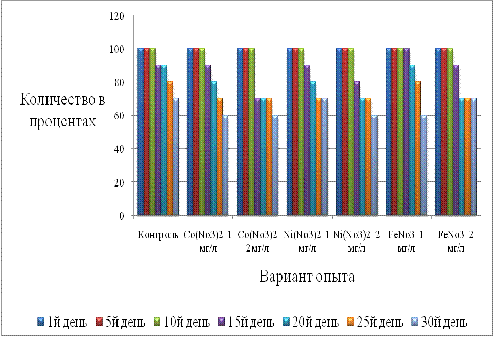
Рисунок 5 - Выживаемость
роголистника в растворах солей тяжелых металлов и в контроле (%)
Таким образом, предположено, что на
выживаемость роголистника менее активно влияют растворы солей Ni(No3)2 1мг/л и FeNo3 2мг/л, так
как выживаемость именно в этих растворах была наибольшей.
По таблицам 5-10 проследим зависимость
прироста основного побега, число и длину боковых отростков у роголистника и
элодеи при воздействии на них используемых нами солей тяжелых металлов.
Сравнение прироста основного побега
роголистника в разных вариантах опыта с помощью критерия Стьюдента показало,
что в опытах зависимость выявлена, то есть рост идет неравномерно, что
объясняется влиянием используемых солей тяжелых металлов на прирост основного
побега элодеи (t = 2,0; 0,7; 0,6; 1,4; 0,9 - для
контроля, 0,5; 2,9; 3,2; 0,8; 5,5- для Co(NO3)2 1мг/л,
5,7; 3,1; 1,5; 2,5; 0,5- для Co(NO3)2 2мг/л,
9,0; 2,6; 2,0; 1,1; 1,7- дляNi(NO3)2 1мг/л,
1,8; 2,0; 4,0; 4,1; 1,3 - для Ni(NO3)2 2мг/л,
1,0; 2,1; 0,8; 0,7; 0,8 - для FeNO3 1мг/л, 3,5; 2,5; 0,7; 1,6;
1,4 - для FeNO3 2мг/л) tст = 2,09
для Р = 0,05. В контроле мы практически не наблюдаем резких изменений к концу
опыта. В опыте с Co(No3)2 концентрацией 1мг/л прироста нет, но и негативного
воздействия, сокращающего прирост, не замечено. В опыте с Co(No3)2 2мг/л и Ni(No3)2 2мг/л
наблюдается увеличение прироста практически вдвое, таким образом можно
предположить, что использование этих солей ускоряет прирост основного побега
роголистника. Как и в контроле, в варианте с применением раствора FeNo3 1мг/л
сходные результаты, то есть его действие на роголистник наименее опасно, в
отличие от других солей тяжелых металлов.
Сравнение прироста основного побега
элодеи в разных вариантах опыта с помощью критерия Стьюдента показало, что в
опытах зависимость выявлена, то есть рост идет неравномерно, что объясняется
влиянием используемых солей тяжелых металлов на прирост основного побега элодеи
(t = 0,9; 1,6;
0,7; 1,2; 1,9; 1,3 - для контроля, 2,5; 1,9; 1,2; 0,5; 7,3; 2,7- для Co(NO3)2 1мг/л,
3,4; 3,0; 1,2; 0,7; 5,5; 3,4- для Co(NO3)2 2мг/л,
4,0; 2,3; 1,0; 1,7; 1,4; 2,6- дляNi(NO3)2 1мг/л,
2,6; 2,2; 3,1; 2,1; 1,8; 1,5 - для Ni(NO3)2 2мг/л,
1,3; 0,5; 0,8; 2,7; 1,3; 0,7 - для FeNO3 1мг/л,
2,3; 0,7; 1,3; 2,6; 3,4; 2,4; 0,9 - для FeNO3 2мг/л) tст = 2,09
для Р = 0,05. Прирост основного побега элодеи в эксперименте можно проследить по
таблице 6. В контроле изменения были незначительны. В опытах с использованием
растворов Co(No3)2 1мг/л и Co(No3)2 2 мг/л
прирост был практически одинаков, что может объясняться схожим их действием на
данный параметр. Наибольший прирост основного побега элодеи мы наблюдали в
опытных сериях Ni(No3)2 1мг/л и
2мг/л. В результате можно заключить, что наименее угнетающее действие на
прирост основного побега элодеи в эксперименте оказывал Ni(No3)2
концентрацией 1мг/л.
Сравнение числа боковых отростков
роголистника в разных вариантах опыта с помощью критерия Стьюдента показало,
что зависимость ни в одном варианте не выявлена, рост идет равномерно, это
объясняется отсутствием влияния солей тяжелых металлов на число боковых
отростков роголистника (t = 1,3; 0,1; 0,07; 1,6; 0,7; 1,1 -
для контроля, 0,5; 1,4; 1,2; 0,5; 1,3; 0,7- для Co(NO3)2 1мг/л,
0,4; 0,3; 1,2; 1,7; 0,5; 1,4- для Co(NO3)2 2мг/л,
0,3; 1,3; 1,0; 0,7; 1,4; 0,7- дляNi(NO3)2 1мг/л,
0,6; 1,2; 0,6; 1,1; 1,4; 0,6 - для Ni(NO3)2 2мг/л,
1,2; 0,8; 0,4; 1,6; 1,2 - для FeNO3 1мг/л, 0,3; 1,6; 0,3; 0,5;
0,7 - для FeNO3 2мг/л) при
tст = 2,09
для Р = 0,05. По таблице 7 проследим изменение числа боковых отростков
роголистника в эксперименте. Сравнивая показатели первого и последнего дней
исследования можно увидеть, что все они увеличиваются постепенно, без резких
изменений, таким образом можно предположить, что используемые соли тяжелых
металлов, на число боковых отростков роголистника действуют менее выражено.
Сравнение числа боковых отростков
элодеи в разных вариантах опыта с помощью критерия Стьюдента показало, что
различий ни в одном варианте не выявлено (t = 0,5; 1,1;
0,7; 0,6; 0,3; 1,9 - для контроля, 1,6; 2,0; 1,4; 1,5; 0,3; 0,7- для Co(NO3)2 1мг/л,
0,5; 1,3; 1,5; 0,7; 0,4; 0,8- для Co(NO3)2 2мг/л,
1,7; 1,3; 1,1; 0,8; 0,4; 1,7- дляNi(NO3)2 1мг/л,
0,2; 1,3; 1,3; 1,2; 0,4; 1,3 - для Ni(NO3)2 2мг/л,
1,4; 0,6; 1,3; 0,8; 1,2; 0,5 - для FeNO3 1мг/л,
0,3; 1,4; 0,3; 0,5; 0,9; 1,1 - для FeNO3 2мг/л) при
tст = 2,09
для Р = 0,05. Изменение числа боковых отростков элодеи в эксперименте
изображено в таблице 8. Из неё следует, что значения меняются незначительно, то
есть можно предположить, что растворы солей тяжелых металлов слабо влияют на
число боковых отростков элодеи.
Сравнение длины боковых отростков
роголистника в разных вариантах опыта с помощью критерия Стьюдента показало,
что в опытах зависимость выявлена, то есть рост идет неравномерно, что
объясняется влиянием используемых солей тяжелых металлов на длину боковых
отростков роголистника (t = 1,5; 1,9; 0,7; 0,4; 1,3; 1,9 -
для контроля, 1,6; 2,3; 4,4; 1,5; 0,8; 1,5- для Co(NO3)2 1мг/л,
2,5; 4,3; 1,5; 0,8; 2,4; 0,9- для Co(NO3)2 2мг/л,
1,9; 1,2; 1,1; 2,4; 0,4; 1,3- дляNi(NO3)2 1мг/л,
1,2; 0,7; 1,2; 1,7; 1,9; 1,1 - для Ni(NO3)2 2мг/л,
0,4; 1,8; 1,4; 1,3; 1,4; 0,8 - для FeNO3 1мг/л,
1,3; 0,9; 1,6; 1,7; 0,9; 0,3 - для FeNO3 2мг/л) при
tст = 2,09
для Р = 0,05. Длина боковых отростков роголистника в эксперименте отражена в
таблице 9. По ней мы можем заметить, как меняется длина боковых отростков
исследуемых растений в зависимости от воздействия на них предложенных нам
растворов солей тяжелых металлов. Итак, при сравнении каждого результата с
контролем, видим, что максимальный прирост наблюдается в варианте с
использованием растворов солей Co(No3)2 2 мг/л и
Ni(No3)2 1мг,
следовательно, они оказывают на длину боковых отростков роголистника
положительное воздействие. Иначе обстоит дело при использовании раствора соли Co(No3)2 1 мг/л,
прирост оказался самым незначительным, и таким образом можно предположить, что
в такой концентрации данная соль тяжелого металла действует угнетающе на длину
боковых отростков роголистника.
Сравнение длины боковых отростков
элодеи в разных вариантах опыта с помощью критерия Стьюдента показало, что в
опытах зависимость выявлена, то есть рост идет неравномерно, что объясняется
влиянием используемых солей тяжелых металлов на длину боковых отростков элодеи
(t = 0,5; 1,8;
1,7; 0,4; 1,7; 1,4 - для контроля, 1,9; 0,2; 1,4; 1,5; 0,8; 1,5- для Co(NO3)2 1мг/л,
2,7; 3,3; 0,5; 0,6; 1,2; 4,8- для Co(NO3)2 2мг/л,
1,9; 1,3; 1,7; 0,4; 0,6; 1,5- дляNi(NO3)2 1мг/л,
1,6; 1,7; 1,2; 0,7; 1,7; 1,3 - для Ni(NO3)2 2мг/л,
3,5; 1,6; 1,4; 1,2; 1,4; 2,9 - для FeNO3 1мг/л,
1,4; 1,9; 0,6; 1,4; 0,5; 1,7 - для FeNO3 2мг/л) при
tст = 2,09
для Р = 0,05. Изменение длины боковых отростков элодеи в эксперименте можно
проследить по таблице 10. Таким образом, можно проследить прирост в зависимости
от воздействия предложенных растворов солей тяжелых металлов. Максимален он
оказался при использовании соли FeNo3 1мг/л, превысив даже
контроль, предположено, что действие данной соли оказывает положительный эффект
на длину боковых отростков элодеи. Иначе результат с применением соли Co(No3)2 2 мг/л,
прирост оказался минимален и составил в 3,5 раза меньше контроля. Таким
образом, предположено, что раствор соли Co(No3)2 2 мг/л
действует подавляюще на прирост длины боковых отростков элодеи.
Проведенные исследования
показали, что по убыванию степени чувствительности исследуемые растительные
объекты располагаются в следующий ряд: сальвиния > элодея > роголистник,
то есть элодея и сальвиния реагируют на токсическое воздействие раньше, чем
роголистник. Разная чувствительность элодеи и сальвинии объяснялась
эколого-биологической особенностью видов.
Исходя из полученных данных, можно сделать
предположение, что растворы солей тяжелых металлов Co(No3)2
2мг/л и Ni(No3)2
2мг/л ускоряют прирост основного побега роголистника, раствор соли FeNo3
1мг/л действует на роголистник менее опасно, в отличие от других солей тяжелых
металлов. В опытах с использованием растворов Co(No3)2
1мг/л и Co(No3)2
2 мг/л прирост основного побега элодеи был практически одинаков, что может
объясняться схожим их действием на данный параметр. Наибольший прирост
основного побега элодеи мы наблюдали в опытных сериях Ni(No3)2
1мг/л и 2мг/л. Исследуя действие используемых солей тяжелых металлов на число
боковых отростков роголистника и элодеи, можно предположить, что используемые
соли тяжелых металлов на данные параметры не влияют, так как все значения
меняются не значительно, и увеличение числа боковых отростков идет равномерно
на протяжении всего опыта. Максимальный прирост боковых отростков роголистника
наблюдается в варианте с использованием растворов солей Co(No3)2
2 мг/л и Ni(No3)2
1мг, следовательно, они оказывают на данные параметры положительное , а
использование раствора соли Co(No3)2
1 мг/л действует угнетающе на длину боковых отростков роголистника. Наибольшей
длина боковых отростков элодеи оказалась при использовании соли FeNo3
1мг/л, превысив даже контроль, предположено, что действие данной соли оказывает
положительный эффект на длину боковых отростков элодеи. Иначе применение соли Co(No3)2
2 мг/л, снижает прирост в 3,5 раза по сравнению с контролем. Таким образом,
предположено, что раствор соли Co(No3)2
2 мг/л действует подавляюще на прирост длины боковых отростков элодеи.
Таблица 5 - Прирост основного побега
роголистника в растворах солей тяжелых металлов и в контроле (lim,
x±m,
Cv)
|
Вариант
опыта
|
Дни
исследования
|
|
1й
|
5й
|
10й
|
15й
|
20й
|
25й
|
30й
|
|
Контроль
|
-
|
0,66-0,86
0,68±0,022 0,4
|
0,60-0,95
0,69±0,031 4,8
|
*
0,69-0,93 0,81±0,021 2,6
|
0,68-0,99
0,83±0,023 2,7
|
0,83-0,99
0,91±0,031 4,2
|
0,84-1,3
1,0±0,032 3,0
|
|
Co(No3)2 1мг/л
|
-
|
0,70-0,79
0,75±0,003 0,4
|
0,61-0,87
0,75±0,042 3,7
|
0,68-0,86
0,75±0,003 0,4
|
0,70-0,79
0,75±0,003 0,4
|
0,72-0,78
0,76±0,016 2,0
|
*
0,74-0,87 0,80±0,012 1,5
|
|
Co(No3)2 2мг/л
|
-
|
0,28-0,52
0,38±0,013 3,3
|
*
0,29-0,54 0,46±0,016 3,6
|
0,34-0,70
0,49±0,004 0,8
|
*
0,34-0,73 0,55±0,041 7,0
|
0,41-0,73
0,56±0,023 4,3
|
*
0,48-0,72 0,62±0,008 6,4
|
|
Ni(No3)2 1мг/л
|
-
|
0,39-0,59
0,53±0,022 0,9
|
*
0,64-0,73 0,71±0,005 0,7
|
0,60-0,89
0,76±0,017 0,6
|
*
0,68-0,94 0,84±0,021 1,9
|
*
0,86-0,96 0,92±0,034 3,2
|
0,89-1,3
0,97±0,014 1,1
|
|
Ni(No3)2 2мг/л
|
-
|
0,29-0,46
0,38±0,012 2,1
|
*
0,31-0,56 0,45±0,033 5,9
|
*
0,42-0,68 0,53±0,014 1,9
|
*
0,48-0,69 0,61±0,015 2,0
|
0,58-0,80
0,69±0,042 5,6
|
*
0,66-0,84 0,73±0,041 5,7
|
|
FeNo3 1мг/л
|
-
|
0,48-0,56
0,52±0,011 1,9
|
*
0,58-0,78 0,66±0,008 1,2
|
*
0,68-0,89 0,75±0,032 4,0
|
*
0,76-0,94 0,83±0,121 14,0
|
*
0,76-1,3 0,90±0,054 5,0
|
0,86-0,99
0,94±0,021 1,7
|
|
FeNo3 2мг/л
|
-
|
0,38-0,56
0,49±0,023 0,4
|
*
0,49-0,64 0,56±0,018 3,2
|
0,60-0,80
0,64±0,032 5,8
|
*
0,59-0,94 0,72±0,041 5,7
|
0,69-0,87
0,76±0,043 5,2
|
|
Примечание:
«*» - значения достоверны на 5%-ном уровне значимости «-» - измерения
прироста в первый день исследования не проводятся
|
Таблица 6 - Прирост основного побега элодеи в
растворах солей тяжелых металлов и в контроле (lim,
x±m,
Cv)
|
Вариант
опыта
|
Дни
исследования
|
|
1й
|
5й
|
10й
|
15й
|
20й
|
25й
|
30й
|
|
Контроль
|
-
|
0,67-0,79
0,72±0,002 0,4
|
0,68-0,81
0,74±0,003 0,4
|
*
0,76-0,86 0,81±0,022 2,8
|
0,79-0,86
0,83±0,008 0,9
|
0,79-0,95
0,88±0,004 0,4
|
*
0,87-0,95 0,91±0,002 0,2
|
|
Co(No3)2 1мг/л
|
-
|
0,40-0,90
0,66±0,011 1,7
|
*
0,50-1,0 0,74±0,006 0,9
|
0,60-1,2
0,77±0,093 13,1
|
*
0,70-1,3 0,88±0,035 3,6
|
*
0,60-1,4 0,94±0,017 1,8
|
*
0,80-1,3 1,02±0,042 4,5
|
|
Co(No3)2 2мг/л
|
-
|
0,60-1,0
0,83±0,031 3,9
|
*
0,60-1,4 0,92±0,009 1,0
|
0,80-1,2
0,94±0,063 6,2
|
*
0,90-1,4 1,01±0,042 4,5
|
0,80-1,3
1,06±0,131 17,5
|
1,0-1,4
1,15±0,036 3,1
|
|
Ni(No3)2 1мг/л
|
-
|
0,60-1,0
0,74±0,071 10
|
0,50-0,9
0,73±0,054 6,9
|
*
0,80-1,3 0,81±0,005 0,5
|
*
0,90-1,1 0,93±0,014 1,5
|
0,80-1,2
0,95±0,054 5,7
|
*
0,80-1,4 1,12±0,052 4,7
|
|
Ni(No3)2 2мг/л
|
-
|
0,30-0,80
0,61±0,013 1,8
|
*
0,60-0,90 0,76±0,047 6,2
|
*
0,70-1,0 0,82±0,132 15,9
|
*
0,70-1,2 0,92±0,134 14,5
|
*
0,80-1,4 1,05±0,221 19,4
|
0,90-1,3
1,05±0,225 24,0
|
|
FeNo3 1мг/л
|
-
|
0,54-0,80
0,65±0,041 6,3
|
0,60-0,80
0,69±0,009 1,3
|
*
0,65-0,85 0,74±0,353 47,1
|
*
0,69-0,9 0,82±0,022 2,4
|
0,75-0,92
0,85±0,024 1,9
|
0,86-0,95
0,89±0,014 1,6
|
|
FeNo3 2мг/л
|
-
|
0,55-0,64
0,59±0,025 4,5
|
*
0,57-0,71 0,65±0,062 8,7
|
0,62-0,75
0,68±0,083 11,8
|
*
0,69-0,79 0,73±0,094 12,0
|
*
0,79-0,83 0,81±0,452 54,0
|
0,79-0,83
0,83±0,451 56,0
|
|
Примечание:
«-» - измерения прироста в первый день исследования не проводятся «*» -
значения достоверны на 5%-ном уровне значимости
|
Таблица 7 - Число боковых отростков роголистника
в растворах солей тяжелых металлов и в контроле (lim,
x±m,
Cv)
|
Вариант
опыта
|
Дни
исследования
|
|
1й
|
5й
|
10й
|
15й
|
20й
|
25й
|
30й
|
|
Контроль
|
49,0-55,0
52,0±7,64 14,5
|
49,0-57,0
53,0±7,66 20,1
|
48,0-62,0
54,0±12,19 23,0
|
54,0-63,0
58,4±11,28 19,2
|
56,0-70,0
62,0±3,26 5,0
|
64,0-77,0
65,0±18,70 26,0
|
63,0-73,0
68,0±8,32 12,0
|
|
Co(No3)2 1мг/л
|
43,0-50,0
45,0± 2,11 4,2
|
46,0-58,0
50,0± 2,13 3,8
|
47,0-61,0
54,0±1,13 2,0
|
55,0-67,0
61,0±5,15 9,2
|
54,0-70,0
64,0±3,21 5,1
|
60,0-80,0
68,0±11,13 16,4
|
63,0-80,0
71,0±4,71 6,7
|
|
Co(No3)2 2мг/л
|
40,0-55,0
47,0± 2,23 5,1
|
43,0-57,0
53,0± 2,32 6,1
|
45,0-59,0
57,0±1,51 2,6
|
55,0-73,0
62,0±6,81 9,1
|
59,0-70,0
64,0±9,36 15,0
|
58,0-73,0
65,0±28,10 44,2
|
64,0-73,0
68,0±9,30 13,0
|
|
Ni(No3)2 1мг/л
|
46,0-57,0
51,0±5,10 8,7
|
50,0-62,0
55,0±5,04 4,2
|
52,0-63,0
58,0±8,03 4,5
|
53,0-64,0
59,6±12,30 20,0
|
57,0-72,0
62,0±32,10 52,0
|
59,0-70,0
64,0±3,26 5,5
|
58,0-69,0
64,0±12,20 18,4
|
|
Ni(No3)2 2мг/л
|
31,0-45,0
38,0±2,71 5,0
|
34,0-42,0
38,0±2,17 4,0
|
39,0-50,0
42,6±8,60 18,7
|
37,0-46,0
42,7±7,19 16,6
|
39,0-52,0
45,8±3,08 6,5
|
48,0-56,0
51,2±5,71 11,2
|
46,0-57,0
51,4±3,27 6,2
|
|
FeNo3 1мг/л
|
46,0-60,0
53,0±5,31 9,1
|
49,0-65,0
58,0±5,39 8,2
|
56,0-67,0
62,0±5,27 9,0
|
59,0-73,0
66,0±17,04 8,5
|
59,0-75,0
67,7±18,43 27,3
|
63,0-74,0
68,7±1,06 1,4
|
65,0-78,0
71,2±14,11 19,8
|
|
FeNo3 2мг/л
|
42,0-56,0
49,0±6,29 16,0
|
49,0-57,0
50,0±7,66 20,1
|
42,0-58,0
50,0±12,64 24,2
|
47,0-56,0
52,5±1,47 2,8
|
49,0-60,0
54,2±0,71 1,2
|
49,0-62,0
56,0±3,31 6,0
|
63,0-73,0
68,0±8,32 12,0
|
Таблица 8 - Число боковых отростков элодеи в
растворах солей тяжелых металлов и в контроле (lim,
x±m,
Cv)
|
Вариант
опыта
|
Дни
исследования
|
|
1й
|
5й
|
10й
|
15й
|
20й
|
25й
|
30й
|
|
Контроль
|
7,0-11,0
9,5±1,46 13,4
|
8,0-11,0
9,7±1,43 14,6
|
9,0-11,0
10,0±1,51 11,0
|
9,0-12,0
10,6±1,81 17,0
|
10,0-13,0
11,8±0,26 2,2
|
10,0-17,0
13,0±1,61 12,8
|
10,0-17,0
14,0±1,62 12,0
|
|
Co(No3)2 1мг/л
|
6,0-11,0
8,0±2,32 22,3
|
7,0-13,0
10,0±2,23 22,2
|
9,0-13,0
10,9±0,42 3,9
|
10,0-13,0
11,7±0,36 3,4
|
11,0-13,0
12,3±0,48 3,8
|
11,0-13,5
12,5±1,92 15,2
|
11,0-14,0
13,0±0,28 7,0
|
|
Co(No3)2 2мг/л
|
5,0-10,0
7,2±1,21 16,1
|
5,0-10,0
7,3±1,65 22,6
|
6,0-10,0
7,9±1,51 13,7
|
6,0-11,0
9,2±0,25 2,7
|
7,0-12,0
11,0±1,62 15,0
|
9,0-12,0
10,5±0,85 7,6
|
11,0-13,0
11,4±0,75 6,6
|
|
Ni(No3)2 1мг/л
|
8,0-12,0
8,2±0,41 5,3
|
8,0-11,0
9,4±0,69 6,5
|
7,0-12,0
9,5±1,25 16,4
|
9,0-12,0
10,4±2,36 22,2
|
9,0-12,0
10,5±2,43 23,4
|
10,0-13,0
11,3±0,98 8,6
|
11,0-13,0
12,0±1,67 13,0
|
|
Ni(No3)2 2мг/л
|
6,5-10,0
6,3±1,16 17,6
|
6,5-10,0
7,5±1,42 19,5
|
7,0-10,0
8,2±0,62 2,4
|
8,0-10,0
9,2±0,34 3,2
|
9,0-12,0
10,9±0,14 1,3
|
10,0-13,0
11,0±1,67 15,4
|
10,0-12,0
11,3±1,42 10,5
|
|
FeNo3 1мг/л
|
6,0-9,0
7,0±1,61 9,4
|
6,5-10,0
8,5±1,42 19,5
|
8,0-11,0
9,0±1,21 10,6
|
9,0-12,0
10,6±0,82 8,3
|
10,0-12,0
11,0±1,63 13,5
|
9,0-13,0
11,0±1,35 11,5
|
10,0-13,0
11,6±1,22 10,0
|
|
FeNo3 2мг/л
|
7,0-9,0
8,0±0,34 3,2
|
8,0-11,0
9,4±0,46 4,5
|
8,0-12,0
9,6±0,64 5,8
|
9,0-12,0
10,2±0,34 2,8
|
9,0-12,0
10,2±0,32 2,8
|
10,0-13,0
11,5±0,72 6,1
|
10,0-13,0
11,6±0,67 4,9
|
Таблица 9 - Длина боковых отростков роголистника
в растворах солей тяжелых металлов и в контроле (lim,
x±m,
Cv)
|
Вариант
опыта
|
Дни
исследования
|
|
1й
|
5й
|
10й
|
15й
|
20й
|
25й
|
30й
|
|
Контроль
|
1,0-1,3
1,2±0,12 8,0
|
1,0-1,5
1,2±0,14 8,0
|
1,0-1,7
1,3±0,25 19,6
|
1,1-1,7
1,4±0,32 24,4
|
1,2-1,7
1,5±0,02 4,5
|
*
1,3-1,7 1,6±0,26 17,4
|
1,5-1,9
1,7±0,06 3,5
|
|
Co(No3)2 1мг/л
|
1,0-1,2
1,1±0,43 31,0
|
1,0-1,4
1,2±0,42 31,2
|
1,1-1,5
1,2±0,05 1,25
|
1,0-1,5
1,2±0,19 16,3
|
1,0-1,5
1,2±0,42 33,0
|
1,1-1,5
1,3±1,26 12,5
|
1,1-1,5
1,3±0,04 2,8
|
|
Co(No3)2 2мг/л
|
0,9-1,1
1,0±1,14 11,3
|
0,9-1,2
1,0±1,13 11,3
|
0,9-1,3
1,0±0,22 17,4
|
1,0-1,5
1,1±0,02 2,3
|
*
1,2-1,7 1,4±0,82 24,3
|
1,3-1,7
1,4±0,31 7,4
|
*
1,4-1,7 1,5±0,32 17,0
|
|
Ni(No3)2 1мг/л
|
1,0-1,2
1,1±0,32 18,0
|
1,0-1,4
1,2±0,92 18,1
|
1,0-1,8
1,3±0,03 2,5
|
*
1,3-1,7 1,5±0,03 0,7
|
1,3-1,8
1,6±0,31 19,0
|
1,4-1,9
1,6±0,81 9,0
|
1,5-1,8
1,6±0,27 11,0
|
|
Ni(No3)2 2мг/л
|
1,1-1,3
1,2±0,62 14,2
|
1,0-1,3
1,2±0,24 14,4
|
1,1-1,5
1,2±0,16 7,8
|
1,1-1,7
1,3±0,08 2,6
|
1,3-1,7
1,4±0,03 2,3
|
*
1,4-1,7 1,5±0,24 16,4
|
*
1,4-1,8 1,6±0,14 22,0
|
|
FeNo3 1мг/л
|
1,0-1,2
1,1±0,16 15,0
|
1,0-1,3
1,1±0,16 15,0
|
1,0-1,4
1,1±0,09 7,0
|
1,0-1,5
1,2±0,13 7,0
|
1,2-1,5
1,3±0,09 6,3
|
1,3-1,4
1,4±0,05 3,5
|
1,3-1,5
1,4±0,05 3,5
|
|
FeNo3 2мг/л
|
1,0-1,3
1,2±0,01 1,3
|
1,0-1,3
1,2±0,02 1,3
|
1,0-1,5
1,3±0,03 2,5
|
1,1-1,6
1,4±0,27 12,3
|
1,2-1,7
1,4±1,67 11,1
|
1,3-1,7
1,5±0,05 3,5
|
1,3-1,7
1,5±0,17 11,0
|
|
Примечание:
«*»- значения достоверны на 5%-ном уровне значимости
|
Таблица 10 - Длина боковых отростков элодеи в
растворах солей тяжелых металлов и в контроле (lim,
x±m,
Cv)
|
Вариант
опыта
|
Дни
исследования
|
|
1й
|
5й
|
10й
|
15й
|
20й
|
25й
|
30й
|
|
Контроль
|
0,6-0,9
0,8±0,03 3,9
|
0,7-1,0
0,8±0,03 4,2
|
0,8-1,3
0,9±0,03 0,3
|
*
0,90-1,5 1,2±0,05 3,7
|
1,0-1,7
1,3±0,02 1,0
|
1,0-1,9
1,4±0,01 0,5
|
1,3-1,8
1,5±0,01 0,7
|
|
Co(No3)2 1мг/л
|
0,3-0,8
0,5±0,12 17,1
|
0,4-0,8
0,5±0,13 19,6
|
0,5-0,9
0,6±0,19 28,6
|
0,70-0,90
0,7±0,04 5,2
|
0,70-1,0
0,8±0,04 4,3
|
8,0-1,0
0,9±0,45 12,8
|
*
0,80-1,2 1,1±0,09 8,7
|
|
Co(No3)2 2мг/л
|
0,5-0,8
0,7±0,01 0,9
|
0,5-0,9
0,7±0,01 0,9
|
0,6-0,9
0,7±0,01 0,8
|
* 0,60-0,90 0,8±0,01 1,2
|
0,60-0,90
0,8±0,04 5,0
|
* 0,80-1,0 0,9±0,05 6,3
|
0,80-1,0
0,9±0,05 5,3
|
|
Ni(No3)2 1мг/л
|
0,4-1,0
0,6±0,06 7,3
|
* 0,5-1,0 0,7±0,06 7,3
|
* 0,5-1,2 0,8±0,06 6,8
|
0,80-1,4
0,8±0,05 6,4
|
* 0,80-1,2 0,9±0,52 55,3
|
* 0,90-1,4 1,2±0,01 0,8
|
1,0-1,5
1,3±0,13 10,2
|
|
Ni(No3)2 2мг/л
|
0,5-1,2
0,7±0,02 2,4
|
* 0,5-1,4 0,8±0,05 2,7
|
* 0,6-1,3 0,9±0,55 64,5
|
* 0,70-1,4 1,0±0,09 9,9
|
* 0,80-1,5 1,2±0,24 16,9
|
* 0,90-1,5 1,3±0,23 18,0
|
0,90-1,7
1,3±0,03 2,0
|
|
FeNo3 1мг/л
|
0,7-1,2
0,8±0,14 16,2
|
0,7-1,2
0,8±0,14 16,2
|
* 0,8-1,3 1,0±0,02 2,5
|
* 0,9-1,4 1,2±0,11 7,7
|
1,0-1,5
1,2±0,01 0,4
|
* 1,1-1,9 1,4±0,06 4,7
|
* 1,4-2,0 1,6±0,01 0,7
|
|
FeNo3 2мг/л
|
0,5-0,9
0,6±0,05 7,4
|
0,5-0,9
0,6±0,05 7,4
|
* 0,7-1,0 0,7±0,35 39,3
|
* 0,8-1,2 0,8±0,45 45,2
|
* 0,9-1,4 0,9±0,11 9,9
|
* 0,9-1,6 1,2±0,13 11,4
|
1,1-1,7
1,2±0,02 1,8
|
|
Примечание:
«*»- значения достоверны на 5%-ном уровне значимости
|
ЗАКЛЮЧЕНИЕ
Таким образом, изучение оксидов тяжелых металлов
FеO,
СuO, NiO
в наноформе в опытах с гуппи позволило сделать следующие выводы:
. В результате лабораторных исследований
выяснено, что оксиды тяжёлых металлов оказывают отрицательное воздействие на
показатели выживаемости аквариумных рыб гуппи. Однако оксид кобальта наиболее
активен в своем отрицательном воздействии по сравнению с другими, применяемыми
в исследовании оксидами тяжелых металлов. Именно добавление оксида кобальта в
наноформе привело к 100% - ной их смертности. Различий в длине и массе тела
гуппи в контроле и вариантах опытов не обнаружено. Отсюда сделано
предположение, что оксиды тяжёлых металлов в наноформе на данные показатели
онтогенеза не влияют. В контроле и опыте с NiO
в наноформе у гуппи происходило живорождение, в отличие от других вариантов
опыта. Данная особенность может заключать в себе тот факт, что оксид никеля в
наноформе не изменял репродуктивные способности гуппи.
Исследование действия солей тяжелых металлов FеNO3,
Сo(NO3)2,
Ni(NO3)2
в ионной форме в опытах с водными растениями позволило сделать следующие
выводы:
. Сопоставление морфологических характеристик
листьев растений элодеи, сформировавшихся за 30 суток на побегах, росших в
присутствии различных тяжелых металлов, показало, что рост побегов и структура
листьев существенно различались. Наибольший прирост побегов наблюдали в
варианте с Ni(NO3)2. У
растений, выращенных в присутствии Ni(No3)2
побеги росли медленнее и их прирост был незначительным. Можно предположить, что
Ni(No3)2
оказывал большее отрицательное влияние на процессы деления и растяжения клеток,
чем другие изученные металлы в такой же концентрации. Наши наблюдения показали,
что у элодеи и сальвинии даже в норме при лабораторном содержании,
морфо-физиологические показатели подвержены изменчивости. Наиболее стабильным
показателем у элодеи является выживаемость, менее вариабелен показатель
прироста основного побега, а показатели числа и длины боковых отростков сильно
изменчивы. У сальвинии менее изменчивы показатели числа лопастей и числа
корней, большей вариабельности подвержены длина корней и особенно число
растений. Причиной такой изменчивости показателей за разные периоды
исследований могут быть температура и качество воды. Аккумуляция и элиминация
тяжёлых металлов водными растениями зависит от особенностей вида растения,
природы тяжелых металлов, их концентрации и продолжительности воздействия.
Тяжёлые металлы у высших водных растений вызывали ряд физиологических
изменений, таких как изменение роста биомассы, ионы кобальта сильно подавляли
рост растений, а ионы железа и никеля только замедляли рост. Величина прироста
основного побега, число и длина боковых отростков и корней элодеи, а также
число растений и длина корней сальвинии колеблются в зависимости от качества воды.
Наибольшей чувствительностью к группе исследованных токсических соединений
обладала сальвиния, среднечувствительной была элодея, и наименьшую
чувствительность проявил роголистник. Отмечена высокая чувствительность
корневой системы сальвинии к действию токсических веществ, несколько меньшая -
боковых отростков элодеи.
3. Исходя из полученных данных,
можно предположить, что все растворы, используемых в опыте солей тяжелых
металлов, действуют на взятые для анализа параметры высших водных растений
по-разному. Чаще своё отрицательное влияние на морфо-физиологическте признаки
высших растений проявляет раствор соли Ni(NO3)2
концентраций 1 и 2 мг/л, больше положительного влияния наблюдается у растворов
солей Co(No3)2
1мг/л и FeNo31мг/л.
Нейтрально проявили себя растения в растворах солей Co(No3)2
2мг/л и FeNo32мг/л.
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1.
Адамова A.A., Босин А.Г. Естественное содержание некоторых микроэлементов в
рыбах Баренцова моря // Гигиена и санитария. 1949. №11. С. 34-38.
2. Артамонов В.И. Растения и чистота природной
среды. М.: Наука, 1986. 172 с.
. Борисова Г.Г., Чукина Н.В. Исследование
химического состава гидрофитов при разных уровнях воздействия на водные
экосистемы // Водное хозяйство России. 2008. № 2. С. 68-82.
4.
Брень Н.В., Домашлинец В.Г. Беспозвоночные как мониторы полиметаллического
загрязнения донных // Гидробиологический журнал. 1998. Т. 34, №5. С. 80-93.
5. Брагинский Л.П. Принципы классификации и
некоторые механизмы структурно-функциональных перестроек пресноводных экосистем
в условиях антропогенного пресса // Гидробиологический журнал. 1998. Т.34, № 6.
С. 72-93.
. Будников Г.К. Тяжелые металлы в экологическом
мониторинге водных систем // Соросовский образовательный журнал. 1998. №5. С.
23-29.
8.
Власов Б.П., Гигевич Г.С. Использование высших водных растений для оценки и
контроля за состоянием водной среды: Метод. рекомендации. Минск: БГУ, 2002. 84
с.
.
Грубинко В.В., Костюк К.В. Структурные изменения в клеточных мембранах водных
растений при действии токсических веществ // Гидробиологический журнал. 2011.
Т.47. №6. С. 43-58.
.
Гусева Т.В., Молчанова Я.П. Гидрохимические показатели состояния окружающей
среды. Справочные материалы. М.: Эколайн. 2000. С. 25
11. Деви С.Р., Прасад М.Н. Антиокислительная
активность растений Brassica juncea, подвергнутых действию высоких концентраций
меди // Физиология растений. 2005. Т. 52. С. 233-237.
. Демидчик В.В., Соколик А.И. Токсичность
избытка меди и толерантность к нему растений // Успехи современной биологии.
2001. Т. 121. С. 511-525.
13.
Золотухина Е.Ю., Гавриленко Е.Е. Тяжелые металлы в водных растениях.
Аккумуляция и токсичность // Биологич. науки. 1989. №9. С. 93-106.
.
Ипатова В.И. Адаптация водных растений к стрессовым абиотическим факторам
среды. М.: Графикон-принт. 2005. 224 с.
.
Костюк К.В., Грубинко В.В. Изменение состава клеточных мембран водных растений
при воздействии токсических веществ // Гидробиологический журнал. 2012. Т. 48,
№ 2. С. 84-92.
.
Лакин Г.Ф. Биометрия. М.:Высшая школа, 1980. 293 с.
.
Лукина Л.Ф. Смирнова Н.Н. Физиология высших водных растений. Киев: Наукова
думка. 1988. 187с.
.
Линник П.Н., Васильчук Т.А. Сосуществующие формы тяжелых метллов в
поверхностных водах Украины и роль органических веществ в их миграции // Методы
и объекты химического анализа. 2008. Т. 2. № 2. С. 130-145.
.
Линник П.Н., Зубко А.В. Адсорбция тяжелых металлов донными отложениями в
присутствии гумусовых веществ // Гидробиологический журнал. 2005. Т. 41, № 3.
С. 104-119.
.
Линник П.Н., Набиванец Б.И. Формы миграции металлов в пресных поверхностных
водах. Л.: Гидрометиздат. 1986. 270 с.
.
Линник Л.Н., Щербань Э.П. Оценка токсичности форм меди в природных водах
методом биотестирования в сочетании с хемилюминесцентным определением
концентрации свободных ионов Cu2+
// Экологическая химия. 1999. Т. 8, № 3. С.168-176.
22. Матвеев В.И., Соловьева В.В. Экология водных
растений: Учебное пособие. Издание 2-е, дополненное и переработанное. Самара:
Изд-во Самарского научного центра РАН. 2005. 282 с.
23.
Мелехова О.П. Оценка эмбриотоксичности водной среды // Известия РАН. Серия
биологическая. №4. 1994. С. 661- 665.
.
Микрякова Т.Ф. Накопление тяжелых металлов макрофитами в условиях различного
уровня загрязнения водной среды // Водные ресурсы. 2002. Т. 29. №2. С. 253-
255.
.
Моисеева Т.И. Рассеянные элементы в поверхностных водах суши: Технофильность,
биоаккумуляция и экотоксикология. М.: Наука, 2006. 216 с.
.
Мур Дж. В., Рамамурти С. Тяжелые металлы в природных водах. М.: Мир, 1987. 285
с.
.
Нахшина Е.П. Тяжелые металлы в системе «вода - донные отложения» водоемов //
Гидробиологический журнал. 1985. Т. 21. №2. С. 80-90.
28. Немова Н.Н. Биохимические эффекты накопления
ртути у рыб. М.: Наука, 2005. 164 с.
29.
Перевозников М.А., Понаморенко A.M. Распространение тяжелых металлов среди
различных звеньев экосистемы бассейна Ладожского озера. СПб.: ГосНИОРХ, 1990.
25 с.
.
Полевой, В.В. Физиология растений. М.: Высш. шк., 1989. 464с.
31. Светашева Е.С. Накопление тяжелых металлов и
нормирование их содержания в водных экосистемах // Материалы 3 Всерос. конф. по
вод. токсикологии «Антропогенное влияние на водные организмы и экосистемы».
Борок, 11-16 нояб. 2008 г. Борок: Яросл. печат. двор, 2008. Ч.З. С. 121 - 123.
32.
Сергеева Н.Р., Лукьяненко В.И. Общая ихтиотоксикология. Краснодар, 2008. 157с.
33. Серегин И.В., Кожевникова А.Д.
Физиологическая роль никеля и его токсическое действие на высшие растения //
Физиология растений. 2006. Т. 53. С. 285-308
34.
Улахович Н.А. Комплексы металлов в живых организмах // Соросовский образовательный
журнал. 1997. № 8. С. 27-32.
.
Фисенко О. Ф., Хоботьев В. Г. Загрязнение металлами // Общая экология,
биоценология, гидробиология. 1986. Вып. 3. С. 110-145
.
Флеров Б.А. Эколого-физиологические аспекты токсикологии пресноводных животных.
Л.: Наука, 1989. 138 с.
.
Христофорова Н.К. Биоиндикация и мониторинг загрязнения морских вод тяжелыми
металлами. М.: Мир, 1989. 267 с.
.
Чернавская Н.М., Кожанова О.Н. Физиология растительных организмов и роль
металлов. М.: Изд-во МГУ, 1989. 157с.
.
Чиркова T.B. Физиологические основы устойчивости растений. Спб.: Изд-во Петерб.
ун-та, 2002. 244 с.
40. Яковлева О.В. Изучение параметров
флуоресценции хлорофилла в листьях травянистых растений, растущих в разных
экологических условиях // Биофизика. 2005. Т.
50. С.
112- 119.
. Bhattacharjee S. Reactive Oxygen
Species and Oxidative Burst: Roles in Stress, Senescence and Signal
Transduction in Plants // Curr. Sci. 2005. V. 89. P. 1113-1121.
42.
Blokhina O., Virolainen E.. Antioxidants, Oxidative Damage and Oxygen Deprivation
Stress: a Review // Annals of Bot. 2003. V.91. P. 179-194
.
Bury N.R. Nutritive metal uptake in teleost fish // J. Exp. Biol. 2003. Vol.
206, № 1. Р. 11-23.
.
Cobbett C., Goldsbrough P. Phytochelatins and metallothioneins: roles in heavy
metal detoxification and homeostasis // Annu. Rev. PlantBiol. 2002. V.53.
P.159-182.
.
Gallego S.M., Benavides M.P. Effect of heavy metal ion excess on sunflower
leaves: evidence for involvement of oxidative stress // Plant Sci. 1996.
Vol.121. P.151-159.
46. Maleva M.G. Ecophysiological
Tolerance of Elodea canadensis to Nickel Exposure // Chemosphere. 2009. V. 77.
P. 392-398.
. Malec P., Maleva M.G.
Identification and Characterization of Cd-Induced Peptides in Egeria densa
(Water Weed): Putative Role in Cd Detoxification // Aquat. Toxicol. 2009. V.
95. P. 213-221.
48.
Rozan T.F., Benoit G. Geochemical fators controlling free Cu ion concentrations
in river water // geochim. Cosmochim. Acta. 1999. Vol. 63, №19/20. Р.
311 - 319.
49. Schutzendubel A., Polle A. Plant
Responses to Abiotic Stress: Heavy Metal-Induced Oxidative Stress and
Protection by Mycorhization // J. Exp. Bot. 2002. V. 53. P. 1351-1365.
ПРИЛОЖЕНИЕ А
Данные1-го
дня исследования
|
Объект
|
Исследуемый
показатель
|
Ёмкости
|
|
|
Co(NO3)2 1 мг/л
|
Co(NO3)2 2 мг/л
|
Ni(NO3)2 1 мг/л
|
Ni(NO3)2 2 мг/л
|
FeNO3 1 мг/л
|
FeNO3 2мг/л
|
Контроль
|
|
Роголистник
|
Выживаемость,
%
|
100
|
100
|
100
|
100
|
100
|
100
|
100
|
|
Число
боковых отростков, шт
|
43,0-50,0
45,0± 2,11 4,2
|
40,0-55,0
47,0± 2,23 5,1
|
46,0-57,0
51,0±5,10 8,7
|
31,0-45,0
38,0±2,71 5,0
|
46,0-60,0
53,0±5,31 9,1
|
42,0-56,0
49,0±6,29 16,0
|
49,0-55,0
52,0±7,6 14,5
|
|
Длина
боковых отростков, см
|
1,0-1,2
1,1±0,43 31,0
|
0,9-1,1
1,0±1,14 11,3
|
1,0-1,2
1,1±0,32 18,0
|
1,1-1,3
1,2±0,62 14,4
|
1,0-1,2
1,1±0,16 15,0
|
1,0-1,3
1,2±0,01 1,3
|
1,0-1,3
1,2±0,12 8,0
|
|
Сальвиния
|
Выживаемость,
%
|
100
|
100
|
100
|
100
|
100
|
100
|
100
|
|
Число
лопастей, шт
|
2,0-5,0
3,3±0,24 13,0
|
2,0-5,0
3,1±0,61 20,9
|
2,0-4,0
3,0±0,15 5,8
|
1,0-3,0
2,4±0,32 13,0
|
2,0-4,0
2,6±0,22 8,7
|
1,0-3,0
2,5±0,63 28,0
|
1,0-5,0
2,9±0,01 3,7
|
|
Число
корней, шт
|
12,0-19,0
16,5±0,64 4,3
|
16,0-18,0
17,8±1,66 9,2
|
20,0-21,0
20,5±0,34 2,1
|
10,0-21,0
16,5±2,50 15,0
|
13,0-17,0
14,5±0,18 4,9
|
15,0-20,0
17,3±4,03 20,2
|
16,0-20,0
16,3±0,14 2,3
|
|
Длина
корней, см
|
0,29-0,56
0,2±0,32 6,5
|
0,13-0,54
0,3±0,04 14,8
|
0,40-1,30
0,8±0,09 11,7
|
0,30-0,90
0,6±0,002 4,0
|
0,26-0,58
0,4±0,013 3,1
|
0,18-0,69
0,4±0,21 2,4
|
0,46-0,68
0,5±0,04 4,6
|
|
Элодея
|
Выживаемость,
%
|
100
|
100
|
100
|
100
|
100
|
100
|
100
|
|
Число
боковых отростков, шт
|
6,0-11,0
8,0±2,32 22,3
|
5,0-10,0
7,2±1,21 16,1
|
8,0-12,0
8,2±0,41 5,3
|
6,5-10,0
6,3±1,16 17,6
|
6,0-9,0
8,0±1,61 9,4
|
7,0-9,0
8,0±0,34 3,2
|
7,0-11,0
9,5±1,46 13,4
|
|
Длина
боковых отростков, см
|
0,3-0,8
0,5±0,12 17,1
|
0,5-0,8
0,68±0,005 0,9
|
0,4-1,0
0,63±0,063 7,3
|
0,5-1,2
0,7±0,02 2,4
|
0,7-1,2
0,8±0,14 16,2
|
0,5-0,9
0,6±0,05 7,4
|
0,6-0,9
0,8±0,03 3,9
|
Данные 5-го дня исследования
|
Объект
|
Исследуемый
показатель
|
Ёмкости
|
|
|
Co(NO3)2 1 мг/л
|
Co(NO3)2 2 мг/л
|
Ni(NO3)2 1 мг/л
|
Ni(NO3)2 2 мг/л
|
FeNO3 1 мг/л
|
FeNO3 2мг/л
|
Контроль
|
|
Роголистник
|
Выживаемость,
%
|
100
|
100
|
100
|
100
|
100
|
100
|
100
|
|
Прирост
основного побега, см
|
0,49-0,86
0,73±0,027 3,7
|
0,28-0,52
0,38±0,013 3,3
|
0,39-0,59
0,53±0,022 0,9
|
0,29-0,46
0,38±0,011 2,1
|
0,48-0,56
0,52±0,017 1,9
|
0,38-0,56
0,49±0,024 0,4
|
0,66-0,86
0,68±0,022 0,4
|
|
Число
боковых отростков, шт
|
46,0-58,0
50,0± 2,13 3,8
|
43,0-57,0
46,0± 2,32 6,1
|
50,0-62,0
57,0±5,04 4,2
|
34,0-42,0
38,0±2,17 4,0
|
49,0-65,0
58,0±5,39 8,2
|
42,0-53,0
43,0±6,97 13,0
|
49,0-57,0
53,0±7,66 20,1
|
|
Длина
боковых отростков, см
|
1,0-1,4
1,2±0,42 31,2
|
0,9-1,2
1,0±1,13 11,3
|
1,0-1,4
1,2±0,92 18,1
|
1,0-1,3
1,6±0,24 14,4
|
1,0-1,3
1,1±0,16 15,0
|
1,0-1,3
1,14±0,016 1,3
|
1,0-1,5
1,2±0,14 8,0
|
|
Сальвиния
|
Выживаемость,
%
|
100
|
100
|
100
|
100
|
100
|
100
|
100
|
|
Число
лопастей, шт
|
2,0-5,0
3,6±0,43 13,3
|
2,0-5,0
3,1±0,62 20,9
|
2,0-5,0
3,3±0,81 5,8
|
1,0-3,0
2,4±0,32 13,5
|
2,0-4,0
2,6±0,22 8,7
|
1,0-3,0
2,6±0,61 28,6
|
1,0-5,0
2,9±0,01 3,7
|
|
Число
корней, шт
|
13,0-20,0
16,5±0,73 4,2
|
16,0-20,0
17,8±1,6 9,8
|
21,0-22,0
21,3±0,4 2,6
|
13,0-22,0
17,5±2,0 12,8
|
13,0-19,0
16,4±0,8 4,9
|
17,0-24,0
21,3±4,0 20,1
|
17,0-23,0
19,3±0,4 2,5
|
|
Длина
корней, см
|
0,30-0,60
0,3±0,02 6,5
|
0,10-0,60
0,3±0,04 14,8
|
0,40-1,30
0,8±0,09 11,7
|
0,30-0,90
0,61±0,002 4,2
|
0,30-0,60
0,44±0,013 3,1
|
0,20-0,70
0,4±0,01 2,6
|
0,50-0,90
0,7±0,04 4,7
|
|
Элодея
|
Выживаемость,
%
|
100
|
100
|
100
|
100
|
100
|
100
|
100
|
|
Прирост
основного побега, см
|
0,40-0,90
0,6±0,01 1,7
|
0,60-1,0
0,8±0,03 3,9
|
0,60-1,0
0,7±0,07 10,1
|
0,30-0,80
0,5±0,01 1,8
|
0,54-0,80
0,6±0,04 6,3
|
0,55-0,64
0,5±0,02 4,5
|
0,67-0,79
0,7±0,002 0,4
|
|
Число
боковых отростков, шт
|
7,0-13,0
10,0±2,23 22,2
|
5,0-10,0
7,3±1,65 22,6
|
8,0-11,0
9,4±0,69 6,5
|
6,5-10,0
7,5±1,42 19,5
|
8,0-10,0
10,0±1,18 11,9
|
8,0-11,0
9,4±0,46 4,5
|
8,0-11,0
9,7±1,43 14,6
|
|
Длина
боковых отростков, см
|
0,40-0,80
0,5±0,13 19,6
|
0,50-0,90
0,5±0,005 0,9
|
0,50-1,0
0,7±0,06 7,3
|
0,50-1,2
0,78±0,02 2,4
|
0,70-1,2
0,8±0,14 16,2
|
0,50-0,9
0,6±0,05 7,4
|
0,60-0,90
0,8±0,03 3,9
|
Данные 10-го дня исследования
|
Объект
|
Исследуемый
показатель
|
Ёмкости
|
|
|
Co(NO3)2 1 мг/л
|
Co(NO3)2 2 мг/л
|
Ni(NO3)2 1 мг/л
|
Ni(NO3)2 2
мг/л
|
FeNO3 1 мг/л
|
FeNO3 1 мг/л
|
Контроль
|
|
Роголистник
|
Выживаемость,
%
|
100
|
100
|
100
|
100
|
100
|
100
|
100
|
|
Прирост
основного побега, см
|
0,61-0,87
0,7±0,04 3,7
|
0,29-0,54
0,41±0,016 3,6
|
0,64-0,73
0,71±0,005 0,7
|
0,31-0,56
0,4±0,03 5,9
|
0,58-0,78
0,66±0,008 1,2
|
0,49-0,64
0,56±0,018 3,2
|
0,60-0,95
0,6±0,03 4,8
|
|
Число
боковых отростков, шт
|
47,0-61,0
54,0±1,13 2,0
|
45,0-59,0
57,0±1,51 2,6
|
52,0-63,0
58,0±8,03 4,5
|
39,0-50,0
42,6±8,60 18,7
|
56,0-67,0
62,0±5,27 9,0
|
42,0-58,0
50,0±12,64 24,2
|
48,0-62,0
54,0±12,19 23,0
|
|
Длина
боковых отростков, см
|
1,1-1,5
1,2±0,05 1,25
|
0,9-1,3
1,0±0,22 17,4
|
1,0-1,8
1,33±0,003 2,5
|
1,1-1,5
1,2±0,16 7,8
|
1,0-1,4
1,1±0,09 7,0
|
1,0-1,5
1,3±0,03 2,5
|
1,0-1,7
1,3±0,25 19,6
|
|
Сальвиния
|
Выживаемость,
%
|
80
|
60
|
70
|
60
|
60
|
70
|
70
|
|
Число
лопастей, шт
|
3,0-5,0
4,0±0,71 17,4
|
2,0-4,0
3,1±0,01 0,3
|
1,5-4,0
2,6±0,84 30,0
|
2,0-4,0
3,3±1,18 35,2
|
2,0-4,0
3,1±0,82 25,4
|
2,0-4,0
3,0±0,62 20,3
|
3,0-4,0
3,1±0,02 4,9
|
|
Число
корней, шт
|
15,0-18,0
16,7±1,73 10,4
|
15,0-19,0
17,1±0,26 1,2
|
18,0-22,0
20,1±3,81 19,0
|
19,0-23,0
20,6±1,37 6,5
|
13,0-20,0
16,0±5,23 33,0
|
17,0-23,0
19,7±6,53 33,6
|
17,0-24,0
20,6±0,91 4,6
|
|
Длина
корней, см
|
0,4-1,2
0,5±0,04 6,9
|
0,4-1,1
0,6±0,05 8,7
|
0,4-1,4
0,8±0,22 25,3
|
0,5-1,1
0,78±0,009 1,1
|
0,5-0,9
0,6±0,02 2,4
|
0,4-0,7
0,5±0,03 5,2
|
0,6-1,0
0,8±0,04 5,6
|
|
Элодея
|
Выживаемость,
%
|
100
|
100
|
100
|
100
|
100
|
100
|
100
|
|
Прирост
основного побега, см
|
0,5-1,0
0,74±0,006 0,9
|
0,6-1,4
0,92±0,009 1,2
|
0,50-0,9
0,7±0,05 6,9
|
0,6-0,9
0,76±0,047 6,2
|
0,6-0,8
0,69±0,009 1,3
|
0,57-0,71
0,6±0,06 8,7
|
0,68-0,81
0,74±0,003 0,4
|
|
Число
боковых отростков, шт
|
9,0-13,0
10,9±0,42 3,9
|
6,0-10,0
7,9±1,51 13,7
|
7,0-12,0
9,5±1,25 16,4
|
7,0-10,0
8,2±0,62 2,4
|
8,0-11,0
11,0±1,21 10,6
|
8,0-12,0
9,6±0,64 5,8
|
9,0-11,0
10,0±1,51 11,0
|
|
Длина
боковых отростков, см
|
0,6-0,9
0,72±0,005 0,8
|
0,5-1,2
0,8±0,06 6,8
|
0,6-1,3
0,9±0,55 64,5
|
0,8-1,3
0,97±0,024 2,5
|
0,7-1,0
0,8±0,35 39,3
|
0,8-1,3
1,0±0,03 0,3
|
Данные 15-го дня исследования
|
Объект
|
Исследуемый
показатель
|
Ёмкости
|
|
|
Co(NO3)2 1 мг/л
|
Co(NO3)2 2 мг/л
|
Ni(NO3)2 1
мг/л
|
Ni(NO3)2 2
мг/л
|
FeNO3 1 мг/л
|
FeNO3 2 мг/л
|
Контроль
|
|
Роголистник
|
Выживаемость,
%
|
90
|
70
|
90
|
80
|
100
|
90
|
90
|
|
Прирост
основного побега, см
|
0,68-0,86
0,74±0,003 0,4
|
0,34-0,70
0,49±0,004 0,8
|
0,60-0,89
0,76±0,017 0,6
|
0,42-0,68
0,51±0,012 1,9
|
0,68-0,89
0,75±0,036 4,0
|
0,54-0,73
0,61±0,005 0,8
|
0,69-0,93
0,81±0,023 2,6
|
|
Число
боковых отростков, шт
|
55,0-67,0
61,0±5,15 9,2
|
55,0-73,0
62,0±6,81 9,1
|
53,0-64,0
59,6±12,30 20,0
|
37,0-46,0
42,7±7,19 16,6
|
59,0-73,0
66,0±17,04 8,5
|
47,0-56,0
50,5±1,47 2,8
|
54,0-63,0
58,4±11,28 19,2
|
|
Длина
боковых отростков, см
|
1,0-1,5
1,17±0,191 16,3
|
1,0-1,5
1,12±0,023 2,3
|
1,3-1,7
1,51±0,031 0,7
|
1,1-1,7
1,25±0,085 2,6
|
1,0-1,5
1,38±0,135 7,0
|
1,1-1,6
1,28±0,274 12,3
|
1,1-1,7
1,38±0,322 24,4
|
|
Сальвиния
|
Выживаемость,
%
|
30
|
-
|
60
|
50
|
10
|
60
|
60
|
|
Число
лопастей, шт
|
2,0-3,0
2,6±0,57 21,3
|
-
|
2,0-4,0
3,3±0,65 19,4
|
2,0-4,0
3,2±0,21 6,2
|
2,0-4,0
3,0±2,23 73,4
|
2,0-4,0
2,8±1,04 35,3
|
2,0-4,0
3,3±0,82 26,7
|
|
Число
корней, шт
|
16,0-18,0
17,1±0,32 2,3
|
-
|
18,0-22,0
20,1±0,27 1,1
|
19,0-23,0
20,4±6,06 32,8
|
15,0-17,0
16,0±5,02 35,4
|
19,0-25,0
25,4±7,07 30,3
|
18,0-23,0
20,1±4,27 21,4
|
|
Длина
корней, см
|
0,3-0,5
0,43±0,002 5,7
|
-
|
0,6-1,4
0,9±0,09 10,6
|
0,40-1,3
0,8±0,12 14,4
|
0,6-0,8
0,7±0,01 1,6
|
0,40-0,70
0,60±0,035 5,8
|
0,60-1,2
0,8±0,04 4,8
|
|
Элодея
|
Выживаемость,
%
|
80
|
70
|
70
|
60
|
80
|
70
|
80
|
|
Прирост
основного побега, см
|
0,60-1,2
0,6±0,09 13,4
|
0,80-1,2
0,9±0,06 6,2
|
0,80-1,3
1,0±0,005 0,5
|
0,70-1,0
0,8±0,13 15,9
|
0,65-0,85
0,74±0,351 47,4
|
0,62-0,75
0,68±0,082 11,8
|
0,76-0,86
0,81±0,02 2,8
|
|
Число
боковых отростков, шт
|
10,0-13,0
11,7±0,363 3,4
|
6,0-11,0
9,2±0,25 2,7
|
9,0-12,0
10,4±2,36 22,2
|
8,0-10,0
9,2±0,34 3,2
|
9,0-12,0
10,6±0,82 8,3
|
9,0-12,0
10,2±0,34 2,8
|
9,0-12,0
10,6±1,81 17,0
|
|
Длина
боковых отростков, см
|
0,70-0,90
0,7±0,04 5,2
|
0,60-0,90
0,8±0,01 1,2
|
0,80-1,4
0,7±0,05 6,4
|
0,70-1,4
1,0±0,09 9,9
|
0,90-1,4
1,46±0,113 7,7
|
0,80-1,2
0,38±0,45 45,2
|
0,90-1,5
1,2±0,05 3,7
|
|
Примечание:
«-» - полное исчезновение измеряемых объектов, вследствие их гибели
|
Данные 20-го дня исследования
|
Объект
|
Исследуемый
показатель
|
Ёмкости
|
|
|
Co(NO3)2 1 мг/л
|
Co(NO3)2 2 мг/л
|
Ni(NO3)2 1
мг/л
|
Ni(NO3)2 2
мг/л
|
FeNO3 1 мг/л
|
FeNO3 2 мг/л
|
Контроль
|
|
Роголистник
|
Выживаемость,
%
|
80
|
70
|
80
|
70
|
90
|
70
|
90
|
|
Прирост
основного побега, см
|
0,70-0,79
0,75±0,003 0,4
|
0,34-0,73
0,5±0,04 7,0
|
0,68-0,94
0,84±0,024 1,9
|
0,48-0,69
0,6±0,01 2,0
|
0,76-0,94
0,83±0,126 14,0
|
0,60-0,80
0,64±0,031 5,8
|
0,68-0,99
0,8±0,02 2,7
|
|
Число
боковых отростков, шт
|
54,0-70,0
64,0±3,21 5,1
|
59,0-70,0
64,0±9,36 15,0
|
57,0-72,0
62,0±32,10 52,0
|
39,0-52,0
45,8±3,08 6,5
|
59,0-75,0
67,7±18,43 27,3
|
49,0-60,0
54,2±0,71 1,2
|
56,0-70,0
62,0±3,26 5,0
|
|
Длина
боковых отростков, см
|
1,0-1,5
1,22±0,42 33,0
|
1,2-1,7
1,4±0,82 24,3
|
1,3-1,7
1,4±0,31 19,0
|
1,3-1,7
1,4±0,03 2,3
|
1,2-1,5
1,3±0,09 6,3
|
1,2-1,7
1,4±1,67 11,1
|
1,3-1,9
1,56±0,016 4,5
|
|
Сальвиния
|
Выживаемость,
%
|
10
|
-
|
50
|
50
|
10
|
50
|
40
|
|
Число
лопастей, шт
|
1,0-2,0
1,5±0,41 28,2
|
-
|
2,0-6,0
4,0±0,05 6,3
|
3,0-6,0
4,0±0,35 27,1
|
1,0-2,0
1,0±1,30 50,1
|
1,0-3,0
2,0±0,74 39,5
|
3,0-4,0
3,25±0,33 9,1
|
|
Число
корней, шт
|
17,0-18,0
17,5±2,90 16,1
|
-
|
18,0-23,0
20,4±4,10 19,4
|
15,0-22,0
17,8±9,0 52,0
|
13,0-15,0
14,0±5,0 37,2
|
17,0-25,0
20,0±2,5 12,0
|
19,0-23,0
20,7±7,1 34,1
|
|
Длина
корней, см
|
0,30-0,40
0,35±0,044 11,7
|
-
|
0,70-1,50
1,12±0,121 11,5
|
0,50-1,0
0,7±0,08 10,3
|
0,40-0,60
0,5±0,12 20,0
|
0,30-0,60
0,4±0,05 9,6
|
0,60-1,4
0,9±0,15 15,7
|
|
Элодея
|
Выживаемость,
%
|
70
|
70
|
60
|
60
|
70
|
60
|
70
|
|
Прирост
основного побега, см
|
0,70-1,3
0,8±0,03 3,6
|
0,90-1,4
1,0±0,04 4,5
|
0,90-1,1
0,93±0,014 1,5
|
0,70-1,2
0,92±0,130 14,5
|
0,69-0,9
0,8±0,02 2,4
|
0,69-0,79
0,73±0,091 12,0
|
0,79-0,86
0,83±0,008 0,9
|
|
Число
боковых отростков, шт
|
11,0-13,0
12,3±0,48 3,8
|
7,0-12,0
11,0±1,62 15,0
|
9,0-12,0
10,5±2,43 23,4
|
9,0-12,0
10,9±0,14 1,3
|
10,0-12,0
11,0±1,63 13,5
|
9,0-12,0
10,2±0,32 2,8
|
10,0-13,0
11,8±0,26 2,2
|
|
Длина
боковых отростков, см
|
0,70-1,0
0,8±0,035 4,3
|
0,60-0,90
0,8±0,04 5,0
|
0,80-1,2
0,9±0,52 55,3
|
0,80-1,5
1,2±0,24 16,9
|
1,0-1,5
1,23±0,005 0,4
|
0,90-1,4
1,1±0,11 9,9
|
1,0-1,7
1,32±0,019 1,0
|
|
Примечание:
«-» - полное исчезновение измеряемых объектов, вследствие их гибели
|
Данные 25-го дня исследования
|
Объект
|
Исследуемый
показатель
|
Ёмкости
|
|
|
Co(NO3)2 1 мг/л
|
Co(NO3)2 2 мг/л
|
Ni(NO3)2 1
мг/л
|
Ni(NO3)2 2
мг/л
|
FeNO3 1 мг/л
|
FeNO3 2 мг/л
|
Контроль
|
|
Роголистник
|
Выживаемость,
%
|
70
|
70
|
70
|
70
|
80
|
70
|
80
|
|
Прирост
основного побега, см
|
0,72-0,78
0,76±0,016 2,0
|
0,41-0,73
0,54±0,023 4,3
|
0,86-0,96
0,92±0,031 3,2
|
0,58-0,80
0,69±0,042 5,6
|
0,76-1,3
0,90±0,054 5,0
|
0,59-0,94
0,72±0,044 5,7
|
0,83-0,99
0,91±0,032 4,2
|
|
Число
боковых отростков, шт
|
60,0-80,0
68,0±11,13 16,4
|
58,0-73,0
65,0±28,10 44,2
|
59,0-70,0
64,0±3,26 5,5
|
48,0-56,0
51,2±5,71 11,2
|
63,0-74,0
68,7±1,06 1,4
|
49,0-62,0
56,0±3,31 6,0
|
64,0-77,0
69,0±18,70 26,0
|
|
Длина
боковых отростков, см
|
1,1-1,5
1,3±1,26 12,5
|
1,3-1,7
1,4±0,31 7,4
|
1,4-1,9
1,5±0,81 49,0
|
1,4-1,7
1,5±0,24 16,4
|
1,3-1,4
1,4±0,05 3,5
|
1,3-1,7
1,4±0,05 3,5
|
1,3-1,7
1,5±0,26 17,4
|
|
Сальвиния
|
Выживаемость,
%
|
-
|
-
|
30
|
20
|
-
|
-
|
40
|
|
Число
лопастей, шт
|
-
|
-
|
2,0-3,0
2,3±0,23 10,2
|
2,0-3,0
2,5±1,14 44,6
|
-
|
-
|
1,0-3,0
2,2±1,2 56,4
|
|
Число
корней, шт
|
-
|
-
|
19,0-23,0
21,3±11,12 50,0
|
16,0-19,0
17,5±8,48 50,0
|
-
|
-
|
17,0-21,0
19,2±5,93 27,5
|
|
Длина
корней, см
|
-
|
-
|
0,90-1,20
1,0±0,17 17,3
|
0,6-0,9
0,7±0,18 24,4
|
-
|
-
|
0,80-1,3
1,1±0,14 12,8
|
|
Элодея
|
Выживаемость,
%
|
70
|
60
|
60
|
60
|
70
|
60
|
70
|
|
Прирост
основного побега, см
|
0,60-1,4
0,92±0,017 1,8
|
0,80-1,3
0,7±0,13 17,5
|
0,80-1,2
0,95±0,054 5,7
|
0,80-1,4
1,05±0,223 19,4
|
0,75-0,92
0,8±0,02 1,9
|
0,69-0,85
0,7±0,02 2,3
|
0,79-0,95
0,88±0,004 0,4
|
|
Число
боковых отростков, шт
|
11,0-13,5
12,5±1,92 15,2
|
9,0-12,0
10,5±0,85 7,6
|
10,0-13,0
11,3±0,98 8,6
|
10,0-13,0
11,0±1,67 15,4
|
9,0-13,0
11,0±1,35 11,5
|
10,0-13,0
11,5±0,72 6,1
|
10,0-17,0
13,0±1,61 12,8
|
|
Длина
боковых отростков, см
|
8,0-1,0
0,9±0,45 12,8
|
0,80-1,0
0,86±0,054 6,3
|
0,90-1,4
1,21±0,009 0,8
|
0,90-1,5
1,3±0,23 18,0
|
1,1-1,9
1,4±0,06 4,7
|
0,90-1,6
1,16±0,131 11,4
|
1,0-1,9
1,4±0,01 0,5
|
|
Примечание:
«-» - полное исчезновение измеряемых объектов, вследствие их гибели
|
Данные 30-го дня исследования
|
Объект
|
Исследуемый
показатель
|
Ёмкости
|
|
|
Co(NO3)2 1 мг/л
|
Co(NO3)2 2 мг/л
|
Ni(NO3)2 1
мг/л
|
Ni(NO3)2 2
мг/л
|
FeNO3 1 мг/л
|
FeNO3 2 мг/л
|
Контроль
|
Выживаемость,
%
|
60
|
60
|
70
|
60
|
70
|
70
|
80
|
|
Прирост
основного побега, см
|
0,72-0,87
0,80±0,012 1,5
|
0,48-0,72
0,62±0,008 6,4
|
0,89-1,3
0,9±0,01 1,1
|
0,66-0,84
0,7±0,04 5,7
|
0,86-0,99
0,94±0,021 1,7
|
0,69-0,87
0,76±0,043 5,2
|
0,84-1,3
1,0±0,03 3,0
|
|
Число
боковых отростков, шт
|
63,0-80,0
71,0±4,71 6,7
|
64,0-73,0
68,0±9,30 13,0
|
58,0-69,0
64,0±12,20 18,4
|
46,0-57,0
51,4±3,27 6,2
|
65,0-78,0
71,2±14,11 19,8
|
49,0-58,0
54,7±2,15 3,8
|
63,0-73,0
68,0±8,32 12,0
|
|
Длина
боковых отростков, см
|
1,1-1,5
1,28±0,036 2,8
|
1,4-1,7
1,5±0,32 17,0
|
1,5-1,8
1,6±0,27 11,0
|
1,4-1,8
1,6±0,14 22,0
|
1,3-1,5
1,4±0,05 3,5
|
1,3-1,7
1,5±0,17 11,0
|
1,5-1,9
1,6±0,06 3,5
|
|
Сальвиния
|
Выживаемость,
%
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
|
Число
лопастей, шт
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
|
Число
корней, шт
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
|
Длина
корней, см
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
|
Элодея
|
Выживаемость,
%
|
60
|
50
|
60
|
60
|
60
|
60
|
70
|
|
Прирост
основного побега, см
|
0,80-1,3
1,0±0,04 4,5
|
1,0-1,4
1,15±0,036 3,1
|
0,80-1,4
1,1±0,05 4,7
|
0,90-1,3
1,05±0,252 24,0
|
0,86-0,95
0,89±0,014 1,6
|
0,79-0,83
0,8±0,45 56,0
|
0,87-0,95
0,91±0,002 0,2
|
|
Число
боковых отростков, шт
|
11,0-14,0
13,0±0,28 7,0
|
11,0-13,0
11,4±0,75 6,6
|
11,0-13,0
12,0±1,67 13,0
|
10,0-12,0
11,3±1,42 10,5
|
10,0-13,0
11,6±1,22 10,0
|
10,0-13,0
11,6±0,67 4,9
|
10,0-17,0
14,0±1,62 12,0
|
|
Длина
боковых отростков, см
|
0,80-1,2
1,1±0,09 8,7
|
0,80-1,0
0,8±0,05 5,3
|
1,0-1,5
1,3±0,13 10,2
|
0,90-1,7
1,3±0,03 2,0
|
1,4-2,0
1,6±0,01 0,7
|
1,1-1,7
1,2±0,02 1,8
|
1,3-1,8
1,5±0,01 0,7
|
|
Примечание:
«-» - полное исчезновение измеряемых объектов, вследствие их гибели
|