Характеристика феназинового комплекса бактерий P. aurantiaca
ОГЛАВЛЕНИЕ
Введение
.
Обзор литературы
.1
Разновидности антибиотиков синтезируемых бактериями рода Pseudomonas
1.2
Классификация и характеристика феназинов
.3
Практическое применение феназиновых антибиотиков и их продуцентов
.4
Пути биосинтеза феназиновых антибиотиков
.4.1
Химический синтез производных феназин-1-карбоксилата
.5
Регуляция экспресии феназинового оперона
.5.1
Роль QS-системы в
регуляции синтеза феназинов
.6
Подходы к повышению продукции феназинов
.7
Методика выделения феназиновых антибиотиков
.8
Антимикробная активность феназинов
.8.1
Антимикробное действие пиоцианина
.8.2
Антимикробное действие иодинина
.8.3
Антимикробное действие хлорорафина
.
Материалы и методы
.1
Объекты исследования
.2
Среды и добавки
.3
Реактивы и материалы
.4
Получение культуральной жидкости штаммов P.
aurantiaca
2.5
Выделение феназина из культуральной жидкости и его очистка
.
Результаты и обсуждения
.1
Подбор оптимальных условий хранения феназиновых антибиотиков
.2
Анализ качественного состава феназинового комплекса P.
aurantiaca
Выводы
Библиографический
список
СПИСОК СОКРАЩЕНИЙ ТЕРМИНОВ ИСПОЛЬЗОВАННЫХ В
РАБОТЕ
RT - (от англ.
Retention
Time) Время задержки
СПИСОК СОКРАЩЕНИЙ НАЗВАНИЙ МИКРООРГАНИЗМОВ
avenae A. avenaesolani A.
solanialternate A. alternatasubtilis B. subtilisalbicans C. albicansdiphtheria
C. diphtheriaecarotovora E. carotovoracoli E. coliavenaceum F.
avenaceumoxysporum F. oxysporumfructigena M. fructigenalacunata M.
lacunataabscessus M. abscessusagglomerans P. agglomeransvariabilis P. variabilisvulgaris
P. vulgarisacidovorans P. acidovoransaeruginosa P. aeruginosaaurantiaca P.
aurantiacacepacia P. cepaciachlororaphis P. chlororaphisfluorescens P.
fluorescensphenazinium P. phenaziniumputida P. putidasyringae P.
syringaemyriotylum P. myriotylumsolani R. solanitritici S. triticiflexneri S.
flexneriaureus S. aureuscampestris X. campestris
ВВЕДЕНИЕ
Урожайность сельскохозяйственных культур зависит
от большого количества природных факторов. Известно, в частности, что в
результате действия фитопатогенных микроорганизмов, сельское хозяйство теряет
до 1/3 урожая [1]. В целях снижения этих потерь, наука вынуждена разрабатывать
целые комплексы химических препаратов. Однако, на ряду с положительным
эффектом, их действие часто оказывает негативное влияние, как на саму
защищаемую культуру, так и на весь животный и растительный мир в целом.
Со временем фитопатогены приобретают
устойчивость к действию пестицидов, вследствие чего возникает необходимость
увеличивать дозу применяемых препаратов, что негативно сказывается на качестве
продукции и состоянии окружающей среды.
В связи с этим, в настоящее
время активно ведутся работы по созданию биологических средств защиты растений
от патогенов. Особый интерес в этом отношении представляют препараты на основе
живых культур микроорганизмов, обеспечивающие длительную защиту
сельскохозяйственных культур. Наиболее перспективными в этом отношении
считаются бактерии рода Pseudomonas,
синтезирующие более 300 различных антимикробных соединений, в том числе -
антибиотики ароматической природы, подавляющие развитие фитопатогенов [9].
Среди наиболее активных антибиотиков бактерий Pseudomonas
стоит отметить соединения феназинового ряда. Известно, что в основе механизма
их действия лежит способность генерировать активные формы кислорода, обладающие
чрезвычайно высокой реакционной способностью, что вызывает гибель
чувствительных к ним микроорганизмов [10].
Целью курсовой работы являлась физико-химическая
характеристика компонентов феназинового комплекса бактерий Pseudomonas
aurantiaca. В связи с
поставленной целью в задачи исследования входило:
. Разработка методов выделения
феназинового комплекса бактерий P.
aurantiaca
. Анализ качественного состава
феназинового комплекса данных бактерий
. Изучение влияния температуры хранения
феназинового комплекса на его стабильность.
1. ОБЗОР ЛИТЕРАТУРЫ
1.1 Разновидности
антибиотиков синтезируемых бактериями рода Pseudomonas
Способность к синтезу антибиотиков позволяет
бактериям рода Pseudomonas,
позволяет им подавлять развитие патогенной микрофлоры и успешно расселяться в
ризосфере. К антибиотическим соединениям наряду с феназинами (PCA) относят:
цианид (HCN), пиоцианин
(Pyo), пиолютеорин (Plt),
оомицины, биосурфактанты. Перечень антибиотиков синтезируемых представителями
рода Pseudomonas
весьма широк. Это вызвано, в первую очередь тем, что отдельный вид бактерий
способен синтезировать сразу несколько антибиотических соединений [4].
Среди этих веществ наиболее многочисленной
группой, является группа антибиотиков антифунгального действия - это пирролнитрины,
оомицин, экомицин, феназины, рамнолипиды. Пирролнитрин, например, широко
применяется в медицине, в качестве противогрибкового средства [8]. Кроме того
антибиотики бактерий рода Pseudomonas,
обеспечивают благоприятные условия для выживания производящих их клеток и
способствуют активному заселению прикорневого пространства.
На сегодняшний день внимание исследователей, в
первую очередь, направлено на изучение антибиотиков феназинового ряда, которые
характеризуются не только уникальным механизмом антимикробного действия и
высокой активностью, но и наличием иных биологических функций. По сравнению с
типичными антифунгальными препаратами, феназины имеют более широкий спектр
действия. Они препятствуют развитию не только фитопатогенных грибов, таких как M.
fructigena, R.
solani, A.
solani, S.
tritici, F.
oxysporum, P.
myriotylum, C.
albicans и других, но и
целого ряда фитопатогенных бактерий - A.
avenae, E.
carotovora, P.
syringae, X.
campestris. Кроме того
соединения феназинового ряда улучшают способность растений усваивать
минеральные вещества из почвы [1].
1.2 Классификация и
характеристика феназинов
Антибиотики феназинового ряда - большая группа
гетероциклических азотсодержащих соединений, включающие порядка 50 различных
производных феназин-1-карбоксилата [9]. Синтез феназинов был обнаружен у
представителей родов Pseudomonas,
Bacillus, Sorangium
и др. [19]
Как правило, один вид бактерий продуцирует
несколько видов разнообразных феназинов. Например, бактерии P.
chlororaphis продуцируют 2 типа
феназинов [5], P. aeruginosa
- 6 типов [20], бактерии P.
fluorescens - только один тип
феназинов [4].
Некоторые феназины являются натуральными
пигментами, например пиоцианин, хлорорафин и иодинин, которые имеют синюю,
зеленую и фиолетовую окраску соответственно [19].
Согласно общепринятой классификации все
феназиновые антибиотики подразделяются на четыре группы: простые, сложные,
производные сафеновой кислоты и терпен-содержащие феназины. Основа молекулы
всех феназинов состоит из трёх ароматических колец. Благодаря этому феназины
могут выступать как в качестве доноров, так и в качестве акцепторов электронов.
Различия между разными типами феназинов, по большому счету, заключается только
в незначительных модификациях ключевого соединения биосинтеза всех феназиновых
антибиотиков - феназин-1-карбоксилата [11].
В качестве заместителей в состав молекулы
феназина могут входить различные функциональные группы (рисунок 1).
Феназины легко вступают в
окислительно-восстановительные реакции и, таким образом, могут выполнять роль переносчиков
и конечных акцепторов электронов. Благодаря их способности переводить
нерастворимые минеральные соли в биологически доступную форму, они обеспечивают
бактериям продуцентам полноценное минеральное питание [4].
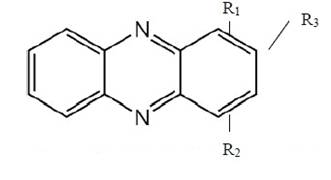 : COOH -
феназин-1-карбоксилат; OH - гемипиоцианин; CONH2 - оксихлрорафин. R1 = О-, R2 =
СH3 - пиоцианин. R1 = COOH, R3 = OH - 2-оксифеназин-1-карбоксилат; R1 = COOH,
R2 = CH3 - 5-метилфеназин-1-карбоксилат [3].
: COOH -
феназин-1-карбоксилат; OH - гемипиоцианин; CONH2 - оксихлрорафин. R1 = О-, R2 =
СH3 - пиоцианин. R1 = COOH, R3 = OH - 2-оксифеназин-1-карбоксилат; R1 = COOH,
R2 = CH3 - 5-метилфеназин-1-карбоксилат [3].
Рисунок 1 - Строение феназиновых антибиотиков
1.3 Практическое
применение феназиновых антибиотиков и их продуцентов
Благодаря своим свойствам, феназиновые
антибиотики и продуцирующие их бактерии широко применяются в сельском
хозяйстве. Известно, что бактерии P.
putida способны подавлять
развитие возбудителя сосудистого и слизистого бактериозов [4].
Обработка посевного материала, а также корней и
проростков некоторыми штаммами бактерий рода Pseudomonas
может существенно снижать пораженность растений фитопатогенами и увеличивать
урожайность сельскохозяйственных культур. Использование таких штаммов в
сельскохозяйственной практике, по мнению многих исследователей, уже в ближайшее
время найдет широкое применение в современной агробиотехнологии. В некоторых
случаях возможно использование смешанных препаратов совместимых бактерий, в том
числе и бактерий различных таксономических групп с обязательным включением
бактерий рода Pseudomonas.
Использование таких препаратов может преследовать различные цели: защиту
растений и урожая от фитопатогенов, получение компостов, стимуляцию прорастания
семян и роста растений, улучшение фосфорного питания растений [1].
Широкое применение феназины нашли и в медицине.
В связи со способностью ломофунгина понижать артериальное давление, ведутся
разработки гипотензивных препаратов на основе данного феназина. Благодаря
антиопухолевой активности некоторых феназинов, в настоящее время они
рассматриваются как одни из наиболее перспективных соединений для разработки
антираковых препаратов [14].
Феназины, также используют для создания так
называемых источников химического света, способных излучать свет в различных
областях спектра и при этом не требующих большого количества энергии. В таких
устройствах применяются феназины связанные с другими соединениями, например,
фе-нантролин-связанный феназин [4].
Продуцент феназинов - P.
aeruginosa применяется в
экспериментах по разработке, так называемых биотопливных элементов (БТЭ) -
совершенно нового экологически чистого источника электрической энергии [7].
Значимость этих исследований особенно заметна в условиях резко уменьшающихся
запасов углеводородных источников энергии.
1.4 Пути биосинтеза
феназиновых антибиотиков
Для выявления механизмов биосинтеза феназиновых
антибиотиков применялся метод меченых предшественников. Было установлено, что
ключевым соединением, необходимым для синтеза всех феназиновых антибиотиков
является феназин-1-карбоксильная кислота. Схема биосинтеза представлена на
рисунке 2. В процессе синтеза задействовано семь генов, организованных в
феназиновый оперон. Уровень продукции феназинов в большой степени зависим от
состава культуральной среды и условий культивирования.
Первый этап ароматического пути биосинтеза
феназиновых антибиотиков - реакцию конденсации фосфоенолпирувата и
эритрозо-4-фосфата, катализирует фермент ДАГФ-синтаза (3-дезокси-D-арабиногептулозо-7-фосфат-синтаза).
В ходе этой реакции образуется 3-дезокси-D-арабиногептулозонат-7-фосфат
[4].
Фермент ДАГФ-синтаза представлен большим
количеством различных форм - изоферментов. Различные изоферменты проявляют
разные степени активности. Формы, составляющие большую часть активности
ДАГФ-синтазы, называют доминантными. Те изоферменты, вклад которых в общую
активность не так велик, называются минорными изоферментами [10].
Основным соединением-предшественником в процессе
биосинтеза феназин-1-карбоксилата и его производных, является шикимовая
кислота, преобразующаяся в хоризмовую кислоту. Хоризмат под влиянием продукта
гена PhzE,
превращается в 2-амино-2-дезоксихоризмат, являющийся предшественником
2,3-дигидро-3-оксиантранилата, который в свою очередь трансформируется в
феназин-1,6-дидикарбоксилат, дающий начало феназину и всем его производным
[24].
Некоторые производные феназин-1-карбоксилата
могут быть синтезированы химическим путем [11].
1.4.1 Химический синтез
производных феназин-1-карбоксилата
Некоторые производные феназина можно получить
химическим синтезом в лабораторных условиях. Метод химического синтеза
феназин-5,10-диоксида был предложен Abd
El-Halim
и сотрудниками его лаборатории в 1995 году. Для проведения реакции они
применяли смесь ледяной уксусной кислоты (8.5 мл.) и перекиси водорода (30%,
3,8 мл.), которую в течение шести часов нагревали до 40 градусов. Затем в
реакционную смесь добавляли 0,1 г. феназина и продолжали нагревать до 50
градусов цельсия, на протяжении 22 часов. Полученный осадок фильтровали, а
затем экстрагировали в дихлорметане. Полученный экстракт элюировали в колонке с
силикагелем смесью растворителей. Исследователями было установлено, что
оптимальной системой растворителей является смесь дихлорметана и этилацетата в
соотношении 8:2 [11].
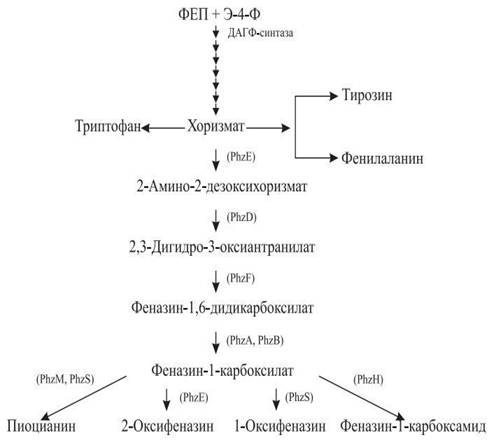
Рисунок 2. Схема синтеза феназиновых
антибиотиков [2]
ФЕП - фосфоенолпируват, Э-4-Ф - эритрозо - 4 -
фосфат. В скобках приведены названия генов Phz-оперона,
продукты которых контролируют соответствующий этап синтеза антибиотиков.
Важнейшим из факторов, контролирующих продукцию
феназинов, является плотность клеточной популяции, регулируемая QS-системой.
Помимо этого важное влияние на уровень продукции феназинов оказывают компоненты
питательной среды, например, кислород, ионы железа и углеводы, однако на данный
момент неизвестно, обусловлены ли эти влияния функционированием QS-системы,
либо являются независимыми от нее. Вместе с тем, установлена ключевая роль
двухкомпонентной GacA/GacS системы, находящейся на вершине регуляторного
каскада синтеза феназинов.
Белок GacS
представляет собой сенсорную киназу, расположенную в клеточной мембране, тогда
как GacA является
регулятором транскрипции. Под воздействием сигнальных молекул происходит
фосфорилирование регулятора ответа GacA,
который в свою очередь регулирует синтез феназиновых антибиотиков.
В качестве промежуточных положительных
регуляторов, ответственных за увеличение продукции феназин-1-карбоксамида, в
данном каскаде выступают продукты генов pip,
psrA и сигма фактор rpoS
[4].
Учеными была установлена неоднозначность функции
psrA. Индукция
экспрессии этого гена, который в свою очередь выполняет функцию активатора rpoS
фактора, оказывающего влияние на экспрессию phzR
и phzI генов, оказывает
негативное влияние на образование феназиновых антибиотиков. Схема процесса GacS/GacA
регуляции приведена на рисунке 3.
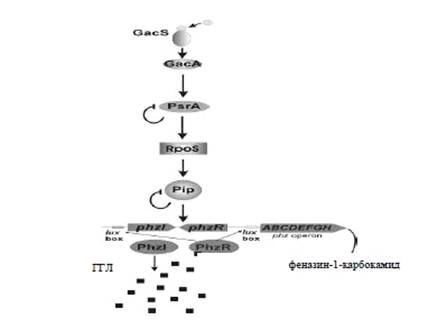
Рисунок 3 - Роль GacS/GacA-системы
в регуляции синтеза феназинов [4]
1.5.1 Роль QS-системы
в регуляции синтеза феназинов
Последнее время внимание исследователей,
работающих в области генетики и микробиологии, направлено на изучение явления,
получившего название Quorum
Sensing (QS).
QS - особый тип
регуляции экспрессии генов. Он основан на действии низкомолекулярных сигнальных
молекул различной природы, аутоиндукторов, которые накапливаются в культуре при
высоких плотностях популяции бактерий [1].
С помощью аутоиндукторов осуществляется
коммуникация бактерий - передача информации между клетками бактерий,
принадлежащих к одному и тому же или к разным видам, родам или даже семействам.
Благодаря QS регуляции
бактерии получают возможность координированно контролировать экспрессию генов
во всем сообществе. Передача информации от клетки к клетке с использованием QS
систем, которая приводит к индукции специализированных наборов генов,
способствует быстрой адаптации популяций бактерий к меняющимся условиям и их
выживанию в природной среде [20]. В настоящее время QS
регуляция обнаружена более чем у 50 видов бактерий. Кроме того регуляторные
системы типа QS участвуют
во взаимодействии бактерий с высшими организмами - животными и растениями [5].
Большой интерес вызывает изучение QS
регуляции у бактерий, используемых для биологической борьбы с заболеваниями
растений, вызываемыми фитопатогенными грибами и бактериями. Экологически
безопасные методы защиты растений с помощью бактерий - антагонистов
фитопатогенов рассматриваются как важная альтернатива традиционным методам,
связанным с применением химических пестицидов. Использование и модификация QS
систем могут повысить эффективность бактерий, перспективных для биологической
борьбы с заболеваниями растений [15].
феназин антибиотик культуральный
биосинтез
1.6 Подходы к повышению
продукции феназинов
Способы повышения уровня продукции феназиновых
соединений можно разделить на две группы: физиологические и генетические [8].
К первой категории относятся методы основанные
на увеличении продуктивности штаммов, синтезирующих феназиновые антибиотики, за
счет экспрериментального подбора условий культивирования и состава питательных
сред [4]. Так, например, было установлено, что добавление в среду ионов магния,
глицерина тирозина и фенилаланина повышает продукцию пиоцианина [9].
Вторая категория методов основана на
манипуляциях с геномом продуцента. К сожалению на сегодняшний день число
публикаций на эту тему невелико и, по видимому, успешных примеров работ пока не
имеется. Наиболее удачным исследованием можно назвать работы китайского ученого
Y. Li.
В его лаборатории, путем направленного мутагенеза gacA-гена
и подбора условий культивирования, был разработан метод, обеспечивающий выход
антибиотиков бактерий рода Pseudomonas
достигающий 2 г/л в условиях непрерывного культивирования [4].
Таким образом можно сделать вывод, что наиболее
рациональным подходом к повышению продукции антибиотиков является совместное
применение методик обеих категорий.
1.7 Методика выделения
феназиновых антибиотиков
Продуценты феназинов выделяют свои антибиотики в
окружающую среду, то есть в культуральную жидкость, однако для экспериментов
зачастую необходим чистый феназин. Первым этапом выделения феназинов из
культуральной жидкости является центрифугирование культуры с целью отделить
супернатант, содержащий феназины в растворенном виде. pH
раствора необходимо довести до значения 1 - 2 добавлением кислоты. Затем
добавляют хлороформ в соотношении 1:1 и тщательно перемешивают на блендере.
Снова центрифугируют и отбирают нижнюю фракцию. К этой фракции добавляют NaOH
(2 моль/л), в соотношении 1:1 [4].
Наличие и концентрация феназинов в растворе
определяется спектрофотометрическим методом, при длине волны 369 нм [17].
Помимо экстракции феназинов с помощью
неорганических растворителей, для их выделения используют также HPLC-хроматографию,
а также выделение отдельных видов феназинов на сорбционных колонках [20].
1.8 Антимикробная
активность феназинов
Феназины обладают цидным эффектом в отношении
целого ряда патогенных бактерий и грибов. Такое разнообразие организмов,
развитие которых подавляется феназинами, объясняется механизмом их действия.
Установлено, что молекулы феназинов способны выходить за пределы
клетки-продуцента, а затем проникать внутрь клетки мишени, где они индуцируют
образование активных форм кислорода, имеющих чрезвычайно высокую реакционную
способность. Установлено, что во внеклеточном пространстве феназины в основном
стимулируют образование пероксида водорода [3, 16].
Немаловажным является то, что феназины способны
влиять на ферменты, ответственные за изменения структуры ДНК, происходящие в
делящихся клетках, а именно - топоизомераз I
и II классов. Выяснено,
что феназиновые антибиотики могут выступать в качестве мощных ингибиторов этих
ферментов. По этой причине феназины рассматриваются, как высокоактивные
антираковые препараты [14].
1.8.1 Антимикробное
действие пиоцианина
В 1989 году исследователями была установлена
прямая связь между активностью фермента супероксиддисмутазы и степенью
устойчивости к действию феназинов на примере пиоцианина [5].
Пиоцианин - это сине-зеленый водорастворимый
пигмент, являющийся вторичным метаболитом P.
aeruginosa. Этот антибиотик
проявляет высокую активность в отношении бактерий B.
subtilis, M.
lacunata, S.
flexneri. Помимо
бактерицидного эффекта, он способствует успешному росту растений, облегчая их
минеральное питание [9]. Химически пиоцианин представляет собой 5-метил-L-гидроксифеназин
[19]. В таблице 2 приведены минимальные бактерицидные концентрации пиоцианина
для разных микроорганизмов. Из таблицы видно, что бактерии D.
pneumonia, P.
vulgaris, S.
Schottmuelleri, проявляют
высокую степень резистентности к воздействию пиоцианина.
Таблица 2 - Минимальная бактерицидная
концентрация пиоцианина для разных видов микроорганизмов [9]
|
Организм
|
Минимальная
бактерицидная концентрация
|
|
Actinobacillus mallei
|
50
|
|
Bacillus anthracis
|
33
|
|
Bacillus subtilis
|
6,25
|
|
Bordetella pertussis
|
33
|
|
Brucella abortus
|
1,25
|
|
Corynebacterium diphtheria
|
25
|
|
Diplococcus pneumonia
|
200
|
|
Escherichia coli
|
100
|
|
Klebsiella rhinoscloromatis
|
50
|
|
Micobacterium tuberculosis
|
100
|
|
Moraxella lacunata
|
12,5
|
|
Neisseria gonorrhoeae
|
16,5
|
|
Proteus vulgaris
|
200
|
|
Salmonella schottmuelleri
|
200
|
|
Salmonella typhosa
|
330
|
|
Shigella flexneri
|
12,5
|
|
Shigella schmitzii
|
100
|
|
Staphylococcus aureus
|
25
|
|
Streptococcus pyogenes
|
25
|
|
Vibrio comma
|
4,1
|
1.8.2 Антимикробное
действие иодинина
1.8.3 Антимикробная
активность хлорорафина
Хлорорафин представляет собой комплекс
фенази-1-карбоксамида с его 5,10-дигидро производным[19]. Он является продуктом
биосинтеза бактерий P. chlororaphis.
Хлорорафин обладает высокой бактерицидной активностью, а в концентрации 30 - 50
мкг/мл подавляет развитие таких грибов, как F.
oxysporum, F.
avenaceum, A.
alternata.
2. МАТЕРИАЛЫ И МЕТОДЫ
2.1 Объекты
исследования
В работе использовались штаммы Pseudomonas
aurantiaca из коллекции
кафедры генетики ВКМВ - 162, а также ранее полученный на его основе мутантный
штамм B162/17 и
генно-инженерный штамм B162/17.31.
2.2 Среды и добавки
Питательный бульон
Для приготовления полноценной питательной среды
использовали сухой препарат питательного бульона в концентрации 5 граммов на
300 миллилитров дистиллированной воды. Раствор автоклавировали 2 часа.
Среда М9
Для приготовления использовали: Na2HPO4
- 4,66 г, KH2PO4
- 2,4 г, NaCl - 0,4 г, NH4CL
- 0,8 г. Компоненты взяты в расчете на 200 миллилитров среды.
Среда PCA
Для приготовления использовали: пептон - 4 г,
глюкозу - 2 г, NaCl
- 1 г, KNO3 - 0,2 г.
Компоненты взяты в расчете на 200 миллилитров среды.
Раствор 20% глюкозы
Для приготовленя раствора 10 г. сухой глюкозы
доводили дистиллированной водой до объёма 50 миллилитров. Раствор
автоклавировали 2 часа.
2.3 Реактивы и
материалы
Раствор NaOH
Для приготовления раствора 10 граммов NaOH
растворяли в 100 миллилитрах дистиллированной воды.
2.4 Получение
культуральной жидкости штаммов P. aurantiaca
Ночную культуру P.
aurantiaca
B162/17 сеяли в
среду M9 с добавление
глюкозы до концентрации 1%. Культуры P.
aurantiaca
B162 и B162/17.31
сеяли в среду PCA. Бактерии
выращивали без аэрации в конических колбах при температуре 28°С. Время
культивирования - 4 суток для среды M9
и 5 суток для среды PCA.
2.5 Выделение феназина
из культуральной жидкости и его очистка
Для выделения феназина pH
культуральной жидкости доводится до уровня 1 - 2 путем добавления HCl.
Затем в колбу вносится хлороформ в объёме равном объёму культуры. Смесь
тщательно перемешивают и отстаивают. Удаляют верхний слой. К оставшейся
жидкости добавляют 10% раствор NaOH
и встряхивают до появления розовой окраски. Верхнюю фазу отбирают и переносят в
пробирки. Подкисляют до уровня pH
1 - 2. На этом этапе половина жидкости отбиралась для подбора условий хранения
феназинов растворенных в кислоте. К оставшемуся феназину добавляют равный объём
хлороформа. После взбалтывания смесь разделяется на две фазы. Нижняя фаза
содержит феназин растворенный в хлороформе. Каждый из образцов разделяли на три
части и хранили в эппендорфах. Одну часть на столе при комнатной температуре,
вторую в холодильнике при температуре 4°C.
Третий в морозильной камере при температуре -20°C.
Концентрацию феназина определяли
спектрофотометрически, при длине волны λ = 369 нм
по калибровочной кривой (рисунок 4).
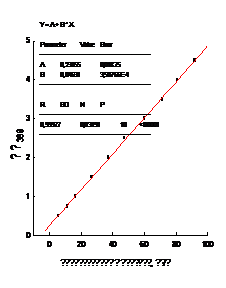
Рисунок 4 - Калибровочная кривая, отражающая
зависимость оптической плотности раствора (ОП369) от концентрации феназина.
3. РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЯ
3.1 Подбор оптимальных
условий хранения феназиновых антибиотиков
Одной из задач данного исследования было
изучение влияния температуры хранения феназина на его стабильность. В связи с
этим проводилась серия измерений активности феназина при его хранении в виде
хлороформного и кислотного растворов. Такие способы хранения препаратов были
выбраны по причине их доступности в лабораторных условиях. С периодичностью
один раз в сутки отбирались пробы препарата феназина, которые подвергались
спектрофотометрическому анализу. Хлороформный и кислотный растворы феназина
разводились в 10 раз хлороформом и 1М HCl
соответственно. Целью данного этапа работы было выяснение темпов снижения
активности феназина в образцах в процессе его хранения. Результаты измерений
приведены в таблицах 3 и 4.
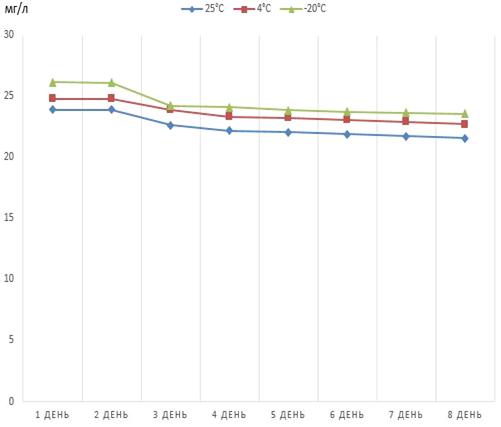
Рисунок 5 - Динамика снижения концентрации
феназина продуцируемого штаммом P.
Aurantiaca
B162-17.31,
хранящегося в хлороформном растворе
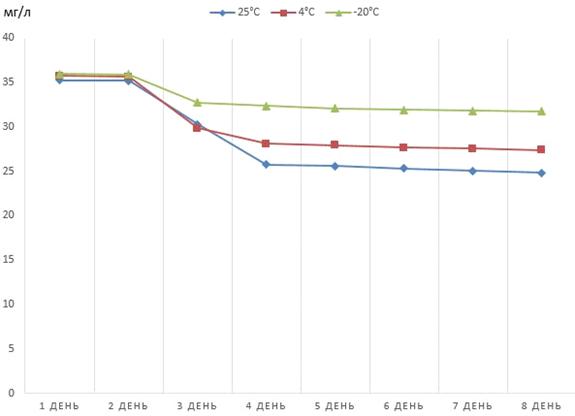
Рисунок 6 - Динамика снижения концентрации
феназина продуцируемого штаммом P.
aurantiaca
B162/17, хранящегося
в хлороформном растворе
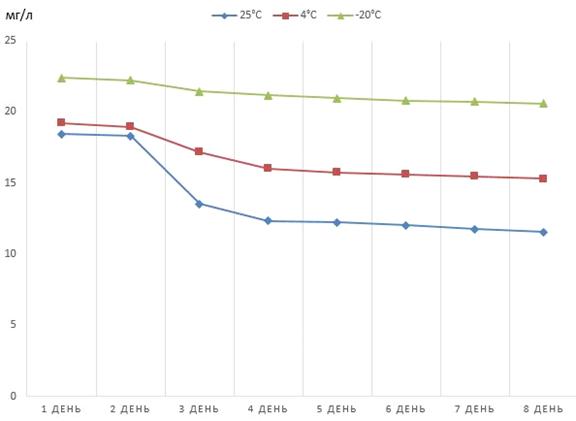
Рисунок 7 - Динамика снижения концентрации
феназина продуцируемого штаммом P.
aurantiaca
B162, хранящегося в
хлороформном растворе
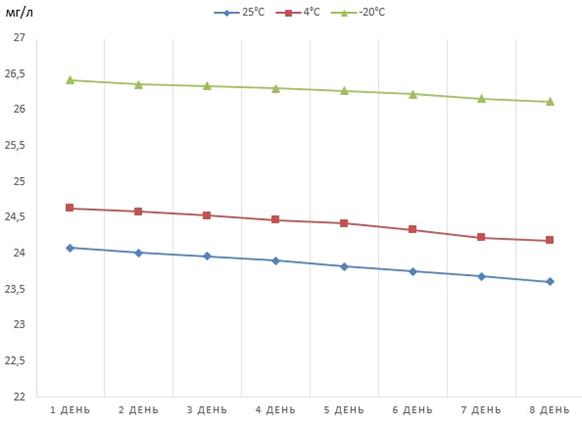
Рисунок 8 - Динамика снижения концентрации
феназина продуцируемого штаммом P.
Aurantiaca
B162-17.31,
хранящегося в кислотном растворе
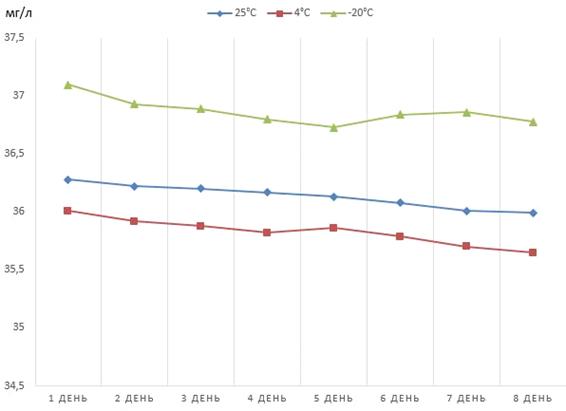
Рисунок 9 - Динамика снижения концентрации
феназина продуцируемого штаммом P.
aurantiaca
B162/17, хранящегося
в кислотном растворе
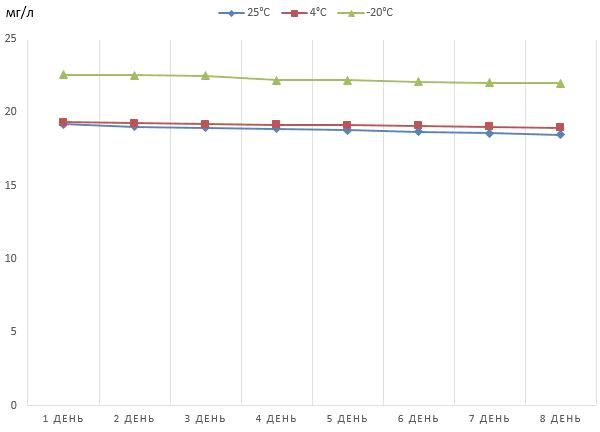
Рисунок 9 - Динамика снижения концентрации
феназина продуцируемого штаммом P.
aurantiaca
B162, хранящегося в
кислотном растворе
Согласно данным полученным в ходе исследования,
менее выраженное снижение концентрации феназина было отмечено при его хранении
в виде раствора в соляной кислоте и заморозке при температуре -20°С. Несмотря
на это, даже при соблюдении выше названных условий наблюдалось снижение
активности препарата.
3.2 Анализ
качественного состава феназинового комплекса P. aurantiaca
Для определения качественного состава
феназиновых комплексов антибиотики экстрагировали из культуральной жидкости
хлороформом, затем высушивали на роторном вакуумном испарителе. Полученные
комплексы были переданы для анализа сотрудникам кафедры биохимии БГУ.
Качественный состав определяли при помощи
жидкостного хроматографа с масс-спектроскопическим детектором LCMS-QP8000α,
элюцию
осуществляли на обратнофазной колонке Restec
Allure C18
(100x2,1 мм, 5μм).
Спектры поглощения регистрировали в потоке с помощью детектора на основе
фотодиодной матрицы SPD-M10Avp.
HPLC профили исследуемых
штаммов приведены на рисунках 10 - 12.
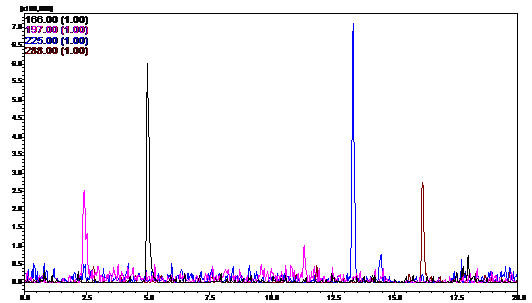
Рисунок 10 - HPLC-профиль
штамма
P. aurantiaca B162
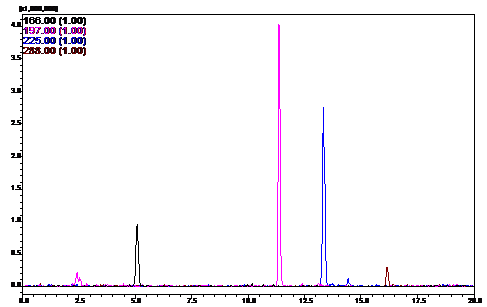
Рисунок 11 - HPLC-профиль
штамма
P. aurantiaca B162/255
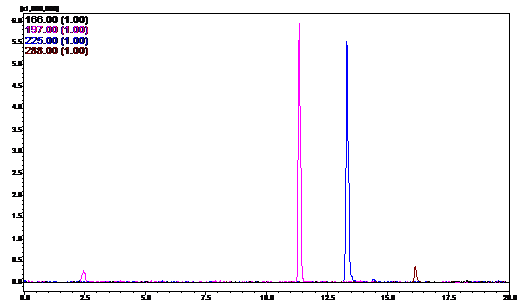
Рисунок 12 - HPLC-профиль
штамма
P. aurantiaca B162.17.31
Обнаружено, что выраженность пиков № 2 и 3
заметно выше у штаммов B162/255
и B162.17.31, чем у
штамма дикого типа. Однако с учётом разницы в масштабах графиков генно-инженерного,
мутантного и дикого штаммов, можно сделать вывод, что пики №1 и №4 проявляются
примерно на равном уровне у всех представленных штаммов.
В ходе исследования феназиновых комплексов было
выявлено наличие семи различных компонентов этих комплексов. По причине
отсутствия эталонов в литературных источниках, на данный момент, установить
структуру удалось лишь для двух соединений, однако работа в направлении
определения структуры остальных соединений ведется совместно с сотрудниками
института биоорганической химии.
Масс-спектры обнаруженных соединений приведены в
рисунках 13 - 19.
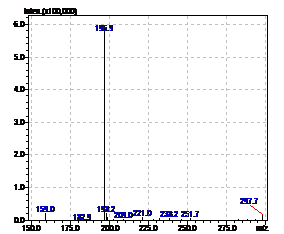
Рисунок 13 - Масс-спектр гидроксифеназина. RT=11,3
мин.
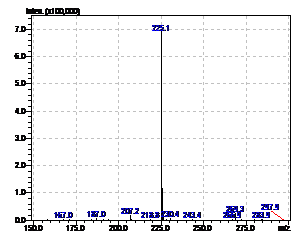
Рисунок 14 - Масс-спектр феназин-1-карбоксилата.
RT=13,3 min.
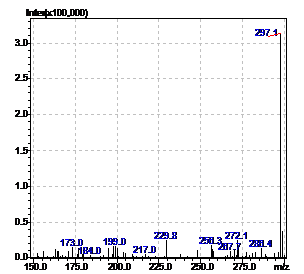
Рисунок 15 - Масс-спектр неизвестного
соединения. RT=15,2 мин.
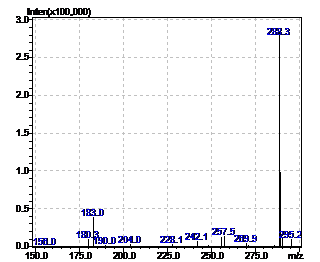
Рисунок 16 - Масс-спектр неизвестного
соединения. RT=16,1 мин.
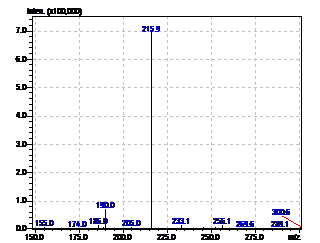
Рисунок 17 - Масс-спектр неизвестного
соединения. RT=16,7 мин.
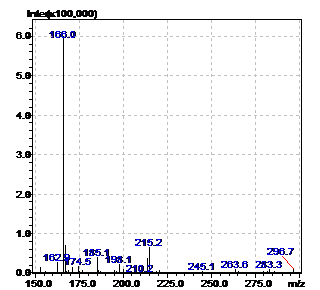
Рисунок 18 - Масс-спектр неизвестного
соединения. RT=4,7 мин.
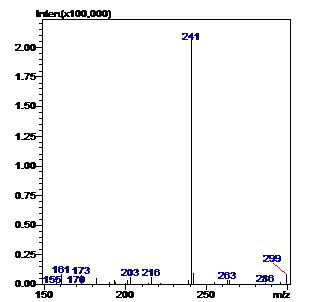
Рисунок 19 - Масс-спектр неизвестного
соединения. RT=8,4 мин.
ВЫВОДЫ
. В ходе исследования был освоен метод
выделения феназинов из культуральной жидкости бактерий-продуцентов.
. Установлено, что в кислотном растворе стабильность
феназинового комплекса выше, чем в хлороформном растворе.
. Показано, что оптимальной для хранения
феназиновых антибиотиков температурой является - 20°С.
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Боронин
А. М. Ризосферные бактерии рода Pseudomonas,
способствующие росту и развитию растений // Соросовский образовательный журнал.
- 1998. - №10. - С. 25 - 31.
. Веремеенко
Е. Г., Федорович М. Н., Феклистова И. Н., Максимова Н. П. Получение и
характеристика мутантов Pseudomonas
aurantiaca - продуцентов
антибиотиков феназинового ряда // Вестник БГУ. - 2009. Серия 2. № 2. - С. 44 -
48.
. Веремеенко
Е. Г., Максимова Н. П. Механизмы устойчивости бактерий Pseudomonas
aurantiaca - продуцентов
феназиновых антибиотиков к собственным феназинам // Труды БГУ. Серия
«Физиологические, биохимические, и молекулярные основы функционирования
биосистем». - 2009. - Т. 4, Ч. 1. - С. 161-167.
. Веремеенко
Е. Г. Получение, характеристика и применение продуцентов феназиновых
антибиотиков бактерий Pseudomonas
aurantiaca: дисс. канд. биол.
. Веселова
М. А. Изучение Quorum
Sensing систем регуляции у
Pseudomonas
chlororaphis и Burkholderia
cepacia: автореф. дисс.
канд. биол.
. Веремеенко
Е. Г., Максимова Н. П. Активация антиоксидантного комплекса у бактерий Pseudomonas
aurantiaca - продуцентов
феназиновых антибиотиков // Микробиология. 2010. - Том 79, №4. - С. 463 - 469.
. Решетилов
А. Н., Понаморева О. Н., Решетилова Т. А., Богдановская В. А. Генерация
электрической энергии в биотопливном элементе на основе клеток микроорганизмов
// Вестник биотехнологии и физико-химической биологии имени Ю. А. Овчинникова.
- 2005. - Том 2. №2. - С. 54 - 62.
. Феклистова
И. Н., Максимова Н. П. Биотехнологические подходы к созданию продуцентов
антибиотиков на основе ризосферных бактерий рода Pseudomonas
// Микробиология - 2008. - Том 77. №2. - С. 176 - 180.
9. Baron
S. S., Terranova G., Rowe J. J. Molecular mechanism of the antimicrobial action
of pyocyanin // Current microbiology. - 1989. - Vol. 18. - P. 223 - 230.
. Laursen
J. B., Nielsen J. Phenazine natural products: biosynthesis, synthetic
analogues, and biological activity // Chem. Rev. - 2004. - Vol.104. - P. 1663 -
1685.
. Nansathit
A., Apipattarakul S., Phaosiri C., Pongdontri P., Chanthai S., Ruangviriyachai
C. Synthesis, Isolation of phenazine derivatives and their antimicrobial
activities // Walailak J sci & Tech - 2009. - Vol. 6. - P. 79 - 91.
. Pierson
L. S. Metabolism and function of phenazines in bacteria: impacts on the
behavior of bacteria in the environment and biotechnological processes // Appl.
Microbiol. Biotech. - 2010. - Vol. 86, №6.
- P. 1659 - 1670.
. Rane
M. R., Sarode P. D., Chaudhari B. L., Chincholkar S. B. Detection, isolation
and identification of phenazine-1-carboxylic acid produced by biocontrol
strains of Pseudomonas aeruginosa // Journal of Scientific & Industrial
Research - 2007. - Vol. 66. - P. 627 - 631.
. Rewcastle
G. W., Denny W. A., Baguley B. C. Synthesis and antitumor activity of
substituted phenazine-1-carboxamides // J. Med. Chem. -
1987. -
Vol. 30. - P. 843 - 851.
. Saleh
O., Gust B., Boll B., Fiedler H., Heide L. Aromatic Prenylaton in phenazine
biosynthesis dihydrophenazine-1-carboxylate dimethylallyltransferase from
Streptomyces anulatus // The journal of biological chemistry - 2009. - Vol.
284. - P. 14439 - 14447.
. Santos
A. S., Sampaio A. P., Vasquez G. S., Pereira N., Freire D. M. G. Evaluation of
different carbon and nitrogen sources in production of rhamnolipids by a strain
of Pseudomonas aeruginosa // Applied Biochemistry and Biotechnology - 2002. -
Vols. 98 - 100. - P. 1025 - 1035.
. Schlereth
D. D., Karyakin A. A. Electropolymerization of phenothiazine, phenoxazine and
phenazine derivates: characterization of the polymers by UV-visible difference
spectroelectrochemistry and fourier transform IR spectroscopy // Journal of
electroanalytical chemistry - 1995. - Vol. 395. - P. 221 - 232.
. Stammer
C., Taurins A. Synthesis of some phenazine derivatives // Canadian journal of
chemistry - 1963. - Vol. 41. - P. 228 - 235.
. Turner
J. M. Occurrence, biochemistry and physiology of phenazine pigment production
// Adv. Microb. Physiol. - 1986. - Vol. 27. - P. 211 - 275.
. Toohey
J. I., Nelson C.D., Krotkov G. Isolation and identification of two phenazines
from a strain of Pseudomonas aureofaciens // Canadian journal of botany. -
1965. - Vol. 43. - P. 1055 - 1062.
. Wilson
R., Sykes D. A., Watson D., Rutman A., Taylor G. W., Cole P. J. Measurement of
Pseudomonas aeruginosa phenazine pigments in sputum and assessment of their
contribution to sputum sol toxicity for respiratory epithelium // Infection and
Immunity - 1988. - Vol. 56. - P. 2515 - 2517.
. Zaugg
W. S. Spectroscopic characteristics and some chemical properties of
N-methylphenazinium methyl sulfate (phenazine methosulfate) and pyocyanine at
the semiquinoid oxidation level // The journal of biological chemistry - 1964.
- Vol. 239. - P. 3964 - 3970.
. Zozulya
V., Blagoi Yu., Lober G., Voloshin I., Winter S., Makitruk V., Shalamay A.
Fluorescence and binding properties of phenazine derivates in complexes with
polynucleotides of various base compositions and secondary structures //
Biophysical chemistry - 1997. - Vol. 65. - P. 55 - 63.
. Zhang
Y., Nakkeeran S., Fernando W. G. D. Biosynthesis of antibiotics by PGPR and its
relation in biocontrol of plant diseases // Biocontrol and Biofertilization -
2005. - Vol. 3. - P. 67 - 109.