Химические эквиваленты. Простые и сложные вещества
Белорусский государственный
университет
информатики и радиоэлектроники
Кафедра химии
Отчет по лабораторной работе № 1
"Химические эквиваленты. Простые
и сложные вещества"
Выполнил:
Студент 1-го курса
Группы № 242701
Жамойть Александр Евгеньевич
Проверила:
Молочко А.П.
Минск 2013
Содержание
Экспериментальная часть
1. Определение эквивалентной массы металла методом вытеснения
водорода
1.1 Ход и данные опыта
1.2 Анализа результатов опыта
2. Определение эквивалентной массы соли
2.1 Ход и данные опыта
2.2 Анализ результатов опыта
Экспериментальная
часть
Цель работы: пользуясь методом вытеснения водорода
или другого газа, определить эквивалентные массы металла и соли.
1.
Определение эквивалентной массы металла методом вытеснения водорода
1.1 Ход и
данные опыта
В данном опыте используется прибор, который изображен на
рис.1. С помощью этого прибора мы определяем объем выделившегося водорода в
реакции металла (2-ух валентного) и кислоты. Далее с помощью закона
эквивалентов находим молярную массу металла, по которой определяем металл.
Численные данные представлены в таблице 1.
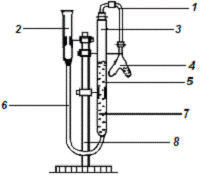
) Трубка для передачи выделившегося газа в сосуд с водой
) Емкость для вытесненной жидкости
) Скопление газа в трубе
) Колба Оствальда
) Емкость для скопления жидкости и газа с делениями
) Трубка, соединяющая емкость для скопления газа и жидкости с
емкостью для вытесненной жидкости
) Использующаяся в опыте жидкость
) Штатив
Рис. 1
Таблица 1.
|
Наименование
измерений
|
Обозначение
|
Численные значения
|
Единица
измерения
|
|
Масса образца
металла
|
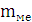
|
0,02
|
г
|
|
Температура
опыта
|
T
|
291
|
K
|
|
Объем
выделившегося H2
|
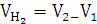
|
22
|
мл
|
|
Атмосферное
давление
|
Pатм
|
727
|
мм. рт. ст.
|
|
Давление
насыщенных водяных паров
|
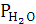
|
15,47
|
мм. рт. ст.
|
|
Давление
выделившегося водорода
|
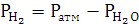
|
711,51
|
мм. рт. ст.
|
Расчеты:
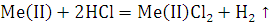
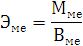
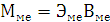
По закону эквивалентов:

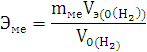
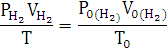
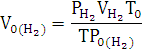

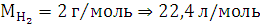
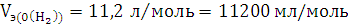

Элемент с ближайшим значением молярной массы Mg.
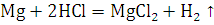
1.2 Анализа
результатов опыта
В данном эксперименте использовался Mg. Это твердое вещество
при обычной температуре. Относиться к щёлочноземельным металлам. Очень
активный. Проводит электрический ток. Серебристого цвета. Число протонов равно
числу электронов, равно числу нейтронов и равно 12. Валентность равна 2.
. Рассчитайте абсолютную и относительную погрешности опыта.
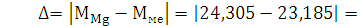 г/моль - абсолютная погрешность
г/моль - абсолютная погрешность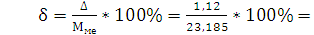 % - относительная
погрешность
% - относительная
погрешность
. С растворами щелочи реагируют только амфотерные металлы:
алюминий, цинк, олово. Примеры:
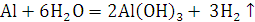
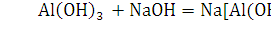
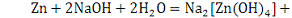
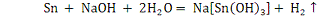
2.
Определение эквивалентной массы соли
2.1 Ход и
данные опыта
Этот опыт похож на первый, за исключением того, что в реакцию
вступает известная соль карбонат кальция с той же соляной кислотой. Для
предотвращения потерь CO2, образующегося в реакции и хорошо
растворяющегося в воде, заменяем воду в приборе на насыщенный раствор NaCl.
Далее опять же используя закон эквивалентов, находим эквивалентную массу
карбоната кальция. Численные данные представлены в таблице 2.
Таблица 2.
|
Наименование измерений
|
Обозначение
|
Численные
значения
|
Единица
измерения
|
|
Масса CaCO3
|
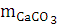
|
0,038
|
г
|
|
Температура
опыта
|
T
|
291
|
K
|
|
Объем
выделившегося CO2
|
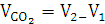
|
8,8
|
мл
|
|
Атмосферное
давление
|
Pатм
|
727
|
мм. рт. ст.
|
|
Давление
насыщенных водяных паров
|
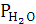
|
15,47
|
мм. рт. ст.
|
|
Давление
выделившегося углекислого газа
|
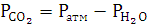
|
711,51
|
мм. рт. ст.
|
Расчеты:
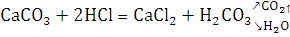
Согласно закону эквивалентов:
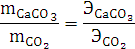
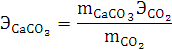

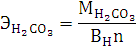
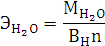
Согласно уравнению Менделеева-Клапейрона:

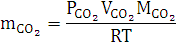
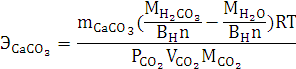
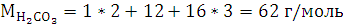
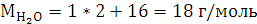
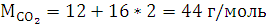
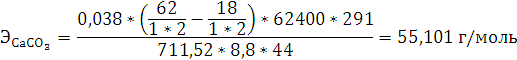
2.2 Анализ
результатов опыта
1.
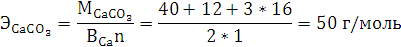
 г/моль - абсолютная погрешность
г/моль - абсолютная погрешность
химический эквивалент металл соль
 % - относительная погрешность
% - относительная погрешность
. При расчете эквивалентной массы карбоната кальция
использовалось значение эквивалентной массы углекислого газа в два раза больше
теоретического, потому что в зависимости от реакции эквивалент сложных
соединений может изменяться. Расчеты проведены выше.
. Эквивалент вещества может изменяться в зависимости от
реакции. Так при разложении 
 эквивалент равен 22, в то время как
теоретический (рассчитанный по формуле
эквивалент равен 22, в то время как
теоретический (рассчитанный по формуле 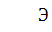 ) равен 11.
) равен 11.
Ответы на контрольные вопросы
1. Мышьяк образует два оксида, из которых один содержит 65,2%
Аs, другой - 75,5 % Аs. Определите эквивалентную массу мышьяка в обоих оксидах.
От чего зависит эквивалент химического элемента?)
Ответ: В оксиде мышьяка (V) его эквивалентная масса равна 15
г/моль, а в оксиде мышьяка (III) 25 г/моль. Эквивалент зависит от валентности
элемента в данном соединении.
. Металл (II) массой 13,43 г вытеснил из раствора кислоты 5 л
водорода, собранного над водой и измеренного при температуре 291 К и 101,3 кПа.
Давление насыщенного пара воды равно 2,07 кПа. Определите, какой это металл.
Ответ: В реакции участвовал Zn.
. Сколько граммов гидроксида натрия вступило в реакцию, если
в результате получилось два эквивалента металла?
Ответ: В реакцию вступило 80 г гидроксида натрия.
. Сколько моль эквивалентов сероводорода получилось при
взаимодействии водорода и 8 г серы при н. у.?
Ответ: Получилось 0,5 