|
Повреждённые структуры
|
Количество операций в
год
|
|
Кожа
|
4,750 млн.
|
|
Хрящ
|
1,132 млн.
|
|
Кровеносные сосуды
|
1,100 млн.
|
|
Поджелудочная железа
|
728 тыс.
|
|
Почка
|
600 тыс.
|
|
Лёгкие
|
261 тыс.
|
|
Печень
|
155 тыс.
|
|
Сухожилия и связки
|
123 тыс.
|
|
Кишечник
|
100 тыс.
|
|
Мочеточник и уретра
|
81,9 тыс.
|
|
Сердечные сосуды
|
65 тыс.
|
|
Мочевой пузырь
|
57,2 тыс.
|
В данное время тканевая инженерия практикует восстановление кожи,
хрящевой и костной тканей. Общий рынок к 2005 г., охватывающий сферы лечения
сердечно - сосудистых болезней, зубов, восстановления и замещения органов,
оценивается в 2,1 млрд. долл. и ежегодно увеличивается на 28 %. В целом мировой
рынок тканеинженерных продуктов для восстановления костной, хрящевой тканей и
кожи на сегодняшний день составляет около 5,6 млрд. долларов. Около 250 компаний
в США, Европе и на Дальнем Востоке заняты в сфере тканевой инженерии и
регенеративной медицины [3].
Наличие спроса на матрицы в нашей стране так же возрастает ежегодно, что
вызывает необходимость в написании технических условий на матрицы для их сертификации
и продажи клиническим центрам, занимающимся трансплантологией. Целью данной
работы явилась разработка проекта технических условий.
1.
Обзор литературы
1.1 Нормативная и законодательная
литература
1.1.1 Закон «о техническом
регулировании»
Закон «о техническом регулировании» принят ГД РФ в 2002. И регулирует
отношения возникающие при:
разработке, принятии, применении и исполнении обязательных требований к
продукции, процессам производства, эксплуатации, хранения, перевозки,
реализации и утилизации;
разработке, принятии, применении и исполнении на добровольной основе
требований к продукции, процессам производства, эксплуатации, хранения,
перевозки, реализации и утилизации;
оценке соответствия.
Закон также определяет права и обязанности участников регулируемых
настоящим Федеральным законом отношений.
Закон содержит требования к функционированию единой сети связи Российской
Федерации и к продукции, связанные с обеспечением целостности, устойчивости
функционирования указанной сети связи и ее безопасности, отношения, связанные с
обеспечением целостности единой сети связи Российской Федерации и
использованием радиочастотного спектра, соответственно устанавливаются и
регулируются законодательством Российской Федерации в области связи.
Действие настоящего Федерального закона не распространяется на
государственные образовательные стандарты, положения (стандарты) о
бухгалтерском учете и правила (стандарты) аудиторской деятельности, стандарты
эмиссии ценных бумаг и проспектов эмиссии ценных бумаг.
Техническое регулирование осуществляется в соответствии с принципами:
применения единых правил установления требований к продукции, процессам
производства, эксплуатации, хранения, перевозки, реализации и утилизации,
выполнению работ или оказанию услуг.
соответствия технического регулирования уровню развития национальной
экономики, развития материально-технической базы, а также уровню
научно-технического развития
независимости органов по аккредитации, органов по сертификации от
изготовителей, продавцов, исполнителей и приобретателей
единства правил и методов исследований (испытаний) и измерений при
проведении процедур обязательной оценки соответствия
единства применения требований технических регламентов независимо от
видов или особенностей сделок
недопустимости ограничения конкуренции при осуществлении аккредитации и
сертификации
недопустимости совмещения полномочий органа государственного контроля
(надзора) и органа по сертификации
недопустимости совмещения одним органом полномочий на аккредитацию и
сертификацию
недопустимости внебюджетного финансирования государственного контроля
(надзора) за соблюдением требований технических регламентов.
Стандартизация осуществляется в целях:
повышения уровня безопасности жизни или здоровья граждан, имущества
физических или юридических лиц, государственного или муниципального имущества,
экологической безопасности, безопасности жизни или здоровья животных и растений
и содействия соблюдению требований технических регламентов
повышения уровня безопасности объектов с учетом риска возникновения
чрезвычайных ситуаций природного и техногенного характера
обеспечения научно-технического прогресса
повышения конкурентоспособности продукции, работ, услуг
рационального использования ресурсов
технической и информационной совместимости
сопоставимости результатов исследований (испытаний) и измерений,
технических и экономико-статистических данных
взаимозаменяемости продукции.
Стандартизация осуществляется в соответствии с принципами:
добровольного применения стандартов
максимального учета при разработке стандартов законных интересов
заинтересованных лиц
применения международного стандарта как основы разработки национального
стандарта, за исключением случаев, если такое применение признано невозможным
вследствие несоответствия требований международных стандартов климатическим и
географическим особенностям Российской Федерации, техническим и (или)
технологическим особенностям или по иным основаниям либо Российская Федерация в
соответствии с установленными процедурами выступала против принятия
международного стандарта или отдельного его положения
недопустимости создания препятствий производству и обращению продукции,
выполнению работ и оказанию услуг в большей степени, чем это минимально
необходимо для выполнения целей, указанных в статье 11 настоящего Федерального
закона
недопустимости установления таких стандартов, которые противоречат
техническим регламентам
обеспечения условий для единообразного применения стандартов.
По закону о техническом регулировании матрицы должны подлежать
обязательной сертификации и на нее должен распространять свое действие
технический регламент, так как эта продукция затрагивает жизнь и здоровье
граждан. Но ввиду отсутствия каких-либо стандартов и технических регламентов на
матрицы для тканевой инженерии, и в присутствии конкурентоспособного рынка в
этой сфере, необходимо сертифицировать продукцию в системе добровольной
сертификации, для чего и были разработаны технические условия [4].
.1.2 Закон «о единстве измерений»
Закон принят 27 апреля 1993 года и устанавливает правовые основы
обеспечения единства измерений в Российской Федерации, регулирует отношения
государственных органов управления Российской Федерации с юридическими и
физическими лицами по вопросам изготовления, выпуска, эксплуатации, ремонта,
продажи и импорта средств измерений и направлен на защиту прав и законных
интересов граждан, установленного правопорядка и экономики Российской Федерации
от отрицательных последствий недостоверных результатов измерений.
Единство измерений - состояние измерений, при котором их результаты
выражены в узаконенных единицах величин и погрешности измерений не выходят за
установленные границы с заданной вероятностью;
В Российской Федерации в установленном порядке допускаются к применению
единицы величин Международной системы единиц, принятой Генеральной конференцией
по мерам и весам, рекомендованные Международной организацией законодательной
метрологии.
Наименования, обозначения и правила написания единиц величин, а также
правила их применения на территории Российской Федерации устанавливает
Правительство Российской Федерации, за исключением случаев, предусмотренных
актами законодательства Российской Федерации.
Правительством Российской Федерации могут быть допущены к применению
наравне с единицами величин Международной системы единиц внесистемные единицы
величин.
Характеристики и параметры продукции, поставляемой на экспорт, в том
числе средств измерений, могут быть выражены в единицах величин, установленных
заказчиком [5].
1.1.3 Требования к разработке и оформлению
технических условий в ГОСТ 2.114-95
Данный стандарт устанавливает общие правила построения, изложения,
оформления, согласования и утверждения технических условий (ТУ) на продукцию
(изделия, материалы, вещества и т.п.)
Технические условия являются техническим документом, который
разрабатывается по решению разработчика (изготовителя) или по требованию
заказчика (потребителя) продукции. Технические условия (ТУ) являются
неотъемлемой частью комплекта конструкторской или другой технической документации
на продукцию, а при отсутствии документации должны содержать полный комплекс
требований к продукции, ее изготовлению, контролю и приемке. ТУ разрабатывают
на одно конкретное изделие, материал, вещество или несколько конкретных
изделий, материалов, веществ и т.п. Требования, установленные ТУ, не должны
противоречить обязательным требованиям государственных (межгосударственных)
стандартов, распространяющихся на данную продукцию.
Обозначение ТУ присваивает разработчик. На изделия машиностроения и
приборостроения ТУ обозначают по ГОСТ 2.201.
Пример - ШРПИ.041221.002ТУ.
На материалы, вещества и т. п. обозначение ТУ рекомендуется формировать
из:
кода "ТУ";
кода группы продукции по классификатору продукции страны - разработчика
ТУ;
трехразрядного регистрационного номера, присваиваемого разработчиком;
кода предприятия разработчика ТУ по классификатору предприятий страны -
разработчика ТУ;
года утверждения документа.
Пример обозначения ТУ для Российской Федерации:
ТУ 1115-017-38576343-2000, где 1115 - код группы продукции по
Общероссийскому классификатору продукции (ОКП), 38576343 - код предприятия по
Общероссийскому классификатору предприятий и организаций (ОКПО).
Пример - ТУ 4311-182-38576343-2000 (АБВГ.523142.025 ТУ), где 4311 - код
группы продукции по Общероссийскому классификатору продукции (ОКП); 38576343 -
код предприятия по Общероссийскому классификатору предприятий и организаций
(ОКПО).
ТУ должны содержать вводную часть и разделы, расположенные в следующей
последовательности:
технические требования;
требования безопасности;
требования охраны окружающей среды,
правила приемки;
методы контроля;
транспортирование и хранение;
указания по эксплуатации;
гарантии изготовителя.
Состав разделов и их содержание определяет разработчик в соответствии с
особенностями продукции. При необходимости ТУ, в зависимости от вида и
назначения продукции, могут быть дополнены другими разделами (подразделами) или
в них могут не включаться отдельные разделы (подразделы), или отдельные разделы
(подразделы) могут быть объединены в один.
В разделе "Технические требования" должны быть приведены
требования и нормы, определяющие показатели качества и потребительские
(эксплуатационные) характеристики продукции.
Раздел в общем случае должен состоять из следующих подразделов:
основные параметры и характеристики (свойства);
требования к сырью, материалам, покупным изделиям;
комплектность;
маркировка;
упаковка.
В разделе "Требования безопасности" устанавливают требования,
которые должны содержать все виды допустимой опасности и устанавливаться таким
образом, чтобы обеспечивалась безопасность продукции в течение срока ее службы
(годности).
В разделе "Требования охраны окружающей среды" устанавливают
требования для предупреждения вреда окружающей природной среде, здоровью и
генетическому фонду человека при испытании, хранении, транспортировании,
эксплуатации (применении) и утилизации продукции, опасной в экологическом
отношении.
В разделе "Правила приемки" указывают порядок контроля
продукции, порядок и условия предъявления и приемки продукции органами технического
контроля предприятия-изготовителя и потребителем (заказчиком), размер
предъявляемых партии, необходимость и время выдержки продукции до начала
приемки, сопроводительную предъявительскую документацию, а также порядок
оформления результатов приемки.
В разделе "Методы контроля" устанавливают приемы, способы,
режимы контроля (испытаний, измерений, анализа) параметров, норм, требований и
характеристик продукции, необходимость контроля которых предусмотрена в разделе
"Правила приемки".
В разделе "Транспортирование и хранение" устанавливают
требования к обеспечению сохраняемости продукции при ее транспортировании и
хранении, в том числе по обеспечению безопасности.
В разделе "Указания по эксплуатации" приводят указания по
установке, монтажу и применению продукции на месте ее эксплуатации
(применения), например способ соединения с другой продукцией; требования к
условиям охлаждения с указанием, при необходимости, критериев и методов
контроля; возможность работы в других средах; особые условия эксплуатации
(необходимость защиты от электрических и радиационных полей, требования
периодической тренировки, эксплуатационного обслуживания и т.п.) сведения об
утилизации; мероприятиях по подготовке и отправке изделий, материалов, веществ
на утилизацию; методах утилизации, если изделие, материалы, вещества
представляют опасность для жизни, здоровья людей и окружающей среды после
окончания срока службы (применения, эксплуатации), либо дают ссылку на
соответствующие документы, например, на эксплуатационные документы.
В разделе "Гарантии изготовителя" устанавливают права и
обязанности изготовителя по гарантиям в соответствии с действующим
законодательством [6].
матрица самоупорядочивание тканевый инженерия
2.
Основная часть
2.1 Сведения об организации
Организация: Федеральное агентство по здравоохранению и социальному
развитию. Научно-исследовательский институт физико-химической медицины. Отдел
морфологии.
Направление исследований: морфологические и морфометрические исследования
клеток крови и клеток в культурах, гистологические и цитологические
исследования, стандартизация и контроль качества гематологических исследований
в клинико-диагностических лабораториях.
Область
интересов:
· Автоматизированная морфометрия клеток крови.
· Биологически активные фосфолипиды, индуцированные
миелопероксидазой, и их сигнальная роль в
фагоцитозе.
· Изучение роли пероксидазной активности цитохрома с и
окисленных фосфолипидов в апоптозе.
· Роль внутриклеточных тиолов в инфицировании клеточной линии
HeLa бактериями Chlamydia trachomatis.
· Разработка цитотоксических тестов для
анализа био совместимости материалов и изделий.
Разработка ТУ на данную продукцию необходимо, для проведения её
сертификации и дальнейшей продажи.
Возможные покупатели: медицинские центры и клиники, занимающиеся биомедициной и
применяющие передовые разработки в области тканевой инженерии.
2.2
Методика получения матриц
2.2.1 Теоретические основы получения
монослойных и многослойных матриц методом самоупорядочивания [7]
Динамика двумерного упорядочивания микрометрово-размерных
полистирольно-латексных сфер на горизонтальном стеклянном субстрате
непосредственно наблюдалась посредством оптической микроскопии. Оказывается,
что упорядочивание начиналось, когда толщина водного слоя, содержащего частицы
становилась приблизительно равной диаметру частиц. Изменением концентрации
электролита, заряда частиц, и их объёмной фракции, доказано, что ни
электростатическое отталкивание, ни Ван-дар-Ваальсово притяжение между частицами
не существенно при формировании двумерных кристаллов. Прямые наблюдения
показали главные факторы, управляющие упорядочиванием - капиллярные силы
притяжения (из-за менисков, сформированных вокруг частиц) и конвективного
транспорта частиц к упорядоченной области. Контроль скорости испарения воды,
оказывается, позволяет получать как хорошо-упорядоченные монослои так и
хорошо-упорядоченные области, состоящие из мультислоев (двойные слои, тройные,
и т.д.). Предлагается двухэтапный механизм формирования множества. В первой
стадии появляется "ядро" упорядоченной фазы, когда верхняя
поверхность утончающегося водного слоя в жидкой пленке прижимает латексные
частицы к границе раздела вода-стекло. Как показано теоретически, когда
сферические частицы частично погружены в жидкий слой на горизонтальном твердом
субстрате, деформации границы раздела жидкость-газ дают начало сильным и
дальнодействующим капиллярным силам.
Предположив, что две частицы радиуса R, частично погружены в жидкий слой,
толщина которого стремится к постоянному значению l0 на большом расстоянии от этих двух частиц (рис. 1). Форма
мениска подчиняется уравнению Лапласа капиллярности и определяется расстоянием
L = 2s между частицами, толщина слоя l0, и
значение контактного угла α, который характеризует смачиваемость
частиц. Водный уровень во внутренней области (между частицами) выше чем во
внешней. Следующий наклон линии контакта трех фаз на поверхности частиц дает
начало двум капиллярным эффектам, приводящих к взаимодействию: (1) эффект
давления, вызванный более высоким гидростатическим давлением в газовой фазе чем
давление в жидкости при z> l0 (особенно во внутренней области),
это различие давления двигает частицы друг к другу; (2) эффект силы
поверхностного натяжения вследствие того, что наклон (относительно
горизонтального) жидкой поверхности, и следовательно x компонента σx поверхностного натяжения, изменяется
по линии контакта. Развитие теории показало, что для микрометровых и меньших
частиц эффект поверхностного натяжения превышает эффект давления на многие
порядки.
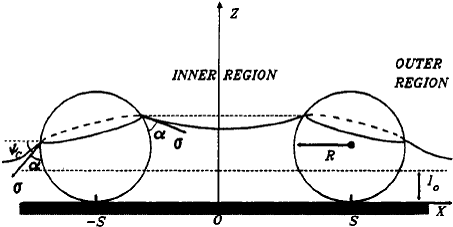
Рис. 1. Две сферы частично погруженные в жидкий
слой на горизонтальном твердом субстрате. Деформация жидкого мениска приводит к
притяжению между частицами.
Следует отметить, что капиллярные силы между частицами, частично
погруженными в жидкий слой на твердом субстрате (мы называем их
"иммерсионными капиллярными силами") на много порядков больше чем
капиллярные силы между подобным плавающими частицами, приложенными к
единственной поверхности, которые иногда называют "флотационными
капиллярными силами".
Механизм, описанный выше предлагает по крайней мере два пути для контроля
над процессом упорядочивания: (1) контроль скорости конвективного потока,
изменяя скорость испарения воды; (2) контроль профиля жидкого мениска,
окружающего упорядоченное множество, удаляя (вводя) некоторое количество
суспензии в течение эксперимента. Оба пути приводят к изменению жидкой толщины
слоя и наклона поверхности на границе между множеством и окружающим мениском.
Изменяя температуру мы имеем возможность изменить относительную влажность
над слоем суспензии и таким образом ускорять (или замедлять) испарение воды с
поверхности слоя. С другой стороны, впрыск (или высасывание) суспензии в (из)
ячейки приводит к увеличению (уменьшению) объема суспензии, таким образом
изменяя форму жидкого мениска. Как правило, 2-ые множества лучшего качества
(большие "монокристаллические" области) были получены, когда скорость
2-ого роста кристалла была ниже. Результат процесса упорядочивания, оказывается,
связан также с величиной угла θ характеризующего наклона окружающего
жидкого мениска на границе с растущим 2-ым множеством. Так как жидкий слой в
ячейке является вогнутым (рис.2), наклон мениска является более близким к
внутренней цилиндрической стенке ячейки.
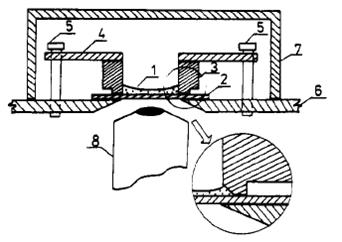
Рис. 2. Схема основной экспериментальной ячейки:
(1) латексная суспензия, (2) стеклянная пластина, (3) тефлоновое кольцо, (4)
латунная пластина, (5) винты, (6) стол микроскопа, (7) стеклянный колпак, (8)
объектив микроскопа.
Именно поэтому, когда упорядоченный монослой частиц в середине субстрата
растет к цилиндрической стенке, угол θ постепенно увеличения. Величина θ
может быть оценена в
каждый момент из интерференционных полос. Когда θ становится достаточно большим, можно
наблюдать формирование упорядоченного двойного слоя, вместо монослоя. Угол θ
может изменяться как
путем изменения скорости испарения воды, так и путем изменения объема суспензии
в ячейке. Например, ускоренное испарение воды и удаление суспензии от мениска
приводят к уменьшению θ. Таким образом, они могут подавить формирование
двойного слоя и других мультислоев. В обратном случае, под контролируемым
увеличением, угла θ (через замедленное испарение или введением суспензии в
ячейку) можно ускорить формирование упорядоченных мультислоев различной
толщины. Более близкий осмотр мультислоев с более высоко разрешающим объективом
(X 100) показывает, что они состоят из хорошо-упорядоченных областей
гексагонально упакованных частиц. Более высокое разрешение показывает также,
что узкие полосы между этими слоями состоят из многих маленьких областей из
частиц с квадратной упаковкой, как показанные на рис. 3. Полная
последовательность слоев следующая: lΔ, 2□, 2Δ, 3□, 3Δ..., где число обозначает число слоев и
символ означает гексагональную (Δ) или квадрат (□) упаковку
частиц.
Рис. 3. Переход между монослоем (яркий, снизу
справа), и двойным слоем (темный, верхний слева) упорядоченных частиц. Частицы,
упакованные в квадратную решетку могут быть замечены в зоне перехода.
Установка, показанная на рис. 2 использовалась в большинстве
экспериментов. Капля латексной суспензии (1 на рис. 2) с данным объемом и
составом помещалась на стеклянную пластину (2). Капля распространяется по
доступной поверхности стекла, окруженной тефлоновым кольцом с внутренним
диаметром 14 мм (3 на рис. 2). Кольцо поджато к стеклу (чтобы избежать утечки
жидкости) толстым латунным листом (4) и винтами (5). Система установлена на
столике (6) металлографического микроскопа и накрыта стеклянным колпаком (7),
который позволяет освещать систему сверху. Наблюдения выполнялись через низ
ячейки в отраженном монохроматическом свете (длина волны λ
= 546 нм) или в
проходящем полихроматическом свете. Объективы (8) с увеличением X4 и X100
(последний, имеющий иммерсионный тип) использовались.
.2.2 Получение матриц
Большинство экспериментов было выполнено с 1% (по весу) суспензией
полистирольного латекса с диаметром частицы 6 мкм. Измерения поверхностного
электрического ξ-потенциала частиц (meansof Zetesizer IIC, Malvem
InstrumentsLtd., Англия), показали, что они сильно заряжены: ξ=
- 106 ± 2 мВ с
добавлением 0,01 моль/л NaCl при 25°С. Латексных суспензии использовались без
дополнительной очистки.
В некоторых экспериментах суспензии были разбавлены водой, очищенную
Milli-Q Organex системой (Millipore, MA). NaCl (Merck) нагревался в течение
нескольких часов при 500°С перед использованием, для удаления влажности и
органических примесей. ПАВы додецилсульфат натрия (SDS) и гексодецилтриметиламмонийбромид использовались без
дополнительной очистки.
В качестве субстрата мы использовали гидрофильньные покровные стекла (Inkglas, Германия) толщиной 0,17 мм.
Стеклянные пластины и тефлоновые кольца тщательно чистили, моя их с моющим средством,
с последующим погружением больше чем на 24 ч в серную кислоту, с последующим
обильным мытьем с дистиллированной водой из Milli-Q Organex системы. Очищенные
пластины хранились в дистиллированной воде от 6 до 12 часов, и высушивались в
вакууме как раз перед экспериментом.
В экспериментах использовалась установка изображенная на рисунке 2. Капля
суспензии объемом 20 мкл размазывалась по основанию экспериментальной ячейки.
Объем и концентрация размазанного количества суспензии были выбраны так, чтобы
обеспечить (приблизительно) формирование плотного монослоя частиц после
испарения воды. Капля спонтанно растекалась и формировала немного вогнутый слой
(рис. 2), толщина которого - приблизительно 100 мкм в центре ячейки. Затем
дожидались полного испарения воды со стекла, и получалась готовая к применению
матрица.
2.3 Требования, предъявляемые к
матрицам
2.3.1 Список требований
· биосовместимость;
· способность естественно разлагаться с течением
времени и затем абсорбироваться в теле человека;
· отсутствие цитотоксичности;
· поддержание адгезии и фиксации, пролиферации и
дифференцировки, помещённых на её поверхность клеток;
· биорезорбируемость обычными метаболическими
путями;
· контроль размера пор при получении различных
подложек;
· контроль топографии поверхности и шероховатость;
· механическая прочность.
2.3.2 Обоснование предъявляемых
требований для использования подожек в тканевой инженерии, собственно к
подложкам и к сырью
Биосовместимость материалов в теле человека играет важную роль в тканевой
инженерии, так как материалы должны быть безопасными для человеческого тела. В
идеальном случае материал используемого имплантанта для замещения дефектных
тканей или их восстановления в повреждённых местах должен обладать полной
биосовместимостью, то есть материал не должен вызывать какую-либо
воспалительную реакцию, чрезмерную иммуногенность или
быть цитотоксичным по отношению к клеткам, тканям или органам in vivo. Кроме этого продукты
процесса разложения имплантата не должны содержать вредные вещества и/или элементы.
Основное требование при разработке и конструировании подложки заключается в её
способности естественно разлагаться с течением времени и затем абсорбироваться
в теле человека, не приводя к каким-либо сторонним эффектам. Вследствие
увеличения спроса на подложки и имплантаты в последние годы произошло быстрое
развитие всесторонних исследований на биосовместимость подложек и на
токсичность продуктов их разложения. Таким образом основными критериями
биологически совместимой матрицы для создания тканеинженерной конструкции
должны быть: отсутствие цитотоксичности, поддержание адгезии и фиксации,
пролиферации и дифференцировки, помещённых на её поверхность клеток, отсутствие
воспалительной реакции на материал и иммунного ответа, достаточная механическая
прочность в соответствии с назначением, биорезорбируемость обычными
метаболическими путями.
Увеличение количества биоразлагаемых полимеров
обуславливается ростом интереса к таким веществам со стороны хирургии и
фармакологии. К биоразлагаемым полимерам относятся полимеры, обеспечивающие
постепенное совмещение с тканями организма и помещаемые в организм лишь на
период восстановления функций тканей или органов. Такие материалы должны
обладать способностью, под воздействием биологических сред, претерпевать
деструктивные и метаболические превращения и постепенно замещаться тканями
организма. В идеальном случае, биосовместимые полимерные должны временно
выполнять функции утраченных в результате оперативного вмешательства тканей, не
препятствовать их регенерации. К биорезорбируемым материалам относятся
полимеры, которые разлагаются после определённого периода времени имплантации с
выделением нетоксичных продуктов разложения, удаляемых с течением времени или в
процессе обмена веществ. С химической точки зрения существует два способа
разложения: 1) гидролиз, когда разложение материала происходит при
взаимодействии с водой; 2) ферментативное разложение под воздействием
биологических агентов, таких как энзимы. Биоразложение подложки должно
сопровождаться заполнением образующихся пространств внеклеточным матриксом. В
настоящее время существует много видов материалов, широко используемых в
качестве биоадсорбируемых имплантатов, и их количество быстро растёт. Пример
коммерчески доступных рассасывающихся ортопедических имплантатов приведён в
таблице 2.
Таблица 2. Пример коммерчески доступных
саморассасывающихся материалов для ортопедических имплантатов.
|
полимер
|
аббревиатура
|
область
применения
|
|
Полигликолевая
кислота
|
PGA
|
Трёхмерные
полимерные подложки для клеточной трансплантации
|
|
Полимолочная
кислота
|
PLA
|
Трёхмерные
полимерные подложки для клеточной трансплантации
|
|
Поли-L-лактид
|
L-PLA
|
Фиксация
трещин, закрепление швов, восстановление мускулов-вращателей, восстановление
мениска
|
|
Поли-D,L-лактид
|
L,D-PLA
|
Фиксация
трещин, закрепление швов
|
Преимуществами использования биоразлагаемых имплантатов над
традиционными металлическими материалами является отсутствие болевых ощущений
при ношении биоразлагаемого имплантата и второй хирургической операции по его
удалению.
При конструировании подложки необходимо учитывать оптимальные
скорость разложения и размер пор, а также учитывать морфологию поверхности.
Биоразлагаемые полимерные подложки должны сохранять свои физические
характеристики и механические свойства, а также способствовать присоединению,
размножению и дифференциации клеток до момента полного восстановления ткани на
повреждённом участке. В идеальном случае скорость разложения и дифференциации
клеток должна быть связана со скоростью образования новой ткани. Однако
последние исследования показали, что скорость разложения разных видов
биоразлагаемых полимеров различная и зависит от состава полимера и условий
окружающей среды. Скорость энзимного разложения зависит от поверхности
полимера, следовательно площадь поверхности и структура (пористость) полимера
являются одним из способов контролирования скорости разложения. Основные
процессы, влияющие на кинетику биодеградации биосовместимых полимеров, включают
растворение, гелеобразование, гидролиз, ферментный гидролиз, десорбцию
продуктов деструкции. В процессе постепенного совмещения искусственные ткани не
должны оказывать отрицательного влияния на окружающие ткани и организм в целом
или, во всяком случае, это влияние не должно выходить за допустимые пределы
[8].
Кинетика абсорбции подложки также критична и зависит от
ткани, которая будет восстановлена на ней. Если подложка используется для
тканевой инженерии скелетной системы, разрушение биоматериала подложки должно
быть относительно медленным, поскольку она должна поддерживать механическую
прочность, пока регенерация ткани полностью незакончена. Для тканевой инженерии
кожи, подложке не требуется оставаться более чем на один месяц. Если подложка
остается в течение более длительного времени чем желаемое, то остающийся
материал может задержать регенерацию ткани, а не ускорить её. Это показывает,
что кинетика абсорбции материала подложки глубоко затронет скорость достижения
успешного лечения при использовании тканевой инженерии.
Поли-α-гидроксикислоты, особенно
гликолиды и полимеры производных молочной кислоты, широко использовались как
биоматериалы для изготовления подложек. Вообще, полигликолевая кислота (PGA) и её сополимеры, типа
сополимер гликолевой и молочной кислот (PLGA), разрушаются слишком
быстро когда используются в качестве подложки, так что их предел прочности
уменьшается вдвое в течение двух недель. Напротив, поли-L-молочная кислота (PLLA) разрушается слишком
медленно, требуя 3-6 лет для полного всасывания. Вследствие этой необычной
способности всасывания PGA и PLLA, лактановые сополимеры, типа лактид-ε-капролактан (PCL) сополимеров (P[LA-CL]), предпочтительно
использовались в недавних работах по тканевой инженерии. Рисунок 4
представляет относительные скорости всасывания PGA, PLGA, P[LA-CL], PLLA и PCL.
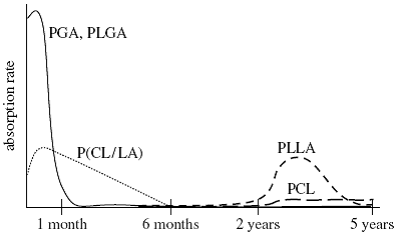
Рис. 4. График скорости абсорбции абсорбирующихся
полиэфиров. Полигликолевая кислота (PGA); сополимер гликолевой и
молочной кислот (PLGA); лактид-ε-капролактан (PCL); сополимер (P[LA-CL]).
Поли-α-гидроксикислоты
разлагаются через неферментативный гидролиз, тогда как встречающиеся в природе
биоматериалы, включая коллаген и хитин, подвергаются ферментативному гидролизу.
Большинство естественно встречающихся полимеров, исключая хитин, гидрофильные и
из них получаются изделия с низкой механической прочностью по сравнению с поли-α-гидроксикислотами. Это ведет к ограниченному применению этих
биополимеров. Альгинат не содержит никаких гидролизующихся связей, но его часто
используются как ресорбирующий биоматериал. Потому что альгинат, который был
сделан водонерастворимыми посредством ионной связи с двухвалентными катионами
типа Ca2+, возвращается к растворимому в воде полимеру, в теле,
поскольку ионные связи освобождаются через обмен Ca2+ с Na+ в теле. Почти все другие
растворимые в воде биополимеры переводятся в водонерастворимые через
ковалентную связь с использованием глутарового альдгида или карбодиимида [9].
Полимерный материал должен легко перерабатываться в изделия
простыми и сравнительно дешёвыми способами. Большое значение имеет доступность
применяемых полимерных материалов и их стоимость, влияющая на экономическую
эффективность применения полимеров по сравнению с традиционными материалами. В
настоящее время существует много способов получения пористых подложек, к
которым относятся пористое выщелачивание, эмульсионная сушка сублимацией,
создание пористости за счёт расширения газа при увеличении температуры,
трёхмерная литография, методы фазового разделения, термическое фазовое
разделение [8, 10]. Обнаружено, что скорость разложения плёнок изменяется при
изменении размера пор и их плотности. Так пористые плёнки разлагаются быстрее,
чем плёнки без пор. Большое количество пор может способствовать усилению
массопереносу внутри трансплантата [8, 11]. Следует заметить, что определённые
размеры пор могут усиливать клеточную активность, при этом оптимальный размер и
геометрия зависят от типа клеток, растущих на повреждённой ткани. На рис. 5
показана зависимость процента клеток, прижившихся на подложках, от диаметра их
пор [9, 12]. Следовательно необходимо контролировать размер пор при получении
различных подложек.
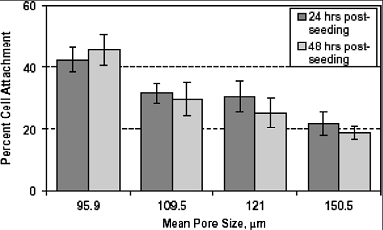
Рис. 5. Зависимость процента присоединившихся
клеток от среднего размера пор подложки при двух значениях времён
культивирования.
Большинству клеток требуется соответствующий субстрат.
Следовательно, конструкция подложек для тканевой инженерии, контроль топографии
поверхности и шероховатость важны для регулирования распространения клеток на
поверхности подложки. На скорость диффузии питательных веществ и кислорода от и
к подложке оказывает влияние шероховатость поверхности. А васкуляризация
улучшает снабжение кислородом и питательными веществами и отвод ненужных
веществ [8, 13].
Механическая прочность играет в некоторых случаях очень
важную роль. Подложки для тканевой инженерии должны обеспечивать временную
физическую поддержку, что бы противостоять внешним и внутренним факторам до тех
пор, пока не образуется новая ткань. На метаболизм, синтез и организацию
внеклеточного матрикса оказывает воздействие механическая структура среды. Эти
силы обычно создаются благодаря как процессу имплантации, так и механическим
силам, действующим на повреждённой поверхности. In vitro подложки должны обладать
способностью противостоять образующейся механической среде, то есть прямому и
гидростатическому давлению. Свойства подложек должны быть подобны свойствам
новой образующейся ткани, что бы обеспечить поддержку структуре на начальной
стадии. На конечном этапе все функции должны быть перенесены на образовавшуюся
ткань, а подложка должна постепенно разложиться [8, 14].
2.4 Методы контроля
2.4.1 Контроль
плотности упаковки
Для контроля над плотностью упаковки полученных структур использовали 2
метода:
) Визуальный
) Расчетный
Визуальный. Для визуальной оценки использовался световой микроскоп МПБ 3М
с объективом Leica х10 и тринокулярной насадкой.
Изображение с микроскопа визуально сопоставлялось с теоретическим
построением гексагональной упаковки микросфер (рис.6)
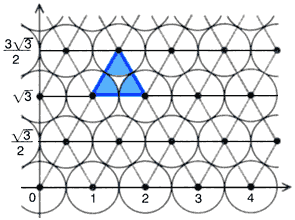
Рис. 6. Изображение теоретической гексагональной
упаковки микросфер.
Расчётный. Для расчётной оценки использовался тот же микроскоп, в
комплекте с цифровой камерой Moticam
1000 и программой захвата изображения МекосЦ.

Рис. 7. Пример фотографии с просвечивающего
светового микроскопа МПБ 3М (объектив Leica х10) 6 мкм
полистирольных микросфер.
2.3.2
Контроль биологической совместимости и пролиферативной активности
Поведение клеток на матрицах анализировали методом флуоресцентной
микроскопии на конфокальном лазерном сканирующем микроскопе Nikon Eclipse E800 (объектив х10). Изображения (рис.8) обрабатывались с
помощью компьютерной программы ImageJ Launcher.
Статистическую обработку данных проводили в программе Microsoft Excel согласно общепринятым правилам.
При работе с культурой клеток использовали макрофаги J774, которые выращивали на среде DMEM
с 10% сывороткой эмбрионов коров (СЭК) в атмосфере 5% СО2 при
температуре 37оС. Жизнеспособность клеток составляла не менее 98 %.
Клетки рассеивали в 24-х луночные плашки, на дне ячеек которых
располагались образцы матриц. Клетки культивировали в инкубаторе в атмосфере 5%
СО2 при температуре 37оС в течение 24 часов (для анализа
пролиферативной активности) и 24 дней (для оценки биологической совместимости)
в стерильных условиях.
Количество рассеянных клеток на одну лунку рассчитывалось с помощью
камеры Горяева. В нашем случае в каждую лунку с покровным стеклом рассеивали по
100000 клеток.
По истечению необходимого времени матрицы с клетками изымали из
инкубатора. Стёкла дважды промывали буферным раствором от не прикрепившихся
клеток, который содержал 88г/л NaCl,
30,26 г/л Na2HPO4·2H2O и 2,35 г/л NaH2PO4·H2O. Перед использованием раствор
разбавляли в 10 раз и доводили до рабочего pH=7,4. Затем матрицы помещали в раствор фиксатора (2%-ый
раствор глютарового альдегида в буферном растворе PBS). Матрицы хранили в этом растворе в течение суток при
температуре 4ºС для окраски клеток перед
микроскопией.


Рис. 8 Пример фотографий с конфокального
лазерного сканирующего микроскопа Nikon Eclipse E800 (объектив х10). При
временах культивирования 24 часа (левый) и 24 дня (правый).
Конфокальная микроскопия
С возникновением методов конфокальной сканирующей микроскопии появилась
возможность путем послойного сканирования просматривать детали объемного
препарата на некоторой его глубине, что не позволяет делать обычный, даже самый
совершенный микроскоп из-за рассеяния и преломления света на оптически
неоднородных фрагментах.
Записав в памяти компьютера серию оптических срезов, можно провести
объемную реконструкцию объекта и получить его трехмерное изображение, не
используя трудоемкую методику изготовления и фотографирования серийных
гистологических срезов.
Большинство современных конфокальных микроскопов построено на базе
люминесцентного (прямого или инвертированного) микроскопа. Следовательно,
объекты исследований должны быть предварительно окрашены соответствующим
люминесцентным красителем или обладать собственной люминесценцией.
Иногда микроскоп имеет т.н. «детектор проходящего света», который
позволяет наблюдать и неокрашенные объекты в режиме интерференционного
контраста.
Способ конфокального сканирования трёхмерных микрообъектов был предложен
ещё в 50-х годах прошлого столетия, но первые коммерческие 3D-микроскопы
появились только к концу 80-х. В настоящее время наибольшее распространение
получила лазерная сканирующая конфокальная микроскопия (LSCM - Laser Scanning
Confocal Microscopy).
Объёмное изображение в LSCM получается при помощи регистрации
флуоресценции в фокусе лазерного луча. Излучаемые фотоны фокусируются
объективом на небольшом (~ 50 мкм) отверстии, которое ослабляет флуоресцентный
сигнал от участков, находящихся не в фокусе.
Получаемые с помощью сканирующих микроскопов виртуальные трёхмерные
изображения высокого разрешения позволяют заглянуть в микромир и по
информативности несопоставимы с обычными двумерными картинками.
Рис. 9. Конфокальный микроскоп Nikon. а) блок лазеров
(аргоновый λ=488 нм; геленеоновый λ=596 нм); б) слева - система управления сканированием лазеров в
микроскопе; в центре - блок питания ртутной лампы; справа (вверху) - блок
питания лампы накаливания; справа (внизу) - блок детекторов; в) микроскоп.
2.5 Текст проекта технических
условий
ОКП 9398-18-6
«СОГЛАСОВАНО»
Руководитель организации, уполномоченной Росздравнадзором на проведение
приемочных технических испытаний
___________________Ф.И.О.
«___»______________ 200 г.
«УТВЕРЖДАЮ» Руководитель организации-разработчика
Иванов И.И.
«___»______________ 200 г.
Технические условия
«Матрицы для тканевой инженерии»
ТУ 9398 - 230 - 49687454 - 2008
Введены впервые
Срок действия
с_____________
до_____________
2008 г.
1 Область
применения
Настоящие технические условия распространяются на полимерные матрицы,
предназначенные для применения в медицине при восстановлении повреждённых или
утраченных тканей.
Технические условия устанавливают требования к качеству, правилам
приёмки, методам контроля, упаковке, маркировке, транспортированию и хранению
матриц.
2 Нормативные
ссылки
ГОСТ 6672-75 Стекла покровные для микропрепаратов. Конструкция и размеры
ГОСТ 14262-78 Кислота серная особой чистоты. Технические условия
ГОСТ 6709-72 Реактивы. Вода дистиллированная. Технические условия»;
ГОСТ 14192-96 Маркировка грузов
ГОСТ 12.1.001-89 Система стандартов безопасности труда. Ультразвук. Общие
требования безопасности
ГОСТ 12.1.005-88 Система стандартов безопасности труда. Общие
санитарно-гигиенические требования к воздуху рабочей зоны.
ГОСТ 12.4.021-75 Система стандартов безопасности труда. Системы
вентиляционные. Общие требования
3 Термины
и определения
В настоящих технических условиях применены термины с соответствующими
определениями:
Матрица - изделие из микросфер различных органических материалов, нанесённых на
неорганический твёрдый субстрат, используемое в качестве подложки (носителя)
для различных клеток, предназначенное для их распластывания, деления и
культивирования.
Субстрат - покровное стекло.
Гексагональная упаковка - плотная упаковка, образующаяся при таком
расположении микросфер, когда вокруг одного шара расположено 6 соседних шаров.
4 Марки
4.1 В зависимости от назначения матрицы выпускают следующих марок:
S -
для кожной тканевой инженерии;
B -
для костной тканевой инженерии;
P -
для культивирования клеток и последующей пересадки клеток без матрицы.
.2 Условное обозначение матрицы состоит из сокращённого названия
материала (PS (полистирол), PGA (полигликолевая
кислота), PLGA (сополимер молочной и гликолевой кислот), PLLA (полимолочная кислота) и
PCL (поликапролактан)),
среднего диаметра микросфер из которых данная матрица получена.
Пример условного обозначения матрицы марки P из полистирольных шаров
диаметром 6 мкм:
PS - P - 6
5 Технические
требования
5.1 Основные
параметры и характеристики
5.1.1 Матрицы должны соответствовать требованиям настоящих технических
условий.
.1.1 По внешнему виду, плотности упаковки микросфер на субстрате,
биологической совместимости, выраженной во времени жизни клеток на матрице и
пролиферативной активности клеток на матрице, выраженной в процентах площади,
занимаемой клетками на подложке по прошествии 24 часов, матрица должна
соответствовать требованиям и нормам, указанным в табл.1.
Таблица
2.
|
Наименование показателя
|
Норма для марки
|
Метод испытания
|
|
S
|
B
|
P
|
|
|
1. Внешний вид матрицы
|
Матрица должна быть
нанесенной на стекло непрозрачной, белой, без посторонних включений,
поверхностных загрязнений и видимых механических повреждений.
|
|
2. Внешний вид под
микроскопом
|
Матрица должна состоять из
преимущественно гексагонально упакованных круглых сфер.
|
По п. 7.2
|
|
3. Плотность упаковки не
менее, %
|
60
|
75
|
По п. 7.3
|
|
4. Время жизни клеток не
менее, дни
|
24
|
16
|
По п. 7.4
|
|
5. Площадь, занимаемая
клетками после 24 часов пребывания на матрице не менее, %
|
70
|
90
|
По п.7.5
|
5.2 Требования
к сырью и материалам.
5.2.1 Материалы, применяемые для изготовления матриц, определяют в
технической документации на матрицы конкретных типов.
.2.2 Для изготовления матриц применяют:
суспензия полистирольного латекса с узким распределением по диаметру
сфер: 6±0,3 мкм или 20±1 мкм;
суспензия полигликолевой кислоты с узким распределением по диаметру сфер:
6±0,5 мкм или 20±1,2 мкм;
суспензия сопополимера молочной и гликолевой кислот с узким
распределением по диаметру сфер: 6±0,5 мкм или 20±1,2 мкм;
суспензия поли-L-молочной кислоты с узким распределением по диаметру
сфер:
6±0,5 мкм или 20±1,2 мкм.
Озвученные ультразвуком перед производством.
.2.3 В качестве субстрата используются стекла покровные по ГОСТ
6672-75, предварительно очищенные в серной кислоте по ГОСТ 14262-78 и затем
отмытые дистиллированной водой по ГОСТ 6709-72.
.2.4 В качестве поверхностно-активных веществ могут использоваться
растворы додецилсульфата натрия и гексадиметиламмонийбромида в концентрациях не
превышающих их критических концентраций мицеллообразования то есть не более
2*10-3 моль/л и 2*10-2 моль/л соответственно.
.2.5 Материалы, применяемые для изготовления матриц должны быть
допущены и разрешены для трансплантации и контакта с тканями человека
национальными органами здравоохранения и не должны вызывать ухудшения
физического состояния человека.
5.3 Упаковка
5.3.1 Матрицы должны быть упакованы в пластиковые контейнеры пыле- и
влагозащитные.
.3.2 Упаковка должна обеспечивать сохранность и качество матриц.
5.4 Маркировка
5.4.1 На каждую упаковочную единицу (контейнер, ящик и т.д.) наносят
маркировку, содержащую:
товарный знак и наименование предприятия-изготовителя;
наименование и обозначение матриц;
количество матриц в штуках;
дату изготовления;
отметку ОТК или информацию, подтверждающую качество продукции.
Транспортная маркировка - по ГОСТ 14192-96.
6 Требования
безопасности.
6.1 При изготовлении матриц должны соблюдаться требования безопасности
по ГОСТ 12.1.001-89, ГОСТ 12.1.005-88, ГОСТ 12.4.021-75. Параметры микроклимата
4 производственных помещений должны соответствовать национальным нормам.
.2 Утилизацию отходов при производстве матриц осуществляют в
соответствии с требованиями национальных санитарных правил, порядком
накопления, транспортирования, обезвреживания и захоронения промышленных
отходов.
.3 Сырье, материалы и готовые изделия должны соответствовать
требованиям национальных норм по предельно-допустимым количествам химических
веществ, выделяющихся из материалов, контактирующих с тканями человека.
7 Правила
приемки.
7.1 Матрицы принимают партиями. Партией считают количество матриц
одного типа и назначения, оформленное одним документом о качестве, содержащим:
товарный знак и наименование предприятия-изготовителя;
местонахождение (юридический адрес предприятия-изготовителя);
количество матриц в партии;
тип матриц;
дату изготовления (месяц, год);
обозначение настоящих технических условий;
отметку ОТК или информацию, подтверждающую качество продукции.
Знак соответствия для сертифицированных матриц проставляют в документах о
качестве, на упаковке и в товаросопроводительной документации изготовителем и
потребителем.
.2 Контроль матриц проводят по двухступенчатому нормальному плану
контроля по группам показателей, указанных в таблице 2.
Таблица
3
|
Группа показателей
|
Номер пункта
(контролируемый показатель)
|
|
1
|
4.1.2 (1); 4.1.2 (2)
|
|
2
|
4.1.2 (3); 4.1.2 (4); 4.1.2
(5)
|
.3 Для контроля качества матриц из разных контейнеров партии в
зависимости от ее объема отбирают выборки в соответствии с таблицей 3.
Таблица
4 в штуках
|
Объем партии
|
Выборка
|
Объем выборки
|
|
От 30 до 50 включ.
|
1
|
8
|
|
От 51 до 100 включ.
|
2
|
16
|
|
От 100 до 300 включ.
|
3
|
30
|
.4 По показателям группы 1 контролируют всю выборку в соответствии с
таблицей 4.
|
Выборка
|
Объем выборки
|
Группа 1
|
|
|
Приемочное число
|
Браковочное число
|
|
1
|
8
|
1
|
2
|
|
2
|
16
|
1
|
4
|
|
3
|
30
|
2
|
6
|
.5 По показателям группы 2 контролируют образцы, взятые из выборки
по 6.4, в соответствии с таблицей 5.
Таблица
6 в штуках
|
Выборка
|
Объем выборки
|
Группа 1
|
|
|
Приемочное число
|
Браковочное число
|
|
1
|
4
|
0
|
2
|
|
2
|
8
|
1
|
3
|
|
3
|
15
|
2
|
5
|
6.6
Решение о партии
6.6.1 Партию принимают, если количество дефектных матриц в выборке по
каждому показателю меньше или равно приемочному числу, указанному в таблицах 4
и 5.
.6.2 Если в выборке количество матриц, не соответствующих требованиям
настоящих технических условий, больше или равно браковочному числу, то проводят
повторный контроль на удвоенном количестве матриц, взятых от той же партии.
Результаты контроля второй выборки являются окончательными и
распространяются на всю партию.
8 Методы
контроля
8.1 Внешний вид матриц контролируют визуально, согласно образцу
эталону на каждый тип матриц, утвержденному в установленном порядке.
.2 Внешний вид матриц под микроскопом так же оценивают визуально,
согласно теоретическому изображению - эталону, гексагональной упаковки
микросфер (Приложение А). Используют световой микроскоп с тринокулярной
насадкой и объективом х10 МПБ 3М или другое аналогичное устройство.
.2.1 Просматривают последовательно всю поверхность матрицы.
.3 Плотность упаковки оценивают используя световой микроскоп с
тринокулярной насадкой и объективом х10 МПБ 3М или другое аналогичное
устройство, укомплектованное так же камерой Moticam 1000 или другой аналогичной с разрешением не ниже 1,3
млн. пикселей.
.3.1 Покровное стекло с матрицей помещают под объектив микроскопа,
добиваются того, чтобы изображение сфер было не в фокусе (сферы темные или
имеют цвет, отличный (темнее) цвета фона).
.3.2 С помощью компьютерной программы МекосЦ или другой аналогичной
программы захвата изображения делают 10 фотографий в произвольных областях
матрицы.
.3.3 С помощью компьютерной программы ImageJ Launcher или другой аналогичной рассчитывают
площадь поверхности, занятую микросферами на каждом из 10 изображений одного
образца. За результат испытаний принимают среднеарифметическое значение 10
измерений.
.4 Биологическую совместимость клеток и матрицы определяют, оценивая
время жизни макрофагов J774
на поверхности матрицы.
.4.1 Макрофаги J774
выращивают на среде DMEM с 10% сывороткой эмбрионов коров (СЭК) в атмосфере 5%
СО2 при температуре 37оС.
.4.2 После чего макрофаги рассеивают в 24-х луночные плашки, на дне ячеек
которых располагают требуемое для анализа данной партии образцы матриц. Клетки
культивируют в инкубаторе в атмосфере 5% СО2 при температуре 37оС
в течении 24 дней.
.4.3 Количество рассеянных клеток на одну лунку рассчитывается с помощью
камеры Горяева (приложение Б). В каждую лунку с покровным стеклом рассеивают по
100000 клеток.
.4.4 По истечению 24 дней матрицы с клетками изымают из инкубатора.
.4.5 Стёкла дважды промывают буферным раствором от не прикрепившихся
клеток, который содержит 88 г/л NaCl,
30,26 г/л Na2HPO4·2H2O и 2,35 г/л NaH2PO4·H2O. Перед использованием раствор
разбавляют в 10 раз и доводят до рабочего pH=7,4.
.4.6 Затем матрицы помещают в раствор фиксатора (2%-ый раствор
глутарового альдегида в буферном растворе PBS (фосфатного буфера)). Матрицы хранят в этом растворе
в течение суток при температуре 4ºС для окраски клеток перед
микроскопией.
.4.7 Микроскопию матриц проводят используя конфокальный микроскоп Nikon Eclipse E800 (объектив х10) или другое аналогичное устройство.
.4.8 Покровное стекло с матрицей помещают под объектив микроскопа.
.4.9 С помощью компьютерной программы МекосЦ или другой аналогичной
программы захвата изображения делают 10 фотографий в произвольных областях
матрицы.
.4.10 С помощью компьютерной программы ImageJ Launcher или другой аналогичной рассчитывают
площадь поверхности, занятую клетками на каждом из 10 изображений одного
образца. За результат испытаний принимают среднеарифметическое значение 10
измерений. Если она составляет не менее 20% от площади матрицы, то матрица
считается биологически совместимой с клетками.
.5 Пролиферативную активность клеток на матрицах определяют, оценивая
площадь, занимаемую макрофагами J774
на поверхности матрицы.
.5.1 Макрофаги J774
выращивают на среде DMEM с 10% сывороткой эмбрионов коров (СЭК) в атмосфере 5%
СО2 при температуре 37оС.
.5.2 После чего макрофаги рассеивают в 24-х луночные плашки, на дне ячеек
которых располагают требуемое для анализа данной партии образцы матриц. Клетки
культивируют в инкубаторе в атмосфере 5% СО2 при температуре 37оС
в течении 24 часов.
.5.3 Количество рассеянных клеток на одну лунку рассчитывается с помощью
камеры Горяева (приложение Б). В каждую лунку с покровным стеклом рассеивают по
100000 клеток.
.5.4 По истечению 24 дней матрицы с клетками изымают из инкубатора.
.5.5 Стёкла дважды промывают буферным раствором от не прикрепившихся
клеток, который содержит 88 г/л NaCl,
30,26 г/л Na2HPO4·2H2O и 2,35 г/л NaH2PO4·H2O. Перед использованием раствор
разбавляют в 10 раз и доводят до рабочего pH=7,4.
.5.6 Затем матрицы помещают в раствор фиксатора (2%-ый раствор глутарового
альдегида в буферном растворе PBS
(фосфатного буфера)). Матрицы хранят в этом растворе в течение суток при
температуре 4ºС для окраски клеток перед
микроскопией.
.5.7 Микроскопию матриц проводят используя конфокальный микроскоп Nikon Eclipse E800 (объектив х10) или другое аналогичное устройство.
.5.8 Покровное стекло с матрицей помещают под объектив микроскопа.
.5.9 С помощью компьютерной программы МекосЦ или другой аналогичной
программы захвата изображения делают 10 фотографий в произвольных областях
матрицы.
.5.10 С помощью компьютерной программы ImageJ Launcher или другой аналогичной рассчитывают
площадь поверхности, занятую клетками на каждом из 10 изображений одного
образца. За результат испытаний принимают среднеарифметическое значение 10
измерений.
9
Транспортировка и хранение
9.1 Матрицы транспортируются всеми видами транспорта в соответствии с
правилами перевозки грузов, действующими на каждом виде транспорта.
.2 Матрицы хранят в отапливаемом помещении с температурой 24ºС и относительной влажностью не более
60% в пыле - влагозащитных пластиковых контейнерах, на расстоянии не менее 2
метров от нагревательных приборов, защищенной от прямого воздействия солнечных
лучей, при отсутствии в помещении кислотной, щелочной и других агрессивных
сред.
.2 Гарантийный срок хранения устанавливается 3 год со дня изготовления.
Выводы
1. Изучена законодательная нормативная и научно-техническая
литература по монослойным матрицам для тканевой инженерии.
. Сформулированы и обоснованы технические параметры качества для
полимерных матриц.
. Выбраны и описаны методы контроля предлагаемых параметров
качества полимерных матриц.
. Разработан проект технических условий на монослойные полимерные
матрицы для тканевой инженерии.
. Проект технических условий представлен на рассмотрение и
утверждение в организацию-производитель матриц (НИИФХМ).
Список литературы
1. Kelvin
G.M. Brockbank, Inc., Tissue Engineering Constructs
and Commercialization 2005.
2. Tissue
engineering from MedBioTech.info (<#"662023.files/image013.gif">
Рис. А.1 - теоретическая схема гексагональной упаковки атмосфер.
Приложение Б
Камера
Горяева
Камера Горяева - прибор для подсчета клеток по типу счетной камеры
Бюркера и снабженный сеткой Горяева.
Счетная камера представляет собой толстую стеклянную пластину (предметное
стекло) с углублением в центре, равным 0,1 мм (рис. Б.1). На дне камеры
нанесены 2 сетки Горяева, разграниченные поперечной канавкой. Сбоку от сеток
расположены стеклянные прямоугольные пластины, к которым притирается шлифованное
покровное стекло.
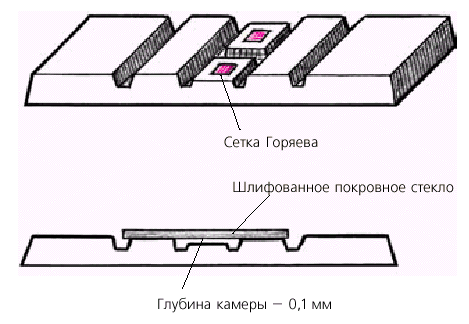
Рис. Б.1 Схематическое изображение камеры Горяева
Каждая сетка Горяева (рис. Б.2) состоит из 225 больших квадратов, 25 из
которых разделены еще на 16 малых квадратов каждый. Сторона большого квадрата
равна 0,2 мм, сторона малого квадрата - в 4 раза меньше (0,05 мм).
Соответственно, площадь большого квадрата составляет 0,04 мм2 (4x10-2 мм2),
малого квадрата - 0,0025 мм2 (25x10-4 мм2).

Рис. Б.2 Сетка Горяева для подсчета клеток.
После заполнения камеры ее оставляют на 1-2 минуты в горизонтальном
положении для оседания клеток.
Подсчет клеток проводят при малом увеличении микроскопа (объектив 10x), в
несколько затемненном поле зрения (при прикрытой диафрагме и опущенном
конденсоре).
Клетки подсчитывают в 5 расположенных по диагонали сетки квадратах,
разделенных на малые, т. е. в 80 малых квадратах. Для этого под микроскопом
находят верхний левый квадрат сетки (разделенный на 16 малых) и подсчитывают
число клеток в нем. При этом целесообразно придерживаться определенной
последовательности подсчета клеток: передвигаться из одного малого квадрата в
другой по горизонтали, например, один ряд справа налево, другой ряд слева
направо и т. д. (рис. Б.3).
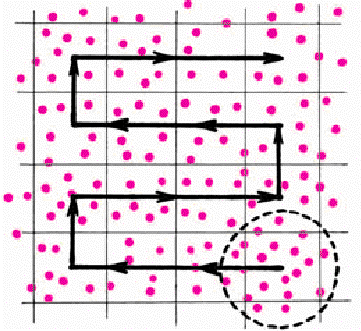
Рис Б.3 Последовательность подсчета клеток в больших квадратах.
В каждом малом квадрате подсчитывают клетки, находящиеся внутри него, а
также расположенные, например, на левой и верхней границе квадрата, пропуская
эритроциты, лежащие на нижней и правой границе (рис. Б.4). Это позволяет
добиться того, чтобы клетки, расположенные на границе квадратов, не попали в
счет дважды.
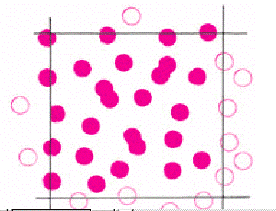
Рис Б.4 Учет клеток в малом квадрате.
Количество клеток в 1 мкл (1 мм3) культуры рассчитывают по
следующей формуле:
X = a/b*80
где Х - число клеток в 1 мкл культуры, а - число сосчитанных клеток, b -
объем малого квадрата (2,5x10-4 мкл), 80 - число малых квадратов, в
которых производился счет. Введя в эту формулу значение объема одного малого
квадрата сетки Горяева, получим упрощенную формулу:
Количество клеток в 1 мкл (Х) равно числу клеток, подсчитанных в 80 малых
квадратах, умноженному на 200.апример, в 5 больших квадратах (80 малых)
сосчитано 456 клеток. Тогда количество клеток в 1 мкл составит 91200, или
примерно 9,1x104/мкл.