Современное состояние и перспективы применения рецепторных методов для определения лекарственных веществ и их метаболитов
Министерство
здравоохранения Республики Беларусь
Витебский
государственный медицинский университет
Курсовая
работа
По
фармацевтической химии
Тема:
Современное состояние и перспективы применения рецепторных методов для
определения лекарственных веществ и их метаболитов
Введение
К концу 50-х - началу 60-х гг. XX в. было
обращено внимание на зависимость фармакологической активности от таких
физических факторов, как степень измельчения и явление полиморфизма, а также от
технологических процессов получения ЛС. Возникло своеобразное противоречие
между существовавшими нормами оценки качества и фактическим действием ЛС.
Последние по результатам аналитического контроля соответствовали в одинаковой
степени требованиям фармакопеи (ФС), но различались по фармакологическому
эффекту. Так возникло понятие о терапевтической неэквивалентности ЛС. Оно
означает, что одни и те же ЛФ, содержащие одинаковые количества ЛС, но
изготовленные разными способами, оказывают неодинаковый терапевтический эффект.
Установить причину такого явления можно только проведением биофармацевтических
и фармакокинетических исследований.
Сформулированные к настоящему времени основные
принципы установления количественных соотношений между химической структурой и
фармакологической активностью можно представить в виде трех основных стадий.
Первая (биофармацевтическая) включает исследование исходного биологически
активного вещества и создание на его основе готовой лекарственной формы. Вторая
стадия (фармакокинетическая) включает исследование таких происходящих в
организме кинетических процессов, как всасывание, распределение, связывание с
белками, биотрансформация и выведение (экскреция) ЛС. Эти процессы изучаются в
сопоставлении с фармакологическим или токсическим действием этих веществ на организм.
Третья стадия (фармакодинамическая) включает исследование взаимодействия ЛС с
рецептором и влияние на регуляторные системы. Следовательно, биологическая
активность ЛС объясняется последовательно происходящими тремя фазами:
биофармацевтической, фармакокинетической и фармакодинамической.
Проведение фармакокинетических испытаний
осуществляется на стыке нескольких наук и требует участия различных
специалистов: врача-клинициста, врача-лаборанта, биохимика,
провизора-аналитика, микробиолога, а в ряде более сложных случаев также
биофизика, математика, программиста.
Исследования в области фармакокинетики
проводятся на животных в период доклинических испытаний, во время клинических
испытаний, при разработке технологии производства и контроля качества ЛФ, а
также продолжаются после внедрения ЛС в медицинскую практику.
Проведение фармакокинетических исследований
возможно только на основе применения современных методов биофармацевтического
анализа, позволяющих проследить процесс всасывания и распределения ЛС в органах
и тканях.
Они включают выяснение влияния различных
биофармацевтических факторов на терапевтическую эффективность ЛС; изучение их
биологической доступности и разработку методов ее определения; создание
способов определения ЛС и их метаболитов в биологических жидкостях [6].
Эти данные дают возможность ориентироваться в
понимании механизма действия, прогнозирования химической структуры ЛС,
обусловливающей направленное действие.
Иначе говоря, результаты фармакокинетических
исследований существенно дополняют данные о связи между химической структурой и
фармакологической активностью ЛС.
Биофармацевтические и фармакокинетические
исследования позволяют решить ряд практических задач, например, дать
рекомендации по изменению физических или химических свойств ЛС для повышения их
фармакологической активности; обосновать оптимальный выбор биофармацевтических
факторов при производстве тех или иных ЛФ.
Практическое значение имеют и такие
рекомендации, как уточнение показаний и противопоказаний, установление
рациональных терапевтических доз и периодичности их приема в течение суток,
определение оптимальных путей введения ЛС в организм, разработка научно
обоснованных схем лечения тех или иных заболеваний.
Определение
Рецепторное взаимодействие используется в
методике, в которой меченый компонент, лиганд, который связывается с
рецептором, используется, чтобы обнаружить этот рецептор. Обычно лиганды
помечают радиоактивными изотопами, такими как 3H, 125I, 35S и т.д., но мечение
флуоресцирующими фрагментами также возможно. Рецептор может быть расположен в
гомогенизированной или нативной ткани или может быть воспроизведен с помощью
рецепторного гена. Препараты ткани инкубируют с меченым лигандом, который имеет
высокий аффинитет к целевому рецептору. Меченый лиганд, связавшийся с тканью,
затем собирают и определяют, используя различные методики, такие как
фильтрующие методики в сочетании с подсчетом радиоактивности, сцинтилляционным
подсчетом и ауторадиографией для радиоактивных лигандов, или время-зависимый
флуоресцентный резонансный энергетический перенос (TR-FRET) или усиленный
флуориметрический гомогенный анализ (AlphaScreen) для лигандов, меченых
флуоресцирующими или хемилюминесцирующими молекулами. Эти методики применяются
in vitro или ex vivo. In vivo рецепторное связывание может быть исследовано с
использованием позитронной эмиссионной томографии или монофотонной эмиссионной
компьютерной томографии (SPECT).
Впервые рецептор-связывающие методики анализа
были предложены в 1970х (исторический взгляд: Lefkowitz 2004; Snyder and
Pasternak 2003). В более ранние года не было никакой информации о природе или
структуре рецепторов. Обширные исследования на протяжении 1980х, ведущие к
синтезу рецпепторных генов и идентификации их структуры. На сегодняшний день,
открыты и исследованы три больших класса рецепторов, локализованные на
клеточной мембране и один класс цитозольных рецепторов.
. G-белок-ассоциированные рецепторы (GPCRs),
также называемые 7-трансмембранные рецепторы, интегральные мембранные
белки-мономеры. Выделено и изучено 802 человеческих G-белка, это самая большая
группа рецепторов и по меньшей мере 50 из них являются мишенями действия
лекарственных средств.
. Мультимерные лиганд-ассоциированные ионные
каналы, чаще всего представляющие собой пентамеры, образующие поры в мембране.
Пример рецепторов этой группы - N-холинорецепторы, GABAA , 5-HT3, глициновые
рецепторы, NMDA и др.
. Рецепторы, являющиеся ферментами с
лиганд-связанным доменом, которые работают в связи с ферментом на внутренней
стороне мембраны, такие как гуанилатциклаза, тирозинкиназа, тирозинфосфатаза,
серин/треонинкиназа. Рецепторами этого семейства являются также клеточный
фактор роста, трансформирующий фактор роста, нейротропный рецепторный фактор.
. Цитозольные рецепторы, регулирующие
транскрипцию в клеточном ядре. Члены этого семейства - стероидные, ретиноидные
и тиреоидные рецепторы.
Большое число членов каждого из этих рецепторных
семейств изучались как нейромедиаторы с помощью анализа рецепторного связывания
и рецепторных методов, описаны сотни различных молекулярных мишеней для них
[4].
Принцип метода
Рецепторный метод анализа основан на
конкурентном ингибировании анализируемым соединением связывания меченого
лиганда со специфическими к нему мембранными рецепторами. Следствием применения
мембранных препаратов рецепторов являются: 1) высокая чувствительность
рецепторного метода, связанная с высоким сродством рецепторов к своим лигандам;
2) высокая его специфичность, обусловленная самой природой рецепторов; 3)
доступность мембранных препаратов, содержащих рецепторы: исходным материалом
для мембран обычно служит мозг животных; 4) относительная простота разделения
свободного и связанного с мембранами меченого лиганда: являясь достаточно
крупными частицами мембраны со связанной с ними меткой, легко отделяются от
меченого лиганда в растворе путем вакуумного фильтрования или
центрифугирования; 5) возможность дискриминации типа лиганда: выше было
показано, что, например, опиоидные рецепторы гетерогенны, поэтому, используя в
анализе меченые лиганды той или иной селективности, можно определить, к какому
типу лигандов следует отнести данное тестируемое соединение; 6) возможность
определения агонист-антагонистической природы лиганда; являясь частью
биохимической системы передачи сигнала, рецепторы в различных средах по-разному
взаимодействуют с агонистами и антагонистами: например, для агонистов опиоидных
рецепторов известен так называемый натриевый сдвиг - сильное, более чем на
порядок, ухудшение IC50 при добавлении солей натрия, в то время как на сродство
антагонистов натриевая среда не влияет: влияние ионов натрия на связывании
агонист-антагонистов существенно менее выражено [4].
Аналитические принципы
Анализ рецепторного связывания производится в
соответствии с аналитическими принципами и методами. Используется дважды
дистиллированная вода, химические реагенты качества ч.д.а. Меченые лиганды
должны иметь чистоту не менее 98%, чистота должна регулярно контролироваться
(например, радиолиганды подвергаются радиоактивному распаду). Стабильность
соединений должна проверятся по мере необходимости (например, катехоламины и
индоламины крайне нестабильны и раствор их приготавливается непосредственно
перед применением). Аналитические весы, пипетки также должны быть
откалиброваны. Соединения должны быть растворены в жидкостях, соответственно их
физико-химическим свойствам. Следует избегать применения пластиковых пробирок и
деталей в автоматических аналитических устройствах, чтобы избежать адсорбции и
потерь липофильных компонентов.
Лиганд-рецепторное взаимодействие происходит согласно
закону действующих масс. Требуется также тщательно контролировать температуру
процесса.
При проведении рецепторного анализа искомой
может быть изотерма концентрации меченого лиганда, кинетика связывания лиганда
с рецептором, конкурентное связывание - в зависимости от этого выделяют и
различные типы анализа [4].
Методы рецепторного анализа in vitro
с использованием тканей, клеточных гомогенизатов или мембранных препаратов
Ткани и препараты
Ткани, используемые для рецепторного анализа,
например, ткани отделов мозга или органов, культивированные клетки (клеточные
линии или первичные культуры) или кровяные клетки, которые несут исследуемый
рецептор, нативный или привитый искусственно, получают от специфических видов
(чаще всего человеческие). Также при подходящих условиях рецепторное связывание
может быть представлено на интактных клетках, гомогенизатах тканей или
мембранных препаратах. Используемые мембранные препараты являются полностью
отделенной фракцией, получаемой с помощью ультрацентрифугирования или
мембранным препаратом, полученным из отделенных клеточных структур (тяжелые и
легкие митохондриальные фракции, фракция плазматической мембраны), с
последующей осторожной гомогенизацией ткани в 0,25М сахарозе. Мембранные
препараты отмываются ресуспендированием в объем и повторным центрифугированием.
Все стадии получения препаратов должны проходить при температуре 0-4 оС,
хранение препаратов - ниже -20оС [4].
Инкубация в пробирках и ячейковых планшетах
Инкубация проводят в пробирках объемом 0,5 -2мл
или 96-ячейковых планшетах (0,1-0,2 мл). Инкубируемая смесь состоит из образцов
клеток или мембранных препаратов, взвешенных в буферном растворе, аликвоты
меченого лиганда, прибавленного в расчете на конечную желаемую концентрацию и,
в зависимости от типа эксперимента, аликвоты конкурентного агониста. Буфер
должне иметь определенную величину рН (около 7,4) и содержать необходимые
добавки, например, ионы металлов. В зависимости от типа эксперимента, инкубация
происходит при заданной температуре в течение заданного периода. Для
исследований конкурентного связывания, время инкубации должно быть достаточным
для установления равновесия.
Методы фильтрации
Меченый лиганд, проникший в тканевой препарат и
свободный меченый лиганд разделяют фильтрацией на стеклянном фильтре (иногда
обработанном полиэтиленимином для предотвращения адсорбции) при разрежении,
далее быстро разбавляют фильтрат охлажденным буферным раствором.
Радиоактивность связавшегося меченого лиганда рассчитывается с использованием
фильтра; для анализа β-излучающих
изотопов, например изотоп трития, фильтр высушивается, добавляется
сцинтилляционная жидкость и подсчитывается радиоактивность. Для анализа γ-излучающих
изотопов, например 125I, радиоактивность определяется непосредственно [4].
Анализ близкой
сцинтилляции
(Scintillation Proximity Assay, SPA)
SPA - гомогенный анализ, позволяющий избежать
стадии фильтрования. Для SPA используются как поливинилтолуольные пузырьки,
наполненные сцинтиллянтом, так и "Flashplates" или
"Scintiplates", 96-ячейковые планшеты со сцинтиллянтом, защищенные
инертным покрытием. Пузырьки или планшеты покрывают мембранным препаратом.
Покрытые пузырьки помещают в ячейки планшета и инкубируют с меченым лигандом
без или с конкурентным агонистом в необходимой концентрации в буфере. Так как
ткань не находится «в свободном растворе», требуется несколько часов инкубации,
чтобы достичь равновесия. После инкубации, многоячейковые планшеты помещаются
прямо в Topcount NXT. Сцинтиллянт будет обнаруживать только ту радиоактивность,
которая происходит в непосредственной близости от него, таким образом, меченый
лиганд, связавшийся с тканью, покроет стенки пузырька или ячейки. Формат
технологии mix-and-read пригоден для высокоэффективного скрининга, но следует
иметь ввиду увеличенную длительность термостатирования.
Нерадиоактивный близкий анализ (Nonradioactive
Proximity Assays)
Загрязнение окружающей среды и высокая стоимость
обезвреживания радиоактивных отходов обусловили развитие методик
нерадиоактивного анализа рецепторного связывания. TR-FRET, известная как
флуоресцентный анализ, и АlphaScreen, основанный на хемилюминесценции, являются
примерами широко применяемых методик в анализе конкурентного рецепторного
связывания. Методики основываются на возбуждении «донорной» пробы (связанной с
лигандом), которая является механизмом переноса энергии акцепторной пробе
(связанной с рецепторным препаратом), если они находятся в непосредственной
близости. Акцепторная проба начинает излучать свет определенной длины волны,
которую обнаруживают и подсчитывают. Применение этой методики ограничено, так
как она требует создания лигандов, меченных относительно большими молекулами, в
результате изменяется нативная структура лиганда. Способность связываться с
рецептором у таких лигандов уменьшается. Развитие таких лигандов - дело проб и
ошибок [4].
Ауторадиография меченых лигандов
Ауторадиография - общая технология, позволяющая
визуализировать распределение радиоактивного лиганда, связанного с молекулярной
целью в срезе ткани. Радиоактивный лиганд может быть введен животному, которое
в последующем умертвляют, вскрывают и делают срезы тканей. С другой стороны,
срезы тканей могут быть инкубированы с радиоактивными лигандами in vitro. Ткань
(чаще всего мозг) рассекают (срез толщиной 20 мкм), обычно замораживают в
криостате, помещают на предметное стекло. Инкубация происходит путем нанесения
на срез ткани капли инкубируемого материала, содержащего радиоактивный лиганд.
После инкубации, срез ткани быстро промывают и высушивают. Существуют различные
техники визуализации радиоактивного лиганда. Требуется долгое время выдержки
(от недели до нескольких месяцев), чтобы получить изображение после длительного
выдерживания среза в фотографической эмульсии. Более короткое время (от
нескольких дней до 1 недели) нужно для получения изображения с помощью фосфора.
Самый быстрый метод - использование β-отображателя,
который способен воспроизводить изображение поглощенной радиоактивности,
требующий 1 суток и позволяющий получить до 15 предметных стекол, подсчет на
которых может производиться одновременно. Изображение анализируется и
производится количественное определение путем подсчета числа β-частиц,
испускаемых с определенной области мозга с использованием β-регистрирующих
программ Biospace Lab, Paris, France) [4].
В соответствии с нейроанатомическими картами,
ауторадиографические техники могут быть использованы для измерения занятости
рецепторов немеченными лекарственными средствами. Вещества, в различных дозах,
регулярно вводятся лабораторным животным, которые затем умерщвляются, их ткани
рассекаются и быстро инкубируются с радиоактивным лигандом на рецептор-мишень.
Отличие выявления меток в определенной области аналогичных органов животных,
которым вводилось лекарственное средство, и которым не вводилось, является
мерой занятости рецепторов лекарственным средством, для которого эти рецепторы
являются мишенью. Эта ex vivo инкубационная методика применима только для
лекарственных средств с достаточно низкой константой диссоциации комплекса
«лиганд-рецептор». Либо, радиоактивный лиганд может быть введен животному,
которому систематически вводили лекарственное средство, таким образом
конкуренция лиганда и лекарственного средства за рецептор будет протекать in
vivo. Впоследствии, животное умерщвляют, ткани рассекают, делают срезы, которые
обрабатывают вышеописанным методом. С открытием высокочувствивтельного β-отображателя
в 1990х, получение изображения требует несколько часов, а определение занятости
рецепторов лекарственным средством стало ценной скрининговой методикой [4].
Флуоресцентный рецепторный анализ
До сих пор среди методов рецепторного анализа
радиорецепторный анализ был краеугольным камнем всех методик. Однако в
последнее время на первые позиции выходит флуоресцентный рецепторный анализ,
так как он более безопасен, дешев и прост, а также показывает не менее высокую
чувствительность.
На рисунке 1 изображены различные методы
рецепторного анализа. (а) радиоактивный рецепторный анализ в гетерогенном
формате, со стадиями отмывки комплекса от несвязавшихся лигандов. Аналитический
шум обусловлен неспецифически связавшимися лигандами. (b) флуоресцентный
рецепторный анализ, представленный подобно радиоактивному анализу.
Аналитический шум возникает из-за аутофлуоресцирующих компонентов и
неспецифически связавшихся лигандов. (с) поляризационный рецепторный анализ,
представленный в однородном формате: несвязанные лиганды не удаляются, однако
только связавшиеся меченные лиганды излучают поляризованную флуоресценцию; (d)
однородный FRET-анализ, в котором только специфично связанные флуоресцентные
лиганды принимают участие в FRET, следовательно, возрастает отношение сигнала к
шуму[2].
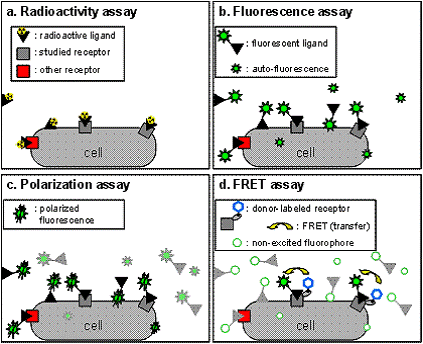
Рисунок 1
гомогенизата сцинтилляция инкубация
рецепторный
Прямое измерение интенсивности флуоресценции
связанных лигандов
Этот подход, возможно, самый простой и состоит в
измерении интенсивности флуоресценции связанной фракции лигандов после
отделения свободной фракции. Чувствительность этого метода может быть
поставлена под сомнение ввиду аутофлуоресценции многих биологических молекул.
Флуоресцентный поляризационный анализ
Этот метод анализа может быть использован для
измерения более избирательно количества связавшихся флуоресцентных лигандов.
Такие методики основаны на возбуждении биологических молекул поляризованным
светом. Вынужденные флуорофоры будут излучать сильно поляризованную
флуоресценцию. С другой стороны, свободные флуорофоры, которые могут легко
вращаться в течение короткого периода между их возбуждением и излучением
флуоресценции, будут противостоять этой поляризации. Таким образом, когда
молекула возбуждается поляризованным светом, флуоресцентный лиганд свободно
диффундирует с определенной молекулярной подвижностью и излучает
неполяризованную флуоресценцию, тогда как у связанного лиганда подобной
подвижности нет, и поляризованная флуоресценция будет регистрироваться и
приведет к картине высокой флуоресцентной анизотропии.
В этом методе уже не требуется отмывать комплекс
от несвязанных лигандов. Однако, сродство флуоресцентных лигандов к рецепторам
должно быть достаточно высоким для того, чтобы отношение связанный
лиганд-свободный лиганд позволяло достичь приемлемой величины сигнала.
Однако несмотря на хорошую воспроизводимость,
все равно существует фактор неспецифического связывани ялигшандов и
аутофлуоресценции, при этом положительный сигнал мало отличается от
отрицательного, что делает методику непригодной для широкого использования
[2].анализ
Как было упомянуто выше, чувствительность
рецепторного анализа сильно зависит от неспецифического связывания, которое
будет уменьшать отношение сигнал-шум и, следовательно, величину аналитического
окна, что ведет к менее достоверному и воспроизводимому результату. Недостаток
избирательности (но не сродства) лиганда может быть вредной для связывания
лиганда с интересующим нас рецептором. Действительно, радиоактивный и
флуоресцентный или поляризационный методы не могут выделить различие между
специфическим связыванием лиганда на двух разных рецепторах.
Для решения этой проблемы создан метод,
основанный на флуоресцентной резонансной передаче энергии (fluorescence
resonance energy transfer - FRET). FRET происходит между «донором» флуорофора и
«акцептором» флуорофора, который переносится как лигандом, так и рецептором.
Существуют три параметра условий эффективности FRET: 1. Два флуорофора должны
иметь способность выделять энергию; 2. Дипольный момент флуорофоров должен быть
правильно ориентирован, FRET будет неэффективным, если диполи перпендикулярны,
и максимален, если они параллельны; 3. Флуорофоры должны быть достаточно
близко, на расстоянии примерно 10 нм.
Но самым важным параметром для FRET является
все-таки энергетическая совместимость рецептора и лиганда. Излучательный спектр
донора должен превышать спектр акцептора, и величина этого разрыва прямо влияет
на эффективность FRET. Однако поиск большого разрыва часто связан с
незначительным разделением между спектром возбуждения донора и акцептора и
между их эмиссионными спектрами [2].
Чтобы увеличить чувствительность FRET подхода,
разработан новый метод, в котором лантаниды осуществляют функцию донора
флуорофоров. Тогда как классические флуорофоры имеют длительность жизни около
нескольких наносекунд, лантаниды характеризуются намного более длительной
флуоресценцией, от нескольких сотен микросекунд до нескольких миллисекунд. Это
привело к созданию время-зависимой FRET (time resolved - TR FRET), методике, в
которой донор флуорофора возбуждается лазером или вспышкой перед измерением
излучаемого сигнала. Еще одно преимущество лантанидов - то, что они
возбуждаются светом в ближней УФ области спектра и имеют большой Стоксов сдвиг
[2].
Аппаратурное оснащение
Один из популярных современных приборов для
проведения рецепторного анализа: Многофункциональный планшетный анализатор
VICTOR серии X - продолжение известной серии надежных и простых в работе планшетных
анализаторов. VICTOR 3 TM от компании PerkinElmer. Наряду с обновленным
дизайном VICTOR X имеет ряд новых конструктивных решений для более удобного
использования: прямая оптическая система с более высокой чувствительностью и
рабочим диапазоном для всех используемых технологий, более удобный модуль
загрузки, использование 1-1536-луночных планшет SBS-формата, а также чашек
Петри, слайдов, фильтров, ПЦР и Терасаки планшет. Планшеты могут загружаться в
анализатор вручную, или со стэкеров на 20 или 40 планшет. Анализаторы VICTOR X
могут работать как самостоятельно, так и в составе многофункциональных
роботизированных комплексов [3].
МЕТОДЫ ДЕТЕКЦИИ
Флюоресценция (340-850 нм).
Измерение соотношения флюоресценции на двух
длинах волн.
Измерение флюоресценции снизу и сверху планшеты.
Поляризационная флюоресценция (400-850 нм)
Флюоресценция, отсроченная по времени (TRF).
Двухоконная TRF.
Измерение эмиссии на двух длинах волн.
Люминесценция.
Импульсная люминесценция (Flash).
Двойная (комбинированная) люминесценция.
Фотометрия в видимой области (340-1000 нм)
УФ-фотометрия (260/280 нм).
ПРИМЕНЕНИЕ
Клеточная биология и цитология.
Иммуноферментный и рецепторный анализы.
Токсикология.
Мониторинг продуктов питания.
Кинетика.
Молекулярная биология.
Количественный анализ (белки, ssDNA, dsDNA,
клетки, бактерии и др.).
Скрининг лекарственных препаратов и метаболитов.
Сенсоры
. Общая характеристика.
Рабочей частью аналитической аппаратуры для
рецепторного анализа являются биосенсоры. Химические (биологические) сенсоры -
это тип аналитических устройств, которые служат для качественного и
количественного определения химических (биологических) веществ. Обычно сенсор
состоит из следующих частей:
Распознающий элемент (он также может быть назван
рецепторным слоем) представляет собой вещество, которое способно селективно
взаимодействовать с аналитом.
Трансдьюсер (англ. Transducer - преобразователь,
датчик) преобразует химическое или биологическое взаимодействие в электрический
сигнал.
Система сбора и обработки данных служит для
усиления и анализа сигнала и отображения результатов.
Биологические сенсоры отличаются от химических
только тем, что они направлены на детектирование органических молекул, важных
для живых организмов: высокомолекулярных, таких как белки, ДНК, и
низкомолекулярных, например, глюкозы и мочевины. В данном обзоре обсуждаются
основные распознающие элементы биологических сенсоров; как и в химических
сенсорах, основное предъявляемое к ним требование - способность улавливать определенный
аналит и не реагировать на посторонние вещества, присутствующие в образце [5].
Необходимо отметить, что разработка сенсоров
является междисциплинарной задачей, которая требует участия широкого круга
специалистов: физиков, инженеров, химиков, биологов, врачей, экологов. Кроме
очевидных требований, предъявляемых к новым сенсорам, таких как простота
эксплуатации, дешевизна, высокая точность, селективность и скорость анализа,
добавляются еще требования миниатюризации (это связано с развитием нанотехнологий),
иногда возможность работать в непрерывном режиме, а иногда даже - возможность
внедрения в человеческий организм.
Используемые в биосенсорах трансдьюсеры
чрезвычайно разнообразны. Возможно, наиболее часто применяются
электрохимические преобразователи, в которых трансдьюсером является электрод,
помещенный в исследуемый раствор. Оптические биосенсоры используют явления
полного внутреннего отражения и поверхностного плазмонного резонанса.
Гравиметрические сенсоры используют изменение массы при связывании аналита, они
обычно основаны на акустических волнах или пьезокварцевых микровесах. Для
ознакомления с типами трансдьюсеров авторы рекомендуют обратиться к обзорам.
. Характеристики биосенсоров.
В данном разделе описаны параметры и
характеристики биосенсоров как аналитических приборов. Все они используются и
для описания химических сенсоров, которые чрезвычайно близки к биологическим по
принципам действия и технической реализации.
Как и любой научный прибор, каждый сенсор имеет
допустимый диапазон температур, давлений и pH. Кроме того, каждый сенсор,
который не только констатирует наличие аналита, но и измеряет его концентрацию,
очевидно, характеризуется такими параметрами, как точность и воспроизводимость.
Также важны такие параметры, как рабочий диапазон (тот диапазон концентраций, в
котором работает метод измерений) и линейный диапазон. Для их определения
требуется построить калибровочную кривую - зависимость величины сигнала от
концентрации аналита, ее линейный участок называется линейным диапазоном. В
некоторых типах сенсоров (например, в потенциометрических) величина сигнала
пропорциональна логарифму концентрации [5].
Чувствительность сенсора показывает отношение
сигнала, выраженного, например, в вольтах, к концентрации аналита, которая
вызвала этот сигнал. Более строго чувствительность определяется как
максимальное значение производной величины отклика по концентрации. Следует
отличать чувствительность от предела обнаружения (detection limit) - той
минимальной концентрации аналита (или минимального количества вещества),
которая может быть детектирована и измерена. Для современных сенсоров это
значение может быть чрезвычайно малым. Так, например, в работе обсуждаются
иммунологические сенсоры с пределом обнаружения 10-21 моль. Описана резонансная
система нанометровых размеров, способная зарегистрировать 1 аттограмм (10-18 г)
вещества, основанная на пьезорезистивном эффекте.
Важнейшей характеристикой сенсора является
селективность, она отражает способность детектировать определенный аналит и не
реагировать на посторонние вещества. Для количественного определения
селективности используются два основных метода. Первый предполагает построение
калибровочных кривых не только для аналита, но и для посторонних примесей при
одинаковых условиях эксперимента. В этом случае селективность выражается как
отношение величины сигнала, вызываемого аналитом к величине сигнала, вызываемой
примесью той же концентрации. При другом подходе в ячейку, уже содержащую
аналит, вводят примеси в тех концентрациях, которых можно ожидать в реальных
образцах, и выражают селективность как изменение сигнала в процентах. Второй
метод дает более наглядное и практически удобное значение селективности, но он
является более субъективным, т.к. зависит от диапазона концентраций, в котором
производятся измерения [5].
К временным характеристикам сенсоров относятся
следующие: время отклика, время жизни и время регенерации. Время отклика
необходимо для возникновения равновесия между анализируемым образцом и
рецепторным слоем. Хотя оно должно быть сведено к минимуму, в некоторых
методах, оно составляет порядка нескольких часов. Время жизни - это срок
воспроизводимой работы сенсора, он ограничен деградацией рецепторного слоя.
Иногда (например, в коммерческих сенсорах для определения глюкозы) используются
одноразовые распознающие элементы. Время регенерации это время, которое
требуется для восстановления работоспособности распознающего элемента. В
заключение скажем, что для непрерывного монитринга часто требуется
изготавливать сенсоры с проточными ячейками или зондами, которые вносятся в
поток анализируемого вещества. Такие сенсоры особенно важны для контроля на
производстве и мониторинга окружающей среды, их проектирование представляет
собой сложную инженерно-техническую работу.
. Распознающие элементы.
Выше было сказано, что одной из основных
характеристик биосенсоров является селективность. Обычно (хотя не всегда)
селективность определяется свойствами распознающего элемента. Ниже
рассматриваются основные типы рецепторных слоев и их особенности.
Наиболее часто распознающими элементами
биосенсоров являются ферменты - высокоспецифичные катализаторы биохимических
реакций. В состав фермента входит одна или несколько белковых молекул, иногда
присутствует небелковая часть. Каталитическая активность ферментов значительно
выше, чем у любых искусственных катализаторов, ферменты увеличивают скорость
реакции в 103-107 раз. Классический пример биосенсора, использующего
ферментативный рецепторный слой это амперометрический сенсор на глюкозу с
глюкозоксидазой (GOD). Возможно, это один из самых первых биосенсоров. В нем
глюкоза окисляется до глюконовой кислоты с образованием перекиси водорода:
Глюкоза+О2->глюконовая кислота+Н2О2.
В разных модификациях может регистрироваться
либо уменьшение концентрации кислорода, либо увеличение концентрации перекиси.
Фермент GOD является сравнительно недорогим, при правильной упаковке
одноразовый распознающий элемент может храниться около 6 месяцев.
Иногда ферменты используются непосредственно в
составе тканей организмов животных или растений. Например, в обсуждается сенсор
на дофамин (нейрогормон, биологический предшественник адреналина), использующий
ткани грибов, иммобилизованные на электроде при помощи углеродной пасты.
Преимущества использования тканей вместо очищенных ферментов состоят в
следующем: ткани существенно дешевле, содержащиеся в них ферменты находятся в
естественном окружении, поэтому они дольше и надежнее работают. Таким образом,
использование тканей в биосенсорах решает проблемы деактивации и деградации
ферментов при их иммобилизации, увеличивает стабильность ферментов. При этом
существенным недостатком, который ограничивает спектр возможных применений
тканей, очевидно, является их низкая селективность, связанная с присутствием
большого количества посторонних ферментов. Тем не менее, использование тканей в
рецепторных слоях в некоторых случаях позволяет радикально снизить
себестоимость биосенсоров [5].
К биосенсорам на основе тканей идеологически
близки технологии с использованием клеток в качестве распознающих элементов. По
мнению автора, клеточные биосенсоры наряду с ферментными занимают лидирующие
позиции по степени разработки и внедрения. Необходимо отметить, что для многих
клеток разработаны методы генной инженерии, позволяющие повысить выработку
определенного белка и таким образом повысить эффективность работы сенсора.
В обзоре рассматриваются клеточные биосенсоры,
созданные с использованием технологий генной инженерии. При проникновении
внутрь клетки аналит вызывает синтез легко детектируемого белка, например, флуоресцентного
белка GFP. В число достоинств таких биоиндикаторов входят следующие:
способность проводить анализ с пространственным разрешением порядка размера
клетки (например, для анализа химического состава почвы), возможность быстрого
обнаружения токсичных веществ, возможность измерять концентрации веществ в
естественной среде, а не в пробе.
Биосенсоры, использующие ферменты в рецепторном
слое, иногда называют каталитическими. Существуют еще и аффинные биосенсоры
(affinity biosensors), использующие антитела, нуклеиновые кислоты и рецепторы.
Отличие между ними состоит в следующем. В ферментативных сенсорах происходит
реакция по общей схеме
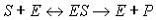
Субстрат (S) связывается с ферментом (E),
образуя комплекс ES, затем субстрат превращается в продукт (P) и
высвобождается. Эта реакция описывается кинетикой Михаеэлиса-Мэттен. В случае
аффинных биосенсоров в рецепторном слое происходит реакция вида
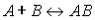
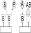
В таких реакциях не образуется новых продуктов,
происходит связывание молекул А и В в комплекс АВ. Реакции этого типа также
называют реакциями непродуктивного связывания. В общем случае это приводит к
ужесточению требований, предъявляемых к трансдьюсеру, т.к. акт связывания
сложнее зарегистрировать. К аффинным биосенсорам относятся сенсоры на ДНК, на
антигены и антитела и сенсоры с использованием рецепторов.
Детектирование молекул ДНК основано на
взаимодействии между комплементарными цепями. Природа этого взаимодействия -
водородные связи между парами нуклеотидов. В ДНК-сенсорах рецепторный слой
состоит из иммобилизованных одноцепочечных ДНК, которые улавливают из раствора
комплементарные цепи. Hекордно предел обнаружения ДНК был достигнут с
использованием метода электрохимической хемилюминесценции и составил 10 аМ
(10-18 М) [5].
Приготовление образцов ДНК для исследований
является сложным и трудоемким процессом. После очистки пробы для увеличения
количества молекул ДНК определенного типа используется процедура полимеразно-цепной
реакции (ПЦР). Развитие ДНК-биосенсоров позволит обходиться без специальных
методов выделения ДНК из образца и ПЦР, и детектировать отдельные цепи в
течение часа. В последние годы была создана технология ДНК-биочипов, которая
позволяет вести анализ большого числа генов одновременно. Развитие
ДНК-биосенсоров представляется крайне важным т.к., оно поможет в обнаружении
патогенных микроорганизмов, мутаций, диагностике наследственных заболеваний, и
во многих других областях. Необходимо отметить развитие методов анализа ДНК с
целью идентификации личности.
Антитела - это сложные белковые молекулы,
построенные из нескольких субъединиц, вырабатывающиеся в организмах позвоночных
в ответ на проникновение чужеродных агентов (антигенов), например, токсинов,
вирусов или чуждых организму макромолекул. Циркулирующие в крови антитела
связываются с антигенами, деактивируют их и выводятся из организма. Кроме того,
связанные антитела служат метками для микроорганизмов, подлежащих уничтожению.
Взаимодействие антиген - антитело считается наиболее селективным для применения
в биосенсорах. С точки зрения физики, это взаимодействие осуществляется теми же
по природе силами, что и взаимодействие фермента с субстратом:
вандерваальсовыми силами, ионными, гидрофобными и гидрофильными
взаимодействиями, водородными связями. Сложность применения антител в
биосенсорах состоит в том, что акт связывания антигена часто тяжело
зарегистрировать. Это является общим недостатком аффинных биосенсоров и требует
применения специальных методов, например, использования меток. Другая сложность
состоит в том, что аффинные взаимодействия часто имеют высокие значения
константы ассоциации, т.е. слабо обратимы, и использующие их распознающие
элементы часто являются одноразовыми или требуют специальных методов
регенерации. Например, для разрушения связи антиген-антитело иногда
используются 10-100 мМ HCl или глициновый буфер pH 1.7-2.2 [5].
Рецепторы - это мембранные белки, способные
связывать определенные лиганды и вызывать определенный физиологический отклик в
ответ на акт связывания. Рецепторы обычно используются в биосенсорах в составе
клеток, так как в очищенном виде они недостаточно стабильны. Биосенсоры на
основе рецепторов не получили широкого распространения. В работе для изучения
активности фермента одновременно использовались методы регистрации аффинного
взаимодействия и каталитической реакции. Белок бета-лактамаза, который иногда
ответственен за устойчивость бактерий к антибиотикам, был иммобилизован на
поверхности, кинетика образования монослоя контролировалась методом
поверхностного плазмонного резонанса. Далее в систему вводился субстрат -
нитроцефин, который под действием бета-лактамаз гидролизовался с образованием
окрашенного продукта. Он регистрировался спектроскопически по изменению спектра
поглощения. В аффинных биосенсорах часто используется метод меток и
конкурирующего связывания. Для анализа образца в сенсор специально вводится
некоторое количество меченого аналита. Метки могут быть различной природы,
например, флуоресцентные или радиоактивные. Связывание меченого аналита,
содержащегося в растворе в малой концентрации, очень чувствительно к
концентрации немеченого аналита, которую требуется измерить. Между мечеными и
немечеными молекулами аналита возникает конкуренция за связывание с рецепторным
слоем. После того как в системе устанавливается равновесие, требуется измерить
количество связанных и свободных меток и вычислить концентрацию аналита.
Классический пример использования радиоактивных меток - радиоиммунологический
анализ. В нем используется конкуренция между мечеными и немечеными антигенами
за связывание с антителами. Флуоресцентные метки часто используются в
биосенсорах с оптическими трансдьюсерами. В иммуноферментном анализе метками
являются ферменты, которые ковалентно пришиваются к антигенам или антителам,
они обнаруживаются при добавлении в систему субстрата.
Достоинства и недостатки использования меток в
сенсорных технологиях: прямые методы измерений, не использующие меток, часто
работают быстрее и с большей точностью, чем косвенные. Введение меток в ряде
случаев приводит к ухудшению связывания за счет возникновения стерических
ограничений или нестабильностью меток. В то же время, при отсутствии меток
требуется использовать дорогостоящее оборудование для регистрации актов связывания
[5].
Применение рецепторного анализа
Данные о рецепторном анализе скептически
воспринимаются клиницистами, исходя из той точки зрения, что подобные данные
ничего не говорят о функции. Да, рецепторный анализ посвящен исключительно
применению в фармакологии. Он демонстрирует существование рецепторов на
молекулярном уровне. Метод посвящен выделению и очистке белков и позволил
выделить первый рецепторный ген. Это позволило изучить локализацию рецепторов
на анатомическом и клеточном уровне и дикамику рецепторного взаимодействия,
включая такие аспекты, как десенситизация рецепторов, рецепторы эндо- и
экзоцитоза, транспорт рецепторов через аксоны.
В области открытия и изучения новых
лекарственных средств, рецепторный анализ стал революционным открытием. Поиск
лекарственных средств с использованием рецепторного взаимодействия начался в
середине 1970х и вскоре привел к созданию автоматизированного рецепторного
анализа, позволяющего изучить влияние тысяч соединений одновременно на многие
рецепторы с минимальным участием персонала [4].
Рецепторный анализ показал, что многие
лекарственный средства, уже длительно применяемые в клинической практике,
взаимодействуют не с одним, а со многими рецепторами, что может вызывать
определенные побочные эффекты.
Рецепторный анализ дает возможность выбрать
между конкурирующими гипотезами о селективном или многоцелевом действии
лекарственных средств.
Описан ряд клинических состояний, при которых
нарушается взаимодействие между гормоном и его специфическим рецептором. Такие
нарушения объясняют изменением числа рецепторов или их сродства к гормону, а
также спонтанным образованием антител к гормональным рецепторам. У больных с
атаксией-телеангиэктазией может отмечаться резкая инсулинорезистентность
вследствие выраженного уменьшения сродства рецепторов к инсулину. У некоторых
больных со злокачественной миастенией образуются антитела к экзогенным
рецепторам ацетилхолина, что и обусловливает развитие соответствующего
клинического синдрома. Подобно этому у больных с acanthosis nigricans
клинически выявляется инсулинорезистентность, причем результаты обследования
таких больных убедительно свидетельствуют о роли антител к инсулиновым
рецепторам в имеющейся инсулинорезистентности. Число специфических рецепторов
инсулина, приходящееся на каждую клетку, может быть снижено при ожирении,
вследствие чего у тучных больных уменьшается чувствительность к инсулину. При
уменьшении массы тела у этих больных число инсулиновых рецепторов на клетку
увеличивается и нормализуется чувствительность к инсулину. У некоторых больных
с гипертиреозом в крови присутствуют антитела к рецепторам ТТГ. В отличие от
больных со злокачественной миастенией и диабетом, у таких больных антитела к
рецепторам ТТГ могут стимулировать мембранные рецепторы в ткани щитовидной железы,
индуцируя повышенную продукцию и секрецию тироксина и трийодтиронина, что и
обусловливает гипертиреоидное состояние [7].
Принцип радиорецепторного метода по существу не
отличается от радиоиммунологического, только гормон, вместо того чтобы связываться
с антителами, связывается со специфическим гормональным рецептором
плазматической мембраны или цитозоля. Специфические рецепторы большинства
полипептидных гормонов располагаются на наружной поверхности плазматической
мембраны клеток, тогда как рецепторы биологически активных стероидов, а также
тироксина и трийодтиронина - в цитозоле и ядрах. Чувствительность
радиорецепторного анализа ниже, чем радиоиммунологического и большинства
биологических методов в системах in vitro. Для того чтобы взаимодействовать со
своим рецептором, гормон должен иметь соответствующую конформацию, т. е. быть
биологически активным. Возможна ситуация, в которой гормон теряет способность
связываться со своим рецептором, но продолжает взаимодействовать с антителами в
системе для радиоиммунологического анализа. Это расхождение отражает тот факт,
что антитела и рецепторы «узнают» разные участки молекулы гормона.
Предложен ряд радиорецепторных методов
гормонального анализа. Обычно получают ткань специфического для данного гормона
органа-мишени и с помощью стандартных методик выделяют из нее рецепторы.
Изолированные рецепторы плазматической мембраны в осадке при хранении в
условиях температуры менее -20 °С относительно стабильны. Однако
солюбилизированные рецепторы полипептидных и стероидных гормонов, выделенные из
плазматических мембран либо из цитозоля и не связанные с лигандами, оказываются
нестабильными, что проявляется снижением их способности связывать специфические
гормоны, даже если они хранились в замороженном виде, сравнительно недолго [9].
Как пример использования рецепторных методов
анализа в современной клинической фармакологии в качестве методики обнаружения
лекарственного средства можно привести исследование фармакодинамики фенотропила
[10]. Для количественного определения рецепторов в мембранных препаратах,
приготовленных из компетентных морфофункциональных образований (гиппокампа,
полосатого тела, коры больших полушарий) мозга крыс, применяли общепринятый
метод радиорецепторного анализа с использованием специфических лигандов,
меченных по тритию, в подборе которых основывались на рекомендациях IUPHAR от
2006 г. Были использованы два методических подхода в действии Фенотропила на
рецепторы нейромедиаторов: метод in vitro и метод ex vivo. В первом случае
мембраны мозга, содержащие рецепторы, инкубировали в пробирках вместе с
радиоактивно меченным лигандом определенного рецептора в присутствии различных
концентраций Фенотропила. Измерение специфически связавшегося в данных условиях
радиоактивного лиганда с мембранным рецептором давало ответ на вопрос:
оказывает ли лекарственное вещество прямое, конкурирующее действие на изучаемый
тип рецептора? Активность препарата в данном варианте опытов выражали величиной
концентрации, изменяющей специфическое связывание радиоактивного лиганда с
рецептором на 50%, - IC50 (“inhibitory concentration 50”). Во втором случае
Фенотропил вводили крысам внутрибрюшинно в дозе 100 мг/кг, один раз в день в
течение 7 сут. Группе контрольных животных вводили физиологический раствор.
Через 24 ч после последней инъекции крыс декапитировали, извлекали мозг,
готовили мембраны выделенных структур мозга, образцы которых инкубировали в
присутствии радиолиганда.
Обработанные результаты измерений были
представлены величинами Bmax и Kd, отражающими концентрацию рецепторов в
мембранах и степень структурного сродства (аффинитета) лекарственного средства
к рецептору.
соответственно. Анализ данных ex vivo позволяет
интерпретировать полученные сведения в свете возможного непрямого,
модулирующего влияния Фенотропила на рецепторный профиль, отражающий реакцию
клеток мозга на субхроническое введение препарата. Все меченые лиганды были
получены методом твердофазного катализа в ОХВАВ Института молекулярной генетики
РАН (заведующий - академик РАН Н.Ф. Мясоедов). Результаты экспериментов
обрабатывали с помощью программ Statistica 6.0 и GraphPad 4.0 Prism [10].
Также рецепторный анализ можно использовать для
определения альбумина в моче методом гетерогенного твердофазного одностадийного
конкурентного рецепторного анализа при изучении клинической фармакологии
пероральных гипогликемических средств, а также многих других [8].
С учетом того, что в Российской Федерации с 2007
года существует ГОСТ, регламентирующий использование рецепторного анализа для
обнаружения противомикробных средств в молоке и молочных продуктах, следует
отметить широкую востребованность рецепторных методов на территории СНГ.
Список использованных источников
1. Ligand
binding assays at equilibrium: validation and interpretation/ Edward C. Hulme
and Mike A. Trevethick// British journal of farmacology. - 2010. - №161. - с.
1219-1237.
2. Original
Fluorescent Ligand-Based Assays Open New Perspectives in G-Protein Coupled
Receptor Drug Screening/ Martin Cottet, Orestis Faklaris, Jurriaan M. Zwier and
others// Pharmaceuticals. - 2011. - №4. - С.
202-214.
3. Pribory
oy/ [Электронный ресурс]/ Каталог компании Pribory oy. Режим доступа: http://
<http://www.pribori.com>. Дата доступа: 25.05.2013
. Springer
reference/[Электронный ресурс]// Receptors: Binding Assays. Режим доступа:
<http://www.springerreference.com>. Дата доступа: 25.05.2013.
. Академия
биосенсоров/ [Электронный ресурс]// Академия биосенсоров: сайт ученых
физического и химического факультетов МГУ им. Ломоносова. Режим доступа:
<http://www.biosensoracademy.com>. Дата доступа: 25.05.2013
. В.Д.
Самуилов. Иммуноферментный анализ/ Биология. Соросовский образовательный
журнал. - 1999. - №12. - с. 9-15
. Доммедика/
фармакология. Современная медицина. Режим доступа:
<http://dommedika.com>. Дата доступа: 25.05.2013.
. Наумов
В.В. Сравнительная эффективность и аспекты механизма действия тауфона и
манинила у больных сахарным диабетом 2-го типа: автореф. дис. канд-та мед.
наук: 14.00.25/ Волгоградский гос. мед. ун-т. - Волгоград: 2004. - 48с.
. Радиорецепторный
анализ/ Медкурсор - актуальная медицина. Режим доступа:
<http://www.medkursor.ru>. Дата доступа: 24.05.2013.
. Фенотропил
как как рецепторный модулятор синаптической нейропередачи / Г.И. Ковалев, В.И.
Ахапкина, Д.А. Абаимов, Ю.Ю. Фирстова // Атмосфера. Нервные болезни. 2007. -
№4. - С. 22-26.