Свойства алкадиенов
Алкадиены
Введение
Диенами называют углеводороды, в молекулах
которых имеется два структурных фрагмента с двойными углерод-углеродными
связями. Различают три типа диенов: изолированные, сопряженные и
куммулированные.
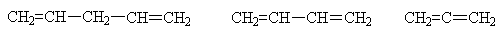
Если между кратными связями в цепи
молекулы диена находится хотя бы одна метиленовая группа (СН2), они
практически не отличаются по своим свойствам от алкенов и поэтому в данном
разделе рассматриваться не будут. Это - так называемые изолированные
диены.
Те соединения, в молекулах которых
двойные связи разделены одной ординарной связью, называются сопряженными.
Они обладают рядом специфических свойств, связанных с сопряжением p-электронных
орбиталей.
Кумулированные диены весьма
мало изучены, но их строение и свойства представляют значительный интерес.
. Сопряженные алкадиены
(1,3-алкадиены)
К наиболее известным представителям
сопряженных диенов относятся: бутадиен-1,3 (дивинил), 2-метилбутадиен-1,3
(изопрен), 2-хлорбутадиен-1,3 (хлоропрен).
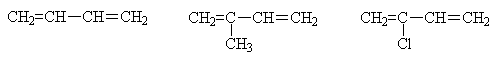
Эти соединения используются в
качестве мономеров для промышленного получения различных полимерных материалов,
главным образом каучуков. Дивинил получают ступенчатым дегидрированием бутана
на оксидном железо-хромовом катализаторе при 550-600 0С.
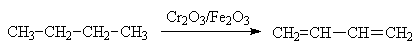
В России Лебедевым был предложен
способ получения дивинила из этанола
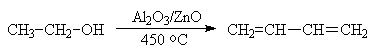
Находит применение способ немецкого
химика Реппе, согласно которому бутадиен синтезируют из
бис-гидроксиметилацетилена через 1,4-бутандиол:
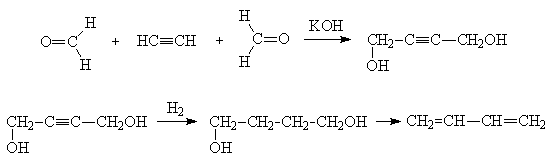
. Cтроение сопряженных диенов
Рассмотрим особенности свойств
сопряженных диенов на примере простейшего представителя - бутадиена-1,3. Согласно
результатам структурных исследований, молекула бутадиена является плоской, все
четыре атома углерода имеют гибридизацию sp2. Она может находиться в
форме двух конформаций, обозначаемых s-цис и s-транс (s от
английского "single" - одинарный). Конформации различаются взаимным
расположением винильных фрагментов относительно ординарной связи, с чем и
связано это обозначение. Барьер вращения в бутадиене составляет 25 кДж/моль,
т.е. значительно выше, чем в этане (13 кДж/моль), но лишь ненамного превосходит
разницу энергий заслоненной и заторможенной конформаций бутана (22,6 кДж/моль).
s-цис-Конформация на 25 кДж/моль менее выгодна, чем s-транс.
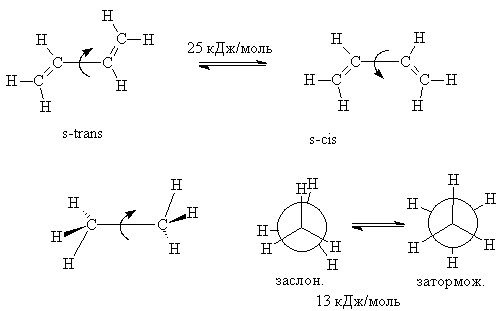
Чем же обусловлено затрудненное
вращение в молекуле бутадиена?
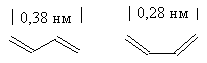
Как показывают структурные
исследования, в молекуле 1,3-бутадиена двойные связи (135 пм) несколько
длиннее, чем в этилене (134 пм), а ординарная связь С2-С3
(146 пм) короче, чем в этане (154 пм). Это заставляет предполагать, что порядок
связей в бутадиене не является целочисленным, т.е. p-электронная плотность
частично делокализована с участием четырех С-атомов. Квантово-химические
расчеты дают следующие величины порядка p-связей С1-С2
0,894, и С2-С3 -0,447.
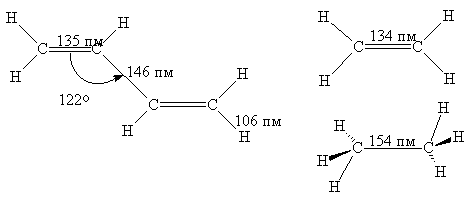
Таким образом, можно говорить о
частичной двоесвязности атомов углерода в молекуле: связь С2-С3
несколько больше чем одинарная, а связи С1-С2 и С3-С4
несколько меньше, чем двойные. Это явление, называется сопряжением p-связей.
Сопряжение возможно благодаря тому, что p-орбитали, которые эти связи образуют,
расположены не на линии между ядрами, а в перпендикулярной плоскости, что
допускает их перекрывание во всех направлениях. Другими словами, p-орбиталь
атома С2 взаимодействует с орбиталями как атома С1, так и
С3.
Делокализацию p-электронов можно
изобразить разными способами:
с помощью набора резонансных
структур (следует помнить, что вклад структур с разделенными зарядами в
резонансный гибрид обычно меньше, чем тех, в которых заряды не разделены).
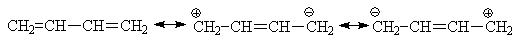
изогнутыми стрелками, показывающими
направление смещения электронной плотности, а также частичной двоесвязностью
(так называемая мезомерная структура, пунктиром обозначаются связи нецелого
порядка)

Обратимся к квантовой химии. В
молекуле бутадиена-1,3 имеется четыре молекулярные p-орбитали (p-МО),
получаемые в результате линейной комбинации четырех атомных р-орбиталей. Эти
p-МО имеют разные энергетические уровни, расчет которых для каждой орбитали
может быть сделан посредством решения уравнения Шредингера (Нy = Еy). В этом
уравнении волновая функция МО представлена как линейная сумма волновых функций
атомных орбиталей с соответствующими коэффициентами.
= с1j1 + с2j2
+ с3j3 +с4j4
- некоторая мера вероятности
пребывания электрона в объеме пространства,
с- доля участия атомной орбитали в
молекулярной орбитали..
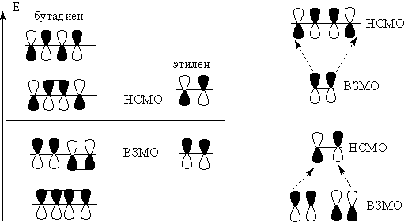
Выше было показано использование
метода молекулярных орбиталей Хюккеля (МОХ) для молекулы этилена. Применим этот
же метод для расчета сопряженной p-системы бутадиена.
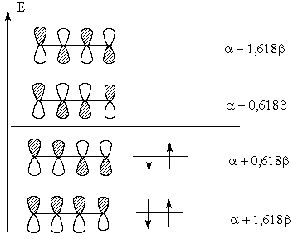
НСМО
ВЗМО
О наличии сопряжения в молекуле
бутадиена-1,3 делают вывод на основании того, что энергия его четырех
электронов меньше таковой двух изолированных пар p-электронов в дух молекулах
этилена, которая, как было показано, равна 2(a + b):
p
= (4a + 4b) - (4a + 4,472b) = 0,472b
p
называют энергией сопряжения или энергией резонанса. Эта величина позволяет
оценить стабилизацию системы за счет сопряжения (резонанса).
Две орбитали ВЗМО и НСМО называют фронтальными, и
они отвечают за реакционную способность соединения: ВЗМО в реакции с
электрофилами, НСМО - с нуклеофилами. Одним из убедительных аргументов,
подтверждающих явление делокализации в 1,3-диенах и других сопряженных системах
считаются данные электронной спектроскопии этих соединений.
Ультрафиолетовая (УФ) или электронная
спектроскопия позволяет определить величину кванта энергии, необходимого для
перехода электрона с одного энергетического уровня на другой. Для этого
измеряется длина волны, при которой происходит наиболее интенсивное поглощение
электромагнитного излучения. Переход любой молекулы из стационарного состояния
в возбужденное является следствием поглощения энергии. Наименьшая энергия
затрачивается при переходе одного электрона с ВЗМО на орбиталь с более высокой
энергией (НСМО). Эта энергия квантована, т.е. конкретному переходу электрона
соответствует строго определенная ее величина. Последняя, в свою очередь, имеет
эквивалент в виде длины волны, при поглощении которой происходит возбуждение
молекулы. Молекулы бесцветных веществ переходят в возбужденное состояние под
действием весьма высоких энергий, т.е. поглощают в коротковолновой части
электромагнитного спектра.. Они занимают область с длинами волн от 100 до 400
нм, что соответствует энергии от 1170 до 293 кДж/моль. Большую энергию
поглощают s-связи. Так, lmax (длина волны максимального поглощения)
алканов лежит в области более коротких, чем 150 нм, волн. Это может быть
зафиксировано лишь в условиях глубокого вакуума, т.к. воздух поглощает при
длине волны, меньшей 180 нм. Несколько меньшая энергия требуется для
возбуждения алкенов, но их область поглощения тоже закрыта воздухом (lmax
гексена-3 184 нм, Е=712 кДж/моль). Соединения же с сопряженными связями
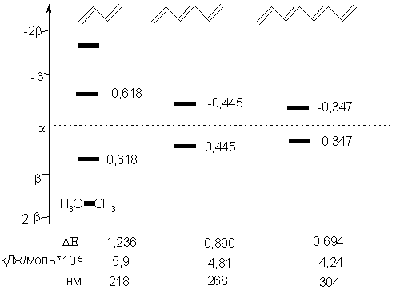
поглощают ультрафиолет в доступной для наблюдения части спектра (lmax
бутадиена-1,3 217 нм, Е = 540 кДж/моль). С увеличением длины сопряжения
максимум поглощения смещается в более длинноволновую область (lmax
гексатриена-1,3,5 255 нм, Е = 452 кДж/моль; декатетраена-2,4,6,8 310
нм, Е = 389 кДж/моль). Для того, чтобы понять причины этого явления
вернемся к рассмотрению молекулярных орбиталей этилена и сопряженных полиенов.
дивинил кумулированный алкадиен
сопряженный
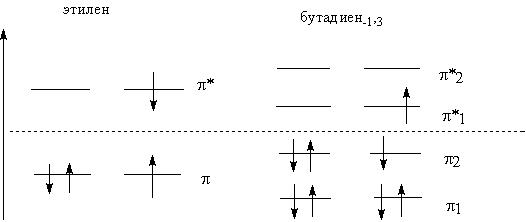
Легко видеть, что энергия ВЗМО
этилена a+b (- 10,88*10-5 кДж/моль) меньше, чем энергия сопряженной
системы бутадиена-1,3, которая имеет величину a+0,618b (- 9,43*10-5
кДж/моль).
Обратное соотношение имеют энергии
НСМО этих молекул. Таким образом, с увеличением длины сопряжения разница
энергий НСМО и ВЗМО «DЕ» уменьшается. Это означает: возбуждение сопряженных
систем требует меньшую энергию, чем несопряженных.
Следовательно, в
бутадиене-1,3-имеется сопряжение.
. Реакционная способность
сопряженных диенов
Квантово-механические расчеты также
дают весьма достоверную информацию о реакционной способности диенов. Согласно
расчетам МОХ, на концевых атомах по фронтальной орбитали ВЗМО находится
наибольшая электронная плотность (0,362), т.е. атака электрофилов должна
направляться по атомам 1 и 4.
К такому же выводу приводит расчет
величин индексов свободной валентности Fr. Последние вычисляются из
представлений о степени насыщенности атома Nr.
r = Nmax
- Nr
max -
максимально возможное число p-связей (максимально возможное значение Nr).
Согласно расчетам молекулы
гипотетического бирадикала триметиленметана, который принят за эталон,
порядок p-связи атома центрального
атома с каждым соседним 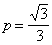 .
.
Максимальная степень связывания
углерода Nmax = 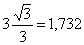 , а с учетом
количества s-связей она составляет величину 3+1,732 =4,732
, а с учетом
количества s-связей она составляет величину 3+1,732 =4,732
Индекс свободной валентности атома r
вычисляется по формуле
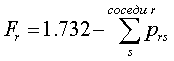
Для бутадиена-1,3 расчет дает
следующие величины порядков связей и индексов свободной валентности
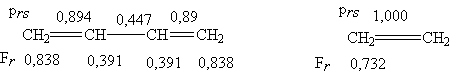
Исходя и изложенных представлений,
легко объяснить, почему для сопряженных диенов характерными являются реакции
[1,4]-присоединения, т.е. протекающие с участием крайних атомов углерода. К
таким превращениям относятся, прежде всего, реакции циклизации, которые по
строению продуктов называют циклоприсоединением.
Бутадиен-1,3 при 150°С димеризуется
с образованием винилциклогексена. Одна молекула реагирует в конформации s-цис
(с участием атомов С1 и С4, такой реагент называют
диеном), а другая - в форме s-транс (так называемый диенофил, реагирует
по С1 и С2)
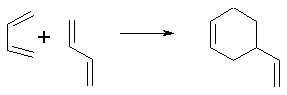
Продукт реакции называется
циклоаддуктом. В соответствии с принятой классификацией, основанной на
количестве атомов, участвующих в образовании цикла - это реакция
4+2-циклоприсоединения.
Превращения подобного типа называют
реакциями диенового синтеза, и они получили имя ученых Дильса и Альдера,
которые их изучали. Синтез Дильса-Альдера относится к классу так называемых
перициклических или электроциклических реакций. Для понимания их механизма
привлекают теорию орбитальной симметрии, которая основана на следующих
утверждениях:
. реакция возможна, если имеет
низкую энергию активации;
. реакция возможна, если она
протекает через стадию образования комплекса, в котором происходит максимальное
связывание;
. максимальное связывание имеет
место в тех случаях, когда в процессе участвуют фронтальные орбитали (ВЗМО и
НСМО) и связывание осуществляется долями орбиталей с одинаковым знаком волновой
функции, т.е. когда реагирующие орбитали соответствуют друг другу по симметрии.

Взаимодействие диенофила с диеном
может реализоваться двумя путями:
ВЗМО диенофила + НСМО диена.
Реакции первого типа называют
реакциями с "нормальными" электронными требованиями (они более
распространены), второго - с "обращенными".
В обоих случаях донором электронов
выступает ВЗМО. Важно помнить, что связывающее взаимодействие возможно лишь
между орбиталями одинаковой симметрии.
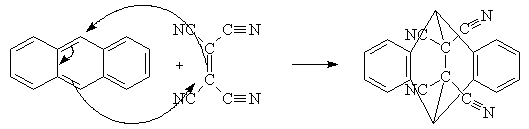
В качестве примера типичной реакции
диенового синтеза с нормальными электронными требованиями можно привести
присоединение тетрацианоэтилена (ТЦЭ) к антрацену. Последний относится к
ароматическим углеводородам, но его ароматический характер выражен несравненно
меньше, чем у бензола: ароматическая p-система сильно деформирована в
центральном кольце преобладает диеновый характер. Реакция антрацена с
диенофилами облегчается еще и тем, что в результате образуются два полноценных
бензольных кольца, которые обладают высокой степенью ароматичности. Диенофил -
ТЦЭ - имеет пониженную электронную плотность С=С-связи (циано-группы -
мезомерные акцепторы) и поэтому сам является сильным акцептором электронов.
Реакцию можно представить как связывание ВЗМО антрацена и НСМО диенофила, т.е.
происходит синхронное перемещение электронной плотности без образования
каких-либо интермедиатов.
Одностадийный характер реакции
Дильса-Альдера подтверждается тем, что она не требует катализатора и на
скорость процесса не оказывают влияния никакие условия кроме температуры.
Сопряженным алкадиенам, как и
алкенам, свойственны реакции присоединения галогенов, водорода,
галогеноводородов. Каталитическое гидрирование 1,3-диенов в большинстве случаев
сразу приводит к образованию алканов. Это превращение еще раз подтверждает
энергетическую выгоду сопряжения, т.к. показывает, что в тех же условиях алкен
активнее диена.
Ранее, в главе Алкены мы
рассматривали гидрирование олефинов и отмечали, что выделяющаяся при этом
энергия может служить м ерой их устойчивости. Так, теплота гидрирования
бутена-1 составляет 127 кДж/моль, т.е. присоединение водорода к двум
изолированным двойным связям должно сопровождаться выделением 254 кДж/моль.
Экспериментально измеренная теплота гидрирования бутадиена-1,3 имеет величину
239 кДж/моль (на 15 кДж/моль меньше). Это согласуется с квантово-химическими
расчетами величин энергий p-электронов этилена и бутадиена-1,3. Для этилена: Е
= 2a + 2b; для бутадиена-1,3:
Е = (2a + 2,236b)*2 = 0,472b. = ЕR
(энергия сопряжения или резонанса).
Присоединение первой молекулы
водорода, как и следует ожидать, происходит к концевым углеродным атомам,
вторая молекула присоединяется к атомам С2 и С3.
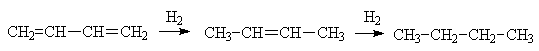
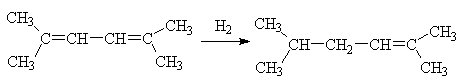
Если положения 1 и 4 полностью
замещены алкильными группами, то имеет место [1,2]-присоединение, что
обусловлено стабильностью возникающего разветвленного олефина.
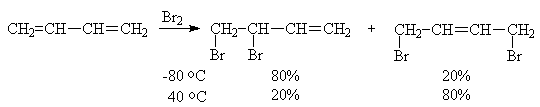
Механизм реакций электрофильного
присоединения к сопряженным системам удобно обсудить на примере взаимодействия
брома с бутадиеном, когда направление реакции сильно зависит от температуры.
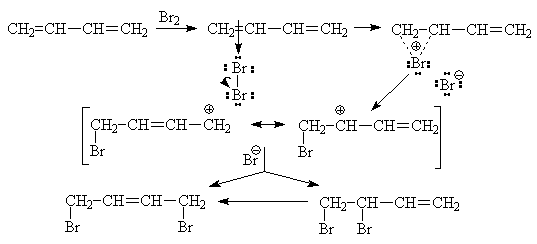
Реакция, как и в случае этилена,
начинается с образования p-комплекса молекулы брома с одной из двойных связей
диена, затем возникает катионный s-комплекс и бромид-ион. Дальнейшие стадии
определяются температурными условиями. Считают, что при более низкой
температуре бромид-ион не успевает отойти на большое расстояние от места своего
возникновения и присоединяется к соседнему атому. Напротив, при повышении
температуры увеличивается вероятность перемещения бромид-иона вдоль цепи
сопряженного карбкатиона, и он атакует атом С4. При выдерживании
одного из продуктов присоединения или их смеси произвольного состава в течение
длительного времени при 40°С образуется смесь 20% 3,4-дибромбутена-1 и 80%
1,4-дибромбутена-2. Это означает, что продукт 1,2-присоединения образуется
легче, чем 1,4-изомер, но он менее устойчив и при повышении температуры перегруппировывается
(через тот же промежуточный аллильный катион).
Таким образом, образование продукта
1,2-присоединения определяется кинетикой процесса (соотношением скоростей
параллельно идущих реакций), поэтому он называется кинетическим продуктом.
1,4-Дибромбутен-2, напротив, образуется под контролем термодинамических
факторов (константами равновесия взаимных превращений продуктов). Это -
термодинамический продукт.
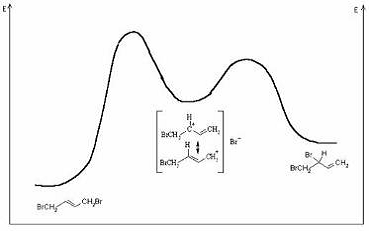
Энергетический профиль реакций
такого типа имеет два максимума, соответствующие двум различным переходным
состояниям. Видно, что переходное состояние 1,2-присоединения лежит ниже по
энергии, тогда как продукт - выше, чем для 1,4-реакции.
Реакции присоединения галогеноводородов
к 1,3-диенам тоже протекают по положениям 1,2 или 1,4 по электрофильному
механизму. Правило Марковникова в классическом варианте здесь не действует,
т.к. образующийся в результате присоединения протона катион является аллильным.
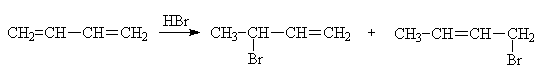
Образующийся в результате
присоединения протона карбкатион аллильного типа резонансно стабилизирован и
потому является энергетически выгодным.
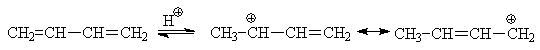
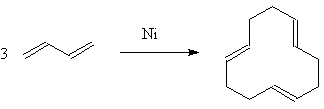
Важное место в химии 1,3-алкадиенов
занимают реакции олигомеризации и полимеризации. К первым относится, например,
рассмотренное выше образование винилциклогексена - превращение, в котором из
двух молекул бутадиена-1,3 получается одна молекула продукта (димеризация). В
присутствии никеля происходит тримеризация бутадиена в циклододекатриены, в
этой реакции все молекулы реагируют по атомам 1,4.
Реакции полимеризации широко
применяются в промышленности для получения полимерных материалов - пластмасс,
смол и волокон. В частности, одним из самых популярных в быту полимеров
является полиэтилен, который получают путем нагревания этилена под давлением в
присутствии кислорода (радикальная полимеризация).
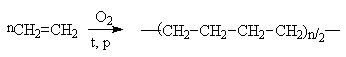
Группа из повторяющихся звеньев в
цепи (она не обязательно соответствует молекуле мономера) называется
элементарным звеном. В случае полиэтилена это - СН2-СН2.
Полимеры получают также из замещенных олефинов: винилхлорида, акрилонитрила,
стирола (винилбензола), винилацетата и т.д.. Сопряженные диены (дивинил,
изопрен) и их производные (хлоропрен) применяются в качестве мономеров для
промышленного получения синтетических каучуков. Для проведения процесса
полимеризации необходимо присутствие инициаторов реакции, например,
органических перекисей. Реакция может быть представлена схемой:
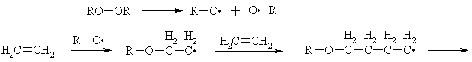
Сопряженные диены полимеризуются
«голова к хвосту»:
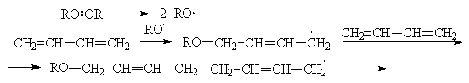
Полимеризация может инициироваться
не только источниками свободных радикалов, но также катализаторами - кислотами
(чаще всего), основаниями (реже) или комплексными соединениями тяжелых металлов
(катализаторы Циглера-Натта). Последние позволяют получать особо ценные
стереорегулярные полимеры из замещенных алкенов и диенов.
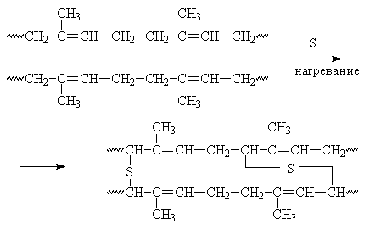
В соке растения Hevea brasiliensis
содержится эмульсия, которая при нагревании коагулирует с образованием эластичной
массы - каучука. Натуральный каучук представляет собой полиизопрен с цис-пространственным
строением.
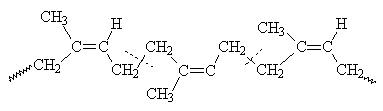
В зависимости от температуры каучук
сильно изменяет свои свойства, и поэтому для превращения его в материал с
хорошими механическими показателями производят вулканизацию, т.е. обрабатывают
серой при повышенной температуре. Сера «сшивает» отдельные полиизопреновые цепи
и этим придает эластичность, прочность, избавляет от липкости и сильного
размягчения при повышении температуры - каучук превращается в резину.
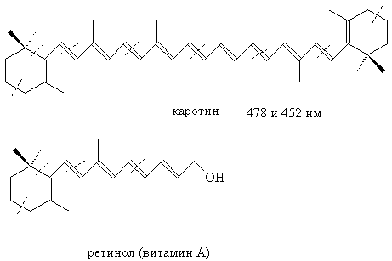
Изопрен как элементарное звено
входит в состав многих природных веществ в основном растительного
происхождения: ликопин, каротины, ментол и др. Эти соединения имеют родственный
биогенез и объединены в класс терпенов. Многие из них обладают специфической
биологической активностью. Отличительной чертой терпенов небольшого
молекулярного веса является сильный, зачастую приятный запах.
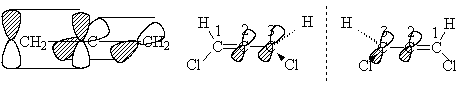
Кумулированные алкадиены (аллены)
Молекула аллена является линенйной
структурой, крайние атомы углерода имеют гибридизацию sp2, средний -
sp. Оси p-орбиталей расположены во взаимно перпендикулярных плоскостях, поэтому
сопряжение кратных связей отсутствует. Это обстоятельство делает возможным для
1,3-дизамещенных алленов явление стереоизомерии, т.е. 1,3-дихлораллен,
например, является хиральным.
Аллен обладает повышенной
реакционной способностью. Так, его каталитическое гидрирование протекает легче,
чем в случае 1,3-диенов, причем одна двойная связь присоединяет водород намного
легче, чем другая (реакцию можно остановить на стадии пропилена). Теплота
гидрирования аллена (298 кДж/моль) значительно выше, чем у двух молекул пропилена
(254 кДж/моль).
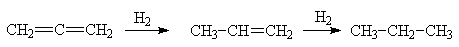
Реакции электрофильного
присоединения начинаются с атаки по центральному атому углерода, что связано с
большей стабильностью промежуточного алкильного катиона по сравнению с
винильным.
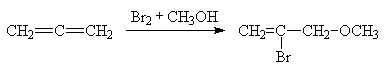
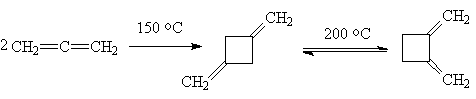
Характерными превращениями для
аллена так же являются реакции димеризации, которые можно рассматривать как
2+2-циклоприсоединение.
Литература
1. Артеменко А.И. Органическая
химия. М.: Высшая школа, 2008.
. Грандберг И.И. Органическая химия.
М.: Высшая школа, 2000.
. Гудкова А.С. От простого к
сложному. М.: Изд-во Моск. ун-та, 2003.
. Потапов В.М., Татаринчик С.Н.
Органическая химия. М.: Химия, 2000.
. Терней А. Современная органическая
химия. В 2-х томах. М: Мир, 2001.
. Тюкавкина Н.А. Органическая химия.
М: Медицина, 2008.