Олефинирование органических соединений. Реакция Виттига-Хорнера
Содержание
Введение
Механизм и стереохимия
Получение фосфонатов
Условия проведения
реакции
Реакция Виттига-Хорнера в органическом синтезе
Заключение
Список использованной
литературы
Введение
В последние годы реакции
карбонильных соединений с иллидами трехвалентного фосфора находят широкое
применение в синтезе олефинов. Одной из первых известных реакций такого типа
является реакция Виттига, в которой карбонильные компоненты вводятся во
взаимодействие с иллидами фосфора с образованием олефинов и фосфин-оксида, как
показано на схеме 1.
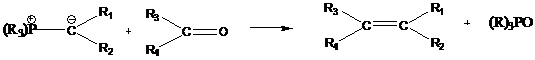
Схема 1 -
Схема реакции Виттига
На данный момент детально
изучены область применения, механизм и стереохимические аспекты данной реакции.
Всё же сенитез олефинов по
Виттигу имеел определенные ограничения, это, в свое время, привело к
возникновению и развитию различных модификаций данного процесса. В них
использовались другие фосфорорганические соединения, которые с легкостью
образовывали карбанион.
В одной из первых модификаций
реакции Виттига использовались карбанионы, генерируемые из производных
дифенилфосфиноксида. Было показано, что они взаимодействуют с альдегидами и
кетонами с образованием олефинов (схема 2).
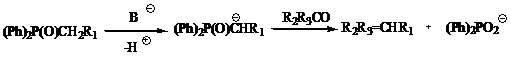
Схема 2 -
Использование дифенилфосфиноксида в модификации р-ции Виттига. R1 = алкил,
алкоксикарбонил и др.
Еще одна модифиация реакции Виттига
была разработана Хорнером, Вэдсвортом и Эмонсом. В этой реакции используются
стабилизированные карбанионы, полученние из фосфонатов. Было показано, что
такие соединения реагируют с альдегидами и кетонами так же, как и производные
фосфиноксидов (схема 3).
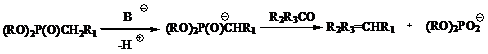
Схема 3 -
Реакция Хорнера. R = алкил, фенил. R1 = электроотрицательная группа
Анионы, полученные из
фосфонатов, обладают более ярко выраженными нуклеофильными свойствами, чем илиды
фосфора. Это приводит к тому, что они способны реагировать с большим
разнообразием карбонильных субстратов при более мягких условиях. Например,
фенилацилиден-трифенилфосфоран (схема 1: R = Ph, R1 = H, R2 = COPh) реагирует с
альдегидами только при длительном кипячении в тетрагидрофуране, в то время как
карбанион из диэтил-фенацилфосфоната (схема 3: R = Et, R1 = COPh) реагирует с
альдегидами с выделнием теплоты.
Водорастворимость получаемых
из фосфонатов фосфат-ионов позволяет более легко выделять олефины из продуктов
реакции.
Повышенная реакционная
способность анионов, полученных из фосфонатов, позволяет проводить их
алкилирование (схема 4), в то время как илиды фосфора обычно не активны в таких
реакциях.
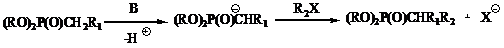
Схема 4 - Алкилирование
карбанионов, полученных из фосфонатов
Фосфонаты более доступны как
продукты реакции Арбузова и дешевле, чем соли алкил-фосфония.
Использование фосфонатов
также имеет преимущества перед использованием фосфин-оксидов. Анионы,
полученныее из фосфонатов, более реакционноспособны по отношению к альдегидам и
кетонам и в то же время менее чувствительны к природе используемого основания и
к атмосферному кислороду.
Механизм и стереохимия
Механизм образования олефинов из
стабилизированных фосфонатных крбанионов аналогичен механизму традиционной
реакции Виттига и представляет собой двухстадийный процесс в котором кабанион
на первой (обратимой) стадии реагирует с карбонильным соединением с
образованием интермедиата оксианиона (бетаина). Далее бетаин (необратимо)
разлагается путем переноса кислорода к фосфору с образованием олефина и
диалкилфосфат-иона (схема 5).
карбанион фосфонат синтез реакция
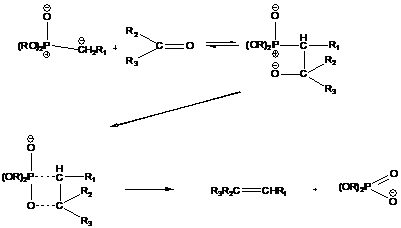
Схема 5 -
Механизм взаимодействия фосфонатного карбаниона с карбонильным соединением
Считается, что превращение бетаина в
олефин протекает путем цис-элиминирования фосфат-иона через четырехчленное
циклическое переходное состояние.
В успешном синтезе олефинов могут
быть использованы только те фосфонаты, которые содержат дополнителную
стабилизирующую карбанион группу (схема 6).
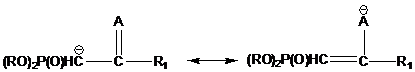
Схема 6 -
Резонансная стабилизация карбаниона. А = гетероатом
С другой стороны из
фосфонатов, в которых R1 (схема 6) = Н, Alk, либо другая нестабилизирующая
группировка, в результате взаимодействия с бутиллитием может образовываться
нестабилизированный карбанион, но его реакции с карбонильными соединениями не
приводят к значительному выходу олефинов.
В литературе описано
использование представленных в таблице 1 различных типов фосфонатов в синтезе
олефинов по реакции Хорнера - Виттига.
Таблица 1 -
Различные типы фосфонатов
|
Тип фосфонатов
|
|
Нестабилизированные фосфонаты
|
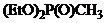
|
|
Фосфонаты, содержащие в α-положении
к анионному центру карбонильную либо циано-группу
|
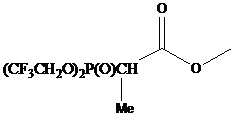 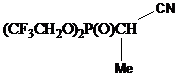
|
|
Винил- и арил- стабилизированные фосфонаты
|

|
|
Бис-фосфонаты
|
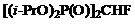
|
Фосфонаты,
стабилизированные гетероатомом 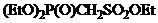
В ряде опытов наблюдалось
присутствие в продуктах реакции как цис- так и транс-олефинов. Такая
стереохимия реакции между фосфонатными карбанионами и карбонильными
соединениями может быть объяснена с позиций ранее предложенного механизма.
Промежуточные оксианионы, образующиеся обратимо в результате реакции
фосфонатного карбаниона и альдегида (схема 7), могут существовать в виде двух
диастереомеров. Эритро-бетаин является предшественником цис-олефина, в то время
как трео-бетаин приводит к транс-продукту.
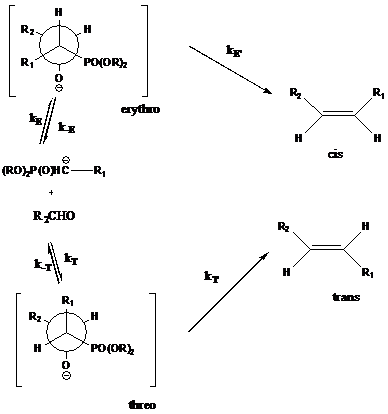
Схема 7 -
Образование цис- и транс- продуктов
Считается, что соотношение изомерных
олефинов можно предсказать исходя из степени обратимости реакций образования
двух различных оксианионов и из скорости их разложения до олефинов.
Поскольку в смеси продуктов зачастую
преобладает транс-олефин, можно предположить, что скорость образования и
разложения до олефина трео-бетаина выше таковой для эритро-бетаина. Низкую
скорость образования эритро-бетаина можно объяснить тем, что в заторможенная
его конформация (схема 7) является весьма напряженной в результате стерического
взаимодействия R1 и R2.
Получение фосфонатов
В основном фосфонаты получают по
реакциям Михаэлиса и Арбузова. Первая включает обработку алкилметаллических
производных диалкилфосфитов алкилгалидами (схема 8).
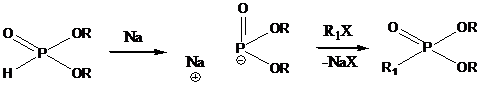
Схема 8 -
Получение фосфонатов по реакции Михаэлиса
Реакция Арбузова включает в
себя обработку триалкилфосфитов алкилгалидами (схема 9).
Схема 9 -
Получение фосфонатов по реакции Арбузова
В последнее время реакция
Арбузова упрощена и адаптирована для получения больших выходов фосфонатов.
Условия проведения реакции
В наше время условия протекания
реакции образования олефинов из карбонильных соединений и фосфонатных
карбанионов мало отличаются от тех, что впервые были предложены Хорнером,
Вэдсвортом и Эмонсом. Фосфонаты, содержащие в α-положении
к анионному центру сильную электроноакцепторную группу (CO2R, COR, CONHR, SO2R,
CN, PO(OR)2) легко и при комнатной температуре дают карбанион при реакции с
таким основаниями как гидрид натрия, амид натрия, либо алкоксиды металлов.
Конденсация протекает при добавлении
карбонильного соединения к карбаниону обычно при комнатной температуре. Растворители
могут различаться по полярности от бензола, через тетрагидрофуран вплоть до
диметилсульфоксида.
Фосфонаты, не содержащие
стабилизированных группировок, как было сказано раньше, образуют карбанион при
взаимодействии с бутил-литием при -78°С в тетрагидрофуране.
Фосфонаты, в которых стабилизирующую
группировку представляют такие заместители, как Ph, CH=CHR, SR, CH(OR)2,
находятся примерно посредине в ряду активности в образовании карбанионов. Они
медленно реагируют с гидридом натрия. Повышение температуры реакционной среды
приводит к их разложению. Для протекания конденсации необходимо присутствие в
смеси карбонильных соединений. Недавние исследования французских ученых
Lavielle и Sturtz реакции образования олефинов из карбонильных соединений и
аллилфосфонатов в смеси HMPA/бензол с использованием NaH в качестве основания
показали, что карбанион образуется только в присутствии карбанильных соединений
в смеси.
Реакция Виттига-Хорнера
в органическом синтезе
Преимущества в использовании
фосфонатных карбанионов в синтезе олефинов перед традиционной реакцией Виттига
значительно расширили применение реакции Виттига-Хорнера
в синтезе широкого спектра соединений. Одним из важных преимуществ является то,
что стерические затруднения в переходном состоянии зачастую позволяют
протекание реакции с преимущественным образованием одного из стереоизомеров.
Хорошо иллюстрируют этот факт синтезы с использованием природных соединений.
Виг и коллеги провели
транс-олефинирование с использованием диэтил 1-этоксикарбонилэтилфосфоната на
различных стадиях в синтезе терпенов ланцеола, гумбертиола и α-фарнесена
(схема 10).
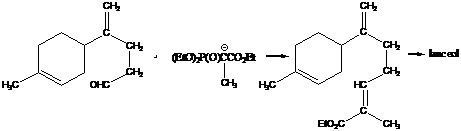
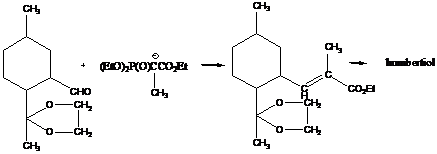
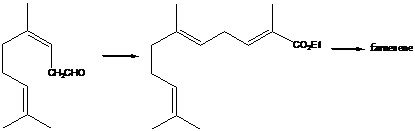
Схема 10 -
Реакция Виттига - Хорнера в синтезе стероидов
Во всех вышеприведенных реакциях
протекало транс-олефинирование и получался транс-олефин. и Wright получали
микофенольную кислоту обработкой соответствующего альдегида диэтил
этоксикарбонилметилфосфанатным анионом. В ходе синтеза образовывался исключительно
транс-2 сложный эфир (схема 11).

Схема 11 -
Реакция Виттига - Хорнера в синтезе микофенольной кислоты
В некоторых случаях
фосфонатная модификация реакции Виттига является альтернативой ранее изученным
реакциям и дает более приемлемые результаты. Так, прямое образование α,β-ненасыщенных
сложных эфиров в ходе реакции между диэтил этоксикарбонилметилфосфоонатом и
альдегидами или кетонами является альтернативой реакции Реформатского.
Фосфонаты, содержащие амидную
группу охотно образуют карбанион, который реагирует с карбонильными
соединениями с образованием α,β-ненасыщенных
амидов.
Японскими исследователями
разработана двухстадийная схема превращения кетонов (альдегидов) в α,β-ненасыщенные
альдегиды.
Заключение
Фосфонатная модификация
реакции Виттига, получившая название реакции Виттига - Хорнера, показала
многочисленные преимущества данного процесса над традиционным олефинированием с
использованием иллидов фосфора.
Достоинства реакции Виттига -
Хорнера привели к широкому распространению метода в органическом синтезе.
Данная модификация показала себя как более выгодная альтернатива некоторым
известным реакциям, нашла применение в стереоселективном синтезе а также в
синтезе многих природных соединений.
Значительный интерес
представляет олефинирование с участием фосфонатных реагентов, обладающих
внутренней асимметрией. Очевидно, что изучение различных вариантов реакции
Виттига - Хорнера в будущем будет продолжаться.
Список
использованной литературы
1. Boutagy
J., Thomas R. Olefin Syntheses with Organic Phosphonate Carbanions// Chem. Rev.
- 1974. - Vol. 74. - P. 87 - 99.
2. Maryanoff
B., Reitz A. The Wittig Olefination Reaction // Chem. Rev. - 1989. - Vol. 89.
No 4. - P. 863 - 927.