Исследование фазообразования в системах Fe2O3-H2O и Fe2O3-Al2O3-H2O
Реферат
Данная работа содержит 108 листов, 43
иллюстрации, 24 таблицы и 4 приложения. Список использованных источников
составляет 40 наименований.
Ключевые слова: оксиды, гидроксиды,
оксигидроксиды железа и алюминия, фазообразование, гидротермальный синтез.
Работа посвящена исследованию фазообразованию в
системах Fe2O3
- H2O
и Fe2O3
- Al2O3
- H2O.
Композиции были получены методом совместного осаждения и гидротермально
обработаны. Для исследования образцов применялись методы рентгенофазового и
комплексного термического анализов. В зависимости от соотношения компонентов
установлены области устойчивости гидратированных форм оксидов. Установлено
взаимное влияние компонентов смеси друг на друга. Получены композиции с
различным фазовым составом в зависимости от условий гидротермального синтеза.
Введение
Интерес к наноразмерным объектам чрезвычайно
высок. Это связано с их необычными физико-химическими, электромагнитными,
оптическими, механическими и др. свойствами, что открывает большие перспективы
практического использования таких объектов. В связи с этим стали активно
развиваться различные физические и химические методы синтеза твердых веществ в
наноразмерном состоянии. Современное развитие физики и химии твердого тела дало
много новых фактов о реальной структуре и свойствах кристаллов. Свойства
массивных материалов - это усреднённые характеристики. На микронном или в
нанометровом уровне, многие свойства материалов изменяются. В частности,
получены многочисленные данные о «размерном эффекте» - зависимости свойств
кристаллических твердых тел при последовательном уменьшении их размеров [1].
Многочисленные исследования в данной области
показали, что структура и свойства веществ в наноразмерном состоянии очень
чувствительны к методу и режиму синтеза. Кроме того, структура и свойства
наночастиц неодинаковы по объёму и сильно зависят от системного окружения. Если
внутри наночастицы наблюдается строго упорядоченное размещение атомов в узлах
соответствующей кристаллической решетки, то в приповерхностной области
расположение атомов далеко от упорядоченного. От центра к периферии наночастицы
меняется не только её структура, но и химический состав.
В данной работе синтезированы композиции на
основе системы Fe2O3-H2O и Fe2O3-Al2O3−H2O,
для получения которых использованы метод совместного осаждения и
гидротермальный синтез.
Гидратированные оксиды железа представляют собой
большой класс неорганических соединений, широко распространенных в природе и
используемых в различных областях промышленности (например, при производстве
магнитных материалов, неорганических пигментов, катализаторов, сорбентов и
др.). При этом эксплуатационные характеристики порошков (и, соответственно,
области их применения) во многом определяются такими свойствами, как размер и
форма частиц, их структура и фазовый состав. Возросшие требования к магнитным
носителям с высокой плотностью записи привели к разработке принципиально нового
способа получения неполярных (non
polar - NP)
частиц γ-Fe2O3,
заключающегося в гидротермальном синтезе анизотропных, беспористых частиц α-Fe2O3
с дальнейшим их переводом в магнитный оксид. Несмотря на существование большого
числа работ, посвященных синтезу частиц α-Fe2O3
путем термообработки растворов солей Fe(NO3)3,
FeCl3
и Fe2(SO4)3
или суспензий Fe(OH)3
и β-FeOOH,
сведения о влиянии условий синтеза на фазовый состав и морфологию частиц водных
оксидов железа, получаемых в гидротермальных условиях (при температурах более
100°С), весьма ограничены [2]. На основе композиций системы Fe2O3-Al2O3-H2O
возможно создание материалов с еще более широким диапазоном эксплуатационных
характеристик. Кроме того, AlxFe1-x(OH)3
в процессе старения в гидротермальных условиях чувствительны к любым изменениям
соотношения ионов, температуры и других факторов как давление и pH
гидротермальной среды, более детальное исследование фазовых превращений данной
системы позволит объяснить многие аспекты, связанные с природным генезисом
алюминий и железо содержащих минералов.
В связи с этим представляет интерес характер
влияния параметров гидротермальной обработки Fe(OH)3,
Fe2O3∙nH2O,
γ-FeOOH
и композиций на основе системы Fe2O3-Al2O3-H2O
(рН, температуры, продолжительности гидротермальной обработки) на
физико-химические свойства (фазовый состав, морфологию, дисперсность)
образующихся кристаллических частиц. Особый интерес при проведении исследований
в этом направлении представляют термохимические аспекты синтеза и поведения при
эксплуатации рассматриваемых материалов.
1. Аналитический обзор
.1 Диаграммы состояния
двухкомпонентных систем
На сегодняшний день хорошо изучены
двухкомпонентные системы Fe2O3
- H2O,
Al2O3
- H2O
и Fe2O3
- Al2O3.
Существует много версий фазовых диаграмм этих систем [3-5].
При обезвоживании гидратов оксида алюминия при
атмосферном давлении точки взаимных превращений гидратов вследствие аморфной
или скрытокристаллической структуры получающихся продуктов сильно варьируются в
пределах до 200°. Лучшие результаты могут быть получены при применении
гидротермального метода, когда вещество подвергается воздействию перегретого
пара в стальном автоклаве.
Известны следующие гидратные формы глинозема:
гидраргиллит (гиббсит) и байерит состава Аl2O3·3Н2O,
диаспор и бёмит состава Аl2O3·Н2O
и γ-глинозем.
Последний обычно содержит весьма незначительное (1-2 %) количество Н2O
и необратимо превращается в корунд при удалении этой воды. На рисунке 1
показано присутствие различных фаз в системе Аl2О3 - Н2О
в зависимости от температуры. В гидротермальных условиях корунд является
стабильной формой выше 450±5 °С, γ-глинозём
в температурном интервале 10-500 °С является нестабильным, диаспор устойчив в
пределах температур 450-280 оС. Бёмит устойчив между 155 и 280 °С,
гиббсит и байерит выше 155 °С нестабильны. Есть указание, что ниже 155 °С
байерит менее устойчив чем гиббсит. Эти данные получили Лаубенгайер и Вейс [3].
По наблюдениям других авторов γ-глинозём
переходит в корунд выше 900 °С при нормальном давлении. Диаспор и бемит
неустойчивы выше 400-500 °С, гиббсит и байерит разлагаются при температурах от
120 до 200 °С с потерей двух молекул воды.

Рисунок 1 - Кривые устойчивости фаз
для системы Аl2О3 - Н2О [3]
На рисунках 2 - 6 показаны диаграммы
фазовых равновесий системы Аl2О3-Н2О,
предложенные различными авторами. На рисунке 2 изображена Р-Т диаграмма
состояния системы Аl2О3-Н2О построенная
Эрвином и Осборном. Ими были изучены условия равновесного сосуществования
отдельных кристаллических фаз в гидротермальных условиях.
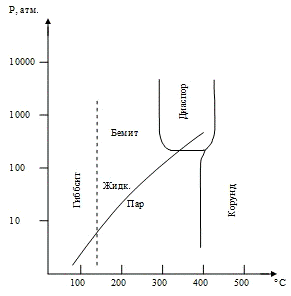
Рисунок 2 - Диаграмма фазовых
равновесий в системе Al2O3 - H2O по Ervin G., Osborn E.F. [3]
Есть данные о получении
синтетического диаспора в стальном автоклаве в щелочной и водных средах при
температуре 315 °С и введением затравки из природного диаспора. В щелочной
среде у кристаллов диаспора наблюдается образование граней, перпендикулярных
плоскостям спайности, в то время как в водной среде преимущественно развивались
изометрические кристаллы.

Рисунок 3 - Система Al2O3-H2O
по данным Torkar
K., Krisher
H. [4]
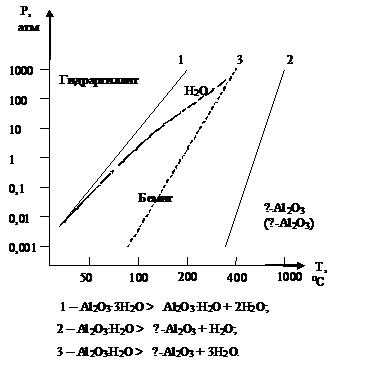
Рисунок 4 - Диаграмма состояния
системы Аl2О3-Н2О по Токару и Уорелу [5]

Рисунок 5 - Диаграмма состояния системы Аl2О3-Н2О
по Кеннеди при низком давлении [5]

Рисунок 6 - Диаграмма состояния системы Аl2О3-Н2О
по Кеннеди при высоком давлении [5]
На рисунках 7 и 8 представлены диаграммы фазовых
равновесий для системы Fe2O3
- H2O
[3].

Рисунок 7 - Температура разложения гетита в
контакте с водным раствором при 1-2 атм.
В зависимости от кислотности-щелочности раствора
по данным Smith
F.G.
и Kidd D.J.
[3]

Рисунок 8 - Пограничная кривая поля стабильности
гематит-гетит в 0,1 М растворе NaOH
в зависимости от температуры и давления. По данным Smith
F.G.
и Kidd D.J.
[3]
Система Fe2O3-Al2O3
изучалась Муаном и Ги. На рисунке 9 приводится построенная Муаном диаграмма
фазовых равновесий в системе оксид железа (III)
- глинозём на воздухе [3], основанная преимущественно на данных Муана и Ги с
уточнением положения поля кристаллизации соединения Fe2O3×Al2O3;
эта фаза не стабильна ниже 1318 °C.
Диаграмма для простоты дана в виде двойной, хотя действительные составы фаз
относятся к тройной системе FeO-Fe2O3-Al2O3,
как было показано в работе Муана и Ги, данные которых представлены на рисунке
10. Сплошные линии указывают на бинарные отношения. Штриховые линии проведены в
тех частях системы, где только шпинель является конденсированной фазой, состав
которой лежит на соединительной линии Fe2O3-Al2O3.
Пунктирная линия используется там, где присутствует жидкая фаза [4].

Рисунок 9 - Квазибинарная диаграмма системы Al2O3-Fe2O3
по Muan A.
и Gee G.L.
[3]

На нижней части рисунка 10 приведена треугольная
диаграмма с нанесёнными на ней кривыми, представляющими составы фаз
кристаллизующихся вдоль пограничных кривых. Буквенные обозначения на линиях
составов соответствуют таковым на верхней псевдо-бинарной части диаграммы. Там,
где нет надёжных данных, линии составов показаны штрихами.
Реакции между фазой Fe2O3·Al2O3
и продуктами её разложения в виде твердых растворов (Fe,
Al)2O3
типа
гематита и твёрдых растворов (Al,
Fe)2O3
типа корунда происходит слишком медленно, чтобы можно было произвести прямое
экспериментальное её изучение при температурах ниже 1318 °C,
в связи с чем Муан использовал косвенный метод определения относительной
стабильности этих двух фазовых композиций. По мере понижения парциального
давления кислорода поле соединения FeO·Al2O3
уменьшается, а при давлении ниже 0.03 атм. оно исчезает.
Общие закономерности в системе оксид железа (III)-Al2O3,
изученной на воздухе и при 1 атм. парциального давления кислорода в
температурных пределах от 1085 до 1725 °С,
по данным Муана и Ги, представлены на рисунке 10. В качестве кристаллических
фаз присутствуют: гематит с корундом в твердом растворе, корунд с гематитом в
твердом растворе, фаза 1:1 = Fe2O3·Al2O3
(т.р.), шпинелевидная фаза, являющаяся в основном твердым раствором между
магнетитом (FeO·Fe2O3)
и герцинитом (FeO·Al2O3)
с некоторым избытком Fe2O3
или Al2O3,
или того и другого одновременно.
Система бинарна, если в качестве фаз
присутствуют только гематит (т.р.), корунд (т.р.) и Fe2O3·Al2O3
(т.р.). По мере возрастания температуры достигается точка, в которой оксид
железа (III) начинает
диссоциировать на оксид железа (II)
и кислород с одновременным образованием шпинелевидной фазы дополнительно к
другим присутствующим фазам. Для чистого Fe2O3
эта диссоциация происходит при 1390 °С на воздухе и при 1455 °С при 1 атм.
давления кислорода; температура разложения медленно понижается по мере
добавления Al2O3.
Фаза 1:1 разлагается на шпинель (т.р.) и корунд (т.р.) при 1440 °С на воздухе и
при 1490 °С при 1 атм. давления кислорода. Чистый компонент - оксид железа (III)
плавится при температуре около 1594 °С, а Al2O3
- при 2054 °С.
1.2 Оксиды алюминия и их
гидратированные формы
Для Al2O3 характерно
существование нескольких модификаций, из которых термодинамически устойчивой
является α-фаза. Эта
фаза называется корундом (пространственная группа 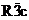 ) и является
родоначальником соответствующего структурного ряда, в который входят другие
оксиды металлов III группы с формулой М2О3.
Структура состоит из слоёв гексагонально плотноупакованных ионов кислорода и
катионов небольшого размера (как правило, с ионным радиусом до 0.65-0.70 Å),
размещенных в двух третях октаэдрических пустот между атомами кислорода
(рисунок 11).
) и является
родоначальником соответствующего структурного ряда, в который входят другие
оксиды металлов III группы с формулой М2О3.
Структура состоит из слоёв гексагонально плотноупакованных ионов кислорода и
катионов небольшого размера (как правило, с ионным радиусом до 0.65-0.70 Å),
размещенных в двух третях октаэдрических пустот между атомами кислорода
(рисунок 11).

Катионы в этой структуре характеризуются
октаэдрической координацией по кислороду, а каждый атом кислорода координирован
с четырьмя катионами. Поскольку катионы попарно расположены в соседних
октаэдрических узлах решетки, для этой структуры характерно сочленение
октаэдров МО6 по одной из граней. Параметры элементарной ячейки α-Al2O3
измерялись
различными исследователями многократно на порошках и монокристаллах различной
чистоты и с разными химической и термической предысториями [6].
В определённом смысле эта структура
представляется неожиданно сложной, ибо в ней координационные группы AlO6
сочленены и по вершинам, и по ребрам, и по граням. Однако анализ моделей этой и
других плотнейших упаковок позволяет думать, что такое описание структуры
оказалось предпочтительнее других геометрически возможных моделей потому, что в
ней окружение иона О2- четырьмя ионами Al3+
наиболее близко к правильно-тетраэдрическому. В корунде валентные углы Al
- O - Al
равны: 85° (один), 94° (два), 120° (один), 132° (два). Эти углы можно сравнить
с «идеальными» величинами, рассчитанными при сочленении полиэдров посредством
общих вершин, ребер и граней. В структуре корунда из-за наличия общих граней у
пар октаэдров AlO6
наблюдается два набора расстояний Al
- O [5].
Кристаллографические данные различных
модификаций оксида алюминия приведены в таблице 1.
Таблица 1 - Кристаллографические данные для
различных модификаций оксидов алюминия
|
Модификация
оксида
|
Пространственная
группа
|
Структура
|
Параметры
элементарной ячейки, Ǻ
|
|
α-Al2O3
|
|
Корунд
(плотнейшая гексагональная)
|
a=4.758 с=12.991
|
|
β-Al2O3
|
P63/mmc
|
β-Al2O3 (гексагональная
сингония)
|
а=5.64
с=22.65
|
|
γ-Al2O3
|
Fd3m
|
Кубическая
типа шпинели
|
а=7.90
|
|
δ-Al2O3
|
-
|
Ромбическая
|
а=5.70
b=2.90 c=11.8
|
|
ε-Al2O3
|
-
|
Кубическая
|
а=7.95
|
Al2O3
и его самая термодинамически устойчивая модификация α-форма
или корунд изучены подробно прежде всего из-за применения Al2O3
в различных высокотемпературных конструкционных материалах (общеизвестны
алундовые трубки и тигли для лабораторных работ, различные виды керамики, на
90-98% состоящие из Al2O3
и т.д.). Корунд химически очень устойчив, не взаимодействует с водой, кислотами
и щелочами (например, алундовые тигли можно отмывать от остатков других веществ
кипячением в некрепкой соляной или азотной кислоте, но необходимо помнить, что
изделия из алунда после кипячения в концентрированной азотной кислоте могут
стать хрупкими и легко разрушаться). α-Al2O3
не взаимодействует также при нагревании в атмосфере водорода, СО или
углеводородов до весьма высоких температур (до 1600-1800 °С). Тот факт, что
корунд не взаимодействует с минеральными кислотами в условиях, когда
большинство солей алюминия хорошо растворимо в воде, может быть объяснён,
видимо, исключительно плотной структурой корунда и крайне незначительным
отклонением от стехиометрии в формуле М2О3. Поэтому
проведение реакций твёрдофазного синтеза с участием α-Al2O3
требует высоких температур и длительности термического воздействия. Плотность =
3,96 г/см3. Тпл=2054 °С, Ткип=2980 °С [6].
При нагревании диаспор дегидратируется
непосредственно до α-Al2O3,
а бёмит и обе модификации Al(OH)3
превращаются в α-Al2O3
только
после длительного нагревания при высоких температурах. При более низких
температурах образуется смесь фаз, в целом обозначаемая как γ-Al2O3.
Эти фазы различаются по степени упорядочения атомов алюминия в кубической
плотнейшей упаковке атомов кислорода и могут быть описаны как дефектная
структура шпинели, поскольку в ней 16 октаэдрических и 8 тетраэдрических
позиций статистически заняты только 211/3 атомами
металла. γ-Al2O3
имеет практическое значение вследствие большой адсорбционной способности и
каталитической активности. Он используется также в производстве синтетического
сапфира в печи Вернейля. Степень упорядочения и пористость структуры зависят от
выбора исходного материала. Например, в структуре байерита атомы кислорода
имеют гексагональную плотнейшую упаковку, и переход к структуре шпинели с
кубической плотнейшей упаковкой означает перестройку всей структуры. Структуру
бёмита в целом нельзя описать по принципу плотнейших упаковок, однако строение
отдельного слоя можно рассматривать как кубическую плотнейшую упаковку атомов
кислорода, поэтому для образования γ-Al2O3
из
структуры AlO(OH)
необходима менее существенная перестройка (по сравнению с предыдущим случаем)
[5].
Практически все формы оксида алюминия содержат в
своём составе некоторое количество остаточных гидроксильных групп. Было
показано, что потеря всей или части воды приводит к изменению кристаллической
структуры. При этом гидроксильные группы занимают определенные позиции в
структуре и стабилизируют те или иные модификации оксида алюминия. Возможность
подобного влияния связывают с высокой удельной поверхностью характерной
практически для всех переходных форм.
Известно около десятка полиморфных модификаций
оксида алюминия, которые Липпенс разделил на две группы:
) низкотемпературные оксиды алюминия Al2O3·nH2O,
где 0<n<0,6, их
получают дегидратацией моно-, тригидратов или разложением солей алюминия при
температурах не выше 600 °С, эти формы (γ,
ρ, χ, η - модификации), как указано выше
содержат некоторое количество воды или другого стабилизатора;
) высокотемпературные оксиды алюминия, почти
безводные, получаемые дегидратацией гидратов алюминия при температурах от 900
до 1000 °С
и кристаллизацией расплавов (α, κ, θ, δ- модификации).
Образование указанных модификаций протекает по
следующим схемам [7]:

Следует отметить, что только диаспор
непосредственно переходит в корунд, что подтверждает важнейшую роль подобия
анионных подрешеток в процессе зародышеобразования новой фазы.
Первая фаза, γ-Al2O3,
образующаяся при дегидратации бемита, имеет дефектную структуру со статическим
размещением ионов металла. Структура δ-фазы
представляет собой тетрагональную сверхструктуру шпинели с утроенным параметром
с, в которой вакансии располагаются упорядоченно по октаэдрическим позициям. В θ-фазе
половина ионов металла занимает тетраэдрические, а вторая половина -
октаэдрические пустоты в искаженной кубической плотнейшей упаковке ионов
кислорода. В структурах всех этих модификаций атомы кислорода имеют кубическую
плотнейшую или близкую к ней упаковку; таким образом структурные изменения
включают перемещения только катионов.
Разнообразие схем дегидратации связано с тем,
что фазовая предыстория исходных компонентов и условия прокаливания (скорость
нагрева, размер частиц, давление водяных паров) существенно влияют на
последовательность дегидратации.
Структуры γ-,
η-модификаций
Al2O3
описываются как кубические, тетрагонально искаженные типа дефектной шпинели с
катионным разупорядочением, особенно в тетраэдрических положениях, а для η-Al2O3
и анионным разупорядочением. Для η-формы,
структурная формула может быть представлена в виде: (Al2/31/3)[Al2]O4,
а для γ-формы в
октаэдрах: (Al)[Al5/31/3]O4,
где в круглых скобках указаны тетраэдрические координированные катионы, в
квадратных скобках - октаэдрически координированные катионы,
- катионная вакансия. С учетом входящей в структуру воды и распределением
протонов по катионным подрешеткам формулы приобретают следующий вид: (H1/3Al1/2)[Al2]O4
для
η-формы
и (Al)[H1/2Al3/2]O4
для γ-модификации.
При этом полагают, что структура θ-формы
подобна η-
Al2O3,
а δ-
Al2O3
- структуре γ-модификации.
Согласно Эрвину модификации оксида алюминия
отличаются только степенью упорядоченности катионов алюминия по тетра- и
октаэдрическим позициям в плотнейшей кубической упаковке кислорода. С
повышением температуры происходит непрерывная перестройка кристаллической
решетки, которая по мере заполнения октаэдрических позиций, заканчивается
образованием стабильной α-фазы.
Рассмотренные выше формы оксида алюминия
генетически связывают со структурой шпинели, для которой характерна плотнейшая
кубическая упаковка кислорода. Другой класс структур формируется путем
распределения ионов алюминия по тетра- и октаэдрическим вакансиям
гексагональной плотнейшей упаковки кислорода.
Оксиды алюминия - одни из самых распространённых
оксидных катализаторов в гетерогенном катализе, причем они используются как в
индивидуальном виде, так и в качестве носителей, на которые наносятся обычно
металлы VIII группы или
(реже) оксиды переходных металлов. Для приготовления катализаторов используются
только метастабильные формы Al2O3
(γ,
θ,
δ,
χ),
которые
удаётся получать с высокоразвитой поверхностью термическим разложением
модификаций гидрооксида алюминия при 350-600 °С.
Гидроксид алюминия А1(ОН)3, бесцветное
твердое вещество. Известны четыре кристаллических. модификации (см. таблицу 2)
- моноклинный (γ) и триклинный
(γ`)
гиббсит,
или гидраргиллит, байерит (α) и
нордстрандит (β), а также аморфный
(гелеобразный) гидроксид алюминия переменного состава А12О3·nН2О.
Существуют также две кристаллические модификации оксигидроксида АlOОН - бемит и
диаспор. Все модификации гидроксида и оксигидроксида встречаются в природе в
виде минералов, являющихся составной частью бокситов. Гидроксид и оксигидроксид
не растворимы в воде. Амфотерны: с кислотами образуют соли А13+, со
щелочами - алюминаты. С NH3·H2O не реагируют. Химическая
активность убывает в ряду: аморфный гидроксид алюминия -> байерит ->
гиббсит -> бемит -> диаспор.
Гиббсит переходит в бемит при температуре >150
°С. Бемит, диаспор переходят в корунд при температуре >300 °С [8].
Если рассматривать два основных типа полиморфных
модификаций гидроксида алюминия: α (байерит)
и γ
(гиббсит),
то внутри каждого типа структур имеются лишь небольшие различия, возникающие из-за
различного способа наложения слоёв. В основе всех модификаций лежит один и тот
же слой АХ3, показанный в идеализированном виде на рис. 12. Его
можно описать либо в виде системы из координационных октаэдров АХ6,
каждый из которых соединён с другими октаэдрами тремя общими рёбрами, либо в
виде пары слоёв атомов Х со слегка искаженной плотнейшей упаковкой, в которой
атомы металла занимают две трети октаэдрических пустот.
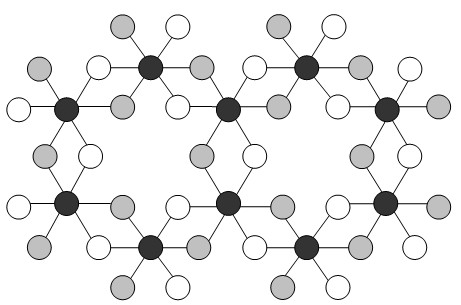
Рисунок 12 - Фрагмент слоя Al(OH)3
(в идеализированном виде) [5]
Структуры различных модификаций отличаются друг
от друга способом наложения слоёв. В байерите все атомы кислорода занимают
слегка искаженную гексагональную плотнейшую упаковку, а в структуре
гидраргиллита (моноклинного гиббсита) ОН-группы на нижней стороне одного слоя
лежат непосредственно над ОН-группами находящегося ниже слоя. По видимому в
нордстрандите реализуется промежуточный случай, когда слои налагаются
приблизительно таким же способом, как в гидраргиллите; можно сравнить расстояние
между слоями (см. таблицу 2) [5]. Способ наложения слоев в гидраргиллите
отвечает существованию направленных связей между ОН-группами соседних слоёв.
Таблица 2 - Межслоевое расстояние в модификациях
Al(OH)3
|
Модификация
Al(OH)3
|
Межслоевое
расстояние d, Å
|
|
Байерит
|
4.72
|
|
Нордстрандит
|
4.79
|
|
Гидраргиллит
(гиббсит)
|
4.85
|
Оксигидроксиды можно охарактеризовать, как такие
соединения металлов, в которых координационная группа атома металла включает
лиганды О и ОН.
Структура α-AlO(OH)
(диаспор) представляет собой простейшую трехмерную каркасную структуру, в
которой двойные цепочки типа рутила сочленены общими вершинами. Объемное
изображение структуры представлено на рисунке 13. Атомы кислорода расположены в
вершинах каждого октаэдра, а атомы алюминия в центрах октаэдров. Двойные линии
обозначают связи О - Н - О.
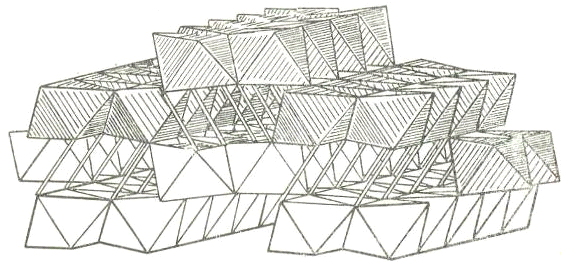
Рисунок 13 - Структура диаспора α-AlO(OH)
по Эвингу [11]
На рисунке 14 показана проекция структуры
диаспора. Двойные цепочки перпендикулярны плоскости чертежа; на нем также можно
видеть слои с плотнейшей упаковкой из атомов кислорода. Атомы водорода в
диаспоре были локализованы методом нейтронографии; они показаны в виде
маленьких черных кружков, соединенных с заштрихованными атомами кислорода.
Связи О - Н - О (2.65 Å) указаны
пунктирными линиями, а атомы водорода лежат немного в стороне от прямой,
соединяющей два атома кислорода (рисунок 15). Из рисунка 14 видно, что
ближайшее окружение атома кислорода ОН-группы состоит из трёх атомов алюминия,
образующих основание пирамиды, четвертой вершиной которой является атом
водорода (Al - 3ОН 1.98 Å),
в то время как ион О2- лежит почти в плоскости трех ближайших атомов
алюминия (Al - 3O
1.86 Å),
причем связь О - Н - О располагается вдоль четвертого направления от центра
тетраэдра. В структуре α-AlO(OH)
в отличии от структуры γ-AlO(OH)
каждая группа ОН- образует водородную связь с атомом кислорода.
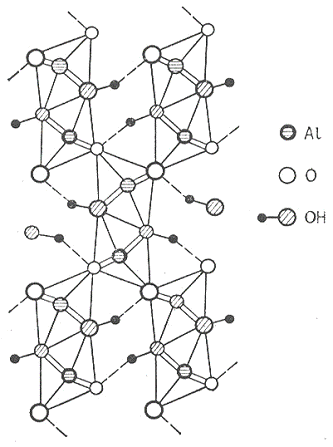
Рисунок 14 - Проекция структуры диаспора α-AlO(OH)
[11]

Рисунок 15 - Строение связи О - Н - О в
структуре диаспора α-AlO(OH)
В результате двух независимых
рентгеноструктурных исследований бемита γ-AlO(OH)
проведенных в центросимметричной пространственной группе Cmcm,
для длины связи О - Н - О были получены значения 2.47 и 2.69 Å.
Методом парамагнитного резонанса было показано, что эта связь не является
симметричной, поэтому структура нуждается в дальнейшем изучении.
Исследование структур двух модификаций AlO(OH)
представляет интерес с практической точки зрения, так как при дегидратации Al(OH)3
и AlO(OH)
образуются катализаторы и абсорбенты. В диаспоре α-AlO(OH)
атомы кислорода имеют гексагональную плотнейшую упаковку, и это соединение
дегидратируется непосредственно до α-Al2O3
(корунд), в структуре которого атомы кислорода размещены таким же образом.
Структуру бемита γ-AlO(OH)
в целом нельзя описать на основе плотнейших упаковок, однако внутри каждого
слоя атомы кислорода образуют кубическую плотнейшую упаковку. Бемит не
дегидратируется непосредственно до γ-Al2O3
со структурой типа шпинели, при его дегидратации образуется ряд промежуточных
фаз. Среди предложенных схем имеются следующие:

Возможно, эти промежуточные фазы, в целом
обозначаемые как модификации γ-оксида
алюминия, представляют собой структуры с различной степенью упорядочения атомов
алюминия в более или менее искаженной плотнейшей упаковке атомов кислорода [5].
Если рассматривать процесс дегидратации бемита
до γ
модификации
оксида алюминия [9], то здесь широко предлагается тип механизма, основанный на
расслоении гидроксида - удаление воды происходит вследствие внутреннего
уплотнения протонов и гидроксильных групп между слоями, возникшими после
разрушения слоистой структуры вещества. Такой механизм дегидратации характерен так
же и для лепидокрокита (γ-FeOOH).
Таблица 3 - Свойства кристаллических модификаций
гидроксида и оксигидроксида алюминия
|
Показатель
|
Гиббсит
|
Байерит
|
Норд-
страндит
|
Бемит
|
Диаспор
|
|
Кристаллическая
решетка
|
Моно-
клинная
|
Трик-
линная
|
Моно-
клинная
|
Трик-
линная
|
Ортором-
бич.
|
Орто-
ромбич.
|
|
Параметры
решетки:
|
|
|
|
|
|
|
|
а,
нм
|
0.864
|
1.733
|
0.501
|
0.889
|
0.297
|
0.440
|
|
b,
нм
|
0.807
|
1.008
|
0.868
|
0.500
|
1.223
|
0.943
|
|
c,
нм
|
0.972
|
0.973
|
0.476
|
1.020
|
0.370
|
0.284
|
|
α
|
-
|
94,17°
|
-
|
92.56°
|
-
|
-
|
|
β
|
94.34°
|
92.13°
|
90.27°
|
110.23°
|
-
|
-
|
|
γ
|
-
|
90.00°
|
-
|
90.32°
|
-
|
-
|
|
Число
формульных единиц в ячейке
|
4
|
16
|
2
|
4
|
2
|
2
|
|
Плотность,
г/см3
|
2.35-2.42
|
-
|
2.53
|
2.44
|
3.01-3.06
|
3.44
|
|
Твердость
по Моосу
|
2.5-3.5
|
-
|
-
|
3
|
3.5-4,0
|
6.5-7.0
|
1.3 Оксиды железа и их
гидратированные формы
Все оксиды железа реакционноактивны, что связано
в немалой степени со способностью железа образовывать различные координационные
соединения.
В системе железо-кислород основными оксидами
являются FeO1+x
(вюстит),
α-Fe2O3
(гематит),
Fe3O4
(магнетит)
и метастабильная фаза γ-Fe2O3,
отличающаяся упорядочением катионных дефектов и выше 430 °С
переходящая необратимо в α-Fe2O3.
Стехиометрический вюстит (FeO)
нестабилен при обычных давлениях, и фаза, образующаяся при небольших
парциальных давлениях кислорода, всегда содержит катионные вакансии.
Характерная для FeO1+x
структура типа NaCl
ниже -180 °С претерпевает ромбоэдрическое искажение. Обычно
вюстит термически устойчив при температурах выше 575-580 °С,
но часто встречается в нестабилизированной (разупорядоченной) форме. Ниже 580 оС
вюстит распадается на металлическое железо и Fe3O4,
хотя устойчивость вюстита зависит от температуры, термической и препаративной
предыстории, уровня примесей, степени деформации и дефектности [6].
Химическая активность FeO1+x
в целом зависит от степени дефектности оксида. Водяной пар может окислять его
(как и нагревание на воздухе при ~250 °С) до Fe2O3,
а с кислотами FeO1+x
взаимодействует
с образованием соответствующих солей Fe
(III) (за исключением HCl,
HBr и HI,
дающие соли железа (II)
с несколько меньшей растворимостью, чем соли трёхвалентного железа). Водород
при ~500-600 °С восстанавливает вюстит до металлического
железа, также действуют углерод и монооксид углерода.
Вюстит - FeO.
Синтезом при атмосферном давлении получают фазу (дефицитную по железу) «вюстит»
Fe1-xO
со структурой NaCl. В его
структуре часть ионов Fe2+
замещена ионами Fe3+
так, что два иона Fe3+
замещают три иона Fe2+
с сохранением электронейтральности структуры в целом. Стехиометрический FeO
синтезируют из Fe0.95O
и металлического железа при давлении >36 кбар и температуре 770 °С.
При температуре ~1000 °С состав оксида находится в
интервале Fe0.946O
- Fe0.875O,
а при более низких температурах происходит диспропорционирование на α-Fe+Fe3O4,
так что синтез следует проводить при температурах >570 °С
с последующей закалкой. При температуре около -70 °С
наблюдается переход второго рода, который происходит в интервале температур и
сопровождается возникновением антиферромагнетизма и очень небольшой
структурныой перестройкой с понижением симметрии до ромбоэдрической; параметр
элементарной ячейки меняется с составом почти линейно, например а=4.3010 Å
для 48.56 ат. % железа. Предполагается, что в структуре закалённых образцов
состава Fe0.9O
вакансии располагаются периодически в виде кластеров, окружающих (по тетраэдру)
ту тетраэдрическую пустоту шаровой упаковки ионов О2-, в которую
внедряется один из катионов Fe3+;
отношение числа вакансий к числу катионов в таких пустотах равно ~3.2:1.
Температура плавления вюстита определяется с точностью до +/- 30 °С
в зависимости от степени дефектности оксида. Часто плавлению вюстита
предшествует так называемое предплавление, т.е. плавление эвтектики на основе
оксида и примесей. Для FeO1+x
приводятся следующие температуры плавления, °С: FeO1.05
1371±5, FeO1.056
1374±5, FeO1.10
1388±5, FeO1.15
1406±5, FeO1.20
1424±5. Температура плавления Fe3O4
при повышенном давлении кислорода 1590±10 °С (поскольку на
воздухе он диссоциирует), а Fe2O3
1350±20 °С.
Вюстит диссоциирует на металлическое железо (в твердой фазе) и кислород.
Магнетит (нем. Magnetit, от греч. Magnetis - магнит),
магнитный железняк, минерал, оксид сложного состава FeO×Fe2O3 (Fe3O4); содержит
31% FeO, 69% Fe2O3; 72,4% Fe; часто
присутствуют примеси MgO, Cr2O3, Al2O3, MnO, ZnO и др.
Магнетит - феррит с кристаллической структурой обращенной шпинели - Fe3+(Fe2+Fe3+)O4; т.е. 1/3
катионов занимает тетраэдрические пустоты в кубической плотнейшей упаковке
анионов О2-, а равные количества катионов Fe2+ и Fe3+
располагаются в октаэдрических пустотах. Высокая электронная проводимость Fe3O4 (магнетита)
обуславливается постоянным обменом электронов между ионами Fe2+ и Fe3+,
расположенных в указанных октаэдрических позициях. При температуре -154 °С магнетит становится
антиферромагнетиком, а его симметрия понижается до ромбоэдрической либо еще
более низкосимметричной. Магнетит в зависимости от степени стехиометричности
претерпевает (до диссоциации) несколько фазовых переходов. По существу, это
один и тот же переход низкотемпературной ромбической фазы в кубическую при
-154±2 °C. Этот переход
является переходом первого рода, связанным с упорядочением ионов Fe2+ и Fe3+ в
октаэдрических пустотах структуры шпинели. Для образцов, содержащих катионные
вакансии, этот переход сдвигается в сторону более низких температур (до -163±1 °С), что свидетельствует о
влиянии атомов железа на природу перехода. Высокотемпературный переход при
~570-590 °С на воздухе
связан с окислением магнетита Fe3O4 до α-Fe2O3.
Диссоциация Fe3O4 происходит
с образованием вюстита (тв.) и кислорода.
Гематит (от греч. Haima, родительный
падеж haimatos - кровь), железный блеск, кровавик, широко распространённый
минерал железа Fe2O3; содержит до 70% железа. Гематит
кристаллизуется в тригональной системе. Кристаллы железно-серого цвета с
полуметаллическим блеском. В зависимости от структуры минеральных агрегатов и
формы кристаллических сростков различаются: 1) железный блеск - кристаллы и
крупнокристаллические ростки; 2) железная слюдка - чешуйчатые агрегаты; 3)
железная роза - сростки пластинчатых кристаллов, напоминающие по форме венчик
махрового цветка шиповника; 4) красный железняк - плотные мелкокристаллические
агрегаты красного цвета; 5) красная стеклянная голова - плотные почковидные
скопления; 6) мартит - плотные или рыхлые образования. Твёрдость гематита по
минералогической шкале 5.5-6, плотность 5260 кг/м3. Цвет порошка
вишнёво-красный. При комнатной температуре антиферромагнитен, при -15 °С,
становится ферромагнитным. При нагревании характризуется эндотермическим
эффектом около 680 °С (переходит в γ-Fe2O3).
При нагревании до 1300-1400 °С переходит в магнетит. γ-Fe2O3,
образующийся при нагревании гематита до 950 °С, при охлаждении превращается в α-Fe2O3.
Fe2O3 не
взаимодействует с водой, в сухом водороде восстанавливается до металлического
железа уже при ~400 оС, а в присутствии паров воды восстановление
идет до низших оксидов. Хорошо растворим в минеральных кислотах. Гематит (α-Fe2O3) имеет
структуру корунда (гексагональная плотнейшая упаковка атомов кислорода), при
нагревании диссоциирует на магнетит и кислород. В газовой фазе после первой
стадии диссоциации не обнаруживается атомов железа или молекул оксида железа
[5].
β-Fe2O3. По-видимому,
под β-Fe2O3 понимают две
различные кристаллические фазы. Одна из них - тетрагональная - образуется при
дегидратации
β-FeOOH, а другая
со структурой биксбиита (С-М2О3) может быть получена
гидролизом FeCl3∙6H2O, а также в
виде поверхностной плёнки при разложении трифтороацетилацетоната железа.
γ-Fe2O3. В
структуре этого оксида 21 1/3 ионов Fe3+ статически
распределены по 8 тетраэдрическим и 16 октаэдрическим позициям в элементарной
ячейки шпинели, содержащей 32 иона кислорода, расположенных по мотиву
кубической плотнейшей упаковки. Метастабильный γ-Fe2O3 при
нагревании на воздухе в интервале 520-600 °С (в зависимости от дисперсности и
химической предыстории) необратимо переходит в α-модификацию.
Маггемит (происходит от слов
магнетит и гематит), минерал, магнитная модификация оксида железа γ-Fe2O3.
Обычно содержит примеси FeO и TiO2.
Неустойчив в природных условиях и легко переходит в устойчивый гематит.
Кристаллизуется в квадратной системе (псевдокубической), обладая дефектной
шпинелевой структурой типа магнетита. Твердость по минералогической шкале 5-6;
плотность 4700-4900 кг/м3. Цвет темно-бурый со стальным отливом;
непрозрачен. В природе встречается только в виде микроскопически мелких
выделений в продуктах окисления магнетита, в титаномагнетитах вместе с
гематитом, гидроокислами железа и др.; реже - в бурых железняках и латеритах
как продукт поверхностного выветривания железистых минералов.
Структуры FeO, Fe3O4 и γ-Fe2O3 имеют много
общего. В кубической элементарной ячейке данных оксидов (а~8.5 Å) содержатся
32 атома кислорода (кубическая плотнейшая упаковка) и следующее число катионов:
FeO: 32 иона Fe2+ во всех
октаэдрических пустотах
Fe3O4: 8 ионов Fe3+ в
тетраэдрических позициях, 8 ионов Fe2+ + 8 ионов Fe3+ в
октаэдрических позициях.
- γ-Fe2O3: 21 1/3
ионов Fe3+, статически
расположенных по 24 вышеуказанным позициям.
Таблица 4 - Кристаллографические
данные для различных модификаций оксидов железа
|
Модификация
оксида
|
Пространственная
группа
|
Структура
|
Параметры
элементарной ячейки, Ǻ
|
|
FeO1+x
|
-
|
NaCl
|
a=4.280-4.309
|
|
α-Fe2O3
|
-
|
Корунд
|
а=5.035
с=13.75
|
|
γ-Fe2O3
|
Fd3m или  Дефектная
структура шпинелиа=8.35 Дефектная
структура шпинелиа=8.35
|
|
|
|
Fe3O4
|
-
|
Кубическая
типа шпинели
|
а=8.394
|
Из всего вышеизложенного становится понятным,
почему γ-Fe2O3
и Fe3O4
легко взаимопревращаемы. Осторожным окислением Fe3O4
можно получить γ-Fe2O3,
который переходит обратно в Fe3O4
при нагревании в вакууме до температуры 250 °С. Процесс окисления FeO
®
Fe3O4
®
γ-Fe2O3
можно интерпретировать следующим образом. Анионная подрешетка в FeO
достраивается за счет добавления новых слоёв атомов кислорода в плотнейшую
упаковку. В эти слои мигрируют катионы, что приводит к непрерывному уменьшению
концентрации атомов железа в заданном объеме и увеличению доли ионов Fe3+.
Термические превращения оксидов железа в
низкотемпературной области связаны, как правило, с магнитным упорядочением того
или иного вида. Указывается на низкотемпературные превращения Fe0.947O
(-87±3 °C) и фазовый переход
второго рода у Fe2O3
при -15±2 °C. У Fe2O3
наблюдается также фазовое превращение при 680±10 °С, связанное с переходом в
диамагнитное состояние. Однако авторы [6], исследовавшие многочисленные образцы
α-
и
γ-
Fe2O3
(которая выше 600 °С переходит в α-форму)
не дают прямых свидетельств в пользу этого перехода.
Свойства [8]:
Гидроксид железа III
(Fe(OH)3)
- коричневый, кристаллическая форма - кубический. Плотность=3.4 - 3.9 г/см3.
Переходит в гематит при >500 °С, реагирует с кислотами, горячими
концентрированными щелочами.
Гидроксид оксид железа (α-FeO(OH))
(Гетит) - коричневый, кристаллическая форма - ромбический. Плотность = 4.28 г/см3.
Теряет 0.5 Н2О при 136 °С, растворяется в HCl.
Таблица 5 - Свойства оксидов и гидроксидов
железа
|
Показатель
|
FeO
|
Fe2O3
|
Fe3O4
|
Fe(OH)2
|
Fe(OH)3
|
α-FeOOH
|
|
|
α
|
γ
|
|
|
|
|
|
Цвет
|
Черный
|
Темно-красный
- черно-фиолето-вый
|
Коричн-евый
|
Черный
|
Бл.-Зел.
|
Красно-
Коричне-вый
|
Коричневый
|
|
Сингония
|
Кубич.
|
Триг.
|
Кубич.
|
Кубич.
|
Гекс.
|
|
Ромб.
|
|
Параметры
решетки, нм a
b
c
|
0.4357
|
0.542 α=55.28°
|
0.8339
|
0.839
|
0.324 0.447
|
|
0.46 0.994 0.3
|
|
Число
формульных единиц в ячейке
|
4
|
2
|
|
8
|
1
|
|
4
|
|
Пространст-венная
группа
|
Fm3m
|
R3c
|
Fd3m
|
Fd3m
|
P3m1
|
|
Pbnm
|
|
Т
пл, °С
|
1369
|
1565 (c разл.)
|
|
1594
|
150
200(разл.)
|
350
400(разл.)
|
136
(разл.)
|
|
Плотность,
г/см3
|
5.7
|
5.24
|
4.4-4.88
|
5.18
|
3.4
|
2.44
|
4.28
|
Рассмотрим структуру гидроксид-оксидов железа.
Гётит α-FeO(OH)
имеет такую же структуру как и диаспор α-AlO(OH).
Лепидокрокит γ-FeO(OH)
имеет один тип структуры с бемитом γ-AlO(OH).
Объёмное изображение структуры лепидокрокита показано на рисунке 16. Атомы
кислорода расположены в вершинах каждого октаэдра, а атомы железа - в центрах
октаэдров. Двойные линии обозначают связи О - Н - О. На проекции этой структуры
(рисунок 17) кружки, показанные тонкими линиями, обозначают атомы, лежащие на
с/2 (1.53 Å) выше и ниже
плоскости, в которой находятся атомы, обозначенные жирными кружками; период
повторяемости последних равен с (3.06 Å).
Таким образом, каждый атом железа имеет координационный многогранник в виде
искаженного октаэдра, образованный атомами кислорода, и эти октаэдры объединены
с образованием гофрированных слоёв (трёхмерная каркасная структура,
образованная сочленением по общим вершинам двойных цепочек типа рутила).
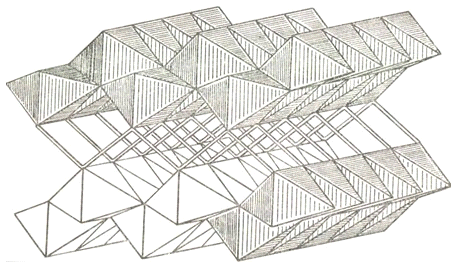
Рисунок 16 - Структура лепидокрокита γ-FeO(OH)
по Эвингу [5]
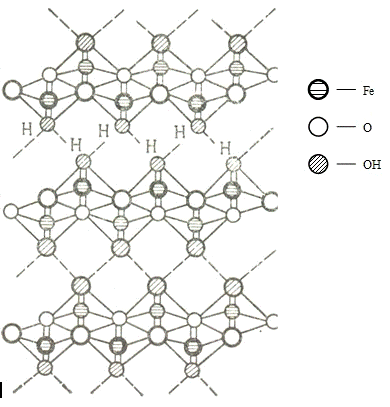
Рисунок 17 - Проекция структуры лепидокрокита γ-FeO(OH)
[5]
Атомы водорода в этой структуре не были
локализованы, однако на основании известного окружения атомов кислорода можно
идентифицировать О- и ОН-группы. Атомы кислорода внутри слоёв находятся на
приблизительно одинаковом расстоянии от четырех атомов железа (два атома железа
на расстоянии 1.93 Å и два - на
расстоянии 2.13 Å), в то
время как атомы кислорода на поверхности слоёв связаны только с двумя атомами
железа (2.05 Å). Расстояние между
атомами кислорода различных слоёв равны всего 2.72 Å,
поэтому очевидно, что на внешней поверхности каждого слоя имеются ОН-группы. В
этой структуре наблюдается образование водородных связей только между
ОН-группами, причем каждая ОН-группа образует две водородные связи.
Образованием связей О - Н - О между ОН-группами
различных слоёв объясняется тот факт, что атомы кислорода соседних слоёв не
накладываются друг на друга плотнейшим образом, хотя внутри каждого отдельного
слоя существует слегка искаженная кубическая плотнейшая упаковка атомов
кислорода. Как видно из рисунков 16 и 17, каждая ОН-группа лежит в той же
плоскости, что и ОН-группы следующего слоя, с которыми она соединена
водородными связями, так что атомы водорода должны располагаться так, как
показано на рисунке 17.
Авторами [20] было показано, что лепидокрокит
свободно переходит в гетит при нагревании в щелочной среде или в растворе FeSO4
но только в присутствии уже сформировавшегося гетита. Этот переход нельзя
отнести к твердофазному, за исключением процессов плавления и кристаллизации.
Данный переход не осуществляется в солях Na2SO4,
CoSO4
и в разбавленной серной кислоте. Функция ионов железа состоит в повышении
растворимой доли лепидокрокита в кислой среде.
Если рассматривать процесс дегидратации гетита,
то согласно авторам [10] он протекает с образованием только одного продукта -
гематита по формуле:
2α-FeOOH
= α-Fe2O3
+ H2O (1)
однако гематит является конечным продуктом
реакции, промежуточное звено которой можно обозначить общей формулой
Fe2-xO3-3x(OH)3x
(x=0: α-Fe2O3;
x=1: Fe(OH)3) (2)
Этот промежуточный продукт назван
гидрогематитом. Основым предположением является то, что гидроксильные группы
занимают позиции О2- в структуре гематита, формируя ассоциации
вакансий в решетке Fe3+.
В процессе дегидратации вода уходит из кристалла
по направлению [010], в кристалле формируется дегидрационные каналы параллельно
кристаллографической оси [001]. Матрица между этими каналами и есть
сформированный гематит. Далее дегидрационные каналы начинают расти и
формируется компактная прослойка гематита на кристаллической поверхности при
этом фронт дегидратации не достигает центра кристалла, т.о. процесс
дегидратации нельзя считать законченным. Компактная прослойка поверхности
гематита является преградой для дальнейшего удлинения дегидрационной зоны,
из-за этого необходимы затраты дополнительной энергии, чтобы превысить барьер и
фронт дегидратации смог приблизиться к центру, до тех пор пока процесс
дегидратации не закончится. В случае очень маленькой частицы дегидратация
закончится прежде чем канал сможет достигнуть критической толщины, таким
образом, дегидрационный барьер не сформируется.
1.4 Применение и получение
композиций на основе оксидных систем
Гидратированные оксиды железа (подразумевается
вся совокупность возможных гидроксидов, оксигидроксидов и собственно оксидов
железа, получаемых в водной фазе) представляют собой большой класс
неорганических соединений, широко распространённых в природе и используемых в
различных областях промышленности (например, при производстве магнитных
материалов, неорганических пигментов, катализаторов и сорбентов, в качестве
исходных веществ при получении ферритов). Оксиды алюминия имеют не меньшее
практическое значение, чем оксиды железа. На основе оксидов алюминия получают
катализаторы для различных процессов, широкий класс сорбентов.
Возросшие требования к магнитным носителям с
высокой плотности записи привели к разработке нового способа получения
неполярных частиц γ-Fe2O3,
являющихся основным материалом для магнитной записи, кроме того, гамма
модификация оксида железа используется в медицине и биотехнологии для создания
полимерных композитов: для разделения клеток, транспорта лекарственных средств
в организме человека, очистке белков и т.д. Есть несколько основных методов
получения γ-Fe2O3.
Один из них заключается в гидротермальном синтезе анизотропных, беспористых
частиц α-Fe2O3
с дальнейшим их переводом в магнитный оксид [2], другой - основан на получении
магнетита Fe3O4
и его последующем окислении при низких тмпературах (не выше 250 °С) в течение
достаточного длительного времени [11].
Авторы [21] показали возможность синтеза γ-Fe2O3
использую микроволновый синтез.
В работе [12] приведен пример получения
суперпарамагнитных и ферромагнитных композитов Fe2О3-SiO2
внедрением частиц оксида железа в решетку диоксида кремния, при применении
золь-гель метода. Такой способ получения композитов в настоящее время
представляет большой интерес в связи с потенциальным применением в областях
хранения информации, получения магнито-оптических твердых устройств, улучшение
визуализации изображения магнитного резонанса и т.д. Однако, несмотря на
популярность основанных на SiO2
материалах, в данной системе сложно получить чистые металлические наночастицы
[13].
Нанокомпозиты представляют большой интерес как в
технологии, так и в фундаментальных исследованиях благодаря их контролируемым и
необычным свойствам. Известный факт, что нанокомпозиты, состоящие из магнитных
металлических наночастиц (ММН) помещенные в немагнитную диэлектрическую матрицу
(НДМ), привлекли внимание благодаря своим новым магнитным свойствам. Несмотря
на то, что на свойства могут влиять не только размер, форма и содержание
наночастиц, но и природа матрицы и взаимодействие между наночастицами и
матрицей, все еще остается проблема приготовления нанокомпозита с ограниченным
распределением по размеру чистых ММН, помещенных в НДМ.
Для получения такого рода чистых ММН, помещенных
в НДМ возможно применять методы коллоидной химии, так как при таком синтезе
прочные и плотные ячейки НДМ могут предотвратить окисление ММН. Если же
получать нанокомпозит путем смешивания металлических наночастиц с веществом
матрицы, но невозможно полностью исключить возможность их окисления и
агломерации в процессе синтеза.
Практический аспект лабораторного исследования
системы AlxFe1-x(OH)3
очевиден. Эта композиция в процессе старения в гидротермальных условиях
чувствительна к любым изменениям соотношения ионов, температуры, давление и рН
гидротермальной среды, более детальное исследование процессов фазовых
превращений в этой системе позволит объяснить многие аспекты, связанные с
природным генезисом алюминий и железосодержащих минералов.
Как уже было сказано, на основе оксида железа и
оксида алюминия возможно создание широкого класса сорбентов. В последнее время
получили широкое распространение исследования направленные на поиск
эффективных, нетоксичных и недорогих сорбентов для очистки вод от фосфора и
мышьяка. Примером этого является работа [14], в которой авторы исследовали
гидратированные наноразмерные оксиды системы TiO2-Fe2O3-Al2O3-H2O
в качестве сорбентов для извлечения фосфат- и арсенат-ионов из водных растворов
в широком интервале рН. Гидратированные оксиды железа и алюминия имеют
достаточно хорошее сродство к фосфатам, арсенатам и арсенитам и тем самым имеют
большие перспективы к использованию в качестве поглотителей фосфатов и мышьяка.
Эти вещества сохраняют высокую селективность при малых содержаниях поглощаемых
элементов и при высоких концентрациях солевого фона. По отношению к фосфатам,
арсенатам и арсенитам они обнаруживают ионообменную функцию, а поэтому пригодны
для многоразового использования, что делает их привлекательными для очистки не
только сточных, но и питьевых и минеральных вод.
1.4.1 Применение методов «мокрой
химии» для синтеза оксидных систем
Известно, что состав и структура оксидов железа,
сформированная в воде, зависит от условий осаждения, таких как концентрация
катионов железа, природа присутствующего аниона и рН. Гидролиз солей железа
сопровождается образованием мономеров и димеров Fe3+,
затем происходит конденсация полимерных образцов. Предполагается, что полимеры,
образующиеся с использованием нитратов не включают нитрат ионы в полимерную
цепь; размер частиц меньше, чем при применении хлоридов в качестве исходных
веществ. Из раствора нитрата обычно получают α-FeOOH, который
переходит в α-Fe2O3
при нагревании, но также было опубликовано, что может быть осажден γ-FeOOH
из растворов нитратов при низкой концентрации железа и низком соотношении OH-
/Fe, который при нагревании переходит в γ-Fe2O3
[12].
Рассматривая систему Al2O3
- Fe2O3
- H2O,
а точнее совместное осаждение гидроксидов железа и алюминия на примере системы AlxFe1-x(OH)3
авторы [15] говорят о взаимном влиянии ионов железа и алюминия приводящие к
изменениям в обоих гидроксидах.
Если не рассматривать мольное соотношение
гироксидов железа и алюминия, то главным фактором влияющим на кристаллизацию
фаз будет являться рН маточного раствора и температура проведения процесса.
В гидротермальных условиях для аморфного Fe(OH)3
свойственна трансформация в гетит (α-FeOOH)
или смесь гетита и гидрогематита (α-Fe2O3∙nH2O).
Введение небольшого количества Al3+
затрудняет образование гетита. Если взять (Al/Fe)<0.25,
то ионы алюминия будут встраиваться по октаэдрическим позициям в решетку
гидрогематита, образую тем самым твердые растворы с ухудшением кристаллизации
при (Al/Fe)<0.18.
При (Al/Fe)>0.25
наряду с алюмогидрогематитом начинает формироваться кристаллический гидроксид
алюминия.
Характерно также влияние ионов железа, находящихся
в системе, на трансформацию аморфного гидроксида алюминия, позволяющее в
гидротермальных условиях формироваться бемиту (γ-AlOOH).
Авторы [15], говоря, что незначительные
отклонения в соотношении Al/Fe
приводят к изменению в формировании продуктов и их кристаллических структур,
исследуют 3 композиции с общей формулой AlxFe1-x(OH)3,
взяв х=0.45; 0.5; 0.55. Для этого необходимые количества солей железа и
алюминия, в качестве которых брались нитраты, осаждали 1М раствором NaOH
до значения рН=10. Далее маточные растворы сутки выдерживались при температурах
20 °С, 60 °С и 100 °С, отфильтровывались, промывались и сушились при комнатной
температуре.
Анализируя результаты работы авторы отмечают,
что при выдержке в 20 °С различий между образцами не наблюдается, при этом
образуется лишь соединение алюминия - байерит (α-Al(OH)3).
При выдержке 60 °С байерит остается единственным соединением только в случае
композиции с х=0.45. В остальных соединениях кроме байерита также присутствует
нордстрандит. В образцах, выдержанных при 20 °С и 60 °С не наблюдалось
кристаллической структуры железосодержащего компонента, из-за этого можно
говорить об угнетающем воздействии ионов алюминия на кристаллизацию соединений
железа.
Наибольшие различия в формировании соединений
для этой серии композиций авторы отмечают в случае термообработке при
температуре 100 °С. Наибольшее количество байерита, сопровождаемое небольшим
количеством гиббсита, наблюдается в случае композиции Al0,45Fe0,55(OH)3.
При равном соотношении гидроксидов железа и алюминия характерно образование
обеих модификаций Al(OH)3.
Хотя содержание в смеси аюмосодержащей
компоненты и будет влиять на формирование соединений железа, аморфный гидроксид
алюминия в присутствии гидроксида железа имеет такой же путь фазовых трансформаций,
как и чистый гидроксид алюминия.
Золь-гель метод:
На сегодняшний день золь-гель метод широко
распространён для получения композиций на основе оксидных систем (Fe2O3,
Al2O3, SiO2 и т.д.). Золь-гель технология
позволяет управляемо формировать композиты желаемого состава с необходимыми
концентрациями легирующих компонентов.
Подобный метод был использован для синтеза
композиций в работе [16] для исследования образцов методами
дифференциально-сканирующей калориметрии. Здесь в качестве исходных реагентов
были использованы шестиводный хлорид алюминия (AlCl3*6H2O)
и четырёхводный хлорид железа (II)
(FeCl2*4H2O).
В качестве вещества-осадителя был взят 0,2 М раствор оксалата аммония ((NH4)2C2O4).
Были сделаны композиции гётита с добавлением алюминия, мольное содержание
которого составило 0%, 10%, 20%, 30%. Авторы использовали карбонат натрия, в
качестве буферной смеси для поддержания рН раствора равного 7. После осаждения
осадок несколько минут промывался дистиллированной водой и ацетоном, после чего
помещался в печь с температурой 110 °С.
В работе [12] при применении золь-гель метода
внедряли частицы оксида железа в решетку диоксида кремния для получения
композитов на основе системы Fe2О3-SiO2.
Кислотно-каталитический золь-гель синтез был реализован путем гомогенизирования
нитрата железа (III)
в этаноле с тетраэтоксисиланом. Авторами брали исходные вещества в таком
соотношении, чтобы получить образцов, в которых мольная доля оксида железа
составляла бы 15%, 20%, 25%, 30 %, 35%. При этом рН растворов в зависимости от
состава находился в интервале 2,1 - 2,4. Образцы выдерживались от 14 до 35 дней
до образования геля, далее сушились и прокаливались при температуре от 300 до
1000 оС. Проанализировав образцы, авторы установили, что в первых
трех образцах содержится γ-Fe2O3,
а в остальных композициях они обнаружили присутствие α-Fe2O3,
при этом γ-Fe2O3
наблюдался в гораздо меньших количествах. Тем самым они показали переход γ-формы
оксида железа в α-форму,
который протекает гораздо легче при увеличении концентрации железосодержащей
компоненты.
D.S.
XUE
с коллегами [13] говоря, что золь-гель метод является одним из способов
приготовления керамической матрицы таких нанокомпозитов, как керамика-керамика
и металл-керамика, применяют его для синтеза чистых Fe-Al2O3
нанокомпозитов. Для приготовления сухого геля смеси FeOOH
и AlOOH использовали
изопропилат алюминия Al(OC3H7)3
и девятиводный нитрат железа Fe(NO3)3·9H2O
c помощью золь-гель
метода синтеза. Авторы полагают, что неорганическая сеть алюминия, содержащая
частицы железа может быть синтезирована путем восстановления сухого геля при
различных температурах в атмосфере водорода в течение 1 часа. Нанокомпозиты с
молярными соотношениями Fe:Al=1:2, 3:8, 1:4, 3:16, и 1:8 были приготовлены
путем контроля стехиометрического соотношения реагентов. Ранее нанокомпозиты Fe-Al2O3
были получены золь-гель методом [19], однако при этом образцы имели высокое
содержание оксидов Fe2O3
и Fe3O4,
и наивысшая чистота ионов металла (74 %) была достигнута после восстановления
при 1000 °С. Происходит переход оксидов в металлическое железо в Fe-Al2O3
нанокомпозитах, но при этом 16% оксида не подверглись восстановлению.
В работах [2,17] исследовали гидротированные
оксиды железа (гидроксиды, оксигидроксиды и оксиды железа, получаемые в водной
фазе). При этом к исходным реагентам FeCl3∙6H2O
и Fe(NO3)3∙9H2O
для получения гидроксида железа (III)
добавлялось вещество-осадитель (NH4OH
или NaOH) до
значения величнины рН (7.0-12.3).
В работе [18] авторы исследовали процессы
гидролиза в водном растворе нитрата железа. В качестве исходного реагента
бралась соль Fe(NO3)3∙9Н2О. Исследования
проводили для двух способов гидролиза. По первому методу к нитрату железа
приливалась дистиллированная вода, раствор помещали в печь при температуре 65
°С. Второй метод отличался от первого тем, что к исходной соли приливалась не
холодная вода, а вода, предварительно нагретая до 65 °С, далее получившийся
раствор также термостатировался при температуре 65 °С. Авторы
показали механизм перехода гетита в гематит по трём основным шагам,
представляющими собой осаждение гетита, гетерогенное образование гематита и
рост гематита.
Гитротермальный синтез:
Если рассматривать гидратированные оксидные
системы железа и алюминия (Fe2O3-Al2O3-H2O),
то на сегодняшний день существует не так много сведений о влиянии параметров
гидротермального синтеза на фазовый состав и морфологию частиц данных оксидов.
Одними из работ, посвященных кристаллизации
гидроксида железа (III)
в гидротермальных условиях, являются [2,17]. Авторы, получив гидроксид железа (III)
описанным выше золь-гель методом, провели гидротермальную обработку суспензий,
как в маточном растворе, так и после предварительной отмывки дистиллированной
водой осадка Fe(OH)3
от растворимых солей. Затем осадок диспергировали в дистиллированной воде и
далее суспензию повторно доводили до заданной величины рН (6.0-12.0), однако в
[17] авторы в суспензию ввели необходимое количество регуляторов роста, в
качестве каковых применяли добавки карбоновых кислот (щавелевой, винной или
лимонной) и фосфоновых кислот (оксоэтилендифосфоновой, а также ряда α-амино-фосфоновых
кислот с общей формулой (NH2)(R)P(O)(OH)2,
где R - радикалы этил,
пропил, н-бутил, изобутил, бензил, оксибензил и салицил). Подготовленные таким
образом образцы помещались в автоклав и термостатировались определенное время
(0-24 ч. [2] и 1-5 ч. [17]) при заданной температуре (90-200 °C
[2] и 120-200 °C [17]).
Авторы [2] показали, что введение щелочи в
раствор хлорида железа (III)
сразу приводило к образованию в нём рассеивающих центров радиусом 200-300 нм.
Отмытый и высушенный осадок Fe(OH)3
являлся рентгеноаморфным, при этом на дифрактограмме наблюдались два широких
максимума в области 2θ=34,9°
и 61,9°, которые по мнению авторов соответствуют двухлинейному ферригидриту.
Проведя старение суспензии Fe(OH)3
в маточном растворе при 90 °С было показано, что кристаллическая фаза α-Fe2O3
появляется уже после 3-х часовой обработки, дальнейшее увеличение времени
выдержки приводит к увеличению доли кристаллической фазы при незначительном
увеличении областей когерентного рассеяния. Увеличение температуры значительно
ускоряет процесс кристаллизации, одновременно увеличивая размер ОКР.
2. Цель и задачи работы
На основании оценки достигнутого уровня знаний
по рассматриваемой проблеме можно сформулировать цель выполняемой работы:
определение характера влияния параметров
осаждения (тип исходной соли, соотношение компонентов, рН) и гидротермальной
обработки Fe(OH)3,
Fe2O3∙nH2O,
γ-FeOOH
и композиций на основе системы Fe2O3-Al2O3-H2O
(рН, температуры, продолжительности гидротермальной обработки) на фазовый
состав, дисперсность образующихся частиц. Особый интерес при проведении
исследований в этом направлении представляют термохимические аспекты синтеза и
поведения при нагревании рассматриваемых материалов.
Обозначим основные задачи, которые необходимо
решить в данной работе:
получение композиций на основе систем Fe2O3-H2O
и Fe2O3-Al2O3-H2O
методом совместного осаждения.
гидротермальная обработка полученных композиций
при различных температурах.
проведение рентгенофазового и термического
анализов образцов.
идентификация образующихся соединений.
выявление областей устойчивости различных форм
оксидов, оксигидроксидов и гидроксидов в исследуемой системе.
определение наличия или отсутствия взаимного
влияния компонентов смеси.
3. Экспериментальная часть
.1.1 Рентгенофазовый анализ
Фазовый состав образцов контролировали методом
рентгенофазового анализа (РФА) с использованием рентгеновского дифрактометра
ДРОН-3М на CoKα-излучении
(λ=0.178897
нм.).
Для анализа, материал проб растирали с помощью пестика в агатовой ступке до
пудрообразного состояния. Подготовленный таким образом материал набивался в
кювету и вручную подпрессовывался, поверхность выравнивалась с помощью стекла.
Съемку проводили в интервале углов 2θ, равном
10-80° с шагом сканирования 0.02°, время съемки в точке - 1 сек. Условия
съемки: напряжение - 38 кВ, ток - 18 мА. Данные об интенсивности в зависимости
от угла получали в виде числового файла.
Идентификация пиков на дифрактограмме проводилась
с помощью программного комплекса PDWin
4.0. Данная программа предназначена для работы с базой порошковых дифракционных
данных, которая основана на картотеке PDF2. Порошковый дифракционный файл (PDF)
представляет собой коллекцию рентгенограмм однофазных образцов в виде таблиц
межплоскостных расстояний и относительных интенсивностей. Рентгенофазовый
анализ образцов сводился к определению серии межплоскостных расстояний и
сравнению их со справочными данными.
Съемка образца с эталоном (эталонирование съемки).
Стандарт используют для устранения систематических ошибок Δ2θ
из
измеренных значений углов отражения. Источниками ошибок являются неточная
юстировка прибора (неточная установка нулевого положения счетчика, смещение
поверхности образца с оси гониометра), проникновение лучей вглубь образца и др.
В качестве эталона используются вещества, для которых надежно определены
параметры решетки (германий, кремний, кварц, хлористый натрий и др.).
Предварительно снимают рентгеновскую дифрактограмму чистого образца для
знакомства с его дифракционной картиной. Затем подбирают эталон, большинство
линий которого не перекрывается с линиями исследуемого вещества. Количественное
соотношение вещество: эталон берется в соответствии с их симметрией и
рассеивающей способностью. Чем симметричнее и тяжелее фаза, тем меньше ее
требуется. Приблизительно оценив необходимое количество эталона (1/10, 1/5,
1/3), порошки образца и эталона взвешивают, перемешивают в ступке и снимают
пробную рентгеновскую дифрактограмму. Если одна из фаз дает слишком слабую
дифракционную картину, содержание ее в смеси увеличивают.
В работе с образцами исследуемой системы в
качестве эталона использовался кремний.
Расчет размера области когерентного рассеяния
(ОКР) производился по величине уширения дифракционного максимума на половине
высоты пика с использованием формулы Шерера:
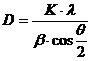 , (3)
, (3)
где D - размер
частиц, нм; λ
- длина
волны, нм; K - константа
(величина K зависит от
способа, которым определены уширения линии и формы кристаллов, в данном случае K≈1); β - ширина
кривой распределения интенсивности на половине высоты максимума рефлекса; θ - угол Брэгга.
.1.2 Сканирующая электронная
микроскопия и рентгеноспектральный микроанализ
Микроструктуру, элементный состав образцов
определяли методами сканирующей электронной микроскопии (СЭМ) и
рентгеноспектрального микроанализа (РСМА) на сканирующих электронных
микроскопах ABT-55 и Hitachi S-570, оснащенных микрозондовыми приставками Link
Analytical 10000/S85.
Все микрофотографии были получены в режиме
рельефа (детектор вторичных электронов).
На каждом отобранном для анализа образце
производили съемку спектральной характеристики, по которой определяли его
интегральный состав. Количественный анализ проводили путем сравнения интенсивностей
спектров эталонного (особо чистые, специальным образом подготовленные вещества)
и исследуемого образцов. Используемые при этом стандарты (Al,
Fe, Cl)
являлись частью набора, которым снабжена приставка Link.
Предел уверенного определения элемента зависит
от его порядкового номера в периодической системе Менделеева и колеблется от
0.1 масс. % для легких элементов до 0.3 масс. % для тяжелых. Обнаружение
меньших количеств элементов является ненадежным.
3.1.3 Комплексный термический анализ
Термические превращения в образцах изучали с
помощью системы комплексного термического анализа STA 429CD фирмы NETZSCH,
Германия, совмещенной с масс-спектрометром MS403C
(метод подключения - капиллярное). Приборы для комплексного термического
анализа - это одновременное получение данных дифференциально-сканирующей
калориметрии (ДСК) и термогравиметрии (ТГ). Значения температур соответствующих
термических эффектов фиксировали по началу пиков на кривых ДСК, определенному
методом пересечения касательных к ветвям базовой кривой и кривой термического
эффекта. Система для анализа газов MS403C
предназначена для качественного анализа компонентов газовой смеси, выделяющейся
в процессе термогравиметрического анализа. Система состоит из следующих частей:
безмасляной вакуумной системы, квадрупольного масс-спектрометра (QMA200),
область: 0-300 аем, линии подачи газов с контролируемым нагревом и со сменным
капилляром и ячейкой ввода газа, программного обеспечения для измерения и
расчета. Квадрупольный масс-спектрометр снабжен источником с пересекающимися
пучками для получения высокой линейности сигналов при низкой фрагментации
молекул и детектором channeltron
(SEM) для быстрого и
точного анализа данных.
Условия съемки: материал используемых тиглей -
корунд, стандартная масса образцов составляла 20 мг, температурная программа:
от 35 до 1000 °С, скорость нагрева - 10 °C/мин,
исследования проводили в инертной атмосфере (аргон) и атмосфере воздуха, поток
инертного газа (Ar)
- 30 см3/мин, поток воздуха (воздушный компрессор) - 30 см3/мин.
Для обработки данных ДСК/ТГ/масс-спектрометрии
использовали стандартное программное обеспечение Proteus
Analysis.
3.1.4 Метод статической магнитной
восприимчивости
Магнитную восприимчивость исследованных
препаратов измеряли по методу Фарадея. Метод Фарадея основан на следующем: при
помещении образца в неоднородное магнитное поле на него действует сила,
направленная вдоль (или против) градиента поля:
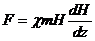 , (4)
, (4)
где χ - магнитная
восприимчивость;- масса навески;- напряженность магнитного поля
Метод Фарадея является
относительным, так как сравниваются силы, действующие на исследуемое вещество и
стандартное вещество при условии постоянства 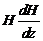 .
.
Этот метод чувствителен и пригоден
для измерения как пара-, так и диамагнитных веществ. Он имеет ряд преимуществ
перед другими методами: небольшие количества вещества для измерений,
возможность работы с порошками, несущественность однородности упаковки.
Характеристика установки:
Установка полупромышленного производства
предназначена для измерения пара- и диамагнитных веществ. Основными частями
установки являются электромагнит с системой питания, электронные микровесы,
криостат, система термостатирования образца и вакуумная установка.
Напряженность поля с постоянным
коэффициентом стабилизации меняется в пределах от 8280 Э до 100 Э. Источник
питания обеспечивает поддержание силы тока в обмотках электромагнита при
заданном значении с точностью 0,02 %.
Гистерезисные явления не сказываются
на измерениях, поскольку сила тока в обмотках электромагнита всегда меняется по
заданному циклу: увеличивается до тока насыщения, затем снижается с
последовательным установлением ряда фиксированных значений.
Сила, действующая на образец в
магнитном поле, измеряется электронными микровесами модели УМВМ № 01 (ЭМ-1-3М).
Максимальная нагрузка на весы - 5 г. Они имеют несколько диапазонов измерения,
характеристики которых приведены в таблице 6.
Таблица 6 -
Характеристика весов установки
|
Диапазон
|
Диапазон
измерений, мг
|
Цена
деления шкалы, мг/дел
|
Чувствительность
весов на данном диапазоне, мг
|
|
50
|
0-50
|
0.50736
|
0.1001
|
|
20
|
0-20
|
0.2011
|
0.02
|
|
5
|
0-10
|
0.10065
|
0.02
|
|
1
|
0-1
|
0.0108
|
0.002
|
Криостат из кварцевого стекла имеет конструкцию,
позволяющую проводить измерения магнитной восприимчивости в интервале
температур 77 - 400 K. Температуру регистрировали с помощью хромель-алюмелевой
термопары. Термостатирование проводили с точностью ±0,5 K. Необходимая
температура достигается с помощью терморегулятора ВРТ-3, включенного в
нагревательную цепь печи. Вакуум в системе создается с помощью форвакуумного
насоса типа РВН-5Д. В качестве теплоносителя при измерениях используется
осушенный гелий, который вводится в откачанную до 0,1 мм рт. ст. (0,13 Па)
систему с помощью дозировочного устройства. Величину остаточного давления
контролируют по показаниям вакуумметра ВИТ-2.
Порядок проведения измерений:
Тщательно растертый порошок препарата помещали в
кварцевую ампулу диаметром 4 - 5 мм. С помощью специального шаблона проверяли
постоянство объема вещества во избежание дополнительных ошибок в величине
магнитной восприимчивости. Величину навески определяли с точностью ±5·10-5 г.
Постоянство нулевой точки весов достигали, изменяя вес дополнительного груза.
Подвешенную к весам ампулу помещали в криостат.
Предварительно определяли силы взаимодействия
пустой ампулы с магнитным полем при его фиксированных значениях. Затем систему
откачивали и в нее запускали гелий. Измерения проводили следующим образом:
после приведения в положение равновесия весов при выключенном магнитном поле,
включали систему питания электромагнита и измеряли силы (по показаниям весов),
действующие на образец при фиксированных значениях напряженности магнитного
поля: 7240, 6330, 5230 и 3640 Э.
Расчет удельной магнитной восприимчивости
проводили при помощи относительного метода, где в качестве стандартных веществ
с известной величиной магнитной восприимчивости использовали сульфат никеля и
дифторид кобальта. Оба стандартных вещества были получены из ВНИИ им. Д.И.
Менделеева и имеют постоянные удельные магнитные восприимчивости:
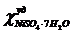 = 16,9·10-6 см3/г;
= 16,9·10-6 см3/г;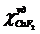 = 103,4·10-6
см3/г.
= 103,4·10-6
см3/г.
Расчет магнитной восприимчивости
образцов проводили по формуле:
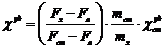 , (5)
, (5)
где Fx - сила, действующая на ампулу
с веществом (в условных единицах),a - сила, действующая на пустую
ампулу;cт - сила, действующая на ампулу со стандартным веществом;ст
- масса стандартного вещества;x - масса исследуемого вещества;
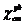 - удельная восприимчивость
стандартного вещества.
- удельная восприимчивость
стандартного вещества.
Измерения магнитной восприимчивости
каждого образца проводили при 16 фиксированных значениях температуры от 77 до
400 K.
оксид алюминий железо
микроанализ
3.2 Объекты исследования
.2.1 Получение исходных композиций
В качестве реактивов использовали FeCl3∙6H2O
(«х.ч.»), Fe(NO3)3∙9H2O
(«х.ч.»), AlCl3∙6H2O
(«х.ч.»), Al(NO3)3∙9H2O
(«х.ч.»), 25,5 %-ный водный раствор гидроксида аммония NH4OH
(«ос.ч.») и дистиллированную воду.
Композиции FexAl1-x(OH)3
получали нейтрализацией 0,5-1 М растворов FeCl3
(Fe(NO3)3)
и AlCl3
(Al(NO3)3)
водным раствором гидроксида аммония до заданной величины рН (8,0-9,0). Значение
этой величины контролировали по изменению окраски полоски универсального
индикатора и при помощи лабораторного рН-метра. Далее полученный осадок
промывался дистиллированной водой при помощи вакуум-фильтра до отсутствия в
промывных водах соответствующего аниона (Cl-
или NO3-).
Их отсутствие проверялось по качественной реакции с нитратом серебра (AgNO3)
(для Cl-)
и дифениламином (для NO3-).
Таким способом были получены образцы, различающиеся между собой мольным
соотношением катионов Fe3+
и Al3+,
фактическое соотношение которых контролировали при помощи рентгеноспектрального
микроанализа (таблица 7).
Далее образцы высушивались при комнатной
температуре и подвергались гидротермальной обработке.
В качестве реперной была использована система Fe2O3
- H2O. Гидратированные оксиды железа получали нейтрализацией 0.5-1 М
растворов FeCl3, Fe(NO3)3 водным раствором
гидроксида аммония до заданной величины рН (8.0-9.0). Далее обработку суспензии
и диспергированного порошка проводили по аналогичной схеме, что и для
композиций FexAl1-x(OH)3.
Таблица 7 - Состав исследуемых композиций
|
Обозначение
образца
|
Заданное
соотношение Fe3+ : Al3+
(композиции, полученные из растворов FeCl3 и AlCl3) , мол. %
|
Соотношение
Fe3+ : Al3+ по данным
РСМА, мол. %
|
|
F1
|
100:0
|
100:0
|
|
F2
|
100:0
|
100:0
|
|
F3
|
100:0
|
100:0
|
|
FA1
|
80:20
|
71.2:28.8
|
|
FA2
|
50:50
|
36.7:63.3
|
|
FA3
|
20:80
|
17.7:82.3
|
|
FA4
|
10:90
|
10.1:89.9
|
|
FA5
|
5:95
|
6.2:93.8
|
|
Обозначение
образца
|
Заданное
соотношение Fe3+ : Al3+
(композиции, полученные из растворов Fe(NO3)3
и Al(NO3)3,
мол. %
|
Соотношение
Fe3+ : Al3+ по данным
РСМА, мол. %
|
|
F4
|
100:0
|
100:0
|
|
FA6
|
50:50
|
37.3:62.7
|
3.2.2 Гидротермальная обработка
образцов
Сущность метода гидротермального синтеза состоит
в воздействии на объект исследования экстремальных условий (высоких давлений и
температур). Гидротермальный синтез неорганических соединений базируется на
способности водных растворов при высокой температуре и высоком давлении
(гидротермальные растворы) растворять нерастворяемые при обычных условиях
вещества [22].
Для проведения гидротермального синтеза бралась
навеска образца, равная 0,5 г. и помещалась в автоклав (рисунок 18). Под
лабораторным автоклавом понимается герметически закрытый сосуд, в котором
исследуемые вещества подвергаются воздействию высокого давления,
непосредственное создание которого происходит за счет нагревания воды и водных
растворов. Исходные вещества, как и продукты реакции, не выводятся из автоклава
до конца опыта.
Автоклав, используемый в работе, рассчитан на
максимальную температуру 225 °С и давление 25 МПа.
Объём воды (VH2O)
для создания необходимого давления рассчитывался по формуле:
VH2O
= (Vтигля
- Vпорошка)∙КЗ, (6)
где КЗ - коэффициент заполнения (таблицы
Кеннеди)
Vтигля
- объём используемого тигля = 16 мл.
Vпорошка
- объём загружаемого образца. Рассчитывается по формуле (2) исходя из взятой
навески образца (mпорошка)
и плотности порошка (ρпорошка):
Vпорошка=mпорошка/ρпорошка (7)
Если порошок состоял из нескольких компонентов
(как в случае композиций Fe:Al),
то общая плотность порошка вычислялась по формуле:
ρобщая=ρкомпонента
А∙Хкомпонента
А + ρкомпонента
Б∙Хкомпонента
Б, (8)
где ρкомпонента
А, Б - плотность соответствующего компонента
Хкомпонента А, Б - мольное содержание
соответствующего компонента в смеси.
Коэффициент заполнения выбирается исходя из
температуры, при которой будет проходить синтез и давления, которое необходимо
создать в автоклаве. Параметры гидротермальной обработки и значения
коэффициента заполнения приведены в таблице 8.
Таблица 8 - Параметры гидротермальной обработки
и значения коэффициента заполнения
|
Температура
синтеза, °С
|
Давление
в автоклаве, МПа
|
Коэффициент
заполнения
|
|
160
|
15
|
0.9023
|
|
170
|
15
|
0.8953
|
|
190
|
15
|
0.8813
|
|
210
|
15
|
0.8629
|
Процесс заполнения и подготовки автоклава: в
тефлоновый тигель автоклава помещается проба образца затем медленно приливается
примерно половина необходимого объёма воды. Полученную суспензию хорошо
перемешивают стеклянной палочкой и, далее, при постоянном перемешивании
доливается оставшееся количество воды. Автоклав закрывается, при этом, для
повышения герметичности, все резьбовые соединения смазываются графитной
смазкой.
Автоклав помещается в печь, температура в
которой равна комнатной. Печь выходит на заданный режим работы, тем самым,
позволяя автоклаву полностью прогреться, исключая какие-либо значимые градиенты
по температуре внутри него.
Продолжительность гидротермальной обработки от 1
до 6 часов. По истечении необходимого времени автоклав вынимается из печки и
охлаждается при комнатной температуре.
Образцы, извлеченные из автоклавов, сушились при
температуре 75 °С.
Процесс получения образцов в виде схемы -
рисунок 19.
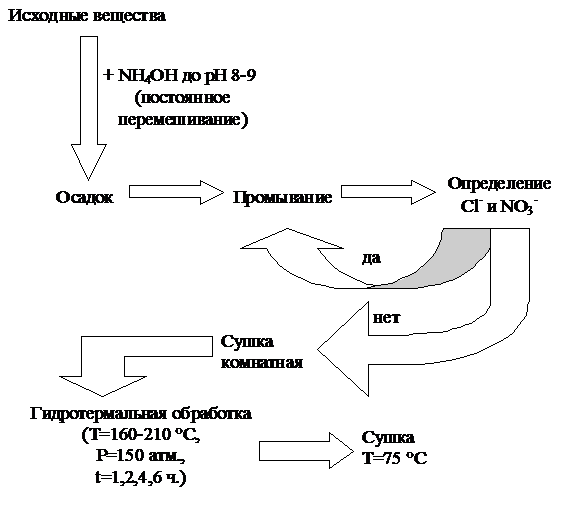
Рисунок 19 - Схема получения
образцов
4. Результаты и обсуждение
.1 Анализ исходных композиций
Для начала рассмотрим отдельно
осажденный гидроксид железа. На рисунке 20 приведены рентгеновские
дифрактограммы гидроксида железа, осажденного из различных солей.
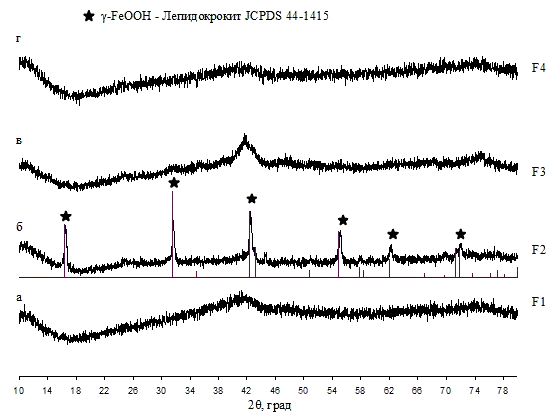
Рисунок 20 - Рентгеновские
дифрактограммы осажденного гидроксида железа
По данным РФА композиции F1,
F3 и F4
рентгеноаморфны. На рентгеновской дифрактограмме «б» образца F2
наблюдаются рентгенографические максимумы соответствующие γ-FeOOH
(лепидокрокит).
Таким образом, на процесс фазообразования влияет не столько выбор типа исходной
соли (F1, F2
и F3 - из раствора FeCl3,
F4 - из раствора Fe(NO3)3)
и pH суспензии, сколько
скорость, с которой происходит осаждение (гидролиз) (изменение pH
среды, pH среды в
начальный момент времени, что происходит при единовременном добавлении
осадителя) и, соответственно, зародыши какой фазы образуются в начальный
момент.
Вместе с тем на рентгенограммах для образцов F1,
F3 и F4
можно выделить два широких максимума в областях 2θ
= 42.8° и 2θ = 73.7°, которые
соответствуют двухлинейному ферригидриту - аналогичный результат был получен и
авторами [2, 17]. В этом случае определение размера ОКР затруднено из-за
большой ширины пика. Была сделана попытка определения размера частиц
(агломератов) с помощью метода динамического светового рассеяния (лазерный
анализатор размеров частиц Horiba
LB-550, Япония).
Результаты измерений показали, что средний размер частиц (агломератов)
составляет около 3 мкм. Сопоставление полученных данных с результатами РФА
указывает на то, что аморфные первичные частицы сильно агломерированы.
Двухлинейный ферригидрит был описан [23, 24].
Непосредственно ферригидритами в минералогии называют твердые полиядерные фазы
чистых кристаллов оксигидроксидных солей и оксигидроксидов с меняющимися
кристаллическим и магнитным поведениями [24]. Общую формулу можно представить в
виде HFe5O8∙4H2O или Fe4O5(OH)2∙2.5H2O.
Авторы [23] сопоставляли экспериментальные данные дифракции электронов с
моделью синтетического двухлинейного ферригидрита, симулирующего дифракцию
электронов единичного кристалла. Результат анализа показал, что часть
синтетического ферригидрита содержит в себе весьма беспорядочно расположенные
нанокристаллы с гексагонально и кубически плотно-упакованными слоями ионов О2-
и ОН-. Структура с кубической упаковкой определяет маггемит и имеет
25 % ионов Fe3+
в тетрагональных позициях. Структура с гексагональной упаковкой соответствует
удвоенной цепочке ионов Fe3+
на разделенных гранях октаэдра, каждый октаэдр разделен одной гранью, двумя
ребрами и тремя углами смежных октаэдров.
Известно, что ферригидрит обычно возникает в
условиях быстрого окисления иона Fe2+ в почти нейтральной среде с
участием железобактерий или путем гидролиза иона Fe3+ в растворе с
рН 8-9. Путем естественного старения ферригидрит переходит в гематит, чему
способствуют содержащиеся в растворе органические кислоты, а при пониженной
концентрации кислорода - в гётит-гидрогётит. Чаще ретгеноаморфен или
гематитоподобен.
Морфология образцов (детектор вторичных
электронов, режим рельефа) определена методом сканирующей электронной
микроскопии (СЭМ) на сканирующем электронном микроскопе Hitachi S-570 (рисунки
21 - 23). Из приведенных микрофотографий Можно заключить, что, несмотря на
сильную агломерацию, минимальный размер агломератов, который удалось
зафиксировать данным методом, составляет менее 100 нм. Вероятнее всего, размер
частиц на порядок меньше этого размера. Необходимо проведение дополнительных
исследований методом просвечивающей электронной микроскопии для прояснения
вопроса о размере и морфологии отдельных частиц.
На рисунке 24 представлены рентгеновские
дифрактограммы для композиций на основе системы Fe2O3−Al2O3−H2O
с различным мольным содержанием катионов железа и алюминия. Дифрактограмма «в»
снималась с внутренним эталоном, в качестве которого использовался кремний.
Следует отметить, что существенного смещения рентгенографических максимумов
относительно эталонных линий не отмечено. На дифрактограммах образцов FA2,
FA3, FA4,
FA5 присутствуют
рентгенографические максимумы, соответствующие α- и
γ-Al(OH)3
(байерит и гиббсита соответственно). Образец FA1
с наибольшим количеством железосодержащего компонента является рентгеноаморфным
(можно выделить только широкие максимумы в областях 2θ
= 42.8°
и 2θ
= 73.7°,
как и в случае чистого Fe(OH)3
- F1, F3
и F4). По данным РСМА
соотношение Fe3+
: Al3+
в данном образце составляет 71.2 : 28.8 мол. %, по-видимому, отсутствие на
дифрактограмме максимумов соответствующих α- и
γ-Al(OH)3,
связано не только с эффектом разбавления, но и с тем, что достаточно большое
количество железосодержащего компонента препятствует кристаллизации
алюмосодержащего компонента.
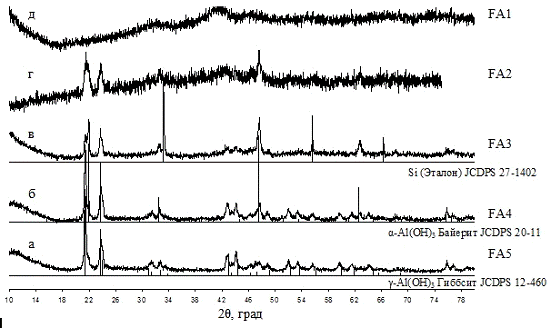
Рисунок 24 - Рентгеновские дифрактограммы
исходных композиций
Анализ дифрактограмм позволяет заметить, что в
зависимости от количества алюмо- и железосодержащего компонентов соотношение
между образующимися фазами соединений алюминия будет разным, об этом можно
судить по интенсивностям пиков на дифрактограммах. В образцах «а» и «б» явно
доминирует гиббсит, в то время как в образцах «в» и «г» преобладает байерит.
4.2 Анализ полученных образцов
.2.1 Рентгенофазовый анализ
Полученные образцы подвергались гидротермальной
обработке в интервале температур 160-210 °С при давлении 15 МПа,
продолжительность изотермической выдержки от 1 до 6 часов. Результаты
рентгенофазового анализа образцов приведены на рисунках 25-32.
Для системы Fe2O3
- H2O
приведем рентгенограмму образца F1
после гидротермальной обработке при температуре 160 °С и выдержке 1-4 часов
(рисунок 25) и рентгенограмму образца F4
после гидротермальной обработке при аналогичных параметрах (рисунок 26).
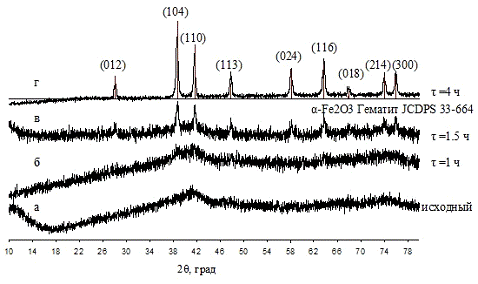
Рисунок 25 - Рентгеновские дифрактограммы
образца F1 исходного и после
гидротермальной обработки (Т=160 °С, Р=150 атм., τ
=1;1.5;4 ч)
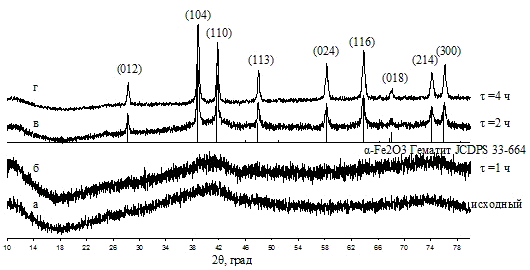
Рисунок 26 - Рентгеновская дифрактограмма
образца F4 исходного и после
гидротермальной обработки (Т=160 °С, Р=150 атм., τ
= 1;2;4 ч)
Сравнив рентгенограммы, представленные на
рисунках 25 и 26, можно констатировать, что образцы (различающиеся между собой
только типом исходной соли) ведут себя схожим образом. После 4-х часов
гидротермальной обработки на рентгенограммах проявляются только рефлексы
гематита с полностью сформировавшейся кристаллической структурой примерно одинаковой
интенсивности. Если повышать температуру гидротермальной обработки, то это
будет сказываться на скорости формирования гематита, который будет наблюдаться
уже после часа выдержки и на увеличении размеров областей когерентного
рассеяния (ОКР).
В работе [2] было указано, что соединения
железа, осажденные из нитратов, имеют меньший размер кристаллитов, чем
соединения железа, осажденные из хлоридов. Связано это с тем, что нитрат-ионы
не встраиваются в кристаллическую структуру, в отличии от хлорид-ионов. В
данной работе это не подтверждается.
Авторами [2] установлено, что при
гидротермальной обработке суспензий Fe(OH)3
(в отсутствие каких-либо добавок) основным фактором, определяющим фазовый
состав, морфологию и дисперсность получаемых продуктов, является рН. При
температуре 160 °С в интервале рН 6-8 (особенно при рН=7) в основном образуются
частицы α-Fe2O3.
Дальнейшее увеличение рН приводит к увеличению среднего размера частиц α-Fe2O3.
На рисунке 27 приведена рентгенограмма образца F2
после гидротермальной обработки. Можно видеть, как с увеличением времени
выдержки количество γ-FeOOH
в образце уменьшается, при этом образуется α-Fe2O3.
Наиболее резкие изменения в образце происходят между 2-мя и 4-мя часами
термостатирования, что хорошо видно из дифрактограмм «в» и «г».
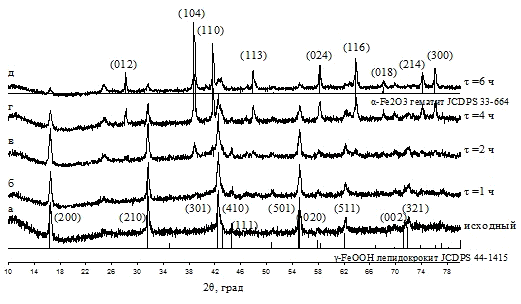
Рисунок 27 - Рентгеновские дифрактограммы
образца F2: исходного и
после гидротермальной обработки (Т=160 °С, Р=15 МПа, τ=1,2,4,6
ч)
Для сравнения образец F2
подвергся простой термообработке при той же температуре, при которой проводился
гидротермальный синтез - 160 °С. Время выдержки составило 4 часа.
Образец спрессовывали в таблетку, которую
помещали в корундовый тигель. Тигель ставили в печь, температура в которой была
равна комнатной, затем выводили на заданный режим. Таким образом были
воспроизведены температурные параметры гидротермального синтеза.
После термообработки был проведен
рентгенофазовый анализ, результаты которого приведены на рисунке 28. Для
наглядности на рисунке так же были показаны рентгенограмма этого же образца в
исходном состоянии и после гидротермального синтеза при данной температуре.
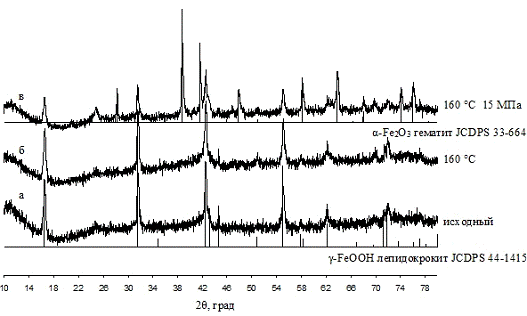
Рисунок 28 - Рентгеновские дифрактограммы
образца F2: исходного (а),
термообработанного - 160 °С, 4 часа (б) и гидротермально обработанного - 160
°С, 15 МПа, 4 часа (в)
Как видно из дифрактограмм «а» и «б» на рисунке
28, термообработанный на воздухе образец практически не отличается от
исходного, и чтобы наблюдать какие-нибудь изменения необходимо увеличивать либо
температуру, либо время выдержки.
Проведение процесса при повышенном давлении
способствует быстрейшему формированию соединений.
Система Fe2O3-Al2O3-H2O.
На рисунках 29, 30, 31 приведены рентгеновские
дифрактограммы композиций FA3,
FA2 и FA1
соответственно. Все эти композиции гидротермально обрабатывались при одинаковых
условиях. При этом в образцах FA3
и FA2 изменения в
фазовом составе наблюдались уже при 160 °С, а наиболее показательные
трансформации происходили при повышении температуры со 170 °С до 190 °С, что и
отражено на рисунках 29 и 30. При 2-х часовой изотермической выдержке при
повышении температуры уже видно образование γ-AlOOH - бемита,
а при 6-ти часовой (FA3)
или уже при 4-х часовой (FA2)
выдержке начинает образовываться гематит. При этом в случае образца с мольным
содержанием FA5 пока точно
неизвестно какая фаза (гиббсит или байерит) первой подвергается дегидратации с
образованием бемита.
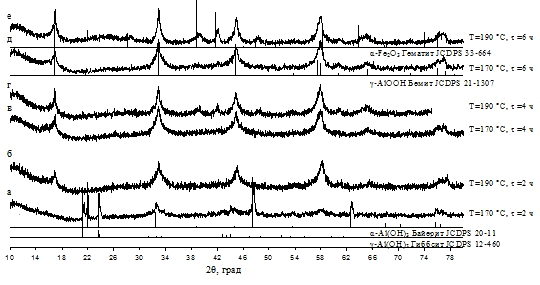
Рисунок 29 - Рентгеновские дифрактограммы
образца FA3 после
гидротермальной обработки при температурах 170 и 190 °С и времени выдержки τ
= 2,4,6 ч
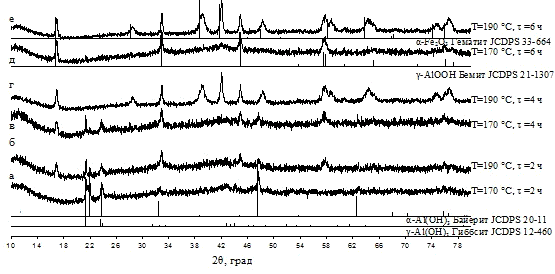
Рисунок 30 - Рентгеновские дифрактограммы
образца FA2 после
гидротермальной обработки при температурах 170 и 190 °С и времени выдержки τ
=2,4,6 ч
Образец F1,
являясь исходно рентгеноаморфным, не претерпевает никаких изменений при
температурах синтеза 170 и 190 °С. И только при температуре 210 °С в образце
начинает формироваться кристаллическая структура (дифрактограмма «г», рисунок
31). Однако и в этих условиях необходимо выдерживать композицию достаточно
продолжительное время, чтобы наличие кристаллической фазы в образце четко
проявлялось на дифрактограмме. При этом появляются рефлексы только соединения
железа - гематита (дифрактограмма «д» на рисунке 31).
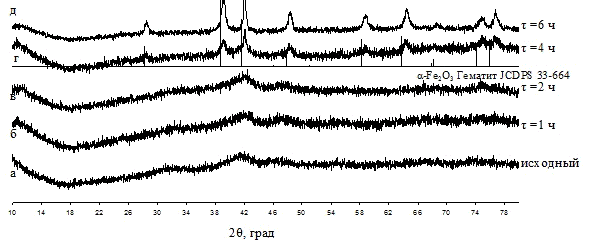
Рисунок 31 - Рентгеновские дифрактограммы
образца FA1: исходного
и подвергнутого гидротермальной обработке при температуре 210 °С и времени
выдержки τ =1, 2, 4, 6
ч
В связи с этим можно констатировать, что
введение небольшого количества алюмосодержащего компонента будет препятствовать
кристаллизации железосодержащего вещества.
Рентгенограммы образцов, в которых мольное
содержание алюминия значительно превышает содержание железа (FA4
и FA5), подвергнутых
гидротермальному синтезу, представлены на рисунке 32. И если исходный фазовый
состав образцов практически идентичен, то после гидротермального синтеза, в
зависимости от выдержки, будут наблюдаться значительные расхождения в составе.
В образце с мольным соотношением FA5
видно резкое уменьшение времени формирования бемита по отношению к образцу FA4,
то есть уже при выдержке 4 часа в образце F5
присутствует хорошо сформированная кристаллическая фаза. В то время как в
образце F4 рефлексы
отвечающие бемиту появляются только при 6-ти часовом термостатировании.
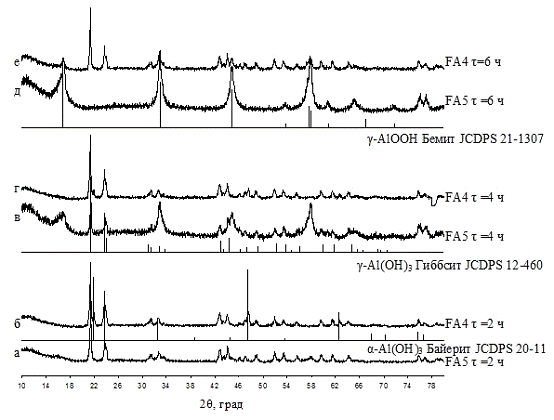
Рисунок 32 - Рентгеновские дифрактограммы
образцов FA4 и FA5,
после гидротермальной обработке при температуре 160 °С и времени выдержки τ=2,4,6
ч
При проведении термического анализа образцы вся
серия образцов нагревалась до 1000 °С. Далее был проведен рентгенофазовый
анализ термообработанных образцов, результаты которого приведены на рисунке 33.
В образцах FA2 и FA3
присутствуют кристаллические фазы корунда α-Al2O3
и гематита α-Fe2O3,
а в образце F1 присутствует
только гематит. При этом все пики, судя по рефлексам внутреннего стандарта,
оказываются смещенными относительно их рентгенограмм по картотеке JCDPS.
И если в образце FA1
наблюдаются твёрдые растворы на основе гематита, то в образце F3
наблюдается уже механическая смесь из твердых растворов на основе гематита и
корунда. Однако при увеличении присутствия алюмосодержащего компонента в
образце после термообработки в его составе обнаружится γ-Al2O3,
что можно видеть из соответствующих рентгенограмм «г» и «д» на рисунке 33.
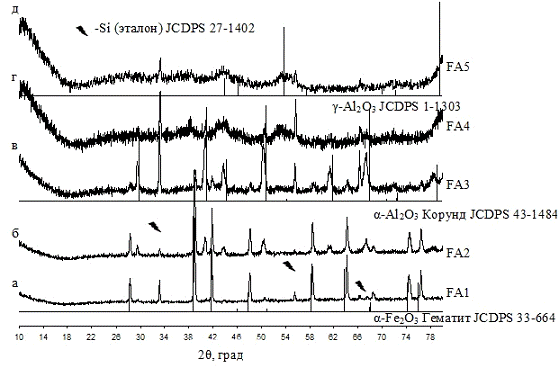
Рисунок 33 - Рентгеновские дифрактограммы серии
образцов FA после
термообработки (Тmax=1000
°С)
4.2.2 Расчет размера области
когерентного рассеяния
Система Fe2O3
- H2O
Рассмотрим образец F1
подвергнутый гидротермальной обработке при температурах 170, 190 и 210 °С в
течение 1,2,4 и 6 ч. Как было показано выше, в этих условиях образуется α-Fe2O3.
В этом случае размеры ОКР определялась по пику (110). Результаты приведены в
таблице 10.
Таблица 10 - Изменение свойств Fe(OH)3
при проведении гидротермального синтеза в зависимости от температуры и времени
|
Температура
синтеза, °С
|
Время
синтеза, ч
|
Значение
полуширины на полувысоте пика (w), град.
|
Размер
ОКР (D), нм.
|
|
170
|
1
|
1,943
|
5,37
|
|
2
|
0,292
|
35,71
|
|
4
|
0,285
|
36,58
|
|
6
|
0,283
|
36,84
|
|
190
|
1
|
0,693
|
15,05
|
|
2
|
0,296
|
35,23
|
|
4
|
0,266
|
39,20
|
|
6
|
0,267
|
39,05
|
|
210
|
1
|
0,352
|
36,21
|
|
2
|
0,273
|
38,19
|
|
4
|
0,258
|
40,41
|
|
6
|
0,263
|
39,65
|
Покажем изменения размеров ОКР (плоскость (110))
для этого образца при проведении гидротермального синтеза на графиках,
изображенных на рисунке 34. На рисунке показаны три зависимости: размер ОКР от
времени выдержки композиции при трёх температурах синтеза. Видно, что при 170 и
190 °С размер ОКР резко увеличивается при повышении времени выдержки от 1 часа
до 2-х часов. Далее размер ОКР меняется незначительно. При 210 °С размер частиц
в интервале времени от 1 до 6 ч меняется от 35 до 40 нм.
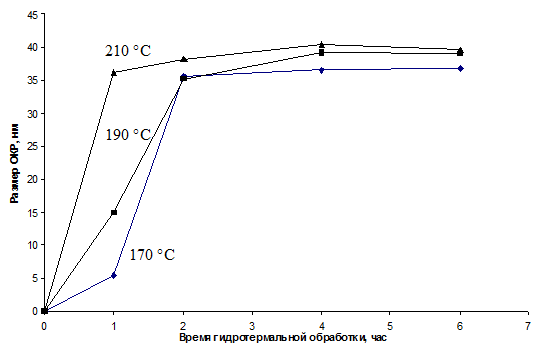
Рисунок 34 - Графики изменения
размеров ОКР гематита при проведении гидротермального синтеза.
Рассмотрим образец F2,
подвергнутый гидротермальному синтезу при температурах 160 (рисунок 28) и 170
°С в течение 1,2,4 и 6 ч. В этих условиях идет формирование гематита, для
которого размеры ОКР также определялись по пику (110). Результаты представлены
в таблице 11.
Таблица 11 - Значения ОКР для α-Fe2O3,
образующегося при гидротермальной обработке образца F2
|
Температура
синтеза, °С
|
Время
синтеза, час
|
Значение
полуширины на полувысоте пика (w), град.
|
Размер
ОКР (D), нм.
|
|
160
|
1
|
-
|
-
|
|
2
|
0,698
|
14,94
|
|
4
|
0,267
|
39,05
|
|
6
|
0,257
|
40,57
|
|
170
|
1
|
-
|
-
|
|
2
|
0,469
|
22,23
|
|
4
|
0,257
|
40,57
|
|
6
|
0,239
|
43,63
|
На рисунке 35 показаны графики изменения
размеров ОКР гематита по пику (110) после проведения гидротермального синтеза
при различных температурах.
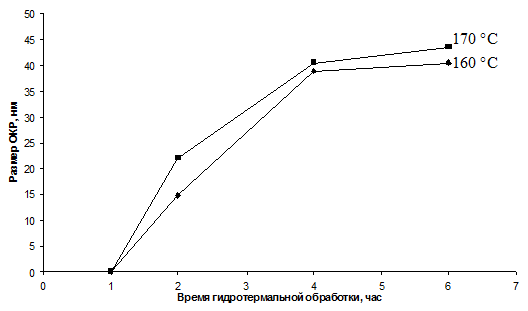
Рисунок 35 - График изменения
размера ОКР гематита при проведении гидротермального синтеза
Следует отметить, что одного часа
гидротермальной обработки недостаточно для формирования кристаллической
структуры гематита.
При повышении времени синтеза с 2 до
4 часов заметно резкое увеличение размеров ОКР. Размер ОКР тем больше, чем
больше температура синтеза при соответствующих временах термостатирования.
4.2.3 Результаты комплексного
термического анализа и масс-спектрометрии
Комплексный термический анализ
совмещает в себе данные дифференциально-сканирующей калориметрии и
термогравиметрии. Результаты такого анализа представлены на рисунке 36.
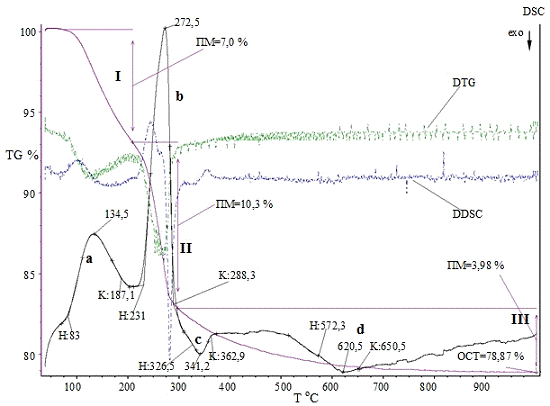
Рисунок 36 - Результаты комплексного
термического анализа для образца FA2
Данные комплексного термического
анализа представлены в таблице 12.
Таблица 12 - Данные комплексного
термического анализа
|
Термогравиметрия
|
Дифференциально-сканирующая
калориметрия
|
|
ступень
|
потеря
массы
|
пик
|
начало,
°C
|
максимум,
°C
|
конец,
°C
|
|
%
|
мг
|
|
|
|
|
|
I
|
7,0
|
a
|
83
|
134,5
|
187,1
|
|
II
|
10,3
|
b
|
231
|
272,5
|
288,3
|
|
III
|
3,98
|
c
|
326,5
|
341,2
|
362,9
|
|
|
d
|
572,3
|
620,5
|
650,5
|
|
|
|
|
|
|
|
Далее для наглядности отдельно рассмотрим
результаты дифференциально- сканирующей калориметрии и термогравиметрии для
всей серии образцов.
На рисунке 37 показаны данные термогравиметрии.
Видно, что с увеличением содержания алюмосодержащей компоненты в образце,
потеря массы растет. Начиная от 17,8 % от общей массы в случае образца FA1
и достигая потери почти трети от своего первоначального значения для образца FA5.
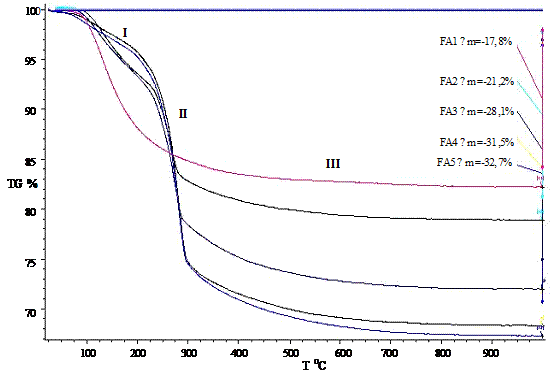
Рисунок 37 - Результаты
термогравиметрии всей серии образцов
До 100 °С образцы теряют до 1,5 %
своей массы. Уменьшение веса образцов ступенчато, в три стадии, первая из
которых находится в интервале от 80 до 225 °С (в случае образцов FA2 и FA3), а для
композиций FA4 и FA5 границы
ступени смещены на 10 °С в область более низких температур. Вторая ступень,
наиболее интенсивная, в зависимости от состава образца заканчивается при
280-295 °С для FA2 и FA5
соответственно. Третья ступень потери массы самая пологая, но она продолжается
вплоть до окончания нагрева (до 1000 °С). Интересно, что термогравиметрическая
кривая образца FA1 не имеет ярко выраженных ступеней,
уменьшение его веса имеет минимальное значение из всей серии композиций и
происходит плавно на протяжении всего нагрева.
Теперь отдельно рассмотрим данные
дифференциально-сканирующей калориметрии (рисунок 38). На кривой ДСК образца
FA1 видны эндотермический пик (пик «а») при температуре 133 °С и два
экзотермических пика при 329 (пик «с») и 631 °С (пик «d»). На кривых ДСК для
остальных образцов так же можно наблюдать пик «а», однако если для композиций
FA2 и FA3 он находится примерно при таком же значении температуры, то для
образцов FA4 и FA5 он смещается в зону более низких температур (114 и 97 °С
соответственно). Можно заметить, что отчетливый эффект «а» накладывается на
менее выраженный эффект «а`», максимум которого находится примерно при 75 °С.
Образцы с железосодержащим
компонентом, составляющим 50, 20, 10 и 5%, имеют интенсивный эндотермический
эффект при температурах 285 (5% Fe) - 274 оС (50% Fe). При этом интенсивность
этого эффекта тем меньше, чем большее количество железосодержащего компонента
находится в образце. Пик «с» для образцов FA2 и FA3 становится более
интенсивным и смешается в высокотемпературную зону (340 °С) по отношению к
образцу FA1, однако этот пик совершенно не виден для композиций FA4 и FA5, что
может свидетельствовать о каком-то побочном явлении, которое следует
рассматривать в дальнейших исследованиях. Эффект «d», так хорошо заметный для
образца FA1, на других композициях проявляется только на кривой ДСК для FA2 при
температуре 625 °С.
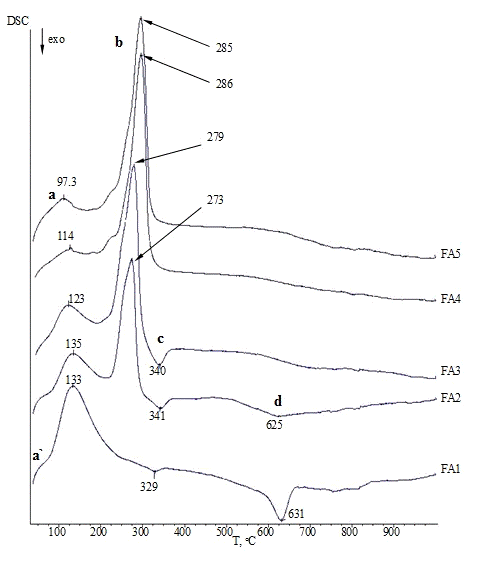
Рисунок 38 - Данные
дифференциально-сканирующей калориметрии образцов FA1 - FA5
На рисунке 39 представлены данные
ДСК, полученные авторами [16]. Кривые соответствуют термическому анализу гетита
содержащего определенное количество алюмосодержащей компоненты: 0 и 20 %.
Видно, что эти данные расходятся с результатами, полученными в этой работе.
Эндотермический пик при 245 °С (кривая «а» на рисунке 36) не проявляется на
аналогичной кривой на рисунке 36. При этом авторы связывают этот эффект с
дегидратацией гетита по соответствующей формуле:
2FeO(OH) = Fe2О3+H2О (9)
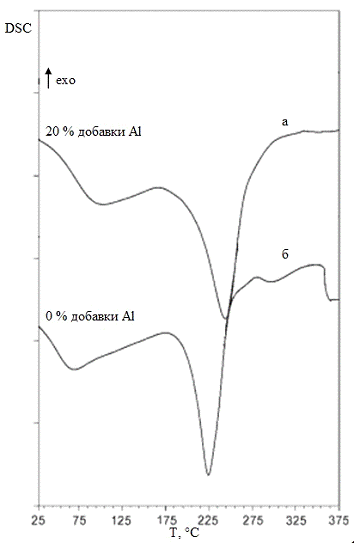
Рисунок 39 - Кривые ДСК для гетита с добавкой
алюмосодержащей компоненты 0 и 20 % по данным [16].
Отличие в результатах наблюдается также и в
данных термогравиметрии. Если потеря массы соответствующего образца по результатам
данной работы составила 18 % (рисунок 37), то по данным работы [16] потеря
массы гетита с добавлением 20 % алюмосодержащего вещества составила примерно 24
% (рисунок 40).
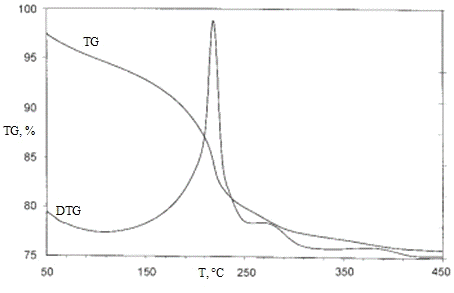
Рисунок 40 -Данные термогравиметрии образца
гетита с 20% добавлением алюмосодержащего компонента по данным [16].
Совместно с термическим анализом проводилась и
масс-спектрометрия, результаты которой для образца FA2
представлены на рисунке 41. На рисунке 41, а представлен масс-спектр воды,
который совпадает с пиками «a»
и «b», при этом если
пик «b» полностью
ответственен за удаление воды из образца, то на пик «a»
дополнительно накладывается пик, соответствующий удалению углекислого газа,
масс-спектр которого изображен на рисунке 41, в. Пик «c»,
скорее всего, отвечает за процесс горения. Этому соответствует экзотермический
эффект, выделение (повышение ионного тока) углекислого газа и поглощение
(уменьшение ионного тока) кислорода (рисунок 41, б). Пик «d»,
по-видимому, соответствует структурным преобразованиям в веществе.
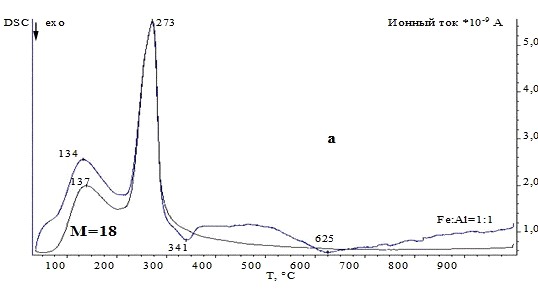
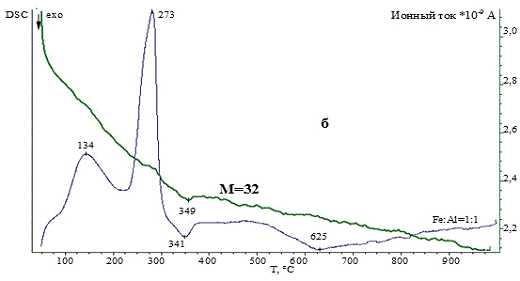
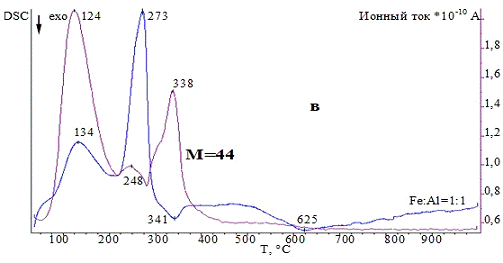
а -
масс-спектр H2O,
б - масс-спектр О2, в - масс-спектр СО2
Рисунок 41 - Результаты масс-спектрометрии
Таким образом, на кривых ДСК есть два пика («a»
и «b») соответствующие
процессам дегидратации. Однако, если пик «а» связан с удалением воды из
железосодержащего соединения (на кривой термогравиметрии первая ступень потери
массы), то пик «b» отвечает
за удаление воды из алюмосодержащего вещества (на кривой термогравиметрии
вторая ступень потери массы) [25].
Сущность масс-спектрометрии состоит в
детектировании отношения массы к заряду. Но одной молекулярной массе может
соответствовать несколько соединений, поэтому для точной идентификации
образующегося соединения необходимо фиксировать спектры разных молекулярных
масс, которые предположительно будут образовываться вместе с данным
соединением.
В качестве примера можно привести масс-спектр
воды. Имея молекулярную массу 18 г/моль при проведении масс-спектрометрии также
должны фиксироваться соединения с молекулярной массой 19 г/моль, 17 г/моль и 16
г/моль, что и представлено на рисунке 42.
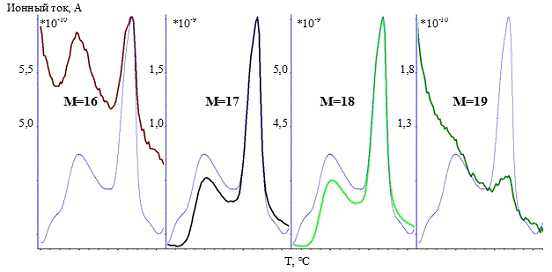
Рисунок 42 - Пример идентификации соединения по
фиксирующимся масс-спектрам
В качестве среды для проведения синхронного
термического анализа кроме аргона была использована атмосфера воздуха.
Результаты проведенного анализа в разных средах для образца FA2
представлены на рисунке 43.
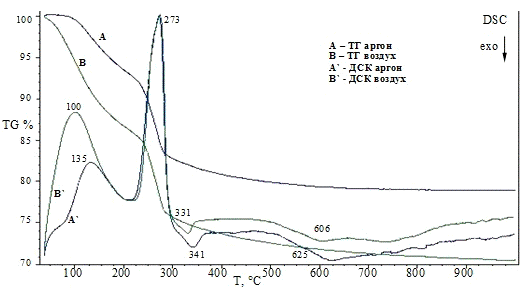
Рисунок 43 - Результаты синхронного термического
анализа образца FA2
в различных атмосферах: аргон и воздух
Образец FA2,
осажденный из нитратов, также исследовался методом синхронного термического
анализа. Его результат, в сравнении с образцом FA2,
осажденным из хлоридов, представлен на рисунке 44.
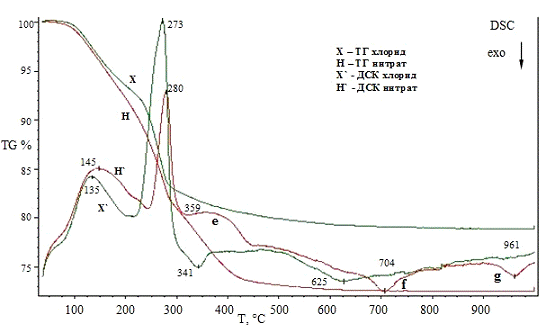
По полученным данным можно сделать ряд выводов:
Качественно, съёмки в аргоне и в воздухе
различаются только тем, что в диапазоне температур от 0 до 200 °С кривая ДСК
образца в атмосфере воздуха имеет один пик, а кривая ДСК образца в атмосфере
аргона имеет два перекрывающихся пика. При этом аналогичный пик для образца в
атмосфере аргона находится при более высокой температуре.
Потеря массы образца в атмосфере аргона всегда
больше потери массы образца в атмосфере воздуха, за счет того, что образцы в
атмосфере аргона при температуре до 100 °С практически не теряют массы.
На кривой ДСК образца FA2
(рисунок 42), осажденного из нитратов, видны 3 пика, не наблюдавшихся для
образцов, осажденных из хлоридов. Первый пик «е» - эндотермический с максимумом
при 359 °С. Два других пика «f»
и «g» -
экзотермические, схожи по форме и имеют максимумы при 704 °С и 961 °С
соответственно. Пик «d»,
наблюдавшийся у образцов FA2
и FA1, на кривой ДСК
данного образца отсутствует. Сравнивая кривые ДСК данного образца саналогичным
образцом, осажденным из хлоридов видно, что пик «a»
смешается в высокотемпературную зону и имеет максимум при 145 °С. Заметно
меньше интенсивность пика «b»,
максимум которого так же смещается и находится при температуре 280 °С.
Потеря массы у образца, осажденного из нитратов,
оказывается на 6,5 % больше, чем у аналогичного образца, осажденного из
хлоридов. За счет потерь массы при эффекте «е».
Анализируя результаты комплексного термического
анализа всей серии образцов наблюдается резкое отличие в кривой ДСК для образца
FA1 от остальных
образцов. Наблюдается резкое увеличение пика «a»
и вместе с этим отсутствует пик «b».
Пик «с» заметно сглаживается, резко увеличивается пик «d».
С увеличением содержания железа потери образца в
массе уменьшаются.
Проанализировав масс-спектр образца FA2
можно сказать, что пик «а» связан с процессами удаления воды (как физически
сорбированной на поверхности образца, так и из железосодержащей компоненты) и
процессом выделения углекислого газа (первая ступень потери массы), который в
свою очередь может образовываться по нескольким причинам:
а) углекислый газ, возможно, абсорбируется
раствором аммиака (использовавшемся при процессах осаждения), образуя карбонат
аммония, который при синхронном термическом анализе разлагается и выделяет
углекислый газ.
б) горение легковоспламеняющейся жидкости, которая
могла присутствовать в образце из-за низкого качества воды.
Пик «b»
точно совпадает с масс-спектром удаляемой воды, вероятнее всего из
алюмосодержащей компоненты (вторая ступень потери массы).
По всей видимости, ответственным за пик «с»
является процесс горения (частички бумажного фильтра или органические добавки,
присутствующие в воде), т.к. форма пика свидетельствует о процессе, идущем с
выделением тепла; возрастание ионного тока углекислого газа, говорит о том, что
количество этого вещества увеличивается, а уменьшение ионного тока кислорода
говорят о том, что это вещество расходуется.
пик «d»
не является масс-спектром какого-либо вещества и, по всей видимости,
соответствует структурным преобразованиям.
4.2.4 Результаты измерения магнитной
восприимчивости
Наличие в ионах Fe3+
и Fe2+
внутреннего незаполненного уровня (3d6),
на котором находятся нескомпенсированные электроны, обладающие спиновым
магнитным моментом, приводит к появлению в веществе, содержащем эти ионы
магнитного момента. Наличие магнитного момента является необходимым условием
возникновения явления кооперативного магнетизма, включающего в себя
ферромагнетизм, антиферромагнетизм и ферримагнетизм (нескомпенсированнный
антиферромагнетизм). Ферромагнитные (ферримагнитные) свойства проявляются
только при определенной кристаллической структуре и при температуре не выше
некоторой критической (для ферромагнетиков - температуры Кюри, для
ферримагнетиков - температуры Нееля). При этом между электронами незаполненных
внутренних уровней соседних атомов возникает сильное электростатическое
взаимодействие, называемое обменным [27].
Известно, что магнитная структура
ферромагнетиков состоит из доменов -
магнитоупорядоченных областей макроскопических размеров. Каждый домен имеет
постоянный магнитный момент, не зависящий от внешнего поля [28]. Без внешнего
магнитного поля эти моменты взаимно компенсируются, и намагниченность
отсутствует. В ансамбле наночастиц доменом может быть каждая частица. Магнитный
момент она приобретает за счет перехода в состояние молекулы-радикала при
размере частицы dsc
<
30 нм. Поэтому ферромагнетизм можно ожидать у наночастиц размером dsc
£
30 нм. Магнитоактивная форма вещества возникает здесь за счет размерного
эффекта [29].
Магнитную восприимчивость проб образцов измеряли
по методу Фарадея. Значения удельной магнитной восприимчивости для исследуемых
образцов представлены в таблице 13. Измерения проводились на воздухе при
комнатной температуре при четырех значениях напряженности магнитного поля.
Таблица 13 - Значения удельной магнитной
восприимчивости образцов
|
Напряженность
магнитного поля, Э
|
3640
|
5230
|
6330
|
7240
|
|
Образец
|
Соотношение
Fe3+ : Al3+ по данным
РСМА, мол. %
|
Данные
РФА
|
Удельная
магнитная восприимчивость, ×106, см3/г
|
|
F1
|
100:0
|
рентгено
аморфный продукт
|
158
|
155
|
157
|
153
|
|
FA2
|
36.7:63.3
|
α-Al(OH)3(крист.)
и γ-Al(OH)3(крист.)
Fe-содержащий
компонент рентгеноаморф.
|
28.4
|
27.1
|
26.8
|
26.5
|
|
FA4
|
10.1:89.9
|
α-Al(OH)3(крист.)
и γ-Al(OH)3(крист.)
Fe-содержащий
компонент рентгеноаморф.
|
6.09
|
5.89
|
5.99
|
5.74
|
|
FA5
|
6.2:93.8
|
α-Al(OH)3(крист.)
и γ-Al(OH)3(крист.)
Fe-содержащий
компонент рентгеноаморф.
|
3.44
|
3.71
|
3.79
|
3.62
|
|
F2
|
100:0
|
γ-FeOOH(крист.)
|
1159
|
930
|
823
|
706
|
Для образца F2
удельная магнитная восприимчивость зависит от напряженности магнитного поля.
Для композиций Al1-xFex(OH)3
удельная магнитная восприимчивость не зависит от напряженности магнитного поля,
железосодержащий компонент рентгеноаморфный.
Дальнейшие исследования в данной области
связаны, прежде всего, с определением парамагнитной составляющей магнитной
восприимчивости для фаз переменного состава на основе Al1-xFexOOH
(структура бемита) и (Fe1-yAly)2O3
× nH2O.
Следующий шаг синтез разбавленных твердых растворов и определение валентного,
спинного состояния железа, кластеризация и агрегативное состояние атомов
железа.
Выводы
1. Методом совместного осаждения из водных
растворов солей FeCl3,
AlCl3,
Fe(NO3)3,
Al(NO3)3
были получены композиции с различным мольным содержанием катионов железа и
алюминия. Проведена гидротермальная обработка композиций в интервале температур
160-210 °С при давлении 15 МПа, продолжительность изотермической выдержки от 1
до 6 часов;
2. Установлено, что на процессы
фазообразования в системы Fe2O3 - H2O в
процессе осаждения сильное влияние оказывает химическая предыстория. В
зависимости от соотношения OH-/Fe3+ устойчивы различные
гидратированные формы оксида железа. Показано, что при значении рН = 8-9
наблюдается образование рентгеноаморфного гидроксида железа. При повышенной
концентрации ОН- групп и низком соотношении OH-/Fe3+
образуется оксигидроксид железа - лепидокрокит;
. Установлено, что устойчивость различных
структурных форм оксидных нанокристаллов в системе Fe2O3−Al2O3−H2O
в процессе золь-гель синтеза зависит от химической и термической предыстории.
При совместном осаждении гидроксидов наблюдается взаимное влияние компонентов
на области устойчивости различных форм гидроксидов, оксигидроксидов, оксидов;
. Показано влияние параметров
гидротермальной обработки композиций на основе системы Fe2O3−Al2O3−H2O
(тип исходных солей железа и алюминия, химический состав гидротермальной среды,
концентрации компонентов, температура, продолжительность гидротермальной
обработки) на физико-химические свойства (фазовый состав, морфологию)
образующихся при этом частиц;
. Установлено, что присутствие
алюмосодержащей компоненты препятствует кристаллизации a-Fe2O3
при гидротермальной обработке исследуемых композиций;
. Показано, что в гидротермальных
условиях существуют фазы переменного состава на основе Al1-xFexOOH
(структура бемита) и (Fe1-yAly)2O3
× nH2O;
. По данным рентгенофазового анализа
композиций системы Fe2O3−Al2O3−H2O
после термообработки до 1000 °С
обнаружено существование твёрдых растворов на основе алюмо- и железосодержащих
фаз.
Список использованных источников
Пул-мл.,Ч. Мир материалов и
нанотехнологий / Ч.Пул-мл., Ф.Оуэнс. - М.: Техносфера, 2006. - 336 с.
Гидротермальная кристаллизация
гидроксида железа (III) / В.В.Попов, А.И.Горбунов // Неорганические материалы.
- 2006. - том 42. - №3. - С. 319-326.
Диаграммы состояния силикатных
систем. Выпуск первый. Двойные системы.: справочник / Н.А.Торопов [и др.] - М.:
Наука. 1965.- 548 с.
Чухров Ф.В. Минералы: справочник.
Диаграммы фазовых равновесий. Выпуск 1 / отв. ред. Ф.В. Чухров. - М.:
Наука,1974. - 492 с.
Уэллс А. Структурная неорганическая
химия: В 3-х т. Т. 2: Пер. с англ. А. Уэллс - М.: Мир, 1987.-696 с., ил.
Лазарев В.Б. Химические и физические
свойства простых оксидов металлов / В.Б. Лазарев, В.В. Соболев, И.С.
Шаплыгин.-М.: Наука, 1983.-239 с.
Ишутина Ж.Н. Фазообразование и
свойства материалов в нанокомпозициях на основе системы Al2O3
- SiO2
- TiO2
: дис. …к-та хим. наук : 05.17.11 : защищена 20.03.97 : утв. 14.02.97 / Ишутина
Жанна Николаевна. - СПб., 1997. - 191 с.
Свойства неорганических соединений.:
cправочник / А.И
Ефимов [и др.] - Л.: Химия, 1983. - 392 с.
9 The Dehydration of Boehmite,
γ-AlOOH, to γ-Al2O3
/ S.J.Wilson // Journal of Solid State Chemistry. - 1979. T. 30. - № 2. - C.
247-255.
Walter D. The mechanism of the
thermal transformation from goethite to hematite / D.Walter, G.Buxbaum, W.Laqua
// Journal of Thermal Analysis and Calorimetry. - 2001. T.
63. - C. 733-748.
Abercade
consulting [Электронный
ресурс] / Нанопорошки: описание мирового рынка. - Электрон. дан. - М.: исслед.
ком. Abercade.,
2008 г. - Режим доступа: #"660687.files/image054.gif">
Рисунок А 2 - График конкурентоспособности
продукции
Проведенное маркетинговое исследование показало,
что исследуемый продукт является востребованным на сегодняшнем рынке, и в
течение планируемого года спрос на данные исследования будет только возрастать.
Оценка конкурентоспособности товара указывает,
что наш товар, лишь по некоторым параметрам уступает товарам конкурентов (по
возможности и простоте интеграции в промышленность и по объёму производимой
продукции), в то время как по общей оценке он значительно превосходит их.
Расчет затрат на выполнение
научно-исследовательской работы.
Обоснование договорной цены разработки.
При определении договорной цены на «know
how» необходимо
руководствоваться взаимной выгодой как продавца, так и покупателя.
Целесообразно выделить минимальную цену продавца и максимальную цену
покупателя.
Под минимальной ценой продавца понимается цена,
ниже которой продажа нецелесообразна. Обычно уровень данной цены определяется
затратами на разработку «know
how».
Под максимальной ценой покупателя понимается
цена, выше которой затраты на приобретение и подготовку к использованию «know
how» не окупятся
будущей прибылью от его использования.
Определение минимальной цены продавца «know
how».
Минимальная цена продавца устанавливается исходя
из расчета затрат на разработку «know
how» по
нижеприведенным статьям.
Расчет суммы затрат на сырьё, материалы,
реактивы, покупные изделия и полуфабрикаты.
К данной статье относятся стоимость всех
материалов, расходуемых в процессе непосредственного выполнения работ по
созданию «know
how». Расчет
представлен в таблице А 2.
Таблица А 2 - Расчет суммы затрат на материалы
|
Наименование
материала
|
Техническая
характеристика
|
Единица
измерения
|
Израсходованное
количество
|
Цена,
руб.
|
Сумма
затрат, руб.
|
|
Алюминий
хлористый 6/в
|
имп
|
кг
|
0,5
|
1318,8
|
659,4
|
|
Алюминий
азотнокислый 9/в
|
ч
|
кг
|
0,5
|
103
|
51,5
|
|
Железо
(III)
хлористое 6/в
|
ч
|
кг
|
0,5
|
32,9
|
16,45
|
|
Железо
(III)
азотнокислое 9/в
|
ч
|
кг
|
0,5
|
142
|
71
|
|
Аммиак
водный марка 25-5
|
осч
|
кг
|
1
|
42,3
|
42,3
|
|
Индикаторная
бумага универсальная 0-12рН
|
|
уп
|
2
|
110,8
|
221,6
|
|
Фильтры
бумажные обеззоленные
|
|
уп
|
2
|
18,6
|
37,2
|
|
Смазка
графитная
|
|
кг
|
0,1
|
57,9
|
5,79
|
|
|
|
|
|
|
|
Итого:
|
|
|
|
|
1105
|
Расчет суммы затрат на энергоресурсы.
Расчет затрат на электроэнергию (ЗЭ/Э)
производится по формуле:
ЗЭ/Эi=Мi*Тi*ЦЭ/Э*КМi, (А
1)
где Мi
- установленная мощность i
оборудования, используемого при проведении исследований, кВт;
Тi
- время использования i
оборудования за весь период исследования, час.;
ЦЭ/Э - цена одного киловатт/часа
электроэнергии, руб.;
КМi
- коэффициент использования оборудования по мощности, доли единицы.
Расчет суммы затрат на электроэнергию произведен
в таблице А 3.
Таблица А 3. Расчет суммы затрат на
электроэнергию
|
Наименование
используемого оборудования
|
Устано-вленная
мощ-ность, кВт
|
Число
единиц оборудования, шт.
|
Время
использо-вания оборудо-вания, час
|
Коэффициент
использования мощности, доли единицы
|
Цена
одного кВт/ч электро-энергии, руб.
|
Затраты
на электро-энергию, руб.
|
|
Дистиллятор
|
0,8
|
1
|
200
|
0,8
|
0,9
|
115,2
|
|
Сушильный
шкаф
|
0,8
|
1
|
100
|
0,8
|
|
57,6
|
|
Мешалка
|
0,05
|
1
|
60
|
0,8
|
|
2,16
|
|
Комплекс
синхронного термического анализа
|
3
|
1
|
15
|
0,8
|
|
32,4
|
|
Рентгеновский
дифрактометр
|
2
|
1
|
100
|
0,8
|
|
160
|
|
Итого:
|
|
|
|
|
|
368
|
Расчет затрат на другие виды энергии (ЗЭi),
осуществляется по формуле:
ЗЭi=
РЭi
* ЦЭi, (А
2)
где РЭi
- расход i-го вида
энергоресурса в натуральных единицах измерения;
ЦЭi
- цена i-го вида
энергоресурса за единицу, руб.
В качестве других видов энергии использовалась
вода
ЗЭ/В= РЭ/В * ЦЭ/В=0,6
м3 * 7,58 руб = 4,55 руб = 5 руб. (А 3)
Расчет суммы затрат на специальное оборудование
для научных и экспериментальных работ
К данной статье относятся затраты на
приобретение и монтаж специального оборудования для проведения исследований.
Для стеклянных приборов и посуды, которые
сдаются на кафедру, в сумму затрат включаются только амортизационные отчисления
в размере 50% стоимости вышеуказанных приборов.
Таблица А 4 - Расчет стоимости приборов и
стеклянной посуды и суммы амортизационных отчислений.
|
Наименование
используемого оборудования
|
Число
единиц оборудования, шт.
|
Стоимость
единицы оборудования, руб.
|
Стоимость
всего оборудования, руб.
|
Годовая
норма амортизации, %
|
Время
использования, мес
|
Сумма
амортизации, руб.
|
|
Колба
с тубусом (Бунзена) для фильтрования под вакуумом 1-500-34 ТС
|
1
|
228,3
|
228,3
|
-
|
3
|
114,15
|
|
Колба
коническая со шлифом и пришлифованной пробкой Кн-1-250-29/32 ПМ ТС
|
5
|
204,4
|
1022
|
-
|
3
|
511
|
|
Стакан
высокий с носиком В-1-800 со шкалой ТС (Simax)
|
4
|
124,4
|
497,6
|
-
|
3
|
248,8
|
|
Стаканчик
для взвешивания высокий (Бюкс) СВ-24/10
|
10
|
32
|
320
|
-
|
2
|
160
|
|
Чашка
Петри 120-20 ТС
|
5
|
15
|
75
|
-
|
1
|
37,5
|
|
Воронка
лабораторная В-75-110 ХС
|
1
|
35,6
|
35,6
|
-
|
1
|
17,3
|
|
Цилиндр
мерный 1-100-2
|
1
|
158,9
|
158,9
|
-
|
0,5
|
79,45
|
|
Цилиндр
мерный 3-25
|
1
|
20,3
|
20,3
|
-
|
1
|
10,15
|
|
Чашка
выпарительная N 3 V=100 мл
|
4
|
37,7
|
150,8
|
-
|
1
|
75,4
|
|
Воронка
Бюхнера N 2 d=80 мм
|
1
|
101,5
|
101,5
|
-
|
3
|
50,75
|
|
|
|
|
|
|
|
|
Итого:
|
|
|
2610
|
|
|
1305
|
Для специального оборудования, которое может
быть использовано и для других исследований в эту статью расходов включается
только сумма амортизации за время использования конкретного вида оборудования
для исследования по рассматриваемой теме. Сумма амортизационных отчислений (А)
определяется по следующей формуле:
А=(ФП*НА*Т)/(100*12), (A
4)
где ФП - первоначальная стоимость
оборудования и приборов, руб;
НА - годовая норма амортизации, %;
Т - время использования конкретного оборудования
или прибора для проводимого исследования, мес.
Таблица А 5 - Расчет стоимости специального
оборудования и суммы амортизационных отчислений
|
Наименование
используемого оборудования
|
Число
единиц оборудования, шт.
|
Стоимость
единицы оборудования, руб.
|
Стоимость
всего оборудования, руб.
|
Годовая
норма амортизации, %
|
Время
использования, мес
|
Сумма
амортизации, руб.
|
|
Пипетка
полипропиленовая 5 мл
|
1
|
22,9
|
22,9
|
10
|
2
|
0,38
|
|
Ареометры
общего назначения АОН-1 ХС
|
19
(набор)
|
2043,6
|
2043,6
|
10
|
0,1
|
1,7
|
|
Ступка
агатовая с пестом 50 мл
|
1
|
7770
|
7770
|
15
|
0,1
|
9,7
|
|
Автоклав
|
4
|
10000
|
40000
|
10
|
0,07
|
23,3
|
|
Сушильный
шкаф
|
1
|
48000
|
48000
|
15
|
0,14
|
84,3
|
|
Рентгеновский
дифрактометр
|
1
|
250000
|
250000
|
10
|
0,14
|
292
|
|
Система
синхронного термического анализа
|
1
|
30000000
|
30000000
|
10
|
0,02
|
|
Итого:
|
|
|
30310447
|
|
|
5411
|
Расчет суммы заработной платы с обязательными
начислениями
К данной статье относится заработная плата с
обязательными начислениями сотрудников, занимавшихся исследованиями.
Трудозатраты студента-дипломника включаются в
стоимость «know
how» исходя из часовой
тарифной ставки VIII
разряда единой тарифной сетки, так как его можно рассматривать в качестве
работника с незаконченным высшим образованием, поэтому он занимает должность
инженера II категории.
При этом студента-дипломника принимают на работу на неполную (50%) тарифную
ставку.
Часовая тарифная ставка определяется исходя из
установленного работнику тарифа:
ТСТ=ОК/(Д*ТСМ), (А
5)
где ОК - оклад работника за месяц,
руб;
Д - среднее число рабочих дней в месяце, день;
ТСМ - продолжительность рабочего дня,
час.
Таким образом, часовая тарифная ставка научного
сотрудника (руководитель) будет определяться:
ТСТ=20000/(22*8)=113,6 руб. (А 6)
Часовая тарифная ставка инженера II
категории (студент-дипломник):
ТСТ=1194/(11*8)=13,6 руб. (А 7)
Основная заработная плата (ЗПОСН)
конкретного работника определяется по формуле:
ЗПОСН=ТСТ*ТФ, (А
8)
где ТФ - время, затраченное
конкретным работником на исследование, час. Основная заработная плата научного
сотрудника:
ЗПОСН=113,6*880=99968 руб. (А 9)
Основная заработная плата инженера II
категории:
ЗПОСН=13,6*880=11968 руб. (А 10)
Дополнительная заработная плата начисляется в
размере 10% от суммы основной заработной платы.
Единый социальный налог берется в виде 26% от
суммы основной и дополнительной заработной платы.
Сведем полученные данные в таблицу А 6.
Таблица А 6 - Расчет суммы заработной платы с
обязательными начислениями
|
Категория
работников
|
Количество
человек
|
Квалификационный
разряд
|
Часовая
тарифная ставка, руб
|
Затраченное
время, час
|
Основная
заработная плата, руб.
|
Дополнительная
заработная плата, руб.
|
Единый
социальный налог, руб.
|
Итого
затраты на заработную плату, руб.
|
|
Научный
сотрудник
|
1
|
|
113,6
|
30
|
3408
|
340,8
|
975
|
4724
|
|
Инженер
2 кат. (студент-дипломник)
|
1
|
VIII
|
13,6
|
880
|
11968
|
1196,8
|
3423
|
16588
|
|
Итого:
|
2
|
|
|
|
15376
|
1537,6
|
4398
|
21312
|
Расчет суммы расходов на использование
вычислительной техники
Расчет суммы расходов на использование
вычислительной техники (ЗВТ) будет определяться по формуле:
ЗВТ=ТВТ*СВТ, (А
11)
где ТВТ - количество часов работы
вычислительной техники, час;
СВТ - стоимость одного машино/часа
эксплуатации вычислительной техники, руб/час.
Таким образом:
ЗВТ=200*200=40000 руб. (А 12)
Расчет суммы накладных расходов
К данной статье затрат относятся косвенные
расходы лабораторий, где проводились исследования и общеинститутские расходы.
Это затраты на содержание административно-управленческого персонала, на
отопление и освещение, расходы на текущий ремонт, на командировки, канцелярские
товары и прочее. Они определяются в виде процента от суммы прямых затрат и
составляют 10 %.
Результаты расчетов суммы затрат по все статьям
представим в виде основной таблицы, представляющей собой смету затрат на
разработку «know
how» (см. таблицу A
7)
Таблица А 7 - Смета затрат на разработку «know
how»
|
Наименование
статьи затрат
|
Сумма,
руб.
|
Удельный
вес, %
|
|
1
Сырье, материалы, реактивы, покупные изделия и полуфабрикаты
|
1105
|
1,5
|
|
2
Энергетические ресурсы, в т.ч.: 2.1 электроэнергия 2.2 вода
|
373 368 5
|
0,5
0,49
0,01
|
|
3
Специальное оборудование для научных и экспериментальных работ
|
6716
|
9
|
|
4
Заработная плата с обязательными начислениями, в т.ч.: 4.1 основная
заработная плата 4.2 дополнительная заработная плата 4.3 единый социальный
налог
|
21312
15376 1537,6 4398
|
28
20
2
6
|
|
5
Использование вычислительной техники
|
40000
|
52
|
|
6
Накладные расходы
|
6951
|
9
|
|
Итого
|
76461
|
100
|
Таким образом, рассчитав полную смету затрат на
разработку «know
how», можно определить
минимальную цену продавца «know
how»
ЦМИН=80000 руб.
Максимальная цена покупателя «know
how» будет
определяться по формуле:
ЦМАК=С+р*С, (А
13)
где C
- себестоимость продукции, руб;
р - рентабельность, %.
Для данного исследования целесообразно будет
задаться рентабельностью 15 %, таким образом, максимальная цена покупателя «know
how» рассчитывается:
ЦМАК=76461+0,15*76461=87930 руб. (А
14)
ЦМАК=90000 руб.
Основные выводы:
произведено позиционирование продукта на рынке и
оценена конкурентоспособность товара. Товар является выгодным вложением
инвестиций из-за широкой области применений и бурного развития отрасли. При
этом товар по сумме предъявляемых требований превосходит своих конкурентов на
рынке.
была рассчитана минимальная цена продавца (80000
руб.) и максимальная цена покупателя (90000 руб.) «know
how». Таким образом,
реальная договорная цена на «know
how» будет лежать в
этом интервале.
Приложение Б
Охрана труда и окружающей среды
Вступление
Охрана труда
- это система сохранения жизни и здоровья работников в процессе трудовой
деятельности, включающая в себя правовые, социально-экономические,
организационно-технические, санитарно-гигиенические, лечебно-профилактические,
реабилитационные и иные мероприятия.
Охрана труда является одним из наиболее важных
аспектов производства. Целью её является обеспечение безопасности жизни,
сохранение здоровья и работоспособности работников предприятия в процессе
трудовой деятельности.
Целью данной работы является изучение характера
влияния параметров гидротермальной обработки Fe(OH)3,
Fe2O3∙nH2O,
γ-FeOOH
и композиций на основе системы Fe2O3-Al2O3-H2O,
на физико-химические свойства образующихся при этом частиц.
В процессе выполнения работы необходимо
соблюдать все нормы и правила по охране труда и окружающей среды и особое
внимание уделить работе с сосудами высокого давления.
Опасные и вредные производственные факторы
Опасные и вредные производственные факторы
разделяют по природе действия на следующие группы [30]:
физические
химические
биологические
психофизиологические
Выбранному способу производства продукта присущи
следующие опасные и вредные производственные факторы:
а) физические - повышены температуры,
рентгеновское излучение, работа с сосудами высокого давления
б) химические - вредное воздействие на организм
человека сырья, полупродуктов, готовой продукции и отходов производства
(таблица Б 1).
Таблица Б 1 - Характеристика физико-химических
свойств сырья, готового продукта и отходов производства [31].
|
Вещества
|
Физико-химические
свойства
|
Токсические
свойства
|
|
Агрегатное
состояние
|
Температура
кипения, оС
|
Температура
плавления, оС
|
Плотность,
кг/м3
|
Характер
действия на организм человека
|
Класс
опасности
|
ПДК
р.з., мг/м3
|
|
AlCl3
|
т
|
180
(возг.)
|
193
|
2440
|
Поражение
легких
|
IV
|
6
|
|
Al(NO3)3
|
т
|
150 (разл.)
|
74
|
?
|
Поражение
легких
|
IV
|
6
|
|
FeCl3
|
т
|
315
|
307
|
2900
|
Поражение
легких
|
III
|
4
|
|
Fe(NO3)3
|
т
|
125
|
47
|
1680
|
Поражение
легких
|
III
|
4
|
|
Fe(OH)3
|
т
|
-
|
-
|
3700
|
Поражение
легких
|
III
|
4
|
|
Al(OH)3
|
т
|
-
|
-
|
3100
|
Поражение
легких
|
IV
|
6
|
|
NH4OH
|
ж
|
-
|
-
|
-
|
Раздражение
слизистой
|
IV
|
20
|
Характеристика помещения лаборатории по
взрывопожарной и пожарной опасности
Дипломная работа выполнялась в лаборатории
физикохимии наноразмерных систем (ФХНС) института химии силикатов РАН. Данная
лаборатория относится к категории помещений В4 (пожароопасная), в которой горючие
и трудногорючие жидкости, твердые горючие и трудногорючие вещества и материалы
(в том числе пыли и волокна), вещества и материалы, способные при
взаимодействии с водой, кислородом воздуха или друг с другом только гореть. При
этом пожарная нагрузка, величина которой должна составлять 1-180 МДж/м2,
размещается на любом участке пола помещения площадью 10 м2 [32].
В соответствии с ПУЭ [33], взрывоопасная
зона - это помещение или ограниченное пространство в помещении или наружной
электроустановке, в которых могут образоваться взрывоопасные смеси.
Место проведения работы относится к классу В-1б
- зоны, расположенные в помещениях, в которых взрывоопасные смеси с воздухом
возможны только в результате аварий или неисправностей. Зоны лабораторных и
других помещений, в которых горючие газы с ЛВЖ имеются в небольших количествах,
недостаточных для создания взрывоопасной смеси в зоне, превышающей 5%
свободного объема помещения.
К первичным огнетушащим средствам относятся
различные огнетушители, асбестовое полотно, песок, а также водопроводная вода.
В условиях лаборатории, при чрезвычайном обилии разнообразных горючих веществ с
различными свойствами, особенно важно правильное и своевременное применение
первичных средств тушения огня. Успешная борьба с загораниями невозможна без
четкого знания возможностей и областей применения каждого из имеющихся в
лаборатории огнетушащих средств.
Каждая комната лаборатории оснащена
огнетушителем ОУ-2, имеется ящик с песком. Ручной огнетушитель ОУ-2 заполняется
сжиженным диоксидом углерода под давлением 6 МПа. При повороте до отказа
маховичка вентиля против часовой стрелки сжиженный диоксид углерода
выбрасывается из баллона через раструб. На выходе за счет частичного испарения
струя сильно охлаждается и поступает в зону горения в виде снегообразной массы.
Тушение основано на понижении концентрации кислорода в зоне горения и
охлаждение горящего вещества ниже температуры вспышки.
В условиях химических лабораторий углекислотные
огнетушители представляют собой наиболее предпочтительное огнетушащее средство.
Диоксид углерода не содержит воды и не причиняет вреда оборудованию.
Огнетушители весьма удобны и эффективны для тушения практически любых загораний
на небольшой площади, в том числе электроустановок, находящихся под напряжением
не выше 10 кВ.
Углекислотные огнетушители нельзя применять для
тушения горящей одежды на человеке - снегообразная масса СО2 при
попадании на незащищенную кожу вызывает обморожение. Диоксид углерода не
прекращает горения щелочных металлов, многих жидких металл-органических
соединений, а также горючих составов, содержащих способный отщепляться при
нагревании кислород.
Песок рекомендуется применять при загорании
небольших количеств горючих жидкостей или легковоспламеняющихся жидкостей и
твердых веществ, в том числе тех, которые нельзя тушить водой. Однако по
эффективности песок значительно уступает прочим огнегасительным средствам.
Единственное преимущество заключается в его дешевизне [34].
Система оповещения людей о пожаре соответствует
[37].
Вентиляция
Все работы по получению образцов в данной работе
проводились в вытяжных шкафах. Вентиляционная установка характеризуется
кратностью обмена воздуха в ней и скоростью подсоса воздуха в рабочем проёме.
Системы вентиляции и кондиционирования воздуха
соответствуют ГОСТ 12.4.021-75 [35].
Скорость подсоса воздуха в вытяжных шкафах и
кратность обмена воздуха для веществ разных классов опасности, использовавшихся
в работе, приведены в таблице Б 2
Таблица Б 2 - Характеристика вытяжных шкафов
|
Класс
опасности веществ
|
Скорость
подсоса воздуха, м/с
|
Кратность
обмена воздуха, ч-1
|
|
III
|
0,50-0,75
|
200-250
|
|
IV
|
0,35-0,50
|
150-200
|
Скорость подсоса воздуха в используемых вытяжных
шкафах составила 0,7 м/с, что удовлетворяет требованиям, предъявляемым к
вытяжным шкафам.
Естественное и искусственное освещение
Нормы освещения в лаборатории соответствуют СНиП
23-05-95. Освещение является естественным (боковым) и искусственным (рабочим).
Охарактеризуем исследовательский процесс с целью установления разряда
зрительных работ.
Характеристика зрительной работы - средней
точности
Наименьший или эквивалентный размер объекта
различения - от 0,5 мм до 1 мм.
Разряд зрительной работы - IV
Подразряд зрительной работы - б
Контраст объекта с фоном - малый, средний
Характеристика фона - средний, темный
Норма освещенности рабочего места при общем
искусственном освещении составляет 200 лк [36].
Так как освещение является совмещенным
(люминисцентные лампы - искусственное освещение и боковой естественный свет -
естественное освещение), то значение коэффициента естественного освещения (КЕО)
будет равно 0,9%.
Содержимое аптечки
Для оказания первой медицинской помощи
пострадавшему в лабораторной аптечке имеются все необходимые компоненты:
а) Нашатырный спирт - 25 мл
б) Стерильные бинты - 5 шт
в) Вазелин - 1 тюбик
г) Вата гигроскопичная - 150 г
д) Горькая соль - 300 г
е) Йодная настойка - 20 мл
ж) Уголь активированный - 100 г
з) Марганцево-кислый калий - 20 г
и) Перекись водорода 3%-ный раствор - 100 г
к) Вазелиновое масло - 200 г
л) Пластырь бактерицидный
Безопасность проведения исследования
Электрооборудование, применяемое в работе:
а) сушильный шкаф
б) мешалка
в) персональный компьютер
По отношению к опасности поражения людей
электрическим током данная лаборатория относится к помещению без повышенной
опасности, т.е. отсутствуют условия создающие повышенную или особую опасность.
Поражение людей электрическим током происходит
при совпадении следующих обстоятельств:
а) отсутствие или нарушение заземления прибора;
б) появление на корпусе прибора электрического
напряжения вследствие замыкания на корпус или пробоя на корпус;
в) одновременное прикосновение к корпусу
поврежденного прибора или к токоведущим частям с нарушенной изоляцией и к
заземлённому оборудованию либо ситуация, когда человек прикасается к
поврежденному прибору, стоя на влажном полу.
Основными мерами предотвращения поражений
электрическим током в лабораториях является защита от прикосновения к
находящимся под напряжением частям электрооборудования и применение защитного
заземления. Защите от случайного прикосновения подлежат все токоведущие части
независимо от напряжения.
Для защиты от поражения электрическим током
работа проводилась на оборудовании класса I.
Эти аппараты отличаются способом присоединения к системе защитного заземления.
Как правило, заземляющий провод проходит в общей оболочке с токоведущими
проводами, т.е. приборы имеют трёхжильный сетевой шнур и сетевую вилку с
заземляющим контактом. К классу I
относятся и аппараты рассчитаные на постоянное присоединение к питающей сети,
поскольку заземление производится при их установки и не может быть отсоединено
без помощи инструмента.
Первая помощь при поражении электрическим током:
Исход поражения током зависит от длительности
его воздействия на человека. Поэтому главная задача при оказании первой помощи
- как можно быстрее освободить пострадавшего от действия тока. В помещениях
лабораторий это быстрее и надежнее всего достигается путем отключения
электроэнергии общим рубильником. Допускается отключение от сети прибора,
вызвавшего поражение.
Запрещается прикасаться голыми руками к
обнаженным частям тела пострадавшего до размыкания электрической цепи.
При любом поражении электрическим током следует
немедленно вызвать врача.
Если пострадавший потерял сознание, следует:
проверить пульс и дыхание
при наличии дыхания и пульса положить его на
спину и повернуть голову в сторону , предупреждая западание языка.
обрызгать лицо холодной водой, дать понюхать
вату, смоченную нашатырным спиртом
после прихода в сознание дать настойку
валерианы.
Если дыхание слабое и неровное производят
искусственнее дыхание и массаж сердца.
Если дыхание и пульс отсутствуют. Немедленно
приступают к исскуственному дыханию «рот в рот» с одновременным массажем
сердца. Помощь оказывается непрерывно до полного восстановления дыхания и
пульса.
В работе применялся 25,5% раствор NH4OH,
который при попадании на слизистые может вызвать химический ожог
При неосторожном обращении с нагревательными
приборами возможно получение термического ожога
Первая помощь при ожогах:
а) термический.
Степени: 1-покраснение, 2-образование пузырей,
3-омертвение отдельных участков кожи, 4-омертвение глубже лежащих тканей.
При термических ожогах (кроме локальных 1-й
степени) следует вызвать врача или немедленно доставить пострадавшего в
ближайшее лечебное учреждение.
До оказания медицинской помощи необходимо обнажить
обожженный участок и закрыть его сухой асептической повязкой. Применение любых
обезболивающих средств. Применение сухого холода.
В ходе исследования не производилась работа с
ЛВЖ, едкими веществами, радиоактивными веществами, взрывчатыми веществами,
микроорганизмами, ультрафиолетовым излучением.
б) химический
Пораженное место промыть струёй воды в течение
длительного времени (15 минут). При ожогах кислотами накладывают примочки 2%-м
раствором бикарбоната натрия, а при ожогах щелочами - 2%-м раствором уксусной
или лимонной кислот. При сильном ожоге необходимо вызвать врача.
Для проведения исследования необходимо
использовать стеклянную посуду. И при неаккуратном обращении с ней есть
вероятность получения пореза.
Первая помощь при кровотечении:
Различают капиллярное, венозное или артериальное
кровотечение
Способ остановки капиллярного или венозного
кровотечения (кровь темная) - наложение на рану давящей повязки.
Остановка артериального кровотечения (кровь
алая) - наложение жгута или полное сгибание конечности в суставе и фиксация её
в таком положении с помощью ремня или бинта.
Особое внимание следует обратить на работу с
аппаратами, работающими под давлением.
В ходе исследования применялся метод
гидротермального синтеза, при котором в специальном стальном сосуде (автоклаве)
создавалось высокое (150 атм.) давление.
Используемые автоклавы относились к категории
«В», т.е. в этих автоклавах исследуемы процессы известны, применяемые вещества
не вызывают нерегулируемого повышения температуры и давления, не являются
горючими и вредными для здоровья. Заданное давление создается за счет внешнего
подогрева автоклава электропечью с выносными приборами автоматического
регулирования температуры печи.
Работая с автоклавами, необходимо выполнять
следующие требования:
. Режим работы автоклавов при проведении каждого
опыта задаётся зав. лабораторией или руководителем группы и записывается в
специальном журнале с указанием всех параметров.
. Гидротермальные исследования в автоклавах
ёмкостью до 0,065 л можно проводить только в стальных кабинах, установленных в
лаборатории или в автоклавной.
) автоклавы ставятся в печь группами не более
4-х штук в одну печь.
) одновременно в кабине можно работать только в
одной печи.
) Регулирование температуры в печи
осуществляется автоматически извне кабины. Необходимо включать дублирующий
прибор для подстраховки регулирующего прибора.
) Запрещается открывать кабину и входить в нее
во время работы. Открывать кабину можно только после остывания печи с
автоклавами до 90 С.
) Открывание автоклавов разрешается только после
полного их остывания до комнатной температуры.
) после каждого раскрытия автоклава необходимо
тщательно осмотреть его снаружи и внутри и о всех замеченных неисправностях и
дефектах сообщить зав. лабораторией или руководителю исследования.
) Освободив автоклав от продуктов реакции, его
необходимо тщательно вымыть горячей водой и просушить.
Проведём анализ технологических операций с точки
зрения опасностей и вредностей при выполнении исследований, позволяющий
разрабатывать профилактику травматизма и обозначим меры, которые необходимо
предпринимать для безопасного проведения данных технологических операций
(таблица Б 3).
Таблица Б 3 - Анализ технологических операций с
точки зрения опасностей и вредностей при их проведении
|
Наиме-нование
техноло-гических операций
|
Оборудова-ние
для проведения операции
|
Реактивы,
необходимые для проведения операции
|
Возможные
опасности и вредности при проведении данной технологической операции
|
Причины
проявления данной опасности и вредности
|
Меры
по безопасному проведению данной технологи-ческой операции
|
|
Золь-гель
метод
|
мешалка
|
NH4OH
|
Поражение
эл. током; Раздражение слизистой
|
Открытые
эл. контакты; Нет защитных средств
|
Заземление
оборудова-ния; Работа в тяге, работа в индивидуальных средствах защиты
|
|
Гидротер-мальный
синтез
|
Сушильный
шкаф, автоклав
|
Дистиллированная
вода
|
Термический
ожог, повышение давления в автоклаве
|
Прикосновение
к автоклаву или печи во время синтеза. Неправильные условия синтеза
|
Полное
соблюдение мер техники безопасности по работе с сосудами высокого давления.
|
Охрана окружающей среды
При проведении любых работ особое внимание нужно
уделить охране окружающей среды.
Данные об отходах, образующихся во время работы,
представлены в таблице Б 4.
Таблица Б 4 Характеристика производственных отходов
|
Отходы
|
Агрегатное
состояние
|
Количество
отходов
|
Вредные
вещества (примеси)
|
Примечание
(куда направляется отход)
|
|
Отработанные
реактивы: Fe(OH)3,
Al(OH)3
|
т
|
20
г.
|
Fe(OH)3,
Al(OH)3
|
В
канализацию
|
|
Отработанные
растворы:
NH4OH
|
ж
|
10
мл.
|
NH4OH
|
В
канализацию
|
Образующиеся отходы не содержат вредных веществ,
не нуждаются в дополнительной обработке и могут спокойно утилизироваться в
канализацию.
Приложение В
Стандартизация
Работа оформлена в соответствии с ГОСТ 7.32-91
«Отчет о научно-исследовательской работе. Структура и правила оформления» [38].
При выполнении дипломной работы была
использована следующая нормативно-техническая документация:
ГОСТ 7.9-95 Реферат и аннотация Общие требования
[39].
ГОСТ 7.1-2003 Библиографическая запись.
Библиографическое описание Общие требования и правила составления [40].
ГОСТ 12.4.021-75 Системы вентиляционные. Общие
требования [35].
НПБ 104-03 "Об утверждении норм пожарной
безопасности "Проектирование систем оповещения людей о пожаре в зданиях и
сооружениях" [37].
НПБ 105-03 "Определение категорий
помещений, зданий и наружных установок по взрывопожарной и пожарной
опасности" [32].
СНиП 23-05-95 Естественное и искусственное
освещение [35].
ГОСТ 12.1.005-88 Общие санитарно-гигиенические
требования к воздуху рабочей зоны [31].
ГОСТ 12.0.003-74 Опасные и вредные
производственные факторы [30].
Приложение Г
Патентный поиск
Перечень патентов, отобранных в процессе поиска
и написания дипломной работы, представлен в таблице Г 1.
Таблица Г 1 - Список патентов
|
Страна
|
Индекс
МПК
|
№
заявки
|
Название
патента
|
Дата
публикации
|
|
Япония
|
C01G
049/02
|
05/847,446
|
23.01.1979
|
|
Япония
|
C01G
049/02
|
06/210,351
|
Process for producing acicular
hydrated ferric oxide particles
|
13.07.1982
|
|
Соединённые
Штаты Америки
|
C01G
049/02
|
05/484,044
|
Hydrothermal process for
preparation of alpha iron oxide crystals
|
11.11.1975
|
|
Германия
|
C01G
049/02
|
07/024,563
|
Preparation of acicular
alpha-Fe.sub.2 O.sub.3
|
27.09.1988
|
|
Соединённые
Штаты Америки
|
C04B035/26
|
10/124,078
|
Synthesis of magnetite
nanoparticles and the process of forming Fe-based nanomaterials
|
08.11.2005
|
|
Соединённые
Штаты Америки
|
C01F
07/02
|
08/894,311
|
Firing sol-gel alumina particles
|
04.07.2000
|
|
Япония
|
B29C
071/00 C01F 007/02
|
09/396,010
|
Method for manufacturing plate
boehmite
|
11.06.2002
|
|
Страна
|
Индекс
МПК
|
№
заявки
|
Название
патента
|
Дата
публикации
|
|
Япония
|
C01F
07/02
|
09/142,440
|
Alumina sol, process for preparing
the same, process for preparing alumina molding using the same, and
alumina-based catalyst prepared thereby
|
09.01.2001
|