Инверсионно-вольтамперометрическое определение платины, родия
Введение
Платиновые металлы, соединения и
материалы на их основе (сплавы, катализаторы, порошки, покрытия, оксидные
пленки) сочетают в себе уникальные физические и химические свойства, благодаря
чему играют важную роль в разных отраслях промышленности. Россия входит в
тройку лидеров по производству платиновых металлов, которые образуют валютный
фонд государства [1].
Современный уровень развития науки и
техники выдвигает задачу определения малых количеств веществ во все более
сложных объектах, поэтому требования, предъявляемые к методам анализа следовых
количеств веществ, постоянно повышаются.
Актуальным также является разработка
условий анализа многокомпонентных систем.
Интерес к хлоридным и нитритным
комплексам был обусловлен тем, что при вскрытии руд платиновых металлов они
присутствуют в основном в виде хлоридных комплексов, а при аффинаже - в виде
нитритных. Вольтамперометрическому определению платиновых металлов в растворе
их нитритных комплексов предшествует стадия пробоподготовки: переведение нитритного
комплекса в хлоридный путем длительного упаривания с хлороводородной кислотой.
Недостатками данного способа являются длительность, трудоемкость и выделение
токсичных газов.
Целью данной работы является
исследование возможности инверсионно-вольтамперометрического определения
платины, родия при совместном присутствии в растворах их нитритных и хлоридных
комплексов.
Глава 1. Литературная часть
.1 Физико-химические свойства
платины, родия
Платина - химический элемент VIII
группы периодической системы, атомный номер 78, атомная масса 195,08, внешняя
электронная конфигурация 4f145d96s1. Серовато-белый пластичный металл.
Температуры плавления и кипения - 1769°С и 3800°С,удельное электрическое
сопротивление- 0,098 мкОм·м. Платина - один из самых тяжелых (плотность 21,5
г/см3, атомная плотность 6,62·1022ат/см³) и самых редких металлов: среднее содержание в земной коре 5·10-7
% по массе [2].
Платиновая чернь - мельчайший
порошок платины с размером частиц 20-40 мкм. Как и все мелкораздробленные
металлы, платиновая чернь имеет черный цвет. Каталитическая активность
платиновой черни намного выше, чем у компактного металла.
При комнатной температуре
металлическая платина весьма инертна, при нагревании в атмосфере кислорода
медленно окисляется с образованием летучих оксидов. В мелкораздробленном
состоянии поглощает большие количества кислорода. Платина растворяется в жидком
броме и в царской водке. При нагревании реагирует с другими галогенами,
пероксидами, углеродом, серой, фосфором, кремнием. Разрушается при нагревании
со щелочами в присутствии кислорода, поэтому в платиновой посуде нельзя плавить
щелочи.
В своих соединениях платина
проявляет почти все степени окисления от 0 до +8, из которых наиболее устойчивы
+2 и +4. Для платины, как и для родия и иридия, характерно образование
многочисленных комплексных соединений. Платина является очень активным
катализатором многих химических реакций, в том числе используемых в
промышленных масштабах. Используется при лечении больных раком легкого[3].
Родий - элемент побочной подгруппы
восьмой группы периодической системы химических элементов Д. И. Менделеева,
атомный номер 45, атомная масса 102,906, внешняя электронная конфигурация
4d85s15p05d0. Твёрдый переходный металл серебристо - белого цвета. Типичные
соединения родия (III) имеют глубокий тёмно-красный цвет.
Этот металл по химической стойкости
в большинстве коррозионных сред превосходит платину. Металлический родий
растворяется в царской водке при кипячении, а также электрохимически, анодно- в
смеси перекиси водорода и серной кислоты. Мелкоизмельчённый родий медленно
окисляется только при температуре выше 600 ˚C. Например, для превращения
200 мг родия в оксид нагреванием порошка металла в пламени горелки Бунзена
требуется 3 суток [4]. При нагревании медленно взаимодействует с
концентрированной серной кислотой, раствором гипохлорита натрия и
бромоводорода. При спекании реагирует с расплавами гидросульфата калия KHSO4,
пероксида натрия Na2O2 и пероксида бария BaO2.
Высшую степень окисления +6 родий
проявляет в гексафториде RhF6, который образуется при прямом сжигании родия
вофторе. В низших степенях окисления +1 и +2 родий образует комплексные
соединения. Наиболее распространенные степени +1 и +3.
.2 Хлоридные комплексы платины,
родия
Платина образует два ряда
комплексных хлоридов: производные платины (IV) общей формулы Mn[PtCl6] и
производные платины (II) типа M2[PtCl4], где М - водород или щелочные,
щелочноземельные элементы, органические основания. Соединения платины (IV)
получают главным образом растворением металла в смеси соляной и азотной кислот,
при этом наряду с H2[PtCl6]·6H2O (оранжево-красные кристаллы, расплывающиеся на
воздухе) образуется и нитрозосоль (NO)2[PtCl6], которую можно перевести в
платинохлористоводородную кислоту повторной обработкой раствора горячей водой и
соляной кислотой. Стандартный окислительно-восстановительный потенциал пары
[PtCl6]2-/ [PtCl4]2- он составляет +0,7 В.
При реакции обмена H2[PtCl6] с
солями калия, рубидия, цезия и аммония (карбонатами и галогенидами) получают
характерные желтые малорастворимые хлороплатинаты [5].
Система Rh(III) - Н2O - CI-
характеризуется сложными превращениями, включая акватацию, гидролиз, реакции
изомеризации и полимеризации. Протекающие при этом в данной системе
гидролитические процессы не сопровождаются изменением степени окисления
центрального атома. Стандартный окислительно-восстановительный потенциал пары
[RhCl6]3- /Rh равен +0,43 В, а для пары [RhCl6]2-/ [RhCl6]3- он составляет +1,2
В.
При концентрации родия в растворе
5·10-3 - 7,5·10-4 М, и рН 3,3 - 4,5 начинается гидролиз. В щелочных растворах
происходит быстрое замещение хлорид-ионов на ОН--группы и образование
полиядерных гидроксокомплексов с высокой степенью полимеризации [6].
Таблица 1 - Химические формы
нахождения комплексов родия (III) в солянокислых растворах
|
Комплекс
|
Концентрация HCl, M
|
|
[RhCl6]3-
|
6,00-11,00
|
|
[RhCl6]3-, [Rh(H2O) Cl5]2-
|
2,00-6,00
|
|
[Rh(H2O) Cl5]2-, [Rh(H2O)2Cl4]-
|
0,50-2,00
|
|
[Rh(H2O)2Cl4]-
|
0,25-0,50
|
|
[Rh(H2O)2Cl4]-, [Rh(H2O)3Cl3]0
|
0,10-0,25
|
Области доминирования
хлорокомплексов родия (III) в НСl - растворах при t = 25 °С с концентрацией по
металлу 5·10-4 М приведены в таблице 1.
.3 Нитритные комплексы платины,
родия
Комплексы рассматриваемых металлов с
нитрит ионами в качестве лигандов образуются при нитровании нитритом натрия и
замещения лигандов во внутренней сфере исходных, например хлоридных комплексов
на ион NO2-. В нитрокомплексах платиновые металлы проявляют более низкие
характерные для них степени окисления по сравнению с другими их комплексными
соединениями. Известны комплексы следующего состава: [M(NO2)4]2-, где М =
Pd(II), Pt(II); [M'(NO2)6]3-, где М' = Rh(III). Различие в составе и свойствах
указанных соединений обусловливает возможность разделения близких по свойствам
платиновых металлов. Нитритные комплексы хорошо растворимы в водных растворах и
не гидролизуются.
Нитрокомплексы платины, родия в
аффинажном производстве получают путем нитрования исходных хлоридных
комплексов:
[PtCl6] + 7NaNO2 = Na2[Pt(NO2)4] +
4NaCl + NO2↑ + 2HC1, (4)[RhCl6] + 6NaNO2 = Na3[Rh(NO2)6] + 3НС1 + 3NaCl. (5)
При последующей операции осаждения
происходит сильное разогревание растворов и выделение ядовитых паров оксидов
азота:
+ НС1 = NaCl + HNO2, (7)
HNO2 → NO2 + NO + H2O, (8)
HC1 + 2NaNO2 = 2NaCl + NO2 + 8NO +
H2O. (9)
Кроме того, операция нитрования
проводится для очистки растворов от неблагородных металлов, которые выделяются
в форме гидроксидов:
МеС13+ 3NaNО2+ 3Н2О = Ме(ОН)3↓
+ 3NaCl + 3HNО, (10)
МеС12 + 2NaNO2+ 2Н2О = Ме(ОН)2↓+
2NaCl + 2HNО2. (11)
Золото при этом восстанавливается до
элементного состояния:
Н[АuСl4] + 6NaNО2 → 2Аu↓
+ 6NaCl + 6NО2 + 2НС1. (12)
Нитритные комплексы родия и платины
характеризуются тяжело разрушаемой структурой, что приводит к безвозвратной
потере металлов в аффинажном производстве, особенно их микроколичеств за счет
невозможности перевода их в более лабильные соединения [7].
.4 Технологические аспекты аффинажа
платиновых металлов
На аффинаж поступает как первичное
сырье (концентраты шламов и «шлиховая платина»), так и вторичное (электронный
лом, отработанные электролиты и катализаторы). Выбор оптимальной
технологической схемы и режимов технологических операций зависит от состава
продуктов, подлежащих переработке. С целью максимального извлечения ценных
металлов с минимальными потерями, а также с целью сокращения незавершенного
производства, необходимо рационально сочетать в технологическом цикле известные
методы и приемы [8].
Аффинаж по классической схеме
предусматривает выделение платиновых металлов в виде труднорастворимых
комплексных соединений с последующим их прокаливанием и получением
аффинированных порошков. Следует подчеркнуть, что в настоящее время и в нашей
стране, и за рубежом для вскрытия платиносодержащего сырья используется процесс
нитрования, в результате которого все металлы платиновой группы переходят в
раствор в виде комплексных нитритов, золото остается в твердом остатке в
элементном состоянии. Процесс нитрования платиновых металлов ведут раствором
NaNO2 в соотношении 1:1. Избытка NaNO2 следует избегать, т.к. при последующей
операции осаждения солей возможно сильное разогревание растворов и выделение
оксидов азота и может произойти высаливание металлов в гидраты. Заметим, что
если в гидратах повышено содержание платиновых металлов, то их промывку ведут
хлоридными растворами. Растворы от промывки гидратов присоединяют к
пронитрованным растворам.
Такие растворы поступают на операцию
выделения концентрата раствором NH4C1, содержащего смешанные соли натрия и
аммония.
Процесс электролиза осуществляется в
электролитической ванне с титановым катодом, который навешивается на медные
штанги, покрытые платиновой фольгой, и анодом из титана.
Последняя операция - очистка
выделившегося на катоде металла от примесей. После проверки раствор
декантируется и промывается дистиллированной водой до отсутствия в пробе хлора
и свинца. В ходе данного этапа происходят самые значительные потери
металловзасчет невозможности их экспрессного детектирования в смывных водах
[9].
.5 Методы определения платины, родия
платина родий инверсионный
вольтамперометрический
1.5.1 Атомно-адсорбционный анализ
Методы атомно-абсорбционной
спектроскопии используются в анализе практически любого технического или
природного объекта, особенно там, где необходимо определить небольшие
содержания элементов.
Широко применяется
атомно-абсорбционное определение металлов платиновой группы в продуктах с
высоким их содержанием (шламы, концентраты и др.) Предложены методы прямого
определения элементов без их разделения и отделения от сопутствующих металлов.
При анализе бедных продуктов
определению предшествует стадия концентрирования, используя, например,
пробирное коллектирование или экстракцию [10].
Известны также методики определения
металлов платиновой группы в биологических образцах методом электротермической
атомно-абсорбционной спектроскопии [11].
Отходы горно-металлургического
производства для определения потери благородных металлов анализируют
атомно-абсорбционным методом с предварительным химическим разложением проб.
Предел обнаружения с помощью
атомно-абсорбционного анализа для многих элементов характеризуется величиной
порядка 10-5-10-6 %. Погрешность определения обычно составляет примерно 5% и в
зависимости от различных условий изменяется в пределах от 3 до 10%.
Метод имеет также ряд ограничений:
не определяются элементы, резонансные линии которых лежат в далеком
ультрафиолете; трудность многоэлементного анализа; дорогостоящее оборудование и
материалы [12].
.5.2 Атомно-эмиссионный анализ
Атомно-эмиссионный спектральный
анализ (АЭСА) - метод элементного анализа, основанный на изучении спектров испускания
свободных атомов и ионов в газовой фазе в области длин волн 150-800 нм.
Для определения металлов платиновой
группы в пробах сульфидных медно-никелевых руд с малым (10-2-10-8%) их
содержанием, при значительном содержании в этих пробах меди, никеля, железа,
наибольшее применение получил эмиссионный спектральный анализ в сочетании с
эффективными методами, позволяющими определять благородные металлы и
концентрировать их из больших навесок.
Для прямого определения металлов в
порошковых и солевых пробах разработаны схемы с применением атомизатора,
включающего печь-пламя, дугу переменного тока и последующий искровой разряд с
абсолютной чувствительностью 10-8г для навесок массой 1 г с коэффициентом
вариации 7-10%. Для анализа металлических сплавов рекомендуется использовать
искровой разряд. При этом образуются пары и аэрозоль, которые вдуваются в
пламя.
Для определения концентраций
платиновых металлов в сплавах золота и серебра (если сплавы содержат более 1 %
металлов платиновой группы) применяется эмиссионно-спектральный анализ с
использованием квантометров [13].
Чувствительность и точность АЭСА
главным образом зависят от физических характеристик источников возбуждения
спектров - температуры, концентрации электронов, времени пребывания атомов в
зоне возбуждения спектров, стабильности режима источника и т. д. Для решения
конкретной аналитической задачи необходимо выбрать подходящий источник
излучения, добиться оптимизации его характеристик с помощью различных приемов -
использование инертной атмосферы, наложение магнитного поля, введение
специальных веществ, стабилизирующих температуру разряда, степень ионизации
атомов, диффузионные процессы на оптимальном уровне и т.д. Ввиду многообразия
взаимовлияющих факторов при этом часто используют методы математического планирования
экспериментов [14].
Инверсионная вольтамперометрия (ИВ)
- это метод электрохимического анализа, в котором для снижения нижней границы
определяемых концентраций используется предварительное концентрирование анализируемого
компонента на рабочем электроде с помощью различных электрохимических или
химических реакций с последующей регистрацией вольтамперограммы концентрата
(кривой “ток - потенциал”). На такой вольтамперограмме будет наблюдаться пик
(рисунок 1), положение которого на оси потенциалов характеризует природу
определяемого компонента, а высота определяется концентрацией накопленного на
электроде вещества и, следовательно, является аналитическим сигналом.
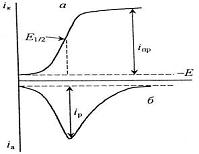
а - электронакопление; б - окисление
концентрата
Рисунок 1 - Схематическое
изображение принципа инверсионной вольтамперометрии
Вольтамперные инверсионные методы
называют катодными или анодными в зависимости от характера инверсионного потока
(восстановления или окисления соответственно). Направление поляризации
электрода зависит от свойств накопленного вещества [15].
Процесс измерения включает несколько
стадий. В наиболее распространенном варианте метода - анодной ИВ, реализуют
обычно четыре стадии:
.Электрохимическая регенерация
поверхности индикаторного электрода: потенциал регулируется в пределах 0 - 650
мВ.
.Электроконцентрирование
определяемых металлов на поверхности индикаторного электрода в режиме
предельного тока при вращении электрода и поддержании отрицательного потенциала
Еэ в пределах от 0 до -1500 мВ.
.Успокоение раствора перед съемкой
вольтамперной кривой. Потенциал электрода поддерживается близким потенциалу
стадии накопления (Е3 = Е2).
.Измерительная стадия. Потенциал
линейно изменяют от Е3 до Е1. Скорость развертки задается в пределах 60-300
мВ/с [16].
В последние годы активно применяют
модифицированные электроды для устранения влияния так называемых «химических
шумов» - совокупности токов разряда примесей и емкостных составляющих.
Инверсионный вольтамперометрический
метод является одним из самых чувствительных методов используемых в микро- и
даже суб-микро анализе количества органических и неорганических веществ.
Основные метрологические
характеристики - коэффициент чувствительности, границы определяемых содержаний
и предел обнаружения [17].
Существенными преимуществами
инверсионных электрохимических методов являются:
возможность определения
значительного числа химических элементов Периодической системы и многих
органических веществ;
низкие пределы обнаружения,
достигающие для некоторых элементов (Cd, Bi, Tl, Pb, Sb, Ni) и органических
веществ уровня 10-9 - 10-11 М;
высокая селективность и хорошие
метрологические характеристики методик на их основе;
легкость компьютеризации и
автоматизации аналитических определений;
относительная простота и
сравнительная дешевизна приборов;
наличие приборов новых моделей,
выпускающихся в последнее время в Санкт-Петербурге и Томске [18].
Глава 2. Экспериментальная часть
.1 Реактивы, приборы и посуда
[PtCl6], х.ч.,[RhCl6],
х.ч.,[Pt(NO2)4]·6 H2O, х.ч.,[Rh(NO2)6]·6 H2O, х.ч.,концентрированная, х.ч.,,
ч.д.а.,SO4, ч.д.а.,, ч.д.а.,, ч.д.а.,
Муравьиная кислота, ч.д.а.,
Дистиллированная вода,
Аналитические весы METTLER TOLEDO,
Анализатор вольтамперометрический
ТА-4 (OOO «НПП Томьаналит»),
Стаканчики из оптически прозрачного
кварца вместимостью 20 мл,
Рабочий электрод -
углеродсодержащий,
Электрод сравнения - хлорсеребряный,
Вспомогательный электрод -
хлорсеребряный,
Пипетки стеклянные вместимостью
0,1;0,5; 1,0; 2,0; 5,0; 10,0 мл,
Мерные колбы на 25, 50, 100 мл,
Дозатор пипеточный, ТУ 64 - 1 - 3329
- 81, 5-50мкл.
2.2 Подготовка к проведению
вольтамперометрического определения
.2.1 Подготовка электродов
Углеродсодержащий электрод применяют
в качестве рабочего. При подготовке поверхности электрода к работе срезают
торец толщиной 0,3 - 0,5 мм и промывают дистиллированной водой.
Хлорсеребрянный электрод принимают в
качестве электрода сравнения и вспомогательного электрода. Перед работой
серебряную спираль выкручивали против часовой стрелки из корпуса электрода.
Корпус заполняли с помощью шприца раствором KCl 1М. Аналогичным образом
готовили все шесть электродов, используемых в работе.
.2.2 Приготовление растворов
Растворы хлорида калия, нитрата
калия и нитрита натрия готовили путем разбавления точных навесок в
дистиллированной воде.
Растворы соляной и серной кислот
готовили путем разбавления концентрированных кислот в дистиллированной воде.
Растворы хлоридных комплексов
платины, родия концентрацией 1 мг/л готовили разбавлением более
концентрированных растворов в 1М соляной кислоте.
.3 Методика выполнения измерений на
анализаторе ТА-4
Выполнение измерений проводят в три
этапа: отмывка электрохимической ячейки; проверка стаканчиков, фонового
раствора и электродов на чистоту; измерение концентраций определяемых элементов
в анализируемой пробе и в пробе с добавкой. Проводят проверку методики и
работоспособности электродов методом «введено-найдено».
Перед анализом каждой пробы проводят
отмывку стаканчиков и электродов: наливают по 10 мл дистиллированной воды в
стаканчики и устанавливают их в анализатор. Проводят отмывку ячеек при
потенциале 0,5 В в течении 120 секунд, операцию повторят трижды, меняя воду.
Проверяют стаканчики, фоновый раствор и электроды на чистоту: в стаканчики вносят
10 мл дистиллированной воды и добавляют 0,2 мл фонового электролита. Стаканчики
с полученным фоновым раствором и электроды устанавливают в анализатор и
начинают регистрацию вольтамперограмм фона. Регистрируют три воспроизводимые
вольтамперограммы. Стаканчики, фоновый раствор и электроды считают чистыми,
если на вольтамперограммах отсутствуют пики определяемых элементов. В
проверенный фоновый электролит добавляют аликвотную часть анализируемой пробы и
приступают к проведению измерений величины силы тока, соответствующей
концентрации определяемого элемента. Регистрируют три воспроизводимые
вольтамперограммы пробы. Далее в ячейки вносят добавку стандартных образцов
исследуемых металлов и запускают регистрацию вольтамперограмм пробы с добавкой.
Обрабатывают полученные вольтамперограммы фона, пробы и пробы с добавкой:
усредняют и при необходимости корректируют линии остаточного тока [19].
.4 Результаты эксперимента и их
обсуждение
.4.1 Выбор оптимальных параметров
вольтамперометрического определения платины, родия и иридия
Природа фонового электролита,
потенциал и время электрохимического накопления определяемого элемента на
рабочем электроде - предопределяющие параметры при вольтамперометрическом
определении металлов.
Влияние природы фонового электролита
Фоновый электролит кроме уменьшения
сопротивления раствора, может выполнять ряд дополнительных функций:
образовывать комплексы с
определяемыми элементами и тем самым способствовать их концентрированию на
электроде;
устранять мешающее влияние
компонентов, присутствующих в пробе, на процесс накопления или регистрации пика
исследуемого элемента;
выполнять роль буфера для
стабилизации рН раствора.
При выборе фонового электролита для
вольтамперометрического определения платины руководствовались литературными
данными [15,16], на основании которых пригодными были выбраны электролиты
следующего состава [20]:
М HCl, 1 M H2SO4, концентрированная
муравьиная кислота для определения платины из хлоридных комплексов. Пример
вольтамперограммы восстановления платины представлен на рисунке 2.
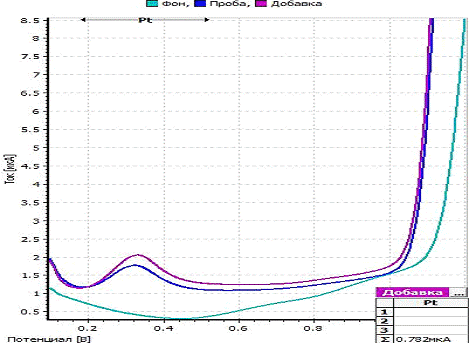 -
вольтамперограмма фона; b - вольтамперограмма пробы; c - вольтамперограмма
пробы с добавкой; CPt=2,50 мг/л; фон - 2 М HCl; Енак = 0,6 В; tнак = 80 с
-
вольтамперограмма фона; b - вольтамперограмма пробы; c - вольтамперограмма
пробы с добавкой; CPt=2,50 мг/л; фон - 2 М HCl; Енак = 0,6 В; tнак = 80 с
Рисунок 2 - Экспериментальные
вольтамперограммы определения платины из раствора ее хлоридного комплекса
H2[PtCl6]
Максимум кривой анодного растворения
платины из раствора ее хлоридного комплекса H2[PtCl6] находится при потенциале
0,35 В.
Критерием выбора фонового
электролита, пригодного для анализа, послужило наличие четко выраженного пика
определяемого элемента на вольтамперной кривой.
M KNO3, 1 M H2SO4, концентрированная
HCOOH для определения платины из нитритных комплексов. Пример вольтамперограммы
восстановления платины представлен на рисунке 3.
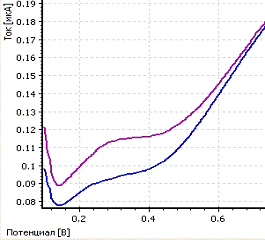 -
вольтамперограмма пробы; b - вольтамперограмма пробы с добавкой; CPt= 0,1 мг/л;
фон - HCOOH; Енак = - 0,6 В; tнак = 200 с
-
вольтамперограмма пробы; b - вольтамперограмма пробы с добавкой; CPt= 0,1 мг/л;
фон - HCOOH; Енак = - 0,6 В; tнак = 200 с
Рисунок 3 - Экспериментальные
вольтамперограммы определения платины из раствора ее нитритного комплекса
H2[Pt(NO2)4]
Максимум кривой анодного растворения
платины из раствора ее нитритного комплекса H2[Pt(NO2)4] находится при
потенциале 0,35 В. Следовательно, форма нахождения платины не влияет на
положение максимума на вольтамперной кривой.
Пригодными фоновыми электролитами
для вольтамперометрического определения хлоридных и нитритных комплексов родия
(III) являются: 1 M H2SO4 и концентрированная муравьиная кислота.
Пример вольтамперограмм представлен
на рисунке 4.
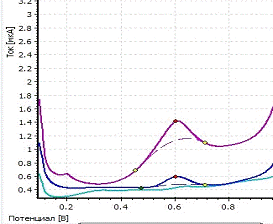
a - вольтамперограмма фона; b
-вольтамперограмма пробы; c - вольтамперограмма пробы с добавкой; CRh= 1 мг/л;
фон - HCOOH; Енак = 0,6 В; tнак = 150 с
Рисунок 4 - Экспериментальные
вольтамперограммы определения родия из раствора его хлоридного комплекса
H3[RhCl6]
Максимум кривой анодного растворения
родия находится при потенциале 0,60 В.
Универсальным фоновым электролитом
для определения платины, родия при совместном присутствии является
концентрированная муравьиная кислота.
Потенциал накопления, подаваемый на
рабочий электрод, должен поляризовать его таким образом, чтобы протекал процесс
накопления только определяемого элемента на поверхности электрода.
Изменяя потенциал накопления в
диапазоне от -0,400 до -0,800 В, установили оптимальное значение для
электровосстановления платины, родия и иридия на электродах.
Полученные данные представлены в
таблице 2.
Таблица 2 - Данные влияния
потенциала накопления на точность вольтамперометрического определения платины,
родия
|
Определяемый металл (Ераст, В)
|
Введено, мг/л
|
Потенциал накопления, В
|
Найдено, мг/л
|
Относительное стандартное отклонение, Sr
|
|
Pt (0,35)
|
0,100
|
-0,400
|
0,077±0,009
|
0,045
|
|
|
-0,500
|
0,093±0,009
|
0,038
|
|
|
-0,600
|
0,103±0,009
|
0,033
|
|
|
-0,700
|
0,107±0,022
|
0,084
|
|
Rh (0,60)
|
0,100
|
-0,400
|
0,092±0.006
|
0,028
|
|
|
-0,500
|
0,086±0.011
|
0,052
|
|
|
-0,600
|
0,101±0,001
|
0,003
|
|
|
-0,700
|
0,105±0,024
|
0,091
|
|
|
-0,700
|
0,091±0,008
|
0,033
|
|
|
-0,800
|
0,101±0,001
|
0,004
|
Из полученных данных видно, что
наименьшая ошибка определения наблюдается при потенциалах накопления: -0,600 В
для платины и родия, Данные влияния потенциала накопления на определение
платины, родия из одной аликвоты представлены в таблице 3.
При определении металлов из одной
аликвоты был выбран потенциал -0,600 В, обеспечивающий электровосстановление
платины, родия на поверхности углеродсодержащего электрода.
Таблица 3 - Данные влияния
потенциала накопления на точность вольтамперометрического определения платины,
родия при совместном присутствии в растворе; фон - HCOOH; tнак = 200 с
|
Введено, мг/л
|
Потенциал, В
|
Найдено, мг/л
|
|
|
Pt
|
Rh
|
|
0,40
|
-0,600
|
0,40±0,13
|
0,32±0,10
|
|
-0,700
|
0,49±0,17
|
0,44±0,13
|
|
-0,800
|
0,40±0,02
|
0,39±0,04
|
Определение оптимального времени
накопления
Время накопления варьируют от 80 до
300 секунд. Полученные данные зависимости вольтамперометрического определения
платины, родия от изменения времени накопления металлов представлены в таблице
4.
Таблица 4 - Влияние времени
накопления металлов на эффективность их определения
|
Определяемый металл (Ераст, В)
|
Введено, мг/л
|
Найдено, мг/л
|
|
|
t=80 c
|
t=150 c
|
t=200 c
|
t=300 c
|
|
Pt (0,35)
|
0,001
|
0
|
0
|
0,0006
|
0,001
|
0,001
|
|
0,100
|
0,036
|
0,085
|
0,097
|
0,114
|
0,125
|
|
0,500
|
0,080
|
0,213
|
0,503
|
0,841
|
0,898
|
|
1,000
|
0,410
|
0,965
|
1,007
|
1,439
|
1,742
|
|
Rh (0,60)
|
0,001
|
0
|
0
|
0,0009
|
0,001
|
0,0012
|
|
0,100
|
0,084
|
0,087
|
0,094
|
0,103
|
0,116
|
|
0,500
|
0,456
|
0,486
|
0,507
|
0,524
|
0,568
|
|
1,000
|
0,934
|
0,987
|
1,002
|
1,109
|
1,151
|
Из полученных данных видно, что
оптимальное время накопления металлов составляет 250 с для растворов с
концентрацией меньше 0,1 мг/л; 200 с - для растворов с концентрацией выше 0,1
мг/л.
.4.2 Нахождение диапазона
определяемых концентраций
Диапазон определяемых концентраций
платины, родия исследуют методом «введено-найдено». В стаканчики с проверенным
на чистоту фоновым раствором добавляют 0,1 мл раствора исследуемого металла с
концентрацией 1 мг/л и проводят измерение тока, соответствующего определяемого
элемента в растворе. Далее в каждую ячейку вносят 0,1 мл добавки с
концентрацией 1 мг/л и запускают регистрацию вольтамперограмм пробы с добавкой.
Получают три воспроизводимые вольтамперограммы и обрабатывают их. Такие же
операции проводят для серии растворов определяемого металла с различными
концентрациями [21].
Результаты значений диапазона
определяемых концентраций платины, родия приведены в таблицах 5-6.
Таблица 5 - Результаты определения
концентрации платины из раствора хлоридного комплекса на фоне 2М соляной
кислоты; Енак = - 0,6 В
|
Введено Pt (IV), мг/л
|
Найдено Pt (IV), мг/л
|
Относительное стандартное отклонение, Sr
|
|
0,010
|
0,013 ± 0,017
|
0,54
|
|
0,050
|
0,037 ± 0,020
|
0,22
|
|
0,100
|
0,094 ± 0,015
|
0,06
|
|
0,400
|
0,367 ± 0,010
|
|
1,000
|
0,985 ± 0,050
|
0,02
|
|
1,500
|
1,378 ± 0,273
|
0,08
|
|
2,000
|
1,850 ± 0,388
|
0,08
|
Экспериментально установленный
диапазон определяемых концентраций платины в растворе его хлоридного комплекса
на фоне 2 М соляной кислоты составил 0,1 - 2,5 мг/л.
Таблица 6 - Результаты определения
концентрации родия на фоне концентрированной муравьиной кислоты; Енак = - 0,6 В
|
Комплекс
|
Введено Rh, мг/л
|
Найдено Rh, мг/л
|
Относительное стандартное отклонение, Sr
|
|
[RhCl6]3-
|
0,001
|
0,001
|
0,01
|
|
1,000
|
1,000±0,07
|
0,03
|
|
[Rh(NO2)6]3-
|
0,001
|
0,001
|
0,14
|
|
1,000
|
1,000±0,24
|
0,09
|
Экспериментально установленный
диапазон определяемых концентраций родия на фоне концентрированной муравьиной
кислоты в растворе его хлоридных комплексов составил от 0,001 мг/л до 1,000
мг/л.
2.4.3 Определение платиновых
металлов при совместном присутствии в растворе
Разность потенциалов анодного
растворения платины (0,35 В), родия (0,60 В) указывает на возможность
раздельного определения металлов при их совместном присутствии в растворе.
Данные определения платины и родия
при совместном присутствии представлены на рисунке 5 и в таблице 7.
Таблица 7 - Результаты
вольтамперометрического определения массовых концентрации платины и родия в
растворе, содержащем их хлоридные комплексы; фон - HCOOH; Енак = 0,6 В
|
Введено Pt,Rh, мг/л
|
Найдено, мг/л
|
Относительное стандартное отклонение, Sr
|
|
Pt
|
Rh
|
Pt
|
Rh
|
|
0,10
|
0,12 ± 0,07
|
0,10 ± 0,02
|
0,18
|
0,06
|
|
0,40
|
0,38 ± 0,13
|
0,42 ± 0,02
|
0,11
|
0,01
|
|
1,00
|
1,02 ± 0,05
|
1,00 ± 0,07
|
0,02
|
0,02
|
Диапазон определяемых концентраций
платины и родия при совместном присутствии составил 0,1 - 1,0 мг/л.
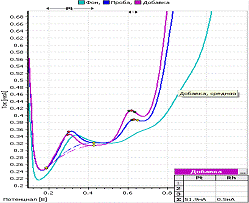 -
вольтамперограмма фона; b - вольтамперограмма пробы; c - вольтамперограмма
пробы с добавкой; CPt=CRh=0,01 мг/л; фон - HCOOH Енак = 0,6 В; tнак = 250 с
-
вольтамперограмма фона; b - вольтамперограмма пробы; c - вольтамперограмма
пробы с добавкой; CPt=CRh=0,01 мг/л; фон - HCOOH Енак = 0,6 В; tнак = 250 с
Рисунок 5 - Вольтамперограмма
определения платины и родия при совместном присутствии их в растворе
На вольтамперограмме видны два четко
выраженных пика платины и родия при потенциалах, соответствующих определяемым
элементам.
Экспериментально установленный
диапазон определяемых концентраций платины, родия при совместном присутствии в
растворе, содержащем их хлоридные комплексы на фоне концентрированной
муравьиной кислоты составил 0,1 - 1,0 мг/л.
Полученные данные не превышают
погрешность, предусмотренную возможностями метода, равную 20%.
Выводы
. Показана возможность прямого
определения микроколичеств платины, родия в растворах их хлоридных комплексов
методом инверсионной вольтамперометрии с использованием в качестве
индикаторного углеродсодержащего электрода в диапазоне концентраций 0,1 - 1,0
мг/л. Ошибка определения не превышает 20%.
. Исследована серия фоновых
электролитов, из которых универсальным фоновым электролитом для определения
платины, родия при совместном присутствии является концентрированная муравьиная
кислота.
. Экспериментально установлены
диапазоны определяемых концентраций индивидуальных металлов и при их попарном
присутствии в растворе: платина и родий (0,1 - 1,0 мг/л).
. Установлено оптимальное время
накопления платины, родия. Оно составляет 250 с для растворов с концентрацией
меньше 0,10 мг/л; 200 с -для растворов с концентрацией выше 0,10 мг/л.
. Выбрана величина потенциала
накопления: -0,600 В для растворов платины и родия. Потенциал определения
данных металлов при совместном присутствии составил -0,600 В.
Список литературы
1. Буслаева, Т.М. Платиновые металлы и их роль в современном
обществе / Т.М. Буслаева. - М.: Химия, 1999. - 327 с.
. Колпакова, Н.А. Определение платины методом инверсионной
вольтамперометрии в биологических тканях у больных раком легкого / Н.А.
Колпакова, Е.А. Смышляева, А.А. Завьялов // Известия Томского политехнического
университета. - 2003. - Т.306, №4. - С. 84 - 86.
. Третьяков,Ю.Д. Неорганическая химия / под ред. Ю. Д. Третьякова.
Т.3: Химия переходных элементов. Кн.2: учебник для студ. высш. учеб.заведений -
М.: Академия, 2007.-400с.
. Ливингстон, С. Химия рутения, родия, палладия, осмия, иридия,
платины / С. Ливингстон. - М.: Мир, 1978. - 367 с.
. Реми, Г. Курс неорганической химии/ Г.Реми.- М.: Мир,
1974.-755с.
. Зайцев, Н.К. Альтернативные методы вскрытия маслорастворимых
проб в инверсионной вольтамперометрии / Н.К. Зайцев,Е. А. Осипова, В. И.
Игнатов // Аналитическая химия - новые методы и возможности: сб. мат. конф.,
май 2010, МГУ. - М., 2010. - С. 178- 182.
.Клебанов, О.Б. Справочник технолога по обогащению руд цветных
металлов / О.Б. Клебанов, Л.Я. Шубов, Н.К. Щеглова.-М.: Недра, 1974.- 472с.
. Химия / В.Шретер, К.Х.Лаутеншлегер, А. Бибрак; пер. с нем.-М.:
Химия, 1989. - 648 с.
. Гинзбург, С.И. Аналитическая химия платиновых металлов / С.И.
Гинзбург. - М.: Наука, 1972. - 614 с.
. Хвостова, В. П., Химические методы вскрытия платиносодержащих
руд и горных пород / В.П. Хвостова, В. Головня // Заводская лаборатория. -
1982. - Т. 48, №7 - С. 3.
. Колпакова, Н.А. Определение платиновых металлов в рудах и
концентратах методом инверсионной вольтамперометрии / Н. А. Колпакова, Ю. А.
Иванов, А.Ф. Коробейников // Платина России. Проблемы развития минерально -
сырьевой базы платиновых металлов. - М.: Геоинформмарк, 1995. - Т. II, Кн. 1.-
С. 181.
. Звягинцев, О. Е. Аффинаж золота, серебра и металлов платиновой
группы / О. Е. Звягинцев. - М.: Химия, 1945. - 245 с.
. Барышников, И. Ф.Пробоотбирание и анализ благородных металлов
/И.Ф. Барышников. - М.: Металлургия, 1978. - 431с.
. Zimmermann, S., Messerschmidt J., Von Bohlen A., Sures B.
Determination of Pt, Pd and Rh in biological samples by electrothermal atomic
absorption spectrometry as compared with adsorptive cathodicsripping
voltammetry and total-reflection X-ray fluorescence analysis // Anal.
Chim.Acta. - 2003. - № 498. - P. 93 - 104.
.Петрухин, О.М. Химические методы анализа / О.М. Петрухин. - М.:
Химия, 2009. - 400 с.
. Воробьёва, С.В. Методы анализа металлов платиновой группы,
золота и серебра / С. В. Воробьёва. - Оренбург: ГОУ ВПО ОГУ, 2004. - 18 с.
. Зайдель, А.Н. Основы спектрального анализа / А. Н. Зайдель. -
М.: Химия,1965. - 245 с.
. Harvey, D. Modern analytical chemistry / D. Harvey. - New York:
McGraw-Hill, 2000. - 805 p.
. Электроаналитические методы: теория и практика / под ред. Ф.
Шольца; пер. с англ. под ред. В. Н. Майстренко. - М.: БИНОМ, 2009. - 326 с.
. Нейман, Е. Я. Руководство по эксплуатации анализатора
вольтамперометрического ТА - 4 / Е. Я. Нейман - Томск: Томь Аналит, 2010. - 125
с.