Адсорбция ПАВ из растворов на твердом адсорбенте и определение его удельной поверхности
Лабораторная
работа
Тема:
Изучение
адсорбции ПАВ из растворов на твердом адсорбенте и определение его удельной
поверхности. Применение уравнения Фрейндлиха и Ленгмюра для описания адсорбции
органических кислот на активированном угле
Цель работы:
Получение изотерм поверхностного
натяжения растворов ПАВ на границе с воздухом; определение предельной адсорбции
ПАВ из водного раствора на угле; вычисление удельной поверхности адсорбента
С ростом концентрации раствора число молекул ПАВ
в адсорбционном слое увеличивается. При некоторой концентрации раствора может
образоваться предельно насыщенный адсорбционный слой, так называемый “частокол
Ленгмюра”. При введении адсорбентов в водные растворы ПАВ молекулы ПАВ
адсорбируются на границе вода - твердая поверхность.
Согласно правилу Ребиндера при адсорбции ПАВ
разность полярностей между адсорбентом и растворителем уменьшается. Все
полярные гидрофильные поверхности адсорбируют ПАВ из неполярных и слабополярных
жидкостей. Неполярные сорбенты, такие, как уголь или некоторые полимерные
материалы, наоборот, хорошо адсорбируют ПАВ из полярных жидкостей. На адсорбцию
ПАВ из растворов существенное влияние оказывает и пористость сорбента. Влияние
пористости определяется соотношением размеров пор и молекул ПАВ. С уменьшением
размеров пор адсорбция небольших молекул ПАВ, как правило, возрастает. Однако
это наблюдается, только если молекулы ПАВ имеют размеры, позволяющие проникнуть
в поры адсорбента. По истечении определенного времени в системе адсорбент -
водный раствор ПАВ устанавливается равновесие между количеством А
молекул ПАВ, перешедших на поверхность сорбента, и их объемной равновесной
концентрацией С.
Это равновесие может быть описано уравнением
Ленгмюра, при этом емкость монослоя А отвечает предельной адсорбции. Для
более точного определения величины А предпочтительнее использовать
уравнение Ленгмюра в линейной форме:
/А = 1/А + (1/ (А
К)) . (1/С) А = х / m
(I)
Графически зависимость
/А = f
(1/С)
выражается прямой, пересекающей ось ординат.
Отрезок, отсекаемый от оси ординат, определяет
величину, обратную емкости монослоя. Тангенс угла наклона прямой позволяет
найти константу адсорбционного равновесия К.
Процесс адсорбции протекает обычно с очень
большой скоростью. Однако диффузия растворенного вещества в растворах,
посредством которой восполняется убыль концентрации у поверхности адсорбента,
происходит весьма медленно, что замедляет установление адсорбционного
равновесия. Для более быстрого установления равновесия рекомендуется
перемешивать или встряхивать растворы с адсорбентом. В большинстве случаев
равновесие достигается в течение нескольких минут, только при мелкопористых
сорбентах и больших молекулах адсорбированного вещества процесс длится
несколько суток. Исследование адсорбции из растворов твердыми сорбентами ведут
при определенной температуре, учитывая изменение концентрации раствора после
сорбции. Поэтому всегда необходимо оперировать с растворами определенного
объема и известной концентрации.
Экспериментальная часть
Прежде всего определяют концентрацию данной для
опыта кислоты посредством титрования раствором NaОН.
Результаты титрования записываются в таблицу 1.
Таблица
1
|
Аликвотная
часть раствора уксусной кислоты Vа,см3
|
Объем
титранта (NaOH),
пошедший на титрование растворов уксусной кислоты
|
Средний
объем титранта, Vср, см3
|
Концентрация
уксусной кислоты, моль/дм3
|
|
6
6
|
15
15
|
15
|
1
|
Концентрацию уксусной кислоты Скислоты
вычисляют по известному закону эквивалентов:
Vа
С
(1/1CH3COOH) = VNaOH С
(1/1NaOH)
С (1/1NaOH)
- молярная концентрация эквивалента раствора NaOH
в моль/дм3.
С кислоты = 0,4*15/6 =1,0 моль/дм3
Готовим растворы уксусной кислоты с заданной
концентрации:0,8; 0,6; 0,4; 0,3; 0,2; 0,1 моль/дм3 объемом 50 см3
Таблица
2
Приготовление исходных растворов пропионовой
кислоты (Co)
=1 моль/дм3
|
Концентрация
приготовленных растворов, моль/дм3
|
0,8
|
0,6
|
0,4
|
0,3
|
0,2
|
0,1
|
|
Vкислоты, л
|
40
|
30
|
20
|
15
|
10
|
5
|
|
Vводы, мл
|
10
|
20
|
30
|
35
|
40
|
45
|
Для каждого полученного раствора добавляют по
1,00 г адсорбента (активированного угля). Встряхивают в течение 1 часа до
установления адсорбционного равновесия. После чего фильтруют растворы,
отбрасывая первые порции фильтрата. Остальное употребляют для определения
равновесной концентрации уксусной кислоты методом кислотно-основного титрования
гидроксидом натрия с фенолфталеином. Результаты титрования рассчитывают по
закону эквивалентов.
адсорбция кислота активированный
уголь
Таблица
3
Результаты анализа растворов уксусной кислоты
после адсорбции
|
Начал.
конц-ия уксусной к-ты до адсорбции, С0моль/дм3
|
Молярная
концентрация эквивалента гидроксида натрия, С (1/1NaOH), моль/дм3
|
Алик.
част раствора уксусной к-ты Va,см3
|
Объем
титр, пош. на титр. раст-ов уксусной к-ты Vт,см3
|
Средний
объём титра, Vср, см3
|
Равновесная
конц-я уксусной к-ты после адсорбции,С моль/дм3
|
|
0,8
|
0,4
|
8
|
14,5
|
14,7
|
0,7300
|
|
0,6
|
0,4
|
10
|
13,5
|
13,5
|
13,5
|
0,5400
|
|
0,4
|
0,4
|
4
|
13,7
|
13,9
|
13,8
|
0,3450
|
|
0,3
|
0,4
|
5
|
12,75
|
12,85
|
12,7
|
0,2540
|
|
0,2
|
0,1
|
8
|
12,4
|
12,4
|
12,4
|
0,1550
|
|
0,1
|
0,1
|
10
|
6,1
|
6,3
|
6,1
|
00,610
|
С кислоты = V
ср. (NaOH)* C(NaOH)
/ Vа
С кислоты = 14,6*0,4 / 8 =0,7300
Величину адсорбции рассчитывают по уравнению
Г = (С0 - Ср) * V/
m, результаты
записывают в таблицу.
Таблица
4
Результаты исследования адсорбции уксусной
кислоты на угле
|
№
|
Молярная
концентрация уксусной кислоты до адсорбции, c0, моль/дм3
|
Молярная
концентрация уксусной кислоты после адсорбции, ср, моль/дм3
|
Масса
угля, m, г
|
Гиббсов-ская
адсорбция, Г, ммоль/г
|
1/ср
|
1/Г
|
lgср
|
lgГ
|
|
1
|
0,8
|
0,7300
|
1
|
3,500
|
1,3699
|
0,2857
|
-0,1367
|
0,5441
|
|
2
|
0,6
|
0,5400
|
1
|
3,000
|
1,8519
|
0,3333
|
-0,2676
|
0,4771
|
|
3
|
0,3450
|
1
|
2,750
|
2,8986
|
0,3636
|
-0,4622
|
0,4393
|
|
4
|
0,3
|
0,2540
|
1
|
2,300
|
3,9370
|
0,4348
|
-0,5952
|
0,3617
|
|
5
|
0,2
|
0,1550
|
1
|
2,250
|
6,4516
|
0,4444
|
-0,8097
|
0,3522
|
|
6
|
0,1
|
00,610
|
1
|
1,950
|
16,3934
|
0,5128
|
-1,2147
|
0,2900
|
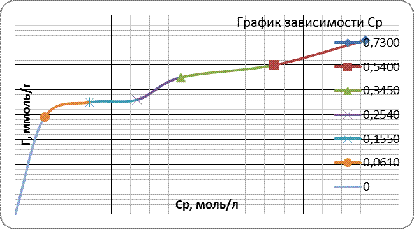
Эти данные используют также для построения
изотермы адсорбции, подобной изображенной на рис. 2, откладывая по оси абсцисс
значения равновесной концентрации, а по оси ординат - молярную концентрацию
уксусной кислоты после адсорбции.
Графическое определение констант К и 1/n
в уравнении Фрейндлиха
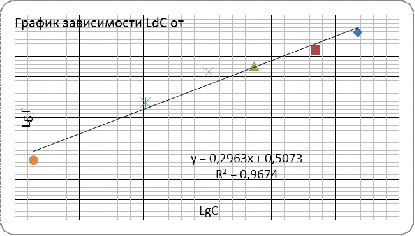
Уравнение прямой:
lg( x/m
) = 0,2963х + 0,5073
Lg
K = 0,5073=> K=
10 0,5073 = 3,216 л/моль
/n
=0,2963
Графическое определение емкости монослоя Г͚
в соответствии с линейной формой уравнения Ленгмюра
/Г = 1/Г͚ +(1/Г͚ * К) * 1/с
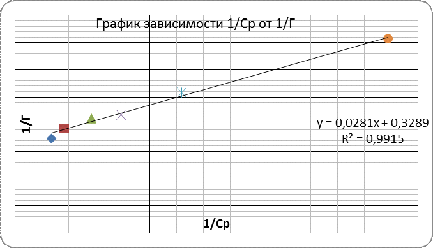
/Г = 0,0281х + 0,3289
/Г͚ = 0,3289=>Г͚ = 1/0,3289= 3,0404
ммоль/г
/Г͚ * К =0,0281 = > К = 1/0,281*1/3,0404
= 11,705 Л/МОЛЬ
Вычислим удельную поверхность( Sуд.)
адсорбента
Sуд
= Г͚ * NА
* S0 = 2.89 ммоль/г * 10 -3 * 6,022 * 10 23 1/моль
* 0,25* 10 -18
м2/молекула =435,09 м2/г
Вывод: Изучили адсорбцию ПАВ из раствора
уксусной кислоты на твердом адсорбенте; получили изотерму адсорбции; определили
предельную адсорбцию уксусной кислоты из водного раствора на угле Г͚ =
2,89 ммоль/г. Вычислили удельную поверхность адсорбента Sуд
= 435,09
м2/г
Уравнение Ленгмюра
/Г = 0,3458 + 0,0171 * 1/С
Уравнение Фрейндлиха
lg( x/m
) = 0,5416 + 0,2757*lg
C
Уравнение Ленгмюра
Гс =2,89 * ( 59,17 * с )/( 1+ 59,17 *
с )