Определение параметров липидного обмена у мужчин и женщин разных возрастных групп г. Петропавловска–Камчатского
Министерство
образования и науки Российской Федерации
Федеральное
государственное бюджетное образовательное учреждение
высшего
профессионального образования
«Камчатский
государственный университет имени Витуса Беринга»
Кафедра
биологии и химии
ВЫПУСКНАЯ
КВАЛИФИКАЦИОННАЯ РАБОТА
Определение
параметров липидного обмена у мужчин и женщин разных возрастных групп г.
Петропавловска - Камчатского
Петропавловск-Камчатский
Оглавление
ВВЕДЕНИЕ
ГЛАВА.
I. ОБЗОР ЛИТЕРАТУРНЫХ ДАННЫХ
1.1
Характеристика параметров липидного обмена
1.2
Обмен липидов
1.3
Общая характеристика липопротеидов
1.4 Определение
«нормальных» значений липидов сыворотки крови
ГЛАВА
II. МАТЕРИАЛЫ И МЕТОДЫ
2.1
Преаналитическая стадия исследования липидного обмена
2.2
Аналитическая стадия при лабораторном исследовании липидов
2.3
Определение показателей общего холестерина
2.4
Определение содержания триглицеридов
2.5
Определение содержания липопротеидов высокой плотности
2.6
Определение холестерина низкой плотности
2.7 Определение
холестерина очень низкой плотности и коэффициента атерогенности расчётным
способом
ГЛАВА
III. РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
ЗАКЛЮЧЕНИЕ
БИБЛИОГРАФИЧЕСКИЙ
СПИСОК
ПРИНЯТЫЕ СОКРАЩЕНИЯ
липид обмен холестерин триглицерид
АДФ - аденозиндифосфат
АКТГ - адренокортикотропный гормон
АМФ - аденозимонофосфат
АПБ или АПБ - SH - ацилпереносящий белок
апо - аполипопротеин (апопротеин) белковая часть
липопротеина
АТФ - аденозинтрифосфат
АХАТ - ацил - КоА - холестерин - ацилтрансфераза
БПЭХС - белки, переносящие эфиры холестерина
ВЖК - высшие жирные кислоты
ВОЗ - Всемирная организация здравоохранения
ГЛП - гиперлипопротеидемия
ГТГ - гипертриглицеридемия
ГХС - гиперхолестеринемия
ДГ - диглицериды
ДЛП - дислипопротеидемия
ЖК - жирные кислоты
ИБС - ишемическая болезнь сердца
КА - коэффициент атерогенности
КоА - коэнзим А
лизо - ФЛ - лизофосфолипиды
ЛП - липопротеиды, липопротеидный
ЛПБ - липидпереносящий белок
ЛПЛ - липопротеидлипаза
ЛПВП - липопротеиды высокой плотности
ЛПНП - липопротеиды низкой плотности
ЛПОНП - липопротеиды очень низкой плотности
ЛППП - липопротеиды промежуточной плотности
ЛХАТ - лецитин - холестерин - ацилтрансфераза
МГ - моноглицериды
НАД+ (НАДН) - никотинамид - адениндинуклеотид;
окисленная и восстановленная (в скобках) формы
НАДФ+ (НАДФН) - никотинамид -
адениндинуклеотидфосфат;
окисленная и восстановленная (в скобках) формы
НЭЖК - неэстерифицированные жирные кислоты
НЭХС - неэстерифицированный холестерин
ПОЛ - перекисное окисление липидов
П - ТГЛ - печёночная триглицеридлипаза
СЖК - свободные жирные кислоты
ТГ - триглицериды, триглицеридный
ТГЛ - триглицеридлипаза
ФАД (ФАДН2) - флавин - адениндинуклеотид;
окисленная и
восстановленная (в скобках) формы
ФЛ - фосфолипидный, фосфолипидный
ХМ - хиломикроны
ХС - холестерин, холестериновый
ЭХС - эстерифицированный холестерин, эфиры
холестерина
ЭХС - ПБ - эфиры холестерина переносящий белок
ВВЕДЕНИЕ
Изучение состава и характера метаболизма липидов
занимает значительное место в современной биохимии. Такое внимание к вопросу
обмена липидов связано с их участием во многих физиологических процессах
протекающих в клетках и тканях организма.
Многочисленными клиническими и
эпидемиологическими исследованиями установлено, что повышение уровня
холестерина в крови - один из основных факторов риска атеросклероза и
ишемической болезни сердца (ИБС).
Согласно меморандуму ВОЗ, ведущим фактором
патогенеза атеросклероза являются нарушения (генетически детерминированные и
приобретённые) метаболизма липопротеинов (ЛП). При этом наиболее ярким
интегральным индикатором этих нарушений служат дислипопротеинемии (ДЛП). Те или
иные варианты дисбаланса липопротеинового спектра крови свидетельствуют о
различной степени риска формирования атеросклероза у конкретного больного.
Однако, в любом случае, выявление и детальный анализ (фенотипирование) ДЛП,
наряду с изучением других параметров ЛП, составляет основу лабораторной
диагностики ранних стадий атеросклеростического поражения. Более того, как
показывает опыт ведущих стран Европы и США, профилактика атеросклероза и
обусловленной им сердечно - сосудистой патологии должна быть направлена именно
на коррекцию нарушения обмена ЛП.
Таким образом, изучение показателей липидного
обмена имеет исключительное диагностическое значение при оценке факторов риска
развития атеросклероза и сердечно-сосудистой патологии у пациентов разных
возрастных групп, в том числе и при диспансерных обследованиях.
Объект исследования: различные возрастные группы
г. Петропавловска - Камчатского.
Предметом исследования: являются показатели
липидного профиля плазмы крови обследуемого.
Целью настоящей работы является изучение
показателей липидного обмена у мужчин и женщин разных возрастных групп для
оценки степени риска развития атеросклероза и ИБС.
Задачи:
Определение особенностей липидного обмена у
мужчин и женщин разных возрастных групп, проживающих на Камчатке;
Анализ показателей липидограмм у мужчин и женщин
разных возрастных групп для выявления изменений, характеризующих развитие
атеросклероза и ИБС.
ГЛАВА. I. ОБЗОР ЛИТЕРАТУРНЫХ ДАННЫХ
.1 Характеристика параметров липидного обмена
Слово «холестерин» в переводе с греческого
означает «твёрдая желчь» (холе - желчь, «стерос» - твёрдый). В чистом виде
холестерин впервые был выведен в 1789 году французским врачом и аптекарем
Фуркруа из желчных камней. Оказалось, что камни, образующиеся в желчном пузыре
из - за нарушения его работы вследствие увеличения слишком жирной пищей,
состоят в основном из твёрдого воскоподобного вещества жёлтого цвета, жирного
на ощупь. Это вещество и есть холестерин. Только в 1929 году французский учёный
Машбеф во Франции установил, что холестерин и другие липиды крови -
жироподобные вещества (фосфолипиды) и жиры (триглицериды), действительно
нерастворимые в воде, соединяются в печени с белковыми компонентами
(протеинами) и образуют комплексы липопротеины (или липопротеиды), которые
хорошо смешиваются с кровью. Кровь транспортирует холестерин и другие липиды в
составе липопротеидов во все органы и ткани. За это открытие Машбеф был
удостоен звания лауреата Нобелевской премии.Он выделил из лошадиной плазмы
методом многократного высаливания сложный белок, содержащий 59% белка и 41%
липидов. Проведённые почти сорок лет спустя исследования показали, что сложный
белок Мабефа представляет собой не что иное, как один из классов плазменных
(ЛП), а именно липопротеиды высокой плотности (ЛПВП), уровень, которого в крови
лошади особенно высок. Со времени выделения белка Машбефа, первого плазменного
ЛП, прошёл более чем полувековой период. В течение этого времени знания о ЛП
далеко продвинулись вперёд, а в последние два десятилетия пополнились
фундаментальными открытиями, как в области структуры, их синтеза,
метаболических превращений и взаимодействия ЛП частиц с клетками, так и функции
этого класса соединений [Холодов 1990].
Липиды представляют собой обширную неоднородную
группу соединений, существенно различающихся по своей химической структуре и
выполняемым функциям. Поэтому трудно дать единое определение, которое подошло
бы для всех соединений, относящихся к этому классу. Недаром в одном из руководств
по биохимии [Fairley J.,Kilgour G.,1966] говорится, что «все определения,
данные классу соединений, называемому липидами, были либо беспредельно
сложными, либо полностью запутанными».
Поэтому, не пытаясь дать общее определение
термину «липиды», отметим, что они представляют группу веществ, которые
характеризуются следующими признаками:
природными органическими соединениями (жиры и
жироподобные
вещества);
нерастворимостью в воде, поэтому они
транспортируются в крови в
ассоциации с белками;
растворимостью в неполярных растворителях, таких
как эфир, бензол,
хлороформ или ацетон;
содержанием в своём составе высших алкильных
радикалов;
распространённостью в живых организмах,
жирные кислоты в крови ассоциированы с
альбумином,
другие липиды транспортируются в составе
липопротеидов.
Под это определение попадает большое количество
веществ, в том числе и такие, которые обычно причисляются к другим классам
соединений, например, жирорастворимые витамины и их производные, каротиноиды,
высшие углеводороды и спирты. Включение всех этих веществ в число липидов в
известной степени оправдано, потому что в живых организмах они находятся вместе
с липидами и вместе с ними экстрагируются неполярными растворителями.
С другой стороны, имеются представители липидов,
которые довольно хорошо растворяются в воде (например, лизолецитины) и по этому
признаку не подходят под определение «липиды». Термин «липиды» является более
общим, чем термин «липоиды», объединяющий группу жироподобных веществ, таких
как фосфолипиды (ФЛ), стерины, сфинголипиды и воски.
Липиды разделяются на 2 группы по принципу
гидролитического расщепления. Первая группа - это липиды, которые не
подвергаются гидролизу и к ним относят некоторые углероды, например, сквален и
каротиноиды, высшие альдегиды, кетоны и хитоны (витамины группы К), жирные
кислоты (ЖК) и простагландины (ПГ). Во вторую группу включены липиды, гидролиз
которых приводит к «освобождению» двух и более индивидуальных соединений. В эту
группу входят в основном вещества, содержащие сложноэфирную и /или амидную
связь, а также связь типа простого эфира ацеталя или полуацеталя. Это - воски,
эфиры стеринов, в том числе холестерина (ХЛ), и многоатомных спиртов (например,
глицериды, ФЛ, включая сфингомиелины), гликолипиды, серусодержащие липиды и
липиды, имеющие в своём составе аминокислоты.
В зависимости от химического состава липиды
подразделяются на несколько классов. Если оставить в стороне ряд соединений,
которые по отдельным признакам подходят к определению «липиды» или являются их
предшественниками (например, жирные кислоты) или производными (например,
простагландины), то можно использовать следующую классификацию липидов,
основанную на их структурных особенностях:
глицериды;
воски;
фосфолипиды: гликосфинголипиды, сфингомиелины;
гликолипиды (гликосфинголипиды): цереброзиды,
ганглиозиды;
другие сложные липиды (сульфолипиды,
аминолипиды);
стерины и их эфиры с жирными кислотами.
Различают простые, липиды, представляющие собой
эфиры жирных кислот и спиртов, и сложные липиды, характеризующиеся наличием
дополнительных компонентов. Выделяют также группу нейтральных липидов. Это - не
несущие электрического заряда глицериды, воски и эфиры стеринов
Простые липиды включают вещества, молекулы
которых состоят только из остатков сложных эфиров жирных кислот (или
альдегидов) и спиртов. К простым липидам относятся глицериды и воски. Сюда же
можно условно отнести и эфиры стеринов с жирными кислотами.
Жирные кислоты (ЖК) СН3(СН2)пСОО- представляют
собой углеводородные цепи, которые оканчиваются карбоксильной группой.
Нумерация углеродных атомов в жирно - кислотной цепи начинается с атома
углерода карбоксильной группы. Важной характеристикой ЖК является длина
углеводородной цепи. Из адипоцитов человека выделено 52 ЖК, включая
короткоцепочечные (n, число атомов углерода=2-4), средние (n=5-12) и
длинноцепочечные (n=13-20). В природе обнаружено свыше 200 ЖК, однако в тканях
человека и животных в составе простых и сложных липидов найдено около 70 ЖК,
причём половина из них в минорных или следовых количествах. Практическое
значение имеет немного более 20 ЖК. Все они содержат чётное число углеродных
атомов, главным образом от 12 до 24.
Жирные кислоты свободные, или
неэтерифицированные - основной поставщик энергии в организме. В крови человека
присутствуют также насыщенные, мононенасыщенные и полиненасыщенные жирные
кислоты.
Насыщенные жирные кислоты, когда соединение не
содержат двойных связей (все атомы углерода насыщены атомами водорода) и
оказывают атерогенное действие:
СН3 - СН2 - СН2 - СН2 СООН
Жирные кислоты могут быть ненасыщенными, когда
не все атомы углерода насыщены водородом, в результате в структуре молекулы
образуется одна (мононенасыщенная кислота) или несколько двойных связей
(полиненасыщенная жирная кислота) и обладают антиатерогенным действием:
СН3 - СН = СН - СН2 - СН = CН СООН
В любой полиненасыщенной ЖК двойные связи
следуют одна за другой так, что между ними находится одна метиленовая группа.
Поэтому, зная, сколько углеродных атомов и двойных связей содержит кислота (по
её рациональному названию), и положение первой двойной связи по отношению к
углероду концевой метильной группы, не представляет труда воспроизвести формулу
самой кислоты и положение остальных двойных связей.
Жирные кислоты часто изображают в виде вытянутой
зигзагообразной линии, отражающей жёсткость валентного угла в 111о для
насыщенной и в 123о - для двойной связи. Такая конформация является условной и
справедлива в том случае, когда ЖК находится в кристаллическом состоянии.
Местом хранения ЖК служит жировая ткань, где они
откладываются в виде ТГ. Последовательное расщепление ТГ до глицерина и ЖК в
жировой ткани активирует гормонозависимая триглицеридлипаза. Инсулин ингибирует
активность этого фермента и при увеличении инсулина, липиды накапливаются в
жировой ткани. При недостатке инсулина, продолжительном голодании, стрессе
усиливается липолиз и увеличивается концентрация в сыворотке НЭЖК и глицерина.
В свободном виде ЖК транспортируются в плазме из жировой ткани к печени и
скелетным мышцам, в этом случае они связаны с альбумином. Большая часть ЖК
может образовываться в печени из углеводных предшественников. Линолевая кислота
и арахидоновая кислота не синтезируются в организме, они являются незаменимыми
ЖК. Растительные масла, богатые полиеновыми жирными кислотами, рекомендуются
использовать в пищу, взамен жиров животного происхождения, где много насыщенных
жирных кислот.
Триглицериды (ТГ или по международной
классификации триацилглицирины) - представляют собой сложные эфиры трёхатомного
спирта глицерина и длинноцепочечных высших жирных кислот, среди которых в
организме человека доминируют ненасыщенные - пальмитиновые кислоты С15Н31СООН,
стеариновая С17Н35СООН и олеиновая С17Н33СООН, реже присутствуют
полиненасыщенные - линоленовая и арахидоновая кислоты.
В триглициридах, в отличие от диглицеридов и
моноглицеридов, остатки ЖК присоединены по месту всех трёх гидроксильных групп.
Распределение жирных кислот в молекуле ТГ
зависит от длины цепи и степени ненасыщенности. Если в состав ТГ могут входить
все три кислотных радикала одной и той же ЖК, но могут быть одинаковыми только
две кислоты и такие ТГ называют простыми (например, триолеин, трипальмитин).
Если же кислотные радикалы принадлежат разным ЖК, то такие ТГ называются
смешанными (например, пальмитиновая, стеариновая, лауриновая и др.). Большая
часть ТГ тканей человека и других млекопитающих содержит в своём составе
смешанный набор ЖК. В средней позиции чаще находится кислота с наибольшей
длиной цепи и наибольшим числом двойных связей, крайние позиции обычно занимают
насыщенные кислоты. ТГ человеческого организма встречаются в форме
протоплазматического и резервного жира. Протоплазматический жир входит в состав
клеток всех органов, а резервный запасается в организме преимущественно в
жировом депо. [Холодов 1990].
Интенсивность обмена ТГ наибольшая среди других
липидов: в день метаболическая скорость обмена триглицеридов составляет 75 -
150 г, тогда как холестерина 1 - 3 г. ТГ пищи в тонком кишечнике под действием
липазы подвергаются гидролизу. Образовавшиеся глицерин и свободные жирные
кислоты абсорбируются клетками эпителия, где происходит ресинтез ТГ. Из
кишечника ТГ выходят в лимфотические сосуды в форме хиломикронов (ХМ), а затем
поступают в кровоток. В норме всасывается до 90% ТГ, т. е. в кровь попадает 80
- 170 ммоль (70 - 150 г) экзогенных ТГ. Поэтому после приёма пищи, особенно
жирной, уровень ТГ заметно повышается и остаётся высоким несколько часов. В
норме все ТГ хиломикрон должны быть удалены из кровотока в течение 12 ч.
Образование ТГ имеет место в печени по глицерофосфатному
пути из глицерина ЖК, которые попадают в печень из жировой ткани или образуются
из глюкозы. Жирнокислотный состав ТГ в организме в большей степени, чем
фосфолипидов, зависит от состава жирной пищи. Большинство органов реализует
именно ТГ для энергетических потребностей. Исключением является мозг,
энергетическое обеспечение его происходит за счёт метаболизма глюкозы.
Измерение уровня ТГ натощак отражает количество
эндогенных ТГ, находящихся в сыворотке.
Воски представляют собой сложные эфиры высших
жирных кислот (ВЖК), образуемые длинноцепочечными ЖК и длинноцепочечными
спиртами (с числом углеродных атомов от 16 до 36). Воски широко распространены
в природе, причём в самых различных объектах - от очень мелких (планктон), до
очень крупных (голова кашалота). У позвоночных воски, секретируемые кожными
железами, выполняют функцию защитного покрытия, смазывающего кожу и
предохраняющего её от воды. Восковым секретом покрыты также волосы. Перья птиц,
особенно водоплавающих, и шкура животных имеют восковое покрытие, которое
придаёт водоотталкивающие свойства. Воск овечьей шерсти, называется ланолином,
в качестве спиртовой компоненты содержат ланостерин - один из конечных
продуктов биосинтеза холестерина.
Фосфолипиды (ФЛ) - сложные липиды, эфиры
многоатомных спиртов глицерина или с жирными кислотами и фосфорной кислотой,
но, в отличие от ТГ, они содержат фосфатное основание вместо одной ЖК. Это
придаёт молекуле ФЛ алифатический характер - неполярные цепи ЖК способны
взаимодействовать с липидами, а полярные фосфатные головки - с водным
окружением. В результате этого свойства ФЛ являются неотъемлемым компонентом
всех клеточных мембран. В состав ФЛ входят также азотсодержащие соединения:
холин, этаноламин или серин и другие гидрофильные группы, соединённые эфирной
связью с фосфатом. В липопротеидах ФЛ играют ключевую роль, поддерживая в
растворённом состоянии неполярные липиды, такие как ТГ и эфиры холестерина.
Нарушение секреции ФЛ в желчь приводит к образованию холестериновых камней и
желчнокаменной болезни. Наиболее богаты ФЛ ткани мозга и нервов, печень, почки,
сердце, скелетные мышцы. Всюду, где содержаться ФЛ им сопутствует холестерин
(ХЛ).
||CH2 - O - C - R1
|| |- C - O - CH O
| ||- O - C - P - N
|
Рис. 3. Химическая структура фосфолипидов
плазмы: P - фосфат, N - азотистое основание, R - радикал жирной кислоты. [
Холодов ]
В зависимости от того, какой многоатомный спирт
участвует в образовании ФЛ (глицерин или сфингозин), их делят на две группы:
глицерофосфолипиды и сфингофосфолипиды.
Наиболее распространёнными глицерофосфолипидами
в тканях животных являются глицеро - ФЛ. Основой их служат фосфатидные кислоты,
содержащие, как правило, в 1 - м положении насыщенную и во 2 - м положении -
ненасыщенную ЖК. В зависимости от характера азотистого основания, присоединённого
к фосфорной кислоте, глицеро - ФЛ разделяют на фосфатидилхолины (лецитины),
фосфатидилэтаноламины (кефалины) и фосфатидилсерины.
||- O - C - R1||
||- C - O - CH
| O-
| +- O - P - O - CH2 - CH2 - N
(CH3)3
|
Рис. 4. Структурная формула фосфатидилхолина
(лецитина). [Холодов]
При отщеплении от лецитина и кефалина
ненасыщенной жирной кислоты (под влиянием фосфолипазы А2) образуются
лизолецитин и лизокефалин, которые могут вызывать гемолиз эритроцитов. Большое
содержание фосфолипазы А2 характерно для ядов змей, пчёл и ос. ФЛ крови активно
участвуют в образовании липопротеидов, тем самым способствуют выходу ТГ. Кроме
того, часть жирных кислот триглициридов участвует в образовании фосфолипидов и
в составе их молекул выходит из печени. Поэтому недостаточное образование
фосфолипидов влечёт за собой нарушение обмена липидов и тем самым вызывает
жировую инфильтрацию печени.
Своебразным представителем глицеро - ФЛ является
кардиолипин, впервые выделенный из сердечной мышцы. По своей химической структуре
кардиолипин можно рассматривать как соединение, в котором две молекулы
фосфатидной кислоты связаны с помощью одной молекулы глицерина. Кардиолипин
локализован во внутренней мембране митохондрий и обладает иммунными свойствами.
Сфинго - ФЛ (их называют также сфингомиелинами из - за высокого содержания в
миелиновых оболочках) содержат аминоспирт сфингозин, к которому по месту
аминогруппы присоединена молекула ЖК, а по месту гидроксильной группы -
молекула фосфорной кислоты; которая связана с холестерином.
Гликолипиды характеризуются тем, что в их состав
входит углеводная компонента, чаще всего галактоза или её производная. От
сфингофосфолипидов отличаются отсутствием фосфорной кислоты и азотистых
оснований. В зависимости от числа и состава моносахаридных остатков, их делят
на цереброзиды, сульфатиды и ганглиозиды [Горячковский 1994]. Гликолипиды
обнаружены в мембранах клеток мозговой ткани, цереброзиды и сульфатиды в белом
веществе, а ганглиозиды в сером веществе головного мозга.
Цереброзиды рассматривают как простые
гликолипиды, образованные сфингозином, ЖК и галактозой. В цереброзидах ЖК
присоединена к сфингозину не по месту гидроксильной группы, как в ТГ, ФЛ и ЭХЛ,
а по месту аминогруппы с образованием амидной связи. Входящие в состав
цереброзидов ЖК необычны в том отношении, что, обычно, содержат 24 атома
углерода (чаще встречаются нервоновая, цереброновая и лигноцериновая кислоты).
Цереброзиды обнаруживаются главным образом в миелиновых оболочках и в мембранах
нервных клетках мозга, что и предопределило их название.
Ганглиозиды представляют собой собой группу
соединений, которую относят к гликолипидам из - за наличия в их составе глюкозы
и галактозы. С равным правом ганглиозиды можно рассматривать как сфинголипиды
из - за наличия в них церамида (сфингозидна, ацилированного жирной кислотой).
Ещё одной особенностью строения ганглиозидов является то, чтоони содержат
производные аминосахаридов: сиаловую (N -aцетилнейраминовую) кислоту и N -
aцетилгалактозамин. В молекуле ганглиозида выделяют гидрофобную часть (церамид)
и гидрофильную (углеводная цепь). Ганглиозиды обнаружены в сером веществе
головного мозга. Они локализованы в плазматических мембранах нервных клеток и
участвуют в формировании защитного слоя клеток - гликокаликса и в осуществлении
ими рецепторной функции.
Стероиды. К стероидам относятся стеролы (или
стерины), стериды, желчные кислоты, мужские и женские половые гормоны, гормоны
надпочечников, витамины группы Д, сердечные гликозиды [Чиркин 2003].
Наиболее важным представителем соединений стеринов
и их эфиров с жирными кислотами является холестерин (ХС).
Холестерин. О нём написано не поддающееся учёту
количества статей, большое число обзоров и несколько монографий. Одна из первых
монографий «Химия холестерина» (1934) принадлежит перу русского химика И. А.
Ремезова, работавшего в Институте экспериментальной медицины (Ленинград).
Холестерин является мононасыщенным стерином
состава С27Н4О (ОН)5; по химической структуре это одноатомный вторичный спирт
(холестерол). Термин холестерин определяет источник, из которого он впервые был
выделен (chole - желчь). ХС в своей структуре имеет ядро, образованное
гидрированным фенантреном (кольца А, В и С) и циклопентаном (кольцо D) с
боковой цепью у 17 - го углеродного атома:
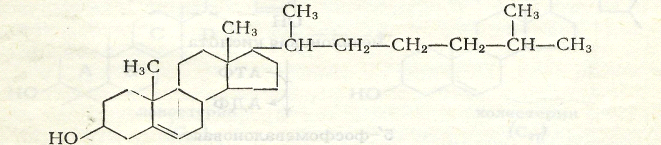
Рис.5. Структурная формула холестерина.
[Холодов]
Каждое из 6 - углеродных колец может находиться
в форме «кресла» или «ванны». В природных стероидах, в том числе и в ХС, все
кольца находятся в форме «кресла», что является более устойчивой конформацией.
У 3 - го углеродного атома имеется гидроксильная
группа, за счёт которой образуются сложные эфиры холестерина с ЖК. Молекулярная
масса ХС 387 Д, в чистом виде он является порошком белого цвета. ХС хорошо
растворим в органических растворителях: наилучшими являются спирты с 6 - 7
атомами углерода, а в воде крайне низка и составляет всего 4,7 ммоль/л при
250С. Химическая структура ХС ограничивает число биохимических реакций, в
которые он вступает. Около 2/3 холестерина в крови представлено в форме эфиров
холестерина и жирных кислот; около 1/3 - в форме свободного холестерина.
Холестерин входит в состав всех живых клеток. В биологических мембранах ХС
выполняет структурную роль, определяющую проницаемость мембраны и создание
микроокружения для встроенных в мембрану ферментов. Важной функцией ХС является
его роль как предшественника синтеза стероидных гормонов.
Основная масса ХС синтезируется в печени и
поступает с пищей. ХС, как и другие липиды, транспортируется в сыворотке крови
в составе липопротеидов.
В клинической практике для выявления нарушений
липидного обмена определяют уровень холестерина и ТГ в сыворотке крови.
1.2 Обмен липидов
Жир является важной составной частью пищи. Он
служит источником энергии, содержит незаменимые ЖК, является носителем жирорастворимых
витаминов. Кроме того, пищевой жир придаёт пище вкус и обеспечивает чувство
сытости в процессе её переедания.
В организм взрослого человека с пищей ежесуточно
поступает 60 - 80 г жиров (ТГ) животного и растительного происхождения. Из
этого количества подавляющая часть (более 85%) подвергается расщеплению в
желудочно - кишечном тракте. В пожилом возрасте, а также при малой физической
нагрузке потребность в жирах снижается. В условиях холодного климата при
тяжёлой физической работе потребность в жирах у человека повышается.
В полости рта ТГ не подвергаются никаким
изменениям, так как слюна не содержит расщепляющих жиры ферментов. С желудочным
соком выделяется липаза, однако её роль в гидролизе пищевых ТГ у взрослого
человека невелика.
Расщепление жиров, входящих в состав пищи,
происходит у человека преимущественно в верхних отделах тонкого кишка, под
действием липазы панкреатического сока. Панкреатическая липаза, как и другие
пищеварительные ферменты (пепсин, трипсин, химотрипсин), поступает в верхний
отдел тонкой кишки в виде неактивной пролипазы. Превращение пролипазы в
активную липазу происходит при участии желчных кислот и ещё одного белка
панкреатического сока - колипазы. Липаза действует на эмульгированные жиры.
Наиболее мощным эмульгирующим действием на жиры, обладают соли желчных кислот,
попадающие в двенадцатиперстную кишку с желчью в виде конъюгатов с глицином или
таурином (гликохолевая, таурохолевая и другие кислоты) [Осачук, Коновалова
2001]. В двенадцатиперстную кишку вместе с пищевой кашицей заносится небольшое
количество желудочного сока, содержащего соляную кислоту, которая
нейтрализуется в основном бикарбонатами, содержащимися в панкреатическом соке и
желчи. Одновременно начинается эмульгирование жира (ТГ), в результате чего
резко увеличивается поверхность жиров, что облегчает взаимодействие их с
липазой, т. е. ускоряет ферментативный гидролиз [Галлер, Генефельд и др. 1999].
Основная масса липидов пищи представлена ТГ,
меньше ФЛ и стероидами. Липаза, воздействуя на ТГ пищи, расщепляет их на бета -
моноглицерид, глицерин и ЖК и используется стенкой кишечника и на ресинтез ТГ.
Подавляющая часть ФЛ содержимого тонкой кишки
приходится на фосфатидилхолин (лецетин), основная масса которого поступает в
кишечник с желчью (11 - 12 г/сут) и меньшая (1 - 2 г/сут) - с пищей.
Расщепление ФЛ происходит при участии ферментов: фосфалипаз [Камышников 1997].
ФЛ гидролизируются на составные компоненты: спирт, ЖК, азотистое основание и
фосфорную кислоту, которые в таком виде могут поступать в стенку кишечника
[Чаяло 1996].
Таким образом, продукты расщепления пищевых
жиров, образовавшиеся в полости кишечника и поступившиеся в его стенку, снова
используются для ресинтеза жиров. Биологический смысл этого процесса сводится к
тому, что в стенке кишечника синтезируются жиры, более специфичные для данного
вида животного и отличающиеся от пищевого жира [Осачук, Коновалова 2001].
Смесь всосавшихся и ресинтезированных в стенке
кишечника липидов поступает в лимфатическую систему, а затем через грудной
лимфатический проток в кровь и с током крови распределяется в организме. ТГ,
ФЛ, ХС практически не растворимы в воде, в связи, с чем они не могут
транспортироваться кровью или лимфой в виде одиночных молекул. Перенос всех
этих соединений осуществляется в виде особым образом организованных
надмолекулярных агрегатов - липопротеидных комплексов или просто липопротеидов.
В транспорте экзогенных липидов, т. е. липидов, поступающих во внутреннюю среду
организма из кишечника. Принимают участие главным образом хиломикроны (ХМ) и
липопротеиды очень низкой плотности (ЛПОНП) [Ткачук 2002]. Благодаря большим
размерам, хиломикроны неспособны проникать в кровеносные капилляры Они
диффундируют в лимфатическую систему кишечника, а из неё через грудной
лимфатический проток в кровяное русло, т. е. с их помощью осуществляется
транспорт экзогенных ТГ, ХС и частично ФЛ в печень и жировую ткань
[Горячковский 1994]. В клетки жировой ткани ХМ не способны проникать, в связи с
чем, ТГ гидролизуются на поверхности эндотелия капилляров жировой ткани при
участии фермента липопротеинлипазы (ЛПЛ). ЛПЛ расщепляет ТГ до ЖК и МГ. ЛПЛ
способна гидролизовать триглицериды ЛПОНП [Холодов, Чаяло 1990]. ХМ, потеряв
большую часть ТГ, под действием ЛПВ превращаются в ремнантные ХМ. В лимфе, а
особенно в крови, пре - ХМ при взаимодействии с ЛПВП обогащаются апопротеинамиС
и превращаются в зрелые хиломикроны [Осачук, Коновалова 2001].
В организме млекопитающих имеется особая ткань,
выполняющая сугубо специфическую роль в липидном обмене, - жировая ткань,
состоящая из жировых клеток, или адипоцитов. ТГ жировой ткани не могут быть
использованы организмом без предварительного расщепления: они постоянно
подвергаются гидролизу (липолизу), в ходе которого освобождаются свободные или
НЭЖК - главный энергетический материал ТГ. Под действием липаз, содержащихся в
жировой ткани, образуются конечные продукты - глицерин и НЭЖК, которые покидают
жировую ткань и поступают в кровеносное русло. В жировой ткани активно
протекает и противоположный липолизу процесс - эстерификация ЖК (образование
ТГ). Предполагается, что в этой ткани имеются два пула ЖК: первый содержит ЖК,
образующиеся при липолизе ТГ. Этот пул поставляет ЖК для реэстерификации, и
также участвуют в мобилизации их в кровь. Второй пул содержит ЖК. Освободившись
при липолизе ХМ и ЛПОНП, частично пополняется ЖК из первого пула. Из второго
пула ЖК не мобилизуются в кровь, а он участвует только в реэстерификации ЖК и
их бета - окислении. Жировая ткань является тем местом, где особенно заметно
происходит превращение глюкозы в жиры. Как только запасы углеводов истощаются,
и снижается интенсивность гликолиза, происходит усиление липолиза, в результате
чего ткани получают повышенные количества ЖК для окисления. Вместе с тем,
повышение содержания ЖК вызывает понижение интенсивности утилизации и окисления
глюкозы, например, в мышцах.
Всё это свидетельствует о том, что жировой и
углеводный обмен, являющиеся главными энергообразующими процессами в животном
организме, настолько тесно связаны друг с другом, что многие факторы, влияющие
на один вид обмена, прямо или косвенно сказываются на другом [Пархотник 1996].
Бурая жировая ткань это - специализированный тип
жировой ткани, локализованной небольшими участками под кожей в области шеи,
верхней части груди, спины (между лопатками) и подмышечных впадин. Ткань
характеризуется хорошо обеспеченным кровоснабжением, а её клетки - большим
числом митохондрий увеличенного (по сравнению с белой жировой тканью) размера и
высоким содержанием цитохромов, которые ответственны за специфическую окраску этой
ткани. Основными окислительными субстратами бурой жировой ткани являются
глюкоза и ЖК.
Характерной особенностью бурой жировой ткани
является то, что в митохондриях её клеток окисление и фосфорилирование
разобщены. Поэтому окислительные реакции дают много тепла и мало свободной
энергии, запасаемой в АТФ. Это объясняется наличием во внутренней мембране
митохондрий жировых клеток специальных пор, через которые, минуя АТФ -
синтетазу, возвращаются ионы Н+, выведенные из митохондрий наружу в результате
переноса электронов. Вследствие этого почти вся энергия, генерируемая переносом
электронов, переходит в тепло.
Особое значение бурая жировая ткань в общем
обмене организма приобретает тогда, когда необходимо повышенное образование
тепла: у новорожденных, у животных, пробудившихся после зимней спячки, у
животных, подвергшихся воздействию холода. Примечательно то, что бурая жировая
ткань редуцирована или вообще отсутствует у тучных людей и, наоборот,
достаточно развита у тех людей, которые «хорошо едят, но не накапливают жир».
Как уже отмечалось, в организме человека и
других млекопитающих, половина всей энергии, поставляемой окислительными
процессами в состоянии покоя, обеспечивается за счёт окисления ЖК. При
физической нагрузке, особенно длительной, доля энергии, выделяющейся за счёт
окисления ЖК, становится ещё более значительной.
Непосредственным источником ЖК для их окисления
является, жировая ткань, откуда ЖК транспортируются в различные органы и ткани
в виде комплекса альбумин - НЭЖК. Какую - то часть ТГ доставляют в клетки ЛП,
расщепление которых лизосомальными ферментами ведёт к освобождению ЖК.
В цитоплазме клеток постоянно содержатся ТГ
эндогенного происхождения, которые при воздействии внутриклеточных липаз
расщепляются с освобождением ЖК. Ещё одним источником являются ФЛ клеточных
мембран, которые, постоянно обновляясь, освобождаются (при действии фосфолипаз)
ЖК.
Доставка ЖК к месту их окисления - к
митохондриям - происходит сложным путём: при участии альбумина, как уже
отмечалось, осуществляется транспорт ЖК в клетку; при участии специальных
белков - транспорта в пределах цитозоля; при участии картинина - транспорт ЖК
из цитозоля в митохондрии.
Свободная ЖК, независимо от длины углеродной
цепи, является метаболически инертной и не может подвергаться никаким
биохимическим превращениям, в том числе, окислению, пока не будет активирована.
Активация ЖК протекает на наружной поверхности мембраны митохондрий при участии
АТФ, КоА и ионов магния. Реакция катализируется ферментом ацил - КоА -
синтетазой, с образованием ацил - КоА, являющийся активной формой ЖК. Перенос
активной формы ЖК в митохондрии, осуществляется при участии картинина.[Климов
1992]. Картинин возвращается на наружную поверхность мембраны, а активированная
ЖК окисляется в митохондриях по общей схеме бета - окисления ЖК. В результате
одного завершённого цикла окисления происходит отщепление от одной молекулы
ацетил - КоА, т. е. укорочение жирно - кислотной цепи на два углеродных атома в
соответствии с теорией бета - окисления[Чиркин 2003]. При этом в каждом цикле
окисления ЖК происходит генерирование ацетил - КоА, ФАДН2 и НАДН. С учётом
одной молекулы АТФ, потраченной в самом начале на активацию ЖК, общий
энергетический выход при полном окислении одной молекулы пальмитиновой кислоты
в условиях животного организма, составит 130 молекул АТФ. Таким образом,
эффективность накопления энергии в результате окисления ЖК составляет около 40%
[Осачук, Коновалова 2001]. Обычно деградация жирных кислот происходит без
существенного накопления промежуточных продуктов и, в частности, ацетил - КоА.
Однако, некоторые условия (голодание, сахарный диабет, резкие смены диеты и т.
п.) приводят к появлению в крови, так называемых кетоновых тел. К ним относятся
ацетоуксусная кислота, ацетон и 3 - гидроксимасляная кислота. Образуются они в
печени из ацетил - КоА и током крови доставляются к периферическим тканям, где
окисляются в цикле трикарбонатных кислот. Потеря организмом способности
утилизировать эти вещества (кетоз) приводит к значительному накоплению в крови
(кетонемия) и в моче (кетонурия), что является диагностическим признаком ряда
заболеваний [Турчинский 2002].
Основным местом синтеза ЖК является цитоплазма.
Особенно активно липогенез протекает в жировой ткани, молочной железе, печени.
Сырьём для биосинтеза служит ацетил - КоА, который образуется из избыточной
глюкозы пищи, не использованной на энергетические нужды. Основной путь
биосинтеза ЖК, протекающий в цитоплазме, катализируется особой синтетазной
системой, состоящей из 7 ферментов [Чаяло 1990]. При биосинтезе ЖК происходит
постепенное удлинение цепи ЖК на 2 углеродных атома, до получения специфической
для данного органа или ткани жирной кислоты с необходимым числом углеродных
атомов [Камышников 1997]. Синтез ТГ происходит главным образом в печени, жировой
ткани, стенки кишечника. Место клеточной локализации синтеза - гладкий
эндоплазматический ретикулум. Вещества для синтеза ТГ, служат ацил - КоА и
фосфоглицерин, а ферментами ацилтрансферазы [Либов, Иткин и др. 2003]. По мере
своего возникновения ТГ мигрируют и поглощаются жировыми включениями клетки.
При полном ферментативном гидролизе ТГ конечными продуктами реакции являются
глицерол и свободные жирные кислоты (СЖК) [Долгов 1999]
.3 Общая характеристика липопротеидов
Исходя из современных представлений, само
понятие «липопротеиды» («липопротеины») можно определить следующим образом:
липопротеиды - это высокомолекулярные водорастворимые частицы, представляющие
собой комплекс белков и липидов, образованных нековалентными связями, в котором
белки совместно с полярными липидами формируют поверхностный гидрофильный слой,
который окружает и защищает внутреннюю гидрофобную липидную сферу от водной
среды и обеспечивает транспорт липидов в кровяном русле и доставку их в органы
и ткани. [Холодов, Чаяло 1990]. Одним из признаков ЛП является наличие в них
наружного гидрофильного белково - липидного слоя и липидной гидрофобной сферы
(ядра).
Липиды играют важную роль в процессах
жизнедеятельности. Будучи одним из основных компонентов биологических мембран,
липиды влияют на проницаемость клеточных мембран по отношению к ионам и
органическим соединениям, служат предшественниками стероидов, с выраженным
биологическим воздействием: желчных кислот, витаминов группы D, половых
гормонов, гормонов коры надпочечников [Бурлакова 1996]. Липиды участвуют в
передаче нервного импульса и создании межклеточных контактов, а также в
процессах терморегуляции, предохранении жизненно важных органов от механических
воздействий, потери белка, в создании эластичности кожных покровов, защите от избыточного
удаления влаги.
ЛП плазмы крови являются уникальной транспортной
формой липидов в организме человека и животных. Они осуществляют транспорт
липидов, как пищевого происхождения, так и заново синтезированных в печени и
стенке тонкой кишки (т. е. эндогенного происхождения) в систему циркуляции и
далее к месту утилизации или депонировании. Известно, что отдельные ЛП
осуществляют «захват» избыточного ХС из клеток периферических тканей и его
«обратный» транспорт в печень для окисления в желчные кислоты и выведения с
желчью. ЛП осуществляют транспорт жирорастворимых витаминов, гормонов,
соединений обладающих в отношении липидов антиоксидатной активностью.
Основными липидами, транспортируемыми в токе
крови в составе липопротеидных комплексов, являются ТГ, НЭХ, ЭХС, ФЛ и
небольшое количество НЭЖК.
Частицы липопротеидов (ЛП) - макромолекулярные
комплексы, внутренняя часть которых содержит нейтральные липиды (ТГ и эфиры
холестерина), а поверхностный слой состоит из фосфолипидов,
неэтерифицированного холестерина и специфичных липидтранспортных белков,
называемых аполипопротеидами (апоЛП). Апопротеины выполняют функции лигантов во
взаимодействии ЛП со специфическими рецепторами на клеточных мембранах,
способствуют формированию мицелл ЛП в гепатоцитах, регулируют гомеостаз ХС в
клетках и в организме в целом [Долгов 1999].
Основные апопротеины плазмы кров: А - 1, А - 2,
А - 4, В - 100, В - 48, С - 1, С - 2, Д, Е, Апо - а. Структура и концентрация в
плазме крови каждого апопротеина находится под генетическим контролем, в то
время как содержание липидов и ЛП в большей степени подвержено влиянию
диетических и других факторов [Карпищенко 2001]. В связи с этим в диагностике
наследственных заболеваний особую значимость приобретает анализ важнейших
апопротеинов.
Плазменные ЛП - частицы имеют сферическую форму.
Внутри находится жировая «капля», содержащая неполярные липиды (ТГ и эфиры ХС)
и формирующая ядро ЛП - частицы. Именно ядро частицы определяет её размеры и
сферическую форму. Оно окружено оболочкой из ФЛ, связанного или НЭХС и белка.
Целесообразность образования такой структуры объясняется тем, что неполярные
липиды нерастворимы в водной среде и поэтому не могут транспортироваться в токе
крови. Полярные же липиды (ФЛ, свободный или НЭХС) совместно с белком формируют
поверхностный гидрофильный слой, который, с одной стороны, защищает внутреннюю
гидрофобную липидную сферу от водной среды, а с другой - обеспечивает
растворимость и транспорт ЛП - частицы в этой же водной среде [Осачук,
Коновалова 2001] (рис. 6.)
Наружная оболочка ЛП - частицы, в отличие от
ядра, обладает относительно высокой электронной плотностью и содержит липидный
монослой. ФЛ и НЭХС расположены в наружной оболочке таким образом, что их
полярные группы ориентированы наружу, а гидрофобные жирно - кислотные «хвосты»
- внутрь частицы. Такая структура обеспечивает непосредственный контакт
белковых молекул с белками.
Липиды оболочки ЛП - частицы обладают более
высокой микровязкостью, чем липиды ядра. Микровязкость липидов возрастает, если
в оболочке увеличивается содержание НЭХС, а в сердцевине - содержание ЭХС и ТГ
с НЖК. В целом интегральность структуры ЛП - частицы обеспечивается
гидрофобными и, в меньшей степени, ионными связями; при этом имеет место
следующие взаимодействия: липид - липид, липид - белок, белок - белок.
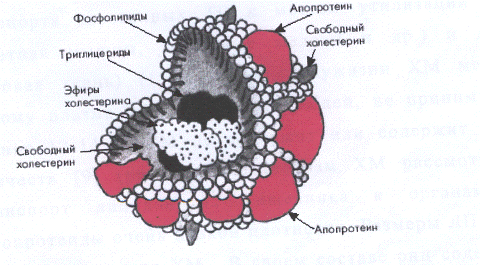
Рис. 6. Структура липопротеинов . [Осачук,
Коновалова]
В зависимости от класса ЛП изменяется
соотношение между основными липидами: с увеличением плотности частиц
уменьшается доля ТГ и возрастает доля ЭХС. ТГ являются растворителем для ЭХС и
в богатых ТГ липид - белковых комплексах (ХМ и ЛПОНП) эфиры ХС равномерно
распределены по ядру, тогда как в ЛПНП и ЛПВП они образуют скопления.
ЛП классифицируются на основании подвижности их
в электрическом поле или гидратированной плотности в условиях усиленной
гравитации при флотации или седиментации. При электрофорезе ЛП разделяют на
фракции, одна из которых остаётся на старте (хиломикроны), другие мигрируют к
зонам глобулинов - бета - ЛП, пре - бета - ЛП, альфа - ЛП. По величине
гидратированной плотности ЛП принято разделят на 5 классов: хиломикроны (ХМ),
ЛП очень низкой плотности (ЛПОНП), ЛП промежуточной плотности (ЛППП), ЛП низкой
плотности (ЛПНП), ЛП высокой плотности (ЛПВП). По электрофоретической подвижности
ЛПОНП соответствуют пре - ß - ЛП,
ЛПНП - ß-
ЛП,
ЛПВП - à-
ЛП, хиломикроны остаются на старте.
К данной группе липопротеидов относятся
хиломикроны (ХМ) и липопротеиды очень низкой плотности (ЛПОНП). Эти два класса
имеют много общего в структурной организации, физики - химических свойствах и
процессах катаболизма, и поэтому некоторые их превращения будут рассмотрены
совместно.
Хиломикроны. Ещё врачи средних веков при
осуществлении процедуры кровопускания наблюдали в отдельных случаях наличие
белесоватого или молочного вида у крови. Высказывались предположения, что
причиной этого является высокая концентрация жира в крови.
Хиломикроны человека, являющиеся самыми крупными
ЛП - частицами, диаметр от 100 до 1100 нм и представляют собой сферические
частицы необычно низкой плотности (d<0,95) и достигают большой скорости
флотации. Поэтому в отличие от других классов ЛП, всплывают при обычном
центрифугировании или при длительном стоянии плазмы в пробирке. В ХМ содержание
липидов составляет 98 - 99,5%, белков 0,5 - 2%, в основном содержащих ТГ.
[Меньшиков 1981]. Основной белок первичных ХМ - апоВ. ХМ в организме содержащие
длинноцепочечные ТГ. Период полужизни ХМ меньше 1 часа, поэтому плазма крови
здоровых людей, не принимавших пищи в течение 12 - 14 ч, ХМ не содержит или
содержит их ничтожные количества (рис. 7.)
ХМ образуются в процессе всасывания пищевого
жира и предназначены для транспорта экзогенных ТГ к местам их утилизации
скелетным и сердечным мышцам и лактирующей молочной железы, депонирования
(жировой ткань) [Карпищенко 2001].
ХМ синтезируются в кишечнике и служат для
переноса пищевых липидов. ХМ сначала попадают в лимфатическую систему, а затем
в кровоток. Если с пищей принимать ТГ, содержащие ЖК с число углеродных атомов
менее 12, то ХМ в стенке кишечника не образуются, поскольку такие ЖК после
всасывания в стенке кишечника поступают через воротную вену непосредственно в
печень, минуя лимфатическую систему.
Размеры ЛПОНП в среднем в 10 раз меньше размера
ХМ. В своём составе содержат 90 - 92% липидов, 8 - 10% белка. ЛПОНП образуются
в печени, секретируются гепатоцитами в кровоток и транспортируют эндогенные ТГ,
на долю которых приходится 50 - 70% массы частицы [Меньшиков 1981]. Их
образование - защитная реакция организма, направленная на предотвращение жировой
инфильтрации, а в последующем и дистрофии печени [Турчинский 1990]. Небольшая
часть ЛПОНП, образуется в кишечнике, принимая участие в транспорте экзогенных
липидов. Период полужизни ЛПОНП от 2 до 4 часов, их расщепление происходит под
действием липолитических ферментов. Первичные ЛПОНП имеют в составе только апоВ
- 100. В кровотоке в состав ЛПОНП включаются апопротеины из ЛПВП - апоС - II и
апоЕ. ЛПОНП, подобно ХМ, деградируют под влиянием липопротеидлипазы (ЛПЛ)
расположенной на эндотелии капилляров и трансформируются в липопротеиды
промежуточной плотности («ремнанты» ЛППП), которые далее с участием печёночной
триацилглициринлипазы (П - ТГЛ) превращаются в ЛПНП [Осачук, Коваленко 2001].
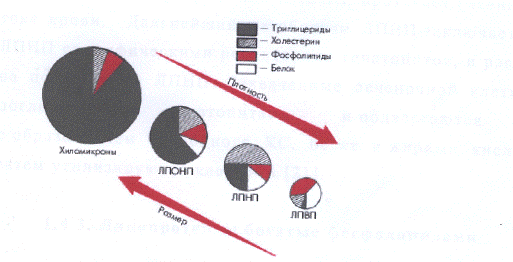
Рис. 7. Состав, размер и плотность частиц
основных классов липопротеинов.[Осачук, Коновалова]
Главным представителем этой группы являются
липопротеиды низкой плотности (ЛПНП или бета - ЛП), названные так потому, что
частицы их имеют низкую плотность. Эти частицы содержат в своём составе около
80% липидов, 20% белка. ЛПНП - основные переносчики холестерина в виде эфиров
холестерина. Они образуются из ЛПОНП через ЛППП. Рецепторы ЛПНП расположены на
мембране клетки в специальных образованиях. После специфического связывания
частицы ЛПНП и рецептора, образовавшийся комплекс подвергается эндоцитозу в
составе везикул, которые в свою очередь, сливаясь, образуются в эндосомы.
Основная роль рецептора ЛПНП заключается в обеспечении клетки холестерином
адекватно её потребности. Важнейшая физиологическая функция ЛПНП - рецептора -
быстрое эффективное удаление ЛПНП в печень, где избыток холестерина окисляется
в желчные кислоты и выводится из организма через кишечник. В результате этих
процессов образуются отдельные классы липидов: апобелки разрушаются до
аминокислот.
ЛПНП у человека содержат большую часть
циркулирующего холестерина и транспортируют его к периферическим тканям для
формирования мембран и процессов стероидогенеза. ЛПНП взаимодействуют с
рецепторами на плазматической мембране клеток печени, надпочечников и
периферических тканей. После взаимодействия с рецептором ЛПНП подвергаются
эндоцитозу, и компоненты ЛПНП катализируются в лизосомах.
Опосредованный рецепторами эндоцитоз ЛПНП
представляет главный источник ХС построения клеточных мембран. Печень является
основным местом рецептор - опосредованного катаболизма ЛПНП: гепатоциты
захватывают примерно половину частиц ЛПНП. Число рецепторов увеличивается во
время деления клеток, когда требуется большое количество холестерина.
Наибольшая экспрессия рецепторов имеет место в злокачественных клетках. ЛПНП
могут включаться в клетки периферических тканей за счёт неспецифического
эндоцитоза. [Чурина 1983]. Этот процесс, обеспечивающий поступление ХС в ткани
пропорционально его концентрации в системном кровотоке, в норме имеет низкую
эффективность, но становится значительным, если концентрация ЛПНП в кровотоке
увеличена, например, семейной гиперхолистеринемии.
Представителями этого класса являются
липопротеиды высокой плотности (ЛПВП или а - липопротеиды), содержащие примерно
52% белка и приблизительно 485 липидов, их которых наибольшее количество
относится к группе ФЛ (40%). Имеющих в качестве основных белковых компонентов
апопротеины группы А и С. ЛПВП самые плотные ЛП белковые комплексы, поскольку содержание
белка составляют около 50% от массы частицы. ЛПВП представляют собой частицы
сферической формы, диаметр которых колеблется в пределах 6 - 12 нм. Период
полужизни этого липопротеида около 5 суток [Холодов 1990]. ЛПВП образуются
несколькими путями, включая синтез и секрецию первичных и насцентных ЛПВП
печенью и тонким кишечником, в процессе ЛП, богатых ТГ, или в результате
взаимодействия новообразованных апоЛП с мембранами клеток, при контакте с
периферическими тканями, а также с ХМ и ЛПОНП, обогащаются холестерином.
Холестерин эстерифицируется при участии фермента лецитин - холестерин
ацетилтрансферазы (ЛХАТ), частицы преобразуются в ЛПВП3. Образованные эфиры
холестерина при участии белка, переносящего эфиры холестерина (БПЭХС),
передаются в ЛП, содержащие апоВ, в обмен на триглицериды. Ремнантные частицы
удаляются из кровотока в печень, в результате холестерин прямо или после
превращения в желчные кислоты экскретируется вс желчью. Многие ЛПВП повторно
рециркулируют в организме, некоторые частицы захватываются печенью и
разрушаются.
Таким образом, ЛП плазмы крови, традиционно
разделяемые на классы физическими, химическими и иммунохимическими методами,
метаболически являются единой системой.
Свободные радикалы, образующиеся в организме
человека в процессе обмена веществ, являются высокоактивными и нестабильными
молекулами, которые легко окисляют ХС ЛПНП. В результате образуются
модифицированные (окисленные) ЛПНП, которые захватываются тканевыми
макрофагами, образующиеся из моноцитов крови, и трансформированные
гладкомышечные клетки могут захватывать ЛПНП посредством скевенджер -
рецепторов. В норме процессы перекисного окисления липидов выражены слабо. Они
существенно усиливаются при различных заболеваниях сердечно - сосудистой
системы, в частности, при атеросклерозе, являясь одним из важных этиологических
факторов, способствующих возникновению и прогрессированию заболевания [Титов
2002]. Таким образом, ЛПНП относятся к наиболее атерогенной фракции ЛП.
Увеличение общего содержания ЛПНП, особенно модифицированных окисленных ЛП,
ассоциируется с высоким риском возникновения атеросклероза и его осложнений.
Организм человека имеет защиту от данного явления и большую группу
антиоксидантов. Антиоксиданты тормозят переход обычных ЛПНП в модифицированные,
угнетая химическую реакцию окисления липидов [Чиркин 2003].
Процессы обмена жира в организме регулируются
нейрогуморальным путём. Нервная система непосредственно влияет на жировую
ткань, стимулируя распад (мобилизацию) жира и доставку его к органам, главным
образом в печень. Одновременно ЦНС и её высший отдел, кора головного мозга,
осуществляют согласованность различных гормональных влияний [Камышников 1997].
Процесс резервных ТГ или липолиз стимулируется рядом гормонов, к числу которых
относятся адреналин, норадреналин, глюкагон, соматотропин, АКТГ, кортизол,
тироксин, тестостерон. Стимулируют процесс распада жира и гормоны гипофиза:
гормон роста, кортиклтропин. Угнетает липолиз инсулин, который усиливает
биосинтез жирных кислот, превращение углеводов в жиры и подавляет процесс бета
- окисления ЖК [Азизова 2003]. Снижение выработки гормонов гипофиза и половых
гормонов приводит к стимуляции процессов синтеза жиров и торможению липолиза, в
результате чего происходит ожирение организма [Камышников 1997].
Основная цель исследования липидного обмена -
это выявление гиперлипидемии как фактора риска сердечно - сосудистых
заболеваний. Поэтому исследование липидов необходимо назначать:
при ишемической болезни сердца, нарушении
мозгового кровообращения
и кровотока в крупных артериях;
лицам с отягощённой наследственностью (ИБС у
родителей в возрасте 60 лет)
при наличии локальных липидных отложений в
возрасте до 50 лет;
в случаях липимической сыворотки.
|
Таблица
1[Турчинский Интерпретация результатов анализа липидов в сыворотке
|
|
Концентрация
в плазме, (сыворотке) ммоль/л
|
Желательно
(нормальный уровень)
|
Высокий
(пограничный уровень)
|
Высокий
(патологический уровень)
|
|
Холестерин
общий
|
3,52
- 5,20
|
5,20
- 6,50
|
>6,50
|
|
ХС
- ЛПНП: мужчины женщины.
|
|
|
до
3,37
|
3,38
- 4,12
|
более
4,14
|
|
до
2,85
|
2,86
- 3,34
|
более
3,37
|
|
ХС
- ЛПВП: мужчины женщины.
|
|
|
1,42
|
0,9
- 1,42
|
<0,9
|
|
1,68
|
1,16
- 1,68
|
<1,16
|
|
Триглицериды
|
0,15
- 1,71
|
1,71
- 2,29
|
>2,29
|
|
Индекс
атерогенности
|
<3
|
3
- 4
|
>4
|
В обязательный перечень лабораторных
исследований анализа липидов сыворотки входит у больных сахарным диабетом и
гипертензией, которые в свою очередь являются факторами риска ишемической
болезни сердца (ИБС).
Анализ липидного спектра рекомендуется проводить
у мужчин возрастом 20 - 60 лет, так как в этой группе проявляется склонность к
сердечно - сосудистым заболеваниям.
1.4 Определение «нормальных» значений липидов
сыворотки крови
В таблице 1 представлены величины нормального,
пограничного и патологического значений фракций липидов в сыворотке крови у
мужчин и женщин разных возрастов.
При рождении концентрация холестерина в
сыворотки крови очень низкая - ниже 2,6 ммоль/л, ХС - ЛПВП - меньше 1,0
ммоль/л. Затем уровень общего холестерина с возрастом повышается, до 55 лет
концентрация ХС обычно у мужчин выше, после 55 лет - у женщин.
Для установления гиперлипидемии необходимы
чёткие биохимические
критерии.
В настоящее время существуют два подхода к этому вопросу. Долгие годы
нормальный уровень ХС и ТГ сыворотки крови, а также ХС - ЛПНП и ЛПВП
устанавливали по результатам эпидемиологических исследований. Для каждой
популяции определяли свои критерии нормы показателей липидного обмена в
зависимости от 5 - 10% минимальных и максимальных значений при Гауссовом
распределении. Гиперлипидемией в этом случае считали, такую концентрацию ХС и
ТГ, которая превышала 90 или 95% отрезную точку в соответствии с полом и
возрастом. [Осачук, Коновалова 2001]. Именно эти критерии значения нормы
положены в основу классификации ГЛП, предложенной Фредриксоном и соавт. и после
некоторых дополнений принятой ВОЗ.
При таком определении критериев «нормы» верхняя
граница нормальных значений для общего ХС составляет 6,50 ммоль/л. Однако
исследования показали, что риск ИБС увеличивается при уровне общего ХС выше
5,20 ммоль/л.
Таким образом, фактически «нормальные» значения
перекрываются с уровнем холестерина, способствующего развитию атеросклероза.
Учитывая, накопленные данные о взаимосвязи повышенного уровня ХС и риска ИБС
была предложена классификация ГЛП.
Нарушение липидного обмена (дислипидемия), в
первую очередь повышенное содержание в крови ХС, ТГ и атерогенных ЛП являются
важнейшим фактором риска атеросклероза и патогенетически связанных с ним
заболеваний сердечно - сосудистой системы (инфаркта миокарда, хронических форм
ИБС, мозгового инсульта, облитерирующего атеросклероза артерий нижних
конечностей и др.) [Титов 2002]. Содержание общего ХС ниже 5,20 ммоль/л
считается оптимальным или, точнее, “желательным” уровнем (таб. № 1). Содержание
общего ХС значительно повышается при атерогенных типах гиперлипопротеинемии
(ГЛП) 2а, 2б, 3 типов при ДЛП 1, 4 и 5 типов увеличения уровня ХС менее
выражено [Ройтман 2004].
Следует подчеркнуть, что для липидов
существенное значение имеют «индивидуальные нормы», ориентировка на которые
часто более значима, чем сопоставление с референтными значениями, выделенными
для популяции. Отчасти это связано с тем, что достаточно много физиологических
факторов влияет на базальный уровень липидов в организме. Гиперхолестеринемия
(ГХС) - наиболее документированный фактор коронарного атеросклероза и риска ИБС
[Чурина 1983]. Другими факторами риска являются гипертензия, курение, сахарный
диабет, ожирение, наследственная предрасположенность и др.
Многочисленными клиническими и
эпидемиологическими исследованиями установлено, что повышение уровня
холестерина (ХС) в крови является одним из основных факторов риска
атеросклероза. Это патологическое состояние связано с нарушениями в стенках
крупных сосудов - аорты или крупных артерий, вызываемых избыточным накоплением
в них ХС [Титов 2002].
Атеросклеротические изменения в стенке сосудов
начинаются с образования липидных пятен или полосок на внутренней поверхности
аорты или крупных артерий. Если процесс прогрессирует, то идёт инфильтрация и
отложение липопротеидов, преимущественно ЛПОНП и ЛПНП в интиме (внутренняя
оболочка, состоящая из слоя эндотелия и соединительнотканной прослойки )
артерий с последующим увеличением количества волокнистых структур межклеточного
матрикса и пролиферацией клеточных элементов [Чиркин 2003]. В интиме возрастает
количество макрофагов, которые начинают усиленно поглощать липопротеиды,
поступающие из кровяного русла в стенку сосудов. Липопротеиды, поглощённые
макрофагами, поступают в их лизосомы и там утилизируются. Но в макрофагах нет
ферментных механизмов, способных расщеплять ХС. Избыточный холестерин в клетках
подвергается этерификации и откладывается в вакуолях. Эти вакуоли постепенно
накапливаются в цитоплазме макрофагов, придавая цитозолю клеток ячеистый вид -
формируются так называемые «пенистые» клетки - наличие которых в интиме артерий
является характерным признаком развивающегося атеросклероза. Пенистые клетки
гибнут, накопленный ХС оказывается в межклеточном веществе интимы, представляет
собой инородный материал. Вокруг него происходит образование
соединительнотканной фиброзной капсулы. Таким путём формируется
атеросклеротическая бляшка характернейший элемент атеросклеротических
изменённых стенок сосудов.
Многочисленные нарушения метаболизма ЛП,
характеризуются повышением липидов крови (гиперлипопротеидемия), снижением
(гиполипопротеидемия) или изменением соотношения классов ЛП
(дислипопротеидемия).
ГЛАВА II. МАТЕРИАЛЫ И МЕТОДЫ
Исследования проводились на базе
Медикосанитарной части поликлиники УФСБ России по Камчатскому краю г. Петропавловска
- Камчатского. Обследовали 68 человек - 33 женщины (49,2%) и 36 мужчин (53,7%).
Было сформировано 2 возрастные группы: от 35 до
50 лет - 16 женщин и 18 мужчин, от 50 до 60 лет - 17 женщин и 18 мужчин. Все
пациенты долгое время проживали на Камчатке (более 20 лет).
Все пациенты находились на обследовании и
лечение в поликлинике, не имели сопутствующих заболеваний, таких как
заболевания печени, почек, гипотиреоз ожирение, при которых также нарушен обмен
липидов.
Исследование производили с развёрнутой
липидограммой определения общего ХС, ТГ, ХС - ЛПНП, ХС - ЛПВП стандартными
наборами реагентов фирмы ООО «Ольвекс диагностикум». Концентрацию ХС - ЛПОНП и
коэффициента атерогенности определяли расчётным способом.
Сыворотка крови, полученная методом центрифугирования,
исследовалась визуально и химически.
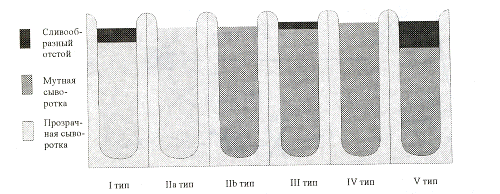
Рис. 9. Внешний вид сыворотки при различных
типах ГЛП [Камышников]
Внешний вид сыворотки. Оценка внешнего вида
сыворотки крови позволяет ориентировочно определить содержание в ней ТГ. Если
сыворотка крови прозрачная, уровень триглицеридов не превышает 2,2 ммоль/л.
Выраженная опалесценция сыворотки крови характерна для гипертриглицеридемии
порядка 3 - 6 ммоль/л, которая уже не прозрачная. Наличие хиломикрон в крови
можно выявить при проведении «теста стояния»: на основании появления «крема» на
поверхности сыворотки при стоянии в течение 16 часов при температуре + 40 С.
Это часто связано с тем, проба взята не натощак.
.1 Преаналитическая стадия исследования
липидного обмена
Взятие крови для определения показателей
липидного обмена проводят после 12 - 16 ч. голодания. Концентрация ХС в крови
не меняется до и после приёма пищи, однако выраженная опалесценция сыворотки
крови, обусловленная наличием хиломикронов и ЛПОНП, может мешать определению.
Желательно, чтобы в течение по мере двух недель до взятия крови, пациент не
менял привычного питания. Накануне нельзя принимать алкоголь, это частая
причина гипертриглицеридемии, даже после продолжительного голодания. На уровень
липидов крови может оказывать положение пациента при взятии крови (сидя, стоя,
лёжа), длительность и интенсивность перетягивания руки жгутом при взятии крови
из вены. Пробы крови нужно брать в одном положении пациентов (лучше сидя) и не
допускается стаз крови (>1 мин пережимать сосуды). Для определения ХС и ТГ
можно использовать сыворотку или плазму крови, но необходимо знать. Что
значения ХС и ТГ, определённые в плазме крови, на 2 - 4% ниже таковых в
сыворотке. Это обусловлено разведением за счёт жидкости, теряемой эритроцитами
под действием антикоагулянта. Лучше использовать один тип антикоагулянта ЭДТА.
При определении показателей липидного обмена
необходимо проведение стандартизации и контроля качества лабораторных
исследований не только на аналитическом, но и на преаналитическом этапе.
Доставка крови в лабораторию, центрифугирование
и отделение сыворотки крови от кровяного сгустка рекомендуется проводить в
течение 2 ч после взятия крови для предотвращения динамического обмена
свободного ХС между сывороткой крови и мембраной эритроцитов.
При интерпретации анализов показателей липидного
обмена необходимо учитывать, что уровень липидов и апопротеинов в сыворотки
крови у мужчин и женщин, изменяется с возрастом, при определённых
физиологических состояниях (беременности), наличии заболеваний (хирургические
вмешательства) и т. д.
.2 Аналитическая стадия при лабораторном
исследовании липидов
Алгоритм диагностики нарушений липидного обмена
(патология системы липопротеидов) включает три последовательных этапа.
Первый этап - скрининг включает определение в
крови содержания общего ХС и ТГ в состоянии сытости или натощак. В случае
констатации гиперхолестеринемии и гипертриглицеридемии следует провести второй
этап исследования.
Второй этап - фенотипирование ГЛП предусматривает
повторное определение уровня в крови ХС и ТГ и с целью исключения алиментарного
влияния на уровень липидов (обязательное голодание в течение 12 ч),
электрофорез ЛП на ацетате целлюлозы (агарозе) и определение ХС - ЛПВП.
Фенотипирование позволяет провести дифференциальную диагностику между
отдельными формами ГЛП.
Для оценки холестерина классов ЛП используют
формулу Фридвальда:
ХС - ЛПНП = общий холестерин - (ХС - ЛПВП +
ТГ/2,2)
Для оценки соотношения атерогенных и
антиатерогенных липопротеидов используется предложенный А. Н. Климовым
холестериновый коэффициент атерогенности (индекс атерогенности, ИА),
рассчитываемый на основании формулы:
общий холестерин - ХС - ЛПВП
ИА = -----------------
ХС - ЛПВП
В случае неясного генеза ГЛП следует провести
третий этап исследования.
Третий этап - дифференциальная диагностика
первичных и вторичных ГЛП.
Дифференциальную диагностику проводят методом
исключения всех заболеваний, для которых характерны вторичные ГЛП - сахарный
диабет, снижение в крови альбумина, ожирение, избыток или недостаток тиреоидных
гормонов, патология печени и т. д.
Комплексное лабораторное исследование и
исключение вторичных
ГЛП даёт основание поставить диагноз первичных
ГЛП и заниматься выяснением конкретных механизмов нарушения метаболизма ЛП.
.3 Определение показателей общего холестерина
Холестерин из состава эфиров освобождается под
действием фермента холестеринэстеразы (ХЭ). При участии фермента
холестериноксидазы (ХО) холестерин окисляется до 4 - холестен - 3 она.
Образующаяся перекись водорода, при участии фермента пероксидазы, способствует
окислительному азосочетанию - аминоантипирина (4 - ААП) и фенола с образованием
окрашенного соединения (хинониминовый краситель). Интенсивность окраски
реакционной среды пропорциональна содержанию холестерина в исследуемом
материале и определяется фотометрически при длине волны (490 - 520) нм.
Исследуемый материал: свежая сыворотка без
следов гемолиза.
Состав набора:
Монореагент
Калибратор - раствор холестерина 5,17 ммоль/л.
Дата изготовления, серия и номер по каталогу
указаны на упаковке.
Таблица 2
Соотношение основных реагентов при применении
методики анализа общего холестерина
|
Компоненты
реакционной среды
|
Опытная
проба
|
Калибровочная
проба
|
Контрольная
проба
|
|
Монореагент,
мл
|
2,0
|
2,0
|
2,0
|
|
Сыворотка,
мл
|
0,02
|
|
|
|
Калибратор,
мл
|
|
0,02
|
|
|
Вода
дистилл.,мл
|
|
|
0,02
|
Реакционную смесь тщательно перемешать и
инкубировать при комнатной температуре не менее 15 минут. После инкубации
измеряли оптическую плотность опытной и калибровочных проб против контрольной
(холостой) пробы при длине волны 520 нм, в кювете с толщиной поглощающего слоя
10 мм, на фотометре биохимического анализатора Roki.
Расчёт содержания холестерина в исследуемом
образце по формуле:
Е пробы
С = 5,17 Х ------ (ммоль/л)
Е калибратора
Интерпретация результатов анализа:
нормальные показатели - 5,17 ммоль/л;
пограничные показатели - 5,17 - 6,50 ммоль/л; патологические показатели - свыше
6,50 ммоль/л.
2.4 Определение содержания триглицеридов
Липаза катализирует гидролиз липидов до
глицерина и жирных кислот. Глицерин запускает ряд сопряжённых ферментативных
реакций с участием ферментов глицерокиназы а присутствии АТФ и
глицеролфосфатоксидазы.
Образующаяся в ходе данных реакций перекись
водорода при участии фермента пероксидазы способствует окислительному
азосочетанию 4 - аминоантипирина и фенола с образованием окрашенного соединения
(хинониминовый краситель). Интенсивность окраски реакционной среды пропорциональна
содержанию триглициридов в исследуемом материале, определяемая фотометрически.
Таблица 3
Соотношение основных реагентов при применении
методики анализа содеражния триглицеридов
|
Компоненты
реакционной средыОпытная пробаКалибровочная пробаКонтрольная проба
|
|
|
|
|
Монореагент.
мл
|
2,0
|
2,0
|
2,0
|
|
Сыворотка,
мл
|
0,02
|
|
|
|
Калибратор,
мл
|
|
0,02
|
|
|
Вода
дистилл.,мл
|
|
|
0,02
|
Исследуемый материал: свежая сыворотка без
следов гемолиза.
Состав набора:
Монореагент
Калибратор - 2,29 ммоль/л.
Реакционную смесь тщательно перемешать и
инкубировать при комнатной температуре не менее 15 минут. После инкубации
измеряли оптическую плотность опытной и калибровочных проб против контрольной
(холостой) пробы при длине волны 520 нм, в кювете с толщиной поглощающего слоя
10 мм, на фотометре биохимического анализатора Roki.
Расчёт концентрации триглицеридов в исследуемом
образце по формуле:
Е пробы
С = 5,17 Х ------ (ммоль/л)
Е калибратора
Интерпритация результатов анализа:
нормальные показатели - 0,15 - 1,71 ммоль/л;
группа риска - 1,71 - 2,29 ммоль/л;
патологические показатели - свыше 2,29 ммоль/л.
2.5 Определение содержания липопротеидов высокой
плотности
Хиломикроны липопротеидов очень низкой плотности
(ЛПОНП) и липопротеиды низкой плотности (ЛПНП) осаждаются при добавлении к
сыворотке фосфорновольфрамовой кислоты и ионов магния. После центрифугирования
в супернатане остаются только холестерин ЛПВП, концентрация которого
определяется так же, как концентрация общего холестерина.
Исследуемый материал: сыворотка
гепаринизированная.
Состав набора:
Калибратор (только для каталога № 013. 004. (50
мг/100мл и 1,29ммоль/ь).
Таблица 4
Соотношение основных реагентов при применении
методики анализа содеражния ЛПВП
|
Компоненты
реакционной среды
|
Опытная
проба
|
Калибровочная
проба
|
Контрольная
проба
|
|
Осаждающий
реагент, мл
|
0,3
|
0,3
|
0,3
|
|
Сыворотка,
мл
|
0,15
|
|
|
|
Калибратор,
мл
|
|
0,15
|
|
|
Вода
дистилл.,мл
|
|
|
0,15
|
Пробы перемешать и инкубировать в течение 10
минут при комнатной температуре. По окончанию инкубации центрифугировали пробы
в течение 10 минут при 4000g. Прозрачный супернатант использовали для
определения концентрации ХС - ЛПВП с монореагентом для холестерина.
Реакционную смесь перемешать и инкубировать
через 15 минут при комнатной температуре. После окончания инкубации измеряли
оптическую плотность опытной и калибровочных проб против контрольной (холостой)
пробы при длине волны 500 нм.
Таблица 5
Соотношение основных реагентов при применении
методики анализа содержания ЛПВП
|
Компоненты
реакционной среды
|
Опытная
проба
|
Калибровочная
проба
|
Контрольная
проба
|
|
Монореагент,
мл
|
1,0
|
1,0
|
1,0
|
|
Супернатант
опытной пробы, мл
|
0,1
|
|
|
|
Супернатант
калибровочной пробы мл
|
|
0,1
|
|
|
Супернатант
контрольной пробы.,мл
|
|
|
0,1
|
Расчёт концентрации (С) холестерина ЛПВП в
сыворотке проводили по формуле:
Е пробы
С = ------- Х 1,29 ммоль/л
Е калибратора
Интерпретация результатов:
Мужчины:
нормальные значения: 1,42 ммоль/л; группа риска:
0,9 - 1,42 ммоль/л; патология: 0,9 ммоль/л
Женщины:
нормальные значения: 1,68 ммоль/л; группа риска:
1,16 - 1,68 ммоль/л; патология: 1,16 ммоль/л.
.6 Определение холестерина низкой плотности
При добавлении к сыворотки гепарина (ЛПНП)
преципитируются в своей изоэлектрической точке при рН 5,10. После
центрифугирования в супернатанте остаётся холестерин хиломикронов, (ЛПОНП) и
(ЛПНП). Концентрация ХС ЛПНП определяется разницей общего холестерина и
холестерина супернатана.
Исследуемый материал: Сыворотка
гепаринизированная.
Состав набора: Осаждающий реагент, Калибратор -
раствор холестерина 5,17 ммоль/л
Таблица 6
Соотношение компонентов набора при проведении
осаждения ЛПНП
|
Компоненты
реакционной среды
|
Опытная
проба
|
Калибровочная
проба
|
Контрольная
проба
|
|
Осаждающий
реагент, мл
|
1,0
|
1,0
|
1,0
|
|
Сыворотка,
мл
|
0,2
|
|
|
|
Калибратор,
мл
|
|
0,2
|
|
|
Вода
дистилл.,мл
|
|
|
0,2
|
Пробы тщательно перемешать и инкубировать в
течение 10 минут при комнатной температуре. По окончанию инкубации
центрифугировать 10 минут при 4000g. Прозрачный супернатант использовали для
определения концентрации холестерина.
Таблица 7
Соотношение компонентов набора при проведении
осаждения ЛПНП
|
Компоненты
реакционной среды
|
Опытная
проба
|
Калибровочная
проба
|
Контрольная
проба
|
|
Монореагент,
мл
|
2,0
|
2,0
|
2,0
|
|
Супернатант
опытной пробы, мл
|
0,2
|
|
|
|
Супернатант
калибровочной пробы калибратор, мл
|
|
0,2
|
|
|
Супернатант
контрольной пробы.,мл
|
|
|
0,2
|
Реакционную смесь тщательно перемешивать и
инкубировать 15 минут при комнатной температуре. После окончания инкубации
измерить оптическую плотность опытной и калибровочных проб против контрольной
(холостой) пробы при длине волны 500 нм.
Расчёт концентрации холестерина ЛПНП (С) в
исследуемой сыворотке проводить по формуле:
Е пробы
Собщ. хол - ------ Х 5,17 ммоль/л
Е калибратора
Интерпретация результатов:
рекомендованные значения: до 3,37 ммоль/л;
группа риска:3,38 - 4,14 ммоль/л
патология: свыше 4,14 ммоль/л
.7 Определение холестерина очень низкой
плотности и коэффициента атерогенности расчётным способом
Содержание ХС - ЛПОНП рассчитывали по следующему
соотношению:
ХС - ЛПОНП = ТГ/5 Х 2,29, где
ТГ - концентрация ТГ (ммоль/л) в исследуемой
сыворотки крови;
- эмпирически найденный коэффициент,
,29 - поправочный коэффициент, выведенный в
формулу для адекватного выражения результатов расчёта в ммоль/л.
Рассчитывали коэффициент атерогенности. Он
отражает соотношение циркулирующих в крови, атерогенных и неатерогенныхЛП.
К = Общий ХС - ХС - ЛПВП/ ХС - ЛПВП
Повышение данного коэффициента свидетельствует о
преобладании атерогенных ЛП, что является фактором риска в развитии
атеросклероза.
Полученные результата исследований
обрабатывались статистически, с получением средне - арифметических значений и
стандартного отклонения.
ГЛАВА III. РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Атерогенные ЛПНП у мужчин, достигали
патологического уровня 4,4 ± 0,3, у женщин этот показатель был несколько снижен
3,7 ± 0,6 и находился в пограничных пределах.
При сравнении показателей липидного обмена у
мужчин и женщин в первой возрастной группе (от 35 до 50 лет) можно отметить,
что уровень общего холестерина у женщин находится в пределах пограничного
уровня 5,8 ± 0,7, у мужчин значения общего холестерина несколько выше и
достигают в отдельных случаях патологических значений (6,2 ± 0,8).
ЛПНП в сыворотке мужчин представлены значением
4,4 ± 0,3, что является высоким (патологическим) уровнем. В свою очередь, у
женщин этот показатель был несколько снижен 3,7 ± 0,6 и находился в пограничных
пределах.
Концентрации ТГ в крови у мужчин оказывается
выше, достигая патологических значений (1,9 ± 0,9), у женщин этот показатель
ниже 1,6 ± 0,4, что тоже превышает нормальные значения. Отмечено, что
концентрация ТГ у мужчин на протяжении всей жизни оказывается выше, чем у
женщин.
ЛПОНП у мужчин достигают значения 1,0 ± 0,5, у женщин
этот показатель немного ниже 0,7 ± 0,3 и превышает физиологическую норму.
Важно отметить, что при небольших отличиях
уровня общего ХС крови у женщин и мужчин этого возраста, содержание ЛПВП у
мужчин были значительно сниженными (0,8 ± 0,3), а у женщин приближались к норме
(1,3 ± 0,2).
Коэффициент атерогенности у мужчин превышает
границу патологии (6,8 ± 1,2), у женщин незначительно превышает норму (3,1 ±
0,6).
Таким образом, в данной возрастной группе риск
развития атеросклероза и ИБС у женщин ниже, чем у мужчин. Это обусловлено более
высоким, но пограничным, уровнем ЛПВП (1,3 ± 0,6), что объясняется действием
половых гормонов эстрогенов (табл.8)
Таблица 8
Содержание холестерина и его липидных фракций в
сыворотке крови
мужчин
и женщин 35 - 50лет.
|
Показатели
ммоль/л
|
Женщины
|
Мужчины
|
|
Общий
ХС
|
5,8
± 0,7
|
6,2
± 0,8
|
|
ЛПВП
|
1,3
± 0,2
|
0,8
± 0,3
|
|
ТГ
|
1,5
± 0,4
|
1,9
± 1,0
|
|
ЛПОНП
|
0,7
± 0,3
|
1,0
± 0,5
|
|
ЛПНП
|
3,8
± 0,8
|
4,4
± 0,3
|
|
КА
|
3,1
± 0,8
|
6,8
±1,2
|
ЛПОНП, как главные переносчики ТГ из мест
синтеза к местам утилизации у мужчин достигают значения 1,0 ± 0,5, у женщин
этот показатель, хотя и ниже 0,7 ± 0,3, но всё же превышает физиологическую
норму. Необходимо отметить, что высокие уровни ХС, ТГ сочетаются с высоким
содержанием ЛПНП и ЛПОНП, что соответствует нашим данным. Особо следует
остановиться на ЛПВП. Согласно литературным данным роль ЛПВП в организме,
прежде всего, определяется их участием в гомеостазе ХС сыворотки крови и тканей
благодаря вовлечению в так называемый обратный транспорт ХС [Осачук, Коновалова
2001]. Способность ЛПВП осуществлять обратный транспорт ХС из периферических
тканей в печень для окисления в желчные кислоты и выведения с желчью, как
известно, объясняют их антиатерогенную активность. Важно отметить, что при
небольших отличиях уровня общего ХС крови у женщин и мужчин этого возраста,
содержание ЛПВП и его доля в общем плазменном пуле ХС, у мужчин были
значительно сниженными (0,8 ± 0,3), (табл. 10), у женщин приближались к норме
(1,3 ± 0,2). Весьма демонстративными являются расчётные показатели коэффициента
атерогенности. У мужчин этот показатель превышает границу патологии (6,8 ±
1,2), у женщин незначительно превышает норму (3,1 ± 0,6) (табл. 10). Согласно
литературным данным, с изменением показателей ХС липопротеиновых фракций тесно связаны
сдвиги в величинах КА. Он представляет собой отношение атерогенных ЛП к
антиатерогенным ЛП. Повышение КА наблюдается при всех формах и стадиях
атеросклероза, ИБС, гипертонической болезни.
Оценивая результаты коэффициента атерогенности,
видно, что риск развития атеросклероза и ИБС у женщин ниже, чем у мужчин. Это
обусловлено более высоким уровнем ЛПВП, что строго соответствует
репродуктивному периоду жизни. Его обеспечивают женские половые гормоны
эстрогены, которые поддерживают высокий уровень ЛПВП («хорошего» ХС), функция
которого состоит, в обратном транспорте ХС из периферических тканей в печень
[Чурина 1983].
Характеризуя данную возрастную группу мужчин и
женщин можно отметить, что адаптация мужчин к условиям Крайнего Севера, в
данном случае Камчатки, является предрасполагающим фактором, к повышению в
сыворотке крови ХС, ТГ атерогенных ЛПНП и ЛПОНП, снижением антиатерогенных ЛПВП
и повышением коэффициента атерогенности, что можно рассматривать, как риск в
возникновении атеросклероза и ИБС, что не расходится с литературными данными
[Осачук Коновалова 2001]. Женщины этой возрастной группы менее подвержены
адаптогенному фактору из - за высокого уровня в сыворотке крови антиатерогенных
ЛПВП. Имеются данные, что предрасположенность к атеросклерозу при одинаковой
картине липопротеидного спектра крови выше у мужчин молодого и среднего
возраста, чем у соответствующих по возрасту группах женщин.
Сравнивая возрастную группу мужчин и женщин от
50 до 60 лет следует отметить, что концентрация общего ХС у женщин увеличилась
и достигла патологических цифр 6,8 ± 1,6, а мужчин значения ХС остались
практически на прежнем уровне.
Значения атерогенных ЛПНП и ЛПОНП у женщин этой
возрастной категории увеличились по сравнению с мужчинами и достигли в
отдельных случаях патологических значений. Концентрация ЛПВП заметно снизились,
по сравнению с мужчинами.
Содержание ТГ у женщин и мужчин этой возрастной
категории достигли практически одинаковых значений.
Расчётные показатели КА у женщин и значительно
увеличились, в свою очередь, у мужчин отмечено некоторе снижение этого
показателя.
Характеризуя данную возрастную группу мужчин и
женщин можно отметить, что адаптация мужчин к условиям Крайнего Севера является
предрасполагающим фактором, к повышению в сыворотке крови ХС, ТГ атерогенных
ЛПНП и ЛПОНП, снижением антиатерогенных ЛПВП и повышением коэффициента
атерогенности, что можно рассматривать, как риск в возникновении атеросклероза
и ИБС.
Кроме того, в возрастной группе 50 - 60 лет у
мужчин и женщин происходит практически выравнивание значений ХС и его липидных
фракций. Это объясняется тем, что у женщин второй половины зрелости, происходит
снижение уровня ЛПВП и повышается риск сердечно - сосудистой патологии. Имеются
данные, что к 50 - 60 годам жизни, риск возникновения атеросклероза и ИБС у
мужчин и женщин становится одинаковым.
Таблица 9
Содержание холестерина и его липидных фракций в
сыворотке крови
мужчин
и женщин 50 - 60 лет
|
Показатели
ммоль/л
|
Женщины
|
Мужчины
|
|
Общий
ХС
|
6,8
± 1,6
|
6,3
± 1,0
|
|
ЛПВП
|
0,9
± 0,2
|
1,0
± 0,3
|
|
ТГ
|
1,7
± 1,0
|
1,8
± 0,7
|
|
ЛПОНП
|
1,1
± 0,6
|
0,9
± 0,5
|
|
ЛПНП
|
4,5
± 1,3
|
4,2
± 0,4
|
|
КА
|
6,5
± 1,2
|
5,9
±1,8
|
Содержание ТГ у женщин и мужчин этой возрастной
категории достигли практически одинаковых значений (табл. 5). Расчётные
показатели КА у женщин значительно увеличились, у мужчин по нашим данным
снижение КА.
Таким образом, женщины возрастной группы 35 - 50
лет менее подвержены адаптогенному фактору из - за высокого уровня в сыворотке
крови антиатерогенных ЛПВП, а у женщин в возрастной группе 50 - 60 лет влияние
адаптогенного фактора усиливается. Это выражается в повышении уровня ХС, ТГ,
так же содержания в них ЛПНП и ЛПОНП, и соответственно в снижении ЛПВП, и
повышении КА. Это связано с тем, что в постменопаузный период происходит
прекращение непосредственного влияния эстрогенов на сосудистую стенку и
кровоток, в связи со снижением в сыворотке крови ЛПВП и увеличении риска в
развитии атеросклероза и ИБС, подтверждается проведенными исследованиями.
Таблица 10
Содержание холестерина и его липидных фракций в
сыворотке крови
у
женщин разных возрастных групп.
|
Показатели
ммоль/л
|
Женщины
35 - 50 лет
|
Женщины
50 - 60 лет
|
|
Общий
ХС
|
5,8
± 0,7
|
6,8
± 1,6
|
|
ЛПВП
|
1,3
± 0,2
|
0,9
± 0,2
|
|
ТГ
|
1,5
± 0,4
|
1,7
± 1,0
|
|
ЛПОНП
|
0,7
± 0,3
|
1,1
± 0,6
|
|
ЛПНП
|
3,8
± 0,8
|
4,5
± 1,3
|
|
КА
|
3,1
± 0,8
|
6,5
± 1,2
|
Концентрация ТГ у женщин увеличилась с 1,5 ± 0,4
до 1,7 ± 1,0, у мужчин отмечается незначительное снижение с 1,9 ± 1,0 до 1,8 ±
0,7. Можно отметить, что показания ТГ у мужчин и женщин достигли практически
одинаковых значений. Имеются литературные данные [Осачук, Коновалова 2001], что
высокий уровень ХС и ТГ у мужчин достигает к 50 - 60 годам, а у женщин пик
приходится на десять лет позже.
Сравнивая показания, антиатерогенных ЛПВП у
женщин разных возрастных групп, можем отметить значительное снижение показаний
с 1,3 ± 0,2 до 0,9 ± 0,2, что является неблагоприятным фактором в развитии
атеросклероза и ИБС. Согласно литературным данным, снижение уровня ЛПВП более
чётко предсказывает формирование ИБС, чем повышение в сыворотке крови
атерогенных ЛПНП и ЛПОНП [Чиркин 2003]. У мужчин ЛПВП немного увеличиваются с
0,8 ± 0,3 до 1,0 ± 0,3, отмечается положительная динамика, которая выражается в
небольшом снижении риска атеросклероза и ИБС. Показания коэффициента
атерогенности у женщин значительно увеличиваются с 3,1 ± 0,8 до 6,5 ± 1,2, а у
мужчин незначительно снижаются с 6,8 ±1,2 до 5,9 ± 1,8.
Таким образом, у женщин второго периода зрелости
влияние адоптагенного фактора усиливается. Это выражается в повышении уровня
ХС, ТГ, так же содержания в них ЛПНП и ЛПОНП, и соответственно в снижении ЛПВП,
и повышении КА. Это связано с тем, что в постменопаузный период происходит
прекращение непосредственного влияния эстрогенов на сосудистую стенку и
кровоток, в связи со снижением в сыворотке крови ЛПВП и увеличении риска в
развитии атеросклероза и ИБС, подтверждается проведенными исследованиями. У
мужчин, по представленным здесь показаниям, происходит небольшое повышение ЛПВП
незначительное уменьшение КА, что рассматривается, как положительная динамика в
снижении риска атеросклероза и ИБС. Согласно литературным данным [Турчинский
1990] можно предположить, что адаптагенный фактор не оказывает большого влияния
на женщин репродуктивного периода за счёт высокого уровня ЛПВП, в отличие от
мужчин, с наступлением постменопаузы, влияние адоптагенного фактора на женщин
усиливается т. к. снижается уровень ЛПВП и повышается уровень общего ХС, ТГ, у
которых ЛПВП снижены.
При сравнении показателей липидного обмена у
мужчин разных возрастных групп (35 - 50, 50 - 60 лет) можно отметить, что
показания общего ХС остались практически на прежнем уровне с 6,2 ± 0,8 до 6,3 ±
1,0, отмечается незначительное снижение ТГ с 1,9 ± 1,0 до 1,8 ± 0,7.
Установлено, что высокий уровень ХС и ТГ у мужчин достигается к 50 - 60 годам,
у женщин пик приходится на десять лет позже.
Таблица 11
Содержание холестерина и его липидных фракций в
сыворотке крови
у
мужчин разных возрастных групп.
|
Показатели
ммоль/л
|
Мужчины
35 - 50 лет
|
Мужчины
50 - 60 лет
|
|
Общий
ХС
|
6,2
± 0,8
|
6,3
± 1,0
|
|
ЛПВП
|
0,8
± 0,3
|
1,0
± 0,3
|
|
ТГ
|
1,9
± 1,0
|
1,8
± 0,7
|
|
ЛПОНП
|
1,0
± 0,5
|
0,9
± 0,5
|
|
ЛПНП
|
4,4
± 0,3
|
4,2
± 0,4
|
|
КА
|
6,8
±1,2
|
5,9
±1,8
|
Показатели ЛПОНП изменяются с 1,0 ± 0,5 до 0,9 ±
0,5 и ЛПНП незначительно снижаются или остаются на прежнем уровне с 4,4 ± 0,3
до 4,2 ± 0,4. В свою очередь, содержание ЛПВП немного увеличиваются с 0,8 ± 0,3
до 1,0 ± 0,3, отмечается положительная динамика, которая выражается в небольшом
снижении риска атеросклероза и ИБС.Отмечается, что снижение уровня ЛПВП более
чётко предсказывает формирование ИБС, чем повышение в сыворотке крови
атерогенных ЛПНП и ЛПОНП.
У мужчин, по представленным здесь показаниям,
происходит небольшое повышение ЛПВП незначительное уменьшение КА, что
рассматривается, как положительная динамика в снижении риска атеросклероза и
ИБС. Исследователями отмечается, что адаптогенный фактор не оказывает большого
влияния на женщин репродуктивного периода за счёт высокого уровня ЛПВП, в
отличие от мужчин.
С наступлением постменопаузы влияние
адаптогенного фактора на женщин усиливается (снижается уровень ЛПВП и
повышается уровень общего ХС, ТГ, у которых ЛПВП снижены).
Различие в риске атеросклероза и ИБС у мужчин и
женщин 1 - ой возрастной группы, отчасти может быть объяснено неодинаковым
содержанием в крови некоторых липопротеидных фракций, в частности ЛПВП, что
соответствует нашим исследованиям. Согласно литературным данным [Осачук,
Коновалова 2001]ВП, конкурируя с ЛПНП в связывании с клеточными рецепторами,
препятствуют накоплению ХС в клетку, способствуя мобилизации внутриклеточного
ХС, транспорту его в печень и последующей экскреции с желчью.
Во 2 - ой возрастной группе происходит
практически сравнивание показаний ХС и его липидных фракций у мужчин и женщин.
Это происходит потому, что у женщин второй половины зрелости, происходит
снижение уровня ЛПВП и повышается риск сердечно - сосудистой патологии. Имеются
данные, что к 50 - 60 годам жизни, риск возникновения атеросклероза и ИБС у
мужчин и женщин сравнивается [Турчинский 1990], что соответствует нашим
исследованиям.
ЗАКЛЮЧЕНИЕ
Таким образом, установлено, что своевременный
контроль уровня липидов в сыворотке крови правильной диагностикой необходимой
для назначения адекватного лечения, коррекции и профилактики нарушений
липидного обмена. Выявлены статистически значимые различия уровня липидов и
липоротеидов. У женщин с высоким коронарным риском в различных возрастных
группах. У женщин с возрастом проявляются более высокие уровни, ХС ЛПНП.
Статистически не различаются уровни ТГ и ХС ЛПВП в обеих возрастных группах.
Малоизученным остается в настоящее время вопрос
о состоянии липидного обмена и возможности его ранней коррекции у женщин
репродуктивного возраста.
С возрастом доля ЛПВП-ХС в общем количестве ХС
снижается. У женщин лет соотношение общий ХС/ЛПВП-ХС составляет 3,4, к 75-89
годам оно повышается до 4,7. Когда это соотношение превышает 7,5, риск ИБС у
женщин становится таким же, как у мужчин. Оптимальным считают соотношение 3,5,
а при величинах 5 и более риск значительно возрастает.
На основании выше изложенного можно сделать
следующие выводы:
Имеются определенные особенности липидного
обмена у мужчин и женщин разных возрастов: в группе 35 - 50 лет у мужчни
отмечается превышение всех показателей липидного обмена до патологического
уровня, кроме ЛПОНП, который имеет пограничные значения, у женщин отмечаются
пограничные значения показателей; в группе 50 - 60 лет отмечается выравнивание
содержания ХС и его липидных фракций, значительно увеличивается КА у женщин;
При анализе показателей липидограмм у мужчин с
возрастом отмечается незначительное увеличение содержания ХС, ЛПВП и снижение
ЛПНП, ЛПОНП и ТГ, незначительное снижение КА; у женщин - повышение ХС, ТГ,
ЛПОНП, ЛПНП, снижение ЛПВП, резкое увеличение КА.
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
Азизова
Д. Ш. Состояние липидного обмена у мужчин. - Москва - 2003, 189 с.;
Богацкая
Л. Н., Новикова С.Н. Липиды крови у больных пожилого и старческого возраста. -
Киев. - 1990, 215 с.;
Бурлакова
Е. Б. Биохимия липидов и их роль в обмене веществ. Москва. 1994, 221 с.;
Галлер
Г., Генефельд М., Яросс В. Нарушение липидного обмена. - Москва. Медицина.
1999, 336 с.;
Горячковский
А. М. Справочное пособие по клинической биохимии. - Одесса. 1994, 416 с.;
Долгов
В. В. лабораторная диагностика нарушений обмена липидов. Учебное пособие. 1999,
148 с.;
Иоффе
Д. В. Стерины как комплексообразователи. Успехи химии. - 1986, 361 с,;
Камышников
В. С. О чем говорят медицинские анализы. - Минск. 1997, 224 с.;
Карпищенко
А. И. Справочник по медецинской лабороторной диагностике ( программы и
алгоритмы ). - Санкт-Петербург 2001.
Климов
А. Н. Липопротеиды плазмы крови, их функция и метаболизм. - Москва. Медицина.
1991, 112 с.;
Климов
А. Н., Никульчева Н.П. Липиды, липопротеиды и атеросклероз. - Москва. 1992, 303
с.;
Либов
И. А., Иткин Д. А., Черкесова С. В. Нарушение липидного обмена и атеросклероза.
- Москва. 2003, 278 с.;
Меньшиков
В. В. Биохимические исследования в клинике. 1981, 383 с.;
Осачук
С. С., Коновалова Н. Ю. Изменение жирнокислотного спектра липопротеинов высокой
плотности у мужчин и женщин. 2001, 397 с.;
Пархотник
И. И. Лечебная физкультура при заболеваниях внутренних органов и нарушение
обмена веществ: цикл лекций. - Киев, 1996.
Ройтман
А. П. Современные аспекты дислипопротеинемий. - Москва. 2004, 264с,;
Титов
В. Н. Клиническая химия атеросклероза. 2002, 354 с.;
Титов
В.Н. Патогенез атеросклероза для XXI века. - Москва. 1998, 289 с.;
Ткачук
В. А. Клиническая биохимия. - Москва. ГЭОТАР - МЕД. 2002, 236 с.;
Турчинский
В. И. Ишемическая болезнь сердца на Крайнем Севере. - Новосибирск. 1990, 390
с.;
Холодов
Ю. Д., Чаяло П. П. Липопротеиды крови. - Киев. Высшая школа. 1990, 192 с.;
Чаяло
П. П. Нарушение обмена липопротеидов. Киев. 1996, 211 с.;
Чиркин
А. А. Карманный справочник врача. Липидный обмен. - Москва 2003, 231 с,;
Чурина
С. К. Особенности патогенеза ИБС у женщин молодого и среднего возраста. -
Москва. Медицина 1983, 256 с.