Комплексная лучевая диагностика периферического рака легкого
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ
РЕСПУБЛИКИ БЕЛАРУСЬ
Учреждение образования
"Гомельский государственный медицинский университет"
Медикодиагностический факультет
Кафедра онкологии с курсом лучевой
диагностики и лучевой терапии
Курсовая работа
КОМПЛЕКСНАЯ ЛУЧЕВАЯ ДИАГНОСТИКА
ПЕРИФЕРИЧЕСКОГО РАКА ЛЕГКОГО
Исполнитель: студент 503 группы
Кравченко Е.В.
Научный руководитель: к. м. н. Юрковский А.М.
Гомель 2010
Реферат
Курсовая работа ____ страниц, 11 рисунков, 3 таблицы, 10
источников, 1 приложение.
Перечень ключевых слов: периферический рак легкого,
рентгенологическое исследование, компьютерная томография, магнитно-резонансная
томография, трансторакальное ультразвуковое исследование, лабораторная
диагностика.
Рак легкого является социальной и научной проблемой, важность
которой не уменьшается со временем, несмотря на научно-технический прогресс и
возрастающие возможности диагностики. Это наиболее распространенное в мировой
популяции злокачественное новообразование у мужчин.
В Беларуси заболеваемость раком легкого занимает первое место
в структуре заболеваемости злокачественными новообразованиями и смертности от
них.
Высокий удельный вес данной формы рака и отсутствие надежных
лучевых критериев, позволяющих своевременно диагностировать данную патологию
является одной из основных медицинских проблем, поэтому в данной работе главной
целью будет являться выделение наиболее информативных лучевых критериев,
позволяющих диагностировать периферический рак легкого и проведение
сравнительного анализа методов исследования данного заболевания.
Содержание
Перечень условных обозначений
Введение
Глава 1. Периферический рак легкого
1.1 Эпидемиология
1.2 Этиология
1.3 Патогенез
1.4 Классификация периферического рака легкого
1.4.1 Клиникоанатомическая классификация
1.4.2 Гистологическая классификация
1.4.3 TNМклассификация
1.4.4 Классификация по стадиям рака легкого
Глава 2. Диагностика периферического рака легкого
2.1 Рентгенодиагностика периферического рака легкого
2.2 Компьютерная томография
2.3 Магнитнорезонансная томография периферического рака легкого
2.4 Трансторакальное ультразвуковое исследование периферического
рака легкого
2.5 Лабораторная диагностика рака легкого
Глава 3. Сравнительная характеристика методов исследования
3.1 Рентгенологическое исследование (РИ)
3.2 Ультразвуковое исследование (УЗИ)
3.3 Компьютерная томография (КТ)
3.4 Магнитнорезонансная томография (МРТ)
Список использованных источников
Приложения
Перечень
условных обозначений
КТ - компьютерная томография
МРТ - магнитно-резонансная томография
РИ - рентгенологическое исследование
ТТУЗИ - трансторакальное ультразвуковое исследование
УЗИ - ультразвуковое исследование
Введение
Рак легкого является актуальнейшей социальной и научной
проблемой, важность которой не уменьшается со временем, несмотря на
научно-технический прогресс и возрастающие возможности диагностики.
Заболеваемость раком легкого неуклонно растет во всех развитых странах мира.
Параллельно с этим наблюдается и увеличение показателей смертности от рака
легкого. Эти статистические показатели повышаются каждые 5 лет на 8-10%. В
большинстве промышленно развитых стран мира в последнее десятилетие в структуре
общей онкологической заболеваемости рак легкого занимает первое место.
По данным официальной статистики, в 1997 году заболеваемость
раком органов дыхания составила 45 на 100 тысяч населения. Среди всех
заболевших злокачественными опухолями рак легкого составил 15%. В то же время
больные с 1-2 стадиями составили всего лишь 19,6%. Несмотря на определенные
достижения в области диагностики, пятилетняя выживаемость не превышает 7%,
причем 60% больных погибает в течение первого года с момента установления
диагноза.
Главной причиной запущенности рака легкого является поздняя
диагностика, в основе которой лежит плохое знание клинико-рентгенологических
проявлений рака легкого и несоблюдение правильной диагностической технологии,
отказ от своевременного применения адекватных диагностических средств [1].
Одной из сложнейших проблем современной онкологии является
улучшение диагностики рака легкого, так как у каждого второго больного это
заболевание выявляется в поздней стадии, что препятствует его радикальному
лечению. В диагностическом плане наиболее сложным является распознавание
периферического рака легкого, поскольку стандартные методы бронхоскопической
или пункционной верификации этого заболевания исчерпали свои возможности,
морфологическое подтверждение диагноза периферического рака легкого получают у
48,2% больных [2]. Кроме того, имеются большие трудности в дифференциальной
диагностике периферического рака легкого и других шаровидных теней в легких в
связи со сходством рентгенологических признаков при традиционном
рентгенологическом исследовании.
Второй не менее важной проблемой является необходимость
дооперационного определения степени распространенности опухолевого роста и
путей возможного метастазирования. Сроки жизни больного раком легкого, как
известно, находятся в прямой зависимости от стадии заболевания к моменту начала
лечения. Так, по данным Sagawa M. et al. (1990), пятилетняя выживаемость при
стадии заболевания T1N0M0 имеет место у 80% больных, при стадии T1-2N1M0 - у
35-40%, при наличии метастазов в средостении - у 2%. Многие исследователи
указывают на то, что после гистологического изучения оперированных органов
стадия рака, установленная на основе совокупности клинических,
рентгенологических и эндоскопических данных, в 36-45% случаев оказывается
ошибочной.
Несмотря на обширный комплекс диагностических методов,
используемых в дооперационном обследовании (рентгенологический, эндоскопический,
морфологический, радиоизотопный), у значительной части пациентов операция
ограничивается пробной торакотомией, так как не была установлена инвазия
злокачественной опухоли в структуры средостения, сосуды.
Неоправданные оперативные вмешательства в 20-29,5% случаев
ведут к послеоперационным осложнениям и в 10-14% - к летальному исходу. В связи
с этим оценка распространенности рака легкого клинико-рентгенологическими
методами нуждается в коррекции [2].
Поэтому главной целью является выделить наиболее информативные
лучевые критерии, позволяющие диагностировать периферический рак легкого.
Глава 1.
Периферический рак легкого
Периферический рак составляет от 12 до 37,5 % всех опухолей
легких. Опухоль развивается из эпителия бронхов IV-VI порядка и более мелких
ветвей и постепенно разрастается в виде узла. Макроскопически он имеет вид
сероватого округлого образования с более или менее четкими границами. Нередко в
центре опухоли (независимо от ее величины) имеется размягчение ткани - некроз
или полость распада. Раковый узел может располагаться в кортикальной
(субплевральная форма), в центральной и в срединной зонах.
Наиболее частой локализацией периферического рака легкого
является верхняя доля (70%), реже это заболевание встречается в нижней доле
(23%) и еще реже - в средней (7%) [3].
1.1
Эпидемиология
Рак легкого - наиболее распространенное в мировой популяции
злокачественное новообразование у мужчин. В Беларуси заболеваемость раком
легкого занимает первое место в структуре заболеваемости злокачественными новообразованиями
и смертности от них. За 35 лет в республике зарегистрировано 112 139 случаев
рака легкого, из них 96 987 у мужчин и 15 152 у женщин.
В 1970 г. раком легкого заболело 1046 мужчин (16,4 % от
общего числа заболевших злокачественными новообразованиями у мужчин) и уступает
по числу только заболевшим раком желудка. К середине 1990-х гг. XX в. число
ежегодно выявляемых новых случаев рака легкого достигло 4089 и волнообразно
снизилось до 3886 в 2004 г., составив 21 % в структуре онкологической заболеваемости
мужчин. Таким образом, число новых случаев рака легкого в 1995 г. по сравнению
с 1970 г. возросло в 3,9 раза, а в 2004 г. - в 3,7.
рак периферический легкое диагностический
В начале 1970-х гг. среди женского населения ежегодно
регистрировалось около 300 (277-310) случаев рака легкого (3,7 % в структуре
онкологической заболеваемости женского населения), с начала 1990-х гг. и до
настоящего времени - 490-550 (3,0-4,1% женской онкологической патологии). Число
заболевших за 35 лет возросло практически в 2 раза.
Таким образом, отмеченный рост числа больных, страдающих
данным заболеванием, обусловлен главным образом увеличением заболеваемости
мужчин. Если соотношение числа заболевших раком легкого мужчин к числу
заболевших женщин в начале 1970-х гг. составило 3,8: 1, то в начале нынешнего
века возросло до 7,4: 1.
В связи с разнонаправленностью динамики заболеваемости
злокачественными новообразованиями отдельных локализаций и ее иногда
существенными различиями у мужчин и женщин рак легкого в отдельные промежутки
указанного срока наблюдения занимал разные ранговые места в структуре
онкологической патологии. Так, у мужчин на протяжении всех 35 лет
злокачественные новообразования легкого наряду с раком желудка и раком кожи
составляли три самые распространенные локализации. Однако если до 1981-1984 гг.
рак легкого уступал по частоте раку желудка, то в последующие годы он прочно
занял лидирующее положение среди других локализаций злокачественных
новообразований у мужчин. У женщин на долю рака легкого в начале 1970-х гг.
приходилось 3,7 % (7е ранговое место в структуре женской онкопатологии), а к
2004 г. - 3,0 % (11е ранговое место).
Для оценки реального уровня заболеваемости раком легкого
приводится анализ грубых интенсивных показателей заболеваемости с разделением
заболевших по полу и месту жительства (город - село) за 1970-2004 гг.
Уровень заболеваемости мужчин городского и сельского
населения в 1970-1972 гг. был практически одинаков (23,1 и 27,6
соответственно). Однако данные, характеризующие динамику показателей
заболеваемости, свидетельствуют о том, что в течение 20 лет (начиная с середины
1970-х гг.) она увеличивалась с большим среднегодовым темпом прироста у мужчин
села. В 1995 г. заболеваемость мужчин города составила 65,0 %000
(увеличилась в 2,8 раза), а села - 131,2 %000 (увеличилась в 4,6
раза), т.е. частота рака легкого у сельских мужчин в середине 1990-х гг.
превысила его частоту у городских мужчин в 2 раза.
Последние 10 лет характеризуются практически стабильными
показателями заболеваемости у мужчин города на уровне 65,0 - 69,5 %000
и снижением заболеваемости у мужчин, проживающих в сельской местности, со 131,2
до 120,0 %000. У женщин за 35 лет частота рака легкого
возросла с 5,9 до 10,4 %000 (в 1,8 раза), причем рост заболеваемости
был более выражен в период с 1970 по 1990 г. Различия между показателями
заболеваемости женщин городского и сельского населения выражены незначительно,
при некотором превышении их у женщин села.
Естественно, что указанные различия в динамике показателей у
мужчин и женщин изменили и соотношение заболеваемости. Если в начале 1970-х гг.
соотношение заболеваемости мужчин и женщин в целом составило 4,3: 1, городских
жителей - 3,7: 1, сельских - 4,9: 1, то в конце описываемого периода - 8,1: 1;
7,2: 1 и 9,8: 1 соответственно.
Возрастное распределение заболевших раком легкого у мужчин
практически не отличается от особенностей возрастной частоты рака других
локализаций, т.е. заболевание у лиц до 35 лет встречается крайне редко. В
каждой последующей возрастной группе происходит увеличение показателей
заболеваемости, которая достигает максимума в группе 65-74 года и составляет в
1970-е гг. около 200,0 на 100 000 населения соответствующей возрастной группы и
около 500,0 к середине 1990-х гг.
Заметное увеличение заболеваемости произошло в возрастных
группах начиная с 45 лет, и за 30 лет заболеваемость в каждой возрастной группе
возросла в среднем в 2,5 раза. За последние 10 лет произошло снижение числа
ежегодно выявляемых больных раком легкого. В это время у мужчин отмечено
уменьшение числа заболевших практически во всех возрастных группах до 70 лет.
Однако среди лиц старше 70 лет повозрастные показатели заболеваемости находятся
на уровне предыдущих лет, который является максимальным.
Таким образом, в Беларуси после продолжительного постоянного
увеличения заболеваемости раком легкого у мужчин наметилась тенденция к ее стабилизации
и даже снижению. Однако рак легкого по-прежнему занимает лидирующее место в
структуре онкологической заболеваемости, что ставит его в разряд основных
медицинских и социальных проблем и требует углубленных эпидемиологических
исследований по выявлению причин, влияющих на характер заболеваемости [4].
1.2 Этиология
Основные этиологические факторы:
Генетические факторы.
Три и более случаев развития рака лёгкого в семье (у
ближайших родственников).
Первичная множественность опухолей (наличие злокачественной
опухоли в анамнезе).
Модифицируемые факторы.
) Экзогенные:
курение,
радон-222.
загрязнение окружающей среды канцерогенными веществами.
профессиональные вредности (асбест).
) Эндогенные:
возраст старше 50 лет,
хронические лёгочные заболевания (туберкулёз, пневмония,
бронхит, локализованный пневмофиброз и др.),
эндокринные заболевания [5].
1.3 Патогенез
В патогенезе рака легкого можно условно выделить 3 этапа.этап
связан с первичным контактом канцерогенного агента и легких, его активацией,
взаимодействием с ДНК эпителиальной клетки, что приводит к изменению ее генома
и фенотипа, образованию латентной раковой клетки.этап характеризуется
хроническим повторным контактом канцерогенов или некоторых других повреждающих
агентов (промоторов) с клетками; происходят дополнительные генные изменения,
вызывающие размножение раковых клеток с образованием опухолевого узла.этап -
нарастание различных признаков злокачественности (атипии, инвазивного роста,
метастазирования, хромосомных аберраций и др.), часто независимо друг от друга.
1.4
Классификация периферического рака легкого
1.4.1
Клиникоанатомическая классификация
1) Центральная форма, возникающая в крупных бронхах (главном,
промежуточном, долевом, сегментарном и субсегментарном).
Экзофитный (эндобронхиальный) рак, растущий в просвет бронха.
Эндофитный (экзобронхиальный) рак с преимущественным ростом
опухоли в толщу лёгочной паренхимы.
Разветвлённый (перибронхиальный) рак с муфтообразным
перибронхиальным ростом опухоли вокруг бронхов. На практике чаще наблюдают
смешанный характер роста опухоли с преобладанием того или иного компонента.
) Периферическая форма развивается из эпителия мелких бронхов
или локализуется в паренхиме лёгкого.
Узловой (круглая опухоль).
Пневмониеподобный.
Рак Пенкоста (рак верхушки лёгкого).
Полостной рак.
) Медиастинальная форма - множественное метастатическое
поражение средостенных лимфатических узлов без установленной локализации
первичной опухоли в лёгком (Приложение А рисунок 10).
) Диссеминированная форма (первичный канцероматоз) - множественное
поражение лёгких без установленной локализации первичной опухоли в других
органах.
Рак чаще возникает в правом лёгком (56%), преимущественно в
верхней доле.
1.4.2
Гистологическая классификация
Для рака лёгкого характерно большое разнообразие
гистологической структуры. В настоящее время принята Международная
гистологическая классификация (ВОЗ, 1999).
) Мелкоклеточный рак:
Овсяноклеточный.
Рак из клеток промежуточного типа.
Комбинированный овсяноклеточный рак.
) Немелкоклеточный рак:
Плоскоклеточный (эпидермоидный, веретеноклеточный) рак.
Железистый рак (аденокарцинома).
Ацинарная аденокарцинома.
Папиллярная аденокарцинома.
Бронхиолоальвеолярный рак.
Солидный рак с образованием слизи.
Крупноклеточный рак.
Гигантоклеточный.
Светлоклеточный.
Железистоплоскоклеточный (диморфный) рак.
Рак бронхиальных желёз.
Аденокистозный рак.
Мукоэпидермоидный рак.
Другие типы.
Карциноид: типичный, атипичный.
Неклассифицируемый рак.
Другие.
Плоскоклеточный рак происходит из метаплазированного
бронхиального эпителия. Это наиболее частый гистологический вариант
заболевания. Его особенностью является склонность к спонтанному распаду.
Аденокарцинома обычно является периферической субплевральной
опухолью. Развивается из железистых клеток слизистой бронха или из рубцовой
ткани после перенесенного туберкулеза. Протекает более агрессивно, чем
плоскоклеточный рак. Интенсивно метастазирует в регионарные лимфатические узлы,
кости и головной мозг, образует имплантационные метастазы, часто сопровождается
злокачественным плевритом.
Бронхиоло-альвеолярный рак возникает из пневмоцитов, всегда
расположен в легочной паренхиме и не связан с бронхом. Выделяют две
разновидности этой опухоли: солитарную (60%) и мультицентрическую (40%).
Крупноклеточный рак считается недифференцированным с высокой
потенциальной злокачественностью.
Железисто-плоскоклеточный рак состоит из железистых и
эпидермоидных элементов, встречается редко.
Рак бронхиальных желез - редкая опухоль. Гистологически
выделяют мукоэпидермоидную и аденокистозную карциномы.
Мелкоклеточный рак развивается из нейроэктодермальных клеток
Кульчицкого, расположенных в базальном слое бронхиального эпителия. Это самая
злокачественная разновидность легочного рака, характеризующаяся интенсивным
метастазированием и высокой метаболической активностью [6].
1.4.3
TNМклассификация
В настоящее время принята Международная классификация рака
лёгкого по системе TNM (2002).
Т - первичная опухоль.
ТХ - недостаточно данных для оценки первичной опухоли, о
наличии которой судят только на основании обнаружения раковых клеток в мокроте
или смыве из бронхов, а рентгенологически и бронхоскопически опухоль не
обнаруживают.
ТО - первичную опухоль определить не удаётся.-
внутриэпителиальный (преинвазивный) рак (carcinoma in situ).- микроинвазивный
рак, или опухоль размером до 3 см в наибольшем измерении, окружённая лёгочной
тканью или висцеральной плеврой, без поражения последней и бронхоскопических
признаков инвазии проксимальнее долевого бронха.
Т2 - опухоль размером более 3 см в наибольшем измерении или
распространяющаяся на главный бронх не менее чем на 2 см от киля бифуркации
трахеи (carina trachealis), или прорастающая в висцеральную плевру, или
сопровождающаяся ателектазом, но не всего лёгкого.
ТЗ - опухоль любого размера, непосредственно
распространяющаяся на грудную стенку, диафрагму, медиастинальную плевру,
перикард или опухоль, распространяющаяся на главный бронх менее чем на 2 см от
киля бифуркации трахеи, но без вовлечения последнего, или опухоль с ателектазом
всего лёгкого.
Т4 - опухоль любого размера, непосредственно
распространяющаяся на средостение, сердце (миокард), магистральные сосуды
(аорта, общий ствол лёгочной артерии, верхняя полая вена), трахею, пищевод,
тела позвонков, киль трахеи или опухоль со злокачественным цитологически
подтверждённым плевральным выпотом.- регионарные лимфатические узлы.-
регионарные лимфатические узлы невозможно оценить.- нет метастазов во
внутригрудных лимфатических узлах.- метастатическое поражение ипсилатеральных
пульмональных, бронхопульмональных и/или лимфатических узлов корня лёгкого,
включая их вовлечение при непосредственном распространении самой опухоли.-
метастатическое поражение ипсилатеральных средостенных лимфатических узлов.-
поражение контралатеральных средостенных и/или корневых
лимфатических узлов, прескаленных и/или надключичных на
стороне поражения или противоположной стороне.
М - отдалённые метастазы.- отдалённые метастазы невозможно
оценить.
МО - нет отдалённых метастазов.- отдалённые метастазы
имеются.- гистопатологическая градация (обычно определяют в послеоперационном
периоде).- степень дифференцировки клеток не может быть оценена.- высокая
степень дифференцировки.- умеренная степень дифференцировки.-
низкодифференцированная опухоль.- недифференцированная опухоль [5].
1.4.4
Классификация по стадиям рака легкого
Таблица 1 - Группировка по стадиям
|
Occult
carcinoma
|
N0
|
М0
|
|
Стадия 0
|
Tis
|
N0
|
М0
|
|
Стадия IA
|
T1
|
N0
|
М0
|
|
Стадия IB
|
T2
|
N0
|
М0
|
|
Стадия IIА
|
T1
|
N1
|
М0
|
|
Стадия II В
|
T2 T3
|
N1 N0
|
М0 М0
|
|
Стадия IIIA
|
T1 T2
T3
|
N2 N2
N1, N2
|
М0 М0
М0
|
|
Стадия IIIB
|
ЛюбаяT T4
|
N3
Любая N
|
М0 М0
|
|
Стадия IV
|
Любая T
|
Любая N
|
М1
|
Глава 2.
Диагностика периферического рака легкого
В алгоритм лучевой диагностики при установлении рака легкого,
определении его регионарного распространения, лимфогенного и отдаленного
метастазирования, входят следующие методы:
Первичные:
. Флюорография.
. Рентгенография в 2-х проекциях, рентгеноскопия.
Дополнительные:
. КТ грудной клетки, при необходимости КТ брюшной полости и
головного мозга.
По специальным показаниям:
. Ультразвуковое исследование (УЗИ) органов брюшной полости.
Трансторакальное ультразвуковое исследование (ТТУЗИ).
. Магнитнорезонансная томография (МРТ).
. Дополнительно могут быть использованы ангиография
(аортография, венокаваграфия, ангиопульмонография), рентгенография костей,
остеосцинтиграфия, перфузионная сцинтиграфия легких, эхокардиоскопия.
. Обязательными являются бронхоскопия с биопсией и
морфологические методы верификации диагноза.
. Лабораторная диагностика.
2.1
Рентгенодиагностика периферического рака легкого
Периферический рак составляет 20-30% от общего числа случаев
рака легкого и около половины всех солитарных узловых образований.
Периферический рак длительное время развивается скрыто.
Клинические симптомы обычно появляются в том случае, когда опухоль
распространяется на соседние органы, на средостение, грудную стенку. Тогда
больные предъявляют жалобы на боли в груди. При прорастании опухоли в крупный
бронх появляется кашель и кровохарканье. В поздних стадиях появляются признаки
интоксикации: слабость, утомляемость, потеря аппетита. В связи с этим
своевременное выявление периферического рака - в первую очередь прерогатива
рентгенологического исследования.
Одной из причин ошибочной диагностики периферического рака
является неправильная трактовка рентгенологической картины. В сознании врачей
периферический рак часто ассоциируется с округлым "шаровидным"
образованием. Между тем периферический рак на разных этапах развития имеет
разную макроморфологическую и и рентгенологическую картину.
Общепринятое мнение о шаровидной форме периферического рака
справедливо только по отношению к относительно большим узлам, диаметр которых
превышает 3-4 см. Большинство более мелких опухолей не имеет шаровидной формы и
приобретает таковую только по мере роста новообразования. Сравнительно маленькие
опухоли имеют вид очага уплотнения неправильной, амебовидной или звездчатой
формы, неоднородной структуры с нечеткими, неровными контурами.
Иногда опухоль имеет несколько центров роста и выглядит в
виде конгломерата сливающихся очагов уплотнения. Большое значение в диагностике
периферического рака имеет симптом лучистости в виде веерообразно расходящихся
отростков по периферии опухоли, так называемая Corona maligna (Приложение А
рисунок 1). Этот симптом наблюдается примерно в 2/3 случаев периферического
рака. Считается, что лучистость легочного рисунка вокруг опухоли, так же как и
втяжение прилежащей утолщенной плевры, является выражением не только ракового
лимфангита, но и сморщивания опухоли. Одновременно с ростом опухоли в ней
развиваются некробиотические процессы, которые стимулируют реактивную и
стромогенную реакцию соединительной ткани. Вследствие этого в зоне опухоли
формируется нечто, подобное звездчатому рубцу.
Опухолевый очаг на ранних стадиях развития обычно имеет
неоднородную структуру. Основной причиной неоднородности является
мультицентричность и неправильная форма роста, реже она объясняется распадом
опухоли. На рентгенограммах впечатление неоднородности структуры раковой
опухоли усиливается за счет наслоения нормального или патологически измененного
легочного рисунка, в особенности, если он по тем или иным причинам усилен.. G.
Rigler в 1955 г. описал характерный для злокачественных опухолей легких симптом
зарубки или вырезки - локальное втяжение медиального контура опухоли,
обусловленное, вероятно, обрастанием опухолью прилежащего крупного сосуда
(Приложение А рисунок 4,5). Этот симптом встречается относительно редко, не
более чем у 8-10% больных.
Когда опухоль прилежит к междолевой щели, можно видеть легкое
втяжение утолщенной плевры (симптом паруса).
Контуры сравнительно небольших периферических опухолей в
большинстве случаев нечеткие. Это свидетельствует о том, что на ранних стадиях
развития раковый процесс имеет склонность к инфильтративному росту. Позднее,
когда размеры опухоли превышают 2,5 см диаметром, ее контуры становятся
бугристыми, но более четкими.
На более поздних этапах развития появляется дорожка ракового
лимфангита, связывающая опухоль с корнем. Различают два вида дорожек: одна из
них - в виде неоднородной тяжистости за счет периобронхиальной и
периваскулярной опухолевой инфильтрации, вторая - однородная, широкая,
связанная с цепочкой метастатически измененных лимфоузлов или с ростом самой
опухоли. В корне появляются увеличенные лимфоузлы. В этих случаях говорят о
фазе биполярности. Распространение опухолевого процесса на крупный бронх
вызывает его обструкцию, присоединяется ателектаз - происходит так называемая
централизация периферического рака. Однако симптом "дорожки к корню"
для постановки диагноза периферического рака самостоятельного значения не
имеет, т.к. может встречаться и при других заболеваниях (туберкулезе,
хронической пневмонии). Отмечается, что при раке (в отличие от туберкулеза) в
дорожке редко виден дренирующий бронх.
Таким образом, периферический рак на разных стадиях эволюции
имеет разную рентгенологическую картину, и, следовательно,
дифференциально-диагностический ряд в каждом случае иной. На ранних стадиях
развития периферический рак чаще всего похож на очаг воспаления или
пневмосклероза и гораздо реже напоминает доброкачественную опухоль или кисту.
Периферический рак довольно часто распадается. Распад в
опухолевом узле встречается примерно у трети больных периферическим раком. В
некоторых случаях опухоль распадается полностью, приобретая вид тонкостенного
кистозного образования. При полостной форме начального рака опухоль
определяется в виде полости небольших размеров с относительно тонкими,
неровными контурами. С течением времени отмечается увеличение размеров как
самой тени, так и полости, а стенки ее приобретают бугристый внутренний контур.
Периодически полость может заполняться опухолевыми массами, а затем появляться
вновь (Приложение А рисунок 3), [1].
К периферическому раку относятся также верхушечный
(Приложение А рисунок 6) и кортикоплевральный рак, имеющие характерные
клинико-рентгенологические проявления.
Верхушечный рак легкого (опухоль Пэнкоста).
В современном понимании - это стелющийся периферический рак I
сегмента легкого, прорастающий окружающие ткани, приводящий к разрушению I, II,
иногда III ребер и верхних грудных позвонков.
В начале заболевания клиническая картина скудна и проявляется
болями в верхней конечности без других неврологических симптомов, что приводит
к диагностическим ошибкам и безуспешному лечению по поводу плексита или
бурсита.
Рентгенологическая картина опухоли Пэнкоста в этот период
также не характерна. В некоторых случаях отмечается лишь понижение прозрачности
верхушки легкого, в других - малоинфонсивная плоская тень без четких контуров,
симулирующая апикальные плевральные наложения.
На определенном этапе роста опухоли нижний край затемнения на
верхушке становится более четким, а сама тень более интенсивной и оформленной.
Изменения со стороны ребер не выявляются. Клинически отмечаются нарастающие
боли в верхней конечности и грудной клетке.
Для уточнения характера поражения у больных с такой
клинико-рентгенологической картиной необходимо использовать томографию
(Приложение А рисунок 7).
В дальнейшем опухоль прорастает ребра, позвонки, плечевое
сплетение. Сдавление подключичных сосудов может вызвать отек конечности, при
поражении пограничного симпатического ствола развивается синдром Горнера -
птоз, энофтальм, миоз.
В этой стадии заболевания на рентгенограммах выявляется
интенсивное затемнение верхушки легкого с дугообразной нижней границей.
Очертания верхней части тени четко не выявляются. Определяется разрушение IIII
ребер - от узурации небольших участков до полной деструкции на большом
протяжении, а также поражение боковых поверхностей тел и поперечных отростков
позвонков.
Важно подчеркнуть, что при наличии интенсивного затемнения
верхушек легких, необходимо тщательно изучать состояние ребер, особенно их
задних отрезков.
Кортико-плевральный рак (этот термин признается не всеми
онкологами, но, с нашей точки зрения, имеет право на существование) также
является периферическим раком, но исходящим из плащевого слоя легкого
непосредственно у позвоночника. Опухоль растет не узлом, а стелется по плевре,
врастая в поперечные отростки, дужки и тела позвонков. По нашим данным,
основным симптомом такой опухоли являются нарастающие боли в грудном отделе
позвоночника, не поддающиеся терапии. В последующем может развиваться клиника,
обусловленная поражением спинного мозга.
Поражения легких и позвоночника на стандартных
рентгенограммах в начале могут вообще не выявляться, а болевые ощущения
рассматриваются как следствие дегенеративно-дистрофических изменений в
позвонках. В дальнейшем на рентгенограммах появляется деструкция тела
позвонков, поперечных отростков, а иногда и ребер, которая (без данных продольной
или компьютерной томографии) расценивается как метастатическое поражение. В
других случаях опухоль стелется вдоль позвоночника на значительном протяжении.
При этом интенсивная гомогенная, расположенная парамедиастинально
(паравертебрально) тень с довольно четким наружным контуром может на
переднезадних рентгенограммах легких симулировать картину плеврита. По мере
роста опухоль может распространяться и на верхушку легкого. Деструкция ребер и
позвонков к этому времени выявляется уже на обычных рентгенограммах и
продольных томограммах [3].
Бронхиоло-альвеолярный рак (аденоматоз легких) составляет
около 5% от всех оперированных по поводу рака легкого. Многие вопросы,
связанные с природой этого заболевания неизвестны, однако хорошо изучена его
гистологическая картина и клинико-рентгенологические проявления. Принято
считать, что бронхиоло-альвеолярный рак возникает из эпителия альвеол или
бронхиол. Для гистологической картины характерно формирование папилломатозных
структур, распространяющихся внутри просвета бронхиального дерева на более или
менее обширные участки легкого без разрушения межальвеолярных и междольковых
перегородок. Опухоль отличается медленными темпами роста. В некоторых случаях
опухоль на протяжении нескольких лет не обнаруживает динамики роста.
Характерной рентгенологической картины этого заболевания не
существует, как не существует и предпочтительной локализации (Приложение А
рисунок 8). При бронхиоло-альвеолярном раке встречаются, пожалуй, все известные
в рентгенологии синдромы: это может быть солитарный периферический узел или
пневмониеподобный инфильтрат, группа очагов, симулирующих туберкулез,
прикорневое уплотнение, долевое или субдолевое уплотнение, уплотнение всего
легкого, мелкоузелковая диссеминация и т.д. Среди этого многообразия наиболее
часто встречаются три формы: узловая, пневмониеподобная и диссеминированная.
Процесс может быть односторонним и двусторонним. Наиболее характерная картина
наблюдается при пневмониеподобном солитарном образовании. При этой форме в
рентгенологическом изображении определяется фокус понижения пневматизации
неправильной формы, с нечеткими очертаниями, неоднородной структуры с наличием
мелких участков просветления округлой или овальной формы, придающих картине
опухоли ноздреватый вид. Подобные просветления не являются отображением
деструктивного процесса, они обусловлены чередованием участков опухолевой
инфильтрации с участками легочной ткани, сохранившей воздушность. Учитывая
многообразие рентгенологических проявлений, решающее значение в диагностике
бронхиоло-альвеолярного рака приобретает цитологическое исследование мокроты
или пункционная и катетеризационная биопсия.
В дифференциально-диагностический ряд с периферическим раком
можно поставить десятки заболеваний, сопровождающихся формированием уплотнения
в легком. Однако практически в подавляющем большинстве случаев приходится иметь
дело с ограниченным кругом патологических процессов. На первом месте по частоте
и сходству рентгенологической картины стоит туберкулема. В дифференциальной
диагностике периферического рака и туберкулемы следует учитывать клиническую
картину. Периферический рак на ранних стадиях развития обычно протекает
бессимптомно, в то время как при обострении туберкулемы появляется ряд общих и
клинических признаков интоксикации: слабость, утомляемость, понижение аппетита,
небольшая потеря массы тела, субфебрилитет, анемия, палочкоядерный сдвиг,
увеличение СОЭ. Следует, правда, иметь в виду, что описанные симптомы на ранних
стадиях развития туберкулеза непостоянны и выражены слабо. Микобактерии
туберкулеза обнаруживают лишь у части больных, нередко лишь при многократных
исследованиях.
Основной упор в дифференциальной рентгенологической диагностике
туберкулем и периферического рака делается на выявление туберкулезного фона -
пневмосклероза, очагов, кальцинированных включений. Лишь в 17% туберкулем на
обычных томограммах отсутствуют кальцинированные включения. У большинства
больных с туберкулемами выявляются туберкулезные изменения в окружающей
легочной ткани или в другом легком. Правда, у некоторых больных туберкулемы
являются единственным патологическим образованием в легочной ткани.
Как уже отмечалось выше, фактор локализации процесса не имеет
значения в дифференциальной диагностике рака и туберкулеза. Опухолевый узел
может располагаться в любом сегменте легкого. Как и при центральном раке
отмечается некоторое преобладание частоты в верхних долях.
Несмотря на отмеченные трудности, общее рентгенологическое
дообследование, включающее рентгенографию и томографию с учетом клинических
данных, не менее чем в 80% случаев позволяет установить правильный диагноз
периферического рака легкого. Сомнения остаются в тех редких случаях, когда
туберкулез и рак имеют атипичную картину. Непреодолимые трудности возникают в
тех случаях, когда периферический рак имеет вид солитарного узла округлой формы
однородной структуры с четкими контурами, расположенного на фоне неизмененной
окружающей легочной ткани при полном отсутствии клинических проявлений. Общее
рентгенологическое дообследование в подобных случаях оказывается
нерезультативным в дифференцировании периферического рака, туреркулемы,
доброкачественной опухоли или кисты. В этих случаях программу дообследования больного
завершает чрескожная трансторакальная и эндоскопическая трансбронхиальная
пункция.
В дифференцировании периферического рака с другими узловыми
образованиями определенные трудности вызывают так называемые шаровидные
пневмонии. Подобные образования в рентгенологическом изображении, включая
компьютерную томографию, имеют вид довольно крупных фокусов - инфильтратов
диаметром 5-7 см округлой или неправильно округлой формы с довольно четкими
неровными "лохматыми" контурами. Нередко наблюдается также конвергенция
окружающих фиброзных тяжей и сосудистого рисунка в сторону фокуса с
формированием спикулообразной тяжистости, схожей с периферическим раком. В
отличие от обычной очаговой пневмонии эти образования создают затемнение более
высокой оптической плотности. Структура таких образований неоднородна. На
томограммах (особенно на КТ) в области, инфильтрата обычно выявляются
множественные полости деструкции неправильной, иногда щелевидной формы,
различного размера, придающие инфильтрату вид ноздреватости наподобие
"швейцарского сыра". В рентгенологическом изображении подобные
образования весьма похожи на периферический рак.
Шаровидная пневмония постепенно рассасывается, однако для
этого обычно требуется длительное время, иногда проходит несколько месяцев
прежде чем инфильтрат подвергается полной регрессии. В конечном счете, на месте
пневмонического фокуса остается звездчатый рубец весьма похожий на
периферический рак.
В литературе подобные постпневмонические образования
описываются под различными наименованиями: инфекционная гранулема, локальная
организующаяся пневмония, узловой фиброз, воспалительная псевдоопухоль. В
трудных случаях в целях исключения рака приходится выполнять трансторакальную
пункцию с биопсией.
В оценке стадийности рака легкого и выработке рациональной
лечебной тактики, в частности, целесообразности и объема предполагаемой
операции большое значение имеет оценка распространенности злокачественного
процесса.
Таким образом, запущенность рака легкого и
неудовлетворительные результаты его лечения в значительной мере зависят от
неправильной тактики ведения больных на ранних этапах заболевания - от первых
клинических проявлений, обнаружения неспецифических изменений, выявляемых при
рентгенологическом исследовании, до верификации диагноза.
Рак легкого на ранних стадиях развития не имеет
патогномоничных клинических признаков и специфичной рентгенологической картины.
Наиболее часто рак легкого приходится дифференцировать с затянувшейся
пневмонией, инфильтративным туберкулезом, туберкулемой, шаровидной пневмонией,
узловым фиброзом.
Ранняя диагностика рака легкого должна строиться на основе
выполнения стандартизованной программы комплекса диагностических средств,
включающего рентгенологическое исследование.
При подозрении на периферический рак средством верификации
диагноза является трансторакальная пункция [1].
2.2
Компьютерная томография
Большая разрешающая способность КТ,
возможность получения поперечного сечения и одномоментная оценка всех
анатомических структур позволяют дифференцировать целый ряд образований,
которые нечетко определяются на обычных рентгенограммах и томограммах.
Применение КТ у больных раком легкого позволило сократить число диагностических
методов, направленных на установление распространенности опухолевого процесса.
Из диагностического алгоритма исключены инвазивные методы
(пневмомедиастинография, диагностический пневмоторакс, ангиография), сокращены
сроки обследования больных. В то же время существуют разные точки зрения
относительно информативности КТ в обнаружении метастазов в бронхопульмональных
лимфатических узлах, не уделено должного внимания оптимизации
компьютерно-томографического исследования с целью повышения эффективности
метода и уменьшения лучевой нагрузки на пациента.
В связи с этим оценка регионарного
метастазирования и степени инвазии опухоли в структуры средостения и грудной
стенки, т.е. дескрипторов Т, N, М, с помощью КТ нуждается в дальнейшей
детализации.
Методика исследования: обследование больного проводят в
горизонтальном положении на спине, при задержанном вдохе. Толщина среза 8 мм,
шаг томографии 8-16 мм, при уточнении изменений эти параметры уменьшаются. Зону
сканирования выбирают в зависимости от распространенности процесса по
топограмме в прямой проекции, исследование обычно начинают от уровня яремной
ямки.
На томограммах определяются легочная паренхима, элементы
средостения, мягкие ткани и ребра грудной стенки. Поскольку они имеют разные
показатели коэффициента поглощения, резко отличающиеся друг от друга, каждый
срез необходимо просматривать на двух режимах: (окна 520-1000 и 120-300).
Наличие режима "двух окон" позволяет одновременно оценивать все
структуры на срезе.
К-Т картина периферического рака легкого характеризуется
такими же признаками, как и в традиционной рентгенодиагностике: образование
неправильной округлой формы с нечеткими неровными контурами. Эти отличия
периферического рака от доброкачественных образований и метастазов проявляются
в виде широкой (более 3-4 мм) зоны увеличения плотности вокруг опухоли (от -
550 до - 250 ед. Н), а плотность самой злокачественной опухоли расположена в
диапазоне от +30 до + 60 ед.Н. КТ позволяет выявить возможный распад опухоли с
образованием полости при пересмотре срезов на более низком "окне"
(Приложение А рисунок 5). При помощи КТ удается обнаружить и явления регионарного
лимфангита в виде "дорожки" между корнем легкого и опухолью. В
отличие от сосудов "дорожка" уменьшается по ширине от образования к
корню легкого.
К-Т исследование позволяет изучить взаимоотношение между
периферическим раком и органами средостения, а также элементами грудной стенки.
Прорастание опухоли проявляется, в первую очередь, в том,
что:
а) опухоль локализуется как в легком, так и в средостении с
вовлечением в процесс крупных сосудистых структур;
б) между опухолью, средостением и плеврой отсутствует жировая
клетчатка;
в) имеется наличие жидкости в полости перикарда и утолщение
его стенки;
г) при непосредственной близости опухоли к плевре последняя
утолщена и подтянута к узлу.
Увеличенные свыше 10 мм лимфоузлы, что указывает на их
метастазирование, особенно в области бифуркации трахеи и легочных корней, имеют
тенденцию к слиянию. В то же время в неувеличенных лимфоузлах в 20-25% случаев
выявляются скрытые метастазы рака легкого.
Исходя из этих данных, степени операбельности рака легкого
при КТ исследовании определяют по таким признакам: вовлечение в опухолевый
процесс смежных элементов средостения (перикарда, верхней полой вены), а также
плевры и других структур грудной стенки (Приложение А рисунок 6).
Метастатическое поражение лимфоузлов средостения.
В оценке стадийности рака легкого и выработке рациональной
лечебной тактики, в частности, целесообразности и объема предполагаемой
операции большое значение имеет оценка распространенности злокачественного
процесса.
Широкие возможности в этом плане открывает компьютерная
томография. Этот метод позволяет оценивать вовлечение в опухолевый процесс
главного бронха, легочных сосудов и структур средостения. Выявляемая при
компьютерной томографии ограниченная инвазия перикарда, медиастинальной плевры
и пограничной жировой ткани, легочных вен и диафрагмальных нервов
свидетельствует о возможности радикальной операции. Распространение же
опухолевого процесса на сердце, крупные сосуды, пищевод, трахею и тела
позвонков является противопоказанием к операции. Компьютерная томография
позволяет оценить состояние лимфатических узлов средостения, что является
важным и для определения стадии процесса, оценки операбельности и прогноза
заболевания. По мнению большинства авторов, при размерах лимфатического узла
менее 7 мм, метастазы в них, как правило, отсутствуют [2].
2.3
Магнитнорезонансная томография периферического рака легкого
Распространенность опухоли в грудной клетке в настоящее время
устанавливается с помощью рентгенологических методик (рентгенография, линейная
томография, КТ). В последнее время в диагностике периферического рака все чаще
используется мультиспиральная КТ и метод трансторакальной пункционной биопсии
под контролем КТ. Роль МРТ в диагностическом алгоритме обследования больных с
периферическим раком легкого в настоящее время не определена. В тоже время,
анализируя результаты наблюдений и данные литературы, можно заключить, что МРТ
является высокочувствительным методом визуализации неизмененных анатомических
структур грудной клетки и патологических образований в легких и средостении.
По данным исследования, проведенного авторами (Гамова Е.В.,
Нуднов Н.В., Межведомственная клиническая больница № 38, г. Москва), МРТ
предлагается как один из методов в комплексной диагностике периферического рака
легкого. Целью исследования являлось уточнение MP-семиотики периферического
рака легкого и возможностей МРТ в оценке распространенности опухолевого
процесса в грудной клетке.
Авторами был проведен анализ данных МРТ грудной клетки 121
пациента с наличием на рентгенограммах симптома периферического затемнения в
легком. У 44 из них морфологически подтвержден диагноз - периферический рак
легкого. Эпителиальные опухоли верифицированы в 43 случаях (аденокарцинома -
22, плоскоклеточный рак - 12, мелко клеточный рак - 6, карциноид - 3), в 1
случае имела место лейомиосаркома.
МРТ выполнялась на магнитно - резонансном томографе с
постоянным сверхпроводящим магнитом напряженностью поля 0,5Т на
приемно-излучающей катушке, встроенной в корпус томографа, с применением
двойной синхронизации по ЭКГ и дыханию. При анализе томограмм оценивались
локализация, размеры опухоли, ее форма, характер контуров, внутренняя
структура, перифокальная реакция легочной ткани, наличие сателлитных поражений
(реакция корня легкого, состояние лимфатических узлов средостения, вовлечение
плевры, мягких тканей грудной стенки).
В наблюдениях чаще отмечалась правосторонняя локализация
периферического рака (29 случаев из 44). В большинстве случаев опухолевый узел
располагался в нижней доле (25 наблюдений), у 15 больных отмечено поражение
верхней доли, у 3 - средней, в 1 случае имел место периферический рак,
распространяющийся на 2 доли легкого.
На MP-томограммах периферический рак легкого на фоне слабо
выраженной ячеистости легочного поля имел вид участка средне или слабо
повышенной интенсивности MP-сигнала на Т1 - взвешенных изображениях (ВИ) и
повышенной на Т2 ВИ. Размеры выявляемых узлов в наблюдениях варьировали в
широких пределах 7 - 160 мм. Форма опухолевого узла была различной, от
правильной шаровидной до причудливой. Контуры опухоли чаще характеризовались
четкостью и неровностью.
Структура опухоли чаще была негомогенной. Неоднородность
опухолевого узла объясняется как различными релаксационными свойствами ткани
опухоли, так и наличием участков некроза в опухолевом узле.
Интенсивность MP - сигнала от опухолевого узла был средне или
слабо повышенной на Т1 - и повышенной на Т2 ВИ. Относительная интенсивность MP
- сигнала определялась при сравнении с мягкими тканями грудной стенки,
абсолютная измерялась в единицах яркости, аналогично измерению плотности
объекта при КТ. Интенсивность MP - сигнала в абсолютных единицах на Т1 ВИ
варьировала от 104 до 482., на Т2 ВИ от 60 до 225. Несмотря на большой разброс
показателей яркости, наблюдалась определенная закономерность соотношения
абсолютных показателей яркости MP - сигнала от эпителиальных опухолей на Т1 - и
Т2 ВИ. Коэффициент отношения Т1/Т2 в среднем составлял 1,9 - 2,7.
В большинстве случаев наблюдаемого рака отмечалась
перифокальная реакция со стороны легочной ткани (corona maligna), лишь в 4
наблюдениях изменений со стороны прилежащей к раковому узлу легочной паренхимы
отмечено не было. Образование лучистого венчика, коротких тяжей, уходящих в
легочную ткань, обусловлено распространением опухоли вдоль стенок бронхов, лимфатических
и кровеносных сосудов, вдоль междольковых перегородок. Нередко на
MP-томограммах можно было видеть "дорожку " к плевре или корню
легкого. Симптом "дорожки" может быть обусловлен явлениями лимфостаза
в блокированных опухолью лимфатических сосудах с воспалением и фиброзом
различной степени зрелости, либо перибронхиально-периваскулярным ростом
опухоли. Надо помнить, что наличие дорожки не всегда является отражением
опухолевой инфильтрации, так как может быть следствием воспалительных
изменений, сопутствующих раковому процессу.
Индикатором злокачественности периферической опухоли является
метастазирование в регионарные лимфатические узлы. Выявление метастазов имеет
важное значение при определении стадии опухолевого процесса, кроме того,
обнаруженные лимфатические узлы могут быть удалены во время торакотомии.
Поражение лимфатических узлов корня легкого на стороне поражения было отмечено
у 43,2% больных, поражение лимфатических узлов средостения - у 54,5%.
Лимфатические узлы корня легкого в норме на MP-томограммах отображения не
имеют. Из медиастинальных лимфатических узлов на MP-томограммах могут получать
отображение лимфатические узлы паратрахеальной и бифуркационной областей,
аортальнолегочного окна. Размеры узлов указанной локализации в норме не превышают
4 - 8 мм по длинной оси, форма их овальная. Пораженные лимфатические узлы на
MP-томограммах имели вид дополнительных образований с четкими очертаниями,
форма их ближе к сферической. Размеры пораженных лимфатических узлов
варьировали от 3-4мм до 20мм, структура в большинстве наблюдений была
гомогенной, интенсивность MP-сигнала средней на Т1 ВИ и Т2 ВИ. В ряде случаев
отмечалась конгломерация и неоднородность пораженных медиастинальных
лимфатических узлов за счет развития в них вторичных изменений. При
патоморфологическом сопоставлении данных, полученных при операции, и данных МРТ
удалось разделить МР-признаки метастатического поражения и признаки реактивной
гиперплазии лимфатических узлов. При ретроспективном анализе лимфатические узлы
без признаков опухолевого поражения на МР-томограммах либо не были видны, либо
размеры видимых в норме узлов не превышали 10 мм. Таким образом, можно сделать
вывод, что появление лимфатических узлов, не видимых в норме на пути
регионарного оттока, конгломерация узлов, увеличение видимых в норме
лимфатических узлов более 10 мм должно расцениваться как метастатическое
поражение.
Помимо метастазирования, на MP-томограммах можно отметить
прямое врастание периферических опухолей в рядом расположенные структуры
(Приложение А рисунок 11). Информация о поражении грудной стенки и средостения
является важным фактором при определении возможности и объема хирургического
вмешательства. При расположении периферической опухоли в плащевом слое легкого
инвазия плевры отмечалась у 47,7% больных. Прорастание в мягкие ткани грудной
стенки выявлено у 1 больного, прорастание в клетчатку средостения - у 1
больного. При оценке врастания опухоли per continuitatem измерялась площадь
контакта с пограничной структурой, угол между ней и опухолью, наличие интакткой
прослойки, наличие дополнительных масс и изменение интенсивности сигнала от
контактной структуры.
В норме на MP-томограммах листки плевры не дифференцируются и
отображения не имеют. Прямыми признаками поражения плевры считались: ее
утолщение в месте контакта, изменение интенсивности MP-сигнала, тракция плевры
в легочное поле. При оценке плеврального поражения угол наклона между плеврой и
опухолью более 90 градусов рассматривался как высокая вероятность поражения
плевры, острый угол, менее 90 градусов, классифицировалсля как возможная
инфильтрация. Наличие интактной легочной ткани между плеврой и опухолью
расценивалось как отсутствие инвазии плевры. При наличии "дорожки" к
плевре поражение последней рассматривалось как возможное. Надо помнить, что
утолщение плевры может быть обусловлено не только опухолевой инвазией, но и
фибринозным плевритом, плевральной гиалинизацией, воспалением или хроническим
слипчивым рубцеванием. Утолщение плевры в сочетании с изменением MP-сигнала в
месте контакта может быть результатом ятерогенного воздействия - пункционной
биопсии. В связи с вышеизложенными, признаки поражения плевры в каждом
конкретном случае должны рассматриваться в комплексе.
При оценке мягких тканей грудной стенки наличие
дополнительного компонента в проекции межреберных промежутков и деструкция
ребер рассматривались как инвазия. При близком расположении опухоли к
средостению учитывались признаки поражения медиастинальной плевры и
распространения мягкотканного компонента в клетчатку средостения.
Контрастное усиление было выполнено всем пациентам с
периферическим раком. Реакция на введение контрастного препарата со стороны
опухолевого узла была различной. Отмечалось как повышение интенсивности
MP-сигнала от структуры опухоли, так и ее понижение. Выраженное повышение
MP-сигнала было характерно для аденокарцином и единственного наблюдаемого
авторами случая лейомиосаркомы. Понижение сигнала после контрастирования или
слабое его повышение отмечалось в случаях плоскоклеточного рака. Мелкоклеточный
рак и карциноид на введение контрастного препарата отвечали слабым или средним
повышением сигнала. Во всех наблюдениях после контрастирования лучше выявлялась
внутренняя неоднородность опухолевого узла, опухолевая инвазия контактных
структур.
Таким образом, периферический рак легкого на МР-томограммах
имеет характерную картину. Признаками злокачественности опухолевого узла
следует считать совокупность следующих признаков в различных сочетаниях:
неровность контуров, спикулы по периферии контура узла, негомогенность структуры,
полости некроза, "дорожки" к корню легкого и плевре. Важнейшими
признаками злокачественности опухоли являются метастатическое поражение
лимфатических узлов и опухолевая инвазия пограничных структур, которые также
хорошо выявляются при МР-томографии. Поэтому МРТ может является методом выбора
при уточняющей диагностике и определении распространенности процесса у больных
с периферическими образованиями в легком [7].
2.4
Трансторакальное ультразвуковое исследование периферического рака легкого
По данным литературы, автором (Сафонов Д.В., Нижегородская
государственная медицинская академия) была проведена работа, целью которой
явилось изучение диагностических возможностей трансторакального ультразвукового
исследования (ТТУЗИ) и определение ультразвуковой семиотики различных форм
периферического рака легкого. Все исследования были верифицированы результатами
оперативных вмешательств и данными гистологических исследований операционного и
биопсийного материала. ТТУЗИ проводилось в вертикальном положении больного из
межреберной, субкостальной, супрастернальной или надключичной позиции датчика в
зависимости от локализации патологических изменений. Для оценки возможности
эхолокации патологического образования и ускорения поиска зоны соприкосновения
его с грудной стенкой проведению ТТУЗИ предшествовала рентгенография грудной
клетки в двух проекциях.
Образование сканировалось под различными углами наклона
датчика в продольной и поперечной плоскостях. Оценивались его размеры,
эхогенность, эхоструктура, контуры, взаимодействие с окружающими тканями,
дыхательная подвижность. Обязательно обследовалась плевральная полость для
выявления выпота, определения его объема и эхоструктуры. Супра- и
парастернально осматривалось верхнее средостение для исключения метастатического
поражения интрааортопульмональных и паратрахеальных лимфоузлов. При
необходимости обследовались лимфоузлы надключичной и переднешейной области.
При ТТУЗИ эхоскопические признаки злокачественного процесса в
легких были получены у 146 больных, из них у 63 диагностирован периферический
рак легкого, у 61 - обтурационный ателектаз доли или сегмента легкого (среди
них у 11 лоцировалась сама опухоль в корне легкого), у 9 больных выявлены
опухоли неэпителиальной природы. Экссудативный плеврит опухолевой этиологии диагностирован
у 30 пациентов, у 17 из них он наблюдался в сочетании с другими ультразвуковыми
признаками злокачественного процесса, а у 13 оказался единственным
эхоскопическим проявлением рака легкого.
Результаты проведенного автором исследования:
Основным препятствием на пути распространения ультразвука при
ТТ-УЗИ является воздух, при этом экранирующий воздушный барьер может
располагаться в подкожной жировой клетчатке и межмышечном пространстве, в
плевральной полости или в легком. Успешная ультразвуковая визуализация
патологических изменений в легком или вне его возможна только при отсутствии
между объектом исследования и датчиком газообразной среды, независимо от ее
толщины и локализации. Значение имеет только площадь газообразных включений.
Если она превосходит размеры расположенного позади нее патологического объекта,
то его визуализация невозможна. При относительно небольших размерах воздушных
включений, они лоцируются перед исследуемой структурой или внутри нее в виде
единичных или множественных линейных гиперэхогенных включений с последующими
реверберациями "хвоста кометы".
Подкожная и межмышечная эмфизема делают ТТ-УЗИ абсолютно
неинформативным, поскольку экранирование ультразвука происходит на самом
поверхностном уровне, когда невозможно лоцировать не только внутрилегочные
образования, но и патологические изменения в плевральной полости и мягких
тканях грудной стенки. Ультразвуковое изображение представлено вуалеподобной
структурой, возникающей сразу же позади эхогенной линии кожи. Она появляется
из-за многочисленных ревербераций, вызванных отражением и значительным
рассеиванием ультразвука от воздушных включений в подкожной клетчатке и мышцах.
Следующим уровнем возможного экранирования является
плевральная полость. Воздух при пневмотораксе имеет вид гиперэхогенной присте
ночной линии с ровной поверхностью. Она расположена за межреберными мышцами, не
смещается при дыхании и вызывает множественные интенсивные артефакты
"повторного эхо". Последние представляют собой гиперэхогенные полосы,
расположенные параллельно пристеночной гиперэхогенной линии на равном
расстоянии друг от друга, интенсивность которых убывает по мере удаления от
грудной стенки. Пневмоторакс позволяет оценить состояние мягких тканей грудной
стенки, но препятствует визуализации плевральной полости и легкого.
Основной причиной отсутствия визуализации внутрилегочных
образований служит воздух в альвеолах субплеврального слоя нормальной легочной
паренхимы. Для успешной эхолокации объемное образование должно на определенном
протяжении достигать висцеральной плевры. Однако воздушное легкое не
препятствует визуализации мягких тканей грудной стенки, плевры и плевральной
полости. Очаг в толще легкого возможно лоцировать при отсутствии между ним и
грудной стенкой воздушной легочной паренхимы, когда он расположен в зоне
ателектаза или воспалительной инфильтрации, а безвоздушная легочная ткань
служит акустическим окном для ультразвуковых волн.
Эхоскопическая семиотика рака легкого включает прямые и
косвенные признаки. К прямым относится непосредственная визуализация опухоли, к
косвенным - обтурационный ателектаз сегмента или доли легкого, увеличенные
медиастинальные или надключичные лимфоузлы и экссудативный плеврит. При
периферическом раке лоцировалось само злокачественное образование, при
центральном - как правило, долевой ателектаз как следствие эндобронхиальной
обструкции. Увеличенные лимфоузлы или плевральный выпот свидетельствовали о
степени распространенности опухолевого процесса.
Ультразвуковую картину периферического рака легкого
классифицировали на три основные формы: типичную (38-60,3% больных), с распадом
(19-30,2% больных) и кортикоплевральную (6-9,5% больных). Для наиболее частой
типичной формы характерна однородная, преимущественно гипоэхогенная
эхоструктура и четкие, ровные или волнистые, полицикличные контуры. Диаметр
образований колебался от 1,5 до 30 см, чаще не превышая 5-7 см, соответственно
и зона соприкосновения опухоли с грудной стенкой значительно варьировала от
одного межреберья до половины грудной клетки. У 5 больных (13,2%) опухоль имела
очень низкую, практически анэхогенную, мелкозернистую структуру, создающую
впечатление о жидкостном характере образования. Дистальное псевдоусиление
позади таких очагов не могло служить достоверным признаком жидкостной
эхоструктуры, поскольку неоднократно наблюдалось позади гипо - и
среднеэхогенных, заведомо тканевых образований. Солидный характер образования
определялся при строго перпендикулярном сканировании с использованием
высокочастотного датчика 7,5 МГц. Опухоли средней эхогенности встречались реже
и имели более неоднородную эхоструктуру за счет участков, отличающихся по
эхогенности от основного фона. Наряду с ровными или полицикличными границами
при типичном периферическом раке встречались и мелкозазубренные,
"лучистые" контуры, с мелкими шиповидными или продолговатыми
выростами. Нечеткость контуров появлялась только на участках прорастания
опухоли в грудную стенку или в средостение или на уровне ее боковых отделов
из-за их расположения к фронту ультразвуковой волны под слишком острым углом с неэффективным
отражением.
Эхокартина периферического рака с распадом очень разнообразна
и определяется макроскопическим строением опухоли. В зависимости от содержимого
полости распада мы выделили 3 эхоскопических варианта этой формы: с воздушной
полостью (11 больных), с жидкостью в полости (З больных) и абсцессоподобную (5
больных). Для всех опухолей с распадом характерна значительная неоднородность
эхоструктуры за счет наличия на фоне опухолевой ткани анэхогенных включений
жидкости или гиперэхогенных сигналов с реверберациями от воздуха. Наружные
контуры распадающихся опухолей эхоскопически аналогичны контурам при типичной
форме периферического рака. При первом варианте полостного рака расположение,
размеры и число линейных гиперэхогенных эхосигналов на фоне гипо- или
среднеэхогенной опухолевой ткани определялись локализацией, формой и
количеством воздушных, практически "сухиx" полостей распада. При
одной крупной центрально расположенной полости приблизительно округлой формы
лоцировался гиперэхогенный дугообразный или неровный линейный эхосигнал в
центральной части образования. Полость неправильной формы, с глубокими
"карманами" эхоскопически имела вид ветвящейся гиперэхогенной линии
или нескольких отдельных гиперэхогенных отрезков, которые при сканировании соединялись
друг с другом. Несколько мелких полостей вызывали появление обособленных друг
от друга гиперэхогенных отрезков в разных отделах опухоли. Эксцентричное
расположение полости распада приводило к значительной разнице в толщине стенок
опухоли, расположенных вокруг гиперэхогенного сигнала.
Выраженность ревербераций "хвоста кометы"
соответствовала длине линейного гиперэхогенного эхосигнала от воздушной полости
распада и при ее небольшом размере незначительно препятствовала визуализации
глубже лежащей опухолевой ткани. В таких случаях, изменяя наклон датчика,
удавалось лоцировать весь массив злокачествениого образования. При большой
полости с длинным гиперэхогенным эхосигналом возникающие позади него обширные
реверберации полностью экранировали глубже лежащие отделы.
Распадающийся периферический рак с жидкость содержащими
полостями встречался реже, чем с воздушными. Жидкость в полости распада
лоцировалась в виде анэхогенных участков, чаще множественных и расположенных
центрально, неправильной формы и с неровными, местами нечеткими контурами.
Окружающая их опухолевая ткань отличалась повышенной эхогенностью, вероятно,
вследствие некроза. Такая картина характерна для ранней стадии многофокусного
распада.
Абсцессоподобная форма (с воздухом и жидкостью в полости)
периферического рака представляла наибольшие диагностические трудности,
поскольку в структуре опухоли лоцировались и гиперэхогенные включения от
воздуха, и анэхогенная жидкость. Эхоскопическая картина внутрилегочного
образования определялась количественным соотношением этих компонентов. При
большом количестве жидкости преобладало однородное анэхогенное пространство, но
чаще распадающийся крошковидный детрит, фибрин, гнойнонекротические массы
вызывали появление разнокалиберной взвеси на фоне анэхогенной жидкости. При
адекватном дренировании полости распада через бронх в ней преобладал воздух, а
небольшое количество жидкости со взвесью оседало на дне.
В таких случаях полостное образование имело неоднородную
эхоструктуру за счет большого количества отдельных линейных гиперэхогенных
эхосигналов от воздуха в верхних отделах полости и гипоэхогенного жидкостного
содержимого с неоднородной грубозернистой взвесью в нижних отделах. Между ними
могла определяться зона с неоднородной мозаичной структурой за счет гиперэхогенных
пузырьков воздуха, перемешанных с гипоэхогенной, со взвесью жидкостью. Такое
содержимое полостного образования типично для абсцессов легкого и требовало
проведения дифференциальной диагностики, которую еще больше осложняла клиника
абсцедирования при инфицировании полости распада. Основное диагностическое
значение в данной ситуации имеет оценка стенок полостного образования. Для
абсцессов характерна гипоэхогенная равномерной толщины до 10 мм стенка с
нечетким внутренним контуром. При раке легкого с распадом стенка на протяжении
неравномерной толщины, с неровными контурами, выростами, чаще среднеэхогенная,
при динамическом наблюдении не изменяется.
Реже других встречалась кортикоплевральная форма
периферического рака, типичная для опухоли Пенкоста. При ТТУЗИ она лоцировалась
в виде однородного гипоэхогенного образования неправильно овальной или
треугольной формы с характерными значительно неровными, местами нечеткими,
"рваными" контурами. Опухоль располагалась в кортикальном слое
легкого и широко соприкасалась с грудной стенкой на определенном участке
прорастая в нее. Злокачественные опухоли легкого неэпителиальной природы
(ангиолейомиома, лимфосаркома, саркома, метастазы гипернефроидного рака) имели
большие размеры и конгломератное строение, представленное гипо - или
среднеэхогенными очагами неоднородной эхоструктуры с неровными, бугристыми
контурами. Только у саркомы легкого лоцировалась однородная гипоэхогенная
структура. Все образования прорастали в соседние органы. Метастазы рака легкого
в легочную ткань эхоскопически не отличались от типичной формы периферического
рака, только меньшего размера (до 2-3 см диаметром).
ТТУЗИ позволяет достоверно определить прорастание
периферического рака в мягкие ткани грудной стенки, ребра, диафрагму, печень. В
этих случаях опухолевая ткань замещала нормальную эхоструктуру органа,
распространяясь вглубь него на определенное расстояние. Эхоскопически
диагностировать прорастание опухоли в соседние структуры обычно не представляло
сложности. Диагностические затруднения возникали только при оценке вовлечения в
опухолевый процесс костальной плевры. В норме костальная плевра не
визуализировалась отдельно от пристеночной гиперэхогенной линии поверхности
воздушного легкого. Поэтому судить о распространении на нее периферического
рака можно только по отсутствию дыхательной подвижности образования в сочетании
с его выбуханием над поверхностью воздушного легкого, когда опухолевая ткань
вплотную прилежит к межреберным мышцам. При этом следует помнить о том, что
плевральные сращения после перенесенных плевропневмоний или плеврита также
могут ограничивать дыхательную подвижность образования, а выраженные
плевральные шварты имитировать распространение опухоли по плевре.
Заключительным этапом ТТУЗИ при раке легкого является
сканирование верхнего переднего средостения для оценки состояния
паратрахеальных и интрааортопульмональных лимфоузлов. Эхолокация лимфоузлов,
расположенных глубже в средостении и корне легкого невозможна из-за
экранирования легочной тканью. Метастатически увеличенные медиастинальные
лимфоузлы выявлены в 15 наблюдениях, однако их целенаправленный поиск
проводился не у всех больных и стал обязательным этапом ТТУЗИ при
онкообследовании только в последнее время. Они лоцировались в пространстве
между дугой аорты и легочной артерией в виде множественных округлых или
овальных образований средней эхогенности, размерами от 10 мм до конгломератов,
более 4-5 см в диаметре. При обширном метастазировании определялись увеличенные
над - и подключичные и переднешейные лимфоузлы.
ТТУЗИ является информативным радиологически безопасным
дополнительным методом лучевой диагностики злокачественных опухолей легких [8].
.5
Лабораторная диагностика рака легкого
При наличии огромного числа существующих в настоящее время
маркеров злокачественного роста, разрозненных и порой противоречивых сведениях
об их диагностической значимости, выбор наиболее адекватных комплексов
лабораторных тестов для диагностики в клинической онкологии затруднен.
В течение последних лет выявлена и подробно изучается иммунохимическими
методами серия различных веществ - маркеров опухолей. Это соединения,
продуцируемые клетками злокачественных новообразований и нормальными клетками в
ответ на опухолевую инвазию. Опухолевая ткань при малигнизации приобретает
характерный антигенный состав, опухолеассоциированные антигены поступают в
кровь, где и осуществляется их детекция. Существует достаточно широкая панель
опухолеассоциированных антигенов, включая более 20 тестов. При различной
локализации опухолевого процесса наибольшей чувствительностью обладают
отдельные из них. В частности, маркером для рака легкого и нейробластомы -
нейронспецифическая енолаза (НСЕ); Однако ни один из антигенов не обладает
абсолютной чувствительностью и специфичностью для выявления рака различных
локализаций.
В результате системного действия злокачественной опухоли в
организме развиваются многообразные метаболические нарушения, что приводит к
изменениям биохимических, биофизических и структурно-функциональных
характеристик клеточных и гуморальных компонентов крови.
Многочисленные и разносторонние биохимические и биофизические
исследования свидетельствуют, что при злокачественном процессе наблюдается
дезинтеграция в различных звеньях метаболизма организма-опухоленосителя. Одним
из основных проявлений таких гомеостатических сдвигов является нарушение
транспортных функций, как на уровне отдельных клеток, так и на уровне
функциональных систем, в частности, системы крови и ее основного транспортного
компонента - альбумина.
По оценкам многих специалистов методы, определяющие
структурно-функциональное состояние транспортных систем гомеостаза и, в
частности, транспортных белков, перспективны для диагностики ранних стадий
онкологических заболеваний, поскольку такие биологические структуры участвуют
во многих метаболических процессах и позволяют давать интегральную оценку
метаболическим сдвигам, возникающим в организме больных. К таким методам
относится исследование конформационного состояния сывороточного альбумина,
проводимое с помощью ЭПР-анализатора крови, методика которого разработана в ГУ
"НИИ онкологии и медицинской радиологии им.Н. Н. Александрова".
С целью повышения диагностической чувствительности
лабораторных тестов необходим комплексный подход к изучаемым показателям у
онкологических больных.
Изменения в биохимических показателях крови можно
использовать при построении диагностических систем, основанных на
статистических методах классификации и прогнозирования.
В качестве показателей биохимического тестирования крови при
построении решающих правил диагностики рассмотрены следующие: витамин А (А),
витамин Е (Е), диенкетоны (Д), диеновые конъюгаты (ДК), малоновый диальдегид
(МДА), супероксиддисмутаза (СОД), основания Шиффа (ШО), нейронспецифическая
енолаза (НСЕ), карбогидратный антиген 19-9 (СА 19-9), ЭПР-параметр альфа
(Альфа), простатспецифический антиген (ПСА).
На основе использования линейного дискриминантного анализа
создано два диагностически информативных комплекса тестов для диагностики рака
легкого (таблица 2).
В первый комплекс тестов включены: А, Альфа, ДК, МДА, НСЕ.
Второй информативный набор показателей включает: Альфа, Д, Е,
СОД, ШО.
Таблица 2 - Комплексы биохимических тестов и решающие правила
для диагностики рака легкого
|
Комплексы
тестов
|
Решающее
правило
|
|
А + Альфа + ДК
+ МДА+ НСЕ
|
Z1
=.7,5444.2,7778. XА + 1,0957. XАльфа + 1, 1924. XДК + 1,4964. XМДА + 0,0785.
XНСЕ > 0
|
|
Альфа + Д + Е
+ СОД + ШО
|
Z2 = 12,0270 +
2,2524 Х XАльфа - 1,5418 Х XД - 0,2709 Х XЕ - 0,0082 Х XСОД - 0,1833 Х XШО
> 0
|
Для диагностики злокачественных новообразований может
применяться компьютерная экспертная система ("Экспертная система"),
разработанная совместно НИИ онкологии и медрадиологии им. Н.Н. Александрова и
Национальным научно-исследовательским центром прикладных проблем математики и
информатики Белорусского государственного университета.
В экспертной системе реализована возможность диагностики
злокачественных опухолей на основе показателей биохимического тестирования
крови с использованием различных статистических решающих правил. Основные
локализации рака, включенные в экспертную систему: рак легкого, пищевода,
желудка и предстательной железы.
Обучающие выборки, на основании которых строились
статистические решающие правила диагностики каждой локализации рака,
формировались из больных раком этой локализации и доноров.
Биохимические показатели крови, на основе которых строится
экспертная система диагностики, имеют ряд особенностей. Так как у части
обследуемых невозможно получить все биохимические показатели крови, то матрица
исходных данных содержит пропущенные значения. Известно также, что на конечной
стадии развития злокачественных опухолей у определенных биохимических
показателей крови, в частности, показателей иммуноферментного анализа,
наблюдаются аномальные наблюдения ("выбросы"). В связи с этим
экспертная система содержит блок предварительной обработки данных, который
включает проверку на наличие аномальных наблюдений и заполнение пропущенных
значений в матрице данных. Выявление аномальных наблюдений проводится с
использованием критерия Греббса. Заполнение пропущенных значений осуществляется
на основе Е-Малгоритма и безусловными средними значениями.
В клинической онкологии для диагностики злокачественных
опухолей широко используется метод линейного параметрического дискриминантного
анализа, применяемый в случае, когда имеется априорная информация о группах
клинически здоровых лиц и имеющих злокачественные новообразования. Однако, как
правило, для построения решающих правил классификации используются показатели
биохимического тестирования крови, информативность которых определяется по
отдельности. В экспертной системе диагностика злокачественных опухолей осуществляется
на основании наборов (комплексов) наиболее информативных в совокупности
показателей, при использовании которых можно получить наибольшую
диагностическую значимость: чувствительность и специфичность. Наряду с линейным
в экспертной системе применяется квадратичный дискриминантный анализ.
Следует отметить также, что в экспертную систему для
диагностики злокачественных новообразований включен также метод логистической
регрессии. В основе этого метода лежит математическая модель, отличная от
модели квадратичного дискриминантного анализа. Это позволяет с одной стороны
сформировать наборы информативных показателей отличные от наборов, полученных
методами дискриминантного анализа, а с другой стороны сравнить результаты
прогнозирования с применением дискриминантного анализа с результатами
прогнозирования, полученными по методу логистической регрессии.
Для каждой из основных рассматриваемых локализаций в
экспертную систему включены решающие правила, построенные по различным
комплексам информативных показателей. Кроме того, в экспертной системе
реализована возможность построения решающих правил диагностики путем
формирования наборов показателей непосредственно самим пользователем. При этом
для каждого такого набора вычисляются его диагностическая чувствительность и
специфичность.
По результатам применения представленных в системе решающих
правил, основанных на различных статистических подходах, для каждого
обследуемого выдается экспертное заключение о его принадлежности к определенной
клинической группе.
В таблицах приведены информативные наборы показателей для
диагностики рака различных локализаций с использованием статистических методов,
представленных в экспертной системе (таблица 3).
Таблица 3 - Информативные наборы показателей для диагностики
рака легкого
|
Статистический
метод диагностики
|
Информативные
наборы
|
ДЧ
|
ДС
|
|
Линейный ДА
|
А, Альфа, ДК,
МДА, НСЕ
|
90,8
|
100
|
|
Линейный ДА
|
Альфа, Д, Е,
СОД, ШО
|
82,56
|
92
|
|
Квадратичный ДА
|
А, Альфа, ДК,
МДА
|
95,4
|
97,9
|
|
Квадратичный ДА
|
Альфа, ДК, МДА,
НСЕ
|
94,25
|
98
|
|
Логистическая
регрессия
|
Альфа, ДК, МДА,
НСЕ
|
97,7
|
9
|
|
Робастный
квадратичный ДА
|
А, Альфа, НСЕ
|
87,36
|
100
|
Разработанные комплексы лабораторных тестов и решающие
правила предназначены для диагностики рака легкого, пищевода, желудка,
предстательной железы в специализированных онкологических учреждениях на
поликлиническом этапе при первичном обследовании больных и при мониторинге
противоопухолевого лечения.
Наборы информативных показателей позволяют проводить
дифференциальную диагностику в группах больных раком легкого и хроническими
незлокачественными заболеваниями легких с диагностической чувствительностью
82,6.97,7 %.
Целесообразность проведения диагностики рака легкого по
разработанным комплексам информативных тестов и решающим правилам обусловлена
тем, что на доклиническом этапе в условиях поликлиники при первичном осмотре
больных существует возможность формирования групп повышенного риска с помощью
доступных методов лабораторной детекции. В случае получения положительного
ответа у этой части больных проводится углубленное специальное обследование с
использованием дорогостоящего оборудования [9].
Глава 3.
Сравнительная характеристика методов исследования
Перечисленные диагностические изображения объединяет
использование различных видов волновой энергии - рентгеновского излучения
(рентгенодиагностика и КТ), гамма-излучения (радионуклидная визуализация),
ультразвуковых волн (УЗИ), радиоволн в сильном магнитном поле (МРТ). Все они в
противоположность видимому свету проникают сквозь ткани тела. В процессе
взаимодействия с ними волновая энергия подвергается изменениям и в результате
на выходе из тела содержит информацию о состоянии этих тканей, которая
преобразуется в изображение
Рентгеновское изображение представляет собой проекцию
трехмерного пространства тела на плоскость: в одних и тех же местах
рентгенограммы отображаются, накладываясь друг на друга, детали, расположенные
на разной глубине тела. Таким образом, оно является проекционным, или
суммационным. Для объемных представлений об объекте используются изображения в
разных проекциях, например рентгенография органов грудной клетки в прямой и
боковой проекциях.
При послойных методах (томографии) - КТ, МРТ и УЗИ - получают
изображения отдельных слоев трехмерного пространства тела, параллельных той или
иной анатомической плоскости - сагиттальной, фронтальной, аксиальной или
промежуточным между ними (косым). Изображаемый слой только приближается к
плоскости, сохраняя конечную толщину.
Наконец, все большее место занимает построение трехмерных
(3D) изображений на основе послойных.
3.1
Рентгенологическое исследование (РИ)
Основные виды рентгенологического исследования:
рентгеноскопия, или просвечивание (в режиме реального времени), и
рентгенография - получение снимков (регистрация изображения на специальной
фотопленке). Рентгенография - первичный, а в большинстве случаев и
окончательный метод визуализации органов грудной полости и костного скелета
благодаря высокому естественному контрасту по плотности между нормальными и
патологическими тканями.
Важное преимущество рентгенографии:
) высокое пространственное разрешение. По этому параметру с
ней не может сравниться ни один метод визуализации. На рентгенограммах могут
отображаться, особенно при специальных технических условиях, очень мелкие
детали размером до 50-100 мкм (детали легочного рисунка, костной структуры).
) Доступность. РИ - самый доступный метод визуализации и в
наших условиях нередко - единственно доступный. Однако далеко не всегда
имеющиеся технические средства способны обеспечить его проведение на
современном уровне.
) Стоимость РИ относительно невысокая, но растет с повышением
качества изображения и применением более совершенной аппаратуры.
Недостатки рентгенографии.
) Суммационная природа изображения, сильно затрудняющая
выявление патологических изменений.
) Низкий контраст между мягкими тканями (все ткани, кроме
костной, легочной и жировой, а также почти все патологические ткани).
Вследствие этого диагностически важные детали часто
отображаются на пределе различаемости, и при их распознавании большую роль
играет опыт рентгенолога. Целые области тела, в которых и нормальные и
патологические структуры имеют близкую мягкотканную плотность, выглядят на
рентгенограммах монотонно "серыми" с едва намечающимися контрастами
за счет жировой ткани. Монотонность нарушается лишь при наличии газа и
обызвествлений.
) Вредность. Хотя лучевая нагрузка при рентгенографии не
велика, нужно помнить, что, прибегая к широкому рентгеновскому исследованию или
к повторной многократной рентгенографии, можно приблизиться к допустимому
пределу облучения. Поэтому назначение РИ требует осторожности, особенно у
молодых и вообще у лиц детородного возраста. Критерий здесь всегда один: на
сколько оправдано исследование интересами здоровья пациента.
3.2
Ультразвуковое исследование (УЗИ)
В основе УЗИ (синонимы: эхография, улътрасонография)
находится отражение части ультразвуковых волн от поверхностей раздела между
средами с различными физическими (акустическими) свойствами. Ткани тела,
отличаясь по плотности и другим физическим характеристикам, в разной степени
отражают ультразвуковые волны, порождая неодинаковой силы эхо (разная
эхогенность ткани) и тем самым - контраст в УЗ-изображении.
Преимущества УЗИ:
) УЗИ относится к послойным методам, поэтому говорят также об
У3-томографии. Однако область его применения и выбор изображаемой плоскости во
многих случаях ограничены наличием костных и газосодержащих структур на пути
УЗ-пучка, который почти полностью отражается от их поверхности.
) В противоположность рентгенодиагностике У3И обеспечивает
высокий мягкотканный контраст и благодаря этому прекрасно дополняет ее в тех
случаях, когда она малоинформативна.
) УЗИ осуществляется в режиме реального времени и в этом
смысле сравнимо с рентгеноскопией.
) Пространственное разрешение УЗИ возрастает с повышением
частоты используемых УЗ-волн. Однако одновременно уменьшается глубина их
проникновения в ткани. С глубиной снижается как пространственное разрешение,
так и тканевой контраст. Поэтому возможности УЗИ тем хуже, чем глубже
расположен патологический процесс, т.е. чем дальше он от УЗ-датчика, который
передает УЗ-волны в тело и принимает эхо от тканей. Преобладающие датчики с
частотой 3,5 и 5 МГц обеспечивают визуализацию достаточно мелких деталей в
глубоких слоях, но не реализуют возможности УЗИ в диагностике поверхностных
патологических изменений, для которых оптимально УЗИ в режиме повышенной
частоты.
) Отсутствие лучевой нагрузки
) Возможность получать 3-D изображения.
Недостатки У3И:
) ослабление УЗпучка с нарастающей толщиной тканей;
) результаты УЗИ зависят от опыта исследующего врача гораздо
больше при других методах, и могут значительно различаться в разных руках;
) зависимость информативности от класса используемой
аппаратур;
) ограниченное документирование результатов: невыявленные
изменения регистрируются, трудно оценить динамику;
Трехмерное УЗИ только выходит на клиническую арену.
Существенным ограничением является отсутствие режима реального времени, однако
к нему уже удалось приблизиться. Применение ЗDУЗИ представляется весьма
перспективным в связи с возможностью получения многоплоскостного изображения
(режим мультислайсинга), более объективному прослеживанию динамики
патологического процесса благодаря сравнению с сохраненными в памяти
волюметрическими данными предшествующих исследований и более точным измерениям,
особенно образований геометрически неправильной формы.
3.3
Компьютерная томография (КТ)
Преимущества КТ.
) Преодолен один из главных недостатков рентгенографии -
суперпозиция структур, расположенных на разной глубине. Остается только
суперпозиция в пределах выделенного слоя. Задача выделения слоя решается
несравненно более эффективно, чем при обычной томографии: он ближе к истинному
анатомическому слою тканей, и его изображение не перекрывается тенями от
неполного размазывания. Таким образом, КТ является мощным инструментом
пространственного анализа.
) Обеспечивает изображения в аксиальной плоскости,
недоступные в рентгенодиагностике. Отсюда полное название метода: рентгеновская
аксиальная компьютерная томография. Эта плоскость часто оптимальна для представления
топографии органов и пространственных соотношений между ними.
) КТ резко улучшила тканевой контраст по сравнению с
рентгенодиагностикой. Практически это вылилось в дифференцирование жидкостных
образовали от солидных и в более высокий мягкотканный контраст вплоть до
различения серого и белого вещества головного мозга, высокую чувствительность к
обызвествлениям и др. Объединение преимуществ рентгенодиагностики (высокий
естественный контраст при наличии воздуха и извести) и УЗИ (отличный мягкотканный
контраст) делает КТ буквально универсальным методом визуализации.
В диагностике болезней легких и особенно средостения КТ
предоставляет диагностическую информацию, которая не может быть получена
другими методами, дополняет и уточняет УЗИ и рентгенограммы.
КТ в режиме повышенного разрешения используется для
визуализации костей и при некоторых болезнях легких.
Недостатки КТ:
) по пространственному разрешению существенно уступает
рентгенографии;
) артефакты от образований с высокой плотностью (кости, барий,
металлические инородные тела, зубные пломбы) и от газов, от движений
(пульсации, перистальтики) и другие мешают распознаванию патологических
изменений.
) КТ в аксиальной плоскости дает хороший анатомический обзор,
но не обеспечивает оптимального представления многих образований. Частично это
восполняется благодаря реформации - компьютерному преобразованию данных,
порученных в аксиальном плоскости, в изображения в других плоскостях. Однако
качество преобразованных изображений гораздо хуже полученных при прямом
сканировании из-за низкого пространственного разрешения в направлении длинной
оси тела.
) Вредность. Доза ионизирующего излучения при КТ довольно
высокая и прямо зависит от количества выполненных срезов. Уже только поэтому КТ
должна производиться строго по показаниям.
Динамическая КТ с контрастированием, т.е. повторные
сканирования одного и того же слоя с короткими интервалами времени после
болюсного введения КС, позволяет:
) получить изображения сосудистого русла в различные фазы
контрастирования (артериальную, венозную, паренхиматозную);
визуализировать патологические очаги в период максимального
контраста с окружающими тканями;
) изучать быстротекущие процессы и оценивать динамику
накопления и вымывания КС.
Методика не оправдывает себя при поиске очагов, не
визуализируемых при нативной КТ (т.е. без контрастирования), и при
множественных очагах поражения, так как для динамического сканирования каждого
нового слоя требуется повторное введение КС, что резко удорожает исследование,
увеличивает лучевую нагрузку и быстро приближает суммарную дозу КС к
допустимой.
КТ со спиральным сканированием (выполняется на специальных
томографах) позволяет получить изображение большого объема тканей за одну
дыхательную паузу.
Преимущества:
) улучшение временного разрешения и резкое ускорение всей
процедуры КТ (облегчает исследование тяжелых и неконтактных больных и
увеличивает пропускную способность томографов);
) возможность использования непрерывных тонких слоев и
реформации изображений в оптимальной плоскости с высоким пространственным
разрешением и без искажений морфологии, обусловленных нестандартной глубиной
вдоха;
) возможность быстрого сканирования большого объема тканей и
тем самым его изображения в той или иной фазе контрастирования, а также
динамического сканирования такого объема тканей после одного введения КС
(спиральная динамическая КТ с контрастированием - СДКТ), что позволяет получить
важную диагностическую информацию, недостижимую без этой техники, и означает
принципиально иной уровень КТ-визуализации (без оснащения автоматическим
шприцем спиральный компьютерный томограф лишается своих основных преимуществ);
) распространение на все тело трехмерной реконструкции
изображений, расширяющее возможности КТ.
Благодаря этим преимуществам спиральная КТ стала предпочтительной
при заболеваниях грудной и брюшной полости (в частности, обеспечила высокого
качества преобразования в разных плоскостях).
3.4
Магнитнорезонансная томография (МРТ)
МРТ стала внедряться в клинику примерно на десятилетие позже
КТ (в 80-е годы). По значению появление МРТ сравнивают с открытием
рентгеновских лучей. Принцип МРТ: воздействуя радиочастотным импульсом на ткани
тела пациента, помещенного в сильное магнитное поле (в тысячи и десятки тысяч
раз сильнее магнитного поля Земли), получают от ядер подвижных атомов водорода
(протонов), входящих в их состав, радиоволновой (магнитно-резонансный) сигнал,
на основе которого строится изображение с помощью компьютера.
Очень высокая информативность МРТ обусловлена рядом ее
достоинств:
) Особенно высокий тканевый контраст, основанный не на
плотности, а на нескольких параметрах, зависящих от ряда физико-химических
свойств тканей, и визуализация благодаря этому изменений, которые не
дифференцируются при УЗИ и КТ.
) Возможность управлять контрастом, ставя его в зависимость
то от одного, то от другого параметра. Фактически MP-изображение - это не один,
а несколько видов изображений, полученных в разных режимах, с отличающимся
контрастом: если в одном из них ткань выглядит темной, то в другом может дать
яркий сигнал. Варьируя контраст, можно выделить одни ткани и детали и подавить
изображение других. По яркостному выражению контраста MP-изображение
существенно отличается от рентгеновского и КТ-изображения. В отличие от них
обызвествленные образования выглядят не светлыми, а, как и воздух - темными.
Ясно, что к MP-изображениям нельзя подходить с мерками, привычными для оценки
рентгенограмм. Его анализ требует учета многих факторов и специфических знаний.
) Отсутствие артефактов от костей, нередко перекрывающих мягкотканные
контрасты при КТ.
) Мультипланарность - возможность изображений в любой
плоскости без ограничений, присущих УЗИ, не говоря уже о стандартной КТ.
Облегчает анатомическую ориентировку, обеспечивает отображение патологических
изменений в оптимальной плоскости и точное определение границ анатомических и
патологических образований при любой их пространственной ориентации. Наряду с
этим используются МРТ с трехмерным сбором данных и трехмерные реконструкции
MP-изображения со всеми их преимуществами.
) МРТ отображает кровоток без искусственного контрастирования
благодаря чувствительности уже самых простых режимов к движениям.
Диагностические возможности МРТ расширяются благодаря внутривенному
контрастированию с помощью особых КС.
МРТ привела к дальнейшему сужению сферы инвазивных
диагностических исследований, внутривенного контрастирования при КТ и
контрастных РИ. Помимо МРА, созданы методики изображения жидкого содержимого
полостей и протоков без введения КС.
) Вредность. При МРТ нет ионизирующего излучения и
радиационной вредности. Для подавляющего большинства пациентов метод не
представляет опасности.
Недостатки МРТ:
) В отличие от КТ плохо отображаются обызвествления.
) Артефакты, специфические для МРТ, могут сделать изображен
непригодным для интерпретации.
Длительное время изображения вместе с артефактами от
дыхательных и других движений ограничивает применения МРТ в диагностике
заболеваний грудной и брюшной полости.
) Даже на самом современном уровне МРТ уступает КТ но
пространственному разрешению в плоскости отображаемого слоя, причем любое
повышение временного разрешения тесно сопряжено с ухудшением пространственного
разрешения и наоборот.
) Доступность и цена. МРТ - наименее доступный метод
визуализации из-за очень высокой цены аппаратуры. С повышением интенсивности
используемого магнитного поля увеличиваются возможности томографов, но и
одновременно растет закупочная цена, К этому нужно добавить высокие
эксплуатационные расходы на периодическое восполнение жидкого гелия в
томографах с высокой и средней силой поля (для создания сверхпроводимости в
катушках электромагнита). Поэтому МРТ - очень дорогое исследование (за рубежом
примерно в 2 раза дороже КТ).
МРТ противопоказана:
) пациентам с установленным водителем ритма или с
внутриглазничными, внутричерепными и внутрипозвоночными ферромагнитными
инородными телами и с сосудистыми клипсами из ферромагнитных материалов
(абсолютное противопоказание);
) реанимационным больным из-за воздействия магнитных полей
МРтомографов на системы жизнеобеспечения.
) пациентам с клаустрофобией (составляют примерно 1%); хотя
она нередко уступает седативным средствам (реланиум);
) женщинам в первой трети беременности.
В силу отсутствия радиационной вредности МРТ в перспективе
заменит в ряде применений другие методы визуализации, основанные на
использовании ионизирующего излучения, даже если они равноценны по
информативности и более доступны и дешевы [10].
Заключение
Рак легкого на ранних стадиях развития не
имеет патогномоничных клинических признаков и специфичной рентгенологической
картины. Наиболее часто рак легкого приходится дифференцировать с затянувшейся
пневмонией, инфильтративным туберкулезом, туберкулемой, шаровидной пневмонией,
узловым фиброзом.
Ранняя диагностика рака легкого должна
строиться на основе выполнения стандартизованного комплекса диагностических
методов, включающего рентгенологическое исследование (в передней прямой и
боковой проекциях), компьютерную томографию, бронхоскопию, трансторакальную
пункцию.
Методом первого ряда является
рентгенография и линейная томография и, при необходимости, КТ.
КТ также является методом выбора для
определения стадии заболевания. Большая разрешающая способность КТ, возможность
получения поперечного сечения и одномоментная оценка всех анатомических
структур позволяют дифференцировать целый ряд образований, которые нечетко
определяются на обычных рентгенограммах и томограммах. Только с помощью этого
неинвазивного метода можно выявить небольшие метастазы в лимфоузлах
средостения, прорастание опухоли в крупные сосуды, перикард и сердце.
МРТ применяется как уточняющий метод
исследования для оценки стадии опухолевого процесса.
ТТУЗИ может использоваться при определенных обстоятельствах
как дополнительный метод визуализации (для определения распространенности
процесса у больных с периферическими образованиями в легком и как метод
наведения при диагностических пункциях).
Скрининговым методом визуализации легких
является флюорография. Она помогает выявить подозрительные на рак тени в
доклинической стадии.
Для диагностики злокачественных новообразований на ранних
этапах может применяться компьютерная экспертная система ("Экспертная
система"), разработанная совместно НИИ онкологии и медрадиологии им. Н.Н.
Александрова и Национальным научно-исследовательским центром прикладных проблем
математики и информатики Белорусского государственного университета.
Современные компьютерные технологии (компьютерная томография
и ее модификации, магнитно-резонансная томография) позволяют существенно
расширить возможности визуализации патологических изменений в легких.
Список
использованных источников
1.
Власов П.В. Рентгенодиагностика рака легкого / П.В. Власов // Медицинская
визуализация. - 2005. - № 2. - С.49-59.
.
Серова Т.Н., Ваганов Ю.В., Кузнецова Т.А. Комплексная интроскопическая
диагностика при синдроме шаровидной тени в легких. - Мн., 2000. - 13с.
.
Голуб Г.Д., Серова Т.Н. Лучевая диагностика периферического рака легкого / Г.Д.
Голуб, Т.Н. Серова // Новости лучевой диагностики. - 2001. - № 1 - 2. - С.4-10.
.
Эпидемиология злокачественных новообразований в Беларуси / И.В. Залуцкий [и
др.]. - Минск: Зорны верасень, 2006. - 207 с.
.
Чиссов В.И., Дарьялова С.Л. Онкология: учебник. / В.И. Чиссов, С.Л. Дарьялова;
под ред.В.И. Чиссова. - Москва: ГЭОТАРМедиа, 2007. - 560 с.
.
Антоненкова Н.Н. Онкология: учебное пособие / Н.Н. Антоненкова [и др.]; под
общ. ред. И.В. Залуцкого. - Минск: Выш. шк., 2007. - 703 с.
.
Гамова Е.В., Нуднов Н.В. Периферический рак легкого в МР - изображении / Е.В.
Гамова, Н.В. Нуднов // Вестник рентгенологии и радиологии. - 2005. - № 4. -
С.24-28.
.
Сафонов Д.В. Ультразвуковая диагностика рака легких / Д.В. Сафонов //
Медицинская визуализация. - 2002. - № 2. - С.105-112.
.
Шотемор Ш.Ш. Путеводитель по диагностическим изображениям. Справочник
практического врача / Ш.Ш. Шотемор, И.И. Пурижанский, Т.В. Шевякова - Москва:
Советский спорт, 2001. - 400 с.
Приложения
Приложение А
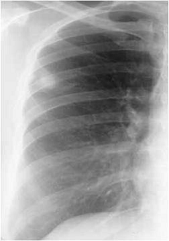
Рисунок 1 - Периферический рак легкого, тень с нечеткими
"лучистыми" контурами (Corona maligna).
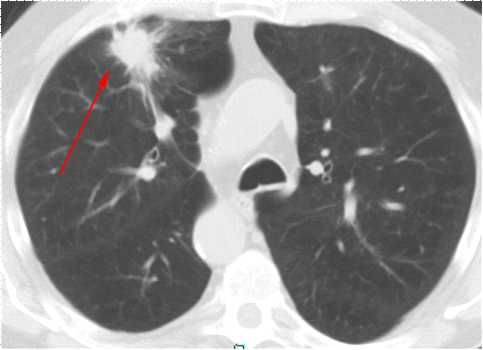
Рисунок 2 - КТ, периферический рак легкого, симптом лучистости
(Corona maligna).
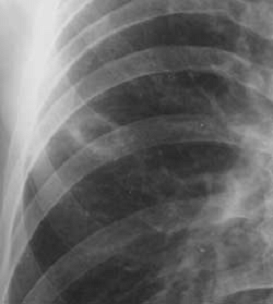
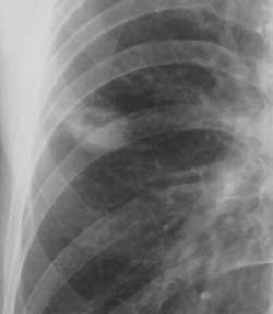
Рисунок 3 - Полостная форма рака. Периодически полость может
заполняться опухолевыми массами, а затем появляться вновь. (Слева) Небольшая
полость на уровне IV ребра. (Справа) Через 9 месяцев заметное увеличение
размеров опухоли. Контуры стенок неровные, полость частично заполнена детритом.
Деформация легочного рисунка вокруг опухоли.
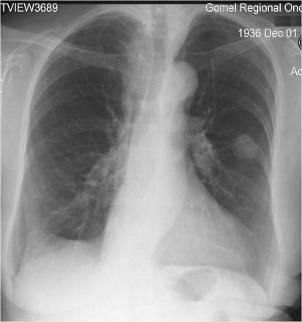
Рисунок 4 - Периферический рак легкого, симптом вырезки (Риглера).
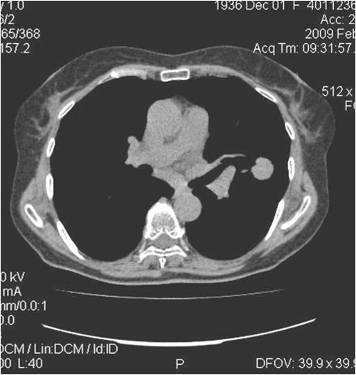
Рисунок 5 - КТ, периферический рак легкого, симптом Риглера.
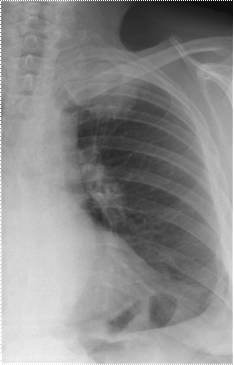
Рисунок 6 - Рак верхушки легкого (опухоль Пэнкоста).
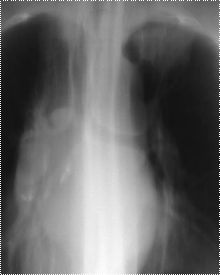
Рисунок 7 - Томография, рак верхушки легкого.
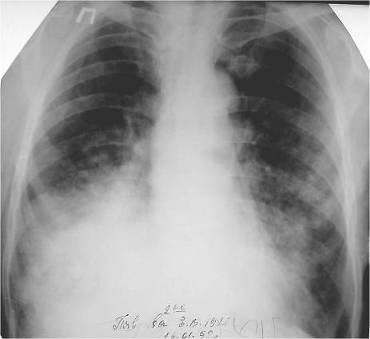
Рисунок 8 - Бронхиолоальвеолярный рак.
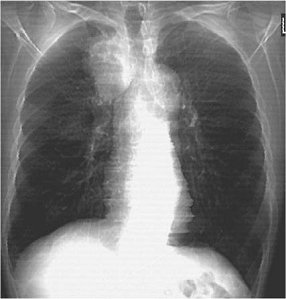
Рисунок 9 - Медиастинальная форма - метастатическое поражение
средостенных лимфатических узлов без установленной локализации первичной
опухоли в лёгком.
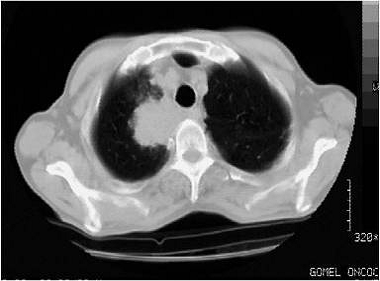
Рисунок 10 - КТ, медиастинальная форма рака легкого.
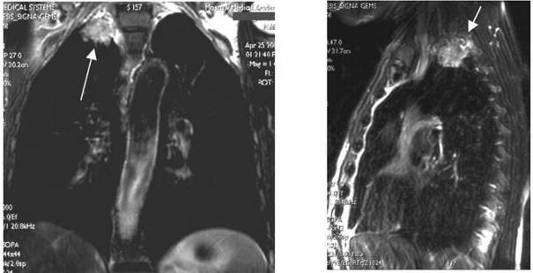
Рисунок 11 - МРТ органов грудной клетки. Опухолевый узел
прорастает тело верхнегрудного позвонка.