Клинико-иммунологические особенности папилломавирусной инфекции гениталий женщин, протекающей на фоне урогенитального микоплазмоза
ФЕДЕРАЛЬНОЕ АГЕНТСТВО ПО ОБРАЗОВАНИЮ ГОУ ВПО «УЛЬЯНОВСКИЙ ГОСУДАРСТВЕННЫЙ
УНИВЕРСИТЕТ »
КЛИНИКО-ИММУНОЛОГИЧЕСКИЕ
ОСОБЕННОСТИ ПАПИЛЛОМАВИРУСНОЙ ИНФЕКЦИИ ГЕНИТАЛИЙ ЖЕНЩИН, ПРОТЕКАЮЩЕЙ НА ФОНЕ
УРОГЕНИТАЛЬНОГО МИКОПЛАЗМОЗА
14.01.10 - кожные и венерические болезни
ДИПЛОМНАЯ РАБОТА
БАРДУШКИН АНДРЕЙ АЛЕКСАНДРОВИЧ
Ульяновск - 2013
ОГЛАВЛЕНИЕ
ПЕРЕЧЕНЬ ПРИНЯТЫХ СОКРАЩЕНИЙ
ВВЕДЕНИЕ
ГЛАВА 1.Обзор литературы
1.1 Значение папилломавирусной инфекции в патологии
урогенитального тракта у женщин
.2 Современное состояние проблемы микоплазменных инфекций
урогенитального трата
ГЛАВА 2. МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
2.1 Характеристика обследованного контингента
.2 Методы исследования
.3 Методы статистического анализа данных
ГЛАВА 3. ОСОБЕННОСТИ КлиническИХ ПРОЯВЛЕНИЙ ПАПИЛЛОМАВИРУСНОЙ
ИНФЕКЦИИ ГЕНИТАЛИЙ ПРИ УРОГЕНИТАЛЬНОМ МИКОПЛАЗМОЗЕ У ЖЕНЩИН
3.1 Клиническая
характеристика больных ПВИ в ассоциации с урогенитальным микоплазмозом
СПИСОК ЛИТЕРАТУРЫ
ПЕРЕЧЕНЬ ПРИНЯТЫХ СОКРАЩЕНИЙ
БВ - бактериальный вагиноз
ВПГ - вирус простого герпеса
ВПЧ - вирус папилломы человека
ЕК - естественные киллеры
ИЛ - интерлейкин
ИППП - инфекции, передающиеся половым путем
ИФА - иммуноферментный анализ
ИФН - интерферон
КОЕ - колониеобразующие единицы
КФ - кислая фосфатаза
ИЛ - интерлейкин
МПО - миелопероксидаза
МФА - метод флуоресцирующих антител
НГ - нейтрофильные гранулоциты
НГУ - негонококковые уретриты
НСТ - тест нитросинего тетразолия
ПВИ - папилломавирусная инфекция
ПЦР - полимеразная цепная реакция
РБТЛ - реакция бластной трансформации лимфоцитов
УМ - урогенитальный микоплазмоз
ФАН - фагоцитарная активность нейтрофилов
ФНО - фактор некроза опухоли
ЦИК - циркулирующие иммунные комплексы
ЦМВ - цитомегаловирус человека
ЩФ - щелочная фосфатаза
CD - кластеры дифференцировки
Ig - иммуноглобулин
LD50 - 50% летальная доза (Dosis letalis 50)
ВВЕДЕНИЕ
Папилломавирусная инфекция (ПВИ) является одной из наиболее часто
встречающихся среди заболеваний передающихся половым путем (Дубенский В.В.,
2000; Кулаков В.И., 2003). Показатели ее распространенности позволяют говорить
о ПВИ как об эпидемическом заболевании, что свидетельствует не только о
медико-биологической актуальности данной проблемы, но и ее социальном значении
(Аполихина И.А. и соавт., 2007; Kirwan J., 2001; Silins I. et al., 2002). В США ПВИ относится к самой
«дорогостоящей» инфекцией после СПИДа, т. к. затраты на проведение диагностики
и лечения всех видов папилломавирусной инфекции составляет 1,6-6 млрд. долл. в
год (Роговская С.И.,
2003).
В настоящее время отмечается общий рост инфицированности ВПЧ. Поскольку
вирус передается половым путем, основной пик инфицирования приходится на женщин
молодого, сексуально активного возраста. По данным различных исследований,
частота инфицирования ВПЧ в возрастной группе 16-29 лет составляет 45-81 %
(С.И. Роговская, 2005).Однако эти цифры отражают лишь частоту клинических
проявлений ВПЧ, а не истинные масштабы инфицированности населения, так как не
регистрируются субклинические и латентные формы инфекции (Moberg et al., 2005; Shijders J., Meijer C., 2006).
В мире ежегодно диагностируется около 500 тыс. новых случаев рака шейки
матки, из них почти половина (234 тыс.) заканчивается летально (ВОЗ, 2006). РШМ
является тяжелым, быстропрогрессирующим и трудноизлечимым заболеванием,
поражающим женщин детородного и трудоспособного возраста. Несмотря на
эффективный арсенал хирургических, лучевых и химиотерапевтических средств для
лечения рака шейки матки, используемых в качестве самостоятельных и комплексных
методов, смертность от злокачественных опухолей половых органов у женщин
остается высокой. Одногодичная летальность с момента установления диагноза при
раке шейки матки составляет 16,3 % (И.В. Залуцкий, 2005).
У больных папилломавирусной инфекцией (ПВИ) выявлены выраженные нарушения
клеточного, гуморального иммунитета и, в особенности, нейтрофильного звена
антиинфекционной защиты как на системном, так и на локальном уровнях.
Установлено существенное повышение продуктов перекисного окисления липидов и
снижение активности каталазы в крови и вагинально-цервикальном смыве.
Применение Полиоксидония в комплексной терапии ПВИ оказывает существенный
корригирующий эффект на нарушенные показатели иммунного и оксидантного статуса.
Иммуномодулирующее влияние Полиоксидония дает положительный клинический эффект,
что подтверждается при кольпоскопическом, гистологическом и цитологическом
иследовании.
Наиболее часто неблагоприятное течение и исход папилломавирусной инфекции
шейки матки отмечается среди женщин с сочетанной вирусно-бактериальной и
вирусно-грибковой инфекцией нижнего отдела генитального тракта [6, 8]. Как
показали многочисленные клинические и бактериологические исследования, среди
женщин с осложнениями ПВИ шейки матки в сочетании с кандидозом, чаще всего
регистрируется затяжное течение заболевания с большим числом рецидивов и
превращением в неоплазию [2, 5]. Инфицирование человека может происходить как
одним, так и несколькими типами ВПЧ. После адсорбции ВПЧ происходит его
проникновение в клетку-мишень, транспортировку вириона к ядру клетки,
транскрипция ранних генов, трансляция ранних белков и репликация (А.А.Воробьев,
2006).
После инфицирования ВПЧ в клетках нарушается нормальный процесс
дифференцировки, что морфологически проявляется деформацией внутренних слоев
эпидермиса и общим утолщением кожи.
В настоящее время существует единое мнение о развитии ПВИ шейки матки и
ее осложнений на фоне сниженного иммунитета [10, 11].
Изученные в настоящее время иммунопатогенетические особенности
персистирующей папилломавирусной инфекции убедительно указывают на нарушения клеточного
иммунного ответа у данной категории больных. Многообразие иммунологических
нарушений, особенности ВПЧ вызывают большие сложности в диагностике, лечении и
профилактике персистирующей папилломавирусной инфекции. Только при условии
изучения иммунопатологических изменений при данном заболевании возможно
разработать эффективные методы лечения, способные повлиять на течение инфекции.
ЦЕЛЬ ИССЛЕДОВАНИЯ. Установить особенности клинического
течения и реакций иммунной системы при папилломавирусной инфекции гениталий у
женщин, протекающей на фоне урогенитального микоплазмоза для оптимизации их
диагностики и лечения.
ЗАДАЧИ ИССЛЕДОВАНИЯ
1. Изучить распространенность бессимптомной и манифестной форм
папилломавирусной инфекции среди пациентов дерматовенерологического профиля.
2. Установить частоту встречаемости инфекций передаваемых половым путём,
сочетанных с ВПИ, вызванной неонкогенными типами вируса папилломы человека. Определить
частоту урогенитального микоплазмоза у женщин с ПВИ.
3. Выявить особенности клинических проявлений, у женщин папилломавирусной инфекции
гениталий, ассоциированной с урогенитальным микоплазмозом.
4. Установить особенности
микроценоза влагалища при наличии у женщин папилломавирусной инфекции гениталий,
протекающего на фоне урогенитального микоплазмоза.
5. Изучить состояние иммунитета и цитокинового профиля у женщин с
микоплазмозом и папилломавирусной инфекцией гениталий в зависимости от
характера их клинических проявлений.
ГЛАВА 1. Обзор литературы
.1 Современное состояние проблемы микоплазменных
инфекций урогенитального тракта
Роль микоплазм в инфекционной патологии человека еще
не оценена в должной мере. Для некоторых патогенных видов микоплазм доказана их
этиологическая роль в развитии острых и хронических заболеваний различной локализации
с широким спектром осложнений. Распространенное носительство микоплазм можно
рассматривать как патогенный потенциал этих микроорганизмов, так как оно
приводит к развитию таких патологических состояний как иммуносупрессия,
аутоиммунные реакции, возникновение хромосомных аберраций, развитие
неопластических процессов, а также способствует развитию смешанных
микоплазмо-вирусных и микоплазмо-бактериальных инфекций. Совокупность
характерных для микоплазм свойств, таких как их убиквитарность, способность
преодолевать тканевые барьеры, отсутствие выраженного тропизма,
многокомпонентность факторов вирулентности, отличающая их от типичных
бактериальных патогенов, свидетельствует об особом характере взаимодействия
микоплазм с организмом хозяина (Макаров О.В. и соавт., 2007).
По мнению ряда авторов (Кисина В.И., 2005; Calleri L. et al., 2000), обнаружение микоплазм в
мочеполовой системе имеет большое значение, так как это может быть связано с
разнообразными патологическими состояниями у взрослых обоего пола, у беременных
и новорожденных. Микоплазмы обусловливают широкий спектр патологий
мочевыводящих путей - пиелонефрита, цистита, гломерулонефрита, различных
синдромов поражения мочеполового тракта, несколько реже их выделяют при
синдроме Рейтера, ревматоидных и ювенильных артритах (Оржесковская Е.А.,
Херрманн Б., Савичева А. М., 2004; Кисина В.И., Забиров К.И., 2005).
Микоплазмы выделяют из урогенитального тракта человека
со значительной частотой. У мужчин данный возбудитель выявляют реже, чем у
женщин, однако у 10,8% бесплодных мужчин он выявлялся без признаков поражения
мочеполового тракта (Adair C.D. et al, 1998). По данным других исследователей у женщин с дизурией
представители рода Mycоplasmataceae являются преобладающим инфекционным агентом
(Макаров О.В. и соавт., 2007).
Частота выделения микоплазм из канала шейки матки женщин репродуктивного
возраста вне беременности не превышает 7-10%, а при вагинитах она увеличивается
до 23,6 %. Широкое распространение генитальных микоплазм среди клинически
здоровых женщин разного возраста позволяет считать их комменсалами,
проявляющими патогенные свойства при изменении физиологического или иммунного
статуса, особенно в сочетании с инфекционными патогенами (Прилепская В. Н.,
Быковская О. В., 2005). Установлено, что микоплазмы могут стать причиной
развития воспалительных процессов органов мочеполовой системы, вызывая у женщин
вульвовагинит, сальпингит, уретрит и цервицит (P.Lidbric, 2004).
М. hominis
и M. genitalium колонизируют влагалище, вызывая
бактериальный вагиноз, реже поражают шейку матки и уретру, способны вызывать
уретриты, цервициты и воспалительные поражения тазовых органов (сальпингиты,
оофориты, эндометриты, аднекситы и др.). Они часто выделяются от клинически
здоровых женщин, существуют определенные пороговые величины (104 КОЕ/мл), при
достижении которых проявляется повреждающее действие возбудителя (Цветковская
Г.А., Войтих Д.В., Пичко Н.П. и соавт., 2006).
Изучение распространенности уреаплазмы по сравнению с
другими не- гонококковыми инфекциями у молодых женщин (до 30 лет) выявило (Kong F., Zhang X., 1997), что
женщины были чаще инфицированы U. urealyticum (44,7%) и реже M. hominis (11%) и С. trachomatis (7,7%). В противоположность указанным исследованиям M.Arsienazy-Elbar (1996) показано, что среди больных U. urealyticum выявляется лишь в 6,5% случаев.
Во время беременности интенсивность инфицирования микоплазмами
увеличивается в 1,5 раза и составляет 50-75% (Дружинина Е.Б., Маранян А., 2006;
Дружинина Е.Б., Протопова Н.В., 2006).
Урогенитальные микоплазмы представляют уникальную группу микроорганизмов,
отличающихся от других бактерий полным отсутствием клеточной стенки и малыми
размерами клеток. Микоплазмы вследствие редукции генома утратили значительную
часть бактериальной хромосомы, но сохранили минимальный набор генов,
необходимых для поддержания жизнеспособности (Кисина В.И., 2005). Установлено,
что кодирующая часть их генома составляет около 90% (Оржесковская Е. А., 2005; P. Dybvig, 2008).Такая рациональная структура генома привела к
полной зависимости микоплазм от внешних источников питательных веществ и
вызвала необходимость адаптации к паразитическому способу существования, в
частности на мембранах клеток (Макаров О.В. и соавт., 2007). Антигенная
структура микоплазм сложна и имеет видовые различия. Для нее характерен
выраженный антигенный полиморфизм с высокой частотой спонтанных и
индуцированных мутаций (Борхсениус С.Н., Чернова О. А., Чернов В. М., Воинский
М. С., 2002.).
Для человека патогенны 5 видов микоплазм - M. genitalium, M. hominis, M. pneumoniae, M. incognitus и M. fermentantas, однако наиболее часто
воспалительные процессы вызывают M. hominis и M. genitalium.
Характер и течение инфекционного процесса, вызванного микоплазмами,
определяется, в первую очередь, факторами патогенности, присущими данному виду
или штамму микоплазм. Многочисленные литературные данные указывают на
разнообразие механизмов патогенности микоплазм, однако данный вопрос нельзя
считать окончательно решенным (Цветковская. Г.А, Войтих Д.В, Печко Н.П. и
соавт., 2006).
Основным и наиболее детально изученным фактором
патогенности микоплазм является комплекс поверхностных белков-адгезинов,
которые обеспечивают связывание микроорганизмов с клеткой (Байцур, М. В.,
Екимов А. Н., 2000). Адгезия микоплазм на поверхности клеток хозяина является
первым и ключевым этапом взаимодействия патогена с макроорганизмом, что
определяет возможность развития инфекции (Кисина В.И., Забиров К.И., 2005;
Макаров О.В. и соавт., 2007). Основным адгезином M.hominis (Mh) является липопротеин Р120, в
адгезии принимают участие Р50, Р60, Р80.
Микоплазмы с неадгезивным фенотипом являются
авирулентными. В слу- чае спонтанной реверсии происходит восстановление синтеза
белков адгезии, образование полноценной терминальной структуры и восстановление
вирулентности (Малышкина А.И., Посисеева Л.В., Сотникова Н.Ю., 2004; Воропаева
Е.А. и соавт., 2005).
К следующей группе факторов патогенности можно отнести
те, которые нарушают целостность клеточных мембран клетки-хозяина, такие,
например, как гемолизины (Малышкина А.И., Перетятко Л.П., 2004). Классические
токсины микоплазмы не продуцируют. Тем не менее, некоторые продукты метаболизма
микоплазм, такие как перекись водорода и супероксидные радикалы, оказывают
токсическое действие. Являясь мощными оксидантами, они повреждают мембраны
клеток эпителия и эритроцитов.
Считается, что прикрепившиеся к мембране микоплазмы
продуцируют перекись и супероксидные анионы или индуцируют продукцию этих
анионов в клетке (Бархатова О. Ч., Хойкова, 2000). Оксиданты подавляют
активность каталазы, что ведет к снижению распада внутриклеточной перекиси
водорода и окислению мембранных липидов (Мелкова И.Б., Цернецова Л.Ф., Кошубa А.Э., 2006). Для запуска указанного
процесса необходимо, чтобы микоплазмы прикреплялись к клетке. По-видимому,
количество супероксидных анионов или других аналогичных по действию компонентов
слишком незначительно, чтобы индуцировать процесс при отсутствии
непосредственного контакта.
Работами ряда исследователей было установлено, что
контакт между микоплазмами и клетками хозяина настолько тесный, что может
происходить слияние контактирующих мембран и обмен отдельными их компонентами (Sugiyama Е. et al., 1993). В результате этого процесса продукты метаболизма
микоплазм, включая гидролитические ферменты, могут попадать непосредственно в
цитоплазму эукариотической клетки. Таким образом, нуклеазы микоплазм в
сочетании с супероксидными радикалами могут вызывать кластогенный эффект.
Защитная система организма часто не воспринимает микоплазмы как чужеродные
объекты, так как тесная связь микоплазм с мембраной клеток может приводить к
маскировке генов, что доказывает значение микоплазм в повреждение клеточных
мембран (МальцеваЛ.И., Зефирова Т. П. и соавт., 2005).
К патогенному потенциалу следует отнести способность
микоплазм изменять метаболизм клеток хозяина, оказывать кластогенный и
онкогенный эффекты, нарушать все уровни защиты макроорганизма, вызывать
аутоиммунные расстройства, а также длительно персистировать в инфицированном
организме (Коршунова О.В., 2000; Балабанов Д.Н., 2009; Раковская И. В., 2005).
Показано, что способность микоплазм оказывать
существенное влияние на синтез РНК и ДНК в клетках ткани хозяина обусловлено
наличием у всех микоплазм ДНК-полимеразы и нуклеаз. В метафазных пластинках
клеток амниона человека было обнаружено три новых варианта хромосом уже через
28 дней после их заражения. Длительное наблюдение за контаминированными
клетками позволило выявить также уменьшение числа хромосом и нарастание
хромосомных аберраций. После элиминации микоплазм частота хромосомных аберраций
уменьшалась, однако редуцированное число хромосом и их новые варианты
сохранялись и после деконтаминации клеток (Нарушева С.М., 1998).
Установлено, что микоплазмы урогенитального тракта
человека участвуют в возникновении некоторых заболеваний, связанных с
нарушением хромосомного аппарата (Ворошилина Е.С., Плотко Е.Э., Хаютин В.Н.,
2006). Так, в лимфоцитах человека при заражении их клиническими штаммами M. hominis, выделенными от женщин, страдающих невынашиванием
беременности, наблюдали появление хромосомных аберраций (Анкирская А.С., 1999;
Рухадзе Т.Н. и соавт., 2000). Известно также, что микоплазмы адсорбируются на
сперматозоидах человека и часто обнаруживаются у женщин при спонтанных абортах,
при этом хромосомные аномалии выявляются у плода в 20% случаев (Воропаева Е.А.
и соавт., 2006).
Обнаружение у микоплазм способности нарушать синтез
ДНК в клетках и индуцировать хромосомные перестройки послужили основанием для
исследова- ния трансформирующих свойств микоплазм (Макаров О.В. и соавт.,
2007). Авторы показали, что M. hominis, M. fermentans, M. orale и M. artritidis вызывали транс-формацию клеток,
сходную с изменениями, индуцируемыми вирусами папилломы и саркомы Рауса.
Выявлена определенная роль микоплазм в патогенезе
злокачественной метаплазии шейки матки (Прилепская В.Н., 2000). Исследования
онкогенного действия микоплазм показали, что их тесный контакт с мембраной
клетки хозяина может запускать целый каскад сигналов, передаваемых от клеточной
мембраны к ядру, изменяющих функцию многих генов, в том числе онкогенов. Кроме
того микоплазмы индуцируют выработку цитокинов, которые влияют на процессы
клеточной пролиферации и дифференциации (Бугрова О.Г., 2000).
Исследования на культуре эмбриональных клеток мышей,
инфицированных M. fermentans и M. penetrans, выявили
онкогенный эффект у этих микоплазм (Calleri L., Taccani C., Porcelli A., 2000).
Малигнизация клеток наблюдалась только после длительного периода латенции.
Через 18 пассажей в клетках с персистирующими микоплазмами происходила
необратимая трансформация. При заражении мышей этими клетками наблюдали
развитие опухолей. В дальнейшем такие индуцированные хромосомные перестройки
накапливались в культуре клеток и в организме животных в отсутствии микоплазм.
Вопрос об онкогенной роли микоплазм, является исключительно важным и
интересным, требующим дальнейших исследований.
Одной из наиболее характерных особенностей микоплазм
является отсутствие у них клеточной стенки, которая, как правило, содержит
основные антигенные детерминанты (Макаров О.В. c соавт., 2007). В отсутствии клеточной стенки микоплазмы
окружены цитоплазматической мембраной, которая имеет структурное и
биохимическое сходство с мембраной клеток эукариот. Это обусловливает их слабую
иммуногенность и способствует их персистенции.
Прочное связывание микоплазм с мембранами
эпителиальных клеток обеспечивает их устойчивость к противоточному воздействию
различных биологических жидкостей (крови, слизи, мочи), к механическому
движению ресничек мерцательного эпителия; кроме того, эти возбудители часто
сосредоточиваются в криптах мембран, что делает их недоступными для действия
антител и комплемента (Серов В.Н., Кудрявцева Л.И., 1999; Малышкина А.И., 2004;
Сотникова Н.Ю. с соавт., 2004).
Несмотря на то, что в инфицированном организме
микоплазмы индуцируют все виды иммунных реакций, они обладают удивительной
способностью ускользать от иммунологического надзора и длительно
персистировать, вызывая прогрессирующие деструктивные и пролиферативные
процессы (Бугрова О.Г., 2000).
Механизмы, обеспечивающие длительное пребывание
микоплазм в организме хозяина, разделяют на две основные группы: первые
направлены на ускользание от защитных систем хозяина, вторые - на активизацию
его иммунной системы (Железнякова Г.Ф., 2006) .
К первой группе можно отнести уже упомянутые выше биологические
свойства микоплазм, связанные с отсутствием сильных иммуногенов, их адсорбцией
на мембранах и в ее инвагинатах, где они недоступны для действия антител. Эта
группа факторов включает также феномен микробной мимикрии, обусловленной
присутствием в мембранах этих прокариот и мембранах эукариотических клеток
общих и перекрестно-реагирующих антигенов. В процессе межмембранного
взаимодействия микоплазм с эукариотической клеткой может происходить
непосредственный обмен некоторыми компонентами, который способствует проявлению
микробной мимикрии.
Наличие общих антигенных детерминант у микоплазм и
клеток хозяина, а также появление комбинированных и новых антигенов в
результате межмембранного обмена являются причиной образования аутореактивных
антител и аутоиммунных расстройств. Персистирующие микоплазмы могут влиять на
дифференцировку и функциональную активность лимфоцитов, в том числе на
субпопуляцию Т-супрессоров, которые в свою очередь определяют толерантность
В-лимфоцитов (Коршунов В.М. с соавт., 1999; Байцур, М.В., Екимов А.Н, 2002;
Макаров О.В. с соавт., 2007).
Большое значение для понимания механизмов развития
аутоиммунитета имеют теории двойного распознавания и идиотипической сети
(Кисина В.И., 2005; Кисина В.И., Забиров К.И., 2005). Будучи мембранными
паразитами, микоплазмы обладают мембранными лигандами, идентичными или
комплементарными рецепторам соответствующих клеток эукариот, что позволяет им
не распознаваться как «чужое». Однако присутствие таких «дополнительных»
детерминант может привести к нарушению иммунологического равновесия, выработке
против них антиидиотипических антител и развитию аутоиммунного процесса.
Ко второй группе механизмов активного воздействия
микоплазм на иммунную систему чувствительного хозяина можно отнести их
ингибирующее действие на функции фагоцитарной системы, стимулирующее или
ингибирующее воздействие на стволовые клетки крови, а также неспецифическую
стимуляцию иммунитета, приводящую к развитию иммунопатологических реакций и
иммуносупрессии, а также цитодеструктивное действие микоплазм на
иммунокомпетентные клетки (Малышкина А.И.с соавт., 2004; Балабанов Д.Н.2009).
Микоплазмы способны избегать действия микробицидных механизмов фагоцитов, в
частности, при отсутствии антител макрофаги не способны фагоцитировать
микоплазмы. В цитоплазме нейтрофилов эти возбудители способны сохранять свою
жизнеспособность (Савицкая К.И., Зур Н.В., Молочков В.А. и др., 2003).
Микоплазмы являются комменсалами урогенитального тракта и способны в
определенных условиях вызывать воспалительные процессы урогенитального тракта в
ассоциации с другими патогенами (Данилов Е.Ю., 2007). Полимикробные ассоциации
с различной степенью значимости микроорганизмов-ассоциантов в современных
условиях приобретают все большее значение в этиологии заболеваниий органов
малого таза. Исследованиями Н.Ю.Ширшовой и Е.В.Шипициной (2004) установлено,
что в структуре инфекционных заболеваний нижнего отдела половых путей смешанные
инфекции составляют 20-30%, в ассоциациях возбудителей чаще других встречаются
микоплазмы. При эндоцервиците в 82,86% случаях в воспалительный процесс
вовлекалась микрофлора влагалища. Полученные И.Н. Горнастаевой и Т.А.Гасановой
(2004) данные также позволяют утверждать, что урогенитальные инфекции при
обострении хронического сальпингита на современном этапе характеризуется
высоким удельным весом микст-инфекций. Они, в свою очередь, могут являться
причиной развития вторичного бесплодия, перинатальной инфекции, невынашивания
плода у женщин (Цветковская Г.А., Войтих Д.В., 2006).
В связи с этим интересным становится рассмотрение роли представителей
рода Mycoplasma в формировании измененных микробных сообществ при бактериальных
вагинитах (Зигангирова Н. А., 2008). У микоплазм обнаружены
аргинин-дегидролазы, которые гидролизируют аргинин с накоплением аммиака,
влияющего на рН влагалищного секрета, что способствует изменению вагинальной
флоры (Мотавкина Н.С., Бушуева Е.Н., 2006).
Таким образом, существуют различные механизмы,
обеспечивающие микоплазмам возможность ускользать от иммунного контроля
макроорганизма, длительно в нем сохраняться, диссеминировать и
репродуцироваться в благоприятных нишах обитания. Особое значение для понимания
механизмов развития патологических состояний, вызванных уреаплазмами, имеет то,
что они являются мембранными паразитами и способны взаимодействовать с геномом
эукариотической клетки, вызывая в ней неопластические процессы. Однако сведения
по данным вопросам крайне малочисленны и противоречивы. Кроме того, при
диагностике полиэтологических форм урогенитальных инфекций следует обращать
внимание на наличие и персистентность сопутствующих микоплазмам условно
патогенных микроорганизмов.
1.2 Значение папилломавирусной инфекции в
патологии урогенитального тракта у женщин
Проблема диагностики и лечения заболеваний, ассоциированных с вирусом
папилломы человека в последнее десятилетие является актуальной в связи с резким
ростом заболеваемости, значительной контагиозностью и высоким онкогенным
потенциалом данного возбудителя в различных возрастных группах (В.И. Киселев,
2004; Львов Н.Д. и соавт., 2007; Dalstein V. et al., 2003).
Установлено, что за последние десятилетие количество инфицированных
вирусом папилломы человека (ВПЧ) увеличилось во всем мире в 10 раз (Новиков
А.И. и соавт., 2005; Ушакова И.Г., 2009). Однако сведения о частоте инфицированности
ВПЧ различных популяционных групп женского населения репродуктивного возраста
противоречивы и по данным различных авторов колеблются от 8% до 49% (Оганезов В.К., Кураскуа И.В., 2002;
Катханова О.А., 2003; Дерябин П.Г. и соавт., 2003; Прилепская В.Н., 2004;
Роговская С.И., 2007; Calinisan J.H. et al., 2004).
Следует отметить, что указанные показатели свидетельствуют лишь о частоте
клинических проявлений ПВИ, а не об истинных масштабах инфицированности
населения вирусом папилломы человека, т.к. не отражают субклинические и
латентные формы инфекции (Кулаков и соав., 2000; Прилепская В.Н. и соавт.,
2000; Роговская С.И., 2003; Кубанов А.А., 2005; Евстигнеева Н.П., 2007).
Большое количество женщин без выраженной клинической картины вагинального
кондиломатоза являются резервуаром ВПЧ, представляя опасность заражения половых
партнеров и плода (Quint W. et al., 2006). Крайне малочисленны данные о региональных
особенностях инфицированности населения ПВИ (Новик В.И., 2002; Шипулина О.Ю. и
соавт., 2002; Кунцевич Л.Д. и соавт., 2005; Beckel N.E. et al., 2003; Romanowski B., 2003).
В последнее десятилетие актуальность проблемы диагностики и лечения ВПИ
чрезвычайно возросла в связи со значительным ростом заболеваемости, выраженной
контагиозностью и высоким онкогенным потенциалом данного возбудителя (Фролова
И.И., 2003; Сафронникова Н.Р., 2003; Киселев В.И., 2004; Подистов Ю.И., 2005;
Лялина и соавт., 2007). ВПЧ является инициирующим фактором в развитии рака
шейки матки, занимающего второе место в структуре онкологической заболеваемости
у женщин (Козаченко В.П., 2000; Munoz N. et al., 2002; Sherman M.E., M.Schiffman, J.T.Cox, 2002; Bekkers R. et al., 2006).
ВПЧ рассматривается в качестве причины дистрофических и злокачественных
заболеваний вульвы и влагалища. Уровень инфицированности ВПЧ так или иначе
отражает частоту ВПЧ-связанных заболеваний. Показано, что частота
заболеваемости раком шейки матки зависит от сексуального поведения, а риск
инфицирования ВПЧ зависит от возраста начала половой жизни, количества половых
партнеров, способа контрацепции, наличия сопутствующих инфекций и заболеваний
урогенитального тракта (В.П. Козаченко, 2000).
Установлено также, что ВПЧ способен поражать клетки трофобласта, что
приводит к спонтанным абортам (Коча М.Н., Гилберт Г.Л., Браун Дж.Б., 1996).
Однако до сих пор отсутствует понимание причин различной скорости
прогрессирования ПВИ, не установлены прогностические признаки персистенции
вируса, факторы развития интраэпителиальной неоплазии, в 15-20% случаев
приводящей к инвазивному раку (Прилепская В.Н., 2001; Козаченко В.П. и соавт.,
2001; Минкина Г.Н. и соавт., 2003; Кисина В.И., 2003; Киселев В.И., Ашрафян
Л.А. и соавт., 2004). Ежегодно в мире регистрируется около 470 тыс. новых
случаев рака шейки матки (Waggoner S., 2003). В
Российской федерации за последние 10 лет заболеваемость раком шейки матки у
женщин до 29 лет
возросла в 2 раза, увеличилась частота быстро прогрессирующих форм, имеющих
латентную фазу менее 12 месяцев (Бебнева Т.Н., Прилепская ВН., 2001).
В связи с этим большую
актуальность приобретают исследования, направленные на обнаружение
патологического процесса на доклинической стадии, когда высока эффективность
терапевтических мероприятий (Шипицына Е.В. и соавт., 2004; Кубанов А.А., 2005;
Куевда Д.А. и соавт., 2005; Катханов А.М., Катханова О.А., 2005; Шипулина О.Ю.
и соавт., 2005). Важное клиническое значение приобрел ранний
молекулярно-генетический скрининг ВПЧ (Lorincz A., 2003; Dubin G., 2005; Khan M. et al., 2005). В настоящее время ПЦР
рекомендован ВОЗ для дополнительного молекулярного детектирования ВПЧ (Копанев
М.А. и соавт., 2003; Полонская Н.Ю. и соавт., 2004; Шипулин Г.А., Шипулина
О.Ю., 2006; Cuzick J. et al., 2006; Dalstein V. et al., 2006; Quint W. et al., 2006).
ВПЧ передается при тесном контакте с инфицированным или пораженным
эпителием. Клетками-мишенями для ВПЧ являются эпителиальные клетки кожи и
слизистых оболочек, на которые они могут оказывать продуктивное или
трансформирующее воздействие. При продуктивном воздействии возникают
доброкачественные новообразования - папилломы и кондиломы кожи и слизистых
оболочек. Результатом трансформирующего воздействия являются дисплазии тяжелой
степени, прогрессирующее развитие которых приводит к раку (Роговская С.И.,
2005).
Хозяином вируса папилломы являются человек и позвоночные животные (C.M.
Fauquet, M.A.Mayo, J.Maniloff, 2005). Согласно классификации вирусов, принятой
на 7 Международном Конгрессе по таксономии с 1 января 2002 года папилломавирус
человека выделен в семейство Papillomaviridae (International Congress of
Taxonomy, 2001). Идентифицировано и введено в таксономию более 140 различных
его типов, 75 из них молекулярно клонированы и полностью секвенированы. Кроме
того, выявлено более 300 новых папилломавирусов, еще не вошедших в таксономию (E.M.de Villiers, C.Fauquet,
T.R.Broker, H.U.Bernard, H.Hausen, 2004).
Семейство Papillomaviridae включает 16 родов, из них вирусы,
входящие в род Alphapapillomavirus (HPV-2, HPV-3,
HPV-6, HPV-7, HPV-10, HPV-13, HPV-16, HPV-18, HPV-26, HPV-28, HPV-32, HPV-33,
HPV-34, HPV-40, HPV-42, HPV-45, HPV-52, HPV-53, HPV-54, HPV-55, HPV-57, HPV-61,
HPV-66, HPV-67, HPV-68, HPV-69, HPV-71, HPV-77, HPV-81, HPV-84, HPV-cand85,
HPV-cand86, HPV-cand89, HPV-cand90, HPV-cand91, HPV-94, PCPV-1, RhPV-1) наиболее часто поражают слизистую аногенитальной области
и лица. Для
инфекции характерно скрытое течение и активация при развитии иммунодефицита.
ВПЧ 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 68 относятся к вирусам
высокого онкогенного риска. HPV-16 и HPV-18 вызывают цервикальные папилломы,
дисплазию, рак, HPV-16 - самый распространенный в России высокоонкогенный тип
(Ю.К. Скрипкин, 1995).
ВПЧ имеет достаточно простую организацию генома, он способен существовать
как в свободной эписомальной, так и в интегрированной форме, когда вирусная ДНК
включается в ядерный материал клетки хозяина. Именно в интегрированной форме
ВПЧ способен к злокачественной трансформации, неинтегрированная инфекция
является продуктивной инфекцией. Продуктивная инфекция приводит к образованию
остроконечных кондилом, которые имеют очень низкую вероятность развития в
злокачественную опухоль, а непродуктивные плоские кондиломы, которые обычно не
видны невооруженным глазом, имеют намного больший онкогенный риск (В.И.Киселев,
О.И.Киселев, 2003; 2007).
Инфицирование человека может происходить как одним, так и несколькими
типами ВПЧ. После адсорбции ВПЧ происходит его проникновение в клетку-мишень,
транспортировку вириона к ядру клетки, транскрипция ранних генов, трансляция
ранних белков и репликация (А.А.Воробьев, 2006).
После инфицирования ВПЧ в клетках нарушается нормальный процесс
дифференцировки, что морфологически проявляется деформацией внутренних слоев
эпидермиса и общим утолщением кожи. Репродукция ВПЧ в эпидермисе завершается в
клетках ороговевающего слоя эпидермиса или слизистых оболочек соответствующей
локализации. На конечной стадии дифференцировки при активной сборке зрелых
вирусных частиц происходит их выделение из клеток на поверхность кожи. Эти
участки кожи инфекционно опасны в отношении контактного заражения (P.K.Chan,
A.R.Chang, J.L.Cheung, 2002; S.Franceschi, X.Castellsague, L.Dal Maso, 2002).
В то же время многие авторы считают, что инфицирование эпителиальных
клеток ВПЧ недостаточно для образования злокачественной опухоли (C.B.Woodman,
S.Collins, H.Winter, A.Bailey, J.Ellis, P.Prior, M.Yates, T.P.Rollason,
L.S.Young, 2005).
Вирусы папилломы человека относятся к антропонозным возбудителям.
Установлена способность вирусов сохраняться определенное время в отшелушенных
клетках кожи, поэтому для некоторых заболеваний, обусловленных ВПЧ, возможен
контактно-бытовой путь передачи инфекции, реализуемый при наличии
микроповреждений эпителия. Известно инфицирование через хирургические
инструменты, во время лазерной деструкции генитальных бородавок, при вдыхании
образующегося дыма, однако основным путем заражения ВПЧ является половой
(Семенов Д.М., 2006).
Инкубационный период при папилломавирусной инфекции длится от 2-х месяцев
до 2-10 лет. При усиленном размножении вируса болезнь переходит в стадию
продуктивной инфекции, при которой развиваются клинические проявления. У 30%
больных в течение 6-12 месяцев происходит самопроизвольная элиминация вируса и
излечение. В других случаях наблюдается длительное рецидивирующее течение с
возможной дальнейшей неоплазией.
Генитальная ВПЧ-инфекция имеет высокую контагиозность, заражение при
однократном половом акте происходит примерно в 60 % случаев. При активной половой
жизни, особенно в возрасте до 30 лет, ВПЧ-инфекция с одинаковой частотой
поражает и мужчин, и женщин, однако наиболее серьезные поражения она вызывает у
женщин (В.И.Кулаков, 2000; A.K.Lie, F.E.Skjeldestad, B.Hagen, 2005). Так, по
данным ВОЗ, в мире ежегодно фиксируется около 600 тыс. случаев рака шейки
матки. Несмотря на проводимую терапию, у 45-55 % больных наблюдается
неблагоприятный исход (J.Dillner, C.J.Meijer, G.von Krogh, S.Horenblas, 2003) .
Спектр клинических проявлений генитальной ВПЧ-инфекции варьирует от
субклинических признаков до рака шейки матки (В.К. Овчаров и соав., 1996; H.
Serra, A.Pista, P.Figueiredo, 2002). В настоящее время описано несколько
вариантов течения болезни:
латентное течение (при персистенции папилломавируса в базальном слое
эпителия), характеризующееся отсутствием клинических проявлений,
кольпоскопической, цитологической и гистологической нормой, наличие
ВПЧ-инфекции определяется ДНК-методами (ПЦР);
продуктивная инфекция проявляется клинически папилломами, бородавками, кондиломами
(вирус копируется в инфицированных клетках), происходит усиленное размножение
клеток базального слоя эпителия, что ведет к прогрессированию инфекции, ВПЧ
выявляется методом ПЦР, при гистологическом исследовании определяются явления
гиперкератоза;
неоплазия развивается при интеграции ДНК вируса в геном клетки, в
структуре эпителиальных клеток происходят изменения (койлоцитоз), наибо-лее
часто поражения локализуются в переходной зоне шейки матки на стыке
многослойного плоского и цилиндрического эпителия; при цитологическом
ис-следовании в цитоплазме появляются вакуоли, ВПЧ-инфекция подтверждается при
гистологическом обследовании и кольпоскопии.
при инвазивной опухоли вирус в клетке существует в интегрированной форме,
при которой выявляются «атипичные» клетки, наиболее часто локализуется в
переходной зоне шейки матки, выявляется при кольпоскопическом и гистологическом
исследовании (S.F.Altekruse, J.V Jr.Lacey, L.A.Brinton, 2003).
Согласно МКБ к инфекциям, передающимся половым путем, относят остроконечные
кондиломы, этиологическим фактором которых являются папилломавирусы 6, 11 типа.
Основной путь передачи половой. Остроконечные кондиломы представляют собой
образования мягковатой консистенции, имеющие дольчатое строение, по форме
напоминающие «цветную капусту».
Обычно расположены на узком основании - «ножке». У мужчин чаще
локализуется на крайней плоти, венечной борозде головки полового члена, место
локализации у женщин - преддверие влагалища, малые и большие половые губы,
область заднего прохода. Злокачественная трансформация развивается у 4 - 10 %
женщин в течение 3-5 лет (А.А.Кубанов, 2005; Г.Бауэр, 2002).
Многочисленные эпидемиологические исследования позволили определить
распространенность ВПЧ-инфекции в различных странах мира (А.И.Новиков,
А.В.Кононов, И.Г.Ваганова, 2002; V.Moreno, F.Bosch, N.Munoz et al., 2002;
L.Brabin, 2002; L.R.Lipsey, D.W.Northfelt, 2003). Распространение ВПЧ высокого
онкогенного риска обнаружено в Китае (Гонконг) - 37, 9% (M.M.Madeleine,
J.R.Daling, S.M.Schwartz, 2002), Японии - 38,8% (A.Hildesheim, Wang S.S.,
2002), США - 39,2% (N.Agrawal, M.Mane, M.Chiriva-Internati, 2002), Белоруссии -
38,7% (Д.М. Семенов, Т.И.Дмитраченко, С.Н.Занько, 2005; Методология скрининга
предопухолевых заболеваний и опухолей шейки матки, тела матки и яичников, 2005)
и России - 14% (И.И.Семена, 2005).
Разнообразные клинические проявления ВПЧ, способность возбудителя
рецидивировать или спонтанно претерпевать обратное развитие, связывают с
различными триггерными факторами, которые могут определять течение и прогноз
заболевания. К этим факторам относят сексуальное поведение, изменения иммунного
статуса, использование оральных контрацептивов, авитаминозы, курение и
урбанизацию (Семенов Д.М., 2006; Boon M.E., van Ravenswaay
Claasen H.H., van Westering R.P., Kok L.P., 2003).
Среди критериев рискованного сексуального поведения выделяют раннее
начало половой жизни (до 17 лет), количества половых партнеров в течение
последнего года (больше 3) и на протяжении сексуальной жизни (N.F.Schlecht,
E.L.Franco, T.E.Rohan, 2002).
Среди женщин, инфицированных ВПЧ, рискованное сексуальное поведение
определялось статистически значимо чаще (р < 0,001), чем среди женщин
контрольной группы, где ВПЧ инфекция не была выявлена. Обнаружено также, что на
риск появления цервикального рака оказывает влияние сексуальное поведение
партнера. Повышенный риск развития рака шейки матки был отмечен у женщин,
половые партнеры которых имели половые связи с женщиной, умершей от рака шейки
матки; партнеры которых имели множество половых связей; партнеры которых имели
генитальные поражения, вызванные ВПЧ, или карциному полового члена
(X.Castellsague, F.X.Bosch, N.Munoz, 2002; Ragin C.C., Taioli E., 2007).
Важным фактором, способствующим развитию ПВИ является нарушение иммунного
ответа. Установлено, что распространенность ВПЧ-инфекции и цервикальных
интраэпителиальных неоплазий на фоне иммуносупрессивной терапии возрастает в
10-14 раз, а у женщин, инфицированных ВИЧ, в 2-4 раза по сравнению с
ВИЧ-отрицательными (Г.Н.Дранник, 2003; Brabin L., 2002). Только изучение
иммунопатологических изменений при данном заболевании позволит разработать
эффективные методы лечения.
С учетом тропности ВПЧ к многослойному плоскому эпителию важное значение
имеет система местной защиты. По данным литературы, при цервикальных интраэпителиальных
неоплазиях и раке шейки матки местные нарушения антигенпрезентирующей
способности эпителия цервикального канала сопровождаются изменениями активности
клеточного звена иммунной системы (А.И.Новиков, А.В.Кононов, И.Г.Ваганова,
2002; Башмакова М.А., Савичева А.М., 2003; Д.М.Семенов, 2004). У пациенток с
персистирующей папилломавирусной инфекцией выявлены нарушения клеточного
иммунного ответа, вызывающие большие сложности в ее диагностике, лечении и
профилактике. Установлено, что цитотоксическое действие Т-лимфоцитов направлено
на разрушение клеток CIN III, презентирующих белки E6 и E7 папилломавируса 16
типа (D.Harper, E.Franco, C.Wheeler
et al., 2006).
Данные о роли гуморальных факторов в защите организма от ВПЧ-инфекции и
развитии неопластических процессов противоречивы. В клинической практике
наиболее часто используется оценка количества общих иммуноглобулинов, однако
наиболее показательным представляется определение антител, специфичных по
отношению к ВПЧ, так как имеются данные о значимом повышении по сравнению с
нормой содержания IgА и IgG к белкам ВПЧ типа 16 у пациенток с CIN. В настоящее
время активно изучается механизму миграции в очаг ВПЧ-инфекции макрофагов и
других эффекторных клеток (A.K.Lie, F.E.Skjeldestad, B.Hagen, 2005).
ВПЧ-инфекция затрагивает многие компоненты иммунитета на системном и
локальном уровне. Так, установлено изменение уровня продукции
противовоспалительного (ИЛ-10) и провоспалительного (ФНО) цитокинов. Показано
снижение (Дранник Г.Н., 2003) уровня ИЛ-12 / ИЛ-10, что свидетель-
ствует об угнетении Th1-звена цитокинов. Однако до настоящего времени не
известно, является ли изменение интенсивности продукции различных цитокинов
причиной или, наоборот, следствием пролиферации и неопластической трансформации
инфицированных папилломавирусом клеток. В связи с этим дальнейшие исследования
роли цитокинов в регуляции иммунного ответа при инфекционных и неопластических
процессах, в которых участвуют ВПЧ, позволят оптимизировать терапевтические
мероприятия при данных патологиях.
Установлено, что ВПЧ-инфекция развивается на фоне изменений в системе
интерферонов, обеспечивающих неспецифическую противовирусную защиту. Продукция
ИФНγ
и ИФНβ
у больных ВПЧ-инфекцией
значительно снижена, а общего сывороточного ИФН - повышена (Семена И.И., 2005).
Имеются данные о значительном снижении способности клеток крови отвечать
продукцией ИФН на воздействие индукторов, что свидетельствует о тяжелом,
хроническом воспалительном процессе. В то же время другие авторы считают, что
уровень ИФНγ в крови пациентов с CIN не меняется (К.Хэтч, Н.Хэкер, 2002).
Обсуждается роль гормонального статуса как возможного триггерного
фактора, влияющего на риск инфицирования и течение ВПЧ-инфекции. В ранних
исследованиях было показано увеличение частоты клинических проявлений
ВПЧ-инфекции и повышенный риск возникновения рака шейки матки у лиц,
использующих контрацептивы. Так, по данным исследований IARC, использование
комбинированных оральных контрацептивов менее 5 лет не ассоциируется с
повышением частоты развития рака шейки матки, относительный риск этого
заболевания при приеме оральных контрацептивов от 5 до 9 лет составляет 2,72 %,
более 10 лет - 4,48 % (V.Moreno, F.Bosch, Munoz N. et al., 2002). Эти данные,
однако, не получили подтверждения в исследованиях L.Brabin (2002) и
A.Hildesheim, Wang S.S. (2002). Работами этих авторов была обнаружена
зависимость между оральными контрацептивами и неинвазивным раком, а также
повышением риска возникновения аденокарциномы, но не плоскоклеточных кондилом.
К триггерным факторам развития ВПЧ относят дефицит в организме витамина
А, β-каротина, витамина С и фолиевой
кислоты. В литературе имеются данные о защитной роли каротиноидов при
канцерогенезе (С.И. Роговская, 2005).
Ускоряет развитие цервикальной дисплазии и является фактором риска
развития рака шейки матки также наличие сопутствующих ИППП. Однако, наряду с
доказанной ролью ВПЧ в генезе цервикального рака значимость других инфекционных
агентов в качестве кофакторов в развитии цервикальной интраэпителиальной
неоплазии остается неясной. Так, показано, что у женщин с герпес-вирусной
инфекцией половых органов наблюдается повышение риска последующего развития
рака шейки матки приблизительно в 2-4 раза. Рядом исследований было показано,
что до 80 % женщин, больных раком шейки матки, имели признаки предшествующей
инфекции ВПГ-2. Показано, что цитомегаловирус человека также способен усиливать
трансформацию клеток, инфицированных ВПЧ in vitro, и может участвовать в
развитии цервикальных неоплазий (А.И.Новиков, А.В.Кононов, И.Г. Ваганова, 2002;
Башмакова М.А., Савичева А.М., 2003).
Было установлено, что цервикальная дисплазия чаще обнаруживается у
инфицированных вирусом иммунодефицита человека. Предполагается, что
ВИЧ-индуцированная иммуносупрессия может ускорять прогрессию предшествующих
поражений в более тяжелые состояния (N.Agrawal, M.Mane, 2002; M. Lipsey L.R., Northfelt D.W., 2003).
Показано, что персистенции ВПЧ способствует ее микстинфицирование с
другими ИППП с преобладанием вирус-вирусных ассоциаций. Однако данные об
ассоциации ВПЧ с другими возбудителями инфекций, передаваемых половым путем
(ИППП) требуют уточнения.
При наличии клеточных атипий, кроме вирусов, у 28% больных часто
встречаются такие возбудители ИППП, как Gardnerella vaginalis, Candida species, Mycoplasma hominis, Ureaplasma urealiticum, Chlamidia trachomatis (Новиков А.И., Кононов А.В.,
Ваганова И.Г., 2002). Наблюдения, проведенные рядом исследователей, показали,
что плоскоклеточные интраэпителиальные поражения шейки матки сопровождаются
существенными качественными и количественными изменениями вагинальной
микрофлоры, проявлявшимися в снижении частоты выделения доминирующих
представителей микробиоценоза влагалища и шейки матки здоровых женщин -
лактобактерий и бифидобактерий на фоне повышение частоты выделения и избыточного
роста представителей условно патогенной микрофлоры (Семенов Д.М., Дмитраченко
Т.И., Занько С.Н., 2005). Дисбактериоз сопровождался высокой частотой
обнаружения клостридий, актиномицетов, гарднерелл, грибов рода Candida (Башмакова М.А., Савичева А.М.,
2003).
По данным И.И.Семены (2005) у 69,5 % женщин со множественными
остроконечными кандиломами были обнаружены ИППП (урогенитальный хламидиоз,
микоплазмоз, уреаплазмоз). Автор считает, что наличие сочетанной инфекции может
свидетельствовать об утяжелении течения ВПЧ-инфекции и ухудшении прогноза
заболевания.
Среди факторов, способствующих развитию ВПЧ-инфекции, ряд авторов
выделяет курение. Обнаружено, что число курящих среди пациенток с раком шейки
матки намного больше, чем среди некурящих (В.А.Молочков, В.И. Киселев,
И.В.Рудых, 2004). Исследованиями М.А.Башмакова и А.М. Савичева (2003)
установлено, что производные никотина и дыма (3-4-бензпирен, антрацен) были
обнаружены в цервикальной слизи курильщиков. Под действием этих веществ в шейке
матки уменьшается число клеток Лангерганса, являющихся важнейшей частью
Т-лимфоцитарного звена клеточно-опосредованного иммунитета, противостоящего
внедрению онкогенных факторов, в частности ВПЧ.
К триггерным факторам ВПЧ-инфекции относят также урбанизацию. По данным ряда
авторов, риск развития CIN и рака шейки матки достоверно выше у женщин,
проживающих в крупных городах, по сравнению с сельскими районами (M.E.Boon,
H.H.van Ravenswaay Claasen, R.P.van Westering, L.P.Kok, 2003).
При попадании в организм вирус папилломы человека инфицирует базальный
слой эпителия. Мишенью для воздействия онкогенных типов ВПЧ является зона
трансформации шейки матки, где и развиваются предраковые изменения. В норме в
области наружного зева шейки матки многослойный плоский эпителий влагалищной
части шейки матки переходит в железистый эпителий цервикального канала. На
данном участке чувствительные к ВПЧ-инфекции клетки базального слоя эпителия
расположены наиболее близко к поверхности и создаются благоприятные условия для
инфицирования ВПЧ.
В зараженной клетке вирус может существовать в различных состояниях:
эписомальная форма (вне хромосом клетки) считается доброкачественной,
интегрированная (встроена в геном клетки) расценивается как злокачественная
форма персистирования вируса [64].
Генитальные типы ВПЧ могут инфицировать любую часть генитального тракта,
включая шейку матки, влагалище, вульву и перианальную область. В случае, когда
поражение обнаружено в одном месте, оно часто присутствует и в других областях
нижнего отдела полового тракта. Поражения могут регрессировать, персистировать
или прогрессировать. Спектр клинических проявлений генитальной ВПЧ-инфекции
варьирует от клинических и субклинических признаков до рака шейки матки. В
большинстве случаев ВПЧ инфекция не манифестирует, оставаясь бессимптомной
[65].
В клинической практике общепринято подразделение ВПЧ-инфекции на
следующие формы течения заболевания:
Клиническая форма - выставляется в случае наличия видимых вооруженным
глазом клинических проявлений или невидимых, но при наличии соответствующей
симптоматики (кондиломатоз, плоские кондиломы, вульгарные бородавки;
симптоматические внутриэпителиальные неоплазии (ВН) на ранних стадиях,
койлоцитоз, дискератоз при отсутствии дисплазии (плоские кондиломы)).
Субклиническая форма - выставляется в случае отсутствия видимых
вооруженным глазом клинических проявлений и бессимптомного течения; выявляется
только при кольпоскопии или цитологическом или гистологическом обследовании
(асимптоматические ВН на ранних стадиях, койлоцитоз, дискератоз при отсутствии
дисплазии (плоские кондиломы)).
Латентная форма - выставляется при отсутствии морфологических или
гистологических отклонений и обнаружении ДНК ВПЧ методом молекулярной
гибридизации.
Течение ВПЧ-инфекции достаточно вариабельно: она способна спонтанно
регрессировать, персистировать и рецидивировать (прогрессировать с развитием
CIN), соответственно характеризуется различной визуальной и кольпоскопической
картиной, а также различными морфологическими признаками [66].
Структура ВПЧ-ассоциированной патологии, согласно литературным данным, в
16,9 % случаев представлена плоскими и остроконечными кондиломами, в 28,2 % -
различными изменениями метапластического или плоского эпителия шейки матки при
наличии единичных клеток с койлоцитозом, в 16,9 % - цервикальными
интраэпителиальными неоплазиям в сочетании с плоской кондиломой, в 27,4 % -
цервикальными интраэпителиальными неоплазиями разной степени тяжести без
койлоцитов, в 10,4 % наблюдений - раком шейки матки [65].
В качестве проявления клинической формы папилломавирусной инфекции
выступают генитальные бородавки (остроконечные, плоские и эндофитные
кондиломы). Генитальные бородавки обычно ассоциируются с вирусом папилломы
человека низкого онкогенного риска, наиболее часто (80 %) - с ВПЧ-6 [67]. Это
визуальная форма ВПЧ-инфекции, которая имеет ряд специфических симптомов и
видна невооруженным глазом.
Экзофитные кондиломы приподняты над поверхностью кожи или слизистой
оболочки. При кольпоскопическом исследовании характеристика экзофитных кондилом
различна. По внешнему виду можно условно выделить три основные формы:
остроконечную, папиллярную, папуловидную [4]. Типичные остроконечные кондиломы
представляют собой папиллярные выросты эпителия с васкуляризованной
соединительно-тканной стромой, возможно наличие ножки или широкого основания в
виде единичного узелка или множественных эпителиальных выростов, напоминающих
цветную капусту. Папиллярные кондиломы напоминают бородавку-опухоль.
Кольпоскопическая картина характеризуется наличием отдельных сосочков,
образующих розетки, на фоне почти гладкой окружающей поверхности кондиломы. В
каждом сосочке пролиферирующего плоского эпителия определяется расширенная
сосудистая петля почковидной формы. Эти почковидные разнокалиберные сосуды
равномерно располагаются по поверхности кондиломы и образуют повторяющийся
рисунок. Поверхность кондиломы обычно покрыта белым налетом, вследствие чего
сосудистая сеть выражена не очень четко; при пальпации - плотноэластической
консистенции. Кондиломы в виде пятен (macules) представляют собой четко
ограниченные от окружающего нормального эпителия ацетобелые участки, содержащие
хорошо определяемые петли капилляров. Поверхность их обычно гладкая,
немикропапиллярная или с небольшими шиповидными выпячиваниями.
Экзофитная кондилома при гистологическом исследовании представляет собой
опухолевидное образование древовидной формы, поверхность которого покрыта
многослойным плоским эпителием с выраженным папилломатозом, акантозом и
паракератозом.
Субклиническая форма ВПЧ-инфекции проявляется в виде различных морфологических
изменений плоского эпителия без наружных разрастаний и может быть обнаружена
при кольпоскопическом и микроскопическом исследовании ткани [68].
При гистологическом исследовании плоская кондилома представляет собой
участок влагалищной части шейки матки, покрытый многослойным плоским или
метапластическим эпителием, спаракератозом, дискератозом и погружением
некоторых участков в подэпителиальную соединительную ткань (акантоз). В свою
очередь соединительно-тканные сосочки с центрально расположенными капиллярами
пронизывают толщу эпителия, периодически доходя почти до поверхности
эпителиального пласта (именно эти взаимные прорастания и представляют
кольпоскопическую картину «мозаика и пунктуация»). При этом в промежуточном
слое эпителия встречаются скопления одноядерных и двуядерных клеток с
койлоцитозом.
К латентной форме ВПЧ-инфекции относят бессимптомное, т.е. без каких-либо
клинических проявлений ВПЧ-носительство, выявляемое с помощью
молекулярно-биологических методов.
В настоящее время не вызывает сомнений наличие прямой связи между
выявлением высоко онкогенных типов ВПЧ в тканях шейки матки и более высокой
степенью тяжести CIN. Таким образом, выявление ДНК ВПЧ при CIN и раке шейки
матки, обнаружение койлоцитов, специфичных для цитопатического действия ВПЧ,
позволяет отнести это патологическое состояние к ВПЧ-ассоциированным
заболеваниям.
Метод ы диагностики ВПЧ-инфекции
В лабораторной диагностике ВПЧ-инфекции применяют почти исключительно
ДНК-методы.
Существуют три основные категории лабораторных методов определения ДНК
ВПЧ:
• неамплификационные (дотблот, саузерн-блот гибридизация, гибридизация in
situ на фильтре и в ткани);
• амплификационные (полимеразная цепная реакция - ПЦР, лигазная цепная
реакция - ЛЦР);
• сигнальные амплификационные (система гибридной ловушки Digene Hybrid Capture System II) [69].
Среди амплификационных методов наибольшее распространение получила
полимеразная цепная реакция. Метод имеет большую диагностическую значимость и
позволяет идентифицировать отдельные типы ВПЧ.
В диагностике ВПЧ-ассоциированных заболеваний применяют различные методы,
как-то:
• клинико-визуальный;
• кольпоскопический;
• цитологический;
• гистологический;
• иммуноцитохимические для обнаружения капсидного антигена ВПЧ;
• электронно-микроскопические для нахождения зрелых вирионов в клетках;
• компьютерная резонансная томография;
• ультразвуковое исследование (УЗИ); и др. [74].
Клинико-визуальный метод является наиболее простым в диагностике
ВПЧ-инфекции гениталий. С помощью рутинного осмотра вульвы, промежности,
прианальной области, шейки матки и влагалища с использованием теста с раствором
Люголя и 3-5 % уксусной кислотой выявляется большинство клинических и
субклинических форм инфекции. Однако визуальный метод не позволяет судить о
характере и прогнозе течения патологического процесса [75].
Кольпоскопия представляет собой высокоинформативный и недорогой метод
диагностики заболеваний шейки матки. Наиболее распространенной является
расширенная кольпоскопия, которая включает осмотр и ревизию состояния слизистой
оболочки шейки матки, влагалища и вульвы при увеличении микроскопа в 7-30 раз и
применении некоторых эпителиальных тестов, при которых оценивается реакция
тканей в ответ на их обработку различными медикаментозными средствами. Для
более детального осмотра сосудистой сети применяются различные фильтры [76].
Диагностика типичных экзофитных кондилом не представляет особых
трудностей. Кольпоскопически они имеют характерный вид с пальцеобразными
выпячиваниями и наличием петли сосуда в каждом из них. Большие трудности
вызывает диагностика субклинических форм папилломавирусной инфекции и выявление
кольпоскопических признаков, характеризующих вирусные поражения слизистой
оболочки шейки матки, влагалища и вульвы. Это сложно еще и потому, что участки
ВПЧ-инфекции могут сочетаться с другими доброкачественными и злокачественными
образованиями эпителия. В связи с большим разнообразием проявлений
субклинической инфекции специфического комплекса кольпоскопических признаков
нет. Точно диагностировать внутриэпителиальные кондиломы с помощью только
кольпоскопического метода возможно только при выраженном ороговении или при
сочетании плоских форм кондилом с экзофитными.
С помощью только кольпоскопии весьма трудно отличить зоны
доброкачественной ВПЧ-инфекции и CIN.
Достоинством кольпоскопии, несмотря на ее неспецифичность, является
возможность выявления различных типов эпителия, оценки размеров и качества
патологических образований, состояния сосудистого рисунка, качества шеечных
желез и возможность прицельно произвести биопсию ткани с наиболее атипически
измененных участков [77].
Общепринятым и широко распространенным на сегодняшний день методом
выявления цервикальной онкологической патологии является цитологический анализ
мазка. Однако длительный опыт его использования в России, Беларуси и ряде
других стран мира показал, что данный метод не лишен ряда существенных
недостатков. К ним могут быть отнесены сложность исполнения, необъективность
трактовки результатов, сложность стандартизации и высокие требования к
квалификации врача-цитолога. Результатом этого становится низкая
воспроизводимость (конкорданс результатов от 11 до 80 %) и низкая
чувствительность метода (40-60 %), что не может соответствовать требованиям,
предъявляемым к скрининговым тестам [78].
Гистологический метод диагностики ВПЧ-инфекции мог бы служить золотым
стандартом диагностики вируса папилломы человека, однако высокая стоимость,
невозможность частого проведения, не всегда точный прицельный забор материала
ограничивают его использование. При этом четкие признаки ВПЧ-инфицирования не
всегда понятны даже при гистологическом исследовании, особенно при
дифференцировке картины CIN и ВПЧ-инфекции, которые часто сопровождаются
воспалительным процессом [79,80].
Серологические тесты (определение антител в крови) пока не имеют
клинического значения, поскольку антитела к ВПЧ появляются только у 7-70 %
инфицированных.
Методы иммуноферментного анализа, направленные на определение онкобелка
Е7 в цервикальном материале как маркера, свидетельствующего о начавшимся
процессе малигнизации эпителиальных клеток, содержащих интегрированную копию
генома ВПЧ, в настоящее время слишком трудоемки для клинических лабораторий
[81].
ГЛАВА 2. МАТЕРИАЛЫ И МЕТОДЫ
.1 Характеристика больных
Работа выполнена на базе МУЗ «Областной клинический кожно-венерологический
диспансер №1» г.Ульяновска, на кафедре инфекционных и кожно-венерических
болезней ФГБОУ ВПО «Ульяновский государственный университет» в период 2008-2012
г.г.
При организации исследования были учтены международные требования,
предъявляемые к работам подобного рода: репрезентативность по возрастным и
половым характеристикам и достаточный объем выборок.
Программа исследования состояла из нескольких этапов:
отбор пациентов и включение их в исследование;
оценка исходных клинико-лабораторных данных;
выявление особенностей течения папилломавирусной инфекции в сочетании с
микоплазмозом;
характеристика иммунологического статуса пациентов;
изучение микробного пейзажа репродуктивной системы и биологических
свойств микоплазм, выделенных у больных папилломавирусной инфекции;
статистическая обработка полученных данных.
В исследование были включены 347 женщин с папилломовирусной инфекцией,
вызванной ВПЧ низкого онкогенного риска, которые находились на лечении в МУЗ
«Областной клинический кожно-венерологический диспансер №1» г.Ульяновска.
Критериями включения больных в исследование являлись: женский пол,
наличие генитальной папилломовирусной инфекции, вызванной ВПЧ низкого
онкогенного риска, возрастные группы, информированное согласие пациента.
Среди обследованных ВПЧ 6 типа выявлен у 218 женщин (62,8%), 11 типа - у
121 (34,9% ) и 42 типа - у 8 пациенток (2,3%).
В исследование не включали пациенток с ВПЧ высокого онкогенного риска, с
сочетанием ВПЧ высокого онкогенного и низкого онкогенного риска, с цервикальной
интраэпителиальной неоплазией (CIN) Ш степени многослойного плоского эпителия
по данным цитологического исследования, а также женщин с положительными
результатами исследований на сифилис, ВИЧ и гепатиты.
ПВИ наблюдалась в виде моноинфекции у 108 пациенток (31,1%), у остальных
больных (239 женщин) она был ассоциирована с другими урогенитальными
инфекциями: микоплазмозом - у 42,3%, хламидиозом - у 22,6%, уреаплазмозом - у
9,6%, герпесвирусной инфекцией - у 12,1% и кандидозом - 10,5% пациенток. Реже папилломавирусная
инфекция сочеталась с гонореей (1,7%) и трихомониазом (1,2%) (табл.1).
Таблица 1
Сопутствующие урогенитальные инфекции у больных ПВИ (n=239)
|
№ п/п
|
Сопутствующие инфекции
|
Количество больных
|
|
|
абс.
|
%
|
|
Микоплазмоз
|
101
|
42,3
|
|
Хламидиоз
|
54
|
22,6
|
|
Уреаплазмоз
|
23
|
9,6
|
|
Герпесвирусная инфекция
|
29
|
12,1
|
|
Кандидоз
|
25
|
10,5
|
|
Трихомониаз
|
4
|
1,7
|
|
Гонорея
|
3
|
1,2
|
|
Всего:
|
239
|
100
|
Частое сочетание ПВИ с другими возбудителями урогенитальной патологии
бактериальной и вирусной природы и их ассоциаций выявлены у 63,6% обследованных
(133 женщины): с одной инфекцией - у 49,8%, двумя - 31,4%, тремя и более - у
18,8%.
Пациентки с сочетанием двух (кроме ПВИ+УМ) трех и более возбудителей ИППП
были исключены из дизайна исследования.
В связи с тем, что наиболее часто у обследованных женщин
папилломавирусная инфекция сочеталась с урогенитальным микоплазмозом, для
дальнейшего исследования всех пациенток разделили на 3 группы: в первую группу
входили больные ПВИ в сочетании с урогенитальным микоплазмозом (n=101), во вторую группу были включены
пациентки с изолированным течением ПВИ (n=108). Группу сравнения составили 52
практически здоровых женщин, репрезентативных по возрасту (третья группа).
2.2 Методы исследований
Всем больным проводилось комплексное обследование, включавшее клиническое
обследование больных; выявление урогенитальных инфекций; иммунологические тесты
и изучение микроценоза половых органов. Лабораторное обследование включало
общеклинические, серологические, бактериологические и вирусологические исследования.
Общий анализ крови и мочи проводили по общепринятой методике с определением
общепринятых показателей.
Для диагностике ВПИ применяли следующие методы:
· клинико-визуальный (наличие кондилом);
· кольпоскопию, при необходимости дополненную эпителиальными
тестами;
· морфологические: цитологические исследования соскоба
патологически измененного участка слизистой и гистологического исследования
биопсийной ткани с использованием классификации Бетесда (The Bethesda system -
TBS, 2001) и общепринятой классификации цитологических картин (Папаниколау,
1947);
· молекулярно-биологические (PCR real-time), позволяющие
типировать ДНК ВПЧ и прогнозировать течение заболевания.
2.2.1 Методы клинического
обследования
Клиническое обследование пациенток включало оценку анамнестических данных
и объективного статуса, общеклинические лабораторные и инструментальные методы
исследования, а также цитологическое и гистологическое исследования.
При сборе анамнеза большое значение придавали возрасту начала половой
жизни, количеству половых партнеров, семейному положению, наличию
воспалительных заболеваний урогенитального тракта.
Лабораторное обследование включало общеклинические, серологические,
бактериологические и вирусологические исследования. Общий анализ крови и мочи
проводили по общепринятой методике с определением общепринятых показателей.
Форму ПВИ (клиническая, субклиническая и латентная) определяли в
соответствии с классификацией ВПЧ-ассоциированных поражений нижнего отдела
гениталий (С.И. Роговская, 2005).
Для объективной оценки состояния слизистой оболочки влагалища, шейки
матки и выявления субклинической формы ПВИ проводили кольпоскопию, которая
позволяла оценить состояние эпителия шейки матки и влагалища, выявить очаг
поражения, провести дифференциацию доброкачественных папиллом, осуществить
прицельное взятие мазков и биопсии.
В процессе расширенного кольпоскопического исследования с помощью
микроскопа проводили осмотр и ревизию состояния слизистой оболочки влагалища и
шейки матки использовали эпителиальный тест - симптом жемчужины, позволяющих
оценивать реакцию тканей в ответ на их 3-5% раствором уксусной кислоты. При
положительном результате этой пробы кондиломы быстро становятся белыми, сосуды
сокращаются равномерно, что свидетельствует о доброкачественности процесса. Поверхность
доброкачественной папилломы микропапиллярная, а не гладкая как у
злокачественной опухоли.
Кольпоскопию (расширенная кольпоскопия в условиях 15- и 30-кратного
увеличения, кольпоскопия с цветными фильтрами) осуществляли при помощи
кольпоскопа фирмы Olympus Optical CO.LTD, модель OCS-3 (Япония). Оценку
результатов проводили на основании международной терминологии кольпоскопических
терминов, принятой на 7 Всемирном конгрессе патологии шейки матки и
кольпоскопии (Рим, 1990, пересмотр Барселона, 2003).
При кольпоскопии оценивали состояние эпителия, стыка различных его типов,
состояние желез, рельефа поверхности, подлежащей соединительной ткани, общей
архитектуры. Нормальная кольпоскопическая картина характеризовалась
многослойным плоским и цилиндрическим эпителием, зоной трасформации. К
аномальной картине относили ацетобелый эпителий, мозаику, пунктуацию, наличие
атипических сосудов. При выявлении очагов атипичного эпителия оценивали его
локализацию, площадь и края поражения, степень выраженности аномальных
признаков, сосудистый рисунок, интенсивность и равномерность окраски эпителия
после обработки растворами уксусной кислоты и Люголя. Участки с выявленными
атипичными отклонениями подлежали прицельной биопсии.
Цитологическое исследование мазков проводили по Папаниколау (PAP - smear
test) Цитологическое исследование мазков по Папаниколау позволило определять
следующие результаты:
• 1-й класс - атипические клетки отсутствуют, нормальная
цитологическая картина;
• 2-й класс - изменение клеточных элементов обусловлено
воспалительным процессом на слизистой;
• 3-й класс - имеются единичные клетки с изменениями соотношения
ядра и цитоплазмы, диагноз недостаточно ясен, требуется повторная цитология или
необходимо гистологическое исследование биоптированной ткани для изучения
состояния шейки матки;
• 4-й класс - обнаруживаются отдельные клетки с признаками
злокачественности, а именно с увеличенными ядрами и базофильной цитоплазмой,
неравномерным распределением хроматина;
• 5-й класс - в мазке имеются многочисленные атипические клетки.
Мазки для цитологического исследования брали с поверхности экзоцервикса и
влагалища шпателем, а из эндоцервикса - щеткой-эндобрашем под контролем
кольпоскопа. Материал наносили на специально обработанное, обезжиренное стекло,
которое помещали для фиксации мазка в смесь Никифорова на 20 минут с
последующей его окраской по Романовскому-Гимзе и гематоксилин-эозином. Оценку
результата цитологического исследования проводили на основании классификации
Папаниколау (модифицированной) и Терминологической системы Бетесда ТВС (the
Terminology Bethesda system), предложенной в 1988 году и пересмотренной в 1992
и 2001 годах.
При исследовании выявляли наличие койлоцитов, образующихся в тканях в
результате цитопатического эффекта ВПЧ и представляющих собой клетки плоского
эпителия промежуточного типа с увеличенными в разной степени ядрами, неровной
складчатой мембраной и гиперхроматозом. Цитоплазма в этих клетках сохранялась
только в периферических отделах, с характерной обширной околоядерной зоной
просветления за счет дегенеративных изменений и некроза разрушенных
цитоплазматических органелл. Цитологически эти клетки окрашивались оксифильно.
Вокруг ядра имелась зона просветления, в цитоплазме - множество вакуолей,
содержащих вирусные частицы. По периферии койлоцитов в ряде случаев
обнаруживались цитоплазматические фибриллы.
Гистологические методы диагностики ПВИ позволяют оценить морфологическую
степень изменения тканей при наличии ПВИ, выполнялись под контролем
кольпоскопа. Забор материала проводили путем биопсии. Показанием для проведения
биопсии шейки матки являлись кольпоскопические изменения. Забор образца ткани
производили из наиболее измененного участка при помощи специальных биопсийных
щипцов - конхотомов и сравнивали с образцом неизмененной ткани. Полученный
материал сразу фиксировали и проводили традиционное гистологическое
исследование с последующей окраской гематоксилин-эозином в
патологоанатомической лаборатории МУЗ «Областная клиническая больница» г.
Ульяновска. Процедура выполнялась в амбулаторных условиях под внутривенным
обезболиванием препаратом «диприван».
При учете результата гистологических исследований учитывали следующие
категории ЦИН:
• ЦИН I (лёгкая дисплазия) определяется тогда, когда эпителий
шейки матки поражён вглубь на одну треть его толщины,
• ЦИН II (умеренная дисплазия) - эпителий шейки матки поражён на
глубину не более двух третей.
• ЦИН III (выраженная дисплазия или рак in situ) - эпителий шейки
матки поражён на глубину более двух третей.
Молекулярно-биологические методы выявления ПВИ
Определение ДНК ВПЧ в вагинальном и цервикальном секрете проводили
методом ПЦР в реальном времени с тест-системой «АмплиСенс ВПЧ ВКР генотип FRT» ЦНИИ эпидемиологии (Москва),
позволившей выделить типы вируса (Роговская С. И., 2003 - афтореф докт.), а
также произвести количественный подсчёт вирусной нагрузки (количество ДНК в
препарате). В основе данной методики лежит амплификация хемилюминисцентного
сигнала от молекулы зонда при его связывании с геномом вируса.
Материалом для исследования служил соскоб из цервикального канала,
уретры, поверхности кожи и слизистой, а также с поверхности экзофитной
кондиломы. Все пациентки были обследованы методом ПЦР real time с определением 6 низкоонкогенных типов ВПЧ (6, 11,
42, 43, 44) и количественным подсчётом вирусной нагрузки (количество ДНК в
препарате).
Следует отметить, что ДНК ВПЧ удалось обнаружить не у всех женщин,
несмотря на очевидные клинико-морфологические признаки инфекции. Поэтому в
исследование были взяты пациентки только с положительными результатами
выявления ДНК низко онкогенных ВПЧ при помощи ПЦР.
Лабораторные методы выявления урогенитальных инфекций
С целью лабораторной диагностики урогенитальных инфекций использовали
комплекс методов, направленных на детекцию самого микроорганизма (прямые методы)
или определение специфической реакции пациента, служащей маркером
бессимптомного носительства или инфекции - непрямые методы (Макаров О.В. и
соавт., 2007).
Выявление урогенитального микоплазмоза
Для выявления микоплазм использовали прямой вариант МФА с
контрастированием фона, культуральный метод и ПЦР.
При выполнении МФА приготовленные из исследуемого материала мазки
фиксировали в ацетоне 10 мин. и окрашивали 15-20 мин. при 37о С люминесцирующим
иммуноглобулином к микоплазмам во влажной камере. Затем стекло промывали дважды
по 10 мин. в фосфатно-буферном растворе (рН 7,2-7,4), ополаскивали
дистиллированной водой, высушивали и изучали в люминесцентном микроскопе.
Микоплазмы выявлялись в виде ярко-зеленого свечения на красноватом фоне
препарата (Медицинская микробиология, 2002. Под ред. А.М.Королюка,
В.Б.Сбойчакова).
При выделении микоплазм бактериологическим методом производили посев
исследуемого материала в универсальную жидкую транспортную среду (НИИ
эпидемиологии и микробиологии им. Пастера, г. С.-Петербург) с последующим
пересевом в среду «Микоплазма-50» (НИИ эпидемиологии и микробиологии им.
Пастера г., С.-Петербург) и среды, содержащие лошадиную сыворотку, дрожжевой
экстракт и пенициллин из расчета 1000 ед./мл (BioMeriox, Франция). Положительным результатом
после инкубирования в течение 14 суток считалось наличие микоплазм в количестве
более 104 КОЕ/мл (Дмитриев Г.А., 2007). Идентификацию чистых культур микоплазм
осуществляли по культурально-ферментативным и антигенным признакам.
Для обнаружения микоплазм помимо культурального метода
использовали полимеразную цепную реакцию. Для этого применяли готовые наборы
Полимик-МК (НПФ «Литех», г. Москва).
Выявление урогенитального уреаплазмоза
С целью диагностики урогенитального уреаплазмоза (А63.8) использовали вариант
МФА с контрастированием фона. Приготовленные из исследуемого материала мазки
после фиксации окрашивали люминесцирующим иммуноглобулином против Ureaplasma
urealyticum и изучали в люминесцентном микроскопе. Возбудители выявлялись в
виде ярко-зеленого гранулярного свечения на мембранах эпителиальных клеток и в
межклеточном пространстве на красноватом фоне препарата (Кисина В.И., 2005;
Кисина В.И., Забиров К.И., 2005).
Для индикации уреаплазм применяли также традиционный культуральный метод
диагностики - культивирование уреаплазм на специальных питательных средах,
содержащих сыворотку и дрожжевой экстракт (рН среды менее 7,0) при 370 С с
последующей их идентификацией.
Наиболее эффективным методом диагностики уреаплазмоза является ПЦР
(Макаров О.В. и соавт., 2007). Основными мишенями для амплификации при
выявлении уреаплазм являлись гены уреазы. При положительной ПЦР фрагменты
анализируемой ДНК проявляются в виде светящихся оранжево-красных полос.
Использовали комплект «АмплиСенс» вариант FER для ПЦР-амплификации ДНК.
Выявление урогенитального хламидиоза
Материалом для обнаружения урогенитального хламидиоза (А56.0) служили
соскобы эпителия слизистой уретры, цервикального канала, из которых готовили
мазки (Коршунов В.М. и соавт., 1999). Часть мазков окрашивали по
Романовскому-Гимзе для выявления внутриклеточных включений, остальные
использовали для прямого варианта МФА, при котором антитела, меченые
флюорохромом образуют соединения со специфическим антигеном, наблюдаемые в
люминесцентном микроскопе (Савченко Т.Н., Гиммельфарб Е.И., Дугиева М.З.,
2004). В тест-системе прямого МФА использовали овечью хламидийную
антисыворотку, меченую флюоресцином изотиоцинатом, и для контрастирования фона
- бычий альбумин, меченый родамином (НИИЭМ им. Н.Ф. Гамалеи АН РФ) (Приказ М3
РФ №936. 1995 г.).
С целью выявления в сыворотке крови больных специфических антител
использовали ИФА, который проводили с использованием тест-системы ЗАО
«Вектор-Бест» (Беднова В.Н. и соавт., 1998).
Идентификация урогенитального герпеса
Идентификацию урогенитального герпеса (А76.0) проводили по характерным
поражениям слизистой оболочки и кожи, подтвержденным выявлением антигенов и
антител (Сметник В.П., Тумилович Л.Г., 2005). Материалом для исследований
служили отделяемое уретры, влагалища, шейки матки (Сидорова И.С., 2003).
Выявление антигенов ВПГ-2 проводили с помощью иммуноферментной моноклональной
тест-системы «ВПГ-2-тест» - «сэндвич» - вариантом ИФА. Для этого исследуемые и
контрольные образцы вносили в лунки планшета для ИФА, которые предварительно
иммобилизировали моноклональными к ВПГ-2 антителами. Далее в лунки вносили
конъюгат моноклональных антител с пероксидазой хрена. На заключительном этапе
вносили субстратный раствор. Окрашивание раствора в лунках свидетельствовало о
наличии антигенов ВПГ-2 в исследуемом материале. В стадии ремиссии у больных
проводили выявление антител к ВПГ-2 с помощью тест-системы «Герпес-скрин» с
использованием перекиси водорода, приобретающего окраску от светло-желтого до
оранжево-коричневой. Интенсивность окраски пропорциональна количеству антител к
ВПГ в образце.
Наиболее точным и современным методом диагностики герпетической инфекции
является полимеразная цепная реакция (Краснопольский В.И. и соавт., 1999). Для
определения ДНК ВПГ методом ПЦР из образцов крови пациентов ДНК исследовали в
ПЦР с наружными праймерами, затем продукт амплификации изучали в повторной ПЦР
с внутренними праймерами. Продукты реакции визуализировали электрофорезом в 6%
полиакриламидном геле и окрашивали бромистым этидием.
Диагностика урогенитального кандидоза
Урогенитальный кандидоз (В37.4) диагностировали путем выделения культуры
возбудителя из исследуемого материала (мазок из влагалища) на среде Сабуро с
последующей идентификацией, микроскопии данного патологического материала и
выявления специфических антител в сыворотке крови больных с помощью
твердофазного варианта ИФА с использованием иммуноферментного анализатора
(NIHON Konden). Учёт
результатов ИФА проводили путём определения оптической плотности проб,
соответствующих разведений сыворотки пациента в лунках титровального
полистерольного планшета ТУ 62-2 375-86. Длина волны зондирующего излучения
490-492 нм.
Диагностика трихомониаза
Диагностику трихомониаза проводили путём микроскопии нативных и
окрашенных метиленовым синим или по Романовскому-Гимзе препаратов (О.К.
Поздеев, 1999; B.A. Paterson et al., 1998). Специфические антитела в сыворотке крови больных
определяли ИФА, для чего использовали набор реактивов для ИФА-диагностики
трихомоноза ЗАО “Вектор-Бест”.
Диагностика гонореи
Диагностику гонореи проводили бактериоскопическим (окраска метиленовым
синим, по Граму), бактериологическим методами (П.О. Дэвис и др., 1999).
Материалом для исследований служили отделяемое уретры, влагалища, шейки матки,
осадок мочи, сперма, сок предстательной железы. При необходимости для выявления
специфических антител в сыворотке крови больного ставили реакцию связывания
комплемента (РСК) - реакцию Борде-Жангу (Приказ М3 РФ №936. 1995 г.).
Молекулярно-генетическое выявление маркеров патогенности микоплазм
У выделенных микоплазм выявляли нуклеотидные последовательности генов,
детерминирующих экспрессию факторов патогенности методом полимеразной цепной
реакции (МУ 1.3.2569-09). Для этого проводили выделение бактериальной ДНК.
Выделение бактериальной ДНК
Бактериальную ДНК выделяли из культур, выросших на питательных средах,
методом аффинной сорбции, основанной на предварительном лизировании
исследуемого образца с последующим сорбированием ДНК на нуклеосорбенте, в
качестве которого использовали двуокись кремния. Отбор проб микоплазм проводили
в одноразовые полипропиленовые пробирки «Эппендорф» объемом 1,6 мл.
Материал из колоний микоплазм помещали 500 мкл стерильного 0,9% NaCl, осаждали при 12000 об./мин на
центрифуге «Эппендорф» (Cyclotemp-202, Россия). Осадок ресуспендировали и разводили в буфере, содержащем
2,5mM MgCl2 0,01% желатин, до конечной концентрации 104 КОЕ/мл.
Культуры лизировали при помощи коммерческого набора «ДНК-Экспресс» (НПФ
«Литех», Москва) для термического клеточного лизиса. Хранение образцов перед использованием
осуществляли при 4оС.
Выделение ДНК микоплазм проводили с использованием оптимизированных
коммерческих наборов: «Проба ГС» и «Проба НК» (ООО «ДНК-Технология», Москва),
«Пробоподготовка универсальная для выделения ДНК» (ООО «ИзоГен», Москва), «ДНК-Экспресс»,
«Выделение ДНК из биопроб» (НПФ «Литех», Москва) и «ДНК-сорб-А-М - вариант 100»
(«ИнтеЛабСервис», Москва).
Таблица 2
Использованные в работе праймеры
|
Ген
|
Фактор патогенности
|
Пары праймеров (прямой и
обратный)
|
Размер ампликона н.п.
|
|
Праймер M. hominis
|
|
4
|
P-120-адгезия
|
5’ TGCGGTTCTTCCTTTGATTGCTAGTT 3’ 5’ GGGTTTTGCTGFFGGATGCTACCAG 3’
|
527
|
Подбор праймеров и температуры отжига осуществляли при использовании
пакета программ в Gene Runner Version 3.05 и Primer Blast (ресурсы GeneBank) (США). Праймеры микоплазм были
синтезированы в «ЗАО Симтол» (Москва) (табл.2).
Амплификация ДНК
Синтез ДНК осуществляли на программируемом
амплификаторе «Терцик» (ДНК Технология, Москва). Для проведения амплификации
была использована коммерческая стандартная лиофилизованная реакционная смесь с
оптимизированной для классической схемы ПЦР буферной системой (ООО «ИзоГен»,
Москва), «Набор реагентов для проведения ПЦР-РВ с Taq-ДНК-полимеразой и
ингибирующими активность фермента антителами в присутствии красителя SYBR Green
I» (Компания «Синтол», Москва).
Проведение амплификации состояло из трех этапов: денатурации ДНК при 94ºС, отжига праймеров на
денатурированной ДНК и элонгации - синтеза новой цепи с помощью фермента Taq-ДНК-полимеразы, наибольшая
активность которого проявляется при 72ºС.
Для получения достаточного количества копий искомого фрагмента ДНК
применяли классический тип протокола ПЦР (табл. 3).
Таблица 3
Использованные режимы амплификации
|
Гены
|
Температурный режим, Сº
|
Время
|
Количество циклов
|
|
Предварительный нагрев
|
94
|
2 мин
|
1
|
|
P-120
|
72
|
20 сек
|
1
|
|
Окончательный результат
|
72
|
1 мин
|
1
|
1- пауза (предварительный нагрев амплификатора для «горячего старта»
(общая денатурация ДНК))
инфекция папилломавирусный хламидиоз патология
Детекция результатов ПЦР
Для проведения электрофоретической детекции продуктов амплификации ПЦР
были использованы готовые 2,3% агарозные гели с навеской буферной смеси
(Трис-боратной).
Регистрацию
результатов ПЦР осуществляли путем электрофоретического разделения продуктов
амплификации на окрашенном бромистом этидием агарозном геле. Определение длины
амплификонов производили учитывая зависимость между длиной фрагмента и
величиной, обратной его подвижности. Основное соотношение между длиной
фрагмента (L) и величиной, обратной его подвижности (m)
выражается как m x L = c или
(mj-mo) = c, что можно представить следующим образом: 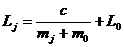
где
Lj - размер неизвестного фрагмента, Lo -
размер стандартного фрагиента, mj - подвижность неизвестного фрагмента, mo -
подвижность известного фрагмента, С - константа. Lна этапе
детекции продукты амплификации ПЦР (20мкл) анализировали электрофоретически,
для чего были использованы готовые агарозные гели, содержащие 2,3 % агарозы и
бромистого этидия.
Анализ
электрофореграмм проводили с помощью видеосистемы Gel Imager
и программного обеспечения Gel Analyzer. Эта система позволяла
документировать и обрабатывать видеоизображение фореграмм в УФ-излучении 254
нм.
Иммунологические методы
Содержание лейкоцитов и лимфоцитов в периферической крови
Количество лейкоцитов и лимфоцитов в периферической крови определяли с
помощью автоматического гематологического анализатора (Cell-Dyn 3700), который
оценивает размеры, структурные, цитохимические и другие характеристики клеток.
В анализаторах серии Cell-Dyn для дифференцировки лейкоцитов применяется
технология MAPSS - Multi Angle Polarized Scatter Separation
(мультипараметрическая система лазерного светорассеивания) регистрация
интенсивности рассеивания клетками поляризованного лазерного луча под разными
углами (Луговская С.А. и соавт., 2006). Принцип этого метода заключается в
компьютерном анализе дисперсии лазерного счета клетками крови. Рассеивание
клеткой поляризованного лазерного луча под разными углами дает сведения о таких
ее свойствах, как: размер клеток, структура и степень сложности клеток,
ядерно-цитоплазматическое соотношение, оценка формы клеточного ядра.
Анализ клеток происходит в проточной кювете при пересечении луча лазера
длиной 633 нм. После контакта лазерного луча с окрашенной клеткой происходит
рассеивание последнего под большим и малым углами и возбуждение флюоресцентного
красителя. Данные сигналы улавливаются фотоумножителями. На основании
полученных сигналов все клетки распределяются по соответствующим кластерам в
соответствии с их размером, структурой и количеством ДНК. Таким образом,
происходит дифференцировка лейкоцитов на популяции.
Определение субпопуляций лимфоцитов и их функциональной активности
У больных исследовали мембранные маркеры субпопуляций лимфоцитов (CD3+,
CD4+, CD8+, CD16+, CD19+ лимфоциты) с помощью
моноклональных антилимфоцитарных антител к дифференцировочным антигенам
поверхности клеток в реакции непрямой иммунофлуоресценции (Козинец Г.И. и
соавт., 2002). С этой целью использовали диагностикумы ООО «Сорбент» для проточного
цитометра (фитц-меченные моноклональные а/т).
Реакция торможения миграции лейкоцитов (РТМЛ)
Изучение функциональной активности иммуноцитов проводили в реакции
торможения миграции лейкоцитов in vitro по А.Г. Артемовой (1973), т.к.
происходит выделение белкового биологически активного продукта - МИФ (миграцию
ингибирующим фактором). По степени торможения миграции лейкоцитов судили о
лимфокинпродуцирующей способности лимфоцитов.
Учет миграции лейкоцитов проводили с помощью шкалы окуляра-микрометра,
считая от их исходного положения до границы миграции основной массы клеток.
Величину индекса миграции (ИМ) определяли по формуле:
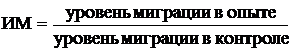 ,
,
где
процент миграции составил ИМ∙100%
Среднюю величину определяли при постановке опыта в 5 капиллярах системы
Перфильева-Габбе. Степень угнетения Т-системы при усилении миграции лейкоцитов
определяли исходя из величины процента миграции лейкоцитов здоровых людей.
Реакция бластной трансформации лимфоцитов (РБТЛ)
Функциональную активность всего пула Т-лимфоцитов оценивали по
способности лимфоцитов переходить в лимфобласты под влиянием неспецифической
стимуляции митогеном (Чернушенко Е.Ф., Когосова Л.С., 1978). Степень
функциональной активности лимфоцитов, их готовность к стимуляции определяли по
проценту лимфоцитов, претерпевших бласттрансформацию при трехдневном
культивировании в присутствии митогена. Для этого готовили мазки (окраска по
Романовскому-Гимзе) и производили подсчет отдельно количество малых лимфоцитов
(диаметр клеток 7-7,5 мкм), бластоподобных переходных форм (диаметр клеток 8-14
мкм) и бластов (диаметр клеток более 14 мкм).
Определение количества Т-лимфоцитов методом спонтанного
розеткообразования с эритроцитами барана (Еа-РОК) (Jondal M., 1997)
Определение проводили, смешивая 1% смесь отмытых эритроцитов барана, 0,6%
раствор глютарового альдегида, краску Романовского, 0,01 М раствор теофиллина,
среду 199 Хенкса, 1% раствор бычьего альбумина, раствор фиколла-400, раствор
уротраста, 3% раствор уксусной кислоты и 0,2% раствор трипанового синего.
Далее готовили стандартную взвесь лимфоцитов 2·109 клеток в 1 мл, в
центрифужную пробирку вносили 0,1 мл взвеси лимфоцитов и 0,1 мл 1% взвеси
эритроцитов барана, полученную смесь перемешивали. Смесь инкубировали 10 мин.
при температуре 370 С, затем центрифугировали 5 мин. при 1000 об./мин. После
этого клетки помещали на 2 часа в холодильник при температуре 40 С. Затем
клетки аккуратно ресуспендировали и в камере Горяева определяли процент РОК.
Сывороточные иммуноглобулины
Количественное определение иммуноглобулинов различных классов в сыворотке
крови проводили методом радиальной иммунодиффузии в геле агарозы (Галицкий
Я.Д., 1987).
Вероналовый буфер (1,84 г веронала и 0,34 г едкого натра и 200 мл
дистиллированной воды) смешивали с гелем агарозы (агароза 3,6 г), после чего
кипятили в течение 10-15 мин. на водяной бане до полного расплавления агара и
получения прозрачного геля. Расплавленный агар разливали по 21 мл в подогретые
стеклянные цилиндры, которые закрывали пробками и помещали на водяную баню с
температурой 56-580 С. Ампулу моноспецифичной сыворотки с рабочим титром
1:20-1:30 разводили в 1 мл вероналового буфера, выливали в соответствующий
цилиндр, перемешивали и 10-15 мин. выдерживали в водяной бане.
Стеклянные пластины размером 9x12 см протирали эфиром, помещали на строго
горизонтальную поверхность и подогревали. На середину пластины из цилиндра
выливали расплавленный агар, содержащий моноспецифическую сыворотку. С помощью
круглого штампа по трафарету в геле вырезали лунки.
Исследуемую сыворотку вносили в лунки до исчезновения вогнутого мениска.
Каждую сыворотку вносят в лунки агаровых пластин, содержащих моноспецифическую
сыворотку. В 4 лунки агаровой пластины вносили цельную и разведенную в 2, 4, 8
раз стандартную (эталонную) сыворотку с известным содержанием иммуноглобулинов
всех классов.
После внесения исследуемых сывороток пластины помещали во влажную камеру
и инкубировали в течение 24 часов (для определения Ig A и Ig G) или 48 часов
(для определения Ig M). После инкубации пластины извлекали из влажной камеры и
окрашивали красителем бромфеноловым синим.
Для оценки результатов реакции измеряли диаметр образовавшихся вокруг
лунок колец преципитации. Затем на полулогарифмической бумаге наносили на оси
абсцисс диаметры колец стандартной сыворотки, а по оси ординат - известную
концентрацию каждого класса иммуноглобулинов в (г/л) и строили калибровочный
график, с помощью которого вычисляли содержание иммуноглобулинов в каждой
исследуемой сыворотке.
Циркулирующие иммунные комплексы (ЦИК)
Определение производили с помощью метода, основанного на способности
полиэтиленгликоля (ПЭГ) с молекулярной массой 6000 в низких концентрациях
(3,5%) растворять свободные иммуноглобулины и преципитировать иммунные
комплексы (Гриневич Ю.А., Алферов А.Н., 1981). Исследуемую сыворотку
инкубировали в течение 18 часов с 7% раствором ПЭГ, затем центрифугировали при
20000g на рефрижераторной центрифуге УРВ-1. Осадок растворяли в 5 мл 0,1%
раствора NaOH. Оптическую плотность определяли на
СФ-26 при длине волны 280 нм в кюветах 10 мм против 0,1 Н NaOH, оптическая плотность принималась за
100% шкалы пропускания. Позитивным считали тест, если оптическая плотность
исследуемого образца составляла 0,12 и более. Для определения концентрации
белка строили калибровочную кривую, где на оси ординат отмечали оптическую
плотность раствора, а на оси абсцисс - содержание белка в мг. В качестве
стандарта использовали бычий сывороточный альбумин. Концентрацию иммунных
комплексов рассчитывали на 1 мл цельной сыворотки.
Метод определения фагоцитарной реакции лейкоцитов крови
Оценку функциональной активности полиморфноядерных лейкоцитов
периферической крови проводили в тесте с микробной тест-культурой (Маянский
А.Н., Маянский Д.Н., 1989). Фагоцитарная активность лейкоцитов определялась при
помощи процентного отношения активных, участвовавших в фагоцитозе лейкоцитов, к
общему числу подсчитанных нейтрофильных лейкоцитов.
Фагоцитарный индекс определялся средним числом фагоцитированных микробов,
приходящихся на один активный лейкоцит. Фагоцитарный индекс характеризует
интенсивность фагоцитоза. Для определения фагоцитарного индекса использовали те
же мазки, по которым определялась фагоцитарная активность лейкоцитов. В
препаратах, приготовленных описанным выше способом, подсчитывали не менее 100
лейкоцитов и количество поглощенных ими микробных тел. Вычислялся фагоцитарный
индекс путем деления числа фагоцитированных бактерий на число активных
лейкоцитов.
Фагоцитарное число является дополнительным показателем, характеризующим
как агрессивность лейкоцитов, так и их активность. Вычислялось фагоцитарное
число путем деления числа фагоцитированных бактерий на общее число подсчитанных
лейкоцитов.
Для определения индекса завершенности фагоцитоза в мерную центрифужную
пробирку с 5 мг щавелевокислого натрия вносили 0,5 мл исследуемой крови. После
тщательного перемешивания в пробирку добавляли равное количество
двухмиллиардной взвеси микроорганизмов. После перемешивания смесь помещали в
термостат при 37о С на 30 мин. Затем, несколько капель исследуемой
лейкоцитарно-микробной взвеси вносили в чашку Петри с застывшим хорошо
подсушенным 2%-ным мясо-пептонным агаром. Засеянные чашки помещали в термостат, при 37о С для
выращивания микробов и наступления третьей фазы фагоцитарной реакции, т.е.
захватывания микробов фагоцитами. После окончания установленного срока
инкубации приступали к изготовлению мазков-отпечатков. Приготовленные
мазки-отпечатки высушивали и окрашивали способом Романовского-Гимза.
При микроскопировании препаратов, приготовленных из
лейкоцитарно-микробной взвеси, инкубированной в термостате, отчетливо были
видны различия между жизнеспособными и нежизнеспособными клетками. Первые характеризовались
гигантскими размерами, вторые сохраняли исходную величину. В случаях, когда
процесс фагоцитоза носил завершенный характер, внутри лейкоцитов отмечались
фрагменты разрушенных клеток, имеющих разнообразную форму и отдельные микробные
тела значительно меньших размеров, чем в лейкоцитах с незавершенным
фагоцитозом.
Тест
восстановления нитросинего тетразолия (НСТ-тест)
Метод основан на цитохимическом выявлении темно-синих гранул диформазана,
которые образуются в цитоплазме нейтрофила в результате восстановления
нитросинего тетразолия. Эти химические реакции осуществляются благодаря
активации кислородзависимой биоцидности фагоцита (Маянский А.Н. и соавт.,
1999). Повышенный метаболизм лейкоцитов выступает как донатор электронов
бесцветного раствора НСТ, трансформируя формазан в восстановленную форму в виде
черных глыбок определяющихся в нейтрофилах крови (Герасимов И.Г., Калуцкая
О.А., 2000).
Мазки крови окрашивали дважды: по Паппенгейму (комбинация методов
Мая-Грюнвальда и Романовского-Гимзы) и второй раз тетразолиевым нитросиним. В
готовом мазке подсчитывали общее число нейтрофильных гранулоцитов и число
нейтрофилов, содержащих зерна формазана. Результат выражали в процентном
отношении числа активированных нейтрофилов к 100 клеткам нейтрофилов в мазке.
Подобная реакция обозначается как спонтанный тест НСТ. Он улавливает такие
отклонения в организме, которые не регистрируются общепринятыми лабораторными
тестами и другими маркерами. Нарушение кислородзависимых механизмов совпадает с
увеличением числа активированных нейтрофилов (Карпищенко А.И., 1999).
Механизм данного теста основан на том, что фагоцитирующие клетки в
присутствии фагоцитированного антигена активируют цитоплазматические
пищеварительные энзимы, способные разрушить данный антиген. Доказано, что
поглощение НСТ является эквивалентом поглощения микробных тел. Как микробные
АГ, так и НСТ в присутствии ионов галоидов (йода, брома, хлора) активизирует
клеточный метаболизм, вызывает «респираторный взрыв», который сопровождается
увеличением потребления кислорода, активизацией гексозомонофосфатного шунта,
образованием перекиси водорода и свободных радикалов в нейтрофильных
гранулоцитах. Это дало основание считать НСТ-тест показателем метаболической
активности клеток, в частности нейтрофильных лейкоцитов и эквивалентом их
фагоцитарной и бактерицидной активности (Зинкин В.Ю., Годков М.А., 2004).
Метод определения активности миелопероксидазы в
нейтрофильных гранулоцитах (Allen R.C., Stephens J.T. Jr., 2011)
Активность миелопероксидазы проявляется при наличии в среде перекиси
водорода. Активность фермента определяется по появлению в цитоплазме
нейтрофилов (n=100) окрашенного продукта пероксидазной реакции - оксибензидина.
Оксибензидин окрашивает места локализации пероксидазы в желто - коричневый
цвет, под микроскопами эти участки выглядят как желто-коричневые гранулы.
Степень окрашивания цитоплазмы нейтрофилов пропорциональна активности
миелопероксидазы.
С целью определения уровня активности миелопероксидазы в нейтрофильных
гранулоцитах готовили мазки крови, наносили на них инкубационную среду,
докрашивали ядра клеток 0,1% раствором нейтрального красного и производили
сравнительную оценку результатов по определению средних цитохимических
коэффициентов (СЦК) по формуле:
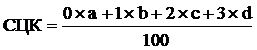 ,
,
где
a - количество нейтрофилов без гранул;
b,c,d -
количество нейтрофилов с окрашенной цитоплазмой.
Цифры
обозначают степень окрашивания цитоплазмы: 0 - цитоплазма не содержит гранул; 1
- слабое окрашивание цитоплазмы; 2 - окрашивание средней интенсивности; 3 -
интенсивно окрашенная цитоплазма.
Снижение
СЦК свидетельствует о дефектности кислородзависимых антимикробных систем
нейтрофила.
Метод определения активности катионных белков нейтрофильных гранулоцитов
Катионные белки лизосом нейтрофилов в нейтральной среде способны
связывать анионный краситель бромфеноловый синий. Степень гранулярного синего
окрашивания цитоплазмы пропорционально содержанию катионных белков в клетках.
Снижение данного показателя свидетельствует о дефектности кислороднезависимой
системы нейтрофила (Карпищенко А.И., 1999).
Готовые тонкие мазки крови высушивали, фиксировали их и окрашивали
0,15-ый раствором бромфенолового синего. Затем производили докрашивание ядер
0,1%-ым раствором нейтрального красного. Анализировали интенсивность окрашивания
цитоплазмы 100 нейтрофилов, вычисляли средний цитохимический коэффициент (СЦК):
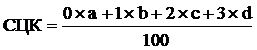 ,
,
где a - количество нейтрофилов без гранул; b,c,d - количество нейтрофилов
с окрашенной цитоплазмой. Цифры, указывающие на интенсивность окраски
цитоплазмы: 0 - отсутствие окраски, 1 - наличие в цитоплазме единичных синих
гранул; 2 - синие гранулы занимают до 1/3 площади цитоплазмы; 3 - синие гранулы
занимают ½ площади цитоплазмы.
Методика выявления щелочной фосфатазы
Щелочная фосфатаза (ЩФ) или фосфогидролаза моноэфиров ортофосфорной
кислоты локализуется в специфических, или вторичных гранулах нейтрофильных
лейкоцитов. Отмечается повышение активности ЩФ в нейтрофилах при воспалении,
облучении, интоксикации, острых повреждениях тканей, шоке.
Мазки крови фиксировали смесью формальдегид-метанола в течение 30 с.
(формальдегид - 10 мл, абсолютный метанол - 90 мл). Затем помещали на 20 мин.
при комнатной температуре в инкубационную среду следующего состава: α-нафтил-фосфат натрия - 35 мг, прочный
синий RR - 35 мг, трис-буфер, рН 9,6 (вместо пропандиолового буфера) - 35 мг. В
50 мл дистиллированной воды растворяли 2,42 г трис-буфера, добавляли 18,9 мл
соляной кислоты, приливали дистиллированную воду до общего объема 100 мл.
Докрашивали ядра 0,01% водным раствором азура II и микроскопировали (×90,
×10). Места
локализации щелочной фосфатазы определялись в виде гранул коричневого цвета.
Анализировали интенсивность окрашивания цитоплазмы 100 нейтрофилов, вычисляли
средний цитохимический коэффициент (СЦК).
При проведении цитохимических исследований применялась оценка результатов
по М.Г. Шубич, Б.С. Нагоеву (1980), основанная на выявлении специфической
окраски различной степени интенсивности в цитоплазме нейтрофильных лейкоцитов.
Картина распределения и количества осадка позволила разделить клетки на
четыре типа по степени активности фермента: «0» - отсутствие фермента,
цитоплазма не окрашена; «1» - слабое диффузное окрашивание, единичные гранулы в
цитоплазме; «2» - диффузная окраска с умеренным количеством гранул; «3» -
сильно положительная реакция с многочисленными гранулами.
Для определения СЦК количественное выражение результатов проводилось
путем подсчета 100 нейтрофилов с их дифференцировкой по описанному выше
принципу. Число клеток с одинаковой активностью окраски умножали на цифру,
соответствующую данному типу степени активности фермента. Сумма этих
произведений, деленная на 100, и представляет собой СЦК для одной клетки:
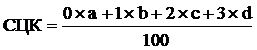 .
.
Методика выявления кислой фосфатазы
Кислая фосфатаза (КФ) или фосфогидролаза ортофосфорной кислоты постоянно
локализуется в лизосомах или первичных, азурофильных гранулах нейтрофилов.
Активность этого гидролитического фермента во многом определяет их
функциональную способность. При фагоцитозе отмечается повышение содержания КФ в
нейтрофильных лейкоцитах (Шубич М.Г., Нестерова И.В., 1980).
Мазки крови фиксировали при 40С в холодном 10% формалине на 960 спирте в
течение 30 с. Переносили мазки на 2 ч. при 370С в инкубационную среду
следующего состава: раствор «А»: нафтол-фосфат или (AS-BI) - 20 мг
диметилформамид - 0,5 мл, холодный 0,1 н. раствор уксуснокислого натрия (1,36 г
уксуснокислого натрия растворяли в 100 мл дистиллированной воды) - 40 мл;
раствор «Б»: 2% фуксин для фуксинсернистой кислоты на 1 н. HCI (4,04 мл
концентрированной соляной кислоты доводили дистиллированной водой до 50 мл) - 8
капель, 4% раствор азотистокислого натрия - 8 капель. Рабочий раствор: раствор
«А» сливали с раствором «Б», перемешивали, отфильтровывали, устанавливали рН
5,2-5,4 (если pH больше 5,4, то подкисляли 1 н. соляной кислотой) и докрашивали
ядра 2% раствором метилового зеленого.
В местах локализации кислой фосфатазы отмечалось окрашивание в коричневый
цвет. Анализировали интенсивность окрашивания цитоплазмы 100 нейтрофилов,
вычисляли средний цитохимический коэффициент (СЦК).
Определение уровня цитокинов
Количественное определение уровня цитокинов с помощью специфических
антител является сегодня самым распространенным способом детекции этих белков
(Сенников С.В., Силков А.Н., 2005). Нами применялся набор реактивов фирмы
«Bender Medsystems» (Австрия) для определения цитокинов методом проточной
цитометрии.
Изучали спонтанную и индуцированную способность лейкоцитов крови
секретировать IL-1β, IL-2, IL-4, IL-6, IL-8, IL-10, фактор некроза опухоли-α
(FNO-α)
и гамма интерферон (IFN-γ).
В качестве мутагена
использовали ФГА. Для определения продукции про- и противовоспалительных
цитокинов постановку ИФА проводили в соответствии с методическими
рекомендациями производителя.
Изучение микробиоценоза влагалища
Состояние вагинального микроценоза, количественную и качественную оценку
его состава производили в соответствии с Приказом МЗ СССР №535 от 22.04.85. «Об
унификации микробиологических методов исследования, применяющихся в клинико-диагностических
лабораториях». При диагностике ИППП использовали Приказ № 286 «Об улучшении
выявления больных гонорей и трихомониазом в акушерских и гинекологических
отделениях (палатах, кабинетах), женских консультациях и урологических
кабинетах) и Приказ МЗ.РФ. №415 от 20.08.2003. «Гонокковая инфекция».
Идентификацию стафилококков проводили согласно приказу Минздрава России от
28.12.1995 г. № 691 «О профилактике внутрибольничных инфекций в акушерских
стационарах г. Москвы».
С целью определения видового состава и биологических свойств микрофлоры
производили взятие материала из заднего свода влагалища и цервикального канала.
Видовой состав определяли с помощью коммерческих тест-систем фирмы «Лахема
(Чехия), набор СИБ для дифференциации коринебактерий, набор №2 СИБ для
дифференции энтеробактерий и определителя бактерий Берджи.
Для выделения и идентификации микрофлоры влагалища у обследованных женщин
применяли бактериологический метод, при выполнении которого использовали
вышеуказанные специальные среды (табл. 2).
Видовую принадлежность микрококков определяли по их
способности гидролизировать эскулин с образованием эскулитина и глюкозы (В.П.
Саргсяна, 1988) при помощи «Enterotest-1» и «Enterotest-2» (Чехия). Эскулитин
связан с цитратом железа, образует комплекс черного цвета, придает характерную
черную окраску колониям в соответствии с классификацией Берджи (2004).
При учете результатов посева учитывали интенсивность
роста выделенных культур:
I - очень скудный рост - рост только на жидких питательных
средах; на плотной питательной среде рост отсутствует.
II - скудный рост - на плотной питательной среде рост до 10
колоний микроорганизмов определенного вида.
III - умеренный рост - на плотной питательной среде рост
от 10 до 100 колоний.
IV - обильный рост - на плотной питательной среде рост более
100 колоний.
Определение чувствительности микроорганизмов к химиопрепаратам
У выделенных культур микоплазм определяли
чувствительность к антибиотикам, наиболее часто назначаемым при лечении
урогенитального микоплазмоза: тетрациклины - доксициклин, тетрациклин;
макролиды - джозамицин, мидекамицин; фторхинолоны - офлоксацин, ципрофлоксацин,
пефлоксацин, спарфлоксацин, левофлоксацин, моксифлоксацин; линкозамиды -
линкомицин, клиндамицин; аминогликозиды - гентамицин при помощи тест-системы
«МИКОПЛАЗМА-АЧ», «МИКОПЛАЗМА-П-120» (НИИ эпидемиологии и микробиологии им.
Пастера, г.С.-Петербург) и Mycoplasma IST (BioMeriox, Франция). В соответствии с
инструкцией при изменении цвета среды в лунках с антибиотиками микоплазмы
расценивали как резистентные (R),
при отсутствии изменения цвета среды - как чувствительные (S).
Для выявления чувствительности микроорганизмов
определяли минимальную ингибирующую концентрацию препарата - МИК в ЕД/мл или
мкг/мл (Навашин С.М., Чучалин А.Г., Белоусов Ю.Б., 1998). По чувствительности к
химиопрепаратам микроорганизмы делили на три группы - чувствительные, умеренно
чувствительные и устойчивые.
Таблица 1
Объем проведенных исследований
|
№
|
Методы исследований
|
Количество исследований
|
|
А
|
Анализ историй болезни и
карт амбулаторного наблюдения
|
305
|
|
Б
|
Сбор и изучение анамнеза
|
305
|
|
В
|
Анализ карт амбулаторного
наблюдения
|
305
|
|
Г
|
Объективное обследование
больных
|
1325
|
|
Д
|
Лабораторные исследования:
|
1670
|
|
1.
|
Общий анализ крови
|
851
|
|
2.
|
Общий анализ мочи
|
819
|
|
Е
|
Инструментальные:
|
1688
|
|
1.
|
Кольпоскопия
|
369
|
|
2.
|
Гистологические/цитологические
исследования
|
1319
|
|
Ж
|
Лабораторное выявление
урогенитальных инфекций:
|
2650
|
|
1.
|
Культурально-биохимический
|
265
|
|
2.
|
Метод флуоресцирующих
антител (МФА)
|
795
|
|
3.
|
Иммуноферментный анализ (ИФА)
|
530
|
|
4.
|
Полимеразная цепная реакция
(ПЦР)
|
1060
|
|
З
|
Иммунологические
|
|
|
1.
|
Общее число лейкоцитов в 1л
|
305
|
|
2.
|
Относительное и абсолютное
число нейтрофилов
|
610
|
|
а
|
Фагоцитаоный показатель
|
305
|
|
б
|
Фагоцитарное число
|
305
|
|
в
|
Показатель завершенности
фагоцитоза
|
305
|
|
3.
|
Клеточные иммунные реакции
|
|
|
а
|
CD3+ - лимфоциты
|
305
|
|
б
|
CD 4+ - лимфоциты
|
305
|
|
в
|
CD 8+ - лимфоциты
|
305
|
|
г
|
CD 4+ / CD 4+
|
305
|
|
4.
|
Исследование гуморальных
реакций
|
|
|
а
|
Абсолютное число
В-лимфоциты (CD 20+)
|
305
|
|
в
|
Ig М, Ig G, Ig
А, мг %
|
795
|
|
5.
|
Исследование цитокинового
профиля
|
|
|
-
|
ИЛ - 1β, - 2, -
4, - 8, - 10.
|
1525
|
|
-
|
ФНО α
|
305
|
Таблица 2
Объем
проведенных иммунологических исследований
|
Методы исследований
|
Количество исследований
|
|
1. Определение
лейкоцитарной формулы
|
156
|
|
2. Определение количества
Т- и В-лимфоцитов
|
312
|
|
3. Определение уровня
иммуноглобулинов (А, М, G)
|
408
|
|
4. Определение
цитопатогенного действия лимфоцитов
|
156
|
|
5. Определение субпопуляций
Т-лимфоцитов
|
312
|
|
6. Определение уровня
иммуноглобулина Е
|
156
|
|
7. Определение уровня ЦИК
|
156
|
|
8. Реакция бластной
трансформации лимфоцитов
|
225
|
|
9. Определение фагоцитарной
активности нейтрофилов
|
156
|
|
10. Реакция торможения
миграции лейкоцитов
|
166
|
|
11. Аффинность Еа-РОК
Т-лимфоцитов
|
152
|
Таблица 4
Количество проведенных исследований
|
п/№
|
Методы исследований
|
Количество исследований
|
|
1.
|
Изучение морфологических,
культурально-биохимических, серологических свойств микрофлоры влагалища
|
1425
|
|
2.
|
Количественный анализ
микрофлоры влагалища
|
1225
|
|
3.
|
Выявление микоплазм
клинических изолятов Enterococcus faecalis
|
425
|
|
4.
|
Определение вирулентности
|
180
|
|
5.
|
Изучение чувствительности к
химиопрепаратам (диско-диффузионный метод)
|
425
|
|
6.
|
Исследование нуклеотидных
последовательностей генов, детерминирующих экспрессию факторов патогенности
М. hominis и E. faecalis (ПЦР) ((МУ.1.3.2569-09)
|
845
|
|
7.
|
Выявление адгезивной и
гемолитической активности, выделение бактериальной ДНК микоплазм и
энтероккока (сylm, cpd, cps, P-120, )
|
845
|
|
8.
|
Амплификация ДНК
нуклеотидных последовательностей ( сylm, cpd, cps,
P-120, )
|
845
|
|
9.
|
Детекция результатов ПЦР
ДНК нуклеотидных последовательностей (сylm, cpd,
cps, P-120, )
|
840
|
|
10.
|
Методы статистического
анализа
|
890
|
2.3 Методы статистического анализа
Статистическую обработку результатов исследования проводили на
персональной ЭВМ типа IBM «Pentium-IV», графическая обработка материалов
выполнена с помощью пакета статистической обработки Statistika 6 данных. Статистическую обработку
полученных результатов обследования производили на компьютере с использованием
пакета специальных прикладных программ Microsoft Excell 7.0.
Результаты исследований составили базу данных первичных показателей,
заложенных в компьютер. Обработка и анализ данных выполнялся на IBM совместимых компьютерах с
использованием статистического программного пакета Statistica версии 6.0. Для всех параметров при
статистической обработке вариационных рядов вычислялись значения средней
арифметической (М-Mean),
среднеквадратического отклонения (а=Std. Dev.) и стандартная ошибка (t=Std. Error).
Достоверность различий между показателями оценивалась t-критерием Фишера-Стьюдента, уровень надежности составил 95%.
но в силу того, что значительная часть параметров распределялась «не
нормально», оценка уровней значимых (р<0,05) и достоверных (р<0,001)
межгрупповых различий по количественным (метрическим) и порядковым (балльным
или полуметрическим) признакам производилась с использованием непараметрических
методов статистической обработки, в том числе U-критерия Манна-Уитни.
Использованы также частотный и корреляционный виды анализа, оценка χ2-квадрат 2x2 и тесты расхождения между
двумя усреднениями (Реброва
О.Ю., 2002).
ГЛАВА 3. КлиническАЯ ХАРАКТЕРИСТИКА
ПАПИЛЛОМАВИРУСНОЙ ИНФЕКЦИИ ГЕНИТАЛИЙ ПРИ СОЧЕТАНИИ С УРОГЕНИТАЛЬНЫМ
МИКОПЛАЗМОЗОМ
.1 Клиническая характеристика больных ПВИ в
ассоциации с урогенитальным микоплазмозом
Обследовали 101 женщину с ПВИ в сочетании с урогенитальным микоплазмозом
(первая группа) и 108 пациенток с папилломавирусной инфекцией без УМ (вторая
группа).
При сборе анамнеза большое значение придавалось следующим данным:
возрасту начала половой жизни, количеству половых партнеров, семейному
положению, характеру менструальной функции, используемым методам контрацепции.
Анализ возрастной структуры пациенток не выявил достоверных различий
частоты встречаемости ПВИ в зависимости от возраста у женщин первой и второй
групп. Ведущее место по
инфицированности ВПЧ среди обследованных занимали сексуально активные женщины в
возрасте 20-30 лет независимо от наличия у них микоплазмоза (табл.1).
Таблица 1
Возрастная структура пациенток с ПВИ
|
Группы обследованных
|
Возраст
|
|
20-30 лет
|
31-40 лет
|
41-50 лет
|
51 год и более
|
|
абс
|
%
|
абс.
|
%
|
абс.
|
%
|
абс.
|
%
|
|
Первая (n=101)
|
36
|
35,6
|
23
|
22,8
|
22
|
21,8
|
20
|
19,8
|
|
Вторая (n=108)
|
39
|
36,1
|
25
|
23,1
|
23
|
21,4
|
21
|
19,4
|
Среди факторов, увеличивающих риск инфицирования ПВИ, часто отмечают
раннее начало половой жизни, что объясняется неполноценностью эпителия шейки
матки у девушек и частую смену половых партнеров. Большинство пациенток и
первой и второй групп (52,9%и 52,7% соответственно) отмечали начало половой
жизни в возрасте 17-19 лет; у 15,8% (первая группа) и 14,8% (вторая группа)
половой дебют состоялся в 14-17 лет.
Большинство исследований подтверждает наличие корреляции между числом
половых партнеров и частотой папилломавирусной инфекцией среди женщин. Среднее
количество половых партнеров у обследованных женщин первой и второй групп
составило 7,2±0,4 и 6, 9±0,6 (р>0,05)соответственно.
Курение и прием алкоголя относятся к значимым факторам риска
инфицирования ВПЧ. Установлено, что что из всех пациенток 43,7% курили и 21,7%
употребляли алкоголь, достоверных различий данных показателей у женщин обеих
групп также не выявлено.
В социальном плане большинство обследованных имело высокий уровень
образования (высшее, неоконченное высшее образование и среднее) и, тем не
менее, 79,9% из них были недостаточно информированы о заболевании и о путях его
передачи.
Социальный статус обследованных женщин первой и второй групп не имел
достоверных различий. Большинство обследованных обеих групп составляли женщины
рабочих профессий (31,7±0,9%
и 30,4±0,1% соответственно) и служащие -
8,7±1,1% и 25,9±0,6% соответственно (табл. 2).
Таблица 2
Социальный статус больных миомой матки
|
Группы женщин
|
Домашние хозяйки
|
Служащие
|
Рабочие
|
Учащиеся
|
|
Первая (n=101)
|
Абс.число
|
16
|
29
|
32
|
24
|
|
%
|
15,8±0,2%
|
28,7±1,1%
|
31,7±0,9%
|
23,8±1,5%
|
|
Вторая (n=108)
|
Абс.число
|
20
|
28
|
33
|
27
|
|
%
|
18,5 ±0,3%
|
25,9±0,6%
|
30,4±0,1%
|
25,0±0,2%
|
Анализ репродуктивной функции у обследованных пациенток показал, что у
большинства больных она была сохранена. Достоверных различий у пациенток первой
и второй групп женщин по количеству ранних (7,9±0,3% и 7,5±0,1% соответственно) и поздних (2,6±0,1% и 2,5±0,3% соответственно) выкидышей не
обнаружено (табл. 3).
Таблица 3
Исходы беременностей в анамнезе у обследованных женщин (%)
|
Исходы беременности
|
Группы обследованных женщин
|
|
Первая
|
Вторая
|
Здоровые (группа сравнения)
|
|
(n=101)
|
(n=108)
|
(n=52)
|
|
Количество родов
|
90,1±5,2
|
90,7±6,8
|
92,3±4,1
|
|
Количество медицинских
абортов
|
134,6±9,2
|
131,5±6,9
|
115±4,2
|
|
Количество ранних выкидышей
|
6,9±0,5
|
7,4±0,8
|
5,8±0,6
|
|
Количество поздних
выкидышей
|
2,9±0,4
|
2,7±0,4
|
1,9±0,3
|
Примечание: * - достоверность различий исхода беременностей в
обследованных группах
Анамнез показал, что менструальная функция у пациенток находится в
пределах нормы, для всех обследованных женщин характерно начало менархе в 12,4±0,6 лет. Длительность и характер
десквамационной фазы менструального цикла у пациенток составил 3,1±1,8 дней, что не превышает средние
показатели, продолжительность менструального цикла составляла 21-28 дней.
Из всех обследованных первой, второй групп и группы сравнения не выявлено
также достоверных различий в использовании методов контрацепции, 17,8±2,4%; 15,7±1,9% и 17,3±2,7% пациенток соответственно
применяли комбинированную оральную контрацепцию в течение года и более.
Преимущественно пациентки использовали однофазные оральные контрацептивы
(«марвелон», «логест», «жанин», «диана-35»), реже - трехфазный препарат
«три-регол». Процент использования барьерной контрацепции составил 11,9±3,1%; 12,0±1,4% и 11,5±0,9% женщин соответственно.
Антиспермицидные препараты («фарматекс») применяли 4,9±0,3% и 4,6±1,1% пациенток соответственно (в
группе сравнения 3,9±0,6%;
р>0,05); 4,9±0,7%
и 5,5±1,1% пациенток использовали
внутриматочную контрацепцию (в группе сравнения 5,8±0,6%; р>0,05). Не использовали
никаких методов контрацепции 60,5% и 62,2% пациенток (в группе сравнения 61,5±0,6%; р>0,05).
При изучении гинекологического анамнеза обследованных с ПВИ (n=209) было отмечено, что большинство
пациенток (85,6±5,7%)
имели сопутствующие или раннее перенесенные гинекологические заболевания.
Наиболее частыми из них были хронические воспалительные заболевания матки и
придатков (57,4±7,1%)
и бактериальный вагиноз (62,6±8,2%).


Рис. 2. Структура воспалительных заболеваний репродуктивной системы у
женщин с ПВИ - цифры!
У 97 (46,4%) обследованных женщин из 209 пациенток с ПВИ отмечалась
экстрагенитальная патология: хронические заболевания дыхательных путей (34,4±2,4%), сердечно-сосудистой системы
(19,6±5,1%), желудочно-кишечного тракта
(14,8±2,8%), мочеполовой системы (23,4±3,9%); и щитовидной железы (2,4±1,1%) (табл. 4).
Таблица 4
Экстрагенитальные заболевания у женщин с ПВИ (%)
|
Экстрагенитальные
заболевания
|
Обследованные женщины
|
|
1 группа
|
2 группа
|
|
абс.
|
%
|
абс.
|
%
|
|
сердечно-сосудистой системы
|
37
|
36,6±3,7
|
35
|
32,4±4,5
|
|
щитовидной железы
|
2
|
1,9±0,7
|
3
|
2,8±1,0
|
|
мочеполовой системы
|
90,1±4,0*
|
76
|
70,3±2,3
|
|
дыхательных путей
|
20
|
19,8±1,6
|
18
|
16,7±1,2
|
|
желудочно-кишечного тракта
|
15
|
14,8±2,3
|
19
|
17,6±4,4
|
Примечание: * - достоверность различий показателей экстрагенитальной
патологии в обследованных группах
Как видно из таблицы, показатели частоты встречаемости экстрагенитальными
заболеваниями среди пациенток первой и второй групп не имели достоверных
различий, кроме заболеваний мочеполовой системы. Наиболее часто среди патологий
мочевыделительной системы выявлялись хронический цистит и пиелонефрит,
дыхательных путей - бронхит, щитовидной железы - аутоиммунный тиреоидит и
узловой нетоксический зоб.
Следовательно, при относительно одинаковом возрастном и социальном
статусе у пациенток с ПВИ были выявлены частые случаи сопутствующих
экстрагенитальных и гинекологических заболеваний, что создает неблагоприятный
преморбидный фон.
Поводом для обращения к врачу у 62,7% пациенток из 209 служило наличие
жалоб и в 37,3% случаев профилактический осмотр. Наиболее частыми жалобами были
наличие наличие экзофитных образований (кондиломы) в области наружных гениталий
(55,1%), зуд в области гениталий (у 67%), выделение из половых путей (у 59%),
дизурические явления (у 5%). Никаких жалоб не предъявляли 18% женщин (рис. 2).

Рис.
2. Особенности жалоб у женщин с миомой матки Исправить по тексту.
Далее у пациенток изучали содержание лейкоцитов и интенсивность роста
микрофлоры в содержимом влагалища, а также производили оценку слизистого
отделяемого и эпителия.
Проведенные исследования выявили увеличение во влагалищном содержимом
количества лейкоцитов. Так, при наличие микоплазмоза количество лейкоцитов
менее 10 было достоверно меньше у пациенток первой группы (10,9±0,7%) по сравнению со здоровыми (36,5±1,9%), и, наоборот, повышенное
содержание лейкоцитов (>20)
было отмечено в обеих группах (35,6±3,1% и 23,1±2,5% соответственно), тогда как в группе сравнения лейкоцитов во
влагалищном содержимом не выявлено. Содержание лейкоцитов 10-20 было обнаружено
у 53,5±4,2% пациенток первой группы; 56,5±5,1% второй группы и 63,5±3,1% здоровых женщин (табл. 5).
Таблица 5
Количество лейкоцитов в содержимом влагалища у обследованных женщин
|
Количество лейкоцитов
|
Количество женщин (%)
|
|
Больные ПВИ
|
Здоровые (группа сравнения)
(n=52)
|
|
с микоплазмозом (n=101)
|
без микоплазмоза (n=108)
|
|
|
|
< 10
|
11 / 10,9±0,7*
|
22 / 20,4±0,9
|
19 / 36,5±1,9
|
|
10-20
|
54 / 53,5±4,2
|
61/ 56,5±5,1
|
33/ 63,5±3,1
|
|
> 20
|
36 / 35,6±3,1*
|
25 / 23,1±2,5*
|
0
|
Примечание: * - достоверность различий показателей количества лейкоцитов
в содержимом влагалища у обследованных женщин
Кроме того, у женщин с ПВИ на фоне микоплазмоза была снижена выработка
цервикальной слизи по сравнению со здоровыми женщинами, что также может
способствовать поддержанию воспалительного процесса во влагалище (табл.6).
Таблица 6
Показатели секреции цервикальной слизи и слущивания эпителия у
обследованных женщин
|
Основные показатели
|
Количество женщин (%)
|
|
Больные ПВИ
|
Здоровые (группа сравнения)
(n=52)
|
|
с микоплазмозом (n=101)
|
без микоплазмоза (n=108)
|
|
|
Слизь
|
+
|
58,4±4,1* /-59ж
|
33,3±3,5 /36
|
32,7±2,4 / 17
|
|
+ +
|
41,6±1,9* / 42
|
66,7±4,1 / 72
|
67,3±3,9 /35
|
|
Эпителий
|
< 10
|
43,4±1,9* / 44
|
33,3±2,8 /36
|
10/ 19,2±0,8
|
|
10-20
|
36,7±0,8 /37
|
44,5±3,4* /48
|
18 / 34,6±3,1
|
|
> 20
|
19,9±1,3* /20
|
22,2±0,9 /24
|
24/ 46,2±1,9
|
Примечание: * - достоверность различий показателей секреции цервикальной
слизи и слущивания эпителия у обследованных женщин
У пациенток первой группы выявлена пониженная способность влагалища к
самоочищению. Лишь у 19,9±1,3%
пациенток первой и 22,2±0,9%
второй группы женщин данный показатель был высоким (табл.5).
В ряде случаев у обследованных женщин обнаружено увеличение количественных
показателей общей микробной обсемененности половых органов, наиболее выраженный
у пациенток первой группы (табл.6).
Таблица 6
Показатели общей микробной обсемененности половых органов у обследованных
|
Микрофлора
|
Первая группа
|
Вторая группа
|
Здоровые
|
|
скудная
|
12,1±0,1*
|
75,0±0,3
|
61,2±0,2
|
|
умеренная
|
32,1±1,1*
|
25,0±0,2
|
21,6±2,4
|
|
обильная
|
55,8±2,3*
|
|
17,2±0,4*
|
Примечание: * - достоверность различий показателей общей микробной
обсемененности половых органов у обследованных женщин
Таким образом, результаты бактериоскопического исследования влагалищного
содержимого указывают на то, что ПВИ сопровождается воспалительным процессом, а
микоплазмоз усугубляет данный процесс.
Клиническая характеристика пациенток с ПВИ
В соответствии с программой исследования у женщин сравниваемых групп
проводили клинико-визуальный осмотр, расширенную кольпоскопию шейки матки,
определение типа ВПЧ, цитоморфологическое исследование.
Клинико-визуальный метод позволил обнаружить по характерной клинической
картине экзофитные кондиломы. Учитывая, что процесс имеет особенность
распространяться, пациенткам проводили осмотр цервикального канала и уретры.
Проявления ПВИ, видимые невооруженным глазом - экзофитные кондиломы
(остроконечные типичные, папиллярные, папуловидные) расценивали как клиническую
форму инфекции. Установлено, что частота встречаемости экзофитных кондилом в
области половых органов при ПВИ в сочетании с урогенитальным микоплазмозом
(первая группа) и при ПВИ без УМ (вторая группа) имела достоверное различие
(р<0,05).
В первой группе преобладали экзофитные формы (45,5±3,6%), тогда как во
второй - субклинические (37,0±7,3; р<0,05%). Субклинические формы
встречались с одинаковой частотой в обеих группах, латентные были выявлены
достоверно чаще у пациенток второй группы (табл. 5).
Таблица 5
Формы папилломавирусной инфекции у обследованных
|
Формы ПВИ
|
Первая группа (n=101)
|
Вторая группа (n=108)
|
|
Абс.
|
%
|
Абс.
|
%
|
|
Клиническая (экзофитные
кондиломы)
|
46
|
45,5±3,6*
|
31
|
28,7±3,0
|
|
Субклинические
|
33
|
32,7±6,2
|
40
|
37,0±7,3
|
|
Латентные
|
22
|
21,8±4,3*
|
37
|
34,3±3,7
|
Примечание: * - достоверность различий в обследованных группах
При субклинической форме очаги ПВИ были не видимы невооруженным глазом,
они выявлялись только при кольпоскопии и/или цитологическом или гистологическом
исследовании. Проявлялись в виде: морфологических изменений плоского эпителия
(плоские кондиломы) без видимого экзофитного роста, обнаруживались типичная
структура с множеством койлоцитов; малых форм (различные поражения
метапластического эпителия с единичными койлоцитами) и кондиломатозного
цервицита/вагинита.
К латентной форме ПВИ относили бессимптомное ВПЧ-носительство, выявляемое
только ПЦР, без обнаружения других клинических или субклинических признаков
инфекции
Визуально-клинические проявления ПВИ
Проведенные исследования показали, что проявления клинической формы ПВИ,
имели разнообразную локализацию и формы инфекции, которые нередко сочетались.
Признаки ПВИ выявлялись на вульве, промежности, перианальной области, шейке
матки, влагалище в виде остроконечных, папиллярных и папуловидных кондилом.
Экзофитные формы ПВИ были представлены кондиломами, приподнятыми над уровнем
кожи или слизистой оболочки, размеры варьировали от пятна с мелкой точечностью
и низкими шиловидными выпячиваниями до обширных опухолей типа гигантских кондилом.
Экзофитные образования имели вид одиночных узелков или красноватых
столбиков, иногда собранных в группы в форме множественных выростов по типу
"цветной капусты". Они локализовались на поверхности кожи и
слизистых, часто имели тонкую ножку, реже - широкое мягкое основание, не
сращенное с подлежащими тканями. Часто кондиломы встречались небольшими
группами и/или в виде множественных скоплений, реже встречались единичные
кондиломы.
Локализовались экзофитные кондиломы у обследованных женщин обеих групп
чаще в области вульвы и промежности, включая наружное отверстие уретры больших
и малых половых губ, шейки матки, реже - устья уретры и промежности (табл. 6).
Таблица 6
Локализация экзофитных кондилом у женщин с ПВИ
|
Локализация
|
Первая группа
|
Вторая группа
|
|
абс.
|
%
|
абс.
|
%
|
|
|
Кожа промежности
|
|
|
|
|
|
|
Большие половые губы
|
|
|
|
|
|
|
Малые половые губы
|
|
|
|
|
|
|
Преддверие влагалища
|
|
|
|
|
|
|
Устье уретры
|
|
|
|
|
|
|
Шейка матки
|
|
|
|
|
|
При наличии экзофитных кондилом в области наружных половых органов очаги
ПВИ нередко обнаруживались во влагалище и на шейке матки. В первой группе
сочетанная локализация встречалась достоверно чаще, чем во второй (28,7% и
18,5% соответственно; р<0,05).
Результаты кольпоскопических исследований
Для исследования папилломавирусных поражений влагалища и шейки матки использовали
кольпоскопию.
Проведенные кольпоскопические исследования показали, что у 63 больных
первой группы (62,4%) имела место патология шейки матки, тогда как во второй
группе данный показатель составил 38,0%.
Характерной кольпоскопической картиной при остроконечных кондиломах
являлись белесые эпителиальные формирования с пальцеобразными выростами,
придающими образованию неправильную форму. В этих выростах после обработки
места поражения 3% раствором уксусной кислоты обнаруживалась правильная капиллярная
сеть, являющаяся важным диагностическим критерием. Как показали проведенные
исследования наиболее часто у обследованных женщин первой группы встречались
«Ненормальные кольпоскопические образования» (28,6%): пунктуация, ацетобелый
эпителий, мозаика нежная и грубая, лейкоплакия тонкая и толстая, йоднегативная
зона. «Неудовлетворительная кольпоскопия» (43%) включала в себя: «граница
эпителия не визуализируется», «повреждение полностью не визуализируется» и др.
(рис. 6).
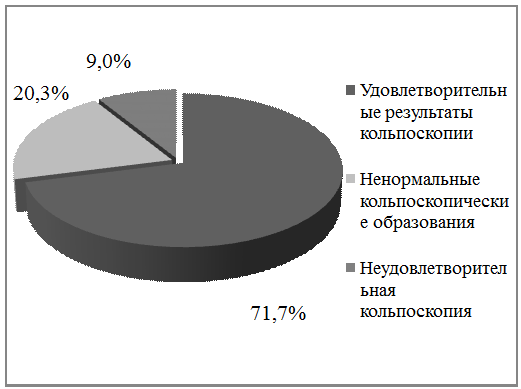
Рис.
6. Результаты кольпоскопического исследования женщин с ПВИ: два блина - 1-я и
2-я группы.
Кольпоскопические
исследования женщин с ПВИ без сопутствующего урогенитального микоплазмоза
выявили меньшую выраженность изменений шейки матки (табл. 8).
Таблица
8
Кольпоскопическая
картина у женщин с ПВИ (абс./%)
|
Образование
|
Больные ПВИ+УМ (n=101)
|
Больные ПВИ (n=108)
|
|
1. Удовлетворительные
результаты кольпоскопии
|
|
Оригинальный сквамозный
эпителий
|
51/ 41,1±3,1
|
31/ 68,9±2,9
|
|
2. Ненормальные
кольпоскопические образования
|
|
Пунктуация (нежная и
грубая)
|
24 / 19,3±2,6
|
7/ 15,5±1,8
|
|
Ацетобелый эпителий
|
29 / 23,4±2,9
|
8 /17,8±1,3
|
|
Мозаика (нежная и грубая)
|
31/ 25,0±3,5
|
9 /20,7±1,7
|
|
Лейкоплакия (тонкая и
толстая)
|
3/ 2,4±2,1
|
-
|
|
Йод-негативная зона
|
14 / 11,3±2,4
|
6 /8,9±0,7
|
|
Атипические сосуды
|
-
|
-
|
|
3. Неудовлетворительная
кольпоскопия
|
|
Сильное воспаление или
атрофия
|
-
|
-
|
|
Граница эпителия не
визуализируется
|
5/ 4,0±3,2
|
-
|
|
Цервикс не визуализируется
|
-
|
-
|
|
Повреждение полностью не
визуализируется
|
3 /2,4±1,8
|
-
|
|
4. Разные результаты
|
|
Кондиломы
|
14/ 11,3±3,3
|
2 /4,4±2,6
|
|
Эрозия
|
6 /4,8±3,4
|
1/ 2,2±1,9
|
В группе сравнения результаты кольпоскопии были в норме. Многослойный
плоский эпителий имел бледно-розовый цвет и гладкую блестящую поверхность. Во
время кольпоскопии эта ткань визуализируется в виде тонкого, бессосудистого
эпителия. При обработке раствором уксуса эпителий бледнел незначительно и
равномерно, окраска раствором Люголя вызывало его равномерное окрашивание в
темно-коричневый цвет. Цилиндрический эпителий у здоровых женщин имел сосочковую
структуру или гроздевидную поверхность, четко контурировался после обработки
уксусом и слабо реагировал на раствор Люголя.
Морфологические изменения при ПВИ
Степень поражения эпителиальных клеток при ПВИ возможно определить на
основании цитологических и гистологических исследований, в связи с этим у
пациенток с целью уточнения диагноза было проведено морфологическое
исследование шейки матки.
Результаты цитологических исследований оценивали по наличию изменений
клеток цервикального канала, характеру изменений клеток эпителия и др. Для
этого использовали классификации по Папаниколау (PAP - smear test), учитывая её
широкую распространённость в клинической практике. При оценке категории мазка
составлены следующие типы цитологических заключений (табл. 9).
Таблица 9
Цитологическая
картина эпителия шейки матки у женщин с ПВИ (%)
|
Класс препарата
|
Оценка препарата
|
Пациенты с ПВИ
|
Здоровые (n=52)
|
|
|
с УМ (n=101)
|
без УМ (n=108)
|
|
|
1
|
Цитологическая картина в
пределах нормы
|
-
|
3,9±0,7
|
100,0
|
|
2
|
Умеренные изменения клеток
эпителия (обусловленные воспалительным процессом на слизистой);
|
24,7±3,8*
|
61,8±4,2
|
-
|
|
3
|
Изменения единичных клеток
эпителия (диагноз недостаточно ясен)
|
75,3±5,9*
|
34,3±2,5
|
-
|
|
4
|
Наличие отдельных клеток с
признаками злокачественности
|
-
|
-
|
-
|
|
5
|
Наличие многочисленных
атипические клетки
|
-
|
-
|
-
|
Примечание
Как видно из приведенной таблицы, у женщин первой группы не было выявлено
«Цитологическая картина в пределах нормы». При клинической и субклинической
инфекции имелись различной степени выраженности изменения эпителиальных клеток.
В этих случаях в препаратах, приготовленных из поверхностных слоев эпителия
обнаруживались койлоциты - оксифильно окрашенные клетки, характеризующиеся
уменьшенными размерами, увеличенным гиперхромным ядром и перинуклеарным светлым
ободком. В ряде случаев при остроконечных кондиломах наблюдался акантоз и
паракератоз. При умеренных изменениях клеток эпителия течение папилломавирусной
инфекции сопровождалось небольшим количеством койлоцитов, увеличение ядер в
койлоцитах было минимально.
При значительных изменениях клеток эпителия койлоциты по данным
цитологического исследования выявлялись достоверно чаще, особенно у женщин
первой группы по сравнению со второй (75,8±4,2% и 31,8±2,9% соответственно, р<0,05).
Основным методом диагностики CIN (цервикальной интраэпителиальной
неоплазии) является прицельная биопсия с последующим гистологическим
исследованием полученного препарата. Результаты гистологического исследования
позволяют точно установить диагноз CIN и его стадию.
У 25 женщин первой группы и 37 - второй со значительными изменениями
клеток эпителия, выявленными при цитологической исследовании, были проведены
гистологические исследования ткани шейки матки. Они показали, что
морфологические изменения были более выражены у женщин первой группы по
сравнению со второй. Незначительные клеточные изменения обнаружены у 27,9% и
31,4% обследованных соответственно. Было обнаружено умеренное утолщение
рогового слоя с папилломатозом, паракератозом и акантозом. Папилломавирусные
изменения (плоская кондилома) обнаружены у 17,0% пациенток первой и 15% второй
групп. Диагностически важным считается наличие в глубоких участках мальпигиева
слоя койлоцитов. Они были выявлены у 46,7% первой и 21,3% второй групп.
В случаях плоской кондиломы, локализующейся на шейке матки, обнаруживался
многослойный плоский или метапластический эпителиий, акантоз, паракератоз и
дискератоз. Практически всегда определялись койлоциты.
Диагноз CIN установлен у 41,9% пациенток: при
CIN I (18,6% случаев) отмечалась слабовыраженная дисплазия, наличие койлоцитоза
и дискератоз; при CIN II (23,3% случаев) - выраженная дисплазия, койлоцитоз и
дискератоз (табл. 10). Или эту таблицу переделать в рис?
Таблица 10
Результаты гистологического исследования пациенток
|
Морфологические изменения
|
Группы
|
|
Первая (n=25)
|
Вторая (n=37)
|
|
Абс.
|
%
|
Абс.
|
%
|
|
CIN I
|
9
|
36,0±5,3
|
27
|
73,0±8,7
|
|
CIN II
|
16
|
64,0 ±10,5
|
10
|
27,0±3,2
|
Пациентки с CIN III не были
включеы в наше исследование. У одной пациентки по данным гистологического
исследования обнаружена CIN I
и плоская кондилома одновременно. При латентной форме ПВИ морфологические
изменения отсутствовали.
Типы ВПЧ у обследованных
Всех пациенток обследовали на наличие ДНК ВПЧ низкого онкогенного риска
методом полимеразной цепной реакции (определяли 6,11, 42-44 и 54 типы вируса).
Из всех известных типов ВПЧ низкой онкогенной активности у обследованных
были выявлены 6, 11, 42 и 44 типы. У 40 пациенток первой группы (39,6%) и 43
женщин второй группы (39,8%) папилломавирусная инфекция была обусловлена одним
типом ВПЧ низкого онкогенного риска. У 61 пациентки (60,4%) ПВИ была
обусловлена множественными типами ВПЧ низкого онкогенного риска: два типа ВПЧ
обнаружены у 42 пациенток (41,6%), три и более типа у 19 обследованных (18,8%).
Сравнительное определение типа ВПЧ у женщин обеих групп не выявило
достоверных различий (р>0,05) (табл.11).
Таблица 11
Типы ВПЧ у обследованных (НАДО ЦИФРЫ ИСПРАВИТЬ,
|
Типы ВПЧ
|
Количество обследованных
|
|
Первая группа (n=101)
|
Вторая группа (n=108)
|
|
Абс.
|
%
|
Абс.
|
%
|
|
6
|
85
|
84,2±6,1
|
89
|
82,4±8,4
|
|
11
|
43
|
42,5±4,3
|
49
|
45,4±5,2
|
|
42
|
5
|
4,9±1,3
|
5
|
4,6±0,7
|
|
44
|
2
|
2,0±1,2
|
3
|
2,8±1,5
|
Примечание: * - достоверность различий в обследованных группах
Количественные показатели содержания ДНК ВПЧ низкого онкогенного риска
различных типов в исходных пробах колебались, максимального уровня они
достигали у 6 типа ВПЧ, минимальные показатели были у 44 типа. У женщин первой
группы с клинической и субклинической формами ВПИ количество копий ДНК 6, 1,
42, 44 типов ВПЧ в пробах были выше, чем у пациенток второй группы. При латентной
форме заболевания концентрация копий ДНК ВПЧ у пациенток с сочетанным и
изолированным течением ВПИ не имела отличий (табл. 12).
Таблица 12
Количественные показатели содержания ДНК ВПЧ низкого онкогенного риска
при различных клинических форма ПВИ
|
Тип ВПЧ
|
Число копий ДНК (копий/мл)
|
|
Первая группа
|
Вторая группа
|
|
Клиническая форма
|
|
6
|
40600
|
32000
|
|
11
|
16200
|
1000
|
|
42
|
2180
|
190
|
|
44
|
5200
|
180
|
|
Субклиническая форма
|
|
6
|
32000
|
26000
|
|
11
|
8000
|
5200
|
|
42
|
1000
|
180
|
|
44
|
190
|
-
|
|
Латентная форма
|
|
6
|
2180
|
2200
|
|
11
|
1000
|
1000
|
|
42
|
180
|
100
|
|
44
|
180
|
180
|
Примечание:* - достоверность различий показателей концентрации ДНК ВПЧ в
обследованных группах
Таким образом, анализ анамнестических данных не выявил достоверных
различий частоты встречаемости ПВИ у пациенток первой и второй групп в зависимости
от возраста, образовательного и социального статуса у женщин.
У обследованных на фоне сохранения репродуктивной функции отмечались
хронические воспалительные заболевания матки и придатков и бактериальный
вагиноз. Из сопутствующей экстрагенитальной патологии наиболее часто
встречались заболевания сердечно-сосудистой и мочевыделительной системы.
Наиболее часто среди патологий мочевыделительной системы выявлялись хронический
цистит и пиелонефрит, дыхательных путей - бронхит, щитовидной железы - аутоиммунный
тиреоидит и узловой нетоксический зоб.
Проведенные исследования выявили у больных папилломавирусной инфекцией
гениталий увеличение во влагалищном содержимом количества лейкоцитов, снижение
выработки цервикальной слизи и десквамации эпителия, а также увеличение
интенсивности роста микрофлоры в содержимом влагалища, более выраженные при ВПИ
в сочетании с урогенитальным микоплазмозом.
Установлено, что результатом продуктивного воздействия ПВИ на слизистые
являются: клиническая форма инфекции, характеризующаяся экзофитными
разрастаниями; субклиническая, сопровождающаяся повреждением эпителиальных
тканей без экзофитного роста, выявляемая посредством цитологических и
гистологических исследований; латентная, асимптомная, диагносцируемая с помощью
молекулярно-биологических тестов.
Локализовались экзофитные кондиломы у обследованных женщин обеих групп
чаще в области вульвы и промежности, включая наружное отверстие уретры больших
и малых половых губ, шейки матки, реже - устья уретры и промежности.
Проведенные кольпоскопические исследования показали, что у 63 больных
первой группы (62,4%) имела место патология шейки матки, тогда как во второй
группе данный показатель составил 38,0%. Наиболее часто у обследованных женщин
первой группы встречались пунктуация, ацетобелый эпителий, мозаика нежная и
грубая, лейкоплакия тонкая и толстая, наличие йоднегативной зоны.
Кольпоскопические исследования женщин с ПВИ без сопутствующего урогенитального
микоплазмоза выявили меньшую выраженность изменений шейки матки.
Цитологические исследования (PAP - smear test) выявили при клинической и
субклинической формах ПВИ достоверно более выраженные изменения эпителиальных
клеток цервикального канала у пациенток первой группы, по сравнению со второй
группой. При значительных изменениях клеток эпителия койлоциты выявлялись
достоверно чаще, особенно при сочетании папилломовирусной инфекции с
урогенитальным микоплазмозом.
Проведенные гистологические исследования показали, что морфологические
изменения ткани шейки матки были более выражены у женщин с сочетанием ПВИ и
урогенитального микоплазмоза по сравнению с изолированным течением
папилломавирусной инфекции. Так, слабовыраженная цервикальная
интраэпителиальная дисплазия (CIN I) была обнаружена в два раза чаще у
пациенток второй группы, чем первой, в то время как более выраженная дисплазия (CIN
II), достоверно чаще встречалась при сочетании ПВИ и урогенитального
микоплазмоза.
У обследованных были выявлены ВПЧ низкой онкогенной активности 6, 11, 42
и 44 типов. У 40 пациенток первой группы (39,6%) и 43 женщин второй группы
(39,8%) папилломавирусная инфекция была обусловлена одним типом ВПЧ низкого
онкогенного риска. У 61 пациентки (60,4%) ПВИ была обусловлена множественными
типами ВПЧ низкого онкогенного риска: два типа ВПЧ обнаружены у 42 пациенток
(41,6%), три и более типа у 19 обследованных (18,8%).
Количественные показатели содержания ДНК ВПЧ низкого онкогенного риска
различных типов в исходных пробах колебались, максимального уровня они
достигали у 6 типа ВПЧ, минимального - у 44 типа. У женщин первой группы с
клинической и субклинической формами ВПИ количество копий ДНК 6, 1, 42, 44
типов ВПЧ в пробах были выше, чем у пациенток второй группы. При латентной
форме заболевания концентрация копий ДНК ВПЧ у пациенток с сочетанным и
изолированным течением ВПИ не имела отличий.
Библиографический список
1. Киселев
В.И. Вирусы папилломы человека в развитии рака шейки матки. М.: Димитрейд
График Групп® 2004. С. 17-22.
. Клиническая
патология беременности и новорожденного / Под ред. М.Н. Кочи, Г.Л. Гилберта,
Дж.Б. Брауна (пер. англ.). М.: Медицина, 1996. 314 с.
. Козаченко
В.П. Диагностика и лечение эпителиальных дисплазий и преинвазивной карциномы
шейки матки // Заболевания шейки матки, влагалища и вульвы: Клинические лекции
/ Под ред. проф. В.Н. Прилепской. М.: МЕДпресс, 2-е изд. 2000. С. 139-152.
. Роговская
С.И. Папилломавирусная инфекция у женщин и патология шейки матки. Москва: Изд.
группа «ГЭОТАР - Медиа», 2005. С. 15-17.
. Борьба с
основными болезнями в Европе - актуальные проблемы и пути их решения // Факты и
цифры Европейского регионального бюро ВОЗ Копенгаген [Электронный ресурс].
2006. Режим доступа: http://www.euro.who.int/mediacentre. Дата доступа:
10.07.2007.
. Методология
скрининга предопухолевых заболеваний и опухолей шейки матки, тела матки и
яичников: Инструкция по применению, утв. М-вом здравоохранения Респ. Беларусь
3.02.2005. / И.В. Залуцкий [и др.]. Минск: Дикта, 2005. 3 с.
.
Version 4 is based on Virus Taxonomy, Classification and Nomenclature of
Viruses, 8th ICTV Report of the International Committee on Taxonomy of Viruses.
Fauquet C.M., Mayo M.A., Maniloff J., Desselberger U., and Ball, LA. (EDS)
(2005) Elsevier / Academic Press. Рp. 1259.
.
de Villiers E.M., Fauquet C., Broker T.R., Bernard H.U., and zur Hausen H.
Clas-sification of papillomaviruses // Virology, 2004. 324(1): 17-27.
.
Human papillomavirus and genital warts // National Institute of Allergy and In-
fectious Diseases. [Electronic resource] July, 2004. Mode of access: http://
www.niaid.nih.gov/factsheets/stdhpv.htm. Date of access: July 22, 2005.
12. Киселев
В.И., Киселев О.И. Вирусы папилломы человека в развитии рака шейки матки. М.:
Медицина, 2003. 42 c.
.
Woodman C.B., Collins S., Winter H., Bailey A., Ellis J., Prior P., Yates M.
Rollason T.P., Young L.S. Natural history of cervical human papillomavirus
infection in young women: a longitudinal cohort study // Lancet. 2004.1 Jun. 9; 357
(9271):1831-6.
. Кулаков
В.И. и др. Современные подходы к диагностике папилломавирусной инфекции
гениталий женщин и их значение для скрининга рака шейки матки // Гинекология.
2000. № 1 (2). С. 4-8.
17.
Dillner J., Meijer C.J., von Krogh G., Horenblas S. Epidemiology of human
papillomavirus infection // Scand. J. Urol. Nephrol. Suppl. 2003; (205):194-200.
. Кожные и
венерические болезни: Руководство для врачей / Под ред. Ю.К. Скрипкина. М.,
1995. С. 309.
.
Международная классификация болезней: Краткий вариант, основанный на Междунар.
статистической классификации болезней и проблем, связанных со здоровьем, 10-го
пересмотра, принятой 43-й Всемирной Ассамблеей Здравоохранения / В.К. Овчаров
[и др.]; Отдел медицинской демографии и Международной классификации болезней
НИИ социальной гигиены, экономики и управления здравоохранением им. Н.А.
Семашко РАМН. Москва, 1996. 23с.
.
Serra H., Pista A., Figueiredo P. Cervix uteri lesions and human papiloma virus
infection (HPV): detection and characterization of DNA/HPV using PCR
(polymerase chain reaction // Acta Med. Port. 2000. Jul-Aug.; 13 (4):181-92.
.
Wick M.J. Diagnosis of human papillomavirus infections. // Clin. Lab. Med. 2002
Jun.; 20(2):271-87, vi.
.
Franceschi S., Castellsague X., Dal Maso L. Prevalence and determinants of
human papillomavirus genital infection in women // Br. J. Cancer. 2002. Mar. 4;
86 (5):705-11.
.
Chan P.K., Chang A.R., Cheung J.L. Determinants of cervical human papillomavirus
infection: differences between high- and low-oncogenic risk types // J. Infect.
Dis. 2002. Jan. 1; 185 (1):28-35.
.
Sherman M.E., Schiffman M., Cox J.T. Effects of age and human papilloma viral
load on colposcopy triage: data from the randomized Atypical Squamous Cells of
Undetermined Significance / Low-Grade Squamous Intraepithelial Lesion Triage
Study (ALTS) // J. Natl. Cancer.
Inst. 2002. Jan. 16; 94 (2):102-7.
. Кубанов
А.А. Результаты генотипирования вируса папилломы человека при скрининговом исследовании
в Московском регионе // Вестн. дерматологии и венерологии [Электронный ресурс].
2005.
. Семенов
Д.М. Клиническая картина и эпидемиология папилломавирусной инфекции у женщин
репродуктивного возраста в Республике Беларусь // Охрана материнства и детства.
2006. №1 (7).
С. 98-04.
.
Altekruse S.F., Lacey J.V Jr., Brinton L.A. Comparison of human papillomavirus
genotypes, sexual. and reproductive risk factors of cervical adenocarcinoma and
squamous cell carcinoma: Northeastern United States // Am. J. Obstet. Gynecol.
2003. Mar.;188 (3):657-3.
.
Schlecht N.F., Franco E.L., Rohan T.E. Repeatability of sexual history in
longitudinal studies on HPV infection and cervical neoplasia: determinants of
reporting error at follow-up interviews // J. Epidemiol. Biostat. 2002; 6 (5):393-07.
. Семенов
Д.М. Триггерные факторы, определяющие клиническое течение папилломавирусной
инфекции у женщин с патологией шейки матки // Охрана материнства и детства. 2006. №2 (8). С. 98-106.
.
Castellsague X., Bosch F.X., Munoz N. Male circumcision, penile human
papillomavirus infection, and cervical cancer in female partners // N. Engl. J.
Med. 2002. 11; 346 (15):1105-12.
.
Ragin C.C., Taioli E. Survival of squamous cell carcinoma of the head and neck
in relation to human papillomavirus infection: Review and metaanalysis // Int. J. Cancer. 2007. Jun. 1;
703-7.
. Дранник
Г.Н. Клиническая иммунология и аллергология / М.: Мед. информ. агентство, 2003.
С. 113-127.
. Семена И.И.
Папилломавирусная инфекция: Клинико-иммунологические особенности женщин и
методы комбинированной терапии: Автореф. дисс. ... канд. мед. наук. С.-Пб. 2005.
.
Madeleine M.M., Daling J.R., Schwartz S.M. Human papillomavirus and longterm
oral contraceptive use increase the risk of adenocarcinoma in situ of the
cervix // Cancer. Epidemiol. Biomarkers Prev. 2002. Mar.; 10 (3):171-7.
.
MorenoV., Bosch F., Munoz N. et al. International Agency for Research on
Cancer. Multicentric Cervical Cancer Study Group. Effect of oral contraceptives
on risc of cervical cancer in women with human papillomavirus infection: the
IARC multicentric case- control study// Lancet. 2002. Mar.; 30; 359
(9312):1085-92.
.
Brabin L. Interactions of the female hormonal environment, susceptibility to
viral infections, and disease progression // AIDS Patient Care STDS 2002. May;
16(5): 211-21.
.
Hildesheim A., Wang S.S. Host and viral genetics and risk of cervical cancer: a
review // Virus. Res. 2002. Nov.; 89 (2):229-40.
.
Lipsey L.R., Northfelt D.W. Anogenital neoplasia in patients with HIV infection
// Curr. Opin. Oncol. 2003. Sep.; 5 (5):861-6.
.
Agrawal N., Mane M., Chiriva-Internati M. Temporal acceleration of the human
papillomavirus life cycle by adeno-associated virus (AAV) type 2 superinfection
in natural host tissue // Virology. 2002. Jun. 5; 297 (2):203-10.
. Новиков
А.И., Кононов А.В., Ваганова И.Г. Инфекции, передаваемые половым путем, и
экзоцервикс. М.: Медицина, 2002. С. 34-59.
. Семенов
Д.М., Дмитраченко Т.И., Занько С.Н. Микст-инфекция в акушерстве и гинекологии
// Тез. докл. науч. сессии ВГМУ. Витебск, 2005.
. Новиков
А.И., Кононов А.В., Ваганова И.Г. Инфекции, передаваемые половым путем, и
экзоцервикс. М.: Медицина, 2002. С. 80-82.
. Башмакова
М.А., Савичева А.М. Папилломавирусная инфекция: Пособие для врачей. М.:
Медицина, 2003. С. 8-10.
.
Boon M.E., van Ravenswaay Claasen H.H., van Westering R.P., Kok L.P.
Urbanization and the incidence of abnormalities of squamous and glandular
epithelium of the cervix // Cancer. 2003. Feb. 25; 99 (1):4-8.
. Роговская
С.И. Папилломавирусная инфекция у женщин и патология шейки матки. М.: ГЭОТАР -
Медиа 2005. С. 48-67.
. Семенов
Д.М. Клинико-патогенетические аспекты папилломавирусной инфекции в
акушерско-гинекологической практике: Сб. научн. тр. ВГМУ. Витебск, 2004.
. Новиков
А.И., Кононов А.В., Ваганова И.Г. Инфекции, передаваемые половым путем, и
экзоцервикс. М.: Медицина, 2002. С. 34-59.
. Башмакова
М.А., Савичева А.М. Папилломавирусная инфекция: Пособие для врачей. М.:
Медицина, 2003. С. 8-10.
. Кузнецова
Ю.Н. Латентная папилломавирусная инфекция урогенитального тракта женщин,
обусловленная ВПЧ 16-го и 18-го типов: Варианты течения, тактика ведения.
Автореф. дисс. ... канд. мед. наук. Екатеринбург, 2003.
. Бауэр Г.
Цветной атлас по кольпоскопии: Пер. с нем. / Под ред. С.И. Роговской. М.:
ГЭОТАР-МЕД, 2002. С. 287.
. Молочков
В.А., Киселев В.И., Рудых И.В. Папилломавирусная инфекция. Клиника,
диагностика, лечение: Пособие для врачей. М.: Русский врач. 2004. 35 с.
. Буданов
П.В., Вороной С.В., Асланов А.Г. Принципы лечения папилломавирусной инфекции //
Вопр. гинекологии, акушерства и перенатологии. 2004 Т. 3, № 4, С.70-75.
. Линимент
циклоферона в клинической практике: Клинические рекомендации для врачей.
С.-Пб., 2007. 80
с.
.
Bodner K., Bodner-Adler B., Wierrani F. Is therapeutic conization sufficient to
eliminate a high-risk HPV infection of the uterine cervix? A
clinicopathological analysis // Anticancer Res. 2002. Nov.-Dec.; 22 (6B):3733-6.
. Хэтч К.,
Хэкер Н. Дисплазии шейки матки, влагалища и вульвы. Гинекология по Милю Новаку.
/ Пер. с англ. Под ред. Дж. Берека, И. Адаши и П. Хиллард. М.: Практика, 2002. С. 280-297.
.
Lie A.K., Skjeldestad F.E., Hagen B. Occurrence of human papillomavirus
infection in cervical intraepithelial neoplasia. A retrospective
histopathological study of 317 cases treated by laser conization // APMIS.
2005. Oct.; 103 (10):693-8.
.
Mayerson D., Barrena N., Wild R. Electrosurgery resection of intraepithelial
lesions of lower female genital tract // Rev. Chil. Obstet. Ginecol. 2003; 58
(2):142-6.
.
Harper D., Franco E., wheeler C. et al. Sustained efficacy up to 4,5 years of a
bivalent L1 virus - like particle vaccine against human papillomavirus types 16
and 18: follow - up from a randomized controlled trial // Lancet. 2006; 367: 1247 - 1255.
. Инструкция
по применению Гардасил, 8 ноября 2006. №01. -11//1814.
.
Гинекология: Национальное руководство / Под ред. В.И. Кулакова, И.Б. Манухина,
Г.М. Савельевой. М.: ГЭОТАР-Медиа, 2007. С. 397-398.
.
Профилактика рака шейки матки: Руководство для врачей. М.: МЕД пресс-информ,
2008. 43 с