Изменения транскрипционной активности синтаз оксида азота с возрастом и при развитии ретинопатии
1. Цели и задачи
исследования
Старение и развитие ассоциированных
с ним заболеваний связаны с изменениями генерации оксида азота (NO), одной из
ключевых сигнальных молекул, регулирующих функции сердечнососудистой, нервной и
иммунных систем организма. NO - ключевой вазодилататор, эффективный модулятор
синаптической пластичности, вовлечен в процессы памяти, обучения, иммунный
ответ и др. (Alderton et al., 2001; Pacher et al., 2007). NO синтезируется
синтазами оксида азота (NOS). Известны три изоформы NOS, и все они генерируют
NO каталитической конверсией аргинина в цитруллин. Эндотелиальная (NOS3) и
нейронная (NOS1) синтазы конститутивно генерируют небольшое количество NO,
выполняющего роль сигнальной молекулы; для их активации необходимы кальций и кальмодулин.
Индуцибельная NOS2 не зависит от кальция и кальмодулина, её экспрессия
многократно усиливается в патологических условиях. При этом NO, реагируя с
супероксидом кислорода, образует мощный окислитель пероксинитрит, который,
обеспечивая микробицидный потенциал клеток иммунной системы, способен также
вызывать необратимые повреждения ДНК, приводить к гибели клеток.
Как недостаток, так и избыточная
генерация NO вносят существенный вклад в патогенез ассоциированных со старением
нейродегенеративных, сердечнососудистых, а, по последним данным, и заболеваний
органа зрения. Однако многие механизмы реализации эффектов NO, в том числе - в
развитии заболеваний и старении - остаются не ясными в силу невозможности их
исследования у людей. Так, сведения об изменении экспрессии синтаз NO в
сетчатке с возрастом крайне ограничены. Такая информация необходима для
понимания механизмов перехода обычных для старения структурно-функциональных
изменений сетчатки в патологические, свойственные, в частности, возрастной
макулярной дегенерации (ВМД) - заболеванию, которое становится основной
причиной потери зрения людьми старшего возраста. Продуктивный подход к
исследованию патогенеза заболеваний - использование биологических моделей.
Показано, что уникальной моделью ВМД является созданная в ИЦиГ СО РАН линия
преждевременно стареющих крыс OXYS (Колосова и др., 2003; Pennesi et al.,
2012). Модель активно используется для исследования механизмов патогенеза
заболевания и оценки эффективности новых способов лечения, однако молекулярно-генетические
механизмы развития у крыс OXYS ретинопатии, аналогичной ВМД у людей, остаются
не ясными. Ранее было показано, что в возрасте 1,5 - 3 месяца - критический
период развития у крыс OXYS признаков преждевременного старения, в том числе
ретинопатии, в их организме снижена генерация NO (Bobko et al., 2005). Целью
настоящего исследования явилась оценка транскрипционной активности генов синтаз
оксида азота (NOS1, NOS2 и NOS3) в сетчатке крыс OXYS и Вистар (контроль)
разного возраста и оценка возможной связи развития ретинопатии с изменением
генерации NO.
Для достижения поставленной цели
решались следующие задачи:
1. Оценить уровень мРНК генов
NOS1, NOS2 и NOS3 в сетчатке крыс Вистар и OXYS разного возраста (в возрасте 3
и 18 месяцев) методом ПЦР в реальном времени.
2. Определить содержание
белковых продуктов гена NOS2 в сетчатке крыс Вистар и OXYS.
. Сопоставить изменения
экспрессии генов NOS1, NOS2 и NOS3 в сетчатке крыс OXYS с выраженностью
патологических изменений.
. Сравнить уровень генерации
NO в организме крыс Вистар и OXYS разного возраста по содержанию его стабильных
метаболитов в сыворотке крови.
2. Обзор литературы
2.1 Оксид азота
Оксид азота обладает широким
спектром биологического действия: участвует в функционировании центральной и
вегетативной нервной системы, пищеварительного канала и мочеполовой системы,
секреторных тканей и органов дыхания, в регуляции сердечнососудистой системы. В
высоких концентрациях NO может проявлять цитостатическую и / или
цитотоксическую активность, т.е. он играет определенную роль в системе
клеточного иммунитета. Этим объясняется влияние NO на процессы инициирования и
протекания апоптоза. (Denis, 1991; Moore et al., 1993).и его производные
способны влиять на экспрессию ряда важнейших белков и ферментов как на уровне
транскрипции, так и трансляции (стресс-белков, ферритина, белков
антиоксидантной защиты, белков - рецепторов трансферритина, ядерного белка р53,
ответственного за блокаду злокачественных новообразований и других белков). В
разных электронных состояниях молекула NO может активировать или подавлять
активность многих ферментов и белков (РНК-редуктазы, компонентов дыхательной
цепи и гликолиза, ядерных факторов транскрипции, белков ионных каналов (Hill et
al., 2010).
Направленность действия NO зависит
от его концентрации. Так, он обладает свойствами цитопротектора, и его
недостаточный синтез приводит к свободнорадикальному повреждению мембран
клеток, развитию дисфункции эндотелия, атеросклероза. В то же время, избыточный
синтез NO может инициировать апоптотическую гибель клеток (Pacher et al.,
2007). Таким образом, существует оптимальная для процесса нормальной
жизнедеятельности клеток концентрация NO, которая составляет порядка нескольких
наномолей (Pacher et al., 2007).
2.2 Биохимические
свойства
В химическом отношении NO -
небольшая липофильная молекула, состоящая из одного атома азота и одного атома
кислорода. NO имеет непарный электрон, что превращает его в высоко реактивный
радикал, свободно проникающий через биологические мембраны и легко вступающий в
реакции с другими соединениями. NO - это растворимый в воде и жирах бесцветный
газ с уникальными физиологическими свойствами. Как соединение с промежуточной
степенью окисления азота NO может быть как восстановителем, так и окислителем.
В организме молекула NO существует в трех формах, которые могут переходить одна
в другую при окислении или восстановлении: NO* - относительно стабильный,
нейтрально заряженный радикал; NO- - нитроксил-анион с высокой
химической активностью, обусловленной наличием лишнего электрона; NO+
- ион нитрозиния (Степанов и др., 2004, Hill et al., 2010). Каждая из описанных
форм имеет свои мишени и играет различные роли в клеточных процессах.
.3 Образование NO
В организме оксид азота образуется
ферментативным путем пятиэлектронным окислением амнокислоты L-аргинина до
L-цитруллина.
Arg + 3NADPH + 4О2 + 3H =
2Cit + 2NO + 3NADPH + 4H2O
где Arg - аргинин; Cit - цитруллин
(Осипов и др., 2007).
Синтез NO осуществляется семейством
уникальных цитохром-P450-подобных гемопротеинов - NO-синтаз (КФ 1.14.13.39,
систематическое название «L-аргинин, НАДФН: кислородоксдоредуктаза»
(оксид-азота-образующая)), молекулы которых содержат домены с редуктазной и
оксигеназной активностью и при синтезе присоединяют молекулярный кислород к
конечному атому азота в гуанидиновой группе L-аргинина (Alderton et al., 2001).
Все NO-синтазы в активной форме
представляют собой гомодимеры. В монодимере, начиная с С-конца, выделяют
следующие домены:
) редуктазный, сходный по
аминокислотному составу с цитохром-Р450-редуктазой;
) малый кальмодулинсвязывающий;
) оксигеназный, с характеристиками,
схожими с цитохромом Р450, но без структурной гомологии;
) N - концевую специфическую
последовательность.
По характеру индукции и действию
ферменты разделяются на два класса:
. Кальций- и
кальмодулин-зависимые, конститутивно экспрессируеющиеся NO-синтазы, которые, в
свою очередь, разделяют на эндотелиальную (тип 3, eNOS или NOS3), и
нейрональную (тип 1, nNOS или NOS1). Эти две изоформы экспрессируются постоянно
и в условиях физиологической нормы, и при патологических состояниях.
. Кальций-независимая,
индуцибельно экспрессируемая NO-синтаза (тип 2, iNOS или NOS2) (Alderton et
al., 2001).
Нейрональная NO-синтаза (160 кДа)
кроме нервной ткани, экспрессируется в скелетных мышцах, кардиомиоцитах,
эпителии бронхов и трахеи. Фермент участвует в обеспечении механизмов памяти,
модуляции болевого раздражения, координации между нервной активностью и
сосудистым тонусом. При избирательном блокировании nNOS повышаются
агрессивность животных, увеличивается частота небольших церебральных инфарктов.
В условиях дефицита L-аргинина nNOS может генерировать супероксид-анион и
перекись водорода, которые способны оказывать нейротоксическое действие при
ишемии (Knott et al., 2009).
Индуцибельная NO-синтаза (135 кДа)
присутствует в макрофагах, нейтрофилах, кератиноцитах, фибробластах,
хондроцитах, остеокластах, нейронах, астроцитах, в гепатоцитах, островках
поджелудочной железы, эндотелии, эндокарде, гладких мышцах сосудов, а также в
клетках различных типов эпителия: дыхательном, ретинальном, пигментном. Фермент
активируется при воспалительных процессах цитокинами или бактериальными
антигенами, а также ультрафиолетом, озоном, никотиновой кислотой, гормонами,
которые воздействуют на синтез сАМР (адреналин, глюкагон). Эта изоформа NOS
генерирует во много раз большее количество NO в сравнении с другими формами
NO-синтаз, не используя при этом Са2+. Длительность интенсивного
синтеза оксида азота составляет около пяти суток (Soskić et al., 2011). Высокие
концентрации оксида азота способны стимулировать Т-клеточное звено иммунитета и
проявлять цитотоксические свойства, с которыми связывают возможное участие
оксида азота в подавлении некоторых этапов канцерогенеза. Экспериментальная
блокада iNOS приводит к повышению чувствительности организма к инфекциям,
ослаблению, но не полной утрате гипотензивного эффекта эндотоксина. Изменению
активности этого фермента отводится важная роль в патофизиологических
механизмах развития ишемии, инсульта и других сосудистых катастроф. (Kaur et
al., 2008).
Третий тип NOS - эндотелиальная
NO-синтаза с молекулярной массой 133 кДа, конституциональный мембраносвязанный
фермент, регулируемый уровнем ионов кальция. eNOS, помимо эндотелиальных
клеток, встречается в целом ряде тканей (кардиомиоциты, пейсмекерные клетки,
тромбоциты, гиппокамп, легочный и почечный эпителий). Блокада eNOS не приводит
к развитию сердечнососудистых аномалий, но способствует нарушению регуляции
сосудистого тонуса: у экспериментальных животных отмечается умеренное повышение
АД, блокируется эндотелий-зависимая релаксация в ответ на ацетилхолин, но при
этом не нарушается эндотелий-независимая релаксация на нитропруссид натрия
(Tоda et al., 2009).
2.4 Регуляторные функции
оксида азота
Образовавшийся NO оказывает как
аутокринное, так паракринное действие. Основные его мишени - железосодержащие
белки и ферменты, такие как гуанилатциклаза, гемоглобин, собственно NOS и др.
Наиболее впечатляющий пример - это активация гуанилатциклазы. Присоединение NO
к железу гема регуляторной субъединицы гуанилатциклазы вызывает разрыв связи
между Fe и азотом имидазольной группы гистидина, в результате чего изменяется
как структура активного центра, так и конформация белка (Stone et al., 1995).
Активность фермента возрастает в десятки раз, что приводит к увеличению уровня
цГМФ. Далее цГМФ может модулировать работу цГМФ-зависимых Са2+каналов
плазмалеммы, снижая их активность или активировать G-киназы (цГМФ-зависимой
протеинкиназы). Активация последних приводит, например, к фосфорилированию
фосфоламбана - белка, регулирующего активность Са2+ насоса
саркоплазматического ретикулума, и усилению депонирования в нем Са2+.
Кроме того, G-киназы стимулируют протеинфосфатазу, дефосфорилирующую К+
каналы, и активируют последние. Эти процессы направлены на снижение уровня
свободного Са2+ в цитоплазме клеток. Если клеткой-мишенью
оказываются тромбоциты, то повышение cGMP вызывает снижение свертываемости
крови. В случае гладкомышечной клетки, увеличение внутриклеточного цГМФ
приводит к расслаблению гладкой мускулатуры. Данный механизм лежит в основе
таких физиологических явлений, как регуляция тонуса сосудов, регуляция тонуса
сфинктера Одди в двенадцатиперстной кишке и некоторых других (Alderton et al.,
2001).
Другой мишенью NO являются SH-группы
белков, нитрозилирование которых изменяет активность ферментов. Как правило,
восстановление или окисление таких групп вызывает конформационные перестройки
белка, отражающиеся на его ферментативной активности. Примером такой регуляции
является изменение активности глутаматных рецепторов постсинаптических мембран
при нитрозилировании их SH-группы оксидом азота. В результате изменяется
конформация рецепторного комплекса, и он переходит в неактивное состояние. По
такому механизму NO модулирует передачу нервных импульсов в нейронах головного
мозга (Fujimori and Pan-Hou, 1991). Реакции S-нитрозилирования /
денитрозилирования протеинов являются, одним из механизмов передачи
внутриклеточных сигналов. Таким образом, может регулироваться запуск каскада
сериновых протеаз (каспаз), участвующих в запрограммированной клеточной смерти
(апоптозе) (Mannick et al., 1999).
Наконец, NO может нитрозилировать
SH-группы белков, участвующих в транспорте и депонировании металлов переменной
валентности, в частности, белков, участвующих в метаболизме меди и
металлотионеинов (Culotta et al., 1997; Pufhal et al., 1997).
Регуляция активности ферментов через
образование нитрозильных комплексов - феномен, имеющий большое значение не
только при обычных физиологических условиях, но и при возникновении
патологических процессов.
3. Изменение генерации
оксида азота при старении и развитии связанных с ним заболеваний
Старение - это связанное с возрастом
накопление изменений, ведущих к нарушению функций организма и к прогрессивному
росту риска болезни и смерти.
До сих пор наиболее популярной
концепцией старения остается свободно-радикальная теория Хармана (Harman D.,
1956), предположившего, что ведущую роль в ослаблении жизненных функций с
возрастом играет усиление накопления окислительных повреждений макромолекул АФК.
Многочисленными исследованиями было установлено, что при старении действительно
возрастает уровень окислительных повреждений ДНК, белков и липидов и
свободнорадикальные процессы играют важную роль в патогенезе старения и
связанных с ним заболеваний. На сегодня общепризнано, что окислительный стресс
- нарушение баланса в системах генерации и детоксикации АФК - один из
фундаментальных молекулярных механизмов патогенеза. В последнее десятилетие
растет количество данных, свидетельствующих о том, что существенный вклад в его
развитие вносит чрезмерное производство NО (McCann et al., 2005; Jung et al.,
2012). Однако до сих пор остается не ясным, является накопление окислительных
повреждений причиной или следствием возрастных изменений организма.
Имеются убедительные доказательства
того, что при старении увеличивается образование пероксинитрита - продукта
взаимодействия оксида азота с анион-радикалом (Csiszar et al., 2002; Adler et
al., 2003; Sun et al., 2004; Francia et al., 2004), который определяет многие
из негативных последствий окислительного стресса (Pacher et al., 2007; Csiszar
et al, 2009).
Известно, что фенотип стареющих
клеток смещается в направлении провоспалительного состояния на фоне
происходящей в организме активации молекул адгезии, цитокинов и хемокинов
(Ungvari et al., 2004). Это способствует агрегации тромбоцитов и воспалительной
клеточной адгезии. Усиление экспрессии провосполительных ферментов, в том числе
iNOS и циклооксигеназы-2 (COX-2), индуцирует возрастную эндотелиальную
дисфункцию (Ungvari et al., 2004). Кроме того, перепроизводство оксида азота
iNOS может приводить к посттрансляционным модификациям белков и / или к
образованию активных нитрозильных соеденений, которые с возрастом повышают
вазоконстрикцию в артериях. Нарушение биодоступности NO приводит к нарушениям
регуляции потребления O2 миокардом у старых крыс (Adler et al.,
2003). Имеются данные, что мыши с нокаутом по гену eNOS характеризуются
преждевременным старением «сердечного фенотипа», ассоциированного с ранней
смертностью (Li et al., 2004), что иллюстрирует ключевую роль NO в защите
сердечнососудистой системы. Исследования показывают, что снижение продукции
эндотелием NO способствует апоптозу эндотелиальных клеток (Hoffmann et al.,
2001; Csiszar et al., 2004) и приводит к снижению клеточности сосудов,
нарушению микроциркуляции.
Таким образом, старение организма
сопровождается снижением биодоступности NO в результате его взаимодействия с
супероксид аниономна фоне снижения резервов антиоксидантной защиты, изменения
соотношения экспрессии / активности синтаз оксида азота. Снижение
биодоступности оксида азота может также происходить в результате аномальной
экспрессии и активности синтаз оксида азота, которые наряду с NO сами при
определенных условиях могут генерировать анион-радикал кислорода.
3.1 Изменение экспрессии
eNOS
Информация об изменениях экспрессии
eNOS при старении противоречива. По данным одних авторов, экспрессия eNOS в
сосудах с возрастом уменьшается (Challah et al., 1997; Yoon et al., 2010), по
данным других - возрастает (Cernadas et al., 1998; Matz et al., 2000; van der
Loo et al., 2000; Goettsch et al., 2001) или остается неизменной (Sun et al.,
2004; Rodriguez-Manas et al., 2009; Yang et al., 2009). Тем не менее,
большинство авторов все-таки полагает, что при старении происходит понижение
активности eNOS (Chou et al., 1998; Smith et al., 2006 a, b; Yoon et al.,
2010). В частности, активность eNOS снижается из-за недостатка субстратов или
кофакторов, внутриклеточной локализации, белок-белковых взаимодействий и
посттрансляционных модификаций, таких как ацитилирование, нитрозилирование и
фосфорилирование (Dudzinski and Michel, 2007; Villanueva and Giulivi, 2010).
Активация каталитической активности
eNOS происходит при присоединении кальмодулина, который необходим для переноса
электронов между оксигеназным и редуктазным доменом (Chen et al, 2000). В
клетке eNOS связывается с кавеолином-1 в кавеолах и микродоменах эндотелиальной
плазматической мембраны, что приводит к снижению ее ферментативной активности
(Dudzinski and Michel, 2007; Yoon et al., 2010). eNOS мигрирует внутрь клетки в
ответ на повышение цитозольного кальция в присутствии кальмодулина, который
нарушает взаимодействие eNOS с кавеолином-1 (Michel et al, 1997), тем самым
активируя фермент для синтеза NO (Toda et al., 2009).
Белок-белковое взаимодействие с
hsp90 активирует eNOS, повышая её сродство к кальмодулину, а hsp70, напротив,
ингибирует hsp90 и способствует деградации синтаз оксида азота (Dudzinski and
Michel, 2007). В старых клетках эндотелия происходит снижение hsp90 (Smith et
al., 2006b; Yoon et al., 2010), что, возможно, в определенной степени
определяет снижение экспрессии eNOS, уменьшение генерации оксида азота и
снижение NO-сосудистой релаксации с возрастом. Регуляция активности
производиться путем фосфорилирование и дефосфорилирования на разных сайтах Ser
и Thr. Фосфорилирование Ser 1177/1176 активирует каталитический домен eNOS, а
Thr 495, напротив, ингибирует активность eNOS. (Dudzinski and Michel, 2007). В
эндотелиальных клетках старых крыс, как и в стареющих эндотелиальных клетках in
vitro, выявлено понижение фосфорилирования Ser 1177 и повышение
фосфорилирования Thr 495 (Smith et al., 2006a; Yoon et al., 2010).
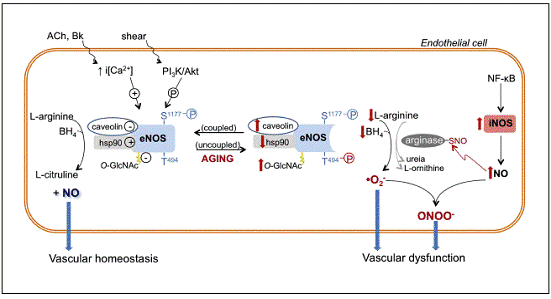
Рис. 1. Механизмы участия eNOS в
регуляции функционального состояния эндотелия и его нарушениях при старении и
развитии связанных с ним заболеваний
При старении одновременно со
снижением способности eNOS генерировать NO, растет её способность провоцировать
развитие окислительного стресса, поскольку несвязанная eNOS является источником
анион-радикала кислорода. На брыжеечной артериии старых крыс показано, что с
возрастом соотношение мономеры/димерыe NOS увеличивается, что указывает на
разобщение eNOS, ассоциированное с повышением продукции O2-(Yang et
al., 2009).
В ряде работ показано, что
разобщение eNOS при старении связано со снижением BH4, а не с
дефицитом L-аргинина, поскольку добавление предшественников BH4
улучшает сосудистую релаксацию и сопротивление артерий у стареющих животных,
снижает разобщение eNOS.
3.2 Изменения экспрессии
iNOS при старении
Существуют убедительные данные,
свидетельствующие об увеличении экспрессии гена iNOS при старении (Chung et
al., 2006). Этот фермент является активным, поскольку сам содержит кальций и
кальмодулин и продуцирует большое количество оксида азота. NO при
взаимодействии с анион-радикалом превращается в пероксинитрит (van der Loo et
al., 2000), наиболее реакционноспособный радикал, способный повреждать белки,
липиды и нуклеиновые кислоты (Peluffo and Radi, 2007). Также NO может
взаимодействовать с остатками цистеина белков, приводя к образованию
S-нитрозотиолов (SNO), что в конечном итоге нарушает функции ферментов,
рецепторов, сигнальных молекул (Moncada and Higgs, 2006).
Фармакологическое селективное
ингибирование iNOS предотвращает возрастное снижение функции сердца (Yang et
al., 2004) и обращает вспять нарушения эндотелий-зависимой вазорелаксации у
старых крыс (Tian et al., 2010). Селективное ингибирование iNOS у больных
артериальной гипертензией привело к впечатляющему восстановлению
эндотелийзависимой вазодилатации (Smith et al., 2011). Такие результаты
свидетельствуют об участии возрастных изменений iNOS в аномальной
вазоконстрикции, нарушении сосудистого тонуса при старении.
Усиление экспрессии гена iNOS и многих
других провоспалительных молекул обеспечивает транскрипционный фактор NF-kB,
который реагирует на окислительные стимулы и регулирует воспалительный процесс
(Chung et al., 2009). Комплексная активация NF-kB-зависимых генов приводит к
распространению системного воспалительного процесса (Makarov, 2000). В свою
очередь, активность NF-kB модулируется IκB киназой (IKK) и MAP киназами. Активированный IKK комплекс
фосфорилирует субъединицу IκB комплекса NF-κB/IκB,
что вызывает деградацию IκB, которая затем приводит к активации NF-kB (Chung et al., 2009).
Известно, что при старении IKK усиливает свою деятельность, направленную на
NF-kB (Chung et al., 2009). Также с возрастом происходит существенное повышение
активности ERK, JNK и р38 МАРК путей, которые контролируют NF-kB-зависимую
транскрипцию в течение воспалительной реакции, параллельно увеличивая
производство АФК (Kim et al., 2002).
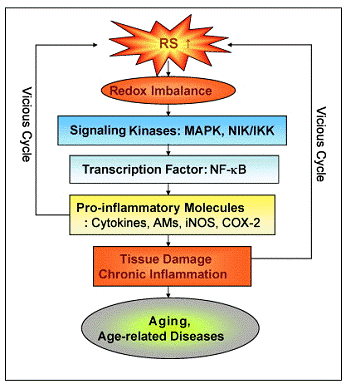
Рис. 2. Основные молекулярные
провоспалительные пути, участвующие в процессе старения и развития
ассоциированных со старением заболеваний
3.3 Изменение экспрессии
nNOS при старении
неактивна в мономерной форме,
активация происходит при димеризации. Для димеризации обязательным является
наличие тетрагидробиоптерина (BH4), гема и L-аргинина (Zhou and Zhu,
2009). Регуляция активности nNOS происходит посредством фосфорилирования и
дефосфорилирования Ser847 и Ser1412, белок-белковых взаимодействий,
кальмодулина (Zhou and Zhu, 2009).Фосфорилирование nNOS имеет важное значение
для её функционального состояния и определяется активностью ряда киназ и
фосфатаз, например, кальмодулин-зависимой киназой и фосфатазой 1, которые, в
свою очередь, регулируются внеклеточными и внутриклеточными сигналами. В
зависимости от сайта фосфорилирования, оно по-разному влияет на активность
nNOS. Так, протеинкиназа CaMKII фосфорилирует nNOS на Ser847, что снижает её
активность путем ингибирования активности Са2+-СаМ (Zhou and Zhu,
2009). Протеинфосфатаза 1 уменьшает уровень фосфорилирования nNOS на Ser847,
что приводит к повышенной активности nNOS. Другой сайт фосфорилирования nNOS
находится на Ser1412, он аналогичен сайту Ser 1177/1176 на эндотелиальной NOS.
Фосфорилирование этого сайта увеличивает активность nNOS, в то время как
дефосфорилирование фосфотазой снижает её (Zhou and Zhu, 2009). Важную роль в
стабилизации димеров nNOS играет белок теплового шока hsp-90, который
содействует вставке гема в мономер (Corso-Díaz and Krukoff, 2010), что повышает ассоциацию nNOS с
кальмодулином (Zhou and Zhu, 2009).
Деятельность nNOS в основном
регулируется внутриклеточной концентрацией Ca2+. nNOS
неактивна при базальной внутриклеточной концентрации кальция. Когда
стимулирующие факторы увеличивают уровень Ca2+ в клетке, кальмодулин
связывается с nNOS, приводя к активации последней. Когда внутриклеточная
концентрация кальция снижается до базального уровня, кальмодулин отделяется,
переводя nNOS в неактивную форму (Zhou and Zhu, 2009).
Сведения об изменении экспрессии
nNOS противоречивы. Так, при оценке активности nNOS в мозжечках крыс Вистар в
возрасте от 2 до 24 месяцев установлено, что к возрасту 6 месяцев происходит
повышение активности фермента, которая затем возвращается к уровню 2 и / или 12
месячных крыс, а в дальнейшем квозрасту 24 месяцев происходит ее снижение (Yu
et al., 2000), которое авторы связывают с уменьшением количества нейронов при
старении.
С другой стороны, имеются данные,
указывающие на активацию nNOS в головном мозге крыс Вистар при старении,
которая происходит из-за повышения фосфорилирования. Предполагается, что понижение
транскрипционной активности nNOS может быть адаптивным механизмом, который
защищает мозг от избыточной генерации NO. (Jesko et al., 2003). Имеются данные,
указывающие на связь между снижением генерации NO, nNOS и гибелью нейронов
(Zhou and Zhu, 2009).Изменениям генерации NO, в том числе и нейрональной NOS,
отводится важная роль в развитии возрастно-зависимых нейродегенеративных
заболеваний, таких как болезнь Паркинсона и Альцгеймера (Zhou and Zhu, 2009).
4. Возрастная макулярная
дегенерация
Возрастная макулярная дегенерация
(ВМД) - комплексное, многофакторное заболевание глаз, приводящее к
необратимому отмиранию фоторецепторов, подлежащих клеток ретинального
пигментного эпителия (РПЭ), изменение мембраны Бруха и хориокапиляров в области
макулы и потере центрального зрения. ВМД становится основной причиной потери
зрения людьми старше 60 лет (Seddon et al., 2005). Несмотря на то, что болезнь
представляет серьезную экономическую и социальную проблему, ее патогенез и
этиология до конца неясны.
Сетчатка является самой активной в
потреблении кислорода тканью в организме человека с уровнем потребления на 50%
больше, чем в мозге или почке (Rattner and Nathans, 2006). Такой интенсивный
обмен веществ к усилению образования АФК и повышает вероятность развития
окислительного стресса, что при недостаточной эффективности работы систем
антиокисидантной защиты может приводить к дегенеративным процессам. Тогда в
сетчатке, особенно в макуле и парамакулярной области, под действием кислорода и
света образуются нерасщепляемые полимерные структуры - друзы - депонированное
аморфное вещество, находящееся между клетками пигментного эпителия и внешней
коллагеновой зоной мембраны Бруха, основным компонентом которых является
липофусцин. Липофусцин - комплекс соединений нестабильного состава, состоящих в
основном из белков (50%) и липидов (44%). Содержимое гранул, по-видимому,
представляет собой остатки неполной деградации компонентов внешних сегментов
фоторецепторов, которые фагоцитируются клетками пигментного эпителия (Nowak, 2006).
Образование друз, иммунорективных образований, провоцирует воспалительный
процесс, атрофию прилегающих слоев сетчатки, неоваскуляризацию - рост
патологических новообразованных сосудов. В дальнейшем происходят процессы
рубцевания, сопровождающиеся потерей большого количества фоторецепторов
сетчатки.
На основе клинических данных принято
выделять «сухую» и «влажную» формы заболевания. Сухая (неэкссудативная) форма
встречается в 90% случаях ВМД. В макулярной области диагностируются друзы,
происходит перераспределение пигмента, появляются дефекты пигментного эпителия
и хориокапиллярного слоя. Влажная (экссудативная) стадия развивается у 10%
больных с ВМД. Она характеризуется врастанием новообразованных сосудов через
дефекты мембраны Бруха под пигментный эпителий сетчатки или под нейроэпителий.
Патологическая проницаемость новообразованных сосудов приводит к отеку
сетчатки, выделению экссудата и кровоизлияниям в стекловидное тело и сетчатку,
что в итоге становиться причиной потери зрения.
С возрастом происходят
структурно-функциональные изменения хориокаппиляров, ретинального пигментного
эпителия (РПЭ) и мембраны Бруха. В том числе - потеря меланиновых гранул
клетками РПЭ, увеличение количества и повышение плотности липофусциновых
гранул, формирование друз между клетками РПЭ и мембраной Бруха или в самой
мембране, уплотнение мембраны Бруха, атрофия микроворсинок и нарушение
базальной складчатости на клетках РПЭ, склеротизация стенок хориокапилляров и
сужение их просвета (Bonilha, 2008; McLeod et al., 2009). Эти характерные для
так называемого физиологического старения изменения аналогичны тем, что
происходят на ранних стадиях ВМД и лежат в основе патогенеза этого заболевания,
но не всегда приводят к его развитию (Smith and Steinle, 2007; Ehrlich et al.,
2008).
Изменения в иммунной системе играют
важную роль в развитии ВМД. Гистологические исследования выявили наличие
компонентов системы комплемента в друзах и между клетками пигментного эпителия
и мембраной Бруха (Hageman et al., 2001). Пораженную ВМД сетчатку отличает
повышенная иммунореактивность, которая обусловлена формированием в ней друз
(Penfold et al., 1997). Исследования показали, что влияние системы комплимента
на развитие ВМД может реализовываться путем активации местного иммунного ответа
в хориоидальной оболочке (Goverdhan et al., 2005).
В нормальных условиях,
эндотелиальные клетки, выстилающие кровеносные сосуды, устойчивы к
проангиогенным стимулам. Незначительная пролиферация, поддерживающая
оптимальное функциональное состояние эндотелия, регулируется балансом между
проангиогенными и антиангиогенными факторами. В сетчатке ключевую роль играют
фактор роста эндотелия сосудов VEGF (vascular endothelial growth factor) и его
антагонист нейротрофный фактор пигментного эпителия PEDF (pigment
epithelium-derived factor). Гипоксия и ишемия являются эффективными
инициирующими стимулами, увеличивающими экспрессию проангиогенных факторов, что
в конечном итоге приводит к хориоидальной (или субретинальной)
неоваскуляризации. На сегодняшний день показано, что активации HIF-1 при
гипоксии и NO могут активировать пролиферацию и миграцию эпителиальных клеток,
провоцируя, таким образом, неоваскуляризацию (Olson and van der Vliet, 2011).
По последним данным, в инициации хориоидальной неоваскуляризации и её
прогрессии важную роль играютлокальное воспаление и системный иммунный ответ
как процессы, обеспечивающие созданиесоответствующей проангиогенной клеточной и
молекулярной среды.
Новообразованные сосуды, как
правило, неполноценные, с повышенной проницаемостью, врастают со стороны
хориоидеи через дефекты мембраны Бруха и приводят к образованию субретинальной
неоваскулярной мембраны. Ухудшение сосудистого кровотока макулярной области
ведет к развитию дегенеративных изменений: апоптозу клеток РПЭ, депонированию
продуктов метаболизма в виде друз, нарушению целостности мембраны Бруха,
экссудативной или геморрагической отслойке пигментного эпителия (Nowak, 2006).
В условиях воспаления происходит
усиленная экспрессия iNOS в клетках РПЭ сетчатки, что приводит к генерации
большого количества NO, способного опосредовать проангиогенный ответ ряда
ключевых факторов, включая VEGF (Bhutto et al., 2009). Этот эффект обусловлен
тем, что в условиях недостатка кислорода возможна активация HIF-1 большим
количеством NO, производимым iNOS (Brüne and Zhou, 2007), доказана связь между активацией HIF-1 и eNOS
(Olson and van der Vliet, 2011).
На сегодня не вызывает сомнений, что
ключевую роль в патогенезе ВМД играет окислительный стресс, вероятность
которого при старении растет на фоне ослабления систем антиоксидантных защиты и
увеличения генерации АФК (Jarrett and Boulton, 2012). В условиях воспаления
усиленная индукция iNOS приводит к длительному повышению генерации NO, который,
взаимодействуя с анион-радикалом кислорода, превращается в реакционно-способный
пероксинитрит, способный повреждать белки, липиды, нуклеиновые кислоты,
способствовать таким образом развитию ВМД (Chiou, 2001). Экспериментальные
данные показывают, что NO является важным стимулятором хориоидальной
неоваскуляризации при влажной форме ВМД, а его снижение рассматривается как
потенциальная мишень для терапевтических воздействий (Bhutto et al., 2012). В
то же время Bhutto и соавторы показали, что связанное с сужением сосудов и
гемодинамическими изменениями снижение экспрессии синтаз окисида азота в
сосудистой оболочке глаза при ВМД неблагоприятно сказывается на трофике
сетчатки и может усиливать ишемию (Bhutto et al., 2009).
5. Крысы линии OXYS как
модель преждевременного старения и связанных с ним заболеваний
Линия крыс OXYS создана в 70-е годы
в Институте цитологии и генетики СО РАН под руководством академика Р.И.
Салганика. Отбор происходил путем инбридинга и селекции из крыс линии Вистар по
признаку ранней спонтанной катаракты. В пяти первых поколениях её развитие
провоцировали обогащенной галактозой диетой (Соловьева и др., 1975, Obukhova et
al., 2009). Накопление галактозы в тканях токсично. Первоначально у крыс,
чувствительных к галактозе, наблюдалось существенное снижение продолжительности
жизни (до 14 месяцев), низкая фертильность, высокий процент развития «болезней
пожилого возраста» - катаракты, кардиомиопатии, сколиоза, эмфиземы, повышенная
частота возникновения опухолей, нарушения памяти (Salganik et al., 1994).
В 1996 году линия крыс OXYS была
зарегистрирована в международной базе данных, а ключевой характеристикой линии
явилась врожденная гиперпродукция кислородных радикалов.
На данный момент, крысы линии OXYS
являются признанной моделью ВМД (Pennesi et al., 2012). Ретинопатия,
аналогичная по клиническим и морфологическим проявлениям ВМД, развивается у
крыс OXYS к возрасту 3 месяцев и затем прогрессирует, достигая выраженных
стадий к возрасту 12-14 месяцев. Как показали морфологические исследования,
патологические изменения затрагивают у крыс OXYS те же структуры сетчатки, что
и ВМД у людей и соответствует у большинства животных сухой, атрофической форме
заболевания. Основой её развития у крыс OXYS становятся изменения клеток РПЭ:
дистрофические на доклинических стадиях заболевания и дегенеративные - на
поздних. Так, уже в возрасте 20 дней при отсутствии клинических проявлений
ретинопатии в сетчатке крыс OXYS снижена, по сравнению с крысами Вистар,
площадь клеток РПЭ, увеличено количество сосудов с признаками нарушения
кровотока (Markovets et al., 2011). С возрастом эти изменения нарастают и сопровождаются
гибелью фоторецепторов (Zhdankina et al., 2008, Saprunova et al., 2010). К
возрасту 24 месяцев становится практически тотальной, что подтверждают
результаты электроретинографии, которые выявили у крыс OXYS снижение амплитуды
b-волны - показателя функционального состояния нейросенсорных клеток, значения
которой к возрасту 24 месяцев драматически снижается на фоне практически
полного исчезновения фоторецепторов (Neroev et al., 2008).
С дисфункцией РПЭ связывают
существенное снижение ключевых регуляторов ангиогенеза в сетчатке - генов
эндотелиального фактора роста VEGF и его антагониста фактора пигментного
эпителия PEDF в критический период манифестации ранних стадий ретинопатии
практически у 100% крыс OXYS в возрасте 3 месяцев. С возрастом и по мере прогрессии
ретинопатии экспрессия генов VEGF и PEDF в сетчатке у OXYS увеличивается, как и
у крыс Вистар (Markovets et al., 2011), но её повышенный уровень
регистрируется. Увеличение экспрессии VEGF является одной из причин
хориоидальной неоваскуляризации (Grisanti and Tatar, 2008), что согласуется с
данными по крысам OXYS.
Ранее двумя независимыми способами
было установлено, что в организме крыс OXYS в период развития признаков
преждевременного старения продукция NO снижена. Основанием послужило непосредственное
измерение его уровня в крови методом ЭПР-спектроскопии спиновых ловушек и
содержания в ней стабильных метаболитов NO - нитратов и нитритов (Bobko et al.,
2005). Однако причины таких изменений исследованы не были, связь развития
признаков преждевременного старения у крыс OXYS, в том числе и ретинопатии, с
изменением продукции NO, не изучена. Оценка возможной связи развития
ретинопатии у крыс OXYS с изменением транскрипционной активности синтаз NO, и,
соответственно, продукции NO, представляют большой интерес для понимания
молекулярных механизмов развития ретинопатии у крыс OXYS и ВМД у людей.
6. Материалы и методы
В работе были
использованы: SDS, бромистый этидий,
глицерин, борная кислота, трис, ЭДТА, dATP, dGTP, dTTP, dCTP, N,
N-метиленбисакриламид, акриламид, аммония персульфат, минеральное масло
(«Медиген», Россия), фенол, хлороформ, этанол, изопрапонол, β-меркаптоэтанол,
бромфеноловый синий, ксиленцианол, BSA, Tween20, hort-start Taq-ДНК-полимераза
(«СибЭнзим», Россия); TEMED («Reanal», Венгрия), маркер молекулярного веса ДНК
pUC19/MspI (13 фрагментов от 26 п.н. до 501 п.н.) («Сибэнзим», Россия),
бромистый этидий, SYBR Green I («Molecular Probes», США), ингибиторы протеаз
(P8340 Sigma-Aldrich), фосфатно-солевой буфер, Rat Nitric oxide synthase inducible
ELISA Kit (EIAab®), TRI®Reagent (Ambion), ДНКаза I (RQ1
RNase-Free DNase, Promega), DTT, ZnSO4, гранулы кадмия, NaNO2,
сульфаниламид, HCl, нафтилэтилендиамин, водный раствор аммиака, MgSO4, CaCl2,
ацетат натрия, фермент M-MLV Reverse Transcriptase, KCl, MgCl2, (NH4)2SO4,
PonceauS, уксусная кислота, PageBlue (Fermentas), тропикамид.
Животные
Работа выполнена на крысах-самцах
линий OXYS и Вистар в качестве контроля из Центра коллективного пользования
«Генофонды лабораторных животных» Института цитологии и генетики СО РАН.
Животных содержали группами по 5 особей в клетках размером 57×36×20 см при
температуре 22±20С в условиях фиксированного режима освещения (12 ч
свет /12 ч темнота) при свободном доступе к воде и пище - стандартному
гранулированному корму для лабораторных животных («Чара», ЗАО
«Ассортимент-Агро», Россия). Всего использовано 32 животных в возрасте 3 и 18
месяцев.
Офтальмологический
осмотр
Анализ проводился совместно c
офтальмологом, заведующей отделением микрохирургии глаза Новосибирской государственной
областной клинической больницы д.м.н. А.Ж. Фурсовой. Состояние глазного дна
животных было обследовано с помощью прямого офтальмоскопа «Вeta» (Германия)
после предварительного расширения зрачков 1% тропикамидом. Для оценки наличия и
степени выраженности патологических изменений сетчатки использовали принятую в
клинической практике классификацию в соответствии с рекомендациями,
представленными в работе «Офтальмология: национальное руководство» (Аветисов и
др., 2008) и международном протоколе Age-Related Eye Disease Study
(AREDS, «Возраст-зависимых глазных болезней исследование»)
(#"658430.files/image003.gif"> с(T)
(Pfaffl et al., 2002), обработку результатов и статистический анализ производили
в программе REST 2009. Эта программа ведет расчет по следующей формуле:
с(T)
(Pfaffl et al., 2002), обработку результатов и статистический анализ производили
в программе REST 2009. Эта программа ведет расчет по следующей формуле:
R = E -С(T)/ Eref -С(T)ref,
где E - эффективность реакции, Eref
- эффективность контрольной последовательности, R - относительная концентрация
субстрата. В качестве контрольной последовательности использовался ген Rpl 30.
Таким образом определяли
межлинейные; различия в уровнях экспрессии изучаемых генов, а также влияние на
неё возраста животных. Статистический анализ производился по критерию
Манна-Уитни, различия считались достоверными при p < 0,05.
Забор и хранение печени
Крыс декапитировали, извлекали
печень и помещали ее на ледяную чашку Петри. Печень очищали от всех посторонних
тканей, помещали в фольгу и замораживали в жидком азоте. Образцы хранили при
температуре -700С до момента использования.
Выделение белка для
иммуноферментного (ELISA)
Все операции выделения белка
проводились при +40С на снегу. Для выделения белка из двух сетчаток
(50-100 мкг) и печени (100-150 мкг) использовали 500 мкл 1×PBS (0,01 М
фосфатно-солевой буфер) с коктейлем ингибиторов протеаз (P8340 Sigma-Aldrich).
После тщательного гомогенизирования раствор белка лизировали при помощи
двукратной заморозке при -200С. Затем проводили центрифугирование
образцов на 5 000 об/мин в течение 5 минут. Супернатант собирали, разделяли на
аликвоты для дальнейшего использования, замораживали и хранили при -200С.
Концентрация тотального белка определяли с помощью реактивов BioRad
ProteinAssay на основе метода Бредфорда.
Проведение
иммуноферментного анализа ELISA
Образцы белка после выделения,
разводили до концентрации общего белка 4 мг/мл. По 100 мкл образцов вместе со
стандартами белка из набора Rat Nitric oxide synthase inducible ELISA Kit
(EIAab®) наносили на планшет с повторами и инкубировали 2 часа при
370С. После инкубации раствор белка сливали, и в ячейки добавляли
моноклональные антитела против крысиной iNOS, разведенные в буфере из набора;
инкубировали 1 час при 370С. После этого антитела сливали и ячейки
промывали 3 раза буфером из набора. После добавления вторичных антител планшет
инкубировали 1 час при 370С. Антитела сливали, и планшет промывали 5
раза буфером. Затем в ячейки добавляли субстрат для ферментной реакции, и через
30 минут реакция останавливали добавлением Stop Solution из набора.
Интенсивность окраски в ячейках считывали на длине волны 450 нм. По полученным
данным строили калибровочную кривую и определяли концентрацию белка iNOS в
образцах, которую затем пересчитывали в мкг/мл.
Выделение сыворотки
крови
Крыс декапитировали, кровь отбирали
в центрифужные пробирки, затем центрифугировали для отделения клеток при 3000
об/мин 20 мин при +40С. После центрифугирования верхняя фракция
собирали, помещали в пластиковые пробирки, и хранили при температуре -700С
до момента использования.
Измерения содержания стабильных
метаболитов оксида азота (нитратов и нитритов) в сыворотке крови методом Грисса.
В пробирку помещали по 2 гранулы
кадмия (0.5 - 0.6 г.) на 240 мкл образца. Дважды последовательно промывали
растворами (по 1 мл): ddH2O, 0,1 М HCl, 0,1 М NH4OH.
Активацию проводили перед добавлением к кадмию растворов образцов. К каждому
образцу (80 мкл) сыворотки крови добавляли 12 мкл 30% раствора ZnSO4 и
доводили общий объем до 240 мкл ddH2O. Образцы смешивали
встряхиванием, инкубировали 15 минут при комнатной температуре и
центрифугировали 5 минут при 4 000 об/мин. Полученный супернатант переносили в
пробирки с активированным кадмием и оставляли инкубироваться на ночь при
комнатной температуре при постоянном перемешивании. После инкубации образцы
центрифугировали при 5 000 об/мин. Образцы вместе со стандартом (500 мкМ NaNO2
в разведениях от 1:5 до 1:1000) наносили на планшет по 100 мкл с повторами. В
ячейки последовательно добавляли растворы 5 mМ сульфаниламида в 3 М HCl и 1 mМ
нафтилэтилендиамина в деионизированной воде, инкубировали 5 минут при комнатной
температуре. Интенсивность окраски считывали на длине волны 540 нм. По
полученным данным строили калибровочную кривую и определяли суммарное
содержание нитритов в сыворотке крови.
Статистический анализ
Полученные данные анализировались в
программе StatSoft Statistica 6.0 с помощью однофакторного и двухфакторного
дисперсионного анализа с post-hoc сравнением групповых средних в тесте
Ньюмена-Кейлса. Как независимые факторы рассматривали генотип (Вистар или OXYS)
и возраст (3 и 18 месяцев). Данные представлены как среднее ± ошибка среднего.
Результаты считались значимыми при p < 0,05.
7. Результаты
Офтальмологическая
характеристика сетчатки крыс OXYS в возрасте 3 и 18 месяцев
При офтальмологических осмотрах
животных установлено, что в возрасте 3-х месяцев заболеваемость достигла 100%.
Половина животных была подвержена 1-й стадии заболевания, которая
характеризуется наличием «твердых» друз (мелкие очажки желтого цвета с четкими
контурами), зоны атрофии клеток РПЭ и хориокапилляров. В некоторых случаях
наблюдалась отслойка пигментного эпителия. У второй половины животных в этом
возрасте регистрировались признаки второй стадии заболевания: большие «мягкие»
и твердые друзы с тенденцией к сливанию, отек центральной зоны сетчатки,
серозная отслойка пигментного эпителия и нейроретины. К возрасту 18 месяцев
процент животных со второй стадией увеличился и достиг 78%. В этом возрасте
клинические проявления, соответствующие 3-й стадии макулодистрофии
(геморрагическая отслойка сетчатки, кровоизлияния в центральную область,
формирование новых сосудов и признаки рубцевания на сетчатки) были выявлены у
6% крыс OXYS.
В противоположность крысам OXYS, у
крыс Вистар первичные изменения сетчатки не обнаружены.
Анализа результатов офтальмологических
осмотров позволяет выделить два критических периода развития ретинопатии
сетчатки у крыс OXYS. Первый - возраст 3 месяца, в который наблюдается резкий
подъем заболеваемости. В результате 100% крыс OXYS в возрасте 3 мес. имеют
клинически выявляемые патологические изменения глазного дна, соответствующие 1
и 2 стадиям заболевания. Второй период - возраст 18 месяцев, в который
регистрируется активное прогрессирование заболевания, увеличение количества
животных с выраженными патологическими изменениями 2 и 3-й стадии. Эти
возрастные периоды были выбраны для исследования молекулярных процессов ранних
и поздних стадий дегенерации сетчатки.
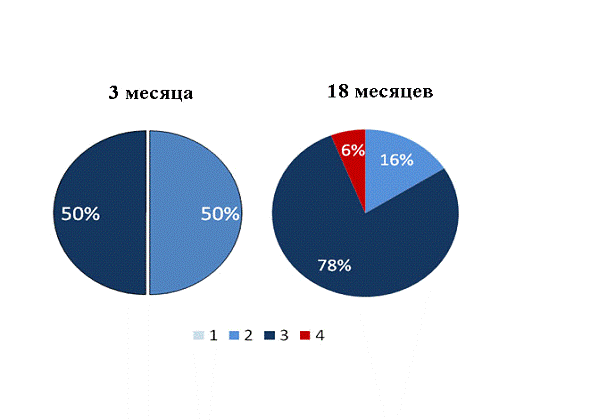
Рис. 3. Доля глаз крыс OXYS с
различными стадиями ретинопатии в зависимости от возраста. Данные представлены
как % глаз с соответствующей стадией заболевания: 1 - сетчатка без изменений,
2, 3 и 4 - изменения аналогичны первой, второй и третьей стадиям ВМД в
соответствии с международной классификацией AREDS
Транскрипционная
активность генов nNOS, iNOS и eNOS в сетчатке крыс OXYS и Вистар
Анализ транскрипционной активности
генов NOSs был проведен с помощью метода Real-time PCR. Данные представлены как
отношение соответствующего уровня мРНК NOSs крыс OXYS к уровню РНК NOSs крыс
Вистар.
Статистический анализ показал, что
наиболее существенные межлинейные различия имеются в уровне транскрипционной
активности гена iNOS. Независимо от возраста и выраженности патологических
изменений уровень мРНК этого гена в сетчатке крыс OXYS был в семь раз ниже, чем
у крыс Вистар (p<0,05). Межлинейные отличия в уровнях мРНК гена nNOS в
возрасте 3 месяцев отсутствовали, а в возрасте 18 месяцев уровень мРНК nNOS у
крыс OXYS был в 2,4 раза выше, чем у крыс Вистар (p<0,05). Достоверных
различий в уровне экспрессии гена eNOS не выявлено. Эти данные подтвердили
результаты прямого секвенирования транскриптома сетчатки, выполненного в нашем
секторе.
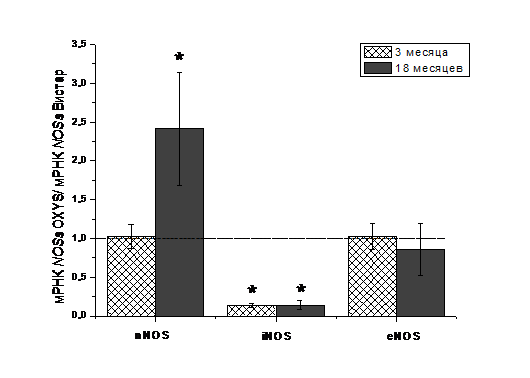
Рис. 4. Отношение
экспрессии мРНК генов nNOS iNOS и eNOS в сетчатке крыс Вистар и крыс OXYS в
возрасте 3 и 18 месяцев. Данные получены метод real-time PCR. Пунктирной линией
отмечен уровень экспрессии мРНК NOSs крыс Вистар, принятый за единицу. * -
достоверные различия по сравнению с крысами Вистар. n=6
Исследование
межвозрастных отличий транскрипционной активности генов NOSs не выявило
достоверных изменений у обеих линий животных.
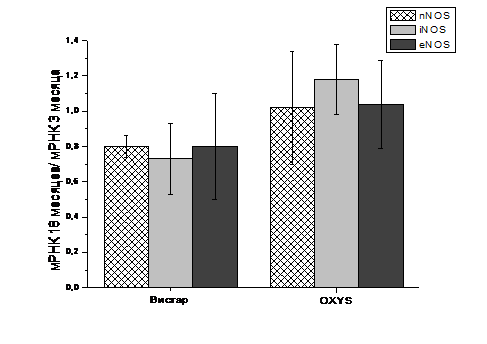
Рис. 5. Межвозрастные
отличия экспрессии мРНК генов NOSs. Данные представлены как отношение уровня
мРНК в 18 мес./уровню мРНК в 3 мес. Данные получены метод real-time PCR. n=6
Содержание белка iNOS в
сетчатке в возрасте 3 и 18 месяцев крыс OXYS и Вистар
Поскольку наиболее яркие
различия уровня мРНК были получены для гена iNOS, было оценено содержание белка
iNOS в сетчатке методом иммуноферментного анализа (ELISA). В качестве
положительного контроля использовались образцы печени.
Двухфакторный анализ
(ANOVA) показал, что содержания белка iNOS в сетчатке не зависит от возраста (F1.35=0,
39, p=0,53), но зависит от генотипа животных: достоверно выше у крыс OXYS (F1.35=5,35,
p=0,027). Однако значимые межлинейные развличия были выявлены только у
трехмесячных животных. Post-hoc сравнения показали, что в этом возрасте у крыс
OXYS удельное количество белка iNOS в 1,3 раза выше, чем у крыс Вистар: 39, 5
против 31 нг/мг (F1.17=6,34, p=0,022). В другой возрастной группе, в
возрасте 18 месяцев, достоверных отличий в содержании белка iNOS между крысами
OXYS и Вистар не выявлено (F1.18=0,75, p=0,4).
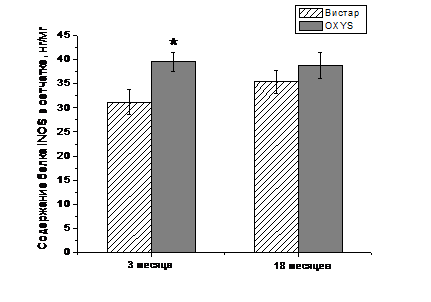
Рис. 6. Содержания белка
iNOS в сетчатке крыс OXYS и Вистар в возрасте 3 и 18 месяцев. Данные получены
методом ELISA. * - достоверные различия по сравнению с крысами 3-месячными
крысами Вистар. n=10
В печени содержание белка
iNOS не зависело от возраста (F1.10=0,018, p=0,9) и генотипа
животных (F1.10=1,04, p=0,33), но факторы «Возраст» и «генотип»
взаимодействовали (F1.9=5,66, p=0,04). Взаимодействие факторов
определили различия в изменении с возрастом содержания белка iNOS в сетчатке
крыс OXYS и Вистар. Post-hoc анализ, не выявил значимых межлинейных отличий в
возрасте 3 месяцев (F1.10=0,018, p=0,9), в то время как в возрасте
18 месяцев относительный уровень iNOS у крыс OXYS был в 1, 8 раза выше, чем у
Вистар (F1.10=85,39, p=0,0008). Такие различия определило снижение к
возрасту 18 месяцев на 35% содержания белка iNOS в печени крыс Вистар. (F1.10=44,87,
p=0,03).
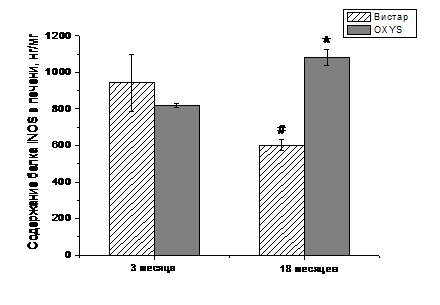
Рис. 7. Содержания белка
iNOS в печени крыс OXYS и Вистар в возрасте 3 и 18 месяцев. Данные получены
методом ELISA. * - достоверные межлинейные отличия, # - достоверные
межвозрастные отличия. n=6
Согласно условиям
эксперимента, анализировалось одинаковое количество общего белка сетчатки и
печени. Но уровень содержания белка iNOS в печени более чем в 30 раз выше, чем
в сетчатке. Эти данные дают основания предполагать, что в сетчатки белок iNOS
содержится в следовых количествах.
Содержание стабильных
метаболитов оксида азота в сыворотке крови
Для оценки системных изменений продукции
оксида азота в организме проведено исследование содержания его стабильных
метаболитов - нитратов и нитритов - в сыворотке крови крыс OXYS и Вистар в
возрасте 3 и 18 месяцев методом Грисса. Как показал двухфакторный ANOVA-анализ
результатов, уровень нитратов и нитритов не зависел ни от генотипа животных (F1.36=2,13,
p=0,153), ни от их возраста (F1.36=0,085, p=0,772). Однофакторный
дисперсионный анализ (One-way ANOVA) не выявил достоверных межлинейных отличий
в уровне стабильных метаболитов NO в сыворотке крови крыс OXYS и Вистар как в
возрасте 3 месяцев (F1.18=0,26, p=0,61), так и в возрасте 15 месяцев
(F1.17=3,49, p=0,07). Межвозрастных различий также не обнаружено.
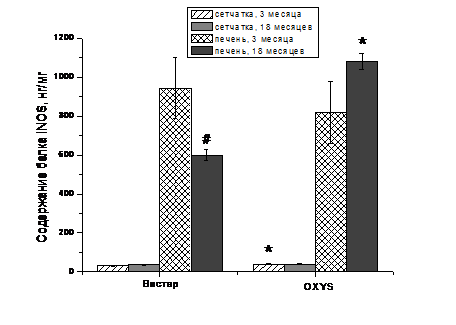
Рис. 8. Сравнение содержания белка
iNOS в сетчатке и печени крыс OXYS и Вистар разного возраста. Данные получены
методом ELISA. n=6-10
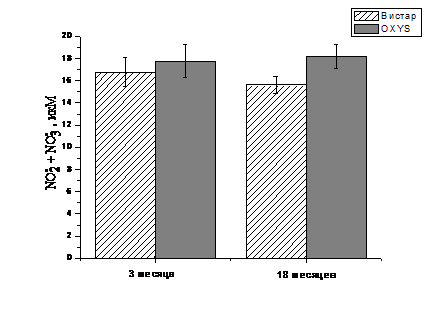
Рис. 9. Суммарная концентрация
нитратов и нитритов в сыворотке крови крыс OXYS и Вистар в возрасте 3 и 18
месяцев. Данные получены методом Грисса. n=10
8. Обсуждение
Оксид азота является триггером
множества сигнальных путей и вносит свой вклад в контроль многочисленных
клеточных функций. Многочисленные исследования, выполненные как на различных
моделях животных, так и на людях, показали, что изменения в генерации и
биодоступности NO играют вносят существенный вклад в процесс старения и
развитие ассоциированных с ним заболеваний, влияют на продолжительности жизни.
Но привести накопленные на сегодня знания к общему знаменателю сложно: полученные
результаты весьма противоречивы.
ВМД - многофакторное заболевание, в
патогенезе которого участвуют сотни генов. На момент постановки задач
настоящего исследования нам удалось найти только одну работу (Bhutto et al.,
2009), в которой обсуждался вклад изменений с возрастом экспрессии синтаз
оксида азота в развитие ВМД - существенное снижение иммунореактивности nNOS и
eNOS в сетчатке и хориоидее с ВМД. Однако данные об изменении экспрессии генов
NOSs с возрастом и при развитии ВМД малочисленны и противоречивы.
Исследовать у людей ранние
доклинические стадии заболеваний невозможно, также как получать образцы
сетчатки пациентов для масштабных исследований молекулярно-генетических
механизмов развития ВМД. Закономерно, для таких исследований необходимы адекватные
биологические модели. Настоящее исследование выполнено на уникальной модели ВМД
- линии преждевременно стареющих крыс OXYS. Его основной целью явилось изучение
изменения транскрипционной активности синтаз оксида азота с возрастом и при
развитии ретинопатии. Для её оценки мы использовали животных в возрасте 3
месяцев, к которому заболеваемость крыс OXYS ретинопатией достигает 100%, но
при этом преобладают изменения, соответствующие первой стадии ВМД, и в возрасте
18 месяцев, когда патологические изменения в сетчатке соответствуют выраженным
стадиям ВМД у людей. В качестве контроля использовались одновозрастные крысы
Вистар.
Оценка транскрипционной активности
генов синтаз оксида азота не выявила межвозрастных изменений экспрессии мРНК
NOSs у обеих линий животных, но были найдены межлинейные отличия: повышение
транскрипционной активности мРНК nNOS у крыс OXYS в возрасте 18 месяцев -
период, когда у этой линии крыс преобладают изменения, соответствующие
выраженным стадиям ВМД у людей. При этом изменений в экспрессии мРНК eNOS
выявлено не было. Известно, что оксид азота является мощным сосудорасширяющим
агентом с различными физиологическими функциями и является основным регулятором
кровотока хориоидеи. NO играет важную роль в ретинальной нейротрансмиссии. Продуцируется
NO eNOS в клетках эндотелия, а также nNOS периваскулярных нейронов.
Ранее, Bhutto и соавторы показали,
что у людей с ВМД снижена иммунореактивность nNOS практически во всех
ретинальных структурах (артериях и венах сетчатки, ганглионарных клетках,
нейроэпителии), в то время как различий в содержании iNOS и eNOS обнаружено не
было. При оценке иммунореактивности в структурах хориоидеи было выявлено
снижение содержания eNOS в артериях, лейкоцитах и клетках стромы, а nNOS - в
клетках РПЭ, артериях, венах и лейкоцитах (Bhutto et al., 2009).
Несмотря на то, что eNOS
локализована в основном в сосудах, Kiel предположил, что вклад в регуляцию
кровотока хориоидеи вносит и nNOS (Kiel, 1999). Наблюдаемое нами повышение
уровня мРНК nNOS в сетчатке крыс OXYS по сравнению с крысами Вистар, скорее
всего, способствует вазодилатации в сосудистой оболочке и, вероятно,
обеспечивает регуляцию кровотока на фоне характерного для крыс OXYS повышенного
артериального давления (Bhutto et al., 2012). Следует подчеркнуть, что мы
исследовали экспрессию генов в хориоретинальном комплексе, т.е. в образцах
присутствовала и сосудистая оболочка глаза. Возможно, это стало причиной
нивелирования результатов для eNOS.
Наши исследования показали, что
независимо от возраста и патологических изменений транскрипционная активность
гена iNOS существенно, в семь раз, у крыс OXYS ниже, чем у контрольных крыс
Вистар. Известно, что снижение функциональных резервов иммунной системы вносит
существенный вклад в процесс старения и развитие связанных с ним заболеваний. В
наибольшей степени при старении изменяется тимусзависимое звено иммунитета,
включающее сам тимус и популяцию развивающихся в нем Т-клеток. При этом
фагоцитарная активность нейтрофилов и моноцитов / макрофагов с возрастом может
даже усиливаться, однако бактерицидность, как правило, ослабевает за счёт
снижения способности к «дыхательному взрыву» и генерации NO. Принципиально
важно, что выработка клетками-эффекторами провоспалительных цитокинов при этом
усиливается, а противовоспалительных, напротив, ослабевает, что приводит к
хронизации воспалительных процессов у людей старшего возраста (Chung et al.,
2006).Такая ситуация рассматривается как возможная причина развития
паравоспаления при ВМД (Forrester, 2013).в 2009 году выдвинул гипотезу о вкладе
паравоспаление в патогенез ВМД (Xu et al., 2009). Паравоспаление - это
адаптивный ответ ткани на стресс или повреждение и имеет промежуточные
характеристики между базальным состоянием и воспалительной реакцией.
Паравоспаление направлено на поддержание гомеостаза, на восстановление тканевой
функциональности, но если стресс или повреждение сохраняются в течение
длительного времени, паравоспаление может стать хроническим и привести к
повреждениям (Xu et al., 2009; Parmeggiani et al, 2012). Вклад паравоспаления в
патогенез ВМД недавно был подтвержден исследованиями in vitro (Cao et al.,
2013; Lin et al., 2013).
На следующем этапе было проведено
исследование содержание белковых продуктов гена iNOS в сетчатке крыс OXYS и
Вистар. Мы не только не выявили снижения содержания белка iNOS, напротив, в
возрасте 3 месяцев его экспрессия в сетчатке крыс OXYS была повышена, а в 18
месяцев не отличалась от таковой у крыс Вистар. На фоне значительного снижения
транскрипционной активности гена iNOS такие результаты представляются
неожиданными. Для семейства ферментов NO-синтаз характерна сложная
транскрипционная и посттранскрипционная регуляция экспрессии, а также наличие
альтернативных транскриптов (Pautz et al., 2010). Мы предполагаем, что
несоответствие уровня мРНК гена iNOS и содержание его белковых продуктов у крыс
OXYS связано с различной активностью его альтернативных форм. Результаты,
полученные нами при оценке содержания белкового продукта гена iNOS в печени,
подтверждают точку зрения, согласно которой профиль NOSs может изменяться в
зависимости от концентрации, окружающего напряжения кислорода и типа клеток.
Исследование маркеров воспаления в
сетчатке крыс показали, что экспрессия iNOS в нейроретине и хориоидее различна
и её изменения с возрастом вносят существенный вклад в старение (Steinle et
al., 2009). При этом по данным авторов только к возрасту 32 месяцев происходит
снижение уровней мРНК и белка гена iNOS в сетчатке, тогда как в сосудистой
оболочке эти изменения незначительны и недостоверны (Steinle et al., 2009).
Такие результаты указывают на то, что усиление экспрессии гена iNOS в сетчатке
при так называемом физиологическом старении и отсутствии признаков характерных
для него заболеваний может быть вызвано хронической инфекцией или травмой. При
сравнении уровней мРНК и белка iNOS в сетчатке 3- и 18-месячных животных мы не
выявили достоверных отличий. Результаты оценки уровня мРНК согласуются с
данными Steinle et al., которые не выявили отличий в уровня мРНК iNOS между
молодыми и 22-месячными крысами. Различия появились только к возрасту 32 мес.,
т.е. у очень старых крыс Фишер??? Для крыс Вистар, соответственно, возраст 18
месяцев не может рассматриваться как старческий. В то же время у крыс OXYS
существенное снижается транскрипционная активности гена iNOS в 3 и 18 месяцев,
а уровень белка iNOS повышен в возрасте 3 месяцев. Как показано в работе (Pautz
et al., 2010), такой дисбаланс на уровне экспрессии мРНК и содержании белка мог
быть следствием разной активности альтернативных транскриптов.
Снижение генерации и биодоступности
NO рассматривается сегодня как проявление старения и, в то же время, как одна
из причин изменений в сердечнососудистой, нервной и иммунной системах (Pacher
et al., 2007). Нарушения в генерации NO могут приводить к нарушению в регуляции
кровотока в хориоидеи, эндотелиальной дисфункции, которым отводится важная роль
в развитии ВМД. Ранее двумя независимыми методами было установлено, что в
организме крыс OXYS в период развития признаков преждевременного старения
продукция NO снижена (исследовалась в возрасте 1,5). Основанием послужило
непосредственное измерение его уровня в крови методом ЭПР-спектроскопии
спиновых ловушек и содержания в ней стабильных метаболитов NO - нитратов и
нитритов (Bobko et al., 2005). В нашем исследовании при оценке системных
изменений продукции оксида азота в организме исследованных 3 и 18 месячных
животных не было выявлено ни межлинейных различий, ни значимых изменений с
возрастом. При сравнении наших результатов с полученными ранее данными
оказалось, что межлинейные различия нивелировались за счет снижения показателей
у крыс Вистар. Возможно, такие изменения в организме крыс Вистар отражают
неблагополучное состояние этой линии в ЦКП «Генофонды лабораторных животных»
Института цитологии и генетики СО РАН в настоящее время. При забое животных
неоднократно приходилось наблюдать признаки воспалительных процессов в легких.
В целом выявленные нами отличия в
экспрессии синтаз оксида азота между крысами OXYS и Вистар не укладываются в
представление о существенном вкладе воспаления в патогенез ВМД. Возможно, это
связано с характерным для крыс OXYS сужением функциональной активности иммунной
системы. Результаты неоднозначны и для оценки вклада изменений транскрипционной
активностью генов синтаз оксида азота в развитие ретинопатии у крыс OXYS
необходимы дальнейшие исследования.
Результаты данной работы были
представлены на 51-й Международной научной студенческой конференции «Студент и
научно-технический прогресс»: Биология, 12-18 апреля 2013 г. в Новосибирске.
Тезисы опубликованы в материалах конференции.
. Анализ транскрипционной активности
генов nNOS, iNOS и eNOS в сетчатке показал:
· Межвозрастные
различия в уровнях мРНК генов NOS отсутствовали;
· уровень мРНК гена
iNOS в возрасте 3 и 18 месяцев у крыс OXYS ниже, чем у крыс Вистар;
· межлинейные
различия в уровнях мРНК гена nNOS в возрасте 3 месяцев отсутствовали, в 18
месяцев транскрипционная активность nNOS была выше у крыс OXYS;
· Различий в уровнях
мРНК гена eNOS в сетчатке крыс OXYS и Вистар не выявлено.
. В возрасте 3 месяцев содержание
белка iNOS в сетчатке крыс OXYS достоверно выше, чем у крыс Вистар.
. Различий в содержании стабильных
метаболитов - нитратов и нитритов - в сыворотке крыс Вистар и OXYS в возрасте 3
и 18 месяцев не обнаружено.
Список литературы
ген азот крыса
ретинопатия
1. Аветисова С.Э., Егорова Е.А., Мошетовой Л.К., Нероева В.В.,
Тахчиди Х.П. Офтальмология: национальное руководство. М.: ГЭОТАР - Медиа, 2008.
1017 с.
2. Колосова Н., Лебедев П., Фурсова А., Морозкова Т.,
Гусаревич О. Преждевременно стареющие крысы OXYS как модель сенильной катаракты
человека. // Успехи геронтологии. 2003. Т. 12.С. 143-148.
3. Осипов А.Н., Борисенко Г.Г., Владимиров Ю.А. Биологическая
роль нитрозильных комплексов гемопротеинов. // Успехи биол. химии. 2007. Т. 47.
С. 259-292.
4. Соловьева Н.А., Морозкова Т.С., Салганик Р.И. Получение
сублинии крыс с признаками наследственной галактоземии и исследование их
биохимических особенностей. // Генетика. 1975. Т.18. №5. С. 63-71.
5. Степанов Ю.М., Кононов И.Н., Журбина А.И. и др. Аргинин в
медицинской практике (обзор литературы). // Журн. АМН Украины. 2004. Т. 10.
Вып. 1. С. 340-352.
6. Adler A., Messina E., Sherman B. NAD(P) H oxidase-generated
superoxide anion accounts for reduced control of myocardial O2 consumption by
NO in old Fischer 344 rats. // Am. J. Physiol. Heart Circ. Physiol. 2003. V.
285. P. H1015 - H1022.
7. AldertonW. K., CooperC. E., KnowlesR. G. Nitric oxide
synthases: structure, function and inhibition. // Biochem. J. 2001. V. 357. P.
593-615.
8. Bhutto I.A., Baba T., Merges C., Scott McLeod D., Lutty
G.A. Low Nitric Oxide Synthases (NOS) in Eyes with Age-related Macular
Degeneration (AMD). // Exp. Eye Res. 2009. V. 90. P. 155-167.
9. Bhutto I., Lutty G. Understanding age-related macular
degeneration (AMD): Relationships between the photoreceptor/retinal pigment
epithelium/Bruch’s membrane/choriocapillaris complex. // Mol. Asp. Med. 2012.
V. 33. P. 295-317.
10. Bobko A.A., Sergeeva S.V., Bagryanskaya E.G., Markel A.L.,
Khramtsov V.V., Reznikov V.A., Kolosova N.G. 19F NMR measurements of NO
production in hypertensive ISIAH and OXYS rats. // Biochem. Biophys. Res.
Commun. 2005. V.330. P.367-370.
11. Bonilha V.L. Age and disease-related structural changes in
the retinal pigment epithelium. // Clin. Ophthalmol. 2008. V. 2. P. 413-424.
12. Brüne B., Zhou J.
Nitric oxide and superoxide: Interference with hypoxic signaling. //
Cardiovasc. Res. 2007.V. 75. P. 275-282.
13. Cau S.B., Carneiro F.S., Tostes R.C. (2012). Differential
modulation of nitric oxide synthases in aging: therapeutic opportunities. In:
Front. Physiol. DOI: 10.3389/fphys.2012.00218.
14. Cao S., Walker G.B., Wang X., Cui J.Z., Matsubara J.A.
Altered cytokine profiles of human retinal pigment epithelium: Oxidant injury
and replicative senescence. // Mol Vis. 2013. V. 19. P. 718-728.
15. Cernadas M.R., Sanchez de Miguel L., Garcia-Duran M.,
Gonzalez-Fernandez F., Millas I., Monton M., Rodrigo J., Rico L., Fernandez P.,
de Frutos T., Rodriguez-Feo J.A., Guerra J., Caramelo C., Casado S., Farre L.
Expression of constitutive and inducible nitric oxide synthases in the vascular
wall of young and aging rats. //Circ. Res. 1998. V.83. P. 279-286.
16. Challah M., Nadaud S., Philippe M., Battle T., Soubrier F.,
Corman B., Michel J.B. Circulating and cellular markers of endothelial
dysfunction with aging in rats. // Am. J. Physiol. 1997. V. 273 (Pt 2). P.
H1941-H1948.
17. Chen P.F., Wu K.K. Characterization of the roles of the
594-645 region in human endothelial nitricoxide synthase in regulating
calmoduling binding and electron transfer. // J. Biol. Chem.2000. V. 275. P.
55-63.
18. Chiou G.C. Review: effects of nitric oxide on eye diseases
and their treatment. // J. Ocul. Pharmacol. Ther. 2001. V.17. P. 189-198.
19. Chou T.C., Yen M.H., Li C.Y., Ding Y.A. Alterations of
nitric oxide synthase expression with aging and Hypertension in rats. //
Hypertension. 1998. V. 31. P. 643-648.
20. Chung H.Y., Sung B., Jung K.J., Zou Y., Y B.P. The
molecular inflammatory process in aging. // Antioxid. Redox. Signal. 2006. V.
8. P. 572-581.
21. Chung H.Y., Cesari M., Anton S., Marzetti E., Giovannini
S., Seo A.Y., Carter C., Yu B.P., Leeuwenburg C. Molecular inflammation:
Underpinnings of aging and age-related diseases. // Ageing Research Rev. 2009.
V. 8. P.18-30.
22. Corso-Díaz X, Krukoff
T.L. nNOS-alpha and nNOS - beta localization to aggresome-like inclusions is
dependent on HSP-90 activity. // J. Neurochem. 2010. V. 114. P. 864-887.
23. Csiszar A., Ungvari Z., Edwards J.G. Aging-induced
phenotypic changes and oxidative stress impair coronary arteriolar function. //
Circ. Res. 2002. V. 90. P. 1159-1166.
24. Csiszar A., Ungvari Z., Koller A., Edwards J.G., Kaley G.
Proinflammatory phenotype of coronary arteries promotes endothelial
apoptosis in aging. // Physiol. Genomics. 2004. V. 17. P. 21-30.
25. Csiszar A., Podlutsky A., Wolin M.S., Losonczy G., Pacher
P., Ungvari Z. Oxidative stress and accelerated vascular aging: implications
for cigarette smoking. // Front Biosci. 2009. V. 14. P. 3128-3144.
26. Culotta V.C., Klomp L.W., Strain J., Casareno R.L., Krems
B., Gitlin, J.D. The copper chaperone for superoxide dismutase. // J. Biol.
Chem. 1997. V. 272. P. 23469-23472.
27. Delp M.D., Behnke B.J., Spier S.A., Wu G., Muller-Delp J.M.
Aging diminishes endothelium-dependent vasodilatation and tetrahydrobiopterin
content in rat skeletal muscle arterioles. // J. Physiol. 2008. V. 586. P.
1161-1168.
28. Denis M. Interferon-gamma-treateated murine macrophages
inhibit growth of tuberclebacilli via the generation of reactive nitrogen
intermediates. // Cell Immunol. 1991. V. 132. P. 150-157.