Диагностика опухолей панкреато-дуоденальной зоны
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ
РЕСПУБЛИКИ БЕЛАРУСЬ
Учреждение образования «Гомельский
государственный медицинский университет»
Медико-диагностический факультет
Кафедра онкологии с курсом лучевой
диагностики и лучевой терапии
ДИПЛОМНАЯ РАБОТА
ДИАГНОСТИКА ОПУХОЛЕЙ
ПАНКРЕАТОДУОДЕНАЛЬНОЙ ЗОНЫ
Исполнитель
студент Д-607 группы Вежновец А. И.
Первый руководитель:
Доцент кафедры онкологии Михайлов И.
В.
Второй руководитель:
Зав. отд. лучевой диагностики ГУ
«ГОКОД»
Гопеенко М. Ф.
Гомель 2013
Содержание
Перечень условных обозначений
Введение
Глава 1. Описание методов и их сравнительная характеристика
1.1 Лабораторная диагностика
1.2 УЗИ
.3 Эндоскопические методы исследования
.4 лучевые методы исследования (МСКТ, МРТ, MRCP, ЧЧХГ,
ангиографическое исследование, рентгеновское исследование желудка и
двенадцатиперстной кишки, радиоизотопное исследование)
Глава 2. Описание объекта и методов исследования
.1 Научная новизна результатов исследования
.2 Практическая ценность результатов работы
.3 Объект и методы исследования
Глава 3. Результаты собственных исследований
.1 Анализ информативности клинических симптомов
.2 Анализ информативности УЗИ
.3 Анализ информативности МСКТ
.4 диагностический алгоритм при опухолях
панкреатодуоденальной зоны
Заключение
Библиографический список
ПЕРЕЧЕНЬ УСЛОВНЫХ ОБОЗНАЧЕНИЙ
ПДЗ - панкреатодуоденальная зона
ПЖ - поджелудочная железа
ДК- двенадцатиперстная кишка
БДС- большой дуоденальный сосок
УЗИ- ультразвуковое исследование
ФГДС- фиброгастродуоденоскопия
МРТ- магнитно- резонансная терапия
ЭРХПГ- эндоскопическая ретроградная холангио-панкреатография
ПДР- панкреатодуоденальная резекция
РПЖ- резекция поджелудочной железы
ЧЧДЖП- чрескожное чреспеченочное дренирование желчных протоков
ЧЧХГ- чрезкожная чрезпеченочная холангиография
ВЖП- внутренние желчевыводящие протоки
MRCP - магнитно-резонансная холангиография
ДПК - двенадцатиперстная кишка
МРХПГ - магнитно-резонансная холангиопанкреатикография
ВВЕДЕНИЕ
Опухоли органов панкреатодуоденальной зоны (ПДЗ) составляют 15% всех злокачественных
новообразований желудочно-кишечного тракта и имеют тенденцию к увеличению.
Среди органов панкреатодуоденальной зоны опухолью наиболее часто поражается
поджелудочная железа (ПЖ) - 63 - 86%. Причем более 60% новообразований
приходится на головку ПЖ [9, 17]. По данным J. Ahlyren (1996), раком ПЖ в мире
ежегодно заболевают около 185000 человек [20]. Статистика последних лет
свидетельствует о неуклонном росте заболеваемости и смертности от рака ПЖ. За
последние 50 лет в индустриально развитых странах (США, Великобритания)
заболеваемость выросла более чем в 3 раза и достигла уровня 9,0 на 100000
населения.
В России этот показатель равен 8,2 на 100000 населения. В структуре
онкологических заболеваний рак ПЖ Занимает 9-е место, а среди опухолей желудочно-кишечного
тракта находится на 3-м месте (после рака желудка и толстой кишки) [9]. Второй
по частоте опухолью ПДЗ (8 - 26%) является рак большого дуоденального соска
(БДС), который составляет 1,6 - 2,0% всех злокачественных новообразований [17].
Первичные злокачественные опухоли двенадцатиперстной кишки (ДК) встречаются
крайне редко (по данным разных авторов - 0,6 - 5,7% от опухолей ПДЗ) и
составляют 0,3% всех опухолей пищеварительного тракта [17].
Рак внепеченочных желчных протоков (включая опухоли дистального
отделахоледоха) составляет 1 - 3% всех злокачественных опухолей и 3 - 18%
новообразований органов ПДЗ. Раннее выявление опухолей ПДЗ является одним из
наиболее сложных вопросов лучевой диагностики. Правильная оценка всех
проявлений того или иного патологического процесса влияет на выбор тактики
лечения, а, следовательно, на непосредственные и отдаленные результаты [4].
На сегодняшний день единственным методом потенциально радикального
лечения злокачественных опухолей ПДЗ остается хирургия, при этом операбельность,
по разным данным, не превышает 15-17% [6, 12]. Операбельность определяется
главным образом отношением опухоли к расположенным рядом магистральным сосудам,
следовательно, на этапе обследования и выработки тактики лечения принципиальное
значение имеет информация, позволяющая судить о взаимоотношении опухоли с
прилежащими органами и магистральными сосудами: аортой, чревным стволом,
селезеночной и верхней брыжеечной артериями, верхней брыжеечной и воротной
венами. Клиническая значимость вовлечения вены отражена в классификациях
опухолей поджелудочной железы Японского панкреатологического общества и в
классификации по N.J. Lygidakys, в которых, кроме T, N и др. признаков, имеется
критерий V, отражающий степень инфильтрации (V 0, 1, 2, 3) либо сам факт
инфильтрации (V 0, 1) вены опухолью соответственно.
Богатое кровоснабжение органов данной зоны, близость магистральных
сосудов, густая сеть анастомозов между лимфатическими сосудами и узлами, наряду
с биологическими особенностями опухоли, способствуют раннему лимфогенному и
гематогенному метастазированию. Симптоматика на ранних стадиях мало специфична
и больные длительно наблюдаются у участковых терапевтов по поводу хронического
гастрита, панкреатита, холецистита и т.д. В ряде случаев на I-II стадиях заболевание,
протекая бессимптомно, выявляется как «случайная находка» при обследовании по
поводу другой патологии. Злокачественные опухоли ПДЗ на I стадии ограничены
самим органом и не распространяются на соседние структуры. При отсутствии
длительно текущего перифокального воспаления трудностей для ирургического
лечения, как правило, не возникает. В зависимости от локализации и
морфологической формы опухоли прогноз может быть относительно благоприятным. На
II стадии распространенность процесса несколько больше, включая прилежащие
структуры и органы, но, в отличие от стадии III, отсутствует поражение
лимфатических узлов.
Стадия заболевания имеет важное прогностическое значение и окончательно
устанавливается после планового патологоморфологического исследования.
Отсутствие отдаленных метастазов далеко не всегда означает возможность
выполнить операцию. Встречаются случаи, когда данные обследования указывают на
резектабельность опухоли, а при лапаротомии выясняется, что распространенность
иная и хирургическое пособие ограничивается биопсией. Пробная (диагностическая)
лапаротомия здоровья пациенту не прибавляет, но увеличивает риск летальных
осложнений у данного контингента больных. Поэтому, при подозрении на опухоль
ПДЗ необходимо комплексное обследование, включающее ультразвуковую компьютерную
томографию (УЗИ), фиброгастродуоденоскопию (ФГДС), мультиспиральную
компьютерную томографию (МСКТ) и/или магнитно-резонансную томографию (МРТ),
ангиографию, а при опухолях головки поджелудочной железы и дистального холедоха
- холангиографию и/или эндоскопическую ретроградную холангио-панкреатографию
(ЭРХПГ); биопсию опухоли с целью ее морфологической верификации; исследование
уровня опухолевых маркеров в крови. Первым шагом при обследовании является
собственно выявление опухоли, определение ее органопринадлежности и
морфологической формы. Далее исследуют распространенность процесса и степень
опухолевой инвазии в прилежащие сосуды и органы.
Опухоли органов панкреатодуоденальной зоны (ПДЗ)
составляют 15% всех злокачественных новообразований желудочно-кишечного тракта
и имеют тенденцию к увеличению. По данным Скипенко О.Г. с соавт. (2004)
смертность от рака ПДЗ за последние тридцать лет увеличилась в 10-12 раз.
Спектр новообразований ПДЗ достаточно широк, но наиболее часто встречающимся
является рак поджелудочной железы (ПЖ), ставший в последние десятилетия
лидирующим онкологическим заболеванием в большинстве индустриально развитых
стран, в том числе и в Беларуси. Статистика последних лет свидетельствует о
неуклонном росте заболеваемости и смертности от этой патологии. Второй по
частоте опухолью ПДЗ (8-26%) является рак большого дуоденального соска, который
составляет 1,6-2,0% всех злокачественных заболеваний. Первичные злокачественные
опухоли двенадцатиперстной кишки встречаются крайне редко (по данным разных
авторов 0,6-5,7% от опухолей ПДЗ) и составляют 0,3% всех злокачественных
опухолей пищеварительного тракта.
Раннее выявление опухолей ПДЗ является одним из
наиболее сложных вопросов лучевой диагностики. Правильная оценка всех проявлений
того или иного патологического процесса влияет на выбор тактики лечения, а,
следовательно, на непосредственные и отдаленные результаты.
Единственным методом радикального лечения опухолей
органов ПДЗ был и остается хирургический. Ввиду значительного снижения
показателя хирургической смертности, показания к радикальной
панкреатодуоденальной резекции (ПДР) при раке ПЖ за последние годы расширились.
Однако, согласно данным реестров, только менее 20% рака ПЖ подлежат
хирургической резекции. Причины нерезектабельности включают невыявленные
метастазы в печень, сосудистую инвазию, метастазы в лимфатические узлы и
карциноматоз брюшины. Поэтому, главная цель предоперационной визуализации-
определить наличие потенциально резектабельной или явно нерезектабельной
опухоли и, таким образом, выбрать оптимальное лечение для каждого пациента.
Для предоперационного стадирования рака ПЖ были
предложены различные методы, однако консенсус относительно лучшего алгоритма
использования методик визуализации не достигнут.
Подробную информацию о состоянии органов ПДЗ, в том
числе о распространении опухолевого поражения, позволяет получить многослойная
спиральная компьютерная томография (МСКТ), в последние годы становящаяся все
более доступной для широкого клинического применения в связи с увеличением
парка аппаратуры в стране. Зарубежный опыт использования многослойных
спиральных компьютерных томографов насчитывает более двух десятилетий, однако
данные доступной литературы сильно различаются в плане методики проведения
исследования, а также порядка постпроцессорной обработки изображений.
Таким образом, остается нерешенным вопрос методики
обследования пациентов с подозрением на опухолевый процесс ПЖ и других органов
ПДЗ при многослойной спиральной компьютерной томографии (МСКТ), о ценности
постпроцессорной обработки аксиальных изображений для планирования дальнейшей
тактики ведения пациентов. Нуждается в уточнении лучевая семиотика и признаки
резектабельности опухолей ПДЗ, а также значимость междисциплинарного подхода к
анализу данных МСКТ и виртуального планирования оперативного вмешательства.
Цель исследования. Изучить методы диагностики опухолей панкреатодуоденальной
зоны и разработать диагностический алгоритм.
Задачи исследования:
1. Изучить информативность лабораторных методов диагностики опухолей
панкреато-дуоденальной зоны.
2. Изучить информативность УЗИ.
3. Изучить информативность эндоскопических методов исследования.
. Изучить информативность компьютерной томографии и
магнитно-резонансной томографии.
. Разработать диагностический алгоритм при опухолях
панкреато-дуоденальной зоны.
глава 1.
ОБЗОР ЛИТЕРАТУРЫ:
описание методов диагностики опухолей
ПДЗ и их сравнительная характеристика
В комплекс диагностических мероприятий при дифференциальной диагностике
опухолей головки ПЖ сегодня обязательно входит определение уровня опухолевого
маркера СА 19L9 радиоиммунным методом. Многократное увеличение уровня
этого маркера в крови - в 60-85% случаев достоверно свидетельствует о развитии
рака ПЖ [23].
Открытие гликопротеина муцинового типа - сиалированного антигена Льюиса
(Sialosyl Lewis Antigen), молекулярной массой 500 кДа, ассоциированного с
опухолями поджелудочной железы, желудка, печени, толстой и прямой кишки, было
оперативно использовано для создания нового теста для лабораторной диагностики
рака. Количественное определение этого онкофетального маркёра (шифр СА 19-9) в
сыворотке или плазме крови в настоящее время применяют главным образом для
диагностики РПЖ, реже - злокачественных новообразований желудка, прямой кишки и
желчного пузыря [2, 20].
Как и все известные онкофетальные маркёры, СА 19-9 присутствует в
организме плода. У взрослого человека его продукция осуществляется в основном
эпителиальными клетками пищеварительного тракта и в минимальных количествах
клетками бронхов. Установлено, что наработка СА 19-9 зависит от группы крови.
Так, у людей с редко встречающейся группой Lewis (a-/b-) этот опухолевый маркёр
не вырабатывается [2]. По данным наших исследований, количество лиц с
"нулевыми" значениями СА 19-9 составляет 6,8% (34 человека из 501
обследованных).
Выведение СА 19-9 из организма происходит исключительно с желчью, поэтому
его концентрация зависит от проходимости желчных путей человека. В частности,
механическая желтуха, обусловленная внепеченочным холестазом, часто вызывает
резкое повышение его уровня. У здорового человека с нормальным содержанием
билирубина концентрация СА 19-9 в сыворотке крови может составлять от 0 до
30-37 Ед/мл. При повышенном содержании билирубина или щелочной фосфатазы его
уровень может возрасти до 100 Ед/мл.
Из опубликованных к настоящему времени данных исследований следует, что у
больных РПЖ содержание СА 19-9 превышает нормативные значения в 80% случаев
[3]. При этом его концентрация в сыворотке крови может быть более чем в 7 раз
больше нормы [7]. Следует отметить, что уровень СА 19-9 повышен у 12% пациентов
с доброкачественными опухолями поджелудочной железы, однако его максимальная
концентрация, как правило, не превышает 45 Ед/мл.
В современной онкологии количественное определение СА 19-9 применяют для
диагностики РПЖ, раннего обнаружения метастазирования опухоли, а также для
мониторинга лечения (как хирургического, так и паллиативного) и оценки его
эффективности. Показано, что измерение сывороточного СА 19-9 у больных с
оперированным РПЖ позволило своевременно провести им адъювантную радио- и/или
химиотерапию. Выживаемость этой группы пациентов составила более 7 месяцев
[18].
При исследовании СА 19-9 в динамике необходимо учитывать то, что
биологический период его полужизни составляет 5 суток. Поэтому результат
повторного определения маркёра у пациента через относительно короткий
промежуток времени (менее месяца) может не соответствовать наблюдаемой у него
клинической картине ремиссии [27].
1.2 УЗИ
УЗИ позволяет определить наличие опухолевого узла более 2 см, его
локализацию, форму, размеры, контур, структуру и распространенность на
прилежащие органы. УЗИ дает возможность исследования уровня васкуляризации
опухолевых образований поджелудочной железы с применением режима
энергетического цветового допплеровского картирования и оценить взаимоотношение
с магистральными сосудами, используя различные режимы допплерографии. Важным
признаком злокачественной опухоли ПЖ является наличие неоднородного
гипоэхогенного образования (на фоне гиперэхогенной интактной ткани) с неровными
контурами. В структуре опухоли иногда определяются немногочисленные
гиперэхогенные включения. При поражении головки ПЖ может наблюдаться расширение
вирсунгова протока. В ряде случаев наблюдается расширение общего желчного
протока с одновременным расширением внутрипеченочных желчных протоков,
увеличение размеров желчного пузыря. Расширение общего желчного протока и
вирсунгова протока указывает на сдавление или прорастание ампулы БДС [16].
Важное значение имеет УЗИ для определения распространенности опухоли ПЖ
на прилежащие магистральные сосуды. Верхняя брыжеечная артерия, чревный ствол и
его ветви вовлекаются в процесс, как правило, на поздних стадиях заболевания.
Об отсутствии экстравазальной компрессии в артериях судят по неизмененному
спектру допплеровского сдвига частот, нормальному диапазону величины линейной
скорости кровотока. Наличие гемодинамически значимого сдавления или прорастания
артерий диагностируется на основании локального изменения кровотока,
приобретающего турбулентный или пропульсивный характер и отличающегося
увеличенной скоростью и изменением интенсивности окрашивания в просвете артерий
[13]. По данным Г.Т. Синюковой (2003), чувствительность УЗИ при оценке
распространенности опухоли на селезеночную вену превосходит даже ангиографию
(85,7% против 71,4% соответственно).
Кроме того, УЗИ дает возможность выявить зону опухоли, оптимальную для
забора аспирационного материала в ходе пункционной цитобиопсии.
Последнее исследование выполняется, как правило, под местной анестезией иглой
20, 22G. Точность верификации достигает 92-98% [1, 26]. Г.Т. Синюкова с соавт.
(2003) изучили распространение опухоли ПЖ на следующие сосуды: селезеночную
артерию, селезеночную вену, печеночную артерию, чревный ствол, верхнюю
брыжеечную вену, воротную вену. В ходе исследования учитывали прилежание
опухоли, сдавление, инфильтрацию стенки, а также прорастание в просвет сосуда
[13].
По данным исследования определено, что максимальная точность
ультразвукового метода при оценке состояния печеночной артерии составила 92,6%;
селезеночной артерии, селезеночной вены, чревного ствола - 88,9%;
верхней брыжеечной вены и воротной вены - 85,2%. Эти показатели в ряде
случаев приближаются к точности при ангиографическом исследовании, но уступают
последнему в специфичности и чувствительности. Ряд вопросов относительно
распространенности опухолевого процесса не всегда удается решить на
дооперационном этапе. В этом случае имеется возможность
применения интраоперационной УЗИ. Выделяют следующие показаниями для
этого вида исследования: определение истинных границ опухоли, ее эхо-структуры;
выявление небольших узлов, не визуализируемых при трансабдоминальном
сканировании; уточнение отношения опухоли к прилежащим сосудам; поиск и обнаружение
метастазов в регионарных лимфатических узлах; УЗИ наведение при
интраоперационной пункционной биопсии и другие [16].
Еще одна возможность ультразвукового исследования - это эндоскопическая
УЗИ, которая позволяет визуализировать опухоль более 5 мм в диаметре. Данный
метод применяется для определения отношения опухоли головки ПЖ к общему
желчному протоку; уточнения распространенности рака БДС на стенку
двенадцатиперстной кишки, общего желчного протока и ткань головки ПЖ.
1.3 Эндоскопические методы исследования (ФГДС и ЭРПХГ)
ФГДС - это следующий этап обследования больных с подозрением на опухоль ПДЗ.
При новообразованиях двенадцатиперстной кишки и большого дуоденального соска
данный метод позволяет не только оценить форму, размеры, направленность роста,
но и произвести прицельную биопсию под визуальным контролем. Морфологическое
исследование биоптата в ряде случаев дает дополнительную информацию при
дифференциальной диагностике опухоли ДК и врастания опухоли головки ПЖ в стенку
ДК. При поражениях кишки, обусловленных раком ПЖ, морфологически чаще
обнаруживаются изменения воспалительного характера, а при опухолях БДС или
двенадцатиперстной кишки биопсия подтверждает наличие опухоли [16].
При раке головки ПЖ и дистального холедоха в ходе дуоденоскопии определяется
компрессия ДК извне либо прорастание опухолью стенки двенадцатиперстной кишки.
Кишка при этом резко деформирована, в ее просвете определяется плотная,
бугристая, легко кровоточащая опухоль. На неизмененной слизистой оболочке ДК
могут наблюдаться обширные плоские ригидные язвы. В участках, сдавленных
опухолью перистальтическая волна не прослеживается. Деформацию кишки может быть
значительно выражена вплоть до того, что отсутствует возможность проведения
эндоскопа в нисходящий отдел двенадцатиперстной кишки. Довольно часто
описывается картина эрозивно-геморрагического эзофагита и гастрита, особенно
при нарушении эвакуации содержимого желудка из-за сужения просвета
двенадцатиперстной кишки. Рак двенадцатиперстной кишки - крайне редкое
заболевание. Дифференциальная диагностика первичной злокачественной опухоли ДК
от прорастания ее стенки опухолью головки ПЖ при эндоскопическом исследовании,
как правило, затруднительна. Одной из характерных особенностей истинных
опухолей ДК является их рост по окружности кишки. Слизистая оболочка бугристая,
ригидная, с изъязвлениями неправильной формы. Кроме того, опухоли ДК лишь при
обширном поражении могут явиться причиной механической желтухи.
Важным дифференциально-диагностическим признаком прорастания опухолью ПЖ
стенки двенадцатиперстной кишки может служить то, что при поражении кишки БДС
остается интактным, хотя продольная складка кишки может быть вовлечена в
патологический процесс.
ЭРПХГ является дополнительным методом диагностики, позволяющим в ряде случаев
проводить дифференциальный диагноз между опухолевым и воспалительным процессом
в головке ПЖ, а также между опухолью дистального отдела холедоха и головки ПЖ.
Выделяют три основных типа изменений на ретроградных панкреатикограммах при
раке ПЖ. Это обтурация главного ППЖ; стенозирование протока; неровность
контуров ППЖ [29]. Современные эдоскопические технологии позволяют также
производить предоперационную билиарную декомпрессию в виде
папиллосфинктеротомии при опухолях БДС и ретроградное дренирование холедоха при
раке его дистального отдела либо раке головки ПЖ.
1.4 Лучевые методы исследования
(МСКТ, МРТ, MRCP, ЧЧХГ, ангиографическое исследование, рентгеновское
исследование желудка и двенадцатиперстной кишки, радиоизотопное исследование)
Компьютерная томография ПДЗ (КТ) (спиральная и мультиспиральная)
считается одним из наиболее информативных методов диагностики и
дифференциальной диагностики опухолей ПДЗ[18, 25, 29, 33, 34] и, как правило,
используется как уточняющий метод (после УЗИ) для выявления связи новообразования
с прилежащими сосудами и органами. С помощью КТ удается достаточно подробно
оценитьсостояние внепеченочных желчных протоков, двенадцатиперстной кишки,
поджелудочной железы, перипанкреатической жировой клетчатки и регионарных
лимфатических узлов [4]. Рак ПЖ, по данным КТ, чаще всего характеризуется
локальным увеличением, нечеткостью контуров и деформацией пораженного участка
железы, негомогенностью его структуры, а также инфильтрацией
перипанкреатической клетчатки, сосудов и стенки двенадцатиперстной кишки.
Опухолевая ткань, как правило, пониженной плотности по шкале Хаунсфилда.
Косвенными признаками служат расширение желчных ротоков, увеличение желчного
пузыря и забрюшинных лимфатических узлов, наличие асцита и метастазов в печени
[3, 7, 18]. КТ, особенно с внутривенным контрастированием, при шаге 5 мм
точнее, чем УЗИ, позволяет выявлять опухолевое поражение ПЖ и корректнее
стадировать заболевание [4].
КТ имеет два преимущества в определении прорастания сосудов - это
определение циркулярного сужения при контрастировании и возможность построения
трехмерной реконструкции, позволяющей наглядно передать соотношение
патологического очага с прилежащими сосудами [4,15]. Традиционными критериями
нерезектабельности опухолей ПЖ в КТ-изображении считаются массивная опухолевая
инвазия венозных сосудов (соприкосновение опухоли более чем с 1/2 окружности
верхней брыжеечной вены и воротной вены), опухолевая инфильтрация с тромбозом
или облитерацией просвета сосуда, артериальная инвазия, наличие
метастатического поражения печени, брюшины, отдаленных лимфатических узлов (не
парапанкреатических), прорастание опухоли в соседние органы [24, 25, 33]. В то
же время, венозная инвазия без тромбоза и/или облитерации просвета со суда, по
мнению некоторых авторов, не является абсолютным противопоказанием к резекции
опухоли [25], равно как и инвазия селезеночной вены, артерии и селезенки [35].
По литературным данным, точность метода РКТ в оценке резектабельности опухолей
ПЖ составляет 89-100% [24, 28, 30, 32]. Еще одним преимуществом КТ (в
частности, перед УЗИ и МРТ) является возможность наилучшей оценки опухолевой
инвазии двенадцатиперстной кишки.
С этой целью используется пероральное введение водорастворимого
контрастного вещества для визуализации просвета кишки, а также сканирование
интересующей области с меньшим шагом, позволяющее получить большую разрешающую
способность при изучении кишечной стенки [32]. В сочетании с УЗИ, КТ повышает
точность диагностики опухолей ПЖ с 80 до 90% [4]. Однако ни КТ, ни УЗИ обычно
не позволяют обнаруживать узловые образования ПЖ менее 1,5 см, т.е. когда
отсутствуют изменения ее формы и контуров. Дополнительную информацию в этих
случаях может дать только метод магнитно-резонансной томографии (МРТ).
Показаниями для МРТ ПЖ являются локальное увеличение ПЖ, выявляемое при УЗИ или
КТ (с однородной структурой этого участка), биохимически предполагаемая
островковоклеточная опухоль без видимых достоверных изменений при КТ, спорные
случаи, когда необходимо провести дифференциальную диагностику между опухолевым
и воспалительным характером изменений [4]. Кроме того, возможности МРТ выше
соответствующих возможностей УЗИ и КТ в выявлении метастатического поражения
печени и брюшины [4, 31].
Типичными МРТ проявлениями рака ПЖ можно считать: узловое образование с
нечеткими контурами, гипоинтенсивное в Т1 и Т2 (в Т2 возможно наличие зоны
повышенной интенсивности МР-сигнала в центральных отделах опухоли). Причем,
единственным достоверным дифференциально-диагностическим признаком опухолевого
процесса является симптом неравномерного «кольцевого» или «лучистого»
усиления по периферии опухоли в артериальную фазу контрастирования
(чувствительность 98%, специфичность 93%) [4]. Характерную картину имеют также
апудомы и метастатические опухоли: данные образования гипоинтенсивны в Т1,
умеренно гиперинтенсивны в Т2 и однородно контрастируются в артериальную фазу
исследования [4,32].
Первичная лимфома ПЖ является редкой опухолью, однако каждый радиолог
должен быть знаком с МР-отображением лимфом, поскольку прогноз и дальнейшее
лечение пациентов с этим заболеванием в корне отличается от больных раком ПЖ
[29]. При диффузно-инфильтративном типе опухоль гипоинтенсивна в Т1 и Т2, при
узловом типе, как правило, гипоинтенсивна в Т1 и неоднородно гиперинтенсивна в
Т2. После внутривенного контрастирования визуализируется слабое гомогенное
усиление опухоли [29]. Кальцинация и некроз - надежный признак исключения
лимфомы [29]. Опухоль может «окутывать» верхнюю брыжеечную артерию, а также, в
ряде случаев, вызывать стеноз или окклюзию верхней брыжеечной, селезеночной и
воротной вен.
Выявляемое при МРТ взаимоотношение опухоли ПЖ с прилежащими
магистральными сосудами обеспечивает правильное определение степени их
взаимосвязи (в среднем - в 90%), что позволяет прогнозировать степень сложности
планируемых оперативных вмешательств и, в большинстве случаев, избегать пробных
лапаротомий [4]. Опухоли периампулярной области (БДС и дистального отдела
общего желчного протока) имеют сходную картину и практически не различимы между
собой. В Т1FS периампулярные опухоли имеют пониженную интенсивность МР-сигнала.
Однако, в ряде случаев, присутствие хронического воспаления ПЖ (обусловленного
наличием обструкции ОЖП и панкреатического протока), проявляющегося снижением
интенсивности МР-сигнала ПЖ, может затруднять визуализацию опухолевых узлов.
Поэтому, для их выявления, следует применять внутривенное контрастное
«усиление», при котором гиповаскулярные периампулярные опухоли, как правило,
отчетливо проявляются на фоне более гиперваскулярных тканей поджелудочной железы
[34]. У пациентов с подозрением на билиарную обструкцию опухолевого генеза
также целесообразно выполнять магнитно-резонансную холангиографию (MRCP) [34].
Следует также отметить, что сочетанное использование нативного исследования
(T1FS), внутривенного контрастирования и МRСР дает наиболее исчерпывающую
диагностическую информацию относительно опухолей периампулярной области.
Особенности анатомии панкреатодуоденальной зоны, а именно тот факт, что
терминальный отдел холедоха сначала прилежит к головке поджелудочной железы, а
затем прободает ее и, соединяясь с протоком поджелудочной железы, впадает в
печеночно-поджелудочную ампулу - объясняют причину частого развития
механической желтухи при опухолях фатерова соска, головки поджелудочной железы,
дистального отдела холедоха. При опухолях ПДЗ механическая желтуха встречается,
по данным разных авторов, от 75% до 95%, в зависимости от локализации
опухолевого процесса [2,37,32]. Для купирования желтухи используют различные
способы, но методом выбора считается чрескожное чреспеченочное дренирование
желчных протоков (ЧЧДЖП), которое позволяет одновременно решить две задачи:
лечебную (производится собственно декомпрессия)
диагностическую [выполняется чрескожная чреспеченочная холангиография
(ЧЧХГ), при которой уточняется характер и уровень обтурации; осуществляется
биопсия на уровне блока через холангиостомический канал] [6,9]. Наиболее
характерным рентгенологическим признаком является наличие полного блока и
конической или полукруглой культи с неровными, нечеткими контурами.
Однако рентгенологическая картина при опухолевой желтухе весьма вариабельна и
завсит от первичной локализации опухоли, распространения опухоли по протокам,
выраженности воспалительной инфильтрации, наличия или отсутствия метастазов в
воротах печени и др. [19].
При раке поджелудочной железы преобладает полный блок желчных протоков.
Форма культи и уровень блока чрезвычайно вариабельны. Длина ракового канала у
больных с неполным блоком примерно 25 мм. Достаточно часто инфильтрация
распространяется выше уровня пузырного протока. При опухолях поджелудочной
железы блок желчных протоков чаще встречается на уровне L-1 [5,8]. Для рака
большого дуоденального соска наиболее характерно наличие конической культи с
нечетким контуром и блока желчных протоков на уровне L-III. Протяженность
ракового канала у больных с неполной обтурацией протоков составляет в среднем
18 мм. Раковая инфильтрация не распространяется на внутрипеченочные протоки.
При раке общего желчного протока чаще встречается полный блок, на уровне
L-II. Форма культи отмечается значительной вариабельностью. У больных с
неполным блоком длина ракового канала в среднем 42 мм. Раковая инфильтрация не
распространяется на внутрипеченочные протоки.
Форма, контуры, протяженность культи, характер блока и протяженность
ракового канала не являются специфичными рентгенологическими признаками в
определении первичной локализации опухолей [8,10,33].
Наиболее информативными в диагностике уровня блока магистральных желчных
протоков являются ЧЧХГ и ЭРПХГ, при которых точный топический диагноз
установлен в 97% (при КТ - 69%, УЗИ - 47%). Правильная оценка резектабельности
опухоли по данным КТ составила 54%, УЗИ - 50%, ЧЧХГ и ЭРПХГ - 58% [14]. Уровень
блока желчных протоков при опухолях также не является постоянным, что объясняется
вариабельностью расположения большого дуоденального соска; смещением органов
при дыхательных движениях; низким расположением фатерова сосочка при
спланхноптозе. Точность заключений при холангиографическом исследовании
колеблется от 37% до 96 %, что зависит от многообразия заболеваний, вызывающих
обструкцию желчных протоков, отсутствия патогномоничных рентгенологических
признаков.
Увеличение точности диагностики возможно при сочетании холангиографии с
рентгенографическим исследованием двенадцатиперстной кишки или выполнением
повторной отсроченной холангиографии (после чрескожного дренирования желчных
протоков при механической желтухе). В первом случае точность диагностики
возрастает до 95,9%. При повторных холангиографических исследованиях точность
диагностики повышается в 1-е сутки до - 76,4 %, на 3-и - до 88,3 %, на 5-е - до
94,7 %, на 7-е - до 92,6 % [11]. Такие результаты обусловлены уменьшением
воспалительного отека стенок желчных протоков после их дренирования;
недостаточно тугим заполнением протоков контрастным веществом до их
дренирования; плохим перемешиванием контрастного вещества и желчи; наличием
гнойных масс, хлопьев или замазки до дренирования протоков.
Ангиографическое исследование играет ключевую роль в оценке степени
распространенности и вовлечения в опухолевый процесс магистральных артериальных
и венозных сосудов. Обычно производится целиакография и верхняя
мезентерикография, в ряде случаев дополняемые суперселективной артериографией.
В ходе исследования обязательным условием является получение возвратных сплено-
и мезентерикопортограмм [19,22].
Рак поджелудочной железы сопровождается различными изменениями внутри- и
внеорганных сосудов, визуализируемыми в ходе ангиографии. Это:
патологические сосуды в зоне опухоли;
опухолевая инфильтрация артерий (симптомы «узурации», «культи»);
смещение артерий;
увеличение пораженной части поджелудочной железы;
аваскулярные зоны;
гиперваскуляризация тела и хвоста железы.
Кроме того, ангиографическое исследование позволяет определить
анатомические варианты кровоснабжения, что необходимо для планируемой операции
[22].
Информативность ангиографии меняется в зависимости от размеров
новообразования. Было установлено, что при размерах опухолевого узла до 5 см
(когда эпителиальные злокачественные опухоли еще могут быть операбельны)
диагностические возможности равнялись 55%. При опухолях 5-10 см - 73%, а при
размерах опухоли более 10 см - 87% [22]. Reuter (1969) считает, что
приблизительно в половине случаев при хроническом панкреатите имеются различные
изменения артерий поджелудочной железы, которые трудно отличить от
атеросклеротических изменений и опухолевой инфильтрации. Авторы по-разному
оценивают клинико-рентгенологические признаки. A. Nakao и соавт. [31, 32]
выделяют 4 типа инвазии сосуда опухолью по данным ангиографии (возвратная
мезентерикопортография и целиакопортография):
А - не измененная ангиограмма;
В - одностороннее сужение вены;
С - двустороннее сужение вены;- стеноз, обструкция с наличием
коллатеральных вен.
Авторы выявили корреляцию между ангиографическим типированием и
морфологическим исследование у больных раком головки поджелудочной железы.
Никаких признаков инвазии в воротную или верхнюю брыжеечную вены в ходе
патологоанатомического исследования не было выявлено при рентгенологическом
типе А. При типе В - в 20% случаев имелась инвазия, при типе С - в 70% случаев,
при типе D - в 92%. Ангиографическая классификация опухолевой инвазии воротной
и верхней брыжеечной вены очень проста и коррелирует с морфологической
классификаций опухолевой инвазии. Инвазия опухоли в стенку воротной и верхней
брыжеечной вены влияет на прогноз. Таким образом, ангиографическая
классификация инвазии стенки воротной и верхней брыжеечной вены является
наиболее доступным и практичным показателем при хирургическом лечении местнораспространенного
рака поджелудочной железы. Данная закономерность позволяет более точно
спрогнозировать объем возможного оперативного вмешательства [22].
С другой стороны, некоторые авторы считают, что любая деформация сосудов
в зоне опухоли, как минимум, инвазия адвентиции сосуда [21]. Точность
диагностики поражения крупных сосудов при ангиографии достигает 96%, в то время
как при КТ - 9,4%. По данным С.Г. Калядина [8], существует зависимость между
прорастанием опухолью желудочно-двенадцатиперстной артерии и прорастанием
опухоли в верхние
брыжеечные сосуды. Данное сочетание выявлено в 94,1% случаев при
выполнении селективной АГ и/или портографии и подтверждено на операции [8].
Рентгеновское исследование желудка и двенадцатиперстной кишки
не является приоритетным
при обследовании пациента с подозрением на опухоль ПДЗ, но может в ряде
случаев, дополнить общую клинико-диагностическую картину. При опухолях головки
ПЖ и двенадцатиперстной кишки в зависимости от степени и характера
патологического процесса выявляются некоторые рентгенологические симптомы
поражения желудка и двенадцатиперстной кишки. Однако специфические
рентгенологические симптомы отсутствуют. Опухоль, не прорастающая
двенадцатиперстную кишку, а поддавливающая ее стенки извне, создает компрессию
складок слизистой оболочки, что проявляется в виде различной интенсивности тени
компрессионных и неизмененных складок слизистой оболочки - «симптом полутени».
При малой степени инвазии опухолью стенки двенадцатиперстной кишки, на
определенном участке медиального контура кишки выявляется сглаженность
киркринговых складок, выпрямленность контура, ригидность стенки.
При более глубокой инвазии может наблюдаться и «признак Фростберга» -
деформация контура нисходящей части двенадцатиперстной кишки в виде зеркально
отраженной цифры 3. В результате инфильтрации стенки двенадцатиперстной кишки
изменению подвергается как медиальный, так и латеральный ее контур. На
рентгенограммах это выявляется в виде циркулярного дефекта наполнения,
суживающего на ограниченном участке просвет двенадцатиперстной кишки.
При более обширной инфильтрации контуры кишки становятся изъеденными,
фестончатыми, определяются длительный стаз контрастной массы в различных
отделах ее либо ускоренное опорожнение, маятникообразная перистальтика, чередование
спазмов и парезов различных отделов двенадцатиперстной кишки. Может наблюдаться
спазм нисходящей части кишки с явлениями бульбостаза. Складки слизистой
оболочки двенадцатиперстной кишки отечны, неравномерно утолщены, в просвете
кишки определяется слизь [16].
Радиоизотопное исследование с октреосканом (3-октреотид - аналог
соматостатина с определяемой радиоактивностью) применяется при диагностике
нейроэндокринных опухолей ПЖ. Октреоскан соединяется с рецепторами
соматостатина и позволяет достаточно точно обнаружить опухоль ПЖ [35].
Дополнительную информацию по уточнению диагноза, оценке стадии и операбельности
опухоли при диагностике опухолей ПДЗ в ряде случаев может дать
видеолапароскопическое исследование, которое позволяет выполнить оментобурсоскопию
и лапароскопическую УЗИ [16,27].
опухоль диагностика панкреато дуоденальная
ГЛАВА 2. Объект и
методы исследования
.1 Клинический материал
Работа основана на результатах обследования 72 пациентов обоих полов в
возрасте от 34 до 78 лет (средний возраст 58.9± 0.91), 10 из которых составили
контрольную группу, сформированную из лиц с отсутствием патологических
изменений в органах панкреатодуоденальной зоны для верификации качества
изображений при исследовании по предложенной методике, 62 пациентов с патологией
ПДЗ были направлены на МСКТ после ультразвукового и клинико-лабораторного
обследования с подозрением на наличие опухоли поджелудочной железы. Всего,
учитывая контрольные, проведено 72 исследований.
.2 Методы диагностики
Методика УЗИ. Исследование проводилось натощак или по прошествии 6-7
часов с момента последнего приема пищи. Пациентам с повышенным газообразованием
накануне исследования были назначены энтеросорбенты. При УЗИ органов брюшной
полости оценивают печень, желчный пузырь, поджелудочную железу,
двенадцатиперстную кишку, селезенку, забрюшинное пространство, лимфатические
узлы и крупные сосуды. Оценивались размеры органов, их внутреннюю структуру,
расположение, наличие дополнительных образований, воспалительных изменений и
очагов.
Методика МСКТ. МСКТ включала нативное сканирование после перорального
заполнения желудка и двенадцатиперстной кишки водой, и сканирование органов
брюшной полости и забрюшинного пространства в артериальную и портальную фазы
после внутривенного болюсного контрастирования йодосодержащими препаратами.
Контрастное вещество с концентрацией йода не менее 350 мг\мл вводили с помощью
инъектора со скоростью 3,5 или 4,5 мл\сек. Необходимое и достаточное количество
контрастного препарата было не менее 100 мл из расчета 1-1,5 мл на 1 кг веса
пациента. Сканирование в артериальную фазу проводили на 30 секунде, а
сканирование в портальную фазу - на 65-75 секундах после начала введения
контрастного препарата. Постпроцессорная обработка включала построение объемных
и многоплоскостных реформаций на основе изображений обеих фаз постконтрастного
сканирования. Разработанный подход является универсальным и позволяет получать
необходимую информацию как об образованиях поджелудочной железы, так и о
внеорганных поражениях ПДЗ. При этом не имеет значения количество линеек
детекторов используемого многослойного спирального компьютерного томографа, так
как предложенные параметры подходят для сканирования на томографах и с 4 и с 40
рядами детекторов.
2.3 Оперативные вмешательства
Оперативные вмешательства были показаны 48 пациентам из 62 с патологией
ПДЗ. Удельный вес радикальных операций составил 87%. Наиболее частым видом
оперативного вмешательства явилась панкреатодуоденальная резекция (53%). Данные
об оперативных вмешательствах были обработаны и сведены в таблицу 1.
Таблица 1- Виды хирургических вмешательств у обследованных пациентов (n=48)
|
Вид оперативного
вмешательства
|
Количество
|
|
n=48
|
|
Радикальные операции(n=41)
|
ПДР
|
25
|
53
|
|
Дистальная резекция ПЖ
|
12
|
25
|
|
Энуклеация опухоли (ГИСТ)
|
4
|
9
|
|
Паллиативные операции (n=6)
|
Холецистоеюностомия,
гастроэнтеростомия
|
1
|
2
|
|
Холецистоеюностомия
|
5
|
11
|
|
Эксплоративная лапаротомия
с биопсией
|
1
|
|
Всего
|
48
|
2.4 Статистическая обработка материала
База данных и статистическая обработка материала. Полученные в процессе
исследования данные обрабатывались на персональном компьютере c помощью программной системы STATISTICA 6.0 for Windows.
Критерием статистической достоверности получаемых выводов мы считали
общепринятую в медицине величину р<0,05.
ГЛАВА 3. Результаты
собственных исследований
.1 Анализ информативности клинических симптомов
Жалобы пациентов преимущественно заключались в проявлениях диспепсии,
снижении массы тела, болях в эпигастрии, а также с иррадиацией в спину, в
симптомах механической желтухи. Частота симптомов представлена в таблице 1.
Наиболее частым клиническим симптомом являлась диспепсия, она проявлялась у
95.1 % пациентов основной группы.
Наиболее редкими отмечались жалобы на боли в спине, они беспокоили лишь
27.4% больных.
Таблица 1- Клинические симптомы у пациентов основной группы (n=62)
|
Клинические симптомы
|
Количество пациентов
|
|
n=62
|
%
|
|
Снижение массы тела
|
35
|
56.4
|
|
Диспепсия
|
59
|
95.1
|
|
Боли в эпигастрии
|
31
|
50
|
|
Боли в спине
|
17
|
27.4
|
|
Механическая желтуха
|
26
|
41.9
|
При анализе симптомов, явившихся поводом для обращения к врачу, получена
следующая картина (рисунок 1). Как и в общей структуре клинических проявлений,
лидировали диспепсия, снижение массы тела и механическая желтуха. Болевой
синдром явился причиной лишь 28% обращений за помощью.
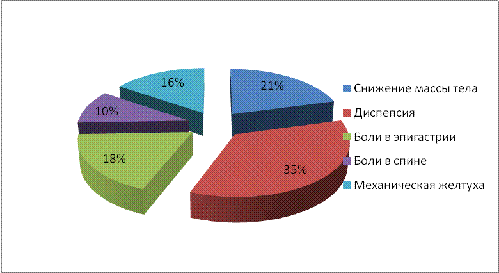
Рисунок
1- Клинические симптомы, послужившие основным поводом для обращения за
медицинской помощью, у пациентов основной группы (n=62)
3.2 Анализ информативности УЗИ
Всем пациентам с патологией панкреатодуоденальной системы было выполнено
УЗИ органов брюшной полости и забрюшинного пространства. Данные представлены в
таблице 3.
Таблица 3- Распределение патологических изменений органов ПДЗ в группе
обследованных (n=62)
|
Патологические изменения
панкреатодуоденальной зоны
|
число пациентов
|
|
n= 62
|
%
|
|
Опухоль головки
поджелудочной железы
|
27
|
43.5
|
|
Опухоль тела поджелудочной
железы
|
7
|
11.2
|
|
Опухоль хвоста
поджелудочной железы
|
7
|
11.2
|
|
Мультифокальная опухоль
поджелудочной железы
|
2
|
3.2
|
5
|
8.3
|
|
Лимфоаденопатия без
поражения ПЖ
|
6
|
9.6
|
|
Отсутствие патологических
изменений по данным УЗИ
|
8
|
13.0
|
По данным ультразвукового исследования проведенного 62 пациентам, более
69% патологических изменений панкреатодуоденальной зоны составляют опухоли
поджелудочной железы. Поражение головки поджелудочной железы наблюдается в
более чем половине случаев. Чувствительность УЗИ составляет 87%, специфичность
- 59.7%. Высокая чувствительность метода, его доступность и отсутствие лучевой
нагрузки являются критериями для утверждения данного метода в качестве
первостепенного метода диагностики патологии ПДЗ.
.3 Анализ информативности МСКТ
При выполнении МСКТ были выявлены следующие патологические изменения
(таблица 4).
Преобладали опухоли головки поджелудочной железы. Всем пациентам, помимо
МСКТ, было выполнено комплексное клинико-лабораторное обследование, УЗИ органов
брюшной полости и забрюшинного пространства. Верификация данных базировалась на
результатах оперативного лечения, патоморфологических исследованиях операционного
и биопсийного материала, а также осуществлялась в ходе динамического
наблюдения.
Таблица 4- Распределение патологических изменений органов ПДЗ в группе
обследованных (n=62)
|
Патологические изменения
|
Число пациентов
|
|
n=62
|
%
|
|
Патологические изменения
поджелудочной железы, из них: 1.Опухоль головки поджелудочной железы 2.
Опухоль тела поджелудочной железы 3. Опухоль хвоста поджелудочной железы 4.
Мультифокальная опухоль поджелудочной железы
|
53 34 10 6 3
|
54.8 16.1 9.7 4.8
|
|
Патологические образования
ДПК, из них: 1. Аденокарцинома 2. Гастроинтестинальная стромальная опухоль
|
7 3 4
|
4.8 6.5
|
|
Лимфоаденопатия без
поражения ПЖ и ВЖП
|
2
|
3.3
|
|
Всего
|
62
|
100
|
По данным МСКТ, подавляющее большинство патологических изменений
приходится на поджелудочную железу (85,4 %). Наиболее часто опухоль
локализовалась в головке поджелудочной железы (64,2 %).
МСКТ является высокочувствительным и высокоспецифичным методом
диагностики. Но высокая стоимость оборудования, расходных материалов и
сопутствующая лучевая нагрузка не позволяет использовать это метод в качестве
первоочередного. Метод МСКТ прекрасно подходит как заключительный.
3.4 Диагностический алгоритм при
опухолях панкреатодуоденальной зоны
Анализ данных литературы и результаты практических исследований позволяют
предложить следующий диагностический алгоритм (рисунок 2).
При подозрение на развитие опухоли поджелудочной железы или внутренних
желчевыводящих протоков Первичными методами диагностики являются УЗИ и ФГДС,
что обусловлено высокой чувствительностью данных методов и их экономической
доступностью для широкого применения. Так же в комплекс исследований первого
звена входят общеклинические лабораторные исследования.
В случае отсутствия видимой на УЗИ патологии производится определение
онкомаркера СА-19-9. А при наличии механической желтухи оправдано назначение
МРХПГ с целью уточнения фактора приведшего к обструкции.
При наличии патологических изменений в органах ПДЗ, повышенном титре
онкомаркера СА-19-9, отсутствии конкрементов по данным МРХПГ при наличии
механической желтухи показано МСКТ брюшной полости с болюсным контрастированием
и многофазным сканированием, как метод наиболее информативный, позволяющий
наиболее полно оценить картину патологического процесса и определить тактику
лечения.

Рисунок 2 - Предлагаемый алгоритм обследования пациентов с подозрением на
опухоль органов панкреатодуоденальной зоны
ЗАКЛЮЧЕНИЕ
Представленные в данной работе цифры информативности отдельных методов в
этом сложном разделе онкологической диагностики порой достаточно противоречивы.
Это, вероятно, связано с особенностями проведения научных исследований и
различным уровнем владения авторами тех или иных диагностических методик. Тем
не менее, удельный вес информативности каждого из представленных методов
достаточно изучен для формирования диагностического алгоритма.
Для выявления первичной локализации опухоли применяются УЗИ и ФГДС. С
целью предварительного определения локорегионарной распространенности процесса
(инвазия сосудов и прилежащих органов, поражение применяют УЗИ с
доплерографией. УЗИ и ФГДС также используются для прицельной биопсии и
морфологической верификации диагноза. С целью предварительной оценки
отдаленного метастазирования применяются УЗИ (печени, забрюшинные лимфоузлы) и
рентгенография органов грудной клетки (легкие). Более точную информацию о
распространенности опухолевого процесса, поражении регионарных лимфатических
узлов, отдаленном метастазировании получают в ходе КТ и/или МРТ. Методом выбора
при оценке состояния сосудов ПДЗ является виртуальная ангиография. Так же может
применяться не утратившие своей актуальности целиакография, верхняя
мезентерико-портография.
В сложных для диагностики случаях в диагностический комплекс включают
ЭРПХГ, видеолапароскопию, радиоизотопную диагностику, магнитно-резонансную
холангиопанкреатикографию и другие методы. Большинство кистозных образований ПЖ
требуют МСКТ - контроля и определения уровня онкомаркера СА 19-9 в динамике.
Изменения в периампулярной зоне, отсутствие визуализируемого субстрата,
вызывающего блок желчных протоков на уровне головки ПЖ, требуют уточнения путем
проведения эндосонографии и МРХПГ.
Только после комплексного обследования можно максимально приблизится к
правильному диагнозу, определить стадию заболевания и выработать оптимальную
лечебную тактику. Учитывая все еще неудовлетворительные отдаленные результаты
лечения больных с опухолями ПДЗ, необходимо развивать и усиливать направления
прецизионной диагностики, поскольку основным методом лечения сегодня остается
хирургический.
Библиографический список
1. Аллахвердян Г.С., Брюзгин В.В, Косырев В.Ю. Применение
пункционной биопсии под контролем УЗКТ на амбулаторном этапе обследования
онкологических больных. Возможности современной онкологии в диагностике и
лечении злокачественных заболеваний. - М., 2003. - С. 16-17.
. Кубышкин В.А. Вишневский В.А. Рак поджелудочной железы. М.:
ИД Медпрактика, 2003. 386 с.
. Shahangian S., Fritsche H.A. Jr., Hughes J.I. et al. // Clin.
Chem. 1989. V. 35. P. 405-408.
. Гурова Н.Ю. Возможности высокопольной магнитно_резонансной
томографии в диагностике заболеваний поджелудочной железы: Автореф. дис… канд.
мед. наук. - М., 2002
. Долгушин Б.И., Патютко Ю.И. Рентгенэндобилиарные
вмешательства в диагностике и лечении больных с опухолями гепатопанкреатодуоденальной
зоны, осложненных механической желтухой // Материалы I съезда онкологов стран
СНГ. - М., 1998. - 336 с.
. Долгушин Б.И., Патютко Ю.И., Гусев Л.И.
Рентгенэндобилиарные вмешательства в диагностике и лечении больных опухолями
гепатопанкреатодуоденальной зоны, осложненными механической жетухой. Анналы
хирургической гепатологии (приложение). Матер. 4-й конф. хирургов_гепатологов.
- Тула, 1998. - С. 84-85.
. Гришина И. Ю. Онкогенез и профилактика рака поджелудочной
железы на этапах хирургического и медикаментозного лечения хронического
панкреатита: Автореф. дис. … канд. мед. наук: ФГУ "Российский центр
функциональной хирургической гастроэнтерологии". Краснодар, 2007. 22 с.
. Berger A.C., Meszoely I.M., Ross E.A. et al. // Ann.
Surg. Oncol. 2004. V. 11. 644-649.
. Косырев В.Ю. Профилактика несостоятельности и оценка
функционирования билио- и панкреатодигестивных анастомозов после
гастропанкреатодуоденальной резекции: Дис. канд. мед. наук. - М., 2001.
. Лотов А.Н., Дадвани С.А., Шкроб О.С. и др. Малоинвазивные
технологии при синдроме механической желтухи // Росс. журн. гастроэнтерол.,
гепатол., колопроктол. - 1999. - № 2 - С. 44-49.
. Охотников О.И. Перкутанная дипевтика в неотложной хирургии
органов панкреатобилиарной зоны: Автореф. дис. д-ра мед. наук. - Воронеж, 1998.
- 39 с.
. Патютко ЮИ., Котельников А.Г. Рак поджелудочной железы:
Диагностика и хирургическое лечение на современном этапе // Анналы хир.
гепатол. - 1998. - ТЗ. №1. - С. 96-111.
. Патютко Ю.И., Синюкова Г.Т., Титова И.А. Возможности УЗКТ в
диагностике опухолей поджелудочной железы и взаимоотношение с магистральными
сосудами гепатопанкреатодуоденальной зоны. Материалы III Съезда онкологов стран
СНГ «Онкология 2004». - Минск, 2004. - С. 189-190.
. Рыков О.В. Выбор метода желчеотведения при
билиопанкреатодуоденальном раке у инкурабельных больных: Дис... канд. мед.
наук, 2001
. Федоров В.Д., Кармазановский Г.Г., Гузеева Е.Б., Цвиркун
В.В. Виртуальное хирургическое моделирование на основе данных компьютерной
томографии. - М.: Издательский дом Видар_М, 2003.
. Федоров В.Д., Буриев И.М., Икрамов Р.З. Хирургическая
панкреатология. - М.: Медицина, 1999. - С. 56-104.
. Трапезников Н.Н., Аксель Е.М. Заболеваемость
злокачественными новообразованиями и смертность от них населения стран СНГ в
1998. - М., 2000. - 270 с.
. Locker G.Y., Hamilton S., Harris J., Jessup J.M. et al. // J. Clin. Oncol. 2006. V. 24. P. 5313-5327.
. Таточенко К.В. Чреспеченочные эндобилиарные и
ангиографические вмешательства: Дис... д-ра мед. наук. - М.,1998.
. Долгушин Б.И., Косырев В.Ю., Синюкова Г.Т. и др. //
Практическая онкология. 2004. Т. 5, № 2. С. 77-84.
. Allema J.H., Reinders M.E., van Gulic T.M., van Leenwen D.J. et al. Portal vein resection in patients undergoing pancreaticoduodenectomy for
carcinoma of the pancreatic head region // Brit. J. Surg. - 1999. - Vol. 81. -
P. 1642-1646.
. Allema J.H., Reinders M.E., van Gulic T.M. et al.
Prognostic factors for survival after pancreaticoduodenectomy for carcinoma of
the pancreatic head region. Chapter 6 in: Surgical treatment of tumors of the
pancreatic head region / Ed. By J.H. Allema, 2001. - P. 89-104.
. Ballantyne K., Percins A., Selby C. et al. Maging of pancreatic and
colorectal cancer using antibody fragments. A preliminary evalution // Europ.
J. Surg. Oncol. - 1998. - Vol. 14. - P. 393-398.
. Bluemke D.A., Cameron J.L., Hruban R.H. et al.
Potentially resectable pancreatic adenocarcinoma: spiral CT assessment with
surgical and pathologic correlation // Radiology. - 2003. - Vol. 197. - P. 381
-385.
. Carlos Valls, Eduard Andнa, Anna Sanchez, Juan Fabregat et
al.. Dual_Phase Helical CT of Pancreatic Adenocarcinoma. Assessment of
Resectability Before Surgery // AJR. - 2002. Vol. 178. - P. 821-826.
. Chistyakova O.V., Bogatyrev V.N., Kosirev V.U. et
al. Cytopathology of metastatic disease to the liver. 14_th international
congress of cytology. May 27.31, 2001. - Amsterdam, 2001. - 55 p.
. Diehl S., Lehmann K., Sadick M., Lachmann R., Georgi
M. et al. Pancreatic
cancer: value of dual_phase helical CT in assessing resectability // Radiology.
- 1998. - Vol. 206. - P. 373-378.
29. Elmar M. Merkle, Greg N. Bender, Hans_Juergen
Brams. Imaging
findings in pancreatic lymphoma. Differential aspects // AJR. - 2000. - Vol.
174. - P. 671-675.
. Gregg Y. Problems in the diagnosis of pancreatic
cancer by endoscopyc retrograde pancreatography // Gastroent. Radiol. - 1999. - Vol. 2. -
P. 179-184.
. Schima W., Fugger R., Schober E. et al. Diagnosis and Staging of
Pancreatic Cancer: Comparison of Mangafodipir TrisodiumEnhanced MR Imaging and
Contrast_Enhanced Helical Hydro_CT // AJR. - 2002. - Vol. 79. - P. 717-724.
. Semelka R.C., Susan M.Ascher, C.A. Rolilve Reinhold.
MRI of the abdomen and pelvis. - WILEY_LISS., 1999. - P. 175-182.
33. Tabuchi T., Itoh K., Ohshio G. et al. Tumor staging of
pancreatic adenocarcinoma using early and late_phase helical CT // AJR. - 1999.
- Vol. 173. - P. 375-380.
. Vargas R., NinocMurcia M., Trueblood W., Brooke
R.J., Jr. MDCT in Pancreatic Adenocarcinoma: Prediction of Vascular Invasion
and Resectability Using a Multiphasic Technique with Curved Planar Reformations
// AJR. - 2004. - Vol. 182. - P. 419-425.
. Weckbecker G. et al. Somatostatin analogs for
diagnosis and treatment of cancer // Pharmac.Ther. - 1999. - Vol. 60. - P.
245-264.