Взаимосвязь биологической активности лекарственных препаратов с их строением
Введение
Фармакологическая активность целиком и полностью определяется строением
лекарственного вещества. Вместе с тем, химическое строение подразумевает под
собой не только известную последовательность атомов в молекуле, но и их
определенное пространственное расположение. Развитие фармакологического эффекта
зачастую обусловлено конформационными изменениями, вызванными влиянием молекулы
лекарственного вещества на молекулярную мишень. Активация или ингибирование
функции рецепторов, трансмембранных каналов и ферментов находятся под
управлением лигандов - специфических соединений, имеющих определенное сродство
к соответствующим биологическим структурам. Очевидно, что интенсивность
фармакологического эффекта обусловлена комплементарностью взаимодействия, полнота
которого подразумевает не только требуемое расположение радикалов, но и форму
молекулы, что объясняется необходимостью проникновения к активному центру
молекулярной мишени.
Форма молекулы, расположение заряженных и неполярных радикалов
детерминирует проникновение через мембраны клеток, ГЭБ и ГМБ, силу и
продолжительность действия, а также скорость элиминации из системного
кровотока.
Если рассматривать важность пространственного строения для
фармацевтической химии, можно отметить, что направленное формирование структуры
лекарственного соединения должным образом может улучшить его терапевтический
профиль, увеличивая продолжительность действия или нивелируя побочные эффекты.
Введение в молекулу гидрофобных фрагментов, например линейных алкильных
«якорей» может увеличить сродство соединения к мембранам и возможность
проникать соединения в клетку, что было продемонстрировано на примере т.н.
«ионов Сукачева».
Введение «якорей» может также способствовать пролонгации действия
лекарственного соединения, что обеспечивается повышением депонирования в
жировой ткани и снижением метаболизма в печени и почках. Азатиоприн является
пролекарством для 6-меркаптопурина, неспецифического цитостатика. В организме
азатиоприн медленно метаболизируется с образованием 6-меркаптопурина, что, в
конечном итоге, приводит к пролонгации действия.
Модификация молекулы может использоваться и для коррекции
органолептических показателей, так, например, левомицетина стеарат,
гидролизующийся в пищеверительном тракте до левомицетина, не обладает обжигающе-горьким
вкусом, что позволяет сохранять изначальную фармакологическую активность при
улучшении вкусовых характеристик.
Многие лекарственные средства, используемые в настоящее время на рынке,
прошли долгий путь от изначальной задумки до конечной реализации, в ходе
которого преследовалось увеличение целевой активности и снижение частоты и
выраженности побочных эффектов, повышение стабильности и времени действия.
Пространственное строение целиком и полностью определяет судьбу лекарственного
средства в организме - возможность связывания его с молекулярными мишенями,
возможность «избежать» нежелательных биотрансформаций, и, напротив, участвовать
в необходимых превращениях.
1.
Молекулярные мишени биологически активных веществ в организме
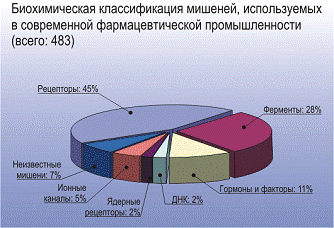
Рисунок 1. Типы молекулярных мишеней для действия лекарственных средств
[5].
Молекулярная мишень - это молекула или молекулярный ансамбль, имеющий
специфический центр связывания для биологически активного соединения.
Молекулярная мишень может быть представлена мембранными белками, распознающими
гормоны или нейротрансмиттеры (рецепторы), а также ионными каналами,
нуклеиновыми кислотами, молекулами-переносчиками или ферментами. Как видно из
Рисунка 2, не все лекарственные соединения воздействуют на рецепторы.
Большинство лекарственных средств должны связаться с молекулярной мишенью,
чтобы произвести эффект, но существуют и исключения. Уже в первых исследованиях
эффектов лекарств на тканях животных в конце XIX в. стало ясно, что большинство
ФАВ реализуют специфическое действие в определенных тканях, т.е. соединение,
которое оказывает эффект на один тип ткани, может не влиять на другой; одно и
то же вещество может оказывать совершенно разные эффекты на разные ткани.
Например, алкалоид пилокарпин, как и нейротрансмиттер ацетилхолин, вызывает
сокращение гладких мышц кишечника и тормозит частоту сердечных сокращений. С
учетом этих феноменов Сэмуэль Лэнгли (1852-1925) в 1878 г., основываясь на
изучении эффектов алкалоидов пилокарпина и атропина на слюноотделение,
предположил, что «существуют некие рецепторные вещества... с которыми оба могут
образовывать соединения». Позже, в 1905 г., изучая действие никотина и кураре
на скелетные мышцы, он обнаружил, что никотин вызывает сокращения, когда действует
на определенные небольшие участки мышц. Лэнгли заключил, что «рецепторная
субстанция» для никотина находится в этих участках и что кураре действует путем
блокады взаимодействия никотина с рецептором [4].

Рисунок 2. Эффективность по
отношению к эндогенному агонисту.
Таким образом, очевидно, что действие некоторых
соединение может быть обусловлено не столько развитием биологического ответа на
связывание с молекулярной мишенью, сколько препятствием связыванию эндогенного
лиганда. Действительно, если рассматривать взаимодействие лиганда и рецептора,
можно отметить, что существующие в настоящее время лекарственные соединения
могут играть роль как агониста, так и антагониста. На Рисунке 3 можно увидеть
более подробную классификацию лигандов по отношению к эффектам, ими
обусловленными. Агонисты различаются по силе и направлению физиологического
ответа, вызываемого ими. Данная классификация не связана с аффинностью лигандов
и опирается лишь на величину отклика рецептора. Таким образом, можно выделить
следующие классы агонистов:
o Суперагонист - соединение, способное
вызывать более сильный физиологический ответ, чем эндогенный агонист.
o Полный агонист - соединение,
вызывающее такой же отклик, как эндогенный агонист (например, изопреналин,
агонист β-адренорецепторов).
o В случае меньшего отклика соединение
называют частичным агонистом (например, арипипразол - частичный агонист
дофаминовых и серотониновых рецепторов).
o В случае если у рецептора имеется
базальная (конститутивная) активность, некоторые вещества - обратные агонисты -
могут уменьшать её. В частности, обратные агонисты рецепторов ГАМКA
обладают анксиогенным или спазмогеннымдействием, однако могут усиливать
когнитивные способности [6].
Рассматривая механизм связывания лиганда и рецепторной молекулы, можно
увидеть, что специфичность и сила связывания обусловлена особенностями строения
обоих компонентов. В частности, важную роль играет активный центр белков -
определённый участок белковой молекулы, как правило, находящийся в её
углублении ("кармане"), сформированный радикалами аминокислот,
собранных на определённом пространственном участке при формировании третичной
структуры и способный комплементарно связываться с лигандом. В линейной
последовательности полипептидной цепи радикалы, формирующие активный центр,
могут находиться на значительном расстоянии друг от друга.
Высокая специфичность связывания белка с лигандом обеспечивается
комплементарностью структуры активного центра белка структуре лиганда. Под
комплементарностью понимают пространственное и химическое соответствие
взаимодействующих молекул. Лиганд должен обладать способностью входить и
пространственно совпадать с конформацией активного центра. Это совпадение может
быть неполным, но благодаря конформационной лабильности белка активный центр
способен к небольшим изменениям и "подгоняется" под лиганд. Кроме
того, между функциональными группами лиганда и радикалами аминокислот,
образующих активный центр, должны возникать связи, удерживающие лиганд в активном
центре. Связи между лигандом и активным центром белка могут быть как
нековалентными (ионными, водородными, гидрофобными), так и ковалентными.
Активный центр белка - относительно изолированный от окружающей белок среды
участок, сформированный аминокислотными остатками. В этом участке каждый
остаток благодаря своему индивидуальному размеру и функциональным группам
формирует "рельеф" активного центра.
Объединение таких аминокислот в единый функциональный комплекс изменяет
реакционную способность их радикалов, подобно тому, как меняется звучание
музыкального инструмента в ансамбле. Поэтому аминокислотные остатки, входящие в
состав активного центра, часто называют "ансамблем" аминокислот.
Уникальные свойства активного центра зависят не только от химических
свойств формирующих его аминокислот, но и от их точной взаимной ориентации в
пространстве. Поэтому даже незначительные нарушения общей конформации белка в
результате точечных изменений его первичной структуры или условий окружающей
среды могут привести к изменению химических и функциональных свойств радикалов,
формирующих активный центр, нарушать связывание белка с лигандом и его функцию.
При денатурации активный центр белков разрушается, и происходит утрата их
биологической активности.
Часто активный центр формируется таким образом, что доступ воды к
функциональным группам его радикалов ограничен, т.е. создаются условия для
связывания лиганда с радикалами аминокислот.
В некоторых случаях лиганд присоединяется только к одному из атомов,
обладающему определённой реакционной способностью, например присоединение О2
к железу миоглобина или гемоглобина. Однако свойства данного атома избирательно
взаимодействовать с О2 определяются свойствами радикалов, окружающих
атом железа в составе тема. Гем содержится и в других белках, таких как
цитохромы. Однако функция атома железа в цитохромах иная, он служит посредником
для передачи электронов от одного вещества другому, при этом железо становится
то двух-, то трёхвалентным.
Центр связывания белка с лигандом часто располагается между доменами.
Например, протеолитический фермент трипсин, участвующий в гидролизе пептидных
связей пищевых белков в кишечнике, имеет 2 домена, разделённых бороздкой.
Внутренняя поверхность бороздки формируется аминокислотными радикалами этих
доменов, стоящими в полипептидной цепи далеко друг от друга (Сер177,
Гис40, Асп85).
Разные домены в белке могут перемещаться друг относительно друга при
взаимодействии с лигандом, что облегчает дальнейшее функционирование белка. В
качестве примера можно рассмотреть работу гексокиназы, фермента,
катализирующего перенос фосфорного остатка с АТФ на молекулу глюкозы (при её
фосфорилировании). Активный центр гексокиназы располагается в расщелине между
двумя доменами. При связывании гексокиназы с глюкозой окружающие её домены сближаются,
и субстрат оказывается в "ловушке", что облегчает его дальнейшее
фосфорилирование.
Основное свойство белков, лежащее в основе их функций, - избирательность
присоединения к определённым участкам белковой молекулы специфических лигандов.
Классификация лигандов
· Лигандами могут быть неорганические (часто ионы металлов) и
органические вещества, низкомолекулярные и высокомолекулярные вещества;
· существуют лиганды, которые изменяют свою химическую
структуру при присоединении к активному центру белка (изменения субстрата в
активном центре фермента);
· существуют лиганды, присоединяющиеся к белку только в момент
функционирования (например, О2, транспортируемый гемоглобином), и
лиганды, постоянно связанные с белком, выполняющие вспомогательную роль при
функционировании белков (например, железо, входящее в состав гемоглобина).
В тех случаях, когда аминокислотные остатки, формирующие активный центр,
не могут обеспечить функционирование данного белка, к определённым участкам
активного центра могут присоединяться небелковые молекулы. Так, в активном
центре многих ферментов присутствует ион металла (кофактор) или органическая
небелковая молекула (кофермент). Небелковую часть, прочно связанную с активным
центром белка и необходимую для его функционирования, называют"простатическая
группа". Миоглобин, гемоглобин и цитохромы имеют в активном центре
простетическую группу - гем, содержащий железо.
Соединение протомеров в олигомерном белке - пример взаимодействия
высокомолекулярных лигандов. Каждый протомер, соединённый с другими
протомерами, служит для них лигандом, так же как они для него.
Иногда присоединение какого-либо лиганда изменяет конформацию белка, в
результате чего формируется центр связывания с другими лигандами. Например,
белок кальмодулин после связывания с четырьмя ионами Са2+ в
специфических участках приобретает способность взаимодействовать с некоторыми
ферментами, меняя их активность [7].
Важным понятием в теории взаимодействия лиганда и активного центра
биологической мишени является «комплементарность». Активный центр фермента
должен определенным образом соответствовать лиганду, что отражается в некоторых
требованиях, предъявляемых к субстрату.
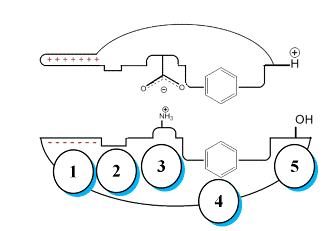
Рисунок 3. Схема взаимодействия
лиганда и молекулярной мишени.
Так, например, ожидаемо, что для успешного взаимодействия необходимо
соответствие размеров активного центра и лиганда (см. 2 положение на рисунке
3), что позволяет повысить специфичность взаимодействия и оградить активный
центр от заведомо неподходящих субстратов. Вместе с тем, при возникновении
комплекса «активный центр-лиганд» возможны следующие виды взаимодействий:
· вандерваальсовы связи (положение 1, рисунок 3), обусловленые
флуктуациями электронных облаков вокруг противоположно поляризованных соседних
атомов;
· электростатические взаимодействия (положение 3, рисунок 3),
возникающие между противоположно заряженными группами;
· гидрофобные взаимодействия (положение 4, рисунок 3),
обусловленные взаимным притяжением неполярных поверхностей;
· водородные связи (положение 5, рисунок 3), возникающие между
подвижным атомом водорода и электроотрицательными атомами фтора, азота или
кислорода.
Несмотря на относительно малую силу описанных взаимодействий (в сравнении
с ковалентными связями), не стоит недооценивать их важность, отражающуюся в
повышении аффинности связывания.
Обобщая вышесказанное, можно отметить, что процесс связывания лиганда и
молекулярной мишени представляет собой высокоспецифический процесс,
контролируемый как размером лиганда, так и его строением, что позволяет
обеспечить селективность взаимодействия. Тем не менее, возможно взаимодействие
между белком и не свойственным ему субстратом (т.н. конкурентное
ингибирование), которое выражается в связывании с активного центра со схожим,
но не целевым лигандом. Стоит отметить, что конкурентное ингибирование возможно
как в естественных условиях (ингибирование малонатом фермента
сукцинатдегидрогеназы, ингибирование фумаратгидратазы пиромеллитовой кислотой
[8]), так и искусственно, во время приема лекарственных средств (ингибирование
моноаминооксидазы ипрониазидом, ниаламидом, ингибирование
дигидроптероатсинтетазы сульфаниламидами - структурными аналогами пара-аминобензойной
кислоты, ингибирование ангиотензинпревращающего фермента каптоприлом,
эналаприлом).
Таким образом, существует возможность целенаправленного изменения
активности многих молекулярных систем при помощи синтетических соединений,
имеющих строение, схожее с естественными субстратами.
Тем не менее, поверхностное понимание механизмов взаимодействия лигандов
и молекулярных мишеней может быть чрезвычайно опасно и, зачастую, приводить к
трагическим последствиям. Наиболее известным случаем можно считать т.н.
«талидомидовую трагедию», которая привела вследствие приема беременными
женщинами недостаточно изученного лекарственного соединения талидомида к
рождение тысяч детей с врожденными уродствами.
2.
Оптическая изомерия
2.1 Общая
характеристика
Оптическая изомерия наблюдается у веществ, проявляющих оптическую
активность, то есть способных вращать плоскополяризованный световой луч.
Вещества, отклоняющие плоскость поляризации луча вправо, называются
правовращающими, влево - левовращающими. Для того чтобы вещество было оптически
активным, требуется выполнение единственного условия - молекула не должна иметь
ни центра, ни плоскости симметрии. В простейшем случае это определяется
наличием в молекуле так называемого асимметрического (хирального) атома. Существуют
оптически активные молекулы и без асимметрического атома углерода, однако мы их
рассматривать не будем. Термин "хиральность" происходит от
английского слова "chirality" (от греч. ceir - рука), предложенного
Кельвином в конце XIX века [18].
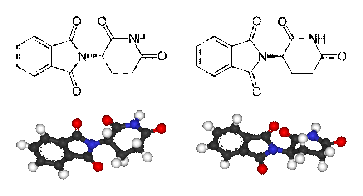
Рисунок 4. Энантиомеры талидомида.
Талидомид (рисунок 4) представляет собой печально известное лекарственное
средство для лечения бессонницы, применявшееся в странах Европы для седации у
беременных женщин в период с 1956 по 1962 гг, в результате чего были рождены от
8000 до 12000 тысяч детей с уродствами. Несмотря на то, что механизм действия R-изомера, отвечающего за снотворный
эффект неизвестен, причина тератогенности S-изомера в некоторой степени ясна - встраивание молекулы S-талидомида между Г-Ц связями ДНК
приводит к нарушению процесса репликации и последующему аномальному развитию
плода [9]. На первый взгляд, может быть недостаточно очевидно, почему молекулы,
имеющие одинаковый порядок атомов в своем составе, оказывают различный
биологический эффект, поэтому проиллюстрируем дальнейшее рассуждение.
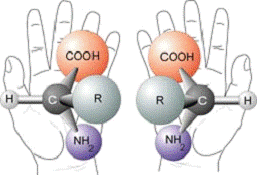
Рисунок
5. Энантиомерия как зеркальная симметрия
Вопреки
тому, что молекулы аминокислот, приведенных на рисунке 5, имеют идентичную
последовательность атомов, они, тем не менее, являются разными веществами, что
выражается в невозможности сопоставления их пространственных моделей, что
обусловлено наличием тетраэдрического центра асимметрии - атома углерода,
имеющего четыре различных заместителя.
Очевидно,
что в данном случае лишь одна из молекул энантиомеров может быть лигандом для
активного центра молекулярной мишени (рисунок 6), так как вторая молекула
энантиомера не будет взаимодействовать с соответствующими участками связывания.
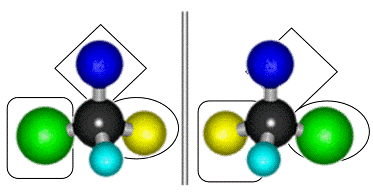
Рисунок 6. Проекция энантиомеров на
плоскость.
Действительно, огромное число молекулярных структур человеческого
организма обладает сродством к молекулам с определенной хиральностью. Так, в
природе преобладают аминокислоты и сахариды только одной конфигурации, а
образование их антиподов подавлено. L-аминокислоты являются естественными для человеческого организма, в то
время как D-аминокислоты ускоренно
метаболизируются при помощи D-оксидаз.
В некоторых случаях разные энантиомеры можно различить и без всяких
приборов - когда они по-разному взаимодействует с асимметрическими рецепторами
в нашем организме.
Яркий пример - аминокислота лейцин: ее правовращающий изомер сладкий, а
левовращающий - горький. Немного отдалившись от темы курсовой работы можно
также добавить, что (+)-энантиомер нооткатона имеет в 2200 раз более
интенсивный горький грейпфрутовый вкус и характерный запах, чем (-)-энантиомер,
а природный (3S, 3aS, 7aR)-изомер винного лактона имеет в 25000000 более
интенсивный сладкий запах с кокосовым оттенком, чем соответствующий (3R, 3aR,
7aS)-изомер [11].
3.1
Влияние оптической изомерии на биологическую активность
Феномен хиральности (стереоизомерия) столь обычен в биологии, что больше
половины всех лекарственных соединений являются хиральными молекулами, т. е.
имеют пары энантиомеров.
Часто один из энантиомеров (эвтомер) значительно более активен по
сравнению с другим, действующим слабее или не действующим вообще (дистомер).
Отношение активности эвтомера к дистомеру называется эвдисмическим и является
мерой стереоизбирательности данного соединения. Чем больше данное отношение,
тем сильнее биологическая активность лишь одного оптического изомера. Особенно
отчетливо это видно тогда, когда центр оптической асимметрии находится в том
месте молекулы, которое отвечает за ее взаимодействие с рецептором (так называемое
правило Пфейффера) [19].
Изучение активности стереоизомеров на изолированных тканях исключает
влияние проникновения и распределения и позволяет оценить эффективность
стереоизомерных веществ в их реакции с рецептором. Взаимодействие
асимметричной, достаточно сложной молекулы лекарственного вещества с еще более
сложной структурой активного центра рецептора, осуществляемое по типу
ключ-замок, определяется, несомненно, их контактом в целом ряде точек. При этом
в структурах вещества и рецептора могут существовать как точки связи, так и
точки взаимного отталкивания. Очевидно, что существование первых обусловливает
сродство вещества к рецептору. Наличие вторых может влиять на сродство,
поскольку взаимное отталкивание каких-то групп вещества и рецептора может
способствовать специфическому изменению конформации последнего.
Если представить себе, что основные силы взаимодействия асимметрично
построенной молекулы лекарственного вещества с активным участком рецептора (или
фермента) сосредоточены минимум в трех точках, то два оптических антипода
вещества могут одинаково ориентировать в отношении данной поверхности только
две из трех групп, участвующих в процессе.
Различная ориентация третьей группы лучше всего может объяснить различие
в биологической активности оптических изомеров, причем в зависимости от степени
участия этой группы в процессе взаимодействия с рецептором влияние оптической
изомерии будет выражено в большей или меньшей степени.
Если вещество взаимодействует с рецептором лишь в двух точках, то разницы
в биологической активности его оптических изомеров ожидать не приходится.
Однако если третья группа в одном изомере пространственно препятствует контакту
вещества с рецептором в двух других точках, то и в этом случае различие между
оптическими антиподами должно иметь место. Например, из двух оптических
изомеров адреналина только у одного все три группы ориентированы таким образом,
что они могут соединяться с соответствующими группами рецептора. В этом случае
будет наблюдаться максимальная фармакологическая активность, соответствующая D-(-)-адреналину. У L-(+)-адреналина спиртовая
гидроксильная группа ориентирована неправильно по отношению к поверхности
рецептора, и данная молекула может взаимодействовать с рецептором только в двух
точках. Поэтому природный D-(-)-адреналин
обладает в десятки раз большей фармакологической активностью, чем
синтезированный искусственно L-(+)-изомер
[18].
Биологически активное вещество с двумя асимметричными центрами имеют
четыре диастереомера, как например α-блокатор лабеталол. В большинстве
случаев один из этих энантиомеров будет более эффективен, чем его зеркальный
энантиомер, что связано с лучшей «подгонкой» к рецепторной молекуле. Например,
5(+)-энантиомер парасимпатомиметического лекарственного средства метахолина
более чем в 250 раз активнее R(-)-энантиомера. Если представить рецептор в виде
перчатки, в которую должна войти молекула лиганда, чтобы вызвать эффект,
становится ясно, почему «левосторонние» лиганды будут более эффективны при
связывании с рецептором для «левой руки», чем их «правосторонние» энантиомеры.
Более активный энантиомер для одного типа рецепторов может быть менее
активным для другого типа рецепторов, например для рецепторов, ответственных за
некоторые нежелательные эффекты. Карведилол - лекарство, взаимодействующее с
адренорецепторами, имеет один хиральный центр и, следовательно, два
энантиомера. Один из этих энантиомеров, 5(-)-изомер, является активным β-блокатором. R(+)-изомер в 100 раз
слабее действует на рецептор. Кетамин относится к внутривенным анестетикам. Его
(+)-энантиомер - более активный и менее токсичный анестетик, чем
(-)-энантиомер. Тем не менее в качестве лекарственного средства до сих пор
используют рацемическую смесь.
Наконец, в связи с тем, что ферменты обычно стереоселективны, один энантиомер
часто имеет большее сродство к ферменту, метаболизирующему лекарственное
вещество, чем другой. В результате энантимомеры могут весьма отличаться друг от
друга по длительности действия.
К сожалению, большинство исследований клинической эффективности и
элиминации лекарственных соединений у человека выполнено с применением
рацемических смесей лекарств, а не их раздельных энантиомеров. В настоящее
время только около 45 % хиральных ЛС, используемых в клинике, доступны как
активные энантиомеры - остальные продаются только как рацемические смеси. В
результате многие больные получают дозы веществ, которые на 50 % или более
неактивны или даже токсичны. Однако отмечается повышение интереса, как на
научном, так и на законодательном уровнях, к производству хиральных ЛС в виде
их активных энантиомеров.
Тем не менее, ряд соединений
присутствует на современном фармацевтическом рынке Республики Беларусь в
качестве рацематов.
Рисунок
7. S- и R-изомеры ибупрофена.
Так, например, широкораспространенное нестероидное противовоспалительное
лекарственное средство ибупрофен (рисунок 7) присутствует в смеси двух
изомеров, один из которых ((S)-(+)-ибупрофен)
обладает целевой активностью и проявляет себя как анальгетик, антипиретик и
оказывает противовосполительное действие, в то время как R-изомер токсичен и может
накапливаться в жировых отложения в виде эфира с глицерином. В связи с этим
стало коммерчески доступно аналогичное лекарственное средство, представляющее
собой энантиомерно чистый (S)-(+)-ибупрофен, т. н. дексибупрофен. В ходе
дальнейших исследований было обнаружено, что в организме человека присутствует
изомераза, способная превращать неактивный (R)-(-)-ибупрофен в активный
(S)-(+)-ибупрофен [10].
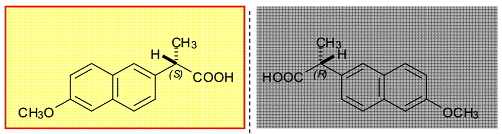
Рисунок
8. R- и S-изомеры напроксена.
Напроксен - нестероидное противовоспалительное лекарственное средство,
производное пропионовой кислоты, также присутствует на рынке в виде
рацемической смеси, несмотря на то, что только S-изомер обладает терапевтической активностью, а R-изомер имеет ярко выраженную
гепатотоксичность [11].
S-амлодипин
уже более 20 лет используется в лечении артериальной гипертензии (АГ) и
стенокардии, в то время как большинство амлодипинсодержащих лекарственных
средств представлены рацемической смесью его S- и R-энантиомеров. Установлено,
что способность блокировать медленные каналы L-типа в гладкомышечных клетках
сосудов, лежащая в основе терапевтического действия данного препарата, присуща
только его S-энантиомеру, в то время как его R-энантиомер в этом плане в 1000
раз менее активен, то есть практически лишен таких свойств [12]. В то же время
R-изомер не является фармакологически инертным, поскольку, в отличие от
S-изомера, способен стимулировать синтез NO эндотелиальными клетками через
кининзависимый механизм [13]. Установлено, что чрезмерная дилатация
прекапиллярно-артериолярного звена сосудов нижних конечностей, обусловленная
избыточным образованием NO, нивелирует реализацию важного физиологического
механизма, предупреждающего развитие отеков тканей нижних конечностей при
нахождении тела в вертикальном положении - так называемого прекапиллярного
постурального вазоконстрикторного рефлекса [14].
Именно это обстоятельство лежит в основе побочного действия традиционного
рацемического амлодипина в виде периферических отеков, развивающихся в
дозозависимом порядке по различным данным у 9-32% получающих его пациентов,
чаще пожилых [15]. В сравнительном рандомизированном исследовании S-амлодипина
и оригинального рацемического амлодипина, выполненном в Украине, частота отеков
на фоне 12-недельного лечения в вышеуказанных группах составила 1,6 и 7,8%
соответственно, то есть терапия асомексом (торговая марка S-амлодипина, производимая Actavis Group) снижала риск их возникновения в 4,8 раза [16].
Частота появления периферических отеков на фоне лечения S-амлодипином в двух
крупных постмаркетинговых исследованиях составила всего 0,75% (14 из 1859
наблюдавшихся) и 0,84% (14 из 1669). При этом по данным 4-недельного
наблюдения, антигипертензивная активность S-амлодипина в дозах 2,5 и 5 мг/сут
оказалась эквивалентной таковой для амлодипина-рацемата, принимаемого вдвое
большими суточными дозами - 5 и 10 мг.
Тем не менее, некоторые лекарственные средства
выпускаются в виде оптически чистых соединений. Их получают тремя методами:
разделением рацемических смесей, модификацией природных оптически активных
соединений (к ним относятся углеводы, аминокислоты, терпены, молочная и винная
кислоты и др.) и прямым синтезом. Последний также требует хиральных источников,
поскольку любые другие традиционные методы синтеза дают рацемат. Это одна из
причин высокой стоимости некоторых ЛС, и не удивительно, что из множества
синтетических хиральных препаратов, выпускаемых во всем мире, лишь небольшую
часть составляют оптически чистые, остальные - рацематы.
Возможно также, что каждый энантиомер обладает своим
специфическим действием. Так, левовращающий S-тироксин (лекарственное средство
левотроид) - это природный гормон щитовидной железы. А правовращающий
R-тироксин («декстроид») понижает содержание холестерина в крови. Некоторые
производители придумывают для подобных случаев торговые названия-палиндромы,
например «Darvon» для наркотического анальгетика и «Novrad» для
противокашлевого препарата.
Как уже отмечалось на примере аминокислоты лейцина,
человек - существо хиральное.
И это относится не только к его внешнему виду.
Энантиомерные ЛС, взаимодействуя с хиральными молекулами в организме, например
с ферментами, могут действовать по-разному. «Правильное» лекарственное средство
подходит к своему рецептору, как ключ к замку, и запускает желаемую
биохимическую реакцию. Антиаритмическое средство S-анаприлин действует в сто
раз сильнее, чем R-форма. У антигельминтного средства левамизола активен в
основном в S-изомер, тогда как его R-антипод вызывает тошноту, поэтому в свое
время рацемический левамизол был заменен одним из энантиомеров. В 60-е годы
одним из предшественников адреналина в организме - диоксифенилаланином (L-ДОФА)
пытались лечить паркинсонизм.
При этом выяснилось, что это вещество, а также
родственные ему дофамин и метилдофа эффективны только в виде S-изомера. В то же
время R-ДОФА вызывает серьезные побочные эффекты, в том числе заболевание
крови. Фирма «Merck» разработала способ производства гипотензивного препарата метилдофа,
включающий самопроизвольную кристаллизацию только нужного энантиомера путем
введения в раствор небольшой затравки этого изомера.
Пеницилламин (3,3-диметилцистеин) - довольно простое
производное аминокислоты цистеина. Это вещество применяют при острых и
хронических отравлениях медью, ртутью, свинцом, другими тяжелыми металлами, так
как оно дает прочные комплексы с ионами этих металлов, и эти комплексы
удаляются почками.
Применяют пеницилламин также при различных формах
ревматоидного артрита, при системной склеродермии, в ряде других случаев. При
этом применяют только S-форму препарата, так как R-изомер токсичен и может
привести к слепоте. Недаром на обложке июньского номера американского журнала
«Journal of Chemical Education» за 1996 год был помещен вот такой необычный
рисунок. Название статьи о лекарственных средствах-антиподах было не менее
красноречивым: «Когда молекула смотрится в зеркало» [17].
4. Геометрическая изомерия
4.1 Общая характеристика
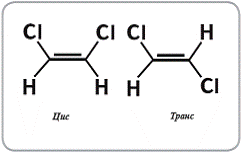
Рисунок 9. Цис- и транс-дихлорэтен.
лекарственный препарат фармакология изомерия
Стереоизомерами называют вещества, имеющие одинаковые химические формулы,
молекулы которых различаются только расположением атомов друг относительно
друга. В отличие от структурных изомеров, в молекулах стереоизомеров характер и
последовательность химических связей совпадают. Важнейшими типами стереомеров
являются цис-транс изомеры (E-Z-изомеры), энантиомеры, диастереомеры и
конформеры. Последний случай относится к большим молекулам, например белкам,
которые при одной и той же первичной структуре могут иметь различные
конформации.
Цис-транс изомерия относится к расположению различных атомов или групп
относительно выделенной связи, например двойной. В цис-изомере эти атомы
находятся по одну сторону от выделенной связи, а в транс-изомере - по разные.
Простейшим примером цис-транс изомерии являются соединения типа дихлорэтена
(рисунок 10). В более сложных случаях для описания такого рода стереоизомерии
используют предложенную ЮПАК номенклатуру: у Z-изомеров группы с наибольшими
весами находятся по одну сторону связи, а у E-изомеров - по разные.
4.2 Влияние геометрической изомерии на биологическую активность
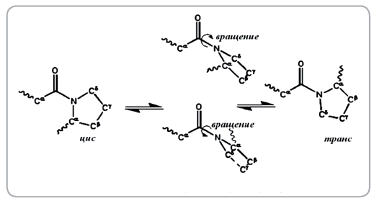
Рисунок 10. Иллюстрация заторможенности вращения относительно пептидной
связи в белках.
Цис-транс изомеры могут быть образованы и
энантиомерами хиральных соединений. Важный пример - пептидная связь в белках,
образованная остатками L-аминокислот. Эта связь имеет характер частично двойной
связи, поэтому атомы скелета пептидной группы (-Cα-C′-N-Cα-) расположены в одной плоскости и
группа может находиться либо в цис-, либо в транс-конформации (рисунок 11).
Хотя в развернутой полипептидной цепи происходит свободная
изомеризация и пептидные группы принимают обе конформации, в нативном белке
только одна из 1000 групп имеет цис-конформацию (остальные находятся в
транс-конформации). Транс-конформация пептидных групп задается при их синтезе
на рибосомах и сохраняется в дальнейшем. Однако если в состав пептидной группы
входит остаток пролина (рисунок 12), что в обычных белках бывает редко, то
соотношение транс/цис становится равным 3/1. Это значит, что в таком случае
изомеризация происходит гораздо быстрее (хотя все равно очень медленно, с
постоянной времени около 20, при комнатной температуре), чем в пептидной связи,
образованной другими аминокислотными остатками.
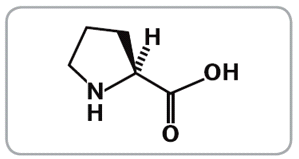
Рисунок 11.
Молекула L-пролина
При синтезе белка процесс сворачивания полипептидной
цепи с образованием нативной конформации (фолдинг) происходит в тысячи раз
быстрее цис-транс изомеризации, тем не менее иногда образуется пептидная группа
в цис-конформации. В этом случае процесс фолдинга останавливается до тех пор,
пока не возникнет правильная конформация, либо прекращается вовсе. Бывает и
наоборот, когда для активной формы белка необходима не транс-конформация,
которая образуется при синтезе, а цис-конформация, тогда приходится ждать, пока
она не образуется. В обоих случаях на помощь приходит специальный фермент -
пептидилпролилизомераза, который существенно ускоряет процесс изомеризации, в
результате чего синтез таких белков идет без задержек.
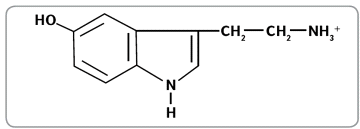
Рисунок 12.
Молекула серотонина
Не так давно было обнаружено, что цис-транс
изомеризация не просто влияет на структуру белка, но такое изменение структуры
может играть важную роль в регуляции биохимических процессов. Одним из
важнейших нейромедиаторов, ответственных за регуляцию очень большого числа
процессов у различных организмов - от нематоды до человека, - является
серотонин (5-гидрокситриптамин, рисунок 13). У человека 80-90% серотонина
обнаруживается в специальных клетках кишечника, где он используется для
регуляции перистальтики. Остальная часть серотонина синтезируется в
серотонергических нейронах в центральной нервной системе, где он участвует в
регуляции аппетита, сна, хорошего настроения и агрессии. Кроме того, он
стимулирует рост клеток, в частности в процессе восстановелния печени после
повреждения, регулирует рост и рассасывание костей. Вырабатывается серотонин и
у растений и грибов, его содержат некоторые овощи и фрукты.
Разнообразие регуляторных функций серотонина
обусловлено наличием в разных клетках различных рецепторов серотонина, которые
образуют так называемое суперсемейство серотониновых рецепторов
(5-HT-рецепторов). Недостаточная или избыточная продукция серотонина приводит к
различным психическим расстройствам. Так, при недостатке серотонина (или
дефектах его рецепторов) у человека возникает депрессия. Поэтому многие
лаборатории занимаются изучением серотониновой регуляции, в частности
механизмов взаимодействия серотонина с различными рецепторами.
Все рецепторы серотонина, кроме 5-HT3,
работают посредством активации G-белков, которые затем вызывают каскад
биохимических реакций, приводящих к определенному результату. Рецептор 5-HT3
- единственный, который относится к типу управляемых ионных каналов (его
ближайший структурный аналог - никотиновый рецептор ацетилхолина). Этот
рецептор представляет собой белок, пять раз пронизывающий клеточную мембрану
нервной клетки, в котором при связывании с серотонином образуется пора,
пропускающая катионы натрия, калия и кальция. Прохождение ионов по открывшемуся
каналу приводит к возбуждению нейрона и генерации нервного импульса.
Однако как открывается канал в мембране, было
неизвестно. Недавно было установлено, что инициатором структурных перестроек в
рецепторе 5-HT3 является изомеризация одного остатка пролина,
находящегося в ключевом для этого типа рецепторов месте (вершина цистеиновой
петли). Если пролин находится в транс-конформации, то канал закрыт. Связывание
серотонина вызывает изомеризацию пролина, и канал открывается. Пожалуй, это
первый случай, когда экспериментально показано, что переключение ионного канала
между открытым и закрытым состояниями обусловлено стереоизомеризацией всего
одного звена в полипептидной цепи [20].
Несмотря на меньшую (в сравнении с оптической
изомерией) значимость цис-транс изомерии для фармации, надо признать, что свою
нишу она, все же, имеет.
Ярким примером различий в свойствах биологически активных соединений в
контексте геометрической изомерии является линолевая кислота, представляющая
собой одноосновную карбоновую кислоту с двумя изолированными связями - CH3(CH2)3-(CH2CH=CH)2(CH2)7COOH.

Рисунок
13. Линолевая кислота.
Линолевая кислота относится к семейству омега-6 полиненасыщенных жирных
кислот и в организме осуществляет регуляцию свойств клеточных и субклеточных
мембран. Примечательно то, что только цис-изомер линолевой кислоты может
использоваться организмом для синтеза арахидоновой кислоты [21], в то время как
транс-изомеры малоактивены и могут накапливаться в органах и тканях. Линолевая
кислота входит во множество лекарственных средств и биологически активных
добавок, реализуемых на территории Республики Беларусь. Так, например,
линолевая кислота является одним из основных компонентов ЛС «Эссенциале» и
«Эссенциале форте Н» (Санофи Авентис), «Эссенцикапс» (МинскИнтерКапс),
«Акулайв» (Lysi HF), «Фосфоглиф» (Фармстандарт-Лексредства) и других.
Вместе с тем, далеко не всегда транс-изомеры жирных кислот являются
индифферентными. В начале 90-х годов прошлого века появился ряд публикаций,
указывающих на связь потребления транс-жиров и риском развития
сердечно-сосудистых заболеваний [22, 23]. В дальнейшем ВОЗ рекомендовала
сократить потребление транс-жиров до следовых количеств [24], так как появились
сведения, подтверждающие влияние транс-изомеров жирных кислот на возникновение
рака, диабета, болезни Альцгеймера и иных, не менее малоприятных заболеваний.
Однако, не только изомеры естественного происхождения проявляют различную
биологическую активность. Так, например, цисплатин (цис-[Pt(NH3)2Cl2],
цис-дихлородиамминплатина(II) является алкилирующим цитотоксическим
лекарственным средством, представленным, как ясно из названия, цис-изомером.
Цисплатин оказывает терапевтическое действие путем связывания с молекулой ДНК и
образованием координационного соединения между атомом платины и двумя
азотистыми основаниями, что приводит к невозможности дальнейшего считывания и
воспроизведения наследственной информации. Исследование показало [25], что
комплекс цисплатин - ДНК более стабилен, чем аналогичный ему комплекс,
содержащий транс-изомер. Таким образом обеспечивается развитие более
длительного терапевтического эффекта, что, очевидно, и определило вывод на
рынок именно цис-изомера. Вместе с тем, существуют исследования [26],
указывающие на наличие комплексных соединений платины, пребывающих в
транс-форме, и обладающих активностью, сравнимой с цисплатином. В таком
контексте становится очевидно, что рассматривать отдельно взятое соединение без
изучение его взаимодействия с молекулярной мишенью не представляется
оптимальным.
Обсуждая вопросы геометрической изомерии, нельзя не упомянуть о наших
соотечественниках, ведущих разработки ЛС на основе комплексов палладия (II) с N-замещенными тетразолами (Белорусский государственный
университет), которые являются эффективными цитостатиками, проявляющими
антипрофилеративную активность как в ряду цис-, так и в ряду транс-изомеров
[27].
Заключение
Подводя итоги, можно отметить, что пространственное строение
лекарственного соединения во многом определяет его фармакологическую
активность. Выраженность биологического эффекта и его направленность зависит от
строения лиганда, взаимодействующего с молекулярной мишенью.
На современном этапе развития фармацевтической индустрии огромное внимание
уделяется методам компьютерного конструирования лекарственных соединений, что
диктуется как экономическими факторами (значительно сокращается время и
стоимость разработки), так и этическими факторами - существующие алгоритмы
позволяют предсказать возможную токсичность исследуемого соединения и
предотвратить трагедии, аналогичные талидомидовой.
На мой взгляд, одним из наиболее примечательных аспектов влияния
пространственного строения лекарственного вещества на фармакологическую
активность и фармакокинетику является изучение взаимодействия лиганда и
рецептора. Изучение структуры биомолекулы, воссоздание ее нативного строения
дает возможность получить информацию об активном центре, что в дальнейшем, при
использовании докинга, позволяет подобрать именно такую структуру, которая
будет производить оптимальный эффект.
Следующим любопытным фактом для меня было существование молекулярных
дескрипторов строения - специальных математических параметров, которые могут
обобщить пространственное расположение атомов до некоторой исчисляемой
величины. Молекулярные дескрипторы в дальнейшем могут использоваться для
построения моделей, в которые «закладываются» имеющиеся сведения относительно
исследуемого соединения, а в качестве результата «получается» интересующий нас параметр
- фармакологическая активность.
Изучение материалов при подготовке курсовой работы было очень интересным,
пусть и сложным, ведь адекватное понимание действия лекарственных веществ
невозможно без изучения тех механизмов, которые оказываются задействованы при
его проникновении в организм. Было приятно узнать, что работы по получению
новых лекарственных соединений ведутся не только в абстрактном «зарубежье», но
и учеными из стран СНГ, а также Беларуси - в частности, НАН РБ долго и вполне
успешно работает над проблемой молекулярного дизайна лигандов к ферментам
микросомального окисления.
Так или иначе, проделанная работа показалась мне полезной, быть может не
столько для моего профессионального роста как провизора-рецептара, сколько для
формирования широкого кругозора и углубленного понимания роли фармацевтической
химии как науки.
Литература
1. MedUniver [Электронный ресурс] / Фармакология. - Режим доступа: http://meduniver.com/Medical/farmacologia/25.html. - Дата доступа: 01.05.2013.
2. Клиническая фармакология. Национальное руководство.
Под редакцией Ю.Б. Белоусова, В.Г. Кукеса, В.К. Лепахина, В.И. Петрова-М:
«ГЭОТАР -Медиа», 2009-965с.
. Википедия [Электронный ресурс] / Агонист. - Режим
доступа: http://ru.wikipedia.org/wiki/Агонист. - Дата доступа: 01.05.2013.
. Биохимия: Учебник / Под ред. Е.С.Северина. - 3-е
изд., испр. - М.: Гэотар-Медиа, 2005. - 784 с.
. Химическая энциклопедия [Электронный ресурс] /
Фумаратгидратаза. - Режим доступа:
http://www.xumuk.ru/encyklopedia/2/4963.html. - Дата доступа: 01.05.2013.
. Солдатенков А.Т. Основы органической химии
лекарственных веществ / А.Т. Солдатенков. - М.: Химия, 2001.- 192 с.
7. Tracy, T. S. Metabolic inversion of
(R)-ibuprofen. Epimerization and hydrolysis of ibuprofenyl-coenzyme A / T.S.
Tracy, S.D. Hall // Drug Metab. Dispos. - 1992. - V.20. - №2. - P. 322-327.
8. Летучие природные
органические соединения [Электронные ресурс] / Режим доступа: http://fen.nsu.ru/posob/pochki/Tkachev.pdf. - Дата доступа: 01.05.2013.
9. Burges,
R.A. Calcium channel blocking properties of amlodipine in vascular smooth
muscle and cardiac muscle in vitro: evidence for voltage modulation of vascular
dihydropyridine receptors / R.A. Burges [et all] // J. Cardiovasc. Pharmacol. -
1987; 9 (1):110-119.
. Laufen,
H. Enantioselective disposition of oral amlodipine in healthy volunteer / H.
Laufen, M. Leitold // Chirality. - 1994. - V. 6 (7). - P. 531-536.
. Cogolludo,
A. New insights in the pharmacological therapy of arterial hypertension / A.
Cogolludo, F. Perez-Vizacaino, J. Tumargo // Curr. Opin. Nephrol. Hypertens. -
2005. - V.14. - P. 423-427.
. Perna
G.P. Efficacy and tolerability of amlodipine in patients with stable angina
pectoris. Results of multicenter study / G.P. Perna [et all] // Clin. Drug.
Invest. - 1997. - V. 13. - P. 149-155.
. Бобров, В.А.
Применение S-амлодипина в лечении больных с мягкой и умеренной
артериальной гипертензией / В.А. Бобров [и др.] // Здоров'я України. - 2007. -
№ 12/1. - С. 1-4.
. Леенсон, И.А. Левое
или правое / И.А. Леенсон // М.: Химия и жизнь. - №5. - 2009. - С. 20-23.
. Алексеев, В.В.
Оптическая изомерия и фармакологическая активность лекарственных препаратов //
Соросовский образовательный журнал, 1998, №1, с. 49-55.
. Яницкий, П.К.
Многообразие строения и форм молекул органических соединений / П.К. Яницкий, В.
Реверский, В. Гумулка // Новости фармации и медицины. 1991. № 4/5. C. 98-104.
. Биология
[Электронный ресурс] / Роль стереоизометрии в биохимической регуляции. Режим
доступа: http://bio.1september.ru/view_article.php?ID=200901701. - Дата
доступа: 01.05.2013.
. Биохимия: Учебник
для ВУЗов / Под ред. Е. С. Северина. - ГЭОТАР-Медиа, 2003. - С. 371-374
19. Intake of trans
fatty acids and risk of coronary heart disease among women / Walter C [et all].
- The Lancet. - V. 341. - P. 581-585.
. Willett,
W.C. Trans fatty acids: are the effects only marginal? / W.C. Willet, A.
Ascherio American Journal of Public Health. - V. 84 (3). - 1994. - P. 722-724.
. WHO
Scientific Update on trans fatty acids: summary and conclusions / R Uauy [et
all] // European Journal of Clinical Nutrition. - № 63. - 2009. - Р.
68-75.
. Nafisi,
S. A comparative study on the interaction of cis- and trans-platin with DNA and
RNA. / S. Nafisi, Z. Norouzi. // DNA Cell Biol.
<http://www.ncbi.nlm.nih.gov/pubmed/19558218> - V. 28(9). - 2009. - P.
469-477.
. Синтез и строение
новых комплексных соединений палладия(ii) с n-замещенными тетразолами / Т.В.
Серебрянская [и др.] // Минск, «Свиридовские чтения», 2008. - С. 45-53.
25. Todeschini,
R. Molecular Descriptors for Chemoinformatics / R. Todeschini, V. Consonni. -
Willey-VCH, 2009. - 1265 c.
. Quantitative
Structure-Activity Relationships: Fundamentals and Application of the Hansch
Analysis [Electronic Resource] / International
Union of Pure and Applied Chemistry. Brasil, 2006. - Mode of access:
http://iupac.org/publications/cd/medicinal_chemistry. - Date of access:
20.04.2013.
. Todeschini,
R. Handbook of Molecular Descriptors / R. Todeschini, V. Consonni. - Wiley-VCH,
2000. - 688 с.