Исследование гуминовых и фульвокислот различных почв Краснодарского края по данным ЭПР и ЯМР спектроскопии
Исследование
гуминовых и фульвокислот различных почв Краснодарского края по данным ЭПР и ЯМР
спектроскопии
химический загрязнение гуминовый почва
Введение
Химическое загрязнение биосферы - одна из причин
возможного экологического кризиса на планете. Специфическая способность почвы
поглощать поступившие из антропогенных источников металлы и распределять их
между свойственными почвам компонентам имеет важное значение в формировании
экологической обстановки.
Исследования состава соединений металлов в
почвах и механизмов их трансформации имеют более, чем полувековую историю, но
актуальность их растет в связи с необходимостью получения адекватной оценки
сегодняшнего состояния загрязненных почв, прогноза их изменения, поиска путей
их улучшения. Сложность решения данной проблемы состоит также в необходимости
учета региональных особенностей состояния элементов в почвах.
Одним из интенсивно развивающихся направлений
современной химии является анализ сложных органических матриц - продуктов
жизнедеятельности и распада живых организмов. Важным представителем таких
объектов являются гуминовые вещества.
Необходимость углубления современных
представлений о химической природе и молекулярной структуре гуминовых веществ
разного генезиса как переходной или конечной формы существования органического
вещества вызвана уникальностью их многочисленных полезных свойств. Всестороннее
применение гуминовых кислот в разных областях промышленности, медицины и
сельского хозяйства требуют более углубленного изучения молекулярной структуры
этих веществ.
Важной задачей является также раскрытие
механизмов трансформации соединений металлов, их подвижности и доступности для
растений, а также защитных (барьерных) свойств почвы. Однако неоднозначность
подходов к способам определения подвижности и доступности металлов растениям
обуславливает необходимость проведения исследований в этом направлении.
Целью данной работы было проведение
сравнительного анализа ряда различных образцов почв и препаратов гуминовых и
фульвокислот методом ЭПР спектроскопии.
Были поставлены следующие задачи: 1) выделение
препаратов гуминовых и фульвокислот из почв; 2) исследование связывания
гуминовых веществ с тяжелыми металлами.
1. Литературный обзор
.1 Общие сведения о Гуминовых
веществах. Биосферные функции
Гуминовые вещества (ГВ)- это сложные смеси
устойчивых к биодеструкции высокомолекулярных темноокрашенных органических
соединений природного происхождения, образующихся при разложении растительных и
животных остатков под действием микроорганизмов и абиотических факторов
среды[1]. ГВ представляют собой макрокомпоненту органического вещества
почвенных и водных экосистем, а также твердых горючих ископаемых. Их содержание
в почвах и водах составляет 60-80% от общего органического вещества, в торфах и
углях оно колеблется от 20 до 90% [2]. Общепринятая классификация ГВ основана
на различии в растворимости в кислотах и щелочах. Согласно этой классификации
ГВ подразделяют на три составляющие: гумин - не извлекаемый остаток,
нерастворимый ни в щелочах, ни в кислотах; гуминовые кислоты (ГК) - фракция ГВ,
растворимая в щелочах и нерастворимая в кислотах (при pH<2); фульвокислоты -
(ФК) - фракция ГВ растворимая и в щелочах и в кислотах.
Гуминовые кислоты (ГК) - высокомолекулярные
азотсодержащие органические кислоты, растворимые в щелочах и нерастворимые в
кислотах. Гуминовые кислоты образуются при бактериальном разложении отмерших
растительных остатков, а так же при длительном воздействии кислорода атмосферы
или пластовых вод на органические вещества. Строение гуминовых кислот
определяется наличием слабо конденсированных и замещенных ароматических ядер,
связанных между собой участками неароматического характера.
Фульвокислоты (ФК) - (креновая и апокреновая)
представляют собой светлоокрашенные (от соломенно-желтой до оранжевой окраски)
высокомолекулярные азотсодержащие органические вещества. Они по сравнению с
гуминовыми кислотами содержат больше кислорода и водорода и меньше углерода.
Элементный состав фульвокислот колеблется в следующих пределах: углерод -
40-52%, кислород - 40-48%, водород - 4-6%, азот - 2-6%. Фульвокислоты хорошо
растворяются в воде, в растворах кислот и щелочей, водном растворе аммиака и
других веществах. Их водные растворы имеют кислую реакцию (рН 2,6-2,8),
поэтому, просачиваясь вглубь, они оказывают сильное разрушающее действие на
минеральную часть почвы и способствуют выносу оснований из верхних горизонтов
почв.
В качестве обобщающего названия, обозначающего
как гуминовые, так и фульвокислоты, применяют термин «гумусовые кислоты» (ГФК).
Гумусовые кислоты являются наиболее подвижной реакционноспособной компонентой
ГВ, активно участвующей в химических процессах, протекающих в экосистемах
[3,1].
Все ГВ образуются в результате посмертного
превращения органических остатков. Превращение органических остатков и ГВ
получило название процесса гумификации. Он идет вне живых организмов, как с их
участием, так и путем чисто химических реакций окисления, восстановления,
гидролиза, конденсации и др. В отличие от живой клетки, в которой синтез
биополимеров осуществляется в соответствии с генетическим кодам, в процессе
гумификации нет какой-либо установленной программы, поэтому могут возникать
любые соединения, как более простые, так и более сложные чем исходные
биомолекулы. Образующиеся продукты вновь подвергаются реакциям синтеза или
разложения, и такой процесс идет практически беспрерывно [4,47].
ГВ считают первой устойчивой формой органических
соединений углерода вне живых организмов. Гуминовые вещества выполняют в
биосфере множество функций, из которых важнейшие следующие:
) Аккумулятивная функция. Она заключается в
накоплении химических элементов и энергии, необходимых живым организмам.
Практически это означает, что ГВ ответственны за жизнеобеспечение почвенной
биоты и гидробиоты, и поскольку они благодаря своей устойчивости сохраняются
длительное время, то тем самым гарантируют непрерывное снабжение растений и
микроорганизмов энергией и строительным материалом. В составе гуминовых веществ
найдено от 40 до 60% углерода, 3-5% азота, 30-40% кислорода, а так же водород,
сера, фосфор. Многие металлические катионы, в том числе так называемые
микроэлементы. Не случайно темно-серые и черные по цвету почвы в народе всегда
считали плодородными и называли, хотя и не всегда правильно, черноземами.
Окраску таким почвам придают ГВ.
) Транспортная функция. Она заключается в
формировании геохимических потоков минеральных и органических веществ,
преимущественно в водных средах, за счет образования устойчивых, но
сравнительно легкорастворимых комплексных соединений гумусовых кислот с катионами
металлов и гидроксидами. Транспортная функция до некоторой степени противоречит
аккумулятивной функции, поскольку их результаты прямо противоположны, но
противоречивость действия обеспечивает многообразия влияния гуминовых веществ
на минеральные компоненты почв и горных погод.
) Регуляторная функция. Эта функция объединяет
множество различных явления и процессов и относится к почвам, водам и другим
природным телам. В регуляторной функции гуминовых веществ можно выделить
несколько главных составляющих: 1) формирование почвенной структуры и
водно-физических свойств почв; 2) регулирование реакций ионного обмена между
твердыми и жидкими фазами; 3) влияние на кислотно-основные и
окислительно-восстановительные режимы; 4) регулирование условий питания живых
организмов путем изменения растворимости минеральных компонентов; 5)
регулирование теплового режима почв и атмосферы, включая проявления парникового
эффекта.
) Протекторная функция, которая заключается в
способности гуминовых веществ связывать в малоподвижные или трудно
диссоциирующие соединения токсичные и радиоактивные элементы, а также
соединения, негативно влияющие на экологическую ситуацию в природе , в том
числе они могут инкорпорировать некоторые пестициды, углеводы, фенолы. Защитная
функция гуминовых веществ настолько велика, что богатые ими почвы могут
полностью предотвратить поступление в грунтовые воды ионов свинца и других
токсичных веществ.
) Физиологическая функция. Многими
исследователями было установлено, что различные гуминовые вещества, особенно
гуминовые кислоты и их соли, могут стимулировать прорастание семян,
активизировать дыхание растений, повышать продуктивность крупного рогатого
скота, птицы. Более того, было показано, что некоторые препараты гуминовых
веществ сдерживают развитие злокачественных опухолей, повышают устойчивость
организмов к различного рода воспалительным процессам.
Гуминовые и фульвоислоты существенно отличаются
по своим свойствам. Гуминовые кислоты способны накапливаться в почве и
формировать ее плодородие. Фульвокислоты активно разрушают минеральную часть
почвы и снижают тем самым ее плодородие. Поэтому важно знать не только общее
количество гумуса в почве, но и его качественный состав - соотношение в нем
гуминовых и фульвокислот является важным показателем их агрохимической оценки
[45].
1.2 Элементный состав гумусовых
кислот
Обычно под элементным составом гумусовых кислот
понимают состав их органической части, образованной сравнимыми количествами
атомов углерода, водорода и кислорода. Обязательным минорным элементом является
азот, почти во всех препаратах определяется и сера. Однако помимо органической
части, в состав всех выделенных препаратов гумусовых кислот входит и
неорганическая часть. Она состоит из зольных элементов (преимущественно ионов
металлов, оксидов кремния и алюминия) и гигроскопической влаги, содержание
которой достигает 10%. Поэтому в общем виде брутто - формулу гумусовых кислот
можно записать следующим образом:
CxHyNzOpSqMr(Al2O3)l(SiO2)m (H2O)n,
где М- ионы металлов,y,z,p,q,r,l,m,n-
стехиометрические коэффициенты.
Средний элементный состав органической части
гумусовых кислот различного происхождения приведен в таблице 1, взятой из
работы [5]. Авторы этой публикации подвергли статистической обработке данные по
элементному составу 650 препаратов гумусовых кислот, опубликованные в более чем
400 литературных источниках. Приводимая ими сводка является наиболее
представительной. Как видно из таблицы 1, содержание углерода в ГК различного
происхождения варьирует от 50 до 60%, кислорода - от 30 до 40%. В целом, для ГК
характерны более низкие значения атомного соотношения Н/С, чем для ФК, что
указывает на их большую ненасыщенность. Данный показатель убывает в ряду:
морские донные отложения> пресные воды> торфа ≈ почвы. ФК
характеризуются более низким содержанием углерода и более высоким - кислорода.
Это предполагает большую степень замещения ароматического каркаса ФК
кислородосодержащими функциональными группами. Максимальное содержание
кислорода характерно для ФК пресных вод [46].
Следует отметить, что наиболее узкими
диапазонами стандартных отклонений (5-10% (отн) от среднего) характеризуются
содержания С и О. Разброс значений для Н гораздо больше (10-20% от среднего),
но максимальные значения стандартных отклонений достигаются для содержаний N и
S.
По-видимому, это связано с большими ошибками в
определении N и S как следствие их низкого содержания по сравнению с С, Н и О.
Нельзя исключать и того, что содержание N и S в гумусовых кислотах не
подчиняется устойчивым закономерностям, а является довольно случайным.
Таблица 1 - Средний элементный состав гумусовых
кислот различного происхождения (в расчете на беззольную навеску, n- число
препаратов, ± стандартное отклонение)
|
Препарат
|
Содержание
элементов, % (масс)
|
Атомные
отношения
|
|
С
|
Н
|
О*
|
N
|
S
|
O/C
|
H/C
|
|
ГК
почв (n=215)
|
55.4±3.8
|
4.8±1
|
36.0±3.7
|
3.6±1.3
|
0.8±0.1
(n=67)
|
0.50±0.09
|
1.04±0.25
|
|
ФК
почв (n=127)
|
45.3±5.4
|
5.0±1
|
46.2±5.2
|
2.6±1.3
|
1.3±0.5
(n=45)
|
0.78±0.16
|
1.35±0.34
|
|
ГК
торфа (n=23)
|
57.1±2.5
|
5.0±0.8
|
35.2±2.7
|
2.8±1.0
(n=21)
|
0.4±0.2
(n=12)
|
0.47±0.06
|
1.04±0.17
|
|
ФК
торфа (n=12)
|
54.2±4.3
|
5.3±1.1
|
37.8±3.7
|
2.0±0.5
|
0.8±0.2
(n=11)
|
0.53±0.09
|
1.20±0.33
|
|
ГК
вод (n=56)
|
51.2±3
|
4.7±0.6
|
40.4±3.8
|
2.6±1.6
|
1.1±0.3
(n=13)
|
0.6±0.08
|
1.12±0.17
|
|
ФК
вод (n=63)
|
46.7±4.3
|
4.2±0.7
|
45.9±5.1
|
2.3±1.07
|
1.2±0.7
(n=14)
|
0.75±0.14
|
1.10±0.13
|
|
ГК
морских ** д.о.(n=95)
|
56.3±6.6
|
5.8±1.4
|
31.7±7.8
|
3.8±1.5
|
3.1±1.4
(n=66)
|
0.45±0.18
|
1.23±0.23
|
|
ФК
морских д.о.(n=12)
|
45.0±4.0
|
5.9±0.9
|
45.1±6.0
|
4.1±2.3
|
0.8±0.6
(n=11)
|
0.77±0.17
|
1.56±0.13
|
* Подавляющее большинство данных по содержанию
кислорода получено по разности; ** д.о.- донные отложения
Авторы процитированного выше обзора склонны
относить наблюдающиеся вариации элементного состава гумусовых кислот различного
происхождения по специфике их генезиса, отводя возможным погрешностям
методического характера второстепенную роль. С точки зрения И.В. Перминовой [6]
это может быть справедливо в отношении содержания углерода (особенно для
низкозольных проб), тогда как содержание кислорода, водорода и азота весьма
существенно зависит как от метода определения, так и способа корректировки
первичных данных анализатора на содержание зольных элементов в пробе и
гигроскопическую влажность. Наличие воды наиболее существенно влияет на
результаты определения водорода. Поэтому именно этим фактором объясняется то,
что даже в пределах выборок препаратов сходного происхождения и фракционного
состава величина относительного стандартного отклонения по водороду достигает
20%, тогда как для двух других макроэлементов- кислорода и углерода- она не
превышает 10 %. Присутствие в составе зольных элементов ионов щелочных и
щелочноземельных металлов может приводить к образованию термостойких карбонатов
и, как следствие, вызывать занижение результатов определения углерода.
1.3 Функциональный состав гумусовых
кислот
В настоящее время в гумусовых кислотах
обнаружено более десяти различных типов кислород, азот и серосодержащих
функциональных групп: карбоксильные, фенольные и спиртовые гидроксильные,
карбонильные, хинонные, метоксильные, сложноэфирные, енольные, амино-, амидо- и
имидогруппы, сульфо-, тиольные и дисульфидные группы [7].
Кислородсодержащие группы. Кислород входит как в
состав каркасной, так и периферической части гумусовых кислот. В последнем
случае он находится преимущественно в углеводных фрагментах. Обобщенные
сведения о распределении кислорода по различным функциональным группам в
гумусовых кислотах почв приведены в таблице 2.
Таблица 2 - Распределение кислорода между
функциональными группами в гумусовых кислотах почв, по данным [6,7]
|
Общее
содержание кислорода,
|
СООН
|
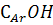
|
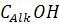
|
C=O
|
Учтенный
кислород,
|
|
%
|
%
кислорода
|
%
|
|
Почвенные
гуминовые кислоты
|
|
37.2
|
24
|
33
|
10
|
8
|
75
|
|
36.8
|
26
|
25
|
15
|
7
|
74
|
|
35.4
|
18
|
38
|
13
|
4
|
73
|
|
Почвенные
фульвокислоты
|
|
47.3
|
58
|
19
|
12
|
6
|
95
|
|
44.8
|
65
|
12
|
13
|
9
|
99
|
Как видно из данной таблицы около 75% кислорода
в молекулах ГК и около 95% - в ФК распределено между четырьмя типами
функциональных групп: карбоксильными, фенольными и спиртовыми гидроксильными, и
карбонильными, причем вклад этих групп в общее содержание кислорода различен
для ГК и ФК. Вышеперечисленные функциональные группы, определяют
комплексообразующую способность гумусовых кислот по отношению к тяжелым
металлам.
Хинонные и семихинонные. Методом ЭПР показано,
что в гумусовых кислотах содержание неспаренных электронов составляет (0,140)спин/г
[8]. Присутствие данных групп обуславливает возможность протекания реакций с
участием гумусовых кислот по свободнорадикальному механизму, в частности,
восстановления ионов металлов в их присутствии и декарбоксилирование отдельных
фрагментов гумусовых кислот.
Азотсодержащие группы. Содержание азота в
гуминовых кислотах составляет 1-5% (таблица 1). Часть азота входит в состав
каркасной (негидролизуемой) части. Остальной азот находится в составе
периферической (гидролизуемой) части. По данным, опубликованным в монографии
Д.С. Орлова, [1] азот периферической части распределяется следующим образом:
20-45% входит в состав аминокислотных остатков, 2-8% - в состав аминосахаров,
8-15% присутствует в гумусовых кислотах в виде солей аммония, до 20% - в
неустановленных фрагментах. При этом азот каркасной части находится в составе
следующих групп: - группы, связанные с ароматическими кольцами, -NH- и =N-
группы в открытых цепях; индольные, пиррольные и пиридиновые кольца; мостиковые
NR- группы, связывающие хинонные кольца; аминокислоты, связанные с
ароматическими ядрами через N.
Из приведенных фрагментов алифатические амины,
аминокислоты и гетероциклы способны образовывать комплексные соединения с
тяжелыми металлами. Таким образом, указанные группы, наряду с
кислородсодержащими, могут влиять на комплексообразующие свойства гумусовых
кислот по отношению к тяжелым металлам.
Серусодержащие группы. Согласно [9],
распределение серы в торфяных гумусовых кислотах можно представить следующим образом
( в % от общей серы): 8-12% - лабильные сульфонатные группы, 3-6% -
аминокислоты, 4-19% - эфиры серной кислоты, 54-70% - тиолы, S- гетероциклы,
стабильные сульфонаты, 3-23%- алифатические сульфиды.
1.4 Модели строения гуминовых и
фульвокислот
Гумусовые кислоты относятся к соединениям
переменного состава, вследствие чего полную и однозначную их структурную
формулу вывести невозможно. Следует отметить, что замена в молекуле гуминовой
или фульвокислоте отдельных структурных фрагментов, боковых цепей и функциональных
групп существенно не изменяет их свойства в целом. Таким образом, существуют
статистические формулы, отражающие средний состав, строение и средние свойства
гумусовых кислот.
К настоящему времени предложены некоторые
варианты формул химического строения ГК, но все они имеют гипотетический
характер, отражая в той или иной мере подробно накопленные экспериментальные
данные. Схемы молекулярного строения ГК можно разделить на две группы: 1)
блок-схемы и 2) структурные (условно) формулы [10].
Интересную блок-схему предложили В. Мистерски и
В. Логинов в 1959 г [11]. Эта схема показывает, что в состав гуминовой кислоты
входит так называемое «ядро», представленное ароматическими кольцами, включая
хиноны, кислород- и азотсодержащие гетероциклы.
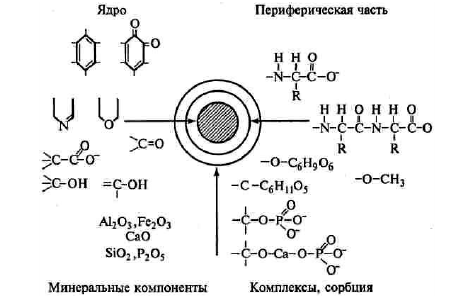
Рисунок 1 - Блок-схема строения гуминовой
кислоты по Мистерски и Логинову
Кольца несут хинонные и карбоксильные группы.
«Ядро» окружено периферическими алифатическими цепями, в том числе углеводного
и полипептидного характера. За счет комплексообразования и сорбции ГК содержат
также минеральные компоненты, в первую очередь, железо, алюминий, кальций,
фосфаты. Эта схема удобна для общей характеристики ГК, но она не раскрывает
характера сочленения слагающих молекулу остатков и, следовательно, не позволяет
объяснить способность ГК участвовать в химических реакциях или, тем более,
прогнозировать роль и функции ГК в почвообразовании. Сходную, но более
формализованную блок-схему ГК предложили М. Чешир с соавторами в 1967 году.
Первая «структурная» формула ГК, выделенной из
каменного угля, была составлена В. Фуксом [12]. Формула Фукса выведена из
существовавших представлений о строении угля в виде циклически
полимеризованного углерода. Она имеет сейчас только историческое значение, поскольку
очень далека от реального строения гумусовых кислот почвы хотя бы потому, что в
ней не отражено участие сильно развитых периферических цепочек, сложенных
углеводами и полипептидами. Этот недостаток был преодолен в формуле В.И.
Касаточкина, который сохранил идею циклически полимеризованного углерода для
«ядра» ГК, но ввел боковые радикалы в виде молекулярных цепей линейно
полимеризованного углерода, несущих различные функциональные группы (рисунок
2).
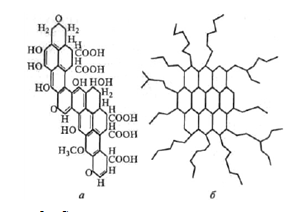
Рисунок 2 - Схема строения гуминовых кислот: а-
по Фуксу; б- по Касаточкину.
Формула Касаточкина, как и предыдущие формулы,
схематична, но она сыграла большую роль в развитии химии почвенного гумуса.
Используя идею о различном соотношении «ядра» и боковых цепей (по Касаточкину,
плоской атомной сетки циклически полимеризованного углерода и молекулярных
цепей линейно полимеризованного углерода), удалось объяснить изменения
содержания углерода и оптической плотности в ГК зонального ряда почв. По В. И.
Касаточкину, в ГК черноземов преобладает «ядро». И поэтому они содержат больше
углерода и отличаются более интенсивной окраской.
Формула Касаточкина имеет ряд существенных
недостатков. Так, наличие плоской атомной сетки циклически полимеризованного
углерода в таком количестве противоречит гибкости молекул ГК, их способности
изменять конфигурацию при образовании гуматов или при деридратации. В плоскую
непрерывную сетку не вписываются гетероциклические атомы азота и кислорода;
такому строению не отвечает и состав продуктов окисления ГК.
Структурная формула мономерного звена молекулы
ГК, содержащая «оптимальное» конденсированное «ядро», предложена Комиссаровым и
Логиновым в 1970 году [13]. Наличие конденсированного ядра ароматического
углерода подтверждено исследованием продуктов окисления. Однако, наличие
плоского конденсированного «ядра» противоречит экспериментальным данным о
строении ГК других природных сред, хотя следует отметить, что для ГК угля доля
конденсированных структур может быть велика.
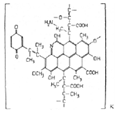
Рисунок 3 - Предполагаемая структурная схема
отдельного фрагмента гуминовой кислоты окисленного угля по Комиссарову.
В формуле Фелбека (рисунок 4) представлены
единичные кольчатые структуры, несущие функциональные группы и связанные с
открытыми цепями [14].
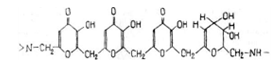
Рисунок 4 - Структурная схема негидролизуемой
части почвенной гуминовой кислоты по Фелбеку.
Сходное с этим изображение строения гуминовой
кислоты дает Фляйг [15] (рисунок 5), но он отмечает при этом возможность
существования двухъядерных ароматических структур.
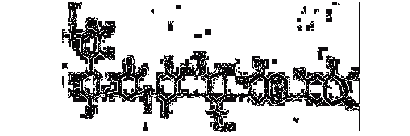
Рисунок 5 - Структурная формула почвенной
гуминовой кислоты по Фляйгу
Схема строения структурной ячейки, предложенная
Орловым, может рассматриваться как возможный вариант блок-схемы (рисунок 6).
Структурная ячейка представляет собой минимальную по размеру часть
макромолекулы, которая содержит набор структурных фрагментов. Подробно
приводятся характерные фрагменты негидролизуемой части молекулы и типичные
способы их соединения, а гидролизуемая периферия дана в виде набора структурных
компонентов, количество и характер сочленения которых варьируется. Состав и
строение структурных ячеек, из которых сложена вся макромолекула, могут также
варьировать.
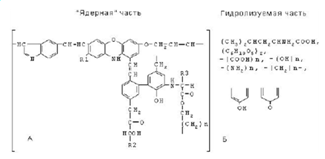
Рисунок 6 - Строение структурной ячейки ГК почв
по Орлову
Эта схема строения ГК позволяет объяснить почти
все известные экспериментальные данные и, по мнению В. Перминовой [16],
удовлетворительно объясняет конформационные особенности молекул, интенсивную
окраску и другие свойства ГК.
Возможны и необходимые замены в составе
компонентов гидролизуемой части молекул в типах замещений шестичленных колец
«ядра», а также в наборе и характере сочленения этих колец [48]. Однако такие
замещения, изменяя индивидуальный облик каждой отдельной молекулы, не должны
практически влиять на их общие типовые признаки.
В 2004 году С. Н. Чуков предложил другой
доработанный вариант [17] блок-схемы Д.С. Орлова. По его мнению, «ядро» ГК все
же включает высокополимеризованные формы ароматического углерода, как это было
показано на основе экспериментальных данных и в структурной формуле И.Д.
Комиссаровым.
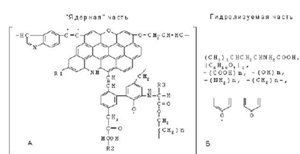
Рисунок 7- Строение структурной ячейки ГК почв
по Орлову, Чукову
Имеются попытки компьютерного моделирования
структуры ГК на основе готовых пакетов программ по данным ЯМР, ММР, элементного
анализа. При этом стоит отметить схожесть полученных структурных формул ГК с
предложенными Фелбеком и Фляйгом.
Шнитцер [18], как один из зарубежных лидеров
изучения ГК, представил структурную формулу этих соединений, которая также
схожа с формулой Орлова, но включает несколькочленные ароматические фрагменты.
Однако, характер сочленения этих фрагментов в макромолекулу по Шнитцеру не
предусматривает единую систему сопряженных связей, как это предусмотрено
формулой Комиссарова.
1.5 Реакционная способность
гуминовых кислот
Наличие различных функциональных групп при
ароматических ядрах и алифатических цепях и особенности строения самого остова
макромолекул - причины многообразия химического взаимодействия ГК.
Рассматривают три типа химических превращений ГК: 1) процессы, протекающие в
периферической, наиболее лабильной части макромолекул; 2) превращение
стабильной, «ядерной» части ГК; 3) преобразования глобального характера,
охватывающие макромолекулу в целом.
По механизму взаимодействия химические реакции,
протекающие при участии ГК, могут относиться к двум типам: 1) гетеролитические
реакции, где макромолекула ГК при формировании новой связи благодаря своему
полифункциональному характеру выступает как нуклеофильный или электрофильный
реагент; 2) радикальные или гомолитические реакции, в которых образование
ковалентной связи обусловлено взаимными одноэлектронными вкладами соединяющихся
реагентов.
В процессе гетеролитических реакций объектом
«атаки» ГК являются карбоксилы, фенольные и спиртовые гидроксилы, карбонильные
и другие функциональные группы, а также двойные связи в углеродном скелете.
Особенности строения ГК оказывают существенное влияние на характер химических
взаимодействий, протекающих при участии этих активных центров макромолекул.
Свертывание макромолекул ГК по длине приводит к
образованию сферических частиц. В этих условиях реакционная способность
макромолекул может заметно снижаться в силу экранирования от внешних
воздействий части ионогенных групп и вследствие других пространственных
затруднений. Одновременно изменяется и сам характер диссоциации функциональных
групп, что обусловлено свободной электрический энергией ионизации.
Важным типом реакции по ароматическому ядру ГК
являются реакции электрофильного замещения: нитрование, галогенирование,
алкилирование, диазотирование, нитрозирование и др. Среди гомолитических
процессов, протекающих при химических взаимодействиях ГК, важное место занимают
свободнорадикальные реакции. Парамагнитные свойства ГК дают основание
рассматривать их как стабильные свободны макрорадикалы.
1.6 Взаимодействие гумусовых кислот
с тяжелыми металлами
Весь спектр взаимодействий ГФК с металлами по
характеру связи ГФК-металл в образующихся соединениях можно разделить на три основных
типа [19,20,21]:
) Образование соединений солевого типа с ионной
связью между анионом ГФК и катионом металла (гуматы и фульваты щелочных
щелочноземельных металлов).
) Образование соединений с преимущественно
ковалентным характером связи ГФК-металл. По данному типу ГФК связываются с
поливалентными катионами (Al, Fe, Si), входящими в структуру глинистых частиц.
) Образование комплексных соединений с
координационной связью ГФК-металл. Данный тип связывания с ГФК характерен для
переходных металлов.
В большинстве соединений связь носит смешанный
характер с преобладанием того или иного типа в зависимости от природы катиона
[22]. Тяжелые металлы (ТМ) относятся к числу переходных и для них характерен
третий тип связывания с ГФК. Единого взгляда на природу комплексообразующих
центров ГФК до сих пор не существует [21]. Это связано со сложностью
качественной и количественной интерпретации данных тех методов, которые
применимы для исследований ГФК и дают информацию о типе образующихся комплексов
[49,50]. Однако, основываясь на исследованиях функционального состава ГФК, а
также ИК и ЭПР спектров комплексов ТМ с ГФК, полагают, что за взаимодействие
гумусовых кислот с тяжелыми металлами ответственны следующие структурные
фрагменты [21]:
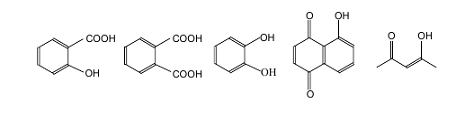
Рисунок 8 - структурные фрагменты взаимодействия
ГК с тяжелыми металлами.
Считается также возможным участие в данном
процессе групп, содержащих гетероциклический или аминный азот [23,24,21].
Однако, ввиду низкого процентного содержания азота, этот тип связывания не
может играть существенной роли. Согласно данным работ [21,25,26], в
металло-гуматном взаимодействии определяющую роль играют карбоксильные группы,
входящие в состав двух основных типов связывающих центров: салицилатных и
фталатных. В то же время в работах [27,28] указывается на существенный вклад
группировок типа пирокатехина. Рассмотренные связывающие центры характерны для
ГФК терригенного происхождения с высоким содержанием ароматических структур.
Для ГФК аквагенного происхождения, отличающихся преобладанием в углеродном
скелете алифатических фрагментов, взаимодействие ГФК с тяжелыми металлами
определяется, в основном, карбоксилат-ионами, эфирными группами, и комбинациями
различных групп [29,30]. Следовательно, доля хелатных взаимодействий для
аквагенных ГФК существенно меньше, что, возможно, и является причиной более
низкой устойчивости их комплексов [30].
1.7 Исследование
структурно-группового состава гумусовых кислот методами спектроскопии ядерного
магнитного резонанса
Трудно переоценить роль 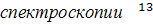
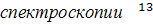 С ЯМР в получении информации о
структуре гумусовых кислот. В 50-х - 70-х годах нынешнего столетия принципы
строения углеродного скелета гумусовых кислот оставались предметом оживленной
дискуссии, в которой часть исследователей придерживались концепции об
алифатическом характере структуры гумусовых кислот, а другая часть
рассматривала структуру гумусовых кислот как исключительно ароматическую.
Получение в 1976 г. первого спектра 13С ЯМР ФК почв [31] позволило
дать однозначный ответ на вопрос о строении углеродного скелета этих
соединений, показав, что в нем в сопоставимых количествах содержатся как
ароматические, так и алифатические фрагменты. Впоследствии эти данные были
подтверждены для гумусовых кислот различного происхождения многочисленными
исследованиями. В ЯМР 13С спектрах гумусовых кислот были обнаружены
сигналы, отнесенные к разным фрагментам структуры этих веществ, что позволило
существенно углубить качественные знания о фрагментном составе гумусовых кислот
[32].
С ЯМР в получении информации о
структуре гумусовых кислот. В 50-х - 70-х годах нынешнего столетия принципы
строения углеродного скелета гумусовых кислот оставались предметом оживленной
дискуссии, в которой часть исследователей придерживались концепции об
алифатическом характере структуры гумусовых кислот, а другая часть
рассматривала структуру гумусовых кислот как исключительно ароматическую.
Получение в 1976 г. первого спектра 13С ЯМР ФК почв [31] позволило
дать однозначный ответ на вопрос о строении углеродного скелета этих
соединений, показав, что в нем в сопоставимых количествах содержатся как
ароматические, так и алифатические фрагменты. Впоследствии эти данные были
подтверждены для гумусовых кислот различного происхождения многочисленными
исследованиями. В ЯМР 13С спектрах гумусовых кислот были обнаружены
сигналы, отнесенные к разным фрагментам структуры этих веществ, что позволило
существенно углубить качественные знания о фрагментном составе гумусовых кислот
[32].
 С ЯМР спектр гумусовых кислот
приведен на рисунке 9. Как видно из рисунка, полидисперсность и химическая
гетерогенность гумусовых кислот приводит к тому,
С ЯМР спектр гумусовых кислот
приведен на рисунке 9. Как видно из рисунка, полидисперсность и химическая
гетерогенность гумусовых кислот приводит к тому, 
 С ЯМР спектры этих соединений не
содержат разрешенных пиков, относимых к
С ЯМР спектры этих соединений не
содержат разрешенных пиков, относимых к 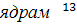
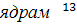 С определенного типа, а представляют
собой суперпозицию большого числа слабовыраженных сигналов.
С определенного типа, а представляют
собой суперпозицию большого числа слабовыраженных сигналов.
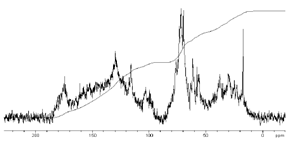
Рисунок 9 - Типичный 13С ЯМР спектр ГК почв
В связи с этим традиционная в
спектроскопии ЯМР задача отнесения индивидуальных сигналов не является актуальной
в случае спектров гумусовых кислот [33]. Общий подход к анализу такого рода
спектров предусматривает выделение в них групп сигналов или спектральных
областей, соответствующих атомам углерода со сходным химическим окружением, и
определение сравнительной интенсивности этих областей. Как видно из рисунка 9.,
в 
 С ЯМР спектре гумусовых кислот
наблюдается лишь один отчетливый минимум с нулевой интенсивностью сигнала при
90 м.д., в остальных случаях невозможно провести точное разделение различных
групп сигналов из-за их частичного перекрывания. Выбор разбиения спектров
гумусовых кислот на группы сигналов представляет собой неоднозначную задачу.
Для выбора границ разбиения анализируют положение локальных минимумов в
спектрах гумусовых кислот и привлекают табличные данные по химическим сдвигам
С ЯМР спектре гумусовых кислот
наблюдается лишь один отчетливый минимум с нулевой интенсивностью сигнала при
90 м.д., в остальных случаях невозможно провести точное разделение различных
групп сигналов из-за их частичного перекрывания. Выбор разбиения спектров
гумусовых кислот на группы сигналов представляет собой неоднозначную задачу.
Для выбора границ разбиения анализируют положение локальных минимумов в
спектрах гумусовых кислот и привлекают табличные данные по химическим сдвигам 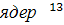
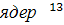 С в органических соединениях в
сочетании с имеющейся информацией об основных структурных элементах гумусовых
кислот [34].
С в органических соединениях в
сочетании с имеющейся информацией об основных структурных элементах гумусовых
кислот [34].
Наиболее распространенным является
выделение 
 С ЯМР спектре гумусовых кислот пяти
наиболее удовлетворительно разделенных диапазонов химических сдвигов,
соответствующих незамещенным и О- замещенным алифатическим, ароматическим,
карбоксильным и карбонильным атомам углерода (таблица 3)
С ЯМР спектре гумусовых кислот пяти
наиболее удовлетворительно разделенных диапазонов химических сдвигов,
соответствующих незамещенным и О- замещенным алифатическим, ароматическим,
карбоксильным и карбонильным атомам углерода (таблица 3)
Таблица 3- Основные диапазоны сигналов в спектре
гумусовых кислот.
|
Тип
атомов углерода
|
Обозначение
|
Диапазон
сиг., м.д
|
|
С-
и Н- замещенные алифатические атомы углерода
|
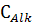
|
0-50
|
|
О-замещенные
алифатические атомы углерода
|
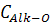
|
50-110
|
|
Ароматические
атомы углерода
|
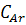
|
110-165
|
|
Атомы
углерода карбоксильных групп и их производных
|
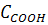
|
165-180
|
|
Атомы
углерода карбонильных групп
|
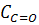
|
180-220
|
В зависимости от цели исследования и
желаемой детализации получаемой информации перечисленные в таблице 3 основные
спектральные диапазоны часто подразделяют на более узкие (таблица 4). При этом
детализация спектральной информации сопровождается снижением достоверности
количественных характеристик определяемого состава [32]. Это обуславливает
проблему оптимизации выбора соотношения информативности и достоверности при 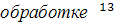
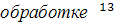 С ЯМР спектров гумусовых кислот,
которая в настоящее время решается каждым исследователем сугубо индивидуально.
С ЯМР спектров гумусовых кислот,
которая в настоящее время решается каждым исследователем сугубо индивидуально.
Таблица 4 - Выделение узких
диапазонов сигналов в 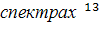
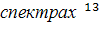 С ЯМР гумусовых кислот.
С ЯМР гумусовых кислот.
|
Диапазон,
м.д
|
Отнесение
сигналов
|
|
10-25
|
Концевые
метильные группы алкильных цепей
|
|
15-50
|
Метиленовые
группы алкильных цепей
|
|
25-50
|
Метиновые
группы алкильных цепей
|
|
29-33
|
Углерод
метиленовых групп в β- и γ- положении
к СООН- группе
|
|
35-50
|
Углерод
метиленовых групп разветвленных алкильных цепей
|
|
41-42
|
Метиленовые
группы в α-положении
к COOH- группе
|
|
51-61
|
Углерод
метоксильных и этоксильных групп
|
|
57-65
|
Углерод
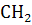 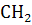 -ОН групп -ОН групп
|
|
65-85
|
Углерод
СН(ОН) групп
|
|
90-110
|
Ацетальный
углерод
|
|
118-122
|
Углерод
ароматических колец в орто-положении к О-заместителю
|
|
120-140
|
Незамещенный
или алкил-замещенный углерод ароматических колец
|
|
140-162
|
О-
и N-
замещенный углерод ароматических колец
|
|
162-190
|
Углерод
карбоксильных групп, сложных эфиров и амидов
|
|
190-220
|
Углерод
кетонных и альдегидных групп
|
Важно отметить принципиальную нестрогость
количественного анализа спектра гумусовых кислот при разбиении на диапазоны в
связи с невозможностью количественного учета перекрывания групп сигналов. В
случае низкомолекулярных соединений для разделения набора перекрывающихся
сигналов используют аппроксимацию пиков лоренцевыми кривыми [35]. Для спектров
полимеров описаны подходы к такому разделению, основанные на аппроксимации
гауссовыми кривыми [36]. Однако в связи с тем, что в спектрах гумусовых кислот
форма пиков в общем случае не является ни лоренцевой, ни гауссовой, а в ряде случаев
невозможно определить и положение пиков при детальном разбиении, применение
такого подхода не позволяет получить существенного повышения точности и
надежности количественного анализа спектров.
Следует отметить, что отнесение некоторых групп
сигналов до сих пор является предметом дискуссии. Так, группу сигналов в
области 90-110 м.д. длительное время относили к незамещенным ароматическим
атомам С в орто- положении к гидроксильной группе. Однако в последние годы
преобладает мнение, что большая часть этих сигналов обусловлена атомами
углерода ацетального типа в полисахаридных циклах периферии гумусовых кислот. В
области 44-60 м.д. некоторые исследователи выделяют группу сигналов N-
замещенного углерода метиленовых групп, однако отделить эти сигналы от находящихся
в этой же области находится сигналов метоксильных и незамещенных СН-групп
представляется невозможным.
Химические сдвиги большинства
сигналов 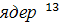
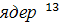 С не зависят от выбора условий регистрации
спектра и растворителя. Однако сигналы карбоксильных групп и атомов
ароматического углерода, замещенного ОН- группой, при переходе от органических
апротонных растворителей к воде и растворам щелочей смещаются в слабое поле в
связи с ионизацией соответствующих групп.
С не зависят от выбора условий регистрации
спектра и растворителя. Однако сигналы карбоксильных групп и атомов
ароматического углерода, замещенного ОН- группой, при переходе от органических
апротонных растворителей к воде и растворам щелочей смещаются в слабое поле в
связи с ионизацией соответствующих групп.
1.8 Использование электронного
парамагнитного резонанса при изучении почв
В последние годы в биохимии почв остро встала
проблема совершенствования методологических подходов к изучению органического
вещества и в особенности почвенного гумуса. Многие традиционные методы, такие,
например, как фракционно-групповой анализ гумуса и др. во многом исчерпали свои
возможности, а целый ряд предлагаемых методов оказались либо сложными для
массового применения, либо косвенными и трудно интерпретируемыми. Причина этого
отчасти заключается в сложном строении и гетерополидисперсном характере
почвенного гумуса. В результате, при изучении процессов трансформации
органического вещества исследователи сталкиваются с трудно сопоставимыми и
зачастую с противоречивыми данными. Таким образом, необходим выход на новый
уровень методологического обеспечения, связанный с использованием современных
методов изучения молекулярной структуры и функциональных свойств гумусовых
веществ.
Одним из таких методов, позволяющих получать
прямую информацию о важнейших физико-химических параметрах гумусовых
соединений, является метод электронного парамагнитного резонанса (ЭПР). ЭПР
обладает высокой чувствительностью и дает многообразную информацию о строении
веществ, содержащих свободные радикалы, которые благодаря большому запасу
энергии и высокой активности играют большую роль в большинстве химических
реакций между органическими, органе минеральными и минеральными соединениями в
почвах. Изучение свободнорадикальной структуры почв и гумусовых веществ
позволяет судить об их реакционной способности и является актуальной задачей в
решении комплексной проблемы формирования и превращения органического вещества
почв.
Важную роль неспаренных (свободных) электронов в
любой химической или биологической системе обусловливает большой запас энергии
и соответственно высокая активность, которой обладают эти электроны. Известно,
что большинство химических реакций идет через стадию образования свободных
радикалов, обладающих неспаренным электроном. Свободный радикал может быть
короткоживущим (например, в ходе реакции неорганических молекул) и стабильным
(обычно в сложных органических системах). В литературе, посвященной
использованию метода ЭПР в изучении природных высокомолекулярных органических
соединений, для обозначения группировок атомов или участков молекул, обладающих
неспаренным свободным электроном, принят термин "парамагнитные
центры". Все вещества, содержащие неспаренные электроны, можно
подразделить на две большие группы. В первой - неспаренные электроны связаны
либо со всей молекулой, либо с большей ее частью. Эти неспаренные электроны
перемещаются по сильно делокализованным молекулярным орбиталям и обуславливают
активность атомных группировок, входящих в состав молекулы. Изучение этих неспаренных
делокализованных электронов важно для понимания специфики реакций, идущих через
стадию свободных радикалов, и механизма процессов полимеризации или образования
промежуточных продуктов каких-либо биохимических реакций. Ко второй - относят
те, в которых неспаренный электрон связан только с каким-либо атомом, а не
перемещается по делокализованной молекулярной орбитали, охватывающей многие
атомы.
Таким образом, цель настоящей работы заключалась
в определении радикальной активности почв методом ЭПР спектроскопии и
установлению корреляции между их происхождением, функциональными
характеристиками и качественным и количественным составом гуминовых (ГК) и
фульвокислот (ФК).
1.9 Строение почвенного профиля.
Почвенные горизонты
Почвенным профилем называется совокупность
почвенных горизонтов, объединенных единым процессом почвообразования. Строение
почвенного профиля определяется морфологическими признаками отдельных почвенных
горизонтов, закономерно переходящих один в другой [37].
Строение профиля большинства почв, если их
рассматривать в разрезе сверху вниз, сравнительно однотипно: сверху лежит
небольшой слой растительных остатков, образующих лесную подстилку, травяной
войлок, или дернину; глубже расположен горизонт, в разной степени окрашенный
гумусом, или перегноем, а под ним образуется горизонт, переходный к материнской
породе (Рисунок 10).
Мощность, или глубина, почвенного профиля
зависит от типа и времени протекающего почвообразовательного процесса и может
изменяться в очень широких пределах.
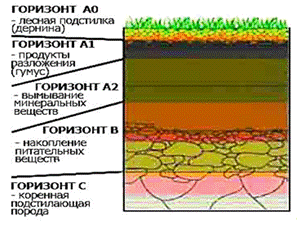
Рисунок 10 - Строение почвенного профиля.
Строение и мощность почвенного профиля позволяют
судить о характере и направлении почвообразовательных процессов, применении
систем обработки почв, необходимости внесения удобрений, видах выращиваемых
культур, об устойчивости и продуктивности лесов. Для характеристики почвенного
профиля в целом производят описание отдельных его горизонтов.
Генетические почвенные горизонты - это
формирующиеся в процессе почвообразования однородные, обычно параллельные
земной поверхности слои почвы, составляющие почвенный профиль и различающиеся
между собой по морфологическим признакам, составу и свойствам [51].
Каждому из горизонтов дается буквенное
обозначение. Буквами обозначают генетические горизонты, а сочетаниями букв и
буквенно-цифровыми индексами - переходные горизонты и подгоризонты. Приняты
следующие обозначения:
Т-торф, органогенный горизонт.
А- горизонт биогенного накопления органического
вещества в почвах. Обычно называется гумусовым, перегнойно- аккумулятивным или
дерновым горизонтом.
Ао- лесная подстилка, травяной войлок, дернина.
Апах- пахотный горизонт почвы.
А1- гумусовый, дерновый,
перегнойно-аккумулятивный, перегнойно-элювиальный горизонт дерново-подзолистых,
серых лесных и осолоделых почв; имеет серый или черный цвет.
А2- элювиальный ( или горизонт вымывания).
Подзолистый или осолоденелый. Обычно окрашен в белесоватые, белесые и белые
тона;
В - иллювиальный, или горизонт вымывания, в
подзолистых, серых лесных, каштановых и некоторых других породах.
G- глеевый горизонт,
характерен для почв с постоянным избыточным увлажнением болотных почв.
С- материнская рыхлая горная порода.
Д- подстилающая горная порода.
Кроме того, применяют буквенные индексы:
g- для оглеенных
горизонтов;
с- скопления водорастворимых солей.
г- скопления гипса; цифровые индексы-1,2,3 и тд.
2. Экспериментальная часть
.1 Реактивы и оборудование
Были использованы следующие
реактивы: MnCl2, CuCl2, 0,05 н. и
1н. 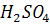
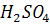 , 0,1 н. NaOH; насыщенный
раствор
, 0,1 н. NaOH; насыщенный
раствор 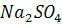
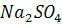 , сухой Ca
, сухой Ca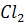
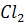 , 0,1 н. HCl, ацетон,
уголь марки АГ-3.
, 0,1 н. HCl, ацетон,
уголь марки АГ-3.
Регистрацию ЭПР спектров исследуемых
почв и препаратов гумусовых веществ проводили на ЭПР спектрометре JES-FA300 при СВЧ
мощности в резонаторе 20-40 мВт и частоте СВЧ 9.372 ГГц.
2.2 Отбор проб
Образцы почв отбирались на территории
Краснодарского края в соответствии с ГОСТ 28168-89 «Почвы. Отбор проб». В
первой партии были отобраны 16 проб участка рисовой оросительной системы ЭСП
«Красное» Красноармейского района (тип почвы: лугово-черноземная мощная
тяжелосуглинистая на деградированных лессовидных суглинках) с различными
вариантами возделывания риса, а также целинного участка, расположенного в
непосредственной близости с рисовой системой (Таблица 15).
Вторая партия образцов была отобрана на
территории рисовой оросительной системы ООО «Зерновая компания «Полтавская» Красноармейского
района на разных горизонтах и типах почв (Таблица 16).
Для сравнения были использованы образцы почв и
препаратов гумусовых кислот северо-западного региона России, предоставленные
Институтом биологии РАН республики Коми. Это торфянисто-подзолисто-глеевая
почва, болотистая, подзолистая и подзолисто поверхностно-глеевая (Таблица 17).
Таблица 15 - Образцы почв ЭСП «Красное»
Красноармейского района
|
код
образца
|
Генетический
горизонт
|
Глубина
отбора образца, см
|
Режим
использования почвы
|
|
1
|
А1
|
0-20
|
Целина
|
|
2
|
А1'
|
40-60
|
|
|
3
|
Апах(карта
1, чек 2)
|
0-20
|
Бессменное
возделывание риса с 1937 года с внесением только минеральных удобрений
|
|
4
|
А1'
(карта 1, чек 2)
|
20-40
|
|
|
5
|
А1''
(карта 1, чек 2)
|
40-60
|
|
|
7
|
Апах(карта
1, чек 2)
|
0-20
|
Бессменное
возделывание риса с внесением минеральных удобрений и сидератов (озимая рожь)
|
|
8
|
А1'
(карта 1, чек 2)
|
20-40
|
|
|
9
|
А1''
(карта 1, чек 2)
|
40-60
|
|
|
10
|
Апах(карта
1, чек 2)
|
0-20
|
Бессменное
возделывание риса с внесением только сидератов (озимая рожь)
|
|
11
|
А1'
(карта 1, чек 2)
|
20-40
|
|
|
12
|
А1''
(карта 1, чек 2)
|
40-60
|
|
|
13
|
Апах(карта
1, чек 1)
|
0-20
|
Бессменное
возделывание риса без удобрений
|
|
14
|
20-40
|
|
|
15
|
А1''
(карта 1, чек 1)
|
40-60
|
|
|
32
|
Апах(карта
1, чек 2)
|
0-20
|
Бессменное
возделывание риса без удобрений
|
|
33
|
А1''
(карта 1, чек 2)
|
40-60
|
|
Таблица 16 - Образцы почв ООО «Зерновая компания
Полтавская»
|
код
образца
|
Генетический
горизонт
|
Глубина
отбора образца, см
|
Наименование
почвы
|
|
1м
|
Апах
|
0-20
|
Рисовая
луговая выщелоченная слабогумусная тяжелосуглинистая на аллювиальных глинах
|
|
2м
|
А1
|
20-40
|
|
|
3м
|
А1'
|
40-60
|
|
|
4м
|
АВ
|
60-80
|
|
|
5м
|
Апах
|
0-20
|
Рисовая
аллювиальная луговая насыщенная слабогумусная тяжелосуглинистая на
аллювиальных тяжелых суглинках
|
|
6м
|
А1
|
20-40
|
|
|
7м
|
В
|
40-60
|
|
|
8м
|
Апах
|
0-20
|
Рисовая
луговая выщелоченная слабосолончаковатая слабогумусная легкоглинистая на
аллювиальных глинах
|
|
9м
|
А1
|
20-40
|
|
|
10м
|
В
|
40-60
|
|
|
11м
|
Апах
|
0-20
|
Рисовая
аллювиальная луговая насыщенная малогумусная легкоглинистая на погребенных
почвах
|
|
12м
|
А1
|
20-40
|
|
|
13м
|
АВ
|
40-60
|
|
|
14м
|
Апах
|
0-20
|
Рисовая
лугово-болотная легкоглинистая на аллювиальных глинах
|
|
15м
|
А1
|
20-40
|
|
|
16м
|
Вg
|
40-60
|
|
Таблица 17 - Образцы препаратов ГК и ФК почв
северо-западного региона России
|
Наименование
образца
|
Генетический
горизонт
|
Глубина
отбора образца, см
|
Наименование
почвы
|
|
ГК
Тпг А0
|
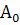
|
0-5
|
Торфяная
перегнойная глеевая
|
|
ФК
Тпг А0
|
|
0-5
|
|
|
ГК
Тпг А0А1
|
|
5-10
|
|
|
ФКТпг
А0А1
|
|
5-10
|
|
|
ГК
Тпг G
|
G
|
10-28
|
|
|
ФКТпг
G
|
G
|
10-28
|
|
|
ГК
Тб1 Oe
|
Oe
|
0-9
|
Торфяная
болотная
|
|
ФК
Тб1 Oe
|
Oe
|
0-9
|
|
|
ФК
Тб1 G
|
G
|
17-25
|
|
|
ГК
Тб1 Апогр
|
Апогр
|
50-60
|
|
|
ФК
Тб1 Апогр
|
Апогр
|
50-60
|
|
|
ГК
Тб2 Oe
|
Oe
|
5-10
|
|
|
ФК
Тб2 Oe
|
Oe
|
5-10
|
|
|
ГК
Тдер(пг)
|
Тпах
|
0-5
|
Торфяная
дерновая перегнойная глеевая
|
|
ФК
Тдер (пг)
|
Тпах
|
0-5
|
|
|
ГК
Тдер (пг)2
|
|
5-10
|
|
|
ФК
Тдер (пг)2
|
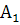
|
5-10
|
|
|
ГК,
П 1
|
|
0-3
|
Подзолистая
|
|
ФК,
П 1
|
|
0-3
|
|
|
ГК,
П 2
|
|
0-2
|
|
|
ФК,
П 2
|
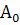
|
0-2
|
|
2.3 Выделение гуминовых кислот
В настоящее время для выделения из почв
препаратов гуминовых кислот используется два метода: принятый в Российской
школе почвоведения [38] и рекомендованный Международным гуминовым обществом -
International Humic Substances Society (IHSS) [39]. В основе обоих методов лежит
общий принцип: щелочная экстракция гуминовых веществ из почв. Однако в
методическом плане имеется ряд различий.
Одно из них заключается в количестве экстракций,
используемых для выделения препарата: согласно принятому в России методу почву
экстрагируют щелочью не менее трех раз, экстракты объединяют для получения
интегральной пробы из которой затем и выделяют препараты ГК. В тоже время
методика, рекомендованная IHHS, предусматривает только однократную экстракцию
почвы щелочью и, соответственно, выделение ГК осуществляют из первичного
щелочного экстракта.
К другим различиям относятся: а) проведение
щелочной экстракции в атмосфере азота, предусмотренное методикой IHHS; б)
коагуляция минеральных взвесей: согласно принятому в России методу проводится в
щелочном экстракте хлоридом натрия, а в методе, рекомендованном IHHS, эта
операция осуществляется с ГК, уже отделенным от фульвокислот, и коагулянтом
служит KCl; в) в рекомендациях IHHS дополнительно предусмотрена обработка
осадка ГК смесью 0.1 М HCl / 0.3 M HF для окончательного удаления тонких
минеральных взвесей.
В данной работе была использована методика,
принятая Российской школой почвоведения. Методика включает в себя следующие
стадии:
а) Пробоподготовка. Перед сушкой образца из него
тщательно отбирают слаборазложившиеся органические остатки (корни, ветки и
т.п.). Образцы высушивают при комнатной температуре, растирают в фарфоровой
ступке, при этом продолжая отбор корешков, и пропускают через сито 1 мм. Из
образца повторно с максимально возможной тщательностью отбирают неразложившиеся
органические остатки.
б) Декальцирование. Декальцирование
проводят только для карбонатных почв. Навеску образца 100 г залили 0,05 н
раствором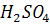
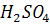 в соотношении 1:10 и оставили на
ночь. Затем декальцинат фильтровали через рыхлый фильтр, перенося на него часть
почвы.
в соотношении 1:10 и оставили на
ночь. Затем декальцинат фильтровали через рыхлый фильтр, перенося на него часть
почвы.
в) Экстракция. После фильтрации
образец почвы сразу же заливали 0,1 н. раствором NaOH в соотношении
почва-раствор 1:10, тщательно взбалтывали и оставляли на 6-8 часов. После
этого, не взмучивая почву, максимально полно слили надосадочный раствор с
помощью сифона и залили почву новой порцией раствора щелочи в том же
соотношении. Тщательно перемешали раствор и оставили до следующего дня с таким
расчетом, чтобы общее время взаимодействия почвы с раствором щелочи составляло
24 часа. Вторую порцию также сифонировали и объединили с первой.
г) Коагуляция минеральных коллоидов
и центрифугирование. Для коагуляции диспергированных в щелочном растворе
минеральных коллоидов в него добавляли насыщенный раствор коагулятора 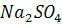
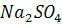 (приготовленный предварительным
растворением избытка сульфата натрия в нагретой дистиллированной воде), по 250
мл на 1 литр щелочной вытяжки, и после тщательного перемешивания оставили на
час для более полной коагуляции коллоидов. После этого раствор центрифугировали
на центрифуге при 13000 об/мин в течение 1 часа.
(приготовленный предварительным
растворением избытка сульфата натрия в нагретой дистиллированной воде), по 250
мл на 1 литр щелочной вытяжки, и после тщательного перемешивания оставили на
час для более полной коагуляции коллоидов. После этого раствор центрифугировали
на центрифуге при 13000 об/мин в течение 1 часа.
д) Осаждение. Осаждение ГК проводили
в очищенном щелочном экстракте постепенным добавлением 1 н. раствора 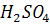
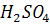 до pH = 1,1-1,2 и оставляли на
ночь. На следующий день сифонировали надосадочную жидкость и отжимали осадок ГК
на центрифуге в течение 15 минут, затем промывали в центрифужных стаканах с
повторным центрифугированием сначала водой подкисленной серной кислотой, затем
чистой водой до начала диспергирования ГК. Надосадочная жидкость включает в
себя фульвокислоты, поэтому ее слили в отдельную емкость, для последующего
выделения фульвокислот.
до pH = 1,1-1,2 и оставляли на
ночь. На следующий день сифонировали надосадочную жидкость и отжимали осадок ГК
на центрифуге в течение 15 минут, затем промывали в центрифужных стаканах с
повторным центрифугированием сначала водой подкисленной серной кислотой, затем
чистой водой до начала диспергирования ГК. Надосадочная жидкость включает в
себя фульвокислоты, поэтому ее слили в отдельную емкость, для последующего
выделения фульвокислот.
е) Диализ. Сушка. Гель ГК после
центрифугирования и промывки поместили в пакеты из полупроницаемого т.н.
диализного целлофана и разместили в больших емкостях с дистиллированной водой.
Пакеты опустили в воду до половины их высоты. Первые три дня воду меняют каждый
день, далее через 5 дней. Полноту удаления контролировали качественной реакцией
на сульфаты в воде, стекающей с мешка после подъема из диализного сосуда.
Препараты ГК из диализных пакетов перенесли в чашки Петри, после чего сушили в
вакуумном шкафу над CaCl2. Затем
препараты переместили в бюксы и досушивали в эксикаторе над 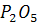
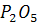 .
.
2.4 Методика выделения фульвокислот
по Форситу
а) Подготовка активированного угля. Для
проведения разделения, в бюхнеровскую воронку вкладывали два фильтра, смачивали
водой и слегка отсасывали с помощью водоструйного насоса. Затем насыпали слой
угля (пригоден уголь марки АГ-3) толщиной 3-4 см. Уголь промывают на воронке
при непрерывном отсасывании 0,1 н NaOH до обесцвечивания вытекающей жидкости.
Затем уголь смачивали небольшой порцией ацетона и продолжали промывать 0,1 н
NaOH до обесцвечивания вытекающей жидкости. Чередование ацетона и NaOH
продолжали до полной очистки угля. Далее уголь промывали 500 мл 0,1 н раствором
HCl и после этого, большим количеством дистиллированной воды. Об окончании
промывки судили по отрицательной реакции на ионы SO32-.
б) Адсорбция фульвокислот. Через очищенный уголь
пропускали надосадочную жидкость, оставшуюся после осаждения ГК. Прошедший
через уголь раствор должен быть бесцветным или слабоокрашенным.
в) Очистка фульвокислот. После пропускания всего
объема раствора уголь промывают 1 л 0,1 н HCl. Затем проводили элюирование
ацетоном, содержащим 10 % (по объему) воды; промывание закончили после
обесцвечивания фильтрата. После ацетона уголь промывали водой. Промывание
закончили, когда при добавлении к элюату избытка ацетона не образовывалось
осадка.
г) Выделение фульвокислот. Фульвокислоты, адсорбированные
на угле, снимали промыванием угля 0,5 н NaOH. Щелочной раствор имеет интенсивно
винно-красный цвет, объем его зависит от количественного содержания ФК. Когда
элюат стал бесцветным, уголь смочили небольшим количеством ацетона и снова
элюировали 0,5 н NaOH. Промывание закончили по обесцвечиванию раствора. Обе
щелочные фракции объединили.
д) Очистка и концентрирование фульвокислот.
Полученный элюат содержит натриевые соли ФК и избыток NaOH. Для получения
свободных ФК, щелочной элюат нейтрализовали соляной кислотой и пропускали через
катион КУ-2 в Н форме. На выходе из катионита pH раствора не превышал 4. Затем
весь элюат выпаривали при температуре не выше 40°С до объема
около 100 мл.
е) Диализ. Сушка. Раствор с осадком ФК очищали
диализом и сушили по аналогии с препаратами ГК.
2.5 Получение ЭПР спектров
Были сняты спектры ЭПР для всех образцов почв и
выделенных из них препаратов гумусовых веществ. Для регистрации ЭПР спектров
использовался ЭПР спектрометр JES-FA300. Параметры получения спектров следующие:
СВЧ мощность в резонаторе 20-40 мВт, частота СВЧ- 9.372 ГГц. Величина модуляции
и усиление варьировались в зависимости от ширины линий и содержания свободных
радикалов в образцах. В качестве эталона использовали ТЭМПОЛ с известным
содержанием свободных радикалов. Концентрацию парамагнитных центров в образцах
определяли методом сравнения относительных интенсивностей сигналов образца и
эталона по формуле:
= (ΔΗ)²
Y,
где ΔΗ
- ширина, Y- амплитуда линии. Абсолютная ошибка определения концентрации свободных
радикалов методом ЭПР составляет 10-20%.
2.6 Получение ЯМР спектров
ЯМР спектры были получены для выборочных
образцов препаратов гумусовых веществ с целью проведения сравнительного анализа
структурно-группового состава. Вследствие особенностей строения ГФК и их малой
концентрации в образцах спектры ЯМР почв не снимались. Для регистрации 13С
ЯМР спектров использовался ЯМР спектрометр JSM
ECA-400. Параметры
получения спектров следующие: методика CP
MAS, скорость вращения
ротора 6 кГц, количество накоплений 10000.
3. Обсуждение результатов
.1 Сравнительный анализ ЭПР спектров
почв и препаратов гуминовых и фульвокислот
В ходе работы были сняты ЭПР спектры почв и
выделенных из них препаратов гумусовых кислот.
Сравнивая между собой ЭПР спектры почв, взятых с
органогенного и минерального горизонтов (рисунок 13,14) видно, что в
минеральном горизонте сигнал практически отсутствует, тогда как в органогенном
горизонте он достаточно интенсивен. Это связано с тем, что ГК и ФК
накапливаются главным образом в органогенном горизонте.
Таким образом, для дальнейшего анализа ЭПР
спектров почв были использованы только образы проб органогенного горизонта.
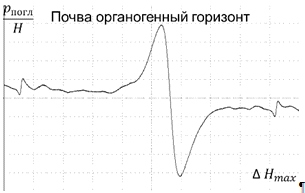
Рисунок 13- ЭПР спектр почвы, органогенный
горизонт
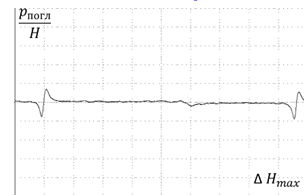
Рисунок 14 - ЭПР спектр почвы, минеральный
горизонт
На ЭПР спектрах как почв, так и препаратов
гуминовых и фульвокислот можно идентифицировать одну интенсивную широкую линию
с g=2,005. Полученный g-фактор близок к значению g-фактора свободного
электрона, что указывает либо на существование сильно делокализованной
молекулярной орбитали, либо на такое состояние, при котором орбитальная
составляющая магнитного момента электрона близка к нулю. Это говорит о
присутствии в структуре гумусовых веществ свободных радикалов.
Сравнивая между собой препараты из торфяной
перегнойно-глеевой почвы (рис. 15) видно, что содержание свободных радикалов в
препаратах ГК значительно выше, чем у ФК. Это указывает на большую склонность
гуминовых кислот, выделенных из торфянисто-подзолисто-глееватой почвы, к
реакциям полимеризации и комплексообразования по свободно-радикальному
механизму. Содержание также зависит от глубины разреза, что свидетельствует о
большей термодинамической устойчивости молекул ГК минеральных горизонтов по
сравнению с ГК органогенных горизонтов.
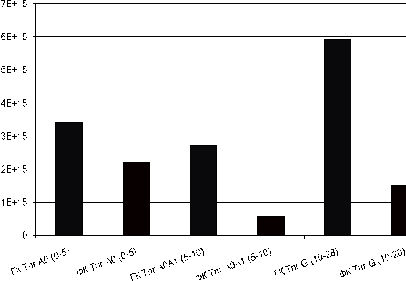
Рисунок 15 - Сравнение содержания свободных
радикалов в препаратах ГК и ФК из торфяной перегнойно-глеевой почвы.
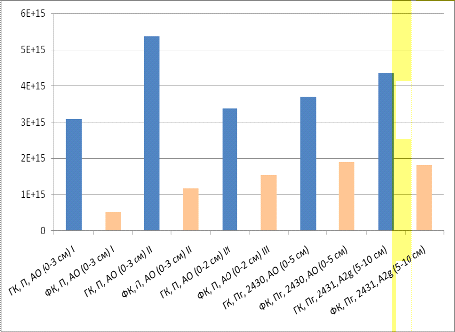
Рисунок 16 - Сравнение содержания свободных
радикалов в препаратах ГК и ФК для подзолистой и подзолистой глеевой почвы.
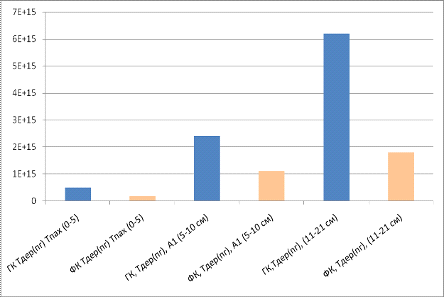
Рисунок 17 - Сравнение содержания свободных
радикалов в препаратах ГК и ФК для торфяной перегнойно-глеевой и торфяной
болотной почвы.
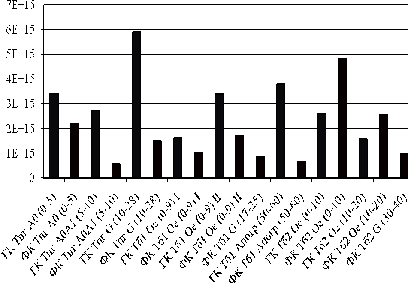
Рисунок 18 - Сравнение содержания свободных
радикалов в препаратах ГК и ФК для торфяной перегнойно-глеевой и торфяной
болотной почвы.
Несколько иная картина изменения концентрации
парамагнитных центров по профилям исследованных почв наблюдается для препаратов
ФК. Так, для ФК подзолистых почв характерно уменьшение содержания свободных
радикалов в минеральных горизонтах более чем в два раза. Таким образом, можно
заключить, что для подзолистой и подзолистой поверхностно-глееватой почв
препараты ФК минеральных горизонтов более термодинамически устойчивы, чем
аналогичные ФК органогенных горизонтов.
Образцы почв Краснодарского края отбирались на
землях сельхозназначения. В первой партии были отобраны 16 проб участка рисовой
оросительной системы ЭСП «Красное» Красноармейского района (тип почвы:
лугово-черноземная мощная тяжелосуглинистая на деградированных лессовидных
суглинках) с различными вариантами возделывания риса, а также почвы целинного
участка, расположенного в непосредственной близости с рисовой системой (Таблица
15).
Вторая партия образцов была отобрана на
территории рисовой оросительной системы ООО «Зерновая компания «Полтавская»
Красноармейского района на разных горизонтах и типах почв (Таблица 16).
Среди партии образцов почв рисовой оросительной
системы ООО «Зерновая компания «Полтавская», наибольшее содержание свободных
радикалов обнаружено у образцов, взятых с глубины 0-20 см и 20-40 см с рисовой
аллювиальной луговой насыщенной малогумусной легкоглинистой погребенной почвы.
Это свидетельствует, о том, что именно этот тип почвы наиболее пригоден для
дальнейшего посева. Проведя сравнение по горизонтам и глубинам разрезов партии
ООО «Полтавская», было установлено, что независимо от глубины отбора пробы,
содержание свободных радикалов было наибольшим в рисовой аллювиальной, луговой,
насыщенной малогумусной части. Наименьшим сигналом отличаются почвы, отобранные
с выщелоченного слабогумусного, легкоглинистого участка почвы.
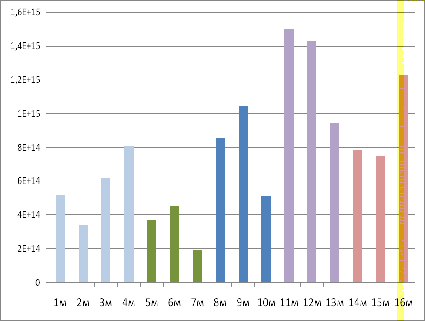
Рисунок 19 - Сравнение образцов ООО
«Полтавская».
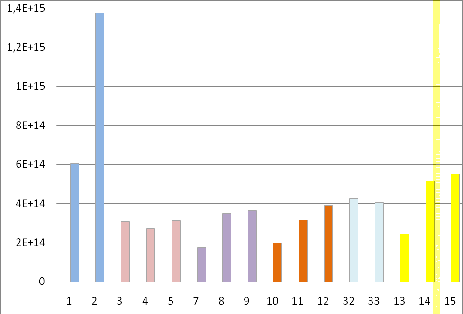
Рисунок 20 - Сравнение образцов ЭСП «Красное».
Проведя сравнения между образцами почвы ЭСП «
Красное» было установлено, что наибольшим содержанием свободных радикалов
обладают образцы, отобранные с целинного участка на глубине 0-20 см и 40-60 см.
Среди остальных участков, наибольшим сигналом отличались образцы, взятые с
участка на котором происходило бессменное возделывание риса без внесения
удобрений. Наименьшим сигналом обладали образцы, отобранные с участка, где
происходило бессменное возделывание риса с 1937 года, с внесением только
минеральных удобрений. На участке с внесением сидератов и минеральных удобрений
сигнал незначительно отличался от участка, на котором использовались только
минеральные удобрения. Таким образом, внесение удобрений уменьшает содержание
ГК и ФК в почвах.
При сравнении всех образцов по горизонтам
обнаружено, что и в первой, и во второй партии наибольший сигнал наблюдается на
пахотном горизонте. Это говорит о том, что распашка почвы значительно повышает
содержание в ней гуминовых веществ.
Сравнивая между собой спектры почв
Краснодарского края и почв северо-западного федерального округа России видно,
что наибольшим сигналом отличаются почвы северо-западного федерального округа,
концентрации парамагнитных центров в этих образцах значительно выше, что
свидетельствует о большем содержании в почвах гуминовых веществ.
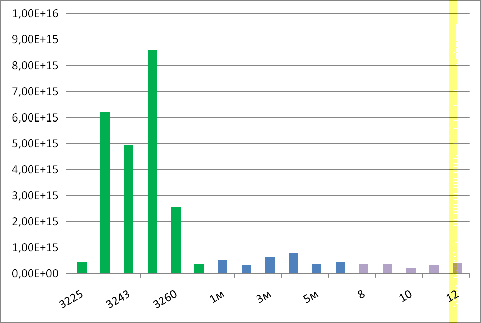
Рисунок 21 - Сравнение почв Краснодарского края
и почв северо-западного федерального округа России.
3.2 Исследование связывания
гуминовых веществ с тяжелыми металлами
В целях установления возможности определения
наличия и содержания подвижной формы марганца и меди в почвах и препаратах
гумусовых кислот были сняты спектры ЭПР препаратов ГК в присутствии MnCl2
и CuCl2.
Гуминовые кислоты были выделены из образцов №10
и 11м, показавших наибольшую парамагнитную активность по данным ЭПР. К образцу
ГК известной массы прибавлялось рассчитанное количество раствора соли металла.
Получившийся раствор высушивался, помещался в капилляр и снимался ЭПР спектр.
Согласно [52] максимальная емкость связывания
гуминовыми кислотами ионов меди зависит от рН и составляет в среднем 80 мг (Cu2+)
/ г (ГК) для рН 6. Это и обусловило выбор концентраций для проведения
эксперимента:
) 64 мг Cu2+
/г ГК; 2) 6,4 мг Cu2+
/г ГК; 3) 0,64 мг Cu2+
/г ГК.
) 55 мг Mn2+
/г ГК; 2) 5,5 мг Mn2+
/г ГК; 3) 0,55 мг Mn2+
/г ГК.
Спектры приведены в Приложении Б. В качестве
эталонных были получены спектры ЭПР 0,01М водных растворов хлоридов марганца и
меди.
Для марганца (II)
комплексообразование не приводит к появлению дополнительного расщепления или
другому характерному изменению спектра ЭПР. Наблюдаемое уширение линий в
спектре в большей степени может быть связано с высокой концентрацией ионов Mn2+
в образце. Таким образом, в исследованном диапазоне концентраций нельзя
использовать данные ЭПР для определения связанного иона Mn2+.
В то же время, высокая чувствительность позволяет определять общее содержание
ионов Mn2+
в образце в диапазоне концентраций 0,05 - 5 мг Mn
2+
/г ГК.
Анализ спектров показывает, что
комплексообразование изменяет симметрию иона меди (II),
что приводит к появлению дополнительного расщепления ЭПР сигнала. Наиболее
оптимальным является диапазон концентраций 0,1 - 5 мг Cu2+
/г ГК. При более высокой концентрации насыщается координационная способность ГК
и наблюдается главным образом спектр меди (II).
При более низких концентрациях в спектре будет превалировать сигнал ГК.
3.3 Исследование
структурно-группового состава гумусовых кислот по данным ЯМР 13С
Часть препаратов ГК и ФК была исследована
методом ЯМР 13С для установления корреляции между типом почвы,
парамагнитной активностью и структурно-групповым составом гумусовых кислот.
На основании анализа химических сдвигов в
спектрах ЯМР 13С в соответствии с таблицей 3 гумусовых веществ
подзолистых и болотно-подзолистых почв установлено, что в макромолекулах ФК
преобладают алифатические структуры, а в ГК - ароматические. Избыточное
увлажнение оказывает воздействие на молекулярную структуру гумусовых веществ и
приводит к накоплению в торфянисто-подзолисто-глееватой почве гу-миновых и
фульвокислот, обогащенных алифатическими структурами. Анаэробные условия и
наличие неокисленных алифатических фрагментов в гумусовых кислотах способствует
процессу оглеения в торфянисто-подзолисто-глееватой почве.
Освоение почв приводит к изменению молекулярной
структуры гумусовых кислот, что проявляется в относительном повышении доли
ароматических молекулярных фрагментов и уменьшении карбоксильных функциональных
групп. Гумусовые кислоты пахотных подзолистых почв менее агрессивны по
сравнению с целинными аналогами.
Сравнительный анализ структурного состава
гумусовых кислот подзолистых и болотно-подзолистых почв показал, что содержание
ароматических структур коррелирует с биологической активностью почв и скоростью
процессов гумификации: в северных регионах протекание этих процессов замедлено,
а в южных - интенсивнее.
Согласно [53] при повышенной биологической
активности почв происходит быстрое разрушение неспецифических соединений и
наиболее простых гумусовых веществ. Поэтому более высокая биологическая
активность подзолистых почв по сравнению с торфянисто-подзолисто-глееватыми
способствует окислению молекул ГК, что приводит к образованию и накоплению
наиболее устойчивых кислородсодержащих продуктов. ФК в подобных условиях
являются одними из наиболее доступных соединений для почвенных микроорганизмов
и поэтому быстро ими разрушаются. Это приводит к постоянному их обновлению. В
результате ФК подзолистых почв являются наиболее молодыми и менее окисленными.
Таким образом, содержание ароматических структур
коррелирует с биологической активностью почв и скоростью процессов гумификации.
Процессы гумификации растительных остатков в подзолистой почве протекает более
интенсивно, что способствует образованию агрессивных гумусовых кислот,
обогащенных кислородосодержащими функциональными группами с высоким содержанием
ароматических фрагментов. Гумусовые вещества торфянисто-подзолисто-глееватой
почвы, наоборот имеют более низкую степень ароматичности и содержат в своей
структуре в основном неокисленные алифатические фрагменты.
Сельскохозяйственное освоение также приводит к
увеличению доли ароматических фрагментов.
Выводы
. Концентрация свободных радикалов в гуминовых
кислотах в 2-10 раз выше, чем в молекулах фульвокислот. Концентрация
парамагнитных центров уменьшается в препаратах гуминовых кислот по профилю
исследованных почв, что свидетельствует о более высокой устойчивости их молекул
в минеральных горизонтах по сравнению с гуминовыми кислотами органогенных
горизонтов.
. Содержание свободных радикалов в погребенных
почвах значительно выше, чем на аллювиальных глинах и суглинках. Установлено,
что глубина отбора проб сильно не влияет на результат, гораздо важнее тип
горизонта.
. Содержание ароматических структур коррелирует
с биологической активностью почв и скоростью процессов гумификации. Гумусовые
вещества торфянисто-подзолисто-глееватой почвы имеют более низкую степень ароматичности.
В подзолистой почве гумификация протекает более интенсивно, что способствует
образованию гумусовых кислот с высоким содержанием ароматических фрагментов.
Сельскохозяйственное освоение также приводит к увеличению доли ароматических
фрагментов.
. Метод ЭПР может быть использован для прямого
определения содержания меди, связанной с ГК и ФК в диапазоне концентраций 0,1 -
5 мг Cu2+
/г ГК, а также общего содержания марганца в диапазоне концентраций 0,05 - 5 мг Mn
2+
/г ГК.
Список литературы
.Орлов
Д.С.// В. Сб.: Гуминовые вещества в биосфере. М.,
Наука.
1993, С.
16-27.
.Thurman
E.M.//Organic geochemistry of natural waters. Martinus Nijhof/Dr/W. Junk
Publishers, Dordrecht, The Netherlands,1985, 451P.
.Stevenson
F.J.// Humus Chemistry, Genesis, Composition, Reactions. John Wiley& Sons,
New York ,1982, 443P.
.Орлов
Д.С.//
В.
Сб.:
Гумусовые
кислоты
почв
и
общая
теория
гумификации.
М.:
Изд-во
МГУ,
1990. С.
56-64.
.Rice
J.A. and MacCarthy P.// Org.Geochemistry.,1991, 17(5), P. 159-165.
6.Перминова
И.В.// Анализ, классификация и прогноз свойств гуминовых кислот: дис. Доктора
химических
наук.-
МГУ,
2000. С.
359.
.Schnitzer
M. and Khan S.U.// In Humic substances in the environment. Marcel Decker, New
York, 1972, P. 12-17.
.Senesi
N.// Analit. Chem. Acta, 1990,232, P. 51-75.
.Lowe
L.E.// Sci. Total Environ., 1992,113, P. 133-145.
10.Попов
А.И.// Гуминовые вещества-свойства, строение, образование./С.-Петербургский
университет.- СПБ, 2004.С. 248.
.Мастерски
В. Исследование некоторых физико-химических свойств гуминовых кислот/В.
Мастерски, В. Логинов// Почвоведение.- 1959.- №2.-С. 134.
.Орлов
Д.С. Химия почв: учебник/ Д.С. Орлов, Л.К. Садовникова, Н. И. Суханова//- М.:
Высш. Шк., 2005. С. 558.
.Комиссаров
И.Д. Структурная схема и моделирование макромолекул гуминовых кислот/ И.Д.
Комиссаров, Л.Ф. Логинов// Гуминовые препараты: научные труды ТСХИ.- Тюмень,
1971. Том
XIV.- С.131-142.
.Felbeck
G/T/ Studies on high pressure hidrogenolysis of organic matter from a muck
soil// Soil Sci Sol America Proc.-1965.-V.29, №1.
.Flaig.
W// Zur Crundiagenforschuhg auf dem Gebret des Humus und der
Bodenfruchtbarkeit.- Koln und Opland,1956. С.
98-100.
.Перминова
И.В.,
Ященко
Н.Ю.,
Полынов
В.А.,
Петросян
В.С.,
Венедиктов
П.С.//
Экологическая
химия,
1995, 4(3), С. 234-238.
17.Орлов
Д.С. Гуминовые кислоты: функции и особенности строения/ Д.С. орлов, С.Н.
Чуков// Сб. тезисов IV съезда Докучаевского общества почвоведов.- Новосибирск,
2004.- Т.1-
С.
323.
.Schnitzer
M. Soil organic matter - the next 75 years// Soil Science.- 1991.-V.151-P.
41-56.
.Кононова
М. М. Органическое вещество почвы. М: Изд-во МГУ, 1963.С.343-350.
.Орлов
Д. С.// Гумусовые кислоты почв. М.: Изд-во МГУ, 1974, С. 287.
21.Stevenson
F.J.//Geochemistry of Soil Humic Substances. In: Humic substances in soil,
sediment and water. Aiken G.R., McKnight D.M., Wershaw R.L., MacCarthy P.
(Eds.), N.Y., John Wiley & Sons, 1985, Р.13-52.
22.Орлов
Д. С.//Химия почв. М., Изд-во МГУ, 1992, С. 259.
23.Rashid
M.A.// Geochemistry of marine humic compounds. Springer-Verlag, Oxford, 1985, Р.
243 .
.Schnitzer
M., Khan S.U//. Humic substances in the environment. N.Y., Marcel Decker, 1972,
Р.
19-23.
.Perdue
E.M.//Geochim. Cosmochim. Acta. 1984, v. 48, Р.
1435-1442.
.Manning
P. G., Ramamoorthy S.//J. Inorg. Nucl. Chem., 1973, v. 35, No. 5, Р.1577-1585.
.Ephraim
J.H., Boren H., Arsenie I., Pettersson C., Allard B.//Sci. Total Environ.,
1989, v. 81/82, Р.
615-624.
.Ephraim
J.//Sci. Total Environ., 1991, v. 108, Р.
261-273
.Rise
G., Sulbu B.//Sci. Total Environ., 1989, v. 81/82, Р.
137-142/
.Орлов
Д.С.//Почвоведение,
1972, N 7, С. 55-63.
.StuermerD.
H. and Payne J. R.// Geochem. Cosmochim. Acta, 1976,40, P. 1109-1114.
.Ricca
G. and Severini F.//Geaderma, 1993, 58, P. 233-244.
.Wershaw
R.L.// In:Humic substances in soil, sediment and water. Aiken G. R., McKnighy
D. M., New York., 1985, Chapter 22.
.Wilson
M.A., Gillam A. H., Collin P. J.// Chem. Geol., 1983, 60(3-4), P. 181-201.
.Sotak
C.Н.,
Dumoulin C. L., Levy G. C.// Anal. Chem., 1983,55,P.
782-787.
.Михайленко
В.И. и Михальчук В.В.// Ж. Прикл. Спектр., 1987, 46(4), С. 535-543.
.Александрова
Л.Н.// Химия, генезис и картография почв.- М.: Наука, 1968. С. 5-10.
.Орлов
Д.С., Гришина Л.А.// Практикум по химии гумуса. М.: Изд-во МГУ, 1981. С.272 .
39.Swift
R.S. Organic matter characterization (chap 35) //Methods of soil analysis.
Madison, WI: Soil Science Society of America, 1996. P. 3. P. 1018-1020.
.Христева
Л.А.//
Труды
почвенного
института
им
В.В.
Докучаева,
Академия
Наук
СССР,
1951, 38, С. 108-184.
41.Аммосова
Я. М. и Балаганская Е.Д.// Почвоведение, 1991, 7, С. 29-39.
.Варшал
Г.М., Велюханова Т.К., Кощеева И.Я.// Геохимическая роль гумусовых кислот в
миграции элементов. В сб. «Гуминовые вещества в биосфере» М., Наука,1993, С.
97-116.
.Данченко
Н.Н.// Функциональный состав гумусовых кислот, определение и взаимосвязь с
реакционной способностью. Дисс. Канд. Хим. Наук., Москва, 1997, 138 С.
.Кауричев
И.С., Карпухин А.И., Степанова Л.П.// В кн.: Особенности почвенных процессов
дерново-подзолистых почв. М., 1977, С. 5-21.
.Драгунов,
С.С. //Методы исследования гумусовых веществ. Труды почв. инст. им. Докучаева,
1951, т.
38, С.
86-98.
.Frimmel
F. H., Hopp W., Quentin K.-E.//Z. Wasser Abwasser-Forsch. 1985, B. 18, S.
259-262.
.Piccolo
A., Camici L. //Int. J. Environ. Anal. Chem., 1990, v. 41,
Р. 65-69.
.Кухаренко
Т.А.//ЖАХ, 1948, т. 3., вып. 3, С. 181-185.
49.Marinsky
J.A.//J. Phys. Chem., 1985, v. 89, Р. 5294-5302.
.Варшал
Г.М. и др. //Биогеохимическая роль гумусовых кислот в процессах миграции
элементов. В сб.: Гуминовые вещества в биосфере. М.: Наука, 1993, С. 23-30.
.Шестаков
Е.И., Карпухин А.И., Кауричев И.С., Рачинский В.В.//Почвовед., 1989, N 12, С.
35-47.
.Семенов
А.А. // Влияние гуминовых кислот на устойчивость растений и микроорганизмов к
воздействию тяжелых металлов: Автореф. дисс. канд. биологических наук.- Москва,
2009.-С. 27.
.Лодыгин
Е. Д.// Особенности строения гумусовых веществ подзолистых и
болотно-подзолистых почв Европейского северо-востока России: дисс. канд.
биологических наук.- Сыктывкар, 2001.-С. 131.
Приложение А
Результаты обработки ЭПР спектров
образцов
Таблица А1-Препараты ГК и ФК северо-западного
региона России
|
Код
образца
|
описание
|
g-фактор
|
C*10-15
( спин/г)
|
|
1
|
ГК
Тпг А0 (0-5)
|
2.0052
|
3.42
|
|
2
|
ФК
Тпг А0 (0-5)
|
2.0050
|
2.21
|
|
3
|
ГК
Тпг А0А1 (5-10)
|
2.0049
|
2.73
|
|
4
|
ФК
Тпг А0А1 (5-10)
|
2.0054
|
0.56
|
|
5
|
ГК
Тпг G (10-28)
|
2.0050
|
5.92
|
|
6
|
ФК
Тпг G (10-28)
|
2.0053
|
1.50
|
|
7
|
ГК
Тб1 Oe (0-9) I
|
2.0053
|
1.63
|
|
8
|
ФК
Тб1 Oe (0-9) I
|
2.0051
|
1.02
|
|
9
|
ГК
Тб1 Oe (0-9) II
|
2.0060
|
3.40
|
|
10
|
ФК
Тб1 Oe (0-9) II
|
2.0052
|
1.72
|
|
11
|
ФК
Тб1 G (17-25)
|
2.0052
|
0.85
|
|
12
|
ГК
Тб1 Апогр (50-60)
|
2.0049
|
3.80
|
|
13
|
ФК
Тб1 Апогр (50-60)
|
2.0051
|
0.67
|
|
14
|
ГК
Тб2 Oe (0-10)
|
2.0052
|
2.60
|
|
15
|
ФК
Тб2 Oe (0-10)
|
2.0065
|
4.83
|
|
16
|
ГК
Тб2 Oe (10-20)
|
2.0059
|
1.60
|
|
17
|
ФК
Тб2 Oe (10-20)
|
2.0055
|
2.55
|
|
18
|
ФК
Тб2 G (30-40)
|
0.98
|
|
19
|
ГК
Тдер(пг) Тпах (0-5)
|
2.0059
|
0.49
|
|
20
|
ФК
Тдер(пг) Тпах (0-5)
|
2.0057
|
0.18
|
|
21
|
ГК,
Тдер(пг), A1 (5-10 см)
|
2.0057
|
2.40
|
|
22
|
ФК,
Тдер(пг), A1 (5-10 см)
|
2.0057
|
1.11
|
|
23
|
ГК,Тдер(пг),
(11-21 см)
|
2.0055
|
6.20
|
|
24
|
ФК,
Тдер(пг), (11-21 см)
|
2.0057
|
1.78
|
|
25
|
ГК,
Серая лесная, А1 (3-9 см)
|
2.0052
|
5.56
|
|
26
|
ФК,
Серая лесная, А1 (3-9 см)
|
2.0054
|
0.91
|
|
27
|
ГК,
Пбь подстилка, АО (0-10 см)
|
2.0054
|
1.73
|
|
28
|
ФК,
Пбь подстилка, АО (0-10 см)
|
2.0056
|
1.29
|
|
29
|
ГК,
П, АО (0-3 см) I
|
2.0053
|
3.09
|
|
30
|
ФК,
П, АО (0-3 см) I
|
2.0063
|
0.52
|
|
31
|
ГК,
П, АО (0-3 см) II
|
2.0054
|
5.37
|
|
32
|
ФК,
П, АО (0-3 см) II
|
2.0063
|
1.17
|
|
33
|
ГК,
П, АО (0-2 см) III
|
2.0054
|
3.37
|
|
34
|
ФК,
П, АО (0-2 см) III
|
2.0054
|
1.54
|
|
35
|
ГК,
Пг, 2430, АО (0-5 см)
|
2.0055
|
3.70
|
|
36
|
ФК,
Пг, 2430, АО (0-5 см)
|
2.0057
|
1.90
|
|
37
|
ГК,
Пг, 2431, A2g (5-10 см)
|
2.0053
|
4.35
|
|
38
|
ФК,
Пг, 2431, A2g (5-10 см)
|
2.0061
|
1.82
|
|
39
|
ГК,
РЖ-9, Тпг, Адер (0-9 см)
|
2.0060
|
1.99
|
|
40
|
ГК,
697, Апогр
|
2.0055
|
11.50
|
|
41
|
ГК,
Пб1, 134, Тр-Печм 02 (10-12 см)
|
2.0056
|
4.63
|
|
42
|
ГК,
Н5-М, Ое (26-30 см)
|
2.0059
|
2.16
|
|
43
|
ГК,
Ппах, Апах (0-15 см)
|
2.0057
|
5.05
|
|
44
|
ГК,
Пдер, Адер (0-4 см)
|
2.0054
|
1.08
|
|
45
|
ГК,
Пбь A2hg (12-15 см)
|
2.0057
|
7.93
|
|
46
|
ГК,
Ж-08, Т61, Ое (0-9 см) II
|
2.0057
|
5.13
|
Таблица А2-Почвы северо-западного региона России
|
код
образца
|
описание
|
g-фактор
|
C*10-15
( спин/г)
|
|
3166
|
Почва,
органогенный горизонт
|
2.0044
|
23.37
|
|
3191
|
Почва,
органогенный горизонт
|
2.0050
|
0.55
|
|
3195
|
Почва,
минеральный горизонт
|
2.0050
|
0.12
|
|
3254
|
Почва,
погребенный горизонт
|
2.0053
|
0.25
|
|
3179
|
Почва,
органогенный горизонт
|
2.0041
|
19.85
|
|
3189
|
Почва,
органогенный горизонт
|
2.0049
|
2.18
|
|
3190
|
Почва,
органогенный горизонт
|
2.0045
|
5.25
|
|
3221
|
Почва,
органогенный горизонт
|
2.0052
|
3.11
|
|
3223
|
Почва,
органогенный горизонт
|
2.0047
|
4.24
|
|
3225
|
Почва,
органогенный горизонт
|
2.0050
|
0.44
|
|
3241
|
Почва,
органогенный горизонт
|
2.0052
|
6.19
|
|
3243
|
Почва,
органогенный горизонт
|
2.0050
|
4.94
|
|
3245
|
Почва,
органогенный горизонт
|
2.0045
|
8.60
|
|
3260
|
Почва,
органогенный горизонт
|
2.0046
|
2.56
|
|
3261
|
Почва,
органогенный горизонт
|
2.0049
|
0.35
|
Таблица А3- Почвы рисовой оросительной системы
ЭСП «Красное»
|
код
образца
|
описание
|
g
фактор
|
C*10-15
( спин/г)
|
|
1
|
А1(о-2о)
|
2.005
|
0.60
|
|
2
|
А1'(40-60)
|
2.005
|
1.38
|
|
3
|
Апах
(карта 1, чек 2)(0-20)
|
2.005
|
0.30
|
|
4
|
А1'
(карта 1, чек 2)(20-40)
|
2.005
|
0.27
|
|
5
|
А1''
(карта 1, чек 2) (40-60)
|
2.005
|
0.31
|
|
7
|
Апах
(карта 1, чек 2)(0-20)
|
2.005
|
0.18
|
|
8
|
А1'
(карта 1, чек 2)(20-40)
|
2.005
|
0.35
|
|
9
|
А1''
(карта 1, чек 2)(40-60)
|
2.005
|
0.37
|
|
10
|
Апах
(карта 1, чек 2)(0-20)
|
2.005
|
0.20
|
|
11
|
А1'
(карта 1, чек 2)(20-40)
|
2.005
|
0.31
|
|
12
|
А1''
(карта 1, чек 2)(40-60)
|
2.005
|
0.39
|
|
32
|
Апах
(карта 1, чек 2)(0-20)
|
2.005
|
0.42
|
|
33
|
А1''
(карта 1, чек 2)(40-60)
|
2.005
|
0.40
|
|
13
|
Апах
(карта 1, чек 1)(0-20)
|
2.005
|
0.24
|
|
14
|
А1'
(карта 1, чек 1)(20-40)
|
2.005
|
0.52
|
|
15
|
А1''
(карта 1, чек 1)(40-60)
|
2.005
|
0.55
|
Таблица А4- Почвы рисовой оросительной системы
ООО «Зерновая компания Полтавская»
|
код
образца
|
Описание
|
g-фактор
|
C*10-15
( спин/г)
|
|
1м
|
точка16_1м_0-20
|
2.005
|
0.52
|
|
2м
|
точка16_2м20-40
|
2.005
|
0.34
|
|
3м
|
точка16_3м40_60
|
2.005
|
0.62
|
|
4м
|
точка16_4м_60-80
|
2.005
|
0.81
|
|
5м
|
5м21_0-20
|
2.005
|
0.37
|
|
6м
|
6м
212
|
2.005
|
0.45
|
|
7м
|
7м21_40-60
|
2.005
|
0.19
|
|
8м
|
8м23_0-20
|
2.005
|
0.86
|
|
9м
|
9м23_20-40
|
2.005
|
1.04
|
|
10м
|
10м23_40-60
|
2.005
|
0.51
|
|
11м
|
11м25_40-60
|
2.005
|
1.50
|
|
12м
|
12м25_0-20
|
2.005
|
1.43
|
|
13м
|
13м25_20-40
|
2.005
|
0.94
|
|
14м
|
14м28_0-20
|
2.005
|
0.78
|
|
15м
|
15м20_20-40
|
2.005
|
0.75
|
|
16м
|
16м28_40-60
|
2.005
|
1.23
|
Приложение Б
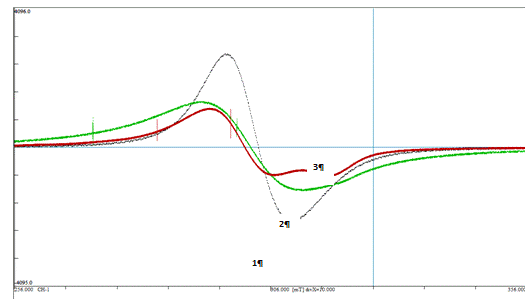
Рис. Спектры ЭПР. 1) 0,01М водный раствор
хлорида меди (II); 2) ГК + CuCl2 (64 мг Cu2+ /1г ГК); 3) ГК + CuCl2 (6,4 мг
Cu2+ /1г ГК)
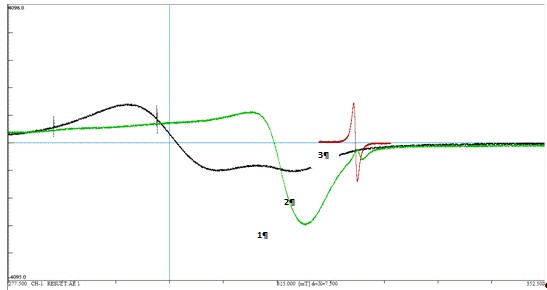
Рис. 1) ГК + CuCl2
(6,4 мг Cu2+
/1г ГК); 2) ГК + CuCl2
(0,64 мг Cu2+
/1г ГК); 3) ГК
Рис. 1) 0,01М водный раствор хлорида марганца (II);
2) ГК + MnCl2
(5,4 мг Mn2+
/1г ГК); 3) ГК (увеличено в 10 раз)