Основные свойства, назначение и роль в народном хозяйстве циркония
Содержание
Введение
Общие сведения
.1 Сведения об открытии металла
.2 Физические и химические
свойства циркония
.3 Нахождение в природе и
минералы циркония
.4 Применение циркония
Технология переработки цирконовых
концентратов
2.1 Способы разложения цирконовых
концентратов
.2 Продукты переработки цирконовых
концентратов
.3 Способ разделения циркония и
гафния
2.4 Производство металлического
циркония
Фторсиликатный способ вскрытия
цирконовых концентратов
.1 Характеристика технологического
процесса
4 Расчёт процесса спекания
цирконового концентрата с фторсиликатом калия
.1 Рациональный состав цирконового
концентрата
.2 Расчёт количества потерь по
операциям технологической схемы
.3 Расчёт материального баланса
процесса спекания
Заключение
Список использованных источников
Введение
Цирконий получают из силикатной руды, содержащей
минерал циркон, путем восстановления оксида и хлорида титана и т.п., или путем
электролиза. Он представляет собой металл серебристо-серого цвета, ковкий и
вязкий.
Крупнейшими странами-продуцентами циркония
являются Австралия, с долей в мировой добыче 41%, ЮАР с долей 32% и Китай с
долей 11% в мировой добыче. Кроме того заметными продуцентами также являются
Индонезия, Украина, Индия и Бразилия. Россия с учетом достаточно больших запасов
занимает в производстве циркония низкие позиции, с долей в мировой добыче 1%.
Мировая торговля циркониевыми рудами и
концентратами составляет около 80% мировой добычи. Основными импортерами руд и
концентратов циркониевых являются Китай с долей 47% в мировом импорте и Испания
с долей 12% в мировом импорте. Заметными импортерами также являются Италия,
Германия, Индия, Бельгия, Франция, Япония, Нидерланды, Таиланд, США, Индонезия.
Объем импорта по крупнейшим странам-импортерам в 2009 году снизился. Китай снизил
ввоз на 8% до 470 тыс.тонн циркония в концентрате, Испания на 23% до 117
тыс.тонн. Увеличили импорт Индия на 12% до 30 тыс.тонн и Бельгия на 66% до 28,9
тыс.тонн. Импорт циркониевых руд и концентратов в Россию в 2009 году снизился
на 46% до 7,6 тыс.тонн. Экспорт руд и концентратов также снизился на 23% до 5,2
тыс.тонн.
Объем торговли собственно металлическим
цирконием, а также изделиями из него достаточно мал, как впрочем и
производство. В Россию в основном импортируется цирконий необработанный,
порошки и прочие изделия, занимающие в общих объемах импорта 99%. В 2009 году
объем импорта циркония в Россию сократился на 41% до 78 тонн.
1.
Общие сведения
.1
Сведения об открытии металла
В 1789 году немецкий химик член Берлинской
Академии наук Мартин Генрих Клапрот, анализируя одну из разновидностей минерала
циркона, обнаружил новый элемент, который он назвал цирконием. Благодаря
красивой окраске - золотистой, оранжевой, розовой - циркон еще в эпоху
Александра Македонского считался драгоценным камнем. Название минерала
происходит, по-видимому, от арабского слова «царгун» - золотистый.
Металлический цирконий получен Берцелиусом в
1824 году в виде сильно загрязненного порошка. В 1925 году Ван-Аркель и де-Бур,
применив йодидное рафинирование, получили пластичный металл. Такой разрыв во
времени обусловлен высокой химической активностью циркония, которая затрудняла
как его выделение из природного сырья и искусственных соединений, так и
получение в пластичном виде.
В 1923 г. Кюстер и Хевеши сообщили об открытии в
циркониевом сырье элемента с атомным номером 72, который они назвали гафнием.
Пластичный гафний был получен одновременно с пластичным цирконием также
йодидным рафинированием. [1]
1.2 Физические
свойства и химические свойства циркония
Цирконий относится к числу тугоплавких
элементов, входящих в четвертую и пятую группу периодической системы. Металл
отличается высокой прочностью кристаллической решетки, что определяет
повышенную плотность, температуру плавления и стойкость против коррозии.
Природный цирконий состоит из пяти изотопов с
массовыми числами 90, 91, 92, 94 и 96. Кроме того, известно восемь
искусственных радиоактивных изотопов циркония с массовыми числами 86, 87, 88,
89, 93, 95, 97. Цирконий имеет как металлические, так и металлоидные свойства.
Существуют устойчивые нерастворимые цирконаты и гафнаты щелочных металлов типа Me2MeO3,
а также многочисленные фторцирконаты, в которые цирконий входит в состав в виде
анионов со фтором.
При температурах до 100 oC
цирконий стоек по отношению к соляной, азотной и фосфорной кислотам любой
концентрации и к серной кислоте концентрации до 50%; однако он легко
растворяется в царской водке и плавиковой кислоте.
Отмечается высокая стойкость циркония по
отношению к концентрированным растворам щелочей при повышенных температурах,
расплавленным щелочным металлам до 600 оС, воде подогретой до
300-350 оС и пару до 400 оС.
При обыкновенной температуре цирконий стоек на
воздухе, но при нагревании взаимодействует с кислородом с выделением
значительных количеств тепла.
Коррозийная стойкость циркония значительно
уменьшается в присутствии некоторых примесей. При нагревании цирконий образует
галоидные соединения: с азотом и водородом - нитриды и гидриды, с углеродом -
карбиды. [1]
Таблица 1.1 - Физические свойства циркония
[1]
|
Свойство
|
Величина
|
|
Атомная
масса
|
91,22
|
|
Атомный
номер
|
40
|
|
Плотность,
г/см3
|
6,45
|
|
Температура
плавления, оС
|
1852
|
|
Температура
кипения, оС
|
3580
- 3700
|
|
Удельная
теплоемкость, кал/г ∙ оС
|
0,0693
|
|
Теплопроводность
при 50 оС кал / (см ∙ сек ∙ оС)
|
0,050
|
1.3
Нахождение в природе и минералы циркония
Соединения циркония широко распространены в
литосфере. Содержание циркония в земной коре 1,7 ∙ 10-2 %.
Концентрация в морской воде 5 ∙ 10-5 мг/л. Насчитывается около
40 минералов циркония.
Основной рудообразующий циркониевый минерал -
циркон ZrSiO4,
содержащий 49,5 % Zr.
Он встречается во всех видах пород. Меньшее промышленное значение имеет
бадделит ZrO2.
Запасы этих минералов превышают 25 - 27 млн. т.
Месторождения третьего минерала - эвдиалита,
несмотря на огромные запасы, представляют для циркониевой промышленности лишь
потенциальный интерес, потому что содержание циркония в эвдиалите в 5-7 раз
меньше, чем в двух предыдущих минералах.
Во всех месторождениях вместе с цирконием
присутствует и гафний благодаря изоморфному замещению атома циркония. Гафний не
образует самостоятельных минералов, но в виде изоморфной примеси всегда
сопутствует цирконию. Содержание двуокиси гафния: в цирконе - 0,8-0,8 %; в
бадделеите - 0,1-3,5 %; в эвдиалите - 0,1-1 %. Производство гафния может быть
организовано лишь при комплексном использовании циркониевых руд.
В настоящее время разрабатываются россыпные
месторождения, образованию которых способствовали высокая плотность, большая
твердость, отсутствие спайности и химическая устойчивость минералов. Обычно в
шлихах россыпных месторождений содержится 30-70 % рудных минералов, в том числе
0,5-10 % циркона. Рентабельными считаются россыпи, содержащие не менее 8-10 кг
циркона в 1 м3. [1]
Циркониевым минералам сопутствует магнетит,
ильменит, рутил, монацит и др.
Наиболее крупные месторождения циркония
находятся в США, Австралии, Индии, Бразилии, Марокко, Мавритании, Нигерии и на
Шри-Ланке. Мировая доля производства в первых четырех странах составляет 100 -
160 тыс. т в год.
В России, на долю которой приходится 10 %
мировых запасов циркония (3 место в мире после Австралии и ЮАР), основными
месторождениями являются: Ковдорское коренное бадделит-апатит-магнетитовое в
Мурманской области, Туганское россыпное циркон-рутил-ильменитовое в Томской
области, Лукояновское россыпное циркон-рутил-ильменитовое в Нижегородской
области, Катугинское коренное циркон-пирохлор-криолитовое в Читинской области.
[5]
1.4 Применение
циркония
В промышленности цирконий стал применяться с
30-х годов XX века. Из-за высокой стоимости его применение ограничено.
Единственным предприятием,
специализирующемся на производстве циркония в России (и на территории бывшего
СССР), является Чепецкий механический завод
<#"655183.files/image001.gif">
Рисунок 3.1 - Принципиальная технологическая
схема процесса спекания цирконового концентрата с фторсиликатом калия. [4]
Этот способ, разработанный в СССР Н.П. Сажиным и
Е.А. Пепеляевой, основан на взаимодействии циркона с фторсиликатом калия в
присутствие хлористого калия при температуре 650-700 оС, в
результате которого образуется K2ZrF6:
ZrSiO4
+ K2ZrF6
→ K2ZrF6
+ 2SiO2
(3.1)
Хлористый калий образует легкоплавкую жидкую
фазу, содержащую K2SiF6.
Также хлористый калий способствует более полному разложению циркона, которая
достигает 97-98 %. Это повышает активность взаимодействия с цирконом и
подавляет диссоциацию K2SiF6
с образованием летучего SiF4.
В присутствие KCl при
температуре 650-700 оС в основном взаимодействие протекает по
реакции:
В процессе охлаждения расплав K2ZrF6Cl
разлагается:
K2ZrF6Cl
→
K2ZrF6
+ KCl (3.3)
Полученный спек содержит в основном K2ZrF6,
но присутствуют также K2ZrF7
и
K2ZrF6Cl.
Продукты реакции (3.1) при температуре 700-900 оС
взаимодействуют по уравенению:
K2ZrF6 + SiO2
= 2KF + SiF4 + ZrO2 (3.4)
Для предотвращения этого процесса, влекущего
образование нерастворимой в воде двуокиси циркония, необходим избыток
четырехфтористого кремния в исходной шихте и продуктах реакции. Это достигается
повышением реагента в шихте, спеканием в герметичном аппарате, а также
осуществлением процесса при возможно более низкой температуре без снижения
вскрытия циркона. Окислы металлов по своей способности к реакции с
кремнефтористым калием располагаются в следующий ряд: ZrO2
>
Al2O3
> TiO2
> Fe2O3.
При введение в шихту около 150 % K2ZrF6
от СНК по реакции (3.1) и 30-50 % КCl
от массы цирконового концентрата, измельченного до крупности 0,1 мм,
взаимодействие протекает полно при 650-700 оС за 1-1,5 часа.
Хлористый калий вводят в шихту в виде раствора, что обеспечивает равномерность
его распределения.
Влажную шихту подают в барабанную печь, где в
зоне спекания поддерживают температуру 650-700 оС.
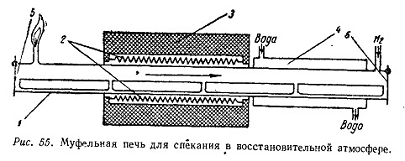
Рисунок 3.2 - Схема муфельной барабанной печи: 1
- муфель; 2 - нагреватели; 3 - огнеупорная кладка печи; 4 - холодильник; 5 -
вход в печь; 6 - выход из печи. [5]
Выше 730-750 оС материал оплавляется,
что нарушает работу печи. Вследствие трудностей строгого поддержания
оптимальной температуры. Так как в барабанной печи с открытым факелом степень
разложения концентрата сильно колеблется, процесс лучше проводить в муфельной
барабанной печи. Муфель изготовлен из жаропрочного сплава, футеровка заключена
в металлический кожух.
Спек состоит из гранул размером 5-10 мм. Его
измельчают до крупности - 0,15 мм и выщелачивают 1%-ным раствором соляной
кислоты при отношении Т:Ж = 1:7 и температуре 85 оС. Кремневую
кислоту отделяют отстаиванием и декантацией при температуре 80 оС.
Затем раствор охлаждают, и основная часть выпадающих кристаллов фторцирконата
калия вместе с соответствующей солью гафния выпадает в раствор. После
отстаивания при температуре не ниже 80 оС осветленный горячий
раствор поступает на кристаллизацию. цирконий концентрат гафний калий
Растворимость K2ZrF6
сильно
зависит от температуры.
Таблица 3.1 - Зависимость температур и
растворимости K2ZrF6
|
Температура,
оС
|
10
|
20
|
40
|
60
|
80
|
90
|
|
Растворимость
K2ZrF6 г/100 г H2O
|
1,22
|
1,55
|
2,37
|
3,81
|
6,9
|
11,1
|
Это позволяет, охлаждая раствор, выделить в
кристаллы от 70 до 90 % циркония в зависимости от его исходной концентрации. Из
маточных растворов осаждают аммиаком гидроксид циркония, который возвращают в
шихту для спекания. Получаемые по описанной технологии из цирконовых
концентратов кристаллы K2ZrF6
имеют следующий состав: (Zr
+ Hf) 31,9 - 32; К 27,2
- 27,6; F 39,9 - 40,05; Fe
0,044 - 0,045; Ti
0,041 - 0,042; Si
0,06 - 0,07; Cl 0,006 -
0,008; Hf 1,5 - 2,5.
Гафний от циркония отделяют дробной кристаллизацией.
Также, помимо фторсиликатного способа,
существуют другие варианты переработки цирконового концентрата фторсодержащими
реагентами, например 40 %-ной плавиковой кислотой. При выпаривание полученного
осадка досуха кремний удаляется в виде летучего SiF2;
остаток от упаривания растворяют в воде и цирконий осаждают из раствора в виде
гидроокиси.
Имеются сообщения о вскрытии тонкоизмельченного
циркона с плавлением с 4- и 6-кратным по массе количеством KHF2
или NaHF2.
Плав затем измельчают, выщелачивают горячей водой, подкисленной плавиковой
кислотой, а двойной фторид циркония и щелочного металла, выпадающий при
охлаждении раствора, отфильтровывают. Методы не нашли промышленного применения
в связи с высокой стоимостью реагентов. [1,2]
4. Расчёт процесса
спекания цирконового концентрата с фторсиликатом калия
Цирконовый концентрат
перерабатывается фторосиликатным способом (спекание с фторсиликатом калия).
Рассчитать суточный расход
концентрата и фторсиликата калия и составить материальный баланс операции
спекания исходя из следующих условий: суточная производительность по фтороцирконату
калия 547,94 кг; потери основного продукта по операциям:
шихтовка 0,3 %, спекание 1 %,
выщелачивание и фильтрация 8,5 %, выпаривание и кристаллизация 5,2 %,
фильтрация и сушка 0,5 %; состав концентрата, %: ZrO2 58,44 (связан в циркон); Fе2О3 1,9 (в
виде гематита); SiO2 31,2 (в свободном
состояние); CaO 1,6 (в концентрате содержится на 50 % в виде карбоната и 50 % в
виде силиката); количество фторосиликата калия бepyт с избытком 50 % против
теоретически необходимого для связывания циркония.
4.1
Рациональный состав цирконового концентрата
Расчет ведем на 100 кг концентрата.
Определяем содержание циркония в цирконе, кг:
MZr
= mZrO2
·
MZr/ AZrO2
= 58,44 · 91,2/ 123,2 = 43,27
Содержание кислорода в цирконе, кг:
(mO2)ZrO2= mZrO2
· MO2/ AZrO2 = 58,44 · 32/ 123,2 = 15,17
Находим количество железа в гематите, кг:
MFe
= mFe2O3·
MFe/ AFe2O3
= 4,26 · 55,8/ 159,6 = 2,97
Содержание кислорода в гематите, кг:
(mO2) Fe2O3 =
mFe2O3· MO2/ AFe2O3 = 4,26 · 32/ 159,6 = 1,29
Оксид кальция в концентрате содержится на 50 % в
виде карбоната и 50 % в виде силиката:
Определяем количество карбоната кальция, кг:
MСaCO3
= mCaO · M CaCO3/ АСaO
= 0,8 ·100,08 / 56,8 = 1,4
Находим количество оксида углерода в карбонате,
кг:
(mCO2
)CaCO3
=mCaCO3
-
mCaO
=
1,4 - 0,8 = 0,6
Рассчитываем количество силиката кальция, кг:
MСaSiO3
= mCaO · M CaSiO3/ АСaO
= 0,8 ·116,18 / 56,8 = 1,65
Вычислим количество кремнезема в силикате, кг:
(mSiO2
)CaSiO3
=mCaSiO3
-
mCaO
=
1,65 - 0,8 = 0,85
Таблица 4.1 - Рациональный состав
цирконового концентрата
|
Соединение
|
Содержание элементов, кг
|
|
Zr
|
Fe
|
SiO2
|
CaO
|
CO2
|
O2
|
Проч.
|
Всего
|
|
ZrO2
|
43,27
|
|
|
|
|
15,17
|
|
58,44
|
|
Fe2O3
|
|
|
|
1,29
|
|
4,26
|
|
SiO2
|
|
|
31,2
|
|
|
|
|
31,2
|
|
CaCO3
|
|
|
|
0,8
|
0,6
|
|
|
1,4
|
|
CaSiO3
|
|
|
0,85
|
0,8
|
|
|
|
1,65
|
|
Прочие
|
|
|
|
|
|
|
3,05
|
3,05
|
|
Итого
|
43,27
|
2,97
|
32,05
|
1,6
|
0,6
|
16,46
|
3,05
|
100
|
4.2 Расчет количества
потерь по операциям технологической схемы
Вычисляем
количество потерь по операциям технологической схемы
на фильтрации и
сушке:
,94 + 547,94 ·
0,005 = 550,67 кг K2ZrF6,
потери составляют
2,73 кг;
на выпаривании и
кристаллизации:
,67 + 550,67 ·
0,052 = 579,3 кг,
потери составляют
28,63 кг;
на выщелачивании и
фильтрации:
,3 + 579, 3 · 0,085
= 628,54 кг,
потери составляют
49,24 кг;
на спекании:
,54 + 628,54 · 0,01
= 634,82 кг,
потери составляют
6,28 кг;
на шихтовке:
,82 + 634,82 ·
0,003 = 636,72 кг,
потери составляют
1,9 кг.
Суммарные потери по
схеме составляют 86,88 кг. Следовательно,
без учета потерь, производительность по фторцирконату калия составляет 636,72
кг/сут. Так как в концентрате ZrO2 содержится 58,44 %, то
суточный расход концентрата составит 372,09 кг.
4.3 Расчет материального
баланса процесса спекания
На спекание
поступает цирконовый концентрат в количестве 372,09 - 372,09 ∙ 0,005 =
370,23 кг. В нем содержится ZrO2 - 58,44 % или 216,36 кг
(в пересчете на ZrSiO4 331,87 кг); Fe2O3
- 4,26 % или 15,77 кг; SiO2 - 31,2 % или 115,51 кг; CaCO3 - 1,4 % или 5,18 кг; CaSiO3 - 1,65 % или 6,1 кг;
прочие компоненты - 3,05 % или 11,29 кг.
Спекание протекает
по реакции
ZrSiO4 + K2SiF6 = K2ZrF6 + 2 SiO2 (4.3)
,31
220,29 283,42 120,18
331,87 399,92
514,52 218,17
С учетом избытка K2SiF6 50 % суточный расход фторсиликата кальция составит 599,88 кг
(избыток 199,96 кг).
Составляем суточный
материальный баланс процесса спекания (табл. 4.2).
Таблица 4.2 -
Суточный материальный баланс процесса спекания. [4]
|
Загружено
|
Количество
|
Получено
|
Количество
|
|
кг/сут
|
%
|
|
кг/сут
|
%
|
|
Цирконовый концентрат
|
370,23
|
38,16
|
Спек
|
970
|
100
|
|
В том числе:
|
|
|
В том числе:
|
|
|
|
ZrO2
|
216,36
|
514,52
|
|
|
Fe2O3
|
15,77
|
|
SiO2
|
218,17
|
|
|
SiO2
|
115,51
|
|
Fe2O3
|
15,77
|
|
|
CaCO3
|
5,18
|
|
Избыточный K2SiF6
|
199,96
|
|
|
CaSiO3
|
6,1
|
|
CaCO3
|
5,18
|
|
|
Прочие
|
11,29
|
|
CaSiO3
|
6,1
|
|
|
K2SiF6
|
599,88
|
61,84
|
Прочие
|
11,29
|
|
|
Итого:
|
970
|
100
|
Итого:
|
970
|
100
|
Заключение
В курсовой работе представлены основные
свойства, назначение и роль в народном хозяйстве циркония. В этой работе собран
краткий аналитический обзор процесса из разных источников, кратко представлена
технология промышленного получения и переработки циркония. Здесь подробно
изложен фторсиликатный способ вскрытия цирконовых концентратов.
Рассчитан рациональный состав концентрата и
суточный материальный баланс процесса переработки цирконового концентрата по
фторсиликатному способу.
Список
использованных источников
1. Основы металлургии. Редкие
металлы. Веллер Р.Л., Ольхов Н.П., Румянцев М.В. Изд-во «Металлургия». 1967,643
с.
2. Металлургия тугоплавких редких
металлов. Зеликман А. Н. Изд-во «Металлургия». 1986,439 с.
. Металлургия тугоплавких редких
металлов. Зеликман А. Н., Коршунов Б.Г. Изд-во «Металлургия». 1991,431 с.
. Михнев А.Д., Колмакова Л.П.,
Ковтун О.Н. Расчеты технологических процессов в металлургии тугоплавких
металлов: Учеб. Пособие / ГУЦМиЗ. - Красноярск, 2006. - 162 с.
. Википедия свободная энциклопедия. URL:www.ru.wikipedia.org
(дата обращения: 10.03.2013)