Анализ динамических характеристик прибора иономер И-102
КУРСОВОЙ ПРОЕКТ
по дисциплине: "Средства измерения параметров
окружающей среды"
на тему: "Анализ динамических характеристик
прибора иономер И-102"
Содержание
Введение
1. Анализ объекта контроля
1.1 Характеристика объекта контроля
1.2 Характеристика контролируемого вредного фактора
.3 Нормирование
. Выбор метода и средства контроля
2.1 Выбор метода измерения
2.2 Выбор
средства измерения
3. Анализ средства измерения
.1 Описание прибора
3.2 Принцип действия преобразователя
3.3 Схема измерительного устройства
3.4 Анализ статических и динамических характеристик средства контроля
Заключение
Библиографический список
Введение
Всемирная организация здравоохранения предупреждает, что 80%
заболеваний на планете вызваны потреблением некачественной питьевой воды.
Практически все поверхностные источники водоснабжения в
последние годы подвергаются воздействию вредных антропогенных загрязнений. 70%
поверхностных вод и 30% подземных потеряли питьевое значение и перешли в
категории загрязненности - "условно чистая" и "грязная".
Практически 70% населения употребляют воду, не соответствующую ГОСТу "Вода
питьевая".
В Украине каждая пятая проба водопроводной воды не
соответствует санитарно-химическим нормам, каждая восьмая - микробиологическим,
а 90% питьевой воды в стране не соответствует рекомендуемым санитарным нормам,
химическим и микробиологическим стандартам. Эту воду используют 70% городов и
населенных пунктов. Больше всего на здоровье человека влияет хлор, используемый
для дезинфекции воды. Хотя вначале он спасает от инфекций, однако потом его
производные начинают влиять на здоровье, так как обладают канцерогенным,
мутагенным эффектом, влияют на наследственность. По данным исследований, у
людей, постоянно употребляющих хлорированную воду, вероятность рака мочевого
пузыря на 21% и рака прямой кишки на 38% выше, чем у тех, кто пьет очищенную,
но нехлорированную воду.
В Японии воду очищают с помощью озона, хотя один из его
недостатков состоит в том, что он не обладает долговременным действием
соединений хлора. Поэтому перед употреблением водопроводную воду надо очищать.
Для освобождения от хлора воду целесообразно отстаивать (от нескольких часов до
суток). Для освобождения от микробов и хлора воду необходимо кипятить не более
1-3 мин. Сырую воду можно пить только в крайних случаях. Нежелательно
использовать для приготовления пищи горячую водопроводную воду: горячая вода
химически более агрессивна, и это может приводить к выщелачиванию тяжелых
металлов из водопроводных труб. Тяжелые металлы накапливаются в жизненно важных
органах человека, вызывая со временем их заболевания.
В последнее время стали использоваться различные бытовые
фильтры для доочистки воды. Фильтр должен удалять микробы, хлор и его
производные, тяжелые металлы, нефтепродукты, нитраты и нитриты, пестициды.
Однако опасно и вторичное загрязнение воды микроорганизмами, осевшими на самом
фильтре.
Приблизительно 70% населения предпочитают держать на кухне
фильтры-кувшины. Каждая вторая семья устанавливает фильтры прямо на кухонный
кран с переключателем: вода для приготовления пищи идет через фильтр, для мытья
- минуя его. Как уже отмечалось, для питания каждого человека требуется
примерно 3 л воды в день.
1.
Анализ объекта контроля
Вода - это ценнейший природный ресурс.
Она играет исключительную роль в процессах
обмена веществ, составляющих основу жизни.
По особенностям происхождения, состава или
применения делят воду на следующие виды:
Мягкая или жесткая вода - по содержанию
минеральных веществ. Жесткая вода имеет повышенное содержание солей Са и Мg.
Пресная вода - вода, соленость которой
не превышает 0,1%, даже в форме льда или пара.
Морская вода - вода морей и океанов. В
среднем соленость Мирового океана составляет около 3,5%. Это значит, что в
каждом литре морской воды растворено 35г солей (в основном NaCl).
Сточные воды - любые воды и атмосферные
осадки, отводимые в водоемы с территорий промышленных предприятий и населенных
мест через систему канализации или самотоком, свойства которых оказались
ухудшенными в результате деятельности человека.
Подземные воды - воды, находящиеся в
толще горных пород верхней части земной коры.
Родниковая вода - это вода подземного
происхождения или же способная стать питьевой после соответствующей обработки.
Талая вода - появляется при таянии
льда и сохраняет 0оС, пока не растает весь лед.
Минеральная вода - это вода, имеющая
лечебные свойства благодаря содержанию в ней тех или иных микроэлементов и
минеральных солей.
Питьевая вода - вода, пригодная к
употреблению внутрь, доставляемая для нужд населения и отвечающая регламентированным
критериям качества.
Тяжелая вода (дейтериевая
и тритиевая).
Дистиллированная и
деионизированная вода. Дистиллированная вода - очищенная вода, практически не содержащая
примесей и посторонних включений.
Ливневая вода или
поверхностные воды - воды, которые текут (водотоки), или собираются на поверхности
земли (водоемы). Объектами поверхностных вод являются моря, озера, реки,
болота, и другие водотоки и водоемы.
Живая и мертвая вода. Мертвая вода - вид вода,
не имеющий места в реальном мире, но распространенный в сказках. Живая вода -
вода, обладающая определенными волшебными свойствами, например, способна
оживлять метрвое тело.
Существует 6 классов качества воды.
Шестиклассная система оценки качества воды принята в зарубежных странах и
положена в основу ГОСТ 17.12.04-77 и ГОСТ 17.13.07-82.
Воды I класса экологически
полноценные, могут использоваться для питья, рекреации, рыбоводства и орошения;
Воды II класса экологически
полноценные, имеют питьевое значение, могут использоваться для рекреации, рыбоводства
и орошения;
Воды III класса экологически
полноценные, могут использоваться для питья с предварительной очисткой, а также
для рыбоводства и орошения;
Воды IV класса экологически
неблагополучны, имеют ограниченное применение в рыбоводстве и орошении, пригодны
для технических целей;
Воды V класса экологически
неблагополучны, имеют техническое значение;
Воды VI класса экологически
неблагополучны, применяются для технических целей с предварительной очисткой.
К основным физическим показателям качества
воды относятся:
1.прозрачность: зависит от степени
рассеивания солнечного света в воде веществами органического и минерального
происхождения, находящимися в воде во взвешенном и коллоидном состоянии. Она
определяет протекание биохимических процессов, требующих освещенности;
2.температура воды: в водных объектах
температура является результатом одновременного действия солнечной радиации,
теплообмена с атмосферой, переноса тепла течениями, перемешивания водных масс и
поступления подогретых вод из внешних источников. Она влияет практически на все
процессы, от которых зависят состав и свойства воды;
3. цветность: обусловливается
содержанием органических окрашенных соединений.
Вещества, определяющие окраску воды,
поступают в воду вследствие выветривания горных пород, внутриводоемных
продукционных процессов, с подземным стоком, из антропогенных источников.
Высокая цветность снижает органолептические свойства воды, уменьшает содержание
растворенного кислорода;
4. запах: создается специфическими
веществами, поступающими в воду в результате жизнедеятельности гидробионтов,
разложения органических веществ, химического взаимодействия содержащихся в воде
компонентов и поступления из внешних (аллохтонных) источников;
5.содержание взвешенных
веществ:
источниками взвешенных веществ могут служить процессы эрозии почв и горных
пород, взмучивание донных отложений, продукты метаболизма и разложения
гидробионтов, продукты химических реакций и антропогенные источники. Взвешенные
вещества влияют на глубину проникновения солнечного света, ухудшают
жизнедеятельность гидробионтов, приводят к заиливанию водных объектов, вызывая
их экологическое старение (эвтрофирование);
6.бактериологические
показатели: характеризуют загрязненность воды патогенными микроорганизмами. К
числу важнейших бактериологических показателей относят: коли-индекс -
количество кишечных палочек в одном литре воды; коли-титр - количество воды в
миллилитрах, в котором может быть обнаружена одна кишечная палочка;
7.химические показатели: могут быть общими и
специфическими. К числу общих химических показателей качества воды относят:
растворенный кислород: основными источниками
поступления кислорода в водные объекты является газообмен с атмосферой
(атмосферная реаэрация), фотосинтез, а также дождевые и талые воды, которые,
как правило, перенасыщены кислородом.
Окислительные реакции являются основными
источниками энергии для большинства гидробионтов. Основными потребителями
растворенного кислорода являются процессы дыхания гидробионтов и окисления
органических веществ.
Низкое содержание растворенного кислорода
(анаэробные условия) сказывается на всем комплексе биохимических и
экологических процессов в водном объекте;
химическое потребление
кислорода
(ХПК): ХПК определяется как количество кислорода, необходимого для
химического окисления содержащихся в единице объема воды органических и
минеральных веществ. При определении ХПК в воду добавляется окислитель -
бихромат калия. Величина ХПК позволяет судить о загрязнении воды окисляемыми
веществами, но не дает информации о составе загрязнения. Поэтому ХПК относят к
обобщенным показателям;
биохимическое потребление
кислорода
(БПК): БПК определяется как количество кислорода, затрачиваемое на
биохимическое окисление содержащихся в единице объема воды органических веществ
за определенный период времени;
водородный показатель (рН): в природных
водах концентрация ионов водорода зависит, главным образом, от соотношения
концентраций угольной кислоты и ее ионов.
Источниками содержания ионов водорода в
воде являются также гуминовые кислоты, присутствующие в кислых почвах и,
особенно, в болотных водах, гидролиз солей тяжелых металлов. От рН зависит
развитие водных растений, характер протекания продукционных процессов.
1.1 Характеристика объекта контроля
Питьевая вода́ - это вода, которая предназначена
для потребления людьми.
Хотя многие источники пресной воды пригодны для питья людьми, они могут
служить распространению болезней или вызывать долгосрочные проблемы со
здоровьем, если они не отвечают определённым стандартам качества воды. Вода,
которая не вредна для человека, называется безопасной водой или
незагрязнённой водой. Различают виды питьевой воды: - вода из подземных
источников: артезианская, родниковая (ключевая); - вода поверхностных
источников: речная, озерная, ледниковая. Потребителю следует знать, что, даже
если производитель изготовит свой продукт на основе обычной водопроводной воды,
что не запрещено, он вправе указать только исходную точку водозабора для
производства водопроводной воды. При использовании воды в качестве
теплоносителя к числу ее важных качеств относятся отсутствие выпадения осадков
на поверхностях теплообмена и минимальная коррозийная активность.
Стабильной называют воду, которая не вызывает коррозии поверхности
металла, с которой она соприкасается, и не выделяет на этих поверхностях осадки
карбонатов кальция. Для поддержания стабильности воды в заданных пределах
необходимо регулировать несколько параметров: рН, щелочность и карбонатную
жесткость. Стабильность увеличивается при введении карбонатов натрия или
кальция, подщелачивании, а уменьшается при умягчении воды или введении кислоты.
Растворами называются гомогенные системы,
содержащие не менее двух веществ. Могут существовать растворы твердых, жидких и
газообразных веществ в жидких растворителях, а также однородные смеси
(растворы) твердых, жидких и газообразных веществ. Как правило, вещество,
взятое в избытке и в том же агрегатном состоянии, что и сам раствор, принято
считать растворителем, а компонент, взятый в недостатке - растворенным
веществом. В зависимости от агрегатного состояния растворителя различают
газообразные, жидкие и твердые растворы.
Газообразными растворами являются воздух и другие смеси
газов. К жидким растворам относят гомогенные смеси газов, жидкостей и твердых
тел с жидкостями. Твердыми растворами являются многие сплавы, например,
металлов друг с другом, стёкла. Наибольшее значение имеют жидкие смеси, в которых
растворителем является жидкость. Наиболее распространенным растворителем из неорганических
веществ, конечно же, является вода. Из органических веществ в качестве
растворителей используют метанол, этанол, диэтиловый эфир, ацетон, бензол,
четыреххлористый углерод и др.
В процессе растворения частицы (ионы или молекулы)
растворяемого вещества под действием хаотически движущихся частиц растворителя
переходят в раствор, образуя в результате беспорядочного движения частиц
качественно новую однородную систему. Способность к образованию растворов
выражена у разных веществ в различной степени. Одни вещества способны
смешиваться друг с другом в любых количествах (вода и спирт), другие - в
ограниченных (хлорид натрия и вода).Частицы, перешедшие в раствор, вследствие
диффузии распределяются по всему объему растворителя. С другой стороны, по мере
увеличения концентрации частицы (ионы, молекулы), находящиеся в непрерывном
движении, при столкновении с твердой поверхностью еще не растворившегося
вещества могут задерживаться на ней, т.е. растворение всегда сопровождается
обратным явлением - кристаллизацией. Может наступить такой момент, когда
одновременно выделяется из раствора столько же частиц (ионов, молекул), сколько
их переходит в раствор - наступает равновесие. По соотношению преобладания
числа частиц, переходящих в раствор или удаляющихся из раствора, различают
растворы насыщенные, ненасыщенные и пересыщенные. По относительным количествам
растворенного вещества и растворителя растворы подразделяют на разбавленные и
концентрированные.
Раствор, в котором данное вещество при данной температуре
больше не растворяется, т.е. раствор, находящийся в равновесии с растворяемым
веществом, называют насыщенным, а раствор, в котором еще можно
растворить добавочное количество данного вещества, - ненасыщенным. Насыщенный
раствор содержит максимально возможное (для данных условий) количество
растворенного вещества. Следовательно, насыщенным раствором является такой
раствор, который находится в равновесии с избытком растворенного вещества.
Концентрация насыщенного раствора (растворимость) для данного вещества при
строго определенных условиях (температура, растворитель)-величина постоянная.
Раствор, содержащий растворенного вещества больше, чем его должно быть в данных
условиях в насыщенном растворе, называется пересыщенным. Пересыщенные
растворы представляют собой неустойчивые, неравновесные системы, в которых
наблюдается самопроизвольный переход в равновесное состояние. При этом
выделяется избыток растворенного вещества, и раствор становится насыщенным.
Насыщенный и ненасыщенный растворы нельзя путать с
разбавленным и концентрированным. Разбавленные растворы - растворы с небольшим
содержанием растворенного вещества; концентрированные растворы - растворы с
большим содержанием растворенного вещества. Необходимо подчеркнуть, что понятие
разбавленный и концентрированный растворы являются относительными, выражающими
только соотношение количеств растворенного вещества и растворителя в растворе.
Сравнивая растворимость различных веществ, мы видим, что насыщенные растворы
малорастворимых веществ являются разбавленными, а хорошо растворимых веществ -
хотя и ненасыщенные, но довольно концентрированными.
1.2 Характеристика контролируемого вредного фактора
Вода является уникальным пищевым продуктом. Усвояемость
организмом человека различных необходимых веществ из жидкой среды на порядок и
более превосходит их усвояемость из твердой пищи. В значительной степени это
касается набора микро- и макроэлементов, содержащихся в природной воде.
Основной природный химический состав воды связан с растворенными в ней
минеральными компонентами: макро- и микроэлементами. Первые - ионы кальция,
магния, натрия, калия, хлориды, сульфаты, бикарбонаты в зависимости от
преобладания тех или иных веществ, определяют гидрохимический класс вод.
Однако, вкусовые особенности воды могут быть обусловлены и присутствием в ней
микроэлементов, например, железа, марганца, цинка, меди. Органолептические
свойства и особенно вкус воды имеют важное физиологическое значение для поддержания
водно-солевого баланса организма человека и в значительной степени определяют
процесс её подготовки в пищевом производстве.
Вкусовые качества воды обусловлены в первую очередь
содержанием и соотношением катионов кальция и магния, бикарбонат-ионов, а также
концентрацией и соотношением сульфатов, хлоридов и карбонатов. Эти
макроэлементы воды в первую очередь определяют физиологическую полноценность
воды для организма. Органолептические свойства воды влияют на секреторную
деятельность желудка, а изменение вкусовых ощущений воды оказывает действие на
чувствительность ахроматического зрения и частоту сердечных сокращений. Так,
содержание солей жесткости в питьевой воде в пределах 1 - 4 мг-экв/л не только
улучшает её вкусовые качества, но и способствует протеканию нормальных обменных
процессов в организме. С питьевой водой человек получает (согласно норм) 1-2 г
минеральных солей в сутки, а в связи с тем, что в отличие от многих пищевых
продуктов ионы в воде находятся в гидратированном состоянии, их усвояемость организмом
увеличивается на порядок.
Особое значение для организма человека имеют ионы кальция ,
как основной структурный компонент в формировании опорных тканей. Недостаток в
организме кальция ведет к остеопорозу, а недостаток его в водном обмене ведет к
отекам. В то же время повышенное содержание кальция в воде (100 - 500 мг/л)
способствует камнеобразованию в почках и мочевом пузыре. Наличие в необходимых
количествах ионов кальция питьевой воде влияет как на возбудительный, так и на
тормозной процессы в коре больших полушарий головного мозга, стимулирует
кроветворение и секреции слюнных и поджелудочной желез, поддерживает высокий
уровень обмена веществ и усиливает защитные реакции организма. Снижение уровня
ионов кальция в крови вызывает учащение сердечного ритма и повышение кровяного
давления.
Вторыми по значимости для организма человека являются ионы
магния. Они активно участвует в обменных реакциях, в построении ряда ферментных
систем, необходимы для осуществления гексокиназной реакции, т.е. для фосфорилирования
глюкозы и использования ее клетками организма. Ионы магния активирует в коре
больших полушарий мозга процесс торможения, косвенно, через ионы натрия и
калия, стимулируют активность аденозинтрифосфорной кислоты в мозговой ткани,
чем усиливают гликолиз и процесс дыхания в тканях мозга, способствуют улучшению
общего самочувствия, оказывают антиспастическое и сосудорасширяющее действие,
повышает устойчивость слизистых оболочек и кожных покровов к проникновению
бактерий и токсичных веществ. В то же время, избыток ионов магния ведет к
нарушению обмена веществ и приостановке роста.
Немаловажное значение в водном обмене организма человека
имеют ионы натрия и калия как антагонисты. Так, ведение ионов калия
способствует выведению ионов натрия. Недостаток ионов калия способствует
задержке воды в организме и развитию отеков, а недостаток ионов натрия ведет к
дегидратации организма.
Среди анионов особое значение для организма человека имеют
хлорид-ионы. Они поддерживают осмотическое давление плазмы крови, лимфы, клеточного
содержимого спинномозговой жидкости, регулируют водный баланс организма,
участвуют в образовании соляной кислоты желудочного сока и поддерживают
кислотно-желудочное равновесие. Повышенное содержание хлоридов отрицательно
влияет на функции системы пищеварения. При повышенном содержании сульфатов в
воде нарушается функция системы пищеварения и она имеет неприятный привкус.
Огромное значение для организма человека имеет присутствие в
питьевой воде микроэлементов, особенно фторидов и йода. Неслучайно в
нормативный документ САН ПиН 2.1.4.116-02 "Питьевая вода. Гигиенические
требования к качеству воды, расфасованной в ёмкости" включено обязательное
содержание этих элементов при розливе воды по первой и высшей категории
качества.
Практический интерес к фторированию питьевой воды обусловлен,
в первую очередь, физиологической ролью этого элемента. Кроме известного
антикариесного воздействия фтора отмечается его свойство являться
биокатализатором процессов минерализации, что используется в лечебных целях при
остеопорозе, рахите и других заболеваниях, а также способность фтора
стимулировать иммунореактивность и кроветворение в организме человека. На
основе натурных наблюдений показано, что природные воды с повышенным
содержанием фтора в сочетании с кальцием положительно влияют на устойчивость
организма к радиационному поражению. Фтор даже способен снижать концентрацию
стронция в костной ткани примерно на 40% и этот процесс не сопровождается
обеднением скелета людей кальцием.По данным ВОЗ, широкое распространение
заболевания кариесом в значительной степени связано с дефицитом фтора в
питьевой воде. Так, в профилактике заболевания кариесом, использование
улучшенных жевательных резинок оценивается всего в 2 - 3 %, а употребление
современных фторсодержащих зубных паст - в 25 - 30 %. Наиболее высокий
профилактический эффект ( от 40 до 70 % ) обеспечивает поступление в организм
фторидов с водой. Таким образом, без достаточного обеспечения организма
фторидами за счет питьевой воды, эффективное решение проблемы кариеса практически
невозможно.
К сожалению, диапазон и уровень физиологически необходимых
концентраций фторидов в воде чрезвычайно узок, низок и составляет 0,6-1,5 мг/л.
При более низких концентрациях практически отсутствует положительное
воздействие этого элемента на организм человека, а увеличение концентраций до
значений более 2-3 мг/л приводит к серьезным нарушениям костной ткани,
угнетению функциональной активности центральной нервной системы.На примере
микроэлемента фтора было более подробно рассмотрено значение поступления
микроэлементов в организм человека именно с питьевой водой и пищевыми
продуктами, содержащими значительное количество жидкости.
Микроэлемент йод участвует в синтезе гормонов щитовидной
железы, воздействует на метаболические и регенераторные процессы организма. При
избытке - влияет на активность ферментных систем, изменяет
структурно-функциональные характеристики щитовидной железы, печени, почек. При
недостатке - изменение метаболических процессов организма, характерных для
гипофункции щитовидной железы. Норма физиологической полноценности йода в
питьевой воде и жидких продуктах на её основе составляет 10-125 мкг/л. В то же
время, поступление йода в организм не должно превышать 1 мг/сутки, при его
избыточном поступлении в организм, в частности с водой, он не успевает
выделяться и может развиться хроническое отравление.
Наличие серьёзных ограничений по макро- и микроэлементному
составу питьевых вод и жидких пищевых продуктов накладывает высокую
ответственность как на сами пищевые производства, так и на производителей
используемого оборудования. Установки подготовки воды для пищевых производств
должны иметь соответствующие сертификаты и санитарно-эпидемиологические
разрешающих применение выбранной аппаратуры и материалов в этих целях.
.3 Нормирование
Наличие высококачественной питьевой воды в количестве,
удовлетворяющем основные потребности человека, является одним из условий
укрепления здоровья людей и устойчивого развития государства. Любое
несоблюдение стандарта качества питьевой воды может привести к неблагоприятным
как краткосрочным, так и долгосрочным последствиям для здоровья и благополучия
населения. В Украине проблема обеспечения населения доброкачественной питьевой
водой в достаточном количестве в настоящее время остается острой.
С 1999 по 2001 гг. общее количество водопроводов
хозяйственно-питьевого водоснабжения увеличилось на 4,0% за счет коммунальных
водопроводов, в то же время количество ведомственных и сельских водопроводов
уменьшилось. На протяжении трех лет около 6,0% водопроводов не отвечало
санитарным нормам. Среди них коммунальные водопроводы составляли 10,2%,
ведомственные - 4,5-5,3% и сельские - 10,5%.
По сравнению с 1999 г. имело место увеличение количества
коммунальных водопроводов, не соответствующих санитарным нормам, из-за
отсутствия ЗСО и обеззараживающих установок; ведомственных - из-за отсутствия
обеззараживающих установок и сельских - из-за отсутствия необходимого комплекса
очистных сооружений. Наибольшее количество водопроводов, не отвечающих
санитарно-гигиеническим требованиям, находилось в Луганской, Донецкой,
Херсонской и Полтавской областях. С 1999 по 2001 гг. в системах
централизованного водоснабжения не соответствовали нормам ГОСТ 2874-82
"Вода питьевая" до 12,2% проб питьевой воды по санитарно-химическим и
до 5,4% - по бактериологическим показателям. Количество проб питьевой воды,
которые имеют отклонения от стандарта, находилось практически на одном уровне.
Количество проб питьевой воды из водопроводных сетей, имеющих
отклонения от стандарта, по санитарно-химическим показателям составляло до
12,2%, в том числе по показателям, характеризующим органолептические свойства,
- 7,9%; общей минерализации - 3,0%, содержанию химических веществ, превышающих
ПДК по санитарно-токсикологическим признакам, - 1,5%, содержанию нитратов -
0,6%. При этом в 2001 г. общее количество нестандартных проб питьевой воды по
сравнению с 1999 г. снизилось в 1,3 раза, количество исследованных проб с
отклонениями по органолептике и минерализации снизилось в 1,2 раза, по
содержанию химических веществ с превышением ПДК и нитратам - в 1,5 раз. По
микробиологическим показателям значительного колебания процента нестандартных
проб питьевой воды из водоразводящих сетей в 1999-2001 гг. не происходило.
Количество проб с отклонениями по этим показателям, включая несоответствие по
коли-индексу и с коли-индексом 20 и больше, на протяжении трех лет были
практически на одном уровне (5,4-5,7%). Постоянные отклонения качества питьевой
воды от гигиенических нормативов по санитарно-химическим показателям регистрировались
в Днепропетровской, Кировоградской. Николаевской, Одесской, Сумской и
Херсонской, по бактериологическим показателям - в Тернопольской, Луганской и
Закарпатской областях.
Актуальной проблемой остается водоснабжение сельского
населения. Количество нестандартных проб воды из децентрализованных систем
водоснабжения по санитарно-химическим и бактериологическим показателям
соответственно до 2,3 и 4,8 раз было больше по сравнению с количеством
нестандартных проб питьевой воды из централизованных систем. Каждая четвертая
проба воды из источников децентрализованного водоснабжения имела отклонения от
гигиенических нормативов по санитарно- бактериологическим показателям и
третья-четвертая проба - по санитарно-химическим показателям. В 1999 - 2001 гг.
в Украине отмечалось ухудшение эпидемической ситуации по острым кишечным
заболеваниям, которые связаны с подачей населению недоброкачественной питьевой
воды. В 1999 г. зарегистрировано две вспышки токсикоинфекции и групповых
кишечных заболеваний в Луганской и Харьковской областях. В последующие два года
количество вспышек ОКИ увеличилась в 3,0 раза. В Днепропетровской,
Кировоградской, Хмельницкой, Донецкой, Одесской и Винницкой областях
зафиксированы возникшие в результате употребления недоброкачественной питьевой
воды вспышки заболевания населения дизентерией Флекснера и Зонне, брюшным
тифом, ротавирусной и энтеровирусной инфекциями, а также вирусным гепатитом А,
для которого водный фактор передачи является основным. Для улучшения качества
питьевой воды следует реализовать ряд мероприятий. В первую очередь это
касается разработки и внедрения государственных стандартов на питьевую воду.
В начале 2002 г. вступил в действие Закон Украины "Про
питну воду та питне водопостачання", который определяет правовые,
экономические и организационные положения функционирования системы питьевого
водоснабжения, направленные на гарантированное обеспечение населения
качественной и безопасной для здоровья человека водой. В то же время до
настоящего времени основным нормативным документом, определяющим качество
питьевой воды, остается ГОСТ 2874-82 "Вода питьевая. Гигиенические
требования и контроль за качеством". По этому нормативному документу
качество питьевой воды оценивается по 28 санитарно-химическим и
бактериологическим показателям.
С 01.01.2000 г. в Украине введен в действие новый нормативный
документ Государственные санитарные правила и нормы (ДСанПіН) №383 (186/1940)
"Вода питна. Гігієнічні вимоги до якості води централізованого
господарсько-питного водопостачання". Он включает 54 показателя качества и
контроля за качеством питьевой воды. В этом документе значительно расширен
спектр показателей, нормативные уровни некоторых из них стали более жесткими.
Проблема загрязнения поверхностных источников водоснабжения и
качества питьевой воды актуальна для всего мира. В мировой практике стандарты
качества питьевой воды постоянно пересматриваются. Стандарты ВОЗ 1970 г. имели
9, 1984 г. - 27, 1993 г. - уже 95 показателей. Указанные стандарты положены в
основу Директивы 90/778/ЕС и для многих стран мира являются основополагающими.
Гигиенические нормативы качества питьевой воды, представленные в новом
нормативном документе ДСанПіНе "Вода питна", являются более жесткими,
чем в ГОСТе 2874-82 "Вода питьевая", и более приближенными к
стандартам качества ВОЗ и ЕС, в некоторых случаях жестче их (органолептические
показатели, мутность, барий, фтор, хлорфенолы, хлороформ, четыреххлористый
углерод).
ДСанПіН № 383 является ведомственным документом, который
ляжет в основу нового национального стандарта (ДСТУ) по питьевой воде. Практика
введения ДСанПіНа №383 "Вода питна" в действие на водопроводных
станциях и контроля качества воды санэпидслужбой позволит при необходимости
пересмотреть некоторые из них. Приближение отечественных гигиенических нормативов
качества питьевой воды к уровню стандартов ВОЗ и ЕС является одним из элементов
вхождения Украины в Европейское Сообщество.
В настоящее время нормативная база Украины в области нормирования
радиоактивности питьевой воды является весьма не совершенной.
Отсутствие единого подхода к нормированию радиационных параметров привело
к тому, что в НРБУ-97 нормируются естественные радионуклиды 238U, 226Ra, 228Ra и 222Rn, в ДР-97 - радионуклиды
Чернобыльского происхождения 137Cs и 90Sr, а в ДСанПиН "Вода питьевая" - суммарная альфа- и
бета-активность. При этом отсутствуют разъяснения о нормируемых радионуклидах
при исследованиях подземных и поверхностных источников питьевого водоснабжения.
Необходимость единого методологического подхода к контролю за радиоактивностью
питьевой воды требует разработки одного нормативного документа,
предусматривающего полный перечень нормируемых в питьевой воде радионуклидов, а
также методики их определения, в том числе гамма- и бета-спектрометрические.
При этом следует учесть международные рекомендации и разделить
радиационный контроль питьевой воды на два этапа:
• экспресс-контроль для определения наличия значимых уровней
радиоактивности (возможно суммарной α- и β-активности);
• детальное исследование с целью последующего принятия мер.
Специалистами Запорожской облСЭС в настоящее время разработаны
методические подходы к исследованию радиоактивности питьевой воды с учетом
особенностей источника водоснабжения, а также методика пробоподготовки для
спектрометрической установки СЕБ-01(150), которая с успехом используется в
лаборатории.
2. Выбор метода и средства контроля
.1 Выбор метода измерения
Существуют следующие методы очистки питьевой воды:
- серебрение воды (обработка воды ионами серебра,
олигодинамия);
- обеззараживание питьевой воды;
хлорирование воды;
озонирование воды;
бромирование воды и йодирование воды;
ультрафиолетовое обеззараживание воды - УФ обеззараживание
воды;
ультразвуковая обработка воды.
1.
Обеззараживание воды серебром. Бактерицидное действие серебра известно
уже давно. Оно связано с процессом соединения ионов серебра с ферментными
системами и оболочкой бактерий. Серебро - тяжелый металл, имеющий высокую
степень опасности для здоровья (в одном ряду со свинцом, кобальтом, мышьяком и
другими веществами). Как и другие тяжелые металлы, серебро способно
накапливаться в организме и вызывать заболевания (аргироз - отравление
серебром). Содержание в питьевой воде серебра регламентируется СанПиН
2.1.4.1074-01 "Питьевая вода. Гигиенические требования к качеству воды
централизованных систем питьевого водоснабжения. Контроль качества"
(содержание в воде серебра не более 0,05 мг/л) и СанПин 2.1.4.1116 - 02
"Питьевая вода. Гигиенические требования к качеству воды, расфасованной в
емкости. Контроль качества" (содержание в воде серебра не более 0,025
мг/л). Лимитирующий признак вредности вещества, по которому установлен норматив
- санитарно-токсикологический. Равноценный класс вредности имеют растворённые в
воде никель (Ni) и хром (Cr6+)… Для бактерицидного действия серебра требуются
достаточно большие концентрации (около 0,015 мг/л, а при малых концентрациях
(10-4…10-6 мг/л) оно оказывает только бактериостатическое действие, т.е.
останавливает рост бактерий, не убивая их. Однако спорообразующие разновидности
микроорганизмов к серебру практически нечувствительны.
Все эти свойства ограничивают применение серебра. Оно может быть уместно
только в целях сохранения исходно чистой воды для длительного хранения
(например, на космических кораблях или при розливе бутилированной питьевой
воды). Часто используются серебрение фильтров на основе активированного угля.
Это делается с целью предотвратить обрастание фильтра микроорганизмами, т.к.
отфильтрованные органические вещества являются хорошей питательной средой для
многих бактерий.
2.
Обеззараживание - дезинфекция питьевой воды. Дезинфекция воды (обеззараживание воды) -
комплекс мер, предпринимаемых с целью очистки воды от микроорганизмов (вирусы,
бактерии, цисты и т.д.). Как показывают многочисленные исследования, качество
питьевой воды в значительной степени зависит от метода и режима ее
обеззараживания. Существующие методы дезинфекции питьевой воды подразделяют на
реагентные, безреагентные и комбинированные. К реагентным методам
обеззараживания воды относятся:
· хлорирование воды;
· озонирование воды;
· серебрение воды
(обработка воды ионами серебра, олигодинамия) - серебрянная вода;
· бромирование воды и
йодирование воды.
К безреагентным методам обеззараживания воды относятся:
· ультрафиолетовое
обеззараживание воды - УФ обеззараживание воды;
· ультразвуковая обработка
воды.
В комбинированных методах дезинфекции воды применяются два
способа обеззараживания или два дезинфектанта, один из которых способен в
течение длительного времени сохранять свою активность в воде.
3.
Хлорирование воды. Хлорирование воды - наиболее распространённый способ
обеззараживания питьевой воды с применением газообразного хлора или
хлорсодержащих соединений, вступающих в реакцию с водой или растворенными в ней
солями. В результате взаимодействия хлора с протеинами и аминосоединениями,
содержащимися в оболочке бактерий и их внутриклеточном веществе, происходят
окислительные процессы, химические изменения внутриклеточного вещества, распад
структуры клеток и гибель бактерий и микроорганизмов. Дезинфекция
(обеззараживание) питьевой воды осуществляется за счёт дозирования хлора,
двуокиси хлора, хлорамина и хлорной извести. Необходимая доза дозируемого
вещества устанавливается пробным хлорированием воды: она определяется
хлорпоглощаемостью воды (количество хлора, необходимое для связывания
содержащихся в воде органических соединений). С целью уничтожения микробов хлор
вводят с избытком из того расчёта, чтобы через 30 мин после хлорирования воды
содержание остаточного хлора было не менее 0,3 мг/л. В некоторых случаях
проводится двойное хлорирование воды - до фильтрации и после чистки воды. Также
при эпидемиологических катастрофах проводится суперхлорирование с последующим
дехлорированием воды.
Содержание в питьевой воде свободного остаточного хлора
регламентируется СанПиН 2.1.4.1074-01 "Питьевая вода. Гигиенические
требования к качеству воды централизованных систем питьевого водоснабжения.
Контроль качества" (содержание в воде свободного остаточного хлора 0,3 -
0,5 мг/л) и СанПин 2.1.4.1116 - 02 "Питьевая вода. Гигиенические требования
к качеству воды, расфасованной в емкости. Контроль качества" (содержание в
воде свободного остаточного хлора не более 0,05 мг/л). Лимитирующий признак
вредности вещества, по которому установлен норматив - органолептический (хотя
это далеко не так…).
4.
Озонирование воды. Озонирование воды - это более высокотехнологичный способ обработки
воды. Озон представляет собой аллотропическую модификацию кислорода. При
нормальной температуре он самопроизвольно диссоциирует, особенно в воде. С
повышением температуры воды распад озона увеличивается. Бактерицидное действие
озона связано с активным проникновением этой химически активной формы кислорода
через клеточные мембраны и последующим окислением органических веществ, что и
вызывает гибель бактериальной клетки. Наряду с обеззараживанием, озонирование
приводит к улучшению вкуса и уничтожению запахов воды.
5.
Бромирование и йодирование воды. Йодирование воды - это метод дезинфекции, при
котором применяются йодсодержащие соединения. Как бактерицидный агент, йод
известен довольно давно и широко применяется в медицине. Сложности связаны с
низкой растворимостью йода в воде, поэтому чаще всего используются его
органические соединения. Помимо этого, йодирование воды может быть причиной
появления специфических запахов. По некоторым оценкам это наиболее эффективные
средства обеззараживания малых объемов воды в полевых условиях. Это соединение
сохраняет бактерицидность даже при очень низких концентрациях. В отличие от
хлора йод не реагирует с аммиаком и более устойчив к влиянию солнечной радиации.
Другим эффективным и простым методом обеззараживания воды для
ванн является бромирование. Бром обладает аналогичным с хлором пролонгированным
действием. Остаточное содержание брома в воде должно быть несколько больше дозы
хлора, но он не оказывает отрицательного влияния на человека, не имеет запаха и
не токсичен, как хлор.
6.
Ультрафиолетовое обеззараживание воды - УФ обеззараживание воды. Ультрафиолетовая
обработка воды заключается в прямом воздействии излучения на нуклеиновые
кислоты, входящие в состав ДНК и РНК всех живых организмов. Оптимальная длина
волн для уничтожения бактерий составляет 250 - 266 нм. Действие
ультрафиолетового стерилизатора на разные типы микроорганизмов имеет одинаковую
природу. Входящие в состав ДНК пирамидиновые основания - тимин и цитозин,
отличающиеся высокой фотохимической активностью в области 250 - 280 нм,
образуют под воздействием облучения сшивки (димеры). Этот фотопродукт обнаружен
при использовании коротковолнового УФ-излучения в биологических дозах у самых
различных объектов. Многочисленные факты свидетельствуют об определяющей роли
димеров в летальном, мутагенном и других эффектах УФ-излучения. При этом
внешняя структура микроорганизма оказывает минимальное влияние на эффективность
ультрафиолетового обеззараживателя воды. Обеззараживание воды ультрафиолетовым
излучением является летальным для большинства микроорганизмов, в том числе и
для устойчивых к окислительным методам вирусов и цист простейших.
7.
Ультразвуковая обработка воды. Колебания среды с частотами, превышающими 20 кГц,
называются ультразвуковыми. При распространении ультразвука в воде, вокруг
объектов, находящихся в ней и имеющих другую плотность, возникают
микроскопические области очень высокого давления (десятки тысяч атмосфер),
сменяющегося высоким разрежением. Это явление называют ультразвуковой
кавитацией. Никакой микроорганизм не способен выдержать такие воздействия и
происходит механическое разрушение бактерий
.2 Выбор средства измерения
Для определения состава и свойств
различных соединений и растворов используются химические, физические и
физико-химические методы анализа. В некоторых случаях появляется необходимость
определять концентрацию различных ионов в растворе.
Ионоселективные
электроды.
Ионоселективным электродом называется индикаторный или измерительный электрод с
относительно высокой специфичностью к отдельному иону или типу ионов.
Ионселективные электроды имеют следующие достоинства: они не оказывают
воздействия на исследуемый раствор; портативны; пригодны как для прямых
определений, так и в качестве индикаторов в титриметрии. В зависимости от типа
мембраны ионселективные электроды можно разделить на следующие группы:
· твердые электроды - гомогенные,
гетерогенные, на основе ионообменных смол, стекол, осадков, моно- и
поликристаллов;
· жидкостные электроды на основе жидких
ионитов хелатов - нейтральные переносчики, биологически активных веществ;
· газовые и энзимные электроды, электроды
с твердыми мембранами. Мембраны данного вида электродов представляют собой
моно- или поликристаллы труднорастворимых в воде солей. В этих мембранах обычно
один из двух составляющих соль ионов способен под действием электрического поля
перемещаться в кристаллической решетке по ее дефектам. Примерами могут служить
мембраны из солей галогенидов серебра, которые обладают ионной проводимостью,
осуществляемой ионами серебра. Поведение этих мембран, в простейших случаях,
идентично поведению соответствующих электродов второго рода (хлорсеребряного и
каломельного). Тонкая пластинка из монокристалла, например, хлорида серебра,
может быть мембраной электрода, обратимой по отношению к иону Cl-, который
закреплен в кристаллической решетке. В то же время такой электрод обладает и
катионной Ag+ функцией за счет постоянства произведения растворимости AgCl.
Кристаллические мембраны отличаются очень высокой селективностью, превышающей
селективность жидкостных электродов (с ионообменными веществами) на несколько
порядков. Это связано с тем, что селективность у твердых кристаллических
мембранных электродов достигается за счет вакансионного механизма переноса
заряда, при котором вакансии заполняются только определенным подвижным ионом
(Ag+), так как форма, размер, распределение заряда вакансии соответствуют
только определенному подвижному иону.
К электродам с твердой мембраной относятся:
лантанфторидный электрод, сульфидсеребряные электроды, галогенсеребряные
электроды, электроды на основе сульфидов (халькогенидов), некоторых двузарядных
ионов металлов, стеклянные электроды.
Сульфидсеребряные
электроды
- этот вид электродов является универсальным, с одной стороны Ag2S является
основой одного из первых гомогенных кристаллических электродов с высокой
избирательностью по отношению к ионам Ag+ и S2-, с другой стороны - Ag2S
оказался превосходной инертной матрицей для кристаллических галогенидов серебра
и многих сульфидов двузарядных металлов. Ag2S-электрод в растворах AgNO3
обладает полной Ag+-функцией в интервале концентраций 100-10-7 М Ag+. Нижний
концентрированный предел обусловлен нестабильностью растворов при концентрации
ниже 10-7 М Ag+. Однако можно измерить очень низкие концентрации свободных
ионов Ag+ в присутствии комплексообразователей, которые создают буферность
раствора относительно измеряемого иона. S2--функция экспериментально
выполняется в интервале от 10-2 до 10-7 М в сильнощелочных сульфидных
растворах. На потенциал рассматриваемого электрода влияют Hg2+ и CN- ионы.
Влияние ионов CN- обусловлено реакцией: 6CN- + Ag2S = S2- + 2Ag(CN)32- В
обычной конструкции ионселективного электрода с твердой мембранной внутренняя
поверхность мембраны контактирует со стандартным раствором электролита, в
который погружен вспомогательный электрод, создающий обратимый переход от
ионной проводимости в электролите к электронной проводимости в металлическом
проводнике. Однако удобнее внутренний контакт создавать с помощью твердых
веществ (графит, металлы) - такие электроды называются твердофазными.
Стеклянные электроды - наиболее
распространенные электроды. С помощью данного вида электродов определяют рН
растворов. Существуют стеклянные электроды которые позволяют определить
концентрацию ионов Na+, K+. В основе теории стеклянного электрода лежит
представление о том, что стекло - это ионообменник, который может вступать в
ионообменное взаимодействие с раствором. Стекло при этом рассматривается как
твердый электролит. Стекло, состоящее из окислов натрия, кальция, кремния,
обладает резко выраженным специфическим сродством к ионам Н+. Вследствие этого
при соприкосновении с водными растворами в поверхностном слое стекол образуется
слой, в котором ионы Na+ оказываются почти полностью замещенными на ионы Н+.
Поэтому мембранный электрод, изготовленный из такого стекла, обладает
Н+-функцией. Введение в состав стекла окислов бария, цезия, лантана и замена
натрия на литий значительно расширяет диапазон Н+-функции стеклянного
электрода. Введение же окислов алюминия и бора значительно снижают Н+-функции
стеклянного электрода. Таким путем удалось создать ионселективные стеклянные
электроды для ионов Na+, K+, Li+, Ag+. Продолжительность функционирования
стеклянного электрода определяется рядом факторов - состав стекла, толщина
рН-чувствтельного поверхностного слоя мембраны, температура и состав раствора,
в котором электрод используется. Разрушение стекла водными растворами
происходит в результате сорбции воды стеклом и глубокое ее проникновение в
толщу. Коррозионному действию щелочных растворов, образующихся при экстракции
щелочных компонентов стекла, подвергается и горловое стекло. Кремнекислородная
сетка испытывает воздействие с обеих сторон мембраны. В конце концов
развиваются трещины, приводящие к нарушению функции электрода. Для защиты
электрода от разрушения необходимо хранить его в воде, так как в воде
происходит выщелачивание связанных ионными силами основных компонентов стекла и
замена их ионами водорода, в результате чего на поверхности стекла образуется
слой гидролизованного кремнезема, предохраняющий стекло от дальнейшего
разрушения. Факторы, влияющие на работу твердых мембранных электродов. Для
достижения теоретических функций в электродах с твердыми мембранами необходимо,
чтобы все твердые соединения, входящие в фазу мембраны, находились в равновесии
с анализируемом раствором. Этого не произойдет, если ионы, присутствующие в
анализируемом растворе, реагируют с отдельными компонентами мембраны. Наиболее
типичной реакцией, характерной для мембран, содержащих галогениды серебра,
является образование мене растворимой серебряной соли. Для электрода с
мембраной из смеси сульфидов серебра и меди обнаружен более сложный характер
влияния, связанный с образованием новой твердой фазы. Если электрод оказался в
растворе, ионы которого приводят к образованию новой твердой фазы, то вернуть
электрод в прежнее состояние можно выдержав его в растворе с высокой
концентрацией соответствующих ионов, жидкими анионообменниками. Эти электроды
могут быть использованы для следующих анионов: ClO4-, SCN-, I-, NO3-, Br-, Cl-.
Возможность изготовления электродов определяется тем, в какой степени
экстрагируются аминокислоты органической фазой.
Нитратные электроды находят применение главным
образом для контроля объектов окружающей среды. Определения нитратов в растения
мешает присутствие больших количеств хлоридов, удалить которые можно, пропуская
анализируемый раствор через ионообменную смолу Dowex 50-X8. При анализе
растительных объектов ионометрический метод, основанный на нитровании
3,4диметилфенола после извлечения нитратов из проб методом восстановительной
дистилляции. При определении же нитрат-ионов в почвах потенциометрия с
использованием ионселективных электродов уступает спектрофотометрическому
методу. Нитратные электроды можно применять для определения оксидов азота после
перевода в нитраты при окислении (например, под действием пероксида водорода).
Газовые электроды. Газовый электрод
включает ионоселективный электрод и сравнительный электрод, контактирующие с
небольшим объемом вспомогательного раствора, который отделен от исследуемого
раствора газовой прослойкой или гидрофобной газопроницаемой мембраной.
Существует два вида газовых электродов. Первый - ионоселективный и сравнительный
электрод погружены в небольшой объем раствора определенного состава,
отделенного от исследуемого раствора гидрофобной газопроницаемой мембраной. Для
этого вида электродов используют два вида мембран - гомогенные, представляющие
собой пленку полимера, в которой растворяется диффузионный газ, и гетерогенные,
микропористые, в которых газ диффундирует фактически через воздух, заполняющий
поры. В качестве мембран используют - силиконовый каучук, тефлон, полипропилен.
Микропористые мембраны обладают лучшими диффузионными характеристиками по
сравнению с гомогенными. Второй тип - в нем газопроницаемая мембрана заменена
газовой прослойкой. В этом электроде для удержания электролита на поверхности
индикаторного электрода и создания стандартной по толщине пленки в электролит
вводят ПАВ или весь раствор впитывается слоем геля. В электроде с гидрофобной
мембраной не требуется обновлять слой электролита на мембране индикаторного
электрода после каждого измерения; электрод можно использовать в условиях
протока; на показания электрода практически не влияют механические помехи
(например, сотрясение); полимерная пленка защищает электрод от воздействия
воздуха. В электроде с газовым зазором можно изменять толщину слоя электролита,
изменяя давление головки электрода на полимерную мембрану; слой электролита на
индикаторном электроде очень тонок, это значительно сокращает время отклика
электрода; диффузия газа в воздушной прослойке происходит гораздо быстрее, чем
в мембране из полимера; из-за отсутствия прямого контакта электрода с образцом
значительно возрастает срок жизни электрода. Одним из наиболее распространенных
электродов, является электрод с чувствительным элементом на аммиак. Эта
электродная система включает катионоселективный электрод и гидрофобную
мембрану, проницаемую для аммиака, но не проницаемую для таких ионов, как Na+,
K+, NH4+. Мембрана отделяет исследуемый щелочной раствор от внутреннего
раствора 0,1М NH4Cl, в который погружен стеклянный рН-электрод и хлорсеребряный
электрод сравнения. Диффузия аммиака через мембрану вызывает изменение рН
раствора, находящегося между мембраной и стеклянным электродом, который
регистрирует это изменение рН. Электроды для определения кислорода и
углекислого газа используют преимущественно в медицине.
3. Анализ средства измерения
.1 Описание прибора
Измерение величины рХ осуществляется с помощью измерительного
милливольтметра.
Разносторонний набор ионоселективных электродов позволяет проводить
измерения активной концентрации определяемых ионов в растворе методом отбора
проб. Комплект иономера предназначен для применения в различных областях
научных исследований, промышленности и учебной практике.
pH от
0 до 14;
pNa от
0 до 3,0;
pK от
0 до 3,0;
pCN от
1 до 5;
pJ от
1 до 5;
pS от
1 до 16.
Принцип действия:
В основу переносного иономера И-102 положен принцип измерения активности
одновалентных ионов контролируемого раствора с помощью соответствующего
ионоселективного электрода и измерительного преобразователя (рис 1).
В качестве ионоселективного электрода для измерения активности ионов H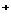 , K
, K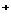 , Na
, Na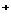 (катионов) использован стеклянный
электрод.
(катионов) использован стеклянный
электрод.
Для определения активности ионов J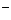 , CN
, CN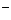 (анионов) использован специальный
электрод, чувствительным элементом которого является осадочная ионообменная
мембрана.
(анионов) использован специальный
электрод, чувствительным элементом которого является осадочная ионообменная
мембрана.
Рис. 1. Схема измерения величины рХ
- чувствительный элемент;
- измерительный электрод;
- контактный полуэлемент;
- вспомогательный электрод;
- электролитический ключ;
- иономер И-102.
Активность ионов S и Ag
и Ag определяется с помощью электрода, чувствительным элементом
которого является аргентит.
определяется с помощью электрода, чувствительным элементом
которого является аргентит.
Аналогично определению величины рН рН = -lga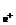 может быть образован отрицательный
логарифм активности ряда других ионов:
может быть образован отрицательный
логарифм активности ряда других ионов:
pNa = - lga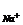 = -lga
= -lga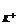 = -lga
= -lga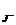 = -lga
= -lga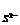
или в общем виде для любого ионоселективного электрода
pX = - lga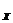 ,
,
где X-H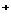 ; Na
; Na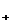 ; K
; K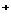 ; J
; J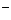 ; S
; S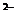 и т.д.;
и т.д.; - активность соответствующего иона в
растворе.
- активность соответствующего иона в
растворе.
Для измерения величины рХ используется электродная система с
измерительным ионоселективным электродом, потенциал чувствительного элемента
которого по отношению к вспомогательному электроду зависит от активности
соответствующего иона в растворе.
Практически чувствительность всех ионоселективных измерительных электродов
подчиняется закону Нернста:
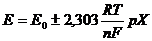 ,
,
где: Е- суммарная электродвижущая сила, измеренная с помощью электродной
системы, мВ.
Знак "+" перед вторым членом уравнения соответствует измерению
анионов.
Знак "-" соответствует измерению катионов.
Е0- постоянная величина которая зависит от выбранного
полуэлемента измерительного электрода и примененного вспомогательного
электрода;
R-
универсальная газовая постоянная, равная 8,315*107 эгр/ 0С
моль;
Т- температура раствора,0К;
F-
96500 кулон/г-экв (число Фарадея);
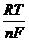 - постоянная Нернста;
- постоянная Нернста;
n-
валентность определяемого иона: 1,2 и т. д.
Иномер И-102 снабжен специальными устройствами, позволяющими произвести
настройку комплекта по калибровочным растворам для работы в широком диапазоне
рХ и температуры. Настройка позволяет уменьшить ошибки измерения величины рХ
путем согласования характеристик иономера с действительными характеристиками
электродной системы. Уменьшение диапазона измерения как по величине рХ, так и
по температуре, позволяет значительно повысить точность измерения комплекта.
В комплекте имеются электроды:
) стеклянные для измерения концентрации ионов водорода ЭСЛ-13-11;
ЭСЛ-15-11; ЭСЛ-43-11; ЭСЛ-45-11; ЭСЛ-18-11; ЭСЛ-48-11;
) стеклянные для измерения концентрации ионов натрия ЭСЛ-51-11;
) стеклянные для измерения концентрации ионов калия ЭСЛ-96-11;
) стеклянные для измерения окислительно-восстановительного потенциала
ЭОЛ-01;
) платиновые для измерения окислительно-восстановительного потенциала
ЭПЛ-02;
) аргентитовые для измерения концентрации ионов серы и серебра ЭАЛ-01;
) серебряные для измерения концентрации ионов хлора и брома ЭСрЛ-01;
) мембранные для измерения концентрации ионов йода, циана ЭМЛ-J-01; ЭМЛ-CN--01;
) вспомогательные ЭВЛ-1М4.
Стеклянные электроды для измерения величины рН, рNa, рК по конструкции и одинаковы и отличаются только
заполнением внутренней полости и маркой стекла шарика. Корпус электрода
выполнен из стеклянной трубки диаметром 8 мм. Нижняя часть корпуса запаяна.
Внутренний контактный полуэлемент экранирован. На верхнюю часть корпуса надет
колпачок, изготовленный из цветного полистирола.
Платиновые электроды ЭПЛ представляют собой стеклянный корпус, в который
вварена платина. Выступающий конец платины сплавлен в виде бусинки. Корпус
электрода изготовлен из стеклянной трубки диаметром 8 мм. На верхнюю часть
корпуса надет цветной колпачок.
Серебряный электрод ЭСрЛ и аргентитовый ЭАЛ также имеют одинаковую
конструкцию корпуса. Корпус их изготовлен из цветного полипропилена. Причем,
нижняя часть корпуса одного цвета, а верхняя, по форме колпачка стеклянного
электрода- другого цвета. Эти электроды отличаются лишь материалом контактного
стержня.
Нижняя часть корпуса мембранных электродов ЭМЛ-J-01, ЭМЛ-CN-01 диаметром 8 мм отливается из
сополимера САМП с одновременным армированием ионоселективной мембраны. Верхняя
часть корпуса отличается по форме колпачка из цветного полипропилена с
одновременным армированием контактного стержня.
Внутренняя полость заполнена раствором, в который погружен контактный
полуэлемент.
Корпус электрода с электродной проводимостью ЭОЛ-01 изготовлен из
стеклянной трубки диаметром 8 мм. Нижняя часть корпуса вместе с шариком (из
спецстекла) с внутренней стороны покрыта серебром и заполнена графитом.
Верхняя часть электрода выполнена в виде колпачка и изготовлена из
цветного полистирола, в который заармирован контактный стержень.
Корпус вспомогательного электрода ЭВЛ-1М4 изготовлен из стеклянной трубки
диаметром 8 мм, к которой приварен электролитический ключ, представляющий собой
капиллярную трубку со втянутым в нее шнуром из кварцевого волокна.
Нижняя часть корпуса заполнена раствором хлористого калия. Верхняя часть
корпуса заполнена смесью кристаллов AgCl и KCl, в которую погружен серебряный
контакт. Верхняя и нижняя полости соединены между собой посредством фитиля из
асбестовой нити. На верхнюю часть корпуса надет колпачок, изготовленный из
цветного полистирола.
3.2 Принцип действия преобразователя
Для измерения э. д. с. электродной
системы, имеющей большое внутреннее сопротивление (до 1000 МОм), и снижения
дрейфа нуля в преобразователе использованы варикапы, включенные в мостовую
схему.
Элементарная схема, поясняющая принцип
действия прибора, приведена на рис. 2. Электродвижущая сила ЕХ
электродной системы сравнивается с падением напряжения на сопротивлении R, через которое протекает
ток Iвых оконченного каскада усилителя.
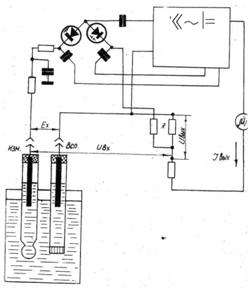
Рис.2 элементарная схема иономера
Падение напряжения Uвых на сопротивлении R противоположно по закону
электродвижущей силе ЕХ, и на вход усилителя подается напряжение:
Uвх = Eх - Uвых = Eх - Iвых * R.
Напряжение Uвх подается на вход мостовой
схемы, затем многократно усиливается с последующим преобразованием в постоянное
напряжение.
При достаточно большом коэффициенте
усиления усилителя напряжение Uвых мало отличается от э. д. с. Eх электродной системы, что
обеспечивает линейность усилителя.
.3 Схема измерительного устройства
Иономер
лабораторный И-102

вода серебрение
ионоселективный электрод
Назначение иономера .
Иономер И-102 лабораторный предназначен для прямого и косвенного
потенциометрического измерения активности ионов водорода pH, активности и
концентрации других одновалентных и двухвалентных анионов и катионов pX,
окислительно-восстановительного потенциала Eh в водных растворах и их
температуры с представлением результатов в цифровой форме и виде аналогового
сигнала напряжения постоянного тока.
Иономер И-102 лабораторный состоит из преобразователя, включающего
трансформатор, измерительную плату и лицевую панель с цифровым дисплеем и
клавиатурой, штатива и электродной системы, состоящей из измерительного,
вспомогательного электрода и термокомпенсатора. Принцип действия прибора
основан на потенциометрическом методе измерений pH и Eh контролируемого
раствора. При погружении электродов в раствор возникает ЭДС, линейно зависящая
от активности ионов и температуры раствора, которая преобразуется в
пропорциональное по величине напряжение и в цифровое значение измеряемого
параметра, которое индицируется на дисплее. Возможно подключение иономера
лабораторного к персональному компьютеру.
|
Параметры
|
Характеристики
|
|
Диапазон измерений pH (pX)
|
от -20 до +20
|
|
Диапазон измерений Eh, мВ
|
от -3000 до +2000
|
|
Диапазон измерений С, г/л
|
от 1х10^-6 до 1х10^2
|
|
Диапазон измерений С,
моль/л
|
от 1х10^-5 до 1
|
|
Диапазон измерений Т, °С
|
от -20 до +150
|
|
Цена единицы младшего
разряда pH (pX)
|
0,001
|
|
Цена единицы младшего
разряда Eh, мВ
|
0,1
|
|
Цена единицы младшего
разряда Т, °С
|
0,1
|
|
Основная абсолютная
погрешность pH (pX)
|
±0,020 для одновалентных
ионов
|
|
Основная абсолютная
погрешность pH (pX)
|
±0,040 для двухвалентных
ионов
|
|
Основная абсолютная
погрешность Eh, мВ
|
±1,0
|
|
Основная абсолютная
погрешность Т, °С
|
±0,5
|
|
Масса, кг
|
2,5
|
|
Габаритные размеры, мм
|
290х280х100
|
|
Входное сопротивление, Ом
|
Более 10^12
|
|
Аналоговый выход
|
2 В, 100 мВ
|
|
Цифровой выход
|
RS-232
|
|
Калибровка
|
Автоматическая по четырем
растворам
|
|
Температурная компенсация,
°С
|
Автоматическая от -20 до
+150
|
|
Питание
|
Сеть однофазного тока
напряжением (220±22)В частотой (50±0,5)Гц
|
|
Потребляемая мощность, ВА
|
20
|
|
Количество каналов
измерения
|
9
|
|
Индикатор
|
Матричный дисплей
|
Область применения иономера .
Иономер лабораторный И-102
используется в лабораториях предприятий и научно-исследовательских учреждений
химической, металлургической, фармацевтической промышленности, в сельском
хозяйстве, в медицине, в биологии.
Иономер И-102 также может
использоваться в станциях ГТИ для оперативного выделения нефтенасыщенных
образцов и контроля pH буровых растворов и пластовых флюидов.
.4 Анализ статических и динамических характеристик средства контроля
Статические характеристики средства измерения описываются при
необходимости использования статического режима его работы. Это такие условия,
когда измеряемая величина последовательно принимает ряд значений, каждое из
которых во время проведения измерений сохраняется постоянно.
Функция преобразования описывает связь между входной и выходной
величинами преобразования. Для изучаемого средства измерения она имеет вид.
Коэффициент преобразования - это отношение выходной величины ко входной.
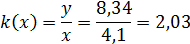
Производной от функции преобразования является чувствительность:
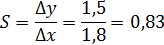
Средняя чувствительность характеризует средство измерения с номинальной
функцией преобразования:
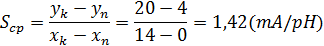
Относительная чувствительность- отношение относительного изменения
выходной величины к относительному изменению входной величины.
Изменение выходного сигнала может быть обусловлено влиянием
неинформативных параметров входного сигнала:
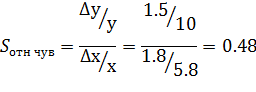
Динамические характеристики средства измерения.
Изменение во времени измеряемой величины приводит к динамическому режиму
работы средства измерения. В таком режиме точность зависит от динамических
свойств средства измерения и характера изменения измеряемой величины.
Для нормирования динамических свойств средств измерения часто указывают
на дифференциальное уравнение, а другие, производные от него динамические
характеристики, находятся экспериментальным путем. Сюда относятся передаточная
функция, амплитудная и фазовая частотные характеристики, переходная и
импульсная переходная функции.
К числу метрологических характеристик средств измерения относятся и
неинформативные параметры выходного сигнала измерительного преобразователя,
поскольку они могут оказывать существенное влияние на погрешность средства
измерений. Например, непостоянство амплитуды колебаний баланса наручных часов
(неинформативный параметр) приводит к изменению частоты его колебаний
(информативный параметр).
При восприятии измеряемой величины или измерительного сигнала средство
измерений оказывает некоторое воздействие на объект измерения или на источник
сигнала. Результатом этого воздействия может быть некоторое изменение
измеряемой величины относительно того значения, которое имело место при
отсутствии средства измерений. Такое обратное воздействие средства измерений на
объект измерений особенно четко просматривается при измерении электрических
величин. Так, ЭДС нормального элемента определяется как напряжение на его
зажимах в режиме холостого хода. При измерении этого напряжения вольтметром с
некоторым конечным входным сопротивлением результат измерения будет зависеть от
соотношения между внутренним сопротивлением нормального элемента (его выходное
сопротивление) и входным сопротивлением вольтметра. Для оценки возникающей при
этом погрешности необходимо знать значения этих сопротивлений, поэтому их
следует рассматривать как метрологические характеристики.
Для определения динамических свойств средства измерения используют
следующий перечень различных методов и средств:
. дифференциальные уравнения
. переходные и импульсные переходные характеристики
.частотные характеристики и т.д.
Перечень динамических свойств, присущих выбранному средству измерения
приведен выше и соответствует типам динамических звеньев данного прибора.
Основное дифференциальное уравнение процесса- молекулярная диффузия имеет
вид:
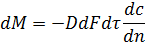
Где F- поверхность соприкосновения фаз
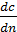 - градиент концентрации.
- градиент концентрации.
Заключение
Основной метод очистки питьевой воды в городах - хлорирование
и фильтрация. Но при хлорировании воды получаем не менее вредное вещество -
трихлорфенол, а фильтрация воды на городской очистной станции дело хорошее, но,
к сожалению, питьевая вода прошедшая не один километр по изношенным
водопроводам, в квартиру попадает далеко не самого лучшего качества и по словам
специалистов получает "вторичное загрязнение". Многие люди пытаются
решить проблему загрязнения питьевой воды посредством кипячения, но это скорее
метод успокоения, так как при кипячении вредные вещества не удаляются или
удаляются в мизерном количестве. При кипячении питьевая вода очищается только
от патогенных микроорганизмов и некоторых химических соединений.
Известно, что вода выводит вредные вещества из организма,
являясь важнейшим элементом физико-химических процессов происходящих в
организме. Обмен веществ невозможен без участия воды и от ее чистоты будет
зависеть в конечном итоге наше самочувствие. Отложение солей, заболевания
суставов и внутренних органов - следствие того, что вода потребляемая человеком
была недостаточно чистая. Чистая вода обладает отличными от загрязненной воды
физико-химическими свойствами. При определении чистоты воды оперируют такими
физическими свойствами как мутность, цвет, запах и вкус. Для чистой воды
характерными являются следующие показатели: мутность, отсутствие запаха, вкус,
цветность. Чистая вода всегда прозрачна, не имеет запаха и вкуса.
К химическим свойствам воды относят: водородный показатель,
общая минерализация, жесткость, кислотность, щелочность, окисляемость
перманганатная и некоторые другие. Кроме того при определении чистоты воды
используют бактериологические показатели, наличие неорганических и органических
примесей, радиологические показатели и некоторые другие.
Сегодня проблема чистой воды становится все более и более
актуальной. Из-за интенсивного химического и биологического загрязнения
источников водоснабжения встал вопрос доступности чистой воды населению
подавляющего числа стран и в том числе жителей Украины.
Однако, благодаря развитию науки и техники сегодня доступы
системы очистки воды, которые позволяют получить практически чистую воду в
условиях химического и бактериологического загрязнения. Системы на основе
обратного осмоса, ультрафиолетовое обеззараживание, системы для умягчения и
обезжелезивания воды позволяют получить чистую воду и нейтрализовать
воздействие загрязнителей.
Библиографический список
1."Ионселективные электроды". Под ред. Р. Дарста.
Пер. с англ. - канд. хим. наук А. А. Белюстина и В.П. Прозе, - под ред. доктора
хим. наук, проф. М.М. Шульца;2008г.
2. Корыта И., Штулик К. "Ионоселективные
электроды": - М.: Мир,. 2007г. -272 с., ил. 4. Лакшиминараянайах Н.
"Мембранные электроды";
3. Вода. Санитарные правила,
нормы и методы безопасного водопользования населения. Сборник документов. 2-е
издание, переработанное и дополненное. /Составители: Ю.А.Рахманин,
З.И.Жолдакова, Г.Н.Красовский. - М.: "ИнтерСЭН", 2009. - 768 с;
.
Руководство по контролю качества питьевой воды. т. 1. Рекомендации Всемирной
организации здравоохранения, Женева, 2009, 256 с.ж
.
Закон Украины "О питьевой воде и питьевом водоснабжении", от 18
ноября 2004 года.
6. Арустанова
Э.А. "Природопользование" - М: Изд. Дом "Дашков и Ко",
2010. - 284с.