Изучение влияния гумата натрия на токсичность и биологическую активности агрохимических средств
Введение
В сложившейся в последние десятилетия сложной
экономической и экологической ситуации остро стоит вопрос применения средств,
повышающих плодородие почв. Для этого обычно используются органические и
минеральные удобрения, а также агромелиоративные мероприятия. На протяжении
нескольких десятков лет ведутся работы по изучению новых веществ, способных
повысить эффективность удобрений и оказать протекторное действие на культуры.
Одной из перспективных разработок в данном
направлении является синтез соединений гуматов, в частности рассматриваемый в
данной работе гумат натрия (Куликова, 2008; Перминова ?). Поскольку гуматы
являются очень важной природной составляющей почв, внесение их под культуры
приводит к существенным прибавкам урожая, более того, это позволяет создать
запас питательных веществ на следующие года.
В условиях современных антропогенных экосистем
особое значение имеет еще одна экологическая функция гумусовых кислот -
биопротекторная, заключающаяся в защите и повышении устойчивости растений при
действии неблагоприятных внешних факторов. Важность этой функции подчеркивается
многими авторами (Орлов, 1990; Карпачевский, 1993; Кирюшин и др., 1993) Однако,
если в литературе достаточно широко представлены работы по исследованию
взаимодействия ксенобиотиков с различными фракциями органического вещества
почв, то работ по влиянию гумусовых веществ на устойчивость растений к действию
различных токсикантов пока сравнительно мало.
Для рационального использования агроценозов
необходимо присутствие в почве всего комплекса необходимых растениям веществ. В
частности цинк является одним из элементов, лимитирующих развитие растений
(Битюцкий, 1999; Ильин, 1991). В серии проведенных опытов, было показано что
избыток цинка также пагубен как его острый недостаток.
Использование серии биотестов (Черемных,
Воронина, 2007; Минеев и др., 1991) для оценки воздействия различных доз цинка
позволяет получить данные по его влиянию на живые организмы (растения,
гидробионты, микроорганизмы, и др.).
В данной работе применялся метод
биотестирования, включающий в себя биотесты на проростках растений и биотесты
на инфузориях. Исследования с помощью двух методов позволяет сопоставлять
полученные результаты, так, с пользование биотеста с растениями условно
имитирует ответ целого организма, а использование теста с инфузориями позволяет
получить ответную реакцию на клеточном уровне.
Цель
Изучение влияния гумата натрия на токсичность и
биологическую активности агрохимических средств (цинковых хелатных удобрений),
с привлечением двух биотест систем: растительный биотест и биотест на
инфузориях.
Задачи исследований
· Провести скрининг методов
биотестирования для соединений полифункционального действия
· Провести биотестирование разных
концентрации цинка на примере препарата Рексолин-Zn15
· Провести биотестирование разных
концентраций гумата натрия
· Оценить действие сочетаний разных
концентраций цинка и гуматов на биологические системы
1. Обзор
литературы
Понятие о биотестировании
Под биотестированием (bioassay) обычно понимают
процедуру установления состояния среды с помощью тест-объектов, сигнализирующих
об опасности независимо от того, какие вещества и в каком сочетании вызывают
изменения жизненно важных функций у тест-объектов. Благодаря простоте,
оперативности и доступности биотестирование получило широкое признание во всем
мире и его все чаще используют наряду с методами аналитической химии.
Биотестирование представляет собой методический
прием лабораторной оценки качества образцов по реакциям подопытных организмов с
известными и поддающимися учету характеристиками. Биологический объект в
биотестировании фактически используется в качестве аналитического прибора или
его части, при этом считается значительно более дешевым. Для биотестирования
возможно использования самых разных характеристик сообщества: на уровне
популяции и сообщества, суборганизменном, на уровне организма, элементов
клеточной структуры или органов, биохимических систем и др.. Возможности и
эффективность применения этих характеристик существенно различаются.
Так, методы биоиндикации, связанные с
исследованиями на суборганизменном уровне, могут быть весьма чувствительными к
действию некоторых факторов среды, но плохо отражают качество среды в целом.
Это относится к показателям, определяемым и на субклеточном, и на клеточном, и
на тканевом уровнях. Количество морфологических аномалий, увеличивается под
действием антропогенных факторов также избирательно: некоторые негативные
воздействия на этот показатель не влияют. Кроме того, выяснить этиологию
наблюдаемых аномалий часто не удается. Все это резко ограничивает
экодиагностические возможности учета отклонений на суборганизменном уровне
(Мелехова, Егорова 2007). Показателем токсического действия служит степень
изменения определенных параметров живых систем, которая фиксируется различными
методами. Это могут быть как биохимические или биофизические методы, разные
виды микроскопии, визуальный подсчет.
На практике наиболее распространенными методами
биотестирования являются такие, в которых фиксируются, главным образом, такие
интегральные параметры, как показатели выживаемости, роста, плодовитости
тест-организмов.
Простейшими количественными показателями
являются биомасса сообщества и его численность. Биомасса или численность
сообщества и тенденции их изменения иногда позволяют в первом приближении
судить о состоянии экосистемы и силе испытываемого ею воздействия.
Состояние такой системы в условиях
антропогенного воздействия может быть оценено также по показателям,
характеризующим динамику биомассы бентоса, т.к. диапазон ее сезонных и
межгодовых изменений увеличивается пропорционально силе воздействия негативных
факторов.
Кроме того, биоиндикация может быть основана на
известном явлении увеличения биомассы, удельной и абсолютной продуктивности
сообществ в условиях нетоксичных дестабилизирующих воздействий (Deeborah
Chapman GB.1999)
Для получения более надежной и полной информации
о качестве среды и состоянии экосистемы необходимо использовать более подробные
характеристики сообществ.
Так, довольно чувствительными индикаторами
воздействий иногда оказываются количественные показатели, учитывающие
абсолютное или относительное обилие совокупно учитываемых членов сообщества,
обладающих сходной жизненной стратегией. Об ухудшении качества среды
свидетельствуют увеличение доли видов "толерантных", по сравнению с
"резистентными" и с "патиентными" видами (Шуйский,
Максимова 2002).
Для биоиндикации используется также соотношение
биомассы и численности (плотности), или средняя масса особи в сообществе.
Уменьшение средней массы особи в сообществе считается признаком ухудшения
качества среды.
Все методы биотестирования характеризуются
своими особенностями. Это и доступность тест-объекта, которая определяется
возможностью их культивирования в лабораторных условиях, поддержанием
необходимых условий температуры, освещенности, сложностью состава питательных
сред, чистотой воздуха и пр. Это и оперативность получения ответа.
Наиболее быстрые реакции на токсическое
воздействие равных концентраций удается регистрировать у простых организмов -
бактерий, водорослей и инфузорий. Наступление таких реакций ограничивается
минутами или несколькими часами. Сутками измеряется проявление ответных реакций
более крупных объектов (у ракообразных - дафний), а так называемая хроническая
токсичность оценивается в течение многих суток и даже недель. Каждый метод
характеризуется и своими техническими способами реализации. С точки зрения
технического оснащения наиболее доступными оказываются методы, основанные на
регистрации общебиологических характеристик - подсчет численности или прироста
популяций.
Для проведения физиолого-биохимических оценок и
определения соотношения, например, живых и мертвых клеток или флуоресценции
тест-культур организмов необходима специальная серийная аппаратура, устройства
которые до настоящего времени производятся промышленностью в крайне
недостаточном количестве (Бойкова , 1989)
Известно, что живые организмы по разным причинам
со временем могут менять свою чувствительность, поэтому обязательной процедурой
в лаборатории является контроль тест-объекта с помощью модельного токсиканта.
Пригодными для анализа признаются тест-системы лишь в том случае, если
концентрация модельного токсиканта, вызывающая 50%-ный эффект за определенное
время, не выходит за пределы фиксированного в описании методики диапазона. Контроль
таких параметров должен проводиться регулярно не реже 1 раза в три месяца.
Определенная нормативным документом процедура
биотестирования промышленных отходов предполагает анализ водной вытяжки на
острую токсичность, т.е. относительной кратковременный эксперимент (от
нескольких минут до 4 суток).
Тест обьекты
Тест-объект (test organism) - организм,
используемый при оценке токсичности химических веществ, почв , природных и
сточных вод, донных отложений, кормов и др. Тест-объекты, по определению Л.П.Брагинского
(2000) - "датчики" сигнальной информации о токсичности среды и
заменители сложных химических анализов, позволяющие оперативно констатировать
факт токсичности (ядовитости, вредности) водной среды ("да" или
"нет"), независимо от того, обусловлена ли она наличием одного точно
определяемого аналитически вещества или целого комплекса аналитически не
определяемых веществ, какой обычно представляют собой сточные воды.
Тест-объекты с известной степенью приближения
дают количественную оценку уровня токсичности.
Важное условие правильного проведения
биотестирования - использование генетически однородных лабораторных культур,
так как они проходят поверки чувствительности, содержатся в специальных,
оговоренных стандартами лабораторных условиях, обеспечивающих необходимую
сходимость и воспроизводимость результатов исследований, а также максимальную
чувствительность в токсическим веществам. (Жмур, 1997) Вместе с тем, совершенно
очевидно, что загрязнение разных типов почв отходами сопровождается с одной
стороны, процессами связывания токсикантов, в частности, гуминовыми
комплексами, аккумуляцией, с другой стороны, биологическим переносом и
транслокацией.
Поэтому, для анализа почвенных образцов,
загрязненных отходами, целесообразно применять более широкий спектр тест-объектов,
включающий почвообитающих организмов, или педобионтов.
Тест-функции
В качестве индикаторов используются
тест-функции. Это критерии токсичности (toxicity criterion), или жизненные
функции, используемые в биотестировании для характеристики отклика тест-объекта
на повреждающее действие среды (Подунова, 1999)Тест-фукнкции, используемые в
качестве показателей биотестирования для различных объектов:
для инфузорий, ракообразных, эмбриональных
стадий моллюсков, рыб, насекомых - выживаемость (смертность) тест-организмов.
для ракообразных, рыб, моллюсков - плодовитость,
появление аномальных отклонений в раннем эмбриональном развитии организма,
степень синхронности дробления яйцеклеток.
для культур одноклеточных водорослей и инфузорий
- гибель клеток, изменение (прирост или убыль) численности клеток в культуре,
коэффициент деления клеток, средняя скорость роста, суточный прирост культуры.
для растений - энергия прорастания семян, длина
первичного корня и др.
Растения в качестве объектов
биотестирования
Одним из методов, обладающим высокой
чувствительностью, универсальностью, интегральностью и простотой является метод
биотестирования с применением растений. Он широко применяется для определения
токсичности веществ как в почве, так и в воде.
Итоговым результатом определения токсичности по
тест-растению (фитотоксичность) является изменение в формировании корневой
системы, морфологических характеристик надземной части растения, биомассе
(общей и отдельных органов растения). Вопрос морфологических изменений в корневой
системе в зависимости от многих факторов давно привлекает внимание
исследователей. На первых этапах развития корневая система растений
высокочувствительна. Изменения внешних морфологических признаков растения в
период вегетации весьма селективны (определённые изменения в морфологии
растения, связаны с определёнными факторами). Эти особенности широко
используются в диагностике питания растений, в определении гормональной
активности, и пр. В настоящее время интерес к этому методу возрос в связи с обострением
экологической ситуации и новыми технические методические возможности.
Кроме оценки неблагоприятного воздействия,
оказывающего прямое или опосредованное воздействие на объекты, метод широко
используется и для оценки стимулирующей активности биологически активных
веществ БАВ. Метод позволяет учитывать не только аллелопатическое
взаимодействие, но и действие органических веществ стохастического характера
(например, гуминовых веществ)
Влияние цинка на развитие растений
Цинк относится к биофильным элементам, поэтому
как его недостаток, так и его избыток может привести к губительным
последствиям. Токсическое действие на растения высоких концентраций цинка может
проявляться в нарушении поступления и распределения других элементов. Выступая
в качестве антагониста железа, цинк вызывает хлороз растений, при этом
уменьшается поглощение железа и нарушается его продвижение. ( Воскресенская и
др.,1987). Общее содержание тяжелых металлов в почвах дает представление лишь о
потенциальной опасности загрязнения, которая может реализоваться при
определенных условиях. В растения из почвы поступают только мобильные
соединения химических элементов, поэтому важно рассматривать подвижные формы
металлов (Ильин, 1990; Никушина, 1994). Попавшие в почву тяжелые металлы,
прежде всего их мобильная форма, претерпевают различные трансформации. Один из
основных процессов, влияющих на их судьбу в почве - закрепление органическим
веществом.
Для цинка, учитывая его частый
дефицит в почвах, повышение содержания его подвижной формы при загрязнении не
такое значительное, Оно составляет для дерново-подзолистых почв 36,18 мг/кг, а
через 2 года - 7,92 мг/кг (Куликова, 2008). Загрязнение почвы тяжелыми
металлами оказывает влияние на формирование урожая и качество продукции (Ильин,
1991).
Выявлено, что токсичные
элементы, накапливающиеся в растениях, до определенного предела не оказывают
отрицательного влияния на продуктивность сельскохозяйственных культур.
Отмечается также эффект от использования биологически активных веществ на рост
и развитие зерновых злаковых культур и формирование урожайности.
В рамках исследования был проведен анализ данных
по существующим нормативам и предельно допустимым концентрациям (ПДК) цинка в
объектах окружающей среды.
Таблица 1. ПДК цинка для почвы, воды и растительной
продукции.
|
Объект
|
Форма
элемента
|
Концентрация,
мг/кг
|
примечания
|
|
Почва
|
валовая
|
100
|
Подвижные
формы Госкомприрода СССР, № 02-2333 от 10.12.90
|
|
Почва
|
подвижный
|
23
|
|
|
Зерно
|
валовое
|
50
|
Федеральный
центра госсанэпиднадзора Минздрава России. МУК 4.1.1503-03
|
|
Зелёная
масса
|
валовое
|
130
|
|
|
Питьевая
вода
|
валовое
|
23
|
|
Влияние гуматов на развитие растений
Физиологическая и
биопротекторная активности относятся к важнейшим функциональным параметрам
гумусовых веществ. Они являются одним из ключевых параметров экологического
потенциала органического вещества почв. Благодаря этим свойствам гумусовые
вещества играют особую роль как в обеспечении высокой биологической
продуктивности системы почва - растение, так и в повышении устойчивости этой
системы к неблагоприятным воздействиям (загрязнению и т.п.).
Способность гумусовых веществ
оказывать благоприятное влияние на рост и развитие растений была обнаружена
К.В. Нефедовым (1887) еще в конце прошлого века и неоднократно подтверждалась
позднее (Ваксман, 1937; Тюрин, 1937). Было доказано, что гумусовые кислоты
влияют на общий ход обмена веществ и в особенности на процессы дыхания и роста
растений.
Установлено, что под действием гумусовых веществ
у растений активизируется корнеобразование, за счет изменения селективности
клеточных мембран усиливается поступление воды и элементов питания, что
гумусовые соединения положительно влияют на все фазы митотического цикла клеток
и вызывают увеличение значений митотического индекса в 1,5 раза. Также показано
положительное влияние гуминовых кислот на поглощение кислорода, активацию
ферментных систем (каталазы, пероксидазы, амилазы, инвертазы, альдолазы и др.)
и углеводного обмена, усиление образования хлорофилла, увеличение содержания
сахаров и белка в урожае. При сравнении транспортного индекса поступления в
растения изотопа серебра и его подвижности в самом растении в составе
комплексов серебра с различными лигандами в ряду минеральные формы - оксалат -
фульваты - гуматы оказалось, что гуминовые кислоты обеспечивают наивысшие
значения этих характеристик (Jones,
Peterson, 1986). При
изучении спектров сверхслабой люминесценции корней ржи и пшеницы показано (Goleblowska,
Flak, 1996)
благоприятное стимулирующее действие гуматов калия как на общий уровень
физиологических процессов в корнях, так и на их рост.
В работе по исследованию воздействия гумусовых
веществ на рост озимой пшеницы в условиях оптимального минерального фона (Gone,
1996) установлено, что гумусовые препараты оказывали стимулирующий эффект не
только на рост растений, размер и вес зерен, но и на общее содержание белка в
зерне.
Особого внимания заслуживает уже давно
дискутируемый в литературе вопрос о возможности проникновения гумусовых веществ
или их фрагментов через клеточную мембрану корневых волосков в ткани растений.
Многие исследователи физиологической активности гумусовых веществ полагают, что
такой процесс возможен и гумусовые вещества поступают в растительные ткани и
непосредственно воздействуют на биохимические процессы внутри клетки. На основе
этих представлений возникают новые теории гумусового питания растений. В
соответствии с положениями одной из них высшие зеленые растения рассматриваются
как факультативные гетеротрофные организмы с «симбионтным пищеварением». При
этом предполагается, что гумусовые вещества и их структурные компоненты,
поступая через клеточную стенку корневых волосков в ткани и клетки растений,
поглощаются и ассимилируются растением целиком и в виде достаточно крупных
блоков встраиваются в качестве готовых структурных элементов в ткани растения.
На основе таких построений предлагается открытие новой трофической ветви
биологического круговорота углерода, в которой циркулируют структурные и
функциональные блоки биологических макромолекул, многократно используемых на
различных трофических уровнях .
Процесс взаимодействия биоты и в особенности
высших растений с гумусовыми веществами очень сложен и составляет одну из
ведущих проблем в почвенном питании растений. Гипотеза поступления крупных
фрагментов гумусовых веществ в растения и встраивания их в готовом виде в ткани
растений, несмотря на всю свою привлекательность, не имеет строгих научных
доказательств. Для решения данного вопроса стали активно использовать
радиоактивные изотопы углерода и других элементов, однако методические
затруднения заметно охладили интерес к этим работам. Так, например, в одной из
первых работ по этому вопросу (Fuhr;
Sauerbeck, 1967) с
использованием метода автодиографии на изотопах С 14 авторы
попытались доказать поступление макромолекул гумусовых веществ в корневую
систему растения. Однако из-за того, что, во-первых, не удалось
дифференцировать прочно адсорбированные на поверхности корневых волосков
макромолекулы от проникших внутрь последних, а во-вторых, не было зафиксировано
передвижения радиоактивной метки к центральному цилиндру (ксилеме) сорта,
авторы сделали вывод, что транспортировка гумусовых веществ через клеточную
стенку если и возможна, то только для соединений ила фульвокислот. В другой
работе (Vaughan;
Jnehan, 1976),
выполненной теми же методами, но уже в модельных условиях на проростках ржи,
показано, что меченные С 1 гумусовые вещества адсорбируются на
поверхности корней, но не транспортируются по ксилеме к проростку.
На основании многолетних
исследований влияния гуминовых веществ торфа на рост и качественные показатели урожая
целого ряда сельскохозяйственных культур (Наумова, 1956) было установлено, что
гумусовые вещества, не проникая внутрь растительной клетки, проявляют
мембранотропное действие и, активизируя тем самым обменные процессы в
растениях, стимулируют рост тканей, повышают их иммунитет и устойчивость к
неблагоприятным условиям.
В то же время, несомненно, еще
одним из реальных механизмов влияния гумусовых кислот на рост растений в
естественных условиях, помимо прямого физиологического воздействия, является
(Чижевский, Дикусар, 1955) стимуляция ПК прикорневой и симбиотической
микрофлоры, в особенности грибов, которые сами выделяют регуляторы роста и
развития растений. В последние годы эти выделяемые почвенными грибами вещества
достаточно подробно исследовались , результатом чего явился вывод о том, что
они ускоряют как общее течение биохимических процессов вблизи поверхности
клеточной стенки корневых волосков, так и выработку ауксино- и
гиббереллиноподобных ростовых стимуляторов в самом растении. На этой основе был
предложен целый ряд эффективных регуляторов роста растений типа фузикокцина,
эмистима и др. По некоторым данным фузикокцин в ряде случаев превосходит
гиббереллин по своему стимулирующему действию на растения.
В условиях современных антропогенных экосистем
особое значение имеет еще одна экологическая функция гумусовых кислот -
биопротекторная, заключающаяся в защите и повышении устойчивости растений при
действии неблагоприятных внешних факторов. Важность этой функции подчеркивается
многими авторами (Орлов, 1990; Карпачевский, 1993; Кирюшин и др., 1993) Однако,
если в литературе достаточно широко представлены работы по исследованию
взаимодействия ксенобиотиков с различными фракциями органического вещества
почв, то работ по влиянию гумусовых веществ на устойчивость растений к действию
различных токсикантов пока сравнительно мало.
Так, например, А.И. Горовая (1983) обнаружила,
что предпосевная обработка семян сорго слабым раствором ГК позволяет ослабить
токсическое влияние гербицидов на митотический цикл клеток меристемы корня.
С.А. Гуминский (1968) показал, что ГК стимулируют процесс дыхания растений в
условиях острого дефицита кислорода. По данным других авторов ГК снимают также
отрицательное воздействие высоких доз минеральных удобрений (Chaminade,
1965), ослабляют вредное действие на растения почвоутомляющих веществ и
радионуклидов (Горовая, 1988), помогают снятию токсикозов у растений.
Совместное применение гуминовых препаратов с фунгицидами позволяет снизить
ингибирующее действие последних на растения (Наумова и др., 1995). Применение
гуматов натрия заметно уменьшает фитотоксическое действие некоторых групп
гербицидов и стимулирует ферментативную активность почв, причем в этом процессе
участвуют CP гуминовых
кислот (Kozjubinskaya
еt.аl.,
1996). Гумусовые вещества обладают выраженной антимутагенной активностью,
защищая растения от воздействия гербицидов (Stewart,
1984, De
Simone е.а., 1996). В
работе группы исследователей из МГУ (Perminova
еt.аl.,
1996) на материалах вегетационных опытов с пшеницей и кукурузой, а также в
лабораторных опытах с культурами водорослей показано, что гумусовые вещества
значительно ослабляют токсичность широкого набора ксенобиотиков (тяжелые
металлы, полициклические углеводороды, гербициды и др.) и являются, по сути,
прекрасными естественными детоксикантами.
При действии на клетки
водоросли Nitellopsis
obtlisa и огурца Cucumis
satins в фитотронах на
искусственных средах гуматы натрия могут выполнять значительную биопротекторную
функцию в условиях дефицита железа, стимулируя адаптивные процессы (изменение
окислительно-восстановительного потенциала плазмалеммы клеток), что повышает
жизнестойкость растений в неблагоприятных условиях (Slesak,
KowaJiszyn, 1996).
Таким образом, важная роль системы гумусовых
кислот почвы в нормализации и стимуляции роста и развития растительных
организмов очевидна. Однако большинство исследований, как это было показано
выше, посвящены изучению механизма действия гумусовых веществ на
физиологические и биохимические процессы в растениях, а не на рассмотрение их биопротекторных
свойств.
Именно в этом направлении будут проводиться
дальнейшие работы с целью выявить защитные свойства гумусовых веществ, изучить
оптимальные концентрации для разного рода почв и загрязнителей.
Совместное влияние меди в качестве
тяжелого метала на развитие растений
Интерес представляют работы по исследованию
совместного действия тяжелых металлов и гуматов (Куликова, 2008)
Результаты биотестирования показали, что
внесение гуминовых препаратов приводило к снижению токсичности меди уже при концентрации
гумусовых веществ 5 мг/л, а при концентрациях 30 мг/л и выше наблюдали полное
снятие негативного действия меди. Особо следует подчеркнуть, что при
концентрациях ГВ 30 мг/л и выше длина корней в присутствии ГВ превышала даже
контрольные значения для проростков, проращиваемых на дистиллированной воде без
внесения меди. (Kholodov
at.el.,
2004)
2. Объекты и методы
Подготовка культивационной воды
Культивационная вода должна удовлетворять
следующим требованиям:
отсутствие органических загрязняющих веществ,
хлора, токсических веществ и антагонистических для парамеции организмов
(простейших, многоклеточных);
рН - (7,0 - 8,0);
жесткость общая от 60 мг/дмз до 200 мг/дм
(выраженная в СаСОз);
концентрация растворенного кислорода - не менее
6 мгО2/дмз.
температура - (+22+ 2)оС;
При исследовании вод с повышенным
солесодержанием (содержание сухого остатка выше 1 г/дм) проводят
предварительную постепенную адаптацию культуры тест - объектов, добавляя
порциями хлористый натрий в культивационную воду (содержание солей по сухому
остатку не должно превышать 6 г/дм ).
Получение исходного материала, транспортировка,
содержание и кормление парамеции, выращивание культуры.
Важное условие правильного проведения
биотестирования - использование генетически однородных лабораторных культур,
т.к. они проходят поверки чувствительности, содержатся в специальных,
оговоренных стандартами лабораторных условиях, обеспечивающих необходимую
сходимость и воспроизводимость результатов исследований, а также максимальную
чувствительность в токсическим веществам. Культуру парамеции выращивают в
термостате при температуре 22оС. В качестве культиваторов используют
чашки Петри (диаметр 9 см). Пересевают культуру инфузорий один раз в 10 дней.
Для этого в чистые чашки Петри наливают на половину чашки, дехлорированную
водопроводную воду.
В каждую чашку добавляют по 1 см суспензии
дрожжей (можно добавить небольшой кусочек сухой корки банана). Таким образом,
содержимое чашек становится питательной средой для выращивания парамеции.
Форма соединения цинка используемая
в исследовании
В данной работе рассматривалась хелатная форма
цинка (цинк-двунатриевый комплекс этилендиаминтетрауксусной кислоты [EDTA-Zn]
Na2 д.в Zn
11 %) в виде препарата «Рексолин 15».
Инфузории в качестве тест объектов
caudatum Ehrenberg - одноклеточные организмы
размером 180 - 300 мкм. Массовый вид, обитающий в пресной воде с высоким
содержанием органических веществ. В сточной воде является часто основным видом,
поли-альфа-мезосапроб.
Простейшие, в том числе ресничные инфузории,
составляют основную часть микрофауны активного ила. Они участвуют в
освобождении очищаемой воды от взвешенных бактериальных клеток и от рыхлых,
плохо оседающих бактериальных агломератов, способствуя тем самым повышению
эффективности очистки. Методика определения острой токсичности водных вытяжек
из отходов, почв, осадков сточных вод, а также пресных поверхностных,
грунтовых, сточных и питьевых вод с использованием инфузорий Paramecium
caudatum в лабораторных условиях основана на определении смертности парамеций
при воздействии токсических веществ, присутствующих в исследуемой водной среде,
по сравнению с контролем. (Гроздов, 2001; Методическое руководство.
Госкомприроды СССР от 06.08.1990).
Культивирование инфузорий Paramecium
caudatum
Культура инфузорий предоставлены для проведения
исследований кафедрой биохимии Московского государственного университета
прикладной биотехнологии.
Инфузории культивировали на минерально-дрожжевой
среде, приготовление которой состоит из двух этапов:
Приготовление 10-кратного концентрированного
раствора по прописи Лозина-Лозинского (в 1 литре дистиллированной воды
растворяли соли; 0,1г NaCl;
0,01г KCl ; 0,01 г MgSO4;
0,01
г CaCl2
;0,02г NaHCO3
).
Приготовление питательной среды (в плоскодонные
конические колбы объемом 100 см3 вносили 45 мл дистиллированной
воды, 5 мл концентрированного раствора Лозина-Лозинского. Закрывали колбу
ватно-марлевой пробкой, кипятили 5 минут и остужали до комнатной температуры.
Среда для культивирования инфузорий была
приготовлена на дистиллированной воде стандартного качества, которую получали с
помощью дистиллятора, не имеющего в своем составе ни латунного, ни медного
испарителя или конденсатора.
Автоматизированная биотехническая
система
В РФ создана автоматизированная биотехническая
система, состоящая из устройства БиоЛаТ программы AutoCiliata и методических
приемов культивирования и проведения исследований с использованием в качестве
тест-объектов инфузорий Stylonychia mytilus, Paramecium caudatum, Tetrahymena
pyriformis.
На первом этапе биотестирования осуществляется
подсчет инфузорий Paramecium caudatum в течение 2-х часов экспозиции их в 2-х
подготовленных пробах продукта, представляющих собой водный экстракт и
разбавленный ацетоновый экстракт. Оценка прироста Tetrahymena pyriformis
осуществляется на основе подсчета их в водном экстракте продукта через 24 часа
после экспозиции в пробе.
Для подсчета простейших применяется
автоматизированный прибор БиоЛаТ. Интегральная оценка безопасности вычисляется
автоматически на основании результатов 2-х этапов биотестирования и в
соответствии с алгоритмом программы AutoCiliata
Способ выявления реакции инфузорий на
исследуемый продукт состоит в сравнении количества этих тест-объектов через
определенные промежутки времени. Подсчет живых клеток простейших основан на
обработке изображения емкости для проведения исследования (лунки) программой
AutoCiliata. Живые инфузории - это подвижные объекты (скорость перемещения
инфузорий может быть 0,01 - 2мм/сек) и признаками, позволяющими
идентифицировать объект, как живую клетку, являются его размеры и факт
самостоятельного перемещения.
В основе формализации процесса биотестирования
лежит принцип многократного подсчета количества тест-объектов в течение
экспозиции и представление процесса изменения этого количества случайным
процессом. Результаты любых измерений, в том числе биологических исследований с
помощью устройства БиоЛаТ, включают ошибки измерений. Такие измерения в течение
некоторых промежутков времени интерпретируются как случайные процессы, имеющие
в своем составе случайные функции ошибок.
Биотест на проростках семян редиса
Биотест на проростках семян редиса широко
применяется для оценки суммарной фитотоксичности почв. Для оценки качества почв
представляется целесообразным использование в качестве тест-организмов проростки
семян растения. Метод основан на высокой отзывчивости семян редиса на
токсические вещества путем учета снижения длины корней проростков в растворах
препаратов вытяжек из анализируемых образцов почвы, сока корневой системы и
конечной продукции по сравнению с контролем, выраженное в процентах. В полевых
условиях при определении суммарной токсичности контролем служит образец,
отобранный с варианта опыта без нагрузки поллютантов.
Оценка длины корня и других характеристик
проростков производится вручную. Для проведения полноценного эксперимента
необходимо измерить и оценить до 300 проростков в одной пробе.
Семена редиса, отобранные по качеству и близким
размерам, помещали в химические стаканы и в течение суток замачивали водными
растворами солей кадмия или водными вытяжками из почв. Семена заливались таким
количеством раствора, чтобы исключить гибель семян от излишней влаги или
пересыхания. Контролем служили семена, замачиваемые водой в тех же объемах.
Через сутки семена раскладывали на чистые чашки Петри с бумажными фильтрами. В
чашки предварительно вносили по 7 мл стерильной водопроводной воды. Затем
раскладывали семена по 10 штук на чашку, которые равномерно распределялись по
поверхности чашки. Чашки выдерживали при определенной температуре в течении двух
суток. На 3-и сутки после раскладывания семян определяли общую длину корневой
системы проростков в каждой повторности, учитывали число непроросших семян
(проросшими считались те, у которых корешок прорывал семенную оболочку). Затем
рассчитывали среднюю длину корня взошедших семян в каждой повторности и среднюю
длину из трех повторностей.
Снижение длины корней проростков замоченных
семян в растворах препаратов по сравнению с контролем, выраженное в процентах,
являлось показателем токсичности препаратов.
биотестирование цинк гумат инфузория
Фитотестирование с растениями
райграса
В качестве тест-организмов была опробована
культура газонной травы райграс. Рассматриваемый метод основан на учете
образовавшейся вегетативной массы, сравнении результатов с контролем и
последующем анализе растительного материала. В данном биотесте исследовалась
продуктивность данной культуры на дерново-подзолистой почве, поглощение
растениями искусственно внесенных повышенных концентраций исследуемых веществ.
Использовались вегетационные сосуды, в которые помещалось по 600 грамм почвы,
вносился азот в качестве дополнительного элемента питания, засевалась тест
культура, и сосуды выставлялись в вегетационном домике. После побеги были
собраны, взвешены и высушены. Сухой материал также был взвешен и сохранен для
определения содержания исследуемого элемента. Также для исследования были
отобраны почвенные образцы для дальнейшего исследования.
Методика определения содержания
подвижного цинка в почве
В ходе исследования необходимо было получить
данные по содержанию цинка в почве, а также по изменению его количества при
применении различных доз цинка и гумата натрия.
Навеску почвы из смешанного образца массой 10
грамм, помещали в конические колбы , приливали 100 мл 1н HCl
взбалтывали на ротаторе в течении часа и оставляли настаиваться на ночь. После
этого содержимое колб фильтровалось, полученные почвенные вытяжки оставлялись
для атомно-абсорбционного анализа (Практикум по агрохимии, 1989).
3. Результаты и их обсуждение
Опыт на райграсе
В опыте на райграсе исследовалось влияние цинка
в концентрациях: 5, 25 и 50 мг/кг и гумата в концентрации: 1, 5 и 10% а также
совместное применение гумата и цинка в максимально исследуемых концентрациях.
Данные по вегетативной массе полученные по
результатам опыта представлены в таблице 1.
Таблица 1. Вегетативная масса
райграса по результатам опыта
|
образец
|
масса
|
%
от контроля
|
%
от комплекса Zn + гNa
|
|
сырой
вес, г
|
сухой
вес, г
|
|
|
|
контроль
|
3,20
|
0,48
|
|
314
|
|
N+гNa
1%
|
3,53
|
0,47
|
110
|
346
|
|
N+гNa
5%
|
3,90
|
0,53
|
122
|
382
|
|
N+гNa
10%
|
4,17
|
0,60
|
130
|
408
|
|
N+Zn
5 мг/кг
|
3,87
|
0,53
|
121
|
379
|
|
N+Zn
25 мг/кг
|
2,63
|
0,40
|
82
|
258
|
|
N+Zn
50 мг/кг
|
0,33
|
0,07
|
10
|
33
|
|
N+Zn+гNa
|
1,02
|
0,22
|
32
|
,
|
Использование гумата натрия в разных
концентрациях привело к увеличению биомассы растений райграса от 10 до 30%.
Использование разных доз цинковых удобрений
повысило биомассу при использовании его в рекомендованной концентрации 5 мг/кг
и привело к снижению биомассы при повышении дозы цинка на 5 и 55%,
соответственно 25 и 50 мг/кг применяемого удобрения.
Совместное использование гумата натрия на фоне
высокой концентрации цинка повлияло положительно на формирование биомассы по
сравнению с вариантом с использованием высокой концентрации (50 мг/кг) цинка.
Биомасса увеличилась на 30%.
Максимальный урожай был получен при наибольшей
концентрации гумата, также в 3 раза увеличилась масса образца с совместным
применением цинка и гумата натрия (Рис.1).

Рис.1. влияние различных концентраций гумата
натрия на биомассу растений
Применение гумата натрия положительно влияло на
биомассу растений райграса и максимально эффективной действующей концентрацией
явилась его 10% содержание в почве. Проявлялись защитные свойства использования
гумата натрия на дерново-подзолистой почве при выраженном угнетающем действии
высокой концентрации цинка.
Определение содержания цинка в почве
Для оценки способности почвы удерживать цинк в
недоступной для растений и организмов форме, был проведен анализ по методике
Соловьева. Из полученных данных видно, что в почве наблюдалось фоновое
содержание цинка. Для образцов Zn
5, Zn 25 и Zn
50 наблюдалось закономерное увеличение концентраций , для образцов с совместным
применением Zn 50 и г Na
10% наблюдается снижения количества доступного цинка на 35 %.(таблица 2.)
Таблица 2 Определение цинка в почве
|
номер
|
тип
образца
|
масса
|
содержание
Zn мкг/мл
|
|
1
|
контроль
|
10
|
3,8
|
|
2
|
N
|
10
|
3,7
|
|
3
|
N+гNa
1
|
10
|
2,9
|
|
4
|
N+гNa
5
|
10
|
2,5
|
|
5
|
N+гNa
10
|
10
|
2,3
|
|
6
|
N+Zn
5
|
10
|
20,6
|
|
7
|
N+Zn
25
|
10
|
26,8
|
|
8
|
N+Zn
50
|
10
|
35,4
|
|
9
|
N+Zn+гNa
|
10
|
23,5
|
Применение цинка позволило существенно умеличить
содержание этого элемента в исследуемой почве. Реккомендованая доза в 5 мг/кг
обеспечила умеличение запаса цинка в подвижной форме более чем в 5 раз(520% от
контроля), а максимальная концентрация вызвала увеличение содержания цинка в 9
раз (931% от контроля). На рисунке 2 показано, что применение гумата натрия
позволило снизить количество доступного цинка, и привести его к значению,
близкому к полученному от реккомендованой дозы удобрения.
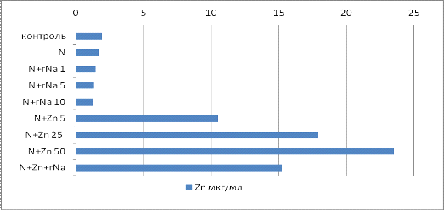
Рисунок 2. Данные по растительному материалу,
определение цинка
Определение содержания цинка в
вегетативном материале райграса
Было проведено исследование поглощенного
растениями цинка и влияния гумата на эту величину. Зависимость содержания цинка
в растении от количества цинка в почве меняется практически линейно, при
совместном использовании цинка и гумата количество поглощенного цинка снизилось
с 24мкг\мл до 15мкг/мл , таким образом на 34 % уменьшилось содержание этого
элемента в растении.(табл 3)
Таблица 3 Данные по растительному
материалу, определение цинка
|
номер
|
тип
образца
|
масса
|
содержание
Zn мкг/мл
|
|
1
|
контроль
|
0,501
|
1,9
|
|
2
|
N
|
0,503
|
1,7
|
|
3
|
N+гNa
1
|
0,502
|
1,4
|
|
4
|
N+гNa
5
|
0,507
|
1,3
|
|
5
|
N+гNa
10
|
0,504
|
1,2
|
|
6
|
N+Zn
5
|
0,505
|
10,5
|
|
7
|
N+Zn
25
|
0,509
|
17,9
|
|
8
|
N+Zn
50
|
0,506
|
23,5
|
|
9
|
N+Zn+гNa
|
0,504
|
15,2
|
По результатам исследования было выявлено, что
применение удобрения в реккомендуемой дозе , увеличило содердание цинка в
растительном материале в 5,5 раз (552% от контроля), а в образцах где
исследовались максимальные концентрации содержание подвижного цинка увеличилось
в 12 раз(1234%от контроля)
На рисунке 3 показано, что применение гумата
натрия и для растительной продукции позволило снизить количество поглощенного
цинка. Таким образом в образце с совместным внесением цинка и гумата натрия ,
содержание цинка увеличилось в 8 раз по сравнению с контролем.
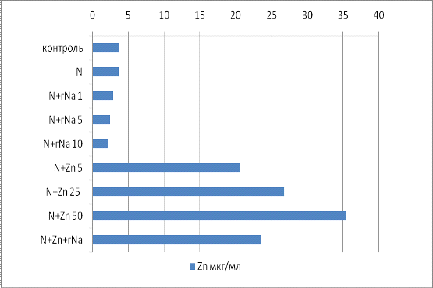
Рисунок 3 определение цинка в почве
Таблица 4 Данные по почвенным образцам,
определение цинка
|
номер
|
тип
образца
|
масса
|
содержание
Zn мкг/мл
|
|
1
|
контроль
|
10
|
3,8
|
|
2
|
N
|
10
|
3,7
|
|
3
|
N+гNa
1
|
10
|
2,9
|
|
4
|
N+гNa
5
|
10
|
2,5
|
|
5
|
N+гNa
10
|
10
|
2,3
|
|
6
|
N+Zn
5
|
10
|
20,6
|
|
7
|
N+Zn
25
|
10
|
26,8
|
|
8
|
N+Zn
50
|
10
|
35,4
|
|
9
|
N+Zn+гNa
|
10
|
23,5
|
Опыт на инфузориях
В лабораторном эксперименте исследовались
растворы хелатной формы цинка в следующих концентрациях:5, 25 и 50 мг/кг. Было
установлено, что высокие концентрации цинка приводят к летальному исходу у
инфузорий, погибало от 18 до 40 % участвовавших в биотесте объектов. Полученные
данные представлены в таблице 5 и рисунке 4
Таблица 5 Зависимость смертности
инфузорий от концентрации цинка
|
концентрация
мг/кг
|
5
|
25
|
50
|
|
количество
инфузорий
|
85
|
82
|
87
|
|
76
|
75
|
71
|
|
79
|
75
|
65
|
|
69
|
62
|
51
|
|
Смертность
по отношению к начальному количеству, %
|
18,7
|
27,0
|
39,9
|
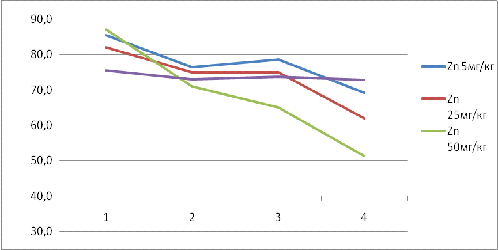
Рис. 4 Зависимость смертности инфузорий от
концентрации цинка
Примечание: 1-количество инфузорий в лунке на
начало эксперимента (до внесения растворов); 2, 3, 4 -количество инфузорий по
данным замеров через 10, 20 и 30 минут соответственно .
Стоит отметить, что для малых концентраций цинка
характерен эффект токсикации и интоксикации (восстановления ) активной
двигательной способности инфузорий.
Достоверная токсичность по результатам
эксперимента установлена при использовании цинка в концентрациях 25 и
50мг/кг.(погибало более 20 % особей)
Динамика во времени показана на графике 5,
данные в таблице 6.
Таблица 6 Зависимость смертности
инфузорий от концентрации гумата натрия
|
Концентрация
%
|
контроль
|
<1%
|
1%
|
5%
|
10%
|
|
количество
инфузорий
|
75
|
53
|
53
|
47
|
41
|
|
73
|
55
|
54
|
48
|
45
|
|
73
|
55
|
56
|
48
|
44
|
|
72
|
50
|
50
|
46
|
42
|
|
Смертность
по отношению к начальному количеству, %
|
|
4
|
7
|
2
|
3
|
Как видно на рисунке 5, для всех исследуемых
концентраций реакция проходила одинаково, что позволяет предполагать отсутствие
влияния дозы гумата на активность тест обьектов.
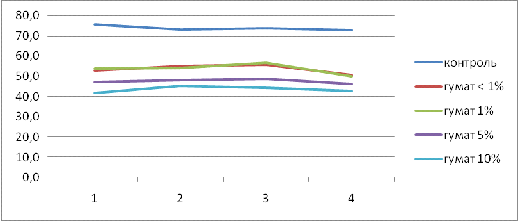
Рис 5 Зависимость смертности инфузорий от
концентрации гумата натрия
Примечание: 1-количество инфузорий в лунке на
начало эксперимента (до внесения растворов); 2, 3, 4 -количество инфузорий по
данным замеров через 10, 20 и 30 минут соответственно .
При совместном применении гумата натрия и цинка
в максимальных рассматриваемых концентрациях наблюдалось снижение смертности
тест объектов по сравнению с образцами ,где был внесен только цинк. Так смертность
снизилась с 39 % до 17% от начального количества. Данные представлены в
таблице7 и рисунке 6.
Таблица 7 Сопоставление данных по
смертности в образцах с внесением цинка отдельно и в комплексе с гуматом натрия
|
вещество
|
Zn
50 +г Na 10
|
Zn
50
|
контроль
|
|
количество
инфузорий
|
88
|
87
|
75
|
|
83
|
71
|
73
|
|
77
|
65
|
73
|
|
73
|
51
|
72
|
|
Смертность
по отношению к начальному количеству, %
|
17
|
40
|
|
На рисунке 6 показано изменение количества
инфузорий при внесении к цинку гумата натрия. Заметно, что это позволило
заметно сократить смнртность, что позволяет судить о снижении данным препаратом
токстического эффекта.
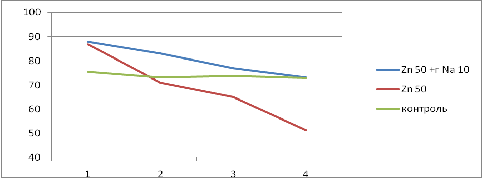
Рис 6 Сопоставление данных по смертности в
образцах с внесением цинка отдельно и в комплексе с гуматом натрия.
Примечание: 1-количество инфузорий в лунке на
начало эксперимента (до внесения растворов); 2, 3, 4 -количество инфузорий по
данным замеров через 10, 20 и 30 минут соответственно.
В контрольном растворе инфузории стабильно
выживали, так для пяти проведенных контрольных замеров количество тест объектов
снизилось в среднем на 4 % , что может быть вызвано погрешностью метода, или
особенностями поведения инфузорий. Данные представлены в таблице 8 и рисунке 7.
Таблица 8 Изменения численности
инфузорий в контрольных образцах
|
повторность
|
1
|
2
|
3
|
4
|
5
|
|
Количество
инфузорий
|
73
|
81
|
77
|
71
|
76
|
|
67
|
80
|
77
|
68
|
73
|
|
67
|
85
|
78
|
71
|
75
|
|
68
|
86
|
72
|
65
|
73
|
|
|
|
|
|
|
|
|
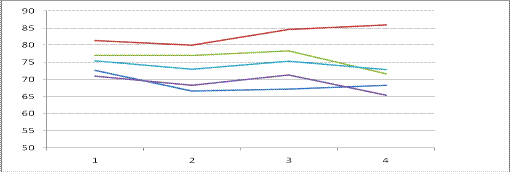
Рис 7 Изменения численности инфузорий в
контрольных образцах
Примечание: 1-количество инфузорий в лунке на
начало эксперимента (до внесения растворов); 2, 3, 4 -количество инфузорий по
данным замеров через 10, 20 и 30 минут соответственно ..
Опыт на проростках семян редиса
В лабораторном эксперименте на проростках семян
редиса с применением различных концентраций цинка были использованы растворы
хелатной формы цинка в следующих концентрациях:5, 25 и 50 мг/кг. Также исследовался
гумат натрия следующих концентраций 1, 5 и 10%
Для серии опытов с растворами заданных
концентраций были получены следующие результаты, приведенные в таблице 9 и
рисунке 8.
Таблица 9 Зависимость длины корней
от используемых концентраций веществ.
|
образец
|
среднее
значение
|
доля
в процентах от контроля с дистиллятом
|
|
дистиллят
|
20,1
|
|
|
гумат
<1
|
7,01
|
35
|
|
г
Na 1
|
2,28
|
11
|
|
г
Na 5
|
1,92
|
10
|
|
г
Na 10
|
1,49
|
7
|
|
Zn
5
|
7,30
|
36
|
|
Zn
25
|
5,61
|
28
|
|
Zn
50
|
3,35
|
17
|
|
Zn+г
Na
|
7,39
|
37
|
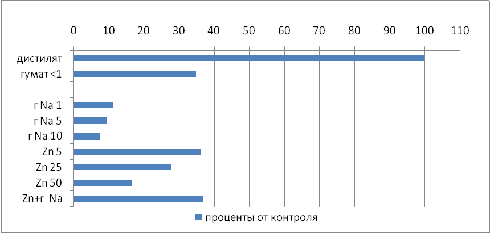
Рисунок 8 Зависимость длины корней от
используемых концентраций веществ.
При совместном применении цинка и гумата длина
корней увеличилась с 17 до 37% от контрольного образца с дистиллятом, что в
действительных величинах составило изменение длины от 3, 5 до 7, 5 см, или 46
%.
В опытах с вытяжками из почвенных образцов под
культурой райграса с теми же внесенными концентрациями цинка и гуматов были
получены следующие результаты. приведенные в таблице 10 и рисунке 9.
Таблица 10.Зависимость длины корней от
используемых концентраций веществ.
|
образец
|
среднее
значение
|
доля
в процентах от контроля с дистиллятом
|
|
дистилят
|
20,69
|
|
|
контроль
почва
|
21,45
|
104
|
|
азот
N
|
25,10
|
121
|
|
г
Na 1
|
32,91
|
159
|
|
г
Na 5
|
34,16
|
165
|
|
г
Na 10
|
35,43
|
171
|
|
Zn
5
|
19,91
|
96
|
|
Zn
25
|
19,24
|
93
|
|
Zn
50
|
17,59
|
85
|
|
Zn+г
Na
|
24,08
|
116
|
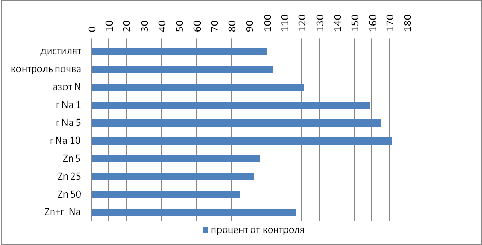
Рисунок 9 Зависимость длины корней от
используемых концентраций веществ.
Заметно, что в комплексе с питательными
компонентами почвы гумат дает прибавку по длине корней от 160 до 171 % в
сравнении с контролем на дистилляте (при концентрациях от 1% до 10%
соответственно).
В образцах с внесенным цинком наблюдалось
угнетение относительно образцов с гуматом и образцов на почвенной вытяжки из
используемой дерново- подзолистой почвы . В образце с совместным внесением
гумата и максимально рассматриваемой концентрации цинка наблюдается прибавка
длинны корня относительно образца отдельно с цинком на 26 % (от 85% до 116 % от
контроля с дистиллятом) и угнетение относительно образца отдельно с гуматом
максимально рассматриваемой концентрации на 32 % (от 171% до 116% от контроля с
дистиллятом).
Выводы
По полученным данным видно, что необходимо с
большой ответственностью подходить к применению микроудобрений, и в частности
рассматриваемого в данной работе препарата Рексолин 15. Его применение в
рекомендованных концентрациях на вегетационных опытах позволило увеличить
урожай на 20 процентов, что позволяет судить о нем, как об эффективном
удобрении. Содержание цинка в продукции возросло в сравнении с контролем, но
осталось в рамках допустимых концентраций 10 мг\кг при максимально разрешенной
по нормативам 130 мг\кг. Совершенно другая картина наблюдалась при превышении
рекомендованной дозы. Урожай понизился на 20 процентов при превышении дозы в 5
раз, а при превышении в 10 раз наблюдалась сильнейшая токсикация и практически
полное отсутствие развития растения.
Рассматривая результаты исследования гуматов на
примере гумата натрия, можно с уверенностью заявить, что применение данного
препарата позволяет значительно снизить негативное влияние веществ, токсичных
при высоких концентрациях. Максимальный эффект был получен при применении 10%
концентрации гумата натрия. Во всех видах проведенных биотестов удалось снизить
угнетение и даже гибель организмов не менее чем на треть. Это довольно существенный
результат, показывающий перспективность применения подобных соединений при
хозяйственном использовании. Использование гумата натрия снижало количество
доступного цинка в почве и количество этого элемента поглощенного растениями на
30 процентов, а также позволило полностью снять отрицательный эффект от
превышения концентрации цинкового удобрения, показав даже некоторую прибавку
урожая в сравнении с контрольными образцами.
Использование методик биотестирования позволило
оценивать эффект, оказываемый исследуемыми препаратами на биологические обьекты
- растения и одноклеточных животных. С точки зрения агрохимической науки это
позволяет судить как об эффективности удобрений, о наиболее оптимальной
концентрации и возможных последствиях от несоблюдения нормативов внесения на
урожай, так и об эффекте, оказываемом продукцией на живые организмы. На основе
проведенной работы, можно отметить достаточно высокую репрезентативность и
воспроизводимость результатов используемых биотестов; возможность оценить не
только количества исследуемых веществ, но и непосредственный эффект на живые
организмы. Оперативность и отзывчивость на изменения искусственно созданной
среды отличают все виды проведенных тестов, как растительных, так и животных.
Дальнейшая работа должна быть направлена на
совершенствование методики биотестов и построения комплекса для определения
токсичности и состава исследуемой почвы или растительных образцов, исследование
протекторных свойств гуминовых веществ и оценки влияния микроудобрений в
повышенных концентрациях.
Список литературы
1. Алексеев
Ю. В. Тяжелые металлы в почвах и растениях. // Л.: Агропромиздат. 1987. 141с.
. Битюцкий
Н.П. Микроэлементы и растение. Учебное пособие. Спб 1999
. Бойкова
Э.Я. Простейшие биомониторы морской среды. //Рига,. Зинатне, 1989, 265с.
. Брагинский
Л.П. Методологические аспекты токсикологического биотестирования на Daphnia
magna Str. и других ветвистоусых ракообразных (критический обзор) // Гидробиол.
журн. - 2000. - Т. 36, N 5. - С. 50-70.
. Брагинский
Л.П. Методологические аспекты токсикологического биотестирования на Daphnia
magna Str. и других ветвистоусых ракообразных (критический обзор) // Гидробиол.
журн. - 2000. - Т. 36, N 5. - С. 50-70.
. В.Ф.
Евтюхин, Т.К.Никушина Влияние многолетнего применения минеральных удобрений на
некоторые агрохимические и экологические показатели серой лесной
тяжелосуглинистой почвы проблемы агрохимии и экологии , 2008, N 2, с. 13-18
. Ваксман
С.А. Гумус. М.: Огиз-сельхозгиз, 1937. 471 с.
. Воскресенская
О.Л.; Чернавина И.А.; Аксенова В.А. Влияние избытка цинка в среде произрастания
на поглощение металлов растениями овса. Физиология устойчивости растений
Нечерноземной зоны РСФСР, 1987
. Голубкова
Э.Г. Экология Paramecium caudatum в условиях острой и хронической интоксикации
//Автореф.канд.дисс. Петрозаводск,1980
. Горовая
А.И., Орлов Д.С., Щербенко О.В. Гуминовые вещества. Киев: Наук. думка, 1995.
304 с.
. Горовая,
А.И. Роль физиологически активных веществ гумусовой природы в повышении
устойчивости растений к действию пестицидов / Горовая А.И. // НДВШ
Биологические науки. - 1988. - № 7. - С. 5-16.
. Горовая,
А.И. Роль физиологически активных гумусовых препаратов в регуляции процессов
клеточного цикла / А.И. Горовая, А.Ф. Кулик // Регуляция клеточного цикла. -
Киев, 1985. - С. 101-109
. Гроздов
А.О. Определение общей токсичности на инфузориях парамециях //Комбикорма,
№4,2001
. Гуминский
С.А. Процессы дыхания в условиях острого дефицита кислорода.М.1968
. Жмур
Н.С. Государственный и производственный контроль токсичности методами
биотестирования в России. - М.: Международный Дом сотрудничества, 1997. 114 с.
. Игнатьев
А.Д., Шаблий В.Я. Использование инфузорий Tetrahymena как тест-объект при
биологических исследованиях М., 1978
. Ильин
В. Б. Тяжелые металлы в системе почва-растение. Новосибирск: Наука.Сиб.отд..1991.151
с.
. Ильин
В.Б. Тяжелые металлы в системе почва-растение. Новосибирск: Наука, СО, 1991.
151 с.
. Мелехова
О. П. , Е. И. Егорова, Т. И. Евсеева и др.; под ред. О.П.Мелеховой и
Е.И.Егоровой Биологический контроль окружающей среды: биоиндикация и
биотестирование «Академия», 2007. - 288 с.
. Методическое
руководство по биотестированию воды РД 118-02-90 Утвержден Госкомприроды СССР
от 06.08.1990. #37.
. Наумова,
Н. Б. Исследование влияния гуминовых веществ торфа на показатели урожая/ - С.84-87.
1956
. Пищулина
Н. Л. Влияние ТМ на растения // Изучение, охрана и рациональное использование
природных ресурсов. Т.2 -Уфа, 1989, с.27
. Подунова
Л.Г. Методическое пособие. Альтернативные методы исследований (экспресс-методы)
токсиколого-гигиенической оценки материалов, изделий и объектов окружающей
среды. \\ Москва, Госкомсанэпидемнадзор, 1999г
. Ремпе
Е.Х., Минеев В.Г., Воронина Л.П. Биотест для определения экологических
последствий применения ХСЗР// ж. Доклады ВАСХНИЛ, №7, 1991, 5-10;
. Руководство
по определению методом биотестирования токсичности вод, донных отложений,
загрязняющих веществ и буровых растворов. - М.: РЭФИЯ, НИА-Природа, 2002.
26. Сайт
Кубанского государственного аграрного университета
http://af.kubagro.ru/kafedry/cytology/sait-lemna/pr.htm
<http://af.kubagro.ru/kafedry/cytology/sait-lemna/pr.htm>
. Сайт
лаборатории экологической токсикологии и водной экологии Университет Гент,
Бельгия http://www.microbiotests.be <http://www.microbiotests.be/>
. Сайт
посвященный проблемам биотестирования
http://bioassay.narod.ru/biotest/biot.html
. Семенченко
В.П. Принципы и системы биоиндикации текучих вод. - Минск: "Орех",
2004. - 125 с.
. Терехова
В.А., Рахлеева А.А., Кудряшов С.В., Долбнева Е.А., Яковлев А.С. Биологические
методы определения экологической токсичности почв и класса опасности отходов //
Междунар. школа «Совр. методы эколого-геохимической оценки состояния и
изменений окружающей среды». Новороссийск, 2003.
. Тома
С.И., Великсар С.Г. Микроэлементы как фактор оптимизации минерального питания и
управления адаптивностью растений//Современное развитие научных идей
Д.Н.Прянишникова.- М.: Наука, 1991, с.242-253.
. Тюрин
И.В.Органическое вещество почв и его роль в почвообразовании и плодородии.
Учение о почвенном гумусе, М.- Л., 1937
. Флеров
Б.А., Жмур Б.С. Биотестирование с использованием цериодафний // Методическое
руководство по биотестированию воды. РД-118-02-90. - М.: 1991. - С.19-28.
. Холодов
В.А. Коваленко А.Н.Куликова H.A.Лебедева Г.Ф.Перминова И.В. Детоксицирующая
способность нативных и химически модифицированных препаратов угля по отношению
к меди Москва 2004
. Цаценко
Л. В., Малюга Н. Г. Рясковые - биоиндикаторы агроценоза: Монография / КубГАУ,
Краснодар, 2000. - 76с.
. Черемных
Е.Г. Воронина, Л.П. . .Автоматизация биотестирования на основе обработки
изображения. Вестник мгу №3 2007.
. Шуйский.И.Ф,
Максимова Е.И, Биоиндикация качества водной среды, состояния пресноводных
экосистем и их антропогенных изменений. Сб.научн. докл 7 межд. Конф «экология и
развитие с.з росии»Спб 2002.
38. Chaminade R. Action de
l'acide humique sur le development et la nutrition minerale des vegetaux.
Trans.6th Intern.Cong.Soil Sci.,4,443-448.(1956)
. Chaminade R. and Blanchet
R. . Mecanisme de l'action stimulante de l'humus sur la nutrition minerale des
vegetaux. C.R.Acad.Sci.(Paris),
237,1768-1770.(1953)
40. Davidchik V.N., Kulikova
N.A., Koroleva O.V. 2004: Laccase stabilization in the presence of coal humic
acids. 2004: Proceedings of the XII Int. Meeting of IHSS Humic Substances and
Soil 2004, 545-546and Water Environment. Sao-Pedro, Brazil, July 25-30,
41. Deeborah Chapman/Water
quality assessments-A guide to use biota Sediments and water in environmental
monitoring.GB.1999.
. Elsokkary I.H.; Lag.L.
Distribution of different fractions of Cd, Pb,Zn and Cu in industry polluted
and non-polluted soils of Odda region, Norway// Acta Agric.Scand/1978,
28,262-268
43. Gone G.U. Humus Pile,
Sincronía: An E-Journal of Culture Studies, 1996
. K. C. Jones and P. J.
Peterson Gold uptake by perennial ryegrass: The influence of humates on the
cycling of gold in soils Biogeochemistry Springer Netherlands Volume 7, Number
1
. Kholodov V.A., Kovalenko
A.N., Kulikova N.A., Lebedeva G.F., Perminova I.V.189-191.
. Liang, J.; Karamanos, R. E.
DTPA-extractable Fe, Mn, Cu andZn. In Soil Sampling and Methods of Analysis,
1st ed.; Carter,M. R., Ed.; Canadian Society of Soil Science, Lewis Publishers:
Boca Raton, FL, 1993; pp 87-90
. Mitchell J. W., Gregory L.
E. Nature New Biol., 1972, v. 239, № 95
. Mount D.I., Norberg T/J/ A
seven-day life-cycle cladoceran toxity test // Environ. Toxicol. Chem. - 1984.
- V. 3. - P. 425-434.
. Slesak, Е.
Y J. growth and nutrient content of cucumber (Cucumis sativus) plants.1988.
Acta Univ. Acta Univ. Wratislaviensis 888, 13-19. Wratislaviensis 888, 13-19
. Stewart J .De Simone.
Effects of land-use changes on humus forms on alpine pastureland (Central Alps,
Tyrol) Geoderma, Volume 124, Issues 3-4, February 1996, Pages 215-222
. Takkar, P. N.; Walker, C.
D. The distribution and correction ofzinc deficiency. In Zinc in Soils and
Plants; Robson, A. D., Ed.;Developments in Plant and Soil Sciences 55; Kluwer
Academic Publishers: Dordrecht, The Netherlands, 1993; pp 151-160.
. Vaughan, D. and Linehan,
D.J., . The growth of wheat plants in humic acid solutions. Plant Soil.
44: 445-449. 1976