Топологический анализ структурных комплексов сульфатов уранила
Введение
Возрастающий интерес к соединениям
урана и трансурановых элементов в первую очередь связан с актуальной на
сегодняшний день проблемой безопасного захоронения ядерных отходов. В процессах
окисления отработавшего ядерного топлива (ОЯТ) образуются разнообразные
минералы шестивалентного урана. Таким образом, происходит иммобилизация
радионуклидов (ОЯТ), которые входят непосредственно в структуры этих
соединений.
Минеральные виды, содержащие уран в
различной форме, очень разнообразны и многочисленны. Кроме того, изучение
кристаллохимии минералов и соединений урана, а также особенностей их
образования связано с перспективами разработки принципов самоорганизации в
актинид-содержащих системах и целенаправленного создания новых материалов с
заданными свойствами на основе оксидов урана. Понимание принципов внутреннего
строения соединений способствует дальнейшему объяснению различных свойств
уранил-содержащих соединений.
уранил кристаллохимический сульфат
топологический
1. Исторические сведения
.1
История открытия
В Богемии
(Чехословакия) с давних пор производилась добыча полиметаллических руд. Среди
руд и минералов горняки часто обнаруживали черный тяжелый минерал, так
называемую смоляную обманку (Pechblende). В XVIII в. полагали, что этот минерал
содержит цинк и железо, однако точных данных о его составе не было. Первым
исследованием смоляной обманки занялся в 1789 г. немецкий натурфилософ и
химик-аналитик Клапрот. В результате многочисленных химических воздействий на
минерал он сумел получить оксид урана, который принял за сам металл. В честь
самой далёкой из известных тогда планет (открытой Уильямом Гершелем восемью
годами раньше) Клапрот, считая новое вещество элементом, назвал его ураном.
Пятьдесят лет уран
Клапрота числился металлом. Только в 1841 г. французский химик Эжен Мелькиор
Пелиго (англ.) (1811-1890) доказал, что, несмотря на характерный металлический
блеск, уран Клапрота не элемент, а оксид UO2. В 1840 г. Пелиго путем
восстановления UCl4 металлическим калием
удалось получить настоящий уран - тяжёлый металл серо-стального цвета, и
определить его атомный вес.
Долгое время химики
располагали солями урана в очень небольших количествах; их использовали для
получения красок и в фотографии. Исследования урана хотя и велись, но мало что
прибавляли к тому, что установил Клапрот. Атомный вес урана принимали равным
120 до тех пор, пока в 1874 г. Д.И. Менделеев не предложил удвоить эту
величину. Опираясь на разработанную им периодическую систему, он поместил уран
в самой дальней клетке своей таблицы. Через 12 лет предвидение Менделеева было
подтверждено опытами немецкого химика Циммермана.
В 1896 г., исследуя
уран, французский химик Антуан Анри Беккерель случайно открыл лучи Беккереля,
которые позже Мария Кюри переименовала в радиоактивность. Беккерель обнаружил,
что двойная соль калий-уранилсульфат оказывает действие на фотографическую
пластинку, завернутую в черную бумагу, т.е. испускает какие-то лучи. В 1899 г.
Резерфорд обнаружил, что излучение урановых препаратов неоднородно, что есть
два вида излучения - альфа- и бета-лучи, которые несут различный электрический
заряд и далеко не одинаковы их пробег в веществе и ионизирующая способность.
Чуть позже, в мае
1900 г., Поль Вийар открыл третий вид излучения - гамма-лучи.
В 1938 немецкие физики Отто Ган и
Фриц Штрассман открыли явление, происходящее с ядром урана при облучении его
нейтронами. Захватывая свободный нейтрон, ядро изотопа урана 235U
делится, при этом выделяется (в расчёте на одно ядро урана) достаточно большая
энергия, в основном, за счёт кинетической энергии осколков и излучения [1],
[2].
Данное открытие
явилось истоком как мирного, так и военного использования внутриатомной
энергии.
Минералогия урана имеет почти
трехвековую историю [3]. Первые описания минералов урана - настурана и
торбернита относятся к XVIII веку. Около 20 минералов было обнаружено в XIX
веке. Однако наибольшая часть минеральных видов и разновидностей была открыта в
XX и начале XXI века, ввиду использования методов рентгеновских исследований, в
частности рентгеноструктурного анализа.
.2 Свойства урана
Уран (лат. Uranium)
(U) - химический элемент с атомным номером 92 и атомной массой 238,029 а.е.м.
Является радиоактивным химическим элементом III группы периодической таблицы,
относится к семейству актинидов. Природный уран состоит из смеси трех изотопов:
238U - 99,2739% с периодом полураспада TЅ = 4,51·109
лет, 235U - 0,7024% (TЅ = 7,13·108 лет) и 234U
- 0,0057% (TЅ = 2,48·105 лет). Последний изотоп является
не первичным, а радиогенным, он входит в состав радиоактивного ряда 238U.
Изотопы урана 238U и 235U являются родоначальниками двух
радиоактивных рядов. Конечными элементами этих рядов являются изотопы свинца 206Pb
и 207Pb. В настоящее время известно 23 искусственных радиоактивных
изотопа урана с массовыми числами от 217 до 242. «Долгожителем» среди них
является 233U с периодом полураспада 1,62∙105 лет.
Он получается в результате нейтронного облучения тория и способен к делению под
воздействием тепловых нейтронов.
Металлический уран - очень тяжелый,
он тяжелее железа в два с половиной раза, а свинца - в полтора. Это один из
самых тяжелых элементов, которые содержатся в недрах Земли. Своим
серебристо-белым цветом и блеском уран напоминает сталь. Чистый металл
пластичен, мягок, имеет высокую плотность, но в то же время легко поддается обработке.
Уран электроположителен, обладает незначительными парамагнитными свойствами,
имеет малую электропроводность, но высокую реакционную способность.
Этот элемент имеет три аллотропные
модификации: α, β и γ. α-уран
имеет ромбическую кристаллическую решетку со следующими параметрами: a = 2,8538
Е, b = 5,8662 Е, с = 4,9557 Е. Эта форма стабильна в температурном диапазоне от
комнатных температур до 667,7°C. β-уран кристаллизуется в тетрагональной сингонии. Параметры
элементарной ячейки β-модификации: a = 10,759 Е, b = 5,656 Е. γ-уран, с
объемно-центрированной кубической структурой, стабилен от 774,8° C до точки
плавления (1132°C). Все три фазы можно получить в процессе восстановления
урана.
Облучение урана
потоком нейтронов, взаимодействие с водой, охлаждающей топливные элементы из
металлического урана, другие факторы работы в мощных реакторах на тепловых
нейтронах - все это приводит к изменениям физико-механических свойства урана:
металл становится хрупким, развивается ползучесть, происходит деформация
изделий из металлического урана. По этой причине в ядерных реакторах
используются урановые сплавы, например с молибденом, такой сплав устойчив к
действию воды, упрочняет металл, сохраняя высокотемпературную кубическую
решетку [1], [2].
.3
Применение урана
Современная атомная энергетика
основана на соединениях урана и их особых свойствах. Хотя еще не так давно - до
пуска первого ядерного реактора - урановые руды добывались в основном для
извлечения из них радия. Небольшие количества урановых соединений использовали
в некоторых красителях и катализаторах, например, малая добавка урана придаёт
жёлто-зелёную флуоресценцию стеклу. Долгое время уран считался элементом,
который не имеет почти никакого промышленного значения, но ситуация кардинально
изменилась после открытия способности изотопов урана к делению.
В наше время основная область
применения металлического урана, так же как и его соединений - топливо для
ядерных реакторов. Так в стационарных реакторах АЭС применяется малообогащенная
(природная) смесь изотопов урана, а в силовых ядерных установках и в реакторах
на быстрых нейтронах используется уран высокой степени обогащения. 1 тонна
обогащенного урана по тепловыделяющей способности равна 1 миллиону 350 тысячам
тонн нефти или природного газа.
Наибольшее применение имеет изотоп
урана 235U, так как в нем возможна самоподдерживающаяся цепная
ядерная реакция, что не характерно для других изотопов урана. Благодаря именно
этому свойству 235U используется как топливо в ядерных реакторах, а
также в ядерном оружии. Однако выделение изотопа 235U из природного
урана - сложная и дорогостоящая технологическая проблема.
Самый распространенный в природе
изотоп урана 238U может делиться, если его бомбардируют
высокоэнергетическими нейтронами. Такое свойство данного изотопа используют для
увеличения мощности термоядерного оружия - используются нейтроны, порождённые
термоядерной реакцией. Кроме того, в результате захвата нейтрона с последующим β-распадом из изотопа 238U
получают изотоп плутония 239Pu, который в свою очередь также может
использоваться как ядерное топливо в ядерных реакторах и в атомном вооружении.
В последнее время большое применение
находит изотоп урана 233U, искусственно получаемый в реакторах из
тория (торий-232 захватывает нейтрон и превращается в торий-233, который
распадается в протактиний-233 и затем в уран-233).
Другие искусственные изотопы урана
не играют заметной роли.
После того, как из природного урана
извлекают «нужные» изотопы 234U и 235U, оставшееся сырье
(238U) носит название «обеднённый уран», так как он обеднён 235-м
изотопом. По некоторым данным, в США хранится около 560 000 тонн обеднённого
гексафторида урана (UF6). Обеднённый уран в два раза менее
радиоактивен, чем природный уран, в основном за счёт удаления из него 234U.
Из-за того, что основное использование урана - производство энергии, обеднённый
уран - малополезный продукт с низкой экономической ценностью. Вместе с тем,
обедненный уран активно используется в научных отраслях для моделирования
систем, содержащих радиоактивные изотопы.
Основное применение урана в геологии
- определение возраста минералов и горных пород с целью выяснения
последовательности протекания геологических процессов. Этим занимается
геохронология. В связи с тем, что горные породы содержат различные концентрации
урана, они обладают различной радиоактивностью. Это свойство используется при
выделении горных пород геофизическими методами. Наиболее широко этот метод
применяется в нефтяной геологии при геофизических исследованиях скважин [1],
[2].
2. Кристаллохимия минералов
и соединений урана
На сегодняшний день известно порядка
двухсот минералов урана. Такое многообразие связано с кристаллохимическими
характеристиками урана и - в более широком смысле - кристаллохимическими
характеристиками актинидов, как особой группы элементов. Характерной
особенность элементов - актиноидов является то, что они способны проявлять
разную степень окисления. Так, для урана характерны степени окисления
+2,+3,+4,+5,+6. Однако, в отличие от стабильных четырехвалентных и
шестивалентных форм, степени окисления +3 и +5 практически неустойчивы. Причем
U3+ в природе не существует и может быть получен только в
лабораторных условиях. Трёхвалентный уран очень неустойчив и подвергается
окислению до U(IV) даже в отсутствие кислорода. Соединения пятивалентного урана
по большей части не устойчивы и довольно легко разлагаются на наиболее
устойчивые соединения четырех и шестивалентного урана.
2.1 Кристаллохимия
минералов и соединений четырехвалентного урана
Кристаллохимия четырехвалентного
урана в кислородных соединениях во многом подобна кристаллохимии редкоземельных
элементов.
Минералы четырехвалентного урана
обычно более сложные, чем можно предположить из их формулы, из-за тенденции к
окислению атомов четырехвалентного урана до U6+ [4]. Минералы, которые
изначально кристаллизуются с четырехвалентным ураном, обычно содержат U4+ и U6+, а также U5+
и REE3+.
Среди минералов четырехвалентного
урана выделяются пять классов [3]: 1) простые оксиды, 2) сложные оксиды урана и
молибдена, 3) сложные оксиды урана и титана, 4) силикаты, 5) фосфаты. Простые
оксиды урана представляют один минеральный вид - уранинит. Уранинит,
несомненно, является основным минералом четырехвалентного урана. Уранинит UO2 относится к структурному типу
флюорита CaF2 (рис. 1).
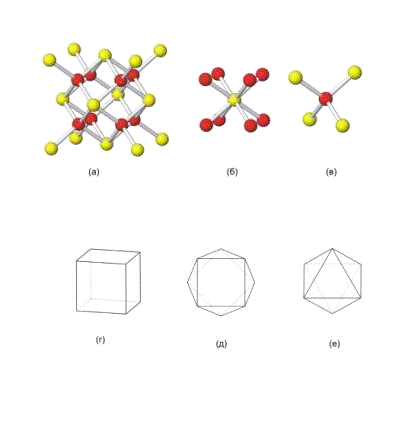
Рис. 1. Структурный тип флюорита
(а), координация катиона (б) и аниона (в). Характерные координационные полиэдры
четырехвалентного урана: куб (г), квадратная антипризма (д), октаэдр (е)
В этом структурном типе катионы имеют
кубическую, а анионы - тетраэдрическую координацию. Для атомов
четырехвалентного урана также характерны координационные полиэдры: октаэдр и
квадратная антипризма (томсоновский куб - это куб с одной из параллельных
граней, повернутой на 45°).
В приповерхностных условиях уранинит
окисляется, что приводит к образованию вторичных фаз, состав которых
определяется составом грунтовых и поверхностных вод и минеральной ассоциацией.
Процессы окисления уранинита в природе во многом подобны процессам окисления ОЯТ,
в связи с чем их изучение представляет несомненный интерес [5].
2.2 Кристаллохимия
минералов и соединений шестивалентного урана
Характерной особенностью ионов U6+ является образование ими линейных комплексов [O=U=O]2+, которые получили
название уранил-ионов. В настоящее время общепризнанной является точка зрения,
согласно которой атомы урана в ионах уранила связаны с атомами кислорода
двойными ковалентными связями [6].
Межатомные расстояния U6+
- OUr в уранил-катионе (далее обозначаемый как Ur) равны ~ 0.18 нм.
В кристаллических структурах минералов и соединений уранила линейный
уранил-катион координирован четырьмя, пятью или шестью дополнительными
анионами, которые располагаются приблизительно в одной плоскости,
перпендикулярной Ur, что ведет к образованию тетрагональных дипирамид Urf4, пентагональных
дипирамид Urf5 или гексагональных дипирамид Urf6 (f: O2-, OH-, H2O).
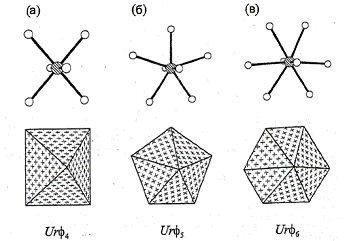
Рис. 2. Координационные полиэдры
атомов урана в соединениях уранила: тетрагональная дипирамида (а), пентагональная
дипирамида (б), гексагональная дипирамида (в)
П.К. Бернс и др. [7] рассчитали
средние геометрические параметры координационных полиэдров уранила на основе
данных по более чем 100 хорошо уточненным структурам (R1≤0.07). Валентность связи U6+ - OUr
составляет ~1.7 валентных единиц
(в.е.), тогда как валентность связи U6+ - Oэкв (Oэкв
- атом кислорода в экваториальной позиции) равна ~0.5 в.е. Таким образом, атомы OUr почти полностью
валентно насыщены и сумма валентных усилий вполне соответствует требованиям,
тогда как для валентного насыщения экваториальных анионов необходимо
образование дополнительных химических связей. Как следствие, уранильные
полиэдры обычно полимеризуются друг с другом и с другими прочными полиэдрами
только через экваториальные вершины и ребра, что приводит к преобладанию среди
минералов и синтетических соединений уранила слоистых структур [5].
2.3
Природные соединения урана
Уран широко
распространён в природе. Содержание урана в земной коре (кларк) составляет
0,0003% (вес.), это означает, что его больше в недрах земли, чем серебра, ртути
и висмута.
Основная масса
урана находится в кислых гранитных породах с высоким содержанием кремния. Так,
в тонне гранита - около 25 грамм элемента №92. Значительная масса урана
сконцентрирована в осадочных породах, особенно богатых органикой. Всего в
относительно тонком, двадцатикилометровом верхнем слое Земли заключено 1,3·1014
тонн урана.
Уран активно
мигрирует в холодных и горячих, нейтральных и щелочных водах в виде простых и
комплексных ионов, особенно в форме карбонатных комплексов. Соединения урана,
как правило, хорошо растворимы в водах с окислительной средой и плохо
растворимы в водах с восстановительной средой (сероводородах).
Наибольшее промышленное значение
имеют окислы урана - уранинит и его разновидности (настуран и урановая чернь),
а также силикаты (коффинит), титанаты (давидит и браннерит), водные фосфаты и
арсенаты уранила (урановые слюдки).
Уранинит - UO2
присутствует преимущественно в древних - докембрийских породах в виде четких
кристаллических форм. Уранинит образует изоморфные ряды с торианитом ThO2
и иттро-церианитом (Y, Ce) O2. Кроме того, все ураниниты содержат
продукты радиогенного распада урана и тория: K, Po, He, Ac, Pb, а также Ca и
Zn. Собственно уранинит - высокотемпературный минерал, характерен для гранитных
и сиенитовых пегматитов в ассоциации со сложными ниобо-тантало-титанатами урана
(колумбит, пирохлор, самарскит и другие), цирконом, монацитом. Помимо этого,
уранинит встречается в гидротермальных, скарновых и осадочных породах.
Настуран (U3O8),
он же урановая смолка или смоляная обманка, образующий скрытокристаллические
агрегаты - вулканогенный и гидротермальный минерал, представлен в палеозойских
и более молодых высоко- и среднетемпературных образованиях. Постоянные спутники
настурана - сульфиды, арсениды, самородные висмут, мышьяк и серебро, карбонаты
и некоторые другие элементы.
Урановые черни
(рыхлые землистые агрегаты) представлены в основном в молодых (кайнозойских и
моложе) образованиях, характерны для гидротермальных сульфидно-урановых и
осадочных месторождений.
Основные месторождения урановых руд
расположены в США (Колорадо, Северная и Южная Дакота), Канаде (провинции
Онтарио и Саскачеван), ЮАР (Витватерсранд), Франции (Центральный массив),
Австралии (Северная территория) и многих других странах. Россия по запасам
урана, с учетом резервных месторождений, занимает третье место в мире (после
Австралии и Казахстана).
В месторождениях России содержится
почти 550 тыс. тонн запасов урана, или немногим менее 10% его мировых запасов;
около 63% их сосредоточено в Республике Саха (Якутия). Главными месторождениями
урана являются: Стрельцовское, Октябрьское, Мало-Тулукуевское, Аргунское
молибден-урановые в вулканитах (Читинская область) - здесь добывается около 93%
российского урана, Далматовское урановое в песчаниках (Курганская область),
Хиагдинское урановое в песчаниках (Республика Бурятия), Южное золото-урановое в
метасоматитах и Северное урановое в метасоматитах (Республика Якутия). Кроме
того, выявлено и оценено множество более мелких урановых месторождений и
рудопроявлений.
Содержание урана в земной коре
постепенно уменьшается за счет радиоактивного распада. В связи с этим процессом
связано накопление в земной коре атомов свинца и гелия. Радиоактивный распад
урана играет важную роль в энергетике земной коры, являясь существенным
источником глубинного тепла [1], [2].
Урановые минералы делят на основе
валентного состояния урана. Так, имеется «восстановленное» семейство с
преобладающим валентным состоянием U4+ и «окисленное»
семейство, в котором вся или большая часть урана присутствует в виде U6+. Большинство минералов с U6+ содержит уранил-ион UO2+. В силу сложности
окисленного семейства минералы делятся химически по анионной ассоциирующейся
группе или группам. Выделяют такие классы соединений, как молибдаты,
вольфраматы, селенаты, хроматы, силикаты уранила и др.
Оксиды и гидроксиды. Структуры оксидов и гидроксидов урана являются прототипными для
целого ряда минералов и соединений. Для минералов данной группы типичным
является наличие в структуре слоев, образованных уранильными полиэдрами. Слои,
в свою очередь, связаны между собой водородными связями с участием молекул
воды, находящейся между слоями.
Ванадаты.
Подобно урану, в природе ванадий обнаруживает ряд валентных
состояний, и его детальная минералогия очень сложна. В низшем валентном
состоянии этот элемент образует отличные от других ванадиевые минералы, но в
высшем валентном состоянии (V5+) он комбинируется с U6+, образуя ряд минералов, таких, например, как кюриенит Pb(UO2)2V2O8∙5H2O, франсвиллит Ba(UO2)2V2O8∙5H2O, вануралит Al(UO2)2V2O8(OH)∙11H2O и др. Ванадаты уранила в
большинстве своем найдены на месторождениях урана в песчаниках. В районе плато
Колорадо (США) они действительно очень обильны. Из всех урановых минералов
ванадаты наименее растворимы, поэтому, если ванадий присутствует, он может быть
эффективным осадителем урана.
Наиболее
распространенным топологическим типом структур ванадатов уранила являются
слоистые структуры, основанные на анионной топологии карнотита. К этой группе
относятся более 10 минералов уранила с общей формулой M[(UO2)2(V2O8)]∙n(H2O) (M = K, Ca, Pb, Ba,
Cu, Al), а также большое число искусственных соединений. В структурах минералов
группы карнотита катионы V5+ находятся в тетрагонально-пирамидальной
координации. Две пирамиды V5+O5 объединяются между собой
общим ребром, образуя димеры V2O8. Пентагональные
бипирамиды UO7, в свою очередь, также образуют димеры, которые
связываясь с ванадатными комплексами, формируют двумерные слои, объединенные
друг с другом дополнительными катионами. Во всех карнотитовых минералах слои
параллельны плоскости (001). Структуры минералов различаются по способу
совмещения слоев и порядку расположения межслоевых ионов.
Селениты и теллуриты. Для этих минералов наиболее характерно слоистое (мартозит -
селенит уранила) и цепочечное строение (моктесумит Pb(UO2) (TeO3)2,
дерриксит Cu4(UO2) (SeO3)2(OH)6,
и демесмэкерит Pb2Cu5(SeO3)6(UO2)2(OH)6·2H2O). Для катионов Te4+ и Se4+,
образующих структуры селенитов и теллуритов, свойственно наличие неподеленной
пары электронов.
Карбонаты и нитраты. Трикарбонатный кластер (UO2) (CO3)34
- является одной из самых распространенных форм существования уранильного
иона UO22+ в условиях окружающей среды. В связи с этим
изучение трикарбонатов уранила представляется весьма интересным с точки зрения
их способности к аккумуляции радионуклидов, в частности, 137Cs.
Известно, по крайней мере, шесть минералов, содержащих в своей структуре
комплексы (UO2) (CO3)34-: бейлиит
Mg2UO2(CO3)3(H2O)18,
андерсонит Na2Ca(UO2(CO3)3) (H2O)5.333,
шварцит CaMg(UO2(CO3)3) (H2O)12,
шрекингерит NaCa3(UO2(CO3)3) (SO4) F(H2O)10, либигит Ca2UO2(CO3)3(H2O)11 и гримзелит K3Na(UO2) (CO3)3(H2O).
Комплексы (UO2) (NO3)3
-, подобные трикарбонатным, были обнаружены и в структурах нитратов M(UO2(NO3)3)
(M = K, Rb, Cs), которые представляют интерес в связи с их интересными
оптическими свойствами, вызванными особенностями их кристаллической структуры.
Так, в ромбоэдрическом уранилатонитрате рубидия Rb(UO2) (NO3)3
линейные уранильные комплексы UO22+ расположены
параллельно оси третьего порядка, что определяет резкий дихроизм кристаллов
этого соединения: в плоскополяризованном свете при ориентации плоскости
поляризации параллельно оси третьего порядка кристаллы бесцветны, тогда как при
поляризации в перпендикулярном направлении кристаллы имеют обычный для
соединений уранила желто-зеленый цвет.
Силикаты. Силикаты уранила являются одними из самых важных минералов
уранила. Наиболее распространенным структурным комплексом в силикатах уранила
является слой с уранофановой топологией. Из четырех вершин тетраэдров SiO4
три поделены с координационными полиэдрами уранила, тогда как одна является
неподеленной и может быть обращена либо вверх либо вниз по отношению к
плоскости слоя. Данные слои характерны для таких соединений силикатов уранила,
как α-уранофан Ca[(UO2)
(SiO3OH)]2(H2O)5, болтвудит (K0.56Na0.42)
[(UO2) (SiO3OH)] (H2O)1.5,
купросклодовскит Cu[(UO2) (SiO3OH)]2(H2O)6,
склодовскит Mg[(UO2) (SiO3OH)]2(H2O)6
и казолит Pb[(UO2) (SiO4)] (H2O) и др.
В структурах гидратированных
силикатов уранила прослеживается четкая взаимосвязь между характером
полимеризации координационных полиэдров и величиной соотношения U: Si. В
силикатах уранила с U: Si = 2:1 и 1:1 тетраэдры SiO4 не связаны
между собой (соддиит и минералы группы уранофана), минералы с U: Si = 1:3
содержат кремнекислородные цепочки (хейвиит и виксит), тогда как в соединениях
с U: Si = 1:4 имеют место слои из силикатных тетраэдров.
Фосфаты и арсенаты. Фосфаты и арсенаты являются одними из наиболее распространенных
минералов уранила. Достаточно высокий заряд групп AsO43-
и PO43 - обуславливает высокую прочность фосфатных и
арсенатных комплексов уранила, их малую растворимость и устойчивость в
природных системах.
Пероксиды. Особенностью пероксидов является присутствие в их структуре
пероксо-ионов O22- Так, например, в кристаллической
структуре студтита [(UO2) (O2) (H2O)2]
(H2O)2 уранил-ионы имеют гексагонально-бипирамидальную
координацию, состоящую, помимо уранильных атомов кислорода, из двух молекул
воды и двух пероксо-ионов с расстоянием O=O, равным 1.46 Ǻ. Гексагональные
бипирамиды связываются своими пероксо-ребрами в электронейтральные цепочки [(UO2)
(O2) (H2O)2], удерживаемые в структуре
посредством водородных связей с дополнительными молекулами воды.
Хроматы,
селенаты, молибдаты. Структуры данных
соединений содержат анионные комплексы (СrO4)2-, (SeO4)2-, (MoO4)2-.Структуры их разнообразны, но наиболее
распространенными является плотные слоистые.
Сульфаты
уранила. Минералы этой группы довольно
широко распространены, но обычно не встречаются в больших количествах. Такое
распределение, несомненно, вызвано средней до высокой растворимостью этих
соединений и относительно ограниченными условиями, при которых они могут
формироваться. Их образование требует отсутствия других оксоанионов, таких, как
VO4, PO4 и AsO4. Как правило, они
находятся в непосредственной близости от активно окисляющихся уранинита и
сульфидных минералов [5], [8].
На сегодняшний день
открыто 15 минералов сульфатов уранила: делиенсит Fe(UO2)2(SO4)2(OH)2∙3H2O
[9]. Назван в честь бельгийского минералога М. Делиенса. Впервые
минерал был обнаружен в зоне окисления уранового месторождения Мас д’Алари во
Франции. Встречается в ассоциации с уранинитом, гипсом, пиритом и др.
Таблитчатые кристаллы бледно-желтого или серовато-белого цвета кристаллизуются
в ромбической сингонии, пространственные группы Pnnm или Pnn2: a = 15.908 (5), b = 16.274 (3), c = 6.903 (1), Z = 4. Форма выделения - сферические
агрегаты. Блеск стеклянный. Спайность, совершенная по {100}. Твердость 2.
Плотность 3,268.
Иоганнит Cu(UO2)2(SO4)2(OH)2∙8H2O
[10]. Минерал назван в честь австрийского минералога А. Иоганна. Был
найден в зоне окисления рудных месторождений в Чехии. Является продуктом
изменения уранинита. Встречается в ассоциации с гипсом, циппеитом,
уранопилитом, брошантитом, халькантитом и др. Таблитчатые, игольчатые
кристаллы, иногда в виде корок изумрудно-зеленого цвета, кристаллизуются в
пространственной группе P1 триклинной сингонии: a = 8.903 (2), b = 9.499 (2), c = 6.812
(2), α = 109.87 (1)о,
β = 112.01 (1)о,
γ = 100.40 (1)о,
Z = 1. Минерал имеет стеклянный блеск, хорошую спайность по {100}. Твердость
2-2,5. Плотность 3,32.
Кокониноит Fe2Al2(UO2)2(SO4)
(PO4)4(OH)2∙20H2O. 18 (H2O) [12]. Был назван по месту находки - округ Коконино, США. Минерал
является вторичным. Микроскопические уплощенные кристаллы желтого цвета
кристаллизуются в моноклинной сингонии, в пространственных группах C2/c или Cс: = 12.50 (3), b = 12.97 (3), c = 23.00 (3), β = 106.6°; Z = 4; Твердость 1-2. Плотность 2,86.
Магнезиоциппеит Mg(H2O)3.5[(UO2)2(SO4)
O2], Mg(UO2)2(SO4) O2∙3,5H2O
[13]. Это магниевый аналог циппеита. Обнаружен в зоне гипергенезиса в
горах на руднике Лаки Страйк, США. Форма выделения - корки желтого,
желтовато-оранжевого цвета. Минерал кристаллизуется в моноклинной сингонии, в C2/m пространственной группе: a = 8.6514 (4), b = 14.1938 (7), c = 17.7211 (9), β = 104.131 (1)°, Z = 6. Имеет матовый блеск. Твердость 5-5,5. Плотность 4,756.
Марекоттит Mg3(UO2)4(SO4)2O3(OH)·29H2O [14]. Название произошло от
места находки минерала - Марекотте, Швейцария. Минерал гидротермальный,
встречается в ассоциации с уранинитом, гипсом и др. Кристаллизуется в форме
мелких алмазоподобных пластинок желто-оранжевого цвета, собранных в розетки.
Кристаллическая структура уточнена в пространственной группе P1 триклинной
сингонии: a = 10.815 (4), b = 11.249 (4), c = 13.851 (6), α = 66.224 (7)о, β = 72.412 (7)о, γ = 69.95 (2)о,
Z = 1. Характерен стеклянный блеск, спайность, совершенная по {011}. Твердость
примерно 3. Плотность 3,86.
Метауранопилит (UO2)6(SO4) (OH)10·5H2O [15]. Название происходит от греч. meta - после и уранопилит.
Минерал вторичный, впервые найден в Рудных горах, в районе Яхимова, Чешская
республика. Игольчатые, таблитчатые кристаллы серого, серовато-зеленого,
желтого цвета кристаллизуются в ромбической сингонии.
Натроциппеит Na5(H2O)12[(UO2)8(SO4)4O5(OH)3] [16] -
минерал группы циппеита, является натриевым аналогом циппеита. Впервые
обнаружен в зоне гипергенезиса на руднике Хэппи Ждек, США. Минерал
кристаллизуется в моноклинной сингонии, пространственная группа P21/n: a = 17.6425 (11), b = 14.6272 (9), c = 17.6922 (11), β = 104.461 (1)°,
Z = 8.
Образует корки желтого цвета. Блеск матовый. Твердость 4,517. Плотность 3,72.
Псевдоиоганнит Cu5(UO2)6(SO4)3(OH)16·14H2O [17]. Впервые обнаружен в горах северной Богемии, близ курортного
района Яхимов, Чешская республика. Микроскопические кристаллы болотно-зеленого
цвета кристаллизуются в триклинной сингонии, пространственная группа P1 или
P-1: a = 10.027 (1), b = 10.822 (1), c = 13.396 (1),
α = 87.97 (1)°,
β = 109.20 (1)°,
γ = 90.89 (1)°, Z = 1. Спайность,
совершенная по {101}. Плотность 4,31.
Рабежакит Ca(UO2)4(SO4)2(OH)6∙6H2O [18]. Минерал назван по месту
находки в зоне окисления уранового месторождения Рабежак во Франции.
Встречается в ассоциации с уранинитом, гипсом, иоганнитом. Уплощенные по {001},
таблитчатые и игольчатые кристаллы янтарно-желтого, буровато-желтого цвета
кристаллизуются в ромбической сингонии. Параметры ячейки кристаллической
решетки: a = 8.73 (1), b = 17.09 (2), c = 15.72 (2), Z = 4. Минерал выделяется в форме стяжений, розеток,
тонкокристаллических корок. Имеет стеклянный блеск. Твердость 3. Плотность
4,31.
Сянцзянит Fe(UO2)4(SO4)2(PO4)2(OH)∙22H2O
[19]. Назван по месту находки в зоне окисления уранового месторождения у
реки Сянцзян в Китае. На месторождении встречается в ассоциации с сабугалитом,
варисцитом, пиритом и др. Кристаллизуется в пространственных группах C2/c или Cc моноклинной сингонии в
виде желтых, ярко-желтых порошковатых, микрокристаллических агрегатов.
Параметры элементарной ячейки: a = 12.54, b = 12.98, c = 23.8, β= 108.6°, Z = 4. Блеск шелковистый. Твердость
1-2. Плотность 3,47.
Уранопилит [(UO2)6(SO4)
O2(OH)6(H2O)6] (H2O)8
[20]. Назван по составу (уран) и от греческого pilos - фетровый. Минерал
вторичный, впервые найден на измененном уранините в Богемии, Яхимов.
Встречается в ассоциации с уранинитом, циппеитом, уранофаном, гипсом и др.
Микрокристаллические иголки, радиально-лучистые агрегаты, бархатистые корки -
все это формы выделения уранопилита, кристаллизующегося в пространственной
группе Р1 моноклинной сингонии. Параметры элементарной ячейки следующие: a = 8.896 (2), b = 14.029 (3), c = 14.339 (3), α = 96.610 (4), β = 98.472 (4), γ = 9.802 (4)°, Z = 2. Цвет минерала желтый. Блеск
шелковистый. Спайность, совершенная по {010}. Твердость 2. Плотность 3,7-4,0.
Цинкциппеит Zn(H2O)3.5[(UO2)2(SO4)
O2] [21]. Название минерала
происходит от состава, содержащего Zn, и сходства с циппеитом. Цинкциппеит относится к группе циппеита.
Впервые обнаружен в зоне окисления уранинита на руднике Хилсайд, штат Аризона,
США. Мельчайшие кристаллы желтого цвета кристаллизуются в виде корок и
землистых агрегатов. Кристаллическая решетка имеет моноклинную симметрию,
пространственная группа C2/m: a = 8.6437 (10), b = 14.1664 (17), c = 17.701 (2), β = 104.041 (3)°. Блеск минерала матовый. Спайность, совершенная в одном
направлении. Плотность 5,032.
Шрёкингерит NaCa3(UO2) (CO3)3(SO4) F∙10H2O [22]. Назван минерал в честь
австрийского геолога И. Шрёкингера. Впервые обнаружен в зоне окисления на
месторождении Яхимов, Чешская республика. Встречается в ассоциации с
уранинитом, андерсонитом, гипсом, доломитом и др. Выделяется в форме розеток,
мелких чешуек, табличек. Минерал окрашен в зеленовато-желтый или темно-зеленый
цвет. Блеск его стеклянный, перламутровый на {001}. Минерал кристаллизуется в
пространственной группе P1 триклинной сингонии, с параметрами элементарной ячейки: a = 9.634 (1), b = 9.635 (1), c = 14.391 (2), α = 91.41 (1), β = 92.33 (1), γ = 120.26 (1)о, Z = 2.
Яхимовит (UO2)8(SO4) (OH)14∙13H2O
[23]. Назван по месту находки в зоне окисления на месторождении Яхимов,
Чехия. Встречается в ассоциации с гипсом, уранопилитом, уранинитом и др. Желтые
игольчатые кристаллы образуют корочки. Минерал кристаллизуется в моноклинной
сингонии, в пространственных группах P21/m или P21. a = 18.553 (8), b = 9.276 (2), c = 13.532 (7), β = 125.56 (2)о, Z = 2. Имеет стеклянный блеск, спайность, совершенную по {010}.
Плотность 4,79.
2.4 Синтетические соединения урана и серы
Кроме минералов урана и серы
известно большое число синтетических соединений, содержащих в своей структуре
уранил-ионы (UO2)2+ и
сульфатные комплексы (SO4)2- Первый
синтетический уранил-сульфат с неорганическими катионами ((CH3)4N)
(UO2(SO4) (NO3)) был получен в 1960 году
Россом и Эвансом [24]. Следующее открытие новой структуры последовало только
спустя 13 лет [25].
Фундаментальным этапом в изучении
данного класса соединений можно считать конец семидесятых - начало
восьмидесятых годов ХХ века. В этот период исследованием уранил-сульфатов
активно занимается группа ученых кафедры неорганической химии Самарского
Государственного Университета в составе Сережкина В., Сережкиной Л.,
Солдаткиной М., Ефремова В., Трунова В., Михайлова Ю., Табаченко Н., Табаченко
В., Ковба Л. Ими изучались водные и безводные уранил-сульфаты Rb, Mg, Zn, с присутствующими в
некоторых случаях анионами фтора и хлора, а также углерод-азотными молекулами.
Немаловажный вклад в развитие знаний
в данной сфере в те года также вносит научная группа химического факультета
Университета Технологий в Хельсинки. Здесь можно отметить публикации ученых,
занимающихся изучением уранил-сульфатных комплексов, Ниинисто Л., Тоивонена,
Валконена.
Следующий этап многочисленных
открытий начинается с 2000 года. Каждый год синтезируется и изучается 1-2 новых
соединения. В этот период помимо вышеупомянутой группы Самарского университета,
интенсивно работает группа профессора Д. О’Хара Оксфордского университета
(Доран М., Норквист А. и др.) и коллектив исследователей из Бельгии (Блатон Н.,
Питерс О., Вохтен Р.). Бельгийскими учеными был синтезирован ряд
оксид-гидроксидных сульфатов уранила с близкими параметрами элементарной ячейки
и единой пространственной группой, в которых позицию катиона частично занимает
калий, а другая часть позиции приходится на атомы Mn, либо Со, либо Ni, или же Zn.
Также нельзя не сказать о научных
достижениях Питера Бернса и его коллег. Интересным его открытием в 2010 году
становится получение новых уранил-сульфатных нанокластеров [26], представляющих
собой комплексы сферической формы, образованные различно ориентированными друг
относительно друга координационными полиэдрами урана и серы. Кроме этого,
Бернсом с коллегами Дили и Хайденом изучались оксид-гидроксид-уранилсульфаты,
где в качестве анионов представлены атомы Mg, Zn, Co, Na, K, либо анионная группа NH4+.
3. Классификация
минералов и синтетических соединений урана и серы
Структуры минералов и соединений
шестивалентного урана удобно разделить на плотные и разреженные. Критерием
такого подразделения можно выбрать способ объединения координационных
полиэдров. Плотными структуры считаются те, в которых превалирует объединение
координационных полиэдров по ребрам, а разреженными - те, в которых полиэдры
объединяются главным образом по вершинам.
Для плотных структур наиболее удобным
методом описания является теория анионных топологий, тогда как для разреженных
- теория графического описания, основанная на использовании графов.
.1 Теория графического
представления структурных комплексов
Графическое представление
структурного комплекса, состоящего из нескольких типов координационных
полиэдров, состоит в сопоставлении катионам вершин определенного цвета.
Существование ребра между двумя вершинами соответствует наличию по крайней мере
одного аниона, с которым соответствующие катионы образуют прочную химическую
связь. В другом выражении, вершины графа соответствуют координационным
полиэдрам, а присутствие ребра между двумя соседними вершинами говорит о том,
что эти полиэдры связаны между собой. Таким образом, каждой разреженной структурной
единице мы можем поставить в соответствие граф, представляющий собой связную
совокупность вершин и ребер. Такое описание позволяет анализировать топологию
структурных единиц, сводя геометрические замысловатые конструкции к простым
графам [5].
3.2 Анионные топологии
П.К. Бернс и др. предложили
иерархическую схему структурной систематики минералов и неорганических
соединений уранила, основанную на выделении в их структурах комплексов с
высокими валентностями связей внутри координационных полиэдров. Для удобства
систематики катионы с низкой валентностью (такие как K, Ca и H), а также связи,
которые они образуют, исключаются из рассмотрения. Эта процедура проводится с
целью упрощения сложности структур и возможности их сравнения между собой.
Вместе с тем, это не означает, что связи, образованные указанными катионами,
являются маловажными. Полиэдрические слои могут содержать только уранильные
полиэдры, или быть образованными объединением уранильных полиэдров с другими
полиэдрами высоковалентных катионов. П.К. Бернс и др. [27] провели
классификацию минералов и неорганических соединений уранила со слоистыми
структурами на основе топологии расположения анионов в плоскости слоя или
анионной топологии. Анионная топология строится следующим образом [27] (рис. 3):
(1) Все анионы, которые не образуют
связей, по крайней мере, с двумя катионами в слое и не являются экваториальными
анионами для дипирамиды или пирамиды в слое, исключаются из рассмотрения.
(2) Катионы и все связи, которые они
образуют, исключаются из рассмотрения; таким образом, остается несвязанный
набор анионов.
(3) Анионы, которые могут
рассматриваться как составляющие одного координационного полиэдра, соединяются
отрезками.
(4) Анионы исключаются из
рассмотрения; таким образом, образуется некоторая серия линий, которая и
называется анионной топологией.
Очевидно, анионная топология
является некоторым периодическим разбиением плоскости на выпуклые
многоугольники, к которому применим математический аппарат теории разбиений
плоскости. Понятие анионной топологии слоя обладает тем преимуществом, что
позволяет сравнивать различные слои и выявлять топологические отношения,
зачастую неочевидные при обычном полиэдрическом подходе. М.Л. Миллер и др. [28]
развили метод последовательного построения анионных топологий из цепочек
многоугольников и выяснили, что для построения большинства топологий в
минералах уранила необходимо иметь достаточно небольшое число таких цепочек.
Заключение
В результате проделанной нами работы
по кристаллохимическому анализу принципа организации строения сульфатов уранила
с неорганическими катионами, было установлено, что для представителей данного
класса соединений характерно большое разнообразие структур, отличающихся по
наличию тех или иных структурообразующих комплексов. Эти комплексы - островные,
цепочечные, и др., образуются объединением координационных полиэдров атомов
урана (пентагональная дипирамида), и серы (тетраэдр). Так из 53 известных на
сегодняшний день природных и синтетических соединений уранил-сульфатов,
имеющихся в банке данных ISCD, мы выделили 4 островных, 16 цепочечных, 30 слоистых, 2 каркасных
соединения и 1 структуру, состоящую из нанокластеров.
Отсюда видно, что слоистых
комплексов большинство и данный топологический тип наиболее характерен для
сульфатов уранила.
Список литературы
1. http://chem100.ru/elem.php? n=92#m0,
http://www.i-think.ru/wikimet/? type=metall§ion_id=310,
http://www.chemport.ru/pertable/elinfo.php? el=92.
2. МГУ им. М.В. Ломоносова, Химический факультет, Кафедра
радиохимии Уран // Учебное пособие. Вена, 2008, Москва, 2009.
. Сидоренко Г.А. // Кристаллохимия минералов урана. М. Атомиздат. 1978. с. 216.
. Burns P.C. A new complex sheet of uranyl polyhedra in the
structure of wцlsendorfite // Amer. Mineral. 1999a. V. 84. 1661-1673.
. Кривовичев С.В., Кривовичев В.Г. Минералогия и кристаллохимия
урана // Учеб. пособие. СПб.: Изд-во: «Соло», 2006.
. Evans H.T. Jr. Uranyl Ion Coordination // Science. 1963.
V. 141. P. 154-158.
7. Burns P.C., Ewing R.E., Hawthorne F.C. The crystal chemistry of
hexavalent Uranium: polyhedron geometries, bond-valence parameters, and
polymerization of polyhedra // Can. Mineral. 1997a. V. 35. P. 1551-1570.
8. Дин К. Смит, мл. Минералогия
урана.
9. (1) Vochten R., Blaton N., Peeters O. Deliensite, Fe(UO2) 2
(SO4) 2 (OH) 2⋅3H2O, a
new ferrous uranyl sulfate hydroxyl hydratefrom Mas d’Alary, Lodиve, Herault,
France. Can. Miner., 1997, 35,
1021-1025. (2) Amer. Miner., 1998, 83, 653.
. (1) Пэлач Ч., Берман Г., Фрондель К. Система минералогии. М.:
Изд. Иностранной Литературы, 1953, II/1, 714. (2) Frondel C. Systematic mineralogy of uranium and thorium. U.S.
Geol. Sur. Bull. 1958, 1064,
130-135. (3) Mereiter K. Die Kristallstruktur
des Johannits, Cu(UO2) 2 (ОН) 2 (SO4) 2⋅8Н2О. Tschermaks Miner. Petrog. Mitt., 1982, 30, 47-57. (4)
Amer. Miner., 1983, 68, 851. (5) Иejka J., Urbanec Z., Иejka J., Jr.,
and Mrazek Z. Contribution to the thermal analysis and crystal chemistry of
johannite Cu[(UO2)2(SO4)2(OH)2∙8H2O
Neues Jahrb. Miner., Abh., 1988, 159, 297-309.
. (1) Can. Min., 1976, 14, 429-436. (2) Burns P.C., Deely
K.M., Hayden L.A. The crystal chemistry of the zippeite group. Can. Miner., 2003,
41 (3), 687-706. (3) Burns P.C. U6+ minerals and inorganic compounds: insights
into an expanded structural hierarchy of crystal structures. Can. Miner., 2000,
43, 1839-1894.
. (1) Young E.J., Weeks A.D., Meyrowitz R. Coconinoite, a new
uranium mineral from Utah and Arizona. Amer. Miner., 1966, 51,
651-663. (2) ЗВМО, 1968, 97 (1), 73. (3) Белова Л.Н. и др. Новые данные о
кокониноите. Докл. РАН, 1993, 329
(6), 772-775.
. Burns P.C., Deely K.M., Hayden L.A. The crystal chemistry of the
zippeite group. Can. Miner., 2003 (3), 41, 687-706.
. (1) Brugger J., Burns P., Meisser N. Contribution to the
mineralogy of acid drainage of uranium minerals: marйcottite and the zippeite
group. Amer. Miner., 2003, 88, 676-685. (2) Burns P.C. U6+ minerals and
inorganic compounds: insights into an expanded structural hierarchy of crystal
structures. Can. Miner., 2005, 43,
1839-1894.
. (1) Пэлач Ч., Берман Г., Фрондель К. Система минералогии. М.:
Изд. Иностранной Литературы, 1953, II/1, 686. (2) Frondel C. Systematic Mineralogy of Uranium and Thorium, U.S.
Geological Survey Bull. 1958, 1064, 211-215. (3) Khosrawan-Sazedj F. The
crystal structure of meta-uranocircite II, Ba(UO2) 2 (PO4) 2·6H2O. Tschermaks
Miner. Petrogr. Mitt, 1982, 29, 197. (4) Burns P.C. U6+ minerals and inorganic
compounds: insights into an expanded structural hierarchy of crystal
structures. Can. Miner., 2005, 43: 1839-1894.
. Саn. Min., 1976, 14, р. 429-436. Burns P.C., Deely K.M., Hayden L.A. The crystal
chemistry of the zippeite group. Can.
Miner., 2003, 41 (3), 687-706.
. (1) Ondruљ P. Veselovsky F., Skala R. et al. New naturally occurring phases of secondary origin from Jбchymov
(Joachimstal). J. Czech Geol. Soc., 1997, 42, 7-107. (2) Ondruљ P.,
Veselovsky F., Gabaљovy A., Hlouљek J., Љrein V. Supplement to secondary and
rockforming minerals of the Jachymov ore district. J. Czech Geol. Soc., 2003,
48 (3-4), 149-155. (3) Brugger J., Wallwork K.S., Meisser N., Pring A., Ondruљ
P., Иejka J. Pseudojohannite from Jбchymov, Musonoп, and La Creusaz: A new
member of the zippeite-group. Amer. Miner., 2006, 91, 929-936.
. (1) Deliens M., Piret P. La rabejacite, Ca(UO2)4(SO4)2(OH)6∙6H2O
sulfate d’uranyle et de calcium des gоtes du Lodevois, Hйrault, France. Eur. J.
Miner., 1994, 5, 873-877. (2) Amer. Miner., 1994, 79, 572. (3)
Sejkora J., Иejka J., Ondruљ P. New data of rabejacite (Jбchymov, the Krusnй
Hory Mts., Czech Republic). Neues Jahrb. Miner. Monat., 2000, 7,
289-301.
19. (1) Hunan 230 Institute and X-ray Laboratory, Wuhan Geologic
College Xiangjiangite - a new uranium mineral discovered in China. Sci. Geol.
Sinica, 1978, 2, 183-188 (на кит. с англ. рефератом). (2) Amer. Miner., 1979, 64, 466. (3) Miner. Abs., 1978,
29, 483.
. (1) Frondel C. Studies of uranium minerals (N): Uranopilite.
Amer. Miner., 1952, 37,
950-959. (2) Frondel C. Systematic mineralogy of uranium and thorium. U.S.
Geol. Sur. Bull. 1958, 1064, 135-140. (3) Ondruљ P., et al. Secondary
minerals of the Jachymov (Joachimsthal) ore district. J. Czech Geol. Soc., 1997,
42 (4), 3-76. (4) Burns P.C. A new uranyl sulfate chain in the structure of
uranopilite. Can. Miner., 2001, 39, 1139-1146.
. (1) Burns P.C., Deely K.M., Hayden L.A. The crystal chemistry of
the zippeite group. Can. Miner., 2003 (3), 41, 687-706. (2) Burns, P.C.
U6+ minerals and inorganic compounds: insights into an expanded structural
hierarchy of crystal structures. Can. Miner. 2005, 43,
1839-1894. Can. Min., 1976, 14, 429-436.
. (1) Пэлач Ч., Берман Г., Фрондель К. Система минералогии. М.:
Изд. Иностранной Литературы, 1953, II/1, 283. (2) Frondel C. Systematic mineralogy of uranium and thorium. U.S.
Geol. Sur. Bull. 1958, 1064, 121-126. (3) Jaffe H.W., Sherwood A.M.,
Peterson M.J. New data on schroeckingerite Amer. Miner., 1948, 33,
152-157. (4) Mereiter K. Crystal structure and crystallographic properties of a
schroeckingerite from Joachimsthal. Tschermaks Miner. Petrog. Mitt., 1986,
35, 1-18.
. (1) Иejka J., Sejkora J., Mrбzek Z., Urbanec Z., Jarchovskэ T.
Jachymovite, (UO2) 8 (SO4) (OH) 14⋅13H2O, a new uranyl mineral from Jachymov, the Kruљnй hory Mts.,
Czech Republic, and its comparison with uranopilite. Neues Jahrb. Miner., Abh.,
1996, 170, 155-170. (2) Amer. Miner., 1997, 82, 207-208. 2.
. Ross, M., Evans, H.T.jr. Journal of Inorganic and Nuclear
Chemistry 1960, 15, 338-351.