Початкові етапи регенерації печінки
РОЗДІЛ І. ОГЛЯД ЛІТЕРАТУРИ
.1 Структурно-функціональна
характеристика білків позаклітинного матриксу печінки
Позаклітинний матрикс (ПКМ) займає незначний відсоток від
загального об'єму печінки, проте відіграє надзвичайно важливу роль у
функціонуванні даного органу в нормі та патологіях [2].
Компонентами позаклітинного матриксу є структурні білки
колаген та еластин, глікозаміноглікани, протеоглікани, а також не колагенові
структурні білки - фібронектин, ламінін.
Колаген (грец. kolla - клей + genos - рід) - один із основних
компонентів сполучної тканини і зумовлює її міцність і гнучкість. Основними
продуцентами колагену в печінці виступають стелатні клітини, які синтезують цей
білковий компонент позаклітинного матриксу у значних кількостях при переході в
активований стан та втраті ліпідних крапель [6].
Еластин - це білок, який присутній у волокнах сполучної
тканини і забезпечує її еластичність. За функціональними властивостями еластин
подібний з колагеном. Взаємодія волокон колагену та еластину створює каркас,
який підтримує тканину, роблячи її гнучкою, міцною та еластичною.
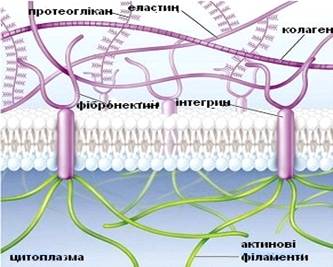
Рис. 1.1. Структура позаклітинного матриксу
Порушення структури еластину можуть проявлятися кардинальними
змінами (аневризми, розриви аорти та дефекти клапанів серця), постійною
пневмонією. Причинами порушення структури еластину є зниження активності
лізиноксидази (КФ 1.4.3.14.) , пов’язане з дефіцитом міді та піридоксину;
дефіцит лізиноксидази (КФ 1.4.3.14.) при спадкових хворобах; синдром Менкеса -
порушення всмоктування міді.
Глікозаміноглікани - вуглеводна частина протеогліканів,
полісахариди, в склад яких входять аміносахарогексозаміни. Глікозаміноглікани в
складі протеогліканів входять в склад міжклітинної рідини сполучної тканини.
Разом з волокнами колагену і еластину, протеоглікани утворюють з’єднуючий
матрикс. Один з представників глікозаміногліканів - гепарин, який володіє
протизгортальною активністю, знаходяться в міжклітинній речовині тканини
печінки, легенях, серця, стінках артерій. Протеоглікани покривають поверхність
клітин, відіграють важливу роль в іонному обміні, імунних реакціях,
диференціюванні тканин.
Протеоглікани - глікопротеїни з високим ступенем
глікозилювання, вуглеводні залишки яких представляють собою довгі нерозгалужені
ланцюги - глікозаміноглікани, які утворилися залишками гексозаміну і уроновою
кислотою або галактозою. Протеоглікани є одними із основних компонентів
позаклітинного матриксу сполучної тканини.
Завдяки особливостям структури і фізико-хімічним властивостям
глікозаміноглікани та протеоглікани виконують функції структурних компонентів
міжклітинного матриксу, взаємодії з колагеном, еластином, фібронектином,
ламініном та іншими білками позаклітинного матриксу, приєднання води, великої
кількісті катіонів і беруть участь у формуванні тургору в різних тканинах;
відіграють роль молекулярного сита в позаклітинному матриксі, перешкоджають
розповсюдженню патогенних мікроорганізмів [2,3].
Фібронектин - глікопротеїн позаклітинного матриксу. У вигляді
розчинної форми синтезується в печінці і клітинах ретикуло-ендотеліальної
системи. Фібронектин зв’язується проколагеновими фібрилами і змінють кінетику
формування фібрил в прецеркулярному матриксі. Також бере участь в міграції
клітин та допомагає переміщуватися в клітинному матриксі.
Ламінін - найбільш розповсюджений глікопротеїн базальних
мембран. Однією з головних функцій ламініну здатність зв’язувати клітини та
модулювати їх поведінку. Впливє на ріст, морфологію, диференціювання та
рухливість клітин.
Білки ПКМ одночасно виступають сигнальними молекулами та
архітектурними молекулами печінки та відповідають за підтримку
диференційованого стану нормальних гепатоцитів та паренхімних клітин. ПКМ та
його окремі компоненти є мультифункціональними [2,3].
1.2 Колаген - основний білок позаклітинного
матриксу
Колаген виявлений у багатоклітинних тварин і є найпоширенішим
протеїном у ссавців, складаючи від 25% до 35% протеїнів тіла. Відсутній у
рослин, бактерій, вірусів, найпростіших і грибів.
Нерозчинність колагену була перешкодою для вивчення мономеру
колагену. Тим не менш, удосконалення мікроскопів і рентгенівських апаратів
полегшили дослідження структури молекули колагену. Ці пізніші відкриття дуже
важливі для кращого розуміння того, як структура колагену впливає на зв’язки
між клітинами і міжклітинною речовиною, як тканини змінюються під час росту і
регенерації, як вони змінюються під час ембріонального розвитку і при патології
[3,4].
.2.1 Будова та синтез
молекули колагену
Молекула колагену являє право закручену спіраль з трьох
ланцюгів, таке утворення відоме під назвою тропоколагену. Макромолекула
колагену має розмір близько 300 нм, діаметр 1,5 нм, молекулярну масу
всередньому 300 000.
Всередині тропоколагенів існує ковалентний зв'язок між
ланцюгами, товщі пучки фібрил формуються за допомогою білків декількох інших
класів, включаючи інші типи колагенів, глікопротеїни, протеоглікани, які
використовуються для формування різних типів тканин з різних комбінацій одних і
тих же основних білків. Амінокислотний склад колагену надзвичайно специфічний і
різко відрізняється від амінокислотного складу інших білків. Поліпептидний
ланцюг молекули колагену містить з 19 різних видів амінокислот, де кожна третя
є гліцином.
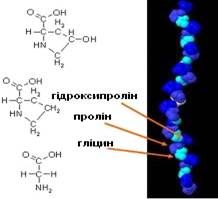
Рис.1.2. Топологія розташування основних амінокислотних
залишків у структурі колагену
У складі колагену є амінокислоти, які відсутні в інших
білках, наприклад, гідроксипролін і гідроксилізин (до 23%), але немає триптофану,
цистеїну й дуже мало тирозину та метіоніну [29].
Первинна структура молекули складається з трьох пептидних
ланцюгів по 1050 амінокислотних залишків кожний, скручених у лівозакручену
спіраль, які у свою чергу переплетені в одну правозакручену спіраль, утворюючи
спільну молекулу. Потрійну спіраль молекули колагену стабілізують водневі
міжспіральні та комплекси електростатичних і гідрофобних зв’язків. Така
структурна модель молекули колагену була запропонована в 1961 р. і майже без
змін є загальноприйнятою на сьогодні. У сполучній тканині молекули колагену за
рахунок міжмолекулярних поперечних зв’язків об’єднуються у фібрили та волокна
діаметром близько 2 і 20 мкм відповідно, утворюючи складну морфологічну
структуру, що має велику міцність. Фібрили нативного колагену мають характерну
окресленість, яка через 64 нм чергується світлими та темними зонами,
зумовленими чергуванням полярних і неполярних ділянок уздовж молекули (головна
прикмета ідентифікації ) [4,5].

Рис. 1.3. Полярні та неполярні ділянки молекули колагену
Синтез колагену - складний ферментативний багатостадійний
процес, який повинен бути забезпечений достатньою кількістю вітамінів і
мінеральних елементів. Поліпептидні ланцюги колагенів синтезуються на
мембранозв'язаних рибосомах і переходять у просвіт ендоплазматичного ретикулуму
у вигляді попередників більшого розміру (про-альфа-ланцюги), які мають
додаткові амінокислотні залишки (пропептиди) на N- і C-кінцях, а також короткий
N-кінцевий сигнальний пептид, який необхідний для перенесення утвореного
поліпептиду всередину ендоплазматичного ретикулуму. Далі деякі залишки проліну
і лізину гідролізуються, а деякі залишки гідроксилізину гліколізуються.
Гідроксильні групи даних амінокислот утворюють між спіральні водневі зв’язки,
які допомагають утворити триланцюгову молекулу проколагену. Харчовий пролін
виявляється попередником гідроксипроліну, а харчовий лізин - попередником
гідроксилізину в складі колагену. Гідроксилювання проліну (або лізину)
каталізуються пролінгідроксилазою (КФ 1.14.11.2.) або лізингідроксилазою (КФ
1.14.11.4.), ферментами, що знаходяться в мікросомальній фракції печінки. Ці
ферменти являються пептидилгідроксилазами, оскільки гідроксилювання проходить
тільки після включення проліну або лізину в пептидний ланцюг [].
Нестача аскорбінової кислоти порушує гідроксилювання проліну,
в результаті чого дефектні про-альфа-ланцюги не можуть утворити стабільну
потрійну спіраль і піддаються деградації всередині клітини, внаслідок чого
спостерігаються симптоми цинги (ламкість кровоносних судин, розхитування
зубів).
Процес формування про колагену в середині клітини включає
наступні етапи:
¾ відщеплення сигнальнх пептидів,
гідроксилювання залишків проліну в g-положенні і лізину з утворенням 4-гідроксипроліну та
гідроксилізину;
¾ гідроксилювання розташованих в
декількох c-положеннях залишків проліну до 3-гідроксироліну, приєднання галактози
або глюкози до декількох залишків гідроксилізину, приєднання багатого на манозу
олігосахариду до одного або двох пептидів, приєднання С-кінцевих пропептидів
внаслідок процесу, спрямованого структурою даних доменів, а також формування як
внутрішніх так і зовнішніх дисульфідних зв’язків.
Після приєднання С-пропептидів і формування кожного ланцюга,
що містить близько 100 залишків 4-гідроксипроліну, в С-кінцевій ділянці
формується «ядро» потрійної спіралі, після чого конформація потрійної спіралі
розповсюджується в напрямку до N-кінцяза принципом подібним до руху блискавки.
Після секреції проколагену із фібробластів N-пропептиди
відщеплюються N-протеїназою колагену (КФ 3.4.24.14.), а С-пропептиди -
С-протеїназою проколагену (КФ 3.4.24.19.). Після чого відбувається збирання
колагену в фібрили. На завершальному етапі лізиноксидаза (КФ 1.4.3.14.)
перетворює деякі залишки лізину та гідроксипроліну в альдегіди, які утворюють
серію складних сполук.
Побудова та процесинг багатьох нефібрилярних колагенів
включають ті самі стадії з деякими важливими відмінностями. Більшість колагенів
містять N- або С-кінцеві неколагенові домени, які не піддаються відщепленню, і
як наслідок, не називаються про пептидами [3,7].
Порушення синтезу колагену лежить в основі таких спадкових
захворювань, як латиризм (розхитаність суглобів, вивихи), синдром
Елерса-Данлоса (до 14 типів проявів), недосконалий остеогенез (хвороба скляного
чоловіка, вроджений рахіт, вроджена ламкість кісток), хвороба Марфана.
Характерним проявом цих захворювань є пошкодження зв'язкового апарату, хрящів,
кісткової системи, наявність вад серцевих клапанів.
Хвороби колагену, у тому числі так звані колагенози,
виникають через безліч причин, якими можуть бути мутації в гені, що приводить
до зміни форми колагенової молекули, або помилки у пострансляцінній модифікації
колагену. Також хвороби можуть бути викликані недоліком або "неправильною
роботою" ферментів, залучених в біосинтез колагену - дефіцит ферментів
гідроксилювання (пролін-, лізингідроксилази), глікозилтрансферази (КФ
2.4.1.2.), N-проколагенової (КФ 3.4.24.14.) і С-проколагенової пептидаз (КФ
3.4.24.19.), лізиноксидаз (КФ 1.4.3.14.) з наступним порушенням поперечних
зшивок, дефіцит міді, вітамінів В6, C. При хворобах, таких як цинга,
відновлення балансу ферментів до нормального може призвести до повного
виліковування [8].
Утворення колагенів регулюється на різних рівнях, починаючи
від синтезу незрілих ланцюгів та їх вітамін С-залежне гідроксилювання за
залишками проліну і закінчуючи дозріванням агрегованих тримерів за участю
трансглутаміназ (КФ 2.3.2.13.) та лізиноксидаз (КФ 1.4.3.14.) [3,7].
Лізилоксидаза (КФ 1.4.3.14.) утворює поперечні зв’язки колагенових фібрил,
представляє собою нерозчинний мідьвмісний білок. Ще один фермент, що бере
участь у дозріванні колагену це трансглутаміназа (КФ 2.3.2.13.), яка зшиває
білки на молекулярному рівні.
Гідроксилювання проліну або лізину каталізуються пролінгідроксилазою
(КФ 1.14.11.2.) або лізингідроксилазою (КФ 1.14.11.4.) - ферментами, що
знаходяться в мікросомальній фракції печінки та каталізують гідроліз
ковалентного зв'язку.
Глікозилтрансфераза (КФ 2.4.1.2.) входить до класу трансфераз
(КФ 2), що каталізують перенесення функціональних груп і молекулярних залишків
від однієї молекули до іншої. Глікозилтрансфераза (КФ 2.4.1.2.) переносить
залишки цукрів.
Також у синтезі колагену беруть участь N-протеїназа колагену
(КФ 3.4.24.14.), що відщеплює N-пропептиди, а С- пропептиди - С-протеїназа про
колагену (КФ 3.4.24.19.). Протеїнази входять до класу гідролаз (КФ 3), які
розщеплюють пептидний зв'язок між амінокислотами в білках[ ].
1.2.2 Типи колагену
На сьогодні відомо 28 типів колагену, які кодуються більш ніж
40 генами, які відрізняються один від одного первинною структурою ланцюгів,
функціями та локалізацією в організмі. Більше 90% всього колагену припадає на
колагени I, II, III, і IV типів [30].
|
Різновиди колагену
|
Типи колагену
|
|
Фібрилярні колагени
|
I, II, III, V, XI, XXIV, XXVII.
|
|
Фідрил-асоційовані колагени
|
IX, XII, XIV, XVI, XIX, XX, XXI, XXII.
|
|
Колагени, що формують філаменти -намистини
|
VI.
|
|
Мережоутворюючі колагени
|
IV, VIII, X.
|
|
Колагени, що формують якірні фібрили
|
VII.
|
|
Трасмембранні колагени
|
XIII, XVII, XXIII, XXV.
|
|
Інші
|
XXVIII, XV, XVIII.
|
Колагени першого типу є тримерними білками, що збираються в
потрійні спіралі без розривів, самозбираються в фібрили і володіють найбільшою
міцністю. Всі інші колагени відрізняються від них в одному або декількох
аспектах. Деякі колагени мають розриви у потрійній спіралі і не обов’язково
збираються у фібрили [9, 23].
Деякі колагени вступають в реакцію N-глікозилювання. Колагени
трьох типів (IX, XII, XIV) модифікуються внаслідок приєднання бокових ланцюгів
глікозаміноглікана, а колагени двох «додаткових» типів (XV і XVIII) мають
потенціальні ділянки для приєднання подібних ланцюгів. Потрійні спіралі деяких
колагенів, які не містять великих С-кінцевих глобулярних доменів можуть
згортатися по механізму, які не включають формування ядра в ділянці С-кінця
[3,7].
Типи колагену
|
Тип колагену
|
Гени
|
Молекули
|
Органи
|
Асоційовані хвороби
|
|
I
|
Col1A1 Col1A2
|
α1 (I) 2 α2 (I), α1 (I) 3
|
Синдром Елерса-Данлоса, остеогенез, ревматизм, синдром
Марфана, дисплазії
|
|
II
|
Col2A1
|
α1 (II) 3
+ тип XI
|
Хрящі, склоподібне тіло, міжхребетні диски
|
Коллагенопатія II і XI типу, синдром Стіклера,
ахондрогенез
|
|
III
|
Col3A1
|
α1 (III)
3
|
М'які тканини і порожнисті органи
|
Синдром Елерса-Данлоса, фібромишечная дисплазія,
аневризма аорти
|
|
IV
|
Col4A1 Col4A2 Col4A3 Col4A4 Col4A5 Col4A6
|
α1 (IV) 2 α2 (IV), інші незрозуміло
|
Базальні мембрани
|
Синдром Альпорта, синдромі Гудпасчера
|
|
V
|
Col5A1 Col5A2 Col5A3
|
α1 (V) 2
α2 (V), α1 (V) α2 (V) α3 (V)
|
М'які тканини, плацента, судини, хоріон
|
Синдром Елерса-Данлоса
|
|
VI
|
Col6A1 Col6A2 Col6A3 Col6A4 Col6A5 Col6A6
|
α1 (VI)
α2 (VI) α3 (VI)
|
Мікрофібрил в м'яких тканинах і хрящах
|
Міопатія Ульріха, міопатія Бетлема, атопічний
дерматит
|
|
VII
|
Col7A1
|
α1 (VII)
3
|
Прикріпні фібрили в зв'язці шкіри і епідерміт
|
Бульозний епідермоліз
|
|
VIII
|
Col8A1 Col8A2
|
α1 (VIII)
α2 (VIII)
|
Рогівка, ендотелій
|
Дистрофія рогівки
|
|
IX
|
Col9A1 Col9A2 Col9A3
|
α1 (IX)
α2 (IX) α3 (IX)
|
Хрящі, склоподібне тіло
|
Синдром Стіклера, остеоартрит, епіфізарних дисплазія
|
|
X
|
Col10A1
|
α1 (X) 3
|
Гіпертрофічна зона області зростання
|
Метафізарних дисплазія Шміда
|
|
XI
|
Col11A1 Col11A2
|
α1 (XI)
α2 (XI) α1 (II), α1 (XI) α2 (V) α1 (II)
|
Хрящі, склоподібне тіло
|
Коллагенопатія II і XI типів, остеопороз
|
|
XII
|
Col12A1
|
α1 (XII)
3
|
М'які тканини
|
Пошкодження сухожиль
|
|
XIII
|
Col13A1
|
α1 (XIII)
3
|
Поверхня клітин, епітельних клітини
|
|
|
XIV
|
Col14A1
|
α1 (IV) 3
|
М'які тканини
|
|
|
XV
|
Col15A1
|
α1 (XV) 3
|
Ендотеліальні клітини
|
Карцинома
|
|
XVI
|
α1 (XVI)
3
|
У всіх тканинах
|
|
|
XVII
|
Col17A1
|
α1 (XVII)
3
|
Поверхня епідермальних клітин
|
Бульозний епідерміоліз, пухирчатка
|
|
XVIII
|
Col18A1
|
α1
(XVIII) 3
|
Ендотеліальні клітини
|
|
|
XIX
|
Col19A1
|
α1 (XIX)
3
|
У всіх тканинах
|
Меланома, карцинома
|
|
XX
|
Col20A1
|
α1 (XX) 3
|
Виділено з курячого ембріона
|
|
|
XXI
|
Col21A1
|
α1 (XXI)
3
|
Кровоносні судини
|
|
|
XXII
|
Col22A1
|
α1 (XXII)
3
|
Тільки в місцях м'язово-сухожильних з'єднань
|
|
|
XXIII
|
Col23A1
|
α1
(XXIII) 3
|
Пухлинні клітини
|
|
|
XXIV
|
Col24A1
|
α1 (XXIV)
3
|
Кістки
|
Остеохондроз
|
|
XXV
|
Col25A1
|
α1 (XXV)
3
|
Атеросклеротичні бляшки
|
Хвороба Альцгеймера
|
|
XXVI
|
Col26A1= EMID2
|
α1 (XXVI)
3
|
Статеві органи
|
|
|
XXVII
|
Col27A1
|
α1
(XXVII) 3
|
М'які тканини
|
|
|
XXVIII
|
Col28A1
|
α1
(XXVIII) 3
|
Нервова система
|
|
1.3 Стелатні клітини печінки як
основні продуценти компонентів позаклітинного матриксу печінки
Стелатні клітини печінки (СКП) мають важливе значення для посилення
диференціації попередників клітин печінки. Однією з властивостей стелатних
клітин є пластичність не тільки тому, що можуть змінювати фенотип, але і тому
що вони виконують різноманітні функції. Вони складають приблизно одну третину
популяції непаренхімних клітин та 15% від загального числа клітин у нормальній
печінці. Стелатні клітини являють собою веретеноподібні клітини з овальними або
видовженими ядрами, що знаходяться між круглими паренхімними клітинами.
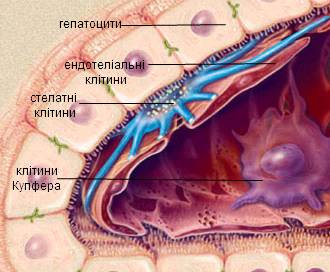
Рис. 1.4. Розташування стелатних клітин в печінці
На ультраструктурі видно, що в клітинах присутній шорсткий
ендоплазматичний ретикулум, невеликий апарат Гольджі та багаточисельні вакуолі.
Навколо клітин знаходяться синусоїди. Зазвичай одну клітину оточує більш ніж
два синусоїди. З базолатерального боку клітин вони розширяються по всьому
просторі забезпечуючи контакт з гепатоцитами. На кожному з них містяться
мікровиступи, функція яких була неясною, однак останні дослідження показали, що
ці виступи відіграють важливу роль, як передовий сигнал хемотаксису [10].
.3.1 Основні функції
стелатних клітин та їх вплив на регенерацію печінки
СКП беруть участь у розвитку та регенерації печінки, сприяючи
дозріванню клітин-попередників через міжклітинні контакти. Розширення
клітин-попередників може бути зумовлено стимуляцією блукаючого нерва, але
неясно чому цей процес вимагає участі стелатних клітин. У будь якому випадку це
відкриття припускає, що пошкодженій печінці може не вистачати життєво важливих
шляхів управління регенерацією печінки. Речовини, які виділяють стелатні
клітини можуть сприяти регенерації гепатоцитів, також вони є важливими для
розвитку жовчних проток в середині печінки. Такий вплив на клітини печінки
можливий через стимуляцію секреції фактору росту гепатоцитів.
Тісний контакт між стелатними клітинами із сусідніми, може
сприяти міжклітинному транспорту розчинних медіаторів і цитокінів. Крім того
вони знаходяться в безпосередній близькості з нервовими закінченнями і беруть
участь в нейрогуморальних реакціях та імунорегуляції. СКП містять рецептори, що
здатні взаємодіяти з бактеріальним ліпополісахаридом, який у свою чергу
стимулює стелатні клітини. СКП здатні стимулювати лімфоцити під час
проліферації та апоптозу, також регулють поведінку лейкоцитів.
Стелатні клітини секретують аполіпопротеїни Е, характерні для
клітин гладких м'язів, але функціональне значення секреції аполіпопротеїну не
визначено. Ще однією родиною ліпідів, що секретують стелатні клітини є
простагландини, які відіграють важливу роль у метаболізмі печінки під час
запалення. Також стелатні клітини є важливим джерелом цитокінів в печінці,
забезпечуючи міжклітинні взаємодії з мембранними рецепторами в нормальній та
пошкодженій печінці. Крім цитокінів цими клітинами також секретуються TGF та EGF,
два потужних фактори росту, які відіграють важливу роль у проліферації
гепатоцитів під час регенерації печінки. TGF та EGF також стимулюють мітоз в
стелатних клітинах. HGF є більш потужним мітогеном стелатних клітин під час
формування гепатоцитів. Секреція HGF зменшується під час гострого ураження
печінки. Фактор стовбурових клітин (SCF) також був виявлений в стелатних
клітинах під час регенерації печінки після часткової гепатектомії.
Тромбоцитарний фактор росту (PDGF) також потужний міоген стелажних клітин. Під
час ураження печінки відбувається активація рецепторів PDGF та збільшується
виробництво фактора росту. Фактор росту сполучної тканини (CTGF також відомий
CCN2) є модулятором фактору росту білка, сильно виражений під час фіброзу
печінки джеререлом якого являються стелатні клітини [24].
Після пошкодження печінки стелатні клітини повинні
«активуватися», переходячи зі стану спокою до проліферативних, фібриногенних і
скоротливих міофібробластів. Під мембраною клітини з'являються численні зв’язки
мікрофіламентів. Після детальної характеристики стелатних клітин печінки, стало
ясно, що подібні клітини існують в інших органах. Зокрема стелатні клітини
підшлункової залози є майже ідентичними зі стелатними клітинами печінки,
незначні відмінності між клітинами могли виникнути насамперед у результаті
різних умов формування. Подальша доля активованих клітин є невизначеною, вони
можуть повернутися в стан спокою або входять в стадію апоптозу.
Активація стелатних клітин складається з двох стадій:
ініціація та perpetuation. Найбільш ранні зміни, що спостерігаються під час
активації стелатних клітин спострігаються у результаті паракринної стимуляції
усіма сусідніми клітинами, в тому числі синусоїдального ендотелію, клітин
Купфера, гепатоцитів та тромбоцитів. Пошкодження ендотеліальних клітин стимулює
утворення целюлози-LAR фібронектин, який у свою чергу активує стелатні клітини.
Ендотеліальні клітини, імовірно, також беруть участь у перетворенні TGF з
латентної до активної форми. Тромбоцити також являються важливим джерелом
активаторів, у тому числі TGF, PDGF та EGF. Інфільтрація та активація клітин
Купфера можуть сприяти активації стелатних клітин. Клітини Купфера стимулюють
матричний синтез, проліферацію та втрату ретинілефірів стелатними клітинами
внаслідок дії цитокінів (особливо TGF) та активних форм кисню. Гепатоцити також
можуть бути джерелом активних форм кисню, хоча вплив на синтез колагену
стелатними клітинами залежить тільки від дози. Цитохром СUР2Е1 також відіграють
важливу роль в генерації активних форм кисню, які стимулюють стелатні клітини
печінки.
Друга стадія збереження сигналів включає в себе такі зміни:
проліферація, хемотаксис, фіброгенез, скоротливість, матрична деградація та
втрата ретинілефірів. Кінцевим результатом цих змін є підвищення та накопичення
компонентів позаклітинного матриксу.
Після детальної характеристики стелатних клітин печінки,
стало ясно, що подібні клітини існують в інших органах. Зокрема стелатні
клітини підшлункової залози є майже ідентичними зі стелатними клітинами
печінки, незначні відмінності між клітинами могли виникнути, насамперед, у
результаті різних умов формування [10] .
1.3.2 Накопичення та зберігання
вітаміну А стелатними клітинами в організмі
Основна важлива функція стелатних клітин в нормальній печінці
зберігання вітаміну А. Вітамін А та його метаболіти, які об’єднують під назвою
ретиноїди, - потенційні регулятори клітинної проліферації, диференціації та
апоптозу [11]. Ретиноєва кислота, основний транскрипційно активний вид
ретиноїдів, залучена у регуляцію більш ніж 500 генів [12]. Повністю-транс- і
9-цис-ізомери ретиноєвої кислоти регулюють транскрипцію, зв’язуючись з одним з
шести ядерних рецепторів - рецепторами ретиноєвої кислоти (RARα,
-β, і -γ)
та ретиноїд Х
рецепторами (RXRα, -β, і -γ)
[6, 13]. Усі
шість з цих ліганд-залежних транскрипційних факторів експресуються у печінці.
Нормальний запас вітаміну А в стелатних клітинах може забезпечити організм
вітаміном протягом декількох місяців.
Близько 50-80% запасів вітаміну накопичуються в печінці, з
яких 80-90% зберігаються в стелатних клітинах. Більшість вітаміну зберігаються
у вигляді цитоплазматичних крапель у вигляді ретинілефірів, переважно
ретинілпальмітат. Вони містять не тільки ретиноїди, але і значну кількість
триацилгліцеролів, фосфоліпідів, холестеролу та вільних жирних кислот.
Кількість крапель варіює в залежності від виду і кількості вітаміну, що
зберігається в організмі.
Ретинілефіри, що надійшли разом з продуктами харчування,
потрапляючи в кишечник гідролізуються до вільного ретинолу, а потім
адсорбуються ентероцитами. Каротиноїди поглинаються в незмінному вигляді, вже
всередині клітити частково перетворюються в ретиналь, який відновлюється до
ретинолу. В ентироцитах ретинол етерифікується жирними кислотами і входить до
складу хіломікронів, які через лімфатичні протоки потрапляють у загальну
циркуляцію. В капілярах хіломікрони перетворюються в хіломікронові залишки, де
і міститься весь вітамін А. Хіломікронові залишки потрапляють в основному в
паренхімні клітини печінки, де відбувається гідроліз ретинілефірів до ретинолу
і останній зв’язується з ретинолзв'язуючим білком (РЗБ). Комплекс ретинол-РЗБ
може секретуватися у кров або надходити до СКП.
Біологічна роль ретиноїдів в регулюванні активації стелатних
клітин залишається невідомою. Незважаючи на втрату ретиноїдів, що є характерною
рисою активації стелатних клітин, як в природних умовах так і в культурі,
невідомо чи цей процес є необхідною умовою для активації і тому висновок про
вплив ретиноїдів на стелатні клітини і фіброгенез суперечливі [10,14].
1.4 Сигнальні молекули, асоційовані
з позаклітинним матриксом печінки
білок печінка еластин матрикс
Вирізняючою особливістю процесу регенерації печінки є те, що
всі молекулярні події не обмежуються визначеним типом клітин, а залежить від
чіткої взаємодії поза- та внутрішньоклітинних факторів, які походять з різних
типів клітин печінки, включаючи клітини Купфера, стелатні клітини печінки,
ендотеліальні клітини, клітини епітелію жовчних проток та гепатоцити.
Наслідком цього є проліферація та відбудова (відновлення)
нормальної паренхіми печінки й повернення повноцінного функціонування даного
органу. В аспекті молекулярних комунікацій між різними типами клітин печінки за
участі сигнальних молекул особливого значення набуває позаклітинний матрикс
печінки.
Відомо, що гостре ураження печінки, в тому числі і втрата
частини паренхіми внаслідок механічного, фізичного чи біологічного пошкодження,
супроводжуються активацією процесів спрямованих на відновлення цього
метаболічно активного органу [15,16]. Одним з елементів цього каскаду
регенераційних процесів є активація стелатних клітин печінки, що полягає у
переході цих клітин зі стану спокою [17]. Морфологічно це проявляється у зміні
фенотипу цих непаренхімних клітин з ліпоцитного до міофібробластного, основною
ознакою чого служить втрата ліпідних крапель цими клітинами [18,19]. Одночасно
активовані стелатні клітини починають інтенсивно синтезувати фактори росту
(особливо фактор росту гепатоцитів) та компоненти позаклітинного матриксу (в
першу чергу колаген), які виступають основними сайтами локалізації та
диференціації новоутворених гепатоцитів [19].
На даний час виділено більше 10 факторів, що впливають на
проліферацію клітин печінки. Серед них найбільш вивчені гепатопоетини,
епідермальний (EGF), трансформуючий (TGF), тромбоцитарний (PDGF),
інсуліноподібний (IGF), гепатоцитарний фактори росту (HGF) [20].- поліпептид,
який продукується в основному в підщелепних і дуоденальних залозах та нирках і
секретується ендокринно в слюну і сечу. Являється потенціальним стимулятором
проліферації і диференціювання багатьох типів клітин, включаючи гепатоцити. Він
активує як ізольованих гепатоцитів в культурі, так і in vivo при введенні його
в черевну порожнину експериментальним тваринам.α - це низькомолекулярний
поліпептид, який володіє мітогенною активністю для різних типів клітин.
Насамперед був виділенний із пухлинних клітин. Подальші дослідження показали,
що TNF-α здатний активувати синтез ДНК в
первинній культурі гепатоцитів.β - гомодимерний пептид,
відомий як сильний інгібітор проліферації, стимулюючий EGF, TGF-α і HGF.
Після часткової гепатектомії (ЧГЕ) у щурів тканинний рівень
TGF-β прогресивно збільшувався від початку регенерації до її піку.
Після 72 годин його концентрація була збільшена в 4 - 8 разів і лиш до 96 годин
досягала контрольного рівня. Ці спостереження навели на думку, що TGF-β під час регенерації печінки
являється антагоністом для факторів стимуляторів [21].і IGF-2 являються яскраво
вираженими мітогенами, які відіграють важливу роль в рості розвитку організму.
Найбільш вивчений IGF-1 або соматомедин. Це поліпептид, який продукується
печінкою. Має паракринний вплив на рецептори непаренхіматозних клітин,
забезпечуючи їх проліферацію.- найбільш сильний стимулятор регенерації печінки.
Це протеїн, вперше виділенний із сиворотки крові щурів після ЧГЕ, а потім із
сиворотки і плазми крові хворих з гострою печінковою недостатністю і з
аскетичної рідини пацієнтів з цирозом печінки.
Такі цитокіни, як інтерлейкін-1 (ІЛ-1), інтерлейкін-6 (ІЛ-6),
фактор некрозу пухлин (TNF-α), а також простагландини,
які утворюються в клітинах Купфера, здатні діяти на клітини печінки в гостру
фазу відповіді на пошкодження. Вони відіграють істотну роль в проліферації і
диференціації клітин. Експерементально встановлено, що в перші години після ЧГЕ
продукція цитокінів клітинами Купфера підвищується. Під їх впливом на поверхні
гепатоцитів, ендотеліальних клітин синусоїдів і клітин Купфера здійснюється
адгезія нейтрофілів. Ці міжклітинні адгезіонні молекули, як і клітини Купфера
здатні виділяти цитокіни, активуючи синусоїдальні клітини. На думку багатьох
дослідників, даний механізм може слугувати пусковим поштовхом до регенерації
печінки.
Паралельно з цим процесом клітини Купфера посилено виробляють
простагландини, які регулюють утворення цитокінів. Збільшення продукції
простагландина Е2 (ПГЕ2) в перші години регенерації печінки пов’язано з стимулюючим
впливом HGF на клітини Купфера. Крім пригнічення активності цитокінів воно
являється потужним мітогенним стимулом проліферації гепатоцитів. Вироблення
ПГЕ2 залишається збільшеним протягом всього процесу регенерації, а по мірі
досягнення печінкою вихідної маси закінчується. Інтерстиційні колагени І та ІІІ
виступають сайтами зв’язування гепатоцитарного фактору росту (HGF) з
позаклітинним матриксом. Ця взаємодія опосередковується унікальними
колагеновими пептидами, які визначають у такий спосіб доступність цього
ростового фактора.
Таким чином, на різних етапах регенерації печінки функціонує
багато ростових факторів. В дійсності регенерація являється результатом
активації десятків, а може і сотні генів, продукти експресії яких в ряді з уже
перерахованими дають сумарний ефект, який приводить до відновлення пошкодженої
печінки [22].
РОЗДІЛ ІІ. МАТЕРІАЛИ І МЕТОДИ ДОСЛІДЖЕНЬ
2.1 Об’єкти та методи досліджень
Дослідження проводили на мишах лінії C57BL/6J масою 25-32 г
та віком 2,5-3 місяці, які знаходилися на стандартному раціоні віварію.
Утримання тварин та маніпуляції з ними проводили згідно з положеннями
«Європейської конвенції про захист хребетних тварин, що використовуються для
дослідних та наукових цілей» (Страсбург, 1986) та «Загальних етичних принципів
експериментів на тваринах», ухвалених Першим Національним конгресом з біоетики
(Київ, 2001).
Миші дикого типу (C57BL/6J) та нокаути Lrat-/- піддавались
частковій гепатектомії (ЧГЕ), яка полягала у резекції 2/3 тканини печінки. ЧГЕ
проводили в ранкові години в умовах анестезії за методом Mitchell &
Willenbring [25], який полягає у почерговому перев’язуванні та резекції лівої
латеральної та медіальної часток печінки
Рівень виживання тварин після проведеної хірургічної
процедури складав > 95 % та не відрізнявся в межах дослідних груп. Групу
дослідного контролю складали тварини, з якими здійснювали усі процедури подібно
до тварин, яким проводили часткову гепатектомію, але не піддавали резекції
тканини печінки.
Евтаназію тварин (5-6 тварин на кожну групу) проводили під
легким ефірним наркозом на 12, 24, 36, 48, 72 години та 7-му добу (168 годин)
після проведення ЧГЕ. Тварин зважували, видаляли регенеровану частину печінки,
яку використовували для подальшого аналізу. Сироватку отримували шляхом
центрифугування крові при 8000 g протягом 15 хвилин.
Визначення рівня колагену проводили на основі аналізу вмісту
гідроксипроліну за методом Bergman & Loxley [26]. Для цього наважку тканини
печінки (100 мг) або сироватку крові (100 мкл), отриманої з кожної тварини у
відповідний проміжок часу, гомогенізували у буфері для екстракції (0,05 моль/л
трис HCl, pH 7,5; 0,15 моль/л NaCl, 10 ммоль/л інгібітор протеїназ ФМСФ) та
гідролізували у запаяних ампулах в присутності 6 моль/л НСl протягом 24 год при
105 °С. Отриманий гідролізат нейтралізували і додавали буфер оксидації
(хлорамін Т в ацетат/цитратному буфері, рН 6,0) та аналітичного
ізопропанолового реактиву (3 частини ДМАБ (2 г. парадиметиламінобензальдегіду в
3 мл 60% хлорної кислоти) та 13 частин ізопропанолу). Проби перемішували та
інкубували протягом 25 хв при 60 °С. Після охолодження зразків додавали
ізопропанол та визначали оптичну густину при λ
= 558 нм.
Кількість гідроксипроліну (у мкг на г тканини або на мл сироватки) визначали на
основі калібрувального графіку, побудованого з використанням стандартних
розчинів гідроксипроліну.
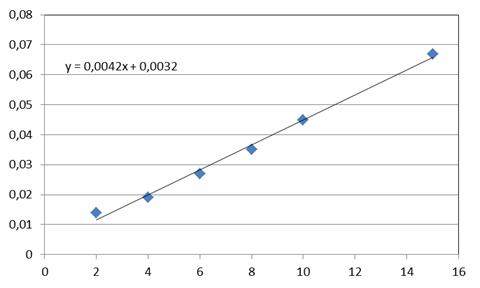
Рис. 2.1.Калібрувальний графік стандартних розчинів
гідроксипроліну
Для аналізу фракційного складу колагену тканину печінки
гомогенізували у буфері для екстракції, після чого колаген екстрагували шляхом
обробки дослідних зразків розчином пепсину (1 мг/мл в 0,5 моль/л оцтовій
кислоті) протягом 24 год при 4 °С. Екстрагований колаген аналізували методом
електрофорезу у 8% верхньому (концентруючий) та 5% нижньому (розділяючий)
поліакриламідному гелі в присутності 10 % ДДС-Na та 4 моль/л сечовини [27].
Електрофорез проводили при 60V, при входженні білків у розділяючий гель
підвищували до 80V. Після проведення електрофорезу, гелі зафарбовували
барвником кумасі G-250, а незв’язаний барвник відмивали сумішшю розчинів 20 %
метанолу та 7 % оцтової кислоти. Отримані забарвлені гелі сканували на приладі
Gel Doc 2000 (BioRad) та аналізували з використанням програми Quantity One.
Статистична
обробка результатів здійснювалась методами варіаційної статистики, обробки
результатів досліджень із застосуванням t-критерія вірогідності різниці
Ст'юдента. Різниця вважалась достовірною при коефіцієнті вірогідності Р <
0,05.
2.2 Техніка безпеки
Вимоги безпеки під час виконання роботи:
Ø дозволяється працювати тільки на
заземлених об’єктах;
Ø забороняється встановлювати
запобіжники, що не відповідають номінальному значенню;
Ø забороняється виконувати заміну
запобіжників при включеному обладнанні;
Ø не виконувати ніяких ремонтних робіт об’єкту
без зняття з нього напруги живлення.
При роботі на центрифугах:
Ø не працювати на частоті обертання,
вищій за максимальну для даного ротору;
Ø не працювати з неповним та
нерівномірно заповненими стаканами роторів типу РПУ К та з неповністю завантаженим
ротором РЗ-21Т;
Ø не центрифугувати препарат із
густиною, більшою за 1.2*103 кг/м3 на максимальній частоті обертання ротору;
Ø не працювати з роторами, що
відпрацювали свій термін експлуатації.
Не запускайте жодного приладу без попередньої перевірки. Не
залишайте діючий прилад без догляду. Для попередження нещасних випадків через
можливий викид реакційної суміші не заглядайте в пробірку чи колбу зверху.
Не виносити із лабораторії прилади, посуд та реактиви. Роботу
з отруйними речовинами проводити у витяжній шафі. Дотримуйтесь запобіжних
заходів при роботі з вибуховими та легкозапальними речовинами.
Не виливайте до раковини залишки кислот, лугів,
вогненебезпечних рідин та ін. Зливайте ці речовини до спеціальних склянок, що
знаходяться під витяжною шафою. Не кидайте до раковини пісок, папір та інші
тверді речовини.
Розчини, що містять кислоти та луги, перед тим як виливати до
каналізаційної системи, необхідно нейтралізувати. Речовини, що мають різкий
запах, та отруйні речовини повинні бути знешкоджені хімічною обробкою або
спалені у спеціально відведеному місці за межами лабораторії, бажано на
повітрі. Не залишайте жодних речовин у посуді без етикеток.
Вимоги безпеки в аварійних ситуаціях
При виникненні пожежі негайно вимкніть газ у всій
лабораторії, приберіть із помешкання всі горючі речовини, засипте піском або
закрийте ковдрою полум’я та повідомте черговому пожежної охорони про те, що
сталося (тел. - 101). Дотримуйтесь правил протипожежної безпеки.
Якщо в лабораторії за якихось причин пролита значна кількість
легко запальної рідини, то необхідно загасити всі горілки та електронагріваючі
прилади, відчинити вікна та збирати пролиту рідину ганчіркою або рушником,
місце проливу засипати піском, потім зібрати його дерев’яною лопаткою і винести
у спеціально відведене місце.
При легких термічних опіках шкіру необхідно обмити спиртом, а
потім змастити гліцерином або вазеліном. При більш сильних опіках обпечене
місце, після промивання концентрованим розчином перманганату калія та спиртом,
необхідно змастити засобом від опіків (наприклад, сульфідиновою емульсією). При
опіках сильними кислотами потрібно промити обпечене місце великою кількістю
води, а потім 3% розчином соди.
При опіках сильними лугами шкіру необхідно промити водою, а
потім нейтралізувати 1% розчином борної кислоти. Аміак майже не діє на шкіру,
але при попаданні в очі може викликати сильне пошкодження чи навіть сліпоту.
При випадковому попаданні реактивів всередину рекомендується
випити більше води. Поряд із цим необхідно: а) при отруєнні кислотами випити
склянку 2% вуглекислої соди; б) при отруєнні лугами випити склянку 2% оцтової
або лимонної кислоти.
При отруєнні необхідно вивести того, хто постраждав, на свіже
повітря, зробити штучне дихання та викликати лікаря.
При необережному згинанні трубок, вставленні трубок або
термометра до отвору колби, можливі порізи та поранення. При порізах у першу
чергу необхідно видалити з рани уламки скла, краї рани продезинфікувати 3%
спиртовим розчином йоду, а потім накласти стерильну пов’язку. При сильних
кровотечах слід накласти вище рани джгут та викликати лікаря або направити
постраждалого до амбулаторії (поліклініки).
У випадку загоряння горючої рідини необхідно загасити всі
горілки, прикрити полум’я азбестовим рушником або засипати його піском, або
скористатися вогнегасником із вуглекислим газом. Розчинні у воді
вогненебезпечні речовини, такі як спирт, ацетон та інші, можна загасити водою.
Якщо горить нерозчинна у воді речовина (наприклад, ефір, бензол, бензин,
скипидар), то воду використовувати для гасіння пожежі не можна, оскільки вона
не лише не буде ліквідована, але може навіть збільшитися. У цьому випадку
полум’я слід гасити піском та використовувати вогнегасник.
Вимоги безпеки після закінчення роботи
По закінченню тієї чи іншої операції необхідно вимкнути газ та
електроприлади, що використовувалися при виконанні даної роботи. Посуд, у якому
проводили роботу із вогненебезпечними реактивами, після закінчення роботи
повинен бути одразу вимитий.
По закінченні роботи привести до ладу робоче місце, прилади
та апаратуру, вимкнути головний газовий кран, головний електрорубильник,
вентиляцію та світло, а також перевірити, чи видалені з приміщення лабораторії
надлишки горючих та легкозапальних речовин, відпрацьовані рідини, сміття,
промаслене ганчір’я, перевірити, чи весь посуд із реактивами закритий пробками
та покладений на відведені місця.
РОЗДІЛ ІІІ. РЕЗУЛЬТАТИ ДОСЛІДЖЕННЬ ТА ЇХ ОБГОВОРЕННЯ
Результати проведеного дослідження показали, що початкові
етапи регенерації супроводжуються зниженням загального рівня колагену (визначеного
за рівнем гідроксипроліну). Зокрема, рівень гідроксипроліну на 24 годину після
гепатектомії в досліджуваних зразках тканин печінки знижується в 1,4 рази
порівняно з вихідними показниками нульового часу (Рис. 3.1.).
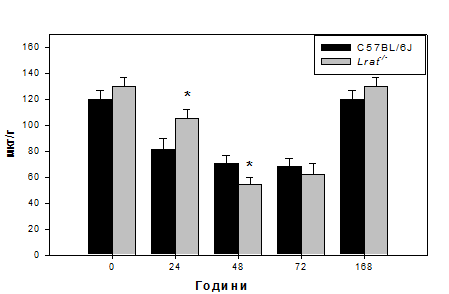
Рис. 3.1. Рівень гідроксипроліну в печінці мишей дикого типу (C57BL/6J)
та нокаутів Lrat-/- після гепатектомії.
Примітка: величини подані як M±m, n = 5; «*» - статистично достовірна
різниця порівняно з показниками мишей C57BL/6J (P ≤ 0,05).
Якісний аналіз фракційного складу колагенових фібрил засвідчив зниження
частки усіх без винятку фракцій колагену в досліджуваних зразках (Рис.3.2.).
Виявлена тенденція до зниження рівня колагену спостерігалась протягом перших
трьох діб після проведеної ЧГЕ, при цьому найнижчий рівень колагену виявлявся в
часовому проміжку, що відповідає 3-ій добі (72 години) після проведеної
гепатектомії.
Встановлена динаміка виявляється цілком закономірною з огляду на
необхідність повноцінного відтворення структури паренхіми печінки. Цей процес в
першу чергу полягає в протеолізі наявного позаклітинного матриксу, з метою
підвищення мобільності клітин печінки.
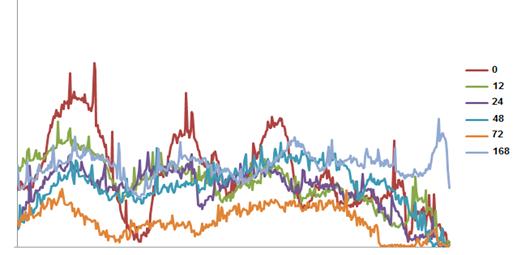
Рис.3.2. Електрофоретичні профілі екстрагованої колагенової фракції
печінки мишей дикого типу (C57BL/6J) після гепатектомії.
Примітка: денситограми фракційного складу колагену печінки позначено
різними кольорами у відповідності до часового проміжку.
Протягом ініціації відновлення паренхіми печінки відбувається
формування аваскулярних кластерів, утворених гепатоцитами та стелатними
клітинами печінки. Надзвичайно важливим виявляється міграція стелатних клітин в
такі кластери з їх наступною адгезією та формуванням щільних клітинних
контактів з гепатоцитами [17-19]. У зв’язку з цим усунення топологічних
перешкод у міграції клітин у вигляді інертного ПКМ шляхом його протеолізу
виявляється цілком закономірним [17]. Цей процес опосередковується дією
спеціалізованої групи більш ніж 20 протеїназ відомих як матриксні
металопротеїнази (MMП). Особливої уваги заслуговують інтерстиційні колагенази
(MMП-1, -8, -13), що виявляються єдиними металопротеїназами здатними
розщеплювати нативні калагени I і III та їх триспіральні домени, забезпечуючи
зниження жорсткості структури ПКМ.
Висловлене припущення підтверджується отриманими нами даними, щодо
підвищення рівня вільного гідроксипроліну в сироватці крові дослідних тварин
(Рис. 3.3.). Рівень цієї амінокислоти, утвореної внаслідок потрансляційних
модифікацій проколагенових поліпептидних ланцюгів та вивільненої при протеолізі
колагену, зростає більш ніж у 2 рази, досягаючи своїх максимальних значень вже
на 12 годину після проведеної часткової гепатектомії.
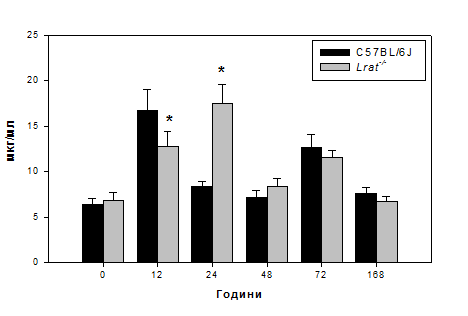
Рис. 3.3. Рівень вільного гідроксипроліну в сироватці мишей дикого типу
(C57BL/6J) та нокаутів Lrat-/- після гепатектомії.
Примітка: величини подані як M±m, n = 5; «*» - статистично достовірна
різниця порівняно з показниками мишей C57BL/6J (P ≤ 0,05).
Водночас в печінках мишей Lrat-/- спостерігається деяке уповільнення
деструкції колагенової компоненти ПКМ. Зокрема на 24 годину при збереженні
тенденції до зниження кількості колагену рівень його в печінці цієї групи на
28% перевищує даний показник в групі тварин з нормальним збереженням вітаміну А
(Рис.3.1.). При цьому електрофоретичний аналіз колагенових фракцій вказує на
зниження частки мономерних колагенових фібрил при збереженні фракції зрілих
тримерів колагену (Рис. 3.4.).
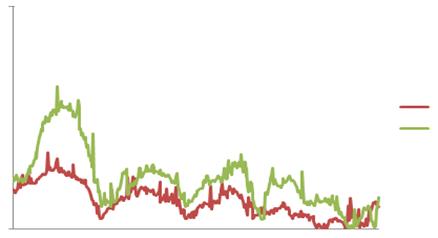
Рис.3.4. Електрофоретичні профілі екстрагованої колагенової фракції
печінки мишей дикого типу (C57BL/6J) та Lrat-/- на 24 годину після
гепатектомії.
Неможливістю повноцінного протеолізу тримерів, значна частка яких
виявляється нами на електрофореграмах при якісному аналізі колагенових фракцій,
можна пояснити підвищений рівень колагену в печінці групи ноакутних тварин
позбавлених ретинілефірів та ліпідних крапель стелатних клітин. Отримані
результати узгоджуються з даними літератури щодо перешкоджання повноцінної
регенерації в умовах порушення протеолітичної деградації колагену І [27].
Водночас порушення протеолізу колегену на початкових етапах регенерації інгібує
проліферацію клітин печінки, в тому числі і стелатних клітин. Дослідження in
vitro засвідчили, що накопичення інтерстиційних фібрилярних колагенів здатне
впливати на проліферацію, виживання та синтетичну активність клітин печінки,
включаючи ендотеліальні клітини, гепатоцити та стелатні клітини. Крім того
інтактний колаген є слабким лігандом до зв’язування сигнальних молекул типу
інтегринів, в той час як частково деградовані зрілі ланцюги виступають сайтами
зв’язування цих молекул і активаторами проліферації гепатоцитів [1].
Починаючи з 3 доби після гепатектомії нами спостерігалася тенденція до
підвищення рівня колагену в регенерованій тканині печінки, досягаючи на 7 добу
вихідних показників (Рис. 3.1.). Після проходження декількох раундів
проліферації клітин печінки (що відбуваються в проміжку між 24 і 48 годинами),
основну частину з яких складають гепатоцити, виникає потреба у формуванні
нового ПКМ для новоутворених клітин. Водночас структурні компоненти ПКМ
виступають місцями зв’язування спеціальних молекул необхідних для повноцінного
відновлення структури печінки [20].
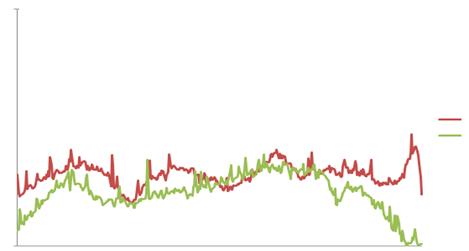
Фракційний аналіз колагенів печінки тварин дикого типу
(С57BL/6J) з нормальною забезпеченістю вітаміном А дозволив виявити колагенові
фібрили різного ступеня олігомеризації, зі значною часткою мономерів та
димерів, що вказує на переважання новосинтезованих колагенових ланцюгів та
лабільність утвореної структури позаклітинного матриксу (Рис. 3.5.).
Водночас в печінці Lrat-/- спостерігається низький рівень
колагену (визначений за рівнем гідроксипроліну), зокрема, на 48 годину даний
показник статистично достовірно нижчий порівняно з печінкою тварин С57BL/6J
(Рис. 3.6.). Це може бути зумовлено як підвищенням активності матриксних
металопротеїназ, так і порушенням процесів формування повноцінного колагену.
Імовірно в нашому експерименті вказані події відбуваються одночасно. Утворені
новосинтезовані колагенові фібрили повинні пройти етап дозрівання за участю
ферменту трансглутамінази, оскільки у незрілому стані ці новосинтезовані
білкові агрегати виявляються чутливими до дії протеїназ. Враховуючи залежність
активності основного ензиму дозрівання колагенів - трансглутамінази - від рівня
вітаміну А [28], цілком імовірно, що в печінці мишей Lrat-/- процес формування
стабільного колагенового тримеру проходить неповноцінно. Цим можна пояснити
виявлений нами загальний низький рівень колагену та низька частка тримерів в
печінці даної групи тварин. В нашому експерименті це також підтверджується
зростанням рівня вільного і зв’язаного гідроксипроліну в сироватці крові
досліджуваних тварин (Рис. 3.6.), значні кількості яких утворюються при
протеолізі незрілих колагенів.
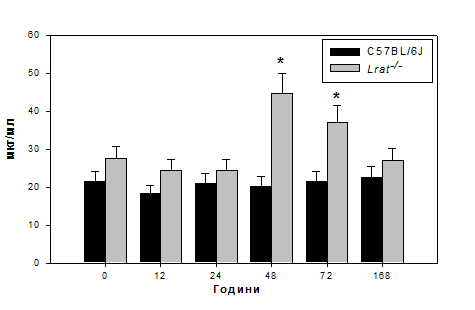
Рис. 3.6. Рівень зв’язаного гідроксипроліну в сироватці мишей дикого
типу (C57BL/6J) та нокаутів Lrat-/- після гепатектомії.
Примітка: величини подані як M±m, n = 5; «*» - статистично достовірна
різниця порівняно з показниками мишей C57BL/6J (P ≤ 0,05).
Отже, нами встановлено, що відсутність достатніх запасів вітаміну А
зумовлює порушення реструктуризації позаклітинного матриксу печінки, що, у свою
чергу, негативно відображається на темпах регенерації печінки.
Висновки
1. Початкові етапи регенерації печінки (12-48 години)
супроводжуються зниженням загального рівня колагену, в той час як у віддалені
періоди після часткової гепатектомії (7 доба) рівень даного білкового
компоненту позаклітинного матриксу печінки зростає, досягаючи вихідних величин.
. Запаси вітаміну А у формі ретинілефірів ліпідних
крапель стелатних клітин необхідні для нормальної реструктуризації колагенового
компоненту позаклітинного матриксу печінки.
Список використаної літератури
1. Zhang
W. Hepatic non-parenchymal cells and extracellular matrix participate in oval
cell-mediated liver regeneration / W. Zhang, X. Chen, W. Zhang, F. Zhang,
S.Xiang, H. Dong // World J. Gastroenterol. - 2009. - Vol. 15, № 5. - P. 552 -
560.
2. Martinez
A. The extracellular matrix in hepatic regeneration / A. Martinez, P. Amenta //
FASEB J. - 1995. - Vol. 9, № 14. - P. 1401-1410.
. Reid
L. Extracellular matrix gradients in the space of Disse: relevance to liver
biology / L. Reid, A. Fiorino, S. Sigal, S. Brill, P. Holst // Hepatology. -
1992. - Vol. 15, №6. - P. 1198-1203.
. Quereshi
S. Extraction and partial characterization of collagen from different animal
skins / S. Quereshi, A. Mhaske, D. Raut, R. Singh // Science. - 2010. - Vol. 2,
№ 9. - P. 28 - 31.
. Ottani
V. Collagen structure and functional implications / V. Ottani, M. Raspanti, A.
Ruggeri // Micron. - 2001. - Vol. 32, № 3. - P. 251 - 260.
6. Estep
J. Hepatic stellate cell and myofibroblast-like cell gene expression in the
explanted cirrhotic livers of patients undergoing liver transplantation / J.
Estep, L. O'Reilly, G. Grant, J. Piper, J. Jonsson, A. Afendy // Dig. Dis. Sci.
- 2010. - Vol. 55, № 2. - P. 496 - 504.
7. Zhou
X. Impaired proteolysis of collagen inhibits proliferation of hepatic stellate
cells / X. Zhou, A. Jamil, A. Nash, J. Chan // J. Biol. Chem. - 2006. - Vol.
281, № 52. - P. 39757 - 39765.
. Hoppe
H. Collectins - soluble proteins containing collagenous regions and lectin
domains - and their roles in innate immunity/ H. Hoppe, K. Reid // Protein Sci.
- 1994. -Vol. 3, № 8. - P.1143 - 1158.
9. Franzke
C. Colagenous transmembrane proteins: recent insights into biology and
pathology / C. Franzke, P. Bruckner // J. Biol. Chem. - 2005. - Vol. 280, № 6.
- P. 4005 - 4008.
10. Friedman
S. Hepatic stellate cells: protean, multifunctional and enigmatic cells of the
liver / S. Friedman // Physiol Rev. - 2008. - Vol. 88, № 1. - P. 125 - 172.
. Gudas
L. Emerging roles for retinoids in regeneration and differentiation in normal
and disease states / L. Gudas // Biochim. Biophys. Acta. - 2012. - Vol. 1821,
№1. - P. 213 - 221.
12. Balmer
J. Gene expression regulation by retinoic acid / J. Balmer, R. Blomhoff // J.
Lipid Res. - 2002. - Vol. 43, №1. - P. 1773 - 1808.
. Shirakami
Y. Hepatic metabolism of retinoids and disease associations / Y. Shirakami, S.
Lee, R. Clugston, W. Blaner // Biochim. Biophys. Acta. - 2012. - Vol. 1821, №1.
- P. 124 - 136.
14. В’юницька
Л. В. Гіпотези щодо механізму дії вітаміну А / Л. В. В’юницька, К. О. Паливода
// Укр. мед. часопис. - 2006. - Т.53, № 3. -C. 33 - 38.
. Fausto
N. Liver regeneration / N. Fausto, J. Campbell, K. Riehle // Hepatology. - 2006.
- Vol. 43, № 1. - P. 45-53.
. Michalopoulos
G. K. Liver regeneration after partial hepatectomy: critical analysis of
mechanistic dilemmas / G. K. Michalopoulos// Am. J. Pathol. - 2010. - Vol. 176,
№ 1. - P. 2 - 13.
17. Mabuchi
A. Role of hepatic stellate cell/hepatocyte interaction and activation of
hepatic stellate cells in the early phase of liver regeneration in the rat / A.
Mabuchi, I. Mullaney, P. Sheard, P. Hessian, B. Mallard, M. Tawadrous // J.
Hepatol. - 2004. - Vol. 40, № 6. - P. 910 - 916.
. Balabaud
C. The role of hepatic stellate cells in liver regeneration / C. Balabaud, P.
Bioulac-Sage, A. Desmouliere // J. Hepatol. - 2004. - Vol. 40, № 6. - P. 1023 -
1026.
. Budny
T. Morphologic features in the regenerating liver - a comparative intravital,
lightmicroscopical and ultrastructural analysis with focus on hepatic stellate
cells / T. Budny, D. Palmes, U. Stratmann, E.Minin, H. Herbst, H. Spiegel //
Virchows Arch. - 2007. - Vol. 451, №4. - P. 781 - 791.
20. Schuppan
D. Collagens in the liver extracellular matrix bind hepatocyte growth factor /
D. Schuppan, M. Schmid, R. Somasundaram, R. Ackermann, M. Ruehl, T. Nakamura,
E. Riecken // Gastroenterology. - 1998. - Vol. 114, № 1. - P. 139 - 152.
. Fausto
N. Regulation of liver growth: protooncogenes and transforming growth factors /
N. Fausto, J. Mead // Lab. Invest. - 1989. - Vol. 60, № 1. - P. 4-13.
. Fausto
N. Liver regeneration and repair: hepatocytes, progenitor cells, and stem cells
/ N. Fausto // Hepatology. - 2004. - Vol. 39, № 6. - P. 1477-1487.
. Cheng
W. The content and ratio of type I and III collagen in skin differ with age and
injuri / W. Cheng, R. Yan-hua, N. Fany-gang // Afr. J. Biotechnol. - 2011. -
Vol. 10, №13. - P. 2524 - 2529.
24. Riehle
K. New concepts in liver regeneration / K. Riehle, Y. Dan, J. Campbell // J
Gastroenterol Hepatol. - 2011. - Vol. 26, № 1. - P. 203 - 212.
. Mitchell
C. A reproducible and well-tolerated method for 2/3 partial hepatectomy in mice
/ C. Mitchell, H. Willenbring // Nat. Protoc. - 2008. - Vol. 3, № 7. - P.
1167-1170.
26. Samuel
C. Determination of сollagen сontent, сoncentration, and sub-types in kidney
tissue / C. Samuel // Meth. Mol. Biol. - 2009. - Vol. 466. - P. 223-235.
27. Makino
H. Changes in growth factor and cytokine expression in biliary obstructed rat
liver and their relationship with delayed liver regeneration after partial
hepatectomy / H. Makino, H.Shimizu, H. Ito, F. Kimura, M. Miyazaki // World J.
Gastroenterol. - 2006. - Vol. 12, № 13. - P. 2053-2059.
. Ohtake
Y. Effect of retinoic acid on transglutaminase and ornithine decarboxylase
activities during liver regeneration / Y. Ohtake, A. Maruko, N. Ohishi, M.
Kawaguchi, T. Satoh, Y.Ohkubo // Cell Biochem. Funct. - 2008. - Vol. 26, № 3. -
P. 359-365.
. Thompson
K. Targeting collagen expresion in alcoholic liver disease / K. Thompson, I.
McKillop, L. Schrum // World J. Gastroenterol. - 2011. - Vol. 17, № 20. - P.
2473-2481.
. Lai
K. Exracellular matrix dynamics in hepatocarcinogenesis / K. Lai, S. Shang, N.
Lahia // Plos Genetics. - 2011. - Vol. 7, № 6. - P. 1-16.