Кинетика микробного роста в природных экосистемах
Кинетика
микробного роста в природных экосистемах
Введение
В микробиологии успех любого
исследования во многом зависит от того, насколько изучены характер роста
данного микроорганизма и его питательные потребности.
Начало выращиванию бактерий и
выделению чистых культур положили работы отцов-основателей этой науки - Луи
Пастера и Роберта Коха. К настоящему времени, спустя более чем 100 лет,
получено в культуре и описано, вероятно, все еще менее одной десятой части
существующих в природе видов прокариот.
О свойствах любой бактерии и ее роли
в природе нельзя судить до тех пор, пока она не изучена в лабораторной
культуре. Например, без этого часто невозможно определить, патогенен данный
микроб или нет. Более чем 90% бактерий не выделены в виде культур, не описаны
как виды и, таким образом, «скрыты» от человека; остается неизвестной их
биологическая ценность. Выяснение питательных и физиологических потребностей
необходимо не только для того, чтобы выращивать микроорганизмы. По требованиям
к условиям культивирования и составу среды можно определить экологическую нишу
и значение микроорганизма, а также его отличительные признаки, используемые для
таксономии, экологического описания и решения практических задач.
Характеристики роста отражают физиологические особенности микроорганизмов.
Наконец, управление ростом культур
лежит в основе биотехнологического применения микроорганизмов. Все это
подчеркивает важность изучения характера роста и питательных потребностей
бактериальных культур.
1. Характер роста
периодической культуры
Культуры называют периодическими,
когда при росте в жидких средах в закрытых сосудах определенного объема
микроорганизмы находятся в закрытой системе. Понятие микробный рост означает
увеличение числа клеток микроорганизма. Под ростом отдельной бактериальной
клетки понимают увеличение ее длины и последующее деление на две дочерние
клетки (бинарное деление). У почкующихся бактерий возрастание числа клеток
может также происходить в результате почкования. Дочерние клетки имеют те же размеры
и состав, что и материнские. Когда время удвоения числа клеток остается
постоянным, культура находится в экспоненциальной фазе роста (неверно
называемой также логарифмической, или лог-фазой, по соображениям удобства
построения графика роста в полулогарифмической шкале).
Удельная скорость роста определяется
ферментативными возможностями данного вида бактерий, составом среды и всеми
биофизическими факторами, влияющими на скорость роста. Как следствие, удельная
скорость роста изменяется по экспоненциальному закону.
Исчерпание питательных веществ и
накопление продуктов обмена до токсической концентрации приводят к постепенной
остановке роста и переходу культуры в стационарную фазу, за которой следует
фаза отмирания. Обычно причинами гибели - лизиса клеток в культуре становятся
их энергетическое истощение и действие ферментов автолиза. Клетки некоторых
бактерий не погибают после прекращения роста, благодаря тому что образуют споры
или цисты, способны переживать неблагоприятные условия. В стационарной фазе происходит
сложная адаптация клеток к условиям голодания и переживания и возможен скрытый
рост выживших клеток на остатках лизированных клеток). Скорость роста в
начальной стадии низка, поскольку в это время происходит адаптация клеток
посевного материала к новым условиям.
Длительность этой фазы, называемой
лаг-фазой или фазой задержки роста, зависит от количества клеток и возраста
культуры, служившей посевным материалом, а также от различий в составе старой и
новой сред. За это время клетки переходят из состояния адаптации к стационарной
фазе роста культуры (часто именно такие, старые культуры используют для засева
сред) в состояние активного роста. Длительность лаг-фазы увеличивается, если
посевной материал был выращен на более богатой среде. При засеве материалом,
взятым из культуры в экспоненциальной фазе роста, при одинаковом составе сред
рост начинается без лаг-фазы.
В определенных условиях наблюдается
не экспоненциальный, а линейный рост - если лимитирующий субстрат поступает в
среду с постоянной скоростью, например добавляется в виде раствора по каплям
или, в случае газа (такого, как О2), проникает в среду путем
диффузии. Линейный рост может быть также обусловлен недостатком того или иного
фермента, например при исчерпании его кофактора.
Микробные культуры используются во
многих биотехнологических процессах в качестве биокатализаторов. Требуемый
продукт они синтезируют чаще всего в стационарной фазе роста, поэтому вначале
их выращивают отдельно в оптимальных для роста условиях (трофофаза) и затем
переносят в «неростовые» условия, обеспечивающие синтез продукта, необходимого
для данного технологического процесса (идиофаза).
Типичная кривая роста, построенная в
полулогарифмической шкале, приведена на рис. 1.
В периодической лабораторной
культуре в течение короткого времени субстраты присутствуют в этом случае в
среде в нелимитирующей концентрации; в природе же такие условия скорее редкое
исключение, чем правило. Микробный рост в природе происходит в условиях,
которые можно сравнить с концом фазы экспоненциального роста, когда количество
субстратов становится лимитирующим и затем недостаточным для поддержания роста.
Рост в таких условиях ограничен концентрацией субстрата, а не количеством
клеточной массы.
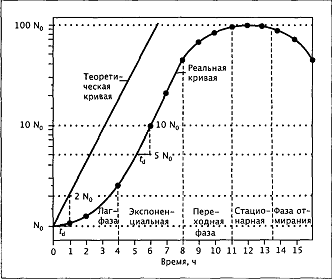
Рис. 1 - Типичная кривая роста
периодической культуры, построенная в полулогарифмической шкале: зависимость
логарифма числа клеток от времени (величина инокулята 1%). Для сравнения
приведена теоретическая кривая экспоненциального роста
Кривая экспоненциального роста должна
быть скорректирована введением понятия емкости с преобразованием в
«логистическую» кривую роста.
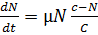
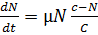 , (1)
, (1)
где N - число клеток,
С - ёмкость, до которой
возможен рост, определяемая, например, как количество лимитирующего рост
субстрата.
Пока величина N невелика
по сравнению с С, последний сомножитель близок к единице и несуществен. Однако,
когда N приближается к соответствию С, экспоненциальный рост корректируется показателем
емкости и нарастание биомассы прекращается с достижением стабильной конечной
плотности популяции.
Показатель емкости С
может относиться к лимитирующему субстрату, т.е. источнику углерода, азота,
серы или фосфора, донору или акцептору электронов либо другим факторам.
Согласно принципу Либиха, рост лимитирован субстратом, который исчерпывается
первым, когда остальные могут присутствовать еще в избытке. Этот принцип не
применим в полной мере к микробным клеткам, так как у них возможна определенная
адаптация к изменениям условий (состава) среды. Содержание азота, серы или
фосфора в клетках может варьировать в зависимости от количества субстрата в 2 -
10 раз.
Эффективность
использования субстрата для достижения конечной емкости С определяется
сродством к субстрату, Кв, данного организма. Этот термин означает
концентрацию субстрата, при которой скорость роста равна половине максимальной.
Если рост и потребление субстрата тесно сопряжены, Кв означает также
концентрацию субстрата, при которой скорость потребления субстрата составляет
1/2 ее максимального значения. Значение Кв можно определить либо
непосредственно по скорости поглощения субстрата (например, клеточной
суспензией, образцом осадков или почвы), либо в лимитированной количеством
субстрата хемостатной культуре при скорости разбавления, соответствующей 1/2
максимальной скорости роста.
2. Хемостат как модель
роста микроорганизмов в природных системах
При хемостатном
(непрерывном) культивировании, в отличие от периодического, в культиватор
постоянно подается свежая питательная среда и концентрация одного из субстратов
поддерживается на уровне, лимитирующем рост. Одновременно происходит постоянный
отток культуры, так что объем ее в культиваторе не изменяется. Культиватор
снабжен мешалкой для равномерного распределения свежей среды - рис. 2.
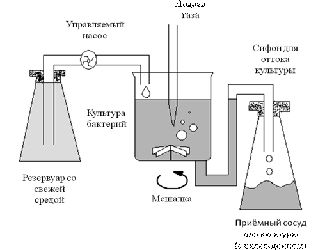
Рис. 2 - Система для
непрерывного культивирования (хемостат)
Хемостат имитирует
ситуацию, существующую в природе, в том отношении, что клетки поддерживаются в
нем в условиях незначительного, но непрерывного поступления субстрата.
Измеряемая концентрация субстрата не дает никакой информации о количестве
субстрата, находящемся в обороте; она отражает лишь сродство к субстрату
соответствующих микробных систем и его связь со скоростью поступления
субстрата. Рост и оборот субстрата не обязательно связаны между собой
стабильным соотношением, но оборот субстрата может быть все менее сопряжен с
ростом по мере снижения скорости поступления субстрата.
Культивирование в
хемостате:
обеспечивает постоянное
получение молодых клеток, выросших в строго определенных условиях при известной
удельной скорости роста; такие клетки необходимы для изучения различных
регуляторных процессов;
позволяет определять
важные показатели роста, а также изучать физиологическую реакцию культуры на
лимитирование питательными веществами;
служит полезной моделью
для описания роста во многих природных местообитаниях;
позволяет выявлять
предпочтительно используемые субстраты в их смеси, а также конкуренцию или
сосуществование двух или трех видов при данных условиях роста;
позволяет проводить
подпитку токсичными субстратами в более высоких концентрациях;
позволяет исследовать
стабильные двухкомпонентные культуры.
3. Способность
микроорганизмов выживать в условиях голодания и при стрессе
В природе микроорганизмы
обычно находятся в условиях недостатка субстрата или голодания, при которых
важнее их способность к выживанию в таких условиях без существенного снижения
плотности популяции, чем быстрый рост при избытке питательных веществ.
Бaктepии, растущие
только при низких концентрациях субстратов, называют олиготрофными, отличая их
от копиотрофных бактерий, способных расти только на богатых лабораторных
средах. Олиготрофные бактерии трудно культивировать, поэтому об их физиологических
и регуляторных способностях мало что известно; влияние на микроорганизмы
условий голодания изучается главным образом на лабораторных штаммах таких
бактерий, как Escherichia coli, Klebsiella или Paracoccus,
т.е. не на тех организмах, для которых такие условия существования обычны в
природных средах.
При изучении способов
выживания микроорганизмов в природных условиях важно разделять различные типы
голодания. Голодание по источнику углерода (обычно он служит одновременно и
источником энергии) - это совершенно иная ситуация для клеток, чем голодание по
источнику азота, серы или фосфора, препятствующее только росту, но не влияющее
на процессы поддержания.
Эффективность поглощения
субстрата может возрастать благодаря увеличению числа систем транспорта
(пермеаз и др.) либо индукции новых, более высокоаффинных транспортных систем,
обеспечивающих поглощение субстрата при его низкой концентрации, например
системы симпорта с использованием протондвижущей силы.
У многих хорошо
изученных бактерий известны специфические высокоаффинные системы транспорта
таких субстратов, как глицерол, фосфат, сахара и аминокислоты.
Другая стратегия
адаптации - это увеличение поверхности клетки, например путем образования
стебельков. Почкующиеся и стебельковые бактерий, например родов Stella, Prosthecochloris
и Caulobacter, приспособлены к обитанию в средах с низким
содержанием субстратов; при культивировании в лабораторных условиях образуемые
их клетками стебельки растут в длину по мере уменьшения концентрации
субстратов. Хотя эти клеточные выросты участвуют также в размножении клеток и
бесспорно еще не доказано, что они «выстланы» транспортными белками,
достигаемое таким путем увеличение поверхности клетки, очевидно, дает
преимущество в условиях голодания. В то же время при данной стратегии
возрастают потери энергии в результате утечки протонов через увеличенную
поверхность клетки.
Одним из способов
длительного выживания в условиях голодания путем снижения энергетических затрат
служит образование спор. Такой переход в покоящуюся стадию обеспечивает
независимость от питания, а также защиту от высыхания и нагревания, например у
поверхности почвы. Другие предназначенные для выживания устойчивые формы, встречающиеся
у отдельных групп микроорганизмов, - это цисты, миксоспоры и акинеты.
Многие грамотрицательные
бактерии при неблагоприятных условиях не образуют спор, но вместо этого снижают
свою потребность в энергии путем уменьшения размеров клеток. При такой стратегии
уменьшается также трата энергии на поддержание мембранного потенциала.
Образование подобных карликовых форм («карликовость») довольно широко
распространено у бактерий в незагрязненных озерах и морской воде. Средние
размеры бактериальных клеток в бедных питательными веществами местообитаниях во
много (до 30) раз меньше, чем размеры не голодающих клеток, как показывает
изучение морских бактерий при различных концентрациях субстрата.
У голодающих бактерий
часто встречается образование слизи. Внеклеточная слизь помогает сохранению
протонного градиента, поддержанию протондвижущей силы и мембранного потенциала.
Однако более важна роль слизи в сохранении воды при высыхании и участие ее в
прикреплении клеток к поверхностям, имеющем, по-видимому, большое значение для
обеспечения субстратом при его низкой концентрации.
4. Снижение числа
микробных клеток вследствие выедания консументами или лизиса под действием
бактериофагов
Приросту численности
микробных клеток противодействуют в природе выедание, фаговая инфекция и гибель
в результате голодания. В водных местообитаниях бактериальные популяции
выедаются простейшими, а также коловратками и некоторыми веслоногими рачками.
Ресничные инфузории, жгутиконосцы и веслоногие питаются взвешенными
бактериальными клетками, отцеживая их из свободной воды, тогда как амебы,
коловратки и нематоды поедают преимущественно прикрепленные бактериальные
клетки. Прикрепление к поверхностям - одна из стратегий, позволяющих избежать
выедания животными, питающимися бактериями.
В то же время заметные
агрегаты бактерий на разлагающемся детрите поедают более крупные животные, в
том числе питающиеся планктоном рыбы, лишенные приспособлений для фильтрации
воды.
Выедание снижает
величину бактериальной популяции и на первый взгляд кажется повреждающим
фактором. Однако уменьшение популяции приводит также к ослаблению конкуренции
за субстраты и, таким образом, способствует повышению концентрации субстрата,
его обороту и скорости роста бактерий, поддерживая микробную популяцию в
активном состоянии. Таким образом, размеры бактериальной популяции зависят как
от поступления питательных веществ, так и от выедания, и оба эти фактора влияют
один на другой через бактериальную популяцию.
Питающиеся бактериями
животные превращают микробную биомассу в животную биомассу с эффективностью, по
данным лабораторных экспериментов, примерно 50%. Это означает, что половина
биомассы-пищи минерализуется, обеспечивая энергию для ассимиляции другой ее
половины животным-консументом.
Названные выше животные,
питающиеся бактериями, относятся к аэробам, т.е. проявляют активность в
аэробных местообитаниях; о значении питания бактериями в анаэробных средах мало
что известно. С открытием факультативно или строго анаэробных ресничных
простейших, жгутиконосцев и грибов, обитающих в бескислородных осадках, рубце
жвачных животных и других подобных местообитаниях, возник вопрос о роли этих
организмов в регуляции численности бактерий в анаэробных сообществах. Опыты по
кормлению анаэробных ресничных инфузорий из бескислородных вод высокоэвтрофных
озер показали, что эффективность их питания значительно ниже (составляет
примерно 5%) по сравнению с аэробными ресничными инфузориями, вследствие
низкого энергетического выхода. Таким образом, в анаэробных средах могут
поддерживаться лишь незначительные популяции простейших, питающихся бактериями.
Питание анаэробных животных и соответственно величина их популяций лимитированы
также из-за прикрепления бактерий к поверхностям, особенно в осадках.
Вклад в регуляцию
численности бактерий в природных популяциях вносят также бактериофаги. В
последние годы становятся известными все новые их виды, и можно предполагать,
что ни один из ныне известных видов бактерий не защищен полностью от поражения
фагами.
Значение бактериофагов
как факторов контроля бактериальных популяций в природе, возможно, проявляется
лишь в некоторых ситуациях, например если генетически однородные популяции
бактерий-хозяев достигают высокой плотности, как при цветении морских
цианобактерий, когда гибель клеток на 50% обусловлена фаговой инфекцией.
Популяции, например гетеротрофных бактерий в толще воды, слишком
немногочисленны и слишком гетерогенны для того, чтобы численность фагов
поддерживалась на достаточно высоком уровне, позволяющем им влиять на
численность этих бактерий-хозяев. По предварительным оценкам, гибель клеток
бактерий всего на 5 - 10% вызвана лизисом под действием фагов. О значении фагов
в почвах или осадках данных пока не имеется, поскольку чрезвычайно сложно
проводить микроскопическое исследование этих местообитаний.
5. Методы
количественного анализа микробной популяции в природе
Для количественной
оценки микробных сообществ в природе необходимы специальные методы, отличные от
используемых при изучении лабораторных культур. Прямой подсчет клеток под
микроскопом на первый взгляд может казаться весьма подходящим методом, но на
самом деле он применим только для анализа проб воды. Однако даже в такой среде
большинство бактерий прикреплено к частицам детрита и едва различимо при
непосредственной микроскопии. Чтобы визуализировать бактериальные клетки в
пробах воды, их окрашивают флуоресцентными красителями, такими как акридиновый
оранжевый или 4', 6-диамидино-2-фенилиндол (ДАФИ). Эти красители проникают
через плазматическую мембрану и связываются либо с клеточными белками (акридиновый
оранжевый), либо с двухцепочечной ДНК (ДАФИ), обеспечивая специфическое
окрашивание бактериальных клеток. Однако вопреки более ранним сведениям эти
красители не позволяют различать живые и мертвые клетки и среди подсчитанных с
их помощью клеток может быть значительная доля мертвых. Имеется возможность
специфически выявлять активно дышащие бактерии, используя новые красители,
которые образуют флуоресцентные производные только после восстановления
дыхательными ферментами (например, 5-циано - 2,3 - дитолил-тетразолийхлорид).
Прямой подсчет с применением флуоресцентных красителей не пригоден, однако, как
метод для исследования образцов осадков или почв, поскольку в этих средах
слишком велик фон естественно флуоресцирующих соединений.
Другие методы, позволяющие
выявлять метаболически активные клетки, основаны на применении радиоактивных
меток и радиоавтографии. Для определения синтеза белка и роста клеток
используют 14С-лейцин, синтеза ДНК и размножения клеток - 3Н-тимидин.
Оба эти маркера использовались в прошлом главным образом для изучения проб воды
и осадков, но получаемые таким способом данные нельзя считать точными,
поскольку внесенный меченый предшественник частично разлагается микробами и
доступная в результате информация не соизмерима с усилиями, затраченными на
эксперименты.
Оценка численности
клеток в бактериальных популяциях чашечным методом Коха, т.е. путем высева на
плотные среды в чашках Петри и культивирования, даже при использовании сложных
и относительно неспецифических сред дает весьма разочаровывающие результаты.
Общее число колоний, например на казеино-крахмало-пептонном агаре, применяемом
в качестве стандартной среды для учета пресноводных бактерий, обычно на 1-2
порядка ниже, чем количество клеток, определяемое путем прямого микроскопирования.
Это означает, что лишь 1 - 10% клеток микробного сообщества могут давать
колонии при использовании данной методики, и другие среды в этом отношении
отнюдь не лучше.
Другой метод
количественного учета клеток с помощью культивирования - это метод наиболее
вероятного числа. Для определения числа микробов этим способом готовят
последовательные разведения (1:10) исследуемого материала в пробирках с жидкой
питательной средой не менее чем в трех повторностях и инкубируют пробирки в
течение времени, необходимого для проявления роста (помутнения среды).
Предполагая, что в последней пробирке, где после достаточного периода инкубации
наблюдается рост, находилась исходно одна-единственная клетка, подсчитывают
исходное число бактерий в образце. Преимущество данного метода состоит в том,
что в жидкой среде в отсутствие контакта с воздухом могут расти даже довольно
чувствительные к О2 бактерии, а также в том, что непосредственно в
пробирках с разведениями можно определять, например, продукты метаболизма.
Недостатком такого подсчета клеток является значительная статистическая
неопределенность, связанная с оценкой результатов по принципу «да» или «нет» в
трех независимых повторностях разведений.
Культивирование
позволяет получить более достоверные сведения, если оно применяется для
количественного определения конкретных метаболических групп бактерий. Так,
метаногенные бактерии, растущие с использованием водорода/формиата, можно
непосредственно подсчитывать в виде колоний в чашках Петри благодаря
естественной флуоресценции, выявляя таким образом 20-50% клеток их популяции.
Сульфатредуцирующие бактерии также довольно успешно подсчитываются путем
культивирования с применением адекватных сред.
Совершенно иной подход к
анализу природных популяций состоит в том, что в качестве показателей биомассы
используются клеточные компоненты (химические маркеры). Общую живую биомассу (в
действительности почти в любой экосистеме она представлена главным образом
микробной биомассой) можно количественно оценить, например в почвенном образце,
путем определения общего содержания АТР. Показателем биомассы может служить
также общее количество ДНК при условии, что процедура экстракции позволяет
отделить ДНК из живых клеток от ДНК мертвых клеток, прикрепленных к почвенным
частицам. В почвенной микробиологии довольно широко применяется метод
фумигации, который состоит в том, что образец подвергают обработке парами
хлороформа, при которой большая часть микробов погибает. Затем в течение 10
суток измеряют количество СО2, образующегося в результате окисления
отмершей биомассы выжившими клетками. Количество СО2 считают
показателем исходного содержания количества биомассы. В качестве
альтернативного показателя определяют общую дегидрогеназную активность клеток
по восстановлению ими солей тетразолия или диметилсульфоксида.
Более специфичная в
отношении отдельных таксонов информация может быть получена при анализе специфических
клеточных компонентов. Так, специфичной таксономической характеристикой служит
профиль клеточных жирных кислот. К сожалению, для определения метаболических
групп прокариот этот параметр малоприменим, поскольку лишь немногие из них,
подобно сульфатредукторам, характеризуются специфическим составом жирных
кислот. Следует учитывать также, что жирнокислотный состав мембранных липидов
подвержен изменениям в зависимости от условий среды. Кроме того, этот метод
предусматривает сравнение с чистыми культурами исследуемых бактерий, но
культивируемые микроорганизмы, как подчеркивалось выше, часто составляют лишь
малую и нерепрезентативную фракцию общей популяции в данном образце.
Химическим показателем
присутствия грибов в сложном микробном сообществе служит эргостерол.
Для выявления и
идентификации определенных типов бактерий в природных образцах применяют
флуоресцентные антитела. В зависимости от использованных для их получения
антигенов антитела могут быть направлены против клеточных компонентов, специфичных
для отдельного штамма, вида или рода, поэтому уровень специфичности, доступный
в исследованиях с применением антител, значительно варьирует. Кроме того, этот
метод, как и метод определения липидов, ограничен распознаванием культивируемых
бактерий, так как их используют при этом для получения антител. Следует
учитывать также, что поверхностные свойства бактерий (образование слизи,
присутствие адгезинов и другие характеристики) в природных условиях и
лабораторных культурах могут существенно различаться. Таким образом, этот
подход пригоден для определенных, хорошо изученных систем, но в целом его
применимость весьма ограничена. С успехом он используется для идентификации
метаногенов в анаэробном активном иле.
Новые возможности для
изучения микробных сообществ открывает применение молекулярно-биологических
методов. Принцип учета микробов на основе анализа рРНК состоит в том, что
синтезированные олигонуклеотидные рРНК-зонды для участков рРНК гибридизуются
специфически с определенными участками рРНК клеток в исследуемом образце. Эти
участки должны быть предварительно, путем сравнения всех имеющихся данных о
последовательностях рРНК, определены как высоко- или низковариабельные и как
специфические для какого-либо домена, типа, подтипа или таксона более низкого ранга
в пределах данной системы, в некоторых случаях вплоть до видового уровня. К
такому зонду, состоящему примерно из 18 или большего числа нуклеотидов,
присоединяют флуоресцентный краситель, и благодаря этому при специфической
гибридизации зонда с рРНК клетка-мишень приобретает флуоресцентную окраску.
Живые клетки бактерий содержат несколько тысяч копий молекул рРНК, поэтому
связывание флуоресцентного зонда с клетками-мишенями обеспечивает хорошо
заметное свечение во флуоресцентном микроскопе.
Этот метод применим,
во-первых, для выявления определенной бактерии в микробном сообществе с помощью
высокоспецифичного зонда. Во-вторых, использование менее специфичных зондов
позволяет в первом приближении идентифицировать неизвестные бактерии в
сообществе, относя их к определенным филогенетическим группам. Таким способом
до 90% общей микробной популяции в пробах озерной воды может быть распределено
по двум основным доменам прокариот. Другой пример подобного использования
рРНК-зондов - идентификацию бактерий в активном иле - иллюстрирует рис. 3.
С помощью более
специфических зондов можно определять некультивируемые формы прокариот,
обитающие, например, в организме простейшего, до уровня рода. Если молекулярные
зонды, специфичные для групп различных уровней в пределах данной
таксономической системы прокариот, связывать с различными флуоресцентными
красителями, в одном препарате из природного образца можно наблюдать
распределение микробов по группам различных филогенетических уровней.
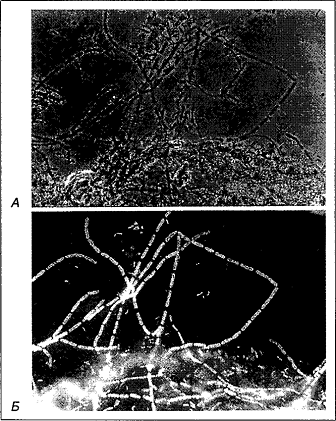
Рис. 3 - Определение
протеобактерий с группоспецифическим нуклеотидным зондом к рРНК. А.
Фазово-контрастная микроскопия. Б. Тот же препарат при флуоресцентной
микроскопии с УФ-эпиосвещением
Этот метод дает
чрезвычайно эффектные результаты при его сочетании с конфокальной лазерной
микроскопией, позволяя одновременно визуализировать группы бактерий различного
систематического уровня в виде трехмерной картины и выявлять, например, их
пространственные взаимосвязи.
Применение полимеразной
цепной реакции позволяет копировать даже единственную молекулу 16S-рРНК (в виде
ДНК) в экстрактах из природных образцов для сравнения нуклеотидных
последовательностей этой ДНК с ДНК известных прокариот. Таким способом
предлагается изучать филогенетические связи некультивируемых бактерий с другими
прокариотами. Амплифицированную ДНК можно использовать для создания зондов,
специфичных к нуклеиновым кислотам неизвестных микроорганизмов, и таким образом
оценивать разнообразие микробного сообщества, независимо от способности данных
микроорганизмов расти в культуре. Этот же метод может быть использован для
того, чтобы проследить судьбу некультивируемого организма при тех или иных
способах изучения общей популяции, например в процессе получения накопительной
культуры нового организма с неизвестными потребностями или при изменениях в
популяциях некультивируемых бактерий, например активного ила, в результате
стрессовых природных ситуаций.
Наряду с
перспективностью методов молекулярных зондов для микробной экологии следует
отметить и их ограничения. Эти методы позволяют установить присутствие
определенного типа микроорганизмов и его принадлежность к той или иной ветви
филогенетической системы, созданной на основе анализа последовательностей.
Однако в большинстве случаев они не дают возможности определить экологическую
нишу (тип метаболизма) некультивируемого организма, поскольку филогенетические
группы не гомологичны метаболическим группам, даже на уровне мельчайших
разветвлений системы. Кроме того, не все прокариоты одинаково доступны для применения
молекулярных зондов. Некоторые бактерии, особенно обладающие толстыми
клеточными стенками или окруженные капсулой либо слизью, остаются трудными
объектами для экстракции ДНК или гибридизации РНК с зондами. Поскольку метод
зондов к тому же селективен, определенные бактерии, возможно важные, при
анализе популяций этим способом могут остаться незамеченными.
Заключение
Основным лимитирующим
фактором в условиях природных экосистем для микроорганизмов является количество
субстрата.
Механизмы устойчивости к
голоданию включают увеличение числа высокоаффинных транспортных систем,
увеличение клеточной поверхности, образование спор, уменьшение размеров клеток,
адаптацию клеточного метаболизма путем синтеза индуцируемых голоданием белков и
образование слизи.
Апробированные и
разработанные простые модели искусственных экосистем (хемостаты) являются
эффективным инструментом для изучения законов функционирования микробных
популяций и их сообществ в природных экосистемах. При разработке подходов
устойчивого развития биосферы экспериментальные и теоретические исследования
позволяют выявить закономерности взаимодействия микробных популяций с
остальными обитателями экосистем и найти подходы к управлению ими в моделях
искусственных экосистем.
Однако все питательные
среды и условия инкубации селективны для небольшой фракции общей бактериальной
популяции, имеющейся в исследуемом образце; попытки составить менее
специфические, более соответствующие природным условиям культуральные среды,
позволяющие более точно оценивать разнообразие и численность микроорганизмов,
пока не дали успеха.
Определение численности
микроорганизмов в природных образцах можно осуществлять путем прямого подсчета
под микроскопом флуоресцентно окрашенных клеток, радиоавтографии клеток,
меченных 14С или 3Н, подсчета колоний, выросших на
плотной питательной среде, определения роста в жидкой среде с учетом
разведения, измерения общего содержания АТР, ДНК или более специфических
клеточных компонентов, таких как жирные кислоты или хлорофилл, либо методами с
применением флуоресцентно меченных антител. Все эти методы имеют свои
ограничения.
Одиночные клетки или
популяции микроорганизмов можно идентифицировать путем гибридизации с
синтетическими рРНК-зондами или с рРНК-зондами, полученными на основе
амплифицированной (методом ПЦР) ДНК. Эти методы можно применять в сочетании с
оптическими для выявления в том числе некультивируемых микроорганизмов в
природных образцах.
Список источников
1. Современная микробиология: прокриоты: В 2-х томах: Т. 1,2. Пер.
с англ. / Под ред. Й. Лендлегера, Г. Древса, Г. Шлегеля. - М.: Мир, 2005. - 496
с.: ил., 24 с.
2. http://zhurnal.ape.relarn.ru/articles/2006/062.pdf -
Электронный научный журнал «Исследовано в России». Статья «Использование малых
моделей искусственных экосистем для изучения взаимодействия ризобактерий с
растением-хозяином и микроскопическими почвенными грибами».