Свойства и получение антибиотиков пенициллинового ряда
ГОСУДАРСТВЕННОЕ
БЮДЖЕТНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ ВЫСШЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ
КУРСКИЙ ГОСУДАРСТВЕННЫЙ МЕДИЦИНСКИЙ УНИВЕРСИТЕТ ФЕДЕРАЛЬНОГО АГЕНСТВА ПО
ЗДРАВООХРАНЕНИЮ И СОЦИАЛЬНОМУ РАЗВИТИЮ
Биотехнологический
факультет
Кафедра
биологической и химической технологий
КУРСОВАЯ
РАБОТА
Свойства и
получение антибиотиков пенициллинового ряда
Выполнила студентка 3 курса 2 группы Е.В.Скорова
Руководитель канд.тех.наук, доцент Л.В.Атрепьева
Курск-2012 г.
Содержание
Введение
. Общая характеристика пенициллинов
. История открытия
. Природные источники
. Биохимическая роль
. Строение и свойства
. Механизм биологического действия
. Методы получения
.1 Аппаратурно-технологическая схема получения пенициллина.
Ферментаторы
.2 Природные
.3 Полусинтетические
.4 Методы выделения антибиотиков
.5 Динамика получения
. Достоинства и недостатки методов
. Методы оценки антибиотической активности
. Контроль качества
. Перспектива развития
Заключение
Список используемых источников
Приложение
Введение
Антибактериальная терапия является важнейшим компонентом современной
клинической медицины.
Сегодня среди возбудителей тяжёлых инфекций преобладают грамположительные
микроорганизмы. В начале 80-х годов прошлого века в этиологии инфекций на их
долю приходилось около 40% случаев заболеваний, спустя 10 лет - свыше 50% , в
настоящее время - 55-60% .
Первые антибиотики, в частности пенициллины, были активны главным
образом, в отношении грамположительных микроорганизмов - стафилококков и
стрептококков. Эффективное лечение заболеваний вызванных грамположительными
бактериями повлекло за собой изменение этиологической структуры ряда инфекций.
В частности, стала возрастать роль микроорганизмов, обладающих природной
устойчивостью или способных быстро формировать приобретённую резистентность к
доступным антибиотикам. Как правило, это были грамотрицательные бактерии. Надо
отметить интересную особенность: в отличие от стафилококков, патогенные
стрептококки за 60 лет использования пенициллина так и не приобрели к нему
устойчивости, они по сей день высокочувствительны к этому антибиотику.
Наиболее актуальными антибиотиками для лечения инфекций респираторного
тракта являются препараты 3-х групп: аминопенициллины, цефалоспорины 2-го
поколения и макролиды. Так как к ампициллину и амоксициллину у ряда
микроорганизмов выработалась устойчивость, для лечения осложнений используют
ингибитор защищённые аминопенициллины: клавуланаты (аугментин, амоксиклав).
1. Общая характеристика
Открытие английским микробиологом А.Флемингом пенициллина стало началом
эры антибиотиков.
Классификация пенициллинов:
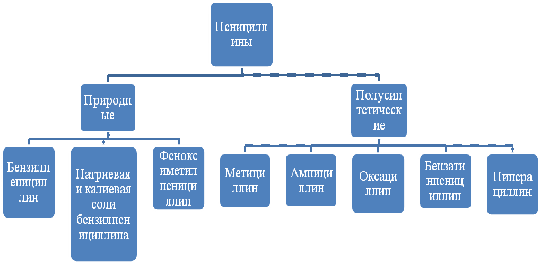
Пенициллины - группа антибиотиков, производные 6- аминопенициллановой
кислоты.
Пенициллины первого поколения - это природные пенициллины. К ним
относятся бензилпенициллин - натрий, бензилпенициллин - калий,
бенизилпенициллин, феноксиметилпеницилин.
Пенициллины первого поколения теперь не вводят в медицинскую практику,
так как они легко инактивируются пенициллиназой и малоактивны.
Значительным достижением современной химиотерапии является создание
полусинтетических пенициллинов второго и третьего поколения - важных
противомикробных средств.
Пенициллины второго поколения - это полусинтетические антибиотики,
молекулы которых содержат аминопенициллятную кислоту, ацилированную
синтетическими кислотами, которые не встречаются в природе. Полусинтетические
пенициллины - это лекарственные средства с широким спектром антибактериального
действия, однако некоторые и них разрушаются под действием пенициллиназы.
Создание пенициллинов третьего поколения является важным событием в
медицине и фармации. Основной особенностью этих антибиотиков является
взаимодействие с бактериальными β-лактамазами и блокирования их.
Вследствие этого антимикробная активность намного увеличивается. Они состоят из
двух веществ - полусинтетического антибиотика и ингибитора β-лактамаз.
Лекарственные средства природных и полусинтетических пенициллинов - это
белые кристаллические вещества без запаха, горькие на вкус. Пенициллины -
нестойкие вещества, они легко поддаются инактивации под действием воды.
Натриевая и калиевая соль бензилпенициллина гигроскопичны и легко растворяются
в воде. Новокаиновая соль бензилпенициллина, феноксиметилпенициллин и
ампициллин малорастворимы в воде.
Несмотря на появление новых групп противомикробных средств,
антибиотические препараты пенициллинового ряда продолжает занимать значительное
место в терапии инфекционных заболеваний. В частности, среди отечественных
препаратов пенициллинов большого распространения приобрели стойкие к гидролизу
полусинтетические препараты «Ампициллин» и «Оксациллин». Так, ампициллин,
благодаря дополнительной активности по отношению к грамотрицательной флоре, на
которую не действует препарат природного происхождения «Бензилпенициллин»,
считается антибиотиком широкого спектра действия, пригодный для употреблении
при заболеваниях, вызванных смешанной инфекцией. Стоит отметить, что среди
парентеральных форм препаратов пенициллинового ряда бензилпенициллин и теперь
часто применяется в медицинской практике. Что касается оксациллина, то по
спектру противомикробной активности он в общем подобен бензилпенициллину, но
превосходит его по гидролитической стойкости и поэтому, в отличии от
последнего, как и ампициллин, пригоден к пероральному употреблению.
Специфичность биологической активности пенициллина прежде всего
обусловлено наличием в его молекуле тиазолидинового и β-лактамного циклов.
Расщепление одного из них приводит к полной потери препаратом активности
относительно бактерий, которые не являются продуцентами фермента β-лактамазы пенициллинов.
Четырёхчленный лактамный цикл характеризуется большой лабильностью к
действию разных по характеру химических факторов. Гидролитическая стойкость
пенициллинов главным образом зависит от нуклеофильности атома кислорода экзоциклической
амидной структуры и существенно повышается при введении в молекулу
электроакцепторных заместителей.
Введение в молекулу 6-АПК остатков аминофенилуксусной и кислоты позволило
получить относительно стойкие к гидролитическому расщеплению препараты
«Ампициллин» и «Оксациллин».
Их продуцируют в виде солей - натрия или калия (бензилпенициллин),
новокаина или N, N-дибензилэтилендиаминовой соли (бензилпеницилин) -
бициллина-1, кислоты или тригидрата (ампициллин) разного дозирования в виде
быстрорастворимого стерильного порошка во флаконах или таблеток (ампициллин,
оксациллин), гранул для изготовления суспензий (ампициллин) и др.
Особенно широкое применение находят комбинированные препараты, которые
состоят из смеси натриевой соли ампициллина и оксациллина в соотношении 2 : 1 (
«Ампиокс-натрий », в Украине - «Ампициллин - оксациллин» ) и ампициллина
тригидрата и оксациллина натриевой соли , взятых в соотношении 1 : 1 ( ампиокс
) , которые выпускаются во флаконах по 100 , 200 или 500 мг и капсулах по 0.25
мг препарата ( сумма ампициллина тригидрата и оксациллина натриевой соли )
соответственно.
Выпускной формой для антибиотиков пенициллинового ряда являются порошки
для инъекций во флаконах различной вместимости, таблетки, гранулы для
приготовления суспензий в упаковках, сироп, капли для приема внутрь и капсулы.
Для антибиотиков пенициллинового ряда существуют свои условия хранения,
например, некоторые антибиотики хранят в защищенном от света месте, а
большинство антибиотиков хранят в сухом, темном месте при температуре не ниже
25 С.
2.
История открытия
Известный английский бактериолог Александр Флеминг опубликовал в 1929 г.
сообщение о действии зеленой плесени на стафилококки. Флеминг выделил гриб,
который оказался Penicillium notatum, и установил, что культуральная
жидкость этой плесени способна оказывать антибактериальное действие по
отношению к патогенным коккам.
Культуральная жидкость гриба, содержащая антибактериальное вещество,
названа Флемингом пенициллином.
Попытки Флеминга выделить активное начало, образуемое Penicillium, не увенчались успехом. Несмотря на
это, Флеминг указал на перспективы практического применения обнаруженного им
фактора.
Спустя примерно десять лет после сообщения Флеминга пенициллин начал
изучать Чейн. Он был убежден, что это вещество - фермент. В 1940 г. Флори и
Чейн получили индивидуальное соединение пенициллина, который оказался не
ферментом, а низкомолекулярным веществом.
О свойствах зеленой плесени было известно задолго до наблюдений Флеминга.
Еще в глубокой древности индейцы из племени майа использовали ее, выращенную на
зернах кукурузы, для лечения ран. Философ, врач и естествоиспытатель Абу-Али
Ибн-Сина рекомендовал использовать плесень при гнойных заболеваниях.[3]
В русской народной медицине с давних времен применялись для лечения ран
присыпки, состоящие из зеленой плесени. В работах русских ученых Манассеина и
Полотебнова в 1871-1872 гг. указывалось отношение Penicillium glaucum к разным бактериям. Полотебнев впервые в
научно-клинической обстановке изучил применение зеленой плесени, показав при
этом практически ценные результаты. Манассеин установил, что молодая культура
плесени подавляет рост некоторых бактерий. В 1877 г. русский врач Лебединский
доложил о подавлении плесенью бактерий желудочно-кишечного тракта. Английский
физик Тиндаль описал в 1876 г. способность Penicillium подавлять бактерии, находящиеся в
жидкости, но объяснял он это явление чисто физическими причинами.
Таким образом, приведенные данные показывают, что человечество на разных
уровнях своего развития знало о целебных свойствах зеленой плесени. Однако эти
сведения носили разрозненный характер и касались лишь воздействия самого гриба
на микроорганизмы. В то время не могло быть и речи о выделении и изучении
активного начала, образуемого плесенью.
И только после 1940 г., когда Флори и Чейн получили препарат (пенициллин)
в очищенном виде, появился широкий научный интерес к этому антибиотическому
веществу.
Изучение пенициллина в Советском Союзе было начато З.В.Ермольевой. В 1942
г. под ее руководством в лаборатории биохимии микробов Всесоюзного института
экспериментальной медицины в Москве был получен первый отечественный пенициллин
- крустозин, сыгравший огромную роль в спасении жизней воинов Советской Армии в
Великой Отечественной Войне.
В январе 1944 г. Москву посетила группа иностранных ученых, среди которых
был профессор Флори, привезший с собой английский штамм продуцента пенициллина.
Сравнение двух штаммов показало, что советский штамм образует 28,ед/мл, а
английский - 20ед/мл.
После того как было установлено, что пенициллин обладает мощными
лечебными свойствами, начались интенсивные поиски продуцентов этого
антибиотика. В результате чего удалось установить, что пенициллин могут
образовывать многие виды Penicillium (P. Chrysogenum, P. Nidricans, P. Turbatum, P. Corylophilum), а
так же некоторые виды Aspergillus.
Первые выделенные из естественных субстратов штаммы Penicillium как
наиболее активные продуценты пенициллина образовывали не более 20 единиц (12
мкг) антибиотика на 1 мл культуральной воды. Даже промышленное создание этого
ценнейшего продукта было начато при активности культуральной жидкости не выше
30 мкг/мл или 50 ед/мл. Насколько низка эта активность, можно судить по тому
факту, что в истинное время в промышленных условиях получают культуральные жидкости
с содержанием пенициллина наиболее 15000 ед/мл, а отдельные штаммы способны
синтезировать антибиотик в количестве до 25 тыс. ед/мл.
3.
Природные источники получения
Пенициллин относится к группе β-лактамных антибиотиков.
В последние годы установлено, что антибиотики этой группы образуются не
только плесневыми грибами, но и некоторыми видами актиномицетов и собственно
бактерий.
В течение ряда лет пенициллин получали путем выращивания гриба в
стеклянных матрацах (бутыли для поверхностного выращивания гриба в любом месте)
на жидкой питательной среде. Это создавало огромные трудности в поддержании
стерильности при засевах каждого матраца и требовало большой затраты рабочей
силы. Учитывая, что выход антибиотика составлял всего несколько десятков единиц
на 1 мл среды, себестоимость пенициллина была чрезвычайно высокой. Так,
например, стоимость 1 кг пенициллина в США, как отмечал в 1959 г. Гольдберг,
составляла в 1943 г. 227 270 долларов, а в 1953 г. - всего 169 долларов, т. е.
за 10 лет стоимость 1 кг пенициллина снизилась более чем в 1340 раз.
Важным этапом в увеличении выхода пенициллина было изучение условий
образования антибиотика.
Первая среда для глубинного образования пенициллина была разработана
Мойером и Кохиллом в 1946 г., в ее состав входил кукурузный экстракт, лактоза, NaN03, глюкоза, однозамещенный
фосфорнокислый калий и другие соли. Эта среда была основной, на ее базе были
разработаны среды, используемые при промышленном производстве пенициллина.
Очень много труда было затрачено на выяснение того состава питательных
сред, который обеспечивал бы наибольший выход пени-циллинов. Было подробно
изучено значение различных источников углерода и азота, влияние микроэлементов
и других факторов. Последний представляет собой побочный продукт производства
крахмала из кукурузы. Его приготовляют экстракцией кукурузы теплой водой. Было
найдено, что введение около 20 г крахмала на 1 л питательной среды резко
ускоряет образование пенициллинов и увеличивает их выход. Правда, данных о
широком применении последней пока не имеется.
Уже сравнительно давно было обнаружено, что введение в питательную среду
небольших количеств фенилуксусной кислоты или ее амида приводит к значительному
повышению выхода бензилпенициллина. Однако причины этого явления оставались
неизвестными. Это утверждение было обосновано приводимыми ниже
экспериментальными данными. Во-вторых, было выяснено, что введение в
питательную среду различных соединений, содержащих замещенные фенильные
остатки, ведет к образованию новых пенициллинов взлете, le1 При этом оказалось,
что в ацильных радикалах последних всегда содержатся те фенильные остатки,
которые имелись и в молекулах веществ, добавленных к питательной среде.
Натуральные (комплексные) среды, состоящие из природных соединений и
имеющие неопределенный химический состав (части зеленых растений, животные
ткани, солод, дрожжи, фрукты, овощи, навоз, почва и т. д.), содержат все
компоненты, необходимые для роста и развития микроорганизмов большинства
видов.[2] Используются следующие среды:
мясопептонная среда, в состав которой одновременно с мясным экстрактом и
пептоном входят хлорид натрия, фосфат калия, иногда глюкоза или сахароза;
используется обычно в лабораторной практике.
картофельные среды с глюкозой и пептоном, часто используемые в
лаборатории для культивирования многих видов актиномицетов и бактерий;
среды с кукурузным экстрактом, соевой мукой, бардой и другими веществами,
в состав которых входят сульфат аммония, карбонат кальция, фосфаты, глюкоза,
сахароза, лактоза или иные углеводы и ряд других соединений; среды успешно
применяются в промышленности, т. к. являются дешевыми и обеспечивают хорошее
развитие микроорганизмов с высоким выходом антибиотиков.
Продуцентами антибиотика пенициллина являются различные виды зеленой
плесени (Penicillium). Продуценты пенициллина выделяют в питательную среду
несколько близких по структуре антибиотиков (пенициллинов), отличающихся друг
от друга по активности. Наибольшее практическое значение среди них имеет
бензилпенициллин. В качестве лекарственных препаратов используются различные
соли бензилпенициллина, которые обладают неодинаковой растворимостью в воде.
Хорошо растворимые соли (натриевая и калиевая) являются препаратами короткого
действия, а плохо растворимые (новокаиновая соль и бициллины) - препаратами
длительного, или пролонгированного, действия. В последние годы в практику
внедрены препараты пенициллина, получаемые полусинтетическим путем, - так
называемые полусинтетические пенициллины (оксациллин, ампициллин и др.).[4]
4. Биохимическая роль
Пенициллины влияют на синтез клеточной стенки, а именно на синтез
пептидогликана. Синтез пептидогликана (гликопептида) очень сложен, фактически
он является одним из важнейших компонентов стенки - это арматура клеточной
стенки. Подобное явление наблюдается при выращивании микроорганизмов в
отсутствии незаменимых аминокислот, и прежде всего в отсутствии лизина или его
предшественника - диаминопимелиновой кислоты. И, если в непрерывный синтез
пептидогликана вмешивается β-лактамный антибиотик, то синтез
пептидогликана нарушается.(рис А,Б)
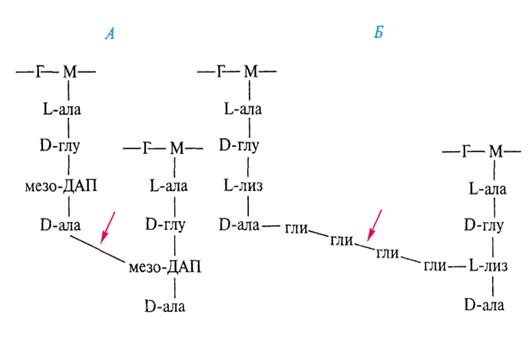
Рисунки А,Б. -Г - N-ацетилглюкозамин;
М- N-ацетилмурамовая кислота; ала -
аланин; глу - глутаминовая кислота; лиз - лизин; ДАП - диаминопимелиновая
кислота; глицирин. Стрелками обозначено место действия пенициллина.
Таким образом, основными компонентами клеточной стенки грамположительных
эубактерий являются три типа макромолекул: пептидогликан, тейховые кислоты и
полисахариды, которые с помощью ковалентных связей образуют сложную структуру с
весьма упорядоченной пространственной организацией. В состав клеточной стенки
эубактерий входят семь различных групп химических веществ, при этом
пептидогликан присутствует только в клеточной стенке. Клеточная стенка
цианобактерий, сходная с таковой грамотрицательных эубактерий, содержит от 20
до 50% этого гетерополимера.
Грамположительные бактерии отличаются от грамотрицательных большим (до 40
раз) содержанием муреина (пептидогликана) в клеточной стенке и отсутствием
внешней мембраны. Клеточная стенка- это высокоорганизованная клеточная
органелла является механически стабилизированной и противостоит высокому
осмотическому давлению, которое составляет от 2 до 25 атм.
Следствием существенных различий структуры клеточной оболочки у
грамположительных и грамотрицательных бактерий является получение разных
образований под действием агентов, нарушающих синтез пептидогликана. Например,
под действием пенициллина из грамположительных клеток образуется протопласт, не
несущий оболочки, а из грамотрицательных - сферопласт, имеющий остатки оболочки
на поверхности клетки. Клетки, утерявши клеточную стенку в результате мутации
или разрушающего воздействия, называются также L-формами и могут существовать только в изотонических
растворах.(рис.1)[21]

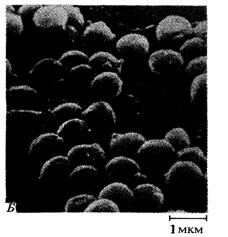
Рисунок 1. Действие пенициллина на клетки Staphylococcus aureus. А. Клетки до обработки пенициллином. Б. В результате
воздействия пенициллина нарушается целостность клеточных, и они лопаются.
Вся эта скрепленная поперечными связями структура, окружающая клетку,
называется муреином (от латинского слова murus - стенка) или пептидогликаном; второе название
подчеркивает гибридную природу данной структуры, представляющей собой сочетание
пептидных и полисахаридных элементов. Тянущийся непрерывно вдоль всей
поверхности бактериальной клетки пептидогликан можно рассматривать как одну
гигантскую мешковидную молекулу. У грамположительных бактерий (дающих окраску
по Граму, т.е. при обработке красителем кристаллическим фиолетовым)
пептидогликан образует вокруг клетки несколько концентрических слоев,
пронизываемых другими макромолекулярными компонентами. Целостность клеточных
стенок имеет жизненно важное значение для защиты, роста и деления бактерий.
5. Строение и свойства
Пенициллины представляют собой сложные соединения, содержащие в своих
молекулах тиазолидиновое и β-лактамное кольцо. Их общая структура
следущая(рис.2):
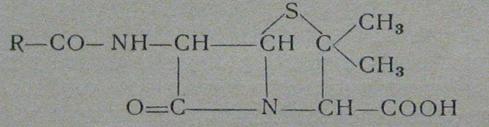
Рисунок 2
В представленной формуле радикал (R) может иметь различное строение. Поэтому известно большое
число типов пенициллинов, отличающихся друг от друга лишь алкильными группами.
Наиболее распространенными являются следующие типы пенициллинов, которые могут
быть получены в процессе ферментации. В отсутствие эффективного предшественника
тип образуемого пенициллина является функцией штамма гриба, и в этом случае,
как правило, образуется смесь нескольких пенициллинов. Из природных
пенициллинов наиболее изучен бензинпенициллин.
Антибиотик образует соли с различными катионами и другими веществами.
Так, известны натриевая, калиевая, кальциевая, цинковая, новокаиновая, N,N’- дибензил-этилендиаминовая (бицилин-1) и другие соли
бензилпенициллина. Неорганические соли хорошо растворимы в воде, метиловом и
этиловом спиртах, но не растворимы в безводных ацетоне, эфире, хлороформе и
различных сложных эфирах. Новокаиновая, N,N’-
дибензил-этилендиаминовая соли плохо растворимы в воде, в связи с чем на
практике их используют в виде суспензий. Чистые кристаллические соли
пенициллинов достаточно устойчивы при хранении (не менее 3 лет при комнатной
температуре). Натриевая соль, например, полностью разрушается лишь при
нагревании в течении 30 мин при 200° С.[5]
Пенициллины в виде чистых кислот менее устойчивы, и только
феноксиметилпенициллин отличается большой стабильностью из-за его низкой гигроскопичности
(он сохраняется до 1 года при температуре ниже 37°). Его новокаиновая соль
хорошо растворима в воде. Пенициллин неустойчив в присутствии ионов водорода и
быстро изомеризуется в биологически неактивную пенилловую кислоту, имеющую
следующее строение (рис.3):
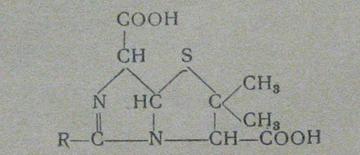
Рисунок 3
Образование пенилловой кислоты при рН 2-3 завершается через 3-4 часа при
комнатной температуре. Более устойчив в кислой среде феноксиметилпенициллин,
который по этой причине применяется в виде свободной кислоты. Щелочная реакция
среды тоже быстро инактивирует пенициллин. При комнатной температуре и рН 12,0
происходит разрыв β-лактамного кольца с образованием пенициллоиновой
кислоты (рис.4):
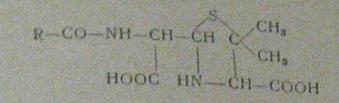
Рисунок 4
Названный продукт щелочного гидролиза не обладает антимикробной
активностью и не представляет интереса с практической точки зрения. Отсюда
следует, что необходимо остерегаться хранить пенициллин при рН выше 8,0. В
названной реакции отрицательную роль могут играть катионы цинка, меди и других
металлов. [2]
Пенициллоиновая кислота также образуется при действии фермента
пенициллиназы, продуцируемого различными грамположительными и
грамотрицательными бактериями. Реакция ферментативного гидролиза протекает
достаточно быстро при комнатной температуре и при нейтральной реакции среды.
Пенициллин инактивируется и при взаимодействии с первичными и вторичными
спиртами. Об этом следует помнить при использовании в виде растворителей
метанола и этанола (рис.5):
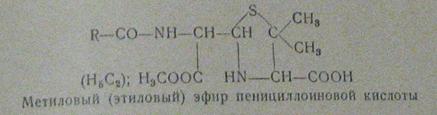
Рисунок 5
В этих реакциях катионы тяжелых металлов также проявляют себя
эффективными катализаторами. Появление все большего числа искусственно
резистентных штаммов микроорганизмов к пенициллину стимулировало работы по
созданию активных полусинтетических пенициллинов. В качестве продукта
биосинтеза пенициллина в 1959 г. была выделена 6-аминопенициллановая кислота
(6-АПК) (рис.6):
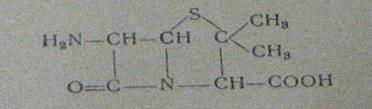
Рисунок 6
6.
Механизм биологического действия
Антибиотики пенициллиновой группы являются специфическими ингибиторами
биосинтеза клеточной стенки, а избирательность их действия на бактериальную
клетку определяется некоторыми особенностями строения клеточной стенки бактерий
по сравнению с животной. Оболочка бактериальной клетки характеризуется жесткой
структурой, обеспечивающей постоянство ее формы и защищающей от неблагоприятных
воздействий внешней среды.
Под влиянием бактериостатических концентраций антибиотика растущие клетки
перестают делиться, резко изменяется их морфология. Микробы значительно
увеличиваются, набухают или принимают удлиненную форму. Измененные клетки
распадаются с образованием мелких частиц и погибают. Наблюдается изменение
физических свойств бактериальных клеток: меняется заряд, электрофоретическая
подвижность, окислительно-восстановительный потенциал и др. Ослабляется
интенсивность окраски по Граму.
В основе антибактериального действия пенициллина лежит подавление синтеза
муреина - опорного полимера клеточной стенки. Клеточная стенка микробов
синтезируется в три стадии, включающие: синтез предшественников клеточной
оболочки - уридиннуклеотидов, утилизацию их и других субстратов с введением в
растущий муреин оболочки; образование поперечных связей между линейными цепями
муреина, осуществляемое посредством реакции транспептидации, в результате чего
две линейные цепи муреина связываются между собой при помощи межпептидного
мостика с отщеплением D-аланина.
Реакция транспептидации управляется специфическим энзимом - транспептидазой,
локализованной на наружной поверхности цитоплазматической мембраны. Пенициллин
тормозит последнюю стадию синтеза клеточной стенки, предотвращая образование
пептидных поперечных связей. Благодаря структурному сходству пенициллина с
пептидным субстратом клеточной стенки антибиотик конкурирует с ним за активный
центр транспептида- зы. Взаимодействие молекулы пенициллина с активным центром
фермента сопровождается образованием ковалентной связи и пенициллоильного
производного, реакция рассматривается как необратимая, а активный центр
фермента прочно блокируется.[7]
Пенициллин проявляет антибактериальное действие в период активного роста
бактерий. Наиболее сильно оно выражено в фазе логарифмического роста.
Морфологическим выражением этого эффекта является прекращение деления клеток,
их увеличение, возникновение гигантских форм, набухание или удлинение.
Измененные клетки локализируются и погибают.
Пенициллин действует бактерицидно в среде, поддерживающей размножение
микробов. Размножающиеся клетки гибнут под воздействием антибиотика из-за
несбалансированного роста вследствие того, что для растущей цитоплазмы «не
хватает» клеточной стенки, образование которой прекращено пенициллином. Одна
цитоплазматическая мембрана не является надежной защитой против вне- и
внутриклеточных различий осмотического давления и не в состоянии выполнить
функции цитоплазматического барьера. Лизис клетки наступает тем быстрее, чем
быстрее идет синтез цитоплазмы на фоне прекратившегося синтеза клеточной
оболочки. Утверждение, что пенициллин не действует на метаболизм не
размножающихся микробов, является не совсем точным. Наличие в среде источника
энергии и набора аминокислот, входящих в состав муреина, обеспечивает синтез
основной структуры клеточной стенки, но не белков цитоплазмы. Клетки не
делятся, но чувствительный к пенициллину процесс в них идет, антибиотик лишь
тормозит его, что, однако, не сопровождается гибелью клетки. Пенициллин резко
нарушает обменные процессы в чувствительных к нему микроорганизмах. Установлено
его тормозящее действие на обмен нуклеиновых кислот, окислительное дезаминирование
аминокислот, обмен пептидов и др. Однако большинство этих нарушений связано с
началом лизиса клетки и не является результатом первичного действия антибиотика
на метаболизм микробов. Избирательность действия бензилпенициллина
преимущественно на грамположительные микроорганизмы объясняется различиями,
существующими в строении их клеточной стенки и стенки грамотрицательных
бактерий. Несмотря на массивность клеточной стенки грамположительных микробов,
она свободно проницаема для таких небольших молекул.
Фармакокинетика
Бензилпенициллин,
карбоксипенициллины и уреидопенициллины в значительной степени разрушаются под
влиянием соляной кислоты желудочного сока, поэтому применяются только
парентерально. Феноксиметилпенициллин, оксациллин и аминопенициллины более
кислотоустойчивы и могут назначаться внутрь. Наилучшим всасыванием в ЖКТ
характеризуется амоксициллин (75% и более). Наиболее высокую степень всасывания
(93%) имеют специальные растворимые таблетки (флемоксин солютаб).
Биодоступность амоксициллина не зависит от приема пищи. Всасывание
феноксиметилпенициллина составляет 40-60% (при приеме натощак концентрации в
крови несколько выше). Хуже всасываются ампициллин (35-40%) и оксациллин
(25-30%), причем пища значительно уменьшает их биодоступность <#"605879.files/image010.jpg">
а Подготовка инокулята
Подготовка посевного материала включает следующие стадии:
) выращивание посевного мицелия 1-й генерации в аппаратах малой емкости
(инокуляторах);
) выращивание посевного мицелия 2-й генерации в аппаратах большой
емкости.
Споровая культура, используемая для засева инокулятора, выращивается на
пшене в стеклянных флаконах, высушивается и в таком виде хранится при комнатной
температуре. Засев производят сухими спорами из 2-3 флаконов.
Основной задачей при культивировании продуцента пенициллина в посевных
аппаратах на стадии подготовки инокулята является быстрое получение большой
массы мицелия, способного обеспечить при пересеве в ферментер интенсивный рост
и высокий выход антибиотика. Для осуществления этой задачи продуцент необходимо
выращивать на средах, богатых легкоусвояемыми питательными веществами, в
условиях хорошей аэрации, при оптимальной для роста микроорганизма температуре.
б Процесс ферментации
Ферментация является основной стадией в производстве пенициллина, на
которой формируется целевой продукт. В промышленности применяется метод
глубинной ферментации, при котором культура микроорганизма выращивается в
питательной среде, заполняя весь ее объем. У различных штаммов потребность в
источниках питания неодинакова. В связи с этим состав сред не является
постоянным и универсальным для всех продуцентов, образующих пенициллин, и
меняется с появлением новых штаммов.
Ферментационная среда должна быть составлена таким образом, чтобы
развивающаяся культура, потребляя питательные вещества и выделяя продукты
обмена, сама создавала необходимые условия и осуществляла переход от фазы роста
мицелия к фазе пенициллин образования. Желательно, чтобы вторая фаза была более
продолжительной и чтобы процесс ферментации прекращался до наступления
автолиза.
Для этого, как и при выращивании посевного материала необходимо
одновременное присутствие в среде как легко-, так и трудноусвояемого углевода.
Легкоусвояемый углевод обеспечивает быстрый рост и образование обильной биомассы;
трудноусвояемый углевод создает условия, благоприятные для биосинтеза
антибиотика.
Исключительно важную роль в обмене веществ клетки играет фосфор, который
необходим не только для нормального роста и развития гриба, но и для
осуществления самого процесса биосинтеза пенициллина. Для образования
пенициллина требуется значительно более высокая концентрация фосфора в среде,
чем для роста гриба.
Обязательным компонентом ферментационной среды является сера, входящая в
состав важнейших аминокислот и ферментов. Сера необходима еще и потому, что она
входит в состав молекулы пенициллина. В питательные среды сера вносится в виде
солей серной кислоты и гипосульфита.
Из других элементов, необходимых для нормальной жизнедеятельности гриба и
образования антибиотика, следует отметить калий, магний, цинк, железо,
марганец, медь.
Установкой для этапа ферментации является обычный ферментер. Он
представляет собой закрытый цилиндрический резервуар, в котором механически
перемешиваются среда и микроорганизмы. Через среду прокачивают воздух, иногда
насыщенный кислородом. Температура регулируется с помощью воды или пара,
пропускаемых по трубкам теплообменника. Такой ферментер с перемешиванием
используется в тех случаях, когда ферментативный процесс требует много
кислорода.(рис.7)
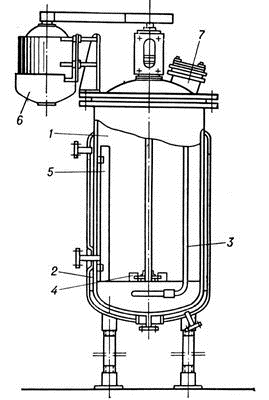
Рисунок 7. Ферментер
- корпус; 2 - паровая рубашка; 3 - барботёр; 4 - мешалка; 5 - отбойник; 6
- электропривод; 7 - загрузочный люк
Уровень качества оборудования непосредственно влияет на эффективность его
эксплуатации. Учитывая ключевое место ферментеров в технологической цепочке, их
качество определяет эффективность всего производственного процесса. Если
качество низкое, то резко возрастают простои оборудования в связи с ремонтом,
последующей наладкой, ревалидацией, очисткой и стерилизацией. В сложных
случаях, например, при выходе из строя важных узлов и деталей ферментера,
которые требуется закупать у поставщика, их ожидание может затянуться на
месяцы.
Соответствие требованиям GMP , как важного показателя качества,
исключительно важно. Причем, оно должно быть не по отдельным элементам, а
концептуальным. Это должно быть и соответствие требованиям GMP всех материалов,
контактирующих с продуктом, и применение автоматической мойки и стерилизации на
месте ( CIP / SIP ), и валидируемость ( IQ / OQ ), и документирование процесса
ферментации, и многое другое.
в Фильтрация
Обычно для отделения мицелия от культуральной жидкости применяют
вакуум-барабанные фильтры непрерывного действия. Фильтрацию начинают до начала
автолиза мицелия, поскольку при фильтрации автолизированной культуры мицелий не
образует плотной пленки на фильтрующей поверхности барабана, а налипает в виде
отдельных тонких комков, которые сами не отходят в зоне «отдувки» фильтра, и их
приходится удалять вручную. При этом продолжительность фильтрации увеличивается
в 2 - 3 раза, выход фильтрата резко падает, а сам фильтрат получается очень
мутным.
Необходимо тщательно соблюдать условия, препятствующие разрушению
пенициллина во время фильтрации, - охлаждение нативного раствора до 4-6°С и
систематическая (после каждой загрузки) обработка фильтра, коммуникаций и
сборников антисептиками, например хлорамином. Фильтр также должен
систематически стерилизоваться острым паром.
г Предварительная обработка нативного раствора
Очень важной характеристикой нативного раствора является содержание в нем
белковых веществ, определяемых осаждением трихлоруксусной кислотой или другим
соответствующим методом.
Применяется несколько способов предварительной обработки нативного
раствора с целью освобождения от белковых примесей: осаждение солями
многовалентных металлов (например, А13+ Fе3+ или Zn2+), коагуляция танином, термическая коагуляция при
температуре 60-75°С и рН 5,5 - 6,0, осаждение примесей катионными детергентами
типа четвертичных аммониевых оснований (например, цетилпиридиний-бромидом или
додецилтриметиламмонийхлоридом и т.п.). Применение этих методов приводит к
потерям антибиотика. Обычно в результате коагуляции и последующей фильтрации
или сепарирования теряется от 5 до 15%) пенициллина. При этом коагуляция солями
металлов позволяет удалять не более 50% общего количества белковых веществ.
д Экстракция и очистка пенициллина
Нативный раствор содержит 3-6% сухих веществ. На минеральные вещества
приходится 30-40% сухого остатка, от 15 до 30% приходится на пенициллин, а
остальное представляет сложную смесь органических веществ, включая белки,
полипептиды, низкомолекулярные азотистые соединения, углеводы, различные
органические кислоты и, в зависимости от штамма продуцента, то или иное
количество пигмента. Для выделения пенициллина из этой сложной смеси можно
пользоваться методами, основанными на адсорбции, экстракции или осаждении.
В промышленности извлечение активного вещества из нативного раствора
основано на экстракции не смешивающимся с водой растворителем при подавленной
диссоциации карбоксильной группы пенициллина. В растворитель, кроме
пенициллина, переходит большая часть органических кислот. Минеральные
загрязнения, большая часть азотистых соединений и других органических веществ
остаются в водной фазе, так что в результате экстракции чистота продукта
увеличивается в 4-6 раз.
К растворителям, применяемым для экстракции пенициллина, предъявляются
следующие основные требования:
) малая растворимость в воде;
) отсутствие взаимодействия с пенициллином;
) низкая упругость пара при температуре 5-30°С;
) возможность регенерации при температуре не выше 120 - 140°;
) низкая стоимость.
С учетом этих и ряда других показателей основными растворителями-экстрагентами
были приняты бутилацетат и амилацетат.
При экстракции пенициллина из нативного раствора образуются весьма
стойкие, трудноразделяемые эмульсин, что обусловлено наличием в нативном
растворе поверхностно-активных веществ. Это требует применения специальных
дезэмульгаторов. Обычно для этой цели применяют анионные детергенты, например
сульфированные жирные или нафтеновые кислоты. Обычно выбор детергента
определяется его доступностью и экономическими соображениями. Для разделения
эмульсии в экстракторах-сепараторах, как правило, достаточно добавлять к
нативному раствору 0,05-0,1% детергента.
На стадии экстракции пенициллина из нативного раствора используются либо
многоступенчатые экстракторы-сепараторы типа «Лувеста» и «Россия», либо двухступенчатая
схема экстрагирования (контактирование подкисленного нативного раствора с
бутилацетатом в специальных смесителях и разделение эмульсии на центробежных
сепараторах типа САЖ-3).
Для дальнейшей очистки пенициллин извлекают из буферного экстракта органическим
растворителем (чаще всего бутилацетатом или хлороформом) при рН 2,0. Процесс
ведется аналогично бутилацетатной экстракции из нативного раствора. Эта стадия
технологически оформляется также с применением многоступенчатых экстракционных
машин или осуществляется в виде двухступенчатой противоточной экстракции с
разделением фаз на сепараторах. Выход составляет около 86% от количества
пенициллина, содержащегося в нативном растворе.
Весь экстракционный процесс извлечения и химической очистки пенициллина проводится
по непрерывной схеме.
е Выделение кристаллических солей пенициллина
Наиболее надежным методом, обеспечивающим получение кристаллического
пенициллина хорошего качества, является выделение бензилпенициллина из
бутилацетатного экстракта в виде концентрированного водного раствора калиевой
соли с последующим упариванием воды с бутанолом под вакуумом, что приводит к
кристаллизации калиевой соли из бутилового спирта.
Важнейшим требованием, предъявляемым к получаемому сухому порошку
пенициллина, является его полная стерильность. Термическая обработка препарата
недостаточна. Стерильность может быть обеспечена лишь при проведении
заключительных стадий процесса в строго асептических условиях, исключающих
возможность заражения продукта микроорганизмами и их спорами. Поэтому, начиная
со стерилизующей фильтрации концентрата и бутанола, все операции проводятся в
изолированных стерильных помещениях и в стерильной аппаратуре. Для обеспечения
условий асептики осуществляется весь комплекс необходимых санитарных и технологических
мероприятий.
Перед регенерацией бутилацетат и бутанол, применяемые в процессе
выделения и химической очистке пенициллина, промывают раствором щелочей для
удаления примесей кислот (продуктов инактивации пенициллина, фенилуксусной
кислоты).
ж Экологические вопросы производства
Основные отходы, образующиеся в результате выделения и химической очистки
антибиотиков, следующие: отработанные нативные растворы, водные маточные и
промывные растворы, водные растворы кислот и щелочей после регенерации ионообменных
смол, отработанный активированный уголь, кубовые остатки после регенерации
растворителей. В этих отходах вредную долю составляют антибиотики и продукты их
деструкции, а также органические растворители.
Принципиальные задачи совершенствования технологии получения антибиотиков
из нативных растворов с точки зрения сокращения отходов производства
заключаются в повышении выхода целевых продуктов и тем самым снижении потерь
антибиотика, снижении расходов сырья на стадиях и повышении эффективности регенерации
органических растворителей.
Существенное снижение потерь антибиотиков в процессе их выделения может
быть достигнуто путем решения комплекса задач: усовершенствование процесса
ферментации с целью повышения качества культуральных жидкостей; проведение эффективной
очистки нативных растворов от примесей, затрудняющих процессы выделения
антибиотиков; сокращение числа технологических стадий; уменьшение длительности
процессов; использование эффективного высокопроизводительного оборудования.
Так, применение эффективной очистки и подготовки нативных растворов
пенициллина позволяет повысить концентрацию перерабатываемых нативных растворов
на 30-40% и открывает возможность применить сокращенную схему экстракционной
очистки антибиотика, что снижает примерно вдвое расход бутилацетата при
экстракции и активированного угля на очистку экстракта. При этом достигается
уменьшение потерь антибиотика на 15-30%, что соответственно снижает количество
поступающих в отходы антибиотика и продуктов деструкции.
Одной из важнейших проблем производства антибиотиков является утилизация
и обезвреживание мицелиальных отходов. Мицелиальные отходы образуются в
результате отделения жидкой фазы культуральной жидкости.
Часть образующихся мицелиальных отходов утилизируется в сельском хозяйстве.
Это мицелиальные массы продуцентов пенициллина, тетрациклина и
хлортетрациклина. Применение мицелиальных отходов для кормления крупного
рогатого скота увеличивает среднесуточные привесы на 16-58%. Расход кормов при
этом снижается на 10-30%.
Однако более двух третей образующегося мицелия утилизируется в отвалы,
систему сточных вод или сжигается, что нельзя назвать приемлемым как с позиции
загрязнения почв и загрузки очистных сооружений, так и с точки зрения
нерационального к этому типу отходов, содержащих достаточное количество ценных
веществ.
Основные газовые выбросы в атмосферу предприятий по производству
антибиотиков, содержащие вредные вещества, включают, кроме воздушных выбросов
общеобменной и местной вентиляции, технологические воздушные выбросы при биосинтезе
антибиотиков, выбросы котельных и некоторых других вспомогательных производств.
Различными способами очистки обеспечивается улавливание около 60% вредных
веществ, отходящих от всех источников загрязнения.
Газообразные вредные вещества состоят в основном из окиси углерода
(77,4%), сернистого газа (15,2%) и окислов азота (7,4%).
К специфическим для производства антибиотиков жидким и газообразным
продуктам относятся пары органических растворителей, составляющие 24,3% от
общей суммы выбрасываемых веществ.
Кроме того, в воздушных выбросах присутствует целый ряд примесей паров
различных веществ, составляющих 0,4% от общей суммы выбрасываемых в атмосферу
жидких и газообразных продуктов. Среди них преобладает хлористый водород, пары
соляной кислоты, формальдегид и трикрезол.
Неспецифические для производства антибиотиков твердые вещества в выбросах
улавливаются газопылеочистными установками на 90%, газообразные выбросы
котельных рассеиваются с помощью высоких труб. Специфические для производства
антибиотиков твердые веществ из воздушных выбросов на 92,5%, органические
растворители - на 10%, обезвреживается 5,4% от объема воздушных выбросов при
биосинтезе антибиотиков.[15]
.2 природные пенициллины
Природные пенициллины образуются в процессе роста Penicillium определенных видов и некоторых
других грибов. В культуральной жидкости продуцента обычно содержится несколько
пенициллинов, обладающих сходным химическим строением и биологическими
свойствами, отличающихся лишь радикалом (R) в боковой цепи. Среди природных пенициллинов наиболее
изучены следующие: пенициллин G,
пенициллин F, дигидропенициллнн F, пенициллин К, пенициллин X. Основой
молекулы всех пенициллинов является сложное гетероциклическое соединение -
6-аминопенициллановая кислота (6-АПК) (рис.8), состоящая из двух колец:
тиазолидинового и β-лактамного
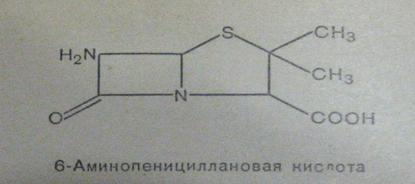
Рисунок 8
Несмотря на сходство физических, химических и биологических свойств, с
практической точки зрения природные пенициллины неравноценны. Наибольшую
ценность, среди них представляет бензилпенициллин (пенициллин G), наименьшую-п-гептилпенициллин
(пенициллин К), инактивирующийся в организме значительно быстрее других
пенициллинов.
Путем добавления в питательную среду веществ, используемых грибом для
построения ацильных радикалов молекулы пенициллина удается изменить процесс
биосинтеза, направив его в сторону образования практически наиболее ценного
антибиотика. Выпускаемый в настоящее время промышленностью препарат содержит в
основном бензилпенициллин.
Возможности направленного биосинтеза были использованы при получении
биосинтетических пенициллинов, отличающихся от бензилпе- нициллина по некоторым
биологическим свойствам. Среди многочисленных биосинтетических пенициллинов
практическое значение имеет феноксиметилпенициллин (пенициллин V), который
значительно более устойчив в кислой среде, чем остальные пенициллины.
Бензилпенициллин - антибиотик, открытие которого в 1928 г. A.Флеминг положило начало современной
антибиотикотерапии бактериальных инфекций. Уникальные свойства этого препарата
(высокая химиотерапевтическая эффективность, бактерицидность, низкая
токсичность и хорошая переносимость, медленное развитие устойчивости в процессе
лечения) выделяют его среди других антибиотиков. [1]
Среди многочисленных природных и биосинтетических пенициллинов в
медицинской практике применяют бензилпенициллин и его соли, а также устойчивый
к действию кислоты желудочного сока феноксиметилпенициллин. Биологические
свойства этих препаратов в связи с их сходством рассматриваются вместе.
Бензилпенициллин (рис.9)
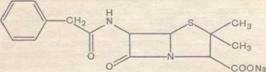
Рисунок 9
Бензилпенициллин - антибиотик, являющийся продуктом жизнедеятельности
различных видов плесневого гриба Penicillium. В настоящее время в производстве пенициллина используют высокоактивные
штаммы Penicillium chrysogenum.[2]
Физико-химические свойства. Строение радикала: R - С6Н5СН2. Суммарная формула: Ci6H18N204S. Молекулярная масса 334,38.
В химическом отношений бензилпенициллин представляет собой одноосновную
кислоту. Образует соли с неорганическими катионами (натрием, калием, кальцием,
аммонием и др.), органическими основаниями и некоторыми алкалоидами. В
медицинской практике применяется в виде калиевой, натриевой, новокаиновой и N,N'-дибензил- этилендиаминовой солей бензилпенициллина.
Бензилпенициллин в виде свободной кислоты плохо растворим в воде, хорошо
- в органических растворителях; нестоек, легко инактивируется в присутствии
влаги. Натриевая и калиевая соли бензилпенициллина хорошо растворимы в воде,
новокаиновая и особенно N,N'- дибензилэтилендиаминовая - очень
плохо, вследствие чего они применяются в виде суспензии.
Натриевая и калиевая соли бензилпенициллина. (рис.10)


Рисунок 10
Аморфные или кристаллические сыпучие порошки белого цвета, хорошо
растворимые в воде, эфире, ацетоне, алкоголе, плохо - в бензоле,
четыреххлористом углероде, диоксане, пиридине. Очищенные препараты натриевой и
калиевой солей бензилпенициллина устойчивы в виде порошков, не теряют активности
при комнатной температуре в течение 3 лет и более. При нагревании в вакууме до
153° С инактивируются в течение 25 ч, в воздухе до 170° С - в течение 1 ч.
Водные растворы натриевой и калиевой солей антибиотика мало стабильны.
Основной причиной нестойкости водных растворов является расщепление β-лактамного кольца бензилпенициллина
при действии воды. Процесс расщепления ускоряется с повышением температуры и рН
среды. Активность антибиотика снижается в присутствии кислот, щелочей, солей
тяжелых металлов и некоторых окислителей (перекись водорода и др.).
Феноксиметилпенициллин (рис.11)
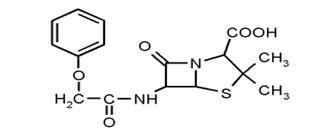
Рисунок 11
По химическому строению, отличается от бензилпенициллина наличием в
молекуле феноксиметильной группы вместо бензильной; отличается от
бензилпенициллина кислотоустойчивостью, что делает его пригодным для применения
внутрь. Не разрушается кислотой желудочного сока; хорошо всасывается из
желудочно-кишечного тракта и создает высокую и более длительную концентрацию
пенициллина в крови. Под действием пенициллиназы феноксиметилпенициллин
разрушается. Применают феноксиметилпенициллин при лечении инфекционных
заболеваний, вызванных чувствительными к пенициллину микроорганизмами.
Назначают его главным образом при инфекциях средней тяжести. Препарат
используют с профилактической целью при вспышках скарлатины, при ангине, после
тонзиллэктомий, для профилактики ревматических атак, а также при дифтерийном
носительстве. При гонорее феноксиметилпенициллин менее эффективен, чем
препараты пенициллина, вводимые парентерально. Для лечения больных сифилисом
(детей и взрослых) его используют в случаях, если затруднено применение
препаратов пенициллина в виде инъекций, при этом препарат назначают внутрь в
дозах, превышающих вдвое дозы пенициллина при парентеральном введении.
Назначают феноксиметилпенициллин внутрь в виде таблеток или суспензии.
.3 полусинтетический метод
Бензилпенициллин, получаемый биосинтетическим путем, и многочисленные
препараты, созданные на его основе, продолжают оставаться высокоэффективными и
наиболее широко применяемыми антибиотиками. Бактерицидный тип действия, высокая
активность в организме больного в сочетании с низким уровнем токсичности
позволяют рассматривать бензилпенициллин как один из идеальных
химиотерапевтических препаратов.
Однако некоторые особенности химического строения бензилпени- циллина
ограничивают его терапевтические возможности. Входящее в молекулу антибиотика β-лактамное кольцо может легко
разрушаться с полной потерей антимикробной активности. С точки зрения
клинической практики наибольшее значение имеет разрыв β-лактамного кольца молекулы
пенициллина под влиянием фермента пенициллиназы (β-лактамазы), которая образуется
многими штаммами грамположительных и грамотрицательных микроорганизмов.
Наиболее часто пенициллиназо-образующие штаммы (разрушающие бензилпенициллин)
обнаруживаются среди стафилококков, которые составляют до 80% всех возбудителей
гнойных процессов различной локализации.
Распространение устойчивых к пенициллину микроорганизмов вызвало необходимость
создания новых «резервных» химиотерапевтических веществ. Такими «резервными»
препаратами являются макролиды (эритромицин, олеандомицин), ристомицин,
ванкомицин, фузидин, линкомицин и др., рассматриваемые в соответствующих
разделах данного справочника.
Другой группой эффективных препаратов резерва являются так называемые
полусинтетические (новые) пенициллины. Их создание стало возможным благодаря
выделению в 1957 г. «ядра» пенициллина - 6- аминопенициллановой кислоты
(6-АПК), на основе которой синтезировано множество пенициллинов, обладающих
новыми ценными для медицинской практики свойствами. Полусинтетические
пенициллины, сохраняя основные преимущества бензилпенициллина (бактерицидность,
низкий уровень токсичности), приобрели новые дополнительные свойства, основным
из которых является кислотоустойчивость, устойчивость к действию β-лактамаз, продуцируемых
резистентными штаммами микроорганизмов, расширение спектра антибактериального
действия. В соответствии с этим современные полусинтетические пенициллины
распределяются на 4 основные группы.[18]
1)Кислотоустойчивые препараты, инактивируемые пенициллиназой.
2)Пенициллиназоустойчивые препараты:
а)некислотоустойчивые,
б)кислотоустойчивые.
3)Препараты широкого спектра действия.
)Препараты с преимущественной активностью в отношении грам- отрицательных
бактерий.
В первую группу входят полусинтетические пенициллины, обладающие, подобно
феноксиметилпенициллину, кислотоустойчивостью: фенетициллин, пропициллин и
фенбенициллин. Эти полусинтетические препараты, предназначенные для
перорального введения, характеризуются антибактериальным спектром, аналогичным
таковому бензилпенициллина и феноксиметилпенициллина. Они неактивны в отношении
микроорганизмов, образующих пенициллиназу. Область применения полусннтетических
пенициллинов этой группы ограничена. Практически они не имеют преимуществ перед
феноксиметилпенициллином.
Основными представителями третьей группы полусинтетических пенициллинов
являются ампициллин, карбенициллин и их производные. Эти антибиотики широкого
спектра действия обладают уникальными свойствами- активностью в отношении ряда
грамотрицательных микроорганизмов при сохранении бактерицидного типа действия и
низкой токсичности, свойственных бензилпенициллину. Основной особенностью
пенициллинов четвертой группы является спектр действия, ограниченный лишь
грамотрицательными бактериями: Escherichia coli, Proteus spp., Klebsiella spp. и др., в
отношении которых они высокоактивны Эти препараты малоактивны в отношении
кокковых форм микроорганизмов. Ниже дана характеристика основных
полусинтетических пенициллинов.
Метициллин (рис.12)
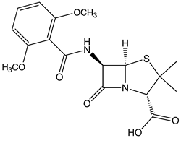 Рисунок 12
Рисунок 12
Суммарная формула: С17Н 19N 2Na06S-H 20. Молекулярная
масса 420,4. Белый кристаллический порошок, хорошо растворимый в воде. Водный
раствор соломенно-желтого цвета, прозрачный, нейтральной реакции. Стерильный
сухой порошок сохраняет активность при нагревании до 110° С в течение 3 ч, при
нагревании до 150° С быстро разрушается. Нейтральные незабуференные растворы
метициллина теряют около 20% активности за 7 дней при 5° С и за 2 дня при 23°
С. При рН 2,0 в течение 20 мин инактивируется 50% препарата. Ввиду неустойчивости
в кислой среде не может применяться внутрь.
Антимикробное действие. Метициллин устойчив к действию стафилококковой
пенициллиназы и характеризуется практически одинаковой активностью в отношении
штаммов стафилококков, образующих и не образующих пенициллиназу. В отношении
большинства штаммов этого микроорганизма МПК антибиотика колеблется в пределах
0,4-6,2 мкг/мл. Антибактериальный спектр метициллина включает также
пневмококки, стрептококки, менингококки, гонококки, палочку сибирской язвы,
возбудителя дифтерии и некоторые другие грамположительные микроорганизмы.
Препарат неактивен в отношении большинства грамот- рицательных бактерий (Escherichia coli, Proteus,
Salmonella, Shigella). Практически идентичный по спектру
антимикробного действия бензилпе- нициллину, он отличается от него меньшей
активностью в отношении пенициллиназонегативных стафилококков (в 50 раз).
Метициллин обладает бактерицидным действием. Активность метициллина в
отношении устойчивых стафилококков при увеличении микробной нагрузки почти не
уменьшается, в то время как активность бензилпенициллина в этих условиях резко
снижается.
Ампициллин (рис.13)
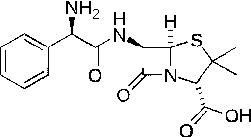
Рисунок 13
Ампициллин - кислотоустойчивый пенициллин с широким спектром действия,
разрушается пенициллиназой. В отличие от других пенициллинов, активен в
отношении грамотрицательных микробов. Спектр действия его более широкий, чем
бензилпенициллина. Он активен в отношении кишечных палочек, сальмонелл, палочек
инфлюэнцы, протея (Paton, 1964). Не
действует на штаммы, продуцирующие пенициллиназу, на культуры синегнойной
палочки, на Aerobacter aerogenes, на капсульные бактерии.
Ампициллин плохо растворим, поэтому парентеральное введение его
затруднено. При приеме внутрь наиболее высокая концентрация ампициллина в крови
достигается через 1,5-2 ч, в течение 6 ч с мочой выделяется в активном виде
около 35% принятого. Препарат не токсичен, иногда вызывает аллергические
высыпания, чаще уртикарные. У некоторых больных отмечались тошнота, рвота,
диарея. Ампициллин оказался полезным для лечения заболеваний дыхательных путей,
долевых и очаговых пневмоний, инфекционных заболеваний мочевых и желчных путей;
при этом наблюдались благоприятные результаты у большинства больных.
Велось наблюдение и выяснилось, что благоприятное влияние ампициллина у
брюшнотифозных бактерионосителей, до того безуспешно лечившихся многими другими
антибиотиками и сульфаниламидами. Небольшое количество наблюдений пока еще не
позволяет в должной мере оценить перспективность применения ампициллина для борьбы
с носительством тифозных микроорганизмов.
Оксациллин (рис.14)
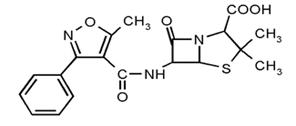
Рисунок 14
Оксациллин - устойчив к действию пенициллиназы и не разрушается
кислотами. Антибактериальный спектр действия такой же, как и пенициллина, но он
активно действует на устойчивые к пенициллину штаммы стрептококков,
пневмококков и стафилококков; не активен в отношении энтерококков и
грамотрицательных бактерий. Оксациллин активнее всех других пенициллинов в
отношении стафилококков, образующих пенициллиназу, воздействует на них
бактерицидно (Anhagen и соавт., 1962). Он активен в
отношении стафилококков, резистентных к другим антибиотикам как in vitro, так и в организме больных. Легко переносится
животными и человеком, хорошо проникает в ткани и органы, но, к сожалению, не
попадает в спинномозговую жидкость.Оксациллин хорошо всасывается при приеме
внутрь, довольно быстро (20-30 мин) поступает в кровь, больше других
пенициллинов связывается с белками сыворотки, сохраняя свою антибактериальную
активность.[2]
Бензатинпенициллин (рис.15)
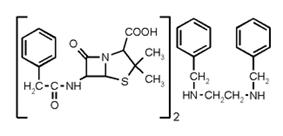
Рисунок 15
Одной инъекцией бензатинпенициллина обеспечивается концентрация
пенициллина 0,08 ЕД 1 мл в течение 14 дней, в более низкой концентрации
пенициллин обнаруживается в сыворотке до 3-4 недель. У некоторых больных
наблюдаются болевые ощущения на месте инъекции, головокружение, обильное
потоотделение, аллергические явления. Препарат в силу своей слабой
растворимости медленно всасывается. Необходимый уровень в крови поддерживается 1-2
инъекциями в день.
Пеперациллин (рис.16)
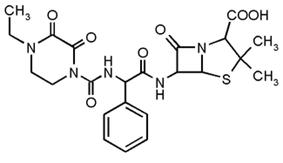
Рисунок 16
Антибиотик широкого спектра действия для парентерального применения.
Действует бактерицидно (блокирует транспептидазу, нарушает синтез
пептидогликана клеточной стенки, вызывает лизис микроорганизмов). Обладает
широким спектром действия, активен в отношении грамположительных и
грамотрицательных микроорганизмов, облигатных анаэробов, бактероидов,
клостридий. Действие распространяется на Escherichia coli, Proteus mirabilis, Proteus vulgaris, Morganella
morganii, Providencia rettgeri, Serratia spp., Klebsiella spp. (в т.ч. Klebsiella pneumoniae),
Enterobacter spp., Citrobacter spp., Salmonella spp., Shigella spp.,
Pseudomonas aeruginosa, Acinetobacter spp., Haemophilus influenzae (непенициллиназообразующие), Neisseria gonorrhoeae,
Neisseria meningitidis, Moraxella spp., Yersinia spp.; умеренно активен
против стрептококков группы D (включая Enterococcus), бета-гемолитических стрептококков (включая Streptococcus pyogenes, Streptococcus
agalactiae), Streptococcus pneumoniae, Streptococcus viridans, Staphylococcus
aureus (непенициллиназообразующие), Staphylococcus
epidermidis (непенициллиназообразующие), Actinomyces,
Bacteroides, Clostridium, Eubacter, Fusobacterium, Peptococcus,
Peptostreptococcus, Veillonella. Разрушается бета-лактамазами стафилококков и некоторых
грамотрицательных бактерий, но активен в отношении Neisseria gonorrhoeae,
продуцирующих β-лактамазу.[11]
7.4 методы выделения антибиотиков
Насбаумер разделил пенициллины после кислотного гидролиза. Анализируя
продукт разложения пенициллина, он исследовал влияние 40 различных компонентов
на идентификацию пенициллияов методом ТСХ. Этот же автор изучил возможность
спектрофотометрического определения пенициллинов в различных фармацевтических
препаратах. Прямому анализу этих антибиотиков мешают полиэтиленгликоли и
стеараты натрия, однако предварительное разделение методом ТСХ позволяет
отделить пенициллины от мешающих анализу соединений. Слои для
хроматографического разделения приготавливают так: смешивают 20 % рисового
крахмала с силикагелем G в фосфатном буфере (рН 5,8). Элюирование проводят
смесью бутилацетат-н-бутанол-уксусная кислота-фосфатный буфер (рН 5,8) -
метанол (80 : 15 : 40 : 24 : 5).
Мак-Гильверей и Стрикленд разделили группу пенициллинов на слоях
целлюлозы MN 300 и на слоях силикагеля G. Для разделения ампициллина и
гетациллина на слоях силикагеля вполне пригодна также смесь ацетонускусная
кислота. Эти системы не позволяют отделить диклоксациллин от нафциллина или
фенициллин от феноксиметилпенициллина. Нафциллин можно обнаружить по
интенсивной желтой окраске, которую он дает с 50 %-ной серной кислотой. Кроме
нафциллина желтую окраску дает только метициллин, но у него другая величина Rf.
Биаджи и др. исследовали влияние рН на разделение методом ТСХ с обращением фаз
пенициллинов и сефалоспоринов. Экстраполированные величины RM для пенициллинов
приведены в табл. 18.6. Аутергофф и Кинцлер делили пенициллины на силикагеле G,
элюируя пробу смесью бензол-этилформиат- муравьиная кислота (80:15:6). Продукты
расщепления окса-циллина и феноксиметилпенициллина были проанализированы
хроматографически Корчагиным и сотрудниками . Вандамм и Фоетс использовали 4
следующие смеси растворителей при разделении продуктов спонтанного химического
и ферментативного разложения пенициллинов и двух цефалоспоринов на силикагеле
G: н-бутанол-вода-этанол-уксусная кислота (5:2:1,5:1,5),
н-бутанол-вода-уксусная кислота (4:1:1), ацетон-уксусная кислота (19:1) и 85
%-ный ацетон.[23]
Манни и другие применили метод измерения отражательной способности in
situ для определения натрийпенициллина G в фармацевтических препаратах. После
хроматографического разделения на силикагеле со смесью
ацетон-хлороформ-уксусная кислота (10:9: 1) авторы измеряли отражательную
способность пятен в области 230 нм. Стандартное отклонение составило 5% для
зон, содержавших 1 мкг пробы, и 1,5% для зон, содержавших 10 мкг. Синсхаймер и
др. определяли флуоресцентным методом in situ следы пенициллина.
Бензил-пенициллин гидролизовали пенициллиназой, подвергали затем
хроматографическому разделению на силикагеле G со смесью
диметилформамид-хлороформ-28 %-ный аммиак (10:5:4) и измеряли при 510 нм
интенсивность флуоресценции пятна с Rf 0,50 (длина волны возбуждающего
излучения составляла 410 нм). Интенсивность флуоресценции пятен
феноксиметил-пенициллина, полученного в результате гидролиза (Rf 0,88),
измеряли в области 480 ом при длине волны возбуждающего излучения 260 нм.
Метициллин гидролизовали и измеряли интенсивность флуоресценции пятна с Rf 0,73
при 480 нм при возбуждающем излучении 350 нм. Пределы чувствительности в
перечисленных выше определениях равны 3, 0,76 и 0,12 мкг соответственно.
Пенициллановую кислоту определяли методом флуоресцентной денситометрии пятна с
Rf 0,45 при 440 нм с возбуждением при 350 нм. В этом случае после разделения на
силикагеле смесью хлороформ-этилацетат-муравьиная кислота (60:40: 1) пластинку
выдерживали 3 мин в парах аммиака, чтобы образовался флуоресцирующий продукт.
Полуколичественное определение пенициллинов и продуктов их превращения
проводили визуально, сравнивая размеры пятен и их окраску .
.5 динамика получения
Общепризнанно, что приоритет в промышленном производстве пенициллина - за
США. Там, не тратя времени на освоение выращивания продуцента на поверхности
культуральной среды, бросили все ресурсы на создание крупных производств,
использующих глубинное (по всему объему среды) выращивание гриба в огромных
баках. И пенициллин - продукт «скромной» плесени, с которой ранее стремились
скорее бороться, чем культивировать, - чудесно оделся в одежду заводов
стоимостью в $20 млн.
Цифры роста производства пенициллина в США впечатляли: июнь 1943 г. - 0,4
млрд ед., сентябрь 1943 г. - 1,8 млрд ед., декабрь 1943 г. - 9,2 млрд ед., март
1944 г. - 40 млрд ед. и т.д. Таким образом за 1943г. производство составило 21
млрд. ед., 1944 г. - 60,3 млрд.ед. Промышленность обеспечивала пенициллином не
только армию США, но и армии союзников, за 1945 г. было произведено 70,5
млрд.ед, что дало разрешению продавать его в аптеках.
Англия - родина пенициллина - намного отставала от лидера: США давали за
прошлый год 90 % всей мировой продукции пенициллина, которая составила 1600
млрд ед.[24]
Что касается СССР, то здесь в начале 1944 г. ежемесячно производилось от
20 до 40 млн ед. пенициллина (в 1000 раз меньше, чем в США).(диагр 1)..
А что касается настоящего времени, то в 2008 г. объем потребления
антибиотиков пенициллинового ряда составил в натуральном исчислении 367 631 кг,
сократившись по сравнению с показателем за предшествующий год на 6,6%. По
данным IMS Health, в 2010 г. объем реализации полусинтетических пенициллинов
составил 5,1 млрд. руб., что превысило прошлогодний уровень на 12,4%. Однако в
натуральных объемах рынок сократился на 7,7% - до 57,8 млн. упаковок. А природных
пенициллинов - в 2010 г. объем сократился на 8,6% в натуральном и на 11,7% в
стоимостном выражении, составив 23 млн. упаковок на сумму 126,2 млн. руб.
(табл.1).
8. Достоинства и недостатки методов
Пенициллины являются первыми антимикробными препаратами, разработанные на
основе продуктов жизнедеятельности микроорганизмов.
Достоинством природных и полусинтетических пенициллинов является то, что
им свойственны высокая химиотерапевтическая эффективность и избирательность
антимикробного эффекта. Действие направлено на мишени в клетках
микроорганизмов, отсутствующие у животных клеток; эффект антибиотиков является
высокоизбирательным, что приближает их к идеальным препаратам. Антимикробный
эффект препаратов сходен с действием физиологически активных веществ, обеспечивающих
иммунные реакции организма. [25]
Так же одними из главных достоинств пенициллинов являются мощное
бактерицидное действие в отношении ряда клинически значимых возбудителей
(стрептококки, низкая токсичность и низкая стоимость.
К недостаткам природных пенициллинов относят возможность развития
аллергических реакций, быстрое выведение из организмов. Благодаря созданию
полусинтетических пенициллинов были приобретены преимущества по спектру
действия, фармакокинетике и другим важным для практики свойствам. Но и у
полусинтетических пенициллинов есть свои недостатки: приобретенная
резистентность стафилококков, пневмококков, гонококков, бактероидов. Например,
ампициллин менее активен в отношении грамположительных бактерий, чем
бензилпенициллин. Недостатком ампициллина является то, что он разрушается
ферментом пенициллиназой, которую могут вырабатывать некоторые виды
стафилококков.
9. Методы оценки антибиотической активности
Методы оценки антибиотической активности основан на способности
антибиотиков угнетать рост микроорганизмов. Активность исследуемого антибиотика
оценивают путем сравнения угнетения роста чувствительных микроорганизмов,
вызванного известными концентрациями исследуемого антибиотика и
государственного стандартного образца данного антибиотика.
Существует две разновидности определения активности антибиотиков:
метод дифуззи в агар;
турбидиметрический метод.
Метод диффузии проводят на твердых средах. Среды засеивают определенным
количеством указанных в НД тест-микроорганизмов. Далее на поверхность среды
наносится раствор исследуемого антибиотика и стандартного образца. После
инкубирования в течении определенного времени измеряют диаметр зон угнетения
ромта тест-микроорганизмов, вызванного исследуемым антибиотиком.
Определение активности антибиотиков турбидиметрическим методом проводится
аналогично, но в жидкой среде, находящейся в пробирке. О степени угнетения
роста микроогранизма судят по величине мутности среды. Многие антибиотики
являются смесями веществ, поэтому для характеристики содержания действующего
вещества в образце антибиотика, кроме обычных параметров(масса, массовая доля)
используют единицы действия (ЕД)- минимальная масса антибиотика, которая
подавляет развитие тест-микроорганизма в определенном объеме питательной среды.
Вопросу рассмотрения антибиотической активности
пенициллина в отношении ряда микробов уделено довольно много внимания.
Установлено, что пенициллин оказывает антимикробное действие в отношении неких
грамположительных бактерий (стафиллококков, стрептококков, диплококков и неких
остальных) и фактически неактивен в отношении грамотрицательных видов и
дрожжей.
Высокие концентрации пенициллина (10 мг/мл) вызывают гибель клеток
гаплоидного штамма дрожжей Saccharomyces cerevisiae и E. coli (Lingel,
oltmanns, 1963).По нраву действия на мельчайшие организмы пенициллин является
бактериостатическим и при определенных концентрациях антибактериальным
антибиотиком.
N-гептилпенициллин менее активен, чем остальные типы
пенициллинов. Это, по-видимому, соединено с тем, что n-гептилпенициллин
значительно быстрее инактивируется в организме. Чувствительные к пенициллину
микроорганизмы относительно просто и быстро приобретают устойчивость к
антибиотику. Так, Staph. aureus прекращает развитие при концентрации
пенициллина 0,05 - 0,06 ед/мл в среде, но уже при 20 поочередных пересевах с
постепенно увеличивающимися концентрациями антибиотика устойчивость
стафилококка растет в 700 раз, т.е. для остановки роста бактерии требуется
концентрация пенициллина равная 42 ед/мл, а после 40 пересевов его устойчивость
растет более чем в 5500 раз.[16]
Микроорганизмы, приобретшие устойчивость к одному из
типов пенициллина, как правило, резистентны и к другим типам пенициллина.У
некоторых бактерий устойчивость к пенициллинам сопровождается способностью
образовывать пенициллиназу. В ряде случаев микроорганизмы с приобретением
стойкости к пенициллину теряют вирулентность. Но вирулентность
восстанавливается опосля нескольких пассажей через звериных и при этом
сохраняется резистентность к антибиотикам.
10. Контроль качества
В контроле качества антибиотиков учитывают такие параметры, как:
)Внешний вид и растворимость.
Пенициллины представляют собой твердые вещества белого цвета.
Растворимость в воде и других растворителях зависит от того, в какой форме
(кислотной или солевой) находится вещество и от природы катиона, входящего в
состав солевой формы. Все эти показатели приведены в таблице (табл.2).
Кислотные формы пенициллинов незначительно растворимы в воде и
применяются в виде таблеток или суспензий. Солевые формы (за исключением
новокаиновой и бензатиновой солей пенициллина) легко или очень легко растворимы
в воде и выпускаются в виде порошков для приготовления раствором для инъекций.
Бензатиновая соль пенициллина очень мало растворима в воде и вводится
внутримышечно в виде суспензии. Она медленно всасывается из места введения, что
обеспечивает пролонгированное действие лекарственного вещества (вводится 1 раз
в неделю).
)Прозрачность и цветность.
Данный показатель определяется для многих пенициллинов. Водне растворы растворимых
солевых форм антибиотиков должны быть прозрачны. Для определения цветности у
некоторых пенициллинов (натривые соли ампициллина, амоксициллина) измеряют
оптическую плотность раствора при 430нм. Она не должна быть большей данной
велечины.
)рН растворов.
Устойчивость пенициллинов зависит от рН, поэтому определение данного
показателя является обязательным при контроле качества субстанций пенициллинов
(табл.3). Водные растворы солей бензилпенициллина, карбенициллина, оксаллицина
и пиперациллина имеют среду близкую к нейтральной, кислотных форм пенициллинов
(феноксиметилпенициллина и, в меньшей степени, ампициллина ) - кислую, а
натриевых солей ампициллина и амоксициллина - щелочную.
)Родственные соединения.
В качестве родственных соединений в субстанциях пенициллинов могут
содержаться:
другие пенициллины (например, бензилпенициллин в
феноксиметилпенициллине);
6-аминопенициллановая кислота;
кислота, ацильный остаток, который входит в состав молекулы пенициллина
(например, фенилуксусная кислота для бензилпенициллина, фенилмалоновая для
карбоксиметилпенициллина);
продукты разрушения пенициллинов - соответствующие пенициллоиновые,
пениллоиновые и пенилловые кислоты;
-
другие вещества, специфические для определенного пенициллина (например,
4-гидроксифеноксиметилпенициллин для феноноксипенициллина, продукты
взаимодействия -N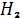
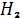 и -COOH
групп для ампициллина, пиперациллина и др.).
и -COOH
групп для ампициллина, пиперациллина и др.).
Определение
примесей родственных соединений происходит методом ВЭЖХ-наиболее эффективный
метод анализа органических проб сложного состава. Задача разделения решается
при помощи хроматографической колонки, которая представляет собой трубку,
заполненную сорбентом. При проведении анализа через хроматографическую колонку подают
жидкость (элюент) определенного состава с постоянной скоростью. В этот поток
вводят точно отмеренную дозу пробы. Компоненты пробы, введенной в
хроматографическую колонку, из-за их разного сродства к сорбенту колонки
двигаются по ней с различными скоростями и достигают детектора последовательно
в разные моменты времени.
Таким
образом, хроматографическая колонка отвечает за селективность и эффективность
разделения компонентов. Подбирая различные типы колонок можно управлять
степенью разделения анализируемых веществ. Идентификация соединений
осуществляется по их времени удерживания. Количественное определение каждого из
компонентов рассчитывают, исходя из величины аналитического сигнала,
измеренного с помощью детектора, подключенного к выходу хроматографической
колонки.
)Вода
или потеря в массе при высушивании.
Данный
показатель определяют для всех пенициллинов. Наименьшее содержание воды
характерно для феноксиметилпенициллина, нибольше - для ампициллина тригидрата.
Данные
показатели определяют для пенициллинов, которые применяются парентерально
(натриевые соли полусинтетических пенициллинов, все соли бензилпенициллина).
Исследуемые пенициллины должны соответствовать испытанию на стерильность, а
содержание эндотоксинов в них не должно превышать определенной величины.
11.
Перспективы развития производства пенициллинов
С каждым годом снижается экспортная активность на рынке пенициллинов.
Несмотря на насыщение рынка, объемы импортных поставок ежегодно увеличиваются
(в 2006 г. прирост составил 18,7% по сравнению с 2005 г.), это происходит за
счет того, что мировые производители могут предложить российскому рынку
пенициллины нового поколения, к которым еще не сформировалась резистентность.
Появление новых более эффективных антибиотиков приводит к сокращению
объемов потребления данных групп антимикробных препаратов. Спрос на данную
продукцию не имеет пропорциональной зависимости от динамики развития отраслей
потребления, объем и структура спроса на медикаменты в большинстве случаев не
зависит от предпочтений конечных потребителей.
Согласно прогнозу, построенному на основе метода экстраполяции и
учитывающему тенденции и особенности, свойственные российскому рынку
антибиотиков пенициллинового ряда, к 2015 году объем потребления антибиотиков
сократится до 246 589 кг или на 32,9% по сравнению с 2006 г.[23]
Заключение
Пенициллин ознаменовал новую эру в медицине. Его открытие имеет огромное
значение для всего человечества. Спасенные им жизни насчитывают сотни и даже
тысячи миллиардов. И все это благодаря Александру Флемингу. Этому человеку
удалось совершить то, что не удавалось никому: открыть чудодейственную лечебную
силу природы. Эта сила смогла остановить стремительное распространение самой
опасной разновидности гриппа в то время; смогла вылечить безнадежных больных от
пневмонии. Нельзя не упомянуть ее роли в спасении солдат и не только во время
второй мировой войны, но и во время войн в Персидском заливе. Пенициллин -
спаситель человечества. Благодаря ему многие болезни XX века перешли из разряда
неизлечимых. Однажды пенициллин сумел остановить поголовное вымирание кур во
Франции в 70-х годах от холеры. Флеминг писал:
«Пенициллин - это дело всей моей жизни… когда я видел глаза
выздоровевших, то не мог удержаться от слез. Я благодарю Бога за то, что он
даровал мне эту радость: спасать жизни людей, за то, что он открыл мне
величайшую тайну природы: пенициллин. Те, кто будет читать мои воспоминания
должен понять - я не считаю себя первооткрывателем, но тем не менее не хочу
отдавать кому-то радость спасения человеческих жизней…Пенициллин - надежда
человечества…».
Пенициллин - это продукт жизнедеятельности различных видов плесневого
грибка Penicillium notatum, Penicilium chrysogenum и др.; является одним из
главных представителей группы антибиотиков. Препарат обладает широким спектром
бактериостатического и бактерицидного действия.
Особенно чувствительны к пенициллину стрептококки, пневмококки,
гонококки, менингококки, возбудители столбняка, газовой гангрены, сибирской
язвы, дифтерии, отдельные штаммы патогенных стафилококков и протея. Пенициллин
неэффективен в отношении бактерий кишечно-тифозно-дизентерийной группы,
туберкулёзных, коклюшных и синегнойных палочек, возбудителей бруцеллёза,
туляремии, холеры, чумы, а также вирусов, грибков и простейших.
По официальным данным уже сегодня 60% микробов абсолютно не чувствительны
к основным антибактериальным препаратам. По этой причине в больницах США
ежегодно умирает около 14 тысяч человек. Антибиотики убивают сильные микробы,
но и оставляют слабые, которые перерождаются и превращаются в более развитые.
Отсюда выводы:
нужно лечиться антибиотиками строго по показаниям. Обычная простуда не
требует назначения антибиотиков, ведь против вирусов они бессильны.
нельзя лечиться по старым схемам. Устойчивость бактерий постоянно растет.
Можно не вылечить инфекцию, но при этом разрушить баланс нормальной микрофлоры.
В результате расплодятся “неправильные” бактерии и грибы.
Список используемых источников
1. Навашкин
С.М., Фомин ИП. «Рациональная антибиотикотерапия» (справоник), изд. Медицина,
1982 г.
. Егоров
Н.С. «Основы учения об антибиотиках», учеб. для студентов спец. ун-тов,4- изд
перераб. и доп., М.: высш.шк. 1986 г.
. Машковскнм
М.Д. Лекарственные средства. - М.; Медицина, 1998.
. Кукес
В.Г. Клиническая фармакология. - М: ГЭОТАР МЕДИЦИНА, 1999 г.
. Кашкин
П.Н.»Антибиотики», изд. Медицина, Ленинградское отделение, 1984 г.
6. Кирхнер
Ю.Тонкослойная хроматография т.1.М.: «МИР» 1981 г.
7. Глущенко
Н.Н. и др. Фармацевтическая химия. - М.: Академия, 2004г.
. Змушко
Е.И., Белозеров Е.С. Лекарственные препараты.- СПб.: Питер, 2000 г.
. Косарев
В.В. Фармакотерапия. - Самара: Медицина. - 1994 г.
. Фармакологический
словарь. / Сост. Фадеева П.М. - М.: Медицина, 2003 г.
. Экспериментальные
методы химической кинетики. / Под ред. Н.М.Эмануэля, М.Г.Кузьмина. - М.: Изд-во
Моск. ун-та, 1985 г.
. Фармацевтический
журнал № 5 2003 г.
. Фармацевт-
практик №11 2004 г.
. Журнал
Провизор №2 январь 2006 г.
. Фармацевтический
анализ/ П.О.Безуглый, В.О.Грудько, С.Г.Леонова и др. - Х.: изд. НФАУ; Золотые
страницы, 2001 г.
. Беталактамные
соединения. Взаимосвязь структуры и биологической активности/ П.С. Ныс, В.Б.
Курочкина//Антибиотики и химеотерапия,- 2000 г., Т - 45.
. Либинсон
Г.С. Проблемы стандартизации антибиотиков. Устойчивость пенициллинов и
цефалоспоринов в растворах// Антибиотики - 1983 г.
. Иваницкая
Л.П. Направленный поиск природных беталактамных антибиотиков//Антибиотики -
1983 г.
. Курочкина
В.Б., Нас П.С. Новые беталактамные структуры// Антибиотики и химеотерапия, 2000
г.
20. <#"605879.files/image021.gif">
Таблица
1
Структура
рынка пенициллинов
|
Группа
|
Доля продаж,
|
Прирост
|
Доля продаж,
|
Прирост
|
|
препаратов
|
упаковка (млн.упак.)
|
(%)
|
рубли (млрд.руб.)
|
(%)
|
|
2009 год
|
2010 год
|
|
2009 год
|
2010 год
|
|
|
Пенициллины
|
|
|
|
|
|
|
|
природные
|
25,2
|
23,0
|
91,3
|
142,8
|
126,2
|
88,4
|
|
Пенициллины
|
|
|
|
|
|
|
|
полусинтетические
|
62,3
|
57,8
|
92,8
|
4,55
|
5Д
|
112,1
|
Таблица 2
Физические
свойства лекарственных веществ группы пенициллинов
|
Вещество
|
Внешний вид
|
|
|
вода
|
этанол
|
другие
|
|
БП натриевая (калиевая
соль)
|
белый или почти белый КП
|
очень легко
|
растворим
|
практически нерастворим в
хлороформе, эфире, жирных маслах и жидком парафине
|
|
БП новокаиновая соль
|
белый КП
|
1:250
|
1:30
|
хлороформ 1:60
|
|
Бензатина БП
|
белый порошок
|
1:5000
|
1:65
|
легко в формамиде и
диметилформамиде, практически нерастворим в хлороформе
|
|
ФМП
|
белый КП, слегка
гигроскопичен
|
1:1700
|
1:7
|
растворим в хлороформе,
практически нерастворим в эфире и бензоле
|
|
КЦ динатриевая соль
|
белый или слегка желтоватый
порошок, гигроскопичен
|
1:1,2
|
1:25
|
растворим в метаноле,
практически нерастворим в эфире, хлороформе
|
Таблица 3
Величины рН
растворов, содержание воды и действующего вещества в субстанциях пенициллинов
|
Вещество
|
Характеристика
|
|
Рн (концентрация, г/л)
|
Н2О (%)
|
Основное вещество, %
|
|
БП (натриевая и калиевая
соли)
|
5,5-7,5 (100)
|
≤1*
|
96,0-102,0
|
|
БП (новокаиновая соль)
|
5,0-7,5 (3,33)
|
2,8-4,2
|
96,0-102,0 (БП) 39,0-42,0
(новокаин)
|
|
Бензатина БП
|
-**
|
5,0-8,0
|
96,0-102,0 (БП) 24,0-27,0
(бензатин)
|
|
ФМП
|
2,4-4,0 (5,0)
|
≤0,5*
|
95,0-100,5 (сумма ФМП и
4-гидроксиФМП)
|
|
КЦ (динатриевая соль)
|
5,5-7,5 (50)
|
≤5,5
|
89,0-101,0
|
Примечания:
) Определение воды проводят методом К.Фишера
) * - потеря в массе при высушивании
) ** - определяется кислотность или щелочность.