Реакции циклоприсоединения, синтезов циклических ангидридов на основе реакции Дильса–Альдера
Оглавление
Введение
. Литературный обзор
.1 История изучения диенового
синтеза
.2 Биография О. Дильса и К. Альдера
.3 Диеновый синтез. Реакция Дильса -
Альдера
.4 Реакции циклоприсоединения
.5 Реакции циклических ангидридов с
соединениями содержащими аминогруппу
. Экспериментальная часть
.1 Перегонка смеси бензола и
дивинила
.2 Реакции циклических ангидридов с
аминокислотами
Выводы
Библиографический список
Введение
Диеновый синтез (Реакция Дильса - Альдера) -
одна из наиболее широко применяемых в органической химии реакций. Она имеет
очень важное как теоретическое, так и практическое значение. Реакция Дильса -
Альдера используется при промышленном производстве фармацевтических препаратов,
красителей, смазочных масел, инсектицидов, синтетических каучуков, пластмасс.
Диеновый синтез широко применяют в синтетической органической химии, в том
числе для синтеза стероидов. Синтез Дильса - Альдера является удобным методом
получения циклических ангидридов дикарбоновых кислот, которые являются основой
для синтеза имидокислот.
Большое значение этой реакции для химической
промышленности было отмечено Нобелевской премией, которую Курт Альдер и Отто
Пауль Герман Дильс, ее первооткрыватели, разделили между собой в 1950 году [7].
Целью работы является изучение реакций циклоприсоединения,
синтезов циклических ангидридов на основе реакции Дильса - Альдера и их
свойств.
Задачами работы являются:
ü Знакомство с литературой по реакции
Дильса - Альдера.
ü Осуществление синтеза веществ на
основе аддуктов реакции Дильса - Альдера.
ü Циклизация ангидрида.
ü Идентификация вновь синтезированного
соединения.
Актуальность: Реакция Дильса - Альдера является
теоретически значимой в вузовском курсе изучения органической химии. Также
данная реакция имеет большое практическое значение.
Новизна: Синтез нового органического соединения,
неописанного в литературных источниках. Перспективы:
Изучение свойств вновь синтезированного органического соединения.
1. Литературный
обзор
.1 История
изучения диенового синтеза
В 40х - 50х годах XX
века исключительную роль в промышленности играло целенаправленное изучение
широких циклов реакций.
Диеновый синтез был предметом интереса химиков
многих стран. Большие заслуги в его развитии принадлежат школе А. Е.
Фаворского. Первые примеры диенового синтеза можно найти в работах В. Н.
Ипатьева (1897) и С. В. Лебедева (1909) по исследованию димеризации изопрена
[5].
Как общая реакция органической химии диеновый
синтез был открыт в 1928 году немецкими химиками-органиками О. Дильсом и К.
Альдером. Диеновый синтез широко применяют в синтетической органической химии,
в том числе для синтеза стероидов. Исследование диенового синтеза позволило
объяснить ряд процессов при полимеризации диеновых углеводородов.
В последующие годы диеновый синтез действительно
стал незаменимым средством для химиков-органиков, которые применяли его при
синтезе таких веществ, как лекарства, витамины, гормоны, стероиды,
синтетические каучуки и пластмассы.
В настоящее время диеновый синтез, называемый
реакцией Дильса - Альдера, является одним из важнейших синтетических методов,
имеющих весьма широкое и разнообразное применение. В большинстве случаев
диеновый синтез непосредственно приводит к ненасыщенным алициклическим и
гетероциклическим шестичленным системам, многие из которых, а также продукты их
дальнейших превращений оказались физиологически активными веществами,
обладающими антиконвульсивным, снотворным, инсектицидным, гербицидным и
репелентным действием. Получение некоторых аддуктов диенового синтеза
осуществлялось, поэтому в промышленных масштабах (например, получение альдрина
и дильдрина, названных в честь ученых, открывших диеновый синтез). Во многих
случаях диеновый синтез оказался единственным методом, позволяющим получать
мостиковые и другие ди- и полициклические структуры, составляющие основу многих
природных соединений и представляющие самостоятельный интерес. Благодаря
стереохимической направленности реакции Дильса - Альдера ее используют также в
синтезе природных соединений определенной пространственной конфигурации. С
каждым годом появляются сотни новых работ по диеновому синтезу, раздвигающие
границы применимости этой реакции [6].
1.2 Биография
О. Дильса и К. Альдера
Отто Пауль Герман Дильс
(23
января 1876 г. - 7 марта 1954 г.)
Немецкий химик Отто Пауль Герман Дильс родился в
Гамбурге. В шесть лет Дильс поступил в Йоахимштальскую гимназию в Берлине. В
двадцатилетнем возрасте Дильс поступил в Берлинский университет для изучения
химии. В 1900 г. он под руководством Эмиля Фишера блестяще защитил докторскую
диссертацию и стал ассистентом Фишера в университетском Химическом институте.
В 1904 г. Дильс становится лектором, а в 1906 г.
- профессором органической химии. В течение этого времени он распространил
сферу своих интересов на другие области химии и в 1907 г. опубликовал удачно
написанный и широко известный учебник "Введение в органическую химию"
("Einfuhrungen in die organische Chemie"). В 1913 г. он стал
руководителем факультета органической химии университета.
В 1916 г. Дильс принял назначение на должность
профессора химии и директора Химического института Университета Кристиана
Альбрехта (позднее Кильского университета). С 1925 г. он ректор этого
университета.
В 1928 г. Дильс с одним из своих бывших
студентов, Куртом Альдером, опубликовал статью, в которой они впервые объясняли
диеновый синтез. Хотя диеновый синтез уже был обнаружен другими химиками, этому
явлению не было дано научного объяснения. Сотрудничество Дильса с Альдером
продолжалось до 1936 года.
В 1950 г. Дильс и Альдер были награждены
Нобелевской премией по химии "за открытие и развитие диенового
синтеза". Болезнь не позволила Дильсу присутствовать на церемонии
награждения.
Отто Дильс умер в Киле 7 марта 1954 г., вскоре
после своего 78-летия.
Кроме Нобелевской премии, Дильс был награжден
медалью Адольфа фон Байера Германского химического общества (1930), получил
почетную медицинскую степень в Кильском университете. Он являлся членом
академий наук Гёттингена, Галле и Мюнхена [7].
Курт Альдер (10
июля 1902 г. - 20 июня 1958 г.)
Немецкий химик Курт Альдер родился в Германии, в
Кенигсхютте. В 1922 г. Альдер окончил в Берлине среднюю школу и поступил в
Берлинский университет, чтобы изучать химию.
Свое обучение Альдер продолжил в Университете
Христиана Альбрехта, где работал у Отто Дильса, профессора органической химии и
директора университетского Химического института. В 1926 г., завершив
диссертацию о реакциях с азодикарбоновым эфиром, Альдер был удостоен докторской
степени и стал ассистентом Дильса. На следующий год он вместе с Дильсом занялся
изучением диенового синтеза.
В 1930 г. Альдер был назначен лектором по
органической химии в Кильском университете, а в 1934 г. стал экстраординарным
профессором, Как специалист высокой квалификации по диеновому синтезу, ученый
получил предложение занять должность руководителя расположенного в Леверкузене
научно-исследовательского отдела концерна "И. Г. Фарбен индустри",
которое принял в 1936 г. В. Леверкузене.
Вернувшись в 1940 г. к академической
деятельности, Альдер, которого не привлекли к исследованиям, осуществляемым в
военное время Германией, был назначен руководителем работ по экспериментальной
химии и химической технологии в Кельнском университете. Одновременно он стал
директором Химического института этого университета.
После получения Нобелевской премии (1950) Альдер
продолжал заниматься преподавательской деятельностью и научными исследованиями
в области дальнейшего потенциального применения диенового синтеза в
промышленных целях. В 1955 г. он, присоединившись к 17 другим Нобелевским
лауреатам, подписал декларацию, призывающую все страны осудить войну как
инструмент внешней политики. В 1957 г. врач, поставив ему диагноз: истощение
организма, посоветовал полный отдых. Альдер умер на следующий год, в возрасте
55 лет.
Помимо Нобелевской премии, Альдер был награжден
медалью Эмиля Фишера Германского химического общества (1938). Ему были
присвоены почетные степени медицинского факультета Кельнского (1950) и
Саламанкского (1954) университетов. Альдер являлся членом Германской академии
естествоиспытателей "Леопольдина" [7].
.3 Диеновый синтез.
Реакция Дильса - Альдера
Диеновый синтез - реакция 1,4-присоединения
диеновых углеводородов с сопряжёнными двойными связями к ненасыщенным
соединениям с активированной двойной связью (диенофилы) (Схема 1).
В реакцию вступают циклические и ациклические
1,3-диены, енины (алкинилалкены -C=C-C≡C-) или их
гетероаналоги - соединения с фрагментами -С=С-С=О, -С=С-СN. Наличие донорных
заместителей в диене облегчает протекание реакции [8].
Диенофилами обычно являются алкены и алкины с
активированной электроноакцепторными заместителями кратной связью. В роли
диенофилов также могут выступать соединения, содержащие двойные связи с
гетероатомом, например -С=О, -С=N-, -СN, -N=О, -S=O, -N=N-. Обнаружено, что в
некоторых случаях даже вещества с изолированными двойными связями могут
присоединять диены, однако такие реакции обычно протекают в более жёстких
условиях.
В результате диенового синтеза образуются
шестичленные циклы, содержащие двойную связь между вторым и третьим атомами
углерода исходного диена.
Типичный пример диенового синтеза - Реакция
Дильса - Альдера - получение ангидрида тетрагидрофталевой кислоты из
бутадиена-1,3 и малеинового ангидрида:
Схема 1

диен диенофил
Реакцию Дильса - Альдера осуществляют простым
смешением или нагреванием реагентов при 100 - 120°С. При отсутствии
активирующей группы в диенофиле для диенового синтеза необходимы жёсткие
условия. Обычно эта реакция протекает с высокими выходами, её скорость
снижается с увеличением количества и объёма заместителей [4].
Реакция Дильса - Альдера высокостереоспецифична
и всегда идёт по схеме цис-присоединения [2].
Неоднократно наблюдалось, что аддукты реакции
диенового синтеза термически неустойчивы. Поэтому в подавляющем числе случаев
данная реакция обратима и при нагревании до температур более 200°C
снова образуются исходные продукты. Диссоциация происходит с различной
лёгкостью в зависимости от характера аддуктов [8].
Механизм данной реакции до сих пор является
дискуссионным.
Различные типы сопряженных систем, способных
вступать в реакцию диенового синтеза, могут быть классифицированы следующим
образом:
. Ациклические сопряжённые системы.
. Алициклические сопряжённые системы:
а) чисто алициклические
б) бициклические
в) алициклически-алициклические
. Ароматические сопряжённые системы:
а) чисто ароматические
б) ароматическо-ациклические
в) ароматическо-алициклические
Реакция Дильса - Альдера иногда сопровождается
полимеризацией диенов - побочная реакция. Применение ингибиторов полимеризации
(гидрохинона), низкая температура реакции и выбор подходящих растворителей
являются иногда эффективными факторами для подавления полимеризации диена [4].
Реакция Дильса - Альдера очень важна для синтеза
сложных природных полициклических структур [2].
1.4 Реакции
циклоприсоединения
Реакции циклоприсоединения - реакции,
протекающие с образованием нового цикла из двух реагирующих молекул (без
отщепления каких-либо групп или атомов). Такие реакции сопровождаются общим
уменьшением кратности связей. Конечным продуктом реакций циклоприсоединения
являются циклические субстраты [3].
Существует две основных группы реакций этого
типа:
ü Присоединение к сопряженным системам
- Реакция Дильса - Альдера;
ü 1,3-диполярное циклоприсоединение -
Реакция Хьюсгена.
В связи с усилением ароматичности в ряду
соединений фуран < пиррол < тиофен пятичленные гетероциклы значительно
различаются по лёгкости вступления реакции 1,4-циклоприсоединения по Дильсу -
Альдеру (диеновый синтез).
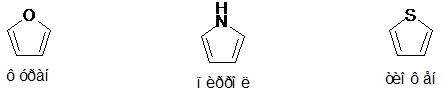
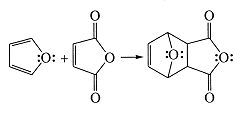
В рассматриваемой группе соединений
ароматический характер наименее выражен в случае фурана. Это вещество отчётливо
проявляет свойства сопряжённого диена и легко вступает в реакцию Дильса -
Альдера с соединениями, содержащими двойную или тройную связь, активированную
диенофилами. Например, при быстром добавлении фурана к малеиновому ангидриду
при комнатной или более низкой температуре получают термодинамически устойчивый
продукт реакции (Схема 2).
Схема 2
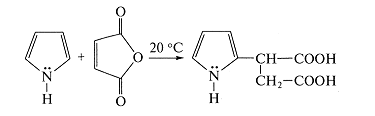
Пиррол с большим трудом вступает в реакцию
1,4-циклоприсоединения по Дильсу - Альдеру. Для него типична реакция
заместительного присоединения по второму атому углерода кольца [3]. Так,
например, при взаимодействии пиррола с малеиновым ангидридом в основном
образуется продукт замещения (Схема 3).
Схема 3
Реакции, обратные циклоприсоединению, называются
циклоэлиминированием.
Циклоприсоединение широко используют в
органической химии для синтеза карбо- и гетероциклических соединений с
различным набором и числом атомов в кольце; оно представляет большой
теоретический интерес.
1.5 Реакции
циклических ангидридов с соединениями содержащими аминогруппу
В ходе Реакции Дильса - Альдера из бутадиена-1,3
и малеинового ангидрида получается 1,2,3,6-тетрагидрофталевый ангидрид (Схема
4).
Схема 4


Ангидрид тетрагидрофталевой кислоты - белый
кристаллический порошок температура плавления, которого 103 - 104°C.
Молекулы данного вещества имеют циклическое строение.
В реакциях ацилирования ангидридов аммиаком и
первичными аминами получаются имиды, в которых с атомом азота связаны две
ацильные группы. Это происходит особенно легко в случае циклических ангидридов,
из которых образуются циклические амиды (Схема 5).
Схема 5

При взаимодействии циклических ангидридов со
вторичными аминами можно последовательно ввести две амидные группы, используя
методы пептидного синтеза для мягкого введения второй амидной группировки
(Схема 6).
Схема 6
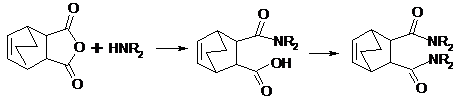
Циклические ангидриды взаимодействуют и с
аминокислотами с образованием N-ацильных производных (Схема 7).
Схема 7
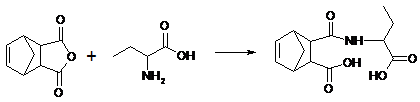
Данная реакция используется для защиты
аминогруппы в синтезе пептидов. Такая защита должна легко сниматься, а амиды,
как известно, гидролизуются в жестких условиях. При разработке методов синтеза
пептидов были найдены защитные группы, которые легко удаляются путем гидролиза
или гидрогенолиза [1].
2. Экспериментальная
часть
.1 Перегонка
смеси бензола и дивинила
Перегонка применяется для очистки жидких веществ
от нелетучих примесей. Она основана на том, что жидкость нагревают до
температуры кипения и пар ее отводят по газоотводной трубке в другой сосуд.
Охлаждаясь, пар конденсируется, а нелетучие примеси остаются в перегонной
колбе. Не следует выпаривать жидкость полностью: 10 - 15% от первоначально
взятого объема ее должно оставаться в колбе. Новую порцию жидкости можно
наливать лишь тогда, когда колба немного остынет. Вещества, которые при
нагревании разлагаются или претерпевают какие-либо другие изменения, перегоняют
при уменьшенном давлении - под вакуумом. Умеренный вакуум может быть достигнут
при использовании водоструйного насоса, присоединяемого к установке для
перегонки. Главное условие успеха этой операции - полная герметичность
аппаратуры. Поэтому лучше всего использовать приборы, собранные на шлифах.
Высокий вакуум создают с помощью специальных вакуумных насосов и используют для
перегонки сравнительно редко. Для
перегонки смеси бензола и дивинила была собрана следующая установка.
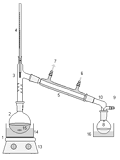
Схема 8: 1
- колбообогреватель, 2 - круглодонная колба со смесью бензола и дивинила, 3 -
насадка Вюрца, 4 - термометр, 5 - холодильник, 8 - дивинил, 10 - аллонж, 15 -
кипелки, 16 - лёд
Отгонка дивинила из раствора протекала при
температуре 81°C. Объём дивинила
составил 300 мл. Общее время перегонки составило около 2-х часов. Результат
перегонки - бензол, который остался в перегонной колбе, - свидетельствует о
том, что малеинового ангидрида в растворе не было.
Была проведена реакция отогнанного дивинила с
перманганатом калия. Раствор перманганата калия обесцветился (Схема 9). Это
свидетельствует о том, что отогнанный дивинил - непредельное органическое
соединение.
Схема 9
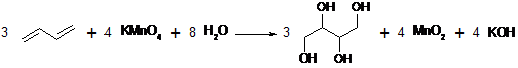
2.2 Реакции
циклических ангидридов с аминокислотами
Для получения необходимой имидокислоты
использовали следующую методику [6]. Аддукт реакции циклопентадиена и
малеинового ангидрида смешивали с a-аминомасляной
кислотой в соотношении 1:1 и нагревали в ледяной уксусной кислоте в течение 1
часа. Важной особенностью этого синтеза является нагревание не ниже 130°C
для того, чтобы полностью прошла циклизация (Схема 10), кислоты. Для выделения
продукта реакции необходимо удаление уксусной кислоты, которое осуществляется
её выпариванием при пониженном давлении на ротационном испарителе до полного
исчезновения запаха уксусной кислоты.
Схема 10
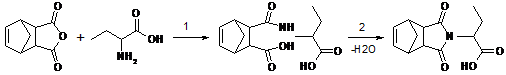
В результате реакции мы получили имидокислоту -
кристаллы белого цвета.
Синтез имидокислоты включает в себя несколько
стадий:
) Стадия нуклеофильного замещения
) Замыкание цикла, которое сопровождается
отщеплением воды. На этой стадии образуется имидокислота, которая представляет
собой новое, неописанное в литературе соединение [6].
Выводы
ангидрид реакция
имидокислота циклопентадиен
1. Были изучены реакции циклоприсоединения,
синтезы циклических ангидридов на основе реакции Дильса - Альдера и их
свойства.
. Осуществлён синтез веществ на основе
аддуктов реакции Дильса - Альдера.
. Получено новое, неописанное в
литературе соединение - имидокислота - на основе циклопентадиена с малеиновым
ангидридом и a-аминомасляной кислоты.
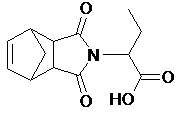
Библиографический список
. Вейганд-Хильгетаг. Методы
эксперимента в органической химии. М.: Химия, 1968.
. Грандберг И. И.
Органическая химия: Учеб. для студ. вузов, обучающихся по агроном. спец. - 4-е
изд., перераб. и доп. - М.: Дрофа, 2001.
. Иванов В.Г. Органическая
химия: Учеб. пособие для студентов вузов: Допущено Учеб. - метод. объединением
по спец. пед. образования/ В.Г. Иванов, В.А. Горленко, О.Н. Гева. -3-е изд.,
испр. - М.: Академия, 2006.
. Клетцель М.С. Органические
реакции // Москва: ИЛ. 1951.
. Балакирева Н.Г. Дипломная
работа. - Ярославль: ЯГПУ, 1993.
. Сёмина М.Ю. Дипломная
работа. - Ярославль: ЯГПУ, 2003.
. http://n-t.ru.
. http://ru.wikipedia.org.