Метод микромасштабной фронтальной хроматографии в исследовании накопления тяжелых металлов почвами
МИНИСТЕРСТВО
ОБРАЗОВАНИЯ РЕСПУБЛИКИ БЕЛАРУСЬ
Учреждение
образования
Гомельский
государственный университет
имени
Франциска Скорины
Биологический
факультет
Кафедра
химии
Дипломная
работа
Метод
микромасштабной фронтальной хроматографии в исследовании накопления тяжелых
металлов почвами
Исполнитель
студентка
группы Би-52
Пантелеева
Т.В.
Научный
руководитель
к.х.н.,
доцент
Пролесковский
Ю.А.
Рецензент
к.б.н.,
доцент
Рассашко
И.Ф.
Гомель
2012г.
Реферат
Ключевые слова: химический эксперимент, виды эксперимента,
самостоятельность, урок, обучение, опыт, вещество, задача, активная
познавательная деятельность, учебная деятельность, проблемные вопросы,
проблемное обучение, техника безопасности.
Объект исследования: химический эксперимент как
одна из форм проведения учебных занятий по химии.
Предмет исследования: практические знания и
умения учащихся средних школ №4 и №19 г. Гомеля, 8, 9 и 11 классы.
Методы исследования: сравнительный анализ,
наблюдение, описательный, литературный.
Задачами дипломной работы являются: разработать
план-конспект по химии с применением школьного химического эксперимента и
провести уроки во время педагогической практики, проанализировать собственные
исследования.
Цель работы:
·
проработка
материала из литературных источников по вопросу «Химический эксперимент как
основа изучения химии в школе» для накопления теоретического и
экспериментального материала с последующим использованием его в педагогической
практике;
·
практическое
применение ранее накопленного материала по данному вопросу во время работы;
·
проработка
материала по использованию современных педагогических технологий, связанных с
организацией химического эксперимента на уроках химии в школе;
·
использование
химического эксперимента в преподавании химии.
Выводы: в результате анализа проделанной
дипломной работы мы пришли к выводу, что применение школьного химического
эксперимента повышает учебно-познавательный интерес к предмету химии, что, в
свою очередь, значительно улучшает и ускоряет процесс запоминания полученной во
время учебных занятий информации.
ВВЕДЕНИЕ
Проблема использования химического эксперимента
на уроках химии существовала давно. Были сделаны выводы, что основой
преподавания химии служит химический эксперимент. Эксперимент может выступать в
роли метода, может служить методическим приемом. Проблемой использования
химического эксперимента занимались ученые: Верховский В.Н., Полосин В.С.,
Вивюрский В.Я., Цветков Л.А., Чертков И.Н., Назарова Т.С. и др.
Верховский В.Н. утверждал, что ведущее место в
преподавании химии занимает школьный химический эксперимент. Это основной и
специфический метод обучения, который непосредственно знакомит с химическими
явлениями и одновременно развивает познавательную деятельность учащихся [1].
Рассматривая эту же проблему Назарова Т.С.
утверждала, что реализация экспериментальной части программы требует от учителя
химии высокой и всесторонней профессиональной подготовки, глубокого понимания
роли химического эксперимента в учебно-воспитательном процессе, творческой
активности в применении методов обучения [2].
В настоящее время уделяется большое внимание
совершенствованию учебно-воспитательного процесса в преподавании химии. В
улучшении учебно-воспитательного процесса большое значение имеют методы
экспериментирования.
Преподавание основ химии в школе не может
совершенствоваться без школьного химического эксперимента. Химия - наука
экспериментальная, поэтому химический эксперимент должен вплетаться в ткань
всего школьного курса.
Эксперимент является важнейшим путем
осуществления связи теории с практикой при обучении химии путем превращения
знаний в убеждения. Химический эксперимент - источник знаний о веществе и
химической реакции − важное условие активизации познавательной
деятельности учащихся, воспитания устойчивого интереса к предмету, формирования
диалектико-материалистического мировоззрения, а также представлений о
практическом применении химических знаний.
В дипломной работе основное внимание уделяется
вопросам влияния школьного химического эксперимента на умственное развитие
учащихся, а также методику преподавания различных экспериментов.
Химический эксперимент оказывает положительное
влияние на умственное развитие учащихся. Характерной особенностью развивающего
обучения в настоящее время является все более широкое использования проблемного
подхода, который включает в себя создание проблемной ситуации, понимание
проблемы, деятельность, направленную на ее решение и получение определенных
знаний.
В последнее время большим интересом пользуются
уроки с применением школьного химического эксперимента. Как показывает опыт,
проведение уроков с химическим экспериментом увеличивает качество знаний
учащихся, так как они вносят разнообразие в повседневную школьную жизнь не
только учащихся, но и педагогов. Отмечено, что ученики очень активно с большим
интересом участвуют в подготовке и проведении таких уроков.
Актуальность темы
В настоящее время в школах республики
осуществляется школьная реформа. Этот процесс коснулся и преподавания химии.
Химия как одна из естественнонаучных дисциплин
призвана познакомить учащихся со свойствами важнейших веществ, окружающих нас,
сформировать понимание сущности химических превращений и их влияние на развитие
природы, жизни и здоровья человека.
Качество знаний учащихся по химии зависит от
использования современных педагогических технологий в обучении и организации
учебной работы учащихся по формированию основополагающих знаний школьного курса
химии, умения применять их на разных уровнях с учетом индивидуальных и
возрастных особенностей, на разных этапах учебно-воспитательного процесса
(актуализация знаний и подготовка учащихся к усвоению нового материала,
закрепление, обобщение, систематизация, коррекция и учет знаний, умений и
навыков).
Цель работы: проработка материала из
методических источников по вопросу «Химический эксперимент как основа изучения
химии в школе» и проведение соответствующих педагогических исследований.
Практическое значение
Школьный химический эксперимент способствует
интенсификации учебно-воспитательного процесса, более осмысленному изучению
материала, приобретению навыков самообразования, превращению систематических
знаний в системные, помогают развитию познавательной деятельности школьников,
их самостоятельности и интереса к изучению химии, повышают прочность и глубину
знаний, формирует личность каждого школьника.
Основной задачей этой работы является
исследование влияния химического эксперимента на знания учащихся по химии.
Данная работа проводилась в городе Гомеле, в
средних школах № 4 и № 19. Для педагогического эксперимента были взяты восьмые,
девятые и одиннадцатые классы.
1. ОБЗОР ЛИТЕРАТУРЫ
1.1 Особенности
преподавания химии в школах на современном этапе
В настоящее время средняя и высшая школы
переживают стадию больших перемен, обусловленных как реформированием средней
школы, так и переходом на многоуровневую систему высшего образования.
Анализируя проблемы реформирования системы
образования в республике, необходимо отметить, что одной из задач, определяющих
содержание среднего образования, является подготовка учащихся к жизни в развивающемся
мире. В этом плане роль химии как науки не только фундаментальной, но и
прикладной, ее влияние на жизнь людей будут все время возрастать. К числу
задач, которые решаются химиками, относятся:
1. Разработка и синтез новых материалов
(полимерных, композиционных, керамических, металлических, волоконных,
биоорганических и др.);
. Проблемы экологии и безопасности
производств, создание безотходных производств;
. Углубленная и комплексная переработка
минерального сырья, нефти, газа, твердых горючих ископаемых и техногенного
сырья;
. Химическая энергетика, создание новых
химических источников тока и систем преобразования энергии;
. Разработка новых методов анализа природных
и созданных руками человека систем;
. Разработка новых технологических
процессов;
. Решение неисчерпаемых проблем биохимии,
создание материалов, совместимых с живыми органами и заменяющих их [3].
Оценка уровней учебных достижений учащихся
осуществляется в соответствии со следующими уровнями усвоения учебного
материала.
Таблица 1 - Оценка уровней учебных достижений
учащихся
|
№
п/п
|
Уровни
учебных достижений учащихся
|
Уровни
усвоения учебного материала
|
Баллы
|
|
1
|
Низкий
(рецептивный)
|
Узнавание
|
1
- 2
|
|
2
|
Удовлетворительный
(рецептивно-репродуктивный)
|
Неосознанное
воспроизведение
|
3
- 4
|
|
3
|
Средний
(репродуктивно-продуктивный)
|
Воспроизведение
на уровне понимания
|
5
- 6
|
|
4
|
Достаточный
(продуктивный)
|
Применение
знаний в знакомой ситуации
|
7
- 8
|
|
5
|
Высокий
(продуктивный, творческий)
|
Применение
знаний в незнакомой ситуации
|
9
- 10
|
Уровни достижений учащихся характеризуются
следующими параметрами.
1. Низкий (рецептивный) уровень: учебная
деятельность носит репродуктивный характер, знания усваиваются на уровне
узнавания, распознавания понятий, установления подобия, копирования,
фиксирования отдельных параметров изучаемого вопроса, причем осознается
значимость материала в пределах одного вопроса параграфа, обученность учащихся
характеризуется способностью к различению, запоминанию; наблюдается проявление
низкого уровня развития мотивационной, эмоциональной, волевой и
саморегуляционной сфер.
. Удовлетворительный
(рецептивно-репродуктивный) уровень: учебная деятельность носит репродуктивный
характер, осуществляются простейшие способы деятельности, материал узнается,
запоминается, воспроизводится частично, на без понимания всех связей и
закономерностей; характерно проявление определенных волевых усилий, мотивации
учения, попытки к самостоятельности и осмыслению учебных действий.
. Средний (репродуктивно-продуктивный)
уровень: учебная деятельность носит репродуктивный и частично продуктивный
характер, материал усваивается на уровне воспроизведения и понимания,
осуществляется описание и анализ действия с объектом изучения, устанавливаются
некоторые причинно-следственные связи, даются определения, объяснения,
осознается значимость материала и его связь с другими параграфами темы;
проявляется самостоятельность, последовательность действий по четко
обозначенным действиям; проявляется средний уровень развития мотивационной,
эмоциональной и волевой сфер, сферы саморегуляции.
. Достаточный (продуктивный) уровень:
учебная деятельность носит продуктивный характер и предполагает высокую степень
осмысления знаний, осознанность их связей в пределах раздела или курса, умение
объяснять, соотносить, сопоставлять, характеризовать, сравнивать,
структурировать, моделировать, анализировать, описывать изучаемые объекты,
применять знания для объяснения наблюдаемых явлений и процессов, для решения
химических задач. Этот уровень характеризуется высокой степенью обученности
учащегося, его ответственностью и самостоятельностью в получении знаний.
Проявляется устойчивый интерес к предмету, близкий к высокому уровень развития
произвольного внимания, мотивационной, эмоциональной и волевой сфер, сферы
саморегуляции. Применение специальных, общеучебных и интеллектуальных умений,
организованность и самокритичность.
. Высокий (продуктивный, творческий)
уровень: учебная деятельность характеризуется целостностью действия учащегося -
доказательностью, обоснованностью суждений, системностью, образностью, пониманием
мировоззренческого значения изучаемого объекта, владением приемами научного
исследования, глубиной усвоения знаний, вплоть до использования их для создания
собственных моделей, проектов. Это уровень поисковой деятельности, решения
эвристических задач.
Ориентировочная основа действий отличается
полнотой и обобщенностью, а исполнительские и контрольно-корректировочные
компоненты учебной деятельности учащегося характеризуются упорядоченностью и
рациональностью.
Его отличает высокая работоспособность, самостоятельность,
целеустремленность, самодисциплина и т.д.[4].
Учение, значимое для учащихся, имеет место
обычно в ситуациях, воспринимаемых как проблемные. Поэтому первое значение
состоит в том, чтобы разрешить учащемуся на любом уровне соприкасаться с важными
проблемами его жизни, спорными вопросами, которые он хочет разрешить.
Главный вывод для образования состоит в том, что
задача учителя - создать атмосферу в классе, помогающую возникновению учения,
значимого для ученика.
Учитель принимает учащегося таким, каков он есть
и способен понять его чувства, способен положительно относиться к нему и
понимать его чувства страха, предчувствия и обескураженность сопутствующие
восприятию нового материала.
Кроме обычных средств - книги, учебники, карты и
т.д., учитель использует себя, свои знания, свой опыт в качестве этих средств.
И.С. Якиманская различает термин
«прожектирование» (медленное, идеальное простраивание чего-либо) и
«проектирование» (как создание и практическое выполнение проекта). Анализ
педагогической литературы позволяет выделить обобщенную схему проектирования
учебной деятельности:
1. Определение цели проектирования
(целеполагание).
. Выяснение системы педагогических факторов
и условий, влияющих на достижение цели (ориентировка).
. Описание педагогической действительности,
подлежащей проектированию (диагностика исходного состояния).
. Выдвижение гипотез о вариантах достижения
цели и оценка вероятности их достижения в конкретных условиях
(прогнозирование).
. Построение конкретной модели (проекта)
педагогического объекта (моделирование).
. Реализация проекта (внедрение).
. Оценка результатов осуществления проекта и
сравнение их с теоретически ожидавшимися (оценивание).
. Построение оптимизированного варианта
конкретного педагогического объекта (коррекция).
Эта наиболее полная схема проектирования не
отвечает всего лишь на один вопрос: кто проектирует? Ответ на него как бы
очевиден - конечно, учитель! Ученик здесь тоже как бы очевиден - все это
делается для него, но без него.
С другой стороны, попытки реализовать такое
проектирование приводят к следующим проблемам, отмечаемым самими учителями:
1. Совместное проектирование понимается как
обучение учащихся активной умственной деятельности при доминирующей роли
учителя в разработке всех компонентов урока.
. Усилия переносятся с совместной разработки
содержания на единоличное создание учителем ситуаций проблемности.
. Совместное проектирование понимается как
совмещение различных уроков.
. Неумение выделять личностно значимые для
учащихся ценности в содержании изучаемых знаний.
. Приоритет тактических планирований в
подготовке к уроку над стратегическими.
Если учитель наращивает свое искусство
упаковщика-иллюминатора, если его урок - это фейерверк красочных образов,
примеров, парадоксов - не стоит обольщаться горящими глазами ошарашенной
публики.
Ученики на таком уроке - зрители в цирке.
Представление окончится, учитель упадет без сил, а к следующему уроку ученики с
нетерпением ожидать продолжения: им важно не содержание, а форма.
Необычный урок привлекает не только формой, но и
возможностью для учеников участвовать в его содержании. Обращение учеников к
знаниям учителя в личностно-ориентированном образовании - это обращение к тем
ценностям, которые содержаться в этих знаниях. Наиболее эффективное средство
соединения знаний учителя с ценностным содержанием сознания ученика - это
включение ученика в совместную деятельность - и по созданию урока, и по его
проведению.
Совместное проектирование учебной деятельности -
процесс, соединяющий нормативные образы и индивидуальное сознание ученика в
совместном с учителем целеполагании, дополнении содержания изучаемых знаний
собственными смыслами, самоопределении в ситуациях выбора и т.д., в ходе
которого создаются условия для внутреннего принятия смысла изучаемых знаний.
Совместное проектирование выстраивается на договорных отношениях и обладает
признаками: самостоятельного освоения новых понятий, самоизменения,
деабсолютизации «открываемого заново» знания, преодоление учителем собственной
«педагогичности», переориентации педагога на способы выработки системы
ценностей самих учеников, возникновения индивидуально-творческого процесса
посредством интеллектуального взаимодействия, пробуждающего способности к
мотивированию, рефлексии, критичности, автономности, построению личностной картины
изучаемого явления.
Объекты обучения - образовательный материал
(предметы, явления, символы, модели, ситуации, ценности, деятельность,
отношения, психологическая атмосфера), в процессе выбора, исследования и
преобразования которого происходит самоопределение и саморазвитие и учителя, и
ученика, и взаимодействующей группы (О.С.Газман). Такое определение объекта
образования ведет к такой с ним работе, которая изменяет и сам материал, и
самих субъектов образования, их взаимодействие и взаимовлияние.
Это принципы: объекта, в качестве которого
выступает учебный материал, представляющий единство выбора, исследования и
преобразования; экспертных оснований в учебном материале; включение ученика в
контекст изучаемого материала; принцип личностных знаков содержания,
определяющих его мировоззренческую интерпретацию; принцип неявного
представления содержания знаний и др.
Развернутое представление принципов позволяет
разработать два комплекса критериев, выступающих мерилом оценки качества
организуемой учителем работы по совместному проектированию урока.
I. Критерии соответствия качества знаний
новой цели: ученическое творчество; самостоятельное порождение смыслов и
ценностей своей учебной деятельности; потребность в смысле знаний; личностное
отношение к знаниям. Учебный программный материал имеет смысл рассматривать как
основу для преобразования, соответствующую данным критериям.. Критерии
соответствия качества преобразований в содержании изучаемого материала
гуманистическим требованиям к организации образования: Ученик становится
субъектом образования, включаясь в совместную с преподавателем работу по
содержания изучаемого материала, присутствующего в фактах, предметах, явлениях,
символах, моделях, научных коллизиях - во всем, что изучается не только для
количественного накопления знаний, но и для придания им качественных, т.е.
личностных смыслов.
Таким образом, смысл образования, как
деятельность по расширению памяти, дополняется деятельностью по расширению
мотивационно-оценочной сферы сознания. Для этого необходима актуализация
личностных структур сознания посредством придания содержанию характеристик
открытости, неоднозначности, дополнительности, контекстности открытий,
нелинейности, личностных смыслов и т.д.
Работа по преобразованию содержания учебного
материала выстраивается с ориентацией на механизм его переосмысления и может
быть представлена четырьмя критериями:
1. Проблемность. Изучение основополагающих
проблем имеет смысл тогда, когда проблемы не транслируются, а порождаются
познающим сознанием.
. Критичность. Учебный материал
преобразуется учителем для того, чтобы представить его содержание как материал
для размышлений учеников. Появляется новое определение творчества: Творчество -
это размышление над известным, в результате которого проявляется новый,
личностный смысл знания, открывается его «значение-для-себя», личностная
ценность. Для этого знание должно переосмыслиться. Введение оснований для
сильной позиции критичности.
3. Открытость для дополнений. Содержание
знаний как контекст открытия. В процессе переосмысления выделяются этапы,
«открывающие» содержание знаний для дополнения их пониманием ученика:
актуализация смысла, понимание рассматриваемой ситуации; дискредитация
(опровержение) прежних смыслов в контексте обнаруженных противоречий; введение
собственных смыслов; реализация вновь обретенного смысла.
. Самоактуализируемая субъектность.
Разработка собственных отношений к учебному материалу. Субъектность, как
обязательное условие развития, не может быть навязана извне. Однако она
инициируется внешними воздействиями, которые, вместе с тем, не являются
определяющими. Внешние воздействия - специально организованная деятельность
учителя, «работающего» с учениками через преобразованное содержание учебного
материала. Объектом деятельности учителя становится не ученик, а содержание,
которое опосредственно влияет на формирование потребностей ученика в
самоактулизации мотивирования, критичности, рефлективности и других личностных
структур сознания по отношению к сообщаемым знаниям.
Следующие умения, проявляющие деятельность
личностных структур сознания учащихся:
1) устанавливать связи смыслов между явными и
неявными противоречиями;
) иметь собственную, отличающуюся от других
мнений, точку зрения («иной смысл», «выход в стороннюю позицию») и уметь ее
аргументировать;
) различать нравственные и технократичные
ценности явления, идеи, факта (мотивирование);
) критично анализировать устоявшуюся
(инвариантную) точку зрения на явление;
) искать и находить новые познавательные
ориентиры, выдвигать гипотезу (критичность);
) дополнять представленные явления учителем
(учебником) собственными смыслами и обмениваться ими с учителем, учениками
(смыслотворчество) [5].
1.2 Роль химического
эксперимента на уроках химии
Важная задача современной школы - органическое
сочетание обучения, воспитания и развития. Химия как учебный предмет средней
школы вносит существенный вклад в ее решение. Ведущее место в преподавании
химии занимает школьный химический эксперимент. Это основной и специфический
метод обучения, который непосредственно знакомит с химическими явлениями и
одновременно развивает познавательную деятельность учащихся.
В системе современного обучения особенно велика
роль химического эксперимента, если он используется не только в качестве
иллюстрации, но и как средство познания.
Однако за последние годы интерес к школьному
химическому эксперименту в значительной степени снизился. Это объясняется тем,
что во многих странах была осуществлена перестройка учебных программ и
учебников химии, в ходе которой в значительной степени увеличился объем
теоретических знаний, и возросла их значимость в обучении. В этих программах
жестко регламентированы демонстрационные и лабораторные опыты, вследствие чего
большинство учителей, выполняя установки программ, практически перестали
творчески подходить к химическому эксперименту. Широкое использование
педагогами технических средств обучения также уменьшило их интерес к школьному
химическому эксперименту.
В условиях развивающего обучения в настоящее
время возникла необходимость поиска новых путей совершенствования химического
эксперимента, в особенности ученического [1].
Химия - наука
экспериментальная, поэтому химический эксперимент должен органично вплетаться в
ткань всего школьного курса. Хорошо подобранные опыты позволяют наглядно
отразить теории и эксперимента, и на практике убедиться в действенности законов
химической науки и возможности научного предвидения.
Использование химического эксперимента в
обучении позволяет ознакомить учащихся не только с самими явлениями, но и
методами химической науки. Кроме того, химический эксперимент как источник
приобретения эмпирических знаний служит надежным средством превращения знаний в
убеждения, а, следовательно, способствует формированию мировоззрения.
Специфика работы учителя химии в классах
гуманитарного профиля требует от него не только строгого выполнения всех
общеметодических требований к проведению химического эксперимента (наглядность,
простота, безопасность, надежность и сопроводительное объяснение), но и учета
познавательных интересов гуманитариев и их психофизиологических особенностей [6].
В усовершенствованной программе по химии усилена
роль всех видов школьного эксперимента, особенно ученического.
Реализация экспериментальной части программы
требует от учителя химии высокой и всесторонней профессиональной подготовки,
глубокого понимания роли химического эксперимента в учебно-воспитательном
процессе, творческой активности в применении методов обучения [2].
Эксперимент - важнейший путь осуществления связи
теории с практикой при обучении химии, путь превращения знаний в убеждения.
Правильно поставить эксперимент и сделать четкие выводы из него - важное
средство формирования диалектико-материалистического мировоззрения учащихся в
процессе усвоения основ химической науки [7].
Выделяют ряд требований к отбору содержания
опытов по химии для учащихся гуманитарных классов. В процессе наблюдения при
самостоятельном выполнении опытов учащиеся не только общаются с конкретными
объектами химической науки, но могут видеть и осуществлять процессы
качественного изменения веществ. Через наблюдение и опыт учащиеся познают
многообразную природу веществ, накапливают факты для сравнений, обобщений,
выводов [8].
Ученик, производящий опыт и наблюдающий
химические превращения в различных условиях, которые он может в доступных для
него возможностях изменять, убеждается, что сложными химическими процессами
можно управлять, осуществлять их целенаправленно.
Химический эксперимент - источник знаний -
предполагает восприятие сущности опыта, умственную деятельность и физический
труд. Проводится он в несколько этапов:
1) обоснование
постановки опыта;
2) его
планирование и проведение;
3) оценка
полученных результатов.
Выполнение эксперимента возможно лишь с опорой
на полученные ранее знания. Планирование эксперимента часто связано с
выдвижением гипотезы. Привлечение к этой работе учащихся способствует развитию
мышления, заставляет их применять имеющиеся знания для формулировки гипотезы, в
результате проверки которой учащиеся получают новые знания.
Функции школьного химического эксперимента. Эксперимент
позволяет выделить и изучить наиболее существенные стороны объекта или явления
с помощью различных инструментов, приборов, технических средств в заданных
условиях. Эксперимент может быть повторен исследователем в случае
необходимости. Это в значительной степени определяет основную функцию научного
эксперимента: получение достоверных данных об окружающей действительности.
Учебный эксперимент отличается от научного тем, что результаты его известны,
условия его проведения подобраны так, что в процессе проведения опытов или их
наблюдения учащиеся должны обнаружить известные признаки реакции и прийти к
ожидаемым результатам [10].
В школьном курсе химии эксперимент является
своеобразным объектом изучения, методом исследования, источником и средством
нового знания. Для него характерны три основные функции:
1) познавательная
- для усвоения основ химии, постановки и решения практических проблем,
выявления значения химии;
2) воспитывающая
- для формирования материалистического мировоззрения, убежденности, идейной
потребности к труду, ориентации учащихся на рабочие профессии;
3) развивающая
- для приобретения и совершенствования общенаучных и практических умений и
навыков.
Химические реакции - основной объект изучения
химии. Эксперимент и связанные с ним наблюдения необходимы при формировании
первоначальных химических понятий.
Ознакомление с химическим экспериментом как
методом научного исследования, овладение навыками химического
экспериментирования для добывания новых знаний и применения их в практической
деятельности играет важную роль для формирования материалистического
мировоззрения учащихся, уяснения роли науки и научных фактов [11].
Важное учебно-воспитательное имеет школьный
химический эксперимент и для политехнической подготовки учащихся: ознакомлении
их с основами химического производства, его особенностями, условиями протекания
химических реакций, химизации народного хозяйства. Один и тот же эксперимент на
разном уровне подготовки учащихся используется неодинаково.
В одних экспериментах явление доступно
непосредственному восприятию. В других - изучаемые предметы и явления не
воспринимаются непосредственно органами чувств и могут быть обнаружены только с
помощью приборов или специальных инструментов. Для понимания сущности
изучаемого предмета или явления, химический эксперимент часто дополняют другими
средствами наглядности - таблицами, моделями, экранными пособиями.
Таким образом, химический эксперимент
пронизывает все темы школьно курса химии, способствуя раскрытию его содержания
и являясь своеобразным методом обучения.
Особенностью учебных программ по химии является
увеличения числа демонстрационных и лабораторных опытов с целью усиления
познавательной мотивации процесса обучения и снижения "хемофобии".
Делается акцент на формирование умений и навыков безопасного обращения с
химическими веществами, используемыми в повседневной жизни, т.е. усиливается
прикладной характер химических знаний [12].
Необходимость реализации задач новых программ и
личностно- ориентированного подхода к обучению позволяет широко использовать
химический эксперимент для развития положительной внутренней мотивации учащихся
и способствует переходу знаний в убеждения, развитию познавательной
самостоятельности в деятельности учащихся, что в конечном итоге, способствует
достижения ими более высоких результатов. В процессе химического эксперимента
формируется самостоятельность действий школьников: умение провести лабораторный
опыт, выполнять практическую работу или решить экспериментальную задачу,
выполнить наблюдение в ходе эксперимента, получить нужный результат, соблюсти
правила охраны труда, обобщить полученные данные. Можно выделить следующие
функции химического эксперимента:
1 эвристическую,
- связана с установлением новых фактом и формированием многих химических
понятий;
2 корректирующую,
- связана с использованием эксперимента для формирования правильных суждений и
исправления ошибочных;
3 обобщающую,
- связана с выработкой предпосылок для эмпирических обобщений и формированием
общих правил работы в лаборатории;
4 исследовательскую,
- обеспечивает самый высокий уровень развития учащихся, их умений сочетать
основные приемы научного исследования с самостоятельным решением и выполнением
учебных заданий [13].
Разберем данное положение на конкретных
примерах. Для формирования начального понятия "катализатор" можно
использовать следующий простой опыт разложения водорода-пероксида в присутствии
марганец-(1У) оксида.
У некоторых учителей возникают вопросы по
методике преподавания темы "Скорость химической реакции" учащимся
можно предложить провести эксперимент по изучению зависимости скорости реакции
от концентрации реагирующих веществ.
Ученический эксперимент можно использовать для
формирования правильных суждений учащихся и исправления ошибочных. Например,
изучая свойства кислотных оксидов на примере взаимодействия некоторых из них с
водой, учащиеся неправильно осуществляют перенос этого свойства на все оксиды и
делают широко распространенную ошибку - пишут уравнение несуществующей в
природе реакции взаимодействия кремний-(1У) оксида с водой. Для коррекции
знаний учащихся в такой ситуации достаточно ввести простейший опыт: речной
песок плюс вода [7].
В практической деятельности велика вероятность
ошибок, связанных с нарушением правил охраны труда. Например, при получении
хлороводорода и соляной кислоты учащиеся нередко опускают газоотводную трубку
прибора в воду, забывая о хорошей растворимости газа в воде. В подобной
ситуации необходим специальный учительский эксперимент, корректирующий
демонстрирующий возможные последствия при неправильном проведении реакции.
При обобщении знаний и формирования обобщенных
понятий также можно использовать эксперимент. Например, продемонстрировав опыты
по электропроводности растворов солей, кислот и щелочей, с одной стороны, и
выявив отсутствие электропроводности растворов глюкозы или глицерина с другой,
можно подвести учащихся к определению понятий "электролит" и
"неэлектролит" [14].
Наиболее доступными для школьников
исследованиями можно считать практические работы по качественному анализу
предложенных веществ. Развитию учащихся способствует конструирование приборов и
установок, освоения доступных методов научно-исследовательской работы.
1.3 Виды школьного
химического эксперимента
Сейчас охарактеризуем виды школьного химического
эксперимента и дадим методические рекомендации по включению его в учебный
процесс с учетом основной типологии уроков. Химический эксперимент включает:
демонстрационные (выполняемые учителем) и лабораторные (выполняемые учащимися)
опыты, а также практические работы.
На уроках изучения нового материала чаще всего
используются демонстрации и лабораторные опыты.
Демонстрационный эксперимент. Применяется в
случаях, когда учащиеся ранее не встречались с изучаемыми явлениями и
процессами и не подготовлены к самостоятельному наблюдению. Учитель не только
показывает изучаемые объекты или проводит реакцию, но и организует наблюдение,
направляя его путем постановки и решения познавательных задач, гипотез в нужное
русло, и подводит учеников к правильным выводам и обобщениям. При этом
демонстрирует безопасные приемы обращения с лабораторным оборудованием,
фиксирует внимание на принципах его действия, условиях проведения опытов,
охране труда. Требования к демонстрационному эксперименту следующие:
5 наглядность
и убедительность опыта (рекомендуется использовать посуду более крупных
размеров, черно-белый фон или проецирование на экран);
6 безопасность
его проведения (строгое соблюдение правил по охране труда и инструкций);
7 подготовленность
и проверенность опыта (даже если он освоен учителем и неоднократно проводился,
его проверяют перед уроком);
8 определение
содержания педагогической деятельности учителя и учебной деятельности учащихся
(каждое действие учителя сопровождается словесными пояснениями, которые
целесообразно иллюстрировать рисунками, записями уравнений химических реакций,
схемами, таблицами).
Лабораторные опыты. Выполняются учащимися
группой или фронтально в процессе усвоения нового материала, носят обучающий
характер, поэтому осуществляются под руководством учителя, который ставит
конкретные цели и задачи, предлагает рациональный план наблюдения, учит
анализировать и обобщать данные. Требования к лабораторным опытам следующие:
9 осуществление
учителем формирования умений проводить наблюдения и фиксировать их;
10целесообразность
избранной методики проведения опыта;
11безопасность
опыта (обеспечение точного выполнения инструкции и правил по охране труда);
12простота
и убедительность;
13обучение
учащихся экономному расходованию реактивов;
Опыты должны быть:
1) эффективными
и способствующими формированию интереса к изучаемому материалу (растворение
аммиака в воде - опыт "Фонтан");
2) иллюстрировать
изучаемый теоретический материал, способствовать формированию химических
понятий (зависимость скорости реакции от различных факторов);
3) моделировать
процессы, происходящие в природе (выделение кислорода при фотосинтезе и его
обнаружение), или имитировать возможные последствия экологических бедствий
(сжигание серы - опыт "Кислотный дождь");
4) показывать
практическую значимость отдельных веществ, их химические и физические свойства
(испытание рН растворов сока лимона, яблока, слюны и т.д.);
5) позволять
воспроизводить химический эксперимент на основе исторического материала
(горение сухого фосфора в закрытой колбе, К.В. Шееле, 1771г.) [15].
Большое внимание учащихся вызывают яркие,
эффективные и занимательные опыты. Однако они уместны на уроке химии только в
том случае, если соответствуют его содержанию.
Учитель должен четко рассчитывать время для
изучения инструкции и проведения лабораторного опыта. Лабораторный опыт
используется как для подтверждения теоретических положений, известных учащимся,
так и в учебных исследованиях как метод, подтверждающий справедливость
гипотезы. Эффективность использования эксперимента значительно возрастает при
переходе от традиционной к исследовательской модели обучения.
Практические работы. Могут проводиться как на
уроках формирования знаний и умений, так и на уроках контроля знаний учащихся.
В первом случае они проводятся после изучения конкретной темы или раздела и
обеспечивают формирование практических умений на основе полеченных после
изучения темы теоретических знаний.
Практические занятия способствуют формированию
знаний, умений и навыков учащихся. Они проводятся после изучения конкретной
темы, раздела и обеспечивают формирование практических умений на основе
полученных после изучения темы теоретических знаний и умений.
Главная задача практических работ, как и
лабораторных опытов, состоит в том, чтобы экспериментальным путем подтвердить
теорию, закон, закономерность, ознакомить учащихся с составом, получением,
химическими свойствами и применением веществ. Для этого учащиеся должны знать:
какие вещества, в каком количестве необходимо брать для получения продукта, для
изучения его состава и химических свойств; при каких условиях проводить
реакции; какие операции при этом выполнять; как осуществлять наблюдение,
сравнение, анализ, выделять существенные признаки, делать выводы. Кроме того,
они должны приобрести умения и навыки выполнения химических операций,
конструирование приборов, выдвижение гипотез и проведение эксперимента для их
проверки, научить оформлять результаты проделанной работы, составлению отчета,
используя язык химии. На практических занятиях учитель наблюдает за выполнением
учащимися работы, оказывает им необходимую помощь.
Подготовка учащихся к практическому занятию
начинается с выполнения целой серии экспериментальных заданий и формирования
знаний и умений, выявления уровня усвоения теоретического материала, который
используется для выполнения практического занятия. Затем учитель определяет
цели и задачи практического занятия. Далее он организует подготовку учащихся к
выполнению практической работы по инструкциям уз учебника или по заготовленным
заранее индивидуальным инструкциям, определяющим порядок выполнения работы,
правила охраны труда при работе в кабинете химии, форму составления отчета.
Учащиеся знакомятся с инструкциями до проведения занятия.
Практическое занятие по решению
экспериментальных задач в определенной степени можно отнести к типу урока контроля
и учета знаний и умений учащихся. Целью данного вида практического занятия
может быть: контроль знаний по целому разделу, направленный на проверку умений
применять полученные теоретические знания при решении экспериментальных задач;
определения уровня развития теоретических и практических умений учащихся
(умение сравнивать, проводить анализ, синтез и обобщение, устанавливать
причинно-следственную зависимость свойств веществ от их строения, выявить
генетическую связь между классами неорганических и органических соединений);
степень самостоятельности в учебной деятельности; уровень сформированности у
учащихся умений самоанализа.
В практике работы школы экспериментальные задачи
подразделяют на следующие типы:
1) задачи,
в процессе которых ученики наблюдают и объясняют происходящие явления;
2) задачи
на получение веществ;
3) задачи
на подтверждение состава вещества;
4) задачи
на распознавания вещества;
5) задачи
на доказательства классификационной принадлежности.
Для проведения эксперимента на высоком научно-теоретическом
и методическом уровне необходимо разнообразие, в том числе и новейших
технологических средств. Наличие учебного оборудования, необходимого для
реализации программы по химии, умение учителя рационально и эффективно его
использовать, отобрать необходимые средства для урока, самостоятельно
изготовить некоторые из них и грамотно включить в урок также составляют
важнейшие условия организации химического эксперимента в школе.
В курсовой работе основное внимание уделяется
вопросам материального обеспечения школьного химического эксперимента, влиянию
научно-технического прогресса на современное оборудование, технику и методику
проведения различных видов эксперимента с использованием традиционного и нового
оборудования. Необходимое требование школьной реформы к эксперименту по химии:
включить новое оборудование для химического эксперимента, разработанное с
учетом научно-технических достижений и передового опыта школ; показать
организацию и проведение химического эксперимента на основе комплектов и наборов
унифицированных узлов и деталей для монтажа различных приборов и установок;
предусмотреть вариативность постановки химического эксперимента,
осуществляемого с помощью нового и модернизированного оборудования, а также с
учетом локальных условий и требований, предъявляемых к самооборудованию,
имеющему особо важное значение в обучении химии; выявить возможность
использования различных приборов для осуществления межпредметных связей.
Все это направлено на оптимизации обучения химии
и предусматривает: сокращение время на подготовку и проведение эксперимента.
Учебный исследовательский эксперимент.
Исследовательская работа учащихся - важное средство формирования их интереса к
предмету, развития профессиональной ориентации. Однако подбор объекта и методов
исследования часто представляют трудную задачу для учителя.
Одни из доступных объектов исследования -
пищевые продукты. Предлагают эксперимент по определению в них поваренной соли.
Он прост и доступен для понимания учащихся, начиная с 8 класса, не требует
слишком сложного оборудования. Работа по этой тематике будет способствовать
формированию у учащихся представлений о здоровом образе жизни и рациональном
питании.
В эксперименте используется одна из ГОСТовых
методик определения хлорида натрия в молочных продуктах. Сущность метода
заключается в извлечении хлорида натрия из исследуемого продукта, проведение
реакции ионного обмена на катионите КУ-2 в Н-форме, титровании образовавшейся
кислоты раствором щелочи известной концентрации. Важно, чтобы работа учащихся
не носила чисто исполнительский характер. Для этого необходимо включать в нее
все стадии научного исследования: теоретический анализ, построение гипотезы,
планирование эксперимента, экспериментальную работу, анализ полученных
результатов, формулировку выводов, оформление отчета.
Можно предложить следующую методику проведения
работы по данному направлению. На первом этапе формируется цель исследования:
разработать метод определения хлорида натрия, пригодный к воспроизведению в
школьных условиях. В ходе беседы учащиеся знакомятся с понятиями массового и
объемного анализа, в качестве примера учитель демонстрирует определение кислоты
титрованием [16].
Ставится задача с помощью учебника и
дополнительной литературы найти способ и предложить реакции, с помощью которых
можно определить содержание хлорида натрия. На следующем занятии обсуждаются
способы, предложенные учащимися, отмечается невозможность использования дорогих
или ядовитых реактивов (соли серебра, свинца) для проведения анализа в школьных
условиях [10].
1.4 Педагогические
основы химического эксперимента
Химический эксперимент как источник познания и
средство воспитания.
В процессе обучения химии важное значение имеет
химический эксперимент. Он является составной частью учебного процесса.
Экспериментальный характер химии вообще проявляется прежде всего в том, что
каждое фундаментальное научное понятие должно логически вытекать из
поставленной задачи и обосновываться практически. Познание начинается с
ощущения и восприятия конкретных предметов, явлений, процессов, фактов и
переходит затем к обобщению и абстрагированию. Химическое понятие - это
обобщенные знания о существенных признаках химических явлений и процессов,
которые формулируются на основе их восприятия. Их анализ дает возможность найти
существенные, присущие им всем черты и на этой основе установить химические
закономерности. Применяя различные виды химического эксперимента, учитель учит
учащихся конкретизировать теоретические знания, находить общее в единичном,
конкретном. Химический эксперимент помогает учащимся наполнить усваиваемые ими
химические понятия живым, конкретным содержанием, увидеть в отдельных фактах
общие закономерности.
Химический эксперимент способствует развитию
самостоятельности, повышает интерес к химии, так как в процессе его выполнения
учащиеся убеждаются не только в практической значимости такой работы, но и
имеют возможность творчески применять свои знания.
Химический эксперимент также является важным
средством развития мышления. В учебном процессе он обеспечивает умственную
активность учащихся, используется для постановки решения проблем и
рассматривается как критерий правильности полученных результатов, сделанных
выводов. Очень часто эксперимент сам становится источником ощущений и
формируемых представлений, без которых не может протекать продуктивная
мыслительная деятельность. В умственном развитии учащихся ведущую роль играет
теория, но в единстве с экспериментом, с практикой. Опыт работы учителей химии
показывает, что одной из причин в отставания в учебе некоторых учащихся является
затруднение, вызванное переходом от наглядных образов к абстрактным понятиям [6].
Для успешного проявления познавательной,
воспитывающей и развивающей функций химического эксперимента важную роль играют
его техническое оснащение, рациональная организация постановки опытов и
включения их в учебный процесс.
Эффективность эксперимента зависит от:
постановки конкретной цели и задачи, которые должны быть решены с помощью
опыта; построения рационального плана; наблюдения; умения фиксировать
результаты наблюдения; умение анализировать и обобщать полученные данные;
наличия и рационального отбора инструментов и средств, с помощью которых
учитель стимулирует и управляет наблюдением учащихся. Поэтому организация
целенаправленного наблюдения, формирование навыка наблюдения, умение
осмысливать результаты наблюдений и сохранять в памяти переработанную
информацию составляют одну и важнейших задач химического эксперимента.
Осмысление, понимание учебного материала
предусматривают не только регистрацию и накопление данных наблюдений и
экспериментов, но и их правильное толкование. Успех работы в значительной мере
зависит от того, насколько правильно определены характер деятельности учителя и
учащихся; место химического эксперимента и наиболее целесообразные формы и
приемы осуществления его на уроках [2].
Необходимость подготовки эксперимента учителем
определяется учебно-воспитательными задачами, которые предъявляются к
эксперименту содержанием предмета химии и методикой его преподавания.
Основные требования к знаниям и умениям учащихся
по химии в 8, 9, 10 и 11 классах.
. Требования к выполнению химического
эксперимента в 8 классе.
Знать правила работы с применяемыми в процессе
эксперимента химическими веществами.
Уметь обращаться с пробирками, мерными сосудами,
лабораторным штативом, спиртовкой; растворять твердые вещества; проводить
нагревание, фильтрование; обращаться с растворами кислот и щелочей; собирать из
готовых деталей приборы для получения газов и наполнять ими сосуды вытеснением
воздуха; выполнять правила по охране труда, уметь оказывать первую помощь при
ожогах кислотами и щелочами.
Уметь определять кислород, водород, растворы
кислот и щелочей. Уметь проводить реакцию нейтрализации.
. Требования к выполнению химического
эксперимента в 9 классе.
Уметь готовить растворы с заданной массовой
долей растворенного вещества, распознавать с помощью качественных реакций
катионы кальция, бария, ненасыщенные углеводороды и белки.
. Требования к выполнению химического
эксперимента в 10 классе.
Уметь собирать прибор для получения газов и
пользоваться им; уметь определять хлорид-, сульфат-, карбонат- и фосфат-ионы,
аммиак. Уметь решать экспериментальные задачи.
. Требования к выполнению химического
эксперимента в 11 классе.
Знать правила работы с органическими веществами,
учитывая их токсичность и пожарную опасность.
Уметь практически определять по характерным
реакциям некоторые органические вещества: ненасыщенные углеводороды,
многоатомные спирты, альдегиды, углеводы (глюкозу), белки [17].
Эффективность обучения химии связана с общим
планированием учебного материала. Преподаватель химии должен уметь планировать
эксперимент и методически правильно применять его, отбирая варианты опытов,
руководить познавательной деятельностью учащихся.
Химический эксперимент планируется в
перспективе. Для этого, в начале учебного года в перспективном плане в
соответствии с учебной программой устанавливается последовательность
преподавания демонстраций, лабораторных опытов, практических занятий и
экспериментальных задач по темам и их связь с теоретическими занятиями.
Определяется перечень экспериментальных умений и навыков, подлежащих привитию
учащимся, и намечаются дидактические средства, с помощью которых можно достичь
поставленные цели; устанавливаются внепрограммные виды химического эксперимента
[13].
1.5 Химический
эксперимент в проблемном обучении
Характерной особенностью развивающего обучения
является все более широкое использование проблемного подхода, который включает
в себя создание проблемной ситуации, понимание проблемы, деятельностью, направленную
на ее решение и получение определенных знаний. Проблемный подход предполагает
активизацию мыслительной деятельности учащихся при постановке перед ними
познавательных задач. Решая эти задачи, учащиеся могут встретиться с трудностью
понимания и осмысления нового учебного материала, т.е. с возникшей проблемной
ситуацией.
Проблемная ситуация - это затруднение или
противоречие, возникшее в процессе выполнения определенной учебной задачи, для
разрешения которой требуется привлечения не только уже имеющихся знаний, но и
получение новых.
Учащиеся быстрее включаются в активную
деятельность в том случае если: проблемная ситуация вызывает у них не только
чувство затруднения, но и уверенность в возможности его преодоления, т.е. она
не слишком проста, но и не слишком трудна.
Проблемные ситуации могут возникать при
расхождении:
1) между
имеющимися знаниями и наблюдаемыми новыми фактами и явлениями. Например,
взаимодействуют с кислотами. Опыт взаимодействия гидроксида алюминия с
гидроксидом натрия вызывает у учащихся недоумение, т.к. в реакцию вступают
нерастворимое и растворимое основания.
2) между
имеющимися знаниями и навыками условиями их применения. Например, при
взаимодействии растворов солей аммония и щелочей учащиеся наблюдают выделение
газа. Учащиеся затрудняются объяснить сущность данного опыта, т.к. до сих пор
они были убеждены, что при взаимодействии растворов солей и щелочей должен
образовываться только осадок.
3) между
теоретическими и практическими знаниями. Например, в представлении учащихся
вода является растворителем многих веществ, в том числе и солей. Растворение
солей они относят к физическим явлениям. Наблюдение гидролиза солей вступает в
противоречие с имеющимися практическими знаниями.
Известно, что создавать проблемные ситуации и
решать их можно с помощью различных методов, привлечениям наглядных и
технических средств обучения, а также с использованием химического
эксперимента. Например, при постановке демонстрационных и лабораторных опытов,
результаты которых не могут быть объяснены учащимися на базе имеющихся у них
знаний, поскольку в них, как правило, содержится новая информация, для
понимания которой нужны новые знания.
Демонстрационный и лабораторный опыты в процессе
проблемного обучения могут, во-первых, служит материалом для создания проблемных
ситуаций и, во-вторых, использовать для их решения.
Чтобы создать проблемные ситуации, преподавателю
необходимо анализировать учебный материал с точки зрения содержания, структуры,
особенностей его усвоения учащимися и возможностей использования опытов для
постановки и решения проблем. Учащихся необходимо обучать решению проблем -
сначала преподаватель сам ставит проблему и показывает пути ее решения, затем
проблемные ситуации анализируются под руководством учителя.
Проблемные ситуации и активная самостоятельная
деятельность создают на уроке атмосферу творчества, развивают интерес к
химической науке, стимулируют глубокое изучение ее фундаментальных законов и
теорий, учат аргументировано отстаивать свою точку зрения.
Ситуация несоответствия (или конфликтов). Эта
ситуация возникает, когда жизненный опыт учащихся, их представление о том или
ином явлении вступают в противоречие с научными данными, или когда возникает
противоречие между теоретически возможным способом решения задачи, найденным
учащимися и невозможностью практического осуществления.
Ситуация неожиданности. Эта ситуация создается
при ознакомлении учащихся с материалом, вызывающим удивления, поражающим своей
неожиданностью и необычностью.
Ситуация опровержения. Она создается, когда
учащимися предлагается на основе всестороннего анализа, доказать
несостоятельность какого-либо предложения, идеи, вывода и т. д.
Ситуация предположения. Эта ситуация создается,
когда предполагается существования какого-либо явления, закона или теории,
расходящегося с полученными ранее знаниями или же требуется доказать
справедливость какого-либо предположения.
Ситуация неопределенности. Возникает, когда
учащимся предлагается задания с недостаточным, избыточным или противоречивым
данным заведомо допущенными ошибками [18].
Использование химического эксперимента при
проблемном обучении открывает больше возможности как для создания и разрешения
проблемных ситуаций, так и для проверки правильности выдвинутой гипотезы.
Эксперимент оказывает положительное влияние на умственное развитие учащихся.
Выполняя лабораторные опыты и практические
работы, учащиеся самостоятельно исследуют химические явления и закономерности и
убеждаются на практике в справедливости изученных теоретических выводов,
законов и их применения, что способствует сознательному усвоению знаний.
Решая экспериментальные задачи, учащиеся не
только усовершенствуют имеющиеся экспериментальные умения и навыки, но и учатся
применять полученные теоретические знания для решения конкретных заданий. Очень
важно проводить анализ результатов экспериментов, чтобы получить четкий ответ
на поставленный в начале опыта вопрос [13].
В курсе химии средней школы на экологические
вопросы обращается особое внимание. В решении экологических задач наиболее
эффективным остается химический эксперимент. При исследовательском эксперименте
возможна различная степень самостоятельности учащихся. Ученическое исследование
сочетает в себе использование теоретических знаний и эксперимента, требует
умение прогнозировать, строить план исследования, а в некоторых случаях
учащийся сам формирует проблему, выдвигает гипотезу и разрабатывает эксперимент
для ее проверки. Таким образом, при данной форме эксперимента от учащихся
требуется максимальная самостоятельность.
В настоящее время учителя используют много
опытов с экологическим содержанием, часть которых посвящена изучению влияния
различных антропогенных факторов на живой организм, в частности на белки, в том
числе и на ферменты [1].
Качество и эффективность химического
эксперимента зависит от подготовки и организации его преподавателем, от
подготовленности учащихся, от помощи, которую оказывает в его проведении
лаборант [13].
В условиях экологизации химического образования
возрастает роль экологизированного химического эксперимента. Его разработка в
настоящее время идет по нескольким направлениям: использование аналитических
методов для определения состояния окружения; переработка отходов, образующихся
в результате химических реакций; использование химического эксперимента для
объяснения природных явлений и процессов; разработка экологически безопасного
эксперимента; изучение воздействия веществ на живые организмы и экосистемы [11].
2. ОБЪЕКТ, МЕТОДИКА И
ПРОГРАММА ИССЛЕДОВАНИЯ
.1 Объект и программа
исследований
Все уроки проводились с применением различных
форм эксперимента с целью накопления материала для дипломной работы. Данное
исследование проводилось в г. Гомеле, в средних школах №4 и №19.
Объекты дипломной работы - различные виды
химического эксперимента на уроках химии в средних школах №4 и №19 г. Гомеля.
Для проведения эксперимента были взяты 8 "Г"; 9 "В" и 11
"А" классы. В этих классах проводились уроки с использованием
школьного химического эксперимента.
Предмет исследования - изучение среднего балла,
процента успеваемости учащихся, влияние уроков с использовании различных видов
химического эксперимента на знания, умения и навыки учащихся.
Цель: применение на практике уроков с
экспериментом по химии, с последующим анализом собственных педагогических
исследований.
Расчеты:
Для расчета некоторых величин, которые играют
важную роль, для того, чтобы понять значение уроков с химическим экспериментом,
мы применяли следующие формулы
средний балл = (количество баллов)/(кол-во
оценок)
процент успеваемости = [(количество
оценок)/(кол-во учеников)]•100%
Велся журнал учета успеваемости в восьмых,
девятых и одиннадцатых классах.
Самым первыми из уроков был урок по
приготовлению раствора с заданной массовой долей растворенного вещества. Нами
была поставлена проблема в начале урока. Задача учеников состояла в том, чтобы
в ходе урока более подробно рассмотреть проблему данной темы урока.
Надо отметить, что ученики восприняли такой ход
урока с большим интересом, но проблема все-таки возникла. Он состоял в
следующем: урок требует довольно глубокой подготовки не только учителя, но и
учеников.
А так как со стороны учеников первый урок не
вызвал нужной серьезности, то некоторые ребята не смогли рассмотреть отдельные
вопросы более глубоко. Но, повторимся: «Это был пробный урок», - который дал
понять ученикам, что такие уроки интересны, требуют постоянной подготовки к
каждому уроку, и более глубокое изучение, иногда также с использованием
дополнительной литературы, к итоговому уроку по данной теме.
Программа исследования включала следующие
вопросы:
1) проработка литературных источников по
тематике дипломной работы;
2) составление рабочих планов конспектов
уроков химии с применением различных видов химического эксперимента;
) проведение педагогических исследований;
) обсуждение собственных результатов и
сравнение их с литературными значениями.
2.2 Методика
исследований
.2.1 Практическая
работа
План-конспект урока
Тема: «Приготовление раствора с заданной
массовой долей растворенного вещества»
Цель работы: познакомить со способами
приготовления раствора с заданной массовой долей растворенного вещества;
закрепить свои знания о количественном выражении состава растворов; повторить
основные правила поведения и работы в химической лаборатории; научить учащихся
готовить растворы определенной концентрации, соблюдая правила по технике
безопасности.
Ход урока
. Организационный момент.
. Проверка знаний.
В начале урока идет опрос домашнего задания
фронтально.
. Этапы урока.
I. Правила по охране труда, которые необходимо
соблюдать при выполнении работы.
Перед тем, как приступить к выполнению
практической работы сейчас повторим правила по технике безопасности при работе
на уроке химии.
1) Прежде чем приступить к выполнению
работы, изучите по тетради для лабораторных работ последовательность ее
проведения. Следует соблюдать все указания по безопасному обращению с
веществами и растворами, методами нагревания, наполнения сосудов и т.д.
2) Проверить наличия исправности приборов,
посуды и других приборов, необходимых для выполнения работ в кабинете химии.
) Освободить место выполнения работ от всех
ненужных для работы предметов и материалов.
) Подготовленное к работе место и прибор
необходимо показать учителю.
) Приступать к выполнению работы только
после разрешения учителя химии.
) Выполняйте только ту работу, которая
предусмотрена заданием.
) При выполнении работы не отвлекайтесь
сами и не отвлекайте других учащихся от выполнения работы.
) При выполнении работ пользуйтесь
посудой, приборами и веществами, представленными учителем.
) Химические вещества для опыта берите
строго в количествах, предусмотренных методикой проведения опыта.
) Не берите химические вещества не
защищенными руками, используйте для этой цели фарфоровые ложечки или шпатели.
) Насыпайте или наливайте реактивы на
столе.
) Не пробуйте химические вещества на
вкус.
) При определении вещества по запаху не
наклоняйтесь над горловиной сосуда и не вдыхайте сильно пары или выделяющейся
газ. Для этого нужно легким движением ладони над горловиной сосуда направить
пары или газ к носу и осторожно вдохнуть.
) При нагревании жидкостей держите сосуд
(колбу, пробирку) отверстием от себя и не направляйте их на соседей.
) Растворение щелочи следует производить
в фарфоровой посуде путем прибавления к воде небольших порций вещества при
непрерывном помешивании.
) Пользуясь кислотами, не приливайте воду
к кислоте, следует делать наоборот - приливать кислоту в воду.
) Запрещается выливать остатки кислот,
щелочей и других реактивов, а также растворов, полученных в результате опыта,
после проведения лабораторных занятий в канализацию. Отработанную жидкость
следует собирать в отведенную стеклянную посуду.
) По окончании практических и
лабораторных работ учащиеся должны вымыть руки с мылом, так как при неопрятном
состоянии рук под ногтями могут скапливаться вредно действующие вещества,
которые при попадании с пищей в организм приводят к отравлению.
II. Беседа по выполнению работы.
Беседую с учащимися о последовательности
проведения практической работы.
III. Выполнения работы (индивидуальное задание).
Индивидуально каждому ученику раздаю карточку с
заданной концентрацией. Затем учащиеся выполняют работу по плану ее проведения:
· рассчитайте массы вещества и воды,
необходимые для приготовления заданного раствора.
IV. Приготовления раствора:
· взвесьте рассчитанную массу
вещества;
· отмерьте нужный объем (массу) воды;
· всыпьте в стакан приготовленную
навеску вещества, влейте воду, размешайте.
V. Сделайте отчет о проделанной работе,
придерживаясь общего плана:
1) название работы;
2) цель работы;
) использованное оборудование;
) название каждой части работы с краткой
записью результатов, соответствующими рисунками, поясняющими подписями и
ответами на поставленные вопросы;
) при необходимости - расчеты или
уравнения соответствующих химических реакций;
) общий вывод из проделанной работы.
После выполнения работы собираю практические
тетради.
2.2.2 Лабораторный опыт
План-конспект урока
Тема: « Химические свойства уксусной кислоты»
Задачи: совершенствовать знания учащихся о
кислотах, их химических свойствах, обусловленных наличием ионов Н+; развивать
знания о функциональной группе как группе, определяющей свойства органических
веществ; развивать у учащихся практические умения работать с реактивами и
оборудованием в соответствии с правилами безопасности, умения анализировать
результаты лабораторных исследований, делать выводы; воспитать у учащихся такие
качества, как коллективизм, ответственность за результат работы.
Для учащихся
Знать: химические свойства уксусной кислоты как
органического вещества, содержащего в своем составе карбоксильную
функциональную группу.
Уметь: проводить исследования, составлять
уравнения химических реакций, делать сравнения и выводы.
Материальное обеспечение урока
Л.о. 8. Химические свойства уксусной кислоты.
Раствор СН3 СООН, растворы NaOH,
СаСО3, СаSО4, СuО,
спиртовка, Mg, Fe,
Сu, индикаторы.
Домашний эксперимент: NаНСО3,
уксус, 3 шарика, 3 колбы.
Инструкция для учащихся о проведении
лабораторного опыта.
Урок изучения нового материала
Форма проведения урока: работа в группах.
Тестовые задания (4 варианта).
Ход урока
. Мотивация и целеполагание.
― У древних греков
представление о кислом вкусе связывалось, прежде всего, с уксусом - раствором
уксусной кислоты, образующемся при скисании вина. Само слово «уксус» означало
кислый. Тема сегодняшнего урока - «Химические свойства уксусной кислоты». Какие
цели мы себе определим?
Ознакомление учащихся со структурой урока.
. Активизация мыслительной деятельности.
― «Кислый» - кислоты
- вещества, которые мы изучаем. Дайте определение неорганическим кислотам,
которое вам известно из 8 и 9 классов.
HCl = H+
+ Cl-.
― Чем обусловлены
свойства растворов кислоты?
Определить их можно с помощью… (индикатора).
Все неорганические кислоты обладают сходными
свойствами, так как в их растворах присутствуют…(ионы H+).
― С чем будут
реагировать растворы кислот?
Составляется схема «Химические свойства соляной
кислоты».
. Изучение нового материала и первичный
контроль.
― Мы изучаем
органические кислоты, поэтому наша задача - установить, будут ли уксусной
кислоте характерны аналогичные свойства. Чем определяется свойства вещества?
― Что особенного в
строении карбоновой кислоты? Чем будет определяться ее свойства?
― Каким будет
кислотный остаток уксусной кислоты?
― Для изучения
свойств уксусной кислоты созданы исследовательские лаборатории, каждая из
которых получила свое задание.
Учащиеся читают инструкцию к лабораторному
исследованию, слушают инструктаж по ОТ, выполняют опыты, работая в группах.
Результаты и выводы оформляют в тетрадях. Защита результатов исследования
проводится у доски.
. Закрепление и обобщение изученного материала.
Выводы оформляются в виде схемы.
. Домашнее задание.
§ 23.
. Контроль знаний.
Выполнение тестовых заданий по вариантам.
― Оцените себя.
Лабораторный опыт:
1) выполнение практической части - 3 балла;
2) оформление опыта в тетради - 3 балла;
) выводы - 3 балла.
Защита - 2 балла.
Тестовое задание (за каждый правильный ответ,
уравнение - по 1 баллу).
-18 баллов - 10.
- 15 баллов - 8.
- 12 баллов - 6.
- 9 баллов - 4.
. Рефлексия и итог урока.
― Уксусная кислота
«на память» о сегодняшнем уроке зажигает для вас фонарики.
Демонстрация домашнего эксперимента.
Группа № 1. Инструкция к лабораторному
исследованию
1. Прослушайте инструктаж по охране труда.
2. Проделайте опыт.
Налейте в 3 пробирки по 1 см3 раствора уксусной
кислоты. В каждую пробирку добавьте по несколько капель индикатора: лакмуса,
метилоранжа, фенолфталеина. (Осторожно! Кислота!) Проведите наблюдения.
3. Оформите результаты в тетрадях. Сделайте
выводы.
4. Подготовьте отчет.
Группа № 2. Инструкция к лабораторному исследованию
1. Прослушайте инструктаж по охране труда.
2. Проделайте опыт.
Налейте в 3 пробирки по 1 см3 раствора уксусной
кислоты. В первую поместите порошок магния, во вторую - порошок железа, в
третью - медную проволоку. (Осторожно! Кислота!) Проведите наблюдения, обратив
внимание на признаки происходящих реакций.
3. Оформите результаты в тетрадях. Сделайте
выводы.
4. Подготовьте отчет.
Группа № 3. Инструкция к лабораторному
исследованию
1. Прослушайте инструктаж по охране труда.
2. Проделайте опыт.
Налейте в пробирку 1см3 раствора гидроксида
натрия. Добавьте 1 - 2 капли фенолфталеина. Затем приливайте по каплям раствор
уксусной кислоты. (Осторожно! Кислота!) Проведите наблюдения, обратив внимание
на признаки реакции.
3. Оформите результаты в тетрадях. Сделайте
выводы.
4. Подготовьте отчет.
Группа № 5. Инструкция к лабораторному
исследованию
1. Прослушайте инструктаж по охране труда.
2. Проделайте опыт.
Налейте в две пробирки по 1 см3 раствора
уксусной кислоты. (Осторожно! Кислота!) В одну пробирку поместите порошок СаСО3
, в другую - СаSО4.
Проведите наблюдения, обратив внимание на признаки реакций.
3. Оформите результаты в тетрадях. Сделайте
выводы.
4. Подготовьте отчет.
Затем раздаю тестовые задания для проверки
усвоения нового материала.
После звонка собираю тетради.
3. РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ И ИХ
ОБСУЖДЕНИЕ
3.1 Проведение
уроков с применением химического эксперимента
За период работы над дипломной работой мы не
только вели журналы успеваемости в классах, в которых проводились уроки с
использованием химического эксперимента, но и просто наблюдали за учащимися. И
надо сказать, что мы заметили достаточно большое изменение у ребят в классах, в
которых практиковалась такая форма обучения как химический эксперимент. Ребята
стали более внимательно относиться к подготовке домашнего задания, так как они
поняли, что лучше готовятся к каждому уроку. Ученики очень активно участвовали
в организации проведенных нами уроков, много проработали дополнительной
литературы, проделали немалую самостоятельную работу при подготовке к этим
урокам. Ученикам очень понравилось то, что они могли сами высказать свое мнение
о проведенном уроке, высказать какие-либо пожелания, и они были рады тому, что
их пожелания учитывались.
Попробуем более подробно показать, как же
повлияло проведение таких уроков на качество знаний учащихся.
В 9 «В» классе проводился урок на тему
«Приготовление раствора с заданной массовой долей растворенного вещества».
Итоги проведенного урока показаны в таблице 2. Учащиеся выполняли практическую
работу с использованием химического эксперимента. Для каждого учащегося было
выдано индивидуальное задание на карточках.
гидрокарбонат кислота соль вещество
Таблица 2 - Успеваемость учащихся на уроке по
теме: «Приготовление раствора с заданной массовой долей растворенного вещества»
в 9 «В» классе
|
Количество
баллов
|
Количество
учащихся
|
Средний
балл
|
%
успеваемости
|
|
0
- 2 3 4 5 6 7 8 9 10
|
−
1 6 3 6 4 4 1 1
|
6,04
|
60
|
Здесь ребята усвоили большой объем знаний, как
готовить растворы с заданной массовой долей растворенного вещества. Все это
хорошо уложилось в памяти учеников, т.к. форма урока очень увлекательна и
интересна.
В 9 «В» классе проводился урок решения
экспериментальных задач по теме «Металлы». На этом уроке ребята выполняли
практическую работу. Перед выполнением работы мы с учащимися решали цепочки
превращения, для того чтобы повторить химические свойства металлов. Результаты
урока отображены в таблице 3.
Таблица 3 - Успеваемость учащихся на уроке по
теме: «Решение экспериментальных задач по теме «Металлы» в 9 «В» классе
|
Количество
баллов
|
Количество
учащихся
|
Средний
балл
|
%
успеваемости
|
|
0
- 4 5 6 7 8 9 10
|
−
4 6 6 4 3 1
|
6,85
|
69
|
На этом уроке учащиеся закрепили знания о
химических свойствах металлов. Ребята научились определять опытным путем
вещества, которые были выданы им в пробирках. Записывали наблюдения и делали
выводы. Записывали уравнения реакций в молекулярной и сокращенной ионной
формах.
В 9 классе учащиеся выполняли практическую
работу по теме «Получение углерод (IV)-оксида.
Изучение его свойств». Итоги урока указаны в таблице 4.
Таблица 4 - Успеваемость учащихся на уроке по
теме: «Получение углерод (IV)-оксида.
Изучение его свойств» в 9 «В» классе
|
Количество
баллов
|
Количество
учащихся
|
Средний
балл
|
%
успеваемости
|
|
0
- 4 5 6 7 8 9 10
|
−
4 3 8 5 2 3
|
7,28
|
73
|
В процессе выполнения практической работы
ученики получили большой объем знаний как получить в лабораторных условиях
опытным путем углерод (IV)-оксид,
получили навыки о том как собрать газ в пробирку методом вытеснения воздуха.
Изучили свойства углерод (IV)-оксида.
Урок понравился ребятам.
В этом же классе проводился урок по теме
«Угольная кислота и ее соли». Перед тем, как рассматривать новый материал была
проведена небольшая самостоятельная работа. Этот урок объяснения нового
материала с лабораторным опытом. Результаты урока показаны в таблице 5.
Таблица 5 - Успеваемость учащихся на уроке по
теме: «Угольная кислота и ее соли» в 9 «В» классе
|
Количество
баллов
|
Количество
учащихся
|
Средний
балл
|
%
успеваемости
|
|
0
- 4 5 6 7 8 9 10
|
−
1 8 5 8 1 3
|
7,64
|
76
|
Ребята заинтересованно слушали и с большим
удовольствием выполняли лабораторный опыт. Во время закрепления нового
материала они активно и с большим интересом участвовали, отвечая на вопросы. В
конце урока нами оценивался каждый ученик.
Решение экспериментальных задач по темам: амины,
аминокислоты, белки, который проводился в 9 классе. Итоги его представлены в
таблице 6. Учащиеся 9 «В» класса выполняли самостоятельную практическую работу,
используя химический эксперимент.
Таблица 6 - Успеваемость учащихся на уроке по
теме: «Решение экспериментальных задач» в 9 «В» классе
|
Количество
баллов
|
Количество
учащихся
|
Средний
балл
|
%
успеваемости
|
|
0
- 5 6 7 8 9 10
|
−
2 9 8 9 3
|
7,9
|
79
|
Здесь ребята усвоили большой объем знаний по
выявлению белка, крахмала, глюкозы и этанола. Также учащиеся получили большое
количество знаний об использовании и применении изучаемых элементов в
современном мире. Все это хорошо уложилось в памяти учеников, т.к. форма урока
очень увлекательна и интересна.
Также проводились уроки химии с применением химического
эксперимента в 8 «Г» классе. Тема практической работы «Приемы обращения с
простейшим лабораторным оборудованием». Итоги урока в таблице 7.
Таблица 7 - Успеваемость учащихся на уроке по
теме: «Приемы обращения с простейшим лабораторным оборудованием» в 8 «Г» классе
|
Количество
баллов
|
Количество
учащихся
|
Средний
балл
|
%
успеваемости
|
|
0
- 2 3 4 5 6 7 8 9 - 10
|
−
1 3 4 8 3 2 −
|
5,71
|
58
|
На этом уроке учащиеся изучили правила работы в
кабинете химии, научились обращаться с пробирками, мерными сосудами, лабораторным
штативом, спиртовкой; растворять твердые вещества; проводить нагревание,
фильтрование; обращаться с растворами кислот и щелочей. Получили навыки как
обращаться с простейшим лабораторным оборудованием, необходимым для проведения
эксперимента (лабораторный штатив, спиртовка, электронагреватель, мерная и
лабораторная посуда; разделять смеси способом фильтрования и выпаривание; мы с
ребятами беседовали на тему значение эксперимента в становлении и развитии
химической науки.
В этом же классе проводился урок объяснения
нового материала по теме «Простые и сложные вещества». Во время объяснения
материала учащиеся выполняли лабораторный опыт. Результаты урока указаны в
таблице 8.
Таблица 8 - Успеваемость учащихся на уроке по
теме: «Простые и сложные вещества» в 8 «Г» классе
|
Количество
баллов
|
Количество
учащихся
|
Средний
балл
|
%
успеваемости
|
|
0
- 3 4 5 6 7 8 9 10
|
−
1 4 9 3 3 2 −
|
6,29
|
63
|
Когда мы проводили закрепление нового материала,
то ребята показали хорошие результаты.
На уроке по теме «Получение кислорода и изучение
его свойств» учащиеся получали кислород в лабораторных условиях и изучали его
свойства. Итоги урока приведены в таблице 9.
Таблица 9 - Успеваемость учащихся на уроке по
теме: «Получение кислорода и изучение его свойств» в 8 «Г» классе
|
Количество
баллов
|
Количество
учащихся
|
Средний
балл
|
%
успеваемости
|
|
0
- 4 5 6 7 8 9 10
|
−
4 9 5 3 2 1
|
6,70
|
67
|
Научились собирать из готовых деталей приборы
для получения газов и наполнять ими сосуды вытеснением воздуха; выполнять
правила по охране труда, получили большое количество знаний о свойствах
кислорода, научились доказывать, что в данной колбе кислород, научились, как
нужно правильно нагревать пробирки с веществом на спиртовке. Все это хорошо
уложилось в памяти учеников, т.к. форма урока очень увлекательна и интересна.
В 11 «А» классе проводился уроки с
использованием химического эксперимента. На уроке по теме «Получение этена и
изучение его свойств» ребята получили большое количество знаний, как получить
этен. Изучили его свойства. Результаты указаны в таблице 10.
Таблица 10 - Успеваемость учащихся на уроке по
теме: «Получение этена и изучение его свойств» в 11 «А» классе
|
Количество
баллов
|
Количество
учащихся
|
Средний
балл
|
%
успеваемости
|
|
0
- 2 3 4 5 6 7 8 9 10
|
−
1 3 3 7 3 3 1 −
|
6,0
|
60
|
Получили знания о правилах работы с
органическими веществами, учитывая их токсичность и пожарную опасность.
Выполняли правила по охране труда, получили большое количество знаний о
свойствах этена. Все это хорошо уложилось в памяти учеников.
В этом же классе проводился урок объяснения
нового материала по теме «Химические свойства уксусной кислоты». На этом уроке
учащиеся работали группами (4 группы). Итоги урока указаны в таблице 11.
Таблица 11 - Успеваемость учащихся на уроке по
теме: «Химические свойства уксусной кислоты» в 11 «А» классе
|
Количество
баллов
|
Количество
учащихся
|
Средний
балл
|
%
успеваемости
|
|
0
- 4 5 6 7 8 9 10
|
−
3 7 2 5 2 2
|
7,09
|
70
|
Ребята изучили химические свойства уксусной
кислоты путем проведения лабораторных опытов, что очень хорошо отразилось, при
закреплении материала, в ответах на тестовые задания.
Учащиеся 11 «А» класса выполняли практической
работы на тему «Получение уксусной кислоты и изучение ее свойств». Итоги урока
в таблице 12.
Таблица 12 - Успеваемость учащихся на уроке по
теме: «Получение уксусной кислоты и изучение ее свойств» в 11 «А» классе
|
Количество
баллов
|
Количество
учащихся
|
Средний
балл
|
%
успеваемости
|
|
0
- 4 5 6 7 8 9 10
|
−
1 3 4 7 4 2
|
7,76
|
78
|
Учащиеся закрепили знания о физических и
химических свойствах уксусной кислоты, как получать в лаборатории уксусную
кислоту. Урок понравился ребятам.
3.2 Сравнительный
анализ среднего балла на уроках с применением школьного химического
эксперимента
Урок с применением школьного химического
эксперимента очень эффективен в изучении химии в школе. Я в этом убедилась
сама, когда мы проводили свои исследования. Если сравнить средний балл и
процент успеваемости учащихся в классах, то можно увидеть, что ребята все лучше
и лучше усваивают химию, лучше готовятся к урокам. На уроках химии они работают
с большим удовольствием, не боятся отвечать, высказывать свои предположения и
выводы.
Чтобы более подробно разобраться в сравнительном
анализе уроков с экспериментом, мы провели некоторые расчеты, разработали
сравнительные таблицы. Все это показано ниже в таблицах 13, 14, 15.
Таблица 13 - Средние баллы учащихся 9 «В» класса
на уроках химии
|
Тема
проведенного урока
|
9
«В» (средний балл)
|
|
Приготовление
раствора с заданной массовой долей растворенного вещества» в 9 «В» классе
|
6,04
|
|
Решение
экспериментальных задач по теме «Металлы»
|
6,85
|
|
Получение
углерод (IV)-оксида.
Изучение его свойств
|
7,28
|
|
Угольная
кислота и ее соли
|
7,64
|
|
Решение
экспериментальных задач по темам: амины, аминокислоты, белки
|
7,9
|
|
Количество
учеников
|
26
|
Таблица 14 - Средние баллы учащихся 8 «Г» класса
на уроках химии
|
Тема
проведенного урока8 «Г» (средний балл)
|
|
|
Приемы
обращения с простейшим лабораторным оборудованием
|
5,71
|
|
Простые
и сложные вещества
|
6,29
|
|
Получение
кислорода и изучение его свойств
|
6,70
|
|
Количество
учеников
|
24
|
Таблица 15 - Средние баллы учащихся 11 «А»
класса на уроках химии
|
Тема
проведенного урока
|
11
«А» (средний балл)
|
|
Получение
этена и изучение его свойств
|
6
|
|
Химические
свойства уксусной кислоты
|
7,09
|
|
Получение
уксусной кислоты и изучение ее свойств
|
7,76
|
|
Количество
учеников
|
21
|
А также мы разработали диаграммы успеваемости
учащихся, в которых показан средний балл успеваемости. Все это показано в
рисунках 1,2,3.
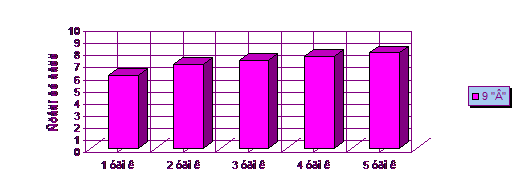
Рисунок 1 Диаграмма успеваемости
учащихся 9 «В» класса
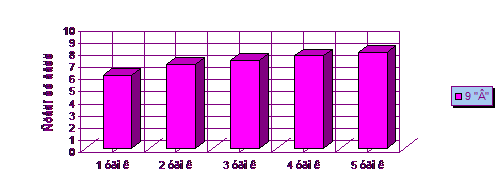
Рисунок 2 Диаграмма успеваемости
учащихся 8 «Г» класса
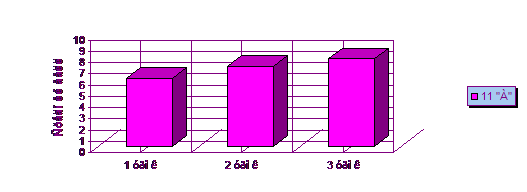
Рисунок 3 Диаграмма успеваемости
учащихся 11 «А» класса
Если рассмотреть диаграммы, на
которых указан средний балл успеваемости учащихся, и сравнить средний балл
первого урока, который проводился с использованием школьного химического
эксперимента, и средние баллы последующих уроков, то видно, что он возрастает.
И в результате проведенных наблюдений можно сделать выводы о том, что благодаря
применению химического эксперимента, успеваемость учеников имела тенденцию к
повышению.
Следовательно, отсюда видно, что
такие уроки действительно улучшают качество знаний учеников.
ЗАКЛЮЧЕНИЕ
Итак, если обобщить все
рассмотренные вопросы выше, то можно сделать некоторые выводы, относящиеся
непосредственно к данной дипломной работе по теме "Химический эксперимент
как основа изучения химии в школе"
Ученикам уроки с использованием
химического эксперимента не только интересны, но и очень полезны, т. к.
необычность уроков стимулирует умственные способности учащихся в направлении
запоминания нового материала, в закреплении старого и также развивает
логическое мышление учеников.
Химический эксперимент является
важной и неотъемлемой частью в изучении химии. Также установлено, что
химический эксперимент является своеобразным объектом изучения, методом
исследования, источником и средством нового знания. Школьный химический
эксперимент оказывает положительное влияние на развитие мышления учащихся. Это
связано с тем, что, выполняя эксперимент самостоятельно, учащиеся не только
общаются с конкретным объектом химической науки, но могут видеть и осуществлять
процессы качественного изменения веществ.
Если класс состоит из сильных
учеников, то уроки с использованием химического эксперимента проводить не
только можно, но и нужно. Как показывает опыт, ученики с большим интересом
принимают участие в провидении таких уроков. Им нравится, что они сами
участвуют в проведении уроков. На таком уроке ученик может реализовать свои
возможности, он вместе с учителем ставит цели урока, к которым должен прийти.
Педагогические исследования и
система проведенных уроков показали, что использование химического эксперимента
на уроке приводит к повышению качества знаний. Значительно повысилась
эффективность и качество учебно-воспитательного процесса.
Из всего этого можно сделать вывод,
что качество знаний учащихся повышается. Ребята развивают в ходе таких уроков и
мышление, и речь, и умственные способности. Все это имеет не малый смысл, как
для учителя, так и для учеников.
Мы считаем, что именно совместное
планирование целей урока, да и проведение самого урока, должно не только
проводиться в каждой школе, но и стать чем-то самим собой разумеющимся.
Проведение уроков с химическим экспериментом, на мой взгляд, должно
практиковаться более широко, чтобы прийти к большему пониманию между учителем и
учениками, которого в наше время то не хватает.
Большие резервы повышения качества и
эффективности учебно-воспитательного процесса заложены в действующих программах
по химии. Они предоставляют каждому учителю право самостоятельно решать вопросы
о методах работы, времени на изучение отдельных тем программы,
последовательности рассмотрения вопросов в пределах одной темы. Тем не менее
нередко у учителей возникают вопросы, где взять время на решение расчетных
задач, отработку навыков написания химических формул и уравнений и т.п.
Предметом особого внимания должно
стать выполнение практической части программы: демонстрационных и лабораторных
опытов, практических занятий.
Значительного повышения
эффективности и качества учебно воспитательного процесса помогает добиться
использование достижений педагогической и психологической науки, творческое
применение передового педагогического опыта.
Значимость исследования заключается
в том, что сделан шаг на пути поиска оптимального использования химического
эксперимента в процессе преподавания химии.
СПИСОК ИСПОЛЬЗОВАННЫХ ИСТОЧНИКОВ
1.
Злотников Э. Г. Химический эксперимент в условиях развивающего обучения // Химия
в школе. - 2001. - №1. - С. 60.
.
Назарова Т.С., Грабецкий А.А., Лаврова В.Н. Химический эксперимент в школе. -
М.: Просвещение, 1987. - 245 с.
.
Г.А.Браницкий, Т.Н.Воробьева. Реформа школы // Химия проблемы
преподавания.-2002 - №2. - С.3-4.
.
ПОСТАНОВЛЕНИЕ 24.05.2002 №21 г. Минск // Критерии и показатели оценки учебных
достижений учащихся.- 2002.- №4. - С.12-13.
.
«Я иду на урок». А.Я. Щелкунова, Н.Г. Иванова. Библиотека «Первого сентября».
Москва, 2000. - С. 25-29.
.
Аршанский Е. П. О химическом эксперименте в гуманитарных классах // Химия в
школе. - 2002. - №2. - С. 63
.
Вивюрский В.Я. Эксперимент по химии в средних школах. - М.: Высшая школа, 1980.
- 214 с.
Верховский
В.Н., Смирнов А.Д. Техника химического эксперимента. - М.: Просвещение,
1973-1975. - 415 с.
Злотников
Э. Г. О соотношении прогностической и экспериментальной деятельности учащихся
// Химия в школе. - 1998. - №6. - С. 72
Багоцкий
С. Г. Химические технологии в школьной программе: на пути к истине // Химия в
школе. - 2002. - №8. - С. 2-4
Савич
Т.З. Формирование понятия о химической реакции. - М.: Просвещение, 1978. - 229
с.
Челноков
В.В. Дифференцированный подход к учащимся при формировании экспериментальных
умений // Химия в школе. - 1996. - №6. - С. 64
Зуева
М.В., Зазнобина Л.С., Штумефкер В.А. Методика преподавания химии в средних
специальных учебных заведениях. - М.: Высшая школа, 1981. - 368 с.
Цобкало
Ж.А., Мычко Д.И. Организация внеклассных экспериментальных исследований // Хiмiя:
праблемы выкладання. - 2001. - №6. - С. 73
Перминова
Л.М. Язык химии как средство развития учащихся // Химия в школе. - 2002. - №7.
- С. 3-8
Можаев
Г. М., Симинихина В. Н. Учебный исследовательский эксперимент // Химия в школе.
- 2003. - №1. - С. 52-53
Ельницкий
А.П., Романовец Г.С., Хвалюк В.Н. Программы для учреждений, обеспечивающих
получение общего среднего образования с русским языком обучения с 11-летним
сроком обучения. - Мн.: Национальный институт образования, 2003. - 47 с.
Тюркина
Н.И. Проблемная ситуация на уроке химии как средство развития познавательной
активности и творческого мышления учащихся // Химия: проблемы преподавания. -
2004. - №2. - С. 40-43
Глазкова
О.В. Химический эксперимент в проблемном обучении // Химия в школе. - 1998. -
№3. - С. 61
Гусева
К.Е., Проскурина И.К. Разработка химического эксперимента с экологическим
содержанием // Химия в школе. - 2002. - №10. - С. 72
Полосин
В.С. Школьный эксперимент по неорганической химии. - М.: Просвещение, 1970. -
234 с.
Сентешов
В.В., Перевозчикова В.П. Эксперимент в десятых классах // Химия в школе. -
1999. - №7. - С. 62
Ситкевич
Л.И. Химический эксперимент в средней школе. - Мн.: Народная асвета, 1969. -
128 с.
Сурин
Ю.В. Развивающий эксперимент: программное обеспечение школьного курса // Химия
в школе. - 1998. - №6. - С. 6-8
Хомченко
Г.П., Платонов Ф.П., Чертков И.Н. Демонстрационный экспермент по химии. - М.:
Просвещение, 1978. - 248 с.
Цветков
Л.А. Эксперимент по органической химии. - М.: Просвещение, 1973. - 158 с.
Чернобельская
Г.М. Что происходит в методологии обучения// Химия в школе.-1997-№5. - С. 7-10
Борисов
И.Н. Методика преподавания химии. М.: Просвещение, 1976. - 462 с.
Садбалдина
С.Т. Об организации собственной деятельности учащихся на уроке // Химия в
школе. - 1988. - №2. - С. 33-38
Башкова
Л. Н. Формирование культуры здоровья младших школьников средствами химического
демонстрационного эксперимента // Химия: проблемы преподавания. - 2004. - №4. -
С. 50-56
Зайцева
Г. А. Химический кабинет как творческая лаборатория учителя и учащихся // Химия
в школе. - 2004. - №1. - С. 54-57
Амирова
А. Х. Демонстрационный и ученический эксперимент в практике обучения химии //
Химия в школе. - 2004. - №6. - С. 62-67
Беляков
С. А. Методические основы использования исторического химического эксперимента
в проблемном обучении // Химия: методика преподавания. - 2004. - №5. - С. 39-41
Аршанский
Е. П. Организация практических работ в гуманитарных классах // Химия в школе. -
2002. - №3. - С. 61
Злотников
Э. Г. Тесты по химическому эксперименту и правилам безопасности // Химия в
школе. - 2002. - №5. - С. 70-76
Правила
безопасности для кабинетов (лабораторий) химии общеобразовательных школ //
Химия в школе. -2005. - №1. - С. 50-53
Степанова
Н. А. Роль химического эксперимента в формировании культуры безопасной
жизнедеятельности // Химия в школе. - 2003. - №4. - С. 57-65
Лебедева
И.Ю. С опыта работы // Химия: проблемы преподавания. - 2001 №2. - С. 118-119
Тулубенская
Т.М. Использование химического эксперимента на уроке обобщения // Химия в
школе. - 1996. - №6. - С. 63
Радецкий
А. М. Об использовании типовых экспериментальных задач при обучении химии //
Химия в школе. - 2003. - №10. - С. 59-64
Приложение 1
Урок на тему «Решение экспериментальных задач по
теме «Металлы»
Цель работы: обобщить тему «Металлы»; повторить
химические свойства металлов в процессе осуществление превращения цепочек
уравнения химических реакций.
Ход урока
. Организационный момент.
. Проверка знаний.
Задаю цепочки превращения.
1) Na → NaOH →
Na2SO4 → NaCl
2) MgCO3 → MgO →
MgCl2 → Mg(OH)2 → Mg(NO3)2 → MgO
) Ca → CaH2 →
Ca(OH)2 → Ca
) CaCO3 → CaO →
CaCl2 → Ca(OH)2 → CaO → CaCO3
) Cu → CuS → CuO →
Cu → Cu(NO3)2 → CuO → Cu(OH)2
) Fe → FeSO4 →
Fe(OH)2 → FeCl2 → Fe → FeCl3
. Этапы урока.
II. Правила по охране труда, которые
необходимо соблюдать при выполнении работы.
Перед тем, как приступить к выполнению
практической работы сейчас повторим правила по технике безопасности при работе
на уроке химии.
1) Прежде чем приступить к выполнению
работы, изучите по тетради для лабораторных работ последовательность ее
проведения. Следует соблюдать все указания по безопасному обращению с
веществами и растворами, методами нагревания, наполнения сосудов и т.д.
2) Проверить наличия исправности приборов,
посуды и других приборов, необходимых для выполнения работ в кабинете химии.
) Освободить место выполнения работ от всех
ненужных для работы предметов и материалов.
) Подготовленное к работе место и прибор
необходимо показать учителю.
) Приступать к выполнению работы только после
разрешения учителя химии.
) Выполняйте только ту работу, которая
предусмотрена заданием.
7) При выполнении работы не отвлекайтесь
сами и не отвлекайте других учащихся от выполнения работы.
8) При выполнении работ пользуйтесь
посудой, приборами и веществами, представленными учителем.
) Химические вещества для опыта берите
строго в количествах, предусмотренных методикой проведения опыта.
) Не берите химические вещества не
защищенными руками, используйте для этой цели фарфоровые ложечки или шпатели.
) Насыпайте или наливайте реактивы на
столе.
) Не пробуйте химические вещества на
вкус.
) При определении вещества по запаху не
наклоняйтесь над горловиной сосуда и не вдыхайте сильно пары или выделяющейся
газ. Для этого нужно легким движением ладони над горловиной сосуда направить
пары или газ к носу и осторожно вдохнуть.
) При нагревании жидкостей держите сосуд
(колбу, пробирку) отверстием от себя и не направляйте их на соседей.
) Растворение щелочи следует производить
в фарфоровой посуде путем прибавления к воде небольших порций вещества при
непрерывном помешивании.
) Пользуясь кислотами, не приливайте воду
к кислоте, следует делать наоборот - приливать кислоту в воду.
) Запрещается выливать остатки кислот,
щелочей и других реактивов, а также растворов, полученных в результате опыта,
после проведения лабораторных занятий в канализацию. Отработанную жидкость
следует собирать в отведенную стеклянную посуду.
) По окончании практических и
лабораторных работ учащиеся должны вымыть руки с мылом, так как при неопрятном
состоянии рук под ногтями могут скапливаться вредно действующие вещества,
которые при попадании с пищей в организм приводят к отравлению.
Беседа по выполнению работы.
Беседую с учащимися о выполнении практической
работы. Ребята внимательно прочитали практическую работу и перед тем как
выполнять ее, каждый ученик рассказал план выполнения практической работы.
Выполнение работы.
Задача 1. В выданных вам пробирках находятся
растворы: а) калий-хлорида и кальций хлорида; б) натрий-хлорида и
барий-хлорида. Определите опытным путем, какое вещество находится в каждой
пробирке. Запишите уравнение реакций.
Задача 2. а) Получите кальций-сульфат
взаимодействием растворов кальций-гидроксида и серной кислоты. б) Получите
барий-сульфат взаимодействием растворов барий-хлорида и серной кислоты.
Запишите уравнения реакций в молекулярной и сокращенной ионной формах.
Задача 3. Из выданных вам растворов солей железа
получите гидроксиды железа (II)
и железа (III). Запишите
уравнения реакций в молекулярной и сокращенной ионной формах.
Задача 4. Необходимо очистить медную пластинку
от налета медь(II)-оксида.
Проверьте, какое из предложенных веществ - воду, серную кислоту,
натрий-гидроксид - можно использовать для этих целей. Выполните опыт, опишите
наблюдения. Сделайте вывод и запишите уравнения реакций.
Задача 5. Очистите железный гвоздь от ржавчины
химическим способом. Составьте и запишите уравнения реакций.
Задача 6. В две пробирки поместите по грануле
цинка примерно одинакового размера и прилейте разбавленную серную кислоту. В
одну из пробирок добавьте 1 - 2 капли раствора медь(II)-сульфата.
Объясните наблюдаемое. Составьте и запишите уравнения реакций.
Задача 7. Получите цинк-сульфата двумя
способами, имея в своем распоряжении цинк, цинк-оксид и раствор серной кислоты.
Запишите соответствующие уравнения реакций в молекулярной и сокращенной ионной
формах.
После выполнения практической работы учащиеся
сдают тетради.
Приложение 2
Проведение урока на тему «Получение углерод(IV)-оксида.
Изучение его свойств»
Цель работы:
) учащиеся должны знать способы получение СО2 в
лаборатории и его химические свойства;
) учащиеся должны уметь экспериментально
получить СО2, познакомиться с одним из лабораторных способов получения СО2 ,
доказать его получение, наблюдать, ставить цель эксперимента и исходя из цели
наблюдения, делать выводы; закрепить знания о физических и химических свойствах
углекислого газа:
― развить умения
записывать химические реакции;
― закрепить знания
основных правил охраны труда;
― воспитываю такие
личностные качества, как аккуратность, чувство бережного отношения к своему
здоровью через соблюдения правил охраны труда, умения работать в паре.
Ход урока
. Организационный момент.
. Проверка знаний.
. Этапы урока.
I. Правила по охране труда, которые
необходимо соблюдать при выполнении работы.
Перед тем, как приступить к выполнению
практической работы сейчас повторим правила по технике безопасности при работе
на уроке химии.
1) Прежде чем приступить к выполнению
работы, изучите по тетради для лабораторных работ последовательность ее
проведения. Следует соблюдать все указания по безопасному обращению с
веществами и растворами, методами нагревания, наполнения сосудов и т.д.
2) Проверить наличия исправности приборов,
посуды и других приборов, необходимых для выполнения работ в кабинете химии.
) Освободить место выполнения работ от
всех ненужных для работы предметов и материалов.
) Подготовленное к работе место и прибор
необходимо показать учителю.
) Приступать к выполнению работы только
после разрешения учителя химии.
) Выполняйте только ту работу, которая
предусмотрена заданием.
) При выполнении работы не отвлекайтесь
сами и не отвлекайте других учащихся от выполнения работы.
) Химические вещества для опыта берите
строго в количествах, предусмотренных методикой проведения опыта.
) Не берите химические вещества не
защищенными руками, используйте для этой цели фарфоровые ложечки или шпатели.
) Насыпайте или наливайте реактивы на
столе.
) Не пробуйте химические вещества на
вкус.
) При определении вещества по запаху не
наклоняйтесь над горловиной сосуда и не вдыхайте сильно пары или выделяющейся
газ. Для этого нужно легким движением ладони над горловиной сосуда направить
пары или газ к носу и осторожно вдохнуть.
) При нагревании жидкостей держите сосуд
(колбу, пробирку) отверстием от себя и не направляйте их на соседей.
) Растворение щелочи следует производить
в фарфоровой посуде путем прибавления к воде небольших порций вещества при
непрерывном помешивании.
) Пользуясь кислотами, не приливайте воду
к кислоте, следует делать наоборот - приливать кислоту в воду.
) Запрещается выливать остатки кислот,
щелочей и других реактивов, а также растворов, полученных в результате опыта,
после проведения лабораторных занятий в канализацию. Отработанную жидкость
следует собирать в отведенную стеклянную посуду.
) По окончании практических и
лабораторных работ учащиеся должны вымыть руки с мылом, так как при неопрятном
состоянии рук под ногтями могут скапливаться вредно действующие вещества,
которые при попадании с пищей в организм приводят к отравлению.
II. Беседа по
выполнению работы.
III. Выполнение
работы.
1) Получение углерод(IV)-оксида.
В пробирку поместите несколько кусочков мрамора
или мела, прилейте к ним 2 - 3 мл разбавленной соляной кислоты. Закройте
пробирку пробкой с газоотводной трубкой. Соберите выделяющийся газ в пробирку
методом вытеснения воздуха. Как надо расположить пробирку - вверх дном или
вниз? Почему?
) Исследование свойств углерод(IV)-оксида.
Опыт 1. Внесите в пробирку с СО2 горящую
лучинку. Что вы наблюдаете? Почему СО2 не поддерживает горение?
Опыт 2. Пропустите выделяющийся газ в пробирки:
а) с водой, подкрашенной раствором лакмуса; б) с раствором кальций-гидроксида
(«известковой водой»). Опишите и объясните наблюдаемые явления. Напишите
уравнения реакций в молекулярной и сокращенной ионной формах.
Оформите отчет о проделанной работе и сделайте
выводы.
Приложение 3
Проведение урока на тему «Решение
экспериментальных задач по темам «Амины, аминокислоты, белки»
В 9 "В" классе я провела урок по
решению экспериментальных задач. При проведении урока я хотела достичь
следующих целей: контроль знаний и понимание учащимися темы азотсодержащие
органические соединения, углеводы; развить у учащихся мышления, память.
Задачи урока: научить учащихся определять
вещества; писать уравнения реакций; знание качественных реакций.
В начале урока включаю учащихся в рабочее
состояние. Связываю пройденный материал с сегодняшним. На прошлом занятии вы
повторили темы: амины, аминокислоты, белки. Сегодня мы будем проводить
самостоятельную практическую работу.
Цели урока: обобщить знания учащихся по темам,
контроль знаний и понимание учащимися темы азотсодержащие органические
соединения, углеводы; развить у учащихся мышление и память, развить
познавательный интерес у учащихся к предмету химии;
воспитать стремление у учащихся к
самосовершенствованию.
Оборудование: листочки с заданиями для
самостоятельной работы.
Подготовка к уроку: раздать карточки для
самостоятельной работы.
Ход урока
. Организационные моменты.
. Проверка знаний.
. Этапы урока.
Правила по охране труда, которые необходимо
соблюдать при выполнении работы.
Перед тем, как приступить к выполнению
практической работы сейчас повторим правила по технике безопасности при работе
на уроке химии.
) Прежде чем приступить к выполнению
работы, изучите по тетради для лабораторных работ последовательность ее
проведения. Следует соблюдать все указания по безопасному обращению с
веществами и растворами, методами нагревания, наполнения сосудов и т.д.
2) Проверить наличия исправности приборов,
посуды и других приборов, необходимых для выполнения работ в кабинете химии.
) Освободить место выполнения работ от
всех ненужных для работы предметов и материалов.
4) Подготовленное к работе место и прибор
необходимо показать учителю.
) Приступать к выполнению работы только после разрешения
учителя химии.
) Выполняйте только ту работу, которая
предусмотрена заданием.
) При выполнении работы не отвлекайтесь
сами и не отвлекайте других учащихся от выполнения работы.
8) При выполнении работ пользуйтесь
посудой, приборами и веществами, представленными учителем.
) Химические вещества для опыта берите
строго в количествах, предусмотренных методикой проведения опыта.
) Не берите химические вещества не
защищенными руками, используйте для этой цели фарфоровые ложечки или шпатели.
) Насыпайте или наливайте реактивы на
столе.
) Не пробуйте химические вещества на
вкус.
) При определении вещества по запаху не
наклоняйтесь над горловиной сосуда и не вдыхайте сильно пары или выделяющейся
газ. Для этого нужно легким движением ладони над горловиной сосуда направить
пары или газ к носу и осторожно вдохнуть.
) При нагревании жидкостей держите сосуд
(колбу, пробирку) отверстием от себя и не направляйте их на соседей.
) Растворение щелочи следует производить
в фарфоровой посуде путем прибавления к воде небольших порций вещества при
непрерывном помешивании.
) Пользуясь кислотами, не приливайте воду
к кислоте, следует делать наоборот - приливать кислоту в воду.
) Запрещается выливать остатки кислот,
щелочей и других реактивов, а также растворов, полученных в результате опыта,
после проведения лабораторных занятий в канализацию. Отработанную жидкость
следует собирать в отведенную стеклянную посуду.
) По окончании практических и
лабораторных работ учащиеся должны вымыть руки с мылом, так как при неопрятном
состоянии рук под ногтями могут скапливаться вредно действующие вещества,
которые при попадании с пищей в организм приводят к отравлению.
Беседа по выполнению работы.
Выполнение работы.
Включаю учащихся в рабочее состояние. Связываю
пройденный материал с сегодняшним. На прошлом уроке вы повторили темы: амины,
аминокислоты, белки. Сегодня мы будем проводить практическую работу по этим
темам.
Откройте тетради, запишем тему урока: «Решение
экспериментальных задач» Откройте учебники на странице 221. В практической работе
№ 5 дано шесть заданий. В самостоятельной работе будет два варианта (Деление на
варианты 1 и 2). Для первого варианта задания 1,3,5; для второго задания 2,4,6.
На каждое задание отводиться по пять минут. Общее время для самостоятельной
работы 20 минут. Каждое задание, выполненное правильно оценивается по два
балла, дополнительные баллы, если приведены несколько реакций по заданиям.
Максимальный балл 8.
Для тех учащихся, которые претендуют на 9-10
баллов, будет дана дополнительная задача.
На решение этой задачи дополнительно дается пять
минут. Ученики приступают к выполнению практической работы.вариант
Задание 1. Докажите опытным путем, что в данном
растворе белок.
Задание 3. Докажите опытным путем качественный
состав сахарозы.
Задание 5. В двух пронумерованных пакетах
находятся сахароза и крахмал. Определите, в каком пакете находится каждое из
выданных веществ
Задача 1
Определите массу соли, полученной при
взаимодействии метиламина массой 15,5 г с НСI.
Задача 2
В каком из углеводов массовая доля водорода
больше:
а) глюкоза и сахароза;
б) сахароза и крахмал;
в) глюкоза и фруктоза.
Ответ обоснуйте.вариант
Задание 2. Докажите опытным путем, что выданное
вам вещество - крахмал.
Задание 4. В двух пронумерованных пробирках
находятся растворы глюкозы и этанола. Определите, в какой пробирке находится
каждое из выданных веществ.
Задание 6. В двух пронумерованных пробирках
находятся растворы белка и карбоновой кислоты. Определите, в какой пробирке
находятся вещества данных классов органических соединений.
Задача 1
Какая масса калий-гидроксида необходимо для
нейтрализации аминоуксусной кислоты химическим количеством 0,2 моль.
Задача 2
Какая масса раствора с массовой долей
натрий-гидроксида 15 % необходима для нейтрализации аминоуксусной кислоты
химическим количеством 0,4 моля.
По истечению времени, которое было отведено для
выполнения практической работы, собираю тетради.
Домашнее задание.
На следующем занятии будет проведена контрольная
работа по данным темам
Приложение 4
Проведение урока на тему «Приемы обращения с
простейшим лабораторным оборудованием»
Цель работы:
. Учащиеся должны знать: правила работы в
кабинете химии;
. Учащиеся должны уметь: обращаться с простейшим
лабораторным оборудованием, необходимым для проведения эксперимента
(лабораторный штатив, спиртовка, электронагреватель, мерная и лабораторная
посуда; разделять смеси способом фильтрования и выпаривание;
. На материале урока воспитываю: чувство
бережного отношения к своему здоровью и здоровью окружающих через соблюдения
ими основных правил поведения и работы в кабинете химии.
Мотивация и целеполагание: беседа на тему
значение эксперимента в становлении и развитии химической науки. Далее говорю о
том, что учащиеся будут изучать свойства веществ экспериментально.
Ход урока
. Организационные моменты.
. Проверка знаний.
Ученикам раздаю карточки с вопросами для
проверки знаний по пройденной теме.
. Этапы урока.
Правила по охране труда, которые необходимо
соблюдать при выполнении работы.
Перед тем, как приступить к выполнению
практической работы сейчас повторим правила по технике безопасности при работе
на уроке химии.
4) Прежде чем приступить к выполнению
работы, изучите по тетради для лабораторных работ последовательность ее
проведения. Следует соблюдать все указания по безопасному обращению с веществами
и растворами, методами нагревания, наполнения сосудов и т.д.
5) Проверить наличия исправности приборов,
посуды и других приборов, необходимых для выполнения работ в кабинете химии.
) Освободить место выполнения работ от
всех ненужных для работы предметов и материалов.
) Подготовленное к работе место и прибор
необходимо показать учителю.
) Приступать к выполнению работы только после
разрешения учителя химии.
) Выполняйте только ту работу, которая
предусмотрена заданием.
19) При выполнении работы не отвлекайтесь
сами и не отвлекайте других учащихся от выполнения работы.
20) При выполнении работ пользуйтесь посудой,
приборами и веществами, представленными учителем.
) Химические вещества для опыта берите
строго в количествах, предусмотренных методикой проведения опыта.
) Не берите химические вещества не
защищенными руками, используйте для этой цели фарфоровые ложечки или шпатели.
) Насыпайте или наливайте реактивы на
столе.
) Не пробуйте химические вещества на
вкус.
) При определении вещества по запаху не
наклоняйтесь над горловиной сосуда и не вдыхайте сильно пары или выделяющейся
газ. Для этого нужно легким движением ладони над горловиной сосуда направить
пары или газ к носу и осторожно вдохнуть.
) При нагревании жидкостей держите сосуд
(колбу, пробирку) отверстием от себя и не направляйте их на соседей.
) Растворение щелочи следует производить
в фарфоровой посуде путем прибавления к воде небольших порций вещества при
непрерывном помешивании.
) Пользуясь кислотами, не приливайте воду
к кислоте, следует делать наоборот - приливать кислоту в воду.
) Запрещается выливать остатки кислот,
щелочей и других реактивов, а также растворов, полученных в результате опыта,
после проведения лабораторных занятий в канализацию. Отработанную жидкость
следует собирать в отведенную стеклянную посуду.
) По окончании практических и
лабораторных работ учащиеся должны вымыть руки с мылом, так как при неопрятном
состоянии рук под ногтями могут скапливаться вредно действующие вещества,
которые при попадании с пищей в организм приводят к отравлению.
Беседа по выполнению работы.
Выполнение работы.
· Назначение и устройство штатива. Рассмотрите
лабораторный штатив, разберите его на составные части. Соберите штатив.
· Нагревательные приборы.
1) Устройство спиртовки. Спиртовка состоит из
резервуара, металлической трубки с диском, фитиля и колпачка. Заправляется
спиртовка только этиловым спиртом (только учителем или лаборантом!).
Рассмотрите спиртовку, зарисуйте ее устройство в тетрадь.
2) Работа со спиртовкой. Зажигается
спиртовка от спички. Зажигать ее с помощью зажигалки или от другой спиртовки
строго запрещено, так как это может быть причиной пожара. Гасить спиртовку
следует, только накрыв пламя колпачком. Зажгите спиртовку, погасите пламя при
помощи колпачка.
) Электронагреватель. Электронагреватель
предназначен для нагревания пробирок и подключается к источнику постоянного
электрического тока. Подключать электронагреватель к источнику следует только
после того, как пробирка установлена, а нагревательный элемент.
· Химическая посуда. Рассмотрите наиболее часто
употребляемую химическую посуду: химический стакан, коническую колбу, пробирку,
стеклянную трубку, круглодонную колбу, плоскодонную колбу, пробку с
газоотводной трубкой, фарфоровую чашку, стеклянную воронку.
· Измерительная химическая посуда.
Рассмотрите химическую посуду, предназначенную для измерения объемов жидкостей
и газов: мензурку, мерный цилиндр, мерный стакан.
· Рассмотрите рисунки 20 и 21.
Подберите названия для каждого образца химической посуды и запишите их в
тетрадь.
· Наберите в пробирку немного воды
(примерно 1/3 объема), закрепите в держателе для пробирок. Нагрейте воду до
кипения. При нагревании пробирки на пламени спиртовки прогрейте ее сначала по
всей длине, а затем только в нижней части.
· Отмерьте мерным цилиндром 25 см3
воды.
· Налейте в фарфоровую чашку немного
выданного вам раствора поваренной соли. Установите чашку на кольцо штатива и
выпарьте воду, осторожно нагревая раствор.
· Приготовьте из фильтровальной бумаги
фильтр, вложите его в воронку. Закрепите воронку в лапке штатива. Смочите
фильтр водой и профильтруйте выданную вам смесь мела и воды.
Приложение 5
Проведение урока на тему «Получение кислорода и
изучение его свойств»
В 8"Г" классе я провела урок на тему
"Получение кислорода и изучение его свойств". Во время проведения
урока я ставила перед собой следующие цели: учащиеся должны знать способы
получения кислорода в лаборатории и его химические свойства; учащиеся должны
уметь экспериментально получить кислород, доказать его получение, наблюдать,
ставить цель эксперимента и, исходя из цели наблюдения делать выводы; развивать
умение записывать химические реакции; закрепит знания основных правил охраны
труда. На материале урока воспитываю такие личностные качества, как
аккуратность, чувство бережного отношения к своему здоровью через соблюдение
правил охраны труда, умение работать в паре.
Цель работы:
) учащиеся должны знать способы получение О2 в
лаборатории и его химические свойства;
) учащиеся должны уметь экспериментально
получить О2, познакомиться с одним из лабораторных способов получения О2 ,
доказать его получение, наблюдать, ставить цель эксперимента и исходя из цели
наблюдения, делать выводы; закрепить знания о физических и химических свойствах
углекислого газа:
― развить умения
записывать химические реакции;
― закрепить знания
основных правил охраны труда;
― воспитываю такие
личностные качества, как аккуратность, чувство бережного отношения к своему
здоровью через соблюдения правил охраны труда, умения работать в паре.
Ход урока
. Организационный момент.
. Актуализация знаний.
В начале урока учащиеся вспоминают способы
получения кислорода в лаборатории; как правильно его собрать; каким способом
можно доказать, что это кислород; какие вещества образуются при взаимодействии
кислорода с веществами; как нужно нагревать пробирки с веществом на спиртовке.
. Этапы урока.
Правила по охране труда, которые необходимо
соблюдать при выполнении работы.
Перед тем, как приступить к выполнению
практической работы сейчас повторим правила по технике безопасности при работе
на уроке химии.
7) Прежде чем приступить к выполнению
работы, изучите по тетради для лабораторных работ последовательность ее
проведения. Следует соблюдать все указания по безопасному обращению с
веществами и растворами, методами нагревания, наполнения сосудов и т.д.
8) Проверить наличия исправности приборов,
посуды и других приборов, необходимых для выполнения работ в кабинете химии.
) Освободить место выполнения работ от
всех ненужных для работы предметов и материалов.
) Подготовленное к работе место и прибор
необходимо показать учителю.
) Приступать к выполнению работы только после
разрешения учителя химии.
) Выполняйте только ту работу, которая
предусмотрена заданием.
31) При выполнении работы не отвлекайтесь
сами и не отвлекайте других учащихся от выполнения работы.
32) При выполнении работ пользуйтесь посудой,
приборами и веществами, представленными учителем.
) Химические вещества для опыта берите
строго в количествах, предусмотренных методикой проведения опыта.
) Не берите химические вещества не защищенными
руками, используйте для этой цели фарфоровые ложечки или шпатели.
) Насыпайте или наливайте реактивы на
столе.
) Не пробуйте химические вещества на
вкус.
) При определении вещества по запаху не
наклоняйтесь над горловиной сосуда и не вдыхайте сильно пары или выделяющейся
газ. Для этого нужно легким движением ладони над горловиной сосуда направить
пары или газ к носу и осторожно вдохнуть.
) При нагревании жидкостей держите сосуд
(колбу, пробирку) отверстием от себя и не направляйте их на соседей.
) Растворение щелочи следует производить
в фарфоровой посуде путем прибавления к воде небольших порций вещества при
непрерывном помешивании.
) Пользуясь кислотами, не приливайте воду
к кислоте, следует делать наоборот - приливать кислоту в воду.
) Запрещается выливать остатки кислот,
щелочей и других реактивов, а также растворов, полученных в результате опыта,
после проведения лабораторных занятий в канализацию. Отработанную жидкость
следует собирать в отведенную стеклянную посуду.
) По окончании практических и
лабораторных работ учащиеся должны вымыть руки с мылом, так как при неопрятном
состоянии рук под ногтями могут скапливаться вредно действующие вещества,
которые при попадании с пищей в организм приводят к отравлению.
Беседа по выполнению работы.
Выполнение работы.
Перед выполнением практической работы проверяю
знание методики проведения опыта методом фронтального опроса. Затем учащиеся
приступают к выполнению практической работы. Инструкция выполнения работы в
учебнике на страницах 81-83, 98.
. Получение и собирание газов
Соберите прибор для получения газов. Проверьте
герметичность прибора.
В пробирку примерно 1/4 ее объема насыпьте
калий-перманганата KMnO4.
Закройте пробирку пробкой с газоотводной трубкой, предварительно положив у
самого отверстия пробирки кусочек ваты. Закрепите прибор в штативе в наклонном
положении так, чтобы дно пробирки было немного выше пробки с газоотводной
трубкой. Подготовьте стакан с подобранной для него крышкой. Нагрейте сначала
всю пробирку, а потом только ту ее часть, где находится вещество. Нагревание
начинайте от дна пробирки, а потом по мере разложения калий-перманганата
надвигайте спиртовку под ту часть пробирки, где это вещество еще не
разложилось.
Убедитесь, что из трубки выходит кислород (как
это сделать?), а затем опустите ее конец в стакан до самого дна (как должен
стоять стакан - дном вверх или вниз и почему?). После заполнения стакана
кислородом (как узнать, когда это произошло?) закройте его крышкой. Отставьте в
сторону штатив с прибором для получения кислорода.
. Исследование свойств кислорода.
Какие физические свойства кислорода можно
установить, рассматривая полученный кислород?
Внесите в стакан с кислородом тлеющую лучинку.
Что вы наблюдаете? Когда процесс закончиться, добавьте в стакан немного
известковой воды и взболтайте. Что произошло с известковой водой? О чем
свидетельствуют наблюдаемые вами изменения?
. Сделайте отчет о проделанной работе по плану.
Название работы.
Цель работы.
Использованное оборудование.
Название каждой части работы с краткой записью
результатов, рисунком прибора, пояснительными надписями и ответами на
поставленные вопросы. Уравнения соответствующих химических реакций. Общий вывод
из проделанной работы.
Приложение 6
Проведение урока на тему «Получение этена и
изучение его свойств»
Цель урока:
1. Учащиеся должны знать способы получения
этена в лаборатории и его свойства;
2. Учащиеся должны уметь экспериментально
получить этен, доказать его получение, наблюдать, ставить цели эксперимента и,
исходя из цели наблюдения, делать выводы:
― развивать умения
записывать химические реакции;
― закрепить знания
основных правил охраны труда;
. На материале урока воспитываю такие
личностные качества, как чувство аккуратности, чувство бережного отношения к
своему здоровью через соблюдения правил по охране труда, умение работать в
паре.
Ход урока
. Организационные моменты.
. Проверка знаний.
. Этапы урока.
Правила по охране труда, которые необходимо
соблюдать при выполнении работы.
Перед тем, как приступить к выполнению
практической работы сейчас повторим правила по технике безопасности при работе
на уроке химии.
10) Прежде чем приступить к выполнению
работы, изучите по тетради для лабораторных работ последовательность ее
проведения. Следует соблюдать все указания по безопасному обращению с
веществами и растворами, методами нагревания, наполнения сосудов и т.д.
11) Проверить наличия исправности приборов,
посуды и других приборов, необходимых для выполнения работ в кабинете химии.
) Освободить место выполнения работ от
всех ненужных для работы предметов и материалов.
) Подготовленное к работе место и прибор
необходимо показать учителю.
) Приступать к выполнению работы только после
разрешения учителя химии.
) Выполняйте только ту работу, которая
предусмотрена заданием.
43) При выполнении работы не отвлекайтесь
сами и не отвлекайте других учащихся от выполнения работы.
44) При выполнении работ пользуйтесь посудой,
приборами и веществами, представленными учителем.
) Химические вещества для опыта берите
строго в количествах, предусмотренных методикой проведения опыта.
) Не берите химические вещества не
защищенными руками, используйте для этой цели фарфоровые ложечки или шпатели.
) Насыпайте или наливайте реактивы на
столе.
) Не пробуйте химические вещества на
вкус.
) При определении вещества по запаху не
наклоняйтесь над горловиной сосуда и не вдыхайте сильно пары или выделяющейся
газ. Для этого нужно легким движением ладони над горловиной сосуда направить
пары или газ к носу и осторожно вдохнуть.
) При нагревании жидкостей держите сосуд
(колбу, пробирку) отверстием от себя и не направляйте их на соседей.
) Растворение щелочи следует производить
в фарфоровой посуде путем прибавления к воде небольших порций вещества при
непрерывном помешивании.
) Пользуясь кислотами, не приливайте воду
к кислоте, следует делать наоборот - приливать кислоту в воду.
) Запрещается выливать остатки кислот,
щелочей и других реактивов, а также растворов, полученных в результате опыта,
после проведения лабораторных занятий в канализацию. Отработанную жидкость
следует собирать в отведенную стеклянную посуду.
) По окончании практических и
лабораторных работ учащиеся должны вымыть руки с мылом, так как при неопрятном
состоянии рук под ногтями могут скапливаться вредно действующие вещества,
которые при попадании с пищей в организм приводят к отравлению.
Беседа по выполнению работы.
Выполнение работы.
1. Поместите в пробирку 5 - 7 кусочков
полиэтилена, каждый размером с горошину, плотно закройте пробкой с газоотводной
трубкой, закрепите пробирку в штативе и проверьте прибор на герметичность.
. Нагрейте пробирку в пламени спиртовки,
соблюдая правила по техники безопасности.
. Когда содержимое пробирки расплавится и начнет
кипеть, пропустите выделяющийся газ в другую пробирку с 1 - 2 см3 йодной воды,
опустив свободный конец газоотводной трубки до дна пробирки. Наблюдайте
происходящие изменения. Составьте уравнения реакций.
. Пропустите этен в пробирку с 1 - 2 см3
разбавленного раствора калия перманганата. Составьте уравнение реакции.
. Выньте газоотводную трубку из раствора,
поверните ее отверстием кверху и подожгите газ. Составьте уравнение реакции.
Приложение G
Проведение урока на тему «Получение уксусной
кислоты и изучение ее свойств»
Цель урока:
) учащиеся должны знать способы получение
уксусной кислоты в лаборатории и его химические свойства;
) учащиеся должны уметь экспериментально
получить уксусную кислоту, познакомиться с одним из лабораторных способов
получения уксусной кислоты, доказать ее получение, наблюдать, ставить цель
эксперимента и исходя из цели наблюдения, делать выводы; закрепить знания о
физических и химических свойствах уксусной кислоты:
― развить умения
записывать химические реакции;
― закрепить знания
основных правил охраны труда;
― воспитываю такие
личностные качества, как аккуратность, чувство бережного отношения к своему
здоровью через соблюдения правил охраны труда, умения работать в паре.
Ход урока
. Организационные моменты.
. Проверка знаний.
. Этапы урока.
Правила по охране труда, которые необходимо
соблюдать при выполнении работы.
Перед тем, как приступить к выполнению практической
работы сейчас повторим правила по технике безопасности при работе на уроке
химии.
13) Прежде чем приступить к выполнению
работы, изучите по тетради для лабораторных работ последовательность ее
проведения. Следует соблюдать все указания по безопасному обращению с
веществами и растворами, методами нагревания, наполнения сосудов и т.д.
14) Проверить наличия исправности приборов,
посуды и других приборов, необходимых для выполнения работ в кабинете химии.
) Освободить место выполнения работ от
всех ненужных для работы предметов и материалов.
) Подготовленное к работе место и прибор
необходимо показать учителю.
) Приступать к выполнению работы только после
разрешения учителя химии.
) Выполняйте только ту работу, которая
предусмотрена заданием.
55) При выполнении работы не отвлекайтесь
сами и не отвлекайте других учащихся от выполнения работы.
56) При выполнении работ пользуйтесь посудой,
приборами и веществами, представленными учителем.
) Химические вещества для опыта берите
строго в количествах, предусмотренных методикой проведения опыта.
) Не берите химические вещества не
защищенными руками, используйте для этой цели фарфоровые ложечки или шпатели.
) Насыпайте или наливайте реактивы на
столе.
) Не пробуйте химические вещества на
вкус.
) При определении вещества по запаху не
наклоняйтесь над горловиной сосуда и не вдыхайте сильно пары или выделяющейся
газ. Для этого нужно легким движением ладони над горловиной сосуда направить
пары или газ к носу и осторожно вдохнуть.
) При нагревании жидкостей держите сосуд
(колбу, пробирку) отверстием от себя и не направляйте их на соседей.
) Растворение щелочи следует производить
в фарфоровой посуде путем прибавления к воде небольших порций вещества при
непрерывном помешивании.
) Пользуясь кислотами, не приливайте воду
к кислоте, следует делать наоборот - приливать кислоту в воду.
) Запрещается выливать остатки кислот,
щелочей и других реактивов, а также растворов, полученных в результате опыта,
после проведения лабораторных занятий в канализацию. Отработанную жидкость следует
собирать в отведенную стеклянную посуду.
) По окончании практических и
лабораторных работ учащиеся должны вымыть руки с мылом, так как при неопрятном
состоянии рук под ногтями могут скапливаться вредно действующие вещества,
которые при попадании с пищей в организм приводят к отравлению.
Беседа по выполнению работы.
Выполнение работы.
1. Поместите в пробирку 0,5 ложечки
безводного натрий-ацетата и прибавьте по каплям раствор серной кислоты (1:10)
так, чтобы он смочил соль.
2. Нагревайте пробирку со смесью веществ на
пламени спиртовки (рис. 48), соблюдая правила по техники безопасности, в
течение 1 - 2 мин. Обратите внимание на появление запаха.
. Составьте уравнение реакции. Сделайте
вывод о лабораторных способах получения карбоновых кислот.
. Налейте в две пробирки 0,5 - 1 см3
раствора уксусной кислоты, выданной для проведения опыта. В первую пробирку
добавьте несколько капель раствора лакмуса, а затем нейтрализуйте кислоту
раствором щелочи. Составьте уравнение реакции. Во вторую пробирку с уксусной
кислотой поместите немного порошка магния. Составьте уравнения реакции.
. Налейте в две пробирки примерно по 0,5
- 1 см3 раствора уксусной кислоты, выданной для проведения опыта. В одну
пробирку добавьте оксид металла (магний оксид), в другую добавьте соль (натрий
гидрокарбонат или натрий гидросульфид). Наблюдайте, что происходит в пробирках.
Составьте уравнения реакций.
Сделайте выводы о свойствах уксусной кислоты,
сравните их со свойствами неорганических кислот.
Приложение 7
Проведение урока на тему «Угольная кислота и ее
соли»
Цели урока:
1) изучить химические свойства кислоты и ее
солей;
2) развить умения и навыков составления
уравнений химической реакции с участием угольной кислоты.
) Развить такие качества как:
собранность, самостоятельность;
) воспитать умения анализировать,
объективно оценивать свои знания.
Ход урока
. Организационный момент.
. Проверка знаний.
Сейчас вы напишете самостоятельную работу (25
минут)
Раздаю на каждый стол задание (4 варианта - по 3
задания).
Вариант 1.
1) Определите степень окисление следующих
веществ:
МgCl2,
Мg (ОН)2, НСlO3,
KMnO4, Fe2O3,
Н3PO4
2) Укажите окислитель и восстановитель, и
переход электронов. Дайте название веществ, расставьте необходимые
коэффициенты.
а) С + О2 → СО2
б) S
+O2 → H2S
в) Si
+ HF →
SiF4↑ + H2
↑
) Определите массу осадка (СаСО3),
образовавшегося при взаимодействии Са (ОН)2 с СО2: m
(Са (ОН)2 = 10 г.
Вариант 2.
1) Определите степень окисление следующих
веществ:
H2S,
Al2(SO4)3,
KMnO4, Р2О5, СО, Nа2СО3
2) Укажите окислитель и восстановитель, и
переход электронов. Дайте название веществ, расставьте необходимые
коэффициенты.
а) Si
+ С → SiC
б) С + СО2 → СО
в) Fe
+ Al2О3 → Fe2O3
+ Al
) При взаимодействии С массой 4 г с Fe2O3
образуется газ и выпадает в осадок Ме. Определите химическое количество газа
СО2?
Вариант 3.
1) Определите степень окисление следующих
веществ
NH3, N2O5, HNO3, KMnO4, MgCO3,
Al2(SO4)3
2) Укажите окислитель и восстановитель, и
переход электронов. Дайте название веществ, расставьте необходимые коэффициенты
а) С + Fe2O3
→ Fe + СО2
б) С + Н2O
→
H2 ↑ + CO↑
в) Mg
+ Si →
Mg2Si
) Определите количество оксида СО2, которое
образуется при разложении СаСО3 m
= 36 г.
Вариант 4.
1) Определите степень окисление следующих
веществ:
AgCl, СO,
H2S, Са
(ОН)2,
H2SO4, KMnO4.
) Укажите окислитель и восстановитель, и переход
электронов. Дайте название веществ, расставьте необходимые коэффициенты.
а) Si
+ HF →
SiF4↑ + H2
↑
б) Si
+ С → SiC
в) С + СО2 → СО
) При горении Si
с химическим количеством 2 моль, образуется SiО4,
определите его массу?
. Объяснение нового материала.
Запишите новую тему: «Угольная кислота и ее
соли».
Как вы уже знаете, что при растворении СО2 в
Воде образуется угольная кислота.
СО2 + Н2О → Н2СО3
Н2СО ― непрочное
вещество.
Угольная кислота при выделении из раствора
разлагается на СО2 и Н2О.
Н2СО3 → Н2О + СО2↑
На прошлом уроке мы проделали опыт: «
Взаимодействия с водой». Т.е. пропускали СО2 через воду подкрашенную лакмусом.
Т.к. образовалась угольная кислота (Н2СО3), то раствор с синей окраской перешел
в розовую.
В этом растворе Н2СО3 являясь слабой
двухосновной кислотой, диссоциирует ступенчато, т.е. постепенно отщепляя ионы
водорода. При этом на первой ступени такой диссоциации, помимо иона водорода
Н+, образуется ион НСО3-:
Н2СО3 ↔ Н+ + НСО3-
НСО3- ↔ Н++ СО32-
НСО3- ― это
гидрокарбонат-ион. Соли, которые содержат такой кислотный остаток, называются
кислыми:
NаОН + Н2СО3 →
NаНСО3 + Н2О
Соли, у которых замещены на металл все ионы
водорода - средними:
NаОН + Н2СО3 →
Nа2СО3 + Н2О
Химические свойства солей угольной кислоты
1. Соли угольной кислоты, кроме карбонатов
щелочных металлов, при нагревании разлагаются с выделением СО2 .
СаСО3 → СаО + СО2↑
NаНСО3 → Nа2СО3
+ СО2↑ + Н2О
. Карбонаты и гидрокарбонаты как соли очень
слабой кислоты взаимодействуют со всеми более сильными кислотами.
СаСО3 + 2НСl
→
СаСl2 + Н2О + СО2↑
. Превращение карбонатов и гидрокарбонатов.
Если пропустить углекислый газ через раствор
кальций-гидроксида, то будет наблюдаться помутнение раствора за счет выпадения
осадка кальций-карбоната:
Са (ОН)2 + СО2 → СаСО3 ↓ + Н2О
При дальнейшем пропускании углекислого газа
через образовавшуюся взвесь твердых частиц кальций - карбоната в воде твердые
частицы будут растворяться, жидкость снова станет прозрачной. Это связано с
образованием растворимого в воде кальций-гидрокарбоната:
СаСО3 + Н2О + СО2→ Са (НСО3)2
При нагревании кальций-гидрокарбоната переходит
в карбонат:
Са (НСО3)2 → СаСО3 + Н2О + СО2↑
Сейчас мы проведем лабораторный опыт 6. Но перед
тем как приступить к выполнению опыта, давайте вспомним правила по техники
безопасности (ребята зачитывают основные правила по технике безопасности).
Затем приступают к выполнению лабораторного опыта.
Лабораторный опыт 6
Взаимодействие карбонатов и гидрокарбонатов
1) В выданный вам раствор кальций- гидроксида
осторожно через чистую стеклянную трубочку пропустите выдыхаемый воздух (что в
нем содержится?) до помутнения раствора. Отметив образование мути, пропускайте
выдыхаемый воздух более интенсивно до ее исчезновения.
2) Объясните наблюдаемые явления. Запишите
уравнения происходящих реакций в молекулярной и сокращенной ионной формах.
После проведения опыта учащиеся записывают в
тетради наблюдения и уравнения реакций в сокращенной ионной и молекулярной
формах.
Затем мы продолжаем рассматривать новую тему.
При нагревании гидрокарбонаты, как уже
отмечалось выше, превращаются в карбонаты с выделением углекислого газа и воды.
Реакцию разложения натрий-гидрокарбоната:
NаНСО3 → Nа2СО3
+ СО2↑ + Н2О
используют в хлебопекарной промышленности и
дома, добавляя это вещество в тесто.
Одной из наиболее широко применяемых солей
угольной кислоты является натрий-карбонат. Это кальцинированная сода. Соду
применяют при производстве мыла, стекла, для получения неорганических
красителей и т.д. Кислую соду NаНСО3
называют пищевой содой. Ее широко используют в медицине при изжоге, а также ее
используют в пищевой промышленности.
. Закрепление нового материала.
Фронтальный опрос. Задаю вопросы классу.
· Как можно получить угольную кислоту?
· Какие соли угольной кислоты бывают?
· Как называются кислые соли?
· Как называются средние соли?
· Где применяют натрий-карбонаты?
· Что образуется при взаимодействии
карбонатов с соляной кислотой?
· Что происходит с солями угольной
кислоты при нагревании?
· С чем взаимодействуют соли уксусной
кислоты?
. Домашнее задание.
§ 20. стр. 108 - 109. № 5, 9,10 (в тетради)
Приложение 8
Проведение урока на тему «Простые и сложные
вещества»
Цели урока:
2. Учащиеся должны уметь: различать простые
и сложные вещества; смеси и сложные вещества.
. На материале урока воспитываю: чувство
бережного отношения к своему здоровью и здоровью окружающих через соблюдения
ими основных правил поведения и работы в кабинете химии.
Ход урока:
. Организационный момент.
. Проверка знаний.
На 5 минут провожу небольшую проверочную работу
по прошедшей теме. Класс делится на два варианта, раздаю задания (по две задачи
в каждом варианте).
Вариант 1.
Задача №1. Масса образца лития равна 3,5 г, а
масса образца железа - 14 г. В каком образце содержится больше атомов и во
сколько раз?
Задача №2. В земной коре содержание кислорода
составляет 49,13 % по массе. Рассчитайте, сколько атомов кислорода содержится в
образце земной коры массой 10 кг.
Вариант 2.
Задача №1. В образце золота число атомов в 3
раза меньше числа атомов в образце серебра. Рассчитайте отношение массы образца
серебра к массе образца золота.
Задача №2. Рассчитайте, сколько атомов кислорода
приходится на 100 атомов кремния в земной коре, если содержание кислорода и
кремния в земной коре соответственно равны 49,13 % и 26,00 % по массе.
. Объяснение нового материала.
Химические элементы в природе существуют в самых
различных формах, как в свободном, так и в связанном состоянии. Например,
благородные газы: гелий, неон, аргон, ксенон находятся в воздухе в виде
одиночных атомов.
Атомы всех остальных элементов в природе не
существуют изолированно друг от друга. Они всегда стремятся соединиться,
связаться с другими атомами за счет особых сил. Как вы думаете, почему так
происходит? В таком состоянии они достигают более устойчивого, стабильного
состояния.
Сейчас рассмотрим что же такое простые вещества
и молекулы. Если вещества состоят из одинаковых атомов, то они относятся к
простым веществам.
Итак, давайте запишем, какие вещества называются
простыми.
Простыми называются вещества, которые образованы
атомами одного химического элемента.
Из курсов «Вселенная» и «Физика» вы уже знаете
немного о молекулах - частицах вещества, состоящих обычно из двух и более
атомов. Что же такое молекула?
Молекула - наименьшая частица вещества,
способная существовать самостоятельно и сохраняющая его химические свойства.
Можно сказать, что молекулы благородных газов
одноатомны. Молекулы таких веществ, как кислород, водород, азот, состоят из
двух атомов (рис. 29). Молекула белого фосфора содержит четыре атома, а серы -
восемь (рис. 30).
Запишите себе в тетради «Молекулярное и
немолекулярное строение простых веществ. Металлы и неметаллы».
Простые вещества, состоящие из молекул,
относятся к веществам молекулярного строения. Элемент кислорода существует в
виде двух простых веществ молекулярного строения: одно из них (просто кислород)
состоит из двухатомных молекул, а второе (озон) из трехатомных (рис. 31).
Гораздо больше простых веществ, которые имеют
немолекулярное строение. Они обычно представляют собой твердые кристаллы,
построенные из атомов (рис. 32).
По своим свойствам простые вещества делятся на
металлы и неметаллы. Все металлы (за исключением ртути) - твердые вещества,
которые хорошо проводят электрический ток и теплоту, имеют характерный
«металлический» блеск. Большинство из них пластичны, т.е. меняют форму при
внешнем воздействии.
Простых веществ неметаллов гораздо меньше, но по
своим свойствам они различаются между собой значительно сильнее, чем металлы.
Почти все они плохо проводят электрический ток и теплоту.
Если, например, рассмотреть алмаз и графит, то
можно увидеть, что это простые вещества, состоящие из одного и того же
химического элемента - углерода. Хотя они оба имеют немолекулярное строение,
свойства этих веществ сильно отличаются: алмаз - бесцветное, прозрачное, самое
твердое вещество в природе, а графит - темно-серое, непрозрачное, мягкое
вещество. Их свойства различны потому, что различно строение их кристаллов,
хотя и построенных из одних и тех же атомов углерода.
Название простых веществ
В настоящее время известно более 400 простых
веществ, хотя элементов пока открыто только 115. Название большинства простых
веществ такие же, как и названия соответствующих химических элементов.
Необходимо различать понятия простое вещество и
химический элемент, особенно если их названия совпадают. Например, если говорят
о том, что в состав какого-то вещества входит азот, то имеют в виду химический
элемент, а когда говорят об азоте, который входит в состав воздуха, то,
конечно, речь идет о простом веществе.
Сложные вещества
Химические элементы существуют не только в виде
свободных атомов и простых веществ. Они также могут входить в состав самых
различных химических соединений.
Вещества, состоящие из атомов различных
химических элементов, называются сложными веществами или химическими
соединениями.
Подавляющее большинство химических веществ - это
сложные вещества. Вы уже знаете некоторые из них. Вода, метан, сахар,
поваренная соль - сложные вещества. Атомы химических элементов, из которых
построено сложное вещество, определяют его состав - качественный и
количественный.
Качественный состав вещества показывают, из
атомов каких элементов оно состоит. Например, вода состоит из атомов водорода и
кислорода, а метан - из атомов углерода и водорода.
Количественный состав показывает число атомов
каждого элемента в молекулах этого вещества. Например, молекула воды состоит из
двух атомов водорода и одного атома кислорода, а молекула метана - из одного
атома углерода и четырех атомов водорода.
Любое сложное вещество можно с помощью различных
химических методов разложить на несколько новых веществ, и так до тех пор, пока
не получатся вещества, каждое из которых будет являться простым. Вы это уже
видели на примере сахара и воды в курсе «Вселенная»:
сахар → вода + уголь (углерод);
вода → водород + кислород.
Свойства простых веществ, которые при этом
получались (углерода, кислорода и водорода), совершенно не похожи на свойства
сложных веществ (сахар и вода). Это разные вещества с разными свойствами.
Свойства сложного вещества не являются суммой свойств простых веществ, которые
образуются при его разложении.
Сейчас мы проведем лабораторный опыт 2. Но перед
тем как приступить к выполнению опыта, давайте вспомним правила по техники
безопасности (ребята зачитывают основные правила по технике безопасности).
Затем приступают к выполнению лабораторного опыта.
Лабораторный опыт 2
Ознакомление с образцами простых и сложных
веществ
1. Из выданных вам веществ выберите металлы и
неметаллы. По каким признакам вы разделили выданные вещества на две группы?
2. Рассмотрите выданные вам простые
вещества: железо, серу, медь, уголь. Охарактеризуйте их устно. Обратите
внимание на отношение к воде. Попробуйте нагреть каждое вещество. Что вы
наблюдаете?
. Сравните свойства сложного вещества
глюкозы со свойствами одного из простых веществ, выданных вам. Нагрейте глюкозу
на пламени спиртовки в пробирке или ложечке для сжигания веществ. Что вы
наблюдаете?
Сложные вещества, как и простые, имеют либо
молекулярное, либо немолекулярное строение. При этом вещества молекулярного
строения могут существовать в различных агрегатных состояниях. Например, метан
- газ, вода - жидкость, сахар - твердое вещество.
Необходимо различать сложные вещества и смеси
веществ. Посмотрите в учебнике таблицу 2. «Отличия между сложными веществами и
смесями веществ».
А сейчас закрепим пройденный материал.
. Закрепление нового материала.
Задаю вопросы классу. Опрос фронтальный.
· Какие вещества называют простыми?
· Какие вещества называют сложными?
· Чем отличается понятия «химический
элемент» и «простое вещество»? Поясните на примере кислорода.
· Что такое молекула?
· Чем отличаются между собой сложные
вещества и смеси? Поясните на примере воды и смеси водорода и кислорода.
Затем трем ученикам даю индивидуальное задание
на карточках.
Карточка 1. Можно ли из одного простого вещества
получить: а) одно новое сложное вещество; б) одно новое простое вещество; в)
несколько новых простых веществ; г) несколько новых сложных веществ; д) новые
простое и сложное вещество? Объясните ответ.
Карточка 2. Можно ли из одного сложного вещества
получить: а) одно новое сложное вещество; б) несколько новых сложных веществ;
в) одно простое и одно сложное вещество; г) два простых вещества; д) одно
простое вещество? Объясните ответ.
Карточка 3. Какие простые вещества являются
металлами, а какие - неметаллами: магний, азот, железо, алюминий, водород,
бром, натрий, кремний, медь, золото, фосфор, кальций, марганец? Как можно
отличить вещества металлы от веществ неметаллов?
Вызываю к доске одного ученика для решения
задачи.
Задача. Анализ порции вещества показал, что оно
содержит 24 г углерода и 32 г кислорода. Сколько атомов кислорода приходится на
каждый атом углерода в этом веществе?