Сравнительная эффективность сухой живой вакцины против трихофитии крупного рогатого скота
Сравнительная
эффективность сухой живой вакцины против трихофитии крупного рогатого скота
Введение
1. Общая характеристика работы
1.1 Актуальность темы дипломной работы
.2 Связь работы с научными программами, темами
.3 Цель и задачи исследования
.4 Методология и методы проведения исследования
.5 Научная новизна, практическая экономическая значимость
полученных результатов
.Основная часть
.1 Обзор литературы
.2 Безопасность и жизнедеятельность в хозяйстве
.3 Результаты исследований
.4 Анализ полученных результатов
.Выводы
.Предложения производству
Список использованных источников литературы
Введение
В наше время большая роль в обеспечении страны продовольствием отводится
к интенсивному развитию промышленных комплексов по производству свинины. Для
этого необходимо по-новому решать вопросы ветеринарного обслуживания
животноводческих хозяйств промышленного типа, комплектовать их здоровым
поголовьем, что обязывает ветеринарных специалистов повысить уровень
организации ветеринарного дела, обратив особое внимание на проведение
профилактических, противоэпизоотических, ветеринарно-санитарных мероприятий,
предупреждение заноса заразных болезней.
Особенно актуально это стало в связи с переходом сельскохозяйственных
предприятий на новые формы собственности, благодаря чему работники, а также
руководство непосредственно заинтересованы в увеличении количества продукции и
повышении её качества.
На сегодняшний день в условиях промышленного животноводства и
концентрации значительного поголовья свиней на ограниченной территории
увеличивается риск возникновения и распространения инфекций. Поэтому важным
аспектом успешного развития животноводства является благополучие хозяйств по
инфекционным болезням.
Одной из главных проблем промышленного животноводства являются болезни
молодняка, в частности пищеварительной и дыхательной систем. В этиологии и
патогенезе желудочно-кишечных болезней важную роль играют различные
условно-патогенные микроорганизмы и гельминты, а также нарушение кормления и
содержания, стрессы, различные токсикозы и отравления, способствующие снижению
общей резистентности организма.
Среди массовых желудочно-кишечных и септических заболеваний новорожденных
поросят первых дней жизни немалую роль занимает анаэробная энтеротоксемия.
Несмотря на большие достижения науки, положение с данным заболеванием
продолжает оставаться тяжелым в многих странах мира, в т.ч. и в Республике
Беларусь.
По данным отечественных и зарубежных исследователей анаэробная
энтеротоксемия в неблагополучных хозяйствах поражает до 100% новорожденных
поросят. Летальность от этой болезни среди животных достигает до 80%.
Возбудители данного заболевания широко распространены в природе и являются
обитателями кишечника животных и человека. Этиологическим фактором заболевания
является микрооганизм Clostridium perfringens типов А, В, С, Д, Е. Заболевают в
основном поросята 1-3-недельного возраста. Болезнь чаще всего наблюдается в
хозяйствах, где нарушаются зоогигиенические условия содержания и кормления
животных.
Исследования отечественных и зарубежных ученых указывают на широкое
распространение анаэробной энтеротоксемии поросят в различных странах и на
территории РБ, а также на значительный экономический ущерб, причиняемый этой
болезнью животноводству.
Этиотропное и симптоматическое лечение поросят при клостридиозах, как
правило, мало эффективно в виду острого течения заболевания. В связи с этим,
основное внимание по профилактике данной болезни уделяется специфической
профилактике с использованием вакцин. С этой целью в различные годы неоднократно
предпринимались попытки изготовления и использования монобиопрепаратов для
активной иммунизации супоросных свиноматок против анаэробной энтеротоксемии
поросят, вызванной Clostridium perfringens типа С. Однако промышленный выпуск
биопрепаратов против данного заболевания у нас в Республике Беларусь не
организован, несмотря на то что А.В. Бубловым, В.Н. Алешкевичем с соавт. в 90-е
годы для профилактики анаэрбной энтеротоксемии у свиней и крупного рогатого
скота предлагался поливалентный анатоксин. Многие вопросы этой проблемы до сих
пор требуют дополнительного изучения и уточнения.
Вместе с тем в настоящее время для профилактики анаэробной энтеротоксемии
поросят в некоторых странах предложены вакцины против данного заболевания:
России - бивалентная вакцина против анаэробной энтеротоксемии и колибактериоза
свиней, США - инактивированная вакцина Clostridium perfringens type C,
Escherichia coli Bacterin Toxoid, производства Pfizer Animal Health против
анаэробной энтеротоксемии и колибактериоза свиней и др.
1. ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
.1 АКТУАЛЬНОСТЬ ТЕМЫ ДИПЛОМНОЙ РАБОТЫ
Среди массовых желудочно-кишечных и септических заболеваний новорожденных
поросят первых дней жизни немалую роль занимает анаэробная энтеротоксемия.
Этиотропное и симптоматическое лечение поросят при клостридиозах, как
правило, мало эффективно в виду острого течения заболевания. В связи с этим,
основное внимание по профилактике данной болезни уделяется специфической
профилактике с использованием вакцин.
В РБ активная иммунизация против анаэробной энтеротоксемии поросят в
настоящее время все еще остаётся несовершенной. Ещё не разработаны
биологические препараты, предназначенные специально для профилактики
энтеротоксемии этого вида животных. Вместе с тем для спёцифической профилактики
энтеротоксемии у новорожденных поросят в ряде стран предложены анатоксинвакцина
CI. perfringensтипа С, ассоциированная вакцина против анаэробной энтеротоксемии
и эшерихиоза поросят. Вакцины вводят свиноматкам двукратно, заканчивая
вакцинацию за 30-35 дней до опороса. После приема поросятами молозива у них
формируется колостральный иммунитет продолжительностью до 1,5 месяца.
.2 СВЯЗЬ РАБОТЫ С НАУЧНЫМИ ПРОГРАММАМИ, ТЕМАМИ
Работа является частью комплексной темы кафедры микробиологии и
вирусологии «Усовершенствование методов диагностики и профилактики инфекционных
болезней животных» № 20066453 УО ВГАВМ, планируемой на 2006-2010 гг.,
утвержденной МСХ и П РБ от 15.12.06 г.
1.3 ЦЕЛЬ И ЗАДАЧИ ИССЛЕДОВАНИЯ
Целью исследования явилось изучение влияния инактивированной вакцины
Clostridium perfringens type C, Escherichia coli Bacterin Toxoid, производства
Pfizer Animal Health, США против анаэробной энтеротоксемии и колибактериоза
свиней на иммунную реактивность животных, разрешенной к применению в
животноводческих хозяйствах РБ.
Для выполнения указанной цели были поставлены следующие задачи:
. Изучить эпизоотическую ситуацию по трихофитии крупного рогатого скота в
ОАО «Агрокомбинат «Южный»» Гомельского района Гомельской области и определить
видовой состав дерматофитов циркулирующих у животных данного неблагополучного
хозяйства.
. Изучить влияние бивалентной вакцины Clostridium perfringens type C,
Escherichia coli Bacterin Toxoid, производства Pfizer Animal Health, США на
иммунологическую реактивность организма супоросных свиноматок и их потомства,
вакцинированных против анаэробной энтеротоксемии.
. Определить профилактическую и экономическую эффективность вышеуказанной
вакцины в условиях неблагополучного по анаэробной энтеротоксемии свиней
животноводческого хозяйства ОАО «Агрокомбинат «Южный»» Гомельского района
Гомельской области.
1.4 МЕТОДОЛОГИЯ И МЕТОДЫ ПРОВЕДЕННОГО ИССЛЕДОВАНИЯ
Экспериментальная работа выполнена в условиях кафедры микробиологии и
вирусологии, ЦНИЛ УО «ВГАВМ», в ОАО «Агрокомбинат «Южный»» Гомельского района Гомельской
области.
На первом этапе мы считали необходимым уточнить эпизоотическую ситуацию
по анаэробной энтеротоксемии в ОАО «Агрокомбинат «Южный»», определить видовой
состав возбудителей заболевания и клинико-эпизоотологические особенности
проявления данного заболевания в данном хозяйстве. При этом использовали данные
ветеринарной отчетности и результаты собственных исследований. Видовой состав
возбудителей анаэробной энтеротоксемии определяли путем бактериологического
исследования патматериала, отобранного от больных и погибших животных.
Выделение культур Cl.perfringens проводили на агаре Цейсслера и бульоне
Кита-Тароцци, руководствуясь Методические указаниями по лабораторной
диагностике инфекционной энтеротоксемии животных и анаэробной дизентерии ягнят
(Утв. ГУВ МСХ и П РБ 14.12.2007, № 10-2-5/1097).
На втором этапе для изучения иммунного статуса животных при вакцинации
против анаэробной энтеротоксемии инактивированной вакциной Clostridium
perfringens type C, Escherichia coli Bacterin Toxoid в ОАО «Агрокомбинат
«Южный»» подобраны 2 группы свиноматок (по 15 гол.) смешанной породы в возрасте
250 дней, живой массой110-120 килограмм.
-ой группе животных инъецировалась инактивированная вакцина Clostridium
perfringens type C, Escherichia coli Bacterin Toxoid (производства Pfizer
Animal Health, США) в соответствии с наставлением.
-я группа свиноматок была контрольной, животным вместо вакцины вводился
физиологический раствор.
За животными проводилось клиническое наблюдение, учёт среднесуточных
приростов живой массы, заболеваемость и сохранность.
Для исследования от супоросных свиноматок и полученных от них
впоследствии поросят отобрана кровь, сыворотка крови и молозива. Показатели
неспецифической резистентности организма и некоторые показатели клеточного и
гуморального иммунитета, биохимические и морфологические показатели крови
изучали, используя Medonic CA-620 и CORMAY LUMEN (соответственно
гематологического и биохимического автоматических анализаторов) в ЦНИЛ УО
«ВГАВМ», а также с помощью общепринятых методик.
Определение титров антитоксинов и типизация выделенных из патматериала
токсинов проводилась в реакции нейтрализации (РН) на белых мышах по
общепринятой в бактериологии методике.
.5 НАУЧНАЯ НОВИЗНА, ПРАКТИЧЕСКАЯ И ЭКОНОМИЧЕСКАЯ ЗНАЧИМОСТЬ ПОЛУЧЕННЫХ
РЕЗУЛЬТАТОВ
Результаты экспериментальных исследований дополняют современные знания по
вопросам эпизоотической ситуации и специфической профилактике анаэробной
энтеротоксемии свиней, что обеспечивает повышение эффективности борьбы с данным
заболеваниям. Способ иммунизации животных вакциной Clostridium perfringens type
C, Escherichia coli Bacterin Toxoid, производства Pfizer Animal Health, США
против анаэробной энтеротоксемии и колибактериоза свиней может быть включен в
комплекс противоэпизоотических мероприятий по профилактике и ликвидации данной
болезни в животноводческих хозяйствах. Экономическая эффективность проводимых
ветеринарных мероприятий при использовании способа иммунизации телят с
использованием вышеуказанной вакцины составляет рубля на рубль затрат.
2. ОСНОВНАЯ ЧАСТЬ
2.1 Обзор литературы
Анаэробная энтеротоксемия свиней (лат. Enterotoxaemia anaerobicasuis;
англ. Anaerobic enterotoxaemia синонимы: анаэробная дизентерия, некротический
энтерит) - остро протекающая токсико-инфекционная болезнь, преимущественно
новорожденных поросят, характеризующаяся диареей, геморрагическим воспалением
кишечника, явлениями токсикоза и высокой летальностью.
Этиология. Возбудитель заболевания - микроорганизм Clostridium
perfringens (далее Cl. perfringens), который впервые выделен и описан под
разными названиями в 1892 году в Америке Велчем и Нуталли, в 1893 году
Френкелем в Германии, в 1898 году Вейоном и Зюбе во Франции.
В настоящее время вид Cl. perfringens принято считать состоящим из 6
самостоятельных типов (А, В, С, Д, Е, F), отличающихся друг от друга антигенной
структурой вырабатываемого токсина, вызывающие характерные для каждого из них
заболевания. Считается, что Cl. perfringens вырабатывает сложный экзотоксин,
состоящий из не менее 15 факторов патогенности, образующихся в различной
комбинации в культурах разных штаммов, которые обозначаются буквами греческого
алфавита.
Токсины альфа, бета, эпсилон, йота обладают выраженными летальными и
некротическими свойствами, играющими основную роль в этиологии болезней,
вызываемых Cl. perfringens и их называют главными летальными токсинами. На
обнаружении этих основных токсинов в реакции нейтрализации с типоспецифическими
антитоксическими сыворотками основана идентификация типов Cl. perfringens.
Посредством выявления и других, второстепенных антигенов, можно дополнительно
уточнить внутритиповые варианты. Токсинообразование для штаммов Cl. perfringens
не постоянно. Наряду с токсигенными штаммами имеются штаммы, вырабатывающие
слабые токсины. Токсигенность одного и того же штамма также может колебаться.
Соотношение между компонентами токсина меняется в зависимости от штаммов, его
индивидуальных свойств, а также от характера среды, на которой выращивались
культуры.
Установлено, что отдельные штаммы Cl. perfringens типов А, В, С, Д синтезируют
энтеротоксин.. perfringens всех типов - довольно толстые палочки 4-8 х 0,6-1,5
мкм, без жгутиков, с закругленными концами. В зависимости от состава среды, под
действием антибиотиков и других факторов, особенно в старых культурах,
наблюдается значительный полиморфизм. Молодая культура возбудителя
грамположительна, старая - грамотрицательна.
В организме животных и на средах, содержащих нативный белок, образуют
капсулы, окружающие тело микроба в виде светлого ободка. При длительном
хранении или после частых пересевов на среды, бедные нативным белком,
способность к образованию капсулы утрачивается.
При неблагоприятных условиях во внешней среде, а также при длительном
выращивании (12-14 дней) на безуглеводистых, щелочных, богатых белками средах,
образуют крупные овальные споры, располагающиеся центрально или субтерминально.
На среде Китта-Тароцци микроорганизм дает бурный рост через 4-6 ч,
сопровождающийся помутнением и газообразованием. Через 2-6 дней рост
прекращается и микробные клетки оседают на дно пробирки. РН среды изменяется в
кислую сторону.
На поверхности глюкозо-кровяного агара Цейсслера Cl. perfringens через
12-18 ч образует крупные, сочные колонии сероватого цвета, окруженные 1-ой или
2-мя светлыми зонами гемолиза, которые при выдерживании на воздухе приобретают
зеленоватый оттенок, что является характерным для колоний микроорганизмов
данного вида.
В молоке через 16-24 ч появляется плотный губчатый сгусток, молочная
сыворотка - прозрачная. При росте на среде Вильсон-Блера, в результате восстановления
железа, через 2-4 ч наступает сплошное почернение агарового столбика. Мозговая
среда не чернеет.
Ферментативные свойства микроба разных типов в основном одинаковые. Cl.
perfringens свертывает лакмусовое молоко с образованием сгустка кирпичного
цвета и полным просветлением молочной сыворотки. Более 90% штаммов сбраживает с
образованием кислоты и газа фруктозу, галактозу, глюкозу, инозит, мальтозу,
лактозу, сахарозу, крахмал. Некоторые штаммы разлагают глицерин, целлюлозу,
гликоген, инулин, раффинозу, рибозу, салицин, трегалозу. Не встречаются штаммы,
способные ферментировать маннит и дульцит.
Протеолитические свойства у Cl. perfringens выражены слабо. Свернутую
сыворотку и вареные кусочки мяса разжижает медленно (на 2-7-й день). Однако, у
большинства штаммов типа А протеолитическая активность выражена в значительной
степени. Желатин разжижают все штаммы. Большинство штаммов способны
гидролизовать казеин.
Некоторые исследователи установили у Cl. perfringens наличие фага.
Вегетативные формы клостридий быстро погибают под действием кислорода,
солнечных лучей, высокой температуры, кислот, щелочей, дезинфицирующих веществ
и антибиотиков, действующих на грамположительные бактерии. Так, солнечные лучи
разрушают вегетативные формы за 5 ч, кипячение - за 1-3 мин; 2%-й раствор
гидроксида натрия или формальдегида, 5%-й раствор фенола - за 5-10 мин.
Споры CI. рerfringens во внешней среде сохраняются годами. Они погибают
при +90 °С через 30 мин, выдерживают кипячение 10-15 мин. В качестве дезсредств
используют раствор хлорной извести с содержанием 5 % активного хлора, 5-10%-й
горячий раствор гидроксида натрия или раствор формальдегида.
Эпизоотологические данные. Энтеротоксемия поросят регистрируется во
многих странах интенсивного свиноводства. В Республике Беларусь ее чаще
регистрируют в крупных специализированных свиноводческих комплексах.
Заболеванию анаэробной энтеротоксемией чаще подвержены поросята в первые дни
жизни, реже поросята-отъемыши до трехмесячного возраста.
Источником возбудителя инфекции служат больные поросята и свино-
матки-клостридионосители, выделяющие возбудитель и инфицирующие окружающую
среду. Возбудитель выделяется преимущественно с каловыми массами. Факторами
передачи являются контаминированные возбудителем объекты внешней среды.
В.Г. Зароза отмечает, что микробы группы CI. рerfringens широко
распространены в природе. Они присуствуют в почве, воде, включая и морскую,
воздухе, содержимом кишечника животных, птиц и человека, в мясных и
растительных продуктах, а также на поверхности кожи животных. Среди них имеются
как возбудители острых инфекций, так и нормальные обитатели кишечника.
В.А. Ленькова, К.Р. Ургуев считают, что CI. рerfringens типа А наиболее
широко распространен, а другие типы встречаются в природе гораздо реже и не
являются постоянными обитателями кишечника человека и животных. CI. рerfringens
других типов широко распространены только там, где среди животных встречаются
инфекции, обусловленные этими возбудителями.
До 20-х годов нашего столетия CI. рerfringens считали возбудителем только
газовой гангрены. В последующем подобные микроорганизмы выделены и описаны при
заболеваниях овец, крупного рогатого скота, лошадей, кроликов, собак,
верблюдов, пищевых отравлениях людей, свиней, птиц и диких зверей.
Заражаются поросята алиментарным путем. В инфицировании новорожденных
большую роль играет загрязнение вымени и сосков свиноматок экскрементами
больных поросят. Кроме того, на свинокомплексах накоплению CI. perfringens и
возникновению болезни способствуют групповое содержание супоросных свиноматок с
одновременным опоросом большого числа животных и передача возбудителя по ходу
технологического процесса.
Важным моментом в возникновении заболевания являются ослабленная
резистентность организма, недостаток молозива и низкое его качество, нарушение
санитарного режима в свиноводстве и др.
Болезнь может возникнуть внутри хозяйства при наличии благоприятных
условий для развития этиологического микроорганизма в организме животных или
появиться в результате заноса высоковирулентных штаммов возбудителя.
Стационарность болезни обусловливается клостридио- носительством взрослых
свиней, обильным инфицированием внешней среды (свинарников, территории фермы) и
устойчивостью возбудителя.
На свиноводческих комплексах болезнь возникает в любое время года, чаще -
в зимне-весенний период, протекает в виде эпизоотических вспышек с охватом
большого поголовья поросят на разных технологических циклах.
Заболеваемость среди поросят иногда достигает 10-80 %, летальность -
50-100%.
Течение и симптомы болезни. Инкубационный период болезни длится от
нескольких часов до нескольких дней. Заболевание отмечается даже в первые часы
после рождения.
Протекает анаэробная энтеротоксемия сверхостро, остро и подостро.
Симптомокомплекс и течение болезни зависят от типа возбудителя и возраста
животных. Болезнь, обусловленная типом В и С, протекает очень быстро, с момента
проявления первых признаков заболевания до гибели поросят проходит несколько
часов, редко 2-3 суток. При сверхостром течении поросята погибают без видимых
признаков заболевания. В отдельных случаях возможно подострое течение болезни.
Характерными признаками болезни являются профузный понос, фекалии с примесью
крови и пузырьками газа, резко выраженное угнетение, прострация.
Анаэробная энтеротоксемия поросят, обусловленная Cl. perfringens типа А,
протекает менее остро. Заболевают поросята на вторые - пятые сутки после
рождения. Они становятся малоподвижными, отказываются от соска, кожный покров
принимает синюшный оттенок, развивается понос. Кровь в фекалиях обнаруживается
не всегда. В случаях подострого течения болезни животные могут выздороветь.
Такие поросята быстро поправляются и хорошо развиваются. Рецедивов болезни у
них не отмечается.
На промышленных комплексах, а также в крупных свиноводческих хозяйствах
анаэробная энтеротоксемия у новорожденных поросят часто протекает в ассоциации
с эшерихиозом, в группе доращивания - с сальмонеллезом и дизентерией.
Патологоанатомические признаки. Трупы павших животных вздуты и быстро
разлагаются. Отмечают пенистые и кровянистые истечения из ротовой и носовой
полостей. Глаза запавшие, слизистая оболочка бледная.
Наиболее характерные изменения находят в тонком кишечнике, особенно в
тощей кишке. У одних поросят весь кишечник геморрагически воспален,
темно-красного цвета и наполнен кровянистым содержимым. У других воспалены лишь
отдельные отрезки кишечника с преимущественной локализацией изменений в тощей
кишке. Кишечная стенка местами некротизирована, покрыта язвами. Содержимое
кишечника кровянистое, с пузырьками газа, желудок наполнен сгустками молока,
слизистая оболочка его гиперемирована или геморрагически воспалена.
В брюшной полости признаки серозно-фибринозного перитонита.
Мезентеральные лимфатические узлы увеличены, гиперемированы. Печень наполнена
кровью темно-вишневого цвета, с серыми или желтыми очагами (пятнистая),
дряблая, края закруглены. Желчный пузырь наполнен густой желчью. Селезенка
увеличена, пульпа её размягчена. Под капсулой почек заметны точечные
кровоизлияния, граница между корковым слоем сглажена, почки иногда размягчены.
В грудной полости обнаруживается небольшое количество прозрачной жидкости
красноватого или соломенного цвета. Слизистая оболочка гортани, трахеи и
бронхов гиперимирована. Лёгкие увеличены, вишневого цвета, отечны. Сердечная
сорочка наполнена прозрачной жидкостью соломенного цвета, мышца сердца дряблая.
На эпикарде, эндокарде и клапанах сердца ясно выражены точечные и диффузные
кровоизлияния.
У поросят старшего возраста обнаруживают геморрагический диатез, отеки
подсерозной оболочки желудка, брыжеечных лимфатических узлов, век, ушей,
лёгких. В содержимом тонкого кишечника примесь крови и фибрина.
Визуальным наблюдением под лупой и при гистологическом исследовании
обнаруживают некроз ворсинок тонкого отдела кишечника, особенно в верхней части
тощей кишки.
Р. Лулов, А.К.. Ангелов отмечают, что патоморфологическая картина
связанная с CI. рerfringens у различных животных в общем подобна на таковую у
овец. Тяжелее всего протекают инфекции типа С, вызывающие самые значительные
патоморфологические изменения. Тип А проявляется легкой желтухой и слабым
гемосидерозом печени, почек и селезенки; тип Д - тяжелым поражением и
гиалиновой дистрофией почек; тип С - некротическим энтеритом, выраженным
геморрагическим диатезом и дегенеративными изменениями ганглиозных клеток и
демиелизацией мозга.
Лабораторная диагностика. Диагноз ставят на основании эпизоотологических
данных, клинической картины, патологоанатомических изменений и результатов
лабораторных исследований.
Материалом для бактериологического исследования служат свежий труп или
перевязанный участок пораженного кишечника, кусочки паренхиматозных органов,
брыжеечные лимфатические узлы, трубчатая кость и содержимое тонкого кишечника.
Материал берут не позднее чем через 3 ч после гибели животного. В теплое время
года патологический материал консервируют.
Для постановки диагноза на анаэробную энтеротоксемию необходимо
обнаружение токсина (определение токсиногенности возбудителя) в материале или
выделение чистой культуры путем бактериологического исследования. В обоих
случаях необходима типизация (определение типа токсина) в патологическом
материале или культуре в реакции нейтрализации (РН) на белых мышах с
типоспецифическими сыворотками к С1. perfringens.
Окончательный диагноз считается установленным:
при обнаружении токсина в фильтрате содержимого тонкого кишечника и
определении его типа в РН с типоспецифическими сыворотками (без выделения
культуры);
при выделении из исходного материала культуры со свойствами, характерными
для возбудителя анаэробной энтеротоксемии поросят, с последующим определением
биологическим методом ее токсичности.
Специфическая профилактика, лечение и меры борьбы. Период новорожденности
- это период приспособления организма животного к новым для него условиям
существования. Он характеризуется значительными функциональными и
морфологическими перестройками, необходимыми для дальнейшего развития вне
организма матери. Так как строение плаценты домашних животных в значительной
мере исключает возможность проникновения через неё антител из материнского
организма, а сам плод, как правило, не синтезирует собственных антител из-за
отсутствия контакта с антигенами и относительной незрелости иммунной системы,
то животные рождаются обычно без антител. Антитела появляются у них только
после получения ими молозива.
Обеспеченность молодых животных колостральными антителами определяется
содержанием иммуноглобулинов в молозиве, количеством выпоенного молозива и
проницаемостью стенок кишечника. Накопление иммуноглобулинов в молочной железе,
по мнению исследователей, происходит наиболее интенсивно в последний период
беременности за счёт перехода их из сыворотки крови.
Пассивный колостральный иммунитет (его продолжительность) зависит от
характера возбудителя, титра антител, вида животных и колеблется от двух недель
до нескольких месяцев.
Основной причиной гибели животных при энтеротоксемии является
интоксикация организма и для обеспечения невосприимчивости необходимо наличие
антитоксического (гуморального) иммунитета.
Многочисленные экспериментальные исследования ученых, проведенные как у
нас в стране, так и за рубежом отмечают ведущую роль антитоксического фактора в
создании иммунитета против токсикоинфекций клостридиальной этиологии.
По данным К.Р. Ургуева антибактериальный иммунитет при клостридиозах играет
второстепенную роль. С данным мнением созвучны результаты опытов
В.Н.Мельникова, Н.И.Мельникова и многочисленные исследования других авторов.
Однако нельзя игнорировать мнение тех специалистов, которые утверждают, что для
получения полноценного и стойкого иммунитета необходимо иммунизировать не
только к токсину, но и к самим возбудителям и их ферментам патогенности.
Первые попытки использования вакцин для борьбы с анаэробной инфекцией
принадлежат Вейнбергу, применившему в 1913 году вакцину из убитых нагреванием
микробных тел Кл.перфрингенс для лечения затянувшихся форм газовой флегмоны.
Затем, начиная приблизительно с 1920 года стали появляться исследования, в
которых для создания иммунитета к анаэробной инфекции в качестве вакцины
использовали культуру, анакультуру, анатоксин.
Особо следует отметить заслуги G.Ramon (1962), как основателя учения об
анатоксинах. Большой вклад в учение об анатоксинах внесли советские учёные П.Ф.
Здродовский, Г.В. Выгодчиков, Б.В. Воскресенский,А.А. Воробьёв, Л.В.Кириллов, К.Р.
Ургуев, Ю.Б. Сафаров, А.В. Ляушкин, В.И. Леньков и др..
Для профилактики клостридиозов сельскохозяйственных животных до сих пор
применяются следующие биопрепараты: поливалентная гидроокисьалюминиевая вакцина
против брадзота, инфекционной энтеротоксемии, злокачественного отёка овец и
анаэробной дизентерии ягнят; поливалентный анатоксин против клостридиозов овец;
формолвакцина и живая вакцина против эмфизематозного карбункула; вакцина против
ботулизма норок и др..
В ряде хозяйств для профилактики болезни, обусловленной Кл. перфрингенс
типов В, С, Д, других видов животных с положительными результатами применяют
поливалентную гидроокисьалюминевую вакцину против брадзота, инфекционной
энтеротоксемии, злокачественного отёка овец и анаэробной дизентерии ягнят или
поливалентный анатоксин против клостридиозов овец.
Согласно К.Р. Ургуева в большинстве стран мира в настоящее время для
профилактики анаэробных болезней преимущественно используют многокомпонентные
вакцины, содержащие антигенный материал 2-8-ми видов и типов клостридий, чаще
Кл. перфрингенс типов В, С, Д, Кл. шово, а также Кл. ботулинум типа С, Кл. нови
типа В, Кл.септикум и Кл. тетани. Это согласуется с сообщениями зарубежных
авторов.
В доступной нам литературе имеются лишь единичные сообщения о формировании
антитоксического иммунитета у свиней при использовании антигенов Кл.перфрингенс
и о показателях колострального иммунитета при введении этих антигенов.
В нашей республике активная иммунизация против анаэробной энтеротоксемии
поросят в настоящее время все еще остаётся несовершенной. Ещё не разработаны
биологические препараты, предназначенные специально для профилактики
энтеротоксемии этого вида животных. Вместе с тем для спёцифической профилактики
энтеротоксемии у новорожденных поросят в в ряде стран предложены
анатоксинвакцина CI. perfringensтипа С, ассоциированная вакцина против
анаэробной энтеротоксемии и эшерихиоза поросят (например, инактивированная
вакцина Clostridium perfringens type C, Escherichia coli Bacterin Toxoid,
производства Pfizer Animal Health, США против анаэробной энтеротоксемии и
колибактериоза свиней). Вакцины вводят свиноматкам двукратно, заканчивая
вакцинацию за 30-35 дней до опороса. После приема поросятами молозива у них
формируется колостральный иммунитет продолжительностью до 1,5 месяца.
Лечение животных, как правило, не дает желаемого результата из-за
возникновения необратимых изменений в органах и тканях, вызванных большим
количеством токсина. Тем не менее в стационарно неблагополучных хозяйствах
поросятам в первые часы жизни можно применить антитоксическую сыворотку против
анаэробной энтеротоксемии и антибиотики. При болезни, обусловленной типом А,
можно применить медицинскую антигангренозную сыворотку. При необходимости через
2-3 дня введение сыворотки и антибиотиков повторяется.
Чтобы не допустить возникновения болезни, обращают внимание на условия
содержания и кормления супоросных свиноматок, особенно во второй половине
супоросности. Проводят также вакцинацию свиноматок в последний период
супоросности (65 и 90 дней) с интервалом 20-25 дней. Для профилактики вспышек
анаэробной энтеротоксемии в группе доращивания поросят иммунизируют в возрасте
15 и 40 дней двукратно с интервалом 20-25 дней.
Необходимо также строго соблюдать санитарный режим в свиноводстве: «все
занято - все свободно», одновременный вывод свинопоголовья, подготовка
помещений к приему животных, тщательная очистка от навоза и дезинфекция. Не
рекомендуется дача супоросным и новорожденным животным неомицина,
окситетрациклина, хлорамфеникола и других антибиотиков, к которым устойчива CI.
perfringens. При возникновении болезни вводят ограничения, которые снимают
после ее ликвидации и проведения всего комплекса мероприятий.
2.2 Материал и методы исследований
анаэробный энтеротоксемия новорожденный поросенок
Экспериментальная работа выполнена в условиях кафедры микробиологии и
вирусологии, ЦНИЛ УО «ВГАВМ», в ОАО «Агрокомбинат «Южный»» Гомельского района
Гомельской области.
При проведении экспериментов нами использованы: инактивированная
бивалентная вакцина «Clostridium perfringens type C, Escherichia coli Bacterin
Toxoid», производства Pfizer Animal Health, США против анаэробной
энтеротоксемии и колибактериоза свиней (Вакцина изготовлена из рerfringens тип
С); кровь и сыворотка крови экспериментальных животных, бактериальные культуры
E.coli, M.lysodeiticus, глицинизированные токсины Cl. рerfringens типов А, В,
С, Д; краситель Романовского-Гимза, изотонический раствор NaСl, метанол,
микроскоп МБИ-2, ФЭК (фотоэлектроколориметре), Medonic CA-620, CORMAY LUMEN,
центрифуга МРW-310.
Для изучения иммунного статуса животных при вакцинации против анаэробной
энтеротоксемии инактивированной вакциной Clostridium perfringens type C,
Escherichia coli Bacterin Toxoid в ОАО «Агрокомбинат «Южный»» подобраны 2
группы свиноматок (по 15 гол.) смешанной породы в возрасте 250 дней, живой
массой 110-120 килограмм:
-ой группе животных во второй половине супоросности инъецировалась
инактивированная вакцина Clostridium perfringens type C, Escherichia coli
Bacterin Toxoid (производства Pfizer Animal Health, США) в/м, дважды с
интервалом 21 день, второе введение препарата проводилось не позже чем за две
недели до опороса.
-я группа свиноматок была контрольной, животным вместо вакцины вводился
физиологический раствор.
Для изучения показателей иммунологической реактивности от супоросных
свиноматок отбирали кровь и сыворотку крови до иммунизации, перед второй
иммунизацией и месяц после опороса, а также сыворотку молозива на 1, 3 и 6 день
после опороса. Перед взятием молозива свиноматкам вводили окситоцин по 10-15 ЕД
на 100 кг ж.м. животного. С целью изучения колострального иммунитета против
возбудителей анаэробной энтеротоксемии у полученных поросят опытной и
контрольной групп (по 15 голов) исследована сыворотка крови до приёма молозива,
на 1, 3, 6, 9 и 15 день после рождения.
Об эпизоотологической эффективности применяемого биопрепарата судили по
заболеваемости, летальности полученного приплода к 7-дневному возрасту и
отъемный период.
Показатели неспецифической резистентности организма и некоторые
показатели клеточного и гуморального иммунитета, биохимические и
морфологические показатели крови изучали, используя Medonic CA-620 и CORMAY
LUMEN (соответственно гематологического и биохимического автоматических
анализаторов) в ЦНИЛ УО «ВГАВМ», а также с помощью общепринятых методик.
Сыворотку крови телят получали по общепринятой методике. Для
гемматологических исследований кровь стабилизировали гепарином.
Фагоцитарную активность нейтрофилов, бактерицидную и лизоцимную
активность сыворотки крови определяли по И.М.Карпутю с помощью тест-культур
E.coli, M.lysodeticus упрощенным нефелометрическим методом.
Для дифференцированного подсчета лейкоцитов крови (выведения лейкограммы)
мазки крови готовили на предметных стеклах, после высушивания и фиксации в
метиловом спирте окрашивали по Романовскому-Гимзе. Лейкограмму выводили на
основании подсчета 100 клеток.
Видовой состав возбудителей изучали на основании выделения Cl.
perfringens из патологического материала отобранного от больных и погибших
поросят с признаками геморрагического гастроэнтерита, определения их
культурально - морфологических и биохимических свойств. Выделение культур Cl.
perfringens проводили на агаре Цейсслера и бульоне Китта-Тароцци,
руководствуясь Методические указаниями по лабораторной диагностике инфекционной
энтеротоксемии животных и анаэробной дизентерии ягнят (Утв. ГУВ МСХ и П РБ
14.12.2007, № 10-2-5/1097).
Типовую принадлежность токсинов определяли в реакции нейтрализации (РН) с
диагностическими антитоксическими сыворотками на белых мышах.
Для определения наличия антитоксинов использовали глицинизированные
токсины Cl. рerfringens типов А, В, С, Д. Количество антител определяли в РН
токсинов сыворотками молозива, крови свиноматок и новорожденных поросят.
Полученные результаты обработаны при помощи программы статистической
обработки Стат.Biom 2720.
2.3 Результаты исследований
.3.1 Результаты по эпизоотологическому
обследованию
При анализе данных журналов бактериологических исследований (экспертиз)
диагностического отдела Гомельской райветстанции установлено, что анаэробная
энтеротоксемия свиней в ОАО «Агрокомбинат «Южный»» Гомельского района не
регистрировалась в предыдущие годы, что отчасти можно объяснить отсутствием
надлежащего оборудования (микроанаэростатов) для выделения анаэробных
микроорганизмов. Специалистами диагностического отдела райветстанции при
гастроэнтеритах поросят обычно выделялись эшерихии, протей, патогенные
стафилококки, сальмонеллы, регистрировалась рота-коронавирусная инфекция.
Профилактику колибактериоза свиней в данной сельскохозяйственной организации
ветспециалисты проводят с помощью поливалентной вакцины против колибактериоза
(эшерихиоза) телят, поросят и ягнят производства УП «Витебская биофабрика».
Вакцину применяют для вакцинации беременных животных за 1,5-2 месяца до родов,
также поросят перед отъёмом.
В ходе производственной практики в январе - апреле 2011 года в ОАО
«Агрокомбинат «Южный»» среди поросят 1-10-ти дневного возраста мы наблюдали
случаи заболевания 11-ти новорождённых животных гастроэтеритами. У больных
регистрировали повышение температуры тела до 40,5оС. У поросят учащался пульс
(225,5±7,8 ударов в минуту) и дыхание (88 дыханий в минуту).
Поросята быстро слабели, через один-два часа оказывались в состоянии
прострации, лежали на боку и обнаруживали слабые признаки жизни. У них
появлялся понос, который являлся ведущим клиническим симптомом болезни. Фекалии
были вначале водянистые, серовато-желтого цвета. Позднее кал становился
кашицеобразным, серовато-белого цвета, с примесью крови. У некоторых животных
пенистый. Им был выпачкан хвост поросят и щетина вокруг ануса. Частые выделения
кала сопровождались болезненными тенезмами. Анальное отверстие открыто
вследствие утомительной диареи. Живот увеличен. Брюшная стенка при пальпации
болезненная. Больные поросята плохо сосали свиноматок и лежали, зарывшись в
подстилку.
Животных подвергли лечению тиланом и симптоматическими средствами.
Два из заболевших поросят погибли на 1-й день болезни, 5 животных на 3-й
день. Трупы павших животных вздуты и быстро разлагались. Отмечались пенистые и
кровянистые истечения из ротовой и носовой полостей. Глаза запавшие, слизистая
оболочка бледная. При вскрытии обнаружили увеличенную с обильным соскобом на
разрезе селезёнку, кровоизлияния на слизистых оболочках и под серозными
покровами. Печень была увеличена, и имела пятнистый вид, дряблую консистенцию.
Желчный пузырь был наполнен желчью и растянут. Отмечался также двусторонний
отёк лёгких, истощение и общая анемия, зернистая дистрофия миокарда и почек.
Наиболее характерные изменения находили в тонком отделе кишечника,
особенно в тощей кишке. У одних поросят весь кишечник был геморрагически
воспален, темно-красного цвета и наполнен кровянистым содержимым, у других
воспалены лишь отдельные отрезки кишечника с преимущественной локализацией
изменений в тощей кишке. Кишечная стенка местами была некротизирована, покрыта
язвами. Содержимое кишечника кровянистое, с пузырьками газа, желудок наполнен
сгустками молока, слизистая оболочка его гиперемирована или геморрагически
воспалена. В брюшной полости признаки серозно-фибринозного перитонита.
Мезентериальные лимфатические узлы увеличены, гиперемированы. На поверхности
почек и под эпикардом обнаруживают точечные кровоизлияния.
От животных отобрали трубчатую кость, селезёнку, головной мозг, долю
печени с желчным пузырём, брыжеечные лимфатические узлы, соответствующие
поражённым участкам тонкого отдела кишечника, и в отдельной посуде - поражённый
отрезок тонкого отдела кишечника. Одновременно от поросят с признаками
гастроэнтерита на исследовании взяли фекалии.
Бактериологическое исследование провели на кафедре микробиологии и
вирусологии УО ВГАВМ. Посевы из патологического материала, перечисленного выше,
делали на МПА, МПБ, среды Эндо, Минка, а также МППБ и среду Цейсслера, которую
после посева патматериала помещали в микроанаэростат.
При исследовании содержимого тонкого отдела кишечника в реакции
нейтрализации на белых мышах в нем обнаружился токсин Cl. рerfringens типа С. В
дальнейшем в результате культурального исследования был выделен микроорганизм
отнесенный к выше указанному виду. Морфологически это были грамположительные
неподвижные палочки с обрубленными или слегка закругленными концами, размером
4-8 х 0,6-1,5 мкм. В мазках-отпечатках, приготовленных из отобранного от
животных патматериала и окрашенных по Ольту, обнаруживались капсулы. В
последствии культуры данного микроорганизма образовывали споры (Фото 2, 3).
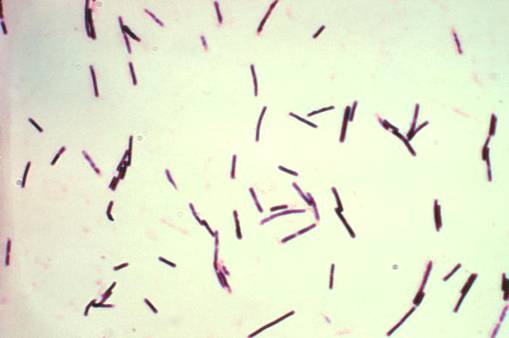
Фото 2 - штамм Cl. perfringens type C, выделенный от поросёнка при подостром течении анаэробной
энтеротоксемии
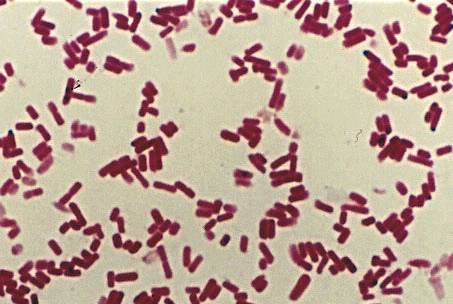
На среде Китта-Тароцци микроорганизм давал бурный рост через 4-6 часов,
сопровождающийся помутнением и газообразованием. Через 2-6 дней рост
прекращался и микробные клетки оседали на дно пробирки.
На агаре Цейслера Кл.перфрингенс образовывал крупные, сочные колонии
сероватого цвета, окруженные 1 или 2-мя светлыми зонами гемолиза, которые при
выдерживании на воздухе приобретали серо-зеленый оттенок, что является
характерным свойством.
Кл. перфрингенс ферментировал с образованием кислоты и газа глюкозу,
сахарозу, лактозу, галактозу и не сбраживал маннит и дульцит. Свертывал
лакмусовое молоко, с образованием губчатого сгустка кирпичного цвета и
просветлением молочной сыворотки.
В результате типирования выделенных токсигенных культур Cl. рerfringens в
реакции нейтрализации с антитоксическими сывортками на белых мышах было
определено, что они также относятся к типу С.
Возбудителей колибактериоза свиней при бактериологическом исследовании не
выделено.
Таким образом было установлено, что анаэробная энтеротоксемия поросят
регистрируется в ОАО «Агрокомбинат «Южный»». В виду не эффективности лечения
при анаэробной энтеротоксемии свиней мы провели исследования по изучению
иммунной реактивности организма данного вида животных, иммунизированных
инактивированной вакциной Clostridium perfringens type C, Escherichia coli
Bacterin Toxoid, производства Pfizer Animal Health, США.
.4.2 Результаты по изучению иммунной реактивности супоросных свиноматок и
их потомства, иммунизированных инактивированной вакциной против анаэробной
энтеротоксемии
Показатели специфического иммунитета в крови и сыворотке молозива
свиноматок, иммунизированных вакциной Бактеринтоксоид Литергард LT-C
В системе мер борьбы с инфекционными болезнями свиней особое место
отводится иммунопрофилактике. Это в равной степени относится и к клостридиозной
инфекции свиней.
Для опыта использовали 30 супоросных свиноматок, которых разделили на две
группы: 15 голов - опытная и 15 голов - контрольная.
После введения препарата у свиноматок общей температурной реакции, а
также выраженной реакции на месте инъекции (покраснение, припухание, некрозы,
абсцессы) не наблюдалось.
С целью изучения иммуногенности вакцины определяли сроки появления
антител и динамику их накопления в крови до иммунизации, перед опоросом и 30-й
день после опороса; в сыворотке молозива - на 1, 3, 6-е сутки после опороса.
Данные исследований отражены в таблицах…….
Таблица.. - Титры антитоксинов Cl. perfringens в сыворотке крови
супоросных свиноматок, иммунизированных вакциной Бактеринтоксоид Литергард LT-C
|
Группа животных
|
Титры антитоксинов, АЕ/см3
|
|
До иммунизации
|
21-й день после первой
вакцинации
|
Перед опоросом
|
30 дней после опороса
|
|
Опытная
|
0,04±0,01
|
0,54±0,03
|
1,34±0,21
|
0,61±0,03
|
|
Контрольная
|
0,04±0,002
|
0,04±0,002
|
0,07±0,004
|
0,02±0,002
|
Как видно из таблицы…до иммунизации всех супоросных свиноматок в их
сыворотке крови антитоксины Cl. perfringens типа С обнаруживаются в титрах
0,04±0,01-0,002 АЕ/см3. В дальнейшем у свиноматок опытной группы перед второй
иммунизацией они регистрировались в пределах 0,54±0,03, перед опоросом -
1,34±0,21, а через 30 дней после опороса - в количестве 0,61±0,03 АЕ/см3. У
контрольных животных соответственно 0,04±0,002, 0,07±0,004, 0,02±0,002 АЕ/см3.
Таблица.. - Титры антитоксинов Cl. perfringens в молозиве свиноматок,
иммунизированных вакциной Бактеринтоксоид Литергард LT-C
|
Группа животных
|
Титры антитоксинов, АЕ/см3
|
|
1-й день
|
3-й день
|
6-й день
|
|
Опытная
|
2,43±0,14
|
0,58±0,03
|
-
|
|
Контрольная
|
0,17±0,03
|
-
|
-
|
Поросята чаще всего заболевают в первые дни жизни, а ранняя иммунизация
новорожденных животных является мало эффективной из-за несовершенства
клеточно-гуморальной системы, создание благополучия среди них при анаэробной
энтеротоксемии можно достигнуть лишь путем формирования колострального
иммунитета. Обеспеченность молодых животных колостральными антителами в
основном определяется содержанием иммуноглобулинов в молозиве. При этом зачастую
концентрация антител в молозиве превосходит таковую в сыворотке крови, что
подтвердилось и при нашем исследовании. Так при наличии в сыворотке крови
антитоксинов в концентрации 1,34±0,21 АЕ/см3 в молозиве свиноматок опытной
группы в 1-й день после опороса их количество регистрировалось в пределах
2,43±0,14 АЕ/см3. В дальнейшем антитела к токсинам Cl. perfringens типа С
регистрировались лишь на 3-й день в пределах 0,58±0,03 АЕ/см3, что объясняется
наступающей после родов секрецией более бедного антителами молозива.
В сыворотке молозива свиноматок не подвергавшихся иммунизации вакциной
Бактеринтоксоид Литергард LT-C антитоксины определялись только в первый день
после опороса в количестве 0,17±0,03 АЕ/см3.
Показатели иммунной реактивности организма поросят, полученных от
свиноматок, иммунизированных бивалентной вакциной против анаэробной
энтеротоксемии и колибактериоза
В ходе исследований приплод на супоросную свиноматку опытной и
контрольной групп составил 10-12 поросят. Общее количество полученных поросят в
опытной группе составило 177 голов, в контрольной 174 голов.
Динамика морфологических показателей крови у поросят при вакцинации их
против анаэробной энтеротоксемии отображена в таблице...
Из приведенных в таблице... данных видно, что у поросят опытной и
контрольной групп на протяжении всего периода исследований колебание количества
эритроцитов и гемоглобина происходило в пределах нормы и без достоверных
различий (Р>0,05).
Количество лейкоцитов от начала опыта у поросят контрольной и опытной
групп составляло соответственно 18,13±1,75·109/л и 19,72±1,39·109/л.. К 3-му
дню после начала опыта содержание их в крови контрольных животных возросло до
23,4±0,29·109/л (Р≤0,05). В последующее время отмечалось постепенное
снижение количества лейкоцитов в контрольной группе. К 6-му дню этот показатель
составил 23,3±0,34·109/л (Р≤0,01). В дальнейшем количество лейкоцитов у
животных контрольной группы пришло в норму и не имело достоверных различий с
опытной группой (Р>0,05). Следует отметить, что в крови животных опытной
группы количество лейкоцитов существенно не изменялось на протяжении всего
опыта.
Таким образом, в крови поросят, полученных от свиноматок не
вакцинированных вакциной против анаэробной энтеротосемии, отмечается
лейкоцитоз, что по-видимому является физиологической реакцией организма на
возможное присутствие антигенов Cl. perfringens.
Анализ лейкограммы (табл. ….) показал, что на 3-й день после начала опыта
отмечается достоверное уменьшение количества сегментоядерных нейтрофилов на 8 %
(Р≤0,05). В эти же сроки относительное содержание лимфоцитов в
контрольной группе увеличивалось на 5,8 % (Р≤0,01). На 6-й день также
было заметно достоверное снижение сегментоядерных нейтро-филов на 7 % (Р≤0,01)
по сравнению с опытной. К 9-му дню исследований показатели лейкограммы опытных
и контрольных животных не имели достоверных различий и не выходили за пределы
физиологической нормы ( Р>0,05).
При изучении иммунологической перестройки в организме у поросят,
полученных от свиноматок вакцинированных против анаэробной энтеротоксемии нами
установлено, что в динамике общего белка (табл....) существенных изменений не
происходило на протяжении всех сроков исследований (Р>0,05). Заметные
структурные изменения установлены в содержании белковых фракций - возрастает
содержание гамма-глобулинов с одновременным уменьшением альбуминов. Так, у
поросят опытной группы к 6-му дню после приёма молозива содержание
гамма-глобулинов возросло с 19,8±1,14 % до 30,4±0,45 % (Р≤0,01), а
содержание альбуминов снизилось с 46,8±1,03 % до 34,6±0,96 % (Р≤0,01). К
9-му дню исследований содержание гамма-глобулинов и альбуминов достигло уровня
начала опыта.
Заметных изменений со стороны альфа- и бета-глобулиновых фракций нами не
установлено. Их колебания у животных обеих групп происходили без достоверных
различий (Р>0,05).
Таблица.. - Гематологические показатели подопытных и контрольных поросят,
полученных от свиноматок иммунизированных вакциной Бактеринтоксоид Литергард
LT-C
|
Показатели (M ±
m)
|
Группа животных
|
Сроки исследования
|
|
|
1-йдень
|
3-й день
|
6-й день
|
9-й день
|
15-й день
|
|
Эритроциты, х 1012/л
|
1 2
|
6,23±0,27 5,64±0,17
|
6,39±0,35 5,78±0,12
|
6,37±0,12 6,65±0,20
|
6,60±0,20 5,92±0,28
|
|
Гемоглобин, г/л
|
1 2
|
112,2±2,54
115,6±5,92
|
104,6±7,40
105,2±2,92
|
113,8±6,42
117,8±4,28
|
108,6±7,40
108,2±5,13
|
105,4±1,25
105,2±2,92
|
|
Лейкоциты, х 109/л
|
1 2
|
19,72±1,39 18,13±1,75
|
20,41±0,79 23,40±0,29*
|
20,32±1,34 23,30±0,34**
|
20,86±0,85 21,24±0,38
|
21,95±0,71 21,61±0,77
|
Примечание: 1 группа - животные, иммунизированные против анаэробной
энтеротоксемии;
группа - интактные животные;
* - достоверность Р<0,05;
**- достоверность Р<0,01.
Таблица.. - Лейкограмма подопытных и контрольных поросят, полученных от
свиноматок иммунизированных вакциной Бактеринтоксоид Литергард LT-C
|
Дни исследования
|
Группы животных
|
Базофилы
|
Эозинофилы
|
Нейтрофилы
|
Лимфоциты
|
Моноциты
|
|
|
|
|
юные
|
палочкояд.
|
сегментояд.
|
|
|
|
1-й день
|
1 2
|
0,6±0,22 0,4±0,22
|
9,6±0,72 9,8±0,65
|
0,2±0,018 0,4±0,22
|
5,2±0,18 5,2±0,33
|
32,2±1,07 31,6±1,44
|
47,0±1,41 48,4±0,81
|
5,2±0,52 4,2±0,95
|
|
3-й день
|
1 2
|
0,4±0,22 0,4±0,22
|
10,0±0,63 10,4±0,43
|
0,4±0,22 0,2±0,18
|
7,2±1,03 4,8±0,52
|
24,2±2,1* 32,2±0,86
|
53,8±1,21** 48,0±0,75
|
4,0±0,93 4,0±0,81
|
|
6-й день
|
1 2
|
0,6±0,22 0,4±0,22
|
10,8±0,52 9,0±0,63
|
0,4±0,22 0,2±0,18
|
7,6±1,37 4,0±0,56
|
25,0±0,89** 32,0±1,05
|
52,2±1,56 50,0±0,63
|
3,6±0,45 4,6±0,35
|
|
9-й день
|
1 2
|
0,4±0,22 0,6±0,22
|
10,8±0,77 11,0±1,02
|
0,2±0,18 0,4±0,36
|
4,2±0,33 3,8±0,33
|
32,8±0,59 33,8±0,91
|
47,0±0,69 45,6±1,71
|
4,6±0,45 4,8±0,65
|
|
15-й день
|
1 2
|
0,4±0,22 0,4±0,22
|
9,0±0,63 9,8±1,21
|
0,2±0,18 0,4±0,22
|
34,0±0,74 32,4±1,04
|
45,8±1,48 45,4±0,92
|
7,0±0,80 7,4±0,92
|
Примечание: 1 группа - животные, иммунизированные против анаэробной
энтеротоксемии;
группа - интактные животные;
* - достоверность Р≤0,05;
**- достоверность Р≤0,01.
Таблица - Динамика общего белка и белковых фракций сыворотки крови у
поросят полученных от свиноматок иммунизированных вакциной Бактеринтоксоид
Литергард LT-C
|
Показатели
|
Группы животных
|
Сроки исследования
|
|
|
1-й день
|
3-й день
|
6-й день
|
9-й день
|
15-й день
|
|
Общий белок, г/л
|
1 2
|
73,2±1,48 75,8±2,7
|
74,7±1,69 74,6±1,43
|
74,6±1,48 75,6±1,89
|
75,4±0,6 74,2±1,77
|
76,0±1,98 75,6±1,61
|
|
Альбумины, %
|
1 2
|
46,8±1,03 44,0±1,05
|
35,4±0,70** 45,8±1,37
|
34,6±0,96** 47,0±2,17
|
46,4±0,72 46,4±0,66
|
45,5±0,92 46,0±0,33
|
|
Альфа-глобулины,%
|
1 2
|
15,4±1,18 17,8±1,53
|
17,4±0,83 17,6±0,45
|
16,8±0,52 16,0±0,94
|
16,6±0,53 16,6±0,87
|
16,8±0,33 16,8±0,76
|
|
Бета-глобулины,%
|
1 2
|
17,6±0,66 16,6±0,87
|
18,6±1,0 16,8±0,59
|
18,2±0,65 17,2±1,03
|
17,2±0,71 16,8±0,33
|
17,2±0,33 17,6±0,6
|
|
Гамма-глобулины,%
|
1 2
|
19,8±1,14 21,6±1,34
|
28,6±0,73** 19,8±0,95
|
30,4±0,45** 19,8±0,71
|
19,8±0,82 20,2±0,71
|
20,6±0,6 19,6±0,83
|
Примечание: 1 группа - животные, иммунизированные против анаэробной
энтеротоксемии;
группа - интактные животные;
* - достоверность Р≤0,05;
**- достоверность Р≤0,01.
При изучении показателей неспецифической резистентности крови контрольных
поросят и полученных от свиноматок иммунизированных инактивированной вакциной
Бактеринтоксоид Литергард LT-C установлено, что фагоцитарная активность
лейкоцитов сыворотки крови поросят опытной группы наиболее высокая на 3 и 6-й
дни жизни и составляла при этом соответственно 84,10±1,46% и 82,40±0,98%. Затем
она уменьшается и на 15-й день равна 69,3±1,76%. У поросят контрольной группы
во все сроки исследований она была несколько меньше, однако существенных
различий при этом не отмечено (Р≥0,05). Такая же закономерность
отмечается по отношению бактерицидной и лизоцимной активности сыворотки крови
(табл…).
Таблица - Показатели неспецифической резистентности крови контрольных
поросят и полученных от свиноматок иммунизированных вакциной Бактеринтоксоид
Литергард LT-C
|
Показатели
|
Дни исследований
|
|
1-й день
|
3-й день
|
6-й день
|
9-й день
|
15-й день
|
|
1 ЛАСК % 2
|
2,56±0,08
|
4,26±0,14
|
4,16±0,06
|
3,15±0,05
|
2,65±0,16
|
3,85±0,06
|
3,78±0,05
|
3,14±0,16
|
2,64±0,08
|
|
1 БАСК % 2
|
38,15±0,99
|
66,39±0,19
|
65,14±3,24
|
48,28±1,52
|
39,77±1,4
|
|
38,44±0,14
|
64,35±1,58
|
51,43±0,29
|
43,89±0,61
|
39,87±0,27
|
|
1 ФА % 2
|
61,27±0,81
|
84,10±1,46
|
82,40±0,98
|
74,20±1,76
|
69,3±1,76
|
|
65,66±0,66
|
79,33±0,66
|
74,0±1,15
|
70,66±0,66
|
69,1±0,48
|
Исследованиями установлено, что до приема молозива у поросят опытной и
контрольной групп антитоксинов Cl. perfringens типа С не установлено. После
приёма молозива на 2-й день у животных, полученных от свиноматок
вакцинированных инактивированной вакциной Бактеринтоксоид Литергард LT-C соответствующие
антитела регистрировались в титрах 0,58
±0,03 АЕ/см3. К 3-му дню жизни поросят их количество увеличилось до 1,28
±0,21 АЕ/см3, а затем наблюдается снижение их титров. На 6-й день они
регистрировались в пределах 0,61±0,03, 9-й - 0,3±0,02, 15-й - 0,17±0,03 АЕ/см3
(табл…).
У поросят контрольной группы антитоксины регистрировались соответственно
в титрах 0,04±0,002; 0,08±0,12; 0,05±0,004; 0,02±0,002 АЕ/см3 и к 15-му дню они
не выявлялись.
Таблица.. - Титры антитоксинов Cl. perfringens типа С в сыворотке крови
опытных и контрольных поросят
|
Группа животных
|
Титры антитоксинов, АЕ/см3
|
|
До приема молозива
|
2-й день
|
3-й день
|
6-й день
|
9-й день
|
15-й день
|
|
Опытная
|
-
|
0,58 ±0,03
|
1,28 ±0,21
|
0,61 ±0,03
|
0,3 ±0,02
|
0,17 ±0,03
|
|
Контрольная
|
-
|
0,04 ±0,002
|
0,08 ±0,12
|
0,05 ±0,004
|
0,02 ±0,002
|
-
|
За время исследований в опытной группе гибели поросят не отмечено, а в
контрольной группе пало 9 животных. От павших поросят контрольной группы
выделена культура Cl. perfringens.
Среднесуточный прирост у поросят контрольной группы составил 326 граммов,
а у поросят опытной группы 367 граммов, т.е. на 41 грамм больше.
2.5 Анализ полученных результатов
В наше время большая роль в обеспечении страны продовольствием отводится
к интенсивному развитию промышленных комплексов по производству свинины. Для
этого необходимо по-новому решать вопросы ветеринарного обслуживания
животноводческих хозяйств промышленного типа, комплектовать их здоровым
поголовьем, что обязывает ветеринарных специалистов повысить уровень
организации ветеринарного дела, обратив особое внимание на проведение
профилактических, противоэпизоотических, ветеринарно-санитарных мероприятий,
предупреждение заноса заразных болезней.
Одной из главных проблем промышленного животноводства являются болезни
молодняка, в частности пищеварительной и дыхательной систем. В этиологии и
патогенезе желудочно-кишечных болезней важную роль играют различные
условно-патогенные микроорганизмы и гельминты, а также нарушение кормления и
содержания, стрессы, различные токсикозы и отравления, способствующие снижению
общей резистентности организма.
Среди массовых желудочно-кишечных и септических заболеваний новорожденных
поросят первых дней жизни немалую роль занимает анаэробная энтеротоксемия.
Несмотря на большие достижения науки, положение с данным заболеванием
продолжает оставаться тяжелым в многих странах мира, в т.ч. и в Республике
Беларусь.
По данным отечественных и зарубежных исследователей анаэробная
энтеротоксемия в неблагополучных хозяйствах поражает до 100% новорожденных
поросят. Летальность от этой болезни среди животных достигает до 80%.
Возбудители данного заболевания широко распространены в природе и являются
обитателями кишечника животных и человека. Этиологическим фактором заболевания
является микрооганизм Clostridium perfringens типов А, В, С, Д, Е. Заболевают в
основном поросята 1-3-недельного возраста. Болезнь чаще всего наблюдается в
хозяйствах, где нарушаются зоогигиенические условия содержания и кормления
животных.
Исследования отечественных и зарубежных ученых указывают на широкое
распространение анаэробной энтеротоксемии поросят в различных странах и на
территории РБ, а также на значительный экономический ущерб, причиняемый этой
болезнью животноводству.
Этиотропное и симптоматическое лечение поросят при клостридиозах, как правило,
мало эффективно в виду острого течения заболевания. В связи с этим, основное
внимание по профилактике данной болезни уделяется специфической профилактике с
использованием вакцин. С этой целью в различные годы неоднократно
предпринимались попытки изготовления и использования монобиопрепаратов для
активной иммунизации супоросных свиноматок против анаэробной энтеротоксемии
поросят, вызванной Clostridium perfringens типа С. Однако промышленный выпуск
биопрепаратов против данного заболевания у нас в Республике Беларусь не
организован, несмотря на то что А.В. Бубловым, В.Н. Алешкевичем с соавт. в 90-е
годы для профилактики анаэрбной энтеротоксемии у свиней и крупного рогатого
скота предлагался поливалентный анатоксин. Многие вопросы этой проблемы до сих пор
требуют дополнительного изучения и уточнения.
Вместе с тем в настоящее время для профилактики анаэробной энтеротоксемии
поросят в некоторых странах предложены вакцины против данного заболевания:
России - бивалентная вакцина против анаэробной энтеротоксемии и колибактериоза
свиней, США - инактивированная вакцина Clostridium perfringens type C,
Escherichia coli Bacterin Toxoid, производства Pfizer Animal Health против
анаэробной энтеротоксемии и колибактериоза свиней и др.
Учитывая выше изложенное мы поставили целью исследований изучение влияния
инактивированной вакцины Clostridium perfringens type C, Escherichia coli
Bacterin Toxoid, производства Pfizer Animal Health, США против анаэробной
энтеротоксемии и колибактериоза свиней на иммунную реактивность животных,
разрешенной к применению в животноводческих хозяйствах РБ.
При прохождении производственной практики в январе - апреле 2011 года в
ОАО «Агрокомбинат «Южный»» среди поросят 1-10-ти дневного возраста наблюдались
случаи заболевания 11-ти новорождённых животных гастроэтеритами. У больных
регистрировали повышение температуры тела до 40,5оС. У поросят учащался пульс
(225,5±7,8 ударов в минуту) и дыхание (88 дыханий в минуту). Поросята быстро
слабели, через один-два часа оказывались в состоянии прострации, лежали на боку
и обнаруживали слабые признаки жизни. У них появлялся понос, который являлся
ведущим клиническим симптомом болезни. Больные поросята плохо сосали свиноматок
и лежали, зарывшись в подстилку.
Животных подвергли лечению тиланом и симптоматическими средствами. Однако
два из заболевших поросят погибли на 1-й день болезни, 5 животных - на 3-й
день. Клинические признаки болезни и патологоанатомическая картина при вскрытии
трупов погибших животных соответствовала таковой, описываемой в специальной литературе,
как при анаэробной энтеротоксемии.
От животных отобрали трубчатую кость, селезёнку, головной мозг, долю
печени с желчным пузырём, брыжеечные лимфатические узлы, соответствующие
поражённым участкам тонкого отдела кишечника, и в отдельной посуде - поражённый
отрезок тонкого отдела кишечника. Одновременно от поросят с признаками
гастроэнтерита на исследовании взяли фекалии.
Бактериологическое исследование провели на кафедре микробиологии и
вирусологии УО ВГАВМ. Посевы из патологического материала, перечисленного выше,
делали на МПА, МПБ, среды Эндо, Минка, а также МППБ и среду Цейсслера, которую
после посева патматериала помещали в микроанаэростат.
При исследовании содержимого тонкого отдела кишечника в реакции
нейтрализации на белых мышах в нем обнаружился токсин Cl. рerfringens типа С. В
дальнейшем в результате культурального исследования был выделен микроорганизм
отнесенный к выше указанному виду.
Возбудителей колибактериоза свиней при бактериологическом исследовании не
выделено.
Исследованиями установлено, что после введения вакцины у свиноматок общей
температурной реакции, а также выраженной реакции на месте инъекции
(покраснение, припухание, некрозы, абсцессы) не наблюдалось.
До иммунизации всех супоросных свиноматок в их сыворотках крови
антитоксины Cl. perfringens типа С обнаруживались в титрах 0,04±0,01-0,002
АЕ/см3. В дальнейшем у свиноматок опытной группы перед второй иммунизацией они
регистрировались в пределах 0,54±0,03, перед опоросом - 1,34±0,21, а через 30
дней после опороса - в количестве 0,61±0,03 АЕ/см3. У контрольных животных
соответственно 0,04±0,002, 0,07±0,004, 0,02±0,002 АЕ/см3.
В молозиве супоросных свиноматок иммунизированных инактивированной
вакциной Clostridium perfringens type C, Escherichia coli Bacterin Toxoid
(производства Pfizer Animal Health, США) антитоксины Cl. perfringens типа С
регистрировались только в 1-й день после опороса в титрах 2,43±0,14 и 3-й день
- 0,58±0,03 АЕ/см3, что подчеркивает важность своевременного получения
подсосными поросятами молозива матери.
В сыворотке молозива свиноматок не подвергавшихся иммунизации вакциной
Бактеринтоксоид Литергард LT-C антитоксины определялись только в первый день
после опороса в количестве 0,17±0,03 АЕ/см3.
У поросят опытной и контрольной групп на протяжении всего периода
исследований колебание количества эритроцитов и гемоглобина в сыворотке крови
происходило в пределах нормы и без достоверных различий (Р>0,05). Отмечаемый
лейкоцитоз в сыворотке крови поросят, полученных от свиноматок не
вакцинированных вакциной против анаэробной энтеротосемии по-видимому является
физиологической реакцией организма на возможное присутствие антигенов Cl.
perfringens.
При изучении иммунологической перестройки в организме у поросят,
полученных от свиноматок вакцинированных против анаэробной энтеротоксемии нами
установлено, что в динамике общего белка существенных изменений не происходило
на протяжении всех сроков исследований (Р>0,05). Заметные структурные
изменения установлены в содержании белковых фракций - возрастает содержание
гамма-глобулинов с одновременным уменьшением альбуминов. У поросят опытной
группы к 6-му дню после приёма молозива содержание гамма-глобулинов возросло с
19,8±1,14 % до 30,4±0,45 % (Р≤0,01), а содержание альбуминов снизилось с
46,8±1,03 % до 34,6±0,96 % (Р≤0,01). К 9-му дню исследований содержание
гамма-глобулинов и альбуминов достигло уровня начала опыта.
Заметных изменений со стороны альфа- и бета-глобулиновых фракций нами не
установлено. Их колебания у животных обеих групп происходили без достоверных
различий (Р>0,05).
При изучении иммунологической перестройки в организме у поросят,
полученных от свиноматок вакцинированных против анаэробной энтеротоксемии нами
установлено, что в динамике общего белка (табл....) существенных изменений не
происходило на протяжении всех сроков исследований (Р>0,05). Заметные
структурные изменения установлены в содержании белковых фракций - возрастает
содержание гамма-глобулинов с одновременным уменьшением альбуминов. Так, у
поросят опытной группы к 6-му дню после приёма молозива содержание
гамма-глобулинов возросло с 19,8±1,14 % до 30,4±0,45 % (Р≤0,01), а
содержание альбуминов снизилось с 46,8±1,03 % до 34,6±0,96 % (Р≤0,01). К
9-му дню исследований содержание гамма-глобулинов и альбуминов достигло уровня
начала опыта.
Заметных изменений со стороны альфа- и бета-глобулиновых фракций нами не
установлено. Их колебания у животных обеих групп происходили без достоверных
различий (Р>0,05).
У поросят, полученных от иммунизированных бивалентной вакциной против
анаэробной энтеротоксемии и колибактериоза свиноматок, после приёма молозива на
2-й день жизни животных антитоксины Cl. perfringens типа С регистрируются в
титрах 0,58±0,03, 3-й - 1,28±0,21 АЕ/см3, 6-й - 0,61±0,03, 9-й - 0,3±0,02, 15-й
- 0,17±0,03 АЕ/см3.
Таким образом установлено, что при двукратной вакцинации супоросных
свиноматок инактивированной вакциной Clostridium perfringens type C,
Escherichia coli Bacterin Toxoid (производства Pfizer Animal Health, США)
согласно наставления достигается 100% профилактическая эффективность
сохранности поросят от анаэробной энтеротоксемии.
3. ВЫВОДЫ
. Анаэробная энтеротоксемия поросят регистрируется в ОАО «Агрокомбинат
«Южный»». Возбудителем болезни является CI. рerfringens типа С. Заболевание
наблюдается у поросят 1-7 дневного возраста.
. В молозиве супоросных свиноматок иммунизированных инактивированной
вакциной Clostridium perfringens type C, Escherichia coli Bacterin Toxoid
(производства Pfizer Animal Health, США) антитоксины Cl. perfringens типа С
регистрируются только в 1-й день после опороса в титрах 2,43±0,14 и 3-й день -
0,58±0,03 АЕ/см3.
. У поросят, полученных от иммунизированных бивалентной вакциной против
анаэробной энтеротоксемии и колибактериоза свиноматок, после приёма молозива на
2-й день жизни животных антитоксины Cl. perfringens типа С регистрируются в
титрах 0,58±0,03, 3-й - 1,28±0,21 АЕ/см3, 6-й - 0,61±0,03, 9-й - 0,3±0,02, 15-й
- 0,17±0,03 АЕ/см3.
. При двукратной вакцинации супоросных свиноматок инактивированной
вакциной Clostridium perfringens type C, Escherichia coli Bacterin Toxoid
(производства Pfizer Animal Health, США) согласно наставления достигается 100%
профилактическая эффективность сохранности поросят от анаэробной энтеротоксемии
4. ПРЕДЛОЖЕНИЯ ПРОИЗВОДСТВУ
. Способ вакцинации поросят против анаэробной энтеротоксемии
использованием инактивированной вакцины Clostridium perfringens type C,
Escherichia coli Bacterin Toxoid, производства Pfizer Animal Health, США против
анаэробной энтеротоксемии и колибактериоза свиней рекомендуем внедрить в
ветеринарную практику.