Роль митохондрий в апоптозе
Курсовая
работа
Учебная
дисциплина: Цитология
Роль
митохондрий в апоптозе
Санкт-Петербург
2010
Содержание
Введение. Некроз и апоптоз
. Митохондрия как центральный
контрольный пункт апоптоза
. Морфологические изменения и
перераспределение митохондрий в клетке во время апоптоза
.1 Перераспределение митохондрий
.2 Морфологические проявления
апоптоза
. Митохондрии - опосредованный
апоптоз
.1 Модели протекания апоптоза
.2 Пять моделей высвобождения
цитохрома С из митохондрии в процессе апоптоза
.3 Митохондриальная пора
. Митохондрии и старение
Заключение
Список литературы
Введение. Некроз и апоптоз
У большинства многоклеточных живых организмов
встречается такой процесс как клеточная гибель. Клетки умирают, будь то
случайно, например, при повреждениях, или же запрограммировано, например,
массовая гибель нейронов (40-70%) в эмбриогенезе, а так же, в течение всей
жизни организма. Клеточную смерть можно разделить на две большие категории -
некроз (от греч. - омертвление) и апоптоз (от греч. - распадение). Эти два
процесса, ведущие к гибели клетки, идут по разным механизмам (см. рис. 1).
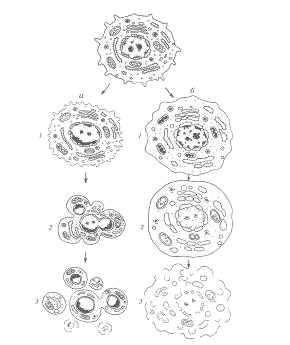
Рис. 1. Два пути клеточной гибели:
а - апоптоз (программированная клеточная
смерть): 1 - специфическое сжатие клетки и конденсация хроматина, 2 -
фрагментация ядра, 3 - фрагментация тела клетки на ряд апоптических телец; б -
некроз: 1 - набухание клетки, вакуолярных компонентов, конденсация хроматина
(кариорексис), 2 - дальнейшее набухание мембранных органоидов, лизис хроматина
ядра (кариолизис), 3 - разрыв мембранных компонентов клетки - лизис клетки
Некроз
- обусловлен нарушением внутриклеточного гомеостаза, за счет подавления работы
мембранных насосов. В результате этого, вода в большом количестве попадает в
клетку, вызывая ее набухание с последующим разрывом и растворением (лопаются
мембраны органоидов, происходит закисление цитоплазмы и растворение ядра
(кариолизис)). Такая гибель является результатом недостатка кислорода, действия
многих ядов, и др. Участок некроза подвергается атаке лейкоцитов и в зоне
некроза развивается воспалительная реакция.
Апоптоз
- программируемая клеточная смерть (ПКС) - регулируемый процесс удаления
ненужных, постаревших и поврежденных клеток. Клетки гибнут не из-за физического
или химического повреждения, а как бы «беспричинно». В ходе апоптоза клетка не
растворяется, а распадается на отдельные участки, ограниченные плазматической
мембраной (апоптические тельца). Эти тельца фагоцитируются (поглощаются) либо
макрофагами, либо соседними здоровыми клетками. И этот процесс не
сопровождается воспалительной реакцией.
Ученые, занимающиеся апоптозом, выяснили, что в
этом процессе колоссальную роль играют митохондрии. Эти органоиды
выделяют в цитозоль вещества, которые повышают вероятность клетки быть
подвергнутой апоптозу.
Я бы хотела обозначить механизмы апоптоза, а так
же, участие в них митохондрий.
1. Митохондрия
как центральный контрольный пункт апоптоза
Термин "апоптоз", предложенный в 1972
г. английскими учеными J.F.R. Кеrr, А.Н. Wyllie и A.R. Currie, состоит из двух
греческих слов и означает в буквальном смысле "отделение лепестков от
цветов", а применимо к клетке - особый тип смерти путем разделения ее на
части ("апоптозные тельца"), которые впоследствии фагоцитируются соседними
клетками разного типа, с целью не допустить появление воспалительной реакции.
Неконтролируемый апоптоз может привести к раку, аутоиммунным и
нейродегенеративным заболеваниям.
Центральным пунктом апоптоза является
митохондрия. Она играет большую роль в апоптозе, вызываемом различными
раздражителями; объединяет сигналы клеточной смерти посредством белков
семейства Bcl-2 (белков, в зависимости от ситуации стимулирующих или
подавляющих апоптоз) и активирует выход цитохрома С (белка, переносящего
электроны между белковыми комплексами во внутренней мембране митохондрии), в
результате чего митохондриальная мембрана становится проницаемой. Механизмы,
которые приводят к этой проницаемости, ещё не до конца изучены. Выделяясь из
митохондрий, цитохром С включается в состав апоптосомы.
Апоптосома - это комплекс, состоящий из белковой
молекул третичной структуры. Ее появление активирует каспазы
(относящиеся к классу цистеиновых протеаз, расщепляющие белки по аспарагиновой
кислоте; при активации приобретают способность расщеплять основные
внутриклеточные элементы), запускающие каскад апоптозных реакций. В состав
апоптосомы входят Apaf-1
(апоптозный протеазоактивирующий фактор 1), прокаспаза и цитохром С. Этот
комплекс, в присутствии АТФ или дАТФ, активирует каспазу 9. Активированная каспаза
9, в свою очередь, активирует другие каспазы, задачей которых является
разрушение клетки.
Далее, вкратце, немного о белках семейства
Bcl-2. Одни способны активировать процессы апоптоза, другие же, наоборот, его
тормозят. На рисунке 2, в зеленом прямоугольнике приведены примеры белков,
борющихся за жизнь клетки, а в красном прямоугольнике те, которые способствуют
клеточной смерти. Из этого списка далее будут упоминаться Bcl-2, Bcl-xl,
Bad, Bid
и Bax.
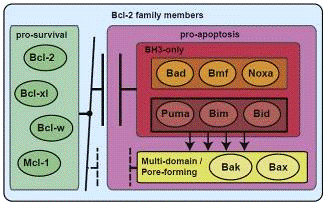
Рисунок 2. Апоптические и противоапоптические
белки семейства Bcl-2
Итак, центральными белками апоптоза, которые
сохраняются на протяжении всей эволюции, являются Bcl-2, Apaf-1 и определенного
рода каспазы.
Если цитохром С высвобождает каспазы, то Bcl-2,
белок, регулирующий программируемую клеточную смерть во многих клеточных
системах посредством контроля проницаемости митохондриальной мембраны, можно
считать защитным механизмом, предотвращающим выделение цитохрома С, то
есть, подавляющим клеточный апоптоз. Поддержка этой идеи была взята от
системы внеклеточного апоптоза, изученной на яйцеклетках лягушек рода Xenopus.
В таких системах митохондрия должна продуцировать цитохром С, высвобождаемый
при активации каспаз. Добавление экзогенного Bcl-2 предотвращает высвобождение
цитохрома С и активацию каспаз. Клак и другие ученые также показали, что Bcl-2
может непосредственно взаимодействовать с митохондрией для предотвращения
высвобождения цитохрома С.
Важный эксперимент показал, что Bcl-2 может
блокировать апоптоз даже в клетках с отсутствующей митохондриальной ДНК
(которая тоже контролирует процесс выхода цитохрома С в цитозоль), но после
этого клетки не в состоянии осуществлять процесс окислительного
фосфорилирования.
Апоптоз может проходить разными путями, даже в
том случае, если митохондриальный противоапоптозный белок Bcl-2 отсутствует.
Например, AIF (апоптоз инициирующий фактор) может вызывать апоптоз посредством
управления проницаемостью мембраны митохондрии; активировать эндонуклеазы,
расщепляющие ламину, ДНК и цитоскелет клетки, и всё это независимо от наличия в
митохондрии Bcl-2.
2. Морфологические изменения и
перераспределение митохондрий в клетке во время апоптоза
2.1 Перераспределение митохондрий
На рисунке 4 митохондрии окрашены антителами,
для того, чтобы их можно было увидеть в клетке. Слева (рисунок «a»)
изображена клетка в нормальном состоянии. Митохондрии располагаются
червеобразно. Далее с митохондрией связывается белок Bax, пытаясь
встроиться в митохондриальную пору с целью выпустить цитохром С. На рисунке («b»)
митохондрии точечно рассеяны по всей клетке. И исчезают из периферии,
группируясь вокруг ядра, на рисунке («с»). Сгруппированные митохондрии теряют
цитохром С.
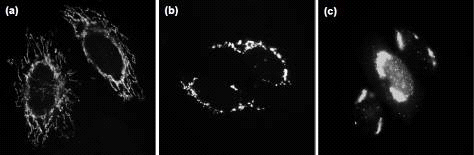
Рисунок 3. Перераспределение митохондрий в
клетке под действием апоптоза
2.2 Морфологические проявления
апоптоза
Целостность плазматической мембраны при апоптозе
не нарушается, хотя происходит ее выпячивание и «пузырение» за счет изменений
цитоскелета. При апоптозе цитоплазма клетки уплотняется, хроматин
конденсируется, ядро подвергается сморщиванию и в дальнейшем распадается на
отдельные везикулы. Как вам уже известно, на заключительных стадиях апоптоза
фрагментации подвергаются сами клетки с формированием, так называемых
апоптозных телец - фрагментов хроматина, окруженных мембраной.
Митохондрия при апоптозе, с точки зрения
морфологии, на протяжении долгого времени остается неизменной, а при некрозе
происходит ее набухание. Однако, обзор литературы прошлого, когда апоптоз ещё
не был описан, показывает аномалии митохондрий в процессе клеточной гибели, что
можно классифицировать как апоптоз. Наиболее частыми нарушениями являются
уменьшение митохондрий в размерах и гиперплотность их матрицы, такие
особенности часто называют «митохондриальный пикноз» (т.е., сморщивание).
Правда, эксперименты, проведенные на симпатических нейронах, показали, что если
апоптоз вызван фактором роста нервов (NFG), то потеря нейронов блокируется с
помощью каспазных ингибиторов, то есть, что переход от нормальной структуры к
конденсированной является обратимым процессом. Кроме того, сильно влияют на
апоптоз клеточные распределения митохондрий; митохондрии, как правило,
разбросаны по всей клетке. Однако, одним из первых событий, которое происходит
при апоптозе, вызванном некрозным фактором опухоли (tumour necrosis factor -
TNF), является перинуклеарная кластеризация митохондрий, которая может привести
к нарушениям кинезин-опосредованного транспорта органелл (кинезин - белок,
самостоятельно перемещающийся по цитоскелету клетки, перенося большие
биомолекулы из центра к периферии).
И при митохондриальной конденсации (пикнозе) и
при перинуклеарной кластеризации во многих типах клеток можно наблюдать
выделение проапоптического белка Bax, относящегося к семейству белков Bcl-2.
Все эти факты оставляют без ответа многие
вопросы об их физиологическом значении. Например, не конденсация ли митохондрий
играет роль в выходе цитохрома С? Процесс кластеризации митохондрии вблизи ядра
продуцирует образование большого количества АТФ, в которой нуждается
энергозависимый апоптоз или же молекулы АТФ нужны для облегчения перемещения
митохондриальных белков (например, AIF) в ядро?
Прояснение молекулярных механизмов, лежащих в
основе этих процессов, может еще больше помочь в понимании роли митохондрии в
посредничестве апоптозу.
3. Митохондрии - опосредованный
апоптоз
.1 Модели протекания апоптоза
На поверхности каждой клетки имеются «смертельные
рецепторы», способные улавливать апоптические сигналы. Многие сигналы смерти
поступают на митохондрию посредством белков семейства Bcl-2, таких, как белки Bid
и Bad. Эти белки работают специфически.
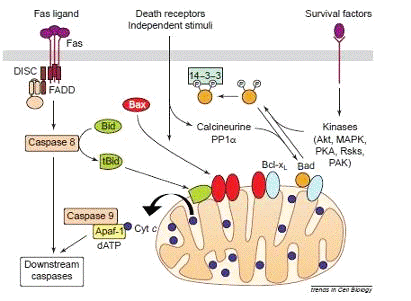
Рисунок 4. Различные механизмы апоптоза
1. В некоторых
клетках белок Fas взаимодействует с трансмембранным белком, запуская тем
самым программу смерти, что приводит к тримеризации Fas и формированию
вызывающего клеточную смерть комплекса сигналов (DISC
- death-inducing
signaling complex). Этот комплекс так же называют апоптосомой, и он формируется
путем объединения цитоплазматической области Fas, белка FADD и
прокаспазы 8, способной к созданию активного фермента - каспазы 8.
Затем, каспаза 8 взаимодействует с белком Bid и
расщепляет его до концевого продукта - t-Bid,
который, активизирует Bax или Bax-подобные белки, способствующие активизации и
выходу цитохрома С (смотри рисунок 5). Bax претерпевает морфологические
изменения, олигомеризуется и встраивается во внешнюю мембрану митохондрии. Это
способствует быстрому освобождению цитохрома с. Вполне возможно, что Bax
вставляется в митохондрию прежде, чем олигомеризуется. Эти события могут быть
вызваны посредством взаимодействия Bax
с белком Bid или
прокаспазой-8 вкупе с белками Bid и tBid, а так же, могут быть подавлены путем
прямого взаимодействия Bax с белками Bcl-2 и Bcl-XL. Bax-подобный
белок «Bak»
активируется через аналогичные механизмы.
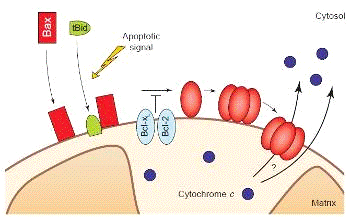
Рисунок 5. Высвобождение цитохрома С белком Bax
Есть, так же, вариант, когда t-Bid
может активизировать цитохром С самостоятельно, без взаимодействия с Bax,
встраиваясь в мембрану митохондрии и, вкупе с белком - порином, образуя канал
проводимости.
После этого, в цитозоле, цитохром С активизирует
каспазу 9, путем связывания Apaf-1 с АТФ/дАТФ и прокаспазой 9 (о комплексе
которых уже говорилось ранее). После чего идет дальнейшее развитие апоптоза,
сопровождающееся образованием новых каспаз и разрушением клетки.
2. Каспаза 8
может так же инициировать сигнальный путь, который не зависит от митохондрии,
путем активизирования дальнейшего каскада реакций с образованием новых каспаз.
3. Белки Bad и
Bax, перемещаясь по митохондрии, так же могут вызвать апоптоз, получив сигнал
независимой от рецепторов смерти. В здоровых клетках Bad фосфорилируется в
ответ на присутствие в клетке некоторых каспаз, таких как, Akt,
митоген-активирующаяся протеиновая киназа (MAPC),
Erk, PKA
(протеинкиназа-А), Rsks
(MAPK-активизирующаяся
киназа) и PAK
(p21-активизирующаяся киназа 1). Проще говоря, апоптоз не запускается в ответ
на пролиферацию (разрастание) клеток.
Связывание Bad с сильными антиапоптозными
белками Bcl-xL и Bcl-2, находящимися на мембране митохондрии,
инактивирует последние, что ведет к клеточной гибели. Однако, будучи
фосфорилированным, Bad может образовывать комплекс с 14-3-3 белком в
цитоплазме, предотвращая тем самым связь Bad с митохондриально локализованными
Bcl-xL и Bcl-2 и, таким образом, подавляя апоптоз. Два
фосфорилированных сериновых остатка встраиваются в белковую последовательность
14-3-3. Фосфорилирование каждого остатка - как результат изоляции Bad
в цитозоле.
4. При
апоптозе Bad является дефосфорилированным и перемещается в митохондрии, где
связывается с Bcl-xL. Между тем, Bcl-xL замещает Bad
на Bax, тем самым
подавляя апоптоз.
Если Bcl-2
включает механизм выживания клеток, то Bax
ускоряет апоптоз. Bcl-2 и Bax
могут образовывать гетеродимеры (причем, в данном случае, способности Bax
заглушаются, и клетка выживает). Предполагается, что соотношение белков Bcl-2 и
Bax может быть главной клеточной способностью к апоптозу. (центральный
рисунок).
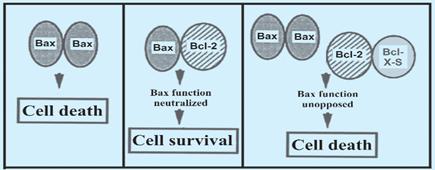
Рисунок 6. Комбинации гетеродимеров,
усиливающих и подавляющих апоптоз
Для активности, подавляющей смерть, Bcl-2 и
Bcl-xL
должны сформировать димеры с протеином Вах, в то время как димеры с протеином
Bad усиливают смерть.
.2 Пять моделей высвобождения
цитохрома С из митохондрии в процессе апоптоза
митохондрия апоптоз цитохром
старение
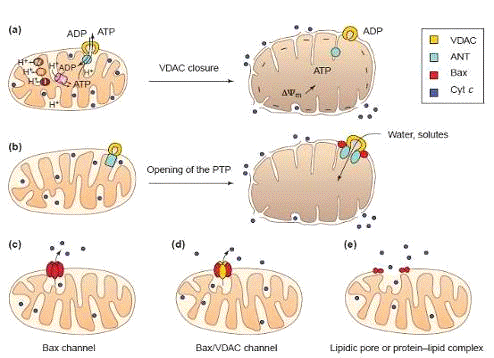
Рисунок 7. Модели высвобождения цитохрома С
МОДЕЛЬ А. Внешняя мембрана митохондрии
разрывается в результате набухания, что позволяет цитохрому С и другим белкам
выйти из межмембранного пространства. Модель А отображает закрытие анионных
каналов (VDAC) и нарушение АТФ-АДФ обмена.
При нормальных условиях (рисунок слева) протоны,
которые накапливаются в межмембранном пространстве в результате переноса
электрона посредством работы АТФ-синтетазного комплекса F1F0.
Прекращение работы АТФ-синтетазного комплекса приводит к нарушению АТФ-АДФ
обмена и накопление протонов в межмембранном пространстве, что способствует
увеличению трансмембранного митохондриального потенциала, который ведет клетку
к осмотическому набуханию (рисунок справа).
МОДЕЛЬ Б. Эта модель предполагает, что поры на
мембране митохондрии открываются, вследствие чего внутренняя проницаемость
увеличивается и митохондрия набухает от воды и растворенных веществ, которые в
неё вливаются через открытые поры.
Bax может заставить
эту пору открыться за счет связывания с ANT
(аденин-никлеотидным транслокатором) на контакте между внутренней и внешней
мембраной или после перемещения во внутренней мембране митохондрии.
МОДЕЛИ С, Д и Е.
Крупные каналы в наружной мембране митохондрии
позволяют выходить цитохрому С без повреждения митохондрии.
Эти каналы могут быть образованы только белком
Bax (модель С), комплексом Bax + VDAC (модель Д), или может быть липидным
каналом или белково-липидным комплексом, образованными после вставки Bax в
наружную мембрану митохондрии (модель Е).
3.3 Митохондриальная пора
Если пора находится в открытом состоянии, то
через нее в митохондрию могут свободно пройти вода и растворенные в ней
вещества, что приведет к отеку и разрыву внешней мембраны митохондрии.
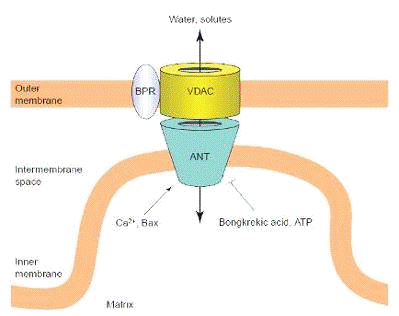
Рисунок 8. Возможные компоненты митохондриальной
поры (PTP)
Сокращение поры вызывают: ANT
(аденин-никлеотидный транслокатор); BPR (переферические рецепторы); VDAC (анион
каналы, зависящие от напряжения). Так же, на рисунке обозначены различные
«открыватели» (Ca2+, Bax, активные формы кислороды) и «закрыватели» (АТФ,
различные кислоты) митохондриальной поры.
4. Митохондрии и старение
Одна из примечательных особенностей митохондрий
- это наличие у них своей собственной ДНК: митохондриальной ДНК. Независимо от
ядерной ДНК, каждая митохондрия имеет свой собственный генетический аппарат.
Наличие своего собственного ДНК в митохондриях открывает новые пути в
исследованиях проблемы старения, которое возможно связано с устойчивостью
митохондрий. К тому же мутация митохондриальной ДНК при известных
дегенеративных болезнях (Альцгеймер, Паркинсон...) наводит на мысль, что они
могут играть особую роль в этих процессах. Из-за постоянного последовательного
деления митохондрий, направленного на производство энергии, их ДНК
«снашивается».
Когда митохондрии перестают вырабатывать энергию
вообще - наступает клеточная смерть (гибнет клетка). Без энергии повреждаются
все функциональные системы в организме, потому, что всё в этом мире требует
энергии. Истощается запас митохондрий в хорошей форме, уменьшая единственный
источник клеточной энергии.
Митохондриальная ДНК в 10 раз чувствительнее к
действию свободных радикалов, чем ядерная. Мутации, вызванные свободными
радикалами, ведут к дисфункции митохондрий. Но, по сравнению с клеточной,
система самовосстановления митохондриальной ДНК очень слабая. Когда повреждения
митохондрий значительны, митохондрии самоуничтожаются. Кроме того, одним из
наиболее агрессивных факторов, приводящих к стимуляции процесса старения,
являются свободные радикалы и другие активные формы кислорода. Один из
источников активных форм кислорода - это митохондриальная дыхательная цепь.
Спектр действия активных форм кислорода в клетке
довольно широк - повреждение мембранных белков, индукция процессов, идущих в
биологических мембранах, инактивация цитозольных ферментов и повреждение
митохондриальной и ядерной ДНК.
Заключение
Во взрослом организме апоптоз происходит всё
время. Отмирают клетки вольфовых и мюллерова каналов при развитии мочеполовой
системы позвоночных; погибает часть нейробластов и гонадоцитов; клетки при
метаморфозах насекомых и амфибий; миллионами погибают клетки крови, эпидермиса
кожи, тонкого кишечника, фолликулярные клетки яичника после овуляции, клетки
молочной железы после лактации. И таких примеров много. Таким образом,
биологическая роль апоптоза, или программированной смерти клеток, очень велика:
это удаление отработавших свое или ненужных на данном этапе развития клеток, а
также удаление измененных или патологических клеток, особенно мутантных или
зараженных вирусами.
Если бы процессы апоптоза не были нормой для
нашего организма, то это привело бы к тому, что клетки с поврежденной ДНК
неконтролируемо делились, приводя к необратимым последствиям. Благодаря
апоптозу идет самоочищение организма от больных клеток. Когда по каким-то
причинам гибель больных клеток нарушается, начинаются серьезные заболевания,
зачастую с летальным исходом. Например, у животных есть белок р53 (р - от
английского protein, a 53 - масса молекулы этого белка в килодальтонах). Этот
белок называют ''стражем генома''. Он обнаруживает разрывы в длинных тяжах ДНК
сначала включает синтез белков репарации (починки) ДНК, а затем, если разрывы
не ликвидированы, блокирует деление клетки. Это дает ей шанс исправить геном до
того как дефект будет передан дочерним клеткам. Если же клетке не удается
справиться с серьезными нарушениями, р53 запускает апоптоз.
Тем самым р53 стабилизирует генетическую
структуру клетки, предотвращая появление вредоносных мутаций, в том числе и
опухолеродных. Онкогены некоторых вирусов связывают р53 и инактивируют его, а
это ведет к освобождению клеточных протоонкогенов, отмене апоптоза и тем самым
к накоплению жизнеспособных мутаций в клетке. Такие клетки представляют собой
благоприятный материал для образования опухолей.
В заключение можно сказать, что основная
биологическая роль апоптоза в норме - установление равновесия между
процессами разрастания (пролиферации) и гибели клеток, что при
сбалансированности их разрастания и апоптоза обеспечивает стабильное состояние
организма. Преобладание разрастания над апоптозом приводит к росту тканей, а
при относительном усилении апоптоза по сравнению с разрастанием возникает
атрофия.
Список
литературы
1. Immo
E. Scheffler Copyright © 1999 John Wiley & Sons, Inc. Mitochondria
2. Solange
Desagher and Jean-Claude Martinou. Trends in CELL BIOLOGY (Vol. 10) //
September 2000
3. Ю.С.Ченцов.
Введение в клеточную биологию // М: Академкнига - 2005
. Э.Г.
Улумбеков, Ю.А. Челышева. Гистология, Эмбриология, Цитология // Гэотар-Медиа -
2009
. http://humbio.ru/
. http://www.medbiol.ru/
. http://ru.wikipedia.org
. http://mglinets.narod.ru