Гормоны поджелудочной железы, превращение глюкозы в этанол
Содержание
1. Гормоны поджелудочной железы, строение, биологическая роль
. Прогоркание жиров катализируется ферментом липоксигеназой. Дать
характеристику этого фермента
. Что такое церамид, липидный двойной слой, текучесть мембраны,
интегральный мембранный белок, рецептор гликолепид
. Сколько оксидоредуктоз, трансфеноз, гидролаз, меаз, изомераз
учавствует в превращении глюкозы в этанол. Написать уравнение реакции
Список использованных источников
1. Гормоны поджелудочной железы,
строение, биологическая роль
Поджелудочная железа выполняет в
организме две важнейшие функции: экзокринную и эндокринную. Экзокринная функция
обеспечивает синтез и секрецию ферментов и ионов, необходимых для процессов
пищеварения. Эндокринную функцию выполняют клетки островкового аппарата
поджелудочной железы, которые секретируют гормоны, участвующие в регуляции
многих процессов в организме.
В островковой части поджелудочной
железы (островки Лангерханса) выделяют 4 типа клеток, секретирующих разные
гормоны: А- (или α-) клетки секретируют глюкагон, В- (или β-) - инсулин, D- (или δ-) - соматостатин, F-клетки
секретируют панкреатический полипептид.
1. Инсулин. Строение,
синтез и секреция
Инсулин - полипептид, состоящий из
двух полипептидных цепей. Цепь А содержит 21 аминокислотный остаток, цепь В -
30 аминокислотных остатков. Обе цепи соединены между собой двумя дисульфидными
мостиками (рис. 1). Инсулин может существовать в нескольких формах: мономера,
димера и гексамера. Гексамерная структура инсулина стабилизируется ионами
цинка, который связывается остатками Гис в положении 10 В-цепи всех 6
субъединиц.
Молекула инсулина содержит также
внутримолекулярный дисульфидный мостик, соединяющий шестой и одиннадцатый
остатки в А-цепи. Инсулины некоторых животных имеют значительное сходство по первичной
структуре с инсулином человека.
В обеих цепях во многих положениях
встречаются замены, не оказывающие влияния на биологическую активность гормона.
Наиболее часто эти замены обнаруживаются в положениях 8, 9 и 10 цепи А.
В то же время в положениях дисульфидных
связей, остатков гидрофобных аминокислот в С-концевых участках В-цепи и С- и
N-концевых остатков А-цепи замены встречаются очень редко, что свидетельствует
о важности этих участков для проявления биологической активности инсулина.
Использование химических модификаций и замен аминокислот в этих участках
позволили установить структуру активного центра инсулина, в формировании
которого принимают участие остатки фенилаланина В-цепи в положениях 24 и 25 и
N- и С-концевые остатки цепи А.
Биосинтез инсулина включает
образование двух неактивных предшественников, препроинсулина и проинсулина,
которые в результате последовательного протеолиза превращаются в активный
гормон. Биосинтез препроинсулина начинается с образования сигнального пептида
на полирибосомах, связанных с ЭР. Сигнальный пептид проникает в просвет ЭР и
направляет поступление в просвет ЭР растущей полипептидной цепи. После
окончания синтеза препроинсулина сигнальный пептид, включающий 24
аминокислотных остатка, отщепляется (рис. 2).
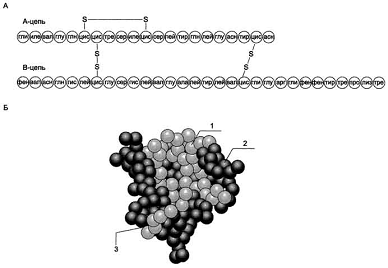
Рис.1. Структура инсулина человека.
А. Первичная структура инсулина. Б. Модель третичной структуры инсулина
(мономер): 1 - А-цепь; 2 - В-цепь; 3 - участок связывания с рецептором
Проинсулин (86 аминокислотных
остатков) поступает в аппарат Гольджи, где под действием специфических протеаз
расщепляется в нескольких участках с образованием инсулина (51 аминокислотный
остаток) и С-пептида, состоящего из 31 аминокислотного остатка.
Инсулин и С-пептид в эквимолярных
количествах включаются в секреторные гранулы. В гранулах инсулин соединяется с
цинком, образуя димеры и гексамеры. Зрелые гранулы сливаются с плазматической
мембраной, и инсулин и С-пептид секретируются во внеклеточную жидкость в
результате экзоцитоза. После секреции в кровь олигомеры инсулина распадаются. Т1/2
инсулина в плазме крови составляет 3-10 мин, С-пептида - около 30 мин.
Разрушение инсулина происходит под действием фермента инсулиназы в основном в
печени и в меньшей степени в почках.
Регуляция синтеза и секреции инсулина.
Глюкоза - главный регулятор секреции инсулина, а β-клетки - наиболее важные глюкозо-чувствительные клетки в
организме. Глюкоза регулирует экспрессию гена инсулина, а также генов других
белков, участвующих в обмене основных энергоносителей. Действие глюкозы на
скорость экспрессии генов может быть прямым, когда глюкоза непосредственно
взаимодействует с транскрипционными факторами, или вторичным, через влияние на
секрецию инсулина и глюкагона. При стимуляции глюкозой инсулин быстро
освобождается из секреторных гранул, что сопровождается активацией транскрипции
мРНК инсулина.
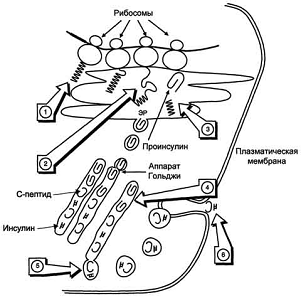
Рис. 2. Схема биосинтеза инсулина в β-клетках островков
Лангерханса. ЭР - эндоплазматический ретикулум. 1 - образование сигнального
пептида; 2 - синтез препроинсулина; 3 - отщепление сигнального пептида; 4 -
транспорт проинсулина в аппарат Гольджи; 5 - превращение проинсулина в инсулин
и С-пептид и включение инсулина и С-пептида в секреторные гранулы; 6 - секреция
инсулина и С-пептида.
Синтез и секреция инсулина не
являются строго сопряжёнными процессами. Синтез гормона стимулируется глюкозой,
а секреция его является Са2+-зависимым процессом и при дефиците Са2+снижается
даже в условиях высокой концентрации глюкозы, которая стимулирует синтез
инсулина.
Потребление глюкозы β-клетками происходит в
основном при участии ГЛЮТ-1 и ГЛЮТ-2, и концентрация глюкозы в клетках быстро
уравнивается с концентрацией глюкозы в крови. В β-клетках глюкоза превращается в глюкозо-6-фосфат глюкокиназой,
имеющей высокую Кm, вследствие чего скорость её фосфорилирования
почти линейно зависит от концентрации глюкозы в крови. Фермент глюкокиназа -
один из важнейших компонентов глюкозо-чувствительного аппарата β-клеток, в который,
помимо глюкозы, вероятно, входят промежуточные продукты метаболизма глюкозы,
цитратного цикла и, возможно, АТФ. Мутации глюкокиназы приводят к развитию
одной из форм сахарного диабета.
2. Биологические функции
инсулина
Инсулин - главный анаболический
гормон. Он участвует в регуляции метаболизма, транспорта глюкозы, аминокислот,
ионов, в синтезе белков. Инсулин влияет также на процессы репликации и
транскрипции, участвуя таким образом в регуляции клеточной дифференцировки,
пролиферации и трансформации клеток. Участие инсулина в регуляции метаболизма
рассмотрено в соответствующих разделах. Влияние инсулина на ключевые ферменты метаболизма
представлено в табл. 1.
Влияние инсулина на метаболизм
глюкозы. Инсулин стимулирует утилизацию глюкозы в клетках разными путями. Около
50% глюкозы используется в процессе Гликолиза, 30-40% превращается в жиры и
около 10% накапливается в форме гликогена. Общий результат стимуляции этих
процессов - снижение концентрации глюкозы в крови.
Влияние инсулина на метаболизм
глюкозы осуществляется путём повышения активности и количества ключевых
ферментов гликолиза: глюкокиназы, фосфофруктокиназы, пируваткиназы. В мышцах
инсулин активирует гексокиназу П. В печени и мышцах под влиянием инсулина
снижается концентрация цАМФ в результате активации фосфодиэстеразы. Кроме того,
инсулин активирует фосфатазы, дефосфорилирующие гликогенсинтазу, в результате
чего происходит активация синтеза гликогена и тормозится его распад.
Таблица 1. Влияние инсулина на
ключевые ферменты метаболизма
|
Печень
|
Мышцы
|
Жировая ткань
|
|
|
Активация
|
|
|
1. Фосфодиэстераза
|
1. Фосфодиэстераза
|
1. ЛП-липаза
|
|
2. Фосфофруктокиназа
|
2. Фосфофруктокиназа
|
2. Фосфофруктокиназа
|
|
3. Пируваткиназа
|
3. Пируваткиназа
|
3. Пируваткиназа
|
|
4. Пируватдегидрогеназный комплекс
|
4. Пируватдегидрогеназный комплекс
|
4. Ацетил-КоА-карбоксилаза
|
|
5. Фосфатаза гликогенсинтазы и гликогенфосфорилазы
|
5. Фосфатаза гликогенсинтазы
|
|
|
б.Ацетил-КоА-карбоксилаза
|
|
|
|
|
Индукция
|
|
|
1. Глюкокиназа
|
|
1. Глицеральдегидфосфат- дегидрогеназа
|
|
2. Цитратлиаза
|
|
2. Пальмитатсинтаза
|
|
3. Пальмитатсинтаза
|
|
|
|
4. Пируваткиназа
|
|
|
|
5. Ацетил-КоА-карбоксилаза
|
|
|
6. Глюкозо-6-фосфатдегидрогеназа
|
|
|
|
|
Репрессия
|
|
|
Фосфоенолпируваткарбоксикиназа
|
|
|
Эффекты инсулина, обусловленные
фосфорилированием и дефосфорилированием ферментов, проявляются очень быстро, в
течение нескольких секунд и минут. Параллельно с активацией ферментов гликолиза
инсулин тормозит глюконеогенез, репрессируя синтез ключевого фермента
глюконеогенеза - фосфоенолпируваткарбок-сикиназы (ФЕП карбоксикиназы).
Влияние инсулина на метаболизм
жиров. Инсулин в жировой ткани тормозит мобилизацию жиров. Он активирует
фосфатазу, которая дефосфорилирует и тем самым инактивирует
гормончувствительную ТАГ-липазу. Таким образом, под влиянием инсулина снижается
концентрация жирных кислот, циркулирующих в крови. Инсулин стимулирует
потребление нейтральных аминокислот в мышцах и синтез белков в печени, мышцах и
сердце.
3. Механизм действия
инсулина
Действие инсулина начинается с его
связывания со специфическим гликопротеиновым рецептором на поверхности
клетки-мишени. Рецепторы инсулина обнаружены почти во всех типах клеток, но
больше всего их в гепатоцитах и клетках жировой ткани. Так как концентрация
инсулина в крови составляет ~10-10 М, количество рецепторов,
связанных с инсулином, зависит от их количества на мембране клетки. Клетки с
разным содержанием рецепторов реагируют по разному на одну и ту же концентрацию
гормона.
Снижение чувствительности клеток к
гормону (десенситизация) опосредуется 2 механизмами. Первый включает утрату
рецепторов путём их интернализации. Комплекс инсулин-рецептор захватывается
внутрь клетки эндоцитозом. В результате интернализации часть рецепторов
подвергается разрушению в лизосомах, а часть возвращается в плазматическую
мембрану. Второй механизм десенситизации - ковалентная модификация рецептора в
результате фосфорилирования. Рецептор инсулина относят к типу рецепторов, обладающих
тирозинкиназной активностью. Стимулированное инсулином аутофосфорилирование β-субъединицы IR по
остаткам тирозина приводит к фосфорилированию других внутриклеточных белков -
субстратов инсулинового рецептора (IRS). Известно несколько таких субстратов:
IRS-1, IRS-2, а также некоторые белки семейства STAT.
Главную роль в формировании ответной
реакции клетки на инсулиновый сигнал играет IRS-1. IRS-1 - фосфопротеин,
состоящий из более чем 1200 аминокислотных остатков. Часть остатков серина,
тирозина и треонина фосфорилирована. При стимуляции инсулином степень
фосфорилирования IRS-1 увеличивается и придаёт ему способность соединяться с
другими цитозольными белками. Это приводит к активации нескольких сигнальных
путей, представляющих каскад реакций активации специфических протеинкиназ. В
результате активации протеинкиназ происходит фосфорилирование ферментов и
факторов транскрипции, что составляет основу многочисленных эффектов инсулина.
Эффекты инсулина могут проявляться в
течение секунд и минут (транспорт веществ, фосфорилирование и
дефосфорилирование белков, активация и ингибирование ферментов, синтез РНК) или
через несколько часов (синтез ДНК, белков, рост клеток).
4. Глюкагон
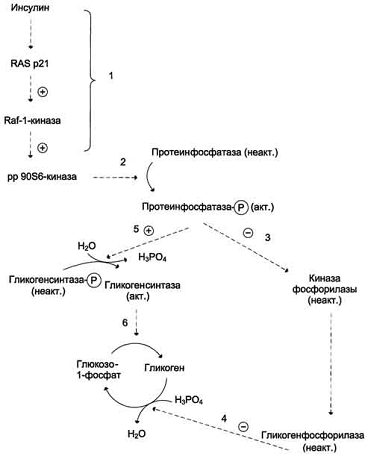
Рис. Активация гликогенсинтазы инсулином.
1 - активация пути RAS; 2 - протеинкиназа ррЭОЗб, активируемая инсулином через
путь RAS, фосфорилирует протеинфосфатазу гранул гликогена, которая включает
каскад реакций дефосфорилирования; 3 - инактивация киназыфосфорилазы и
гликогенфосфорилазы; 4 - торможение мобилизации гликогена; 5 - активация
гликогенсинтазы; 6 - стимуляция синтеза гликогена
Глюкагон - одноцепочечный
полипептид, состоящий из 29 аминокислотных остатков. Биосинтез глюкагона
происходит в α-клетках
островков Лангерханса, в нейроэндокринных клетках кишечника и в некоторых
отделах ЦНС. Неактивный предшественник проглюкагон в результате частичного
протеолиза превращается в несколько пептидов. В клетках поджелудочной железы
главный пептид - глюкагон; в клетках кишечника образуются глюкагоноподобные
пептиды: GLP-1, GLP-2, глицентин и другие. GLP-1 ингибирует секрецию глюкагона
и стимулирует синтез и секрецию инсулина. Стимулятором секреции GLP-1 служит
другой гормон - желудочный ингибирующий полипептид, который синтезируется в
клетках слизистой оболочки верхних отделов тонкого кишечника. Секреция GIP
стимулируется при приёме пищи; наиболее сильным стимулятором служит глюкоза. На
секрецию глюкагона влияют и многие другие соединения, включая аминокислоты,
жирные кислоты, кетоновые тела и нейромедиаторы. При приёме пищи, богатой
углеводами, секреция глюкагона снижается. Белковая пища стимулирует секрецию
инсулина и глюкагона; однако некоторые аминокислоты в большей степени влияют на
секрецию одного из них. Например, аланин стимулирует секрецию глюкагона, но не
инсулина.
В плазме крови глюкагон не связан с
каким-либо транспортным белком. Т1/2 гормона составляет ~5 мин. В
печени глюкагон быстро разрушается под действием специфических протеаз.
Эффекты глюкагона в основном
противоположны эффектам инсулина. Основные клетки-мишени глюкагона - печень и
жировая ткань.
. Прогоркание жиров катализируется
ферментом липоксигеназой. Дать характеристику этого фермента
При хранении растительные масла,
животные жиры, а также жиросодержащие продукты (мука, крупа, кондитерские
изделия, мясные продукты) под влиянием кислорода воздуха, света, ферментов,
влаги приобретают неприятный вкус и запах. Иными словами, жир прогоркает.
Прогоркание жиров и жиросодержащих
продуктов - результат сложных химических и биохимических процессов, протекающих
в липидном комплексе.
В зависимости от характера основного
процесса, протекающего при этом, различают гидролитическое и окислительное
прогоркание. Каждый из них может быть разделен на автокаталитическое
(неферментативное) и ферментативное (биохимическое) прогоркание.
При гидролитическом прогоркании
происходит гидролиз жира с образованием глицерина и свободных жирных кислот.
Неферментативный гидролиз протекает
с участием растворенной в жире воды, и скорость гидролиза жира при обычных
температурах невелика. Ферментативный гидролиз происходит при участии фермента
липазы на поверхности соприкосновения жира и воды и возрастает при
эмульгировании.
Липаза, действует активнее на жиры,
находятся в эмульгированном состоянии. Фермент триацилглицероллипаза широко
распространен в природе и играет важную роль в пищеварении, а также процессах,
протекающих при хранении, переработке растительного сырья и пищевых продуктов.
Наиболее распространенным видом
порчи жиров в процессе хранения является окислительное прогоркание. В первую
очередь окислению подвергаются свободные, а не связанные в триацилглицеролах
ненасыщенные жирные кислоты. Процесс окисления может происходить
неферментативным и ферментативным путями.
В результате неферментативного
окисления кислород присоединяется к ненасыщенным жирным кислотам по месту
двойной связи с образованием циклической перекиси, которая распадается с
образованием альдегидов, придающих жиру неприятный запах и вкус.
Прогоркание жиров сопровождается
окислением сопутствующих веществ: каротиноидов, витамина Е, в результате
снижается пищевая ценность жира и ухудшаются его органолептические свойства.
При ферментативном окислении
этот процесс катализируется ферментом липоксигеназой (класс оксидоредуктаз) с
образованием гидроперекисей.
Специфичность
липоксигеназы состоит в том, что действию фермента подвергаются лишь те
полиненасыщенные жирные кислоты, которые содержат цис-цис-1,4-пентадиеновую
группировку (линолевая, линоленовая, арахидоновая). Липоксигеназа активнее
действует на свободные жирные кислоты, которые образуются в результате
гидролитической порчи, после действия фермента липаза. Характеристика
фермента. Липоксигеназа ферменты
<#"587041.files/image004.gif">
С меньшей скоростью
окисляют сложные эфиры <#"587041.files/image005.gif"> -оксазолинов и продуктов их дальнейшего превращения. Они
встречается в природе как в свободном состоянии в печени, селезенке,
эритроцитах, так и в составе сфинголипидов и имеют D- эритроконфигурацию. При
биосинтезе церамиды образуются из сфингозинов RCH(OH)CH(NH2)CH2OH и ацил-КоА в
присутствии N-ацилтрансферазы и являются предшественниками сфингомиелинов,
цереброзидов, ганглиозидов и т. п. Они выделяют при кислотном гидролизе сложных
сфинголипидов или синтезируют селективным N-ацилированием сфингозинов
ацилхлоридами в ацетатном буфере при рН 7,3. Церамиды служат удобными исходными
соединениями при синтезе сфинголипидов через бензоилцерамиды
RCH(OCOC6H5)CH(NHCOR')CH2OH, которые получают с выходом более 70% путем
последовательного тритилирования, бензоилирования и детритилирования церамид
без выделения промежуточных соединений.
Все биомембраны построены одинаково;
они состоят издвух слоев липидных молекул толщиной около 6 нм, в которые
встроены белки. Некоторые мембраны содержат, кроме того, углеводы, связанные с
липидами и белками. Соотношение липиды: белки: углеводы является характерным
для клетки или мембраны и существенно варьирует в зависимости от типа клеток
или мембран.
Липидный двойной слой. Характерной особенностью молекул фосфолипидов и гликолипидов
является их амфифильность: один конец молекулы гидрофобный, другой -
гидрофильный. Гидрофобный конец составляют углеводородные радикалы жирных
кислот и сфингозина; он занимает большую часть длины молекулы, до 3/4- В
гликолипидах гидрофильный конец образован углеводной частью, в фосфолипидах -
фосфатным остатком с присоединенным к нему холином, этаноламином или сери-ном.
Вследствие амфифильности эти липиды в водной среде образуют многомолекулярные
структуры с упорядоченным расположением молекул: гидрофобные части вытесняются
из водной среды и взаимодействуют друг с другом (как бы растворяются друг в
друге), а гидрофильные части контактируют с водой и гидратируются (как бы
растворяются в воде). Именно эта особенность строения и физико-химических
свойств определяет роль фосфолипидов и гликолипидов в построении биологических
мембран: основу мембран составляет бимолекулярный липидный слой, белки и липиды
наружной поверхности содержат углеводные компоненты, обычно разветвленные
олигосахариды. С внутренней поверхностью мембраны контактируют белки,
соединенные со скелетными и сократительными структурами клетки -
микрофибриллами и микротрубочками.
При электронной микроскопии мембрана
выглядит как совокупность трех полос: промежуточной светлой (гидрофобная часть
липидного бислоя) и двух периферических темных (гидрофильные части мембраны).
Компоненты мембран удерживаются
нековалентными связями вследствие чего они обладают лишь относительной
подвижностью, т. е. могут диффундировать в пределах липидного бислоя. Текучесть
мембран зависит от липидного состава и температуры окружающей среды. С
увеличением содержания ненасыщенных жирных кислот текучесть возрастает, так как
наличие двойных связей способствует нарушению полукристаллической мембранной
структуры. Подвижными являются и мембранные белки. Если белки не закреплены в
мембране, они «плавают» в липидном бислое как в жидкости. Поэтому говорят, что биомембраны
имеют жидкостно-мозаичную структуру. В то время как «дрейф» в
плоскости мембраны происходит достаточно легко, переход белков с внешней
стороны мембраны на внутреннюю («флип-флоп») невозможен, а переход липидов
происходит крайне редко. Для «перескока» липидов необходимы специальные белки
транслокаторы. Исключение составляет холестерин, который может легко переходить
с одной стороны мембраны на другую. Мембранные липиды. В мембранах
содержатся липиды трех классов: фосфолипиды, холестерин и гликолипиды. Наиболее
важная группа, фосфолипиды, включает фосфатидилхолин (лецитин),
фосфатидилэтаноламин, фосфатидилсерин, фосфатидилинозит и фингомиелин. Холестерин
рисутствует во внутриклеточных мембранах животных клеток (за исключением
внутренней мембраны митохондрий). Гликолипиды входят в состав многих
мембран (например, во внешний слой плазматических мембран). В состав
гликолипидов входят углеводные функциональные группы, которые ориентируются в
водную фазу.
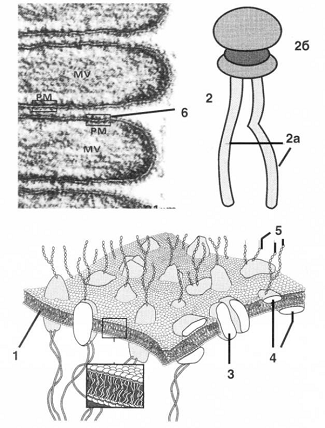
- двойной слой амфифильных липидов;
2 - молекула липида и в ней: 2а -гидрофобная часть (углеводородные
"хвосты"),26 - гидрофильная часть; 3 - интегральные белки:
пронизывают мембрану насквозь; 4 - периферические белки: связаны лишь с одной
стороны мембраны; 5 - углеводные компоненты: связаны с белками на внешней
стороне мембраны;6 - срединная (гидрофобная) часть липидного бислоя.
гормон поджелудочный глюкоза этанол
Липиды мембран представляют собой амфифильные
молекулы с полярной гидрофильной головкой (голубого цвета) и неполярным
липофильным хвостом (желтого цвета). В водной среде они агрегируют за счет
гидрофобных взаимодействий и вандерваальсовых сил.
Протеины могут связываться с
мембраной различным путем.
Интегральные мембранные
белки имеют трансмембранные
спирализованные участки (домены), которые однократно или многократно пересекают
липидный бислой. Такие белки прочно связаны с липидным окружением.
Периферические
мембранные белки удерживаются на мембране
с помощью липидного «якоря» и связаны с другими компонентами мембраны;
например, они часто бывают ассоциированы с интегральными мембранными белками.
У интегральных мембранных белков
фрагмент пептидной цепи, пересекающий липидный бислой, обычно состоит из 21-25
преимущественно гидрофобных аминокислот, которые образуют правую α-спираль с 6 или 7
витками (трансмембранная спираль).
Белки клеточной поверхности и
некоторые липидные молекулы несут ковалентно связанные углеводные компоненты,
экспонированные на наружной стороне мембраны. Эти гликопротеины и гликолипиды
вместе с дополнительными несвязанными гликопротеинами и полисахаридами
образуют клеточную оболочку (гликокаликс).
. Сколько оксидоредуктоз,
трансфеноз, гидролаз, меаз, изомераз учавствует в превращении глюкозы в этанол.
Написать уравнение реакции
Сбраживаться могут лишь углеводы, и
притом весьма избирательно. Дрожжи сбраживают только некоторые 6-углеродные
сахара (глюкозу, фруктозу, маннозу). Схематично спиртовое брожение может быть
изображено уравнением
С6Н12О6 -> 2С2Н5ОН +
2С02 + 23,5 • 104 Дж
глюкоза этиловый спирт
углекислота энергия
Процесс спиртового брожения -
многоступенчатый, состоящий из цепи химических реакций. Превращения глюкозы до
образования пировиноградной кислоты происходят так же, как и при дыхании. Эти
реакции происходят без участия кислорода (анаэробно). Фруктозодифосфатный
(гликолиз) или путь Эмбдена-Мейергофа-Парнаса - универсальный путь.
Процесс начинается с
фосфорилирования (рис. 1). При участии фермента гексокиназы и АТФ глюкоза
фосфорилируется по шестому углеродному атому с образованием глюкозо-6-фосфата.
Это активная форма глюкозы. Она служит исходным продуктом при расщеплении
углеводов любым из трех путей.
При гликолизе глюкозо-6-фосфат
изомеризуется во фруктозо-6-фосфат, а затем под действием 6-фосфофруктокиназы
фосфорилируется по первому углеродному атому. Образовавшийся
фруктозо-1,6-дифосфат под действием фермента альдолазы легко распадается на две
триозы: фосфоглицериновый альдегид и дигидроксиацетонфосфат. Дальнейшее
превращение С3-углеводов осуществляется за счет переноса водорода и
фосфорных остатков через ряд органических кислот с участием специфических
дегидрогеназ. Все реакции этого пути, за исключением трех, протекающих с
участием гексокиназы, 6-фосфофруктокиназы и пируваткиназы, полностью обратимы.
На стадии образования пировиноградной кислоты заканчивается анаэробная фаза
превращения углеводов.
Баланс:
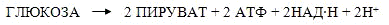
Максимальное количество энергии,
получаемое клеткой при окислении одной молекулы углеводов гликолитическим
путем, равно 2·105Дж.
При спиртовом брожении
пировиноградная кислота превращается в конечном итоге в спирт и углекислоту.
Эти реакции протекают в две стадии. Сначала от пирувата отщепляется С02 и
образуется уксусный альдегид; затем уксусный альдегид присоединяет водород,
восстанавливаясь в этиловый спирт. Все реакции катализируются ферментами. В
восстановлении альдегида участвует НАД-H2.
Обычно при спиртовом брожении, кроме
главных продуктов, образуются побочные. Они довольно разнообразны, но
присутствуют в небольшом количестве: амиловый, бутиловый и другие спирты, смесь
которых называется сивушным маслом - соединение, от которого зависит
специфический аромат вина. Образование побочных веществ связано с тем, что
превращение глюкозы частично идет другими путями.
Биологический смысл спиртового
брожения заключается в том, что образуется определенное количество энергии,
которая запасается в форме АТФ, а затем расходуется на все жизненно необходимые
процессы клетки.
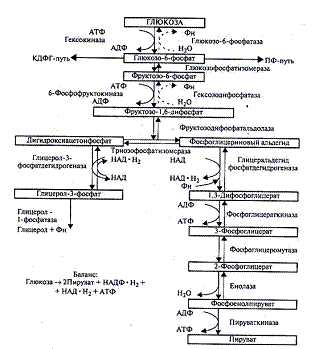
Рис. Фруктозодифосфатный путь
расщепления глюкозы
Список использованных источников
1. Биохимия: Учеб. для вузов, Под ред. Е.С. Северина., 2003.
779 с.
. Филлипович Ю.Б. Основы биохимии / - М.: Издательство
«Агар»,1999.- 512 с.