Оценка некоторых агрохимических средств и токсикантов методами биотеса
Введение
Объективная и интегральная информация о качестве окружающей среды с
каждым днем становится все более востребованной. В настоящее время оценка
загрязнения объектов окружающей среды производится главным образом на основе
результатов физико-химического анализа. Однако, из-за огромного числа
загрязняющих веществ, а также сложности и высокой стоимости химических анализов
организовать эффективный экологический мониторинг средствами аналитической
химии не всегда возможно. Наиболее востребованные методы оказались методы
интегральной оценки качества экосистемы и отдельных ее компонентов, в том числе
и биотестирование.
Экологические объекты, изучаемые нами сложны, и поэтому даже тут
требуется комплексная оценка. В нашем случае мы исследуем аграценоз, который
включается в себя систему почва-растение. В данной работе впервые был применен
комплексный метод биотестирования, который включает в себя биотесты на
проростках растений и биотесты на инфузориях. Автоматизация которых
унифицируется с помощью приборной техники и программного обеспечения.
Исследования с помощью двух методов биотестирования позволит нам сопоставить
результаты. Использование биотеста с растениями условно имитирует ответ целого
организма, а использование теста с инфузориями позволяет получить ответную
реакцию на клеточном уровне. Но также остается актуальными методические
наработки по стандартизации методов, которые позволят повысить
воспроизводимость и точность результатов биотестирования.
Для экологической оценки в настоящее время широко обращаются к
биологическим методам. К сожалению, для оценки состояния аграценоза внедрение
этих методов недостаточно. Оценка состояния объекта с помощью живых,
биологических систем позволяет представить суммарную нагрузку или воздействие с
учётом условий внешней среды. В агрохимической практике, биотестирование может
быть использовано для оценки динамики по оценке экологического состояния
агроценоза, для паспортизации пахотных земель по их экологической
характеристике, для определения общей или суммарной токсичности новых
агрохимических препаратов и т.д. Выполнение такого рода исследований нуждается
в развитии высоко - чувствительных методов, автоматизации и экспресности их
исполнения.
Цель
Изучение влияния токсичности и биологической активности агрохимических средств
с привлечением двух биотест систем: растительный биотест и биотест на
инфузориях.
Задачи исследований
· Оценить действие разных концентраций аммиачной селитры на биологические
системы
· Рассмотрение широкого диапазона концентраций Zn. Получения регрессионных уравнений
по возрастающим дозам цинка
· Биотестирование разных концентрации ТМ (Cd)
· Изучить отзыв биологически активных веществ (БАВ) в биотестах
I. 1.
Литературный обзор
. Понятие о биотестировании
Биотестирование и биоиндикация - это два важных исследовательских приема,
в которых о качестве среды, о факторах, воздействующих на эту среду, судят по
выживаемости, продуктивности, поведению, а также по различным физиологическим
параметрам живых организмов. Биотестирование подразумевает использование живых
организмов, специально помещаемых в данную среду, а биоиндикация - живых
организмов, естественным образом обитающих в данной среде.
В последние 5-10 лет особое внимание уделяется методам биологического
мониторинга, которые основаны на использовании живых организмов, особенно
чувствительных к конкретным химическим веществам. Использование этих методов не
требует больших экономических затрат, а так же позволяет оценить качество среды
в случаях , когда количественное содержание загрязнителя может быть определено
каким-либо методом, но отсутствуют сведений о биологической активности
загрязнителя.
Процесс биотестирования начинается с перевода исследуемого образца в
состояние, удобное для проведения эксперимента, то есть получения действующей
формы, после чего осуществляют ее контакт с тест-системой. Таким образом
биотесты - это выполняемые по определенной схеме и в определенных условиях
испытания действия того или иного вещества (или смеси веществ) на организмы,
путем регистрации одного или нескольких биологических или
физиолого-биологических показателей состояния тест-объекта. К биотестированию
предъявляют определенные требования, например дифференциальное применение (в
зависимости от характера и концентрации загрязняющих веществ), использование
простых биотестов, сочетание их с химико-аналитическими методами и применение
аппаратурного контроля за процессом биотестирования.
В некоторых государствах существуют определенный набор тест-объектов для
биотестирования (например во Франции - это дафнии).
Интергальную оценку качества почв возможно осуществлять при помощи
методов биотестирования, которые в основном разработаны для природных, питьевых
и сточных вод. В качестве наиболее распространенных тест-объектов используют
пресноводных рачков Daphnia
magna, инфузорий, микробные биосенсоры,
гранулированную сперму быков, пыльцевые трубки и др. Однако в силу специфики
содержания тест-культур, не все методы биотестирования можно использовать в
качестве оперативных.
В нашей стране активно проводятся научные разработки методов
биологической диагностики почвенного раствора. В качестве количественного
критерия степени загрязненности почвенного раствора предлагается использовать
показатель интенсивности размножения “почвенных гидробионтов ” - инфузорий и
водорослей (Яковлев, 1997).
Аппаратурное окончание в биотестировании в определенной степени снижает
субъективный оценочный фактор.
В качестве тест-объектов используются различные животные, при этом норма
реакции у разных групп животных на внешние воздействия зависит от уровня
организации организма. У парамеций реакция организма на внешние воздействия
осуществляется на клеточном уровне. Поскольку парамеции, например, Paramecium caudatum, не имеют хитиновой оболочки, норма
их реакции на внешние воздействия довольно высока. Кроме того культура
парамеций культивируется и стандартизируется.
Приведем пример некоторых методов биотестирования:
Светящиеся бактерии. Тест-система люминесцентных бактерий реагирует на
токсичные соединения разнообразной химической природы - металлы, фенолы,
углеводороды, пестициды, микотоксины и др. - с порогом определения порядка 0,01
мг/л и предназначается для контроля токсичности воды и водных вытяжек различных
объектов окружающей среды.
Культура инфузорий тетрахимена. Авторами метода была выявлена высокая
чувствительность инфузорий к неблагоприятным факторам внешней среды и
химическим веществам - тяжелым металлам, канцерогенам, гербицидам и др.
Сперма крупного рогатого скота. Биотестирование на сперматозоидах быка
рекомендуется как самостоятельный экспресс метод для оценки вновь
разрабатываемых изделий и продуктов и указывается, что при отсутствии
токсичности водной вытяжки в тесте со спермой быка исследуемая продукция
является безопасной для использования населением.
Также используются многоклеточные представители водной фауны - дафнии и
рыбы, что нашло отражение в Методических рекомендациях по применению методов
биотестирования для оценки качества воды в системах хозяйственно-питьевого
водоснабжения. [6]
При использовании для биотестирования различных тест-обьектов возникают
проблемы:
нечувствительность тест-объектов к токсичным для человека концентрациям
многих химических соединений;
проблема гипердиагностики опасности загрязнения веществами,
малотоксичными для человека, но высокотоксичными для тест-объекта.
Поэтому любые рекомендации в методических документах или научных
публикациях по практическому использованию того или иного тест-объекта в целях
обеспечения безопасности населения должны обязательно сопровождаться
информацией о том, какие именно химические соединения и в каких концентрациях
реально могут быть обнаружены по реакции биотеста.
2.
Физиолого-биохимическое действие брассиностероидов
Растяжение клетки и ее деление, приводящее к росту
ткани, требует синтеза нуклеиновых кислот (НК) и белков. Гормоны роста, такие
как ауксины, гиббереллины и цитокинины регулируют метаболизм НК в растении. Mandava с сотр. пытались определить, влияют
ли брассиностероиды на НК и синтез белков. Действительно, ингибиторы синтеза
РНК и белка снимают стимуляцию индуцированного БС роста отрезков эпикотилей
маша [7]. Известны данные об активации ДНК - и РНК- полимераз, а также синтеза
ДНК и РНК в растениях фасоли под влиянием обработки БС, причем возрастание
активности РНК- полимеразы I
способствует увеличению объема белоксинтезирующего аппарата и усилению синтеза
белка. Обработка брассинолидом гипокотилей и эпикотилей сои (Glycine max), а также проростков арабидопсиса (Arabidopsis thaliana) вызывает активацию транскрипции
более 50 генов и усиление синтеза полипептидов. Инкубирование отрезков листьев
пшеницы на гомобрассинолиде (10-6 М, 10-8 М) приводит не только к активации
тотального синтеза белка, но и увеличению спектра синтезируемых белков.
Обнаружено существенное влияние БС на аминокислотный состав и биологическую ценность
белка семян люпина. Показано увеличение общего содержания белка, а также
содержания незаменимых аминокислот (до 5%), в том числе за счет треонина,
лейцина, изолейцина и фенилаланина. Очевидно, что при этом улучшается
питательная ценность белка. Весьма важным является также увеличение содержания
глютаминовой кислоты и пролина, играющих важную роль в реакции растений на
стрессовые факторы [8].
К числу вызываемых БС физиологических ответов растений
относятся стимуляция фотосинтетической активности клеток, повышение уровня
растворимых белков и углеводов, модуляция активности ферментативной системы
растений. Так, показано возрастание активности растворимой инвертазы в
изолированных семядолях риса (Oryza Sativa)и
клеточно-стеночной инвертазы в суспензионной культуре клеток томата(Licopersicum esculentum), карбоксилазы в листьях пшеницы и
семядолях растущих в темноте проростков арабидопсиса, нитратредуктазы и
глютаминсинтетазы, АТФ-азы и других ферментов при воздействии БС на
разнообразные растительные объекты.
Имеются убедительные доводы в пользу участия БС в
дифференциации сосудов ксилемы: в наномолярных концентрациях БС увеличивают
формирование элементов трахеид обработанных ауксином и цитокинином отрезков
топинамбура до десяти раз, причем экстрагирование БС из камбиальной части сосны
подтверждает роль эндогенных БС в ксилемной дифференцировке.
Интересным подходом в выяснении роли эндогенных БС в
развитии и дифференцировке растений является использование в опытах ингибитора
синтеза БС, брассиназола. Растущие в темноте проростки арабидопсиса после
обработки брассиназолом приобретали морфологические особенности растений,
растущих на свету, а именно: короткий гипокотиль, широкие семядоли и истинные
листья. Необработанные растения не развивали листовых примордий, более того, в
семядолях опытных растений наблюдалось формирование мембран тилакоидов -
первого этапа дифференцировки пластид, а также повышение уровня
рибулозо-1,5-бисфосфат карбоксилазы. Эти результаты указывают на новую
предполагаемую функцию эндогенных БС в регуляции роста, развития и
дифференцировки растений[9].
Стимулирующее действие БР на рост в длину зависит от спектрального
состава света [11]. Рост в длину второго междоузлия фасоли резко (в 6 раз)
подавлялся, если растения выращивали при освещении люминесцентными лампами
(контроль - выращивание на свету ламп накаливания). Стимулирующее действие БР
на рост этого междоузлия обнаруживалось только при использовании люминесцентных
ламп, а в остальных случаях БР даже тормозил рост. Другие реакции на БР (утолщение,
искривление и расщепление обработанного междоузлия) осуществлялись при любом
освещении.
3.
Биологическая активность БС
Биологическое действие брассинового комплекса, выделенного из пыльцы, БР
и брассиностероидов изучалось на разных растениях. Было показано, что обработка
брассиностероидами оказывает резкое стимулирующее влияние на увеличение длины,
утолщение и расщепление второго междоузлия проростков фасоли, усиливая как
деление, так и растяжение клеток. Опыты с мутантами подтверждают преимущественное
влияние брассиностероидов на рост растяжением. При этом обработка молодых
проростков фасоли продолжает сказываться на протяжении всей жизни растения,
приводит к увеличению размеров всех органов и урожая семян на 30-40%. Сходный
эффект наблюдался при обработке БР семян ячменя перед посевом: увеличение
размеров листьев и стебля, усиление кущения и возрастание скорости достижения
конечного размера органов. Интересно отметить, что БР на медленно растущие
особи популяции действовал сильнее, чем на быстро растущие, благодаря чему
варьирование размеров растении в популяции уменьшалось. Нанесение брассиновой
фракции из пыльцы рапса на самое молодое междоузлие сеянцев древесных пород Betula papirifera, Ulmus pumila, Malus hupehensis
стимулировало рост обработанного и ближайших к нему междоузлий. Через 4-7 дней
длина междоузлий становилась в 2 раза большей, чем в контроле. Эти и ряд других
данных послужили основанием для возможного использования брассиностероидов в
сельском хозяйстве.
Большое внимание в ряде работ уделено сопоставлению действия
брассиностероидов и известных фитогормонов - ауксина, гиббереллина и цитокинина
(приложение, табл. 1). В одной из таких работ в качестве объекта были
использованы отрезки этиолированных проростков фасоли с неразогнутой верхушкой.
Разгибание верхушки происходит при последующем росте в темноте и еще быстрее на
свету. Ауксин индолилуксусная кислота (ИУК) характерным образом тормозит это
распрямление, что авторы рассматривают как биотест на ауксиновую активность. БР
оказывал подобное же действие, между ним и ИУК обнаруживался отчетливо
выраженный синергизм. Эффективность действия БР уменьшалась в присутствии
антиауксина (n-хлорфеноксиизомасляная кислота) и
усиливалась под влиянием 2,3,5-трийодбензойной кислоты, уменьшающей отток эндогенного
ауксина из верхушки. Все это позволило предположить, что действие БР каким-то
образом связано с ауксином.
БР проявлял активность и в других биотестах на ауксины, связанных со
стимуляцией удлинения отрезков мезокотилей кукурузы Zea Mais, эпикотилей азуки (Phaseolus aureux Roxb) и гороха (Pisum sativum L.), набухания эксплантантов из клубней топинамбура. Изгибание
первого междоузлия фасоли при одностороннем нанесении ауксина резко усиливалось
при обработке БР, без ауксина БР не действовал. Синергизм в действии БР и
ауксина обнаружен также в биотесте на изгибание листовой пластинки риса, причем
действие БР угнеталось антиауксином.
В то же время в ряде других реакций на ауксины БР либо не проявлял
активности, либо действовал противоположно ауксину. Так, БР в отличие от
ауксинов не подавлял пробуждения пазушных почек у декапитированных проростков
гороха, не вызывал торможения роста корней кресс-салата и подавлял образование
корней на черенках маша. Следует отметить, что другие стероиды, в частности кортизол,
напротив, резко увеличивали закладку придаточных корней на гипокотилях маша. В
отличие от ауксинов БР стимулировал удлинение отрезков корней кукурузы, причем
эта стимуляция сопровождалась усилением выделения протонов, а взаимодействие с
ИУК на этом объекте было антагонистическим.
Ряд симптомов действия БР на растения сходно с реакциями на этилен. К ним
относится набухание и искривление междоузлий фасоли, эпинастия листьев у
побегов маша и др. Было обнаружено, что при обработке растений БР продукция этилена
в них резко усиливается, причем в этой реакции обнаруживается сильный синергизм
с ИУК . Так, если в контроле продукция этилена составляла 0,41 нл/ч, а в
присутствии 3 мкМ БР и 10 мкМ ИУК соответственно 10,5 и 17 нл/ч, то при
воздействии смеси БР и ИУК - 43,6 нл/ч . При этом для проявления синергизма
необходимо было присутствие кальция в среде инкубации. Установлено, что
действие БР на синтез этилена, так же как и действие ИУК, локализовано на этапе
превращения 5-аденозилметионина в 1-ами-но-циклопропан-1-карбоновую кислоту .
Таким образом, влияние БР на синтез этилена также можно рассматривать как
свидетельство существования тесной взаимосвязи БР и ауксина в действии на
растения. Природа этой взаимосвязи остается пока неясной. В одной из работ
оценивалось влияние БР на метаболизм, поглощение и транспорт экзогенной ИУК в
междоузлиях фасоли . Статистически значимых изменений не было обнаружено, и
поэтому авторы предположили, что БР каким-то образом увеличивает активность
действия ауксина, но не его содержание. Однако было установлено, что синергизм
проявляется только в случае предобработки растений БР (а затем ИУК). По мнению Mandava, эти наблюдения подтверждают, что БР
увеличивает чувствительность тканей к ауксину, приводя к синергестическому
взаимодействию с эндогенными ауксинами, но сами не имеют ауксиноподобных
функций. Хотя имеются противоречащие наблюдения, подобные вышеупомянутому
антагонистическому действию БР и ИУК, Mandava заключает, что в большинстве тестов действие БР служит
посредником эндогенному ауксину .
Способность БР резко стимулировать рост в длину не только отрезков, но и
интактных растений наводит на мысль о сходстве в действии между БР и
гиббереллинами. Можно даже предположить, что ряд случаев обнаружения
гиббереллиноподобной активности (особенно в нейтральной фракции экстрактов)
обусловлены брассиностероидами. БР стимулировал рост в длину проростков фасоли
и маша , причем в последнем случае рост под влиянием 10-7 М БР происходил в 10
раз быстрее, чем в контроле, а под влиянием 10-4 М ГК лишь в 3,7 раза быстрее.
Действие БР в отличие от ГК сопровождалось эпинастией листьев. При совместном
применении взаимодействие БР и ГК было аддитивным. Причем ингибитор роста
антигиббереллинового типа действия (анцимидол) не влиял на рост проростков маша
в присутствии БР. БР, так же как и ГК, полностью снимал угнетение роста
этиолированных гипокотилей фасоли, вызванное светом. При этом рост,
индуцированный БР, был нечувствителен к анцимидолу, но несколько уменьшался под
влиянием 2,3,5-трийодбензойной и n-хлорфеноксиизомасляной
кислоты. Активность БР проявлялась и в других ростовых биотестах на
гиббереллины - таких, как стимуляция роста карликового гороха и гипокотилей
огурца . Как и ГК, БР подавлял образование бетацианина в семядолях амарантуса и
образование придаточных корней на гипокотилях маша, огурца и эпикотилях гороха.
В то же время БР не задерживал старение листьев щавеля (характерная реакция на
гиббереллины), а даже ускорял его.
Некоторые элементы сходства имеются в действии БР и цитокининов. Так, БР,
подобно кинетину, стимулировал рост изолированных семядолей огурца (хотя и
значительно слабее), но в других биотестах на цитокинины (амарантусный тест,
задержка старения листьев дурнишника) БР не обладал активностью .
В процессе онтогенеза проростков пшеницы, а также при увеличении возраста
листа пшеницы у них последовательно возникали периоды повышенной отзывчивости
на цитокинины, гиббереллины и ауксины. Было установлено, что место БР в этой
последовательности находится между гиббереллинами и ауксинами .
В заключение отметим, что БР и другие брассиностероиды оказались
уникальными регуляторами роста, активными в ряде биотестов, характерных для
ауксинов, гиббереллинов и цитокининов. В других же биотестах, характерных для
того или иного фитогормона, брассиностероиды были неактивными или даже
действовали противоположным образом.
. Гормоны и
минеральное питание
Гомеостаз растительного организма поддерживается различными системами
регуляции, в том числе гормональной и трофической. Показано, что гормональный
баланс зависит от уровня и формы минерального питания. В свою очередь, есть
сведения о действии экзогенных гормонов на поглощение ионов. Потому особенный
интерес представляет изучение взаимодействия фитогормонов с элементами
минерального питания.
Брассиностероиды и в этой области являются наименее изученной группой,
поэтому рассмотрение этой темы возможно провести по общим аспектам и
исследованиям с другими фитогормонами с дальнейшим осмыслением материала.
Среди суждений о взаимодействии минерального питания и гормональной
системы существует несколько противоположных точек зрения, которые, однако же,
находят подтверждение в экспериментах.
Так, в работах Треваса утверждается, что скорость роста и развития
растений непосредственно определяется концентрацией поглощенных минеральных
веществ. Особое внимание уделяется азоту, который, по мнению автора, выступает
в качестве регулятора активности ряда ферментов, а также в целом синтеза белка
и нуклеиновых кислот. Гормонам же отводится функция маховика, сглаживающего
пространственные и временные флуктуации в поступлении элементов минерального
питания.
Однако представлению об определяющей роли концентрации азота в регуляции
ростовых процессов противоречат данные о том, что у подорожника активация роста
предшествовала изменению концентрации элементов питания в ткани растений. Кроме
того, давно и неоднократно показано влияние минерального питания на содержание
эндогенных гормонов, причем наибольшее внимание уделялось именно азоту.
Установлено, что не только макро -, но и микроэлементы способны влиять на
уровень гормонов в растении.
брассиностероид
инфузория аммиачный селитра
II 1. Объекты и методы
Наиболее часто в качестве биотестов используются инфузории (Paramecium
caudatum, Tetrahymena pyriformis). (Рис.1,2)Чувствительность этих
организмов и достоверность результатов биотестирования во многом зависят от
условий их культивирования и подготовки к исследованию.
Использование инфузорий для тестирования имеет свои преимущества: они
имеют короткий цикл размножения, поэтому быстро достигается высокая численность
популяции, они просты в содержании и достаточно чувствительны. В аналитическом
аспекте инфузории интересны тем, что могут рассматриваться как простые
рецепторно-эффекторные системы, обладающие способностью реагировать на
химическое воздействие целым комплексом биологических, физиологических и
биохимических изменений.
Для оценки качества почв представляется целесообразным использование в
качестве тест-организмов проростки семян растений. Биотест на проростках семян
редиса широко применяется для оценки суммарной фитотоксичности почв [1]. Метод
основан на высокой отзывчивости семян редиса на токсические вещества путем
учета снижения длины корней проростков в растворах препаратов вытяжек из
анализируемых образцов почвы, сока корневой системы и конечной продукции по
сравнению с контролем, выраженное в процентах. В полевых условиях при
определении суммарной токсичности контролем служит образец, отобранный с
варианта опыта без нагрузки поллютантов.[5]
Оценка длины корня и других характеристик проростков производится в
ручную. Для проведения полноценного эксперимента необходимо измерить и оценить
до 300 проростков в одной пробе. И, хотя этот биотест объективный и наиболее
пригодный для оценки суммарной токсичности (почв с точки зрения продуктивности
растений), широкого применения он не имеет. Поэтому, сочетая методически
отработанный биологический тест и возможности современной техники, на кафедре
агрохимия факультета почвоведения начаты работы по созданию автоматизированного
варианта биотеста.
Методика основана на определении смертности парамеции (Paramecium
caudatum) при воздействии токсических веществ, присутствующих в исследуемой
водной среде, по сравнению с контролем.
Острое токсическое действие исследуемой пробы на парамеции определяют по
их смертности (летальности) за определенный период экспозиции. Критерием острой
токсичности служит гибель 50 % и более парамеции за 24 часа в исследуемой
пробе, при условии, что в кон- троле гибель не превышает 10 %.
При определении острой токсичности устанавливают:
среднюю летальную концентрацию отдельных веществ (кратность разбавления
пробы), вызывающую гибель 50 % тест - объектов за 24 часовую экспозицию;
безвредную (не вызывающую эффекта острой токсичности) концентрацию
отдельных веществ (кратность разбавления пробы), вызывающую гибель не более 10
% за 24 часовую экспозицию.
1.2 Подготовка
культивационной воды
Культивационная вода должна удовлетворять следующим требованиям:
отсутствие органических загрязняющих веществ, хлора, токсических веществ
и антагонистических для парамеции организмов (простейших, многоклеточных);
рН - (7,0 - 8,0);
жесткость общая от 60 мг/дмз до 200 мг/дм (выраженная в СаСОз);
концентрация растворенного кислорода - не менее 6 мгО2/дмз.
температура - (+22+ 2)'С;
При исследовании вод с повышенным солесодержанием (содержание сухого
остатка выше 1 г/дм) проводят предварительную постепенную адаптацию культуры
тест - объектов, добавляя порциями хлористый натрий в культивационную воду
(содержание солей по сухому остатку не должно превышать 6 г/дм ).
Получение исходного материала, транспортировка, содержание и кормление
парамеции, выращивание культуры
Важное условие правильного проведения биотестирования - использование
генетически однородных лабораторных культур, т.к. они проходят поверки
чувствительности, содержатся в специальных, оговоренных стандартами
лабораторных условиях, обеспечивающих необходимую сходимость и
воспроизводимость результатов исследований, а также максимальную
чувствительность в токсическим веществам.
1.3 Подготовка
проб почвы
Пробы, поступающие в лабораторию, регистрируют в журнале учета с
обязательным указанием числа емкостей и номера протокола отбора проб для каждой
пробы. Пробы почв подвергают анализу не позднее 12 ч от момента отбора. При
невозможности обеспечения данного условия, объединенные пробы в естественно
влажном состоянии хранят в холодильнике (в банках с притертой или плотно
завинченной крышкой) не более одной недели при температуре от (+2) 'С до (+4)
'С. Пробы почв не консервируют.
Для проведения контрольных измерений токсичности фоновых образцов почвы
проводят отбор почвы на фоновых (незагрязненных) участках обследуемых областей.
При отборе проб почвы для приготовления фоновых образцов используют
типичные для данного региона почвы, характерные по агрохимическим свойствам.
.4 Культивирование инфузорий Paramecium caudatum
Культура инфузорий предоставлены для проведения исследований кафедрой
биохимии Московского государственного университета прикладной биотехнологии.
Инфузории культивировали на минерально-дрожжевой среде, приготовление
которой состоит из двух этапов:
Приготовление 10-кратного концентрированного раствора по прописи
Лозина-Лозинского (в 1 литре дистиллированной воды растворяли соли; 0,1г NaCl; 0,01г KCl ; 0,01 г MgSO4; 0,01 г CaCl2 ;0,02г NaHCO3 ).
Приготовление питательной среды (в плоскодонные конические колбы объемом
100 см3 вносили 45 мл дистиллированной воды, 5 мл концентрированного раствора
Лозина-Лозинского. Закрывали колбу ватно-марлевой пробкой, кипятили 5 минут и
остужали до комнатной температуры.
Среда для культивирования инфузорий была приготовлена на дистиллированной
воде стандартного качества, которую получали с помощью дистиллятора, не
имеющего в своем составе ни латунного, ни медного испарителя или конденсатора.
1.5
Автоматизированная биотехническая система
В РФ создана автоматизированная биотехническая система, состоящая из
устройства БиоЛаТ программы AutoCiliata и методических приемов культивирования
и проведения исследований с использованием в качестве тест-объектов инфузорий
Stylonychia mytilus, Paramecium caudatum, Tetrahymena pyriformis. Эта система
использована в следующих рекомендациях «МЕТОДИЧЕСКИЕ РЕКОМЕНДАЦИИ определения
безопасности кормов, рыбных продуктов и продуктов животного происхождения
интегральным методом автоматизированного биотестирования на инфузориях
Paramecium caudatum и Tetrahymena pyriformis» Методические рекомендации
разработаны д.в.н., проф. Долговым В.А., д.б.н. Лавиной С.А. (ГНУ ВНИИВСГ и Э),
к.т.н. Черемных Е.Г., Ивановой Г.В. (ФГУ ЦНМВЛ), Дмитриевым М.А. (МГУПБ),
д.х.н., проф. Иванкиным А.Н. (ГНУ ВНИМП), 2007.
Методические рекомендации предназначены для экспрессной оценки
токсичности продуктов животноводства (мясо, мясопродукты, молоко, яйца), кормов
(зерно фуражное, продукты его переработки, комбикорма, мясокостная и рыбная
мука, дрожжи кормовые, жмыхи и шрота), объектов окружающей среды (почва,
природные и сточные воды, органические отходы сельскохозяйственных предприятий
и др.), а также полимерных упаковочных и строительных материалов.
На первом этапе биотестирования осуществляется подсчет инфузорий
Paramecium caudatum в течение 2-х часов экспозиции их в 2-х подготовленных
пробах продукта, представляющих собой водный экстракт и разбавленный ацетоновый
экстракт. Оценка прироста Tetrahymena pyriformis осуществляется на основе
подсчета их в водном экстракте продукта через 24 часа после экспозиции в пробе.
Для подсчета простейших применяется автоматизированный прибор БиоЛаТ.
Интегральная оценка безопасности вычисляется автоматически на основании результатов
2-х этапов биотестирования и в соответствии с алгоритмом программы AutoCiliata
Способ выявления реакции инфузорий на исследуемый продукт состоит в
сравнении количества этих тест-объектов через определенные промежутки времени.
Подсчет живых клеток простейших основан на обработке изображения емкости для
проведения исследования (лунки) программой AutoCiliata. Живые инфузории - это
подвижные объекты (скорость перемещения инфузорий может быть 0,01 - 2мм/сек) и
признаками, позволяющими идентифицировать объект, как живую клетку, являются
его размеры и факт самостоятельного перемещения.
В основе формализации процесса биотестирования лежит принцип
многократного подсчета количества тест-объектов в течение экспозиции и
представление процесса изменения этого количества случайным процессом.
Результаты любых измерений, в том числе биологических исследований с помощью
устройства БиоЛаТ, включают ошибки измерений. Такие измерения в течение
некоторых промежутков времени интерпретируются как случайные процессы, имеющие в
своем составе случайные функции ошибок.
.6 Биотестирование почвенных вытяжек при помощи семян редиса
Вюртцбургского
Биотест с использованием семян редиса был разработан для определения
экологических последствий применения химических средств защиты растений. Редис
отличается от других растений большей отзывчивостью на гербициды и фунгициды,
обусловленной высокой энергией прорастания семян.
Семена редиса, отобранные по качеству и близким размерам, помещали в
химические стаканы и в течение суток замачивали водными растворами солей кадмия
или водными вытяжками из почв. Семена заливались таким количеством раствора,
чтобы исключить гибель семян от излишней влаги или пересыхания. Контролем
служили семена, замачиваемые водой в тех же объемах. Через сутки семена раскладывали
на чистые чашки Петри с бумажными фильтрами. В чашки предварительно вносили по
7 мл стерильной водопроводной воды. Затем раскладывали семена по 15 штук на
чашку, которые равномерно распределялись по поверхности чашки. Чашки
выдерживали при определенной температуре в течении двух суток. На 3-и сутки
после раскладывания семян определяли общую длину корневой системы проростков в
каждой повторности, учитывали число непроросших семян (проросшими считались те,
у которых корешок прорывал семенную оболочку). Затем рассчитывали среднюю длину
корня взошедших семян в каждой повторности и среднюю длину из трех
повторностей.
Снижение длины корней проростков замоченных семян в растворах препаратов
по сравнению с контролем, выраженное в процентах, являлось показателем
токсичности препаратов.
II. 2.
Обсуждение результатов
.1 Оценка действия разных концентраций аммиачной селитры на биологическую
систему
В лабораторном эксперименте на инфузориях с применением различных
концентраций аммиачной селитры были использованы растворы химического вещества
в следующих концентрациях:1000,600,300,150,75,37 мг/кг (табл.1)
Таблица 1. Влияние аммиачной селитры биотест с инфузориями
|
концентр.
|
|
|
|
Токсичность, %
|
|
1
|
2
|
3
|
среднее значение
|
|
NH4NO3(37)
|
25
|
29
|
31
|
6
|
|
NH4NO3(75)
|
20
|
15
|
7
|
6
|
|
NH4NO3(150)
|
7
|
8
|
27
|
11
|
|
NH4NO3(300)
|
8
|
4
|
22
|
14
|
|
NH4NO3(600)
|
8
|
10
|
0
|
14
|
|
NH4NO3(1000)
|
9
|
8
|
0
|
28
|
Все концентрации азота снижали численность инфузорий. Достоверное
изменение более 25% произошли на самой высокой концентрации 1000 мг/кг (рис.1).
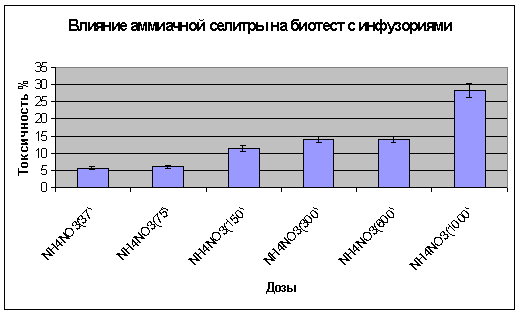
Рисунок
1
Линейная зависимость «доза-эффект» позволяют построить график, отражающий
летальности инфузорий в зависимости от доз минеральных удобрений (граф.1).
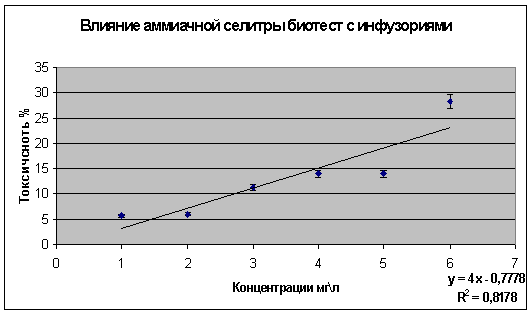
График 1
В растительном биотесте рассматривались концентрации соответствующие
следующим дозам азотных удобрений: 90, 120, 180, 240, 600, 1200 кг/га (табл.2).
Таблица 2. Влияние доз азотных удобрений на динамику корней биотеста
|
кг/га
|
|
|
|
|
1
|
90
|
24
|
|
2
|
120
|
35
|
|
3
|
180
|
30
|
|
4
|
240
|
25
|
|
5
|
600
|
6
|
|
6
|
1500
|
-30
|
Установлено, что в интервале концентраций от 90 до 120 происходит
стимуляция роста корней тест-системы. В интервале концентраций от 120 до 1200
длина корневой системы снижается. Достоверная токсичность установлена в дозе
1200 кг/га (рис.2).
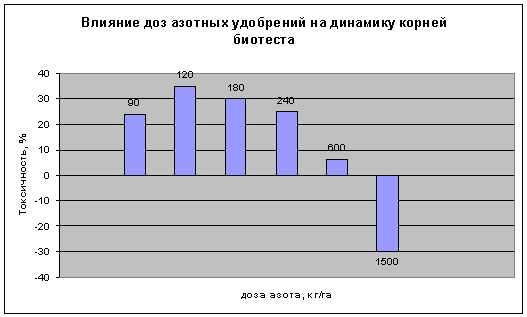
Рисунок
2
Линейная зависимость «доза-эффект» по растительному биотесту тоже может
быть отображена графически (граф.2).
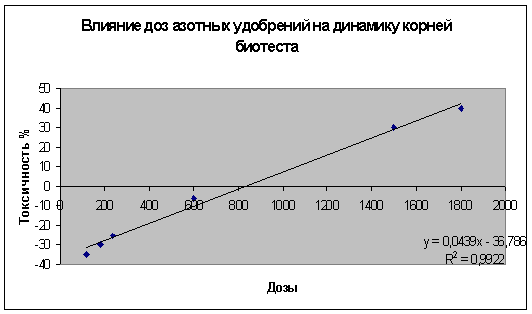
График 2
.2 Рассмотрение влияния концентраций Zn на биотестах
Получены результаты по биотестам на проростках растений и биотестах на
инфузориях.
В тесте на инфузориях проведена оценка концентраций цинка в диапазоне:
50, 5, 1; 0,5; 0,25 мг/л. Установлено, что высокие концентрации цинка 1- 50
мг/л вызывают летальность инфузорий от 5 до 35 % (рис. 3). При концентрациях от
0,5 до 0,25 мг/л он вызывает незначительную до 10% стимуляцию.
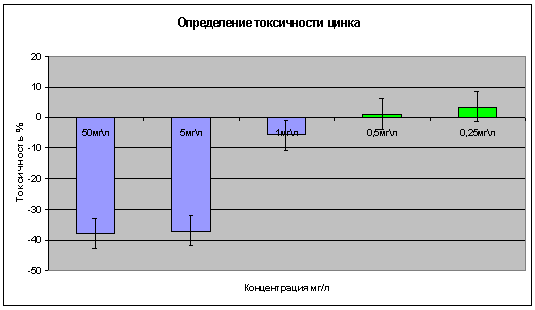
Рисунок
3
В биотесте с редисом можно прибегнуть к оценке разных функций: всхожести
семян, длины проростков, длины корневой системы. С семенами редиса испытывался
большой спектр концентраций. Необходимо отметить, что при воздействии цинка на
корневую систему происходят в структуре корешка морфологические изменения.
Корешок покрывается плотным слоем корневых волосков. Что хотелось бы в
дальнейшем учитывать при биотестировании с использованием автоматического
обсчета корешка. Токсичность проявилась на величине соответствующей ПДК. При
концентрации цинка 32,05 мг/л токсичность равна 10-25%, что выявлено как по
всхожести семян, так и по длине первичного корешка (рис.4). Токсичность была
менее существенна на концентрации 162,5 мг/л. Это, можно связать, с
существующим механизмом живых организмов компенсировать токсичность за счет
внутренних защитных систем.
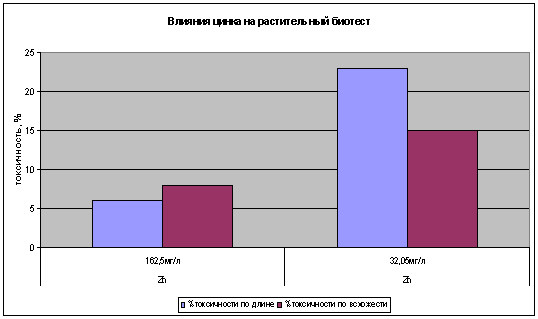
Рисунок
4
.3 Биотестирование разных концентрации ТМ (Cd)
Биотестирование выполнено на семенах редиса в диапазоне концентраций:
1,2-120 мг/л. Установлено, что высокая концентрация кадмия 120 мг/л вызывает
угнетение роста длины корешка на 65-85% и ингибирует всхожесть семян
40-70%(рис.5). При концентрациях 1,2 мг/л кадмий вызывает незначительную до 5%
стимуляцию по длине корешка и достоверное угнетение по всхожести.
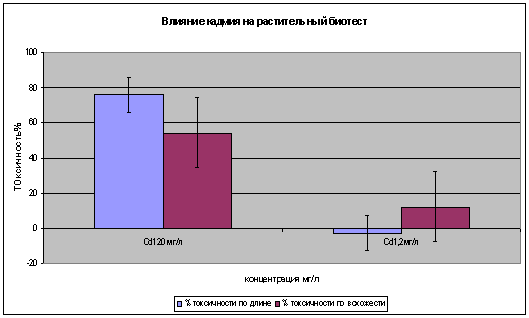
Рисунок
5
Рисунок
6
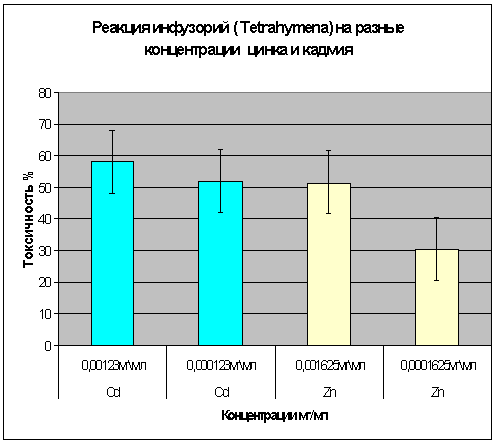
В биотесте с инфузориями (Tetrahymena) большое внимание уделялось тому, что функциональные изменения в
тест-системе производились через 48 часов, что позволяет оценить реакцию
инфузорий при длительном взаимодействии с кадмием и цинком. При концентрации
цинка 0,0001625мкг/мл установлен высокий процент выживания и токсичность равна
20-40%. При увеличении концентрации в 10 раз токсичность колеблется в пределах
40-60%. Испытуемые концентрации кадмия обуславливают высокую токсичность
40-65%(рис.6).
.4 Изучение отзывчивости биологически активных веществ (БАВ) в биотестах
Биологические методы позволяют учесть не только действие веществ
оказывающих негативное воздействие, а дают представление о суммарной
характеристике объекта. Таким образом, учитывают и действие биологически
активных веществ, которые снижают токсичность. Такими веществами выступают
фитогормоны. В качестве фитогормонов в работе были использованы Эпибрассинолид
и Ауксин. Эпибрассинолид является фитогормоном полифункционального действия и
выступает как адаптаген. Ауксин - фитогормон корневого апекса и активно
воздействует на рост корневой системы. Действие этих гормонов было испытано в
совокупности с концентрациями кадмия и цинка. При концентрациях кадмия 1,2мг/л
и цинка 32,05 мг/л проявилась летальность инфузорий от 7 до 13 % (рис. 7).
С добавлением фитогормона Ауксина совместно с исследуемыми химическими
веществами, появился положительный эффект. Можно предположить, что инфузории
под влиянием ауксина проявляют большую подвижность, и как видно из результатов
появляется стимуляция (рис. 7).
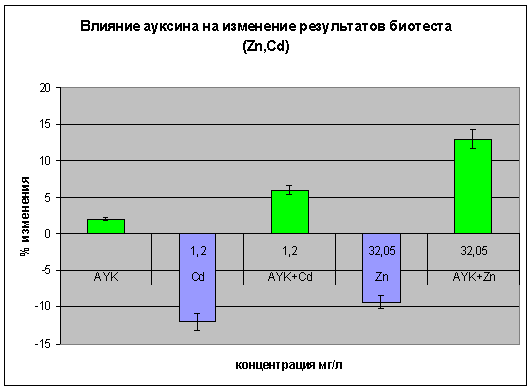
Рисунок
7
С использованием концентрации цинка 32,05 мг/л совместно с разными
концентрациями фитогормона эпибрассинолида на биотесте с проростками.
Установлено, что эпибрассинолид увеличивает проницаемость цинка в семена редиса
и затормаживает всхожесть (рис. 8).
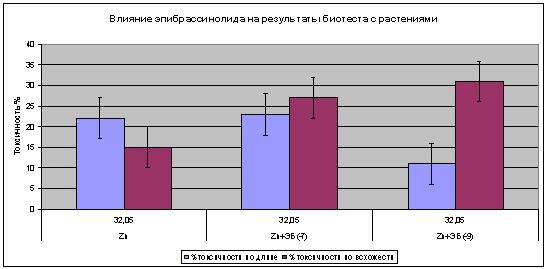
Рисунок
8
При
использовании фитогормона эпибрассинолида с концентрацией кадмия 1,2 мг/л на
биотест с проростками проявляется усиление токсичного эффекта на всхожесть
семян и рост корневой системы.
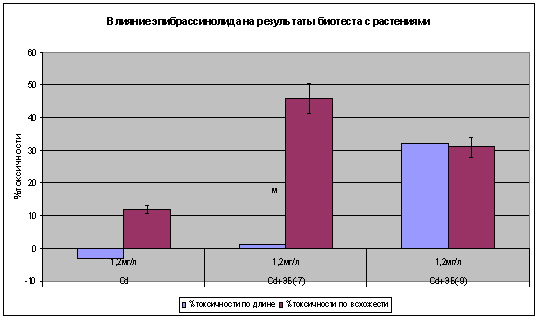
Таким образом, использование эпибрассинолида ведет к усилению
проникновения металлов в семена растений биотеста тем самым подавляет всхожесть
семян и при действие биофильного элемента (zn) рост корневой системы увеличивается, а при проникновении в
семена растения ТМ (cd) рост корней
подавляется.
Выводы
1. Анализ агрохимических средств с помощью методов биотестирования
позволяет расширить наше представление о возможных их эффектах действия в
аграценозе.
2. Оценка динамики широкого спектра агрохимических средств,
интерпретированная графически позволяет вести прогноз возможного токсического
действия в системе «доза-эффект».
. Необходимо провести сопоставление и внедрение лабораторных
исследований с вегетационными и полевыми результатами исследований по
биотестированию.
Список литературы
1. Черемных
Е.Г., Воронина Л.П.* МГУ им. Ломоносова, г. Москва, Воробьевы Горы, кафедра
агрохимии, ф-т. Почвоведения, МГУ Прикладной Биотехнологии, г. Москва,
ул.Талалихина, 33.
. Ремпе Е.Х.,
Минеев В.Г., Воронина Л.П. Биотест для определения экологических последствий
применения ХСЗР// ж. Доклады ВАСХНИЛ, №7, 1991, 5-10;
3.Битюцкий
Н.П. Микроэлементы и растение. Учебное пособие. Спб 1999
. Голубкова
Э.Г. Экология Paramecium caudatum в условиях острой и хронической
интоксикации // Атореф.канд.дисс. Петразоводск, 1980
5. Гроздов
А.О. Определение общей токсичности на инфузориях парамециях Комбикорма,
№4,2001.
.Жмур Н.С.
Государственный и производственный контроль токсичности методами
биотестирования в России. - М..: Международный дом сотрудничества, 1997.
7.
Mandava N.V. Ann. Rev. of Plant Physiology and plant Molecular Biology, 1988,
8. Cerana R.,
Lado P., Anastasia M., Ciuffreda P.,Allevi P. J. Plant Physiol., 1984, v.114,
№3
Шакирова Ф.А.
Неспецифическая устойчивость растений и механизмы ее формирования
.Гамбург
К.З.. Брассины - стероидные гормоны роста растений // Успехи современной
биологии, 1986,Т.102, вып.2(5)
. Mitchell J.
W., Mandava N., Worley J. F., Plimmer J. R.. Smith M. V. Nature, 1970, v. 225,
№ 5257
12.
Mitchell J. W., Gregory
L. E. Nature New Biol., 1972, v. 239, № 95