Аэростазы животноводческих помещений
АЭРОСТАЗЫ ЖИВОТНОВОДЧЕСКИХ ПОМЕЩЕНИЙ
Витебск 2012
Введение
Внешняя среда является основным фактором, определяющим жизнедеятельность
и поведение животных. Однако на животных воздействуют также определенные приемы
и способы кормления, содержания, в том числе и микроклимат, искусственно
создаваемые человеком.
Чтобы получить от животных максимальную продуктивность, необходимо не
только хорошо балансировать кормление, но и поддерживать в животноводческих
помещениях оптимальный микроклимат.
Оптимальный микроклимат в помещениях для животных слагается из комплекса
факторов внешней среды: температуры, влажности, подвижности воздуха, газового
состава, пыли, микробов и некоторых др. Создание оптимального микроклимата
способствуют высокой жизнедеятельности и получению высокой продуктивности от
животных. Однако следует учесть, что оптимальный микроклимат в помещениях
напрямую зависит от эффективности работы систем вентиляции. В настоящее время в
большинстве из животноводческих помещений проектанты обеспечивают расчётный
нормативный воздухообмен, однако распределение свежего приточного воздуха не
всегда равномерно из-за ошибок в проектах, нарушения монтажа вентиляционных
агрегатов, а также вследствие неправильной эксплуатации систем вентиляции в
помещениях. Все это приводит к нарушении воздухообмена во всём помещении или
его частях и чаще всего к застойным явлениям воздушных потоков (аэростазам). В
отдельных случаях эти нарушения происходят из за экономии электроэнергии в
помещении, когда энергетики на ночь электричество в помещениях. Отключая при
этом не только вентиляцию, освещение и прочее.
При плохой работе вентиляции в воздухе животноводческих помещений
накапливается большое количество вредно действующих газов: углекислого,
аммиака, сероводорода, метана и др., которые являются продуктами
жизнедеятельности самих животных. Также происходит увеличение концентрации
микроорганизмов и пыли. Накопление газов, микроорганизмов и пыли в повышенных
концентрациях нарушает нормальное функционирование различных систем организма
животных, что значительно снижает устойчивость организма к различным
заболеваниям инфекционной и неинфекционной этиологии.
Поэтому, одной из важнейших задач животноводства является создание
микроклиматических условий, обеспечивающих здоровье и высокую продуктивность
животных.
1. Влияние отдельных параметров микроклимата на организм и продуктивность
животных
.1 Температура воздуха
животноводческий аэростаз
ультрафиолетовый микроклимат
Известно, что основным параметром воздушной среды помещения является
температура. Она в наибольшей степени влияет на состояние здоровья и
продуктивности животных и птицы. Гигиеническое значение температуры в том, что
она оказывает влияние на терморегуляцию организма. Комплекс физиологических
реакций, направленных на поддержание температуры тела в организме на
относительно постоянном уровне, называется терморегуляцией. Она подразделяется
на процессы химической терморегуляции - реакция теплопродукции и процессы
физической терморегуляции - процессы регуляции теплоотдачи. Так общеизвестно,
что существует определенная температурная зона в границах которой процессы
теплопродукции и теплоотдачи имеют минимальное значение. Эта зона называется
зоной теплового безразличия или зоной комфорта. По величине эта зона ниже
температуры тела и зависит от возраста животных, степени акклиматизации, уровня
кормления и их продуктивности. В пределах зоны комфорта животные и птица дают
максимальную продуктивность и расходуют на единицу продукции наименьшее
количество корма. Для каждого вида животных и птицы имеются допустимые пределы
отклонений температуры (зона термической нейтральности), выход за границы
которых отрицательно отражается на их жизнедеятельности. Так, верхний уровень
температуры для всех видов сельскохозяйственных животных практически равен +25
0С за исключением поросят (+30 0С) и цыплят (+35 0С). Нижний уровень для
крупного рогатого скота равен (коров, откармливаемого скота и молодняка)
составляет +50С, для телят - +12 0С, свиней - + 15 0С, поросят - +22 0С, овец -
+ 50С, кур- несушек - +8 0С, для цыплят - + 16 0С.
Для птиц, как и для млекопитающих, отмечают наличие определенной границы
внешней температуры, при которой в их организме начинает усиливаться
теплорегуляция для поддержания необходимой температуры тела. Эта граница
получила название критической температуры, которая для взрослой птицы
составляет в среднем 80С, для цыплят в возрасте от 1 до 3 недель 210С, для
бройлеров в возрасте от 3 до 7 недель 160С (В.И. Мельник, В.И. Мельник, В.С.
Поплавский, 1977; В.М. Митюшников, 1985).
В птицеводческих помещениях поддерживать оптимальный температурный режим
необходимо, так как терморегуляция у птиц недостаточно развита в связи с
наличием плотности оперения и отсутствием потовых желез. Поэтому птица не может
приспосабливаться к резким колебаниям температуры воздуха. Установлено, что у
птицы в отличии от других сельскохозяйственных животных лучше развита
химическая терморегуляция, что позволяет ей в зависимости от температуры среды
рефлекторно затормаживать и ускорять окислительно - восстановительные процессы
в организме, тем самым уменьшая и увеличивая количество образующейся теплоты.
Отдача тепла у птицы происходит в основном за счет испарения влаги при дыхании
(А.Л. Ермолаева, М.А. Асирян, 1976; А.М. Зайцев, В.И. Жильцов, А.В. Шавров,
1986).
По данным Омар Хаж Бадер Эль-Дин Юзбаши (1974); И.А. Болотникова, В.С.
Михкиевой, Е.К. Олейник (1983); J.D. May (1995); F.W. Edens, K.A. Joyce, C.R. Parkhurst
(1998), куры и другие домашние птицы особенно чувствительны к перегреванию. При
повышении температуры окружающей среды возникает стресс: поднимается
температура тела птицы, учащается дыхание, снижается или полностью прекращается
яйцекладка, у молодняка птиц снижается прирост живой массы тела.
Положительное или отрицательное действие температуры тела на организм
птицы зависит от ее интенсивности, длительности, а также от сочетания с другими
факторами внешней среды. Так, низкая температура окружающего воздуха вызывает
увеличение теплоотдачи и следовательно, усиленное теплооброзование, что связано
с изменением обмена веществ, газообмена и уровнем окислительно -
восстановительных процессов. Так как теплообмен и теплорегуляция у птицы
взаимообусловлены, то температура как один из основных факторов микроклимата,
играет важное значение при этих процессах.
Исследованиями А. М. Зайцева, В.И. Жильцова, А.В. Шаврова (1986); А.Г.
Цубанова (1987), установлено, что основной обмен веществ у взрослых кур
сохраняется только при температуре окружающей среды от 10 до 25 0С, при
температуре ниже 10 и выше 25 0С ухудшается физиологическое состояние птицы
снижается ее яйценоскость. Так, при температуре воздуха 27-290С возникает
перегрев организма, это приводит к снижению резистентности, в результате чего
увеличивается выбраковка и падеж птицы. Низкая температура отрицательно влияет
на рост, развитие и продуктивность птицы. При этом увеличивается расход кормов,
часть питательных веществ идет на образование тепла. Так, если при температуре
12,8 0С яйценоскость составляет 75% при затрате кормов 3,5 кг на 1 кг яичной
массы, то при температуре +29 и -5 0С эти показатели составляют соответственно
50 и 25% яйценоскости при расходе кормов 4 и 12,3 кг. При резком снижении или
повышении температуры воздуха снижается яйценоскость, на восстановление которой
требуется не менее десяти дней. При снижении температуры воздуха в помещениях
для бройлеров с 18 до 10 0С приросты их в возрасте 5-8-ми недель уменьшались на
48%, что в пересчете на каждый градус снижения температуры составило около 6%,
а при повышении температуры воздуха с 23 до 32 0С приросты снижались до 26%,
или на 2,9% на каждый градус повышения температуры.
Исследованиями В.М. Митюшникова (1985) установлено, что при температуре
воздуха 38 0С температура тела кур повышается на 1,50С, дыхание учащается в 4
раза, потребление птицей воды увеличивается, а корма уменьшается в 2 раза,
яйценоскость кур резко падает или даже прекращается.
По данным В.М. Селянского (1975); В.И. Мельник, В.И. Мельник, Л.З.
Поплавского (1977); А. Альбанки (1995), при температуре воздуха в помещении
выше 33 0С яйценоскость кур снижается на 18- 20%, потребление корма на 15-20%,
а потребление воды увеличивается на 50-60%. При температуре воздуха более 26 0С
у кур повышается температура тела. Вес яиц снижается при температуре 38 0С и
составляет только 89% веса, который был при температуре 21 0С. Только через две
- три недели при нормальном температурном режиме (16-18 0С) вес яиц и толщина
скорлупы достигает нормы. При температуре воздуха в птичнике 38-40 0С
наблюдается гибель кур от перегрева. Особенно опасно резкое повышение, а также
сочетание высокой температуры с высокой влажностью воздуха.
Исследованиями М.С. Найденского (1980) установлено, что при клеточном
выращивании племенных кур птица более чувствительна к неблагоприятным факторам
микроклимата, чем при напольном. Так, летом при температуре воздуха выше 27 0С
продуктивность кур снижалась на 10-12%, ухудшались и инкубационные качества
яиц, по сравнению с птицей содержащийся в условиях нормативного микроклимата.
Исследованиями В.В. Коновалова, Н.К. Резника (1980) доказано, что
выращивание цыплят при оптимально низком температурном режиме (23-24 0С)
способствует формированию организма с высоким уровнем газообмена, а в условиях
повышенной температуры окружающей среды (29-31 0С) - с низким. Ферментативная
активность ферментов слизистой оболочки кишечника - щелочная фосфатаза и
амилаза была достоверно выше у цыплят, выращенных в условиях пониженной
температуры. Среднесуточные приросты массы тела за весь период выращивания от 1
до 90 дней были несколько больше и в среднем составляли 10,41 против 9,54 г у
цыплят выращенных в условиях пониженной температуры.
По данным В.И. Мельник, В.И. Мельник, Л.З. Поплавский (1977), содержание
молодок и переярок при температуре 26-32 0С и относительной влажности 76%
способствует снижению количества гемоглобина, щелочного резерва, общего белка,
глюкозы, кальция и фосфора в крови по сравнению с такой же птицей, содержащейся
при температуре 140С.
В опытах Э.Д. Юзбаши (1974); А.К. Даниловой и М.С. Найденского, И.С.
Шпиц, В.С. Яворского (1987), проведенных на курах - несушках, установлено, что
под воздействием высокой температуры (30 С0) содержание гемоглобина снижается
на 11,1-17,5%, уровень эритроцитов крови у молодых кур также снижается, а у
взрослой птицы в середине продуктивного периода активность каталазы снижается
на 6,3-7%. Кроме того, при повышении температуры с 21 до 32 0С снижались
яйценоскость кур с 81,5 до 70,9% и потребление корма на 25%. Масса яиц
снизилась в среднем с 58,9 до 53,6 г, уменьшилась толщина и относительная доля
скорлупы. Концентрация Ca в
плазме крови и гематокритное число понижались в среднем соответственно с 28,7
до 25,4 мг % и с 31,2 до 28,5%. Отмечались также понижение уровня витаминов и
специфических антител в крови, а также снижение эффективности вакцинации.
Уменьшалась резистентность кур, что увеличивало восприимчивость птицы к
заболеваниям.
Аналогичные результаты получены при исследовании влияния высоких и низких
температур на организм свиней, телят и овец. Так, ряд авторов (С.И. Плященко,
В.Т. Сидоров, 1979, Л.И. Бронфман, 1984, Г.А. Соколов, 1998 и некоторые др.)
отмечают снижение естественной резистентности, продуктивности возникновение
массовых желудочно-кишечных заболеваний особенно у молодняка
сельскохозяйственных животных который выращивался в условиях
неудовлетворительного температурного режима. Так, при снижении температуры
воздуха в свинарнике-откормочнике с 19 до 4,9 0С на каждый градус падения
температуры прирост массы тела снижается на 2% (С.И. Плященко, 1971), а у телят
на доращивании при снижении температуры воздуха от 16 0С прирост массы тела
снижается на 3,3 % на каждый градус падения температуры (Rays, 1982), даже у ягнят на откорме при
температуре +15 0С, на каждый градус снижения температуры воздуха в помещении
прирост массы тела снижается на 1,85% (Ames D., 1977). Поэтому считается, что наиболее выгодная отдача при
откорме животных (прирост живой массы) у тех животных которые находятся в
термодинамическом равновесии с внешней средой (рыба).
.2 Относительная влажность воздуха
Влияние на состояние здоровья и продуктивности животных и птицы
относительной влажности следует рассматривать в связи с температурой, так как
она воздействует на терморегуляцию организма. С повышением влажности воздуха в
помещениях испарение влаги органами дыхания животных уменьшается, так как
парциальное давление водяных паров приближается к упругости водяного пара на
поверхности слизистых оболочек дыхательных путей. Кроме того, влага, насыщая
воздух помещений, изменяет их теплоемкость и теплопроводность.
Высокая относительная влажность (85% и выше) отрицательно действует на
теплоотдачу, как при высоких, так и при низких температурах окружающей среды. В
воздухе насыщенным водяными парами невозможна отдача тепла путем испарения.
Очень сырой воздух в сочетании с высокой температурой и малой его подвижностью
тормозит теплоотдачу и способствует в дальнейшем перегреванию организма. При
содержании животных с таким температурно-влажностным режимом у них развивается
патология под названием хронический застой тепла, при этом у них тормозиться
обмен веществ, уменьшается аппетит или происходит полный отказ от корма,
появляется вялость, снижается продуктивность и устойчивость к инфекционным и
незаразным заболеваниям, также отмечают повышение температуры тела на 0,5-1 0С.
При сочетании высокой влажности с низкой температурой воздуха у животных
резко возрастает теплоотдача вследствие того, что теплоёмкость влажного воздуха
в 10 раз больше чем сухого. В таких условиях возрастает количество
респираторных (ринит, бронхит, воспаление легких) и желудочно-кишечных
заболеваний. Также регистрируются маститы, мышечный ревматизм, возрастает
количество инфекционных заболеваний (туберкулёз, трихофитии, паратиф и др.).
Вреден для животных не только слишком влажный, но и слишком сухой воздух
(относительная влажность ниже 40%). При содержании в условиях высокой
температуры и низкой влажности воздуха у животных высыхают кожа и слизистые
оболочки дыхательных путей и ротовой полости, увеличивается потоотделение,
снижается резистентность животных к возбудителям инфекционных заболеваний. В
результат воздействия чрезмерно сухого воздуха у животных высыхает копытный рог
и кожа, образуются трещины, у овец отмечают ломкость шерсти (С.И. Плященко,
В.Т.Сидоров, 1979, А.Ф. Кузнецов, 2003 и др.).
По данным А.Л. Ермолаевой, М.А. Асирян (1976); В.М. Митюшникова (1985),
высокая влажность воздуха в птичниках способствует снижению переваримости
питательных веществ корма, понижению отложения азота и уменьшению содержания
гемоглобина в крови, и как следствие снижению продуктивности. Поэтому при
повышенной влажности снижается резистентность. Пребывание птицы в помещениях с
высокой влажностью и низкой температурой способствует простудным заболеваниям.
При высокой относительной влажности и высокой температуре воздуха теплоотдача у
птиц сильно затруднена, вследствие чего может наступить тепловой удар.
Исследованиями В.И. Мельник, В.И. Мельник, Л.З. Поплавского (1977); А. М.
Зайцева, В.И. Жильцова, А.В. Шаврова (1986) установлено, что воздух влажностью
50% считается сухим, вызывает раздражение слизистых оболочек дыхательных путей
и глаз птицы, повышает хрупкость пера, усиливает потерю влаги организмом. При
этом потребность в воде у птиц увеличивается, а поедаемость корма уменьшается.
По данным Н.И. Щербинина и Ю.Н. Щербинина (1998) в отапливаемых помещениях с
функционирующей расчетной вентиляцией относительная влажность всегда в 1,5-3
раза ниже ОНТП, особенно при увеличении разности температур воздуха внутри
помещения и снаружи. Этому способствует применение капельных поилок. Со
снижением влажности воздуха увеличивается запыленность и бактериальная
обсемененность его.
Поэтому большинство авторов (А.П. Онегов, Ю.И. Дудырев, М.А. Хабибулов,
1984; Г.К. Волков, В.М. Репин, 1986; В.И. Фисинин, Т.А. Столляр, 1989; А. Альбанки,
1995; В.К. Гриб, С.С. Жук, П.Н. Синкевич, 1997 и др.), а также РНТП-1-92
рекомендуют поддерживать относительную влажность в помещениях в пределах
50-75%.
.2 Скорость движения воздуха
Движение воздуха при температуре более низкой, чем температура тела птицы
может вызвать переохлаждение организма. В условиях помещений для животных и
птицы подвижность воздуха является важным фактором теплоотдачи. Она, усиливая
испарение и увеличивая теплоотдачу, воздействует на водный и тепловой обмен
организма животных, поэтому скорость движения воздуха является важным фактором
микроклимата. Так, увеличение скорости движения воздуха с 0,1 до 0,4 м/с
равносильно понижению температуры на 50С (А.П. Онегов, И.Ф. Храбустовский, В.И.
Черных, 1984). Исследованиями А.А. Лебедя (1984), установлено, что при скорости
движения менее 0,2 м/с воздух не успевает уносить с собой выделяемые животными
углекислый газ, аммиак, сероводород и др. Кроме того, в местах со скоростью
движения воздуха менее 0,1 м/с создаются локальные зоны застоя, в которых
накапливаются вредные газы до недопустимых концентраций. В аэростазных условиях
содержания наблюдается снижение продуктивности животных, увеличивается
выбраковка и заболеваемость.
1.3 Химический состав воздуха
Значительное влияние на организм животных и птицы помимо температуры,
влажности и скорости движения воздуха оказывает газовый состав окружающего
воздуха. Многочисленными исследованиями установлено, что в воздухе
птицеводческих и других животноводческих помещений содержится значительное количество
вредных газов, таких как, углекислый, сероводород, аммиак и продукты гниения и
брожения органических веществ (В.М. Селянский, 1975; В.И. Мельник, В.И.
Мельник, Л.З. Поплавский, 1977; А.Ф. Кузнецов, В.И. Баланин, 1984; M. Hasegawa, Y. Kurabayashi, T.
Ishii, 1997 и др.).
По данным Ф.А, Изакова, Н.М. Быкова, П.И. Леонтьева (1982); А. М.
Зайцева, В.И. Жильцова, А.В. Шаврова (1986); J. Hoper, H. Jahn, R. Demir, K.
Hoper (1997) основную роль в жизнедеятельности птицы играет кислород, причем
молодняк нуждается в воздухе больше чем взрослая птица и поглощает кислорода
примерно в 5-6 раз больше, чем крупный рогатый скот. При недостатке кислорода
затормаживаются окислительные процессы, накапливаются токсические продукты, что
приводит к заболеваниям и снижению продуктивности.
Исследованиями Н.И. Щербинина и Ю.Н. Щербинина (1998) установлено, что
применение в птицеводческих хозяйствах мобильных подогревателей воздуха в
холодное время, особенно в первые дни выращивания цыплят, значительно снижает
влажность воздуха, а использование приборов с открытой спиралью или пламенем
горелки снижает концентрацию кислорода на 1,1-2,2% по объему.
Важное значение по содержанию в воздухе занимает углекислый газ. По
своему физиологическому действию углекислый газ в малых концентрациях
стимулирует активность работы дыхательного центра, а в больших угнетает его,
действует как наркотическое средство (усыпляющее).
При повышенной концентрации углекислого газа снижаются окислительные
процессы в организме, возникает ацидоз, происходит раздражение кожи и слизистых
оболочек, усиливается деминерализация костей, ухудшается поедаемость корма и
его переваримость, вследствие чего снижается продуктивность. При концентрации
выше 0,3% происходит отравление животных углекислотой. Высокое и низкое содержание
углекислоты в потребляемом воздухе влечет за собой быструю гибель птицы в
результате выключения дыхательного центра, кислородной недостаточности,
паралича органов дыхания. В птичниках его концентрация может оказаться
недопустимой, так как птица является источником его поступления (А.Л.
Ермолаева, М.А. Асирян, 1976; Ф.А, Изаков, Н.М. Быков, П.И. Леонтьев, 1982;
Л.И. Бронфман, 1984; А.М. Зайцев, В.И. Жильцов, А.В. Шавров, 1986; В.И.
Баланин, 1988, А.Ф. Кузнецов, 2003).
Помимо газов находящихся в атмосферном воздухе, воздушная среда птичников
содержит газы образующиеся при разложении фекалий, помета, мочи, среди которых
основными являются аммиак и сероводород. При концентрации свыше 0,02 мг/л
аммиак раздражает слизистую оболочку, а, попадая в кровь, разрушает эритроциты,
что затрудняет снабжение организма кислородом. В воздухе животноводческих
помещений при неудовлетворительной работе вентиляции в больших количествах
накапливается аммиак - являющийся резко токсичным газом в результате
длительного действия, которого резко снижается резистентность и продуктивность.
Аммиак вызывает раздражение слизистых оболочек носовой полости, гортани,
трахеи, бронхов. Попадая в легкие и кровь, он снижает окислительные свойства
гемоглобина, превращая его в щелочной гематин, в результате чего возникает
кислородная недостаточность у животных. Аммиак в повышенных концентрациях в
воздухе парализует работу мерцательного эпителия нарушая процессы отхаркивания,
нейтрализует лёгкие отрицательные аэроионы свежего воздуха, нарушает электороэффлювиальную
функцию мерцательного эпителия (медленное стекание электронов из его окончаний
на молекулы кислорода и образование отрицательных лёгких ионов кислорода в
верхних дыхательных путях организма); гемолизирует эритроциты вызывая гемолитическую
анемию; раздражает окончание тройничного нерва, что приводит к спазму
бронхиальной и трахеальной мускулатуры. Выпотевая из крови в закрытые полости
аммиак вызывает фибронозное воспаление в них (плеврит, перетонит, орхит,
эндометрит, задержание последа, гемофилезный плеврит и пневмонию), обостряет
протекание хронических инфекций туберкулёз и ангину, ингибирует иммунную
систему и снижает иммунный ответ на введение вакцин. Аммиак также нарушает
барьерную функцию печени вследствие чего личинки гельминтов (аскарид) в ней не
инкапсулируются, а легко мигрируют; снижает жизнеспособность (иммуногенность)
живых аэрозольных и лечебную эффективность антибиотиков, сульфаниламидных
препаратов при лечении респираторных и желудочно-кишечных (протозойных)
заболеваний.Во влажном воздухе аммиак окисляется до азотной кислоты который
превращает кальций штукатурки стен в азотно-кислый кальций (стенную селитру или
труху). В сочетании с другими вредными факторами (сквозняки, патогенная
микрофлора, другие газы и т.д.) аммиак приводит к массовым заболеваниям и
отходу животных с различными диагнозами, особенно при осложнении
условно-патогенной, вирусной и протозойной микрофлорой.
При температуре 10-180С аммиак накапливается главным образом на уровне
155-160 см от пола. При повышении влажности в помещении до 85-90% испарение
аммиака снижается и повышается его растворяемость в воде. В этом случае аммиак
распространяется по всему помещению, достигая наибольшей концентрации над
поверхностью помета (K. Hogberg, 1968; Z. Wachnik, 1973; В.М.
Селянский, 1975; Э. Мотес, 1976; В.И. Мельник, 1977; Л.В. Семен, 1979; А.Ф.
Кузнецов, В.И. Баланин, 1984; В.И. Баланин, 1988).
Исследованиями Б.Ф. Бессарабова (1970); И.А. Болотникова, В.С. Михкиевой,
Е.К. Олейник (1983); А.К. Даниловой, М. С. Найденского, И.С. Шпиц, В.С.
Яворского (1987), установлено, что в воздухе птичников при повышенной
концентрации аммиака содержание микрофлоры возрастает на 30-60%. При
концентрации аммиака 20-30 мг/м3 у птицы нарушаются функции ресничек эпителия
легких и трахеи, которые играют важную роль при удалении пыли и бактерий, может
наступить аммиачная слепота, или кератоконьюнктивит, которая характеризуется
воспалением слизистых оболочек глаза и верхних дыхательных путей у птицы. Также
появляются признаки респираторных заболеваний, осложняющихся колибактериозом и
инфекционным ларинготрахеитом. По данным этих же авторов, установлено, что у
цыплят, подвергшихся воздействию аммиака в концентрации 34-51 мг/м3 ,
отмечались замедление полового созревания на 13-16 дней и более, медленное
нарастание темпов яйцекладки по сравнению с контролем. Путем регрессивного
анализа доказано, что с повышением уровня аммиака в воздухе птичников на 1
мг/м3 яйценоскость снижается на 0,65%.
Если принять яйценоскость и величину падежа при концентрации аммиака 16
мг/м3 за 100%, то с нарастанием загазованности птичника до 30 мг/м3,
яйценоскость снижается на 21,8% и падеж возрастает в 2,2 раза, а при
концентрации 40 мг/м3 соответственно на 37,3% и в 3 раза (Л.И. Бронфман, 1984).
Еще более токсическим действием обладает сероводород, который соединяясь
с тканевыми щелочами, вызывает воспаление слизистых оболочек. Попадая в кровь,
он связывает железо гемоглобина, переводя его в сернистое железо. Таким
образом, гемоглобин лишается возможности поглощать кислород, поэтому возникает
кислородное голодание тканей организма и как следствие большой отход, особенно
у молодняка животных из-за паралича органов дыхания и сердца (А.Л. Ермолаева,
М.А. Асирян, 1976; А. М. Зайцев, В.И. Жильцов, А.В. Шавров, 1986; В.И. Баланин,
1988 и др.).
Длительное действие аммиака и сероводорода приводит к ослаблению общей и
местной сопротивляемости организма, расстройству системы дыхания и
кровообращения, вызывает повышенную трату энергии на усвоение питательных
веществ. Поэтому, по мнению многих авторов (А.П. Онегов, И.Ф. Храбустовский,
В.И. Черных, 1984; А.Ф. Кузнецов, М.В. Демчук, А.И. Карелин и др., 1991),
содержание вредных газов в воздухе животноводческих помещений не должно
превышать: углекислого газа - 0,25%, аммиака - 20 мг/м3, сероводорода - 10
мг/м3, а в птичниках аммиака - 10 мг/м3, углекислого газа 0,2%, а сероводорода
5 мг/м3.
.4 Микробная обсемененность и пылевая загрязненность воздуха
Кроме вышеперечисленных факторов микроклимата на организм животных и
птицы большое влияние оказывает микробная и пылевая загрязненность воздуха.
Воздушная среда животноводческих помещений является благоприятной средой
для развития микроорганизмов. Они находятся на пылинках (твердые аэрозоли) или
включены в капельки (жидкие аэрозоли) и вместе с ними удерживаются в воздухе,
оседают на поверхность предметов и переносятся воздушными течениями на
значительные расстояния. Источником микробного и пылевого загрязнения в воздухе
служат высохший помет, корм, подстилка, капельки слюны и слизи. Способствуют
накоплению микробов и пыли рециркуляции воздуха в помещениях, недостаточный
воздухообмен, скученное содержание животных, сухая уборка помещений и
антисанитарное состояние их.
Установлено, что бактериальная контаминация воздуха неразрывно связана с
пылью, которая является для микробов не только носителем, но и питательной
средой. Увеличение пылевой загрязненности воздуха вызывает блокировку
очистительной функции органов дыхания у животных: уменьшается вентиляция
легких, изменяется энергетический обмен, развивается бронхит, эмфизема,
очаговая пневмония.
Различают прямое и косвенное действие пыли на организм животных. При
прямом влиянии пыль вызывает раздражение кожи, зуд и воспалительные процессы.
Нарушаются теплорегуляторные и выделительные функции кожи. Пыль закупоривает
выводные протоки потовых и сальных желёз. Вследствие чего кожа становиться
сухой, ломкой, больше подвержена механическим повреждениям и трещинам. Возможно
возникновение дерматитов, пиодермий, пустулезной сыпи, инфекционных
заболеваний. У овец резко снижает качество шерсти. Косвенное воздействие пыли
заключается в уменьшении освещенности помещений вследствие оседания на
осветительные приборы, также происходит нейтрализация легких отрицательных
аэроионов и превращение их во вредные для организма тяжелые аэроионы.
Пыль по своему происхождению бывает органической и минеральной. В
помещениях для животных органическая пыль (свыше 50%) состоит из частиц
растений, кормов подстилки, навоза, эпидермиса, волос, спор грибов и
микроорганизмов. Минеральная пыль включает в себя частицы песка, кварца,
известняка, угля и других примесей.
Состав пыли зависит также и от типа кормления животных. Так, по своему
химическому составу пыль птичников содержит более 84% органических веществ, в
том числе 34-50% протеина (за счет протеина комбикорма, пуха и бактериальной
микрофлоры) и 11-18% за счет жира. По своему дисперсионному составу 90,3% всей
пыли в птичниках было размером меньше 100 мкм, в том числе 80% - менее 50 мкм и
64,1 - менее 10 мкм - пыль, которая задерживается в легких и нарушает их
физиологические функции (А.К. Данилова, М.С. Найденский, И.С. Шпиц, В.С.
Яворский, 1979; Л.И. Бронфман, 1984; А.И. Испенков, И.И. Сапего, 1985 и др.).
Существует определенная зависимость между запыленностью воздуха и
микробной обсеменённостью воздуха, так как пыль является источником накопления
микроорганизмов в воздухе. Пыль сорбирует микроорганизмы, так в 1 г пыли
содержится до 1 миллиона и более микроорганизмов. Так, по нашим данным при
движении стада, как правило, поднимается облако пыли, в котором перемещаются
животные, дышат его содержимым, а пыль осаждается на кожу и слизистые оболочки,
затрудняет видимость и передвижение, загрязняет кожный покров и вызывает
легочные заболевания животных, особенно занимающих не лидирующее иерархическое
положение в группе и передвигающихся в середине или конце. Это снижает здоровье
и продуктивность овец, а возникший в легких от пыли первичный патологический
процесс в дальнейшем осложняется неспецифической условно-патогенной микрофлорой
(до 60 видов) и приводит к их гибели. При этом эффект вредного воздействия во
многом зависит от количества и размеров пылевых частиц, их формы, токсичности и
других свойств. Наиболее опасной считается пыль размером от 0,2 до 5 мкм, так
как она проникает глубоко в легкие до альвеол, на 60-100%оседает в них, вызывая
бронхопневмонию. Менее опасными является пылинки размером более 10мкм, которые
осаждаются в верхних дыхательных путях, отхаркиваются и попадают в ротовую
область, заглатываются и оказывают вредное воздействие на желудочно-кишечный
тракт.
Так, в наших наблюдениях травяной покров на прогонах для овец
отсутствовал, а поверхность их представляла сыпучую пылевидную массу со
следующими размерами пылевых частиц: диаметром более 7 мкм - 2,48%, от 3 до 7
мкм - 14, от 2 до 3мкм- 7, от 1 до 2 мкм - 10,1, менее 1 мкм - 65,06, т.е. по
механическому составу наибольшую часть поверхности прогонов составили мелкие
пылевые частицы, которые легко поднимаются с почвы и поддерживаются во
взвешенном состоянии ветром со скоростью не менее 3 м/с. Распространяясь на
большие расстояния и загрязняя окружающую внешнюю среду, они составляют угрозу
для животного мира.
Количество пыли и микробов, содержащихся в 1 м3 воздуха, зависело как от
величины отары, так и от состояния поверхностного слоя почвы прогонов. Так, в
бригаде, где отара овец была больше в 1, 48 раза, количество пыли было больше в
1, 31 раза, а микробов - в 1,3 раза. При этом в большей отаре поднимались в
воздух на 7% больше пылевых частиц диаметром 11-40мкм. Однако более всего
(55-66%) пришлось на долю мелких пылевых частиц диаметром до 10 мкм, которые
наносят больше вреда организму своим глубоким проникновение в дыхательные пути.
Поэтому, по-видимому, в первой отаре отход овец от бронхопневмонии составил 29
голов или 2,29%, а во второй -14 голов или 1,64%. В воздухе пастбища, почва
которого покрыта растительностью, обнаружена пылевая и микробная загрязненность
воздуха меньшая, в 5,9-11,1 раза. Это указывает на то, что санитарное состояние
воздуха прогонов зависит не только от величины перегоняемого стада, но главным
образом от качества поверхностного слоя почвы и состояния покрытия ее
растительностью.
Микробная обсеменённость воздуха является одним важнейших показателей
определяющих эпизоотическое благополучие фермы (комплекса), птицефабрики по
многим инфекционным заболеваниям. Так как, возбудители многих респираторных
заболеваний быстро распространяются через воздух, что представляет большую
опасность возникновения массовых заболеваний среди животных и птицы.
По данным А. Байдевлятова, А. Прокудина (1983); А.П. Кот (1986); А.В.
Байдевлятова, В.В. Германа, В.В. Кирпич и др. (1987) экспериментально доказано,
что при концентрации микроорганизмов свыше 250 тыс. в м3 воздуха у птицы
наступает микробный стресс, который приводит к снижению ее жизнеспособности,
продуктивности, оплаты корма. Установлено, что содержание свыше 1,5% патогенных
серотипов колиформной микрофлоры в общем количестве бактерий, составляющем 130
тыс. в м3 воздуха, обуславливает клиническое проявление колибактериоза и
повышенный отход у цыплят при выращивании в клетках. В птичниках, в которых
микробная обсемененность превышала 80-100 тыс. в м3 снижалась продуктивность и
увеличивалась гибель птицы.
1.5 Видимый свет
Помимо вышеперечисленных факторов микроклимата значительное влияние на
рост и развитие молодняка, и продуктивность кур оказывает видимый свет. При
воздействии светового раздражителя происходит функциональная перестройка в
нервной системе, приводящая к изменению физиологического состояния организма
животного в целом. Реакция организма на влияние интенсивного и продолжительного
освещения сопровождается повышением тонуса нервно - мышечного аппарата, в
результате чего возрастает двигательная активность, отмечаемая почти у всех
животных, особенно у молодняка. Подавление поведенческих реакций и снижение
уровня обмена веществ отмечается в условиях недостаточного освещения помещений
(В.М. Юрков, 1991).
Так, по данным В.М. Гончаренко, Н.К. Резника (1992), А. Альбанки (1995),
несоблюдение нормативов освещенности птичников, понижение или повышение их,
приводит к угнетению роста, развития и жизнеспособности молодняка, способствует
снижению яйценоскости и резистентности взрослой птицы.
Исследованиями А.К. Даниловой, М.С. Найденского, И.С. Шпиц, В.С.
Яворского (1987) в опытах на молодняке который выращивался в клеточных батареях
КБУ-3, доказано, что в первый период от 1 до 60 дней высокая освещенность
способствовала повышению живой массы цыплят, но сопровождалась увеличением их
отхода. Во второй период от 60 до 120 дней этот фактор оказывал уже угнетающее
действие на рост, развитие жизнеспособность и деловой выход ярок.
Исследованиями М.С. Найденского (1994) установлена зависимость между
уровнем освещенности, физиологическим состоянием и яйценоскостью кур.
Лабораторными экспериментами установлено, что максимальная яйценоскость
(235-238 яиц на несушку) получена при освещенности в зоне кормушки от 8 до 22
лк. С повышением освещенности на 40 лк и уменьшением до 4,5 лк яйценоскость
снижалась на 1-5%, а жизнеспособность на 8,8-33%.
По данным В.В. Коновалова, Н.К. Резника (1984), существуют общие
закономерности при формировании светового фона при клеточном содержании птицы -
это высокая освещенность на верхних ярусах и слабая на нижних. На верхних
ярусах освещенность превышает гигиенические нормативы (52 лк), в нижних - резко
снижается (13 лк). Особенно низкий уровень отмечался внутри клеток (5-9 лк). В
таких условиях освещенности у птицы некоторые показатели крови (количество
эритроцитов и гемоглобина, насыщение крови кислородом) были на 10-20% ниже
общепринятых физиологических норм. Все это указывало на ослабление функций
кроветворных органов, недостаточную кислородосвязывающую способность
гемоглобина, снижение интенсивности окислительно - восстановительных процессов
в организме, ухудшение тканевого дыхания и понижение уровня основного обмена.
Исследованиями М.С. Найденского (1980) установлено, что при содержании в
двухъярусных клетках типа КБН племенная птица оказалась очень чувствительна к
повышенной освещенности. Увеличение уровня освещенности с 30 до 156 лк
приводило к снижению яйценоскости на 7%, а жизнеспособности на 7,4%.
1.6 Ионизация
воздуха
Наряду с
вышеперечисленными факторами микроклимата, большое влияние на организм животных
оказывает ионный фон помещения, который напрямую зависит от степени ионизации
воздуха, т.е. наличия в нём положительно и отрицательно заряженных частиц
(аэроионов).
Ионизация
воздуха - это процесс расщепление молекул или атомов газа земной атмосферы под
влиянием различных внешних ионизирующих факторов (электрозаряды, горные реки,
водопады, фонтаны, прибой, дождевые ливни, УФЛ-солнца, химические реакции,
нагревание металлов, действие ионизирующих факторов и др.). В результате
ионизаци происходит отрыв от нейтрального атома или молекулы одного или нескольких
внешних электронов. Оставшаяся часть атома образует положительно заряженный
ион. Свободные от атомов или молекул электроны либо остаются как таковые, либо
присоединяются к нейтральным частицам газа, образуя отрицательно заряженные
ионы.
По характеру заряда различают положительные и отрицательные аэроионы, а
по величине и степени подвижности их условно делят на следующие группы: легкие,
средние, тяжелые. Если нейтральные частицы, вследствие воздействия фактора
ионизации теряют электроны, то при этом возникают положительные аэроионы. В
случае, если нейтральные частицы присоединяют электроны, то возникают
отрицательные ионы. Ионы, существующие в воздухе, как таковые, или
присоединившиеся к молекулам газа, называются легкими; скорость их передвижения
1-2 см/сек. Если легкие ионы соединяются с взвешенными пылевыми частицами,
микробными телами, капельками воды, то образуются ионы более крупных размеров,
которые называются средними или тяжелыми ионами. Эти ионы менее подвижны, они
прочно удерживают заряд. Так, скорость перемещения средних ионов составляет
0,01 см/сек, тяжелых ионов - не более 0,001-0,00025 см/сек.
Степень ионизации различна в течение суток и на протяжении года; минимум
ионизации приходится на утренние и вечерние часы суток в зимнее время года.
Количество легких ионов варьирует в зависимости от географических,
геологических условий, от состояния погоды и радиоактивности внешней среды. С
увеличением влажности воздуха нарастает число тяжелых ионов за счет
рекомбинации ионов с каплями влаги. Понижение атмосферного давления, увеличение
температуры воздуха способствуют выходу из почвы эманации радия, что приводит к
увеличению количества легких ионов.
Существенное влияние на ионизацию воздуха оказывает степень загрязнения
атмосферного воздуха. Если в 1 мл загородного воздуха содержится легких ионов
обоих зарядов около 1000, то в курортных местностях содержание легких ионов
составляет 2000-3000 в 1 мл, то в воздухе промышленных городов их число
уменьшается до 40 в 1 мл.
В воздухе закрытых животноводческих помещений, особенно с недостаточным
уровнем воздухообмена практически нет легких отрицательных аэроионов, и
здоровый организм получает их главным образом за счет электроэффлювиальной
функции мерцательного эпителия. Однако, в случае, когда животное заболело
респираторным заболеванием, эта функция резко снижается и наступает гипоксемия
организма. В связи с этим в промышленных комплексах респираторные болезни
протекают тяжело, лекарственные препараты оказываются малоэффективными, а
вакцинации животных не достигают желаемой цели.
Гигиеническое значение аэроионизации в животноводстве заключается в
действии легких отрицательных ионов кислорода на нейрогуморальную регуляцию
физиологических функций через слизистые оболочки дыхательных путей и кожу. В
дыхательных путях аэроионы повышают или понижают возбудимость легочных
интерорецепторов, передавая соответствующие сигналы через центры головного
мозга к внутренним органам. Аэроионы проникая через стенку альвеол в кровь,
отдают свои заряды ее коллоидам и клеточным элементам. Вследствие этого при
вдыхании отрицательных ионов заряженность кровяных коллоидов увеличивается, а
при вдыхании положительных ионов уменьшается. Кроме того, ионизированный воздух
непосредственно влияет на организм животных (особенно свиней) через рецепторы
кожи, а косвенно через нервные окончания верхних дыхательных путей, вызывая ряд
физиологических реакций в организме (расширение капилляров, выход эритроцитов
из депо, повышение нейроэндокринной регуляции обменных процессов в клетках и
тканях).
Многочисленными опытами на животных установлено, что искусственно
ионизированный воздух отрицательной полярности в определенных концентрациях
способствует улучшению обмена веществ, повышению аппетита и усвояемость корма
животными, быстрому росту и развитию молодняка. Так, по данным В.М. Юркова у
коров под влиянием отрицательно заряженных ионов (концентрация -170…440 тыс. в
1 см2 воздуха, экспозиция - 15 мин., 1,5ч три раза в сутки на протяжении 60
дней, а затем 3…6 ч в течение 30 дней) отмечена лучшая поедаемость кормов и
повышение среднесуточных удоев на 0,5-0,6 л. Молоко обладало более высокими
бактерицидными свойствами и имело меньше кислотность по сравнению с
контрольными животными. Под действием ионизированного воздуха повышается
половая активность быков-производителей, улучшается биохимический и
морфологический состав крови, усиливается легочной обмен. Все это способствует
увеличению концентрации, переживаемости спермиев и их оплодотворяющей
способности. Также установлено, что лёгкие отрицательные аэроионы оказывают
благоприятное действие на молодняк крупного рогатого скота. У телят повышается
поедаемость кормов, усвояемость питательных веществ - протеина, безазотистых
экстрактивных веществ, кальция и фосфора. Также отмечается увеличение
содержания в крови: общего белка в крови на 28,9-34,5 %; титра антител и
фагоцитарного индекса на 0,29-0,49; гаммаглобулинов на 3,76-4,04 %; гемоглобина
5 г/л; эритроцитов на 495 тыс. После двухмесячного эксперимента живая масса
телят была выше по сравнению с контрольными на 4,2 кг (Н.М. Хренов, 1994).
По данным С.С. Абрамова (1989) при ежедневном обогащении воздуха
телятника легкими отрицательными аэроионами в течении 6 ч, при концентрации
аэроионов 9х104-15х104 в 1 см3 воздуха, установлено снижение заболеваемости
телят бронхопневмонией на 25-30 % по сравнению с контрольными группами, которые
не подвергались сеансам аэроионизации.
Аналогичная закономерность прослеживается в воздействии отрицательных
ионов на свиней. Так, у животных подвергавшихся аэроионизации отмечалось повышение:
бактерицидной активности сыворотки крови на 3,5 %, лизоцимной активности 5,8 %
и фагоцитарной на 6,2 %. В сыворотке крови возрастало также содержание общего
белка на 0,42-0,58 %, в основном за счёт гаммаглобулиновой фракции. При этом у
свиноматок повысилась молочность на 4,5 -6,2 %, сохранность поросят на 6-8 %,
прирост живой массы на 5,6-8,4 %. Поросята при этом были более подвижными,
имели лучший аппетит, интенсивней росли и развивались.
Искусственно ионизированный воздух оказывает существенное влияние и на
лошадей. У них повышается температура кожного покрова, учащается пульс и
дыхание, раньше наступает и быстрее протекает линька, изменяется
иммунобиологическая реактивность крови. Так, у лошадей подвергавшихся сеансам
аэроионизации отмечалось увеличение бактерицидной активности сыворотки крови на
6,5-10 %, лизоцимной активность на 10,6 % и активности фагоцитоза на 10,7 %.
Подобные изменения под влиянием ионизации воздуха отмечены в организме у
сельскохозяйственной птицы. Так, отмечено увеличение активности фагоцитоза:
фагоцитарной активности псевдоэозинофилов до 141 %, фагоцитарного индекса до
126 % и увеличение феномена нарастания антител, т.е. возрастание титра реакции
гемагглютинации (РЗГА) от 70 до 135 %. У молодняка птицы отмечено увеличение общего
белка на 26 мг/мл; лизоцима 2,7 %, фагоцитарного индекса 0,27, а также
уменьшается заболеваемость колибактериозом на 41 % (Н.М. Хренов, 1994).
Поэтому в профилактических целях ряд авторов (А.Д. Белов, И.М. Беляков,
В.А. Лукьяновский, 1983; Н.М. Хренов, 1994; А.А. Кузнецов, 1998; В.А. Васяев,
1998; А.Ф. Кузнецов, 2003; Т.В. Соляник, 2003 и др.) рекомендует следующие
концентрации легких отрицательных ионов и наиболее оптимальные режимы
ионизации:
·
телята до
месячного возраста - 200-300 тыс. аэроионов в 1 см3 воздуха с ежедневной
ионизацией 6-8 ч; глубокостельные коровы - 200 тыс/см3 в течение 15-20 дн. по
6-8 ч/сут; быки-производители - 250 тыс/см3 ежедневно в течение 2 мес. по 8-10
ч, перерывы на 20-30 дн.;
·
поросята-сосуны -
300-400 тыс/см3; поросята-отъемыши - 350-450 тыс/см3; взрослые свиньи - 400-500
тыс/см3 (сеансы проводят 3 раза в сутки по 30 мин в течение 3-4 нед. и
повторяют через месяц);
·
цыплята
3-60-суточного возраста - 25тыс/см3 в сутки 1-3 ч с перерывом на 1 ч; через
каждые 5 сут. ионизации 5 сут. пауза; бройлеры -соответственно 60-70 тыс/см3,
0,5-3, один раз, 2-3, 7-5; куры-несушки - 100-250 тыс/см3, 4-8, 9-12, 30 и 30.
Однако при проведении сеансов аэроионизации следует учитывать, что
высокие концентрации аэроионов (свыше 400-700. тыс./см3) вызывают у животных
угнетение, одышку и даже отёк легких. Особенно при резко выраженной сердечной
недостаточности и гнойных формах пневмонии. Для измерения концентрации
аэроионов в воздухе следует использовать специальные приборы, так называемые -
счетчиками ионов: ИТ-6914, СИ-1, САИТГУ-66 ИДР.
Таким образом, значение ионизации воздушной среды животноводческих
помещений заключается в непосредственном стимулировании организма животных
легкими отрицательными аэроионами газов воздуха, а также в косвенном действии
на организм за счет снижения запыленности, микробной загрязненности воздуха,
аммиака, т.е. улучшения микроклимата помещений. Так как, установлено, что
аэроионизация воздуха в 2-4 раза снижает количество аммиака, пыли и
микроорганизмов, на 5-8 % - относительную влажность воздуха. Снижение пыли
объясняется тем, что пылевые частицы под воздействием аэроионов значительно
увеличивают свой заряд и величину вследствие чего быстро оседают. Снижение
микроорганизмов, по видимому, происходит из-за блокирования аэроионами
ферментной системы микробной клетки, вследствие чего клетка потребляет меньше
кислорода и выделяет больше углекислоты. Такая клетка лучше фагоцитируется
лейкоцитами в крови (Ярощенко В.А., 1965; Н.М. Хренов, 1994).
2. Влияние микроклимата на естественную резистентность организма животных
.1 Современное представление о естественной резистентности организма
животных
Устойчивость организма к действию различных неблагоприятных факторов
внешней среды: физических, химических, биологических, технологических и др., во
многом зависит от состояния естественной резистентности и иммунной
реактивности. Большинство средств защиты, которыми располагает организм
животных, являются неспецефическими. Они в одинаковой степени действуют на
любого паразита. В противоположность этому специфический иммунитет, в основе
которого лежит иммунная реактивность организма, направлен только строго против
специфического антигена как экзогенного так и эндогенного происхождения,
угрожающего сохранению гомеостаза организма.
Под неспецифической резистентностью организма понимают его способность
противостоять воздействию различных факторов внешней среды (С.И. Плященко, В.Т.
Сидоров, 1979; И.А. Болотников, 1982; Г.А. Соколов, 1998 и др.). Естественная
резистентность животного организма находится в тесной связи с его
реактивностью. Последняя характеризуется способностью организма отвечать на те
или иные раздражения, следующие из окружающей среды. Ответные реакции организма
животных и птиц на внедрение микроба или продуктов его жизнедеятельности,
называют иммунологической реактивностью.
По данным многих авторов (З.В. Ермольева, 1965; Ф. Бернет, 1971; О.В.
Бухарин, Н.В. Васильев, 1974; У. Дж. Герберт, 1974; Э. Купер, 1980 и др.), при
попадании во внутреннею среду организма возбудителей различных инфекционных и
инвазионных патологий, появлению специфических антител и других специфических
иммунных агентов, предшествует продолжительный индуктивный период. Факторы
неспецифической резистентности довольно сильны и немедленные по типу своего действия,
и в течение индуктивного периода препятствуют размножению и распространению
чужеродного для организма агента.
Состояние ественной резистентности животных определяют неспецифические
защитные факторы организма, которые зависят от видовых, породных, констутиционных
и возрастных особенностей организма, обмена веществ, температуры тела,
состояния кожных и слизистых покровов - как механической преграды для
микроорганизмов и паразитов, кислой реакции секрета кожных желез, наличия
кислой среды содержимого желудка и его ферментов, присутствия в крови,
жидкостях и тканях фагоцитов (микро- и макрофагов), лизоцима, комплемента,
пропердина, интерферона, бета-лизинов, С-реактивного белка и других ингибиторов
инфекционного начала (Ф.Б. Хатт, 1963; З.В. Ермольева, 1965; Ф. Бернет, 1971;
О.В. Бухарин, Н.В. Васильев, 1974; У.Дж. Герберт, 1974; Э. Купер, 1980; Р.В.
Петров, 1982; Д.Ф. Осидзе, А.П. Простяков, 1983;В.М. Митюшников, Р.И. Варакина,
1984; А.П. Смирнов, С.А. Пигалев, 1985; A.J. Husband, 1988; S. Marina, C. Vior, M. Pop, 1988; A.R. Reddy, P.R. Reddy, 1988; С.А. Пигалев, В.М. Скорляков,
1989; В.Н. Сюрин, Р.В. Белоусова, Н.В. Фомина, 1991; А.Ройт, 1991; V. Asensi, J. Fierer, 1991; Г.А. Соколов, 1998 и др.).
Во многом состояние естественной резистентность зависит от условий
кормления, содержания и технологии содержания животных и птицы (С.И. Плященко,
В.Т. Сидоров, 1979; В.М. Митюшников, 1985; С.С. Абрамов, А.Ф. Могиленко, А.И.
Ятусевич, 1989; В.М. Юрков, 1991; Г.А. Соколов, 1998 и др.).
.2 Клеточные факторы защиты
Одним из клеточных факторов защиты организма является фагоцитоз. Впервые
явление фагоцитоза было изучено русским ученым И.М. Мечниковым в 1883 году. Им
было установлено, что фагоцитоз - это врожденная реакция организма, которая
проявляется в способности клеток (фагоцитов) захватывать и переваривать
проникающие в тело животного инородные частицы, в том числе и микроорганизмы.
Ответная реакция организма на внедрение в него микроорганизмов и чужеродных
корпускулярных частиц выражается в поглощении и переваривании их фагоцитами,
главным образом лейкоцитами. Микроорганизмы, захваченные лейкоцитами, могут
подвергаться полному внутриклеточному перевариванию (завершенный фагоцитоз),
выталкиванию из лейкоцитов обратно в окружающую среду или активно размножаться внутри
лейкоцитов (незавершенный фагоцитоз). В последнем случае фагоцитоз приобретает
негативное значение для организма, так как микробы не только остаются живыми,
но сохраняют свои способности к размножению (В.Е. Пигаревский, 1978; Я. Карр,
1978; Э. Купер, 1980; С.А. Пигалев, В.М. Скорляков, 1989; R.E. Price, J.V. Templeton, R.D. Smith, L.D. Adams, 1990; G.Trinchieri, M. Kubin, G. Bellone, M.A.
Cassatella, 1993).
У сельскохозяйственных животных и других высших животных фагоцитарной
способностью обладают клетки мононуклеарной системы. При этом наибольшей
фагоцитарной активностью и большой подвижностью обладают нейтрофилы (А.Д. Адо,
1961; В.М. Юрков, 1991). В их цитоплазме содержится лизоцим, лейкин - вещества,
которые обладают бактерицидными свойствами, а также ряд других ферментов, таких
как оксидаза, пероксидаза, кислая и щелочная фосфотаза, липаза и др., благодаря
этим ферментам происходит разрушение и переваривание микробов и различных
антигенов (В.Е. Пигаревский, 1978; Я. Карр, 1978; И.А. Болотников, В.С. Михкиева,
Е.К. Олейник, 1983; С. Коена, П.А. Уорд, Р.Т. Мак-Класки, 1983; Н. Грин, У.
Стаут, Д. Тейлор, 1990; С.А. Пигалев, В.М. Скорляков, 1989; А. Ройт, 1991).
Помимо нейтрофилов фагоцитарной активностью обладают моноциты, так как их
цитоплазма содержит большое количество лизосом, имеющих набор различных
гидролитических ферментов, что обеспечивает им высокую фагоцитарную активность
(Ф. Бернет, 1964; Ф. Бернет, 1971;Я. Карр, 1978; Н.А. Жарикова, 1979; И.А.
Болотников, В.С. Михкиева, Е.К. Олейник, 1983).
Фагоцитарной активностью обладают также и эозинофилы, так как они
содержат лизоцимные ферменты, однако фагоцитарные реакции у них выражены
слабее. Они участвуют в аллергических и воспалительных процессах, где играют
регуляторную роль (А.Д. Адо, 1961; Ф. Бернет, 1971; М.С. Жаков, И.М. Карпуть,
А.И. Кривутенко, Л.П. Вель, 1980; И.А. Болотников, В.С. Михкиева, Е.К. Олейник,
1983; Е.Н. Горышина, О.Ю. Чага, 1990; А. Ройт, 1991).
Фагоцитарная активность лейкоцитов во многом определяет защитные свойства
организма. Она может изменяться в зависимости от возраста, физиологического
состояния, условий содержания и т.д. (И.А. Болотников, Ю.В. Соловьев, 1980).
Так, по данным С.И. Плященко, А.Ф. Трофимова, (1979), С.С. Абрамова (1990) в
первые месяцы жизни телят клеточные факторы естественной резистентности
выполняют в этот период основную защитную функцию в организме. С возрастом по
мере становления гуморальных механизмов резистентности активность клеточных
факторов снижается. Аналогичная тенденция отмечена у поросят: в становлении
защитных механизмов, у которых выделяют два периода. В начале первого периода
(с 1 по 20-й день жизни) хорошо выражены клеточные факторы защиты. Второй
период (с 20 по 60-й день) наоборот характеризуется постепенным снижением
клеточных факторов и дальнейшем повышением гуморальных механизмов защиты:
увеличение титра нормальных агглютининов, комплементсвязывающей активности
сыворотки крови, повышение содержания общего белка и гаммаглобулинов.
Формирование механизмов резистентности у ягнят сходны с таковыми у телят (С.С.
Абрамов, 1990).
Лейкоциты неодинаково фагоцитируют различные виды микроорганизмов. У птиц
нет нейтрофилов, их функцию выполняют псевдоэозинофилы. Фагоцитарной
активностью у птиц обладают псевдоэозинофилы, моноциты, тромбоциты и эозинофилы
(И.А. Болотников, Ю.В. Соловьев, 1980; G.I. Gleick, 1977; W.H. Grover, H.H. Winklor, 1978).
По данным М.П. Бабиной (2002) в становлении клеточных иммунных механизмов
защиты у цыплят-бройлеров отмечены определённые критические периоды. Они
проявляются некоторым снижением клеточных иммунологических факторов через три
дня после вывода цыплят и особенно снижаются в 12-28- дневном возрасте. В
первый период снижение клеточных факторов иммунной защиты компенсируется
усилением всех показателей фагоцитарной активности псевдоэозинофилов. Во второй
критический иммунологический период - возрастной иммунный дефицит происходит
уменьшение уровня всех популяций лимфоцитов и снижается фагоцитарная активность
псевдоэозинофилов. В критические иммунологические периоды наблюдается повышение
заболеваемости цыплят желудочно-кишечными болезнями и гиповитаминозами группы
В.
Таким образом, состояние фагоцитарной активности лейкоцитов отражает
уровень клеточной защиты организма от микроорганизмов.
.3 Гуморальные факторы защиты
Большая роль в поддержании высокого уровня защитных сил организма
отводиться гуморальным факторам защиты. Известно, что свежеполученная кровь
сельскохозяйственных животных обладает способностью сдерживать рост
(бактериостатическая способность) или вызывать гибель (бактерицидная
способность) микроорганизмов. Эти свойства крови и ее сыворотки обусловлены
содержанием таких веществ, как лизоцим, комплемент, пропердин, интерферон,
бактериолизины, монокины, лейкины и некоторых др. (С.И. Плященко, В.Т. Сидоров,
1979; В.М. Митюшников,1985; С.А. Пигалев, В.М. Скорляков, 1989).
Лизоцим (мурамидаза) - это универсальный защитный фермент, который
содержится в слезах, слюне, носовой слизи, секрете слизистых оболочек,
сыворотке крови и эстрактах полученных из различных органов и тканей (З.В.
Ермольева, 1965; У.Дж. Герберт 1974; В.Е. Пигаревский, 1978; И.А. Болотников,
1982; С.А. Пигалев, В.М. Скорляков, 1989; P.S. Gwakisa, U.M. Minga, 1992). Наименьшее количество лизоцима содержится в
скелетных мышцах и мозге (О. В. Бухарин, Н.В. Васильев, 1974). Много лизоцима в
белке яиц кур (И.А. Болотников, 1982; А.А. Сохин, Е.Ф. Чермушенко, 1984). Титр
лизоцима крови кур имеет достоверную связь с титром лизоцима белка яиц (В.М.
Митюшников, Т.А. Кожаринова, 1974; В.М. Митюшников, 1980). Высокая концентрация
этого фермента отмечена в органах, которые выполняют барьерные функции: печени,
селезенке, легких, а также фагоцитах. Лизоцим устойчив к нагреванию
(инактивируется при кипячении), обладает свойством лизировать живые и убитые, в
основном грамположительные микроорганизмы, что объясняется разным химическим
строением поверхности бактериальной клетки. Противомикробное действие лизоцима
объясняют нарушением им мукополисахаридной структуры бактериальной стенки,
вследствие чего клетка лизируется (П.А. Емельяненко, 1987; Г.А. Грошева, Н.Р.
Есакова, 1996).
Кроме бактерицидного действия, лизоцим оказывает влияние на уровень
пропердина и фагоцитарную активность лейкоцитов, регулирует проницаемость
мембран и тканевых барьеров. Этот фермент вызывает лизис, бактериостаз,
агглютинацию бактерий, стимулирует фагоцитоз, пролиферацию Т- и В-лимфоцитов,
фибробластов, антителооброзование. Основным источником лизоцима являются
нейтрофилы, моноциты и тканевые макрофаги (У.Дж. Герберт 1974; О. В. Бухарин,
Н.В. Васильев, 1974; Я.Е. Коляков, 1986; В.А. Медведский, 1998).
По данным А.Ф. Могиленко (1990), содержание лизоцима в сыворотке крови
является важным показателем, характеризующем состояние неспецифической
реактивности и защитных сил организма.
В свежей сыворотке крови имеется многокомпонентная ферментативная система
комплемента, которая играет важную роль в удалении антигена из организма путем
активизации гуморальной системы иммунитета. В систему комплемента входят 11
белков, которые обладают различной ферментативной активностью и обозначаются
символами от С1 до С9. Основная функция комплемента - лизис антигена.
Существует два пути активации (самосборки) системы комплемента - классический и
альтернативный. В первом случае главным является комплекс антиген - антитело,
во втором (альтернативном) не требуются для активации первые компоненты
классического пути: С1, С2 и С4 (Ф. Бернет, 1971; И.А. Болотников, 1982; Я.Е.
Коляков, 1986; А. Ройт, 1991; В.А. Медведский, 1998).
Система комплимента принимает непосредственное участие в неспецифическом
комплементарном лизисе клеток - мишеней, особенно пораженных вирусами,
хемотаксисе и неиммунном фагоцитозе, антителозависимом комплиментарном лизисе,
спецефическом антителозависимом фагоцитозе, цитотоксичности сенсибилизированных
клеток. Отдельные компоненты комплемента или их фрагменты играют важную роль в
регуляции проницаемости и тонуса сосудов кровяного русла, влияют на систему
свертывания крови, принимают участие в выделении клетками гистамина (Ф. Бернет,
1971; С.А. Пигалев, В.М. Скорляков, 1989; А. Ройт, 1991; P. Benhaim, T.K. Hunt, 1992;
И.М. Карпуть, 1993).
Естественные (нормальные антитела) содержатся в небольших титрах в
сыворотке крови здоровых животных, не подвергшихся специальной иммунизации.
Природа этих антител до конца не выяснена. Считают, что они возникают в
результате перекрестной иммунизации или в ответ на внедрение в организм
незначительного количества инфекционного возбудителя, которое не способны
вызвать острое заболевание, а вызывает лишь латентную или подострую инфекцию
(У.Дж. Герберт, 1974; С.А. Пигалев, В.М. Скорляков, 1989). По данным П.А.
Емельяненко (1987), естественные антитела целесообразней рассматривать в
категории иммуноглобулинов, синтез которых происходит в ответ на антигенное
раздражение. Содержание естественных антител в крови отражает степень зрелости
иммунокомпитентной системы организма животных. Снижение титра нормальных
антител происходит при многих патологических состояниях. Вместе с комплементом
нормальные антитела также обеспечивают бактерицидную активность сыворотки
крови.
Гуморальным фактором естественной резистентности является, также
пропердин или точнее система пропердина (Я.Е. Коляков, 1986). Название
пропердин происходит от лат. pro и perdere - подготавливать к разрушению.
Система пропердина играет важную роль в естественной неспецифической
устойчивости животного организма. Пропердин содержится в свежей нормальной
сыворотке крови в количестве до 25 мкг/мл. Это сывороточный белок мол. массой
220000, который обладает бактерицидностью, способен нейтрализовать некоторые
вирусы. По данным Я.Е. Колякова, (1986); С.А. Пигалева, В.М. Скорлякова (1989);
Н.А. Радчука, Г.В. Дунаева, Н.М. Колычева, Н.И. Смирновой (1991) бактерицидная
активность проявляется не за счет самого пропердина, а системы пропердина,
которая состоит из трех составных частей: 1) пропердина - белка сыворотки, 2)
ионов магния, 3) комплемента. Таким образом пропердин не действует сам по себе,
а совместно с другими факторами, содержащимися в крови животных, в том числе с
комплементом.
Интерферон - это группа белковых веществ, продуцируемых клетками
организма и препятствующие репродукции вируса. Индукторами образования
интерферона помимо вирусов являются бактерии, бактериальные токсины, мутагены и
др. В зависимости от клеточного происхождения и индуцирующих его синтез
факторов различают a-интерферон, или
лейкоцитарный, который продуцируется лейкоцитами и В-интерферон, или
фибробластный, который продуцируется фибробластами. Оба эти интерферрона
отнесены к первому типу и продуцируются при обработке лейкоцитов и фибробластов
вирусами и другими агентами. Иммунный интерферон, или y-интерферон, который продуцируется лимфоцитами и макрофагами,
активированными не вирусными индукторами (У.Дж. Герберт 1974; З.В. Ермольева,
1965; С.А. Пигалев, В.М. Скорляков, 1989; Н.А. Радчук, Г.В. Дунаев и др.,1991;
А. Ройт, 1991; P.S. Morahan, A. Pinto, D.
Stewart, 1991; И.М. Карпуть, 1993; S.C. Kunder, K.M. Kelly, P.S. Morahan, 1993).
Помимо выше перечисленных гуморальных факторов защиты, важную роль играют
такие как, бета-лизины, лактоферрин, ингибиторы, С-реактивный белок и др.
Бета-лизины - это белки сыворотки крови, обладающие способностью
лизировать некоторые бактерии. Они действуют на цитоплазмотическую мембрану
микробной клетки, повреждая ее, тем самым вызывая лизис клеточной стенки
ферментами (аутолизинами), расположенными в цитоплазмотической мембране,
активируемыми и освобождаемыми при взаимодействии бета-лизинов с
цитоплазмотической мембраной. Таким образом, бета лизины вызывают
аутолитические процессы и гибель микробной клетки.
Лактоферрин - негиминовый гликопротеид, обладающий железосвязывающей
активностью. Он связывает два атома трехвалентного железа, тем самым
конкурирует с микробами и подавляет их рост.
Ингибиторы - неспецифические противовирусные вещества, содержащиеся в
слюне, сыворотке крови, секретах эпителия дыхательного и пищеварительного
трактов, экстрактов разных органов и тканей. Они обладают способностью
подавлять активность вирусов вне чувствительной клетки, при нахождении вируса в
крови и в жидкостях. Ингибиторы подразделяют на два класса термолабильные
(теряющие активность при нагревании 60-62 0С в течение часа) и термостабильные
(выдерживают нагревание до 100 0С) (О.В. Бухарин, Н.В. Васильев, 1977; В.Е.
Пигаревский, 1978; С.И. Плященко, В.Т. Сидоров, 1979; И.А. Болотников, 1982;
В.Н. Сюрин, Р.В. Белоусова, Н.В. Фомина, 1991; Н.А. Радчук, Г.В. Дунаев, Н.М.
Колычев, Н.И. Смирнова, 1991).
С-реактивный белок его находят при острых воспалительных процессах и
заболеваниях, сопровождающихся тканевыми деструкциями, так как он может служить
показателем активности этих процессов. В нормальной сыворотке этот белок не
определяется. С-реактивный белок обладает способностью инициировать реакции
преципитации, аглютинации, фагоцитоза, связывания комплементов, т.е. имеет
функциональные черты, сходные с иммуноглобулинами. Кроме того, этот белок
повышает подвижность лейкоцитов (У.Дж. Герберт 1974; С.С. Абрамов, А.Ф.
Могиленко, А.И. Ятусевич, 1988; А. Ройт, 1991).
.4 Микроклимат и естественная резистентность животных
В процессе своего развития организм сельскохозяйственных животных
подвергается постоянному воздействию самых различных факторов внешней среды. К
их числу относятся климатические особенности, космические излучения, условия
обитания (технология содержания, плотность посадки, величина групп, микроклимат
помещения и др.). Одним из важнейшим факторов является воздушная среда, так как
в ее окружении организм животных находится постоянно. Воздушная среда - это
сложный комплекс взаимосвязанных и взаимодействующих факторов. Непосредственное
влияние воздушной среды на организм животных объясняется воздействием на обмен
веществ, тепло - и газообмен, физические свойства крови, морфологический и
биохимический состав ее, температуру кожи и др. В конечном итоге это
сказывается на состоянии здоровья животных, естественной устойчивости их к
различным заболеваниям и на их продуктивности (С.И. Плященко, В.Т. Сидоров,
1979; В.М. Митюшников, 1985; В.М. Юрков, 1991).
По данным С.И. Плященко, В.Т. Сидорова, А.Ф. Трофимова (1990)
устойчивость организма животных к заболеваниям во многом зависит от состояния
микроклимата, формирующегося под влиянием воздухообмена. Воздухообмен при
плохой вентиляции является причиной хронического недостатка кислорода в
организме животных. Концентрация вредно действующих газов также находиться в
прямой зависимости от величины воздухообмена. Так, значительный интерес
представляли показатели защитных сил организма телят. Наиболее высокий уровень
гаммоглобулинов отмечался у телят при интенсивности воздухообмена 35 м3/ч, по
сравнению с подачей воздуха в объёме 12, 25 и 50 м3/ч. Фагоцитарная активность
лейкоцитов была более высокой у телят при интенсивности воздухообмена 20 и 35
м3/ч, по сравнению 12 и 50 м3/ч. При очень высоком уровне воздухообмена (50
м3/ч и выше), отмечалось снижение активности фагоцитоза. Аналогичная
закономерность была отмечена в показателях бактерицидной и лизоцимной
активности сыворотки крови. Следовательно, показатели клеточных и гуморальных
факторов защиты организма при повышении уровня воздухообмена увеличивались. В
помещениях где уровень воздухообмена был низким или повышенным отмечалось
увеличение заболеваемости животных желудочно-кишечными и респираторными
заболеваниями.
Исследованиями С.В. Савченко (2001) установлено, что у свиней
подверженных заболеванию балантидиозом и не подвергавшихся химиопрофилактике,
отмечалось снижение среднесуточных приростов на 36,6 г (19,7 %) и повышение
клинического проявления болезни на 50 %, по сравнению с животными содержащихся
в условиях нормативного микроклимата. При улучшении микроклимата путем обогрева
источниками инфракрасного облучения предупреждало снижение естественной
резистентности организма в первые дни после отъёма поросят от свиноматок и
наблюдалось более позднее (на 5 дней) естественное заражение животных. Таким
образом, улучшение условий микроклимата способствовал постепенной выработке у
поросят устойчивости к повторной инвазии, поэтому болезнь и проявлялась в менее
выраженной форме.
По данным Г.А. Соколова (1998) Наибольший отход ягнят происходит в первые
дни после рождения, особенно при отсутствии искусственного обсушивания
новорожденных, что связано с развитием у них гипотермии и снижением температуры
тела до 34-350С из-за потерей тепла организмом на испарение 250-300 г влаги с
поверхности тела, на что расходуется 600-750 кДж внутренней энергии организма (
ягненка романовской породы). При этом снижается общая устойчивость организма:
уменьшается количество гемоглобина на 9% и эритроцитов на 6%, снижается
бактерицидная активность сыворотки крови и фагоцитарная активность лейкоцитов
на 34%, а фагоцитарное число на 14%.
По данным С.И. Плященко, А.Ф. Трофимов (1985) оптимизация микроклимата за
счёт подогрева приточного воздуха и увеличения воздухообмена до 28-30 м3/ч в
переходный период и 14,5-17 м3/ч на 1 ц живой массы зимой оказывало
положительное влияние на состояние естественных защитных сил организма коров.
Бактерицидная активность сыворотки крови повысилась на 8,9-23,6 %,
комплементарная на 8, лизоцимная на 4,9-10,7 %. Возрастала также активность
клеточных факторов защиты организма. Обеспечение оптимального микроклимата
способствовало снижению заболеваемости коров на 4,0-8,5 %, сокращению сервис -
периода на 6,0-9,6%, числа заболеваний телят, полученных от этих коров на
8,0-9,5%, повышению молочной продуктивности на 6,6-8,1%.
Опыт эксплуатации птицефабрик показывает, что в стадах кур более
распространены не острозаразные, а такие инфекционные и незаразные болезни,
которые возникают на фоне снижения уровня естественной резистентности
организма. Снижение уровня естественной резистентности организма - основной
признак, позволяющий определить наличие той или иной патологии (В.М.
Митюшников, Р.И. Варкина, 1984).
Исследованиями В. Митюшникова, Н. Кравченко (1983), установлено, что
системы вентиляции и отопления в птичниках не обеспечивали необходимый
микроклимат в зимний и переходный периоды года. В результате неравномерного
распределения воздуха в помещениях наблюдались застойные зоны, большой перепад
температуры и влажности, повышенная запыленность, загазованность, бактериальная
обсемененность воздуха и оборудования. Ухудшение микроклимата отрицательно
сказывалось на естественной резистентности кур - несушек, так у них отмечались
достоверное снижение лизоцимной активности и содержания общего белка в
сыворотке крови. Уменьшение гамма - глобулиновой фракции белка сопровождалось
увеличением альбуминовой. Процент псевдоэозинофилов в лейкоцитарной формуле
снизился, а лимфоцитов повысился. Отмечалось также снижение яйценоскости на
2,5-3,4% в зимний и переходный периоды года по сравнению с летним.
Исследованиями Е. Евглевской, М. Найденского (1995), установлено, что у
ремонтного молодняка кур, выращиваемого в многоярусных клеточных батареях при
общепринятом дифференцированном световом режиме (ОНТП 4-88), отмечалось
снижение показателей гемоглобина, эритроцитов на 9,0 и 11,4% (Р<005),
бактерицидной и лизоцимной активностям сыворотки крови на 14,3 (Р<005) и
14,6 (Р<005), чем у птицы, находящей в режиме варьирующего освещения от 10-
15 до 0,1-0,2 лк через каждые 60-70 минут. В птичнике, где птица находилась в
режиме прерывистого освещения падеж снизился почти в двое, а сохранность была
на 9-10% выше по сравнению с птичником, где птица находилась в общепринятом
режиме освещения.
По данным Т.В. Кракосевич (1990), при использовании ритмично-
варьирующего светового режима (от 25 до 1 лк, через каждые 40-50 мин освещения)
при выращивании бройлеров, позволили существенно повысить показатели
естественной резистентности и продуктивность. Так, показатели гемоглобина и
эритроцитов крови на 1,8-2,6%, общего белка на 1,4-2,5%, фагоцитарной
активности лейкоцитов на 2,2-3,8% и бактерицидной активности сыворотки крови на
2,1-3,7% превосходили птицу, содержащуюся при обычном световом режиме. Ритмично
- варьирующий режим освещения оказывал положительное влияние на сохранность
выращиваемого молодняка (на 1,2-2,1% выше) и продуктивность на 2,2-3,1% выше по
сравнению с птицей, содержащийся в обычном световом режиме.
Таким образом, микроклимат и естественная резистентность организма тесно
взаимосвязаны между собой, то есть чем лучше микроклимат, тем лучше
естественная резистентность организма и наоборот. Чем хуже микроклимат, тем
слабее естественная резистентность организма и следовательно происходит
наслоение условно-патогенной микрофлоры вызывая острое проявление болезни.
3. Застойные зоны воздуха (аэростазы) в животноводческих помещениях
Названный нами аэростаз (от лат. aer - воздух; греч. stasis - застой, неподвижность) - это зона
застоя воздуха в помещении, которая оказывает неблагоприятное влияние на
организм животных. Аэростаз чаще возникает в помещениях со сложным инженерным
оборудованием, которое оказывает значительное аэродинамическое сопротивление
или находится в неисправном состоянии, особенно при многоярусном содержании
птицы в клеточных батареях, расположенных в разных соотношениях к приточным и
вытяжным воздуховодам.
Аэростазы возникают вследствие проектных, строительных и эксплуатационных
недостатков вентиляции в помещениях. Например, проектные недостатки возникают
вследствие недостаточного расчётного воздухообмена, неправильного соотношения
притока и вытяжки, неравномерной подачи свежего приточного воздуха в зону
расположения животных, монтаж воздуховодов одинакового диаметра и др.
Строительные недостатки возникают в период стройки или реконструкции помещения
если в нём устанавливают маломощные электровентиляторы, недостаточное
количество воздуховодов или отверстий в них, засорения воздуховодов
строительным мусором, особенно подпольных вытяжных труб и отверстий в них. К
эксплуатационным недостаткам относят: отсутствие или экономия электроэнергии и
периодическое отключение электровентиляторов, износ и выход со строя
вентиляционных агрегатов, скученное содержание животных, закупорка воздуховодов
гнёздами птиц, затопление подпольных вытяжек навозной жижей, стоками грунтовых
или дождевых вод, рециркуляция внутреннего воздуха выше допустимых пределов,
закольцованные движение воздуха по кругу в виде шара или вала внутри помещения.
Все эти вышеперечисленные недостатки помещений вызывают резкое снижение
качества микроклимата. В нем накапливается тепло, влага, углекислый газ и
клоачные газы, пыль и микрофлора в зависимости от степени аэростаза и
недостатка воздухообмена. Как правило, в аэростазе движение воздуха менее 0,1 м/с
кроме закольцованного движения или рециркуляции.
Аэростазы устанавливают бифлюгером или задымлением с составлением и
анализом внутренней аэрорумбограммы - графической записи направлений движения
воздуха в помещении (Г.А. Соколов, 1978; Г.А. Соколов, А.Н. Карташова, 1990;
Г.А. Соколов, 1998; Д.Г. Готовский, 1998).
4. Классификация аэростазов
В настоящее время аэростазы в зависимости от подачи и распределения
воздуха в животноводческие помещения мы подразделяем на следующие виды:
. Общий, т.е. застой воздуха во всем помещении, например, при
недостаточном общем воздухообмене помещения, при отсутствии притока или
вытяжки;
. Локальный - при неправильном воздухораспределении в помещении;
. Токсический - при отключении электроэнергии в птичнике и накоплении углекислоты,
при потере герметичности теплообменника в теплогенераторе и при попадании в
приточный воздух выхлопных газов,
. Гидростатический - при отсутствии вентиляции и 100% влажности воздуха в
помещении.
По степени влияния на организм животных аэростазы мы подразделяем на 3
степени:
-ая степень: снижение воздухообмена помещения на 20-30%, показатели
микроклимата близки к максимальным значениям гигиенических нормативов, а
животные не проявляют видимых клинических признаков какого либо заболевания, но
продуктивность достоверно снижена, например, при откорме бычков на 20-30% .
Такие аэростазы мы называем скрытыми, так как они не обнаруживаются при
проведении текущих исследований микроклимата. Такие аэростазы, как правило,
сопровождаются постепенным снижением естественной резистентности у животных и
возникновением единичных случаев заболеваний, вызванных в основном
условно-патогенной микрофлорой.
-ая степень: снижение воздухообмена на 30-50%, показатели микроклимата
значительно отличаются от нормы. Так, температура выше на 3-5 0С, влажность на
5-10%, аммиак в 1,5-2 раза, микробная обсеменённость в 2-3 раза. При этом
иммунный статус организма значительно ослаблен, хронические болезни обостряются
с явными клиническими признаками, а лекарственные препараты дают значительно
низкую эффективность. При этом у животных, находящихся в условиях аэростаза,
постоянно выделяются больные и исхудавшие, которые чаще в последствии
выбраковываются и идут на санитарный убой - это средний аэростаз.
-ая степень - жёсткий аэростаз, при нём воздухообмен снижен до 80% или
отсутствует вовсе. Микроклимат приобретает токсические свойства: температура
выше нормы на 5-10 0С и более, влажность близка к полному насыщению, аммиак в
3-4 раза превышает норматив, микробная обсемененность в 5-15 раз больше
нормативной. В таких условиях болезнь протекает в виде острой энзоотии только в
аэростазном помещении с характерной для острой инфекции картиной первичного
септического очага в дыхательных путях, в других помещениях её нет. В таких
случаях практические врачи иногда путаются в постановке диагноза и принимают её
как особо опасную инфекцию, например, чуму свиней, пастереллёз крупного
рогатого скота и др. Заболеваемость животных достигает в таких случаях до
50-80%, а отход иногда составляет 33%. Применяемые при этом лекарственные
препараты (сульфаниламиды и антибиотики) не дают лечебного эффекта. Однако они
восстанавливают своё действие на больных животных спустя 3-4 дня после
нормализации микроклимата в помещении. При вскрытии павших животных выделяется
условно-патогенная микрофлора.
Таким
образом, при проведении санитарной паспортизации животноводческих помещений
необходимо составлять внутреннею вертикальную и горизонтальную аэрорумбограмму
(графическую запись движения воздушных масс в помещении) при помощи задымления,
выявлять и ликвидировать аэростазы в различной степени отрицательно влияющих на
организм животных (Г.А. Соколов, Д.Г. Готовский, 2000).
Проблема равномерного распределения свежего приточного воздуха и
возникновения застойных микрозон является особенно актуальной для
птицеводческих помещений. Так, по данным А.К. Даниловой, М.С. Найденского, И.С.
Шпиц, В.С. Яворского (1987), во всех многоярусных батареях типа КБН в следствие
особенности конструкций на уровне всех ярусов, кроме верхнего внутри клетки
образуются застойные зоны с подвижностью воздуха ниже 0,05 м/с. В этих условиях
у птицы снижается возможность конвективных теплопотерь, что может провести к
нарушению теплорегуляции.
Исследованиями В.М. Селянского (1975); Ю.Н. Пчелкина, А.И. Сорокина
(1977), установлено, что в птичниках, где птица содержится в многоярусных
клеточных батареях, микроклимат претерпевает существенные перепады температуры,
влажности воздуха, концентрации аммиака и углекислого газа на разных ярусах.
Так, на каждом уровне имелись значительные отклонения параметров микроклимата
по всему помещению. Содержание вредных газов, пыли, микробных тел в большинстве
случаев значительно превышало нормы. В клетках с птицей наблюдалась
недостаточная подвижность воздуха, значительная запыленность и загрязненность
воздуха по сравнению с общей воздушной средой зала.
По данным Л.Л, Светловой, З.П. Федоровой, И.Д. Ещенко (1978); Б.Л.
Дубового, Л.В. Вергеренко (1978), вентиляция птичников со сквозным
проветриванием уступает системе с верхней подачей и нижней вытяжкой воздуха.
Температура в летние месяцы превышала норму на 8-10 С0, относительная влажность
на 14-24%, концентрация аммиака в средней и верхней зоне колебалась в пределах
нормы, в то время как у пола создавались мертвые зоны, где содержание аммиака в
среднем превышало норму в два раза. В этих застойных зонах количество
микроорганизмов достигает наибольшей величины (от нескольких сот тысяч до 1,5
млн. в 1 м3), содержание пыли и вредных газов в несколько раз превышает ПДК
относительно других зон птичника. Установлено, что гибель птицы находилась в
прямой зависимости от содержания аммиака и микробной обсемененности в
помещениях. Так, в одном из птичников в июне, где концентрация аммиака в ночное
время в 13 раз превышала норму, ежедневно погибало 4,5% птиц от общего
количества индюшат.
По данным В. Иваненко, М. Левыкина, А. Светличного (1993); Н.И.
Щербинина, Ю.Н. Щербинина (1998), минимальный воздухообмен в зимнее время
создает предпосылки к возникновению микрозон с застойным воздухом, в которых
создается повышенная концентрация воздушных вредностей. По их наблюдениям, в
таких зонах содержание аммиака увеличивается в 4-6 раз против тех зон, где
воздушные потоки продвигаются от приточных воздуховодов к вытяжным
вентиляторам.
По данным Б.Ф. Бессарабова (1983), даже при подаче и удалении из
помещения оптимального количества воздуха из-за нерационального его
распределения в цыплятнике образуются застойные зоны с высокой относительной
влажностью, повышенной концентрацией вредных газов и бактерий.
Исследованиями Н. Дьяконова, В. Тимофеева (1991), установлено, что
типовая вентиляция в сблокированных птичниках не обеспечивает равномерной
подачи приточного воздуха, вероятен возврат загрязненного воздуха с приточным,
неравномерное поступление подогретого воздуха в холодный период года, сложность
в обслуживании и малая надежность в работе вытяжных центробежных вентиляторов и
приточных отопительно - вентиляционных установок на кровле.
По данным Е.Н. Короткова (1987); В.В. Золотенкова, Г.Н. Бобылевой (1990),
в помещении птичника при исследовании микроклимата имели место перепады
температур на 6-8 0С, скорость движения воздуха ниже в 2 раза нормативно
допустимой, аммиака содержалось почти в 3 раза выше нормы, относительная
влажность составляла 30-40%, контаминация и запыленность воздуха в 4-5 раз выше
допустимых. Падеж птицы достигал 6 голов в сутки.
По данным В.И. Мельника, В.И. Мельника, Л.З. Поплавского, (1977), при
содержании птицы в четырехъярусных клеточных батареях, отмечались резкие
колебания микроклимата на уровне первых и четвертых ярусов. За три периода года
разность температур между первым и четвертым ярусом клеток составила 4,7 0С
(19,9 против 24,6). Относительная влажность на уровне четвертых ярусов была
ниже гигиенических норм. Скорость движения воздуха в клетках первого яруса
составляла 0,32, четвертого 0,24 м/с. Концентрация углекислого газа и аммиака в
четырехъярусных клеточных батареях только на уровне первых ярусов
соответствовала нормам, тогда как на уровне четвертых ярусов значительно превышала
их. Высокая концентрация газов на уровне четвертых ярусов клеточных батарей
объясняется недостаточной вентиляцией воздуха в этих местах. Данные
микроклимата свидетельствовали о том, что условия содержания кур - несушек в
четырехъярусных и одноярусных клеточных батареях существенно различались. Это
значительно влияло на продуктивность кур несушек. В зимний, переходные и летний
периоды яйценоскость 140 кур из клеток первых ярусов была на 73 яйца больше,
чем у кур из клеток четвертых ярусов. При этом вес яиц от кур, размещенных на
первых ярусах, был на 1,3-1,5 г выше, чем у кур из четвертых.
Исследованиями В.М. Гончаренко, Н.К. Резника (1992) установлено, что
вентиляционное оборудование в птичниках независимо от типа клеточных батарей в
летне-осенний период не обеспечивает оптимальный температурно - влажностный
режим, так температура воздуха превышала норматив на 5-7 С0, а относительная
влажность на 15-20%. Интенсивность освещения в зоне кормушек 4-х ярусных
клеточных батарей колебалась от 15-25 лк на первом ярусе до 120-150 лк на
четвертом. В 3-х ярусных клеточных батареях освещение было более выравненным: в
зоне кормушек на 1-2 ярусах - 65-75 лк, на 3-ем - 80-100 лк. Сохранность птицы
при содержании в каскадных батареях составила 95,4%, в контроле - 89,6%. Яйца,
полученные от несушек в контрольном и опытном птичниках, не имели по массе
существенных различий.
Нашими исследованиями воздухораспределения проведёнными на Витебской
бройлерной птицефабрике установлено, что непроизводительная работа вентиляторов
на притоке и вытяжке приводит к перерасходу энергоресурсов и нарушению
микроклимата в птичниках. Уменьшение подачи свежего воздуха за счет перекрытия
отверстия на притоке (во время снижения температуре в атмосфере) на 1/4 часть
способствовало уменьшению забора из внешней среды до 60,8%. Поэтому недостающий
воздух поступал из помещения. Такая непредвиденная рециркуляция нарушала
равномерность воздухораспределения в самом птичнике; так, в торцовых частях
здания воздух циркулировал по кругу, а в середине, и особенно около стен,
наблюдались аэростазные зоны, что приводило к недостаточности потребления
кислорода, снижению газообмена, нарушению физиологических функций в организме и
отходу цыплят.
Наши исследования, проведенные на птицефабрике им. Крупской г. Минска,
показали, что локальное состояние микроклимата в птичниках с клеточным
содержанием кур несушек в батареях ОБН при нормативном общем воздухообмене не
отвечает гигиеническим требованиям. Так, при составлении внутренней
аэрорумбограммы при помощи задымления, был выявлен аэростаз в середине
помещения, который характеризовался следующими параметрами микроклимата:
температура достигала 23,5 0С, относительная влажность 89%, подвижность воздуха
0,08 м/с, концентрация аммиака 17 мг/м3, содержание углекислого газа 0,5%,
содержание микробов 260 тыс. в м3 воздуха. Аэростазный микроклимат
способствовал повышенной выбраковке птиц от хронических респираторных
заболеваний (риниты, бронхиты, ларинготрахеиты и бронхопневмонии) на 11,1% по
сравнению с птицей, находящейся в условиях нормативного микроклимата в крайних
пристеночных рядах. Наблюдалось снижение яйценоскости у кур из зоны аэростаза
на 23%. С устранением аэростазного участка путем монтажа дополнительного
приточного воздуховода выбраковка птицы снизилась и восстанавливалась
яйценоскость. Из приведенных литературных данных следует, что аэростазы разной
степени по-разному оказывают отрицательное влияние на организм.
5. Воздухораспределение в животноводческих помещениях и его влияние на
микроклимат
Обобщая исследования, проведенные нами в различных животноводческих
помещениях, следует отметить, что равномерность распределение свежего
приточного воздуха по помещениям является решающим фактором формирования как
микроклимата в целом, так и возникновения в отдельных его участках аэростазов
внутри животноводческих построек. То есть возникновение аэростазов целиком и
полностью зависит от равномерности распределения свежего приточного воздуха.
6. Аэростазы в птичниках
Так, исследования воздухораспределения, проведенные в типовых птичниках
птицефабрик Беларуси, где птица содержится в продольно расположенных
трехъярусных клеточных батареях КБУ-3 с вентиляцией сверху - вниз в разные
сезоны года (зима, лето, переходные периоды) показали, что локальное состояние
микроклимата в отдельных частях помещений не соответствовало рекомендованным
гигиеническим стандартам. Так, в исследуемых птичниках в пристеночнах клеточных
батареях обнаружены участки локальных аэростазов, которые располагались на
верхних и средних ярусах, и занимали примерно две трети каждой пристеночной
клеточной батареи, что составляло около 30% от общего объема помещения.
Расчетный воздухообмен на кг ж. м. в холодный период года был 2-2,33 м3/ч и
превышал нормативный (0,75); а в теплый - 2,92-3,09 м3/ч, что значительно ниже
норматива (5,0). Таким образом, в разные периоды года расчетный воздухообмен
был примерно одинаковым. Так, в холодные периоды года он превышал установленный
норматив, а в теплые был ниже норматива, что являлось причинами пониженной
температуры в зимний период и повышенной в летний и весенний периоды внутри
птичников (табл. 1).
Выявленные аэростазы возникали вследствие механического сопротивления,
которое оказывали клеточные батареи, сама птица, опорные колонны и другие
механические и строительные конструкции струям поступающего в помещение свежего
приточного воздуха (рис.1). Причинами, способствующими возникновению
аэростазов, были значительная отдаленность приточных шахт естественной
вентиляции друг от друга, центральное расположение только одного приточного
воздуховода механической вентиляции (рис. 1).
Рис. 1 Внутренняя аэрорумбограмма птичников до реконструкции
- приточные шахты, 2 - приточный воздуховод, 3 - хорошо продуваемы
клеточные батареи, 4 - опорные колонны, 5 - вытяжные вентиляторы, А - участки
локального аэростаза крайних пристеночных клеточных батарей.
Основным признаком застоя воздуха (аэростаза) в птичнике являлись низкая
подвижность воздуха (менее 0,1 м/с) и несоответствие показателей микроклимата
гигиеническим нормативам. Так, в зимний период года в участке локального
аэростаза температура воздуха изменялась в пределах от 15 до 20оС и в целом
соответствовала нормативу. Остальные показатели микроклимата значительно
превышали гигиенические нормативы: относительная влажность на 10%; содержание
аммиака и углекислого газа в 1,25-2,0 раза; микробная обсемененность воздуха в
1,7-2,4 раза; уровень пылевой загрязненности воздуха в 1,5 раза. Скорость
движения воздуха была менее 0,1 м/с, что значительно ниже установленного
норматива - 0,2-0,3 м/с (см. табл. 1).
Таблица 1
Показатели микроклимата птичников в различные сезоны года
|
Показатели микроклимата
|
Зима
|
Весна
|
Лето
|
Осень
|
|
Опыт
|
Контроль
|
Опыт
|
Контроль
|
Опыт
|
Контроль
|
Опыт
|
Контроль
|
|
Температура, 0С
|
15,0-20,0 17,5
|
13,8-16,0 14,9
|
17,8-28,0 22,9
|
16,0-21,6 18,8
|
18,8-27,4 23,1
|
16,6-22,6 19,6
|
20,0-23,4 21,7
|
15,8-18,4 17,1
|
|
Относительная влажность, %
|
70-80 75
|
58-76 67
|
60,0-81,0 70,5
|
50-80 65
|
72-90 81
|
65,0-80,0 72,5
|
58-76 67
|
64-78 71
|
|
Подвижность воздуха, м/с
|
0,01-0,16 0,085
|
0,06-0,49 0,275
|
0,01-0,18 0,095
|
0,12-1,6 0,86
|
0,01-0,09 0,05
|
0,14-0,28 0,21
|
0,04-0,14 0,09
|
0,23-0,72 0,475
|
|
Аммиак, мг/м3
|
12,5-20,0 16,25
|
7,5-11,0 9,25
|
10-16 13
|
5,0-10,0 7,5
|
10,0-15,0 12,5
|
5,0-10,0 7,5
|
10,0-15,0 12,5
|
2,5-10,0 6,25
|
|
Углекислый газ, %
|
0,25-0,4 0,325
|
0,15-0,25 0,2
|
0,3-0,45 0,375
|
0,15-0,25 0,2
|
0,22-0,4 0,31
|
0,1-0,22 0,16
|
0,25-0,4 0,325
|
0,1-0,25 0,175
|
|
Микробная обсемененность,
тыс./м3
|
300,0-435,0 367,5
|
120-225 172,5
|
250-500 375
|
150-260 205
|
290-394 342
|
200-230 215
|
132,0-551,0 341,5
|
72,6-145,3 108,95
|
|
Пылевая загрязненность, мг/м3
|
4-6 5
|
2,0-3,5 2,75
|
8,5-12,0 10,25
|
1,5-3,2 2,35
|
6,0-10,5 8,25
|
0,9-2,6 1,75
|
9-11 10
|
2,6-3,9 3,25
|
Примечание: 1. Числитель - колебания, знаменатель - средняя величина.
. Опыт - зона аэростаза, контроль - участок нормального микроклимата.
В летний период исследований в участке аэростаза основные показатели
микроклимата также превышали гигиенические нормативы: температура воздуха на
9,4 градуса; относительная влажность на 20%; концентрация аммиака в 1,25 раза; содержание
углекислого газа в 1,55 раза; микробная обсемененность в 1,6-2,2 раза; уровень
пылевой загрязненности в 1,5-2,6 раза. Подвижность воздуха была ниже 0,1 м/с,
что значительно ниже гигиенического норматива - 0,3-0,6 м/с (см. табл. 1).
В переходные периоды основные показатели микроклимата в аэростазных зонах
также превышали гигиенические нормативы. Так, в весенний период показатели
микроклимата в аэростазной зоне были выше нормативов: температура воздуха на 10
градусов; относительная влажность на 11%; концентрация аммиака и углекислого
газа в 1,3 и 1,9 раза; общая микробная обсемененность в 1,4 и 2,8 раза; пылевая
загрязненность воздуха в 2-3 раза. Скорость движения воздуха была менее
,1м/с (см.табл. 1). В осенний период показатели микроклимата в зоне
аэростаза, также превышали гигиенические нормативы: температура воздуха на
2-5,4 градуса; содержание аммиака в 1,25 раза, концентрация углекислого газа в
1,25-2 раза; микробная обсемененность в 3,1 раза; уровень пылевой
загрязненности воздуха в 2,25-2,75 раза. Относительная влажность в целом
соответствовала гигиеническим стандартам и изменялась в пределах 58-76%;
скорость движения воздуха была ниже допустимого норматива - 0,2-0,3 м/с и была
менее 0,1 м/с (см. табл. 1).
Выводы:
1 В исследуемых птичниках в результате
неравномерного распределения свежего приточного воздуха образуются зоны с
застойным воздухом, в которых по причине низкой подвижности воздуха происходило
увеличение температуры и накопление вредных выделений (газов, микробов и пыли)
за пределы гигиенических нормативов.
2 В холодный период года в аэростазных
зонах основные показатели микроклимата превышали установленные нормативы:
температура на 10-23,1%, относительная влажность на 6-10%, концентрации аммиака
и углекислого газа на 33,4-50% и 20-50%, микробная обсемененность на
58,6-67,4%, пылевая загрязненность воздуха на 33,4-63,6%. Скорость движения
воздуха в этот период года была на 55-57,5% ниже нормативной.
3 В теплый период года в аэростазных
зонах основные показатели микроклимата, также превышали нормативы: температура
на 34,3-35,7%, относительная влажность на 11-20%, концентрации аммиака и
углекислого газа на 33,4-37,5% и 33,4-55,6%, микробная обсемененность и пылевая
загрязненность на 54,3-64% и 61,9-66,7%. Скорость движения воздуха была на
68,3-83,3% ниже допустимой.
4 Данные аэростазы мы квалифицируем как
средние или даже скрытые в зависимости от сезона года.
.1 Влияние аэростазов на клинико - физиологическое состояние молодняка
кур
Наши исследования, проведенные в описанных выше птичниках, показали, что
внутренние аэростазы оказывают влияние на клинико - физиологическое состояние
организма ремонтного молодняка кур.
Так, в зимний период года в начале исследований у молодняка кур обеих
групп температура тела, частота пульса и количество дыхательных движений были в
пределах физиологических нормативов. Корм и воду птицы принимали охотно,
видимые слизистые оболочки ротовой полости и гортани были розового или бледно -
розового цвета, без повреждений и наложений. Во вторую и третью недели исследований
у молодняка кур опытной группы отмечались увеличение частоты пульса на 13,1% (P<0,01) и 14,3% (P<0,001) и количества дыхательных
движений на 34,2% (P<0,001) и
33,5% (P<0,001) по сравнению с птицей из
контрольной группы (табл. 3.5). Температура тела находилась в пределах
физиологических нормативов. Корм и воду птицы принимали вяло. Видимые слизистые
оболочки ротовой полости и гортани были розового или бледно - розового цвета,
влажные, блестящие, без повреждений и наложений. У молодняка кур контрольной
группы в течение всего периода исследований температура тела, частота пульса и
количество дыхательных движений были в пределах физиологических норм (см. табл.
2). Видимые слизистые ротовой полости и гортани розового или бледно - розового
цвета, влажные, блестящие, без повреждений и наложений.
Таблица 2
Показатели клинического статуса молодняка кур в зимний период, (M±m, p)
|
Показатели Клинического
статуса
|
Опытная группа
|
Контрольная группа
|
|
Время исследований
|
1-я неделя
|
2-я неделя
|
3-я неделя
|
1-я неделя
|
2-я неделя
|
3-я неделя
|
|
Температура, 0С
|
41,21± 0,256
|
41,24± 0,248
|
41,50± 0,274
|
41,21± 0,275
|
41,26± 0,205
|
41,26± 0,286
|
|
Пульс, ударов в мин.
|
132,30 ±3,938
|
160,90** ±1,682
|
163,30*** ±2,222
|
134,0± 4,69
|
139,90 ±3,751
|
139,90 ±3,628
|
|
Дыхание, движений в мин.
|
21,71± 1,742
|
38,86*** ±1,010
|
40,14*** ±1,710
|
22,57± 2,707
|
25,57 ±1,850
|
26,71 ±2,254
|
Примечание: здесь и далее - *, **, *** - уровень значимости критерия
достоверности - P - <0,05, 0,01
и <0,001 - соответственно.
В весенне-летний период года во вторую неделю исследований у птиц опытной
группы, также происходило увеличение частоты пульса и дыхания по сравнению с
контролем. Так, в весенний период года во вторую и третью недели исследований у
птиц опытной группы отмечалось увеличение частоты пульса на 18,7% (P<0,01) и14,3% (P<0,01), и количества дыхательных
движений на 49,3% (P<0,001) и
37,5% (P<0,01) по сравнению с птицей из
контрольной группы. Температура тела была в пределах физиологических нормативов
(табл. 3.).
Таблица 3
Показатели клинического статуса молодняка кур в весенний период, (M±m, p)
|
Показатели Клинического
статуса
|
Опытная группа
|
Контрольная группа
|
|
Время исследований
|
1-я неделя
|
2-я неделя
|
3-я неделя
|
1-я неделя
|
2-я неделя
|
3-я неделя
|
|
Температура, 0С
|
41,26± 0,167
|
41,21± 0,195
|
41,28± 0,283
|
41,31± 0,295
|
41,16± 0,193
|
41,20± 0,239
|
|
Пульс, ударов в мин.
|
136,0± 4,14
|
160,70** ±1,614
|
153,70** ±4,744
|
130,30± 4,433
|
130,70± 2,792
|
131,70± 4,960
|
|
Дыхание, движений в мин.
|
21,14± 1,580
|
41,14*** ±2,324
|
38,86** ±2,613
|
23,29± 2,950
|
20,86± 2,395
|
24,29± 2,809
|
В осенний период года во вторую и третью недели исследований у птиц
опытной группы также отмечались увеличения частоты пульса на 12,2% (P<0,001) и 10,4% (P<0,01), и количества дыхательных
движений на 31,8% (P<0,001) и
33,4% (P<0,001) по сравнению контролем (табл.
3.8). У молодняка кур контрольных групп в переходные периоды года температура
тела, частота пульса и количество дыхательных движений в течение всего периода
исследований были в пределах физиологических норм (см. табл. 4). Видимые
слизистые оболочки гортани и ротовой полости были розового или бледно -
розового цвета, влажные, блестящие без повреждений и наложений.
Таблица 4
Показатели клинического статуса молодняка кур в осенний период, (M±m, p)
|
Показатели клинического
статуса
|
Опытная группа
|
Контрольная группа
|
|
Время исследований
|
1-я неделя
|
2-я неделя
|
3-я неделя
|
1-я неделя
|
2-я неделя
|
3-я неделя
|
|
Температура, 0С
|
41,39± 0,216
|
41,35± 0,163
|
41,17± 0,211
|
41,34± 0,206
|
41,35± 0,208
|
41,36± 0,203
|
|
Пульс, ударов в мин.
|
132,80±3,304
|
154,40***±1,388
|
152,60** ±1,647
|
134,50 ±3,520
|
135,60± 3,184
|
136,80± 3,337
|
|
Дыхание, движений в мин.
|
23,63± 2,052
|
36,13*** ±1,093
|
36,25***±1,521
|
23,13±2,232
|
24,63± 1,954
|
24,13± 1,674
|
Выводы: Локальные аэростазы птичников оказывали негативное влияние на
показатели клинико - физиологического статуса организма, которое проявлялось
увеличением количества дыхательных движений на 34,2-49,3% и учащением пульса на
14,3-18,7% и не оказывали влияние на температура тела молодняка кур.
6.2 Влияние
аэростазов на морфологический состав крови молодняка
кур
Так, в зимний период исследований установлено достоверное снижение
количества эритроцитов на 44,6% (P<0,001)
и гемоглобина на 41,2% (P<0,01)
и 42,4% (P<0,05), во вторую и третью неделю
исследований у птицы, находящейся в аэростазном участке, по сравнению с птицей,
содержащейся в условиях нормального микроклимата. Достоверных различий количества
лейкоцитов и тромбоцитов в течение всего периода исследований в обеих группах
не регистрировалось (табл. 5).
Таблица 5
Показатели морфологического состава крови молодняка кур в зимний период,
(M±m, p)
|
Показатели крови
|
Опытная группа
|
Контрольная группа
|
|
Время исследований
|
1-я неделя
|
2-я неделя
|
3-я неделя
|
1-я неделя
|
2-я неделя
|
3-я неделя
|
|
Эритроциты, х1012/л
|
2,84± 0,277
|
2,83± 0,155
|
2,42 ±0,155
|
2,76± 0,219
|
3,09± 0,129
|
4,37*** ±0,279
|
|
Гемоглобин, г/л
|
35,14± 5,535
|
29,71± 2,447
|
32,57± 3,484
|
37,14± 6,277
|
50,57**±3,993
|
56,57* ±8,185
|
|
Тромбоциты, х109/л
|
124,60±8,430
|
221,70± 12,330
|
168,6± 9,70
|
137,0± 10,54
|
216,30± 11,850
|
154,30± 10,610
|
|
Лейкоциты, х109/л
|
55,43± 3,644
|
71,71± 5,528
|
28,57± 7,325
|
63,43± 4,571
|
62,0± 5,75
|
46,86± 4,837
|
Достоверных изменений клеток крови в лейкограмме в течение зимнего
периода исследований обнаружено не было (табл. 6).
Таблица 6
Лейкограмма крови молодняка кур в зимний период, (M±m)
|
Клетки крови
|
Опытная группа
|
Контрольная группа
|
|
Время Исследований
|
1-я неделя
|
2-я неделя
|
3-я неделя
|
1-я неделя
|
2-я неделя
|
3-я неделя
|
|
Базофилы, %
|
0
|
0
|
0
|
1,0±0
|
0
|
0
|
|
Эозинофилы, %
|
2,0± 0,55
|
5,3± 1,23
|
4,3± 0,76
|
1,5± 2,89
|
3,7± 1,89
|
3,0± 0,71
|
|
Миелоциты, %
|
0
|
0
|
1,0±0
|
0
|
1,0±0
|
0
|
|
Юные, %
|
0
|
0
|
0
|
0
|
1,3±0,33
|
|
|
Палочкоядерные, %
|
0
|
0
|
0
|
0
|
0
|
0
|
|
Сегментоядерные, %
|
2,8± 1,18
|
5,1± 1,53
|
3,0± 0,72
|
2,8± 0,60
|
3,5± 0,76
|
11,3± 3,56
|
|
Лимфоциты, %
|
94,9± 0,96
|
87,9± 1,24
|
91,6± 0,97
|
94,4± 0,11
|
91,7± 1,92
|
85,0± 3,75
|
|
Моноциты, %
|
2,4± 0,68
|
2,8± 1,11
|
1,0±0
|
2,2± 0,60
|
1,2± 0,20
|
1,5± 0,50
|
В теплый период года (весна - лето), у птиц опытной группы, также
отмечалось уменьшение количества эритроцитов и гемоглобина в крови по сравнению
с контролем (табл. 7).
Таблица 7
Показатели морфологического состава крови молодняка кур в весенний
период, (M±m, p)
|
Показатели крови
|
Опытная группа
|
Контрольная группа
|
|
Время исследований
|
1-я неделя
|
2-я неделя
|
3-я неделя
|
1-я неделя
|
2-я неделя
|
3-я неделя
|
|
Эритроциты, х1012/л
|
3,18± 0,142
|
2,72± 0,142
|
2,71± 0,109
|
3,09± 0,186
|
3,25**± 0,133
|
3,31*** ±0,147
|
|
Гемоглобин, г/л
|
34,29± 9,002
|
24,86± 4,469
|
55,14± 8,116
|
29,43± 3,670
|
37,43± 5,066
|
65,71± 7,204
|
|
Тромбоциты, х109/л
|
96,0± 10,76
|
51,43± 11,890
|
84,0± 17,85
|
95,43± 17,640
|
86,86± 13,600
|
64,57± 10,040
|
|
Лейкоциты, х109/л
|
54,57± 3,823
|
46,57± 5,028
|
52,0± 9,32
|
55,43± 5,481
|
37,43± 7,338
|
38,86± 4,426
|
Так, установлено снижение количества эритроцитов во вторую и третью
недели исследований, у молодняка кур опытной группы на 16,3% (P<0,05) и 18,2% (P<0,01) по сравнению с птицей
контрольной группы. Количество гемоглобина у птиц контрольной группы было
недостоверно выше, чем у опытной группы на вторую и третью недели исследований.
Количество лейкоцитов, тромбоцитов в обеих группах в течение периода
исследований не имели достоверных различий (см. табл. 7).
В весенне-летний период на вторую и третью недели исследований,
отмечалось снижение количества сегментоядерных псевдоэозинофилов в лейкограмме
крови у молодняка кур из опытной группы на 5,5% (P<0,05) и 3,9% (P>0,05) по сравнению с контрольной группой. Другие показатели
лейкограммы в течение периода исследований не имели достоверных различий в
обеих группах (см. табл. 8).
Таблица 8
Лейкограмма крови молодняка кур в весенний период, (M±m, p)
|
Клетки крови
|
Опытная группа
|
Контрольная группа
|
|
Время исследований
|
1-я неделя
|
2-я неделя
|
3-я неделя
|
1-я неделя
|
2-я неделя
|
3-я неделя
|
|
1
|
2
|
3
|
4
|
5
|
6
|
7
|
|
Базофилы, %
|
0
|
0
|
0
|
0
|
0
|
0
|
|
Эозинофилы, %
|
1,4± 0,40
|
0
|
4,3± 0,62
|
2,4± 0,51
|
0
|
5,0± 4,20
|
|
Миелоциты, %
|
0
|
0
|
0
|
0
|
0
|
0
|
|
Юные, %
|
1,7± 0,33
|
1,0±0
|
2,0±1,0
|
0
|
1,3± 0,33
|
1,0±1,0
|
|
Палочкоядерные, %
|
0
|
0
|
0
|
0
|
0
|
0
|
|
Сегментоядерные, %
|
5,0± 0,72
|
3,5± 0,67
|
4,3± 1,43
|
6,3± 0,75
|
9,0* ±1,82
|
8,2* ±1,28
|
|
Лимфоциты, %
|
92,3± 0,61
|
91,5± 1,15
|
89,3± 2,44
|
90,9± 0,51
|
87,4± 2,21
|
85,6± 1,54
|
|
Моноциты, %
|
1,5± 0,29
|
4,0± 0,97
|
1,4± 0,25
|
2,0± 0,58
|
2,8± 0,85
|
1,3± 0,33
|
Подобная тенденция к снижению количества гемоглобина и эритроцитов в
условиях аэростаза отмечена нами в осенний период года. Так, установлено, что
количество эритроцитов и гемоглобина было на у птицы выращенной в условиях
нормального микроклимата было 19% (P<0,01) и 24,4% (P<0,05)
выше чем у птицы из зоны застоя воздуха. Достоверных различий количества
лейкоцитов и тромбоцитов в течение всего периода исследований в обеих группах
не регистрировалось (см. табл. 9).
Таблица 9
Показатели морфологического состава крови молодняка кур в осенний период, (M±m, p)
|
Показатели крови
|
Опытная группа
|
Контрольная группа
|
|
Время исследований
|
1-я неделя
|
2-я неделя
|
3-я неделя
|
1-я неделя
|
2-я неделя
|
3-я неделя
|
|
Эритроциты, х1012/л
|
3,17± 0,294
|
2,44± 0,232
|
2,40± 0,096
|
3,29± 0,245
|
2,41± 0,274
|
2,96** ±0,138
|
|
Гемоглобин, г/л
|
29,25± 2,534
|
38,0± 6,33
|
28,75± 2,477
|
36,25± 4,920
|
30,75± 2,698
|
38,0* ±2,92
|
|
Тромбоциты, х109/л
|
36,63± 6,208
|
53,0± 7,0
|
112,50± 15,350
|
39,0± 4,94
|
49,50± 10,250
|
148,80±9,039
|
|
Лейкоциты, х109/л
|
34,50± 6,450
|
35,50± 3,157
|
50,0± 6,14
|
36,0± 5,35
|
34,50± 5,754
|
66,0± 7,21
|
В осенний период года достоверных различий в лейкограмме молодняка кур
опытной и контрольной групп не регистрировалось (табл. 10).
Таблица 10
Лейкограмма крови молодняка кур в осенний период, (M±m)
|
Клетки крови
|
Опытная группа
|
Контрольная группа
|
|
Время исследований
|
1-я неделя
|
2-я неделя
|
3-я неделя
|
1-я неделя
|
2-я неделя
|
3-я неделя
|
|
Базофилы, %
|
2,0±0,71
|
0
|
0
|
1,3±0,25
|
0
|
0
|
|
Эозинофилы, %
|
2,4± 0,61
|
0
|
5,0± 1,53
|
3,6± 0,51
|
0
|
3,5± 1,56
|
|
Миелоциты, %
|
0
|
1,3± 0,33
|
1,8± 0,58
|
1,4± 0,25
|
2,5± 0,29
|
1,0±0
|
|
Юные, %
|
1,4± 0,25
|
3,2± 0,92
|
1,8± 0,48
|
1,4± 0,25
|
2,7± 0,81
|
2,6± 0,75
|
|
Палочкаядерные, %
|
0
|
0
|
0
|
0
|
0
|
0
|
|
Сегментоядерные, %
|
5,3± 1,32
|
8,4± 2,29
|
3,6± 0,97
|
5,9± 1,37
|
6,7± 2,18
|
5,2± 1,25
|
|
Лимфоциты, %
|
85,9± 1,34
|
86,1± 2,47
|
88,4± 1,95
|
85,1± 2,30
|
86,3± 3,09
|
87,8± 1,92
|
|
Моноциты, %
|
3,9± 0,74
|
4,3± 1,02
|
2,8± 1,11
|
3,7± 0,75
|
2,8± 1,25
|
2,8± 1,11
|
Таким образом, в условиях аэростазов происходило снижение количества
эритроцитов в крови, у молодняка кур на 16,3-44,6%, а также снижалось
содержание гемоглобина в эритроцитах на 24,4- 42,4% и не было отмечено изменений
количества лейкоцитов и тромбоцитов.
6.3 Влияние
аэростазов на естественную резистентность организма
птицы
Наши исследования, проведенные в птичниках с клеточным содержанием
ремонтного молодняка показали, что аэростазы оказывали негативное влияние на
естественную резистентность организма ремонтного молодняка кур в разные сезоны
года.
Так, в зимний период года было установлено, что у молодняка кур,
находящегося в зоне локального аэростаза, во вторую и третью недели
исследований происходило снижение: бактерицидной активности сыворотки крови на
19,2% (P<0,01) и 18,6% (P<0,05); фагоцитарной активности
псевдоэозинофилов на 10,6% (P<0,05)
и 14,0% (P<0,01); фагоцитарного индекса на
1,2 (P<0,01) и 0,5 (P<0,01); фагоцитарного числа на 1,7
(P<0,05) и 0,2 (P>0,05) по сравнению с контролем.
Также отмечалось снижение лизоцимной активности сыворотки крови во вторую
и третью недели исследований на 0,5% (P<0,05) и 0,7% (P<0,05)
у молодняка кур, находящегося в зоне аэростаза. Уровень сиаловых кислот в
течение периода исследований не имел достоверных различий в обеих группах
(Р>0,05).
Таблица 11
Показатели естественной резистентности молодняка кур в зимний период года, (M±m, p)
|
Показатели крови
|
Опытная группа
|
Контрольная группа
|
|
Время исследований
|
1-я неделя
|
2-я неделя
|
1-я неделя
|
2-я неделя
|
3-я неделя
|
|
Бактерицидная активность, %
|
51,79± 6,028
|
56,0± 3,54
|
56,0 ±5,44
|
51,14± 6,974
|
75,21** ±4,320
|
74,57* ±4,310
|
|
Лизоцимная активность, %
|
4,43± 0,297
|
2,36± 0,143
|
2,79± 0,214
|
4,79± 0,214
|
2,86* ±0,092
|
3,44* ±0,186
|
|
Фагоцитарная активность, %
|
42,0± 4,93
|
33,71 ±3,068
|
39,71± 2,561
|
46,0± 2,88
|
44,29* ±2,775
|
53,71** 3,006
|
|
Фагоцитарный индекс
|
1,72± 0,226
|
1,65± 0,201
|
1,15± 0,105
|
1,93± 0,244
|
2,83** ±0,171
|
1,64** ±0,078
|
|
Фагоцитарное число
|
4,14± 0,432
|
4,86 ±0,427
|
2,93± 0,234
|
4,16± 0,383
|
6,51* ±0,466
|
3,09± 0,168
|
|
Сиаловые кислоты, ед. опт.
плот.
|
40,0± 5,35
|
91,25 ±9,907
|
67,86± 4,738
|
38,57± 6,335
|
79,30± 11,770
|
76,43± 9,175
|
Динамику показателей естественной резистентности молодняка кур опытной и
контрольных групп в течение зимнего периода исследований, можно увидеть на
представленных диаграммах (рис. 2-4).

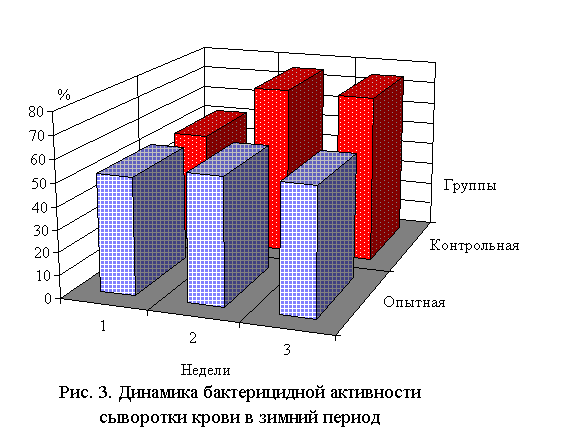
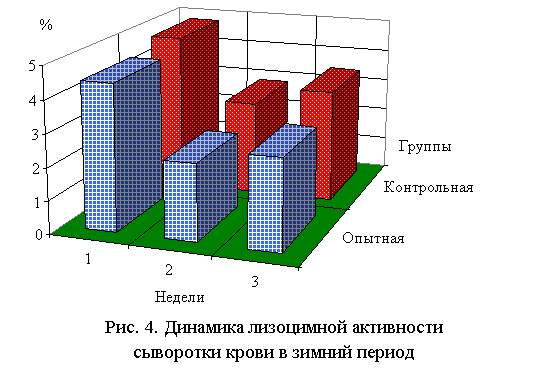
В
теплый период года (весна-лето) нами отмечена похожая тенденция снижения
показателей естественной резистентности организма. Так, в весенний период года
во вторую и третью недели исследований, у молодняка кур опытной группы
происходило снижение бактерицидной активности сыворотки крови на 15,6% (P<0,01)
и 21,4% (P<0,05) и лизоцимной активности сыворотки крови на
1,0% (P<0,05) и 0,7% (P<0,05), по
сравнению контролем. На третьей неделе исследований у молодняка кур опытной группы
отмечалось снижение фагоцитарной активности псевдоэозинофилов на 13,9% (P<0,01)
и фагоцитарного индекса на 1,0 (P<0,01) по сравнению с контролем (табл. 12.).
Таблица
12
Показатели
естественной резистентности молодняка кур
в весенний период года, (M±m, p)
|
Показатели крови
|
Опытная группа
|
Контрольная группа
|
|
Время исследований
|
1-я неделя
|
2-я неделя
|
3-я неделя
|
1-я неделя
|
2-я неделя
|
3-я неделя
|
|
1
|
2
|
3
|
4
|
5
|
6
|
7
|
|
Бактерицидная активность, %
|
52,11± 2,554
|
54,63± 3,465
|
47,14± 6,061
|
49,31± 5,754
|
70,23**±2,796
|
68,57* ±3,401
|
|
Лизоцимная активность, %
|
4,43± 0,202
|
1,19± 0,124
|
4,14± 0,210
|
4,04± 0,081
|
2,14* ±0,322
|
4,86* ±0,210
|
|
Фагоцитарная активность, %
|
24,76± 2,348
|
31,67± 3,363
|
27,71± 2,020
|
24,29± 1,107
|
39,33± 4,185
|
41,60** ±2,638
|
|
Фагоцитарный индекс
|
1,12± 1,068
|
1,24± 0,161
|
1,36± 0,103
|
1,23± 0,097
|
1,86± 0,263
|
2,26** ±0,231
|
|
Фагоцитарное число
|
4,64± 0,369
|
3,94± 0,295
|
4,94± 0,333
|
5,07± 0,332
|
4,64± 0,174
|
5,40± 0,302
|
|
Сиаловые кислоты, ед. опт.
плот.
|
75,0± 16,51
|
56,79± 6,285
|
65,0± 8,66
|
67,86± 12,530
|
59,93± 7,552
|
72,86± 5,467
|
Динамику основных показателей естественной резистентности молодняка кур
опытной и контрольных групп в течение весеннего периода исследований, можно
увидеть на представленных диаграммах (рис. 5-7).

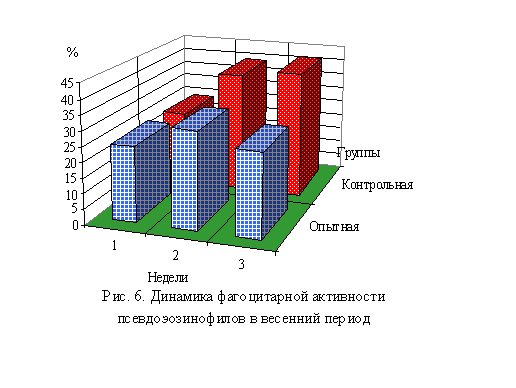
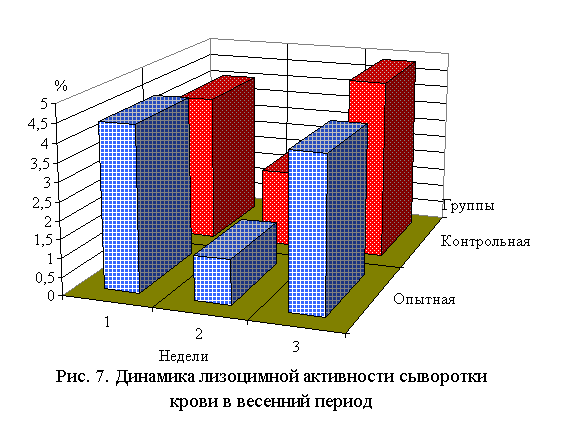
В
осенний период года у молодняка кур, находящегося в зоне застоя (аэростаза),
также отмечалось снижение уровня естественной резистентности организма (табл.
13).
Таблица
13
Показатели
естественной резистентности молодняка кур в осенний период года, (M±m, p)
|
Показатели крови
|
Опытная группа
|
Контрольная группа
|
|
Время исследований
|
1-я неделя
|
2-я неделя
|
3-я неделя
|
1-я неделя
|
2-я неделя
|
3-я неделя
|
|
Бактерицидная активность, %
|
64,06± 4,380
|
37,59± 3,514
|
56,89± 4,797
|
65,63± 4,575
|
56,32* ±6, 942
|
79,66** ±3,334
|
|
Лизоцимная активность, %
|
1,69± 0,283
|
1,63± 0,183
|
2,13± 0,206
|
2,0± 0,38
|
3,13** ±0,398
|
3,19** ±0,210
|
|
Фагоцитарная активность, %
|
37,71± 2,286
|
35,71± 1,017
|
32,00± 2,582
|
35,43± 3,228
|
43,14** ±1,438
|
42,29** ±2,157
|
|
Фагоцитарный индекс
|
1,69± 0,172
|
1,22± 0,041
|
1,03± 0,083
|
1,73± 0,198
|
1,70** ±0,088
|
1,78** ±0,200
|
|
Фагоцитарное число
|
4,45± 0,250
|
3,44± 0,137
|
3,08± 0,228
|
4,85± 0,240
|
3,97± 0,226
|
4,26*± 0,457
|
|
Сиаловые кислоты, ед. опт.
плот.
|
50,16± 3,029
|
56,41± 2,667
|
55,19± 2,341
|
45,63± 2,266
|
51,28± 2,332
|
56,06± 5,527
|
Из данных таблицы следует, что у молодняка кур, находящегося в условиях
аэростаза во вторую и третью недели исследований происходило снижение:
бактерицидной активности сыворотки крови на 18,7%(P<0,05) и 22,7% (P<0,01); фагоцитарной активности псевдоэозинофилов на 7,4% (P<0,01) и 10,3% (P<0,01); фагоцитарного индекса на
0,5 (P<0,01) и 0,8 (P<0,01); фагоцитарного числа на 0,5
(P<0,05) и 1,2 (P<0,05) по сравнению с птицей,
находящейся в условиях нормального микроклимата.
Также отмечалось снижение лизоцимной активности сыворотки крови во вторую
и третью недели исследований на 1,5% (P<0,01) и 1,1% (P<0,01)
у молодняка кур опытной группы по сравнению с контролем. Достоверного изменения
уровня сиаловых кислот в течение периода исследований в обеих исследуемых
группах не наблюдалось.
Динамику основных показателей естественной резистентности молодняка кур
опытной и контрольных групп в течение осеннего периода исследований, можно
увидеть на представленных диаграммах (рис. 8-10).
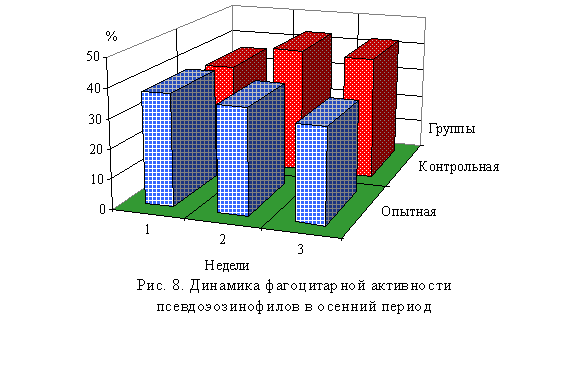
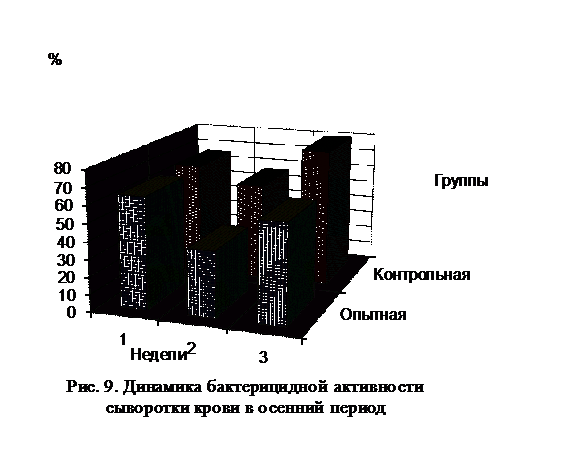

Выводы:
В условиях аэростазов происходило снижение бактерицидной и лизоцимной
активности сыворотки крови молодняка кур на 12,5-22,7% и 0,5-1,5%
соответственно, а также снижалась фагоцитарную активность лейкоцитов (псевдоэозинофилов)
на 7,3-14,0%. Однако содержание сиаловых кислот не претерпевало изменений.
.4
Влияние аэростазов на морфологию внутренних органов молодняка кур
В
результате патоморфологических и гистологических исследований органов иммунной
системы (фабрициева бурса, селезенка и слепокишечные миндалины), легких, а
также гистохимических исследований печени и почек цыплят, выращенных в условиях
аэростаза (опытная группа) или в участке с нормативным микроклиматом
(контрольная группа), установлено, что аэростазы оказывают определенное влияние
на морфологию внутренних органов птицы.
Так,
у цыплят, выращенных в условиях аэростаза, отмечалось уменьшение плотности
расположения диффузной лимфоидной ткани в прослойках рыхлой соединительной
ткани парабронхиальных комплексов легких, по сравнению с птицей, выращенной в
условиях нормального микроклимата. Это может быть связано либо с ослаблением
процессов пролиферации лимфоцитов, либо с гибелью Т- и В-лимфоцитов,
участвующих в развитии иммунных реакций по уничтожению антигенов, которые в
большом количестве поступают в дыхательные пути молодняка кур, выращенного в
условиях аэростаза.
Влияние
аэростазного микроклимата на морфологию фабрициевой бурсы - центрального органа
иммунной системы отразилось на некотором уменьшении размеров корковой зоны
лимфоидных узелков органа, по сравнению с контролем. Возможно, это является
свидетельством более ранней возрастной регрессии органа центральной иммунной
системы, которая по данным С.Б. Селезнева (1987) и др., наступает у птиц
яичного направления в условиях гиподинамии (при клеточном содержании) к моменту
полового созревания, т.е. после 130-140 дней.
При
изучении влияния аэростаза на периферические органы иммуной системы птиц
(селезенку и слепокишечные миндалины) мы обратили внимание на величину и
количество лимфоидных узелков, присутствующих в поле зрения микроскопа на
гистологических срезах исследуемых органов. По данным ряда авторов (G. Thorbecke, S.P. Lerman, 1976; O. Vianio, A. Toivanen, 1977; T. Romppanen, 1981; R. Nienwenhius, D. Opstelten, 1984, И.М. Луппова, 1998), наличие лимфоидных
узелков является свидетельством морфо - функциональной зрелости органов
иммунной системы. Это связано с тем, что в лимфоидных узелках периферических
органов иммунитета происходит вторичная антиген - зависимая дифференцировка
В-лимфоцитов, после чего они трансформируются в плазмоциты, которые участвуют в
синтезе антител, нейтрализующих антигены.
При
этом установлено, что в селезенке, которая в организме является
многофункциональным органом, в том числе и биологическим фильтром протекающей
по организму крови, у птиц обеих групп к 120 - дневному возрасту количество и
размеры лимфоидных узелков были примерно одинаковыми. В собственном слое
слизистой оболочки слепокишечных миндалин у птицы, выращенной в условиях
аэростаза, по сравнению с контрольными животными, размеры и количество
лимфоидных узелков, т.е. площадь, приходящаяся на узелковую лимфоидную ткань,
была значительно большей. Это, очевидно, связано с более интенсивно
протекающими в исследуемом органе реакциями иммунитета по нейтрализации
антигенов, в большем количестве попадающих в организм птиц, выращиваемых в
условиях аэростазного микроклимата.
В
цитоплазме гепатоцитов печени цыплят, выращенных в аэростазной зоне, отмечается
незначительное уменьшение количества гликогена, по сравнению с птицей,
содержащейся в условиях нормативного микроклимата. В почках присутствие зерен
гликогена в клетках эпителия, формирующих почечные канальцы, а также в
прослойках рыхлой соединительной ткани, расположенных между канальцами
нефронов, было примерно одинаковым у птиц обеих групп. Таким образом, в
результате проведенных гистохимических исследований установлено, что у цыплят,
находившихся в условиях аэростаза, по сравнению с контролем, происходят
незначительные изменения в содержании гликогена в печени в связи с
необходимостью регуляции разных уровней обменных процессов в организме.
Таким
образом, локальные аэростазы микроклимата оказывали определенное влияние на
морфологию внутренних органов ремонтного молодняка кур, что проявлялось
уменьшением плотности расположения диффузной лимфоидной ткани в прослойках
рыхлой соединительной ткани парабронхиальных комплексов легких, некоторым
уменьшением размеров корковой зоны лимфоидных узелков в фабрициевой бурсе,
увеличением размеров и количества лимфоидных узелков в слепокишечных
миндалинах, а также незначительным уменьшением содержания запасов гликогена в
печени, по сравнению с молодняком кур, выращенным в условиях нормального
микроклимата т.е. аэростазы оказывали иммуннодепрессивное действие на
центральный орган иммунной системы - фабрициеву бурсу и на состояние лимфоидной
ткани в легких молодняка кур.
.5
Влияние локальных аэростазов на продуктивность молодняка кур
Исследования
динамики среднесуточных приростов в разные сезоны года в опытных и контрольных
группах показали, что локальные зоны застоя в птичниках снижают среднесуточные
приросты молодняка кур (табл. 14).
Таблица
14
Динамика
среднесуточных приростов живой массы у молодняка кур, (M±m, p)
|
Динамика среднесуточных
приростов у птиц в зимний период
|
|
Исследуемые группы
|
Живая масса в начале
исследований, г
|
Живая масса в конце
исследований, г
|
Среднесуточные приросты, г
|
|
Опытная
|
1140±60,9
|
1396±26,7
|
12,2
|
|
Контрольная
|
1105±41,1
|
1509**±10,0
|
19,2**
|
|
Исследуемые группы
|
Живая масса в начале
исследований, г
|
Живая масса в конце
исследований, г
|
Среднесуточные приросты, г
|
|
Опытная
|
971±30,6
|
1113±38,0
|
6,7
|
|
Контрольная
|
962±17,9
|
1215*±20,0
|
12,0*
|
|
Динамика среднесуточных
приростов у птиц в осенний период
|
|
Исследуемые группы
|
Живая масса в начале
исследований, г
|
Живая масса в конце
исследований, г
|
Среднесуточные приросты, г
|
|
Опытная
|
787±16,1
|
1025±11,3
|
11,3
|
|
Контрольная
|
759±18,2
|
1092**±15,6
|
15,9**
|
Так, если в зимний период в начале проведения исследований средняя живая
масса молодняка кур в опытной группе была 1140±60,9 г, а в контрольной группе 1105±41,1 г и не было достоверных различий
между исследуемыми группами, то к концу исследования живая масса в обеих
исследуемых группах уже достоверно отличалась и была в опытной группе 1396±26,7 г; а в контрольной группе 1509±10,0 г, что на 113 г выше, чем в
опытной. В течение периода исследований среднесуточные приросты молодняка кур
составляли, в зоне аэростаза - 12,2 г, а в участке с нормальным микроклиматом -
19,2 г, что на 7 г или 36,5% (P<0,01)
выше, чем в опытной группе (см. табл. 14). В переходные периоды года к концу
проведения исследований, также отмечались достоверные различия в среднесуточных
приростах массы тела у молодняк кур опытных и контрольных групп (см. табл. 14).
Так, в весенне-летний период года средняя живая масса молодняка кур обеих
групп в начале исследований достоверно не отличалась и была 971±30,7 г в опытной группе и 962±17,9 в контрольной группе. Однако, к
концу проведения исследований живая масса молодняка кур была в опытной группе
1113±38,0, а в контрольной 1215±20,0, что на 102 г выше, чем в
опытной. Среднесуточные приросты живой массы кур обеих групп в течение всего
периода исследований составляли у молодняка кур опытной группы 6,7 г в сутки, а
контрольной 12 г, что на 5,3 г или на 44% (P<0,05) больше, чем в подопытной.
В осенний период средняя живая масса цыплят изменялась от 787±16,1 г - в начале, до 1025±11,3 г - в конце исследований
(опытная группа) и от 759±18,2 г - в начале до 1092±15,6 г - в конце исследований (контрольная группа). Таким
образом, средняя живая масса молодняка кур контрольной группы к концу
исследований была на 67 г выше, чем у птиц опытной группы. Среднесуточные
приросты живой массы птиц были в опытной группе- 11,3 г, а в контрольной- 15,9
г, что на 4,6 г или на 28,5% (P<0,01)
выше, чем в опытной группе.
Динамику среднесуточных приростов массы тела птиц в течение зимнего,
переходных периодов можно увидеть на представленных диаграммах (рис. 11-13).
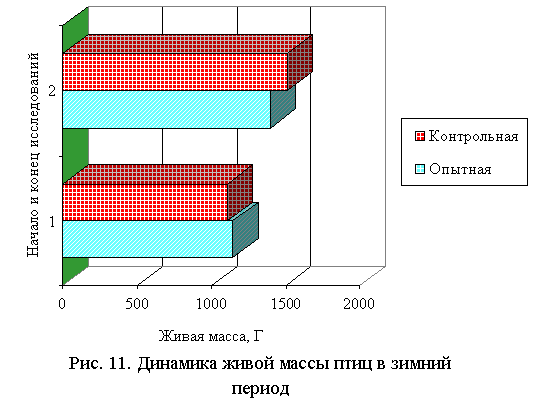
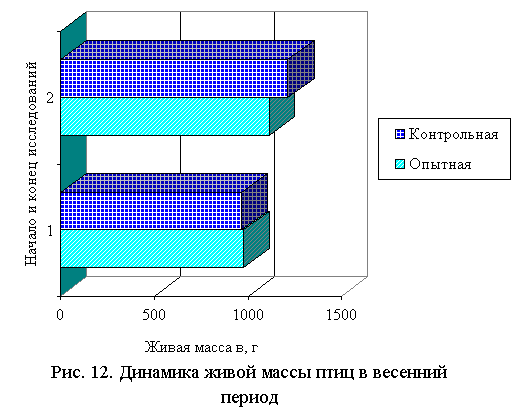
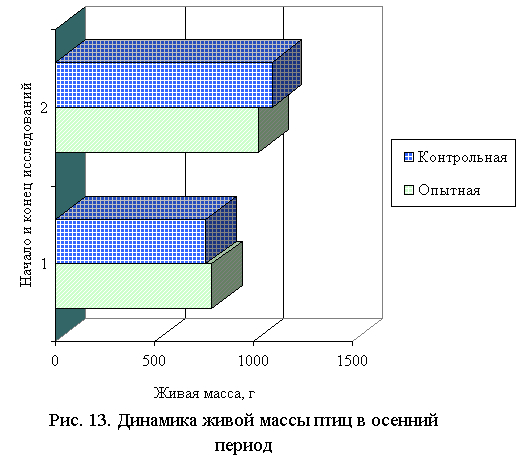
Таким
образом, исходя из вышеизложенного, следует, что локальные аэростазы в
птичниках с клеточным содержанием во все сезоны года, снижали среднесуточные
приросты живой массы тела, у ремонтного молодняка кур несушек на 4,6-7,0 г или
28,5-36,5 %.
.6
Влияние аэростазов на некоторые биохимические показатели крови у птиц
Для
изучения влияния аэростазов на некоторые биохимические показатели крови были
проведены исследования воздухараспределения в одном из птичников Городокской
птицефабрики (отделение Хайсы).
Одними
из основных задач исследований были: изучить равномерность распределения
приточного воздуха, а также изучение влияния различных микроклиматических
условий на иммунитет, заболеваемость и продуктивность ремонтного молодняка кур.
Исследования
проводили в 2-ух зальном птичнике, размером 18 х 30 м каждый. Содержание птицы
в клеточных батареях типа КБУ-3, плотность посадки цыплят 10-12 голов в клетке,
численность птицы на момент посадки 27500 голов. Исследования проводились в
зимний период года декабрь - февраль месяц.
При
изучении равномерности распределения было установлен, что вследствие
неисправности приточного вентилятора в 1-ом зале птичника в середине помещения
возникал локальный аэростаз (см. рис. 14).
Рис. 14 Внутренняя аэрорумбограмма птичника
- приточные шахты, 2 - приточный воздуховод, 3 - клеточная батарея, 4 -
опорные колонны, 5 - зоны локальных аэростазов, 6 - вытяжные вентиляторы.
Таблица № 15
Параметры микроклимата в птичнике в зимний период
|
Показатели микроклимата
|
Начало исследований
|
Середина исследований
|
Конец исследований
|
|
1 зал
|
2 зал
|
1 зал
|
2 зал
|
1 зал
|
2 зал
|
|
Температура, 0С
|
С
|
10,0-17,5 13,75
|
12,0-19,5 15,75
|
14,5-17,0 15,75
|
15,5-18,0 16,75
|
14-18 16
|
14-18 16
|
|
Т
|
10,5-16,5 13,5
|
12,0-18,5 15,25
|
15,0-17,5 16,25
|
15,0-18,5 16,75
|
15-17,5 16,25
|
15-17,5 16,25
|
|
Относительная влажность, %
|
С
|
54-70 62
|
59-68 63,5
|
68-78 73
|
72-81 76,5
|
58-72 65
|
68-72 70
|
|
Т
|
54-81 67,5
|
64-68 66
|
73-80 76,5
|
70-85 77,5
|
69-78 73,5
|
64-77 70,5
|
|
Скорость движения воздуха,
м/с
|
С
|
0,14-0,28 0,21
|
0,11-0,45 0,28
|
0,25-1,3 0,775
|
0,1-0,36 0,23
|
0,36-0,87 0,615
|
0,1-0,18 0,145
|
|
Т
|
0,14-0,18 0,16
|
0,09-0,25 0,17
|
0,16-0,28 0,22
|
0,1-0,17 0,14
|
0,1-0,28 0,19
|
0,14-0,2 0,17
|
|
Аммиак, мг/м3
|
С
|
3,0-7,5 5,25
|
2,5-7,0 4,75
|
4-15 9,5
|
3-12 7,5
|
5-10 7,5
|
6-12 9
|
|
Т
|
3,0-7,5 5,25
|
3-10 6,5
|
5-16 10,5
|
6-15 10,5
|
5-12 8,5
|
3-10 6,5
|
|
Углекислый газ, %
|
С
|
0,05-0,2 0,125
|
0,05-0,15 0,1
|
0,1-0,2 0,15
|
0,1-0,15 0,125
|
0,05-0,2 0,125
|
0,05-0,15 0,1
|
|
Т
|
0,15-0,2 0,175
|
0,1-0,15 0,125
|
0,15-0,2 0,175
|
0,1-0,15 0,125
|
0,15-0,2 0,175
|
0,1-0,15 0,125
|
|
Микробная контаминация,
тыс./м3
|
С
|
114-164 139
|
102-3526 1814
|
126-512 319
|
116-400 258
|
236,88-630 433,44
|
110,88-480 295,44
|
|
Т
|
170-4410 2290
|
32-478 255
|
220-1890 110,95
|
240-1134 120,57
|
241,92-480 360,96
|
100,8-520 310,4
|
Примечание: здесь и далее С - середина помещения, Т - торцевые части
помещения.
Снижение подачи воздуха в помещение способствовало постепенному
накоплению большого количества микроорганизмов в помещении (см. таб.15).
Было установлено, что различия в колебаниях температуры в обеих
исследуемых залах в течение периода выращивания цыплят были незначительными.
Так, в 1-ом зале температура изменялась в пределах 10-18 0С, а во втором в
пределах 12-19,5 0С. Относительная влажность в течение периода исследований в
обеих залах была примерно одинаковой и изменялась в 1-ом зале в пределах
54-81%, а во 2-ом в пределах 59-85%. Концентрации аммиака в 1-ом и 2-ом зале
изменялась в пределах 1-16 мг/м3 и 2,5-15 мг/м3 соответственно. Содержание
углекислого газа колебалось в пределах 0,05-0,2% в 1-ом зале и 0,05-0,15% во
2-ом зале. Колебания общей микробной контаминации воздуха в 1-ом зале
составляли 114-4410 тыс./м3, а во 2-ом 32-3526 тыс./м3.
Основной микробный фон воздуха в птичнике составляли микроорганизмы родов
staphylococcus и salmonella.
Для изучения влияния общей микробной обсемененности на обмен веществ,
иммунитет и продуктивность цыплят были изучены следующие биохимические и
иммунологические показатели крови: содержание кальция и фосфора; глюкозы, общих
липидов, холестерина, общего белка и белковых фракций; бактерицидная и
лизоцимная активность сыворотки крови, фагоцитарная активность нейтрофилов.
Исследования крови цыплят проводили в 50, 70, 93 и 119-ти дневном возрасте.
Также изучались среднесуточные приросты за период выращивания птицы (120 дней).
Для проведения исследований были сформированы две группы аналогов ремонтного
молодняка кур по 200 голов в каждой группе в 1-ом и 2-ом залах птичника.
Данные исследований крови представлены в таблице 16.
Таблица 16
Некоторые биохимические и иммунологические показатели крови цыплят,
выращенных в различных микроклиматических условиях
|
Показатели крови
|
|
50
|
70
|
93
|
119
|
|
1 зал
|
2 зал
|
1 зал
|
2 зал
|
1 зал
|
2 зал
|
1 зал
|
2 зал
|
|
1
|
2
|
3
|
4
|
5
|
6
|
7
|
8
|
9
|
|
БАСК, %
|
51,02± 12,06
|
66,88± 7,740
|
82,05± 8,100
|
78,13± 33,560
|
67,29± 2,656
|
59,52± 8,570
|
77,94± 3,892
|
72,54± 1,471
|
|
ЛАСК, %
|
3,92± 0,417
|
3,42± 0,201
|
1,80± 0,149
|
1,64± 0,179
|
8,4± 0,400
|
11,15*± 0,827
|
6,17± 0,250
|
7,0*±0
|
|
ОБ, г/л
|
32,5± 1,306
|
44,73± 3,318
|
40,74± 2,601
|
41,86± 2,91
|
54,55± 1,792
|
57,35± 1,870
|
58,85± 2,354
|
49,69± 2,798
|
|
Ig, г/л
|
6,76± 1,143
|
11,66± 2,130
|
10,10± 1,117
|
9,37± 2,314
|
13,78± 1,536
|
13,65± 1,930
|
26,04± 2,790
|
19,8± 2,037
|
|
ГЛ, г/л
|
12,48± 1,034
|
14,27± 0,696
|
10,04± 0,266
|
10,31± 0,37
|
11,80± 0,363
|
9,12*** ±0,498
|
10,9± 0,378
|
10,66± 0,349
|
|
ОЛ, г/л
|
4,91± 0,160
|
5,81± 0,385
|
6,3± 0,318
|
6,27± 0,306
|
4,86± 0,337
|
6,09*± 0,357
|
6,6± 0,214
|
5,69± 0,368
|
|
ХЛ, ммоль/л
|
3,79± 0,412
|
3,31± 0,370
|
4,45± 0,425
|
4,17± 0,244
|
3,38± 0,586
|
3,08± 0,262
|
3,71± 0,130
|
5,53*± 0,560
|
|
Ca, ммоль/л
|
2,73± 0,365
|
2,59± 0,370
|
2,24± 0,174
|
2,30± 0,412
|
2,51± 0,294
|
3,54*± 0,348
|
2,73± 0,145
|
3,23*± 0,158
|
|
Р, моль/л
|
1,78± 0,271
|
1,42± 0,163
|
2,41± 0,292
|
3,09± 0,594
|
2,63± 0,279
|
4,37** ±0,431
|
1,72± 0,122
|
2,14*± 0,138
|
Примечание: БАСК и ЛАСК - бактерицидная и лизоцимная активности сыворотки
крови; ОБ - общий белок; Ig-
гаммаглобулины; ГЛ- глюкоза; ОЛ- общие липиды; ХЛ - холестерин; Ca -кальций; Р - фосфор.
Анализируя данные исследований следует отметить, что к концу периода
выращивания у птиц из 1-го зала отмечалось достоверное снижение количества
кальция, неорганического фосфора, холестерина и общих липидов в крови на 15,5%,
19,6%, 33% и 20% соответственно, по сравнению со 2-ым залом. Также происходило
достоверное увеличение количества глюкозы на 22,7% в 1-ом зале по сравнению со
2-ым. В конце периода выращивания у птицы из 1-го зала отмечалось достоверное
снижение лизоцимной активности сыворотки крови на 2,8%, по сравнению со 2-ым
залом. Среднесуточные приросты живой массы птицы в 1-ом зале были 8 г, а во
2-ом 8,6 г. Живая масса птицы в исследуемых группах к 121 дню выращивания
составляла 965 г в 1-ом зале и 1037 г во 2-ом, что на 72 г выше, чем в 1-ом
зале. Сохранность птицы в 1-ом зале составила 90,7%, а во 2-ом 92,2%.
Таким образом, исходя из выше изложенного следует, что в условиях
повышенной микробной контаминации воздуха у птицы развивается состояние
стресса, следствием которого являются изменение отдельных биохимических
показателей крови, снижение иммунной реактивности и продуктивности. Кроме того,
как показали исследования у птицы, выращенной в таких условиях отмечается
повышенная выбраковка от заболеваний вызванных условно-патогенной и патогенной
микрофлорой (колисептицемия и стафилококковый дерматит).
7. Способы обнаружения и ликвидации локальных зон застоя воздуха
(аэростазов) в животноводческих помещениях
Основным способом обнаружения застойных участков в помещении является
составление и запись внутренней аэрорумбограммы т.е. графической записи
направлений движения воздушных масс внутри
помещения. Составляется она при помощи оригинального прибора бифлюгера
конструкции Г.А. Соколова (рис. 2) или при помощи дымаря обыкновенного широко
используемого в пчеловодстве.
Последний метод имеет некоторые недостатки, так при большой скорости
движения воздуха в помещении движение дыма искажает истинное направление
воздуха из-за различной удельной массы дыма и воздуха. Поэтому, для наиболее
точного определения движения потоков воздуха в помещении, следует пользоваться
бифлюгером.
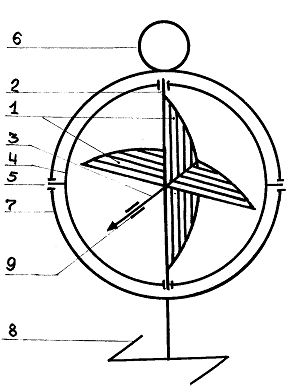
Рис. 15 Бифлюгер
1
Два полукруга
вращения крестовины
2
Ось вращения
крестовины
3
Противовес
4
Промежуточное
кольцо
5
Ось вращения
промежу- точного кольца
6
Кольцо для
подвешивания
7
Кольцо - корпус
8
Подставка
9
Подвижная муфта
для ре- гулирования - уравновешивания крестовины
Работает бифлюгер следующим образом: расположение осей вращения
крестовины под углом 900 друг к другу дает возможность последней занимать
абсолютно безразличное положение в пространстве без движения воздуха, а при
потоке воздуха (сбоку, снизу, сверху и т.д.) последняя способна поворачиваться
своим противовесом - указателем в том направлении откуда идет поток воздуха со
скоростью от 0,15 до 10 м/с. Прибор устанавливается или подвешивается в нужном
для вас месте, в течении 3-10 секунд крестовина поворачивается своим
противовесом - указателем в ту сторону откуда движется поток поступающего
воздуха. По направлению противовеса - указателя определяют направление движения
воздушного потока в данной точке, что отмечается стрелкой на чертеже. Такие
измерения проводят в различных точках помещения, на основании которых
составляется план вертикальных и горизонтальных воздушных потоков, то есть
внутренние аэрорумбограммы помещения.
Причем для определения аэростазных участков со скоростью движения воздуха
более 0,15 м/с помимо бифлюгера можно пользоваться крыльчатым анемометром. Если
скорость движения воздуха в исследуемых участках помещения менее 0,15 м/с, то
следует вначале провести задымление при помощи дымаря, а затем в местах застоя
струй дыма необходимо проводить измерения кататермометрами, т.е. гигиеническими
приборами, которые служат для определения скорости движения воздуха в
помещении. К этим приборам относят шаровой и цилиндрический кататермометры.
Так, при исследовании кататермометром скорости движения воздуха в различных
участках птичника, при обнаружении участков со скоростью движения менее или 0,1
м/с - последние следует считать зонами застоя воздуха (аэростазами).
8. Способы ликвидация аэростазов в птичниках
Одним из основных способов ликвидации зон застоя воздуха в птицеводческих
помещениях является организация правильного и равномерного распределения
свежего приточного воздуха. Этого можно достигнуть путем установления
дополнительных приточных устройств с механическим побуждением движения воздуха
(центробежные вентиляторы) и воздуховодов в помещении. Последние, как правило,
располагают продольно между крайними пристеночными рядами клеточных батарей.
Таким образом, достигается равномерное поступление воздуха в клеточные батареи
с птицей (рис. 16). На представленном рисунке видно, что после установки
дополнительных приточных устройств с механическим побуждением движения воздуха,
воздухораспределение в изучаемом помещении происходит равномерно. То есть,
струя с приточным воздухом достигает крайних пристеночных рядов клеточных
батарей.
Поскольку установка дополнительных
воздуховодов является довольно трудоемким процессом, требующим дополнительных
финансовых и материальных расходов, то, по данным ряда авторов (В.И. Мозжерин,
Е.П. Дементьев, Ф.А. Каримов, С.Г. Каримова, 1974; С.И. Плященко, В.Т. Сидоров,
1979; А.Д. Белов, И.М. Беляков, В.А. Лукьяновский, 1983; С.С. Абрамов, 1989;
М.И. Закревский, А.Н. Карташова, 1993; Н.С. Хренов, 1993; А.В. Фролов, 1997;
А.А. Кузнецов, 1998; В.А. Васяев, 1998; С.Н. Миносян, 1998; А.В. Коробов, 2002
и др.) для быстрого и временного улучшения микроклимата, можно успешно
пользоваться различными методами: искусственное ультрафиолетовое излучение,
аэроионизация, использование различных аэрозолей, т.е. такими, которые
обеспечивают улучшение не только параметров микроклимата, но и повышают
естественную резистентность организма.
Рис. 16. Правильная внутренняя аэрорумбограмма (воздухораспределение)
после установки дополнительных воздуховодов.
- приточные шахты, 2- приточный воздуховод, 3- клеточные батареи, 4-
опорные колонны, 5- вытяжные вентиляторы, 6- дополнительные приточные
воздуховоды
Так, нами проведены опыты по
улучшению микроклимата птичников под влиянием искусственной аэроионизации на
ремонтный молодняк и взрослое поголовье кур-несушек породы «Канадский леггорн
СК-288», линии С. Для проведения исследований в птичниках формировались опытные
группы птицы по 150 голов. Кормление, уход и содержание птицы было одинаковым и
соответствовало зоотехническим нормативам. Различие заключалось лишь в том, что
воздух в месте нахождения опытной группы искусственно ионизировался при помощи
аэроионизатора системы ВИЭСХ.
Аэроионизацию проводили ежедневно на
уровне 40 см от пола по одному часу 4 раза в день в период кормления в течение
2,5 месяцев. Контроль количества аэроионов воздухе проводился ежемесячно при
помощи счетчика ионов САГ-2М.
Концентрация отрицательных лёгких
ионов в зоне расположения птицы была в пределах от 48 до 49 тыс./см3 воздуха..
В зоне аэроионизации микроклимат существенно отличался от такового без неё.
Так, температура воздуха в зоне аэроионизации была в среднем 15,9 0С, а в
контроле, где аэроионизацию не проводили 11,2 0С; влажность 65,6 %, а в
контроле 83,9 %; скорость движения воздуха 0,106 м/с, а в контроле 0,063 м/с,
концентрация аммиака 0,0033 мг/л, а в контроле 0,05 мг/л; углекислого газа 0,2
%, а в контроле 0,6 %. Снижалась также и бактериальная обсемененность в
участках аэроионизации на 31,5 % по сравнению с контрольными участками.
Искусственная аэроионизация оказала
положительное влияние на продуктивность птицы: живая масса цыплят, подвергнутых
ионизации к концу опыта была выше на 23,2 % по сравнению с контролем. При этом
курочек опытной группы наблюдалась более ранняя яйценоскость. Яценоскость
кур-несушек повысилась на 15,3 %.
Таким образом, искусственная
аэроионизация легкими отрицательными ионами способствует улучшению качества
микроклимата в птичниках, увеличению приростов живой массы и яценоскости
кур-несушек.
Также, для временного улучшения параметров микроклимата в участках
локальных аэростазов, нами предложен метод санации застойных зон воздуха
универсальным дезинфицирующим средством Virkon S.
Препарат представляет собой сбалансированную стабилизированную смесь
пероксидных соединений, поверхностно - активных форм органических кислот и
неорганической буферной системы. Главным составляющим компонентом препарата (до
50%) является калия пероксисульфат. Данный препарат обладает широким спектром
антибактериального и антивирусного действия и широко используется для
дезинфекции хирургического оборудования и животноводческих помещений в
присутствии животных, также применяется для предотвращения различных
инфекционных заболеваний (сальмонеллез, колибактериоз, болезнь Марека, болезнь
Гамборо и др.), снижает падеж, предотвращает снижение яйценоскости и повышает
среднесуточные приросты массы тела при многократном применении препарата. Для
аэрозольной дезинфекции помещения в присутствии птицы препарат применяется в
виде 0,5-1% раствора, расход препарата 1 литр на 100 м3.
Дезинфекции препаратом Virkon
проводились в присутствии птицы (поголовье 3900 голов молодняка кур 59 и 102 -
дневного возраста) в участках застоя воздуха (аэростазах) при помощи струйного
аэрозольного генератора типа САГ - 1, препарат употреблялся в виде 1% раствора,
из расчета 1 литр на 100 м3 воздуха, распыление препарата происходило в течение
30 минут. Перед применением препарат смешивали со стабилизатором (глицерин) из
расчета 10% стабилизатора к общему объему раствора. До и после дезинфекции
проводились исследования следующих показателей микроклимата: температура,
относительная влажность, скорость движения воздуха, общая микробная
обсемененность воздуха, концентрации аммиака и углекислого газа. В одном из
птичников было проведено исследование гуморальных факторов естественной
резистентности у птиц из зоны застоя и у птиц из участка нормативного
микроклимата, результаты исследований представлены в таблицах 17-18.
Таблица 17
Показатели микроклимата до и после проведения аэрозольной дезинфекции
|
Параметры микроклимата
|
До дезинфекции в зоне
аэростаза
|
После дезинфекции в зоне
аэростаза (3 часа)
|
|
Ярусы клеточной батареи
|
верхний ярус
|
средний ярус
|
верхний ярус
|
средний ярус
|
|
Температура, ОС
|
25,5
|
23
|
24
|
24,5
|
|
Относительная влажность, %
|
81
|
83
|
75
|
76
|
|
Аммиак, мг/м3
|
12
|
10
|
9
|
7
|
|
Углекислый газ, %
|
0,3
|
0,25
|
0,2
|
0,2
|
|
Скорость движения воздуха,
м/с
|
0,04
|
0,08
|
0,09
|
0,14
|
|
Микробная обсемененность,
тыс./м3
|
89,9
|
98,8
|
47,6
|
77,9
|
Из данных таблицы 17 следует, что через три часа после проведения
аэрозольной дезинфекции в участке застоя воздуха происходили снижения аммиака с
12 до 9 мг/м3 и углекислого газа в 1,25 и 1,5 раза; отмечалось некоторое
увеличение скорости движения воздуха на 0,05-0,06 м/с, что свидетельствует о
лучшей циркуляции воздушных масс в исследуемом участке по сравнению с исходным
состоянием до проведения дезинфекции. Исследования общей микробной
обсемененности седиментационным методом показали, что в зонах застоя воздуха
(аэростазах) происходило снижение общей микробной обсемененности тыс. микробных
тел в м3 воздуха через 3 часа (с 89,9 до 47,6 тыс./м3) в 1,88 раза, через 6
часов (с 89,9 до 45,4 тыс./м3) в 2 раза и через 12 часов (с 89,9 до 28,1
тыс./м3) в 3,2 раза.
Исследования микроклимата в другом птичнике, показали, что после
проведения аэрозольной дезинфекции также происходило улучшение показателей
микроклимата в аэростазных зонах (табл. 18).
Таблица 18
Показатели микроклимата до и после проведения дезинфекции
|
Параметры микроклимата
|
До дезинфекции в зоне
аэростаза
|
После дезинфекции в зоне
аэростаза (3 часа)
|
|
Ярусы клеточной батареи
|
верхний ярус
|
средний ярус
|
Верхний ярус
|
средний ярус
|
|
Температура, ОС
|
22,0
|
21,5
|
24
|
24
|
|
Относительная влажность, %
|
74
|
74
|
67
|
71
|
|
Аммиак, мг/м3
|
12
|
10
|
9
|
7
|
|
Углекислый газ, %
|
0,35
|
0,25
|
0,2
|
0,2
|
|
Скорость движения воздуха,
м/с
|
0,05
|
0,16
|
0,12
|
0,2
|
|
Микробная обсемененность,
тыс./м3
|
40,3
|
66,2
|
22,4
|
37,3
|
Так, после проведения дезинфекции препаратом Virkon в участках аэростазов, происходило улучшение,
санитарных показателей качества микроклимата (аммиака и углекислого газа), т.е.
отмечалось снижение аммиака на 3 мг/м3 и углекислого газа в 1,25 и 1,75 раза в
воздухе аэростазных участков. Также происходило некоторое увеличение скорости
движения воздуха на 0,4-0,7 м/с, что свидетельствует о лучшей циркуляции воздуха
в исследуемом участке (см. табл. 18).
Исследованиями общей микробной обсемененности воздуха седиментационым
методом установлено, что после проведения аэрозольной дезинфекции в участке
аэростаза происходило снижение общей микробной обсемененности воздуха тыс.
микробных тел в м3, через три часа в 1,8 раза (с 40,3 до 22,4 тыс./м3); через 6
часов в 1,2 раза (с 40,3 до 34,7 тыс./м3) и через 12 часов в 1,1 раз (с 40,3 до
37,9 тыс./м3).
В одном из птичников были проведены исследования некоторых показателей естественной
резистентности организма (бактерицидной, лизоцимной активности сыворотки крови
и сиаловых кислот). Было установлено, что применение аэрозольной дезинфекции
препаратом Virkon способствует восстановлению уровня
естественной резистентности у молодняка кур.
Из данных таблицы следует, что уровень показателей естественной
резистентности: бактерицидной и лизоцимной активности сыворотки крови у
молодняка кур из зоны застоя воздуха до проведения дезинфекции составлял 28,2%±5,82 и 1,7%±0,17 соответственно и был достоверно
ниже на 17,3% (Р<0,05) - бактерицидная активность и 1,0% (Р<0,01) -
лизоцимная активность, чем у молодняка кур, находящегося в участках
нормативного микроклимата. Через сутки после проведения аэрозольной дезинфекции
препаратом Virkon S в участках застоя воздуха уровень этих же показателей
составлял уже 58,4%±6,54 - бактерицидная активность и 2,2%±0,33 - лизоцимная активность. В участках с нормальным
микроклиматом он был 59,3%±7,40 - бактерицидная активность и 2,3%±0,11 - лизоцимная активность, т.е.
данные показатели достоверно не отличались в обоих исследуемых участках, что
свидетельствует о том, что данный препарат восстанавливает уровень естественных
гуморальных защитных сил организма. Исследуемый уровень сиаловых кислот в
сыворотке крови молодняка кур после проведения дезинфекции в зоне застоя не
имел достоверных различий с птицей из участков нормального микроклимата, что
свидетельствует о низкой токсичности препарата.
Таблица 19
Показатели гуморальной естественной резистентности птиц
|
Показатели крови
|
Опытная группа
|
Контрольная группа
|
|
Время исследований
|
До дезинфекции
|
после дезинфекции
|
до дезинфек ции
|
после дезинфекции
|
|
БАСК, %
|
28,2±5,82
|
58,4±6,54
|
45,5*±3,80
|
59,3±7,40
|
|
ЛАСК, %
|
1,7±0,17
|
2,2±0,33
|
2,7**±0,21
|
2,3±0,11
|
|
Сиаловые кислоты, ед. опт.
Плотности
|
42,0± 3,32
|
63,8± 4,16
|
45,8± 6,25
|
50,0± 6,58
|
Примечание здесь и далее: БАСК - бактерицидная активность сыворотки
крови; ЛАСК - лизоцимная активность сыворотки крови.
В течение месяца до проведения дезинфекции в 2-х исследуемых птичниках в
аэростазных участках отмечались единичные случаи падежа цыплят от гепатита,
перитонита, алиментарной дистрофии и массовые расклевы. Так, в течение месяца
от внутренних незаразных заболеваний в основном от массового расклева пало 1078
голов, что составляло около 60% от всей павшей птицы по причине расклева и др.
незаразных заболеваний в исследуемых птичниках. После проведения четырехкратных
аэрозольных дезинфекций в аэростазных участках исследуемых птичников полностью
прекратились падеж и выбраковка птиц от расклева и других незаразных
заболеваний.
.1 Использование препарата Virkon S для улучшения
микроклимата в помещениях для напольного содержания цыплят-бройлеров
Наши исследования, проведенные в птичниках-моноблоках для напольного
выращивания цыплят-бройлеров, показали, что при одинаковой системе подачи
воздуха по типу «сверху-вниз» воздухораспределение в типовых помещениях
осуществлялось неравномерно (Рис. 17). Вследствие чего в разных залах одного и
того же моноблока формировались разные микроклиматические условия (см. табл.
20), которые оказывали различное влияние на организм и продуктивность цыплят.
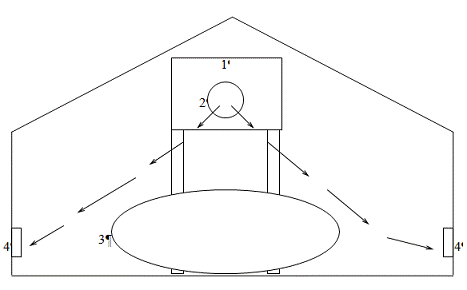
Рис. 17 Внутренняя аэрорумбограмма птичника-моноблока:
- венткамера, 2 - приточный воздуховод, 3 - участок застоя воздуха, 4
-вытяжные вентиляторы.
Исследования проводились в 1-ом и 2-ом залах моноблока, размером 18 х 84
м каждый, с плотностью посадки 15-16 цыплят-бройлеров на 1 м2 площади пола. В
течение периода исследований птица из обеих залов находилась в одинаковых
условиях кормления и содержания.
Таблица 20
Показатели микроклимата в птичнике-моноблоке для выращивания цыплят
бройлеров
|
Показатели микроклимата
|
Периоды выращивания
цыплят-бройлеров
|
|
1-2 недели
|
2-4 недели
|
4-7 недели
|
|
2 зал
|
1 зал
|
2 зал
|
1 зал
|
2 зал
|
1 зал
|
|
Температура, 0С
|
С
|
31,0-27,5 29,3
|
30-29 29,5
|
26,0-22,5 24
|
23-21 22
|
20,5-15,5 17,75
|
16,6-29,6 19,6
|
|
Т
|
31,0-24,5 27,8
|
32,5-26,0 29,3
|
25,5-18,0 21,75
|
26,0-24,5 25,25
|
20,5-11,5 16
|
25,5-17,0 21,25
|
|
Относительная влажность, %
|
С
|
28-36 32
|
36-54 45
|
34-36 35
|
43-45 44
|
45-65 55
|
43-52 47,5
|
|
Т
|
34-59 46,5
|
50-64 57
|
49-56 52,5
|
51-57 54
|
50-64 57
|
59-68 63,5
|
|
Подвижность воздуха, м/с
|
С
|
0,81-1,7 1,3
|
0,1-0,4 0,25
|
0,64-2,0 1,32
|
0,36-1,8 1,1
|
0,41-0,86 0,64
|
0,42-0,5 0,46
|
|
Т
|
0,02-0,25 0,035
|
0,01-0,2 0,11
|
0,14-0,18 0,16
|
0,2-0,32 0,26
|
0,17-0,32 0,245
|
0,11-0,38 0,245
|
|
Аммиак, мг/м3
|
С
|
2,5-5 2,5
|
5-10 5
|
6-7,5 6,75
|
6-15 10,5
|
10-15 12,5
|
5-10 7,5
|
|
Т
|
2,5-6 4,3
|
3-5 4
|
2,5-12,5 7,5
|
4-12,5 8,25
|
5-17,5 11,25
|
22,5-25 23,75
|
|
Углекислый газ, %
|
С
|
0,1-0,4 0,25
|
0,1-0,2 0,15
|
0,3-0,4 0,35
|
0,1-0,2 0,15
|
0,1-0,2 0,15
|
0,1-0,2 0,15
|
|
Т
|
0,1-0,25 0,175
|
0,1-0,3 0,2
|
0,2-0,25 0,23
|
0,25-0,3 0,275
|
0,1-0,2 0,15
|
0,2-0,3 0,25
|
|
Микробная обсемененность,
тыс./м3
|
С
|
398
|
1234
|
-
|
-
|
1844
|
4832
|
113-115 114
|
404-604 504
|
-
|
-
|
2098-2543 2320
|
6359-7312 6835,5
|
Было установлено, что воздухообмен в 1-ом и 2-ом залах был примерно
одинаковым на 10, 21 и 31-ый дни исследований и составлял: 6,13; 3,09; 1,25 и
5,68; 2,66; 1,32 м3/ч на кг ж.м. Различия в колебании температуры в обоих залах
в течение четырёх недель выращивания цыплят были незначительными, однако с
26-го по 45-ый дни выращивания цыплят бройлеров отмечалось увеличение
температуры в торцевых частях 1-го зала в среднем на 5 0С по сравнению со 2-ым
залом.
В течение 4 недель исследований отмечалась низкая относительная влажность
в исследуемых залах, так во 2-ом она была в пределах 28-57%, а 1-ом и 36-56%.
Установлено, что к 4-ой недели выращивания происходило увеличение концентрации
аммиака в обоих исследуемых залах, так в 2-ом зале она колебалась в пределах
5-17,5 мг/м3 , а во втором зале 10-25 мг/м3, что в 1,6 раза выше чем в 1-ом.
Содержание углекислого газа колебалось в пределах 0,2-0,3% в 1-ом зале и
0,1-0,4% во 2-ом зале. К концу периода выращивания цыплят происходило постепенное
увеличение общей микробной обсеменённости воздуха в помещениях, так к 42-му дню
в 1-ом зале она достигала 4832 тыс./м3 и в 2 раза превышала таковую во 2-ом
зале (2543 тыс./м3).
При изучении основного микробного фона воздуха в птичнике были выделены микроорганизмы
родов staphylococcus и bacillus.
Для изучения влияния микроклимата на естественную резистентность и
продуктивность цыплят были изучены следующие гематологические и
иммунологические показатели: эритроциты, тромбоциты, лейкоциты, гемоглобин, бактерицидная
и лизоцимная активности сыворотки крови, фагоцитарная активность тромбоцитов,
общий белок. Исследования крови цыплят проводились в 4, 20, 34 и 41- дневном
возрасте. В течение всего периода исследований проводились наблюдения за общим
клиническим состоянием птицы из двух исследуемых залов. Также изучались
среднесуточные привесы.
Было установлено снижение количества эритроцитов к концу периода
выращивания цыплят в двух исследуемых залах на 9,3% и 24,4%, что как мы
полагаем, происходило, из-за повышения концентрации аммиака в помещениях в этот
период. Также отмечалось достоверное увеличение количества лейкоцитов в 2 и 1,5
раза на 20-ый и 34-ые дни выращивания цыплят и повышение тромбоцитов в 2 раза к
34 дню выращивания у птицы в 1-ом зале по сравнению со 2-ым залом. Увеличение
количества тромбоцитов и лейкоцитов происходило, по-видимому, как следствие
повышенной микробной нагрузки на организм цыплят.
Данные исследования гематологических показателей представлены в таблице
№. 21.
Таблица 21
Некоторые гематологические показатели цыплят-бройлеров, (M±m)
|
Гематологические показатели
|
Дни выращивания
цыплят-бройлеров
|
|
Начало исследований
|
Середина исследований
|
Конец исследований
|
|
1
|
2
|
1
|
2
|
1
|
2
|
|
Эритроциты х1012 л
|
2,9± 0,13
|
2,87± 0,416
|
2,76± 0,271
|
2,02± 0,08
|
2,63± 1,131
|
2,17* ±0,044
|
|
Гемоглобин, г/л
|
21,2± 1,154
|
18,8± 2,417
|
33,0± 2,65
|
23,6± 5,31
|
69,8± 6,71
|
51,2* ±3,67
|
|
Тромбоциты х109 л
|
89,6± 17,92
|
88,8± 15,36
|
100± 17,05
|
122± 17,05
|
147± 36,53
|
70± 10,0
|
|
Лейкоциты х109 л
|
25,6± 4,12
|
35,2± 2,65
|
47,0*± 5,26
|
21,6± 2,71
|
49,0*± 9,98
|
32,0± 16,1
|
Примечания здесь и далее: 1 - 1 зал, 2 - 2 зал; *- P<0,05.
Отмечено также и достоверное снижение показателей естественной
резистентности цыплят в первом зале по сравнению со вторым. Данные об изменении
естественной резистентности в течение периода выращивания цыплят бройлеров
представлены в таблице.
Таблица 22
Некоторые показатели естественной резистентности цыплят - бройлеров, М±м
|
Показатели естественной
резистентности цыплят
|
Дни выращивания
цыплят-бройлеров
|
|
4
|
20
|
34
|
41
|
|
1
|
2
|
1
|
2
|
1
|
2
|
1
|
2
|
|
БАСК, %
|
25,0± 9,57
|
18± 2,0
|
12,7± 2.67
|
18,5± 6,62
|
44,7± 9,12
|
69,2*±4,39
|
56,0± 2,0
|
67,3*±4,37
|
|
ЛАСК, %
|
9,8± 0,92
|
9,3± 0,95
|
7,6± 1,40
|
5,4± 0,24
|
5,8± 0,66
|
8,8*± 0,63
|
9,5± 2,96
|
19,2*±0,58
|
|
ФА, %
|
27,2± 1,96
|
26,0± 2,9
|
41,5± 4,19
|
57,5± 6,89
|
33,6± 8,18
|
24,0± 5,60
|
34,5± 3,95
|
40,5± 11,24
|
|
ФЧ
|
2,5± 0,23
|
3,2± 0,21
|
1,2± 0,19
|
2,9± 0,83
|
5,1± 0,93
|
6,9± 1,65
|
1,5± 0,60
|
1,6± 0,60
|
|
ФИ
|
0,7± 0,08
|
0,9± 0,13
|
2,7± 0,24
|
4,9± 8,85
|
1,9± 0,66
|
1,7± 0,69
|
2,6± 0,12
|
4,0± 0,46
|
|
Общий белок, г/л
|
29,1± 1,06
|
26,4± 2,12
|
20,5± 2,34
|
22,7± 2,17
|
33,6± 1,75
|
31,7± 1,78
|
40,0± 2,15
|
42,6± 2,46
|
Анализируя данные таблицы следует, что на 34 и 41 дни выращивания у
цыплят из 1-го зала отмечалось достоверное снижение: бактерицидной активности
сыворотки крови на 24,5% (P<0,05)
и 11,3% (P<0,05) и лизоцимной активности
сыворотки крови на 3% (P<0,05)и
9,7 % (P<0,05) соответственно, по
сравнению с цыплятами из 2-го зала.
Уровень фагоцитарной активности и общего белка в течение периода
исследований достоверно не отличался в обоих залах.
Таким образом, повышенная микробная контаминация воздуха в помещении
способствовала снижению показателей естественной резистентности у цыплят.
Снижение естественных защитных сил организма не смогло не сказаться на
продуктивности птицы. Так, к концу периода выращивания цыплят-бройлеров
среднесуточные приросты у птицы из первого зала были ниже по сравнению со 2-ым
залом. Так, среднесуточный прирост в 1-ом зале был 31,8 г, а во 2-ом 32,9 г,
что на 1 г выше, чем в первом. Падёжи птиц за период исследований составили в
1-ом зале 1584 головы, а во 2-ом 1377, что на 207 голов меньше, чем в 1-ом.
Для создания оптимальных условий микроклимата, т.е. снижения высокой
микробной контаминации и содержания аммиака в птичниках было проведены
двукратные аэрозольные дезинфекции в 2-ух трёхзальных птичниках-моноблоках № 8
и № 19. Объём каждого зала птичников - 6000 м3.
Дезинфекцию проводили два дня подряд универсальным дезинфицирующим
средством Virkon S согласно инструкции к препарату. До дезинфекции проводилась
механическая чистка помещения и оборудования птичника. До и после проведения
дезинфекции были проведены гигиенические исследования по следующим показателям:
параметрам микроклимата (температуре, относительной влажности, скорости
движения воздуха, аммиаку, общей микробной обсемененности воздуха). В 1-ом зале
птичника-моноблока № 8 дезинфекция не проводилась.
Дезинфекция в птичниках препаратом проводили в присутствии птицы
(поголовье: птичник № 8 - 51383 голов цыплят бройлеров 16-17-ти дневного
возраста; птичник № 19 - 77500 голов 23-25-ти дневного возраста) аэрозольным
методом при помощи струйного аэрозольного генератора типа АПА. Препарат
употреблялся в дозе 1% раствора, расход раствора 24 литра на 6000 м3 воздуха,
распыление препарата производилось в течение 45 минут. Перед применением
препарат смешивали со стабилизатором (глюкоза) из расчета 10% стабилизатора к
общему объему раствора. Распыление препарата в птичниках происходило при
выключенной системе вентиляции.
Контроль качества дезинфекции проводился по общей микробной обсемененности
и количеству кишечной палочки в воздухе.
До и через 3; 6 и 22 часа после дезинфекции в птичнике № 19 проводились
исследования воздуха седиментационным методом на общую микробную обсемененность
и количество кишечной палочки. Было установлено, что через час после проведения
дезинфекции в птичнике отмечалось снижение содержания в воздухе помещения
аммиака с 10 до 7,5 мг/м3. Также, через 3 и 6 ч после дезинфекции в птичнике
происходило снижение общей микробной обсемененности воздуха в 2 и 3 раза соответственно.
Также отмечалось снижение содержания кишечной палочки в воздухе помещения в 1,2
и 2 раза соответственно, через 3 и 6 ч после проведения дезинфекции в
помещении.
Таблица 23
Общее количество микроорганизмов и кишечной палочки в воздухе помещения
до и после проведения аэрозольной дезинфекции Virkon S
|
Показатели
|
Время исследований
|
|
До дезинфекции
|
3 ч после дезинфекции
|
6 ч после дезинфекции
|
24 ч после дезинфекции
|
|
Общая микробная
контаминация воздуха, тыс./ м3
|
554,4
|
262
|
181
|
393,6
|
|
Содержание кишечной
палочки, в м3 воздуха
|
3680
|
3040
|
1760
|
2576
|
Кроме того, для изучения влияния препарата Virkon S на организм цыплят бройлеров в 1-ом и 2-ом зале одного из
птичников-моноблоков проведились исследования крови по следующим показателям:
количество эритроцитов, лейкоцитов и гемоглобина; лейкограмма; бактерицидная и
лизоцимная активности сыворотки крови общий белок и белковые фракции.
Исследования крови проводились за сутки до проведения аэрозольной дезинфекции и
через 5 дней после неё.
Было установлено, что до проведения дезинфекции достоверных различий по
содержанию общего белка и белковых фракций, бактерицидной и лизоцимной
активностям сыворотки крови не отмечалось у птиц из обоих исследуемых залов.
После проведения аэрозольной дезинфекции у птицы из 2-го зала (опытная группа)
происходило достоверное увеличение лизоцимной активности сыворотки крови и
общего белка на 6,1% и 21% соответственно по сравнению с птицей из 1-го зала
(контрольная группа). Также, у птицы из 2-го зала было отмечено увеличение гамма-глобулиновой
фракции белка на 29% по сравнению с первым залом.
Таблица 24
Некоторые гематологические и иммунологические показатели цыплят-
бройлеров до и после проведения аэрозольной дезинфекции, (M±m)
|
Показатели крови
|
Опытная группа
|
Контрольная группа
|
|
До проведения дезинфекции
|
После проведения
дезинфекции
|
До проведения дезинфекции
|
После проведения
дезинфекции
|
|
Эритроциты х1012/л
|
2,76±0,215
|
2,41±0,104
|
2,44±0,178
|
2,53±0,129
|
|
Гемоглобин, г/л
|
70±2,97
|
73,2±1,49
|
65±1,48
|
80,2±6,74
|
|
Лейкоциты х109/л
|
36±6,32
|
20,8±3,20
|
26,4±4,12
|
27,2±6,12
|
|
ЛАСК, %
|
5,4±0,51
|
11,2* ±1,655
|
6,6±0,75
|
5,13±0,826
|
|
Общий белок, г/л
|
28,48±2,395
|
39,36*±1,723
|
26,56±1,30
|
31,04±0,640
|
|
Ig, г/л
|
6,096±1,145
|
12,12±1,816
|
8,22±0,549
|
8,578±0,743
|
В течение периода исследований также изучался среднесуточные приросты
живой массы у птиц из 1 и 2 зала птичника. Было установлено, что к 44 дню
выращивания средняя живая масса цыплят из 1-го зала была 1513 г, а во втором
1677 г, что на 164 г больше, чем в 1-ом. Среднесуточной прирост живой массы с 8
по 44 дни выращивания составил 38 г в 1-ом зале и 42 г во 2-ом зале, что на 4 г
выше, чем в 1-ом зале.
Таким образом, исходя из вышеизложенного, следует, что, во-первых:
универсальное дезинфицирующее средство Virkon, можно использовать в птицеводческих помещениях, для
улучшения микроклимата, как препарат, улучшающий санитарные показатели качества
воздушной среды; во вторых: данный препарат можно использовать в качестве
средства, восстанавливающего уровень естественных защитных сил организма и
снижающего выбраковку цыплят от многих инфекционных и внутренних незаразных
заболеваний (гепатитов, перитонитов, алиментарных дистрофий, каннибализма
(расклёва), стафилококковых дерматитов, колисептицемии и др.).
9. Применение ультрафиолетового облучения для улучшения микроклимата,
повышения естественной резистентности, продуктивности и снижения заболеваемости
у птиц, телят, ягнят и поросят
При отсутствии на животноводческих предприятиях аэрозольной техники и
генераторов аэроионов можно использовать искусственное облучение
ультрафиолетовыми лампами. Так, как известно, что ультрафиолетовые лучи с
различной длиной волн не только улучшают качество микроклимата в
животноводческих помещениях, но и оказывают разностороннее благоприятное
действие на организм животных (А.Д. Белов, И.М. Беляков, В.А. Лукьяновский,
1983; С.С. Абрамов, И.Г. Арестов, И.М. Карпуть, 1990; Л.М. Обухов, 1991; А.В.
Коробов, 2002; А.Ф. Кузнецов, 2003; В.А. Медведский, А.Ф. Трофимов, Т.В.
Соляник и др., 2003 и ряд др.).
Так, нами проведены опыты на Витебской птицефабрике на ремонтном
молодняке кур-несушек породы канадский леггорн в возрасте 6 месяцев, которые
содержались в типовом широкогабаритном птичнике в клетках типа КБУ - 3 с
трёхъярусным расположением клеток. Для этого было сформировано две группы птиц
(опытная и контрольная) по 600 птиц в каждой группе. Для облучения использовали
ДРЭ-250 -БР, которые подвешивались под потолком в проходе между клеточными
батареями с таким расчётом, чтобы они находились от кормушек верхнего яруса на
1 м, среднего - на 2 м и нижнего около 3 м. Включение ламп проводили в период
кормления птиц, чтобы их головы0-56.промиздат, 1991. ий В.М., Обухов Л.М.
Внутренние незаразные болезни сельскохозяйственных животных. йценоскость кур в
верхн и корм находились под облучением на всех 3-ёх ярусах клеточной батареи.
В первый месяц облучения лампы включали сначала по 10 мин, 1 раз в день в
течении 10 дней, затем делали десятидневный перерыв, после которого следовал
опять десятидневный период облучения по 10 мин ежедневно. Во второй месяц опыта
включали лампы ежедневно по 10 мин в течение всего месяца, а в третий месяц
исследования лампы включали ежедневно по 10 мин 2 раза в день. На четвёртый и
пятый месяцы опыта лампы включали по методике первого месяца. Птица контрольной
группы ультрафиолетовому облучению не подвергалась. Учёт яйценоскости кур
проводился ежедневно, отдельно на каждом ярусе клеточной батареи. Одновременно
учитывалась и выбраковка птицы. Ежемесячно определяли вес 20-ти подопытных и
20-ти контрольных окольцованных кур.
Было установлено, что в первый месяц облучения птицы яйценоскость
подопытных кур в верхнем ярусе составила 27,6 яйца на одну голову, а в контроле
- 22,2 яйца (т.е. на 24,3 % меньше, чем в опытной группе). В среднем и нижнем
ярусах увеличение яйценоскости подопытных кур не произошло. Во второй месяц
облучения у подопытных кур верхнего яруса яйценоскость была выше, чем в
контроле на 9,1 %. В третьем месяце облучения дальнейшего увеличения
яйценоскости не произошло. В четвёртый месяц облучения яйценоскость кур в верхнем
ярусе была выше, чем в контроле на 24 %, в среднем ярусе на 18 5 и нижнем - на
16 %.
В пятый месяц облучения яйценоскость подопытных кур была выше, чем в
контроле на 27,4 %, на 18 % и на 15,4 % соответственно. Среднемесячные привесы
у облучаемых кур были выше, чем в контроле: на верхнем ярусе - на 53 г, среднем
- на 42 г и на нижнем - всего на 28 г. Выбраковка облучаемых кур составила 4,23
%, а контрольных - 8,75 %.
Таким образом, ежедневные десятиминутные облучения кур и корма лампами
ДРЭ-250 БР на расстоянии 1-2-3 метров в течение 10-ти дневных периодов с
десятидневными перерывами между ними, что примерно соответствует дозе 30-50 мэр
в час/м2, способствует увеличению яйценоскости кур на15,4-24,3 %. У облучаемых
кур также увеличивались привесы в среднем на 39,3 г на голову в месяц,
снижается выбраковка кур на 4,52 % по сравнению с необлучённой птицей.
Подобные результаты получены при использовании ультрафиолетового
облучения в телятниках. Так, по данным С.С. Абрамова при дозе облучения 160-180
мэр-ч/м телят с двадцатидневного до шестимесячного возраста УФ-лучами ламп
ДРВЭД-22С-160 в условиях карантинного отделения промышленного комплекса колхоза
им.Кирова Витебского района активизировались защитные функции организма. Так,
если до облучения уровень показателей естественной резистентности у телят
подопытных групп был одинаков, то через месяц у облучаемых животных все
изучавшиеся показатели естественного иммунитета были выше, чем у животных
контрольной группы. После пяти месяцев облучения бактерицидная активность
сыворотки крови у облученных телят превосходила таковую у контрольных на - 5 %,
лизоцимная активность сыворотки и содержание сульфгидрильных групп в крови на
6, реакция неспецифической агглютинации на 4, фагоцитарная активность
лейкоцитов на 20 %.
У телят опытных групп происходило статистически достоверное увеличение
содержания общего белка. Так, если перед началом опыта содержание общего белка
составляло у контрольных животных 64,2 г/л, а у опытных - 64,6. г/л, то в конце
наблюдений эти показатели были соответственно 67,7 г/л и 72,0 г/л. При этом у
облучаемых телят гаммаглобулины составляли 24,1 %, у контрольных - 21,9 %.
УФ-облучение способствовало поддержанию на более высоком уровне
кислотно-щелочного равновесия. Так, начале опыта показатели последнего у
облучаемых телят были даже несколько ниже, чем у контрольных, составляя
соответственно 444+2,64 мг% и 452+4,34 мг%. В конце же опыта отмечалось
статистически достоверное превышение указанного показателя у опытных телят
(480+4,7, у опытных и 468+3,25 мг% у контрольных при Р<0,05). УФ-облучение
не оказывает заметного влияния на такие показатели клинического статуса, как
температура, пульс, дыхание, максимальное и минимальное артериальное кровяное
давление подопытных животных.
Под влиянием УФ-лучей произошло значительное улучшение некоторых
показателей микроклимата в облучаемых секциях телятника. Так, в воздухе этих
секций через 30 мин работы лампы ПРК-2 содержание аэроионов отрицательного
знака колебалось в пределах от 18000 до 29000 в 1 cм3 воздуха, положительных -от 15000 до 25000, тогда как в
контрольных секциях в эти же периоды отрицательных аэроионов насчитывалось
насчитывалось от 580 до 960, а положительных - в пределах 860-2100 в 1 см3.
УФ-лучи способствовали снижению микробной загрязненности облучаемой части
телятника. В тех секциях, где применялось ультрафиолетовое облучение, через 30
мин после работы ПРК-2 количество бактерий составляло 25200, в марте - 28800, в
апреле - 28500, воздуха; в контрольных секциях - соответственно: 41360, 47600,
46300 и 44820.
УФ-облучение способствовало лучшему росту опытных животных, о чем могло
судить по изменению их живой массы. Так, перед началом облучения лампами ДРВЭД
масса животных в обеих группах была почти одинаковая и составляла в среднем по
контрольной группе 62,2+0,24 кг, а по опытной - 62,1+0,41 кг. В конце
исследований эти величины составили соответственно 108,9+0,62 и 112,6+0,48 кг
(Р< 0,05).
Среди телят опытной группы не регистрировались такие заболевания, как
периодическая тимпания рубца, гастроэнтериты, отмечено лишь шесть случаев (10
%) бронхопневмонии. В то же время среди контрольных животных бронхопневмонией
переболело 30 %,периодической тимпанией - 3 %, гастроэнтеритами - 5 %.
Таким образом, УФ-облучение молодняка крупного рогатого скота обусловливает
повышение общей устойчивости к неблагоприятным внешним факторам, способствует
интенсификации обменных процессов, предупреждает ряд заболеваний незаразной
этиологии.
Особенность УО-облучения ягнят в климатических условиях Белоруссии
состоит втом, что ягнята в зимне-весенний период, как правило, поражены так
называемыми кошарным инвазиями (кокцидиоз) , у них часто отмечаются нарушения
обмена веществ и большой процент простудных заболеваний. При этом основным
источником перезаражения ягнят кокцидиозом является несменяемая подстилка. В
этих вынужденно неблагоприятных эпизоотических условиях целесообразней всего
применять такие раздражители, которые с одной стороны повышали бы устойчивость
организма молодняка к заболеваниям, а с другой - способствовали санации внешней
среды. Таким раздражителем является УФ-излучение. Так, нами проведены
сравнительные опыты по влиянию различных источников ультрафиолетового излучения
на экзогенное развитие кокцидий овец в лабораторных условиях. В результате
исследований выявлено, что развитие кокцидий овец зависит от различного
соотношения областей ультрафиолетового спектра в излучателе. Так, например,
УФ-источники, имеющие в своем спектре излучения, значительное количество
коротковолновых ультрафиолетовых лучей (БУВ-15, ПРК-2), задерживали экзогенное
развитие кокцидий на 25-28 %. Ультрафиолетовое излучение ламп БУВ-30 и
ДЕВЭД-220 -160 с преобладанием длинно- и средневолновых УФ-лучей задерживало
спорогонию кокцидий лишь до 10-13%. В этом опыте было больше паразитов,
способных заразить ягнят. Кокцидии от овец, подвергнутых лечению лекарственными
веществами (кокцидиовит), менее устойчивы к УФ-лучам и бистро погибают во
внешней среде. Все это, по-видимому, способствует значительному санировании
верхних слоев глубокой несменяемой подстилки и меньшему перезаражению ягнят
кошарными инвазиями.
Исследования, проведенные по УФ-облучению ягнят и несменяемой подстилки
непосредственно в хозяйственных условиях различными источниками УФ-излучения,
показали, что лампы ПРК-2, излучающие резкий видимый свет и все три области
ультрафиолетового спектра, задерживают развитие садист кокцидий в поверхностных
слоях подстилки до 45 %, что значительно санирует среду обитания ягнят в зимних
условиях содержания. Однако эти лампы имеют существенные недостатки, которые
затрудняют их применение в животноводческих помещениях, и не пользуются спросом
у животноводов.
Наиболее целесообразными для применения в овчарнях являются УФ-лампы
ДРВЭД-220 -160. Так, их применяли при содержании овцематок с ягнятам на
соломенной глубокой несменяемой подстилке. УФ-облучение ягнят (50 голов)
проводилось с февраля по апрель ежедневно в течение 6-8 ч на высоте 1,5 м над
спиной -тавотного, доза облучения составляла 100-140 мэр-ч/м2. Приучивание
животных к УФ-облучению про -водилось постепенно в течение пяти дней. Контролем
были ягнята того же помещения, которые находились в одинаковых условиях
кормления и содержания, что и ягнята облучаемой группы. Животные обеих групп
перед облучением были поражены кокцидиями - с интенсивностью инвазии от 51 до
1500 ооцист в 20 полях зрения микроскопа (средняя - 360 ооцист), и у 1/3
поголовья наблюдались признаки поноса.
В сакманах с УФ-лампами поверхностше елок несменяемой подстилки были
значительно суше (на 7-17 %), в ней обнаружены единичные спорулированные
ооцисты кокцидий, в большинстве случаев нежизнеспособные. Поэтому у облучаемых
ягнят кокцидиозная инвазия была 22,5 раза меньше, чем у необлучаемых.
Гематологические показатели у облученных ягнят (табл. 25) были выше, чем у
необлученных (контрольных). Прирост массы у них также был выше на 2,16 кг. Из
50 необлученных ягнят почти все переболели острой формой кокцидиоза и 20 из них
пали.
Таким образом, УФ-облучение лампами ДРВЭД-220 -160 ягнят и подстилки
повышает устойчивость организма к заболеваниям, способствует обеззараживанию
поверхностных слоев несменяемой подстилки и улучшению микроклимата.
Следовательно, УФ-облучение ягнят является необходимой санитарно-гигиенической
процедурой в условиях интенсивного овцеводства.
Таблица 25
Некоторые гематологические показатели крови и прирост живой массы ягнят
при облучении их лампами ДРВЭД-220-160 (средние показатели в конце опыта
|
Группа животных
|
Показатели крови и прироста
живой массы
|
|
Гемоглобин, г/л
|
Эритроциты х 1012 /л
|
Лейкоциты х 109/ л
|
Са, ммоль/л
|
Р, моль/л
|
Живая масса, кг
|
|
Контрольная
|
89
|
8,1
|
10,2
|
2,80
|
2,50
|
10,5
|
|
Подопытная (облучаемая)
|
107
|
10,1
|
7,3
|
3,85
|
2,81
|
12,7
|
Как показали наши исследования не менее важную роль в получении и
выращивании здоровых и жизнеспособных поросят играло УФ-облучение особенно в
сочетании с обогревом инфракрасными лампами.
По мнению большинства из авторов предпосылкой для локального ИК-обогрева
является тот факт, что поросята первый период подсоса нуждаются в высокой
локальной температуре, которая зависит от их возраста. Так, в первую неделю
после опороса она должна быть в пределах - 30-28 °С, во вторую - 28-26 °С, в
третью - 26-24 °С и 24-22 °С в четвертую неделю жизни (А.П. Онегов, И.Ф.
Храбустовский, В.И. Черных, 1984; М.И. Закревский, 2003; В.И. Кобозев, 2003;
А.Ф. Кузнецов, 2003 и многие др.). В этот период наиболее целесообразно
применять комбинированную установку для инфракрасного обогрева и УФ-облучения
молодняка сельскохозяйственных животных ИКУФ-1. При этом один облучатель
устанавливается на два смежных логова для отдыха поросят-сосунов.
При отсутствии в хозяйстве облучателей ИКУФ-1 для облучения поросят в
подсосный период можно применять другие УФ-лампы в сочетании с инфракрасным
обогревом. Так, в нашем опыте с успехом применялись УФ-лампы ДРВЭД-220 -160 в
сочетании с инфракрасными лампами ИКЗ-500.
Так, в свинарнике-маточнике были подушены на высоте 1,5 м от спины
поросят УФ-лампы ДРВЭД-220 -160, которые облучали поросят ежедневно в течение
1,5-2,0 ч, что соответствовало дозе 20-25 мэр-ч/м;2. Поросят облучали с
декадными перерывами после каждых десяти дней облучения в течение подсосного
периода (два месяца). Одновременно применяли инфракрасный обогрев животных
лампами ИКЗ-500.
Такое комбинированное облучение имеет некоторое преимущество перед
облучателем ИКУФ-1 - высоту подвески различных ламп можно регулировать
независимо друг от друга, тем более, что у инфракрасных ламп она должна всегда
определяться опытным путем (по поведению поросят). В результате двухмесячного
УФ-облучения и инфракрасного обогрева поросята имели хорошее общее состояние,
не болели, среди них не било падежа (по контрольным животным - 38 %). Их
прирост ко дню отъема был выше, чем у необлученных (контрольных) животных на
1,75 кг на голову.
В заключение следует отметить, что биологическое действие
ультрафиолетовых лучей чрезвычайно многообразно. Во первых: они усиливают
естественную устойчивость организма, повышают уровень обменных процессов,
увеличивают продуктивность, предупреждают развитие ряда заболеваний. Во вторых:
профилактическое УФ-облучение сельскохозяйственных проводят в течение всего
осенне-зимнего периода, начиная с октября и заканчивал в апреле, т.е. именно в
тот период, когда животные испытывают так называемое ультрафиолетовое
голодание. При содержании животных без прогулок в условиях крупных промышленных
комплексов рекомендуется проводить профилактические УФ-облучение в течение
года.
В третьих под влиянием УФ-лучей значительно возрастает сохранность
молодняка, поэтому только исходя из этого облучение молодняка должно стать обязательной
процедурой.
В четвёртых: в настоящее время промышленность выпускает большой
ассортимент ламп. На наш взгляд наиболее удобными для УФ-облучения являются те,
которые не оказывают вредного воздействия на обслуживающий персонал и животных,
не требуют громоздкой токопитающей системы. Таким требованиям отвечают лампы
ДРВЭД-220 -160.
Весьма перспективны в этом отношении комбинированные установки типа ИКУФ,
сочетающие одновременно источники как инфракрасного, так и ультрафиолетового
облучения. Применение их, особенно в свиноводстве, в значительной степени
решает такую проблему, как повышение сохранности поросят.
В пятых: под влиянием УФ-облучения происходит значительное оздоровление
микроклимата и подстилки в животноводческих помещениях.
.1 Аэростазы в помещениях для содержания свиней и телят. Аэростазный
сепсис свиней на откорме
У свиней на откорме в помещениях с недостаточным воздухообменом
(характерным для жёсткого аэростаза) или отсутствием его микроклимат быстро, в
течение 1...3 суток приобретает токсические свойства. Чаще это наблюдайся в
свинарниках с подпольной вытяжкой воздуха из навозных траншей при подпирании
навозной жижи в вытяжных воздуховодах (рис.4). При этом состояние микроклимата
становится характерным для аэростаза: температура 23...25°С, влажность
97...99%, подвижность воздуха менее 0,1 м/с, концентрация аммиака достигает 45
мг/м3, а микробная обсемененность свыше 230 тыс. микробных тел/м3. Высокая
концентрация аммиака вызывает воспалительный процесс в дыхательных путях,
подавляется иммунная система, открываются ворота для аэрогенной микрофлоры и
организм становится неспособным противостоять инфекции. Развивается его общий
сепсис с характерными клиническими и патолого-анатомическими признаками: общая
слабость, жажда, отказ от корма, стойкая высокая лихорадка, одышка,
гнойно-геморрагическая пневмония, ринит, серозно-фибринозный плеврит,
перикардит, гнойный лимфаденит, особенно средостенных лимфоузлов,
геморрагический диатез, септическая селезенка, зернистая дистрофия печени,
почек, миокарда, катаральный энтероколит, конъюнктивит, рыхлосвернувшаяся
тёмнокрасная кровь, общая анемия. Однако нет инфарктов селезенки. Болезнь может
поражать до 80 % поголовья с отходом до 30...40 %. При этом лекарственные
препараты (антибиотики и сульфаниламиды) становятся неэффективными, что дает
основание ветслужбе ставить подозрение на чуму свиней, поскольку
патолого-анатомические изменения очень схожие. Однако для аэростазного сепсиса
существует характерная черта - наличие болезни и падежа всех возрастных групп
животных только в одном аэростазном помещении. В других помещениях болезни и
падежа нет, что удачно отличает эту болезнь от чумы свиней. После обнаружения
аэростаза и возобновления нормативного воздухообмена в свинарнике спустя 3...4
дня лекарственные препараты начинают восстанавливать лечебный эффект и падеж
прекращается, а затем приостанавливается выявление больных животных.
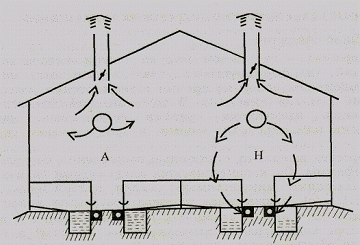
Рис.17. Внутренняя вертикальная аэрорумбограмма свинарника-откормочника
со смешанной вентиляцией: А - аэростаз; Н - нормальная аэрорумбограмма после
очистки навозных траншей и подпольных воздуховодов от навозных стоков.
Аэростазный сепсис свиней может быть с превалированием изменений в легких
и кишечнике в зависимости от преобладающей условно-патогенной микрофлоры.
Возможны наслоения вирусной инфекции и инвазий. Таким образом, жёсткий аэростаз
вызывает у свиней острое проявление болезни в виде сепсиса вызванного
повышенным содержанием условно-патогенной микрофлоры в воздухе, подстилке.,
кормушках и другом оборудовании помещения. При этом отмечается большой отход
свиней, что в целом можно сравнить с особо опасными инфекциями (классическая
чума свиней, сальмонеллёз и некоторые др.).
.2 Аэростазная бронхопневмония телят
В телятниках с недостаточным воздухораспределением приточного воздуха
возникают аэростазы (с признаками характерными для жесткого аэростаза),
приводящие к постановке неправильных диагнозов, неэффективным мероприятиям и
большому экономическому ущербу для хозяйств. Аэростазная бронхопневмония телят
чаще бывает в промышленном скотоводстве в карантинных помещениях откормочных
комплексов. Так, например, в одном карантинном помещении откормочного комплекса
на 3 тыс. голов в секции на 280 голов возникло острое заболевание спустя
10...14 дней после заполнения секции с подозрением на пастереллез: высокая и
стойкая лихорадка, одышка с истечениями из носа, тахикардия, запор-понос,
жажда, общая слабость, отказ от корма. Из 280 телят в течение месяца пало 94,
т.е. более 30% поголовья. При этом антибиотики тетрациклинового ряда и
сульфаниламидные препараты не дали лечебного эффекта. Патолого-анатомические
изменения были характерными: серозный лимфоденит, главным образом бронхиальных
и средостенных лимфоузлов, двухсторонняя лобарная гнойно-некротическая
бронхопневмония, фибринозный плеврит, катар тонкого и толстого кишечника,
катаральный конъюнктивит, общая анемия и истощение. Выделена условно-патогенная
микрофлора.
При этом установлен закольцованный аэростаз, т.е. над животными вращался
воздушный вал с токсическим микроклиматом (температура 23 °С, влажность 97 %,
подвижность менее 0,1 м/с, концентрация аммиака 40 мг/м3, микробная
обсемененность 210 тыс. микробных тел/м3), он не обменивался со свежим
воздухом, так как он из воздуховода подавался вверх к коньковой вентиляции на
естественной тяге. Таким образом, верхняя зона помещения, где не было животных
продувалась, а внизу, где они располагались, обмена с наружным воздухом не было
(рис.18).
Для ликвидации этого аэростаза достаточно было обеспечить приток свежего
воздуха в зону расположения животных и на 3...4-й день после этого
лекарственные препараты стали оказывать лечебный эффект, падеж прекратился, а
впоследствии резко снизился процент выделения больных животных. Из
патологического материала выделена условно-патогенная микрофлора, которая при
нормативном микроклимате не вызывала болезнь животных.
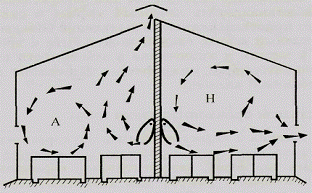
Рис.18. Внутренняя вертикальная аэрорумбограмма карантинного помещения
для телят: А - аэростаз закольцованный; Н - нормальная аэрорумбограмма после
реконструкции притока и вытяжки воздуха.
Таким образом, жёсткий аэростаз закольцованного типа вызывает острое
проявление респираторных болезней с большим процентом отхода, сравнимым с
инфекционным заболеванием, например пастереллёзом.
10. Влияние аэростазов на эффективность лечения некоторых паразитарных
заболеваний животных
Аэростазное состояние микроклимата может наблюдаться в овчарне,
оборудованной вентиляцией на механической тяге с приточными воздуховодами и
отверстиями одинакового диаметра по всей длине воздуховода. В таком случае
нормальный микроклимат обеспечивается только в зоне расположения начальной
части воздуховода, (рис.19, зона Н). В зоне расположения конечной части
воздуховода наблюдается застой воздуха (рис.19, зона А) из-за слабого конечного
аэродинамического давления, что приводит к ухудшению качества микроклимата в
зоне расположения животных, к повышению влажности подстилки и болезням животных
(кошарные инвазии, пневмония, копытная гниль и др.). Для предупреждения
аэростаза подобного типа рекомендуется устройство воздуховодов или выхлопных
отверстий разного диаметра в соответствии с техническими расчетами для
равномерной подачи воздуха в помещение.
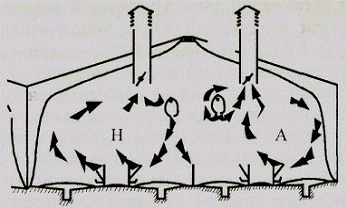
Рис.19. Внутренняя вертикальная аэрорумбограмма широкогабаритнои овчарни
со смешанной вентиляцией: Н - нормальное воздухораспределение в начале
воздуховода; А - аэростазное состояние в конце воздуховода.
Нами проведены 2-летние наблюдения за развитием жёсткого
гидростатического аэростаза в типовой овчарне на 800 голов с вентиляцией на
естественной тяге с содержанием овец на глубокой несменяемой соломенной
подстилке в одном из племзаводов РБ, когда пало до 30-33 % процентов
народившегося молодняка. Развитие жёсткого гидростатического аэростаза
происходило по характерной схеме для весеннего сезона: в конце марта и начале
апреля происходит обильное таяние снегов, поэтому на овцеферме, расположенной
на равнинной местности, происходит подпар талых вод по помещение, в котором
уровень пола близок к уровню грунта участка фермы, поэтому слой глубокой
несменяемой подстилки пропитан талыми водами имеет влажность более 70-ти %, а
уровнявшееся температура и влажность атмосферного воздуха и воздуха помещения
почти равны и составляли: температура в пределах 9-12 0С, влажность 97-100 %. В
некоторые дни стоял тумана снаружи и внутри помещения. В таких условиях
движение воздуха практически отсутствовало (менее 0,05 м/с). В этих влажных и
теплых условиях развивалась болезнь от полиэтиологических причин: развития
эймериоза (заразная болезнь) и пилобезоарная болезнь, которые усиливали друг
друга и усугубляли болезнь молодняка овец.
Развитие полиэтиологической энзоотии от жёсткого гидродинамического
аэростаза происходило по следующей биолого-технологической цепи в условиях РБ
овцематки, содержащиеся на глубокой несменяемой подстилке, до 65 % являются
носителями эймерий без клинического проявления болезни, но выделяют заразное
начало в виде незрелых ооцист с фекалиями в несменяемую глубокую подстилку, где
незрелые ооцисты находят благоприятную среду для созревания (температура 10-30
0С и влажность 45-70 %, свободный доступ кислорода воздуха в поверхностные слои
подстилки), после они способны заразить молодых неболевших ягнят, так как
животные ложатся на зараженную подстилку, фекальные массы вместе с ооцистами
прилипают к шерсти маток, которую ягнята обсасывают при недостатке подкормки, а
от эймериоза животные имеют постоянную жажду. При стремлении к сосанию ягнята
заглатывают спорулированные ооцисты эймерий и шерсть маток, которая при
повышенной влажности воздуха плохо удерживается на коже овцематок. При
отсутствии моциона буферный воздух шерсти содержит много адсорбированного
аммиака и микробов, которые тоже снижают крепость шерсти, способствуют её
выпадению и заглатыванию её вместе с заразным началом. Заглоченная шерсть
свёртывается в клубок, который, как правило, застревает в сычуге перед выходом
в тонкий кишечник, что нарушает проходимость твёрдого пищевого кома по
кишечнику, но пропускает жидкую часть корма вместе с ооцистами эймерий, где
создаются благоприятные условия для обильного развития паразита. Таким образом,
развивается пилобезоарная болезнь и эймериоз. При этом, первое имеет ту
особенность, что пилобезоары мягкие, но при этом невозможно разорвать их
руками, т.е. образуется прочный фильтр, задерживающий твёрдые корма и
пропускающий жидкий корм с ооцистами. Сочетание пилобезоарной болезни и
эймериоза практически не лечится существующими лекарственными препаратами,
болезнь достигает 80-ти % процентов от родившегося молодняка, а падёж - 33 %.
Однако в данных антисанитарных условиях содержания животных решающую роль в
развитии вышеописанной смешанной энзоотии следует отнести высокую влажность как
воздушной среды в помещении, так и глубокой несменяемой подстилки. Поэтому
описанную выше пилобезоарную болезнь и эймериоз ягнят можно отнести к группе
аэростазных болезней т.е. болезней, в развитии которых решающую роль играет
аэростаз в помещениях.
Подобная аэростазная болезнь развивается и в птичнике при напольном
содержании цыплят в микроклиматических условиях с недостаточным воздухообменом
из-за плохо работающей вентиляции и развитием скрытого или среднего аэростаза.
Нами проведены наблюдения по развитию капилляриозно-аскаридиозной и
эймериозной инвазии в условиях скрытого аэростаза в птичнике. Так, при изучении
различных вентиляционных устройств на температурно-влажностный режим воздуха в
помещении в холодные периоды года и санитарно-паразитарное состояние глубокой
несменяемой подстилки. Установлено, что приточно-вытяжная вентиляция на
естественной тяге без подогрева приточного воздуха и принудительная вентиляция
с водяными регистрами не обеспечивали зоогигиенических нормативов воздухообмена
на 30-45 % на уровне 1-ой степени скрытых аэростазов, что не обеспечивало
нормативный температурно-влажностный режим в помещении: температура воздуха
ниже нормы 3,4-6,3 0С, относительная влажность достигала 82,2-90,4 %, аммиак
0,013-0,023 мг/л, углекислый газ 0,03-0,04 %, скорость движения 0,067 м/с. В
таком микроклимате температура в поверхностных слоях подстилки была в пределах
+10 0С - +23 0С, а влажность 55-70 % с хорошим доступом кислорода, что не
способствовало высыханию подстилки и гибели в ней заразного начало (такой
процесс обычно происходит в подстилке с влажностью менее 40-45 %), а
способствовало наоборот не только сохранению но и развитию ооцист эймерий и яиц
гильминтов. Так, в поверхностных слоях подстилки обнаружено до 49 ооцист
эймерий в спорулированном состоянии основного вида Eimeria tenella и подвижные личинки аскаридий и гетеракисов до 132
экземпляров, а также единичные яйца капиллярий в 20 полях зрения микроскопа
(увеличение 7х8), что способствовало снижению яйценоскости на 95 % и увеличению
выбраковки на 6,3 % по сравнению с нормативным микроклиматом.
В птичнике, оборудованном отопительно-вентиляционном устройством ТГ-1,
обеспечивался нормативный воздухообмен с нормативными показателями микроклимата
по физическим и химическим показателям. Так, температура воздуха была на уровне
+15,5 0С, относительная влажность 70,1 %, от чего подстилка была более тёплой
(16-27 0С) и сухой (менее 45 %), выживаемости в подстилке ооцист эймерий (от 0
до 8 спорулированных экземпляров) и яиц гельминтов (от 0 до 6 экземпляров в 20
полях зрения микроскопа).
Таким образом, нормативный микроклимат по сравнению со скрытым
аэростазным способствует санации несменяемой подстилки от инвазивного начала
(эймерии, аскаридии, гетеракисы), предупреждает выбраковку птицы и снижение
яйценоскости.
В наших наблюдениях средний аэростаз (температура + 18-23 0С, влажность
93-98%, концентрация аммиака 25-35 мг/мг3, подвижность воздуха менее 0,1 м/с)
оказывал влияние на санитарно-паразитарное состояние несменяемой подстилки в
телятнике. Так, влажность подстилки 62,5 % и температура +18-23 0С способствовала
спорогонии эймерий в ней и реинвазии животных. Поэтому экстенсивность
эймериозной инвазии (ЭЭИ) достигала 100 % с интенсивностью эймериозной инвазии
(ИЭИ) около 600 ооцист в 20 полях зрения микроскопа пяти видов: Eimeria zurni 41-51 %, E. ellipsoidalis 18-25 %, E. auburnensis, E. Bovis 13-17 %, E. smithi 9-15%, E. bukinonensis 1-4
%.
При этом из 15 наблюдаемых телят заболело эймериозом с клиническими
признаками диареи 12 телят и один из них пал. У животных отмечались следующие
клинические признаки: угнетение, малая подвижность жажда, слабый аппетит (у
отдельных животных наблюдался отказ от корма), одышка, тахикардия, стойкая
лимитирующая лихорадка, ИЭИ колебалась в пределах 631-553 ооцист в 20-ти полях
зрения микроскопа в течение 2-3 недель наблюдений. Возбудителей патогенной
бактериальной инфекции из патологического материала не выделено. Прирост у этих
животных практически отсутствовал.
У телят, содержавшихся в нормативном микроклимате под ИК - лампами,
подстилка была суше 42-50 % влажности и теплее 22-32 0С. При проведении
капрологических исследований было отмечено снижение ЭИИ - 75 % и ИЭИ - 0-120
ооцист в 20-ти полях зрения микроскопа. Клиническое проявление эймериоза было
отмечено только у двух телят, а прирост живой массы тела был на 23 г выше по сравнению
с животными находящимися в условиях аэростаза.
Таким образом, хороший микроклимат и сухая постилка способствовали
безклиническому проявлению эймериозной инвазии, без применения лечебных
специфических мероприятий против данного заболевания.
Заключение
Исходя из литературных данных и наших исследований необходимо отметить,
что проблема возникновения аэростазов в животноводческих помещениях по сей день
является актуальной. Так, как подавляющее большинство из функционирующих в
настоящее время животноводческих помещений построено по типовым проектам,
имеющим те или иные проектные или строительные недостатки, которые в
последствии являются одними из ключевых причин в возникновении аэростазов.
Проведенные нами многочисленные исследования показали, что застойные зоны
воздуха (аэростазы) являются причиной формирования некачественного микроклимата
в животноводческих помещениях, который оказывает разнообразное негативное
влияние на здоровье и продуктивность животных.
Так, установлено, что в условиях локальных аэростазов во все сезоны года
у молодняка птиц отмечалось изменение клинико-физиологического статуса
организма, которое проявлялось учащением пульса на 14,3-18,7% и дыхания на
34,2-49,3%, снижением содержания в крови количества эритроцитов на 16,3-44,6%;
гемоглобина на 24,4-42,4%. Локальные аэростазы являлись причиной снижения
уровня естественной резистентности у молодняка кур, так отмечено снижение
бактерицидной и лизоцимной активности сыворотки крови на 12,5-22,7% и 0,5-1,5%
соответственно, а также снижение фагоцитарной активности псевдоэозинофилов на
7,3-14,0% по сравнению с молодняком кур, который находился в условиях
нормативного микроклимата. Аэростазы также оказывали иммунодепрессивное
действие на центральный орган иммунной системы - фабрициеву бурсу и на
состояние лимфоидной ткани в легких молодняка кур. В условиях аэростазов
регистрировалась повышенная выбраковка птиц от незаразных заболеваний (расклев,
гепатиты, перитониты, алиментарные дистрофии) в основном от расклева до 60% от
всей павшей птицы в исследуемых птичниках. Также, происходило снижение
среднесуточных приростов массы тела на 4,6-7 г или 28,5-36,5% .
Кроме того, исследованиями доказано, что у молодняка птицы выращенного в
условиях аэростазов происходило снижение количества кальция, неорганического
фосфора, холестерина и общих липидов в крови на 15,5%, 19,6%, 33% и 20%
соответственно, по сравнению с птицей выращенной в нормальных
микроклиматических условиях. Также отмечено достоверное увеличение количества
глюкозы на 22,7% у птицы находящейся в условиях аэростаза.
Таким образом, исходя из выше изложенного, следует, что в условиях
аэростазов у птицы развивается состояние стресса, следствием которого являлось
изменение отдельных биохимических показателей крови, снижение иммунной
реактивности и продуктивности. Кроме того, как показали исследования у птицы,
выращенной в таких условиях отмечается повышенная выбраковка от заболеваний
вызванных условно-патогенной и патогенной микрофлорой (колисептицемия и
стафилококковый дерматит), а также паразитами (аскаридиоз, эймириоз и
гетеракидоз).
Сходная тенденция отмечена нами и в других животноводческих помещениях.
Так, установлено, что в условиях аэростазов у животных возникали некоторые
болезни, вызванные условно-патогенной микрофлорой, протекающие в виде острой
энзоотии только в аэростазном помещении с характерной для острой инфекции
картиной первичного септического очага в дыхательных путях. Причем в других
помещениях, где микроклимат соответствовал или был близок к нормативному
заболевание не регистрировалось. В таких случаях практические врачи иногда
ошибались в постановке диагноза и принимали её как особо опасную инфекцию,
например, чуму свиней, пастереллёз крупного рогатого скота и др. Заболеваемость
животных достигала до 50-80%, а отход иногда составляет 33%. Применяемые при
этом лекарственные препараты (сульфаниламиды и антибиотики) не дают лечебного
эффекта. Однако они восстанавливают своё действие на больных животных спустя
3-4 дня после нормализации микроклимата в помещении. При вскрытии павших животных
выделялась условно-патогенная микрофлора. Немаловажную роль аэростазы
микроклимата играли в возникновении и усугублении течения такого протозойного
заболевания как эймериоз овец и телят. Причем, хороший микроклимат и сухая
постилка способствовали безклиническому проявлению эймериозной инвазии, без
применения каких либо лечебных специфических мероприятий против данного
заболевания.
Для обнаружения аэростазов в помещениях целесообразно проводить
задымления дымарем, а также использовать гигиенические приборы: бифлюгер,
крыльчатый анемометр и кататермометр.
Экспериментально доказано, что одним из основных способов ликвидации зон
застоя воздуха в животноводческих помещениях является организация правильного и
равномерного распределения свежего приточного воздуха, которое достигается
путем установки в помещениях дополнительных приточных устройств с механическим
побуждением движения воздуха (центробежных вентиляторов) и воздуховодов.
Однако в настоящее время многие из хозяйств РБ находятся в сложном
экономическом положении и не могут провести реконструкцию систем вентиляции в
помещениях. Поэтому следует изыскивать наиболее дешевые и доступные в условиях
данного хозяйства способы улучшения микроклимата в животноводческих помещениях,
т.е. проведение искусственной аэроионизации, ИК-обогрев, УФ-облучения и т.п.
Для улучшения параметров микроклимата в застойных зонах воздуха мы
предлагаем проведение периодических аэрозольных дезинфекций следующими
препаратами: Virkon, глютекс, янтарная и молочная
кислоты и ряд других малотоксичных препаратов используемых для дезинфекции в
присутствии животных.
Таким образом, аэростазы следует рассматривать как проектные,
строительные и эксплутационные дефекты помещений и их необходимо учитывать при
оценке микроклимата наряду с другими показателями.
Список источников
1
Абрамов С.С.
Влияние отрицательных аэроионов на обменные процессы в организме телят //
Ветеринария. - 1989. - № 7. - С. 23-25.
2
Абрамов С.С.,
Арестов И.Г., Карпуть И.М. и др. Профилактика незаразных болезней молодняка. -
М.: Агропромиздат. - 1990. - 175 с.
3
Абрамов С.С.,
Могиленко А.Ф., Ятусевич А.И. Методические указания по определению естественной
резистентности сельскохозяйственных животных: Метод. указания / Витебский вет.
ин-т. - Витебск, 1989. - 39 с.
4
Абрамов С.С.,
Белко А.А. Методические указания по применению аэрозолей в ветеринарной
терапии: Методические указания / Витебская гос. академия вет. мед. - Витебск,
1997. - 12 с.
5
Адо А.Д.
Патофизиология фагоцитов. - М.: Медицина, 1961.- С. 43-45.
6
Альбанки А. Влияние
факторов микроклимата на продуктивные показатели кур линий 3-2 (7), кросса
Заславский-2 // Пути повышения продуктивности животноводства: Cб. науч. тр. / Горковская сельхоз.
акад. - Горки, 1995. - С.27-31.
7
Антюков М.А.,
Жаков В.М. Определение экономической эффективности ветеринарных мероприятий:
Метод. указания / Витебский вет. ин-т.- Витебск, 1989. - 42 с.
8
Анохим Б.М.,
Данилевский В.М., Обухов Л.М. Внутренние незаразные болезни
сельскохозяйственных животных. - М.: Агропромиздат, 1991. - с. 50-56.
9
Апатенко В.М.
Естественная устойчивость и проблема иммунодефицитов в животноводстве //
Селекция с.-х. Животных на устойчивость к болезням, повышение резистентности и
продуктивного долголетия. - 1992. - Вып. 9. - С. 16-17.
10
Бабина М.П.
Иммунная реактивность цыплят-бройлеров в онтогенезе и её коррекция микробными
препаратами. - Витебск, 2002. -114 с.
11
Баланин В.И.
Зоогигиенический контроль микроклимата в животноводческих и птицеводческих
помещениях. - Л.: Агропромиздат, 1988.- С.5-76.
12
Байдевлятов А.,
Прокудин А. Предельно допустимое содержание микроорганизмов в птичниках //
Птицеводство. - 1983 - № 6. - С. 32-33.
13
Байдевлятов А.Б.,
Герман В.В., Кирпич В.В. и др. Система ветеринарно - санитарных мероприятий в
промышленном птицеводстве. - 2-е изд., доп. и перераб. - К.: Урожай, 1987. - С.
120-123.
14
Белов А.Д.,
Беляков И.М., Лукьяновский В.А. Физиотерапия и физиопрофилактика болезней
животных. - М.: Колос, 1983. - С.59-63.
15
Бернет Ф.
Целостность организма и иммунитет. М.: Мир, 1964. - С.59-65.
16
Бернет Ф.
Клеточная иммунология. - М.: Мир, 1971.- С. 121-133.
17
Бессарабов Б.Ф.
Болезни сельскохозяйственной птицы. - М.: Колос, 1970. - С.164.
18
Бессарабов Б.Ф.
Ветеринарно-санитарные мероприятия по профилактике болезней птиц. - М.:
Россельхозиздат, 1983.- С. 62-64.
19
Бронфман Л.И.
Воздушный режим птицеводческих помещений. - М.: Россельхозиздат, 1974.- С.
14-18.
20
Бронфман Л.И.
Микроклимат помещений в промышленном животноводстве и птицеводстве. - Кишинев.:
Штиинца, 1984.- С.30-48.
21
Болотников И.А., Соловьев
Ю.В. Гематология птицы. - Л.: Наука, 1980. - С. 35-39.
22
Болотников И.А.
Иммунопрофилактика инфекционных болезней птиц. - М.: Россельхозиздат, 1982. -
С.4-32.
23
Болотников И.А.,
Михкиев В.С., Олейник, Е.К. Стресс и иммунитет у птиц. - Л.: Наука, 1983. - С.
14-28.
24
Бухарин О.В.,
Васильев Н.В. Лизоцим и его роль в биологии и медицине. - Томск. Изд-во ТГУ,
1974. - С. 5-28, 71-131.
25
Бухарин О.В.,
Васильев Н.В. Система бета- лизина и ее роль в клинической и эксперементальной
медецине. - Томск. Изд-во ТГУ, 1977. - С.19-48.
26
Васяев В.А.
Зоогигиеническое и биологическое обоснование применения искусственной
аэроионизации при выращивании телят: Автореф. дис. ...к-та вет. наук: 16.00.08
/ Башкирский гос. аграр. универ. - Уфа, 1998. - 19 с.
27
Вильданов Р.Х.
Микрофлора окружающей среды и организма телят при разных системах содержания:
Автореф. дис. ...к-та вет. наук: 16.00.03 / Казанский ордена Ленина
ветеринарный ин-т им. Баумана. - Казань, 1992. - 16 с.
28
Внутренние
болезни животных / Под общ. ред. Г.Г. Щербакова, А.В. Коробова. СПб.: Из-во
«Лань», 2002. - С. 51-73.
29
Волков Г.К.,
Репин В.М., Большаков В.И. и др. Зоогигиенические нормативы для
животноводческих объектов. М.: Агропромиздат, 1986. - С. 240-250.
30
Воздушная среда и
ее влияние на организм животных // Онегов А.П., Храбустовский И.Ф., Черных В.И.
Гигиена сельскохозяйственных животных: Учебники и учеб. пособия для высш. с.-х.
учеб. заведений. - 3-е изд., испр. и доп. - М.: Колос, 1984.- Гл. 1 -С.11-66.
31
Герберт У.Дж.
Ветеринарная иммунология. - М.: Колос, 1974. - С. 13-25.
32
Гигиена птицы //
Кузнецов А.Ф., Демчук М.В., Карелин А.И. и др. Гигиена сельскохозяйственных
животных: Учебники и учеб. пособия для студентов вузов. - В 2 кн.. Кн. 2.
Частная зоогигиена/ Под ред. Кузнецова А.Ф. и Демчука М.В. - М.: Агропромиздат,
1992. -Гл. 5. - С. 134-136.
33
Грин Н., Стаут
У., Тейлор Д. Биология: В 3-х т. / Под ред. Р. Сопера. - М.: Мир, 1990. - Т.2.
- С. 214-215.
34
Грошева Г.А.,
Ресакова Н.Р. Новые методы оценки естественной резистентности и реактивности
организма птиц // Ветеринария. - 1996 - № 9. - С. 34-35.
35
Голосов И.М.
Микроклимат животноводческих помещений. - Л.: Лениздат, 1974. - С.61-65.
36
Гончаренко В.М.,
Резник Н.К. Технологическая и санитарно - гигиеническая оптимизация условий
содержания птицы при промышленном ведении отрасли // Ново в методах зоотехн.
дослiджень. -Харкiв, 1992. - Ч.2. - С.225-228.
37
Горышина Е.Н.,
Чага О.Ю. Сравнительная гистология тканей внутренней среды с основами
иммунологии. Лениград.: изд - во Ленингр. ун-та, 1990. С.216.
38
Готовский Д.Г.
Влияние аэростазов на естественную резистентность и продуктивность молодняка
кур // Ученые записки Витебской государственной академии ветеринарной медицины:
Материалы научно-практической конференции, посвященной 70-летию клинических
кафедр, г. Витебск, 14-15 апреля 1998 г. / ВГАВМ. - Витебск, 1998. - том 34. -
С. 347-349.
39
Готовский Д.Г.
Скрытые локальные аэростазы микроклимата птичников с клеточным содержанием
ремонтного молодняка кур // Международный аграрный журнал. - 1998. - № 4. - С.
42-44.
40
Готовский Д.Г.
Способы обнаружения и ликвидации скрытых локальных аэростазов птичников //
Международный аграрный журнал. - 1998. - № 5. - С. 49-50.
41
Готовский Д.Г.
Гласкович А.А. Видовой состав микробной флоры воздуха птичников и его влияние
на естественную резистентность и заболеваемость молодняка кур // Международный
аграрный журнал. - 1999. - № 11. - С. 45-47.
42
Готовский Д.Г.,
Луппова И.М. Естественная резистентность и иммунная реактивность молодняка кур,
выращенного в разных микроклиматических условиях // Проблемы с.-х. производства
в изменяющихся экономических и экологических условиях: Материалы международной
научно-практической конференции, посвященной 25-летию Смоленского с.-х.
института. - Смоленск, 1999. - Ч. 4 - Общая биология и ветеринарная медицина. -
С. 209-211.
43
Готовский Д.Г.
Аэрозольная дезинфекция препаратом виркон в птичниках // Исследования молодых
ученых в решении проблем животноводства: Материалы международной
научно-практической конференции молодых ученых и преподавателей с.-х. учебный
заведений и научно-исследовательских учреждений, г. Витебск, 22-23 мая 2001 г.
/ ВГАВМ. - Витебск, 2001. - 51 с.
44
Готовский Д.Г.,
Базылев М.В. Влияние микробного стресса на некоторые гематологические,
биохимические и иммунологические показатели цыплят // Ученые записки Витебской
ордена «Знак почета» государственной академии ветеринарной медицины / ВГАВМ. -
Витебск, 2002. - том 38. - С. 32-33.
45
Готовский Д.Г.,
Железко А.Ф., Базылев М.В. Повышение сохранности молодняка кур путём применения
аэрозольной дезинфекции // Интенсификация производства продуктов
животноводства: Материалы международной научно-практической конференции, г.
Жодино, 30-31 октября 2002 г. / РУП «Ин-т животноводства НАН РБ». - Жодино,
2002. - 174 с.
46
Данилова А.К.,
Найденский М.С., Шпиц И.С., Яворский В.С. Гигиена в промышленном птицеводстве.
- М.: Россельхозиздат, 1979.- С.113-156.
47
Данилова А.К.,
Найденский М.С., Шпиц И.С., Яворский В.С. Гигиена в промышленного производства
яиц. - издание 2-е перераб. и доп. - М.: Россельхозиздат, 1987. - С.101-175.
48
Дубова Б.Л.,
Вергеренко Л.В. Значение микроклимата в сохранности индюшат в промышленном
птицеводстве // Гигиена промышленного животноводства: Сб. статей. / Северо -
кавказский зональный науч.-исслед. ветер. ин-т. - Новочеркасск, 1978. - С.
200-202.
49
Дьяконов М.,
Тимофеев В., Резниковский В., Ивко И. Вентиляция в сблокированных птичниках //
Птицеводство. - 1991. - № 5. - С.32-34.
50
Евглевская Е.,
Найденский М. Влияние режима освещения на резистентность птицы // Птицеводство.
- 1995. - № 6. - С. 24-25.
51
Емельяненко П.А.
Иммунология животных в период внутриутробного развития. М.: Агропромиздат,
1987. - С. 36-121.
52
Ермолаева А.Л.,
Асирян М.А. Выращивание молодняка птицы яичных пород. М.: Колос, 1976. -
С.39-55.
53
Ермольева З.В.
Антибиотики, интерферон, бактериальные полисахариды. - М.: Медицина, 1965.- 384
с.
54
Жаков М.С.,
Карпуть И.М., Кривутенко А.И., Вель Л.П. Теоретическое и практическое значение
ветеринарной иммунологии: Методические указания для ветеринарных врачей
факультета повышения квалификации. - Одесса, 1980. - 32 с.
55
Жариков И.С.,
Якубовский М.В., Чулков П.А., Швыдков Н.Н. Экономическая эффективность
ветеринарных мероприятий. - Мн.: Ураджай, 1981. - С.3-21.
56
Жарикова Н.А.
Периферические органы иммунитета - Минск: Беларусь, 1979. - С. 61-68.
57
Закревский М.И.,
Карташова А.Н. Применение ультрафиолетового облучения при выращивании телят //
Технология получения и выращивания здорового молодняка сельскохозяйственных
животных и рыбопосакдочного материала: Тез. докладов Республиканской научно-
практической конференции. / Акад. аграр. наук Респ. Беларусь. Витебский ветер.
ин-т. - Минск, 1993. - С. 22-23.
58
Закомырдин А.А.
Ветеринарно- санитарные мероприятия в промышленном птицеводстве. - 2-е изд.
Перераб. и доп. - М.: Колос, 1981. - С. 94-137.
59
Зайцев А.М., В.И.
Жильцов., Шавров А. В. Микроклимат животноводческих комплексов. -М.:
Агропромиздат, 1986. - С. 5-10.
60
Золотенков В.В.,
Бобылева Г.Н. Микроклимат в птичниках при напольном содержании кур и мероприятия
по его улучшению // Итоги научно - исследовательских работ по зоогигиене за
1986 - 1990 годы и задачи НИР на период 1991-1995 годов: Тез. докл. всесоюз.
координац. совещ., Львов, 25-30 сент. 1990 г. / Львовский ордена труд. красн.
знам. зооветер. ин-т. - Львов, 1990. - Ч.3. - С. 155-156.
61
Иваненко В.,
Левыкин М., Светличный А. Новая конструкция воздуховодов // Птицеводство. -
1993. - №7. - С. 31-33.
62
Иммунология //
Радчук Н.А., Дунаев Г.В., Колычев Н.М., Смирнова Н.И. Ветеринарная микробиолгия
и иммунология: Учеб. пособия для студентов вузов. - М.: Агропромиздат, 1991. -
Гл. 2. - С.124-131.
63
Испенков А.Е.,
Сапего И.И. Зоогигиенический и санитарный режим на фермах и комплексах. -
Минск.: Ураджай, 1985. С.8-44.
64
Карр Ян.
Макрофаги. - М.: Медицина, 1978. - 188 с.
65
Карпуть И.М.
Иммунология и иммунопотология болезней молодняка. - Минск.: Уроджай, 1993. - С.
186-191.
67
Кракосевич Т.В.
Влияние различных световых режимов на рост, развитие и естественную
резистентность бройлеров // Итоги научно - исследовательских работ по
зоогигиене за 1986 - 1990 годы и задачи НИР на период 1991-1995 годов: Тез.
докл. всесоюз. координац. совещ., Львов, 25-30 сент. 1990 г. / Львовский ордена
труд. красн. знам. зооветер. ин-т. - Львов, 1990. - Ч.3. - С. 158-160.
68
Кракосевич Т.В.
Стимуляция роста, развития, резистентности и продуктивности бройлеров
различными световыми режимами: Автореф. Дис. ...к-та сел.хоз наук: 06.02.04,
16.00.08 / Всесоюз. сель.хоз институте заоч. оброзов. - Москва, 1992. - 20 с.
69
Кобозев В.И.,
Железко А.Ф., Закревский М.И и др. Санитарно - гигиеническая оценка
воздухораспределения на птицефабрике Витебская и предложения по его оптимизации
// Ученые записки Витебской государственной академии ветеринарной медицины: Сб.
науч. тр. / Витебская. государ. акад. вет. мед. - Витебск, 1996. - том 33. - С.
25-26.
70
Коена С., Уорд
П.А., Мак-Класки Р.Т. Механизмы иммуногенеза. - М.: Медицина, 1983. - С.
85-106.
71
Козлов Н.Б.
Гипертермия: биохимические основы патогенеза, профилактики, лечения. - Воронеж:
изд-во ВГУ, 1990. - С. 3-5.
72
Коляков Я.Е.
Ветеринарная иммунология. - М.: Агропромиздат, 1986.- С. 28-50.
73
Коновалов В.В.,
Резник Н.К. Выбор температурного режима при выращивании цыплят // Ветеринария.
- 1980.- № 3.
- С. 28-29.
74
Коновалов В.В.,
Резник Н.К. Гигиеническое значение искусственного освещения при выращивании
цыплят// Ветеринария. - 1984. - № 10. - С. 22-23.
75
Коротков Е.Н.
Вентиляция животноводческих помещений. М.: Агропромиздат, 1987. - С. 68-78.
76
Кот А.П. О
микробной загрязненности воздуха птичников // Ветеринария. - 1986 . № 4 - С. 26-29.
77
Кузнецов А.А.
Влияние искусственной аэроионизации на клинико - морфологические показатели
поросят в услових интенсивной технологии производства: Автореф. дис. ...к-та
вет. наук: 16.00.08 / Башкирский гос. аграр. универ. - Уфа, 1998. - 20 с.
78
Кузнецов А.Ф.,
Баланин В.И. Справочник по ветеринарной гигиене. М.: Колос, 1984. - 335 с.
79
Купер Э. Сравнительная
иммунология. - М.: Мир, 1980.- 422 с.
80
Лебедь А.А.
Микроклимат животноводческих помещений. -М.: Колос, 1984. - С. 14-15.
81
Луппова И.М.
Иммуноморфогенез у кур, вакцинированных против ньюкаслской болезни, и влияние
на него триметазона (препарата 0-92): Автореф. дис. ...к-та вет. наук: 16.00.02
/ Витебская государ. акад. вет. мед. - Витебск, 1998. - 20 с.
82
Матвеев О.Ю.
Микроклимат свиноводческих помещений прикухонных хозяйств воинских
подразделений // Ветеринария. - 1993. - № 2. - С. 19-20.
83
Матвеев О.Ю.
Мертвые зоны в животноводческих помещениях малых ферм // Ветеринария. - 1996. -
№ 6. - С.37.
84
Медведский В.А.,
Гусаков В.К., Никитин Ю.И., Мотузко Н.С. Методические указания по определению
форменных элементов и гемоглобина в крови с помощью инструментальных методов:
Метод. указания / Витебская академия вет. мед. - Витебск, 1995. - 14 с.
85
Медведский В.А.
Естественная резистентность свиней и пути ее повышения. - Витебск, ВГАВМ.
-1997. - С. 5-13.
86
Медведский В.А.
Использование биологических стимуляторов для повышения продуктивности и
естественных защитных сил организма свиней. - Витебск, ВГАВМ. - 1998. - С.
4-14.
87
Мельник В.И.,
Мельник В.И., Л.З. Поплавский. Микроклимат при выращивании птицы в клетках. М.: Россельхозиздат, 1977. - С. 5-53.
88
Меркулов Г.А.
Курс патологоанатомической техники. - Л.: Медицина, 1969. - С. 36-110.
89
Методы
исследования системы крови // Смирнов А.М., Дугин Г.Л., Кондратьев В.С. и др.
Практикум по клинической диагностике внутренних незаразных болезней
сельскохозяйственных животных: Учебники и учеб. пособия для высш. с.-х. учеб.
завед. - Л.: Колос, 1978. - Гл. VII. -
С. 236,237.
90
Миносян С.Н.
Аэрозольный метод лечения больных бронхопневмонией телят и ее экономическая
эффективность: Автореф. дис. ...к-та вет. наук: 16.00.01 / Армянская
сельскохозяйственная академия. - Ереван, 1998. - 18 с.
91
Митюшников В.М.
Определение уровня естественной резистентности кур // Ветеринария. - 1980. - №
2.- С. 23-24.
92
Митюшников В.М.,
Варкина Р.И. Ественная резистентность у племенных кур // Ветеринария. - 1984. -
№ 10. - С. 54-56.
93
Митюшников В.М.
Естественная резистентность сельскохозяйственной птицы. - М.: Россельхозиздат,
1985. - 160 с.
94
Митюшников В.М.,
Кожаринова Т.А. К вопросу содержания лизоцима в крови и белке яиц мясных кур /
Научные основы промышленного производства яиц и мяса птицы // Сб. науч. тр. -
Загорск, 1974. - Т.38. - С. 128-131.
95
Митюшников В.,
Кравченко Н. Микроклимат птичника и его влияние на резистентность и
продуктивность кур // Птицеводство. - 1983. - № 4. - С. 24-26.
96
Могиленко А.Ф.
Иммунный статус молодняка крупного рогатого скота при внутренних незаразных
болезнях и его коррекция: Автореф. дис. ...д-ра вет. наук: 16:00:01/ Витебский
вет. ин-т. - Витебск, 1990. - 37 с.
97
Мозжерин В.И.,
Дементьев Е.П., Каримов Ф.А., Каримова С.Г. Методические указания по улучшению
микроклимата в помещениях для свиней (при использовании ионизации воздуха):
Метод. рекомендации / Башкирский сельскохозяйственный ин-т. - Уфа, 1974. - 9 с.
98
Мотес Э.
Микроклимат животноводческих помещений. М.: Колос, 1976. - С. 7-53.
99
Найденский М.С.
Зоогигиеническая оценка содержания кур // Ветеринария. - 1980.- № 6.- С. 28-29.
100Найденский М.С., Данилова А.К., Бирюков Н.В. и др.
Методические рекомендации по оптимизации энергосберегающих световых режимов в
птичниках: Метод. Рекомендации / Московская
вет. академия. - Москва, 1989. - 16 с .
101Найденский М.С., Шуганов В.М. Энергосберегающий
световой режим при содержании племенных кур и петухов в клеточных батареях //
Итоги научно - исследовательских работ по зоогигиене за 1986 - 1990 годы и
задачи НИР на период 1991-1995 годов: Тез. докл. всесоюз. координац. совещ.,
Львов, 25-30 сент. 1990 г. / Львовский ордена труд. красн. знам. зооветер.
ин-т. - Львов, 1990. - Ч.3. - С. 157-158.
102Найденский М.С. Зоогигиеническое обоснование
энергосберегающих световых режимов освещения в птицеводстве: Метод.
рекомендации / Московская вет. академия. - М., 1994. - 27 с.
103Омар Хаж Бадер Эль-Дин Юзбаши. Влияние теплового
стресса на физиологическое состояние и продуктивность кур различного возраста:
Автореф. дис. ...к-та сел.хоз наук: 16:00:08 / Московская вет. академия. -
Москва, 1974. - 18 с.
104Онегов А.П., Дудырев Ю.И., Хабибулов М.А. Справочник
по гигиене сельскохозяйственных животных. - М.: Россельхозиздат, 1984. -С.8-48.
105Осидзе Д.Ф., Простяков А.П. // Факторы резистентности
организма животных. - 1983.- № 3.- С.32-34.
106Петров Р.В. Иммунология. - М.: Медицина, 1982. -
С.14-17.
107Плященко С.И., Хохлова И.И. Микроклимат и
продуктивность животных. - Л.: Колос, 1976. - С. 12-47.
108Плященко С.И., Сидоров В.Т. Естественная
резистентность организма животных. - Л.: Колос, 1979.- С. 5-113.
109Плященко С.И., Трофимов А.Ф. Содержание коров на
фермах и комплексах. - Мн.: Ураджай, 1985. - С. 65-85.
110Плященко С.И., Сидоров В.Т., Трофимов А.Ф. Получение и
выращивание здоровых телят. - Мн.: Ураджай, 1990. - С. 145-179.
111Пчелкин Ю. Н., Сорокин А. И. Устройства и оборудование
для регулирования микроклимата в животноводческих помещениях. - М.:
Россельхозиздат, 1977. - С. 75-77.
112Пигаревский В.Е. Зернистые лейкоциты и их свойства. -
М.: Медицина, 1978.- С24-50.
113Пигалев С.А., Скорляков В.М. Защитные силы организма
животных и способы их повышения в услових промышленных комплексов: Лекция. -
Саратов, 1989. - С. 7-12.
114Поляков А.А. Ветеринарная дезинфекция.- 4-е, изд.,
перераб. и доп. - М.: Колос, 1975. - С. 257-273.
115Понятие о естественной резистентности организма
животных // Соколов Г.А. Ветеринарная гигиена: Учеб. пособия для студентов
вузов. - Мн.: Дизайн ПРО, 1998.- Гл. 1. - С. 4.
116Противовирусный иммунитет // Сюрин В.Н., Белоусова
Р.В., Фомина Н.В. Ветеринарная вирусология: Учебники и учеб. пособия для студ.
сельхоз. вузов. - М.: Агропромиздат, 1991. - Гл. 9. - С. 250-273.
117Профилактика потерь в животноводстве от нарушений
гигиены содержания // Соколов Г.А. Ветеринарная гигиена: Учеб. пособия для
студ. вузов. - Мн.: Дизайн ПРО, 1998.- Гл. 6. - С. 99-103.
118Резнiковский В.К., Iвко I.I., Дьяконов М.П., Тiмофеев В.М. Дослiдження мiкроклiмату
зблокованiх пташникiв // Птахiвнiцтво, 1993. - Вiп. 46. -С. 48-54.
119Ройт А. Основы иммунологии / Под ред. Р.Г. Всилова,
А.Ф. Киркина. - М.: Мир, 1991.- С.10-24.
120Савченко С.В. Ветеринарно-гигиенические мероприятия по
профилактике балантидиоза свиней; Автореф. дис. ...к-та вет. наук: 16:00:06 /
БелНИИЭВ им. Вышелесского. - Минск, 2001. - 20 с.
121Савченко С.В. Рекомендации по
ветеринарно-гигиеническим мероприятиям при профилактике балантидиоза свиней /
ВГАВМ. - Витебск, 2001. - 9 с.
122Светлова Л.Л., Федорова З.П., Ещенко И.Д. Санитарно-
гигиеническое состояние воздушной среды сблокированных и многоэтажных птичников
// Гигиена промышленного животноводства: Сб. статей. / Северо - кавказский
зональный науч.-исслед. ветер. ин-т. - Новочеркасск, 1978. - С.205-207.
123Селезнев С.Б. Возрастная морфология лимфоидных органов
у кур клеточного содержания в зависимости от различной степени их двигательной
активности; Автореф. дис. ...к-та вет. наук: 16:00:02 / Московская вет.
академия. - Москва, 1987. - 14 с.
124Селянский В.М. Микроклимат в птичниках. - М.: Колос,
1975. - 304 с.
125Семен Л.В. Влияние возраста и условий содержания на
показатели белково - азотистого обмена и иммунобиологической реактивности
организма мясных цыплят: Автореф. дис. ...к-та вет. наук: 16:00:08 / Львовский
зооветеринарный ин-т. - Москва, 1979. - 24 с.
126Сидоров В.Т., Фролов А.В., Лапотко А.М. Экологически
безопасная технология санации воздушной среды помещений для выращивания и
откорма телят // Актуальные проблемы интенсивного развития животноводства: Сб.
науч. труд. Международной науч.- практич. конф., Горки 6-8 июня 1996 г. / Бел.
сельхоз. акад. - Горки, 1996. - С. 293-294.
127Смирнов А.П., Пигалев С.А. Адаптация и продуктивность
сельскохозяйственных животных: Лекция. - Саратов, 1985. - С.4-48.
128Смирнова О.В., Кузьмина Т.А. Определение бактерицидной
активности сыворотки крови методом фотонефелометрии // Журнал микробиологии и
иммунологии. - 1966. № 4. - С. 8-11.
129Соколов Г.А. Определение потоков воздуха в помещении
// Ветеринария. - 1978 - № 9. - С. 33-34.
130Соколов Г., Шиенок А. Отравление кур выхлопными газами
теплогенератора // Птицеводство. - 1983 - № 4. - С. 28-29.
131Соколов Г.А. Комплекс зоогигиенических мероприятий по
профилактике эймериоза овец: Автореф. дис. ...д-ра вет. наук: 16:00:08 ,
03.00.19 / Всесоюз. науч.-исслед. ин-т вет. санитарии. - Москва, 1987. - 41 с.
132Соколов Г.А., Карташова А.Н. Зоогигиеническое значение
внутренней аэрорумбограммы животноводческих помещений // Итоги научно -
исследовательских работ по зоогигиене за 1986-1990 годы и задачи НИР на период
1991-1995 годов: Тез. докл. Всесоюзного координац. совещ., Львов, 25-30 сент.
1990 г. / Львовский ордена труд. красн. знамени зооветер. ин-т. - Львов, 1990.
- Ч. 1. - С. 107-108.
133Соколов Г.А. Внутренние аэростазы животноводческих
помещений// Гигиена, ветсанитария и экология животноводства : Матер. Всерос.
науч.-производст. конф., Чебоксары, 22-24 сент. 1994 г./ Российская академия
сельхоз. наук (отд. вет. мед). Всерос. науч.-исслед. ин-т ветеринарной
санитарии, гигиены и экологии. - Чебоксары, 1994. - С. 397-398.
134Соколов Г.А. Аэростазы микроклимата животноводческих
помещений // Ученые записки Витебской государственной академии ветеринарной
медицины: Сб. науч. тр. / Витебская государ. академ. вет. мед. - Витебск, 1994.
- том 31. - С. 172-174.
135Соколов Г.А., Кобозев В.И., Закревский М.И и др. Об
аэростазах в животноводческих помещениях с промышленной технологией //
Актуальные проблемы интенсивного развития животноводства: Сб. науч. тр.
Международной науч.-практич. конф., Горки 6-8 июня 1996 г. / Бел. сельхоз.
акад. - Горки, 1996. - С. 295-297.
136Соколов Г.А., Готовский Д.Г., Баранчук А.Р. Аэростазы
птичников с клеточным содержанием кур // Ветеринарные и зооинженерные проблемы
животноводства: Мат. I
междунар. науч.- практич. конф., Витебск, 28-29 нояб. 1996 г. / Витебская
государ. академ. вет. мед. - Витебск, 1996. - С.208.
137Соколов Г.А., Готовский Д.Г. Влияние внутренних
аэростазов на естественную резистентность и продуктивность молодняка кур //
Конкурентноспособное производство продукции животноводства в республике
Беларусь: Сб. раб. междунар. науч.- производ. конф., Жодино, 23-24 апр. 1998 г.
/ Акад. аграр. наук Респ. Беларусь. Белорус. науч.-исслед. ин-т животноводства.
- Жодино, 1998. - С. 161-162.
138Соколов Г.А., Готовский Д.Г. Влияние внутреннего
аэростаза на естественную резистентность и продуктивность молодняка кур -
несушек при клеточном содержании // НТИ и рынок. - 1998.- № 4 - С. 37-39.
139Соколов Г.А., Кобозев В.И., Готовский Д.Г. Влияние
внутренних аэростазов на естественную резистентность молодняка кур - несушек //
Мат. науч.-производ. конф. Посвященной 190-летию высшего ветеринарного
образования в России и 100-летию ветеринарной науки: Мат. науч.-производ. конф.
/ Российская академия сельхоз. наук. Санкт-Петербургская государ. акад. ветер. мед.
- Санкт-Петербург, 1998. - С. 75.
140Соколов Г.А., Готовский Д.Г. Рекомендации по
обнаружению и ликвидации застойных зон воздуха в птицеводческих помещениях. -
Витебск, 1998. - 19 с.
141Соколов Г.А., Готовский Д.Г. Влияние скрытых локальных
аэростазов на естественную резистентность и продуктивность молодняка кур при
клеточном содержании // Проблемы патологии, санитарии и бесплодия в
животноводстве: Мат. междунар. науч.- практич. конф., Минск, 10-11 дек. 1998 г.
/ Министерство сельского хозяйства и продовольствия республики Беларусь. Акад.
аграр. наук респ. Беларусь. Бел. науч.-исслед. ин-т экспер. ветер. им. С.Н.
Вышелесского. Витебская государ. акад. ветер. мед. - Минск, 1998. - С. 123-124.
142Соколов Г.А., Готовский Д.Г. Классификация внутренних
аэростазов животноводческих помещений // Гигиена содержания и кормления
животных - основа сохранения их здоровья и продуктивности: Материалы
Всероссийской научно-производственной конференции, г. Орёл, 21-23 сентября 2000
г. / Орёл ГАУ. - Орёл, 2000 г. - С. 142-144.
143Сохин А.А., Чермушенко Е.Ф. Прикладная иммунология. -
М., 1984. - 316 с.
144Технология производства яиц // Василюк Я.В., Балобин
Б.В. Птицеводство и технология производства яиц мяса птицы: Учеб. пособие. -
Мн.: Ураджай, 1995. - Гл. 7. - С. 185-196.
145Технические средства для создания и поддержания
микроклимата и облучения в птицеводстве // Гриб В.К., Жук С.С., Синкевич П.Н.
Механизация птицеводства: Уч. пособ. для студ. тех. - Мн.: Ураджай, 1997. - Гл.
6. - С.137-140.
146Технические средства для создания оптимального
микроклимата // Изаков Ф.Я., Быков Н.М., Леонтьев П.И. Механизация и
электрификация птицеводства: Учебники и учебные пособия для с.-х. техникумов. -
М.: Колос, 1982. - Гл. 8. - С. 325-326.
147Хренов Н.М. Аэроионизация в животноводстве. - Киев:
Изд- во УСХА, 1993. - С. 206-220.
148Шабадаш А.Я. Рациональная методика гистохимического
обнаружения гликогена ее терапевтическое обоснование // Изв. АН. СССР. Сер.
биол. наук. -1947. - № 6. - С. 745-746.
149Щербинин Н.И., Щербинин Ю.Н. Причины ухудшения и
способы оптимизации микроклимата птицеводческих помещений на северо-западной
зоне Российской федерации // Мат. науч.-производ. конф. Посвященной 190-летию
высшего ветеринарного образования в России и 100-летию ветеринарной науки: Мат.
науч.-производ. / Российская академия сельхоз. наук. Санкт-Петербургская
государ. акад. ветер. мед. - Санкт-Петербург, 1998. - С. 127-128.
150Цубанов А.Г. Теплоснабжение, отопление и вентиляция
животноводческих помещений. - Мн.: Ураджай, 1987. - С. 10-14.
151Фисинин В.И., Столляр Т. А. Производство бройлеров. -
М.: Агропромиздат, 1989. - С. 93-96.
152Фролов А.В. Использование аэрозолей фитонцидов для
оптимизации среды жизнедеятельности животных при их промышленном содержании:
Автореф. дис. ...к-та биол. наук: 16:00:08/ Белорусский
научно-исследовательский ин-т экспериментальной ветеринарии им. С.Н.
Вышелесского. - Минск, 1997. - 16 с.
153Юрков В.М. Микроклимат животноводческих ферм и
комплексов. - М.: Россельхозиздат, 1985. - С. 31-106.
154Юрков В.М. Влияние света на резистентность и
продуктивность животных. - М.: Россельхозиздат, 1991.- С.10-104.
155Ярных В.С., Симецкий М.А. Ветеринарные препараты в
аэрозольных баллонах. - М.: Колос, 1979. - 167 с.
156Ярных В.С. Аэрозоли в ветеринарии. - М.: Колос, 1972.
- 352 с.
157Asensi V., Fierer J.
Synergistic effect of human lysozyme plus ampicillin or beta-lysin on the
killing of Listeria monocytogenes: Department of Medicine, Veterans
Administration Medical Center, San Diego // J. Infect-Dis. - 1991. - Vol. 163,
№3 - P. 566-574.
158Benhaim P., Hunt T.K.
Natural resistance to infection: leukocyte functions: University of California,
Department of Surgery, San Francisco // J. Burn-Care-Rehabil. - 1992. - Vol.
13, № 2 - P. 195-287.
159Edens F.W., Joyce K.A.,
Parkhurst C.R. Effect of litter moisture and brooding temperature on body
weights of turkey poults experiencing poult enteritis and mortality syndrome:
Department of Poultry Science, North Carolina State University, Raleigh //
Poult-Sc. - 1998. - Vol. 77, №3. - P. 406-411.
160Exner C., Unnshelm J.
Climatic condition and airborn microorganisms in wild cat housing: Institut fur
Tierhygiene, Verhaltenskunde und Tierschutz der Ludwig-Maximililians-Universita
Munhen // Zentralbl-Hyg-Umweltmed. - 1997. - Vol. 199, № 6 - P. 497-512.
161Gleick G.J. The eosinophil: new
aspects of structure and function // J.Allergy and Clin. Immunol. - 1977. - № 1. - P. 73-82.
162Grover W.H., Winkler H.H.,
Hormansell D.E. Phagocytie properties of isolated humen eosinophilis //
J.Immunol. - 1978. - № 2. - P. 718-725.
163Gwakisa P.S., Minga U.M. Humoral
factors of natural resistance of Bos indicus cattle selected for antibody titre
to Brucella abortus: Faculty of Veterinary Medicine, Sokoine University of
Agriculture, Morogoro, Tanzania // Scand. J. Immunol. Suppl. - 1992. - № 11. - P. 99-102.
164Hasegawa M., Kurabayashi
Y., Ishii T. Intra-cage air change rate on forced-air-ventilated
micro-isolation system--environment within cages: carbon dioxide and oxygen
concentration: Technical Research Laboratory, Dai-Dan Co., Ltd., Saitama, Japan
// Exp-Anim. - 1997. - Vol. 46, №4. - P. 244-251.
165Hogberg K. Acta vet. Sconol. //
Scand., Stockholm. - 1968. № 91. - P. 15-16.
166Hoper J., Jahn H., Demir
R., Hoper K. Influence of environmental oxygen concentration on enlargement and
vascular density of the area vasculosa in chick embryos: Institut fur
Physiologie und Kardiologie, Friedrich-Alexander-Universitat,
Erlangen-Nurnberg, Germany // Adv-Exp-Med-Biol. - 1997. - № 428 - P. 97-169.
167Kunder S.C., Kelly K.M.,
Morahan P.S. Biological response modifier-mediated resistance to herpesvirus
infections requires induction of alpha/beta interferon: Department of
Microbiology and Immunology, Medical College of Pennsylvania, Philadelphia //
Antiviral-Res. - 1993. - Vol. 21, № 2. - P. 90-129.
168Laybourn K.A., Hiserodt
J.C., Hunt J.M. Natural cell-mediated immunity in the rabbit: Department of
Pathology and Laboratory Medicine, University of Texas Health Science Center,
Houston // J. Cell-Immunol. - 1990. - Vol.129, № 2 - P. 492-519.
169Marina S., Vior C., Pop M.
Definirea profilului immunologic la puii de gaina // Lucrarile - Inst. agron.
Ciuj-Napoca. Fac. de agronomie. Catedra de medicina veterinara. - 1988. -
P.231-240.
170May J.D. Ability of
broilers to resist heat following neonatal exposure to high environmental
temperature // J. Poultry Sc. - 1995. - Vol.74, № 11. -P. 1905-1907.
171Morahan P.S., Pinto A.,
Stewart D. Varying role of alpha/beta interferon in the antiviral efficacy of
synthetic immunomodulators against Semliki Forest virus infection: Department
of Microbiology and Immunology, Medical College of Pennsylvania, Philadelphia
// Antiviral-Res. - 1991. - Vol. 15, №3 - P. 187-241.
172Nienwenhius R., Opstelten
D. Functional anatomy of germinal centers // Am. J. Anat. - 1984. - Vol. 170, №
3. -P.421-435.
173Price R.E., Templeton
J.W., Smith R.D., Adams L.G. Ability of mononuclear phagocytes from cattle
naturally resistant or susceptible to brucellosis to control in vitro
intracellular survival of Brucella abortus: Department of Veterinary Pathology,
College of Veterinary Medicine, Texas A & M University, College Station //
Infect-Immun. - 1990. - Vol. 58. - № 4. - P. 793-879.
174Reddy A.R., Reddy P.R.
Factors contributing to immunosuppession in chicken // Poultry Adviser. - 1988.
- № 9. - P.53-56.
175Romppanen T. Postembryonic
development of the chicken bursa of Fabricius. A light microscopic histoguan
titativ stady // Poult. Sci. - 1981. - Vol. 61, № 11. - P. 2261-2270.
176Thorbecke G., Lerman S.P.
Germinal centers and their role in animal responses // The reticuloendothelial
system in healthe and diseases. - New York; London. - 1976. - P. 83-100.
177Trinchieri G., Kubin M.,
Bellone G., Cassatella M.A. Cytokine cross - talk between phagocytic cells and
lymphocytes: relevance for differentiation/activation of phagocytic cells and
regulation of adaptive immunity: Wistar Institute of Anatomy and Biology,
Philadelphia, Pennsylvania // J. Cell Biochem. - 1993. - Vol. 53, №4. - P.
268-277.
178Vainio O. Toivanen A.
Earty ontogeny of germinal center formation in the chicken // Folia biol /
(Praha). - 1977. - T. 23. - Fase.6. - P.378-379.
179Wachnik Z. Amoniak a zdrowe those
orobin // Drobiazszno. - 1973. - 21.- P. 16-17.
180Weber W.T., Ewert D.L.
Avian immunology // Progress in clinical and biol. research / Intern. conf. on
avian immunology. Philadelphia, Pa. 13-15.07.1986.- Proc. of the (...). Nev York. - 1987.- P. 351.
181Yahav S., Luger D.,
Cahaner A. Thermoregulation in naked neck chickens subjected to different
ambient temperatures: Institute of Animal Science, Bet Dagan, Hebrew
University, Faculty of Agriculture, Rehovot, Israel // Br-Poult-Sc. -1998. -
Vol. 39, №1. - P. 125-133.
182Нusband A.J. Perspectives in mucosal
immunity: a ruminant model // Veterinary immunology. - 1988. - P.357-365.