Формирование наноразмерных частиц серебра в спиртовом растворе разветвлённого полиэфира
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ
РОССИЙСКОЙ ФЕДЕРАЦИИ
Федеральное государственное бюджетное
образовательное учреждение
высшего профессионального образования
"КУБАНСКИЙ ГОСУДАРСТВЕННЫЙ
УНИВЕРСИТЕТ"
(ФГБОУ ВПО "КубГУ")
Кафедра органической химии и
технологий
ДИПЛОМНАЯ РАБОТА
ФОРМИРОВАНИЕ НАНОРАЗМЕРНЫХ ЧАСТИЦ
СЕРЕБРА В СПИРТОВОМ РАСТВОРЕ РАЗВЕТВЛЁННОГО ПОЛИЭФИРА
Работу выполнила С.В. Жильцова
Факультет химии и высоких технологий
Специальность 020101 - Химия
Нормоконтролёр, преподаватель А.В. Беспалов
Краснодар 2012
Содержание
Введение
1. Литературный обзор
1.1 Металлические наночастицы
1.1.1 Классификация и общие сведения
1.2 Свойства металлических наночастиц
1.2.1 Оптические свойства наночастиц серебра
1.2.2 Антибактериальные свойства наночастиц серебра
1.3 Методы синтеза наночастиц в водных и неводных растворах
1.3.1 Восстановление боргидридами щелочных металлов
1.3.2 Радиационно-химическое восстановление
1.3.3 Фотохимическое восстановление
1.3.4 Восстановление цитрат-ионом (метод Туркевича)
1.3.5 Восстановление органическими соединениями, содержащими
карбонильную группу (реакция Толленса)
1.4 Методы стабилизации частиц в растворах
1.4.1 Стабилизация поверхностно-активными веществами
1.4.2 Стабилизация полимерами
1.5 Полиэфиры
2. Экспериментальная часть
2.1 Реактивы и оборудование
2.2 Подготовка реактивов к использованию
2.3 Получение золя серебра в изопропаноле
2.4 Исследование полученных золей серебра
2.5 Исследование фотоагрегации полученного золя
2.6 Исследование агрегации под действием химических реагентов
3. Результаты и обсуждение
3.1 Получение и исследование золей серебра в изопропаноле
3.2 Исследование процесса фотостимулированной агрегации золя
наноразмерных частиц серебра, стабилизированных полиэфиром Лапрол-5003
3.3 Исследование процесса химической агрегации золя серебра
Выводы
Список литературы
Реферат
Дипломная работа содержит ____ страницу, 11 рисунков, список
использованных источников из 23 наименований.
Ключевые слова: наночастицы серебра, Лапрол-5003, полоса
поверхностного плазмонного резонанса, фотостимулированная агрегация,
электролитическая коагуляции, стабилизация истощения.
Цель данной работы - получение и исследование наноразмерных
частиц серебра в изопропаноле с использованием в качестве стабилизатора
разветвлённого полиэфира Лапрол-5003.
В данной работе было осуществлено получение устойчивых золей
серебра в изопропиловом спирте с использованием в качестве стабилизатора
простого полиэфира Лапрол-5003. Размер полученных частиц был охарактеризован
при помощи методов сканирующей электронной микроскопии и УФ - спектроскопии.
Для установления механизма стабилизации полученного золя исследуемым полиэфиром
были проведены исследования фотостимулированной агрегации и коагуляции золя под
действием электролитов.
Введение
В настоящее время актуальной задачей современной химии
является получение устойчивых дисперсий металлических наночастиц, в частности
наночастиц серебра, так как они обладают биоцидными свойствами.
Бактерицидные свойства металлического серебра связаны с его
медленным окислением и высвобождением ионов Ag+ в окружающую среду.
Благодаря развитой поверхности наночастиц обеспечивается их максимальный
контакт с окружающей средой. Поэтому представляется перспективным использование
препаратов наносеребра как особого класса биоцидных агентов [1].
Большое число работ как отечественных, так и зарубежных
авторов посвящено получению металлических наночастиц в водных растворах, в то
же время работ, посвящённых синтезу золей металлов в неводных средах,
существенно меньше. В связи с чем является перспективным получение золей
серебра в неводных растворах и применение их в лакокрасочных материалах.
Основной проблемой получения золей металлов является
склонность наночастиц к процессам агрегации. Одним из наиболее эффективных
путей предотвращения агрегации является стабилизация дисперсий при помощи
высокомолекулярных соединений. Известно, что полимеры, вводимые в раствор, в
котором осуществляется синтез наночастиц, ведут себя как
"покрывающие" лиганды, останавливающие на определённом этапе дальнейший
рост частиц [2].
Целью данной работы было получение и исследование
наноразмерных частиц серебра в изопропаноле с использованием в качестве
стабилизатора разветвлённого полиэфира Лапрол-5003.
1.
Литературный обзор
1.1
Металлические наночастицы
1.1.1
Классификация и общие сведения
Наночастицы и кластеры металлов - важное состояние
конденсированной фазы. Подобные системы имеют много особенностей и не
наблюдаемых ранее новых физико-химических свойств. Наночастицы можно
рассматривать как промежуточные образования между атомами, с одной стороны, и
твёрдым состоянием - с другой. Они обладают изменяемым набором свойств,
зависящих от размера. Одной из главных причин изменения физических и химических
свойств частиц по мере уменьшения их размеров является возрастание в них
относительной доли "поверхностных" атомов, находящихся в иных
условиях, чем атомы объёмной фазы. С энергетической точки зрения уменьшение
размеров частицы приводит к возрастанию доли поверхностной энергии в её
химическом потенциале [1].
Наночастицы металлов находят применение в различных областях
исследования, например, в катализе, фотонике, медицине, биологии, создании
новейших материалов с уникальными свойствами.
В последнее время появилось множество работ, посвящённых
синтезу наночастиц металлов в водных растворах. Используются различные способы
восстановления ионов серебра: химический, фотохимический, радиохимический и ряд
других [1-3].
1.2 Свойства
металлических наночастиц
Свойства наночастиц металлов (электронные, оптические,
магнитные и др.) могут существенно отличаться от свойств соответствующих
объёмных фаз. На наноуровне также проявляются квантовые эффекты: электронное
туннелирование, размерное квантование энергетических уровней и другие. Для
полупроводниковых наночастиц спектральные характеристики - ширина запрещённой
зоны - начинают отличаться от соответствующих величин для компактных материалов
в большинстве случаев при диаметре частиц меньше 30 нм. Уникальные магнитные
свойства металлсодержащих наночастиц возникают при размерах 2-30 нм.
Поверхностная энергия наночастиц такова, что они способны
эффективно взаимодействовать с любыми химическими соединениями, включая
инертные газы. Для металлических наночастиц не существует инертной среды, на их
поверхности всегда имеется оболочка из лёгких атомов. Углеводороды, этилен,
кислород, CO, CO2, H2O сорбируются и взаимодействуют с поверхностью наночастиц.
Механизм связывания наночастица - органический лиганд включает следующие
взаимодействия: электростатическое взаимодействие между ионами,
донорно-акцепторное взаимодействие между n-донорными центрами и
вакантными орбиталями металла и образование ковалентных связей, дисперсионные
взаимодействия и пространственное экранирование поверхности наночастицы.
Образующийся поверхностный органический слой, покрывающий неорганические в
своей основе наночастицы, определяет их устойчивость, растворимость и
возможность использовать для приготовления наноматериалов различного назначения
[4].
Наночастицы с ковалентно-связанными лигандами растворяются в
органических растворителях без дополнительного введения лигандов. Если же связи
менее прочные и имеется равновесие в растворе, то для растворения наночастиц
необходимо использовать избыток лиганда. Две основные функции лигандов на
поверхности наночастиц: они предохраняют наночастицы от агрегации и
способствуют их диспергированию в различных растворителях. Для защиты
наночастиц от агрегации необходимо, чтобы связанные с донорным атомом
группировки "стелились" вдоль поверхности наночастицы, закрывая как
можно большую её часть; в то же время для увеличения "растворимости"
наночастиц в неполярных растворителях необходимо, чтобы связанные с донорным
атомом радикалы простирались как можно дальше от поверхности наночастицы вглубь
растворителя. Для прикрепления наночастиц к биомолекулам необходимо, чтобы
наночастицы растворялись в воде и имели на своей поверхности функциональные
группы, за которые их можно было соединить с биомолекулами. В таких лигандах
должно быть много гетероатомов (S, O, N) и функциональных групп (-COOH, - NH2). В реакционных средах,
где происходит зарождение и рост наночастиц, используются слабые лиганды,
способные структурировать раствор, в котором идёт образование наночастиц [5].
Свойства коллоидного раствора, в том числе и наночастиц
серебра, определяются возможностью коагуляции и перекристаллизации, т.е.
агрегативной устойчивостью, а также возможностью их окисления кислородом
воздуха. Для описания устойчивости нанодисперсии серебра во времени могут быть
использованы несколько методов. Метод визуального наблюдения за системой может
дать предварительные и общие закономерности относительной устойчивости
исследуемой дисперсии. Может быть зафиксировано изменение окраски системы или
образование осадка в ней. Для наночастиц серебра цвет систем меняется от красного
(жёлто-коричневого) до серого и даже чёрного [4].
1.2.1
Оптические свойства наночастиц серебра
Оптические свойства наночастиц серебра сильно зависят как от
характеристик индивидуальных частиц (их размера, формы и состава, наличия и
структуры адсорбционных слоёв), так и от их окружения, в т. ч. и от способа
пространственного упорядочения частиц. Характерной особенностью спектров
поглощения и рассеяния металлических наночастиц размером более 2 нм является
присутствие интенсивной и широкой полосы в видимой области или в прилегающих к
ней ближних ИК - и УФ-областях. Эту полосу называют полосой поверхностного
плазмонного резонанса (ППР) или, реже, полосой резонанса Ми (по имени Густава
Ми, внёсшего наиболее заметный вклад в теоретическое объяснение этого явления).
Из всех металлов серебро имеет наибольшую интенсивность полосы ППР, у золота и
меди она немного слабее. Серебро обладает самым высоким коэффициентом
экстинкции в максимуме полосы ППР не только среди металлов, но и среди всех
других известных материалов, поглощающих в той же области спектра (т.е. НЧ
серебра пропускают свет в этой спектральной области в меньшей степени, чем
любые другие частицы такого же размера). Возникновение полосы ППР - это
результат взаимодействия падающего на поверхность НЧ света с электронами
проводимости металла. Согласно теории электронного газа, электроны внутренних
оболочек локализованы вблизи атомного ядра, а электроны внешних валентных
оболочек могут свободно перемещаться внутри металлической частицы, и
обусловливают, в частности, высокую электропроводность металлов. Под действием
переменного электрического поля светового луча подвижные электроны проводимости
смещаются. Если размер частицы много меньше длины волны падающего света, то
перемещение электронов приводит к возникновению диполя, колеблющегося с
частотой возбуждающего электрического поля. Если частота колебаний падающего
света совпадает с собственной частотой колебаний электронов проводимости вблизи
поверхности частицы, то наблюдается резонансное поглощение и рассеяние света,
называемое ППР. Колеблющийся диполь, образовавшийся вблизи поверхности при
смещении электронов проводимости, обычно называют поверхностным плазмоном. Для
частиц несферической формы или частиц, находящихся в неоднородном окружении,
различные ориентации частицы по отношению к падающей световой волне
неравноценны. Области положительного и отрицательного заряда, сформировавшиеся
вблизи поверхности наночастицы в результате смещения электронов проводимости,
вызывают поляризацию окружающей среды, в которой находится частица металла.
Такая поляризация приводит к уменьшению величины и частоты колебаний
индуцированного диполя и, как следствие, к сдвигу полосы ППР в длинноволновую
область. Эти эффекты выражены тем сильнее, чем больше способность окружающей
среды к поляризации, т.е. чем больше диэлектрическая проницаемость окружающей
среды [6].
1.2.2
Антибактериальные свойства наночастиц серебра
Типичные наночастицы серебра имеют размеры 25 нм. Они имеют
чрезвычайно большую удельную площадь поверхности, что увеличивает область
контакта серебра с бактериями или вирусами, значительно улучшая его
бактерицидное действие. Таким образом, применение серебра в виде наночастиц
позволяет в сотни раз снизить концентрацию серебра с сохранением всех
бактерицидных свойств.
Антибактериальная активность серебра объясняется тем, что
ионы серебра, взаимодействуя с тиольной группой цистеина, входящего в состав
ферментов, нарушают их функционирование. Для человека же серебро в малых
количествах абсолютно безвредно, так как, попадая в организм, любая растворимая
соль серебра мгновенно превращается в малорастворимый хлорид. В ряде работ
установлено, что биоцидное действие серебра в форме кластеров и наночастиц в
некоторых случаях превосходит аналогичное действие ионов серебра. Так,
например, при воздействии кластерного серебра на дрожжевые клетки Candida utilis отмечено прекращение
роста культуры дрожжей. При действии же водно-органического препарата ионного
серебра той же концентрации наблюдался лишь микробостатический эффект, проявляющийся
в задержке роста с последующим его возобновлением [7,8].
Бактерицидная добавка на основе наночастиц серебра является
одним из последних достижений отечественной науки в области нанобиотехнологий.
После длительного использования, терапевтическая ценность синтетических
антибиотиков уменьшилась из-за появления устойчивых к ним микроорганизмов.
Развитие сопротивляемости микроорганизмов к антибиотикам может произойти из-за
непосредственной мутации микроорганизма, а также из-за приобретения частей ДНК
от других организмов. Уже на протяжении тысячелетий бактерии и вирусы не
способны выработать "иммунитет" к серебру. В то время как серебро
полностью безопасно для млекопитающих (в том числе человека), рептилий,
растений и всех других живых существ, имеющих многоклеточное строение.
В связи со способностью особым образом модифицированных
наночастиц серебра длительное время сохранять биоцидные свойства, рационально
использовать наносеребро не в качестве дезинфицирующих средств частого
применения, а добавлять в краски, лаки и другие материалы, что позволяет
экономить деньги, время и трудозатраты [9].
1.3 Методы
синтеза наночастиц в водных и неводных растворах
1.3.1
Восстановление боргидридами щелочных металлов
Боргидриды (тетрагидробораты) щелочных металлов MBH4 являются одними из
сильных и наиболее широко используемых восстанавливающих реагентов. Они
проявляют восстановительные свойства в любой водной среде - кислой,
нейтральной, щелочной. При этом редокс-потенциал MBH4 изменяется от - 1,24 В в
щелочной среде до - 0,48 В в кислой [3,10]. Восстановительная активность
тетрагидроборатных растворов возрастает с повышением кислотности, что связано с
ускорением реакции гидролиза боргидрид-аниона и образованием промежуточных
продуктов (B2H6, BH (OH) 2, BH (OH) 3-), которые являются еще
более сильными восстановителями, чем BH4 - анион.
Большинство катионов переходных металлов восстанавливаются
боргидридами щелочных металлов. Окислительно-восстановительные реакции с BH4 - анионом идут, если
стандартный редокс-потенциал восстанавливаемого иона металла находится в
интервале от - 0,5 В до - 1,0 В.
ВН3 + 3Н2О → В (ОН) 3
+ 3Н2
либо каталитически разлагается на поверхности образующихся
металлических наноразмерных частиц до элементного бора
ВН3 + М → В + 1,5Н2 + М,
который осаждается и в виде примеси присутствует в металле.
Нанодисперсные золи переходных металлов получают
восстановлением растворов соответствующих солей свежеприготовленным раствором
боргидрида с присутствием стабилизатора, например ПВС или ПАК, различных ПАВ и
пр. Регулирование размеров металлических наночастиц при боргидридном
восстановлении можно осуществлять и комплексным восстановлением. Для этого наряду
с тетрагидроборатом используется более слабый восстановитель, например
цитрат-анион [3].
Известно, что боргидрид-анион может и сам выступать в
качестве стабилизатора образующихся наночастиц. Так, в работе [11] был
осуществлён синтез золей серебра с использованием избытка боргидрида натрия.
Избыток BH4 - анионов адсорбируется на поверхности образующихся наночастиц и
препятствует их коагуляции. Полученные таким образом золи сохраняют
устойчивость в течение длительного времени.
В настоящее время боргидридный метод восстановления золей
металлов является наиболее распространённым в процессах синтеза НРЧ металлов
как в гомогенных, так и в гетерогенных системах. Это объясняется как высокой
реакционной способностью боргидрид-аниона (по сравнению с цитрат-ионом и углеводами),
так и удобством в использовании (по сравнению с восстановлением газообразным
водородом и физическими методами) и невысокой токсичностью (по сравнению с
гидразином и гидроксиламином) [12].
1.3.2
Радиационно-химическое восстановление
Радиационно-химическое восстановление (или окисление) ионов
металлов в водных растворах осуществляется ионными и радикальными частицами,
которые генерируются под действием ионизирующего излучения. В общем виде
процесс генерации активных частиц может быть выражен в виде следующей схемы:
H2O → e-aq
(2,6), H (0,6), OH (2,7), H2 (0,45), H2O2
(0,7), H+ (2,6),
где в скобках приведены значения первичных
радиационно-химических выходов продуктов радиолиза воды или разбавленных
растворов в расчете на 100 эВ поглощенной энергии для легких видов излучения (γ-лучей или ускоренных е-). Образующиеся гидратированный
электрон и атом водорода имеют высокие восстановительные потенциалы (-2,9 и -
2,3 В, соответственно), а гидроксильный радикал, напротив, обладает высокой
окислительной способностью (1,9 В). Для создания благоприятных условий для
восстановления ионов металлов в воду добавляют органические соединения (спирты
или соли органических кислот), которые являются эффективными акцепторами
радикалов ОН. Их взаимодействие обеспечивает трансформацию сильного окислителя
- радикала ОН в органический радикал, обладающий свойствами восстановителя.
Следует отметить, что атомы Н также реагируют с органическими соединениями с
образованием тех же радикалов.
Таким образом, при использовании, например, изопропилового
спирта или формиат-ионов, в результате протекания реакций
(СН3) 2СНОН + ОН (Н) → (СН3)
2СОН + Н2О (Н2)
НСОО - + ОН (Н) → СО2 - +
Н2О (Н2)
инициированных действием на водный раствор ионизирующего
излучения, в нём генерируются только восстановительные частицы: e-aq и радикалы (СН3)
2СОН или СО2-, восстановительные потенциалы
которых равны - 1,4 и - 1,9 В, соответственно.
Собственно радиационно-химическое восстановление ионов
металлов происходит в реакциях одноэлектронного переноса, например:
Ag+ + e-aq (или СО2-)
→ Ag0 (или Ag0 и СО2)
Атомы и ионы в необычных и неустойчивых состояниях окисления,
образующиеся на начальном этапе восстановления ионов металлов в водном
растворе, являются источником формирования наночастиц. Для изучения их также,
как и реакций с их участием, используется метод импульсного радиолиза.
Установлено, что выделению металла предшествует ряд промежуточных стадий
образования, как правило, неустойчивых малых кластеров. В процессе их
последовательного слияния формируются всё более крупные частицы вплоть до
появления квазиметаллических и далее наноразмерных частиц.
Установлено, что возникающие в реакции одноэлектронного
переноса атомы Ag0 далее в результате последовательных превращений дают семейство
"магических" кластеров:
Ag2+ → Ag32+ → Ag42+ → Ag82+
Кластер Ag82+ оказывается достаточно устойчивым, его время
жизни измеряется десятками минут. Спектры поглощения иллюстрируют исчезновение
этого кластера (полосы при 290 и 325 нм), которое сопровождается вначале
образованием квазиметаллических частиц (широкая полоса при 350-370 нм), а затем
появлением полосы поглощения с максимумом при 390 нм. Последняя принадлежит
золям серебра и обусловлена поглощением света электронами проводимости
(поверхностными плазмонами). Высокая плотность электронных уровней в
квазиметаллических частицах приближает их по свойствам к наноразмерным
металлическим частицам, в которых электронные уровни вырождены, валентные
электроны обобществлены и существуют как электроны проводимости. Изменения электронного
строения в ряду "кластер - квазиметаллическая частица - наночастица"
ярко проявляются в оптических спектрах: индивидуальные узкие оптические полосы,
свойственные кластерам различной сложности, переходят по мере увеличения
размера кластера в широкие оптические полосы, характерные для
квазиметаллических частиц, и далее в полосу поглощения плазмонов, уже
отвечающую металлическому состоянию.
Радиационно-химическое восстановление многих ионов металлов в
водных растворах в присутствии стабилизаторов приводит к образованию золей
металла. Этот способ получения металлических наночастиц имеет ряд несомненных
преимуществ, что обеспечило его достаточно широкое применение. К числу
достоинств можно отнести, по крайней мере, следующие. Во-первых, вводимые в исходный
раствор добавки не загрязняют образующиеся металлические золи, что неизбежно
при использовании NaBH4 и других химических восстановителей. Во-вторых, при облучении
радикалы-восстановители генерируются равномерно по объёму раствора, что
позволяет избежать локальных пересыщений, создаваемых при обычном проведении
химического восстановления. В-третьих, простота проведения эксперимента -
реакционный сосуд с вакуумированным раствором помещают на источник излучения,
восстановительный процесс заканчивается после удаления раствора от источника
излучения. В-четвёртых, приготовленные растворы, содержащие в необходимой
концентрации органические соединения, практически прозрачны даже в глубоком
ультрафиолетовом свете, что позволяет успешно применять для исследования золей
наиболее информативный метод электронной спектроскопии. В целом радиохимический
метод восстановления успешно дополняет существующие методы получения НРЧ [13].
1.3.3
Фотохимическое восстановление
Фотохимический способ заключается в УФ-облучении растворов,
содержащих ионы серебра и вещество, служащее восстановителем. Наиболее ярким
примером использования фотохимического восстановления является синтез т. н.
"синего серебра" - полимер-иммобилизованной наноструктуры,
представляющей собой цепочки из ионов и кластеров серебра, закреплённые на
полиакриловой кислоте [1]. В общем виде процесс восстановления протекает по
следующей схеме:
R-COO - + Ag+ → R-COO-Ag+,
R-COO-Ag+→ R-COO·+ Ag0,R-COO-Ag+ + Ag0
→ R-COO-Ag2+ → R-COO-Ag42+
→ … →
R-COO-/Agn
1.3.4
Восстановление цитрат-ионом (метод Туркевича)
Впервые описанный Туркевичем в 1951 г. способ получения
гидрофильных НРЧ золота в настоящее время находит весьма широкое применение.
Суть метода заключается в восстановлении соединений благородных и платиновых
металлов цитратом натрия при кипячении в водном растворе.
Применение в качестве восстановителя цитрата натрия позволяет
как восстанавливать металлсодержащие соединения, так и стабилизировать
образующиеся коллоидные растворы наноразмерных частиц за счёт поверхностной
адсорбции цитрат-ионов [10,12]. Таким образом, при восстановлении H2PtCl6, AgNO3, KAuCl6 получены НРЧ с узким
распределением по размерам Pt (1,5-9,0 нм), Ag (40-60 нм), Au (10-15 нм) [3].
1.3.5
Восстановление органическими соединениями, содержащими карбонильную группу
(реакция Толленса)
Для получения золей платиновых металлов, меди, серебра,
золота на практике часто используют органические соединения, содержащие
карбонильную группу. Часто эти соединения выполняют двоякую функцию -
восстановителя и стабилизатора образующегося коллоида. Показано, что при
получении НРЧ серебра, с использованием глюкозы в качестве восстановителя,
образуются наночастицы больших размеров (80-140 нм) [3].
Имеются сведения о необычном варианте реакции Толленса для
получения НРЧ серебра, в котором для синтеза применялся экстракт листьев Aloe Vera. Методами
ИК-спектроскопии установлено, что за восстановление аммиачного раствора [Ag (NH3) 2] ОН
отвечают низкомолекулярные соединения экстракта Aloe Vera, содержащие карбонильные
группы. Следует отметить, что по сравнению с другими методами, использующими
реакцию Толленса, этот метод позволяет получать сферические НРЧ серебра
небольших размеров (15,2 ± 4,2 нм) [12].
1.4 Методы
стабилизации частиц в растворах
Поверхностная энергия наночастиц настолько велика, что они
способны взаимодействовать с любыми химическими веществами, включая инертные
газы. На их поверхности всегда существует оболочка из лёгких атомов (О2,
Н2О, СО2 и углеводороды), адсорбирующихся и
взаимодействующих с поверхностью наночастиц.
Наночастицы металлов имеют склонность к агрегации, скорость
которой резко возрастает при нагревании, ультрафиолетовом облучении или
интенсивном механическом воздействии. Для предотвращения подобных процессов
используются различные стабилизаторы, в качестве которых используются полимеры
и поверхностно-активные вещества [14].
1.4.1
Стабилизация поверхностно-активными веществами
Наночастицы даже очень малого размера (1 нм) состоят из ядра
и оболочки. Поверхностные атомы имеют отличные от внутренних координационные
числа, длины связей и валентные углы. Все структурные дефекты и примеси также
располагаются в поверхностном слое. Очевидно, что с органическими веществами
также взаимодействуют поверхностные атомы частиц. Образующийся органический поверхностный
слой, покрывающий частицы, определяет их устойчивость и растворимость.
В общих чертах механизм связывания наночастицы с молекулой
стабилизатора включает те же взаимодействия, которые характерны для
классического комплексообразования с ионами металлов:
- электростатическое
ион-ионное взаимодействие;
- донорно-акцепторное взаимодействие n-донорных центров
стабилизатора и вакантных орбиталей атома металла.
Однако, в случае взаимодействия с поверхностью НРЧ,
существенно большую роль играют дисперсионные взаимодействия и пространственное
экранирование поверхности НРЧ.
Существует два случая расположения органической молекулы ПАВ
на поверхности наночастицы (рис.1). При недостатке координирующего лиганда
каждая его молекула стремится покрыть как можно больший участок поверхности
наночастицы (форма b), а при добавлении избытка лиганда осуществляется переход к форме
а.
электролит полиэфир наночастица серебро

Рис.1. Схематичное представление двух предельных случаев
расположения молекулы ПАВ на поверхности металлической наночастицы: при
недостатке молекул ПАВ (a) и при плотном покрытии поверхности частицы молекулами ПАВ (b), где N - координирующаяся
функциональная группа, L - гидрофобный фрагмент молекулы ПАВ.
Изменяя размер частицы и длину неполярной части молекулы
можно варьировать степень упорядоченности молекул на поверхности наночастиц.
Процессы замещения одного лиганда на другой подчиняются
следующим закономерностям:
. Часто для замещения одного лиганда на другой используют
большой (в 1000 и более раз) избыток замещающего лиганда. Если избыток
небольшой, полного замещения (>95%) осуществить не удаётся;
. Лиганды с большими стерическими требованиями более прочно
связаны и легче замещают другие лиганды (в классической координационной химии -
наоборот);
. Меркаптаны и классические ацидные лиганды слабо связываются
с поверхностью частиц, поэтому для полного замещения сильного лиганда на
меркаптан или ацидный лиганд необходимо длительное время и довольно жёсткие
условия реакции [15].
1.4.2
Стабилизация полимерами
Стабилизирующее действие полимера является следствием
адсорбции молекул на поверхности наночастиц. На эффективность стабилизации
влияют природа полимера, его функциональные группы, а, в случае сополимера,
также распределение звеньев в цепи. Первой попыткой количественной оценки
стабилизирующей способности полимера было определение Фарадеем так называемого
"золотого числа", определяемого количеством полимера способного
предотвратить коагуляцию 10 мл золя золота при добавлении 1 мл 10% -го раствора
NaCl. Чем меньше
"золотое число", тем более эффективнее полимер предотвращает
коагуляцию дисперсной фазы. Существует несколько возможных механизмов
стабилизации наночастиц полимерами:
1. Стерическая стабилизация возникает в результате
физической адсорбции, либо хемосорбции молекул полимера на поверхности
наночастиц металла (рис.2). Полимерные молекулы, адсорбирующиеся на поверхности
наночастиц, создают защитную оболочку, наличие которой препятствует агрегации
частиц и их окислению.
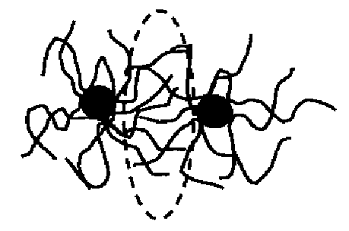
Рис.2. Схематичное представление механизма стерической
стабилизации наночастиц высокомолекулярными соединениями [16].
. Электростерическая стабилизация - это комбинация
стерического и электростатического механизмов стабилизации. В данном случае в
качестве стабилизаторов выступают ионогенные полимеры (полиэлектролиты).
Присутствие в их структуре заряженных групп обеспечивает дополнительное
отталкивание между соседними частицами, окружёнными оболочкой из молекул полиэлектролита
(рис.3).
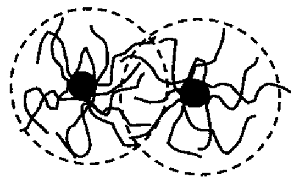
Рис.3. Схематичное представление механизма электростерической
стабилизации незаряженных наночастиц ионогенными высокомолекулярными
соединениями [16].
. Стабилизация исключения (истощения) или стабилизация
депляции (англ. depletion stabilization) является наименее изученным механизмом
стабилизации. Возникает в очень концентрированных растворах полимеров, слабо
взаимодействующих с поверхностью частиц. Основным фактором стабилизации данного
типа является отсутствие прямых взаимодействий между поверхностью наночастиц и
молекулами полимера, вследствие чего защитная адсорбционная оболочка не
образуется. Отдельные молекулы ВМС существуют в растворе в свободном виде и
концентрируются в области между частицами (рис.4), таким образом, препятствуя
их агрегации. Однако, подобный тип стабилизации не обеспечивает защиту частиц
от окисления.

Рис.4. Схематичное представление механизма стабилизации
"истощения" наночастиц высокомолекулярными соединениями [16].
Необходимым условием для эффективной стабилизации является
достаточная активность поверхности НРЧ металла по отношению к полимеру,
образующему адсорбционно-сольватную плёнку на поверхности. Особенно устойчивы
адсорбционные слои, образующиеся при значительных концентрациях полимеров.
Иногда в растворе возникают упорядоченные структуры наночастиц на молекулах
полимеров, в которых частицы металла связывают звенья макромолекул. Чрезвычайно
эффективными стабилизаторами являются полиэлектролиты. У них наблюдается
выраженная тенденция к ассоциации ионных групп, которые образуют ионные
области, в которых и формируются наночастицы. Механизм адсорбции
полиэлектролитов более сложен, нежели неионогенных полимеров [17].
1.5 Полиэфиры
Полиэфиры или полиэстеры - высокомолекулярные соединения,
получаемые поликонденсацией многоосновных кислот или их альдегидов с
многоатомными спиртами. Известны природные (янтарь и др.) и искусственные
полиэфиры. Практическое применение получили глифталевые смолы,
полиэтилентерефталат, полиэфирмалеинаты и полиэфиракрилаты.
Полиэфиры - полимеры, содержащие в основной цепи
макромолекулы функциональные группы простых (простые полиэфиры) или сложных
(сложные эфиры) эфиров. Полиэфиры могут быть насыщенными и ненасыщенными.
Простые полиэфиры, HO - [-R-O-] n-H, где R - углеводородный радикал различного строения, содержащий не
менее двух атомов углерода, получают полимеризацией циклических окисей
(например, окиси этилена и окиси пропилена) или поликонденсацией гликолей.
Сложные полиэфиры линейной структуры, H - [-OAO-CO-A'-CO-] n-OH, где А - углеводородный радикал, A' - остаток органической
или неорганической кислоты (например, полиэтилентерефталат, нуклеиновые
кислоты), получают поликонденсацией либо гликолей с двухосновными кислотами или
их ангидридами, либо оксикислот. При использовании многоатомных спиртов (число
групп ОН более 2, например глицерина, пентаэритрита различных полиолов)
получают разветвлённые (например, алкидные смолы) или сшитые полиэфиры.
Свойства полиэфиров очень разнообразны и зависят от
химического состава, структуры, молекулярной массы и наличия функциональных
групп (-ОН и - СООН). Как правило, простые полиэфиры эластичнее сложных.
Полиэфиры могут вступать в химическую реакцию по концевым функциональным
группам с увеличением молекулярной массы, ненасыщенные полиэфиры способны
"сшиваться" с образованием трёхмерных структур. Сложные полиэфиры
гидролизуются под действием кислот и щелочей, простые полиэфиры значительно
устойчивее к гидролизу.
Области применения полиэфиров: производство волокон, тары,
плёнок, лакокрасочных материалов, покрытий, оргстекла, композиционных
материалов, полиуретанов, в качестве пластификаторов.
Лапролы имеют множество применений, главное из которых -
производство различных типов пенополиуретанов, широко используемых в мебельной
промышленности, автомобилестроении, авиационном и железнодорожном транспорте,
изготовлении товаров бытового назначения, электротехнике. Также Лапролы
применяются в трубопроводном транспорте, медицине, металлургии, лёгкой,
химической и горнообогатительной промышленности, в производстве поролона,
пенопласта и различных строительных материалов. Лапролы применяются в
производстве синтетических смазочных масел, как компонент для получения
тормозной жидкости и в качестве пеногасителя микробиологических процессов.
Лапрол-5003 - это продукт алкоголятной полимеризации окиси
пропилена и окиси этилена с глицерином (М=5000±300). Используется для
получения эластичных пенополиуретанов [18].
2.
Экспериментальная часть
2.1
Реактивы и оборудование
1. Нитрат серебра (AgNO3) марки "х. ч."
- бесцветное кристаллическое вещество. М = 169,88, ρ = 4,352 г/см3, Тпл = 209,7оС, Тразл
= 300оС. Растворимость (г/100 г): в воде - 215,5 (20оС),
471,4 (60оС), 651,9 (80оС), 770 (100оС); в
метаноле - 3,6; в этаноле - 2,12; в ацетоне - 0,44; в пиридине - 33,6.
2. Боргидрид натрия (NaBH4) 97 % (Fluka) - белое порошкообразное
вещество. М = 37,83, ρ = 1,074 г/см3,
Тпл (разл) = 505 оС. Растворимость (г/100 г): в воде-40,6
(0оС), 56 (25оС); ДМСО - 5,8; ДМФА - 18; этаноле-4,0;
изопропаноле - 0,37 (25оС), 0,88 (60оС); трет-бутаноле -
0,11 (25оС), 0,18 (60оС).
. Йодид калия (KI) - бесцветное
кристаллическое вещество. М = 166,003, ρ = 3,13 г/см3, Тпл = 686оС, Ткип
= 1330оС, ηD = 1,667. Растворимость (г/100
г): в воде - 144,5 (20оС), 209 (100оС); спирте (1: 12);
глицирине (1: 2,5).
4. Дистиллированная вода (Н2О) ГОСТ 6709 -
72 - бесцветная прозрачная жидкость. Тпл = 0оС, Ткип
= 100оС.
5. Лапрол-5003 (ОАО "Нижнекамскнефтехим") -
бесцветная вязкая жидкость, хорошо растворимая в органических растворителях. Структурный
фрагмент Лапрола-5003:
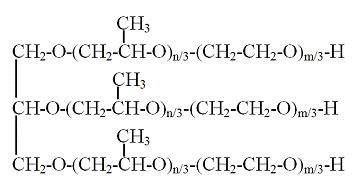
6. Изопропанол (CH3CH (OH) CH3) марки "х. ч."
- бесцветная жидкость с характерным запахом. М = 60,10, ρ = 0,7851 г/см3, Тпл = - 89,5оС,
Ткип = 82,4 оС, ηD = 1,3776. Смешивается
как с водой, так и с органическими растворителями, с водой образуя азеотропную
смесь (87,9 % изопропанола, Ткип = 83,38оС).
Получали бесцветную прозрачную жидкость; nD = 1,3776.
Рис.5. Схема прибора, применяющаяся для перегонки
изопропилового спирта.
2.3 Получение
золя серебра в изопропаноле
В мерный стакан добавили 25 мл изопропанола и добавили 0,2 г
нитрата серебра для создания насыщенного раствора. В другой стакан налили такое
же количество спирта и добавили для насыщения 0,1 г боргидрида натрия. В колбу
добавили 3,4 мл Лапрола-5003 и прибавили 75 мл изопропанола. Затем при
интенсивном перемешивании прибавили 15 мл насыщенного раствора нитрата серебра
в спирте и 0,1 мл насыщенного раствора боргидрида натрия. Раствор приобрёл
слегка желтоватый оттенок. Золь сравнения синтезировали аналогичным образом без
добавления полиэфира.
2.4 Исследование
полученных золей серебра
Для изучения эффективности стабилизации золя серебра
полиэфиром Лапрол-5003 полученный раствор наночастиц серебра исследовали при
помощи оптической спектроскопии поглощения.
Регистрацию оптических спектров поглощения золей проводили в
видимой области на спектрометре Specord - M40 (Carl Zeiss), используя кварцевые спектрофотометрические
кюветы с толщиной поглощающего слоя 1 см.
Исследование полученных золей серебра методом сканирующей
электронной микроскопии проводили спустя 14 суток после синтеза на приборе JSM-7500F (JEOL) при ускоряющем
напряжении 10 кВ. Образец для исследования готовили следующим образом: каплю
исследуемого золя наносили на алюминиевую подложку, после чего высушиванием
удаляли избыток растворителя.
Инфракрасные спектры поглощения чистого полимера и полимера,
содержащего наночастицы серебра, регистрировали на спектрометре ИнфраЛЮМ ФТ-02
(Люмэкс). Исследуемые образцы полимеров помещались между окнами из KBr. Для удаления
растворителя полученный золь серебра подвергался высушиванию под вакуумом.
2.5
Исследование фотоагрегации полученного золя
Для исследования процесса фотостимулированной агрегации
полученный золь серебра в изопропаноле с концентрацией полиэфира равной 3,4 %
подвергали воздействию нефильтрованного света ртутной лампы ДРШ-250. Образец
золя помещали в кварцевую спектрофотометрическую кювету с толщиной поглощающего
слоя в 1 см. Измерение оптической плотности производили через определённые
промежутки времени на фотоколориметре КФК-3 при λmax = 415 нм.
2.6
Исследование агрегации под действием химических реагентов
Для исследования процесса электролитической коагуляции к 15
мл полученного золя серебра приливали насыщенный раствор KI в изопропаноле
небольшими порциями по 0,01 мл. Измерение оптической плотности производили при λmax = 415 нм после добавления каждой порции раствора
KI.
3. Результаты
и обсуждение
3.1 Получение
и исследование золей серебра в изопропаноле
По классической методике прямого химического восстановления
были синтезированы устойчивые золи серебра в изопропаноле. Осуществление
данного способа синтеза было возможно вследствие достаточной растворимости как
исходного предшественника (AgNO3), так и восстановителя (NaBH4) в изопропаноле.
Стабилизацию полученных золей осуществляли при добавлении простого
разветвлённого полиэфира Лапрол-5003 (ОАО "Нижнекамскнефтехим")
непосредственно в процессе синтеза. Поскольку сведения о применении полиэфиров
подобной структуры в качестве стабилизаторов металлических наночастиц в
периодической литературе обнаружены не были, возникла необходимость более
детального изучения процесса стабилизации НРЧ серебра данным полимером, с целью
определения эффективности этой стабилизации, а также установления наиболее
оптимальных условий синтеза.
Эволюция оптических спектров поглощения полученного золя
представлена на рис.6:
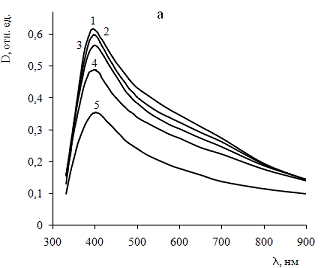
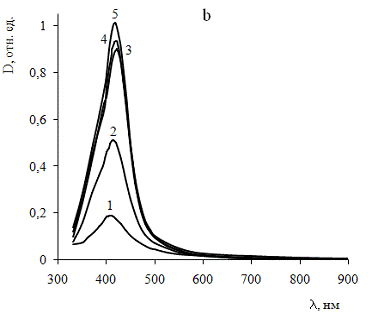
Рис.6. Спектры поглощения золя сравнения (а) и золя,
стабилизированного полиэфиром (b): 1 - через 20 минут после синтеза, 2 - через 24 часа, 3 -
через 48 часов, 4 - через 7 суток, 5 - через 14 суток.
В спектре нестабилизированного золя сравнения (рис.6a) присутствует широкая
полоса поглощения с максимумом в области 395 - 400 нм. Наличие протяжённого
длинноволнового крыла свидетельствует об образовании рыхлых агрегатов серебра
[20,21]. Отмечается незначительное уменьшение интенсивности поглощения,
связанное, по-видимому, с постепенным осаждением агрегатов серебра.
Существенных изменений в спектре нестабилизированного золя в течение времени не
происходит.
В спектре золя, стабилизированного Лапролом-5003, (рис.6б)
наблюдается интенсивная полоса поверхностного плазмонного резонанса (ППР) с
максимумом в районе 415 нм. При этом отмечается интенсивный рост поглощения в
течение первых 48 часов, после чего этот процесс замедляется. Отсутствие
поглощения в длинноволновой области свидетельствует о предотвращении процессов
агрегации наночастиц.

а b
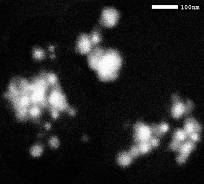
Рис.7. Электронно-микроскопические снимки наночастиц серебра
в нестабилизированном золе (a) и золе, стабилизированном простым полиэфиром Лапрол-5003 (b).
На электронной микрофотографии нестабилизированного золя
(рис.7а) агрегаты наночастиц серебра хорошо заметны, при этом диаметр самих НРЧ
изменяется в довольно широких пределах. На микрофотографии золя серебра,
стабилизированного полиэфиром Лапрол-5003 (рис.7b), присутствуют
изолированные сферические наночастицы серебра, средний диаметр которых
составляет 14±5 нм. Распределение частиц по размеру показано на гистограмме
(рис.8):
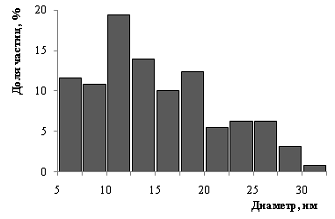
Рис.8. Гистограмма распределения наноразмерных частиц
серебра, полученных в изопропаноле и стабилизированных простым полиэфиром
Лапрол-5003.
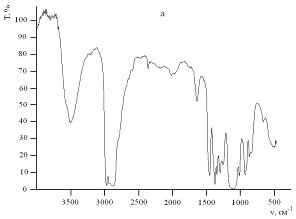
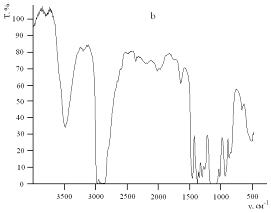
Рис.9. ИК-спектры поглощения чистого полиэфира Лапрол-5003 (a) и полиэфира,
содержащего НРЧ серебра (b).
Инфракрасные спектры поглощения чистого Лапрола-5003 и
исследуемого композита представлены на рис.9. Можно заметить, что спектры
чистого полиэфира и полиэфира, содержащего наноразмерные частицы серебра,
практически не имеют отличий. Это позволяет сделать вывод о том, что структура
полимера не претерпевает существенных изменений в процессе взаимодействия с
формирующимися частицами, что свидетельствует о слабом взаимодействии молекул
полиэфира с поверхностью наночастиц серебра.
Таким образом, несмотря на небольшую молекулярную массу
Лапрола-5003 и его слабое взаимодействие с поверхностью наночастиц, он
оказывается весьма эффективным стабилизатором золей серебра. Причиной,
вероятно, является своеобразный механизм стабилизации золя исследуемым
полиэфиром, т. н. стабилизация "истощения" (depletion stabilization). Сущность данной
стабилизации заключается в том, что молекулы полимера в растворе находятся в
пространстве между частицами серебра и препятствуют их агрегации (рис.4) [16].
Подобный механизм стабилизации характерен для многих неионогенных полимеров,
одним из условий его эффективности является высокая концентрация полимера [22].
В случае же Лапрола-5003 его разветвлённая структура способствует более
эффективному предотвращению агрегации частиц по сравнению с линейными
полимерами, что позволяет использовать растворы с меньшей концентрацией стабилизирующего
полимера.
3.2
Исследование процесса фотостимулированной агрегации золя наноразмерных частиц
серебра, стабилизированных полиэфиром Лапрол-5003
Осуществление фотостимулированной агрегации полученного золя
серебра в спиртовом растворе полиэфира проводилось как с целью определения его
устойчивости к световому воздействию, так и с целью получения дополнительных
сведений о возможном механизме стабилизации НРЧ серебра используемым
полиэфиром.
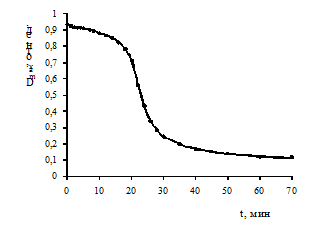
Рис.10. Зависимость оптической плотности исследуемого золя при lmax от времени УФ-облучения.
Полученная зависимость оптической плотности исследуемого золя от
времени облучения УФ-светом представлена на рис.10. В течение первых 16 минут
наблюдается незначительное уменьшение интенсивности полосы ППР, затем
отмечается резкое падение в течение последующих 14 минут, после которого
величина оптической плотности незначительно уменьшается в ходе дальнейшего
облучения. Подобная зависимость характерна для фотостимулированной агрегации
золей наноразмерных металлических частиц [20].
В целом, полученный золь характеризуется довольно высокой
устойчивостью к УФ-облучению. При воздействии УФ-излучения на исследуемый золь
возможно протекание ряда деструктивных процессов, основными из которых
являются:
уменьшение расстояния между соседними частицами вследствие
появления у них электрических зарядов, вызванного фотоэффектом;
сжатие адсорбционного слоя наночастиц и вследствие этого
уменьшение сил взаимного отталкивания;
фотостимулированное окисление частиц серебра кислородом воздуха
[23]:
Agn + 1/4n O2 + hn ® (Ag2O) 1/2n
Поскольку данный полиэфир не образует плотного адсорбционного слоя
на поверхности наночастиц, то он не способен эффективно препятствовать
фотостимулированному окислению частиц серебра. В то же время, находясь в
пространстве между частицами, молекулы Лапрола в определённой степени
препятствуют сближению частиц, хотя, по всей видимости, не столь эффективно как
адсорбирующиеся полимеры [21].
3.3
Исследование процесса химической агрегации золя серебра
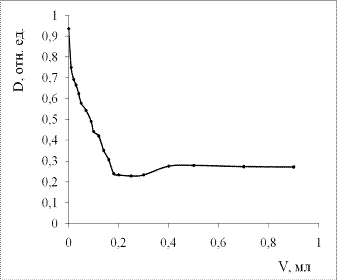
Рис.11. Зависимость оптической плотности исследуемого золя
при lmax от объёма добавленного электролита
(насыщенный раствор KI в изопропаноле).
Как можно заметить из рис.11, полученный золь характеризуется
низкой устойчивостью к электролитической коагуляции. Уже после добавления 0,01
мл насыщенного раствора KI в изопропаноле происходит резкое снижение
интенсивности полосы плазмонного поглощения (на ~0,2 отн. ед.). После
добавления последующих порций интенсивность поглощения продолжает резко
снижаться до 0,24 отн. ед. (общий объём добавленного электролита 0,18 мл),
после чего эта величина стабилизируется. По всей видимости, на данном этапе
большая часть частиц подвергается агрегации, а образующиеся агломераты, размер
которых превышает критический, седиментируют. Определённый интерес вызывает
небольшой рост оптической плотности, наблюдающийся после добавления 0,3 мл
раствора электролита, который может быть связан с частичным редиспергированием
частиц серебра под действием избытка электролита.
Общий механизм электролитической коагуляции исследуемого золя
можно представить следующим образом. На первом этапе, йодид-анионы
адсорбируются на поверхности положительно заряженных частиц серебра, в
результате чего последние теряют заряд и подвергаются быстрой агрегации.
Поскольку молекулы Лапрола стабилизируют золь по механизму
"истощения", они не препятствуют адсорбции I--анионов на поверхности
наночастиц. После осаждения большинства частиц серебра в виде крупных
агломератов, избыток йодида начинает заряжать поверхность оставшихся частиц
отрицательно, в результате чего частицы, оставшиеся в растворе, редиспергируют.
В то же время большая часть серебряных наночастиц подвергается необратимой
коагуляции, так как дальнейшее добавление раствора электролита не приводит к
росту оптической плотности.
Выводы
1. Получены устойчивые золи серебра в изопропаноле с
использованием в качестве стабилизатора простого полиэфира Лапрол-5003.
2. В результате исследования полученных золей
установлено, что используемый полиэфир стабилизирует наночастицы серебра по
механизму "стабилизации истощения" (depletion stabilization).
. Определена устойчивость полученных золей серебра в
изопропаноле к фотостимулированной и электролитической коагуляции.
Список
литературы
1. Сергеев
Г.Б. Нанохимия / Г.Б. Сергеев. - М.: КДУ, 2006. - 12 с.
2. Помогайло
А.Д. Полимер-иммобилизованные наноразмерные и кластерные частицы металлов /
А.Д. Помогайло // Успехи химии. - 1997. - № 8. - С.750-790.
. Помогайло
А.Д. Наночастицы металлов в полимерах / А.Д. Помогайло, А.С. Розенберг, И.Е.
Уфлянд. - М.: Химия, 2000. - 672 с.
. Магнитные
наночастицы: методы получения, строение и свойства / С.П. Губин и др. // Успехи
химии. - 2005. - №6. - С.539-574.
5. Cushing B. L. Recent advances in the liquid-phase
syntheses of inorganic nanoparticles / B. L. Cushing, V. L. Kolesnichenko, C.
J. O’Connor // Chem. Rev. - 2004. - V.104. - P.3893-3946.
. Masala O. Synthesis routes for large volumes of
nanoparticles / O. Masala, R. Seshardi // Annu. Rev. Mater. Res. - 2004. -
V.34. - P.41-81.
7. Ревина
А.А. Биоцидная активность наночастиц серебра в жидкой фазе и в составе
нанокомпозитов / А.А. Ревина // Известия Академии Промышленной Экологии. -
2006. - №3. - С.50-51.
8. The study of antimicrobial activity and preservative
effects of nanosilver ingredient / Kyung - Hwan Cho etc. // Electrochimica
Acta. - 2005. - V.51. - P.956-960.
. Facile synthesis of silver nanoparticles with higly
efficient antimicrobal property / S. Sarkar etc. // Polyhedron. - 2007. - V.26.
- P.4419 - 4426.
. Cushing B. L. Recent advances in the liquid-phase
syntheses of inorganic nanoparticles / B. L. Cushing, V. L. Kolesnichenko, C.
J. O’Connor // Chem. Rev. - 2004. - V.104. - P.3893-3946.
. Synthesis and study of silver nanoparticles/ S. D.
Solomon etc. // Journal of Chemical Education. - 2007. - V.84. - P.322-325.
12. Синтез
и свойства наночастиц серебра: достижения и перспективы / Ю.А. Крутяков и др.
// Успехи химии. - 2008. - №3. - С.242-269.
. Ершов
Б.Г. Ионы металлов в необычных и неустойчивых состояниях окисления в водных
растворах: получение и свойства / Б.Г. Ершов // Успехи химии. - 1997. - №2. -
С.103-116.
14. Xuan Li. Dissolution - accompanied aggregation kinetics of
silver nanoparticles / Xuan Li, Harold W. Walker // Langmuir. - 2010. - V.26. -
№ 22. - P.16690-16698.
15. Губин
С.П. Координационная химия наночастиц / С.П. Губин, Н.А. Катаева //
Координационная химия. - 2006. - Т.32. - № 12. - С.883-893.
16. Mayer A. B. Colloidal metal nanoparticles dispersed in
amphiphilic polymers / A. B. Mayer // Polym. Adv. Technol. - 2001. - № 12. -
P.96-106.
17. Металлополимерные
нанокомпозиты с контролируемой молекулярной архитектурой / А.Д. Помогайло //
Успехи химии. - 1999. - № 6. - С.64-72.
18. ТУ 2226-006-10488057.
19. С.С.
Гитис. Практикум по органической химии / С.С. Гитис, А.И. Глаз, А.В. Иванов. -
М.: Высшая школа, 1991. - 29-30 с.
. О
причинах фотостимулированной агрегации золей металлов / С.В. Карпов и др. //
Коллоидный журнал. - 2002. - Т.64. - № 4. - С.474-492.
. Экспериментальные
проявления взаимосвязи локальной структуры агрегатов наночастиц серебра и их
спектров поглощения / С.В. Карпов и др. // Коллоидный журнал. - 2007. - Т.69. -
№ 2. - С. 190-200.
22. Jenkins P. Depletion flocculation in colloidal dispersions
/ P. Jenkins, M. Snowden // Adv. Colloid Interface Sci. - 1996. - V.68. -
P.57-96.
. Huang Z. - Y. Spontaneous formation of silver particles
in basic 2-propanol / Z. - Y. Huang, G.mills, B. Hajek // J. Phys. Chem. -
1993. - V.97. - № 44. - P.11542-11550.