Получение наночастиц кобальта в водно-органических средах путем химического восстановления кобальта
Реферат
Поверхностно-активное вещество, прямые мицеллы,
критическая концентрация мицеллообразования, наночастицы кобальта, растровая
электронная и атомно-силовая микроскопия, метод Ленгмюра-Блоджетт.
Объектом исследования дипломной работы являются
мицеллярные микроэмульсии, содержащие наноразмерные частицы кобальта.
Целью данной работы явилось исследование
процесса формирования 2D - упорядоченных ансамблей наночастиц кобальта для
создания новых магнитных материалов.
В результате выполнения дипломной работы было
получено:
Реакцией нейтрализации анионный ПАВ - стеарат
натрия. Строение получившегося соединения было доказано с помощью ИК и ЯМР
спектроскопии, а также сравнением его Тпл. с табличными данными.
Методом кондуктометрии определена критическпя
концентрация мицеллообразования полученного АПАВ равная 0,0001М.
Методом синтеза в прямых мицеллах получены
наночастицы кобальта. Показано, что их размер зависит от мольного соотношения
АПАВ и Ме2+ в исходном мицеллярном растворе и варьируется от 50 до 150 нм.
Методом Ленгмюра-Блоджетт получены пленки ЛБ
наночастиц кобальта.
Методом атомно-силовой микроскопии (АСМ)
определена топология пленок ЛБ 2D - упорядоченных ансамблей наночастиц
кобальта. Показано, что размер наночастиц Со равен порядка 10-20 нм, равномерно
распределенных по площади подложки.
Введение
В развитии современных нанотехнологий
значительную роль играют исследования наночастиц металлов. Это обусловлено,
прежде всего, широким спектром возможностей их практического применения, в
которых используются специфические свойства как самих наночастиц, так и
модифицированных ими материалов. Наиболее разработаны, на сегодняшний день,
возможности использования наночастиц металлов при создании новых катализаторов
для различных промышленных процессов.
Здесь тесно сплетаются приемы с использованием
химических реакций, термодинамического и атомно-молекулярного подхода. Эти
системы подчиняются принципам самоорганизации и позволяют формировать
наноматериалы, которые используются в нанотехнологиях и наноустройствах [1].
На сегодняшний день наиболее актуальной
прикладной задачей физики, химии, материаловедения и других смежных областей
является получение новых 2D - упорядоченных магнитных материалов, которые могут
использоваться в разработке систем записи и хранении информации, новых
постоянных магнитах, в системах магнитного охлаждения, в качестве магнитных
сенсоров и т.п. Несмотря на достаточное количество методов получения магнитных
наночастиц и наноматериалов, в настоящее время, пожалуй, единственным методом
обеспечивающий строгую 2D - упорядоченность ферромагнитных наночастиц является
метод Ленгмюра - Блоджетт. Однако, данный подход в получении магнитных
материалов, исходя из литературных данных, практически не исследован.
Таким образом, целью работы явилось исследование
процесса формирования 2D - упорядоченных ансамблей наночастиц кобальта для
создания новых магнитных материалов.
В связи с указанной целью решались следующие
задачи:
. Получение анионного поверхностно-активного
вещества (АПАВ)
. Определение критической концентрации
мицеллообразования (ККМ), полученного АПАВ
. Получение мицеллярных растворов с различным
молярным соотношением АПАВ/ Со2+ и исследование влияния этого соотношения на
размер наночастиц кобальта
. Формирование 2D - упорядоченных пленок наночастиц
кобальта
1. Литературный обзор
.1 Магнитные наночастицы металлов
.1.1 Влияние размера частиц
ферромагнитных металлов на магнитные свойства
Особенности магнитного упорядочения, магнитные
свойства вещества, его поведение во внешних магнитных полях существенно зависят
от размеров частиц, толщины слоев и других геометрических характеристик
объекта. Изменяя строение, состав, форму и размер наночастиц, можно в
определенных пределах управлять магнитными характеристиками материалов на их
основе. Однако контролировать все эти факторы при синтезе примерно одинаковых
по химическому составу и размерам наночастиц удается далеко не всегда, поэтому
свойства однотипных наноматериалов могут сильно различаться [2].
Главным признаком и условием сильного
магнетизма, является самопроизвольное магнитоупорядоченное состояние. Оно
возможно благодаря квантовому обменному взаимодействию, выстраивающему
магнитные моменты атомов переходных металлов параллельно (ферромагнетики) при
температуре ниже точки Кюри [3]. По мере роста числа атомов, охваченных
упорядочением, увеличивается и магнитная энергия частицы (пропорционально ее
объему). При увеличении размера частицы до некоторого критического Rcm
однородное намагниченное состояние становится энергетически менее выгодным, чем
многодоменное. Образование доменов - областей, в которых векторы
намагниченности направлены противоположно друг другу, приводит к понижению
суммарной магнитной энергии частицы.
Критический размер Rcm определяется конкуренцией
между магнитной энергией WM, пропорциональной R3, и энергией доменных стенок
Wd, растущей как R2. Для реальных магнитных материалов значение Rcm заключено в
интервале между 10 нм и десятками микрометров. То есть в этом диапазоне
магнитные свойства и поведение материала будут сильно отличаться от
макроскопического случая.
Одним из свойств наночастиц является
суперпарамагнетизм. Чем больше магнитный момент частицы, тем меньшее магнитное
поле Hs требуется для наблюдения явления насыщения намагниченности.
Эффект суперпарамагнетизма заключается в том,
что под действием тепловых колебаний вектор самопроизвольного намагничивания
начинает хаотически флуктуировать.
Наложение внешнего поля на суперпарамагнетики
приводит к насыщению макронамагниченности в невысоких полях (~0,01 ... 0,1Тл),
поскольку магнитные моменты отдельных частиц превышают атомные в сотни - тысячи
раз. В этом состоянии флуктуации магнитных моментов практически подавлены
внешним магнитным полем.
При большем уменьшении размеров наночастиц
самопроизвольное упорядочение становится невозможным в силу квантовой природы
магнетизма и действия принципа неопределенности. Значительное изменение
магнитных свойств вызывает уменьшение размеров структурных единиц и в
классических ферромагнетиках. В макроскопических образцах обменное взаимодействие
приводит к образованию доменной структуры при температурах ниже точки Кюри.
Суммарные магнитные моменты соседних доменов направлены противоположно, что
уменьшает магнитную энергию кристалла [4].
Увеличение магнитного момента на атом для
проводящих 3d- ферромагнетиков (в том числе для кобальта) может быть
обусловлено уменьшением координационного числа атома или увеличением межатомных
расстояний. Чем меньше энергия межатомных связей, тем меньше ширина зон, тем
больше магнитный момент на атом. Такие условия могут реализовываться на
поверхности металлических наночастиц кобальта, способствуют относительному
увеличению их магнитного момента [5].
Свойства наночастиц во многом определяются тем,
в каких условиях находятся поверхностные атомы. Даже в идеальном случае, когда
химический состав поверхности и внутренних слоев частицы одинаков,
поверхностные атомы все равно имеют меньшее координационное число, искаженную
локальную симметрию и межатомные расстояния. Часто наночастица имеет строение
типа "ядро-оболочка". При этом для наночастиц кобальта ферромагнитное
ядро частицы всегда окружено оболочкой с иными магнитными характеристиками:
антиферромагнитными, парамагнитными или диамагнитными в зависимости от природы
взаимодействия поверхностных атомов с "внешней средой". Исходя из
постулата о том, что для наночастиц не может быть инертной среды, можно
полагать, что наблюдаемые магнитные характеристики материалов, содержащих
наночастицы, зависят от свойств, как ядра частицы, так и ее оболочки, а также
их взаимодействия [6].
Анализ литературных данных показал, что для
создания качественных магнитных материалов на основе НРЧ металлов и их
соединений необходимо стабилизировать и экранировать их от воздействия
окружающей среды. Для стабилизации НРЧ можно использовать как неорганические
матрицы (керамика, оксид алюминия и др.), так и разнообразные органические
соединения, в том числе и полимерные матрицы. Использование полимерных матриц в
качестве стабилизаторов позволяет получать различные материалы, обладающие,
помимо свойств, содержащихся в них наноструктур, специфическими свойствами
полимеров (низкая электропроводность, химическая энертность, оптическая
прозрачность, легкость, простота обработки и т.д.). Это и делает такие
материалы перспективными для использования [7].
1.1.2 Методы исследования магнитных
свойств тонкопленочных магнитных материалов
Магнитные свойства тонкопленочных магнитных
материалов могут быть исследованы с помощью средств магнитной
радиоспектроскопии. Для выявления магнитных свойств кобальт содержащих материалов
наиболее подходящими являются методы: Ферромагнитного резонанса в ЭПР
спектрометре и методики измерения магнитных свойств с помощью магнитометра.
Ферромагнитный резонанс, одна из разновидностей
электронного магнитного резонанса; проявляется в избирательном поглощении
ферромагнетиком энергии электромагнитного поля при частотах, совпадающих с
собственными частотами прецессии магнитных моментов электронной системы
ферромагнитного образца во внутреннем эффективном магнитном поле [8].
Магнитометр - прибор для измерения характеристик
магнитного поля
<#"584818.files/image001.jpg">
Здесь R - углеводородный радикал, обычно С9 -
C19; O+ - основная группа; К- кислотная группа.
В изоэлектрической точке заряды равны, и
молекула АмПАВ представляет собой цвиттерион. Кислотные и основные константы
ионизации истинных АмПАВ весьма низкие и не сильно отличаются. Это сравнительно
редкие вещества. Катионной группой в них как правило служат первичная,
вторичная или третичная аминогруппы, пиридиновая или имидазолиновые группы.
Принципиально вместо азота могут быть сера, фосфор, мышьяк и т.д. В качестве
анионных групп применяют карбоксильную, сульфонатную, сульфоэфирную и фосфатные
группы.
По химическому строению и по некоторому сходству
в поведении АмПАВ можно разделить на пять основных групп:
. Алкиламинокарбоновые кислоты (ААКК)
RNH(CH2)nCOOH, алкиламинофенилкарбоновые кислоты RNHC6H4COOH; ААКК с первичной,
вторичной и третичной аминогруппами - RCH(NH2)COOH, RCH(NHR')COOH,
RN(СН3)-СН2СООН; ААКК с промежуточной гидроксильной группой, с эфирной,
сложноэфирной, амидной, сульфоамидной группами; ААКК с двумя и более амино- и
аминодогруппами; ААКК с несколькими аминными и гидроксильными группами.
. Алкилбетаины (АБ).
. Производные алкилимидазолинов.
. Алкиламиноалкансульфонаты, -сульфаты.
. Полимерные амфолитные ПАВ (ПАмПАВ).
Неионогенные ПАВ
Неионогенные ПАВ (НПАВ) имеют общую формулу:
R-X(CH2CH2)mH, где R-алкил, обычно С8; Х может быть атомом кислорода, азота,
серы или функциональной группой -СОО-, -CONH, -С6Н4O-; m - среднее число
оксиэтильных групп.
НПАВ - соединения, растворимые как в кислой, так
и в щелочной среде, не диссоциирующие в воде [11].
Мицеллы и мицеллообразование
Наличие ковалентно связанных фрагментов в молекуле
ПАВ (углеродного радикала и полярной группы) предопределяет их специфические
свойства. Так, молекулы ПАВ могут находиться и в полярной и неполярной среде. В
обоих случаях для некоторого фрагмента молекулы энергетически не выгодно
находится в объеме фазы. В то же время фазовое равновесие невозможно, т.к.
гидрофильный и гидрофобный фрагменты связаны ковалентно. В результате такого
противоречия молекулы ПАВ стремятся переместиться из объема раствора на
поверхность (адсорбция) или наблюдаются процессы самоорганизации - образование
мицелл, состоящих из нескольких десятков или даже сотен молекул ПАВ. Данные
процессы отражает кривая σ(с) (рис. 1)
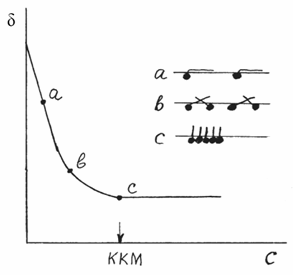
Рисунок 1 - Изотерма поверхностного натяжения
коллоидного (мицеллообразующего) ПАВ и схема уплотнения адсорбционного слоя при
увеличении его концентрации
На участке кривой до точки с снижение σ
свидетельствует
о самопроизвольном переходе молекул ПАВ на поверхность раздела, их
концентрировании на границе раздела фаз и образовании адсорбционного слоя,
ориентированного углеводородными радикалами в неполярную фазу. При этом
снижается запас свободной энергии (в форме свободной поверхностной энергии). С
повышением концентрации ПАВ и увеличением адсорбции происходит уплотнение
адсорбционного слоя (точки а, b). В точке с возможность снижения свободной
энергии путем адсорбции исчерпывается, т.к. достигается предельная адсорбция с
максимально плотной упаковкой адсорбционного слоя. При дальнейшем повышении
концентрации ПАВ молекулы спонтанно образуют ассоциаты - мицеллы. При этом, как
и в случае адсорбции, углеводородные радикалы переходят из воды в неполярную
фазу - углеводородное ядро мицелл. Происходит фазовое разделение раствора на
микроуровне или самоорганизация молекул (ионов) ПАВ с образованием
наноразмерной псевдофазы. Этот процесс имеет коллективный (кооперативный)
характер, т.е. мицелла образуется не путем постепенного прибавления отдельный
мономерных молекул к растущему агрегату, а путем одновременного объединения
многих молекул в крупный агрегат, равновесный с молекулярным раствором.
При небольших концентрациях ПАВ образуют
истинные растворы, состоящие из отдельных молекул или ионов. При повышении
некоторой, специфичной для каждого ПАВ концентрации, называемой критической
концентрацией мицеллообразования (ККМ), происходит самоассоциация ПАВ в
растворе и образование мицелл. Значение ККМ для большинства ионогенных ПАВ
лежат в области 0,1 - 20 ммоль/л [12].
Термодинамической движущей силой
мицеллообразования в водных растворах являются гидрофобные взаимодействия:
углеводородная часть амфифильной молекулы выталкивается из водной среды, дабы
избежать контакта цепи с водой. В результате данного процесса образуются так
называемые прямые мицеллы, ядро которых состоит из плотно упакованных углеводородных
цепей, а оболочка - из полярных групп.
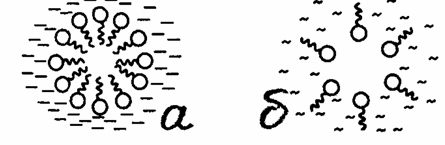
Рисунок 2 - Схематическое изображение мицеллы
ПАВ (а) в воде и (б) в неполярной среде
Мицеллы, образующиеся в неполярной среде,
называются обратными. Их ядра формируются полярными группами, а оболочки -
углеводородными цепями. В отличие от водных сред, где мицеллообразование
обусловлено энтропийным фактором (энтропия системы увеличивается, вследствии
включения в тепловое движение тех молекул воды, которые прежде
взаимодействовали с углеводородными цепями), для обратных мицелл главное
значение имеет изменение энтальпии при замене связи «полярная группа -
углеводород» на связь между полярными группами при их обьединении в ядро
мицеллы. Энергетический выигрыш при объединении полярных групп в ядро настолько
существенен, что и при самых малых концентрациях ПАВ может находиться не в виде
отдельных молекул, а виде небольших предмицеллярных агрегатов.
В зависимости от концентрации ПАВ в области выше
ККМ в объеме водного раствора могут происходить структурные превращения
агрегатов мицелл (т.н. полиморфизм мицелл). В зависимости от строения молекул
ПАВ и физико - химических условий (температура, pH, концентрация электролитов и
других добавок) возникают различные структуры. Вблизи ККМ и в достаточно
широком интервале концентраций выше ККМ форма мицелл близка к сферической (т.н.
мицеллы Гартли). При дальнейшем увеличении концентрации ПАВ форма мицелл
изменяется на цилиндрическую, образующие гексагональную упаковку. Кроме того
могут образовываться пластинчатые (ламеллярные) мицеллы, разделенные тонкими
пленками воды. Такие мицеллы называют мицеллы Мак - Бена.
Если концентрация ПАВ возрастает еще больше, то
в объеме раствора могут возникнуть многослойные концентрические структуры с
замкнутыми поверхностями, т.н. мультиллаилярные липосомы. При еще большем
увеличении концентрации ПАВ (обычно, больше 50 %) в объеме раствора могут
возникать цилиндрические мицеллы. Испаряя воду можно перейти к гексагональному
жидкому кристаллу, т.н. промежуточной фазе, которая затем превращается в
вязкотропную фазу, в которой мицеллы образуют гранецентрическую кубическую
упаковку. И, наконец, при еще большем увеличении концентрации ПАВ образуется
жидкокристаллическая ламеллярная фаза, содержащая 5 - 20% воды. При понижении
содержания воды до 5% возникает фаза геля [12].

Рисунок 3 - Структурные превращения молекул ПАВ
в водном растворе
1.3 Физико-химические свойства
мицелярных растворов
При образовании мицелл в объеме раствора в узкой
области концентраций вблизи ККМ резко изменяются физико-химические свойства
раствора, что используют для экспериментального определения ККМ. Так, если ПАВ
ионное, то по достижению ККМ резко уменьшается эквивалентная электропроводность
его водного раствора, т.к. подвижность, образовавшихся мицелл при этом
значительно меньше, чем отдельных ионов. Характерным и универсальным признаком
мицеллообразования является резкое увеличение интенсивности рассеивания света,
связанное с тем, что мицеллы намного интенсивнее рассеивают свет, чем
индивидуальные ионы. Значительное уменьшение поверхностного натяжения растворов
ПАВ при концентрациях меньше ККМ обусловлено адсорбцией молекул ПАВ на
поверхности раздела жидкость - газ. При достижении ККМ ионы ПАВ агрегируются в
мицеллы. Дальнейшее увеличение концентрации ПАВ в растворе приводит к
увеличению числа мицелл, в то время как концентрация отдельных ионов остается
практически постоянной. Поэтому после ККМ поверхностное натяжение раствора ПАВ
не меняется [13].
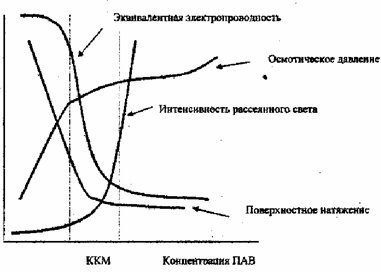
Рисунок 4 - Изменение физико-химических свойств
раствора ПАВ вблизи ККМ
1.4 Формирование наночастиц в
мицелярных системах
Проведение химических реакций с участием прямых
и обратных мицелл активно применяется для синтеза коллоидных кластеров с
высокой величиной монодисперсности в диапазоне размеров 1÷10
нм.
Благодаря броуновскому движению обратные мицеллы
часто сталкиваются и коалесцируют, формируя при этом димеры, которые в свою
очередь снова разделяются на отдельные мицеллы. Т.о. мицеллы могут обмениваться
содержанием водных пулов. Данный процесс является основополагающим при синтезе
неорганических частиц внутри ОМ, т.к. позволяет вступать в реакцию веществам,
локализованным в различных мицелярных растворах при их смешении. Мицеллы в
таких системах часто называют «нанореактороми» в которых создается подходящее
окружение для контролируемой нуклеации и роста частиц. С этой целью смешиваются
две идентичные обратные микроэмульсионные системы, водные фазы которых
содержат, например, вещества А и В, образующие в ходе химической реакции
труднорастворимое соединение С. При коалесценции мицелл в них в результате
обмена веществ образуется новое соединение С (рис. 5).
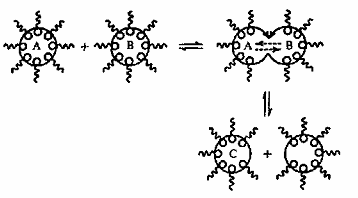
В качестве вещества А, как правило, используют
соль металла, вещества В - восстановитель (боргидрид натрия либо гидразин).
Процесс проводят в условиях продувки системы инертным газом, СО2, H2S. Так были
получены кластеры Pt, Pd, Rh, Ir с размером частиц 3÷5
нм,
а также биметаллические кластеры Pt и Pd. С помощью синтеза нанокластеров в
обратных мицеллах были получены кластеры металлов, полупроводников, например
CdS, CdSe, CdTe, SnO2, TiО2, Fe2O3, MoS2 ,HgS, InAs, GaP, GaAs, Bil3 и др.,
SiO2, высокотемпературной керамики и т.д. Для получения широко применяемых
кластеров Ag2S используют микроэмульсии , содержащие два типа обратных мицелл
Na2S и Ag-ПАВ. В результате столкновения, коалесценции и обмена содержимым
водной фазы происходит реакция образования кластеров Ag2S.
Для освобождения нанокластеров из мицеллы ее
разрушают тиолами, растворяют образовавшиеся кластеры в подходящих
растворителях, например бинзоле, фильтруют раствор и затем выпаривают. Таким
путем можно получить нанокластеры с хорошей монодисперстностью до размеров 10
нм, пассивированные тиолами, например додекатиолом. Из этих кластеров затем с
помощью высаживания на подложках формируют упорядоченные наноструктуры -
коллоидные кристаллы. Подобные двумерные и трехмерные коллоидные кристаллы
наблюдались для металлических кластеров Ag, Co, Au, оксидных и халькогенидных
кластеров металлов. В качестве пассиваторов поверхности нанокластеров
используются алкантиолы, алкилфосфины и дитиолы.
На рисунке 6 приведены снимки с помощью
электронного микроскопа большого количества наночастиц меди с низкой
полидисперсностью, которые формируют несколько слоев [9].

Рисунок 6 - Электронные снимки наночастиц Cu с
разрешением 21 нм
Двумерные наностуктуры представляют собой
плотноупакованные монослои, а трехмерные структуры характеризуются
гранецентрированной кубической решеткой (ГЦК). Как уже отмечалось, такая
методика получения коллоидных кристаллов позволяет варьировать размеры исходных
кластеров. На рисунке 7 проставлены три снимка электронной микроскопии для
наноструктуры Ag2S с размерами 3,0 (A,B), 4,0 (C,D) и 5,8 нм (E,F).

Рисунок 7 - Электронные изображения
нанокристаллов на основе Ag2S с размерами 3,0 (A,B), 4,0 (C,D) и 5,8 нм (E,F)
Несмотря на различие во внешней форме коллоидных
кристаллов (рис. 7 A, D, F), их организация одинакова и соответствует структуре
ГЦК. Формирование таких кластерных кристаллов происходит, по-видимому, под
действием слабых ван-дер-ваальсовых взаимодействий.
Для молекулярных гигантских кластеров Pd также
получаются молекулярные кристаллы, кластеры которых намного труднее разглядеть
в микроскоп из за меньшего размера, но монокристаллы которых могут быть
охарактеризованы рентгеноструктурным анализом и исследованы макроскопическими
методами измерения теплоемкости и намагниченности. Здесь молекулярный кристалл
также образуется под действием сил Ван-дер-Ваальса. Это наличие слабых
формирующих взаимодействий является, видимо, необходимым условием для
формирования упорядоченных наноструктур. Вторым важным условием организации
упорядоченных кластерных кристаллов является, безусловно, требование
монодисперсности кластеров. Поскольку коллоидные кластеры выступают в роли
основных элементов в наноэлектронике, нанооптике и получении наномагнитов,
важным условием выступает прочность и стабильность таких структур. В этом
смысле были бы более предпочтительны ковалентные связи и ковалентные кристаллы.
Однако получить такие кристаллы методами, которые применяются при
кристаллизации коллоидных нанокристаллов, путем нанесения на подложку с
последующим выпариванием, не удается [14].
Двумерные наностуктуры представляют собой
плотноупакованные монослои, а трехмерные структуры характеризуются
гранецентрированной кубической решеткой (ГЦК). Как уже отмечалось, такая методика
получения коллоидных кристаллов позволяет варьировать размеры исходных
кластеров. На рисунке 7 проставлены три снимка электронной микроскопии для
наноструктуры Ag2S с размерами 3,0 (A,B), 4,0 (C,D) и 5,8 нм (E,F).
1.5 Факторы, влияющие на образование
и размер наночастиц в обратных мицеллах
Для целей прогнозирования размера наночастиц,
получаемых в обратных мицеллах необходим поиск взаимосвязи между соотношением
объема водной фазы и ПАВ в наносистеме (W - [H2O]/ПАВ), выявление роли
солюбилизированной водной фазы, межмицеллярного потенциала, добавления
небольшого количества положительно заряженных ПАВ в обратных мицеллах АОТ,
динамики образования микроэмульсий «вода-в-масле».
1.5.1 Соотношение объема водной фазы
и ПАВ
Синтез проводится с различным объемом воды с
образованием наночастицы различных размеров. В качестве примера, на рисунке 8
показано увеличение размеров частиц металлической меди (Cu0)n, с увеличением
объема воды. Объем воды (W = [H2O] / [AOT]), размер частиц кардинально не
меняется и увеличение полидисперсности не наблюдается. Для сравнения полученных
данных из различных материалов, синтез был проведен в тех же экспериментальных
условиях (т.е. те же реагенты и концентрации поверхностно-активных веществ).
Изучены различные материалы и сплавы, CdS [15,16,17], CdyZn1-yS [18], ZnS,
CdyMn1-yS [19] и PbS, для (Ag0)n [20], (Cu0)n [15,21] и Co2B. Тем не менее,
следует отметить, что увеличение размера частиц зависит от используемого
материала. В полупроводниках, размер варьируется от 1 до 4 нм, тогда как с
частицами серебра он колеблется от 1 до 7нм и частицы металлической меди
варьируются от 1 до 12 нм.
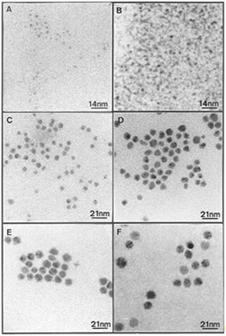
Рисунок 8 - ТЕМ (просвечивающая электронная
микроскопия) моделей медных металлических частиц, полученных в обратных
мицеллах с различным объемом воды: [AOT] = 0.1 M; [Cu(AOT)2] = 10-2 M; [N2H4] =
2 ×
10-2 M; (A) W = 1; (B) W = 3; (C) W = 4; (D) W = 5; (E) W =
10; (F) W = 20
Увеличение размера частиц с увеличением объема
воды может быть отнесено к структурной воде в водном пуле. При малом объеме
воды, количество воды в молекуле поверхностно-активных вещества слишком мало
для гидратации противоионов и главных полярных групп. Это вызывает сильное
взаимодействие между молекулами воды и главными полярными группами. Молекулы
воды можно рассматривать как «связанные». Постепенное увеличение объема воды
вызывает внутри капли, прогрессивный переход от «связанной» к «свободной» воде
в водном пуле. Объемная фаза воды достигает при объеме воды, W = [H2O] / [AOT],
около 10-15.
Для каждого изученного материала, мы
нормализовали крупнейший размер частицы до 1 и, следовательно, получили
относительное изменение размера частиц от объема воды. Пример корреляции между
размерами частиц и объемом воды показано на рисунке 9. В большинстве случаев,
размер частиц возрастает с увеличением объема воды и достигает плато при W =
15. При W = 10-15, полидисперсность размера довольно низка (менее 10%). При
более высоком объеме воды, средний размер частиц заметно не меняется и
увеличение полидисперсности не наблюдается. С частицами меди, при W ≥ 15,
наблюдается образование оксида меди (Cu2O)n, а не металла (Cu0)n. Это означает,
что «свободные» молекулы воды в пуле являются очень эффективными окислителями
для наноразмерных частиц. Кроме того, он подтверждает, что граница раздела фаз
играет важную роль (окислительно-восстановительный потенциал, степень ионизации
и т.д.) в зарождении и росте частиц.
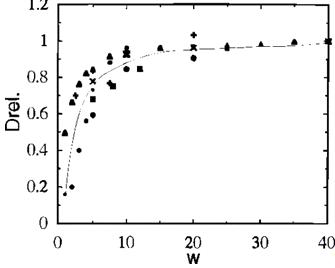
Рисунок 9 - Изменение относительного диаметра
частиц Dm от объема воды. Частицы CdS ( ), PbS (▪),
CdyZn1-yS (·), CdyMn1-yS (+), ZnS (×), (Cu0)n (
), PbS (▪),
CdyZn1-yS (·), CdyMn1-yS (+), ZnS (×), (Cu0)n ( )
и (Ag0)n (твердый восьмиугольник)
)
и (Ag0)n (твердый восьмиугольник)
1.5.2 Выявление роли
солюбилизированной водной фазы
Чтобы продемонстрировать, что размер частиц
связан с физическими свойствами структуры воды, мы используем результаты FTIR
(инфракрасное преобразование Фурье), SAXS (малый угол рассеяния рентгеновских
лучей), а эксперименты импульсного радиолиза выполнены в том же растворе
(Na(АОТ) - изооктан - вода) [22]:
. спектры FTIR обратных мицелл АОТ учитываются
по различным объемам воды. Доли «связанной» и «свободной» воды были оценены без
молекулы воды ОН группы. Кроме того, спектр поглощения двух карбоксильных групп
АОТ изменяется в зависимости от объема воды. Области спектра, полученные при
высоком объеме воды, нормированы на единицу. Изменения карбоксильной группы,
указывают на поведение, аналогичное, как и в зависимости диаметра частицы от
объема воды.
. Размер капель определяется с помощью SASX.
Предполагая, что капля имеет сферическую форму, молекулы поверхностно-активных
веществ на границе раздела фаз и объем молекул воды регулирует размер капель,
видимый объем молекулы воды выводится. Изменение видимого объема воды с
увеличением объема воды находится в хорошем взаимодействии с прямыми
экспериментами. При значение W ≤ 15, молекула воды относительно
кажущегося объема возрастает с увеличением объема воды, и она достигает плато
выше этого значения.
. Гидратированные электроны могут образовываться
в водном пуле методом импульсного радиолиза, а их выработка растет с
увеличением объема воды, достигая плато при W = 15. Аналогичным образом жизнь
гидратированных электронов резко уменьшается с увеличением объема воды и
достигает плато при том же значении W (W = 15) [23,24].
Эти три методы показывают на резкое изменение
физических параметров молекул воды с изменением объема воды.
Подобное поведение таких различных относительных
параметров относительно распределения наноразмеров частиц, для видимого объема
воды, области ОН группы, гидратированный выход электрона, и кинетика позволяет
сделать вывод, что структура воды в водном пуле, играет важную роль в контроле
размера частицы.
.5.3 Межмицеллярный потенциал
В обратных мицеллах, межмицеллярный процесс обмена
регулируется (1) образовавшимися димерами, связавшись с двумя мицеллами и (2)
процессом обмена между двумя каплями в водном пуле. Первый фактор связан с
привлекательным взаимодействием между каплями и включает в себя вероятности
столкновения двух мицелл. Межмицеллярный потенциал снижается либо за счет
уменьшения числа атомов углерода в объеме растворителя, либо за счет увеличения
числа капель [25]. Последнее связано с дискретным характером молекул
растворителя и объясняется появлением слабых сил между двумя мицеллами [26].
Второй фактор связан с границей раздела фаз жесткости и с динамическими
свойствами воды на поверхности «вода-в-масле» [27]. Это соответствует
коэффициенту упругого изгиба границы раздела фаз. Контроль этих параметров
позволяет межмицеллярному процессу изменяться [28]. В (АОТ - вода - изооктан)
мицеллярного раствора, замена изооктана на циклогексан вызывает снижение
межмицеллярной константы скорости на порядок. Кроме того, увеличение числа
капель вызывает снижение межмицеллярной константы скорости [29].
Наночастицы синтезированы путем изменения
межмицеллярного потенциала. Это достигается путем изменения либо основного
растворителя, либо количества капель (т.е. полярная объемная доля). Следующие
данные показывают, что размер частиц управляется межмицеллярным потенциалом:
. Влияние массы растворителя на размер частиц.
Смешивание с тетраборогидратом натрия (Ag(АОТ) - Na(АОТ) - вода - изооктан)
индуцирует образование частиц серебра (Ag0)n [20]. Это происходит в течение
нескольких минут, в присутствии воздуха. Как описано выше, размер частиц
зависит от объема воды: при W = 7,5, средний размер частиц составляет 4,9 нм,
спектр поглощения характеризуется пиком плазмонов с центром в точке 420 нм
(вставка на рис 10). Замена изооктана на циклогексан и поддержание тех же
экспериментальных условий, как описано выше (W = 7.5 [Ag(AOT] =
3 × 10-2 M, [Na(AOT)] = 7 × 10-2 M, [NaBH4] = 2.5 × 10-4 M), вызывает
заметное изменение по сравнению с тем, что показано на вставке рисунка 10.
Спектр поглощения наблюдается сразу же после добавления восстановителя. Этот
спектр, который характеризуется максимумом в центре точки 275 нм (рис. 3),
связан с кластерами Ag42+ [30]. Со временем, размер кластеров увеличивается до
достижения частиц со средним диаметром 3,3 нм. Таким образом, Ag42+
стабилизируется в течение нескольких часов в обратных мицеллах. Обычно такие
кластеры не стабильны, при комнатной температуре, за исключением, когда они
образуются на стекле или в серебряных пленках, полученных при сокращении
поверхности монослоев [31].
В случае CdS полупроводниковых и металлических
частиц меди (Cu0)n, кинетика образования частиц уменьшается по сравнению с тем,
что наблюдается при помощи изооктана как основного растворителя. Тем не менее,
не удалось определить кластеры из нескольких атомов, как это наблюдается с
серебром.
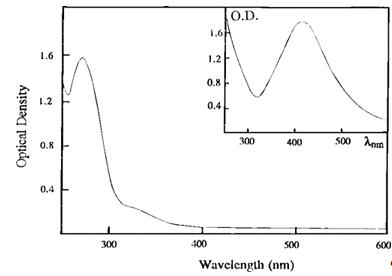
Рисунок 10 - Спектр поглощения Ag42+ получают
восстановлением 3 × 10-2 M Ag(AOT) - 7 ×
10-2 Na(AOT) - циклогексан
На вставке: спектр поглощения 4.9 нм (Ag)n
частиц, полученных от сокращения 3 × 10-2 M
Ag(AOT)−7
× 10-2 Na(AOT) - изооктан. Содержание воды
фиксировано, W = 7.5, и [NaBH4] = 10-4 M. Эти спектры получаются при синтезе,
осуществляемом в присутствии воздуха
В данном объеме воды, полученный размер частиц
меньше, когда основная фаза циклогексан, а не изооктан (рис. 11). Уменьшение
размера частиц этой заменой объясняется обменными процессами, которые вызывают
снижение темпа роста частиц. Это свидетельствует о поверхностно-активных
веществах, выступающих в качестве реагента, который защищает частицы от роста.
С другой стороны, увеличение в растворителе алкильных цепей вызывает увеличение
размера частиц.
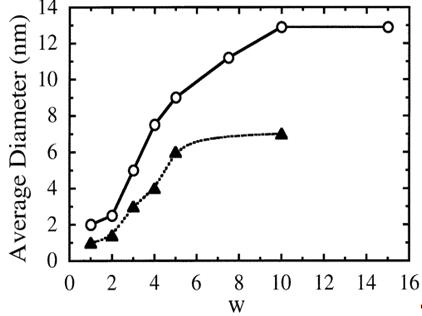
Рисунок 11 - Изменение диаметра частиц меди,
синтезированных в (Cu(AOT)2 - NaAOT - вода - растворитель) обратных мицеллах с
различным объемом воды: [AOT] = 0.1 M; [Cu(AOT)2] = 10-2 M; [N2H4] = 3 ×
10-2 M,
с помощью изооктана (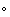 ) и циклогексана (
) и циклогексана ( ), как
основных растворителей
), как
основных растворителей
. Изменение количества капель, поддержание
постоянного мицеллярного диаметра.
Частицы металлической меди были синтезированы с
фиксированным объемом воды и различным числом капель. Уменьшение размера частиц
наблюдается с увеличением числа капель [21].
Таким образом, снижение межмицеллярного
потенциала, либо изменяет объем растворителя, либо увеличивает число капель,
что вызывает уменьшение среднего размера частиц. Такое поведение наблюдается
для наночастиц CdS, CdyZn1-yS, ZnS, и PbS и для (Ag0)n и (Cu0)n. Однако, это не
так для частиц сульфида серебра (см. ниже). Это означает, что межмицеллярный
потенциал является одним из самых важных параметров для контроля размера.
1.5.4 Влияние на размер частиц
добавление небольшого количества положительно заряженных ПАВ в обратных
мицеллах АОТ
Добавление 4 × 10-4 М
хлорида цетилтриметиламмония (CTAC) к 0,1 М AOT обратных мицелл, содержащие
Cu(AOT)2, не меняет средний размер мицеллы. Тем не менее, он вызывает большие
изменения размера в медных металлических частицах, формирование частиц со
средним размером же, полученные без CTAC при низком содержании воды, показаны
на рисунке 5. При увеличении объема воды, значительно увеличивается размер
частиц по сравнению с тем, что получается без CTAC (рис. 12) [32]. Максимальный
диаметр частиц аналогичен полученным, в отсутствие СТАС, и образование
наночастиц заметно увеличивается в присутствии CTAC. Случайное распределение
CTAC в мицеллах не может быть получено из этих данных. Предполагая
распределение Пуассона следует, что одна из десяти обратных мицелл АОТ содержит
молекулу CTAC. Таким образом, трудно предположить, что такая низкая
концентрация CTAC вызывает большое изменение размера частиц. Для объяснения
этих данных, мы предполагаем, совместные солюбилизации CTAC в мицеллы. То есть,
молекулы CTAC растворяются в одной данной капле, и не случайно. Таким образом,
несколько капель будет содержать все молекулы CTAC, а наибольшее количество
капель будут пустыми. Это может повлечь изменения в составе при изменении
окислительно-восстановительного потенциала, в результате чего произойдет
увеличение числа ядер, а затем увеличение размера частицы.
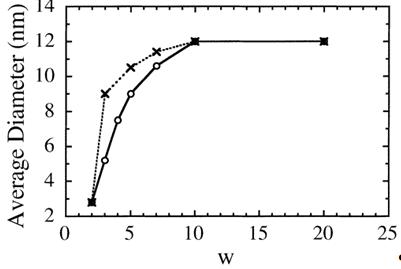
Рисунок 12 - Изменение диаметра частиц меди,
синтезированных в (10-2 M Cu(AOT)2 − 8 ×
10-2 M NaAOT - вода - изооктана) обратных мицеллах водного раствора, в
отсутствии ( ) и в присутствии 4
×
10-4
M CTAC (- - -)
) и в присутствии 4
×
10-4
M CTAC (- - -)
Синтез CdS в присутствии небольшого количества
CTAC вызывает большие изменения в размере частицы [33]. Тем не менее, этот
размер зависит от способа синтеза: смешивание CTAC в мицеллах, содержащих
мицеллы Cd(AOT)2 с содержанием сульфида натрия, S2-, индуцирует образование
частиц меньшего размера. В то время, когда CTAC растворяется в мицеллах содержащих
S2-, получаются крупные частицы.
Эти данные показывают, насколько точно размером
частиц можно управлять. Добавление небольшого количества CTAC вызывает большое
возмущение в получении и размере частиц.
1.5.5 Контроль размеров частиц с
помощью микроэмульсий «вода-в-масле»
Поверхностно-активные вещества с положительной
кривизной, выше определенной концентрации, как правило, называют критической
мицеллярной концентрации (ККМ), могут самостоятельно собираться в агрегаты для
формирования микроэмульсий «вода-в-масле», называются нормальными мицеллами.
Наиболее часто используется ПАВ додецилсульфата натрия (Na(DS)), для того,
чтобы частицы противоиона ПАВ заменяли ионы, участвующие в химической реакции.
Они называются функциональными поверхностно-активными веществами. Таким
образом, используются металлические частицы меди [34], додецилсульфат меди
(Cu(DS)2). В случае с магнитными жидкостями [35], не требуется смешивание
мицелл с додецилсульфатом железа и кобальта ((Fe(DS)2 и Co(DS)2). Критические
мицеллярные концентрации Cu(DS)2, Fe(DS)2, и Co(DS)2 1.3 ×
10-3, 1.42 × 10-3, и 1.2 × 10-3 М
соответственно.
Магнитные жидкости наноразмерных частиц феррита
кобальта.
В этом разделе мы покажем, использование
микроэмульсий «вода-в-масле», образование феррита кобальта в магнитной жидкости
и, как изменяется размер по сравнению с водным раствором. Синтез частиц CoFe2O4
был широко изучен в гомогенных растворах [36]. Процедура заключается в
следующем: очень высокие (> 2 М) концентрациии Fe (II), Fe (III) и Co (II) солей
растворяются в водном растворе. Добавляют основу, и раствор нагревают в течение
1 ч при 100 °C. Осадок, который появляется, промывают, и магнитные частицы
рассеиваются в водном растворе. Это магнитная жидкость. Синтез феррита кобальта
наноразмерных частиц в специальных экспериментальных условиях: низкая
концентрация реагентов, отсутствие ионов Fe (III), и комнатная температура.
Размер частиц находится под контролем радикальных изменений в рН, ионной силе и
добавлении полимеров или ПАВ. Эти химические изменения сильно возмущают
поверхность частиц (при адсорбции макромолекул или гидроксидов и т.д.). Это
вызывает большие изменения магнитных свойств частиц. Поэтому довольно трудно
получить последовательную связь между размерами частиц и магнитными свойствами.
При использовании микроэмульсий «вода-в-масле»
для функционализированных поверхностно-активных веществ, концентрация реагентов
ниже, чем обычно используется (почти на два порядка). При комнатной
температуре, добавление основных смешанных мицелл Co(DS)2 и Fe(DS)2 вызывает
образование осадка стехиометрических наночастиц CoFe2O4 [37,38]. Образуется
магнитная жидкость, смывая этот осадок. Его характеристика указывает на
образование CoFe2O4 с обратной структурой шпинели, как и в объемной фазе. В
начальной точке, эта реакция не требует ионов Fe (III). Таким образом, в
мицеллах, синтез осуществляется в Co(DS)2 и Fe(DS)2 при концентрациях в
диапазоне 10-3 M, тогда как в водном растворе, реакция не происходит при таких
низких концентрациях. Это может быть связано с тем, что формирование мицелл
вызывает высокую локальную концентрацию реагента на границе (Co2+ и Fe2+), а
затем способствует химической реакции. Не очевидное объяснение может быть дано
для формирования CoFe2O4 в мицеллах при комнатной температуре, тогда как раствор
должен быть нагрет до 100 °C в однородном растворе.
Как уже было сказано выше, однородный раствор, в
котором размер частиц находится под контролем радикальных изменений в условия
эксперимента, вызывает большие возмущения в магнитных свойствах наночастиц. В
мицеллярном растворе, размер частицы контролируется сохранностью соотношением
реагентов ([Fe(DS)2]/[CH3NH3OH] и [Fe(DS)2]/[Co(DS)2]) и за счет увеличения
концентрации Fe(DS)2 в 4 раза (6.5 × 10-3 M <
[Fe(DS)2] < 1.2 × 10-3 M) [31,33,34]. На
рисунке 13 показано увеличение размера частиц от 2 до 5 нм. Этот контроль
размера частиц довольно удивителен. Частичное объяснение дано по данным XANES,
полученных при тех же концентрациях, что и при синтезе. Увеличение степени
окисления Co и Fe ионами при увеличении концентрации Fe(DS)2 является
производным от этих данных [39]. Это может привести к увеличению числа ядер, а
затем вызвать увеличение размера частиц. Кроме того, количество кислорода,
растворенного в растворе, зависит от мицеллярной концентрации. Это может
сыграть свою роль в борьбе с размерами частиц.
Рисунок 13 - TEM модели магнитной жидкости,
полученной при различных концентрациях поверхностно содержания
[Co(DS)2]/[Fe(DS)2] = 0.325 и [Co(DS)2]/[NH2CH3] = 1.3 ×
10-2:
[Fe(DS)2] = 6.5 × 10-3 M (A); [Fe(DS)2] = 1.3 × 10-2 M (B);
[Fe(DS)2] = 2.6 × 10-2 M (C)
Подобное поведение наблюдается с наноразмерными
частицами Fe3O4 и γ-Fe2O3. Химическая
реакция происходит при низкой концентрации реагента, при комнатной температуре,
в отсутствие ионов Fe (III). В гомогенных растворах, синтез в отсутствие ионов
Fe (III) вызывают образование очень хорошо определенных частиц в микрометровом
диапазоне [40].
Управление размером частиц не требует больших
изменений в экспериментальных условиях. Это позволяет в первом приближении
считать, что поверхность частиц остается неизменной. Таким образом, можно найти
связь между размерами и магнитными свойствами.
Исследование магнитных свойств наноразмерных
частиц CoFe2O4 показывает, из кривых намагниченности и мессбауэровской
спектроскопии, увеличение анизотропии с уменьшением размера частиц. Для частиц
со средним размером 5 нм, анизотропия остается кубическая, как и в объемной
фазе. И наоборот, когда размер частиц уменьшается с 5 до 3 или 2 нм, анизотропия
наноматериалов изменяется от кубической к осевой [41].
Частицы металлической меди.
Частицы металлической меди получены от
уменьшения в мицеллярном растворе Cu(DS)2 боргидрата натрия, в отсутствие
воздуха. Формирование металлических частиц меди в водном растворе довольно
удивительно. Реакция мгновенная, показав сильное влияние мицеллообразования на
химическое восстановление меди (II). В самом деле, заменив Cu(DS)2 солями его
производных, Cu(Cl)2, осадок оксида меди появляется мгновенно. Чтобы контролировать
размер частиц металлической меди, синтез осуществляется по фиксированным
концентрациям Cu(DS)2 и различным концентрациям додецилсульфата натрия Na(DS).
На рисунке 14 показано уменьшение размеров частиц путем увеличения концентрации
Na(DS). Это может быть связано с уменьшением среднего количества молекул
Cu(DS)2 в мицеллах Na(DS). Это может повлечь уменьшение числа ядер в мицеллах и
уменьшение размеров частиц.
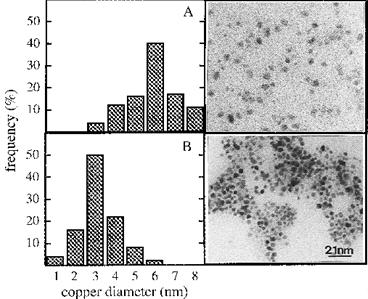
Рисунок 14 - TEM (просвечивающая электронная
микроскопия) модели коллоидных дисперсий меди, полученных в различных
концентрациях додецилсульфата натрия: [Cu(DS)2] = 5 ×
10-4 M; [NaBH4] = 10-3 M; [NaDS] = 10-3 M (A); [NaDS] =10-3
M (B)
1.6 Кондуктометрическое исследование
- теория
Сущность метода. Метод основан на измерении
электропроводности растворов ПАВ и отличается высокой точностью. На кривой
зависимости эквивалентной электропроводности (λ)
водных растворов ПАВ от C1/2 четко фиксируются три области (рис. 15, кривая I).
Резкий излом в падающей ветви кривой 1 вызван
тем, при этой концентрации (порядка нескольких миллимолей на литр) начинается
формирование ионных мицелл, сопровождающееся образованием облаков из
противоионов, связанных с мицеллами. Подвижность поверхностно-активных ионов,
общее число проводящих частиц и заряд в системе при этом уменьшаются и
эквивалентная электропроводность понижается при возрастании концентрации легче,
чем до ККМ. Последующее возрастание электропроводности после минимума этой
кривой (1) объясняется освобождением части противоионов в результате
перекрывания ионных атмосфер при сближении мицелл с увеличением их размеров с
ростом концентрации ПАВ.
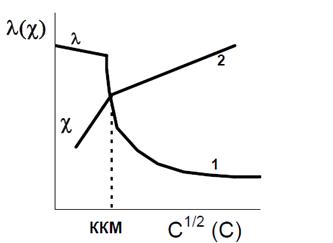
Рисунок 15 - Кривые зависимости эквивалентной (λ)
и
удельной электропроводности (χ) от
концентрации раствора ПАВ: 1 - λ от
С1/2; 2 - χ от С
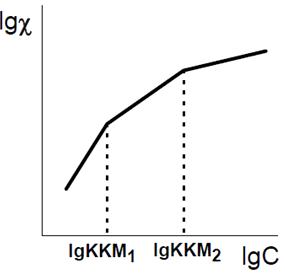
Рисунок 16 - Графическое определение ККМ1 и ККМ2
2. Экспериментальная часть
.1 Исходные вещества
В работе использовались следующие реактивы:
твердые:
кобальта (II) хлорид (моногидрат), стеариновая
кислота, натрия гидроокись, боргидрид натрия, динатриевая соль
этилендиамин-N,N,N',N'-тетрауксусной кислоты 2-водная, эриохром черный Т;
жидкие:
«абсолютированные» этанол, бидистиллированная
деионизированная вода, стандартные титры для pH - метрии.
Все используемые реактивы имели квалификацию чда
и хч.
Все использованные в работе растворители были
предварительно очищены.
Этанол использовался свежеперегнанным.
2.1.1 Очистка хлоридов кобальта (II)
Хлориды кобальта (II) очищались
перекристаллизацией из воды и высушивались под вакуумом при комнатной
температуре.
2.1.2 Определение концентрации ионов
кобальта (II)
Готовили 0,5 М раствор хлорида кобальта (II).
Точную концентрацию ионов металла были
определены титрованием по следующим методикам:
Обратное титрование избытка ЭДТА титрованным
раствором хлорида цинка с эриохром черным Т в качестве индикатора при
определении концентрации кобальта.
2.1.3 Синтез стеарата натрия
Соединение получали реакцией
нейтрализации:Н35СOOH + NaOH → C17H35СOONa + H2O
Соединение является кристаллическим веществом
белого цвета с Тпл. = 180 0С, не растворимо в органических растворителях, плохо
- в холодной воде, хорошо - в этаноле и теплой воде.
Индивидуальность полученного соединения
подтверждена ИК и ЯМР спектроскопическими исследованиями.
2.2 Приготовление мицелярных
растворов
Мицелярные растворы ПАВ стеарата натрия в
дистилированной воде готовились методом диспергирования. Процесс
диспергирования проходил под ультрозвуком в течение полутора часа. Затем мы
сливали растворы и подвергали полученную микроэмульсию ультразвуку в течении
часа под действием инертного газа. При сливании растворов с течением времени
цвет первого изменялся от голубого до желтого, что связано с размерными
эффектами образующихся частиц. В зависимости от исходной концентрации ионов
Co2+ , получаемые растворы оставались либо желтого цвета, либо в них выпадает
осадок наночастиц черного цвета, который реагирует на магнитное воздействие
(рис. 17).

Рисунок 17 - Мицеллярные растворы
2.3 Кондуктометрическое исследование
Исследование проводилось с помощью кондуктометра
“Эксперт - 002”.
Кондуктометр «ЭКСПЕРТ-002» -портативный
кондуктометв/солемер с различными диапазонами измерения удельной
электропроводности (УЭП) и дискретностью представления результатов.
Кондуктометр измеряет:
УЭП,
Т (температуру),°С
2.4 Синтез наночастиц кобальта в
прямых мицеллах
Получение НЧ проводили смешением двух
микроэмульсий (объемом 10 мл каждая), водные фазы которых содержали следующие
компоненты:
.коллоидный раствор АПАВ с концентрацией 0,0001М
и водный раствор хлорида кобальта в различных концентрациях (0,001М; 0,005М;
0,01М; 0,02М; 0,05М).
.коллоидный раствор АПАВ с концентрацией 0,0001М
и боргидрид натрия в количествах расчитанных из уравнения реакции.
2.5 Аппаратное оформление
2.5.1 ИК исследование
ИК-спектры всех соединений были записаны на
спектрометре «ИНФРАЛЮМ ФТ-02» в области 4000 - 350 см-1. Предел допустимой
абсолютной погрешности измерений по шкале волновых чисел ± 0,05см-1.
Спектры ПМР регистрировались на ЯМР спектрометре
JEOL JNM-ECA - 400 с фиксированной частотой 400 МГц при температуре 25 ± 10С.
Ошибка измерений составляла 0,1 м.д. В качестве растворителя использовался
дейтерированный хлороформ (ССl3D), в качестве внутреннего стандарта - ТМС.
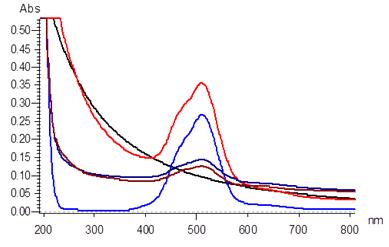
Рисунок 18 - Электронные спектры поглащения
растворов: 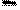 мицеллярный раствор
АПАВ - 0,0001М;
мицеллярный раствор
АПАВ - 0,0001М;  раствор хлорида
кобальта 0,1М;
раствор хлорида
кобальта 0,1М;  мицеллярный раствор
+ хлорид кобальта;
мицеллярный раствор
+ хлорид кобальта;  мицеллярный раствор
+ хлорид кобальта через 10 минут;
мицеллярный раствор
+ хлорид кобальта через 10 минут;  мицеллярный
раствор + хлорид кобальта через 40 минут
мицеллярный
раствор + хлорид кобальта через 40 минут
наночастица кобальт мицелярный
микроскопия
Измерения pH растворов проводили в
термостатируемой ячейке при t=22,5 ± 0,50С на ионометре «ЭКСПЕРТ-001» с
использованием комбинированного стеклянного pH электрода ЭСК-10601/7 с
точностью измерения ± 0,005 ед. pH. Комбинированный стеклянный pH электрод был
предварительно откалиброван по стандартным титрам для pH-метрии. Полученные
спектры предоставлены на рисунке 18.
2.5.2 Растровая электронная микроскопия
Растровая электронная микроскопия проводилась на
растровом электронном микроскопе сверхвысокого разрешения JSM 7500F фирмы JEOL
(Рис. 19):
разрешающая способность: не хуже 1 нм при 15 кВ,
не хуже 2,1 нм при 1 кВ;
увеличение в диапазоне от 20х до 900000х
рабочий диапазон ускоряющих напряжений от 100В
до 30 кВ;
использует детекторы: вторичных электронов,
отраженных электронов, STEM-детектор, энергодисперсионный детектор
система микроанализа состава отдельных образцов

Рисунок 19 - Растровый электронный микроскоп
(РЭМ) JSM - 7500F
Для исследования полученные образцы наклеивались
на держатель с помощью токопроводящей пасты. Исследование проводилось в режимах
детектирования отраженных электронов (COMPO), а также в режиме детектирования
вторичных электронов (SEI). С увеличением до 100000 раз и ускоряющим
напряжением 10 кВ. Средний размер определяется по диаграмме дисперсности.
Диаграмма дисперсности строилась по выборке на фотографии. Точность определения
размера частиц ±1%. Изображение исследуемых материалов приведены на рисунках №
20, 22, 24, 26, 28.
Для определения среднего размера и дисперсности
наночастиц кобальта на изображениях определялось количество частиц, измерялся
диаметр каждой частицы и высчитывался средний размер частиц (рис. 21, 23, 25,
27, 29). Погрешность определения размера частиц вычислялась следующим образом:
. Вычисляется среднее из n измерений:
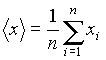 .(1)
.(1)
. Определяется среднеквадратичная погрешность
среднего арифметического:
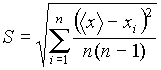 .(2)
.(2)
. Задается доверительная вероятность a и
определяется коэффициент Стьюдента ta,n для заданного a и числа произведенных
измерений n.
. Находится полуширина доверительного интервала
(абсолютная погрешность результата измерений):
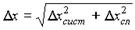 (3)
(3)
где Δ
xсл
= ta,n S
5. Оценивается относительная погрешность
результата измерений
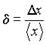 (4)
(4)
. Окончательный результат записали в виде:
=< x> ± D x.(5)

Рисунок 20 - Микрофотография образца поверхности
пленки мицеллярного раствора nАПАВ/nCo2+ 1/10
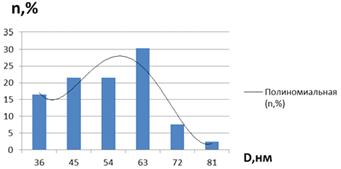
Рисунок 21 - Дисперсность наночастиц кобальта в
образце мицеллярного раствора nАПАВ/nCo2+ 1/10

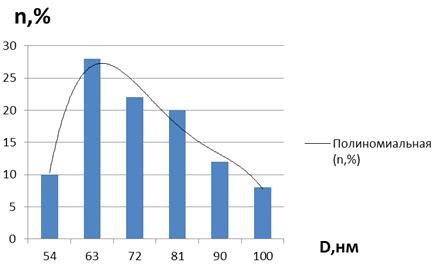
Рисунок 23 - Дисперсность наночастиц кобальта в
образце мицеллярного раствора nАПАВ/nCo2+ 1/50

Рисунок 24 - Микрофотография образца поверхности
пленки мицеллярного раствора nАПАВ/nCo2+ 1/100
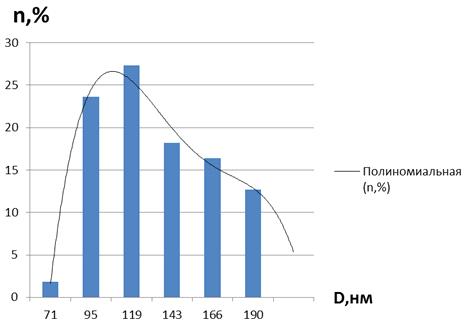
Рисунок 25 - Дисперсность наночастиц кобальта в
образце мицеллярного раствора nАПАВ/nCo2+ 1/100

Рисунок 26 - Микрофотография образца поверхности
пленки мицеллярного раствора nАПАВ/nCo2+ 1/200
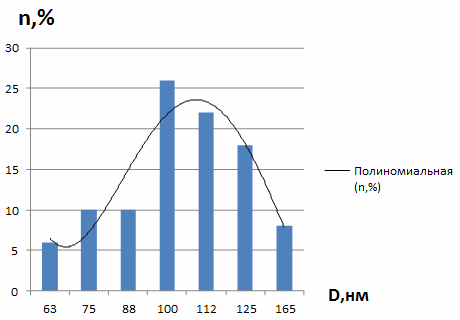
Рисунок 27 - Дисперсность наночастиц кобальта в
образце мицеллярного раствора nАПАВ/nCo2+ 1/200

Рисунок 28 - Микрофотография образца поверхности
пленки мицеллярного раствора nАПАВ/nCo2+ 1/500
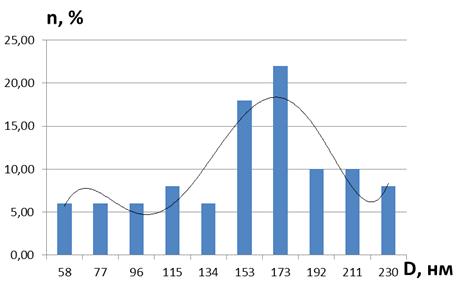
Рисунок 29 - Дисперсность наночастиц кобальта в
образце мицеллярного раствора nАПАВ/nCo2+ 1/500
2.5.3 Получение Пленки
Ленгмюра-Блоджетт
Перенос монослоев с поверхности субфазы на
твердую подложку методом Ленгмюра-Блоджетт проводили при температуре 22,5±10С,
поддерживая постоянной величину поверхностного давления. В качестве подложек
для нанесения пленок использовалась кварцевая пластина, которая предварительно
обрабатывалась кипячением в течение 15 минут в перекисно-аммиачном растворе,
многократно ополаскивались бидистиллированной водой и сушились в инертной
атмосфере. Рабочая площадь пластин 30×10,75×1,23
мм.
Скорость движения барьеров и подложки через
монослой составляла 10 мм/мин. После каждого цикла погружения - поднятия, т.е.
нанесения двух монослоев, пленки сушили на воздухе в течение 20 минут.
Перенос монослоя осуществлялся по Y-типу.
Исследуемый образец содержал 2.
2.5.4 Атомно-силовая микроскопия
Модель JSPM-5400 - сканирующий зондовый
микроскоп высокого разрешения, включающий режим бесконтактной атомно-силовой
микроскопии. Дополнительно включает в себя цифровой процесс обработки сигнала
(DSP) для системы управления, осуществляемый системой полного компьютерного
управления прибором с помощью интуитивно понятного графического
пользовательского интерфейса (GUI) (рис. 30).
Основные характеристики:
Встроен новый усилитель для атомно-силовой
микроскопии с цифровой системой автоподстройки частоты. Данная функция
позволяет проводить стабильные, воспроизводимые наблюдения на атомном уровне.
Интуитивно понятный GUI графический интерфейс
пользователя на базе Windows XP позволяет Вам управлять системой без
пользования инструкцией по эксплуатации.
Вы можете легко и быстро выполнять различные
задания, такие как переустановка сканера и монтаж принадлежностей, в том числе
держателя нагрева, используя автоматическую функцию распознавания сканера.
Усиление механизма столика дает возможность
получения стабильного и бесдрейфового изображения на предельных увеличениях.

Рисунок 30 - JSPM-5400. Сканирующий зондовый
микроскоп
С помощью сканирующего зондового микроскопа были
получены изображения (рис. 31, 32, 33).
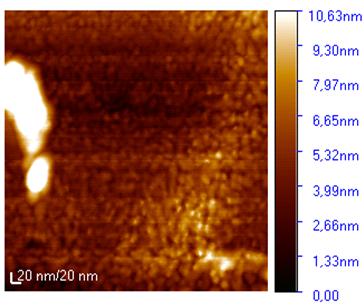
Рисунок 31 - Микрофотография атомно-силового
микроскопа образца пленки нанесенной методом Ленгмюра-Блоджетт
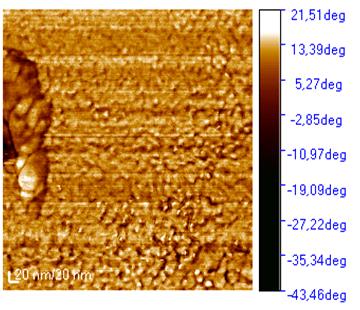
Рисунок 32 - Микрофотография атомно-силового
микроскопа образца пленки нанесенной методом Ленгмюра-Блоджетт

Рисунок 33 - Микрофотография атомно-силового
микроскопа образца пленки нанесенной методом Ленгмюра-Блоджетт
3. Результаты и их обсуждение
Для определения концентрации перехода молекулярной
формы ПАВ в мицеллярный было необходимо определение критической концентрации
мицеллообразования. Данную величину определяли с помощью кондуктометрического
метода. По результатам исследования была построена зависимость эквивалентной
электропроводности водных растворов ПАВ от концентрации (рис. 34). На
зависимости видно постепенное линейное снижение электропроводности до
критической концентрации мицеллообразования, а затем происходит резкое падение
до минимума. Это объясняется тем, что образующиеся мицеллы благодаря большому
размеру менее подвижны в электрическом поле, чем неагрегированные ионы.
Подвижность поверхностно-активных ионов, общее число и заряд проводящих частиц
в системе при этом падает, и электропроводность понижается при возрастании концентрации
резче, чем до ККМ.
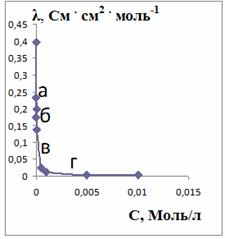
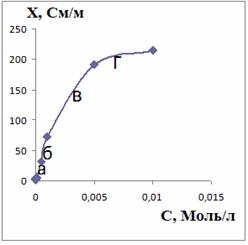
Рисунок 34 - Зависимости эквивалентной (λ)
и
удельной (х) электропроводностей от концентрации АПАВ (С)
Таким образом, ККМ равна 0,0001М.
После определения величины ККМ нами был проведен
ряд экспериментов по синтезу наночастиц кобальта в прямых мицеллах. Для этого
были приготовлены два коллоидных раствора АПАВ, с концентрацией последнего
равного 0.0001М. Один из них содержал водный раствор хлорида кобальта в различных
к АПАВ молярных соотношениях, а другой боргидрид натрия в количествах
расчитанных из уравнения реакции.
При сливании растворов с течением времени цвет
первого изменяется от голубого до желтого, что связано с размерными эффектами
образующихся частиц. В зависимости от исходной концентрации ионов Co2+ ,
получаемые растворы остаются либо желтого цвета, либо в них выпадает осадок
наночастиц черного цвета (рис. 17).
Процесс образования наночастиц кобальта в
растворе был исследован с помощью спектрофотометрического метода. Представлены
электронные спектры поглащения следующих растворов (рис. 18). Видно, что после
восстановления с течением времени концентрация ионов металла уменьшается, что
указывает на образование наночастиц.
Электронные спектры поглащения растворов:
Черный - мицеллярный раствор АПАВ - 0,0001М
Синий - 0,1 М хлорида кобальта
Красный - мицеллярный раствор + хлорид кобальта
Темно синий - мицеллярный раствор + хлорид
кобальта через 10 минут
Коричневый - мицеллярный раствор + хлорид
кобальта через 40 минут
Выпавшие в результате реакции восстановления,
осадки наночастиц кобальта отмывали этиловым спиртом в инертной среде и изучали
с помощью сканирующей электронной микроскопии. Растворы, которые были
прозрачны, так же были изучены. На основе полученных данных была построена
зависимость диаметра полученных наночастиц кобальта от молярного соотношения
АПАВ/ Co2+ (рис.35). Из которой видно, что с увеличением молярного соотношения
АПАВ/ Co2+ увеличивается диаметр наночастиц.
На графике зависимости диаметра частиц от
молерного соотношения АПАВ/Co2+ видно, что диаметр частиц минимален в растворе
с молярным соотношением АПАВ/ Co2+ 1/10, что дает возможность применения его
для получения 2D упорядоченных наночастиц (рис. 35).
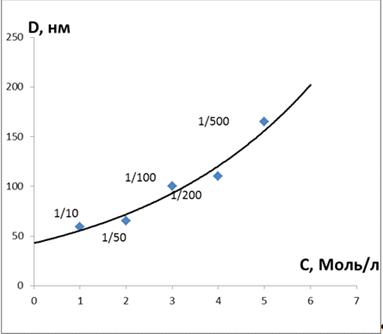
Рисунок 35 - Зависимость диаметра частиц от
молярного соотношения АПАВ/Co2+
Для получения массива 2D упорядоченных
наночастиц кобальта нами была применена технология Ленгмюра- Блоджетт, которая
заключается в перенесении монослоев АПАВ на твердую подложку, в нашем случае -
кремневую. Затем подложка с нанесенным монослоем отжигалась в течение 1 часа
при 300 0С для удаления мицеллярной оболочки.
Результаты исследования структуры полученных 2D
- упорядоченных ансамблей наночастиц кобальта методом атомно-силовой
микроскопии. Видно, что поверхность представляет собой высокоупорядоченную
структуру с размером частиц порядка 10 -20 нм (рис. 31,32,33).
Заключение
В результате выполнения дипломной работы были
получены следующие результаты:
Реакцией нейтрализации получен анионный ПАВ -
стеарат натрия. Строение получившегося соединения было доказано с помощью ИК и
ЯМР спектроскопии, а также сравнением его Тпл. с табличными данными.
Методом кондуктометрии была определена
критическпя концентрация мицеллообразования полученного АПАВ равная 0,0001М.
Методом синтеза в прямых мицеллах были получены
наночастицы кобальта. Показано, что их размер зависит от мольного соотношения
АПАВ и Ме2+ в исходном мицеллярном растворе и варьируется от 50 до 150 нм.
Методом электронной спектроскопии коллоидных
растворов АПАВ до и после восстановления Ме2+ исследовано уменьшение
концентрации Co2+ в восстанавливаемом растворе с течением времени, вследствие
перехода Co2+→ Co0.
Методом Ленгмюра-Блоджетт получены пленки ЛБ
наночастиц кобальта.
Методом атомно-силовой микроскопии (АСМ)
определена топология пленок ЛБ 2D - упорядоченных ансамблей наночастиц
кобальта. Показано, что размер наночастиц Со равен порядка 10-20 нм, равномерно
распределенных по площади подложки.
По данным результатам дипломной работы сделаны
выводы:
. На размер синтезируемых наночастиц кобальта
влияет соотношение АПАВ/Со2+, чем больше количество кобальта, тем больше размер
получаемых наночастиц.
. Пленка наночастиц кобальта, полученная методом
Ленгмюра-Блоджетт имеет упорядоченную, шероховатую структуру. Содержит
равномерно расположенные наночастицы по площади подложки размером 10-20 нм.
Литература
1. Андриевский
Р.А. Наноматериалы: концепция и современные проблемы. / Р.А. Андриевский //
Российский химический журнал. - 2002.- №5. - С.50-56.
2. Ясная
М.А. Нанометаллополимеры как материалы для ионоселективных датчиков / М.А.
Ясная // Неорганическая химия журнал. - 2008. - № 4. - С.647 - 652.
. Ершов
Б.Е. Наночастицы металлов в водных растворах: электронные, оптические и каталитические
свойства. / Б.Е. Ершов // Российско-химический журнал. - 2001. - № 3. - С.21 -
31.
. Бронштейн
Л.М. Наноструктурированные полимерные системы как нанореакторы для формирования
наночастиц / Л.М. Бронштейн, С.Н. Сидоров, П.М. Валецкий // Успехи химии журнал
- 2004. - № 5. - С.542 - 552.
. Губин
С.П. Что такое наночастица? Тенденции развития нанохимии и нанотехнологии /
С.П. Губин // Рос. хим. журн. - 2000. - Т. 44. - С.23 - 31.
. Сергеев
Г.Б. Нанохимия металлов / Г.Б. Сергеев // Успехи химии журнал - 2001. - № 10. -
С.915 - 930.
. Туров
Е. А. Магнитные свойства и строение вещества / Е. А. Туров.- М.: Техносфера,
1955. - 341с.
. Пул
Ч. Нанотехнологии / Ч. Пул, Ф. Оуэнс. - М.: Техносфера, 2004. - 328 с.
. Помогайло
А.Д. Наноцастицы металлов в полимерах / А.Д. Помогайло, А.С. Розенберг, И.Е.
Уфлянд. - М.: Химия, 2000. - 672 с.
. Буканова
Е.Ф. Коллоидная химия ПАВ. Часть 1. Мицеллообразование в водных растворах ПАВ:
Учебное пособие / Е.Ф. Буканова. - М.: МИТХТ им. М.В. Ломоносова, 2006. - 76 с.
. Русанов
А.И. Мицеллообразование в растворах поверхностно - активных веществ / А.И.
Русанов. - СПб.: Химия, 1992. - С. 69.
. Старостин
В.В. Материалы и методы нанотехнологий. / В.В. Старостин. - М.: БИНОМ
Лаборатория знаний. - 2008. - С. 431.
. Суздалев
И.П. Физико-химия нанокластеров, наноструктур и наноматериалов / И.П. Суздалев.
- М.: КомКнига, 2006. - 592 с.
15. Lisiecki,
I. Syntheses of copper nanoparticles in gelified microemulsion and in reverse
micelles/ I. Lisiecki, M. P. Pileni // J. Amer. Chem. Soc. - 1993. - № 2. - P.
110 - 115.
. Suriki,
K. Growth Mechanism of Cadmium Sulfide Ultrafine Particles in Water-in-Oil
Microemulsion/ K.Suriki, M. Harada, A. Shioi // J. Chem. Eng. Jpn. - 1996. - №
3. - P. 108 - 109.
. Hirai,
T. Mechanism of formation of titanium dioxide ultrafine particles in reverse
micelles by hydrolysis of titanium tetrabutoxide / T. Hirai, H. Sato, I.
Komasawa // Ind. Eng. Chem. Res. - 1994. - № 1. - P. 31 - 33.
18. Cizeron,
J. The dynamic of colloidal CdS investigated by spectral methods
<http://gw-chimie.math.unibuc.ro/anunivch/2006-2/AUBCh2006XV25965.pdf> /
J. Cizeron, M.P. Pileni // J. Phys. Chem. - 1995. - № 4. - P. 96 - 99.
19. L.
Levy, J.F. Hochepied, M.P. Pileni // J. Phys. Chem. - 1996. - № 5. - P. 100 -
103.
. Petit,
C. In situ synthesis of silver nanocluster in AOT reverse micelles / С.
Petit, P. Lixon, M.P. Pileni, // - J. Phys. Chem. - 1993. - № 8. - P. 96 - 97.
. Lisiecki,
I. Copper Metallic Particles “in situ” in Reverse Micelles: Influence of
Various on the Size of the Particles/ I. Lisiecki, M.P. Pileni // J. Phys.
Chem. - 1995. - № 6. - P. 99 - 100.
. Motte,
L. Role of water molecules in the growth of nanosizes particles in reverse
micelles / L. Motte, I. Lisiecki, M.P. Pileni, // In Hydrogen Bond Networks; J.
Dore, M.C. Bellisan, Eds.; NATO: 1994. - № 3. - P. 445 - 447.
. Pileni,
M.P. Collections of Copper Nanocrystals Characterized by Different Sizes and
Shapes: Optical Response of These Nanoobjects/ M.P. Pileni, B. Hickel, C.
Ferradini // Puchauld, J. Chem. Phys. Lett. - 1982.
- № 9. - P. 90 - 92.
24. Pileni
M.P. Hydrated Electrons in Reverse Micelles. 2. Quenching
of Hydrated Electron by SodiumNitrate / M.P. Pileni, P. Brochette, B.Hickel,
B.J. Lerebours // Colloid Interface Sci. - 1984. - № 4. - P. 98 - 99.
25. T.K.
Jain, G. Cassin, J.P. Badiali, M.P. Pileni // Langmuir. - 1996. - № 1. - P. 12-13.
. Cassin
G. Aot reverse micelles - depletion model / G. Cassin, J.P. Badiali, M.P.
Pileni // J. Phys. Chem. - 1995. - № 5. - P. 99 - 101.
. Robertus
C. The effect of the composition of the oil phase on the microstructure and
dielectric behavior of water?in?oil microemulsions
<http://link.aip.org/link/jcpsa6/v93/i10/p7293/s1> / C. Robertus, G.H.
Joosten, Y.K. Levine // J. Chem. Phys. - 1990. - №
9. - P. 93 - 94.
. Towey
T.F. Kinetics and mechanism of formation of quantum-sized cadmium sulphide
particles in watcr-aerosol-OT-oil microemulsions / T.F. Towey, A. Khan-Lodl,
B.H. Robinson // J. Chem. Soc., Faraday Trans. 2. - 1990. - № 6. - P. 82 - 86.
. Fletcher,
P.D. A Quasi-Elastic Neutron-Scattering Study of Water-in-Oil Microemulsions
Stabilized by Aerosol - Ot - Effect of Additives Including Solubilized Protein
on Molecular Motions / P.D. Fletcher, B.H. Robinson, J. Tabony // J. Chem.
Soc., Faraday Trans. 1. - 1986. - № 2. - P. 79 - 82.
. Mostafavi,
M. Ultra-slow aggregation process for silver clusters of a few atoms in
solution Chemical Physics Letters / M. Mostafavi, N. Keghouche, M.O. Delcourt,
J. Belloni // Chem. Phys. Lett. - 1990. - № 7. - P. 167
- 170.
31. Yi
K.C. Chemical Formation of Silver particulates films under monolayers / K.C.
Yi, Z. Horvolgyi, J.H. Fendler // J. Phys. Chem. - 1994. - № 3. - P. 97 - 98.
. I.
Lisiecki, M. Borjling, L. Motte, B. Ninham, M.P. Pileni // Langmuir. - 1995. -
№ 1. - P. 11 - 13.
. Pileni
M.P. Nanoparticles synthesized in reverse micelles / M.P. Pileni, L. Motte, J.
Cizeron, C. Petit, N. Moumen, R. Mackay, P. Kumar, K.L. Mittal // Eds.; Marcel
Dekker, Inc.: 1996. - № 1. - P. 44 - 45.
. Motte
L. Synthesis in situ of nanosize silver sulphide semiconductor particles in
reverse micelles / L. Motte, F. Billoudet, M.P. Pileni // J. Mater. Sci. -
1996. - № 1. - P. 31 - 33.
. Lisiecki
I. Control of the shape and the size of copper metallic particles / I.
Lisiecki, F. Billoudet, M.P. Pileni // J. Phys. Chem. - 1996. - № 5. - P. 100 -
104.
. Moumen
N. Controlled preparation of nanosize cobalt ferrite magnetic particles / N.
Moumen, P. Veillet, M.P. Pileni // J. Magn. Magn. Mater. -
1995. - № 8. - P. 148 - 149.
37. S.W.
Charles // J. Magn. Magn. Mater. - 1987. - №2. - P. 61 -
65.
38. Moumen
N. Control of the Size of Cobalt Ferrite Magnetic Fluid / N. Moumen, M.P.
Pileni // J. Phys. Chem. - 1996. - № 6. - P. 99 - 100.
. Moumen
N. Control of the Size of Cobalt Ferrite Magnetic Fluid / N. Moumen, M.P.
Pileni // Chem. Mater. - 1996 - № 1. - P. 7 - 8.
. Moumen
N. Micellar factors which play a role in the control of the nanosize particles
of cobalt ferrite / N. Moumen, I. Lisiecki, V. Briois, M.P. Pileni // Supramol.
Sci. - 1995. - № 1. - P. 17 - 21.
. Matijevic
E. Preparation and properties of uniform size colloids / E. Matijevic // Chem. Mater.
- 1993. - № 1. - P. 13 - 15.
. Горбачук
В.В. Практическое руководство к лабораторным работам по коллоидной химии / В.В.
Горбачук, В.А. Загуменнов, В.А. Сироткин, Д.А. Суслов, В.Е. Никитин. - Казань:
Казанский государственный университет, 2001. - 83 с.