Сравнительное изучение хронического влияния ионов свинца и марганца на содержание общих липидов и холестерина в сыворотке крови сеголеток карпа
Содержание
Введение
Глава 1. Обзор литературы
1.1 Влияние свинцовой и марганцевой интоксикации на метаболизм
живых организмов
1.2 Общая характеристика липидного состава липопротеидов сыворотки
крови рыб
1.3 Липопротеиды крови осетровых (Аcipenseridae) рыб
Глава 2. Экспериментальная часть
2.1 Объект исследования
2.2 Постановка эксперимента
2.2.1 Методика определения содержания общих липидов в сыворотке
крови (Chromy et al., 1975)
2.2.2 Методика определения содержания общего холестерина в
сыворотке крови (Fishbach, Dunning, 2004)
2.3 Вариационно-статистическая обработка результатов
Глава 3. Результаты исследования и их обсуждение
Выводы
Литература
Список
сокращений
МДА - малоновый диальдегид
ЛПВП - липопротеиды высокой плотности
ЛПНП - липопротеиды низкой плотности
ПДК - предельно-допустимая концентрация
ПОЛ - перекисное окисление липидов
Введение
Актуальность проблемы. Среди антропогенных факторов,
действующих на гидробионтов северных широт, наибольшую опасность представляют
промышленные стоки, содержащие соли тяжелых металлов (Лукин и др., 1998).
Токсичность тяжелых металлов тесно связана с их физико-химическими свойствами
(Дмитриева и др., 2002). Им свойственна высокая биологическая активность,
способность аккумулироваться в тканях и органах живых организмов.
Рыбы являются наиболее удобными объектами в исследованиях
водоемов, позволяющих установить степень влияния на живой организм различных
факторов, в том числе и токсикантов. Они могут быть использованы для прогноза
различного рода воздействий на водные экосистемы (Кашулин, 2000; Суховская,
Смирнов, 2006).
Тяжелые металлы действуют на самые разные органы и системы,
зачастую обладают очень высокой кумулятивной способностью (Азарин, 2008). К
настоящему времени большинство исследований было посвящено изучению влияния
марганца и свинца на организм человека во вредных условиях труда, в то время
как роль этих тяжелых металлов, как значимого фактора загрязнения окружающей
среды, практически не изучена.
С одной стороны цинк, медь, марганец, кобальт, железо и другие
элементы относятся к жизненно важным элементам, необходимым в определенных
количествах для нормального функционирования порядка 90 ферментов, части
гормонов, витаминов, биосинтеза РНК и ДНК, влияющим на все виды обмена веществ
в организме, а с другой - находясь в больших количествах в воде и корме, они
могут оказывать отрицательное (токсическое) влияние на рыб (Воробьев, 2008).
Загрязнение вод отрицательно сказывается на всех
представителях биоты, но особое значение для оценки трансформации водных экосистем
имеют исследования на рыбах, являющихся конечным звеном в трофической цепи, в
котором накапливаются и отражаются все изменения на предыдущих уровнях.
Использование биохимических показателей значительно расширяет возможности
изучения, как самих рыб, так и среды их обитания.
В этой связи приобретает актуальность изучения динамики
содержания липидных показателей сыворотки крови сеголеток карпа рыб в условиях
оксидативного стресса, вызванного ионами марганца и свинца.
Цель и задачи исследования. Целью нашей работы является
сравнительное изучение влияние хронической интоксикации ионами марганца и
свинца на содержание общего холестерина и общих липидов в сыворотке крови
сеголеток карпа. Из поставленной цели вытекает задача изучения влияния
загрязнения водной среды ионами марганца и свинца на содержание общего
холестерина и общих липидов в сыворотке крови сеголеток карпа.
Научная новизна. Получены данные о хроническом воздействии
ацетата свинца (0,5 мг/л) и сульфата марганца (0,1 мг/л) на динамику содержания
общего холестерина и общих липидов в сыворотке крови сеголеток карпа.
Теоретическая и практическая значимость. Полученные материалы
по содержанию общего холестерина и общих липидов в сыворотке крови карпа могут
служить важным информативным материалом для оценки патологий, наблюдаемых у рыб
на рыбоводных комбинатах в водоемах, доступных для ксенобиотиков различного
происхождения.
Полученные материалы могут быть использованы также в качестве
биохимического теста для мониторинга и экологических экспертиз водоемов.
Глава 1.
Обзор литературы
1.1 Влияние
свинцовой и марганцевой интоксикации на метаболизм живых организмов
Тяжелые металлы, как и другие химические загрязнители,
попадают в среду обитания человека в результате не только природных процессов
(извержения вулканов, выклинивание на поверхность Земли геохимических аномалий
и т.п.), но, главным образом, вследствие интенсивного развития промышленности,
нерационального использования природных ресурсов и урбанизации жизни общества.
Поступление в окружающую среду металлов, обусловленное техногенной
деятельностью, в сотни и тысячи раз выше их фоновых концентраций, что в
глобальном масштабе сопоставимо или превышает их промышленную добычу.
Антропогенные процессы, определяя в ряде мест и даже отдельных регионах формирование
качественно новых антропогенных биохимических провинций, неизбежно
сопровождаются комплексной полиэлементной химизацией (металлизацией) по
следующей цепи: источники загрязнений (выбросы, отходы, стоки) - депонирование
(почва, донные отложения) и главные жизнеобеспечивающие среды (воздух, вода,
продукты питания) - организм человека. Общепризнано, что промышленные
предприятия и транспорт сегодня интенсивно загрязняют окружающую среду. Добыча
твердого и жидкого топлива, работа горнообогатительных комплексов
сопровождается выбросами весьма токсичных металлов и их соединений: хрома,
меди, кобальта, никеля, цинка, свинца, марганца, ртути и др. Тяжелые металлы
поступают в почву в форме оксидов и солей как растворимых, так и практически
нерастворимых в воде (нитритов, сульфидов, сульфатов, арсенитов и др.). Оксиды
тяжелых металлов закрепляются в основном в твердой фазе почвы, особенно при
нейтральном и щелочном рН. Применение минеральных удобрений может усугублять
негативное воздействие тяжелых металлов, способствуя возникновению ряда
нежелательных физических и биологических процессов: изменяя подвижность тяжелых
металлов в почве, удобрения влияют на доступность их растениям. Основными
загрязнителями мхов стали кадмий (0,30-0,35 мг/кг) и кобальт (более 5 мг/кг), а
лесных подстилок - железо (3500-9000 мг/кг), цинк (100-150 мг/кг), медь
(100-150 мг/кг) и кадмий (более 1 мг/кг). Однако лишь концентрации свинца и
кадмия превышали ПДК. Накопление тяжелых металлов в разных компонентах
биоценозов носит избирательный характер. Для свинца и меди отмечено увеличение
их содержания в трофической цепи "фитофаг - хищник - сапрофаг".
Железо, марганец, медь, цинк и никель в поверхностных водах могут быть в
растворенном виде, в виде коллоидов и взвешенных частиц. Среди твердых субстратов
донных отложений поверхностных водоемов активно накапливаются тяжелые металлы
(железо, марганец, медь, цинк, свинец, хром и кадмий). Техногенное поступление
тяжелых металлов в окружающую среду происходит в виде газов и аэрозолей
(возгонка металлов и пылевидных частиц) и в составе сточных вод. Пути миграции
тяжелых металлов в изучаемой местности можно описать схемой: "источник
эмиссии - атмосфера - почва - растения - животное - человек". Они имеют
длительный период концентрации в живых организмах (Талкин и др., 2007).
Свинец относится к наиболее известным ядам. Все соединения
свинца токсичны. Наиболее токсичны солянокислые и уксуснокислые соли, как
наиболее легко растворимые в воде и жидкостях организма.
Половина от общего количества свинца поступает в окружающую
среду в результате сжигания этилированного бензина. Подсчитано, что в составе
отработанных газов автотранспорта поступает в атмосферу ежегодно до 260 тыс. т
свинца, а один автомобиль ежегодно выбрасывает в атмосферу в среднем 1 кг
свинца в виде аэрозоля. В США более 90% антропогенного загрязнения свинцом
приходится именно на автомобильный транспорт (Пурмаль, 1998).
ион свинец марганец рыба
Существенными источниками загрязнения окружающей среды
свинцом и его соединениями являются предприятия оборонной промышленности. Так,
монтажно-паечные работы обусловливают эмиссию свинца и его неорганических
соединений в приземный слой атмосферы в целом по России в объеме 1 т/год.
Лакокрасочные, пропиточные, эмалировочные работы и работы с применением компаундов
обусловливают эмиссию свинца и его неорганических соединений до 150 т/год без
учета составов с высоким удельным содержанием свинца, но имеющих ограниченное
применение. Поступление свинца в окружающую среду происходит также при
производстве свинецсодержащих боеприпасов, нанесении свинцовых покрытий и
других специальных работах.
Различные соединения
свинца обладают разной токсичностью: малотоксичен стеарат свинца; токсичны соли
неорганических кислот (хлорид свинца, сульфат свинца и др.); высокотоксичны алкилированные
соединения, в частности, тетраэтилсвинец. Однако на практике, как правило,
анализируется только общее содержание свинца в различных компонентах окружающей
среды, продовольственном сырье и пищевых продуктах, без дифференциации на
фракции и идентификации вида соединений.
Тетраэтилсвинец также
поступает в природные воды, в связи с его использованием в качестве
антидетонатора в моторном топливе водных транспортных средств, а также с
поверхностным стоком с городских территорий. Данное вещество характеризуется
высокой токсичностью и обладает кумулятивными свойствами. Сжигание каменного
угля поставляет в окружающую среду 27,5 - 35 тыс. т свинца, а в результате
сжигания нефти и бензина почти 50% антропогенного выброса приходится на свинец.
В результате работы металлургических предприятий на поверхность Земли поступает
около 90 тыс. т свинца. Источником поступления свинца в окружающую среду также
являются предприятия металлургической и химической промышленности, которые
выбрасывают в атмосферу наряду с другими загрязнителями, и оксиды свинца
(Самотуга и др., 2006).
В водных системах свинец в основном связан адсорбционно со
взвешенными частицами или находится в виде растворимых комплексов с гуминовыми
кислотами. При биометилировании, как и в случае со ртутью, свинец образует
тетраметилсвинец. В незагрязненных поверхностных водах и суши содержание свинца
обычно не превышает 3 мкг/л. В реках промышленных регионов отмечается более
высокое содержание свинца. Снег способен в значительной степени аккумулировать этот
токсикант. В окрестностях крупных городов его содержание может достигать почти
1 млн мкг/л, а на некотором удалении от них 1-100 мкг/л. Ежегодно в мире в
результате воздействия атмосферных процессов мигрирует около 180 тыс. тонн
свинца (Brooks, 1972).
В организм человека большая часть свинца поступает с
продуктами питания (от 40 до 70% в разных странах и по различным возрастным
группам), а также с питьевой водой, атмосферным воздухом, при курении, при
случайном попадании в пищевод кусочков свинецсодержащей краски или загрязненной
свинцом почвы.
С атмосферным воздухом поступает незначительное количество
свинца - всего 1-2%, но при этом большая часть свинца абсорбируется в организме
человека. В питьевой воде различных стран мира содержание свинца изменяется в
пределах 1 - 60 мкг/л и в большинстве европейских стран не превышает 20 мкг/л.
Загрязненная свинцом почва является источником его поступления в
продовольственное сырье и непосредственно в организм человека, особенно детей.
Наиболее высокие концентрации свинца обнаруживаются в почве городов, где
расположены предприятия по выплавке свинца, производству свинецсодержащих
аккумуляторов или стекла.
Водные растения хорошо аккумулируют свинец. Иногда
фитопланктон удерживает его с коэффициентом концентрирования 105, как и ртуть.
В регионах с промышленными выбросами накопление тетраметилсвинца в тканях рыб
протекает эффективно и быстро. Острое и хроническое воздействие свинца
наступает при уровне загрязненности 0,1-0,5 мкг/л (Будников, 1998).
Свинец образует в организме стойкие депо, преимущественно в
печени. По прекращении введения свинца происходит его перераспределение и
свинец почти полностью (80-90%) депонируется в костях. Период полураспада
свинца в организме человека составляет 6 лет в мягких тканях и 15 - 20 лет в
скелете.
Свинец, подобно другим тяжелым металлам, включается в
различные клеточные ферменты, в результате чего нарушается обмен веществ в
организме (Brooks, 1972). Производное тетраэтила свинца - триэтилсвинец обладает
нейротоксическим действием. Органические соединения свинца поглощаются кожей,
легкими и желудочно-кишечным трактом. У рыб органами мишенями свинца являются
жабры и желудочно-кишечный тракт. Жабры подвергаются токсической атаке в первую
очередь. Реакция пограничных (эпителиальных) структур при отравлении рыб
ацетатом свинца проявляется задолго до появления высших признаков токсикоза.
Выделена определенная группа клеток жаберного эпителия наиболее подверженная
воздействию токсиканта и аккумулирующая ионы свинца с возникновением последних стадий
обширного тканевого отека.
Хроническое отравление свинцом и накопление его в организме
человека даже при низких уровнях содержания приводит к снижению коэффициента
интеллекта, ослаблению внимания, потере работоспособности, гиперактивности,
расстройству поведения, отставанию в развитии. Известно также, что свинец
неблагоприятно действует на течение и исход беременности. Наличие свинца в
органах плода, а иногда в плаценте приводит к преждевременным родам, выкидышам,
внутриутробной гибели плода. Особенно опасно воздействие свинца на маленьких
детей, оно вызывает умственную отсталость и хроническое заболевание мозга. Так
в США обратили внимание на проявление агрессивности у детей в связи с
повышенным содержанием в их организме свинца. В других регионах планеты рост
числа правонарушений и самоубийств также связывают с повышением содержания
этого токсиканта в окружающей среде (Будников, 1998).
Одним из наиболее коварных последствий действия соединений
свинца является его способность заменять кальций в костях, являясь постоянным
источником отравления в течение длительного времени (Brooks, 1972).
Свинец является одним из сильных энзиматических ядов.
Образование необратимых комплексов "энзим-свинец" приводит к блокаде
ионных каналов и нарушению механизма активного транспорта ионов. Под
воздействием свинца в крови карпа было обнаружено снижение количества
оксигемоглобина, увеличение дезокси - и метгемоглобина, активация перекисного
окисления липидов, увеличение содержания диеновых коньюгатов и МДА (Грубен,
1997). При использовании сублетальных концентраций свинца в наших экспериментах
обнаружено значительное накопление в тканях сеголеток русского осетра МДА,
снижение суммарной антиоксидантной и каталазной активности. Острое свинцовое
отравление сопровождалось развитием катаболического стресса, потерей массы,
расстройством трофической функции, изменением поведенческих реакций. Длительное
воздействие свинца приводит к искривлению позвоночника отставанию в развитии. В
хронических опытах на головастиках озерной лягушки было показано негативное
влияние свинца на процессы метаморфоза (Черкесова и др., 1999).
К числу токсичных тяжелых металлов также относится марганец.
В поверхностные воды марганец поступает в результате выщелачивания
железомарганцевых руд и других минералов, содержащих марганец (пиролюзит,
псиломелан, браунит, манганит, черная охра). Значительные количества марганца
поступают в процессе разложения водных животных и растительных организмов,
особенно сине-зеленых, диатомовых водорослей и высших водных растений.
Соединения марганца выносятся в водоемы со сточными водами марганцевых
обогатительных фабрик, металлургических заводов, предприятий химической
промышленности и с шахтными водами.
Понижение концентрации ионов марганца в природных водах
происходит в результате окисления Mn (II) до MnO2 и других высоковалентных оксидов, выпадающих в
осадок. Основные параметры, определяющие реакцию окисления, - концентрация
растворенного кислорода, величина рН и температура. Концентрация растворенных
соединений марганца понижается вследствие утилизации их водорослями.
Главная форма миграции соединений марганца в поверхностных
водах - взвеси, состав которых определяется в свою очередь составом пород,
дренируемых водами, а также коллоидные гидроксиды тяжелых металлов и сорбированные
соединения марганца. Существенное значение в миграции марганца в растворенной и
коллоидной формах имеют органические вещества и процессы комплексообразования
марганца с неорганическими и органическими лигандами. Mn (II) образует растворимые
комплексы с бикарбонатами и сульфатами. Комплексы марганца с ионом хлора
встречаются редко. Комплексные соединения Mn (II) с органическими
веществами (аминами, органическими кислотами, аминокислотами и гумусовыми
веществами) обычно менее прочны, чем аналогичные соединения с другими
переходными металлами. Mn (III) в повышенных концентрациях может находиться в
растворенном состоянии только в присутствии сильных комплексообразователей, Mn (VII) в природных водах не
встречается.
В речных водах содержание марганца колеблется обычно от 1 до
160 мкг/дм3, среднее содержание в морских водах составляет 2 мкг/дм3, в
подземных - n·102-n·103 мкг/дм3 (Скальный и
др., 2005).
Концентрация марганца в поверхностных водах подвержена
сезонным колебаниям. Факторами, определяющими изменения концентраций марганца,
являются соотношение между поверхностным и подземным стоком, интенсивность
потребления его при фотосинтезе, разложение фитопланктона, микроорганизмов и
высшей водной растительности, а также процессы осаждения его на дно водных объектов.
Роль марганца в жизни высших растений и водорослей водоемов
весьма велика. Марганец способствует утилизации CO2 растениями, чем
повышает интенсивность фотосинтеза, участвует в процессах восстановления
нитратов и ассимиляции азота растениями. Марганец способствует переходу
активного Fe (II) в Fe (III), что предохраняет клетку от отравления, ускоряет рост организмов
и т.д. Важная экологическая и физиологическая роль марганца вызывает
необходимость изучения марганца и его распределения в природных водах.
Для марганца ПДКв (по иону марганца) установлена 0,1 мг/дм3
(лимитирующий показатель вредности - органолептический), ПДКвр - 0,01 мг/дм3
(лимитирующий показатель вредности - токсикологический) (Скальный и др., 2005).
Марганец является эссенциальным элементом для человека и
животных. Соединения марганца в основном поступают в организм с пищей. Много
марганца содержится в ржаном хлебе, пшеничных и рисовых отрубях, сое, горохе,
картофеле, свекле, помидорах, чернике и в некоторых лекарственных растениях (багульник,
вахта трехлистная, лапчатка, эвкалипт).
Всасывание марганца происходит в организме на всем протяжении
тонкого кишечника. Марганец быстро покидает кровяное русло и в тканях
присутствует главным образом в митохондриях клеток ("силовых
станциях" клетки, в которых вырабатывается энергия). В повышенных
количествах он присутствует в печени, трубчатых костях, поджелудочной железе,
почках. Выводится марганец преимущественно с калом, потом, мочой.
Среднесуточная потребность в марганце человека составляет
2,5-5 мг. Биоусвояемость марганца невысока, всего 3-5%. Оптимальная
интенсивность поступления марганца в организм 3-5 мг/день; уровень, приводящий
к дефициту, и порог токсичности оцениваются в 1 и 40 мг/день соответственно.
Марганец относится к важнейшим биоэлементам (микроэлементам)
и является компонентом множества ферментов, выполняя в организме многочисленные
функции:
участвует в синтезе и обмене нейромедиаторов в нервной
системе;
препятствует свободно-радикальному окислению, обеспечивает
стабильность структуры клеточных мембран;
обеспечивает нормальное функционирование мышечной ткани;
участвует в обмене гормонов щитовидной железы (тироксин);
обеспечивает развитие соединительной ткани, хрящей и костей;
усиливает гипогликемический эффект инсулина;
повышает гликолитическую активность;
повышает интенсивность утилизации жиров;
снижает уровень липидов в организме;
противодействует жировой дегенерации печени;
участвует в регуляции обмена витаминов С, Е, группы В,
холина, меди;
участвует в обеспечении полноценной репродуктивной функции;
необходим для нормального роста и развития организма.
Токсическая доза для человека: 40 мг/день.
Летальная доза для человека: данные отсутствуют.
Индикаторы элементного статуса марганца.
Индикатором содержания марганца в организме являются плазма
крови и моча, среднее содержание марганца в этих субстратах (в мкг/л)
составляет 0,3-1,0 и 0,1-1,5 соответственно. В волосах этот показатель
колеблется в пределах 0,2-2,0 мкг/г.
Пониженное содержание марганца в волосах обычно отмечается
при жалобах на общую слабость, утомляемость, плохое настроение, головокружение,
боли в мышцах, избыточный вес. Низкий уровень марганца характерен для пациентов
с рассеянным склерозом, витилиго, сахарным диабетом, различными аллергозами и
ревматическими заболеваниями. У детей, страдающих бронхиальной астмой, уровень
марганца в волосах в 50% случаев понижен.
Дефицит марганца - одно из распространенных отклонений в
биоэлементном обмене современного человека. Этот факт связан с повышенной
психоэмоциональной нагрузкой на человека за счет усиленного "расхода"
марганца для обеспечения основных нейрохимических процессов в центральной
нервной системе. Дефицит марганца отрицательно сказывается на стабильности
мембран нервных клеток и нервной системы в целом, отражается на функциях мозга
и других органов и систем.
Причины дефицита марганца:
недостаточное поступление марганца извне (неадекватное
питание, снижение потребления богатых марганцем продуктов, в частности,
растительной пищи);
избыточное поступление в организм фосфатов (лимонады,
консервы);
усиленное выведение марганца под влиянием избыточного
содержания в организме кальция, меди и железа;
усиленное расходование марганца в результате
психоэмоциональных перегрузок, у женщин в предклимактерический период и при
климаксе;
загрязнение организма различными токсинами (цезий, ванадий);
нарушение регуляции обмена марганца в организме.
Основные проявления дефицита марганца:
утомляемость, слабость, головокружение, плохое настроение;
ухудшение процессов мышления, способности к принятию быстрых
решений, снижение памяти;
нарушения сократительной функции мышц, склонность к спазмам и
судорогам, боли в мышцах, двигательные расстройства;
дегенеративные изменения суставов, склонность к растяжениям и
вывихам, остеопороз в климактерическом периоде;
нарушения пигментации кожи, появление мелкой чешуйчатой сыпи,
витилиго;
задержка роста ногтей и волос;
снижение уровня "полезного" холестерина в крови,
нарушение толерантности к глюкозе, нарастание избыточного веса, ожирение;
бесплодие;
дисфункция яичников, ранний климакс, преждевременное
старение;
расстройства иммунитета, аллергические реакции, риск
онкологических заболеваний;
задержка развития у детей.
Всасыванию марганца в желудочно-кишечном тракте способствуют
витамины B1,
Е, фосфор и кальций (в умеренных количествах), а препятствием является
избыточное поступление фосфора и кальция.
Отмечена связь между повышенным содержанием марганца в
питьевой воде, повышением уровня марганца в биосредах человека и специфическими
нейропсихическими расстройствами. При потреблении питьевой воды с повышенным
содержанием марганца значительно возрастает риск развития врожденных уродств,
онкологических и сердечных заболеваний. У школьников, проживающих в областях
повышенного содержания марганца в питьевой воде, зарегистрированы низкие
показатели краткосрочной памяти, мануальной ловкости и видеоперцептивной
скорости. Есть сведения о положительной корреляции между содержанием марганца в
крови и депрессивными состояниями населения, проживающего в районах с
повышенной промышленной нагрузкой (Кучер и др., 2008).
1.2 Общая
характеристика липидного состава липопротеидов сыворотки крови рыб
К настоящему времени установлено, что большое количество
биохимических реакций в организме протекает при участии свободных радикалов,
обладающих исключительно высокой химической активностью (Шепелев и др., 2000;
Болдырев, 2001; Хуцишвили, Рапорт, 2002).
Классическим примером свободнорадикальных процессов в
организме является перекисное окисление липидов (ПОЛ), протекающее
преимущественно в биологических мембранах (Шепелев и др., 2000).
У рыб ПОЛ является активным метаболическим и регуляторным
фактором. Перекисные процессы у них усиливаются в результате экстремальных
воздействий и формируют уровень ПОЛ, достаточный для адаптации гидробионтов к
новым условиям существования (Грубинко, Леус, 2001). В последние годы
наблюдается значительное повышение интереса биохимиков к изучению роли и
нарушений липидного обмена в различных патологических состояниях. В настоящее
время еще не полностью выяснена кинетика накопления перекисных продуктов и
субклеточная локализация ПОЛ у рыб (Грубинко, Леус, 2001).
Липиды выполняют в организме животных разнообразные функции.
Липиды у рыб служат основным источником энергии. Триглицериды являются основным
хранилищем липидов. У рыб липиды могут находиться в печени, в мышцах,
перивисцеральной жировой ткани. Место хранения липидов зависит от вида рыб (Corraze, Kaushik, 1999). Содержание
липидов зависит от размера и возраста рыб, а также от температуры, солености
воды и питания. Важным адаптивным свойством метаболизма рыб является
способность менять степень ненасыщенности жирных кислот структурных липидов
(Гершанович и др., 1991; Рипатти и др., 1996). Помимо этого, они являются
важнейшими составляющими клеточных мембран и ряда биологических соединений
(Гершанович и др., 1991). Входя в состав биологических мембран, липиды
(фосфолипиды, холестерин) участвуют в процессах клеточной проницаемости (Гурин,
1986), регуляции активности мембранных ферментов (Болдырев, 2001), транспорте веществ
и катионов, окислительном фосфорилировании, связывании гормонов, проведении
нервного импульса (Таранова, 1988), регуляции матричной активности хроматина
(Прохорова, 1982). Фосфолипиды также влияют на функционирование рецепторов,
могут регулировать их число (Кучеренко, Васильев, 1985), взаимодействовать с
токсинами.
Интенсивность обновления фосфолипидов зависит от скорости
синтеза ДНК в клетке. Такие фракции фосфолипидов, как фосфатидилэтаноламины,
кардиолипины дестабилизируют молекулы ДНК путем усиления активности ДНК -
полимеразы. Фосфолипиды влияют на прочность ДНК (стабилизацию структуры). Все
эти данные (Кучеренко, Васильев, 1985) свидетельствуют о важной регуляторной
роли фосфолипидов мембран, составной частью которых являются ненасыщенные жирные
кислоты.
На долю фосфолипидов и холестерина в мембране приходится 40
%, а 60 % составляют белки (Сидоров, 1983). К фосфолипидам относятся -
фосфатидилэтаноламин, фосфатидилсерин, кардиолипин, а также глико- и
сфинглолипиды и стерины (Болдырев, 2001). Главный фосфолипид большинства типов
животных - это фосфатидилхолин. Его содержание составляет не менее 50 % от
суммы фосфолипидов (Васьковский, 1997).
При стрессовых ситуациях или под влиянием токсиканта в
мембранах могут накапливаться минорные фосфолипиды: сульфолипиды,
фосфатидилглицерин, фосфатидная кислота, плазмалогены, диольные липиды,
лизофосфолипиды и др. (Сидоров, 1983).
Важнейшим компонентом большинства липидов являются жирные
кислоты. Жирные кислоты в свободном состоянии редко встречаются в составе
мембран. Они являются важным фактором регулирования проницаемости мембран
(влияют на поверхностные свойства фосфолипидов, белок - липидные и липид -
липидные взаимодействия), функционирования мембранно-связанных ферментов (Богач
и др., 1981). Рыбы отличаются высоким содержанием n-3 полиненасыщенных
жирных кислот. Фосфолипиды богаты полиненасыщенными с длинной цепочкой жирными
кислотами, из которых 20: 5 и 22: 6 (n - 3) превалируют (Corraze, Kaushik, 1999).
Холестерин является важным компонентом плазматической
мембраны, этот стерин оказывает воздействие на мембранные белки,
функционирующие в качестве ионных каналов, транспортеров или рецепторов (Bastiaanse et al., 1997). Свободный
холестерин и его эфиры встречаются в организме в нормальных условиях, лишь в небольшом
количестве (Крепс, 1981; Прохорова, 1982). Эфиры холестерина называются
холестеридами. Около 90% холестерина содержится в органах, а остальная часть -
в тканевых жидкостях, из которых приблизительно 8 % приходится на кровь. В
тканях, синтезирующих стероидные гормоны, и плазме крови количественно (70 - 80
%) преобладает эстерифицированный холестерин. В остальных органах и тканях до
80 % общего количества составляет свободный холестерин (Гурин, 1986).
Синтез холестерина протекает в митохондриях (печени, коре
надпочечников, легких, почках, сердце, селезенке, мышцах, жировой ткани, стенке
пищевода, желудке, кишечнике, коже) (Гурин, 1986), а фосфолипидов - как в
митохондриях, так и в эндоплазматическом ретикулуме, откуда они по мере
надобности транспортируются в другие органеллы (Болдырев, 2001). В мышцах и
почках животных содержится не более 0,4 % холестерина, больше его в тканях
мозга (1,5 - 1,8 %) и особенно в надпочечниках (5,0 - 7,5 %). У рыб наиболее
высокое содержание холестерина обнаружено в икре (290 - 2200 мг %) и молоках
(250 - 320 мг %); в мясе морских костистых рыб содержится 20 - 95 мг %
холестерина (Кизеветтер, 1973).
Включение холестерина в мембрану влияет на многие ее свойства
- на жидкостность, плотность упаковки липидных молекул в гидрофобной фазе
мембраны, на проницаемость для ионов и молекул. Высокие концентрации
холестерина оказывают влияние на мембранные функции, такие как пассивный
транспорт и т.п. Таким образом, холестерин выполняет динамическую функцию в
биологических мембранах (Крепс, 1981). Холестерин, не обладая антирадикальной
активностью, проявляет свойства структурного антиоксиданта. Встраиваясь в
мембранах, он ограничивает подвижность жирнокислотных остатков фосфолипидов
(Гурин, 1986), снижая их доступность для свободнорадикальной атаки (Момыналиев
и др., 1996).
При патологических состояниях содержание холестерина часто
возрастает, вызывая гиперхолестеринемию, отчетливо проявляющуюся при сердечно -
сосудистых заболеваниях и, прежде всего при атеросклерозе, желтухе, гепатите, циррозе
печени, нефрозе, уремии, раке, а также при эндокринных заболеваниях, таких как
- микседема, кретинизм, диабет, авитаминозы. Гипохолестеринемия наблюдается при
следующих заболеваниях - базедова болезнь, шизофрения, злокачественная анемия
(Прохорова, 1982).
Проблема патологии, связанная с усилением процессов
свободнорадикального окисления в организме, остается одной из актуальных в
теоретической и практической медицине (Шепелев и др., 2000).
Липопротеиды - сложные комплексные
соединения сыворотки крови, предназначенные для переноса липидов с периферии в
органы и в обратном направлении. У человека, животных, в том числе и рыб, этот
процесс связан с макромолекулярными комплексами - липопротеидами, которые
наиболее тщательно изучены на человеке, в связи со свойственной ему
сердечнососудистой патологией (атеросклероз коронарных и мозговых сосудов). К
настоящему времени достаточно точно известно, что липопротеиды низкой плотности
человека доставляют к стенкам кровеносных сосудов экзогенный холестерин, и если
эти частицы (особенно модифицированные, например, липидными перекисями) выше
нормы обогащены эфирами холестерина, то происходит не рецепторный захват ими
холестерина и доставка его к стенкам кровеносных сосудов, где образуются
специфические бляшки. Эта группа липопротеидов называется атерогенными.
Наоборот, липопротеиды высокой плотности (ЛПВП), синтезирующиеся в печени и
крови, как правило, снимают холестерин со стенок кровеносных сосудов и
переносят его в печень для последующей переработки в желчные кислоты и удаления
его из организма. Липопротеиды высокой плотности называют антиатерогенными. У
здоровых людей содержание в крови липопротеидов низкой плотности (ЛПНП) и
липопротеиды высокой плотности имеет довольно близкие величины, что приводит к
установлению в организме человека баланса холестерина.
Довольно многообразное и глубокое изучение
липопротеидов проделано на человеке, домашних животных, особенно хороших
моделях атеросклероза (кролик), однако имеются целые классы животных,
липопротеиды которых почти не изучены в силу целого ряда причин: трудоемкости
методов выделения липопротеидов, затруднений в получении и доставке самого
животного и др.
1.3
Липопротеиды крови осетровых (Аcipenseridae) рыб
Липопротеиды осетровых рыб изучены слабо.
Фактически по составу липопротеидов осетровых информации нет. Совершенно
неизвестно, например, какой объем в разные периоды созревания половых продуктов
занимают липопротеиды низкой плотности и липопротеиды высокой плотности в общем
пуле липопротеидов. Неизвестно распределение многих липидных компонентов в
каждом липопротеидном классе. Не ясна роль каждого класса липопротеидов: в
какой степени свойственны им те же функции, что и липопротеидам человека, или у
рыб, в частности осетровых, липопротеидные комплексы выполняют и другие задачи.
Неизвестно насколько каждый класс липопротеидов, содержащих холестерин, может
оказать отрицательное воздействие на сосуды.
Характерной особенностью осетровых рыб
можно считать высокое содержание общих липидов, уровень которых в сыворотке колебался
у осетров от 1200 до 1500, а у белуги от 900 до 1300мг/дл. Фосфолипиды и
триацилглицерины были основными компонентами сыворотки, свободного холестерина
обнаружено очень мало, а связанный холестерин в общих липидах сыворотки
составил только 1/6 у осетров и 1/4 у белуги (табл.1). Если сравнивать с
человеком или некоторыми млекопитающими, то сыворотка крови осетровых
"насыщена" триацилглицеринами и фосфолипидами, тогда как пул
суммарного холестерина у этих рыб исключительно низок. Аналогичная закономерность
прослежена на органах осетровых, в липидах которых тоже очень мало свободного и
связанного холестерина (Лизенко и др., 1991).
Наиболее "мощной" фракцией
непосредственно в фосфолипидах сыворотки является фосфатидилхолин (лецитин),
уровень которого колеблется в пределах 73 - 76%. Половые различия отчетливо
проявляются только в сыворотке крови, где самки имели достоверно более высокую
концентрацию триацилглицеринов и меньшее количество фосфолипидов, а в них
лецитина.
По сравнению с сывороткой, уровень липидов
в липопротеидах низкой плотности обоих представителей осетровых был невысоким
(табл.1). Липопротеиды низкой плотности составляли только 1/4 - 1/6 всех
липидов сыворотки, причем соотношение в них липидных компонентов оставалось
таким же, что и в сыворотке: основная доля принадлежала фосфолипидам, а в них
лецитину, и триацилглицеринам, тогда как концентрация суммарного холестерина не
превышала 50 мг/дл. Учитывая общий пул липидов липопротеиды низкой плотности
осетра и белуги, особенно на высоком фоне липидов сыворотки, можно
предположить, что данный класс липопротеидов осетровых не является абсолютно
идентичным таковому человека, во всяком случае, в количественном отношении.
Если даже эта группа липопротеидов и выполняет
Таблица 1.
Липидный состав сыворотки и липопротеидов низкой
плотности осетровых, мг/дл (Лизенко и др., 1995)
|
Показатель
|
Осетр
|
Белуга
|
|
самцы, п = 12
|
самки, п = 8
|
самцы, п = 8
|
самки, п = 2
|
|
Общие липиды
|
1376,7 ±87,5
190,3 ±16,5
|
1410,0 + 91,0
230,0 ±18,0
|
1078,0 ±115,0
201,0 ±16,0
|
1130,0 205,0
|
|
Фосфолипиды
|
581,0 ±34,7
73,6 ±10,5
|
500,4 ± 33,6
95,7 ±8,9
|
432,0 ±37,0
77,0 ±4,5
|
412,4 82,6
|
|
Триацил-глицерины
|
571,3 + 50,0
84,1 ± 13,0
|
679,6 ±64,1
105,8 ±8,5
|
438,0 ±33,0
82,6 ± 5,7
|
465,5 86,7
|
|
Холестерин
|
34,4 ±9,8 4,6
± 0,3
|
42,3 ±6,0 4,6
+ 0,7
|
30,8 ± 6,0 6,2
± 0,5
|
38,4 7,3
|
|
Эфиры
холестерина
|
190,0+15,8
28,0 ±2,7
|
185,7 ±16,2
23,2 ±2,8
|
177,2 ±23,0
35,2 ±5,0
|
213,7 28,4
|
|
Суммарный
холестерин
|
224,4 ±18,5
32,6 ±3,0
|
228,0 ± 19,0
28,5 ±5,5
|
208,0 ± 28,0
41,4 ±8,5
|
252,1 35,7
|
|
Лизолецитин
|
25,6 ±3,4 3,1
±0,3
|
20,0 ±3,3 4,0
±0,5
|
16,4 ±2,8 4,5
± 0,7
|
12,4 2,0
|
|
Сфингомиелин
|
54,6 ±6,4 6,2 ±
0,6
|
45,1 ±5,3 7,7 +
0,7
|
38,3 ±7,0 6,5 ±
0,4
|
34,2 6,8
|
|
Фосфатидил-холин
|
443,9 ±43,5
50,9 ± 6,0
|
384,0 ±44,0
75,6 ±8,0
|
330,0 ±45,0
55,8 ±6,8
|
313,8 65,2
|
|
Фосфатидил-этаноламин
|
33,7 + 5,4 4,1
±0,7
|
31,3 + 4,9 4,3
± 0,5
|
32,0 ±6,0 6,5
± 0,5
|
30,1 5,9
|
|
Фосфатидная
кислота
|
23,2 ± 2,8 2,3
± 0,9
|
20,0 + 2,5 4,6
± 0,4
|
15,5 ±2,6 3,7
± 0,4
|
21,9 2,7
|
Примечание: над чертой - сыворотка, под
чертой - липопротеиды низкой плотности.
какие-то сходные с человеком функции
(доставляет триацилглицерины и холестерин в органы), то участие их в этом
процессе незначительное или намного меньшее, чем у человека. Скорее всего,
доставка в органы триацилглицеринов, а особенно холестерина, которого очень
мало в липопротеиды низкой плотности, производится другими классами
липопротеидов.
Таблица 2.
Липидный состав липопротеидов высокой плотности
осетровых, мг/дл (Лизенко и др., 1995)
|
Показатель
|
Осетр
|
Белуга
|
|
|
самцы, п = 12
|
самки, п = 8
|
самцы, п = 11
|
самки, п = 2
|
|
Общие липиды
|
803,0 ± 23,0
317,7 ± 45,0
|
813,0 ± 26,2
340,0 ± 51,0
|
600,0 ± 73,3
150,0 ± 28,0
|
660,0 225,0
|
|
Фосфолипиды
|
338,0 ± 19,4
137,2 ± 18,7
|
258,5 ± 18,9
134,2 ±19,0
|
241,2 ± 26,1
70,1 ± 13,0
|
227,0 101,3
|
|
Триацилглицерины
|
329,2 ± 19,9
120,7 ± 29,5
|
460,2 ± 19,5
71,4 ± 15,4
|
249,6 ± 28,0
46,1 ± 9,5
|
312,2 45,9
|
|
Холестерин
|
28,8 ± 3,2
10,5 ± 1,7
|
16,3 ± 1,8
21,1 ± 2,2
|
20,4 ± 3,4
7,5± 3-2
|
20,5 17,8
|
|
Эфиры
холестерина
|
106,8 ± 11,3
49,3 ± 10,2
|
78,0 ± 6,8
113,3 ± 12,3
|
88,8 ± 16,3
26,3 ± 4 7,3
|
100,3 60,0
|
|
Суммарный
холестерин
|
135,7 ± 10,1
58,9 ± 11,5
|
94,3 ± 9,7
134,3 ± 21,2
|
109,2 ± 17,0
33,8 ± 8,5
|
120,3 77,8
|
|
Лизолецитин
|
16,9 ± 1,9 5,5
± 0,7
|
9,8 ± 2,3 5,6
± 0,8
|
7,9 ± 1,2 3,6
± 0,3
|
4,5 4,9
|
|
Сфингомиелин
|
31,4 ± 4,2
11,3 ± 0,9
|
18,4 ± 3,5
10,2 ± 1,0
|
20,3 ± 3,3 6,3
± 0,5
|
17,3 7,6
|
|
Фосфатидилхолин
|
260,3 ± 21,3
105,6 ± 16,2
|
210,4 ± 18,0
103,4 ± 13,0
|
187,6 ± 17,0
50,2 ± 5,0
|
184,8 80,0
|
|
Фосфатидилэтаноламин
|
20,3 ± 2,5 8,4
± 0,7
|
11,0 ± 1,1 9,5
± 0,8
|
15,0 ± 1,0 5,9
± 0,6
|
12,0 6,3
|
|
Фосфатидная
кислота
|
9,2 ± 0,8 6,4
± 0,9
|
8,9 ± 0,6 5,6
± 0,7
|
11,4 ± 1,2 4,1
± 0,4
|
8,4 2,5
|
Примечание: над чертой - ЛПВП2, под чертой
- ЛПВП3.
Совершенно иную картину представляют
липопротеиды высокой плотности (ЛПВП) осетровых, среди которых особенно
выделяется класс ЛПВП2 (табл.2). Концентрация ЛПВП2 в три - четыре раза,
превосходит липопротеиды низкой плотности и в три раза - ЛПВП3, составляя
наиболее "мощную" часть липопротеидов осетровых. В силу своего значительного
обмена именно в этой фракции липопротеидов сосредоточивается главное количество
фосфолипидов, прежде всего лецитина, триацилглицеринов. свободного и связанного
холестерина, т.е. тех компонентов, которые играют центральную роль в
формировании половых продуктов. Одни из этих веществ используются организмом в
качестве строительного и пластического материала (фосфолипиды, холестерин,
триацилглицерины), другие для синтеза половых гормонов. Не исключено, что не
только ЛПВП, но и ЛПВП3 принимают в этом существенное, участие, в какой то
степени дополняя друг друга. Отсюда можно сделать заключение, что именно ЛПВП у
осетровых выполняют транспортную функцию при созревании и формировании гонад,
ибо с их помощью триацилглицерины, лецитин, холестерин и другие минорные липидные
компоненты переносятся из органов и тканей в гонады.
В этой связи необходимо отметить, что
сходные особенности были отмечены у каспийской севрюги, где с помощью
электрофоретического разделения липопротеидов на ЛПОНП, ЛПНП и установлена
главенствующая роль ЛПВП, количество которых в три раза превосходило ЛПНП
(Баль, 1987). Аксенов В.П. и др. (1987 г.) тоже установили, что именно наиболее
"мощная" фракция - ЛПВП транспортируют холестерин во время нерестовой
миграции севрюги. Они обнаружили, что в течение полумесяца количество
холестерина в ЛПВП при нерестовых миграциях возрастало от 20 до 90%.
Приведенные примеры убедительно подтверждают особую значимость ЛПВП в
формировании половых продуктов осетровых, доставляя к ним из органов самые
необходимые вещества, хотя трудно без доказательств отрицать роль и ЛПНП в этом
процессе.
По данным Лизенко Е.И. и др. (1995 г.),
транспорт веществ, необходимых для полного и наиболее удачного формирования
икры и молок, присущ ЛПВП в силу их необычно высокого количества. Эта фракция
обладает особой чувствительностью в липопротеидах человека, так как четко
реагирует на многие патологии снижением содержания всех составляющих ее
компонентов.
Таблица 3.
Липидный состав ЛПНП и ЛПВП осетра (самцы), мг/дл
(Лизенко и др., 1995)
|
Показатель
|
ЛПНП
|
ЛПНП (ЛПВП2 + +
ЛПВП3)
|
|
осетр
|
белуга
|
осетр
|
белуга
|
|
Общие липиды
|
190,3,
|
201,0
|
1120,7
|
750,0
|
|
Фосфолипиды
|
73,6
|
77,0
|
475,3
|
З11, З
|
|
Триацилглицерины
|
84,0
|
82,6
|
449,9
|
295,7
|
|
Холестерин
|
4,6
|
6,2
|
39,4
|
27,9
|
|
Эфиры
холестерина
|
28,0
|
35,2
|
156,1
|
115,1
|
|
Суммарный
холестерин
|
32,6
|
41,4
|
195,5
|
143,0
|
|
Лизолецитин
|
3,1
|
4,5
|
22,4
|
11,5
|
|
Сфингомиелин
|
7,2
|
6,5
|
42,7
|
26,6
|
|
Лецитин
|
55,9
|
55,8
|
365,9
|
237,8
|
|
Фосфатидилэтаноламин
|
5,1
|
6,5
|
28,7
|
19,9
|
|
Фосфатидная
кислота
|
2,3
|
3,7
|
15,6
|
15,5
|
У осетровых объединенная фракция ЛПВП
почти в пять раз по объему превосходит ЛПНП (табл.3), причем в ней
сосредоточено не только основное количество фосфолипидов (лецитина), но и
триацилглицеринов и, главным образом, суммарного холестерина. ЛПНП человека
основной запас суммарного холестерина транспортируют к стенкам сосудов, тогда
как у осетровых в силу слишком малого суммарного объема холестерина в ЛПНП (в
четыре раза ниже, чем в ЛПВП) соответствующая нагрузка холестерина на сосуды из
ЛПНП исключается. Если, по аналогии с липопротеидами человека, относить ЛПВП
рыб к антиатерогенным, то можно предположить, что значительная часть
холестерина выводится ими из организма через печень. Однако наиболее вероятным
местом приложения, как это было сказано выше, являются половые продукты.
Пока остается неясным, в полной ли мере у
рыб такую же, как и у человека, функцию выполняют ЛПНП, в частности, не до
конца ясна их роль у осетровых, так как количество их представлено
незначительной величиной, по сравнению с ЛПВП.
Известно, например, что невысокий уровень
ЛПНП найден у карпа, лосося, сардины и других рыб (Babin, 1989). Вероятно, у рыб,
как и у млекопитающих и человека, ЛПНП транспортируют экзогенные липиды
(холестерин и триацилглицерины к стенкам сосудов и органам, но их участие в
этом транспорте невелико. И только фракция ЛПВП (как хорошо известно, по
исследованиям на человеке) формируется в печени и крови и несет на себе
основную не только выводящую из организма холестерина функцию, но и переносящую
структурные пластические вещества и холестерина из органов и тканей в
формирующиеся половые продукты.
Следует также отметить, что, возможно,
ЛПВП2 представляют собой чрезвычайно гетерогенную по размерам фракцию
липопротеидов и содержат значительную долю компонентов с типичными для ЛПНП
фрагментами, в том числе и апопротеинов, т.е. по выполняемым функциям
фактически являются ЛПНП. Такой вывод вытекает из литературных
сравнительно-эволюционных данных, которые показали, что в процессе эволюции от
рыб (сиг, лещ, налим) к млекопитающим размер липопротеидных частиц низкой плотности
увеличивается. Вполне вероятно, что у осетровых, более примитивных рыб,
истинные по составу апобелков ЛПНП имеют такой небольшой размер, что при
фракционировании (осаждении) попадают во фракцию ЛПВП (Регеранд и др., 1989;
Сидоров и др., 1994).
По мнению авторов более вероятным
предположением является первое, которое основано на том, что ЛПВП2 у рыб
выполняют функцию ЛПНП. Рядом авторов четко показано, что в ЛПВП2 форели и
лосося не обнаружены апобелки, типичные для ЛПНП (Лизенко и др., 1995; Chapman et al., 1978).
Все это говорит о том, что изучение именно
показателей липидного обмена в сыворотке крови рыб в связи с изменяющимися
факторами среды и влиянием таких ксенобиотиков, как тяжелые металлы,
представляет несомненный интерес.
Глава 2.
Экспериментальная часть
2.1 Объект
исследования
Материалом исследования послужили сеголетки карпа (Cyprinus Сarpio L.), достигшие 5 - 6
месяцев, весом 100 - 150 гр., отловленные в прудах Широкольского комбината
Тарумовского района РД перед их переброской в пруды для зимовки. Рыбокомбинат
занимает около 1,5 тыс. гектаров водной поверхности. Глубина прудов составляет
примерно 1,5 - 2 м., они снабжаются пресной водой из р. Сулак.
Выбор объекта исследования связан с тем, что карповые
обладают значительной устойчивостью к смене среды обитания, холоду и другим
неблагоприятным условиям жизни. Рыбы были перевезены в специальных мешочках с
кислородом из с. Юрковка Тарумовского района в г. Махачкала и помещены в
аквариумы объемом 250 - 300 литров по 15 - 20 штук в каждом. В течение месяца
они проходили адаптацию в условиях лаборатории.
2.2
Постановка эксперимента
Сеголетки карпа были распределены на три группы, которые
содержались в разных аквариумах:
- контроль (интактные рыбы, которые содержались в чистой
воде);
- опытная группа (в аквариумы добавляли раствор ацетата
свинца расчета 0,5 мг/ дм3) (ПДК - 0,1 мг/дм3);
- опытная группа (в аквариумы добавляли раствор сульфат
марганца из расчета 0,1 мг/ дм3) (ПДК - 0,01 мг/дм3) (Минина, 2003; Волошина,
2006).
В аквариумах создавались условия постоянного температурного (t 19-210C) и газового режима.
Биохимические анализы проводили на 5, 15, 30 и 40 дни эксперимента по
следующему показателю динамика общих липидов и
общего холестерина в сыворотке сеголеток карпа в норме и при хронической
интоксикации ионами марганца и свинца.
2.2.1
Методика определения содержания общих липидов в сыворотке крови (Chromy et al.,
1975)
Набор реактивов для приготовления 290 мл рабочего раствора
для определения общих липидов в сыворотке крови. Объем достаточен для 180
анализов.
Принцип метода:
Ненасыщенные липиды и жирные кислоты, фосфолипиды и
холестерин взаимодействуют после гидролиза серной кислоты с фосфованилиновым
реактивом с образованием красного окрашивания.
Реактивы:
. Стандартный раствор (8 мл)
общие липиды 8 г/л
. Раствор ванилина (290 мл)
ванилин 10 ммоль/л, кислота ортофосфорная 11,5 моль/л
Состав реакционной смеси:
Ванилин 9,4 ммоль/л
Кислота ортофосфорная 10,8 ммоль/л
Кислота серная 1,1 моль/л
Соотношение сыворотка/реакционная смесь 1/1230
Референтные величины:
(нтБ) С - Общие липиды, (г / л) 4-8
Приведенный диапазон референтных значений является
ориентировочным.
Воспроизводимость:
Около ± 5%
Вспомогательный раствор (не входит в состав набора)
Кислота серная конц., ч. д. а.
Длина волны (510-550) нм
Кювета 1 см
Температура (+15 до +25)°С
В трех пробирках смешивают серную кислоту конц., ч. д. а. в
соотношении 75+1 с сывороткой (проба), реактивом 1 (стандарт) или
дистиллированной водой (контрольный раствор), перемещивают и нагревают 15 мин
на кипящей водяной бане (напр.1,5 мл серной кислоты конц. ч. д. а. и 0,02 мл
сыворотки, реактив 1 или дистиллированной воды). После охлаждения пробирок
проточной водой смешивают гидролизат с реактивом 2 в объемном соотношении 1+15
и оставляют стоять 50 мин при температуре (с +15 до +25)°С (напр.0,1 мл
гидролизата пробы, стандарта или контрольного раствора и 1,5 мл реактива 2). Не
позднее чем через 60 мин измеряют оптическую плотность пробы (А1) и стандарта
(А2) против контрольного раствора.
|
Отмерить (мл)
|
Проба
|
Стандарт
|
Контрольный
раствор
|
|
Сыворотка
Реактив 1 Кислота серная конц.
|
0,02 1,50
|
- 0,02 1,50
|
- 1,50
|
|
Перемешивают и
нагревают 15 мин на кипящей водяной бане. После охлаждения пробирок проточной
водой отмеряют
|
|
Гидролизат
Реактив 2
|
0,10 1,50
|
0,10 1,50
|
0,10 1,50
|
|
Перемешивают и
оставляют стоять 50 мин при (+15 до +25)°С. Не позднее чем через 60 мин
измеряют оптическую плотность пробы (А1) и стандарта (А2) против контрольного
раствора
|
Расчет:
Общие липиды (г/л) = 8 × А1/А2
2.2.2 Методика
определения содержания общего холестерина в сыворотке крови (Fishbach, Dunning,
2004)
Набор реагентов для определения концентрации общего
холестерина в сыворотке и плазме крови энзиматическим колориметрическим
методом.
Принцип метода:
Холестерин из состава эфиров высвобождается под действием
фермента холестеринэстеразы (ХЭ). При участии фермента холестериноксидазы (ХО)
холестерин окисляется до 4-холестен-3-она. Освобождающаяся перекись водорода,
при участии фермента пероксидазы, способствует окислительному азосочетанию 4 -
аминоантипирина (4-ААП) и фенола с образованием окрашенного соединения
(хинониминовый краситель). Интенсивность окраски реакционной среды
пропорциональна содержанию холестерина в исследуемом материале и определяется
фотометрически при длине волны 500 (490-520) нм.
Схема реакции:
Эфиры холестерина + Н2О 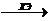 холестерин + жирные кислоты
холестерин + жирные кислоты
Холестерин + О2 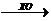 4-холестен-3-он + Н2О2
4-холестен-3-он + Н2О2
Н2О2 + 4-ААП + фенол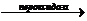 хинониминовый краситель + 4 Н2О
хинониминовый краситель + 4 Н2О
Исследуемый материал:
Сыворотка, гепаринизированная или ЭДТА-плазма крови без следов
гемолиза.
Проба стабильная 7 дней при температуре 2-8˚С.
Состав набора:
Монореагент (250 мл)
Калибратор - раствор холестерина 5,17 ммоль/л (1,5 мл)
Подготовка реагентов к процедуре анализа и их стабильность:
Монореагент готов к применению; после вскрытия флакона монореагент
стабилен не менее 6 месяцев при температуре 2-8 ˚С в защищенном от света
месте. Тщательно закрывать флакон с монореагентом после каждого использования.
Бледно-розовая окраска монореагента с величиной оптической плотности до 0, 200
А, измеренной против дистиллированной водой при длине волны 500 нм, не влияет
на правильность определения холестерина в исследуемом образце.
Калибратор готов к применению; после вскрытия флакона калибратор
стабилен не менее 6 месяцев при температуре 2-8 ˚С.
Невскрытые реагенты стабильны в течение года при температуре 2-8 ˚С,
монореагент в защищенном от света месте.
Процедура анализа:
|
Компоненты
реакционной смеси
|
Опытная проба
|
Калибровочная
проба
|
Контрольная
проба
|
|
Монореагент, мл
|
2,0
|
2,0
|
2,0
|
|
Сыворотка
(плазма), мл
|
0,02
|
-
|
-
|
|
Калибратор, мл
|
-
|
0,02
|
-
|
|
Вода дистилл.,
мл
|
-
|
-
|
0,02
|
Реакционную смесь тщательно перемешайте и инкубируйте не
менее 15 минут при комнатной температуре (18-25 ˚С) или 10 минут при
температуре 37˚С. После окончания инкубации измерьте оптическую плотность
опытной и калибровочной проб против контрольной (холостой) пробы при длине
волны 500 нм (490-540 нм). Окраска растворов стабильна в течение 1 часа после
окончания инкубации при хранении проб в защищенном от света месте при комнатной
температуре. Объемы исследуемого образца и монореагента можно изменить,
соблюдая соотношение 1: 100.
Автоматические анализаторы:
Длина волны 500 нм
Измерение против Контрольной
пробы
Метод измерения Конечная
точка
Изменение оптической плотности Возраст
Температура 37 ˚С
Соотношение образец/реагент 1: 100
Время преинкубации 3 секунды
Время реакции 600
секунд
Предел абсорбции контрольной пробы 0, 200 А
Предел максимальной абсорбции 2,000 А
Калибратор 5,17
ммоль / л
Линейность 0,5-25,8
ммоль / л
Расчет концентрации холестерина (С, моль / л) проведите по
формуле:
С= 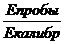 × 5,17 ммоль / л,
× 5,17 ммоль / л,
где Е пробы - ед. опт. плотность исследуемой пробы
Е калибр. - ед. опт. плотность калибровочной пробы
,17 ммоль / л - концентрация холестерина в калибраторе
Аналитические характеристики:
Линейность - 0,5-25,8 ммоль /л
Коэффициент вариации - не менее 5 %.
2.3
Вариационно-статистическая обработка результатов
Полученные данные подвергали вариационно-статистической
обработке по методу малой выборки (Лакин, 1990).
При определении степени различия средних арифметических двух
сравниваемых вариационных рядов вычисляли показатели существенности разницы t.
Затем на основании t по таблице Стьюдента определяли вероятность
различия p.
При р<0,05 различие оценивается как достоверное (вероятность различия более
95%).
Корреляционный анализ проводили с помощью компьютерной
программы "Statistica 5.0".
Построение диаграмм осуществлено при помощи пакета Excel 7.0.
Глава 3.
Результаты исследования и их обсуждение
Полученные материалы представлены в таблице 4 и на рис.1.
Как видно из таблицы 1 содержание общих липидов и общего
холестерина в сыворотке крови в норме у сеголеток карпа составляет 3,96±0,18
г/л и 7,94±0,06 ммоль/л соответственно. Эти данные находятся в соответствии с
литературными (Лизенко и др., 1995; Васильева и др., 2004; Пустовит, Пустовит,
2005; Силкина, Микряков, 2005).
Таблица 4.
Содержание общего холестерина и общих липидов в сыворотке
крови сеголеток карпа при хронической интоксикации ацетатом свинца и сульфатом
марганца (М ± m,
n = 10)
|
Дни Экспозиции
|
Общий
холестерин, ммоль/л
|
Общие липиды,
г/л
|
|
Ацетат свинца,
0,5 мг/л
|
Сульфат
марганца, 0,1 мг/л
|
Ацетат свинца,
0,5 мг/л
|
Сульфат
марганца, 0,1 мг/л
|
|
контроль
|
7,94±0,06
|
3,96±0,18
|
|
5 сутки
|
8,29±0, 19
P<0,1
|
4,37±0,23
P<0,001
|
4,81±0, 20
P<0,02
|
6,25±0,24
P<0,001
|
|
15 сутки
|
7,52±0,46
P>0,1
|
3,11±0,17
P<0,001
|
3,35±0,17
P<0,02
|
7,28±0,18
P<0,001
|
|
30 сутки
|
2,66±0,18
P<0,001
|
14,83±0,18
P<0,001
|
4,49±0,11
P<0,01
|
5,64±0,12
P>0,01
|
|
40 сутки
|
9,41±0,07
P<0,001
|
12,18±0,09
P<0,001
|
6,49±0,48
P<0,1
|
4,89±0,22
P<0,02
|
Р - степень достоверности результата по отношению к контролю
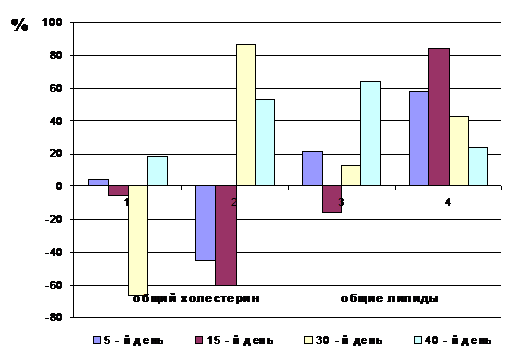
Рис.1. Динамика изменения содержания общего холестерина и
общих липидов (в % по отношению к контролю) в сыворотке крови сеголеток карпа
при хроническом воздействии тяжелых металлов: 1, 3 - ацетат свинца; 2, 4 -
сульфат марганца.
На начальных этапах интоксикации сеголеток карпа (5 сутки) в
водной среде с ионами свинца наблюдается повышение содержания общих липидов в
сыворотке крови на 4,41 и 21,46 % по сравнению с контролем. При выдерживании
рыб в токсической среде с ионами марганца наблюдается снижение содержания
общего холестерина в сыворотке крови на 44,96 % на фоне повышения содержания
общих липидов на 57,83% по сравнению с контролем (табл.4, рис.1).
При экспозиции рыб в водной среде с ацетатом свинца до 15
суток наблюдается снижение концентрации общего холестерина и общих липидов в
сыворотке крови сеголеток карпа на 5,29 и 15,4 % соответственно; а под влиянием
ионов марганца уровень общего холестерина в сыворотке крови карпа падает на
60,83% на фоне повышения общих липидов на 83,84% по сравнению с контролем
(табл.4, рис.1).
Дальнейшее пролонгирование интоксикации карпа в водной среде
с ионами марганца до 30 суток приводит к росту содержания общего холестерина и
общих липидов в сыворотке крови на 86,78 и 42,42% соответственно, что,
вероятно, связано с мобилизацией липидов для энергозатрат, необходимых для
процессов адаптации (Мусаев и др., 2008). При воздействии ионами свинца
содержание холестерина снижается на 66,49% при одновременном росте общих липидов
на 13,38% по сравнению с контролем (табл.4, рис.1).
В опыте Силкина Н.И. и Микрякова В.Р. (2005 г.) по изучению
влияния сублетальных концентраций ионов кадмия на некоторые показатели
липидного обмена рыб были установлены изменения в системе липидного метаболизма
и окислительного гомеостаза у рыб, сопровождающиеся перераспределением
качественного состава липидов в сыворотке крови и печени. В сыворотке крови на
первом этапе опыта содержание структурных фосфолипидов повысилось, а к концу
эксперимента - снизилось; уровень запасных энергетических триацилглицеринов и
неэстерифицированных жирных кислот на протяжении опыта превышал норму, а эфиров
стеринов - был ниже нормы; содержание холестерина превышало контроль на 21 и 28
сутки. В печени опытных рыб содержание фосфолипидов с 7 суток до конца
эксперимента было ниже контроля; уровень триацилглицеринов на 7 и 14 сутки
превысил контроль, а затем понизился, причем, минимум отмечен на 28 сутки;
содержание холестерина и неэстерифицированных жирных кислот было повышенным во
все сроки наблюдения; эфиров стеринов на 7, 14 и 21 сутки - понижались.
Ответная реакция организма на токсическое воздействие кадмия на уровне
липидного метаболизма тканей рыб реализуется через понижение фосфолипидов и
триацилглицеринов и нарастание неэстерифицированных жирных кислот и
холестерина. Изменения содержания холестерина в биомембране изменяют ее
микровязкость, что отражается на активности мембранных ферментов и
липидпереносящих белков. Повышение содержания холестерина может быть обусловлено
интенсификацией образования гормонов стресса интерреналовыми клетками
надпочечников, поскольку холестерин служит общим предшественником стероидных
гормонов. Изменения в содержании неэстерифицированных жирных кислот в крови
отражает реакцию рыб на стрессор. Снижение запасных триацилглицеринов
свидетельствует о повышенных энергетических затратах организмом опытных рыб на
метаболизм. Колебания уровня фосфолипидов, осуществляющих в клетке барьерную
функцию, отражаются на структурной организации мембран.
На 40 сутки экспозиции рыб в водной среде с ионами обоих
тяжелых металлов повышается содержание общего холестерина и общих липидов на
18,51 и 63,89% (ионы свинца) и на 53,40 и 23,48% (ионы марганца) соответственно
по сравнению с контролем (табл.4, рис.1).
На основании полученных нами данных можно заключить, что
изменение некоторых биохимических показателей крови рыб в зависимости от
продолжительности интоксикации ионами марганца и свинца носит разнонаправленный
характер. Так, снижение содержания общего холестерина в крови рыб на 5 и 15
сутки эксперимента и дальнейшее его повышение к 30 и 40 дню (при интоксикации
ионами марганца), связано с его высокой лабильностью и способностью
мобилизоваться из тканей и жидкостей внутренней среды или, наоборот,
поглощаться тканями в зависимости от стрессовой реакции организма на действие
токсиканта. При этом значительное повышение содержание общих липидов в
сыворотке крови рыб на начальных этапах интоксикации под влияние ионов марганца
и свинца, может быть связано с их мобилизацией из тканей в результате
развивающихся в них деструктивных процессов при действии ионов тяжелых
металлов.
Отмеченные отклонения состава липидов являются ответной
реакцией организма карпов на загрязнение. Полученные данные позволяют выдвинуть
положение, что изменения в системе липидного метаболизма и окислительного
гомеостаза у рыб под воздействием ионов свинца и марганца отражают характер
течения патологических процессов в организме.
Выявленные изменения, происходящие в условиях хронического
воздействия ионов свинца и марганца, свидетельствуют об активации деструктивных
процессов в липидном обмене и снижении адаптивного потенциала.
Таким образом, изученные нами биохимические показатели крови
рыб могут служить важным тест - индикатором здоровья гидробионтов и необходимы
для мониторинга экологического состояния водных экосистем в целом.
Выводы
1. Содержание общих липидов и общего холестерина в
сыворотке крови в норме у сеголеток карпа составляет 3,96±0,18 г/л и 7,94±0,06
ммоль/л соответственно.
2. На 5 сутки интоксикации карпа в водной среде с
ионами свинца наблюдается рост содержания общих липидов в сыворотке крови на
4,41 и 21,46 %, тогда как под влиянием ионов марганца наблюдается снижение
общего холестерина на 44,96 % на фоне повышения содержания общих липидов на
57,83% по сравнению с контролем.
3. На 15 сутки экспозиции рыб в водной среде с
ионами свинца наблюдается снижение концентрации общего холестерина и общих
липидов в сыворотке крови сеголеток карпа на 5,29 и 15,4 % соответственно; а
под влиянием ионов марганца уровень общего холестерина в сыворотке крови карпа
падает на 60,83% на фоне повышения общих липидов на 83,84% по сравнению с
контролем.
4. Дальнейшее пролонгирование интоксикации карпа в
водной среде с ионами марганца до 30 суток приводит к росту содержания общего
холестерина и общих липидов в сыворотке крови на 86,78 и 42,42% соответственно.
При воздействии ионами свинца содержание холестерина снижается на 66,49% при
одновременном росте общих липидов на 13,38% по сравнению с контролем.
Литература
1. Азарин
К.В. Тяжелые металлы как экотоксиканты и генераторы окислительного стресса /
Второй Санкт-Петербургский Междунар. экологический форум "Окружающая среда
и здоровье человека" / Конгресс "Экотоксиканты и здоровье
человека" // Вестник Российской военной академии, Приложение 2. - 3. - 23.
- 2008. - С.62-63.
2. Аксенов
В.П., Гераскин П.П., Горбанев Е.А. Содержание холестерина в крови самок севрюги
в период нерестовой миграции / Тез. докл.1-го симпоз. по эколог, биохимии рыб.
- Ярославль, 1987. - С.5-6.
. Аксенова
М.Е. Тяжелые металлы: механизмы нефротоксичности / РДО, Материалы, журнал,
2000. - С.1-2.
. Баль
Н.В. Фракционный состав липопротеидов сыворотки крови каспийской севрюги / Тез.
докл.1-го симпоз. по экологии, биохимии рыб. - Ярославль, 1987. - С. 20-21.
. Богач
П.Г., Курский М.Д., Кучеренко Н.Е., Рыбальченко В.К. Структура и функция
биологических мембран. - Киев: Высшая школа, 1981. - 336 с.
. Болдырев
А.А. Матриксная функция биологических мембран // Соросовский образоват. журн.
Биология. - 2001. - Т.7. - № 7. - С.2-8.
. Будников
Г.К. Тяжелые металлы в экологическом мониторинге водных систем // Соросовский
образоват. журн. Биология. - 1998. - Т.7. - №4. - С.21-28.
. Васильева
О.Б., Лизенко Е.И., Регеранд Т.И., Юровицкий Ю.Г., Сидоров В.С. Биохимические
особенности липидного состава липопротеидов у рыб разной экологии: форели Salmo
Iriseush. и сига Coregonus Lavaretus L. // Изв. АН. Сер. Биол. - 2004. - № 4. -
С.146-149.
. Васьковский
В.Е. Липиды // Соросовский образоват. журн. Биология. - 1997. - №3. - С.32-37.
. Волошина
Г.В. Экологическая оценка состояния поверхностных вод реки Понура // Эколог.
вест. Север. Кавказа. - 2006. - Т.2. - № 1. - С.118-122.
. Воробьев
Д.В. Функциональные особенности метаболизма металлов у рыб в современных
биогеохимических условиях дельты р. Волги // Автореферат диссертации на
соискание ученой степени канд. биол. наук. - Астрахань, 2008. - 22 с.
. Гершанович
А.Д., Лапин В.И., Шатуновский М.И. Особенности обмена липидов у рыб // Успехи
современной биологии. - 1991. - Т.111. - №2. - С. 207-217.
. Грубен
О.М. Взаимосвязь функционирования системы гемоглобина и перекисного окисления
липидов в крови карпа при интоксикации / Докл. Нац. АН Украина. - 1997. - № 2.
- С.146 - 150.
. Гурин
В.Н. Обмен липидов при гипотермии, гипертермии и лихорадке. - Минск: Беларусь,
1986. - С. 190.
. Дмитриева
А.Г., Кожанова О.Н., Дронина Н.Л. 2002. Физиология растительных организмов и
роль металлов. - М.: Изд-во МГУ. - 160 с.
. Кашулин
Н. А, Лукин А.А., Амундсен П.А. 1999. Рыбы пресных вод субарктики как
биоиндикаторы техногенного загрязнения. - Апатиты: КНЦ РАН. - 142 с.
. Кизеветтер
И.В. Биохимия сырья водного происхождения. - М.: Пищевая промышленность, 1973.
- 345 с.
. Крепс
Е.М. Липиды клеточных мембран. - Л.: Наука, 1981. - 339 с.
. Кучеренко
Н.Е., Васильев А.Н. Липиды. - М.: Высшая школа, 1985. - 247 с.
. Кучер
Е.О., Шевчук М.К., Петров А.Н. Изучение влияния совместного введения марганца,
пирацетама и цитофлавина на когнитивные функции белых крыс / Второй
Санкт-Петербургский Междунар. экологический форум "Окружающая среда и
здоровье человека", конгресс "Экотоксиканты и здоровье человека"
// Вестник Российской военной академии, Приложение 2. - 3. - 23. - 2008. -
С.94-95.
. Лакин
Т.Б. Биометрия. - М.: "Высшая школа", 1990. - 352 с.
. Леус
Ю.В., Грубинко В.В. Перекисное окисление липидов и антиоксидантная защита у рыб
(Обзор) // Гидробиология. - 2001. - Т.37. - № 1. - С.64-78.
. Лизенко
Е.И., Сидоров В.С., Лукьяненко В.И., Регеранд Т.И., Гурьянова С.Д., Васильева
Т.С., Такшеев С.А. Общая характеристика липидного состава липопротеидов
сыворотки крови осетровых (Аcipenseridae) // Вопр. ихтиологии. - 1995. - Т.35.
- № 4. - С.553-557.
. Лизенко
Е.И., Загорских О.М., Соловьев Л.Г. Сравнительная характеристика липидного
состава органов енисейских и каспийских осетров // Биохимические особенности
болезней рыб. - Петрозаводск, 1991. - С.36 - 41.
. Лукин
А. А, Даувальтер В.А., Кашулин Н.А., Раткин Н.Е. Влияние аэротехногенного
загрязнения на водосборный бассейн озер Субарктики и рыб // Экология. - 1998. -
№ 2. - С.109-115.
. Методы
биохимических исследований. Учебное пособие под ред. проф. Прохоровой М.И. -
Л., 1982. - 272 с.
. Минина
Л.И. Методические указания к практикуму "Анализ объектов окружающей
среды". Определение массовой концентрации меди, свинца, кадмия в
поверхностных водах суши инверсионным вольтамперметрическим методом / Под
ред.Е.М. Цыганков. - Ростов-на-Дону, 2003. - 26 с.
. Момыналиев
К.Т., Говорун В.М., Панасенко О.М., Сергиенко В.И. Участие холестерина в
гипохлорид - индуцированном окислении холестерин-фосфатидилхолиновых липосом //
Бюллетень экспериментальной биологии и медицины. Биофизика и биохимия. - 1996.
- №5. - С.516-519.
. Мусаев
Б.С., Рабаданова А.И., Мурадова Г.Р. Влияние загрязнения водной среды ацетатом
свинца на белково-липидные компоненты печени и почек сеголеток карпа //
Токсикологический вестник. - 2008. - №4. - С.14-17.
. Пурмаль
А.П. Антропогенная токсикация планеты // Соросовский образоват. журн. Химия. -
1998. - № 9. - С.39-51.
. Пустовит
Н.С., Пустовит О.П. Некоторые гематологические показатели молоди Камчатсткой
микижи Parasalmo mykiss // Вопр. ихтиологии. - 2005. - Т.45. - № 5. -
С.680-688.
. Регеранд
Т.Ч. Липопротеиды сыворотки крови позвоночных животных // Биохимия экто - и
эндотермных организмов. - Петрозаводск, 1989. - С.27 - 53.
. Рипатти
П.О., Михайлова Н.В., Антонова В.В. Содержание жирных кислот в печени и мышцах
молоди озерного лосося Salmo salar morpha Sebago при некрозе плавников // Вопр.
ихтиологии. - 1996. - Т.36. - №1. - С.120-124.
. Самотуга
В.В., Малоног К.П., Бондаренко Ю.Г., Литвиченко О.М. Оцінка ризику для здоров‘я
населення в зв‘язку з викидами канцерогенних речовин автотранспортом //
Актуальные проблемы транспортной медицины. - 2006. - № 3. - 5. - С.118-122.
. Сидоров
В.С. Экологическая биохимия рыб. Липиды. - Л.: Наука, 1983. - 238 с.
. Силкина
Н.И., Микряков В.Р. Влияние сублетальных концентраций ионов кадмия на некоторые
показатели липидного обмена рыб // Мат-лы 3 науч. - практ. конф.
"Актуальные проблемы экологии Ярославской области". - Ярославль:
издание "ВВО РЭА". - 2005. - Вып.3. - Т.1. - С.284-288.
. Скальный,
А.В. Биоэлементология: основные понятия и термины (Текст): терминологический
словарь / А.В. Скальный, И.А. Рудаков, С.В. Нотова, В.В. Скальный, Т.И.
Бурцева, О.В. Баранова, С.Г. Губайдулина. - Оренбург: ГОУ ОГУ, 2005. - 50 с.
. Талакин
Ю.Н., Сергеева Л.А., Давыдова С.Ф., Пидоренко А.И. Гигиенические аспекты
содержания соединений тяжелых металлов в почве и воде: состояние проблемы,
перспективы дальнейших исследований (обзор) // Ж. Довкілля та здоров’я. - 2007.
- № 3. - С.13-19. К
. Таранова
Н.П. Липиды центральной нервной системы при повреждающих воздействиях. -
Ленинград: Наука, Ленинградское отд-ние, 1988. - С.158.
. Хуцишвили
М.Б., Рапорт С.И. Клиническая медицина. Лаборатория хрономедицины и клинических
проблем гастроэнтерологии" РАМН, М. - 2002. - №10. - С.10-16.
. Черкесова
Д.У., Магомедгаджиева Д.Н., Магомедов Т.П., Исуев А.Р. Реакция гидробионтов на
воздействие свинца / В сб. Материалы IV Ассамблеи Ассоциации Университетов
Прикаспийских государств. - Махачкала, 7-11 сентября, 1999. - С.218.
. Шепелев
А.П., Корниенко И.В., Шестопалов А.В., Антипов А.Ю. Роль процессов
свободнорадикального окисления в патогенезе инфекционных болезней // Вопр. мед.
химии. - 2000. - 46. - №2. - С.100-116.
43. Bahin
J. M. V. Plasma lipoproteins in fish // J. Lipid Res. - 1989. - V.30. - № 4. -
P.467-484.
44. Bastiaanse
E. M. Lars Hőld Karin M., Van Der Laarse Arnoud. The effects of membrane
cholesterol content on ion transport processes in plasma membranes // Cardiov. Pes. - 1997. - 33. - №2. - P.272-283.
45. Brooks
R. R. Geobotany and Biogeochemistry in Mineral Exploration. Harper and Row // New York. - 1972. -
4. - 412 p.
46. Chapman
MJ., Goldstein S., Mills G. L. Leger С. Distribution and characterization of the serum lipoproteins and their
apoproteins in the rainbow trout (Salmo gairdnsri) // Biochemistry. - 1978. -
V.17. - №21. - P.4455-4464.
. Cоrraze Genevieve, Kaushik Sadasivam.
Les lipides des poissons marins et d’eau douce // OCL: Oleagineux, corps gras.
lipides. - 1999. - Vol.6. - № 1. - P.111-115.
48. Cromy
V., Kukla R., Homakova M., Malimankova A., Belusa О. // Diagn. Lab. - 1975. - 11. - Р.231.