Свойства нитрата кальция
Содержание
Цель работы и задачи
. Теоретическая
часть
.1 Строение
и хим связь
.2 Физико-хим
св-ва
.3 Получение
.4 Применение
. Экспериментальная
часть
.1 Приготовление растворов
.2 Определение
фазового состава растворов
Вывод
Литература
Приложение
Цель работы и задачи
Цель работы: исследовать свойства нитрата
кальция, выявить оптимальную концентрацию нитрата кальция в водном растворе,
для дальнейшего применения в составе охлаждающей жидкости.
Задачи: 1) изучить методы работы с точными
приборами(рефрактометр, аналитические весы, цифровой термометр)
) методом рефрактометрии определить зависимость
показателя преломления фаз системы вода-нитрат кальция при отрицательной
температуре от концентрации.
) выявить оптимальную концентрацию нитрата
кальция в водном растворе, чтоб при отрицательных температурах концентрация
соли в осадке была минимальна.
1. Теоретическая часть
1.1
Строение
и химическая связь
Кальция нитрат (кальциевая
селитра, азотнокислый кальций, кальций динитрат) - неорганическая соль азотной кислоты.
Соединение сильно гигроскопично, поэтому его хранят без доступа влаги.
Химическая формула Са(NО3)2.

Условно нитраты
могут быть разделены на соединения с преимущественно ковалентным типом связи (соли
Be, Cr, Zn, Fe и др. переходных металлов)
и с преимущественно ионным типом связи (соли
щелочных и щелочно-земельных металлов).
Для ионных нитратов характерны более
высокая термическая устойчивость, преобладание кристаллических структур более
высокой симметрии
и отсутствие расщепления полос нитрат-иона в ИК спектрах. Ковалентные нитраты
имеют более высокую растворимость в орг. растворителях, более низкую
термическую устойчивость, их ИК спектры носят более сложный характер.
.2 Физико-химические свойства
вещества
Внешний вид Са(NO3)2
: бесцветные кубические кристаллы
Молекулярная масса: 164,09
а.е.м.
Температура плавления : 561°C
Температура разложения : 561°C
Таблица 1.Растворимость нитрата
кальция в некоторых растворителях
|
Растворитель
|
Растворимость
в г/100г
|
t˚C
|
|
ацетон
|
16,8
|
20
|
|
вода
|
102
|
0
|
|
вода
|
114,6
|
10
|
|
вода
|
128,8
|
20
|
|
вода
|
138,1
|
25
|
|
вода
|
149,4
|
30
|
|
вода
|
189
|
40
|
|
вода
|
359
|
60
|
|
вода
|
363
|
100
|
|
вода
|
376
|
150
|
|
вода
|
413
|
200
|
|
метанол
|
134
|
10
|
|
метанол
|
144
|
Вкуса, запаха не имеет,
гигроскопичен.
Плотность:2,36 (20°C, г/см3)
Стандартная энтальпия
образования ΔH :-937,2 кДж/моль
Стандартная энергия Гиббса образования ΔG:-742
кДж/моль
Стандартная энтропия образования S:193,3
Дж/моль·K
Стандартная мольная теплоемкость Cp
:149,33 Дж/моль·K
Энтальпия плавления ΔHпл
:21,3 кДж/моль
Вследствие сильной гигроскопичности, даже при
обычных температурных условиях, нитрат кальция, присоединяя воду, переходит в
гидратную форму. Из гидратов существуют моно-, ди-, три- и тетрагидрат, причем
последний Са(NO3)2×4H2O
является стабильным при обычной температуре. При температуре выше 40оС
образуется тригидрат.
Гидратированные нитраты
отличаются от безводных тем, что в их кристаллич. структурах ион
металла
в большинстве случаев связан с молекулами
воды,
а не с ионом
NO-3. Поэтому они лучше, чем безводные нитраты,
растворяются в воде, но хуже- в
органических растворителях.
Нитраты токсичны. Вызывают отек легких, кашель,
рвоту, острую сердечно- сосудистую недостаточность и др. Смертельная доза
нитратов
для человека 8-15 г, допустимое суточное потребление 5 мг/кг.
Физико-химические свойства Са(NO3)2×4H2O,используемого
в химической практике.
Внешний вид: бесцветные моноклинные кристаллы
Молекулярная масса : 236,15 а.е.м.
Температура плавления : 42,7°C
Температура разложения : 100°C
Продукты термического разложения: кальция
нитрат, вода
Растворимость (в г/100 г или характеристика):
ацетон: растворим
вода: легко растворим
этанол: растворим
Вкуса, запаха нет, гигроскопичен
Плотность:1,82 (20°C, г/см3)
Стандартная энтальпия образования ΔH
:-2131,2
кДж/моль
Стандартная энергия Гиббса образования ΔG
:-1700,8
кДж/моль
Стандартная энтропия образования S:339 Дж/моль·K
При 151оС соль полностью теряет воду.
Таблица 2. Зависимость
температуры замерзания раствора нитрата кальция от концентрации.
|
Плотность
раствора кг/л при 20°С
|
Содержание
безводного Нитрата Кальция в 1 литре раствора, кг
|
Температура
замерзания раствора, °С
|
|
Плотность
раствора кг/л при 20°С
|
Содержание
безводного Нитрата Кальция в 1 литре раствора, кг
|
Температура
замерзания раствора, °С
|
|
1,02
|
0,030
|
-0,8
|
|
1,22
|
0,317
|
-11,9
|
|
1,04
|
0,058
|
-1,7
|
|
1,24
|
0,347
|
-13,6
|
|
1,06
|
0,087
|
-2,6
|
|
1,26
|
0,380
|
-15,6
|
|
1,08
|
0,113
|
-3,2
|
|
1,28
|
0,412
|
-16,8
|
|
1,10
|
0,142
|
-4,0
|
|
1,30
|
0,448
|
-18,0
|
|
1,12
|
0,170
|
-5,1
|
|
1,32
|
0,473
|
-19,2
|
|
1,14
|
-6,0
|
|
1,34
|
0,503
|
-20,4
|
|
1,16
|
0,227
|
-7,2
|
|
1,36
|
0,536
|
-21,6
|
.3 Получение нитрата кальция
А Получение нитрата кальция нейтрализацией мела
или известняка азотной кислотой.
Сырье.
Сырьем служат известняк (реже мел) и азотная
кислота. Содержание основного вещества CaCO3
в известняке (меле) колеблется от 90 до 98%. Содержание примесей, состоящих из MgCO3,
CaCO3,
Fe2O3,
Al2O3,
силикатов и др., в зависимости от месторождения известняка (мела) также
различно.
Азотная кислота для получения нитрата кальция
употребляется слабая в пределах 30-45%.
Сущность метода.
Нейтрализация углекислого кальция азотной
кислотой протекает по следующей реакции:
СaCO3 +
2HNO3 = Ca(NO3)2 + H2O + CO2.
Полученные растворы нитрата кальция
декантируются (иногда фильтруются) и выпариваются; после охлаждения и
застывания получается готовый продукт.
Часто нитрат кальция смешивается с другими
продуктами в целях улучшения его физических свойств.
Б Получение нитрата кальция поглощением
хвостовых нитрозных газов известковым молоком.
Сырье.
Сырьем служат известковое молоко с содержанием
окиси кальция 110-130г/л и хвостовые нитрозные газы с содержанием 1-2% NO.
Известковое молоко готовится из
доброкачественной извести (содержание активной CaO
не менее 75-85%).
Сущность метода.
Хвостовые нитрозные газы после кислой абсорбции
поглощаются известковым молоком. Вначале образуется смесь нитрата и нитрита
кальция по уравнению:
2N2O4
+ 2Ca(OH)2
= Ca(NO3)2
+ Ca(NO2)2
+ 2H2O.
При дальнейшей подаче нитрозных газов происходит
разложение нитрита с образованием нитрата. Механизм процесса может быть
представлен следующими реакциями:
2NO2
+ H2O
= HNO2
+ HNO3 ;
Ca(OH)2 + 2HNO3
= Ca(NO3)2 + 2H2O;(OH)2 + 2HNO2
= Ca(NO2)2 + 2H2O.
Образующийся нитрит кальция частично реагирует с
NO2 ,
переходя в нитрат:
(NO2)2 + 2NO2
= Ca(NO3)2 + 2NO.
Одновременно получается небольшое количество
элементарного азота по уравнению:
Ca(NO2)2 + 2NO2
= 2Ca(NO3)2 + N2
Соотношение получаемого нитрита к нитрату
зависит от степени окисления газа. По мере прохождения газов через систему
поглотительных скрубберов, отношение NO
к NO2
в нитрозных газах увеличивается, и поэтому в конце системы, где содержание NO2
невелико, образуется большее количество нитрита.
Получаемые щелока подвергаются инвертированию
азотной кислотой, после чего растворы нитрата кальция перерабатываются по
схемам, описанным выше.
1.4 Применение
1) В сельском хозяйстве.
Кальциевая
селитра является физиологическим щелочным удобрением, пригодным для всех почв и
прежде всего для закисленных почв. В сельском хозяйстве применяют как азотное
удобрение. Выпускают в гранулированном виде; товарный продукт должен содержать
не менее 15,5 % азота, кроме того, к нему добавляют в процессе производства 4-7
% нитрата аммония для уменьшения гигроскопичности удобрения; содержание влаги
не должно превышать 15 %. Нитрат кальция вносят под все культуры. Наиболее
эффективен на кислых почвах, особенно для весенней подкормки озимых. Кальциевая
селитра - единственное полностью усваиваемое растениями удобрение, восполняющее
потери водорастворимого (усваиваемого растениями) кальция в почве. Потери кальция,
в основном, обусловлены выносом с урожаем сельскохозяйственных культур (от 20
до 350 кг/га). И если вынос фосфора, серы и азота восполняется такими широко
применяемыми удобрениями, как аммиачная селитра, сульфат аммония, суперфосфат и
др., то восполнение потерь водорастворимого кальция в почве при этом не
происходит. А между тем кальций регулирует поступление питательных веществ в
растение. Кальций играет ключевую роль в формировании клеточных стенок и
мембран, улучшает окраску и качество плодов, поэтому особенно важен для
быстрорастущих культур. Кальций не перераспределяется внутри растений, т.е. не
перемещается от старых листьев к молодым, поэтому почва всегда должна содержать
достаточное количество этого вещества в доступной для растений форме. А, кроме
того, кальций - это важнейший строительный материал в организмах животного мира
и в человеке, получающих его по пищевой цепочке от растений.
)В пиротехнике.
Несмотря
на то, что нитрат кальция в смеси с горючими веществами способен давать
недорогой источник кирпично-красного пламени, применение его в этом качестве
крайне ограничено из-за сильной гигроскопичности.
) Для изготовления бетона.
Нитрат кальция одна из немногих добавок прошедших проверку машиной
стройиндустрии и научно-исследовательских институтов бывшего СССР, тысячи
испытаний на различных цементах, инертных, в разных условиях и комплексах,
десятилетия наблюдений за свойствами бетонов модифицированных Нитратом Кальция,
а также комплексом Нитрат Кальция + Нитрит Кальция, практически не оставили белых
пятен в понимании свойств бетонов с введенным Нитратом Кальция. Благодаря
тотальной проверке, показывающей превосходные результаты, Нитрат Кальция
присутствует в большинстве тематических ГОСТов и рекомендаций. Немногие
вещества вводимые в бетонные и растворные системы с целью улучшения их свойств
могут похвастать такой детальностью изучения, как Нитрат Кальция.
Уникальность
Нитрата Кальция заключается в том, что он в своей структуре имеет активный ион
Кальция (Ca2+), а Кальций , кремний и вода, как известно, являются
основными материалами формирующими структуру цементного камня. Уникальный
симбиоз одних и тех же ионов добавки NITCAL и продуктов гидратации цемента
позволяет получить равномерную, полноценно сформированную (здоровую) структуру
цементного камня, а благодаря редкой особенности воздействия на гидратацию
двукальцивого силиката и реакции превращения эпоксида с аммонием в амин
позволяет значительно увеличивать динамику набора прочности бетонов в течение
долгих лет.
)В составе охладительной жидкости.

Рис.1 Диаграмма состояния Ca(NO3)2
- H2O
Одновременное присутствие кристаллов соли, льда
и раствора приводит к поддержанию постоянной (эвтектической) температуры до тех
пор, пока одна из фаз не исчезнет.
Следовательно, появляется возможность
использовать модифицированный раствор нитрата кальция дополнительно в качестве
охлаждающей жидкости в производстве теплоносителей для промышленных установок.
2. Экспериментальная часть
2.1 Приготовление растворов
различной концентрации
Формула расчета массы соли для
раствора необходимой концентрации, с учетом того, что соль гидратированная.
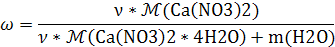
Для нахождения массы необходимо
значение количества вещества. Возьмем его за х. Для приготовления каждого
раствора было взято 50 г воды.
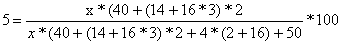
Аналогично рассчитано для всех
остальных концентраций.
2.2 Определение фазового
состава растворов при t=-5˚C
После приготовления растворов
нужных концентраций их помещали в сосуд, а сосуд в изолированный хладотермостат
на основе элементов Пельтье. Раствор в сосуде постоянно перемешивали.
Температуру измеряли при помощи цифрового термометра Testo
735-2, который способен измерять температуру в пределах от -200…+400 , с
погрешностью ±0,03.Опыт проводился при условиях -5˚С. Эту температура
поддерживалась в хладотермостате при помощи регулировки силы тока и напряжения
установки. Время установления равновесия в каждой системе определяли, отбирая
пробы насыщенного раствора и анализируя их химический состав. Равновесие
устанавливалось примерно через 30 мин. После отстаивания смеси отбирались три
пробы и 2-3 пробы осадка. Доводили их до состояния комнатной температуры и
измеряли показатель преломления жидкой (L)
и твёрдой фазы (S) на рефрактометре
ИРФ-454Б2М. Рефрактометрия (от лат. refractus - преломленный и греч. metreo -
измеряю) - это метод исследования веществ, основанный на определении показателя
(коэффициента) преломления (рефракции) и некоторых его функций. Рефрактометрия
(рефрактометрический метод) применяется для идентификации химических
соединений, количественного и структурного анализа, определения
физико-химических параметров веществ.
Показатель преломления n,
представляет собой отношение скоростей света в граничащих средах. Для жидкостей
и твердых тел n обычно определяют относительно воздуха, а для газов -
относительно вакуума. Значения n зависят от длины волны l света и температуры,
которые указывают соответственно в подстрочном и надстрочном индексах. Влияние
температуры на показатель преломления определяется двумя факторами: изменением
количества частиц жидкости в единице объема и зависимостью поляризуемости
молекул от температуры. Второй фактор становится существенным лишь при очень
большом изменении температуры.
Температурный коэффициент
показателя преломления пропорционален температурному коэффициенту плотности.
Обычно n жидких и твердых тел рефрактометрией определяют с точностью до 0,0001
на рефрактометрах,
в которых измеряют предельные углы полного внутреннего отражения. Наиболее
распространены рефрактометры Аббе с призменными блоками и компенсаторами
дисперсии, позволяющие определять nD в "белом" свете по
шкале или цифровому индикатору. Максимальная точность абсолютных измерений (10
-10) достигается на гониометрах с помощью методов отклонения лучей
призмой из исследуемого материала.
Таблица 3. Зависимость
показателей преломления от концентрации растворов.
|
№
|
Исходная
концентрация, масс %
|
Жидкая
фаза-L
|
Твердая
фаза- S
|
nD23
Показатель преломления жидкой фазы.
|
nD23 Показатель
преломления твердой фазы.
|
Ca(NO3)2
в L, масс %
|
Ca(NO3)2 в
S , масс
%
|
|
|
Ca(NO3)2
|
H2O
|
|
|
|
|
|
|
|
|
1
|
5
|
95
|
+
|
1,3333
|
1,3395
|
0
|
5,0
|
|
|
2
|
10
|
90
|
+
|
+
|
1,3441
|
1,3394
|
5,9
|
4,1
|
|
|
3
|
15
|
85
|
+
|
+
|
1,3553
|
1,3501
|
13,0
|
10,5
|
|
|
4
|
20
|
80
|
+
|
-
|
1,3625
|
-
|
20
|
-
|
|
|
5
|
25
|
75
|
+
|
-
|
1,3695
|
-
|
25
|
-
|
|
|
6
|
30
|
70
|
+
|
-
|
1,3700
|
-
|
30
|
-
|
|
|
7
|
35
|
65
|
+
|
-
|
1,7540
|
-
|
35
|
-
|
|
|
8
|
40
|
60
|
+
|
-
|
1,8152
|
-
|
40
|
-
|
|
|
9
|
45
|
+
|
-
|
1,8995
|
-
|
45
|
-
|
|
|
10
|
50
|
50
|
+
|
-
|
1,9569
|
-
|
50
|
-
|
|
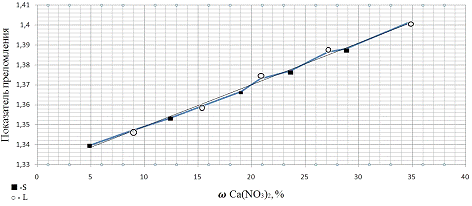
Рисунок 2. Зависимость
показатель преломления от количества растворов в системе Ca(NO3)2
- H2O
при температуре -5˚C
Вывод
1) Исследована
зависимость показателя преломления растворов нитрата кальция от их
концентраций.
2) Нитрат
кальция может быть использован в составе охлаждающих жидкостей.
3) Найдена
оптимальная концентрация нитрата кальция в растворе, после замораживания
которого при -5˚С образуется минимальное количество кристаллов- 15%.
Литература
1) Рабинович В.А.,
Хавин З.Я. "Краткий химический справочник" Л.: Химия, 1977 стр. 71
2)
http://ru.wikipedia.org/wiki/Нитрат_кальция
3) Addison С.
С.,
Logan N.. Anhydrous metal nitrates, "Advances Inorganic Chemistry and
Radiochemistry", 1964, v. 6, p. 72-142. П.М. Чукуров.
) http://www.bhz.kosnet.ru/Rus/Prod/Agrprom/Cal-2H2Oud.html
) http://tvibo.ru/nitcal
) http://www.nha.su/shop/UID_14445.html
)М. А.
Миниович.
Соли азотной кислоты (нитраты). 1946. 78 с.
) Киргинцев А.Н. Растворимость
неорганических веществ в воде. /А.Н. Киргинцев, Л.Н. Трушникова, В.Г.
Лаврентьева. Справочник// Изд-во "Химия". Л., 1972. - 154с.
9) С.И. Нифталиев, И.В. Кузнецова,
О.А. Козадерова, Г.В. Клоков, В.В. Окшин, А.В.Мельник. Модифицирование и
применение нитрат-содержащего раствора - отхода производства минерального
удобрения.
) http://www.eurolab.ru/refraktometriya
Приложение
нитрат кальций
рефрактометрия концентрация
Технические характеристики приборов,
используемых в эксперименте.
)Рефрактометр Аббе лабораторный ИРФ-454Б2М
предназначен для измерения показателя преломления nD и средней
дисперсии неагрессивных жидкостей и твердых тел. Имеет дополнительную шкалу
"Brix".
Рефрактометр может применяться:
В пищевой промышленности
для контроля качества пива, вин, коньяков, водок
и ликеров;
для определения массовой доли растворимых сухих
веществ (%, Brix,) в продуктах переработки
плодов и овощей, в напитках, сиропах, консервах,
рассолах;
для измерения процентного содержания жира в
твердых продуктах питания;
при определении влажности меда и т.д.
В медицинских учреждениях
для определения белка в сыворотке крови с
помощью таблицы Рейса;
для определения плотности мочи, субретинальной
жидкости глаза;
для определения концентрации лекарств.
В фармацевтической промышленности
для исследования концентрации растворов
различных лекарственных препаратов.
При обслуживании автомобилей, тракторов, судов
для определения сорта моторных топлив,
охлаждающих жидкостей.
При обслуживании авиационной техники
для определения с большей точностью объемной
концентрации противокристаллизационной жидкости "ИМ".
Технические характеристики
|
Диапазон
измерения: - показателя преломления nD - сухих веществ по сахарозе
(Brix), %
|
1,2
... 1,7 0 ... 85
|
|
Основная
допустимая погрешность измерений: - по показателю преломления nD -
по сухим веществам, %
|
+1·10-4
+ 0,15
|
|
Габаритные
размеры, мм
|
170х115х270
|
|
Масса,
кг
|
3,1
|
2) Цифровой термометр Testo
735-2 Прочный, надежный и компактный измерительный прибор с разъемом для
высокоточного зонда Pt100, 2 разъемами для быстродействующих термопарных зондов.
Результаты измерений не более 3-х доп. зондов температуры отображаются на
высокочетком дисплее. Погрешность измерений 0.05 °C с разрешением 0.001 °C
достигается с помощью сменного погружного/проникающего зонда Pt100. Аппарат
подходит для использования в качестве эталонного прибора.
Память прибора позволяет сохранить до 10,000
значений
Отображение, сохранение и печать данных
дифференциальной температуры, макс/мин/среднего значений
Акустический сигнал тревоги при превышении
предельных значений
Цикличность измерений от 1 раза в 0,5 секунд до
24 часов
Диапазон измерений: -200 … +1000 °C
Погрешность:
±(0.2 °C + 0.3% от изм. знач.) (в ост.
диапазоне)
Разрешение: 0.1 °C
Тип зонда Тип S PT10RH РТ
Диапазон измерений: 0 … +1760 °C
Погрешность: ±1 °C
Разрешение: 1 °C