Производство лечебно-профилактических сывороток и иммуноглобулинов
План
Введение
История
развития искусственной пассивной иммунизации
Характеристика
сывороток и иммуноглобулинов
Классификация
и получение сывороток и иммуноглобулинов
Основные
принципы гипериммунизации
Основные
принципы грундиммунизации
Методы
введения антигена при получении сывороток
Очистка
и концентрация сывороток
Характеристика
иммунодиагностических препаратов
Виды
серологических иммунных реакций
Реакция
агглютинации (РА)
Реакция
преципитации
Реакция
связывания комплемента (РСК)
Реакция
нейтрализации
Основные
принципы производства иммунодиагностикумов
Характеристика
моноклональных антител
Заключение
Список
использованных источников
Введение
сыворотка антиген иммунодиагностикум
антитело
Одним из наиболее важных факторов в
возникновении научной медицины в 19-м столетии было все более широкое признание
существования возбудителей болезней. Согласно этой теории, возбудители инфекций
возникают не путем самопроизвольного зарождения, а воспроизводятся из себе
подобных и являются этиологическими факторами конкретных и воспроизводимых
нозологических форм. Луи Пастер (Louis Paster), развивая свои великолепные
исследования о природе и способах предотвращения болезни шелковичных червей, а
также болезней вина и пива, вступил в борьбу, чтобы убедить ученый мир в правильности
своей теории возбудителя. Его сообщение в 1880 г. о возможности
профилактической иммунизации против куриной холеры знаменует возникновение
научной иммунологии.
На сегодняшний день существует всего два
способа, применение которых обеспечивает индифферентность организма к
заболеванию передающемуся инфекционным путем - это активная и пассивная
иммунизация. Пассивная иммунизация обеспечивается путем переноса от одного
организма (уже перенесшего данное инфекционное заболевание) к другому антител.
Однако, концентрация антител постепенно уменьшается и иммунизированный организм
не в состоянии восполнить их начальную концентрацию, а значит постепенно такая
защита исчезает. Для такой иммунизации активно используются
лечебно-профилактические сыворотки, получаемые, в основном, из крови
животных-доноров. Применение гипериммунных сывороток для лечения ряда
бактерийных инфекций (дифтерия, скарлатина, столбняк, дизентерия, сибирская
язва), проведенное в конце XIX в., обусловлено было исследованиями в области
иммунологии и, в частности, учением о специфических антителах. С проведением
первых наблюдений, касающихся терапевтической эффективности специфических
сывороток, начало формироваться направление прикладной иммунологии, получившее
название сывороточного дела. [1]
История развития искусственной пассивной
иммунизации
В конце 80-х годов 19 столетия, особенно в
последнее десятилетие, открытия новых бактериальных возбудителей болезней
следовали одно за другим с нарастающей частотой, и доказательства их
этиологической роли обыч но удовлетворяли требованиям коховской триады. Как
только удавалось получить культуру возбудителя на искусственной питательной
среде, возникала возможность приготовить соответствующую вакцину из ослабленных
или убитых микробов для профилактики данной болезни. Но как показал Пастер
(Pasteur) в 1885 г. в своих знаменитых работах по бешенству, выделение
возбудителя не является абсолютно необходимым. Так и не добившись успеха в
выделении возбудителя бешенства, Пастер тем не менее сознавал, что тот должен
присутствовать в головном и спинном мозге зараженных животных, поскольку
введение такого мозга нормальным животным вызывало у них заболевание. Вслед за
этим Пастер предложил метод ослабления (аттенуации) возбудителя бешенства путем
хранения его в течение разных сроков и вскоре показал, что курс вакцинации с
введением материала все более высокой вирулентности обеспечивает защиту от
бешенства, даже если оно вызвано укусом бешеного животного.
Итак, на протяжении 80-90-х годов прошлого
столетия осуществимость профилактической иммунизации была доказана для целого
ряда инфекционных заболеваний. Однако попытки применить эти новые
иммунологические подходы ко всем болезням принесли во многих случаях
отрицательный результат. В частности, некоторые возбудители, позднее названные
вирусами и риккет- сиями, было невозможно выделить существовавшими тогда
методами. В других случаях, как, например, при поражении Treponema pallidum,
вызывающей сифилис, хотя возбудитель и мог быть обнаружен при
гистопатологическом исследовании, вырастить его на искусственной питательной
среде для приготовления вакцины не удавалось. И наконец, были такие
заболевания, как дифтерия и туберкулез, при которых сам возбудитель можно было
вырастить и использовать для иммунизации, но это не обеспечивало защиты от
инфекции, а иммунизация микробами типа холерного вибриона для профилактики
холеры у человека оказалась малопригодной.
Значительный успех был достигнут в 1888 г.,
когда Эмиль Ру и Александр Йерсен (Emile Roux, Alexandre Yersin) сумели выделить
растворимый токсин из надосадочной жидкости культур дифтерийной палочки. Этот
токсин при введении экспериментальным животным вызывал всю картину дифтерии;
стало очевидным, что по крайней мере иногда болезнь вызывает не сам микроб как
таковой, а вырабатываемый им экзотоксин. После этого понадобилось немного
времени, чтобы Беринг (Behring) и его сотрудник Китасато (Kitasato) развили эти
наблюдения, и в 1890 г. они сообщили, что после иммунизации дифтерийным или
столбнячным токсином в крови животных появляется нечто, способное
нейтрализовать или разрушить токсин и тем самым предотвратить заболевание.
Антитоксические сыворотки животных вскоре испытали на больных детях. Эффект был
поразительным. Дети быстро выздоравливали, особенно если сыворотка вводилась на
ранних сроках заболевания. Вещество, которое вызывало обезвреживание токсина,
получило название анти-токсина, а вскоре для обозначения этого нового класса
веществ был введен более общий и менее обязывающий термин - анти-тело. То, что
вызывает образование этих антител стали называть анти-геном.
Данные фон Беринга об эффективности
терапевтического применения антитоксина сразу же убедили медицинский мир, а
всеобщий характер этого явления был подтвержден наблюдениями Пауля Эрлиха (Paul
Erlich), который показал, что иммунизация животных токсинами растительного
происхождения - рицином и абрином - также приводит к образованию нейтрализующих
антитоксинов. Аналогичные токсины стали искать при других инфекционных
заболеваниях, но вскоре было установлено, что этот новый терапевтический
В 1890г. Е. Behring и Sh. Kitasato, иммунизируя
кроликов столбнячным токсином, установили появление антитоксических свойств у
сыворотки и показали, что введение этим животным 20 ДLm столбнячного токсина не
вызывает заболевания. В том же году этими же авторами было показано наличие
дифтерийного антитоксина в крови морских свинок, получавших сублетальные дозы
дифтерийного токсина. Через год после этого открытия Е. Behring путем
иммунизации лошадей впервые получил лечебную противостолбнячную сыворотку, а
уже в 1893 г. С. П. Федоров и Ф. Н. Ремезов провели подобные же наблюдения в
России. В 1892 г. Е. Behring и К. Wernieke была получена противодифтерийная
сыворотка. В России указанная сыворотка была приготовлена на лошадях
одновременно в разных городах - Г. К. Габричевским (1895) в Москве, А. Д.
Павловским и А. М. Максутовым (1895) в Киеве, С. К. Дзержговским (1895) в
Петербурге, В. В. Родзевичем (1897) в Самаре, П. В. Бутягиным (1897) в Томске.
В этот же период были предложены сыворотки против змеиного яда (A. Calmette,
1895), стрептококковой инфекции (А. Marmorek, 1895; Н. Aronson, 1896),
противодизентерийная (Н. Shiga, 1898) и сибиреязвенная (Скляво, 1895).
Первые попытки получения специфической сыворотки
против газовой инфекции были предприняты в 1910 г. М. Weinberg. Автор проводил
иммунизацию морских свинок постепенно возрастающими дозами Cl. perfringens и
установил, что хотя сыворотка этих животных и не обладала агглютинирующими и
бактерицидными свойствами, но выявляла слабовыраженный превентивный эффект.
Более активный препарат был получен этим же исследователем только в 1915 г.
вначале на баранах, а затем на лошадях.
В конце XIX в. начали предприниматься первые
попытки по изучению возможности изготовления специфической сыворотки против
бешенства (Babes, Lepp, 1889), а уже в 1891 г. Babes и Archez применили
сыворотку иммунизированных собак для профилактики бешенства у 12 лиц,
покусанных больным волком, и сообщили, что введение им 40 - 60 мл сыворотки
обеспечило предупреждение заболевания у 11 человек. В дальнейшем достаточно
активная сыворотка была получена от кроликов и баранов (A. Marie, 1905).
Позже исследованиями S. Ftexner (1910), S.
Flexner, P. Lewis (1910), A. Petit (1918) было показано, что введение вируса
полиомиелита козам, овцам и лошадям приводит к выработке специфических антител,
способных нейтрализовать вирус в достаточно больших концентрациях. В дальнейшем
были получены специфические гипериммунные сыворотки против вирусов оспы
(Albreshoff, 1928), желтой лихорадки (G. Bauer, N. Hudson, 1930; A. Petit, G.
Stefanopoulo, 1933). гриппа (P. Laidlaw с соавт., 1935), клещевого (Е. Н.
Левкович, М. П. Чумаков, 1937) и японского (И. М. Родин, Л. И. Мартьянова,
1956) энцефалитов, чумы, (А. И. Желтенков, 1946) и других опасных для человека
вирусных и бактерийных заболеваний.
Также предложен метод изготовления
антилимфоцитарной сыворотки на лошадях (R. Реrреr с соавт., 1967), ослах (У. А.
Арипов с соавт., 1970), козах (N. Kashiwadi с соавт., 1968) и других животных.
Серьезное внимание уделялось изготовлению
различных диагностических сывороточных препаратов и асцитических жидкостей.
Так, проводились исследования по отработке условий изготовления агглютинирующих
сывороток к холерному вибриону (М. Gruber, N. Durham. 1896) и брюшному тифу,
дизентерии (Р. В. Фрадкина, Н. Г. Шейнман, 1937; Д. Штибен, В. Г. Багликова,
1934), ботулинической (С. А. Зелевинская, 1935) и газовой (С. И. Наследышева,
1935) инфекций. [1,2]
Характеристика сывороток и иммуноглобулинов
Мощным средством экстренной профилактики и лечения
многих заболеваний, прежде всего инфекционных, являются нормальные и
специфические иммуноглобулины, сыворотки, плазма и моноклональные антитела. В
практике здравоохранения применяются гомологичные (человеческие) и
гетерологичные (лошадиные и др.) иммуноглобулины и сыворотки.
Пассивная иммунизация дает быстрый и хороший
эффект, особенно в сочетании с антибиотикотерапией. Такой способ
иммунопрофилактики используется в качестве превентивной меры при опасности
заражения в эпидемические сезоны и в стрессовых ситуациях, а также при сепсисе,
токсических состояниях и др. Сывороточные препараты применяются для
профилактики и лечения вирусных и бактериальных инфекций, лечения первичных и
вторичных иммунодефицитов, аутоиммунных, аллергических, дерматологических заболеваний,
подавления реакции отторжения пересаженных органов и тканей. В зависимости от
вида и тяжести инфекции сывороточные препараты вводят внутримышечно,
внутривенно или через рот.
К сожалению, сывороточные препараты создают
непродолжительный пассивный иммунитет, он возникает сразу же после
внутривенного введения препаратов, при местном их введении антитела в крови
достигают защитного уровня через 12-44 ч после инъекции. Гомологичный
иммуноглобулин создает иммунитет на 4-5-й нед и не вызывает сильных побочных
реакций.
Специфические иммуноглобулины оказывают не
только прямое действие на возбудителя инфекции, они обладают выраженным
неспецифическим иммуномодулирующим свойством. Оно зависит прежде всего от
присутствия в препаратах биологически активных веществ (лизоцим, компоненты
системы комплемента, цитокины и др.) Гетерологичные препараты имеют ряд
недостатков, они быстро исчезают из циркуляции, иммунитет, созданный ими,
сохраняется не более 2 нед. Препараты обладают сильными аллергенными
свойствами, перед их введением необходимо ставить кожные пробы для выявления
повышенной чувствительности к гетерологичному белку. Российскими
производителями осуществляется выпуск широкого спектра сывороточных препаратов
и иммуноглобулинов. (табл 1) [3]
Таблица 1 - Отечественные сывороточные
препараты, применяемые для профилактики и лечения инфекционных болезней
|
Инфекции
|
Гомологичные
|
Гетеролитичные
специфические сыворотки и иммуноглобулины
|
|
Нормальный
иммуноглобулин
|
Специфический
иммуноглобулин
|
Иммунная
плазма
|
|
|
Бешенство
|
|
|
|
+
|
|
Ботулизм
|
|
+
|
|
+
|
|
Гангрена
|
|
|
|
+
|
|
Гепатит
А
|
+
|
|
|
|
|
Гепатит
В
|
|
+
|
|
|
|
Грипп
|
+
|
+
|
|
|
|
Дифтерия
|
|
|
|
+
|
|
Бактериальные
кишечные инфекции
|
+
|
|
|
|
|
Клещевой
эцефалит
|
|
+
|
|
+
|
|
Коклюш
|
|
+
|
|
|
|
Корь
|
|
|
|
|
Лептоспироз
|
|
|
|
+
|
|
Лихорадка
Эбола
|
|
+
|
|
|
|
Менингококковая
инфекция
|
+
|
|
|
|
|
Полиомиелит
|
+
|
|
|
|
|
Протейная
инфекция
|
|
|
+
|
|
|
Ротавирусная
инфекция
|
|
+
|
|
|
|
Сибирская
язва
|
|
|
|
+
|
|
Синегнойная
инфекция
|
|
|
+
|
|
|
Стафилококковая
инфекция
|
|
+
|
+
|
|
|
Столбняк
|
|
+
|
|
+
|
|
Японский
энцефалит
|
|
|
|
+
|
Классификация и получение сывороток и
иммуноглобулинов
Гетерологичные (ксеногенные) антисыворотки
получают путем гипериммунизации лошадей, от которых можно забрать достаточно
много крови. Существуют антимикробные и антитоксические сыворотки. С целью
иммунотерапии антитоксические сыворотки применяются наиболее часто. Их получают
путем многократной иммунизации лошадей соответствующим анатоксином. Затем
сыворотки концентрируют и очищают от балластных веществ методом ферментирования
и диализа. Силу антитоксических сывороток измеряют в международных единицах
(МЕ) по способности нейтрализовать определенную дозу токсина. К антитоксическим относятся
противодифтерийная, противостолбнячная, противогангренозная,
противоботулиническая и противостафилококковая сыворотки.
Антитоксические сыворотки необходимо вводить как
можно раньше от начала заболевания, так как антитела способны нейтрализовать
токсин только до его адсорбции на клетках-мишенях. Вводят сыворотки после
обязательного предварительного контроля на чувствительность к лошадиному белку
по Безредко, поскольку они могут вызывать аллергические реакции, особенно при
повторном введении. Контроль проводят путем постановки внутрикожной пробы с
лошадиной сывороткой в разведении 1:100 в объеме 0,1 мл. Результат учитывают
через 20-30 минут. При отсутствии выраженной кожной реакции вводят необходимую
дозу сыворотки.
Аллогенные антисыворотки получают из донорской
или плацентарной крови. Из них выделяют очищенные и концентрированные
иммуноглобулины. Препараты иммуноглобулинов, полученные из нормальной или
иммунной сыворотки в настоящее время широко применяются в медицинской практике.
Их вводят внутримышечно, а специальные, дезагрегированные иммуноглобулины -
внутривенно («октагам» - IgG, «пентаглобин» - IgM). Нормальный донорский или
плацентарный иммуноглобулин содержит много антител различной специфичности,
направленных против всех инфекций, перенесенных донором, или образовавшихся в
результате вакцинации. Как правило, такие иммуноглобулины используются для
иммунотерапии затяжных, вялотекущих инфекций.
Из сыворотки крови специально иммунизированных
доноров получают гипериммунные иммуноглобулины целенаправленного действия.
Другой путь - отбор сывороток крови доноров, имеющих высокий уровень антител.
Эти препараты содержат высокий титр антител к соответствующим возбудителям.
Такие специфические иммуноглобулины направленного действия используют для
экстренной иммунотерапии (ИТ) и иммунопрофилактики (ИП) столбняка, гриппа,
клещевого энцефалита, стафилококковой инфекции. Например, противостолбнячный
донорский иммуноглобулин используют для экстренной профилактики столбняка у
людей с повышенной чувствительностью к лошадиному белку.
Другой путь создания пассивного искусственного
иммунитета - это получение препаратов специфических антител на основе
использования аллогенных сывороток. Начало этим работам положило применение
сыворотки доноров с целью профилактики кори, а также успешное использование их
цельной крови, плазмы или сыворотки для лечения ряда заболеваний инфекционной
этиологии.
Иммуноглобулиновые фракции сывороток крови
человека, содержащие оттитрованные антитела к инфекционным агентам
(противостафилококковые, противогриппозные, противооспенные и др.). Их получают
несколькими способами - путем сбора сыворотки от реконвалесцентов, специально
иммунизированных доноров крови и из препаратов плазмы с высоким содержанием
специфических антител, полученных после массовой иммунизации населения по
эпидпоказаниям, или после вспышки инфекции (например, гриппозной). Из
приготовленных в это время серий иммуноглобулина из плацентарного сырья
отбирают препараты с высоким содержанием антител.
Все выпускаемые в настоящее время препараты
иммуноглобулинов, изготовленные из крови человека, проверяются на отсутствие
антигенов вирусов гепатита и ВИЧ-инфекции.
Среди них различают:
стандартные (поливалентные) иммуноглобулины,
преимущественно класса IgG;
препараты, содержащие IgG и обогащенные IgM или
IgA;
гипериммунные препараты иммуноглобулинов,
обогащенные IgG-антителами против конкретных инфектов.
Препараты внутривенного иммуноглобулина показаны
для заместительной терапии при первичных иммунодефицитах (агаммаглобулинемия,
при тяжелых гнойно-септических заболеваниях, аутоиммунных тромбоцитопениях. Они
применяются для лечения осложненных гнойно-воспалительных аутоиммунных и
аллергических заболеваний.
Существуют препараты иммуноглобулины различного
производства (интраглобин, пентаглобин, октагам и др.).
Пентаглобин - обогащен IgM. Среди IgM имеются
антитела против грамотрицательных и других бактерий, они эффективны как
опсонины и индукторы комплементзависимого лизиса.
Иммуноглобулин человека нормальный выпускается в
ампулах в виде 10%-ного раствора иммунологически активной фракции белка. Он
применяется для профилактики кори, инфекционного гепатита, коклюша,
менингококковой инфекции, полиомиелита потому, что обычно содержит небольшое
количество антител против этих инфектов.
Иммуноглобулин человеческий противогриппозный
выделяют из донорских сывороток; он предназначен для лечения токсических форм
гриппа и предупреждения его осложнений.
Следующую группу иммуноглобулинов составляют
препараты специфического целенаправленного действия, полученные из крови
человека и предназначенные для лечения стафилококковой инфекции, клещевого
энцефалита и гриппа.
Антистафилококковый иммуноглобулин человека
выпускается двух видов - донорский и плацентарный. Первый получают из плазмы
доноров, иммунизированных стафилококковым анатоксином, второй - путем отбора
плацентарного сырья с высоким титром противостафилококкового антитоксина. Оба
препарата выпускаются в ампулах по 5,0 мл, содержание стафилококкового
антитоксина составляет 100 МЕ. Показанием к применению препарата служит наличие
заболевания, вызванного патогенными стафилококками, не поддающегося лечению
антибиотиками и химиопрепаратами, а также противопоказания к введению
последних.
Противостолбнячный иммуноглобулин из донорской
плазмы используют наряду с противостолбнячной сывороткой, изготовляемой из
плазмы гипериммунизированных лошадей. С целью его получения предварительно
отбирают доноров из числа лиц, иммунизированных столбнячным анатоксином.
Доноров иммунизируют повторно столбнячным анатоксином и через 3 недели из их
крови выделяют гамма-глобулиновую фракцию.
Специфический противоцитомегаловирусный
иммуноглобулин (цитотект) применяют: при острой ЦМВ инфекции у недоношенных
новорожденных и грудных детей; по показаниям детям с первичными и вторичными
иммунодефицитами; для лечения ЦМВ инфекции у реципиентов после трансплантации
костного мозга или органов и тканей. Выпускается по 10, 20, 50 мл. Вводят
внутривенно по 2-4 мл/кг/сутки через 1 -3 дня 3-5 инъекций.
Специфический противогепатитный иммуноглобулин
(гепатект) используют: для профилактики гепатита В у новорожденных от
матерей-носительниц HBs Аг (параллельно применяют HBs вакцину); для экстренной
профилактики гепатита В в случаях вероятного инфицирования. Выпускается 10%
раствор в ампулах по 2 мл и 10 мл. Вводят внутривенно детям по 0,4 мл/кг (не
менее 2 мл).
Разработаны препараты антител третьего поколения
на основе моноклональных антител, получаемых из антителообразующих гибридных
клеток животных и человека. Внедрение таких препаратов позволит решить многие
проблемы лечения и профилактики инфекционных заболеваний. Основным направлением
их применения является подавление возбудителя или модификация иммунного ответа
путем связывания некоторых ключевых его факторов моноклональными антителами.
Ниже перечислены некоторые варианты
использования таких моноклональных антител:
антитела против респираторно-синцитиального
вируса
антитела против Т-хелперов 2 типа могут
использоваться в терапии ВИЧ-инфекции;
антитела против СD4+ лимфоцитов или ФНОа - в
терапии ревматоидного артрита, других аутоиммунных заболеваний;
антитела против рецепторов к интерлейкину-2 -
при угрозе отторжения аллотрансплантанта почки;
антитела против IgЕ - при тяжелых аллергических
реакциях.
Отмечаются большие перспективы этого нового
метода иммунотерапии.
[3, 4]
Основные принципы гипериммунизации
Под гипериммунизацией понимается процесс
длительного введения возрастающих доз антигена с целью накопления в крови
животных максимального количества защитных антител и поддержание их на
достаточном уровне содержания в сыворотке крови в течение максимального по
продолжительности времени. В зависимости от характера применяемого антигена
принято различать антибактериальные, антитоксические и антивирусные сыворотки.
Основной целью гипериммунизации является
создание таких условий, при которых становится возможным получение от
продуцентов высокоактивной специфической сыворотки. Одним из важнейших
моментов, обеспечивающих успех сывороточного производства, является подбор
продуцентов, так как животные, и, в частности, лошади, с иммунологической точки
зрения оказываются далеко не равноценными. Успех иммунизации зависит, с одной
стороны, от физиологических особенностей организма продуцента, их возраста,
пола, породы, физического состояния, ухода и кормления, с другой, - от условий
иммунизации и эксплуатации, при этом важное значение имеют качество и доза
применяемого антигена, схема иммунизации, место введения, время кровопускания и
ряд других моментов.
Большая роль в успехе эксплуатации
животных-продуцентов принадлежит индивидуальной иммунологической реактивности.
Проблема реактивности в иммунологии, по П. Ф.
Здродовокому (1950), делится на 2 раздела. Первый включает закономерности
общего порядка (факторы индивидуальности, значение питания, воздействие влияния
внешней среды и т. д.), второй освещает закономерности специального характера,
связанные с воздействием на организм различных иммунизаторных раздражений.
Важнейшим моментом, обеспечивающим успех производства
гипериммунных сывороток, является подбор продуцентов, иммунологическая
реактивность которых различна и зависит от ряда физиологических особенностей и,
прежде всего, от породы, возраста и пола.
По мнению ряда специалистов сывороточного
производства, порода животных-продуцентов имеет немаловажное значение и в
значительной мере определяет успех иммунизации. Так, еще в 1895 г. Г. И.
Габричевский при производстве противодифтерийной сыворотки подчеркивал, что чем
породистее продуцент, тем быстрее и в большем титре он способен вырабатывать
антитоксин.
Этой же точки зрения придерживаются ряд других
исследователей, проводивших наблюдения в основном по изготовлению
антитоксических сывороток (Г. В. Выгодчиков, 1943). Многие авторы при
производстве антитоксических и антивирусных сывороток предпочитают использовать
в качестве продуцентов лошадей донской, верхово-донской, англо-донской пород
независимо от мест их заготовки. Нерентабельными продуцентами оказались лошади
казахской (местной), монгольской пород и беспородные (С. Д. Роньжина, 1959; Ю.
Б. Лукин, 1956; Р. М. Слободской, 1959, Л. А. Стрельникова, 1970).
Значительный материал в данном отношении
накоплен в Томском институте вакцин и сывороток, в котором проводились
специальные исследования по выяснению влияния породы лошадей на качество
антитоксических и антивирусных сывороток. Определенный вклад в изучение влияния
породы лошадей внес Р. М. Слободской (1959), который провел наблюдения над
лошадьми улучшенной (помесь с орловским рысаком) - (33 лошади), донской и
арабской породами (35 лошадей) и беспородными (14 лошадей), иммунизированными
столбнячным анатоксином. Оказалось, что первые 3 группы животных способны
вырабатывать антитоксин высокого титра и длительно удерживать его на этом
уровне.
Что же касается беспородных лошадей, то у
значительной части посла подъема титра до 600-700 АЕ уже после 5-6 циклов
иммунизации активность сыворотки резко снижалась и лошади становились
непригодными для дальнейшей эксплуатации. Продолжением этих исследований по
праву следует считать наблюдения Р. А. Зиняевой (1969), которая провела анализ
эффективности эксплуатации 1090 лошадей-продуцентов противостолбнячной
сыворотки, находящихся под гипериммунизацией за период 1952-1968 гг. с
использованием статистического аппарата теории информации. При этом удалось с
большой достоверностью показать, что выход в продуценты у лошадей донской
породы колеблется от 59 (Алма-Атинская область) до 89 (Красноярский край) и
даже 96% (Ростовская область). Из лошадей казахской улучшенной породы установлено,
что 89% животных становятся продуцентами, причем 85% - уже после 1-го цикла
иммунизации с титром 300-1200 АЕ. Лошади арабской породы также дают выход в
продуценты до 90%. [5]
Сравнительно низкий выход продуцентов отмечался
у лошадей, заготовленных в Томской области (72%), и местной казахской породы,
приобретенных в Уральской области (71%).
Основные принципы грундиммунизации
Для оценки иммунологического статуса животных
проводят их грундиммунизацию. Под грундиммунизацией понимается состояние иммунитета,
возникающее после первичной иммунизации соответствующим антигеном и
обеспечивающее после повторного введения антигена, произведенного через
оптимальный интервал времени, высокоиммунологический эффект, выражающийся в
быстрой продукции соответствующих специфических антител (Г. В. Выгодчиков,
1958).
Создание грундиммунитета имеет важное значение
для производства высокоактивных специфических сывороток, применяемых для
профилактики и лечения ряда инфекций, и, прежде всего, дифтерии, столбняка,
газовой инфекции (гангрены), ботулизма и некоторых других заболеваний.
Немаловажное значение грундиммунизация имеет и при изготовлении противовирусных
сывороток.
Необходимо отметить, что явление повышенной
выработки специфических антител при повторном введении антигена давно было
подмечено исследователями (Dungern, 1903; Cole, 1904; Dorgenson, 1905), но
только в 1915 г. М. Райский установил, что животные, ранее иммунизированные
чужеродной сывороткой, отвечают на повторное введение этой же сыворотки
усиленной выработкой прецинитинов даже при использовании небольших ее доз.
Важное значение имеет длина интервала между повторным
введением антигена, так называемый «закон интервалов», обоснованный в 1937 г.
П. Ф. Здродовским. Наблюдения, проведенные в этом отношении Е. Ф. Гогиным, М.
И. Игнатовой (1937), М. Вагнер, Н. Каминской (1942), Ф. М. Кац (1946),
показали, что грундирование как за 2-3 месяца, так и за 2-3 года до начала
иммунизации приводит к одинаковым результатам.
В настоящее время интервал между грундированием
и началом цикла иммунизации еще больше укорочен и, по данным большинства
авторов (не превышает 1-2 месяца.
На основании многочисленных исследований
подготовительная иммунизация животных, используемых для всех видов
эксплуатации, включает обязательное введение столбнячного анатоксина, так как
он не только предохраняет лошадей от спонтанного заболевания столбняком, но
вместе с тем создает резерв подготовленных для соответственной иммунизации
животных при постановке их под данный вид иммунизации. Грундирование лошадей
столбнячным анатоксином проводится двукратно в дозах 10-20 мл с 1%-ными
квасцами с интервалом 15-20 дней.
Вместе с этим нельзя обойти молчанием данные
некоторых исследователей, не установивших положительного влияния
грундиммунизации на усиление иммунологической реактивности организма. Так, Н.
П. Ефимова (1955) провела наблюдения на 2 группах продуцентов
противодифтерийной сыворотки. При этом одна - получала анатоксин без
предварительной подготовки, а вторая - трехкратно грундировалась
соответствующим антигеном. Оказалось, что в контрольной группе лошадей титр
антитоксина был от 300 до 1700 АЕ и удерживался на этом уровне длительное
время. В группе опытных лошадей титр антител не превышал 900 АЕ и, достигнув
максимума к 2-3 циклам, снижался. По мнению этих авторов, грундиммунизация
связана с явлением угнетения иммунологической реактивности как следствием
изменения чувствительности организма у грундированных животных.
Показана возможность использования для
грундирования ассоциированных анатоксинов. Так, описан опыт применения с целью
грундирования дифтерийно-столбнячного антигена (Б. Г. Трухманов, Е. Н. Родюкова,
1956; Ю. Б. Лукин, М. В. Евсеев, А. А. Ковшова, Г. А. Рахимов, Л. И. Афанасьев,
1965). При производстве противоботулинических сывороток с успехом применяется
двукратное грундирование лошадей смесью анатоксинов, содержащих типы А, В, С и
Е, в ланолине или с 1%-ными квасцами. При дальнейшей эксплуатации таких лошадей
можно при необходимости свободно переводить их из-под одного типа
ботулинической иммунизации под другой.
В настоящее время метод грундирования лошадей
рекомендуется использовать и при получении противовирусных сывороток. Так, Ю.
К. Петров, 3. Г. Пейсель наблюдали высокую продукцию противогриппозных антител
у животных, если им за 2 месяца перед началом эксплуатации вводили по 15 и 20
мл гриппозного антигена. Авторы отмечали не только положительный эффект
подготовки в отношении получения высокого титра антител (1:640-1:1600), но и
обнаружили, что при этом затрачивается меньшее количество антигена (в 2 раза),
а продолжительность цикла сокращается с 60 до 35 дней.
Предварительное введение свежим лошадям за 14-21
день до начала основного цикла иммунизации небольших доз антигена, содержащего
вирус клещевого энцефалита, значительно усиливает иммунологическую реактивность
животных и обеспечивает получение высокоактивной сыворотки. Такой же эффект обнаружен
и при использовании лошадей и других животных, полученных из мест, где имеются
природные очаги клещевого энцефалита и в крови которых содержатся специфические
антитела к данной инфекции. Широко применяется метод грундирования лошадей и
при производстве антирабической сыворотки (Л. А. Стрельникова, 1970) и ряда
других видов противовирусных сывороток.
Таким образом, использование предварительного
грундирования у лошадей-продуцентов лечебно-профилактических сывороток является
оправданным и способствует наиболее эффективному получению в короткий срок
высококачественных антитоксических и антивирусных сывороточных препаратов. [6]
Методы введения антигена при получении сывороток
Очень большое значение для получения
высококачественной специфической сыворотки имеет схема иммунизации. Схемы,
применяемые в производственных институтах, различны, но несмотря на то, что в
каждом отдельном иммунизационном отделе принята определенная схема, все
специалисты сходятся в одном мнении, что не может быть единой схемы для всех
продуцентов, а для каждого животного должна применяться своя, с учетом
особенностей иммунологической реактивности организма. Индивидуальный подход к
каждой лошади, поставленной под эксплуатацию, - мысль, которая проходит красной
нитью через все работы, выполненные в данной области знаний. Разнообразие схем
иммунизации определяется различием методов введения антигена, его дозировкой,
количеством и временем цикловых кровопусканий. Немаловажное влияние на степень
антителообразования оказывают количество инъекций и интервалы между ними.
В практике производства специфических сывороток
используют различные методы введения антигенов. Наиболее эффективным способом
иммунизации является внутривенное вливание, позволяющее в сравнительно короткий
срок получить высокотитражную сыворотку. Однако при использовании этого
способа, особенно при повторных циклах эксплуатации, можно столкнуться с
явлениями анафилактического шока, приводящее животное к гибели. В связи с этим
при изготовлении сывороток на крупных животных чаще всего предпочитают
использовать другие парэнтеральные методы введения антигенов. Наибольшее
внимание при этом отдается подкожному и внутримышечному способам инъецирования,
получившим широкое распространение при изготовлении антитоксических и антибактериальных
сывороток.
Эффективность подкожного и внутримышечного
методов иммунизации значительно повышается при условии применения дробного
метода введения антигена одновременно небольшими дозами в различные участки
тела животного с охватом возможно большего количества лимфоузлов. Указанное
положение достаточно четко и на высоком научном уровне обосновано
исследованиями, выполненными в лаборатории П. Ф. Здродовского (1961), где
показано, что иммунные антитела образуются в клетках плазмоцитарного типа,
находящихся в лимфатических узлах и селезенке, поэтому большее вовлечение их в
иммунизаторный процесс способно интенсифицировать антителообразование. Дробный
метод введения антигена с одинаковым успехом был применен при изготовлении
противостолбнячной и противодифтерийной сывороток (3. Г. Пейсель, 1959; И. М.
Моргунов, Е. Г. Дреслер, E. С. Тюрина, 1961), сыворотки против клещевого
энцефалита (Ю. В. Федоров, 1963) и ряда других видов иммунизации.
В последнее время рекомендуется производить
гипериммунизацию лошадей-продуцентов антитоксических сывороток путем
постепенного вовлечения в процесс антителообразования определенных групп
лимфатических узлов различной локализации и, в первую очередь, регионарных в
отношении места введения антигена. Особо благоприятные условия для нарастания
антитоксина в крови продуцентов создаются при поочередном вовлечении в
иммунизаторный процесс различных групп лимфатических узлов при двукратном
введении антигена в течение цикла. При этом первую инъекцию анатоксина
рекомендуется производить в затылочную область, краниальную и каудальную части
середины боковой грудной стенки одной и той же стороны лошади. Антиген из
первых двух точек поступает прежде всего в пакеты поверхностных шейных,
подмышечных, заглоточных лимфатических узлов, а также в глубокие нижнешейные,
расположенные у входа в грудную полость и средостенные краниальные узлы. Из
третьей точки антиген проникает в надколенные, латеральные, повздошные,
поверхностные и глубокие паховые лимфатические узлы.
Второе введение анатоксина осуществляется в 7-8
мест с учетом поступления его в те же лимфатические узлы. В последующем цикле
антиген применяют по той же схеме, но на противоположном боку лошади.
В Томском институте вакцин и сывороток на
протяжении многих лет при производстве ряда гипериммунных сывороток
(противостолбнячная, противодифтерийная, противоботулиническая, против газовой
инфекции, против клещевого энцефалита, антирабическая) с успехом используется
иммунизация животных подкожно и внутримышечно. Последние не вызывают резких
отклонений в состоянии здоровья лошадей и редко сопровождаются местными и
общими реакциями.
Методы эксплуатации, применяемые в различных
производственных институтах, часто весьма заметно отличаются один; от другого.
Однако все они преследуют общую цель - получить от одного животного-продуцента
наибольшее количество сыворотки с максимальным титром антител при наименьшей ее
себестоимости.
В практике сывороточного производства различают
несколько основных методов эксплуатации. К ним относятся прерывистая и непрерывная,
в некоторых случаях используется кратковременная или ударная (экспресс-метод)
иммунизация.
Прерывистая иммунизация
Наиболее распространенным является прерывистый
метод эксплуатации, когда курс иммунизации (цикл) завершается кровопусканиями с
последующим предоставлением животным отдыха от 12 до 30 дней. В этот период
продуценты не подвергаются никаким манипуляциям. Во время отдыха происходит
полное восстановление иммунологической реактивности организма, гематологических
и биохимических показателей крови, но вместе с тем наблюдается снижение титра
антител чаще всего на 50-60%. Для повышения специфической активности сыворотки
проводят новый, укороченный цикл гипериммунизации, состоящий, как правило, из
2-3 инъекций антигена, и вновь производят крововзятие.
При таком методе лошадь служит значительно
дольше, чем при других способах эксплуатации. Этот метод является наиболее
принятым в сывороточном производстве, так как позволяет длительное время
эксплуатировать продуцента. Были испытаны схемы с 1, 2, 3 и 4-недельными
интервалами. Оказалось, что наиболее эффективные результаты получаются при
интервалах между циклами в 15-20 дней. Этого же мнения придерживаются и многие
другие исследователи, проводившие наблюдения как при антитоксической , так и
противовирусной иммунизациях. Используя указанный метод эксплуатации
продуцентов, можно в течение года получить от одной лошади от 160 до 200 литров
крови.
Непрерывная иммунизация
Широкое распространение в практике сывороточного
производства получил непрерывный метод эксплуатации животных. Сущность его
заключается в том, что регулярных перерывов для отдыха между циклами не
делается, и кровь берется между очередными инъекциями антигена.
Указанный метод впервые был использован в
Нью-Йоркском институте Wadsworth и в разных модификациях описан в отечественной
литературе. Различают две разновидности непрерывной эксплуатации
животных-продуцентов. Первая заключается в том, что после цикловых
кровопусканий предоставляется отдых на несколько дней, вторая - когда
совершенно не делается перерывов, и на следующий день, вслед за цикловыми
кровопусканиями, начинается новый цикл гипериммунизации. Можно привести
достаточно большое число примеров эксплуатации животных-продуцентов разных
видов сыворотки указанным методом. Он был с одинаковым успехом испытан при
производстве противостолбнячной и других сывороток. Подобные же результаты
описаны и в области изготовления диагностических сывороток. Так, М. И.
Федорович (1950), применив метод непрерывной иммунизации при эксплуатации
лошадей, коз, баранов и кроликов, приготовила в короткий срок значительное
количество сыворотки, не отличающейся по своим качествам от подобной,
получаемой при применении прерывистого метода.
Е. Ф. Гогин и И. Е. Корчемкина (1934) указывают
на целесообразность использования под непрерывный метод эксплуатации только
свежих лошадей, подчеркивая рентабельность указанного метода эксплуатации.
Однако учитывая, что из 17 свежих животных, находящихся под эксплуатацией, уже
в течение первых 6 месяцев отошло 12 продуцентов, едва ли можно окупить их
стоимость количеством взятой крови. Поэтому подавляющее число авторов приходят
к выводу о необходимости использования указанного метода только у лошадей,
прошедших достаточное количество циклов эксплуатации и легко переносящих
процесс гипериммунизации.
Таким образом, на основании приведенного
материала видно, что применение непрерывного метода эксплуатации весьма
рентабельно, так как позволяет за небольшой промежуток времени получить
значительное количество специфической сыворотки, обладающей достаточно высокой
активностью. Однако применение его оправдано у животных-продуцентов, прошедших
уже ряд циклов эксплуатации.
Очистка и концентрация сывороток
Технологическую схему очистки и концентрации
антитоксических сывороток с помощью ферментолиза создал авторский коллектив во
главе с А. В. Бейлинсон. Были предложены последовательно 3 схемы очистки
антитоксических сывороток, включающих ферментолиз, термоденатурацию балластных
белков и диализ - Диаферм. Последняя модификация метода Диаферм-3 ИЭМ АМН СССР
широко применяется во всех сывороточных производствах нашей страны. При очистке
этим методом ферментация белков сыворотки ведется 2 часа при температуре 23° и
pH среды 3,2 и 4,2 высокоактивным ферментом.
Балластные вещества удаляются с осадком при pH
4,3 прогреванием ферментированных сывороток 45 минут при 58° в присутствии
14%-сернокислого аммония.
Ферментированный иммунный глобулин выделяется из
фильтрата при pH 7,0-7,1 дополнительным высаливанием сернокислым аммонием из
расчета 200 г на 1 л фильтрата. Выпавший при этих условиях осадок иммунного
глобулина отфильтровывается, прессуется и подвергается диализу проточной
водопроводной водой.
Для последующей очистки ферментированных белков
в сыворотку добавляют хлороформ и соляную кислоту до pH 5,0-5,3.
Еще в 1945 г. А. В. Бейлинсон с соавт. отметила,
что сыворотки, полученные после обработки пепсином, отличаются значительной
вязкостью. Для освобождения от последней авторы применили изоэлектрическое
осаждение денатурированных продуктов протеолиза при наличии в среде тонко
эмульгированного хлороформа. Добавление в сыворотку после диализа 30% по объему
хлороформа и энергичное встряхивание приводит в процессе осторожного и
медленного подкисления к получению стабильной эмульсии хлороформа с
желатинированными частицами белка, загрязняющего концентрированную сыворотку и
сообщающего ей повышенную вязкость. После стояния на холоде эмульсия хлороформа
в сыворотке разрушается, а желатинированные белки продолжают прочно удерживать
хлороформ, погружаясь вместе с ним на дно, где образуют плотный осадок.
Дополнительная очистка демонстративно видна на фореграммах. В сыворотке после
диализа содержится 3 фракции белков, находящихся в зоне гамма-, бета-, и
альфа-глобулинов. Дополнительная обработка ее хлороформом с последующим
изоосаждением при вышеуказанном pH ведет к исчезновению фракции, лежащей в зоне
альфа-глобулина, при этом оседает до 65% из противостолбнячной, до 50% - из
противодифтерийной сывороток липопротеидов.
Балластный осадок удаляют центрифугированием или
сепарированием, а прозрачную жидкость подщелачивают до pH 7,0, добавляют 0,8%
хлористого натрия и подвергают стерилизующей фильтрации. (см табл 2)
|
1
стадия
|
|
1
|
Сыворотка
разводится до 3% белка
|
|
2
|
Ферментолиз
при 23° 1 ч при pH - 3,2; 1 ч при pH - 4,2
|
|
3
|
Термоденатурация
(добавление 14% (NH4)2SО4 и прогревание при pH 4,3, 58° 45 мин.)
|
|
4
|
Фильтрация
|
|
2
стадия
|
|
1
|
Осадок
отбрасывается Высаливание иммунного глобулина: в фильтрат с pH 7,0-7,1
добавляется до 34%-ной концентрации (NH4)2SО4
|
|
2
|
Фильтрация
|
|
3
|
Фильтрат
отбрасывается. Осадок иммунного глобулина прессуется
|
|
4
|
Диализ
иммунного глобулина до 0,2% (NH4)2SО4
|
|
3
стадия
|
|
1
|
Освобождение
антитоксина от балластного белка хлороформом и подкислением НСl.
|
|
2
|
Сепарирование
|
|
3
|
Осадок
балластного белка и хлороформ отбрасываются.
|
|
4
|
Стандартизация
раствора антитоксина до 0,85% NaCl и pH 6,8-7,0
|
|
5
|
Стерилизующая
фильтрация
|
Характеристика иммунодиагностических препаратов
Как правило, серологические реакции,
обеспечивающие развитие иммунных реакций организма могут быть поставлены в двух
вариантах:
с известными иммунными или гипериммунными
сыворотками (диагностические сыворотки) для определения (идентификации и
типизации) вирусов, выделенных из исследуемого патологического материала;
с известными антигенами (диагностикумами) для
обнаружения антител и определения их количества в присылаемых для исследования
сыворотках крови, взятых от больных и переболевших животных.
С помощью серологических реакций
можно установить сроки появления в крови антител у вакцинированных животных и выявить
динамику антителообразования. Диагностикумы - взвеси убитых микробов, которые
служат в качестве антигенов при серологических исследованиях и аллергенов для
аллергических диагностических проб.
Диагностикумы нашли широкое применение при диагностике брюшного тифа
<#"580049.files/image001.gif">
Рисунок 1 - Классификация и цели
использования реакции агглютинации (РА)
В качестве антигена в РА используют
суточную взвесь живых или убитых формалином, спиртом, нагреванием бактерий
(диагностикумы). Обычно для приготовления бактериальных антигенов используют
S-формы культур, которые в 0,5 % растворе натрия хлорида образуют равномерную
взвесь. R-формы бактерий как антигены не пригодны, так как агглютинируются
спонтанно.
Для получения агглютинирующих
сывороток иммунизируют кроликов. При этом им 5-7 раз подкожно, а затем
внутривенно с интервалами 2-7 суток в возрастающих дозах вводят убитые
бактерии. Заканчивают курс иммунизации животных 2-3 инъекциями живых бактерий.
Через неделю определяют титр сыворотки - максимальное ее разведение, которое
агглютинирует гомологичный микроорганизм. Если титр сыворотки недостаточен,
иммунизацию продолжают.
Полученные таким путем
агглютинирующие сыворотки называются неадсорбированными, поскольку содержат
групповые агглютинины и могут в небольших разведениях склеивать родственные в
антигенном отношении бактерии. Поэтому для определения вида бактерий надо
ставить развернутую реакцию с сывороткой, разведенной от 1:100 до ее титра.
Сыворотка соответствует микробу в том случае, если агглютинирует его как
минимум до половины титра.
В некоторых случаях, когда, для
агглютинации берется небольшое количество бактерий и учесть ориентировочную РА
из-за этого трудно, капли сыворотки с внесенной в нее культурой высушивают,
фиксируют, окрашивают фуксином Пфейффера и микроскопируют. При положительной
реакции агглютинации в отдельных полях зрения микроскопа наблюдаются скопления
бактерий, при отрицательной - бактерии распределены в мазке равномерно. Эта
реакция получила название микроагглютинации. Агглютинацию живых лептоспир
наблюдают в темном поле зрения в раздавленной капле, где они, склеиваясь,
обнаруживаются в виде искрящихся «паучков».
Ориентировочная РА ставится перед
постановкой развернутой РА дня того, чтобы получить предварительное
представление об антигенной структуре бактерий, отобрать положительно
реагирующие с сывороткой колонии и исключить из дальнейших исследований
неагглютинирующиеся.
Развернутая РА для идентификации
бактерий. Ставят ее следующим образом. В агглютинационные пробирки
предварительно разливают по 1 мл изотонического раствора натрия хлорида. В
первую из них доливают 1 мл сыворотки, разведенной 1:100, и, смешав ее, 1 мл
переносят во вторую, из второй - в третью и т. д. В полученные двукратные
разведения сывороток (от 1:100 до 1:1600 и более) вносят по 1-2 капли антигена
(двухмиллиардной взвеси бактерий). Контролями служат изотонический раствор
натрия хлорида с антигеном и исследуемая сыворотка без него. Пробирки энергично
встряхивают и помещают на 2 ч в термостат при температуре 37 °С, затем
осуществляют предварительный учет, начиная с контролей. Отсутствие агглютинации
в контроле и наличие взвешенных хлопьев в двух, трех и более пробирках опыта
свидетельствуют о положительной реакции. Окончательные результаты учитывают
через 18-20 ч, выдерживая штатив с пробирками при комнатной температуре.
Интенсивность реакции выражается плюсами: «++++» - сыворотка прозрачная, с
хлопьевидным осадком склеивающихся бактерий на дне пробирки; «+++», «++» и «+»
- убывающие просветления с уменьшением бактериального осадка. Заостряя внимание
на агглютинате и его характере, следует указать, что жгутиковые бактерии
агглютинируются в виде рыхлых легковзбиваемых хлопьев спустя 2 часа, а
безжгутиковые бактерии и риккетсии склеиваются через 18-20 ч с образованием
мелкозернистых трудноразбиваемых при встряхивании осадков.
Развернутая РА для идентификации
инфекционных заболеваний. Эта реакция позволяет обнаружить в сыворотке больных
для антитела к определенным видам патогенных микроорганизмов. Наличие их в
крови - хотя и косвенный, но очень важный показатель природы заболевания, так
как образуются они только под воздействием соответствующего возбудителя. Способ
подтверждения диагноза по титру антител получил название «серодиагностика».
Развернутая РА дня серодиагностики ставится в сыворотке больных. Ее, как и
диагностическую сыворотку, разводят в изотоническом растворе натрия хлорида от
1:50-1:100 до 1:800 или 1:1600, так как в более низких титрах сыворотки могут
находиться нормальные агглютинины, имеющиеся у здоровых людей или больных с
другим диагнозом. В качестве антигена в этой реакции используют диагностикумы -
заведомо известные взвеси, как правило, убитых бактерий, с которыми безопасно
работать. РА для серодиагностики ставится и учитывается так же, как развернутая
РА для определения вида бактерий. Диагностическое значение имеют титры
1:100-1:200 и выше, т. е. такое высокое содержание антител в сыворотке больных
подтверждает клинический диагноз. Более достоверные результаты дает выявление
нарастания титра антител в «парных» сыворотках, полученных от больного в начале
заболевания и спустя 7-10 суток, когда титр агглютининов под воздействием
патогенного микроба повышается в 1,3-2 раза и более.
В лабораторной диагностике
определенное значение придается выявлению в сыворотке О-,-Н-, Vi-агглютининов,
которые вырабатываются в разное время болезни, например при брюшном тифе и
паратифах О-агглютинины накапливаются в ее разгаре, Н - в конце, a Vi - у
выздоровевшего. Для их обнаружения готовят О-, Н-, Vi- диагностикумы, прогревая
взвеси бактерий при температуре 100 °С в течение 1,5-2 ч (О), обрабатывая их
формалином (Н) или спиртом (Vi).
Реакция непрямой гемаглютинации
(РНГА). Реакция ставятся: 1) для обнаружения полисахаридов, белков, экстрактов
бактерий и других высокодисперсных веществ, риккетсий и вирусов, комплексы
которых с агглютанинами в обычных РА увидеть не удается, или 2) для выявления
антител в сыворотках больных к этим высокодисперсным веществам и мельчайшим
микроорганизмам. Используя РИГА для обнаружения антител в сыворотках
серодиагностики больных, готовят эритроцитарные антигенные диагностикумы. Для
этого эритроциты обрабатывают раствором танина в разведении 1:20000-1:200000 в
течение 15 мин, что придает им устойчивость и повышает адсорбционную
способность. Затем их смешивают с известным антигеном и инкубируют 2 ч при
температуре 37 °С. Сенсибилизированные антигеном эритроциты 2-3 раза отмывают
0,85 % раствором натрия хлорида и в количестве 0,1- 0,25 мл 0,5 % взвеси
добавляют к сыворотке, разведенной от 1:10 до 1:1280 и разлитой по 0,25-0,5 мл
в луночки плексигласовых досок. В качестве контроля используют взвеси интактных
и нагруженных антигеном эритроцитов, которые вносят в сыворотки, дающие
заведомо положительную и отрицательную реакции. Результаты учитывают через 2 ч
после инкубации в термостате. РНГА оценивают плюсами: «++++» - эритроциты
равномерно покрывают всю лунку пластинки в виде зонтика с неровными краями; «+++»
и «++» - осадок эритроцитов в виде зонтика, в центре небольшое кольцо из
нескле- ившихся эритроцитов; «+» - в основном несклеившиеся эритроциты. При
отрицательной реакции эритроциты спонтанно агглютинируют в виде маленького
диска («пуговицы») на дне лунок. В серодиагностике бактериальных и
риккетсиозных инфекций РНГА по чувствительности и наглядности результатов
превосходит развернутую РА, а при индикации противовирусных антител и вовсе не
может быть ею заменена. [4]
Реакции преципитации
Реакцией преципитации (РП)
называется осаждение из раствора антигена (преципитиногена) при воздействии на
него иммунной сыворотки (преципитина) и электролита. Посредством РП можно
выявить антиген в разведениях 1:100000 и даже 1:1000000, т. е. в таких малых
количествах, которые не обнаруживаются химическим путем. Преципитиногены
представляют собой ультрамикроскопические частицы белково-полисахаридной
природы, экстракты из микроорганизмов, органов и тканей, продукты распада
бактериальных клеток, их лизаты, фильтраты патологического материала. Так как
преципитиногены обладают термоустойчивосгью, то для их извлечения материалы
подвергаются кипячению. В РП используются жидкие и прозрачные антигены.
Преципитирующие сыворотки обычно получают путем гипериммунизации кроликов циклами
в течение нескольких месяцев, вводя им бактериальные взвеси, фильтраты
бульонных культур, аутолизаты, солевые экстракты микроорганизмов, сывороточные
белки.
Титр преципитирующей сыворотки в
отличие от титра других диагностических сывороток определяется максимальным
разведением антигена, который преципитируется данной сывороткой. Это
объясняется тем, что преципитоген, участвующий в РП, содержит в единице объема
гораздо больше частиц, чем антител в преципитирующей сыворотке такого же
объема. В связи с этим преципитирующие сыворотки выпускают с титром не ниже
1:100000.
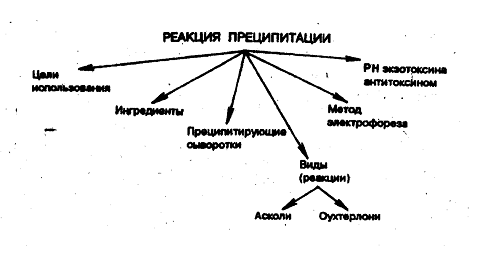
Рисунок 2 - Классификация и цели
использования реакции преципитации (РП)
Реакция кольцепреципитации Асколли.
В узкую пробирку диаметром 0,5 см с неразведенной преципитирующей сывороткой в
количестве 0,3-0,5 мл, держа ее в наклонном положении, пастеровской пипеткой
медленно по стенке наслаивается такой же объем антигена. Пробирку осторожно,
чтобы не смешать жидкости, ставят вертикально. При правильном наслоении
преципитиногена на сыворотку четко обозначается граница между двумя слоями
жидкости. Результаты реакции учитывают в зависимости от вида антигена и антител
через 5-10 мин, 1-2 ч или через 20-24 ч. В случае положительной реакции в
пробирке на границе между сывороткой и исследуемым экстрактом появляется
преципитат в виде кольца белого цвета Постановка реакции обязательно
сопровождается контролями сыворотки и антигена. Реакцию кольцепреципигации
широко используют не только в диагностике инфекционных болезней бактериальной и
вирусной природы, но и в судебной медицине для определения видовой
принадлежности белка, в частности кровяных пятен; в санитарной практике при
выявлении фальсификации мясных, рыбных, мучных изделий, примесей в молоке. С её
помощью удается определить степень родства различных видов животных и растений.
Недостаток реакции кольцепреципигации - нестойкость преципитата (кольца),
который исчезает даже при легком встряхивании. Кроме того, с ее помощью нельзя
определить количественный состав антигенов, участвующих в формировании
преципитата.
Двойная радиальная иммунодиффузия в
агаре (метод Оухтарлони) Реакцию ставят на чашках Петри в лунках пластинок
агарового геля, вследствие чего ее также называют реакцией преципитации в
агаровом геле (РПГ). Антигены и сыворотки в РПГ вносятся так, чтобы лунки,
содержащие их, находились на определенном расстоянии. Диффундируя навстречу и
соединяясь друг с другом, антитело и антиген образуют иммунологический
комплекс, визуально обнаруживаемый в виде белой полосы (дуги). При наличии
сложного по составу преципитиногена может возникать несколько линий
преципитата. У серологически родственных антигенов они сливаются воедино, а у
разнородных - перекрещиваются, что позволяет определить детали их антигенной
структуры. Реакция Оухтерлони в различных модификациях широко используется в
диагностике вирусных и бактериальных заболеваний.
Иммуноэлектрофорез. С помощью этого
метода можно провести более тонкий анализ антигенной структуры бактерий,
белков, тканей, произвести идентификацию отдельных антигенов в
многокомпонентной системе.
В основе метода лежит электрофорез
антигенов в геле с последующей их преципитацией иммунной сывороткой. Для
постановки реакции иммуноэлектрофореза используют пластины из стекла, на
которые нанесен слой агара. Вначале антиген, помещенный в центре такой
пластины, разделяется в электрическом поле. Затем в канавку агара,
расположенную параллельно линии, по которой разделялись антигены, добавляют
иммунную сыворотку. Диффундируя навстречу друг другу, антигены и антитела в
месте их встречи образуют дуги преципитации.
Реакция связывания комплемента (РСК)
Реакция связывания комплемента (РСК)
- сложная двухэтапная реакция, в которой используются пять ингредиентов,
составляющих две системы: антиген, антитело и комплемент (первая система),
эритроциты барана, сенсибилизированные (обработанные) гемолитической
сывороткой, содержащей специфические к ним антитела (вторая, или гемолитическая
индикаторная система). При этом взаимодействие антитела с антигеном на первом
этапе реакции приводит к образованию иммунного комплекса, что сопровождается
активацией (адсорбцией) на нем комплемента, но визуально обнаружить это
невозможно. Ввиду этого Дж. Борде и О. Жангу предложили на втором этапе
постановки реакции в качестве индикатора фиксации комплемента на комплексе
антиген-антитело использовать гемсистему, которая, сама являясь иммунным
комплексом, тоже способна связывать его. В конечном итоге возможны два
результата реакции. Если антитело и антиген соответствуют друг другу и
комлемент связывается образовавшимся комплексом, гемолиза эритроцитов
гемсистемы не произойдет. При несоответствии антитела антигену комплемент,
оставаясь свободным, присоединится к гемсистеме и вызовет гемолиз (рис. 3).
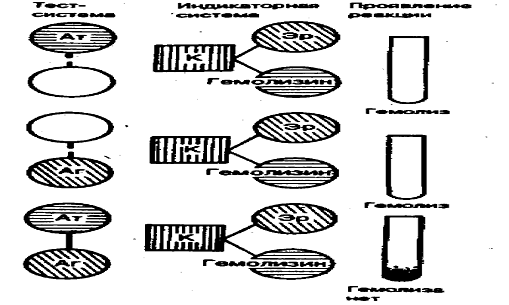
Рисунок 3 - Реакция связывания
комплемента 1 - положительная, 2,3 - отрицательная. Ат - антитело, Аг -
антиген, К - комплимент, Эр - эритроциты барана.
Как и другие серологические реакции,
РСК может быть использована для выявления специфических антител по известному
антигену или для определения антигена по известным антителам.
Реакция нейтрализации
Репродуцируясь в культурах клеток, вирусы
вызывают разного рода цитопатическое действие (ЦПД), выражающееся в округлении,
сморщивании, уменьшении или, наоборот, увеличении размеров клеток, слиянии их и
образовании симпластов, деструкции цитоплазмы и ядра. Наконец, в монослое
клеток, зараженных вирусами, в результате разрушения ими отдельных участков
клеточного пласта могут появляться «стерильные пятна», или бляшки,
представляющие собой клон вирусной частицы, что дает возможность не только
изолировать вирус, но и определить его титр. Для этого из флакона с монослойной
культурой клеток удаляют питательную среду и заражают ее вирусом. После
адсорбций вируса на клетках через 30-60 мин культуру клеток быстро покрывают 3
% расплавленным агаром, содержащим лошадиную сыворотку, солевые добавки и
индикатор нейтральный красный. В монослое, где происходит нормальный рост
клеток, среда подкисляется и индикатор окрашивает его в розовый цвет.
Пораженные вирусом клетки прекращают метаболизм, pH не меняется и в этих местах
четко обозначаются островки неокрашенной среды в виде беловатых бляшек
различных размеров и конфигураций. Идентифицировать вирус по характеру бляшек
очень трудно, и поэтому прибегают к постановке реакции нейтрализации (PH)
выделенного вируса заведомо известными вируснейтрализующими сыворотками. С этой
целью полученный от больного вирус накапливают в культуре клеток и различные
его разведения вмешивают с неразведанной противовирусной сывороткой или,
наоборот, Достоянную дозу вируса добавляют к различным разведениям иммунной
выворотки. Смеси инкубируют в термостате при температуре 37 °С в течение 1-2 ч
или при температуре 4 °С в течение 18 ч. После этого смесями вируса и сыворотки
заражают культуру клеток и о нейтрализующей силе ее антител судят по отсутствию
ЦПД на клетки.
Смесью вирусов и сывороток можно заражать
куриные эмбрионы или чувствительных животных. В таких случаях нейтрализующую
активность антител чаще всего определяют по нейтрализации вирусных
гемагглютининов в жидкостях эмбриона и устранению летального действия вируса на
эмбрионы и животных. Одновременно вычисляют индекс нейтрализации, выражающий
максимальное количество смертельных доз вируса, которое нейтрализуется данной
сывороткой, по сравнению с результатами контрольного опыта, принимаемыми за
единицу.
Подобным образом с помощью PH идентифицируются
вирусы, выделенные из материала больных при заражении им куриных эмбрионов и
животных. В таких случаях к вируснейтрализукмцим сывороткам прибавляют
вируссодержащие жидкости эмбрионов и взвеси пораженных органов животных. После
определенного времени инкубации смесями инфицируют культуры клеток, куриные
эмбрионы и животных.
В серодиагностике вирусных инфекций PH
определяют динамику нарастания тигра вируснейтрализующих антител по известному
вирусу. При этом ставим реакцию с парными сыворотками, взятыми от больных в
начале и в конце болезни. Диагностическим явится 4-кратное возрастание титра
иммуноглобулинов во второй из них. [11]
Основные принципы производства
иммунодиагностикумов
Агглютинирующие сыворотки готовятся путем
гипериммунизации животных корпускулярным антигеном. В качестве продуцентов для
их получения используют различных животных. Большинство исследователей получали
агглютинирующие сыворотки на кроликах. Сравнительное изучение качества
получаемых агглютинирующих сывороток при использовании различных животных
показало, что кролики являются наиболее реактивными. Кроме того, они дают
наиболее специфичные сыворотки. При необходимости получения агглютинирующих
сывороток в больших количествах используют крупных животных, как-то: коз,
баранов, ослов, лошадей. Также ряд исследователей с успехом готовили
агглютинирующую брюшнотифозную и дизентерийную сыворотки на ослах. Б. Г.
Вайнберг (1939) получил хорошую продукцию брюшнотифозных агглютининов при
иммунизации сусликов. М. И. Федорович (1949) готовила агглютинирующие сыворотки
против кишечнотифозной группы бактерий, помимо кроликов, на лошадях, козах,
баранах. Н. А. Хоменко и Т. С. Фейгин (1965) указывают, что хотя сыворотки от
крупных животных менее специфичны, они могут быть выпущены после
соответствующей обработки в виде строго специфичных адсорбированных препаратов.
Для производства сывороток используют половозрелых
животных со сформировавшейся нервной системой. Рекомендуется применять для
иммунизации кроликов с 8-месячного возраста. При изучении продукции
брюшнотифозных антител пришли к выводу что наибольшие титры сывороток дают
кролики весом 2-2,5 кг. Рекомендуется применять для приготовления анаэробных
агглютинирующих сывороток животных весом около 3 кг. Примерно такого же веса
кроликов использовал Н. М. Ландсман (1970). Помимо этого он применял
1,5-2-летних баранов весом 30-40 кг. Что касается требований к лошадям, то они
аналогичны тем, которые предъявляют к этому виду животных, предназначенных для
производств гипериммунных сывороток.
Особое внимание исследователей обращается на
состояние упитанности животных. Было показано, что от лошадей с хорошей упитанностью
титры агглютинирующей дизентерийной сыворотки были в 5 раз выше, чем при плохой
упитанности. Диалогичные данные наблюдались и при использовании других видов
животных.
При получении агглютинирующих сывороток
некоторые авторы придают значение наличию у животных нормальных антител. Так, В
С. Киктейко (1940) показал, что чем выше уровень нормальных агглютинирующих
антител в сыворотке крови кроликов, тем более высокие титры получают иммунных
агглютининов.
В качестве антигена при получении последних применяют
живые или убитые различными способами культуры. Большое значение при
производстве агглютинирующих сывороток имеет антигенный аппарат бактерий,
используемых для иммунизации животных. В настоящее время твердо установлено,
что более полноценный антигенный аппарат отмечается у бактерий в S-форме.
Диссоциация подчас приводит к потере видовой специфичности. Бактерии имеют
сложную антигенную структуру. Известно наличие у многих бактерий групповых,
видовых и типовых антигенов. Так, у сальмонелл различают основные антигены:
соматический О-антиген и жгутиковый Н-антиген. Соматический О-антиген
расположен на поверхности бактериальной клетки, соответствует полному антигену
Буавена. Имеются жгутиковые Н-антигены. Одни Н-антигены обладают специфическими
свойствами, характерными для вида, так называемые Н-антигены 1-й фазы, другие -
Н-антигены 2-й фазы - неспецифические, обнаруживаются у различных видов
сальмонелл. Кроме этих основных антигенных комплексов некоторые сальмонеллы
содержат Vi-антиген и поверхностные антигены комплекса К-антигенов.
Знание антигенного аппарата сальмонелл позволило
Кауфману и Уайту (1953) создать схему их классификации. На основе общности
О-антигенных кохмплексов группа разбита на подгруппы. На основе же наличия
специфических и неспецифических Н-антигенов в отдельных подгруппах определены
типы.
При выборе метода изготовления антигена следует
учитывать, что антигенные комплексы обладают неодинаковой чувствительностью к
воздействию температуры и химических веществ. Vi-антиген сальмонеллезных бактерий
не выдерживает нагревания при температуре 60° в течение 30 минут; полное его
разрушение наступает при кипячении. Жгутиковые Н-антигены полностью разрушаются
при 2,5-часовом кипячении бактерий или обработке спиртом. Соматический
О-антиген термостабилен, не разрушается при кипячении и автоклавировании,
выдерживает обработку спиртом, ацетоном, формалином, эфиром, хлороформом,
мертиолятом. Поверхностные антигены относительно устойчивы к обработке
формалином. Воздействие формалина в количестве 0,1-0,3% или в виде паров
обеспечивает сохранение О-, К- и Н-антигенов. Vi-антиген лабилен и разрушается
от незначительных химических или физических воздействий. Гипериммунизация
вакцинами или живыми микробными телами, содержащими различные антигенные
комплексы, способствует образованию соответствующих им антител.
Используемые при производстве агглютинирующих
сывороток штаммы должны быть типичными по морфологическим культуральным и
биохимическим свойствам, находиться в S-форме. Они должны агглютинироваться
гомологичными сыворотками.
В качестве антигена применяют живые и убитые
микробные тела. Для производства культура засевается на твердую или жидкую
питательные среды (последние используются при производстве, например,
сывороток, содержащих Н-антитела). Длительность культивирования зависит от вида
микроба. Способы приготовления антигена различны. В качестве примера приведем
некоторые из них. Для получения Vi-сыворотки можно применить для иммунизации
живую культуру, состоящую из О-агглютинабельных штаммов в V-форме. Было
показано, что Vi-антиген содержится в большинстве случаев в свежевыделенных из
организма брюшнотифозных больных гемокультурах. Для иммунизации животных лучше
применять вновь пересеянные суточные культуры. Хотя следует отметить, что
Vi-антиген, помимо свежих, обнаружен и в старых культурах. Показано, что его
можно выделить из брюшнотифозных микробов путем осаждения полного антигена
квасцами. Для получения Н-сыворотки используют Н-антиген в однофазном
состоянии. Для этого штаммы с достаточно развитым жгутиковым аппаратом
выращивают на жидкой питательной среде. 3. С, Островская (1940), S. Bornstein
(1943) и др. получали Н-антиген путем обработки микробной культуры формалином
или использовали живую культуру. Однако при этом сохраняется и О-антиген. Для
получения чистого Н-антигена S. Bornstein (1943) рекомендует бактерийные взвеси
повторно центрифугировать, так как при этом отделяются жгутики.
Попытка применить иммунологическую подготовку
(грундирование) животных не дала положительного эффекта. Антиген вводится в
возрастающих количествах с интервалом между инъекциями в 3-5 дней, Такие
интервалы используются при изготовлении многих агглютинирующих сывороток
(лептоспирозных, против бактерий рода шигелл, рода сальмонелл, коли-сывороток и
т. д.). Так, примерная схема иммунизации кроликов при изготовлении
агглютинирующей сыворотки против бактерий рода шигелл: 500 млн. - 1 млрд. - 2
млрд. микробных тел в 1 мл внутривенно, при изготовлении агглютинирующих
лептоспирозных сывороток антиген в виде 9-10-дневной бульонной культуры вводят
по схеме 2-3-5 мл внутривенно. Длительность интервала и доза введения антигена
в значительной степени зависят от токсичности антигена.
Реже применяется схема, при которой антиген
вводится несколькими циклами по 3 ежедневные инъекции за цикл промежутками
между циклами в 6-7 дней. Количество циклов определяется напряженностью титра
антител. Такая иммунизация используется, например, при производстве
агглютинирующей дифтерийной сыворотки. Схема введения антигена при ней
следующая: 1-й цикл - 500 млн. - 1 млрд.- 2 млрд. микробных тел в виде
формолвакцины ежедневно; 2- й цикл - 3 млрд.- 4 млрд. -5 млрд. микробных тел;
3-й цикл - 6 млрд. -7 млрд. -8 млрд. На 5-12-й день после иммунизации
проводится кровопускание, после которого животным дается отдых в 20-30 дней, и
начинается следующий цикл.
При приготовлении агглютинирующих сывороток на
мелких животных после проведения цикла их кровопускают, а затем через 48 часов
полностью обескровливают. Данный прием предупреждает получение сывороток с
наличием групповых агглютининов. Длительная гипериммунизация жиротных
способствует этому.
Полученная из крови сыворотка консервируется
1-2% перекристаллизованной борной кислотой или мертиолятом 1:10000. Считается,
что агглютинирующие сыворотки сохраняют лучше свой титр при консервировании их
40% глицерина или 0,1% хинозола. С данной целью используются и другие
консерванты. Лучшим методом сохранения сыворотками иммунных свойств является их
лиофилизация.
Агглютинирующие сыворотки выпускаются в нативном
и адсорбированном виде. В нативном виде они применяются для ориентировочной
идентификации микробов в развернутой пробирочной реакции агглютинации или в
реакции агглютинации на стекле.
Для более тонкой дифференциации микробов
используют адсорбированные сыворотки. Они могут содержать от одного вида
антител (монорецепторные) до двух и больше (поливалентные).
Возможность их получения была показана К. Aok
(1926) и Т. Haashi (1927). В СССР впервые они были приготовлены для
тифо-паратифозных и дизентерийных бактерий Ф. Г. Бернгофом и П. Н. Скраник
(1937), Ф. Г. Бернгофом (1944), Л. Д. Гринберг и Ю. Г. Вейсман. Последние
авторы, пользуясь методом Кастелляни, извлекали из сыворотки групповые антигены
и оставляли один типоспецифический.
Принцип изготовления адсорбированных сывороток
заключается в насыщении их всеми неспецифическими групповыми антигенами, при
этом неистощенными остаются антитела к специфическим антигенам.
Для адсорбции используется микробная масса в
виде живых или убитых бактерий.
Для изготовления адсорбированных агглютинирующих
сывороток удобно для адсорбции использовать лиофилизированную микробную массу,
полученную из культур, выращенных реакторным методом и убитых формалином или
нагреванием. Это позволяет всегда иметь в распоряжении полный набор необходимых
адсорбентов с неограниченным сроком хранения.
На качество получаемых адсорбированных сывороток
влияет ряд моментов. Показано, что удаление из сыворотки гетерологичных
агглютининов зависит от количественных соотношений между антителами сыворотки и
добавляемыми адсорбентами. Важно достигнуть в сыворотке минимальной
концентрации антител, подлежащих удалению при сохранении достаточного
количества гомологичных агглютининов.
После окончания адсорбции микробная масса
удаляется центрифугированием или сепарированием на сепараторах АСГ-1А, готовая
адсорбированная сыворотка подвергается стерилизующей фильтрации.
Повысить титры готовых адсорбированных сывороток
можно путем концентрации их сернокислым аммонием, а также ультрафильтрацией.
Сыворотки выпускаются в жидком и сухом виде. Для выпуска неадсорбированных
агглютинирующих сывороток в лиофилизированном виде в них добавляют сахарозу, а
в адсорбированные - сахарозо-желатиновую среду. Выпускаются они в наборах, при
комплектовании которых учитывается распространенность отдельных видов и типов
бактерий.
Применяют агглютинирующие сыворотки для
серологической идентификации и типирования микробов в реакции агглютинации на
стекле и в развернутой реакции агглютинации. Срок годности жидких сывороток 1
год при температуре +4 С°, сухих - 3 и больше лет при комнатной температуре.
В настоящее время изготавливаются также
различные преципитирующие сыворотки. Так, нашли широкое применение в судебной
экспертизе диагностические сыворотки к различным чужеродным белкам (человека,
животных, птиц), в медицине и ветеринарии - преципитирующая сибиреязвенная
сыворотка, в медицине - диагностические преципитирующие дизентерийная для
постановки реакции кольцепреципитации с целью выявления специфических
полисахаридов дизентерийных микробов, стрептококковые А, В, С, Д для
типирования соответствующего микроба, оспенная, полиомиелитная для постановки
реакции преципитации в агаре и другие.
Принципы изготовления различных гипериммунных
преципитирующих сывороток примерно одинаковы.
Широко применяется в судебно-медицинской
практике преципитирующая сыворотка к чужеродным белкам. Для ее производства
используют кроликов. Считается, что лучшими продуцентами являются
животные-самцы. Определенное значение имеет возраст кроликов. Некоторые авторы
указывают на пониженную способность молодых животных продуцировать
преципитирующие сыворотки. Большое значение при производстве преципитирующей с
чужеродными белками сыворотки имеет схема иммунизации.
Наиболее оптимальным сроком между первичной
иммунизацией и реиммунизацией кроликов гетерогенными белками с целью получения
высоких титров преципитинов, является 2 месяца и больше (до 26 месяцев). Весьма
эффективна двухкратная реиммунизация с интервалом в 30-60 дней Предложенные
различные схемы гипериммунизации включают многократные внутривенные инъекции
антигена. При первичной иммунизации вводили внутривенно гетерогенный белок в
малых дозах (0,01-0,03 мл), при отдаленной реиммунизации - двухкратно большие
дозы (0,1 мл). С целью увеличения титра антител применяется полный и неполный
адъюванты Фрейнда. Лучшее образование преципитинов наблюдалось при
использовании последнего.
В последние годы ведутся исследования по
получению преципитирующих вирусных сывороток для постановки реакции
преципитации в агаре.
Практическое применение находит гипериммунная
оспенная кроличья сыворотка в реакции микропреципитации в агаре, основанная на
образовании в агаровом геле зон преципитации при взаимодействии оспенного
антигена со специфической сывороткой. Реакция применяется для быстрой
диагностики натуральной оспы или вакцинии. Этот метод впервые был предложен К-
Dumbell, М. Nizamuddin (1959).
Сыворотка для постановки реакции преципитации в
агаровом геле была изготовлена К. Dumbell, М. Nizamuddin (1959). Несколько
позднее С. С. Маренникова и Н. Н. Мальцева (1961) разработали схему и
предложили в производство гипериммунизацию кроликов вирусвакциной, включающую
вначале накожную аппликацию вируса и последующие внутривенные инъекции антигена
(2-4) в уменьшающихся дозах с интервалом между введениями 5 дней. Кровопускание
проводили через 7 дней после последней инъекции антигена.
Большие исследования по совершенствованию схем
гипериммунизации кроликов с целью получения высокоактивных преципитирующих
оспенных сывороток проведены в Томском институте вакцин и сывороток. Испытание
различных вариантов схем и методов введения, выполненные на значительном числе
кроликов, показало, что наиболее оптимальной является нанесение антигена на
скарифицированную кожу кролика в объеме 0,2-0,3 мл с последующей внутривенной
иммунизацией в дозе 1, 6 мл за 2 инъекции с интервалом между инъекциями в 12
дней и кровопусканием на 8-й день после окончания иммунизации. Эта схема
позволяет получать сыворотки с титром преципитинов в 1-м цикле 1:8±1,7, во 2-м
- 1:17,3±1,8, в 3ем - 1:14,5±1,1. Интенсивное образование преципитинов отмечено
и при однократном внутривенном введении вируса. Хороший эффект дает
использование в качестве антигена штаммов Листеровского (Московский институт
вирусных препаратов), Белорусского (Минский институт эпидемиологии и микробиологии),
достаточными антигенными свойствами обладают штаммы Ташкентский и белый клон
Московского института вирусных препаратов. Очистка и концентрация полученных
сывороток методом Диаферм-3 и замораживанием позволяет получать их с более
высокими специфическими свойствами.
С целью получения нейтрализующих антител
используется метод многократного введения антигена.
Так, специфическая вируснейтрализующая
гипериммунная сыворотка против полиомиелита была приготовлена путем
многократной иммунизации обезьян, кроликов, ослов, коз, лошадей вирусом
полиомиелита, выращенным в культуре ткани. Наиболее высокие титры сывороток
наблюдались при гипериммунизации обезьян и кроликов. Рекомендуется использовать
антигены, содержащие живые и убитые вирусы, а также аттенуированные вакцинные
штаммы Сэбина. При изучении эффективности различных способов введения антигенов
и схем гипериммунизации кроликов пришли к выводу, что наиболее экономичной
является схема, включающая внутримышечную грундиммуиизацию с использованием
адъюванта и в дальнейшем внутривенные инъекции вируса.
При получении иммунных сывороток к арбовирусам
рекомендуются схемы, разработанные G. Casals (1947, 1949), D. Clarke, G. Casals
(1958). Белым мышам 5-6-недельного возраста вводят внутрибрюшинно по 0,2 мл
свежеприготовленной 10%-ной суспензии инфицированного мозга мышей-сосунков
четырехкратно с интервалом в 7 дней. Кровь берут через 7 дней после последней
инъекции антигена. Если агент патогенный, первые 2 инъекции делают
инактивированным вирусом.
Рекомендуется для получения нейтрализующих
сывороток к вирусам клещевого и японского энцефалитов осуществлять семикратные
внутрибрюшинные инъекции 10%-ной суспензии мозга инфицированных -белых мышей
кроликам с интервалом в 7-8 дней, а кровопускания проводить на 10-й день после
окончания иммунизации.
Для постановки реакции нейтрализации с целью
лабораторной диагностики аденовирусных заболеваний используется
типоспецифическая гипериммунная кроличья сыворотка. Были получены сыворотки с
титрами нейтрализующих антител от 1:64 до 1:256 при гипериммунизации кроликов
вирусом, выращенным на культуре клеток HeLa и FL, или КВ при внутривенных
шестикратных инъекциях с интервалами в 3 дня различных доз вируса с титром
103-105 ТЦД/мл, а также при комбинированной (внутривенно и внутрибрюшинно) гипериммунизации.
Для приготовления иммунных сывороток к вирусу
бешенства лучше использовать хомяков (самцов в возрасте 6-8 недель) или морских
свинок. Животных иммунизируют инактивированной мозговой тканью внутрибрюшинно
четырехкратно с 7-дневными интервалами. Антиген применяется в смеси с Arlacel и
8,5 частей минерального масла. На 10-14-й день вводят внутрибрюшинно 1,0 мл
10%-ной вируссодержащей суспензии и на 10-14-й день берут кровь.
Таким образом, для получения специфических
вируснейтрализующих сывороток используются различные схемы и способы введения
антигенов. Принципиально важным в изготовлении указанных сывороточных
диагностических препаратов является обязательный прогрев полученных сывороток с
целью инактивации неспецифических термолабильных ингибиторов. Температура
прогрева зависит от вида используемых сывороток. Сыворотки обезьян, морских
свинок и лошадей инактивируют при 56°, кроликов и белых крыс - при 60°, петухов
- при 57°, а сыворотки к вирусам СА и лихорадки Денге из-за термолабильности антител
прогреву не подлежат. [12]
Характеристика моноклональных антител
Доказательством клональной основы иммунного
ответа послужило создание гибридомной технологии для получения моноклональных
антител. Технология основана на двух достижениях клеточной биологии:
разработке метода гибридизации соматических
клеток (первоначально его использовали преимущественно в генетике);
получении линий миеломных клеток.
В 1976 г. Г. Келер (G. Koehler) и Ц. Мильштейн
(C. Milstein) применили соматическую гибридизацию для слияния миеломных и
нормальных антителообразующих клеток, что привело к созданию качественно новой
клеточной технологии гибридом (рис. 4), революционизировавшей как иммунологию,
так и биотехнологию.
Несколько ранее Ц. Мильштейн впервые использовал
миеломные белки как источник гомогенных иммуноглобулинов, необходимых для
изучения структуры V-доменов антител. Иногда удавалось определить специфичность
этих моноклональных иммуноглобулинов, но большой проблемой была невозможность
получения моноклональных антител заданной специфичности. В данном чисто
исследовательском контексте и решалась задача получения гибридом - клеток,
совмещающих два свойства: способность к неограниченному росту, которую они
наследуют от миеломных (опухолевых) клеток, и задаваемую иммунизацией
специфичность, которую они получают от антителообразующих клеток,
присутствующих в селезенке иммунизированных мышей.
Первоначально для слияния клетки обрабатывали
вирусом Сендай. Позже с этой целью стали применять полиэтиленгликоль,
вызывающий слияние клеточных мембран, благодаря наличию в его составе, наряду с
гидрофильными, гидрофобных групп. Для создания гибридом, продуциру ющих чистые
моноклональные антитела, были получены мутанты миеломы, не секретирующие
иммуноглобулины. Практически все линии миелом, используемые в настоящее время
для гибридизации, происходят от культивируемого варианта Р3 миеломы MOPC-2,
развившейся у мышей линии BALB/c и продуцирующей IgG к-типа. При получении
гибридом чаще других применяют сублинии P3 X63-Ag8.653, NS-Ag4/1 и Sp2/0-Ag14
(последняя сама по себе гибридома - продукт слияния клеток линии P3 X63-Ag8.653
и нормальных спленоцитов мышей линии BALB/c).
Клетки этих линий, утратившие способность
секретировать собственные иммуноглобулины, были отобраны на селективных средах
на устойчивость к 8-азагуанину и 6-тиогуанину (что отражено в их обозначениях).
У этих клеток блокирован запасной путь синтеза нуклеотидов из гипоксантина и гуанина,
используемых в качестве предшественников нуклеотидов. Эти особенности
используют для отбора гибридных клеток после слияния. При соблюдении всех
деталей технологии доля слившихся клеток с нужными характеристиками (возникших
при слиянии клетки миеломы и антителообразующей клетки) невелика, поэтому
необходимо создавать особые условия для их селекции. Нормальные партнеры для
слияния способны выживать in vitro в течение нескольких дней и затем погибают.
Для подавления роста опухолевых партнеров используют селективную среду НАТ,
содержащую гипоксантин (Н - Hypoxantine), аминоптерин (А - Aminopterine) и
тимидин (T - Thymidine). Аминоптерин - яд, подавляющий основной путь биосинтеза
нуклеотидов, гипоксантин и тимидин - субстраты для реализации запасных путей,
заблокированных у миеломных клеток (о чем свидетельствует устойчивость к
8-азагуанину и 6-тиогуанину), но реализуемых у гибридных клеток, которые
наследуют соответствующий ген от нормальной родительской клетки. В результате
культивирования на среде НАТ выживают только гибриды нормальных и опухолевых
клеток, унаследовавшие от клеток миеломы «бессмертие», а от нормальных клеток -
способность синтезировать нуклеотиды из гипоксантина и тимидина. Неслившиеся
опухолевые клетки или гибриды типа «миеломахмиелома» погибают, поскольку в
среде HAT нет субстрата для синтеза ими нуклеотидов или этот процесс
заблокирован. Неслившиеся нормальные клетки или их гибриды друг с другом
погибают, поскольку не способны длительное время выживать in vitro. Выжившие
клетки переводят сначала на среду НТ, а затем на обычную ростовую среду RPMI
1640. Затем возникает необходимость в отборе клеток-продуцентов антител нужной
специфичности. Это необходимо сделать как можно раньше, чтобы нужный клон не
был подавлен другими клетками. Антитела к растворимым антигенам выявляют в
иммуноферментной тест-системе, а к мембранным - методом проточной цитометрии.
При выявлении продуцентов антител нужной специфичности их клонируют - проводят
несколько пассажей клеток, постепенно увеличивая их разведение вплоть до одной
клетки на лунку. Для каждого пассажа берут клетки из лунок с наибольшим титром
антител. Получив несколько клонов, поддерживают те из них, которые обладают
преимуществами перед другими по специфичности антител, продуктивности, скорости
роста и изотипу (предпочтитение отдают IgG-антителам). Моноклональность
подтверждают методом изоэлектрофокусирования, доказательством гомогенности по
изотипу и т.д. Обычно на этапах отбора и повторного клонирования теряется много
клонов. Отобранные и стабилизированные путем повторных клонирований гибридомы
хранят в замороженном состоянии в жидком азоте. Для наработки моноклональных
антител клетки гибридомы культивируют in vitro или in vivo в брюшной полости
сингенных мышей линии BALB/c или их гибридов с другими линиями.
Несмотря на значительные целенаправленные
усилия, не удалось разработать адекватные методы получения гибридом на основе
клеток человека, хотя потребность в человеческих моноклональных антителах,
которые можно было бы использовать при иммунотерапии, очень велика. В настоящее
время эту проблему решают с помощью генно-инженерных подходов. Самый
распространенный среди них - «гуманизация» мышиных антител. Метод состоит в
создании генетических комплексов, объединяющих V-гены мышиных антител и С-гены
иммуноглобулинов человека. Следующим шагом послужила замена не только С-генов,
но и каркасных последовательностей V-генов мыши соответствующими
последовательностями генов человека. В этом случае от мышиных антител остаются
только гипервариабельные участки, определяющие специфичность антител, но не их
антигенность.
В настоящее время получение моноклональных
антител стало одним из наиболее доходных направлений биотехнологического
бизнеса. Получено огромное число моноклональных антител, с помощью которых
решены многие принципиальные проблемы иммунологии и других разделов биологии.
Моноклональные антитела широко используют в иммунодиагностике. Проточная
цитометрия была усовершенствована и нашла чрезвычайно широкое распространение в
значительной степени благодаря применению моноклональных антител. Их используют
также для фракционирования клеток, чрезвычайно востребованного в
экспериментальных исследованиях, а в последние годы ставшего очень актуальным в
связи с быстрым развитием цитотерапии. Наконец, моноклональные антитела
используют в иммунотерапии как самостоятельные факторы и основу для создания
иммунотоксинов.
Гибридомы получают также путем слияния клеток
иной природы, чем антителопродуценты, например Т-лимфоцитов. Однако этот прием
используют исключительно в экспериментальной иммунологии. [13]
Заключение
Эпидемическая обстановка в мире никогда не была
спокойной. Все время наблюдались вспышки инфекционных заболеваний и появлялись
новые виды заразных болезней, а в последние 10 лет поисходит возвращение «старых»
инфекций. Генетическая изменчивость циркулирующих штаммов, внутрибольничные
инфекции, бактерионосительство, трудности в обеспечении и применении
иммунобиологических препаратов требуют усиления работы в области
иммунопрофилактики и иммунотерапии. Недостаточное внимание к этим проблемам
неминуемо приводит к подъему инфекционной заболеваемости.
Профилактика и лечение, основанные на
иммунологических принципах, стали решающим средством снижения детской
смертности, увеличения продолжительности и улучшения качества жизни всех
возрастных групп населения. Хорошо известно, что профилактика является самым
эффективным и самым экономичным способом сохранения здоровья людей.
Изменились наши представления об
иммунопрофилактике и иммунотерапии групп повышенного риска. Именно эти группы
людей нуждаются в иммунологической помощи, так как они наиболее чувствительны к
инфекционным болезням. Резко сократился список противопоказаний к вакцинации и
иммунотерапии. В недалеком будущем он будет еще короче.
В реферате были рассмотрены основные принципы
производства сывороток и иммуноглобулинов, описаны вопросы подготовки животных,
основные принципы гипериммунизации и грундиммунизации, приведена схема
выделения и очистки готового продукта. [3]
Список использованных источников
Пол
У., Сильверстайн А., Купер М. Иммунология в 3-х т. Т. 1 - М.: Мир, 1988. 467 с.
<http://bio-mind.ru/serum/immune-13>
Медуницын
Н.В., В.И. Покровский. Основы иммунопрофилактики и иммунотерапии инфекционных
болезней - М.: ГЭОТАР-Медиа, 2005. - 512 с.
Новиков
Д.К., Генералов И.И. Основы иммунологии. - Витебск, - ВГМУ, 2007 - 160 с.
В.М.
Безгин, Н.Н. Быкова, В.Е. Козлов, А.А. Нежута, А.В. Сверчков Основы
промышленной иммунобиотехнологии - Курск, 2011
<http://bio-mind.ru/serum/immune-35>
<http://bio-mind.ru/serum/immune-37>
<http://bio-mind.ru/serum/immune-57>
<http://bio-mind.ru/serum/immune-67>
<http://imuno.net/52.php>
С.А.
Павлович. Основы иммунологии. - М.: Высшая школа, 1997 - 116 с.
<http://bio-mind.ru/serum/immune-175>
А.А.
Ярлин. Иммунология. - М.: ГЭОТАР-Медиа, 2010 - 752 с.