Структура і властивості природної кістки
ВСТУП
Розробка матеріалів для медицини є однією з найважливіших завдань
сучасного матеріалознавства [1-4]. Найбільш перспективні для застосування в
кістковій хірургії матеріали на основі гідроксиапатиту (ГАП) Са10(РО4)6(ОН)2,
який виявляє здатність до утворення безпосереднього зв'язку з кістковою
тканиною і характеризується остеокондуктівнимі поведінкою, стійкістю до
біорезорбціі і відсутністю негативних реакцій організму [1-5]. Біологічну
поведінку керамічних матеріалів на основі ГАП залежить від багатьох факторів, в
тому числі від їх хімічного і фазового складу, мікроструктури, розміру та
змісту пор.
У хірургії використовують як щільно спеченим, так і пористу кераміку, в
залежності від вимог, що пред'являються до несучої здатності імплантується
пристрою.Пориста кераміка має низьку міцність, тому її можна використовувати
або для імплантації в тканини, що не несуть значних навантажень (операції на
середнє вухо, деякі щелепно-лицьові операції), або як засіб для локалізований
доставки лікарських препаратів [11]. Пори в імплантаті необхідні для
остеоінтеграції. Цей процес залежить від розміру, кількості та ступеня
взаємозв'язку пор. Вважають, що мінімальний розмір пор, необхідних для
проростання кісткової тканини в імплантат, становить 100-135 мкм; чим більше їх
зміст і ступінь взаємозв'язку, тим ефективніше протікають процеси проростання і
фіксації кісткової тканини. Розмноженню остеогенних клітин передує адсорбція
протеїнів, отже, наявність також і тонких, субмікронних пір, порівнянних за
розміром з протеїнами плазми крові, має сприяти біоінтеграціі [11]. Таким
чином, необхідна кераміка з бімодального розподілом пор.
Особливий інтерес представляють гранули з ГАП, які знайшли застосування,
наприклад в щелепно-лицевої хірургії та системи доставки лікарських препаратів.
Гранули можуть бути виготовлені різними способами, включаючи дроблення блоків з
подальшою обкаткою, розпилювальної сушінням, загартуванням в рідину,
гідротермальних синтезом з отриманням нерегулярної або близькою до сферичної
геометрії.Остання краще як для запобігання запальної реакції організму, так і
для процесу остеоінтеграції [13].
На основі пористої кераміки можуть бути створені композиційні матеріали,
наприклад просоченням порового простору полімером. Це дозволить підвищити
міцність до рівня, необхідного для застосування матеріалу як кісткового
імплантату, що несе значні навантаження. Багато із зазначених завдань, зокрема
технологія пористих гранул сферичної форми, кераміки з бімодального розподілом
пор, композиційних матеріалів на основі ГАП не можна розглядати як повністю
вирішені, незважаючи на їх актуальність у зв'язку з потребами сучасної
медицини.
1.
ЛІТЕРАТУРНИЙ ОГЛЯД
1.1 Структура і властивості природної кістки
Важливо знати фізичні, хімічні та механічні властивості природної кістки,
тому що вони дають необхідні кількісні орієнтири при розробці нових матеріалів
для виготовлення медичних імплантатів. Кістка живої людини є складно
влаштованою, активно функціонуючою і безперервно змінючуїмся протягом життя
органом. Структурно-функціональною одиницею кістки є остеон, що представляє
собою мікроскопічну систему кісткових трубок (циліндрів) вставлених один в
одного. Центром системи є живильний канал діаметром від 10 до 100 мкм,
усередині якого проходить кровоносну капіляр. Кількість кісткових циліндрів,
складових остеон, може коливатися від 4 до 20. З остеонів складається компактна
речовина кістки, а губчасту речовину кістки представляє собою пористу матрицю
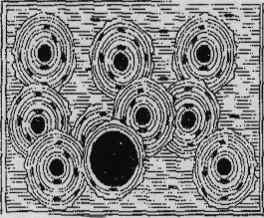
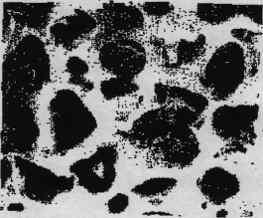
(рис.1.1). Зовні кістка вкрита тонкою сполучною тканиною (окістям), що містить
судини і нерви, які проникають в товщу кістки через так звані живильні отвори.
Внутрішній шар окістя містить велику кількість остеобластів, за рахунок яких
відбувається ріст кістки [10].
а б
Рис. 1.1 - Структура компактної (а) і губчастої (б) кістки дорослої
людини.
Кістка є кераміко-рганічною композиційним матеріалом, головними
складовими якого є колаген (20%), фосфат кальцію (69%) і вода (9%). Інші
органічні матеріали, типу білків, полісахаридів, ліпідів і т.д. представлені в
малих кількостях [21]. Колаген знаходиться всередині кісткової тканини у
вигляді мікроволокондіаметром від 100 до 2000 нм. Фосфат кальцію у вигляді
закристалізованій ГАП забезпечує жорсткість кістки. Кристали ГАП мають вигляд
голок приблизнодовжиною 40-60 нм, шириною 20 нм, і товщиною 1,5-5 нм [10].
Мінеральний компонент кістки, хоча і подібний ГАП, але він містить домішки
іонів фтору, магнію,натрію та ін [1] (табл. 1.1).
Таблиця 1.1 - Зміст неорганічних фаз у кістки дорослої людини.
|
Елементи
|
Кількість^ %
|
|
Кальцій
|
34,8
|
|
Фосфор
|
15,2
|
|
Натрій
|
0,9
|
|
Магній
|
0,72
|
|
Калій
|
0,03
|
|
Карбонати
|
7,4
|
|
Фтор
|
0,03
|
|
Хлор
|
0,13
|
|
Пірофосфати
|
0,07
|
|
Інші елементи
|
0,04
|
Кістка дуже неоднорідна по мікроструктурі і механічними властивостями.
Механічні властивості визначаються пористістю (зміст пір варіюється від 5 до
95%), ступенем мінералізації і орієнтацією волокон колагену [21]. Наприклад,
кортикальна кістка є композиційним матеріалом, на наноструктурних рівні
представляють собою взаємопроникливий каркас, що складається з мінералів на
основі ГАП і волокон колагену. Даний каркас формує шарувату мікроструктуру,
яка, у свою чергу, є основною для орієнтованих циліндричних утворень на
макрорівні [14]. Така складна структура обумовлює високу міцність і, особливо,
опір руйнуванню кісткової тканини, у відповідності з відомими уявленнями
механіки руйнування композиційних матеріалів з тендітними матрицями [7-9].
Тверді тканини зубів містять меншу кількість органічної складової, але
мінеральна частина дентину складається з циліндричних кристалів ГАП,
орієнтованих по площинах з кристалічної решітки, що обумовлює анізотропію
механічних властивостей [1]. У табл. 1.2 наведені дані по міцності та модуля
нормальної пружності кортикальної кістки, дентину та зубної емалі. Різниця у
властивостях цих тканин визначається відмінностями в складі і мікроструктурі.
Згідно з даними [1,10], міцність при стисненні губчастої речовини з
проксимальної області болипеберцовой кістки становить всього лише близько 3,5
МПа, міцність цієї речовини з головки кульшового суглоба дорівнює 1-15 МПа, а
міцність кортикальної кістки верхньої суглобової поверхні болипеберцовой кістки
- 3-23 МПа. За деякими оцінками, міцність кортикальної кістки може досягати
значення 150 МПа [1].
Таблиця 1.2 - Механічні властивості твердих тканин.
|
Тканина
|
Міцність при стисканні, МПа
|
Міцність при розтягуванні,
МПа
|
Модуль нормальної
пружності, ГПа:
|
|
Кортикальна тканина кістки
|
88-164
|
89-114
|
3,9-11,7
|
|
Дентин
|
295
|
52
|
18,2
|
|
Емаль
|
384
|
10
|
82,4
|
1.2 Синтез і властивості гідроксилапатиту
Існує кілька методів отримання порошку ГА [3]:
. Мокрі (жидкофазная);
. Сухі (твердофазні);
. Гідротермальні.
У залежності від методу, може бути отриманий порошок з різною
морфологією, питомою поверхнею, стехіометрією і рівнем кристалізації.
Мокрі способи припускають утворення осаду ГА з застосуванням реакції
осадження в результаті змішування водних розчинів сполук, що містять іони+ і
(PO4)3, при збереженні рН більше семи і витримуванні осаду у відповідних
умовах. В якості джерел іонів кальцію в більшості випадків використовують
CaCl2, Ca(NOa)2, Ca(OH)2, CaCO3, CaSO4-2H2O, (CH3COO)2Ca та ін, а як джерело
фосфору використовують H3PO4, NH4H2PO4, (NH4)2HPO4, Na3PO4 і K3PO4. Для
регулювання рН застосовують газоподібний аміак, NH4OH і NaOH. У мокрих методах
вельми характерне утворення на початковій стадії осаду, що не відповідає складу
ГАП. При витримці первісного осаду фосфату кальцію у відповідних умовах, у
ньому збільшується співвідношення Са/Р і відбувається кристалізація ГАП. На
швидкість кристалізації первинного осаду в ГАП впливає багато факторів, такі,
як концентрація вихідних солей, порядок та швидкість перемішування, рН,
температура реакції, час витримування та ін Тому для отримання відтворюваних
результатів, необхідно суворо дотримуватися всіх умов синтезу. Серед безлічі
мокрих методів можна виділити кілька "класичних", які з тими чи
іншими змінами наводяться в болипенстве зарубіжних статей і патентів. Одним з
них є метод, що використовує Ca (NO3)2 в якості джерела кальцію і заснований на
реакції [9]:
Ca (N03)2 +6 (NH4) 2HPO4 +8NH40H = Ca10 (PO4)6 (OH)2 +20NH4NO3 (1)
З вітчизняних публікацій з синтезу слід відзначити роботу, де
рекомендовано проведення реакції [13]:
Ca (NO3)2 + 6KH2PO4 + 14NaOH = Ca10(PO4)6(OH)2 + 6KNO3 + 14NaNO3 + 12H2O
(2)
Зростання кристалів і їх виділення з розчину відбувається поступово;
відфільтрований осад ГАП промивають водою і спиртом і сушать при температурі
40-50 0C.
Варіант реакції з використанням сполук калію (замість натрію і амонію)
для експрес синтезу кристалів ГАП описаний в [12]. ГАП отримують при швидкому
змішуванні розчинів Ca (NO3) 2 і K3PO4. Початкове відношення Са / Р становить
1,58, а через 6 годин -1,67.
Інша група класичних методів отримання ГАП мокрим способом заснована на
реакції [8]:
Са (ОН)2 +6Н3РО4 = Са10(Р04)6(ОН)2 +18H2O (3)
Ця реакція також описана в зарубіжних патенти (головним чином, японських
авторів). Зазначена вище базова реакція між Ca (OH) 2 і H3PO4 в деяких патентах
трансформована таким чином, що проведена заміна (іноді частково) одних
реагентів на інші того ж призначення. Так, у високоякісний ГА отримують із
суміші Ca(OH)2, Са3 (РО4)2, (NH4)3PO4, і H3PO4, яка відповідає складу кінцевого
продукту, з наступним ультразвуковим опроміненням при частоті 10-30 кГц [34]. У
роботі описано освіта ГАП при додаванні Ca (OH) 2 до водної суспензії Са3
(РО4)2 при перемішуванні в інтервалі температур від 5 до 100° C в атмосфері
інертного газу, рН суміші підтримують рівним 10, регулюючи кількість подаваного
Са(ОН)2 до тих пір, поки Са / Р не складе 1,6. Далі взаємодія проводять до
моменту, коли Са / Р досягає 1,67, підтримуючи рН = 7 -11.
У роботі вивчені умови утворення ГАП з хлористого кальцію, двузамещенного
фосфату амонію та водного розчину аміаку. Ця система досліджена методом
розчинності у варіанті методу залишкових концентрацій Тананаева. У залежності
від умов осадження (вихідне мольне співвідношення компонентів, рН середовища та
ін) іони Ca2 + можуть утворювати трехкальциевого фосфат (ТКФ, хімічна формула
Са3(РО4)2 і / або ГАП.
Остання група класичних методів отримання ГАП мокрим способом полягає в
тому, що в якості реагентів використовують СаСОз і водний розчин H3PO4.
Заслуговує на увагу синтез ГАП прокаливанием СаСОз при 800-1300° C протягом
0,5-10 год, охолодженням отриманого CaO в інертній атмосфері до температури
нижче 500° С і гасінням водою в турбулентному потоці у водному розчині [3].
Відомо, що в практиці синтезу ряду матеріалів добре зарекомендував себе
алкоксометод отримання складних оксидів, що відкриває широкі можливості підвищення
чистоти матеріалу і його дисперсності [16]. У роботі [18] реакція синтезу ГАП,
що включала стадії утворення розчину етілата кальцію Са(ЕtO)2, і його взаємодію
з фосфорною кислотою, а потім відпал отриманого продукту на повітрі,
представлена в наступному вигляді:
^ HCa (EtO) 2 => mEQ4Cax (PO4) y (EtO) z-nEtOH ^ ^ ^ Са5 (РО4) 3ОН (4)
У результаті синтезу за описаною схемою до проведення відпалу утворюється
аморфний продукт, що не дає рефлексів, характерних для дифрактограми
тонкокристаллическая ГАП.
З наведених вище прикладів випливає висновок, що для мокрих способів
характерно безліч змінюють факторів, які не завжди дають можливість досягти
гарну відтворюваність, зберегти стехиометрическое співвідношення Са / Р у
процесі синтезу, тобто отримати порошок із заданими хімічними і фізичними
властивостями. Серед цієї безлічі факторів заснованими є рН розчину,
температура реакції і тривалість процесу.
Сухі способи передбачають отримання ГАП із застосуванням твердофазних
реакцій, дифузійних процесів в результаті прожарювання при температурі
1000-1300 0C сумішей сполук, що містять іони Ca2 + і РО3 "4, в певних
кількостях. В якості джерела груп ОН використовують атмосферу парів води. У
роботі [3 ], наприклад, описано синтез ГАП з солей лужноземельних металів (Ca,
Sa або Ba) і H3PO4.
Інший приклад сухих способів - отримання ГАП прокаливанием сумішей
Са3(РО4)2 і CaCO3, CaP2O7 і CaCO3, СаНРО4-2Н2О і CaO при температурі 900-1300°
C у присутності парів води [14].
Сухі методи вважаються стандартними для утворення ГАП стехіометричного
складу з Са / Р = 1,67, але є тривалими і енергоємними (ведуться при високих
температурах). Крім того, цими методами важко досягти гомогенності продукту.
У багатьох роботах зустрічається ще один метод синтезу ГАП,
гідротермальний метод, що включає реакції при високих температурах і тиску, що
вимагають дорогої апаратури [3]. У якості вихідних матеріалів застосовують
CaCO3 з фосфатом амонію, Ca (NO3)2 і (NKU)2HPO4 у водному розчині аміаку. У
роботах використовують пірофосфат кальцію (Ca2P2O7) з невеликими
варіаціями.Так, в [17] описано взаємодію Ca2P2O7 з H3PO4. Автори [15] вважають,
що стехіометричний продукт гідротермальних методом можна отримати за реакцією:
ЗСаР2О +4СаО + Н2О = Са10(РО4)6(ОН)2 (5)
У роботі [18] було вивчено вплив NHUOH на швидкість процесу росту
кристалів.Призматичні кристали в відсутність NH4OH утворюються більш ніж за 96
годин навіть при температурі 500° C і тиску 80 МПа. Введення останнього значно
збільшує швидкість реакції. Гідротермальний синтез проводять у золотих капсулах.Кількість
вихідних реагентів разом з H2O має займати 50-60% обсягу автоклава (залежно від
температури, при якій проводиться синтез).
Крім трьох описаних груп методів отримання ГАП, відомі й деякі інші, що
мають набагато менше значення. Так, його можна отримати в опадах, що
утворюються при змішуванні K4P2O і CaCb у співвідношенні два до одного, в
результаті гідролізу після витримування протягом 2 тижнів.
Представляє інтерес метод синтезу ГАП з використанням стадії сушіння з
виморожуванням суміші ацетату кальцію з тріетілфосфатом [3]. Перевагою методу є
можливість отримати високодисперсні і високо пористі зразки.
Таким чином, існує три основних способи синтезу і безлічі різновидів їх
для отримання порошку ГАП. Серед усього великої кількості методів синтезу
порошку, перевага віддається мокрим методів, як найбільш простим.
ГАП - член групи апатитів складу Mi0 (Zo4) 6X2. Вперше структура
фторапатитом (ФА), спорідненого з'єднання ГАП, була визначена в роботах
Нара-Сабо, що стали згодом класичними для рентгеноструктурних досліджень ГАП,
ФА і хлорапатіта. У цих дослідженнях зроблені основні висновки про особливості
будови кристалічної решітки. Подальші роботи підтвердили правильність
розшифровки структури ФА.Структура ГАП відноситься до гексагональної сингонії,
елементарна комірка відповідає пр. гр. Р62 / т і містить дві формульні одиниці,
ідеалізована формула Саю (РО4)6 (ОН)2. Параметри елементарної комірки рівні а =
0,942 HM, з = 0,87 HM. Розташування атомів в елементарній решітці і проекція
структури вздовж осі С показано на рис. 1.2. Атоми кальцію займають дві
позиції: з десяти атомів в елементарній комірці шість знаходиться в позиції
Ca11 і чотири Ca1. Ca1 розташований на осі третього порядку і оточений
дев'ятьма атомами кисню фосфатних груп. Атоми Ca11 утворюють рівносторонній
трикутник, в центрі якого на гексагональної осі лежить атом фтору, група
гідроксилу (ОН) дещо зміщена центру трикутника [6].
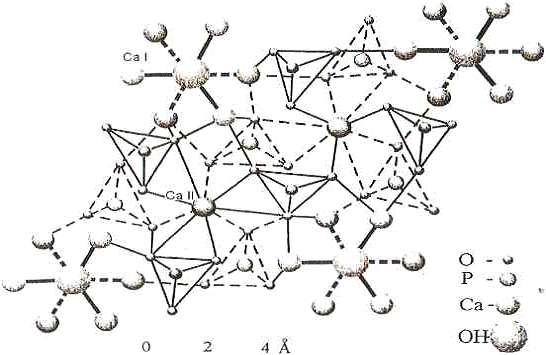
Рис.
1.2 - Структура Ca-ГАП
Однією
з фундаментальних проблем хімії апатитів, в тому числі ГА, є проблема
ізоморфних заміщень. Для біологічного процесів росту нової тканини становить
великий інтерес порівняльне вивчення фтор-, хлор-і гідроксиапатиту кальцію і
особливості розташування з в структурі апатиту. У роботі [19] показано, що іони
фтору заміщають іони гідроксилу в структурі Са10(РО4)6(ОН)2, так як фторапатит
термодинамічно більш стійкий, ніж ГАП. На основі структурно-термохімічної
моделі, запропонованої в [6], вперше досліджені енергетичні аспекти взаємодії
іонів фтору, хлору і гідроксил-іонів в Са-каналах структури ГА і взаємодії
Ca-каналів і РО3 "4 груп. Структура ГАП умовно представляється у вигляді
двох підсистем. Перша підсистема - це Са-канали, в яких розташовані іони F
", СГ і ВІН" і які доступні для ізоморфних заміщень. Друга підсистема
- це основний каркас, який представляє фосфат кальцію. У цей каркас іони фтору,
хлору можуть впроваджуватися з малої ймовірністю, а такі іони як СОз2
"можуть ізоморфно заміщати РС> 43" групи. Ці дві підсистеми:
Ca-канали і остовних каркас, є взаємозалежними і ізоморфне заміщення в
Ca-каналах залежить від енергетики або напруженості PO зв'язків в основному
каркасі.
З
вищесказаного випливає, що в структурі ГАП можливі різного роду заміщення одних
елементів іншими. При цьому певні атоми можуть заміщати повністю або частково
різні позиції в структурі ГА [3,10].
.3
Кераміка на основі гідроксиапатиту
Однією
з ключових при створенні матеріалів для імплантації є проблема механічних
властивостей. Керамічний матеріал повинен володіти достатньою міцністю,
близькою до міцності кісткової тканини; високим опором втоми при впливі
статистичних і динамічних навантажень, особливо в корозійно-активному
середовищі організму, а також задовільною в'язкості руйнування. Особливе місце
займає проблема біомеханічної сумісності. Наприклад, губчасту речовину кістки
має модуль нормальної пружності в інтервалі 0,005-0,5 ГПа, в залежності від
ділянки кістки і її віку [10,21]. Корундова кераміка для медичного застосування
характеризується значенням модуля пружності близько 380 ГПа. Різниця модулів в
7600 разів (з кортикальної частиною кісткової тканини - до 55 разів) призводить
до того, що кісткова тканина екранується імплантатом від впливу механічного
навантаження. Це чинить негативний вплив на кісткову тканину, яка повинна
перебуває під впливом механічних напруг для забезпечення її життєздатності.
Крім того, виникає градієнт напружень може призводити до руйнування тканин по
межі розділу з імплантуються матеріалом. Висока твердість імплантується
матеріалу може зумовлювати підвищений знос кістки.
1.3.1 Щільна кераміка на основі гідроксилапатиту
Кераміка
на основі фосфату кальцію може бути виготовлена із застосуванням різних
технологій, вибір яких залежить від вимог до мікроструктурі і властивостями
матеріалу [6,10]. Для імплантатів, що несуть механічне навантаження, доцільно
використовувати щільно спеченим кераміку, що володіє більшою міцністю в
порівнянні з пористою керамікою. Мікроструктура такої кераміки повинна бути
тонкодисперсної, оскільки міцність зростає із зменшенням розміру зерна згідно
відомої залежності [9]:
а
= Ci0 + bd'1 / 2, (6)
де
а і b - постійні, d - розмір зерна.
Щільна
кераміка може бути отримана пресуванням або шлікерної литтям з наступним
спіканням без додатка тиску, гарячим одноосьовим або ізостатичним пресуванням
[10]. При цьому щільність кераміки прагнуть довести до теоретично розрахованого
значення, що становить 3,16 г/см3 [3].
Спікання
кераміки ГАП ускладнюється двома причинами: втрата радикалів ОН і розпаду ГАП
при високих температурах [15]. Перший процес відбувається згідно реакції:
(PO4MOH)2
= Са10(Р04)6(ОН) 2.2хОхпх + хН2О2 (7),
де
пх - вакансія, х <1.
Оксігідроксіапатіт
Са10 (РО4)6(ОН) 2.2ХОхпх формується вже при температурі 900° С на повітрі, а в
атмосфері, що не містять парів води, температура його освіти знижується до 850°
C.
Гідроксилапатит
при високих температурах може розкладатися на трехкальциевого фосфат Са3 (РО4)2
і тетракальціевий фосфат Са4Р2О9 згідно реакції:
Са10
(РО4)6(ОН) 2 = 2 (а-Са3 (РО4)2) + Ca4P2O9 + H2O (8)
Вважають,
що критичною для збереження фазового складу верхньої температурою спікання ГАП
є температура близько 1300 0C, причому точне її значення залежить від
атмосфери, в якій проводиться спікання, а саме, від парціального тиску парів
води [10]. Підвищення вмісту вологи в середовищі спікання стабілізує ГАП при
високих температурах. У роботі [6], однак, була продемонстрована стійкість ГАП
з співвідношенням Са / Р = 1,68 до термічного розкладання аж до температури
1450 С при витримках до 3 ч. Підвищення температури до 1500 0C призводить до
розкладання ГАП. Щільність, близька до теоретичної, досягається при температурі
спікання тонко дисперсних порошків ГАП 1300 0C з витримкою при цій температурі
протягом 3 ч. Подальше підвищення температури призводить до збиральної рекристалізації-розмір
зерна збільшується від 4 до 14 мкм з підвищенням температури спікання від 1300
до 1450 0C.Залежність розміру зерна від температури термообробки описується
рівнянням Арреніуса. Оцінена за цієї залежності уявна енергія активації дорівнює
196 кДж / моль [6].
Представляється
очевидним, що температурно-часові параметри процесу спікання повинні залежати
від передісторії порошку і його дисперсності, що впливають на активність при
спіканні, а також і від фазового складу. Збільшення розміру часток вихідного
порошку ГАП від 1 до 4,2 мкм призводить до значного підвищення температури
початку інтенсивної усадки при спіканні. Незважаючи на більш високу щільність
сирих прессовок, отриманих з великих порошків, що досягається при спіканні
густина збільшується із зменшенням розміру частинок.
Ущільнення
при спіканні може бути інтенсифікований допомогою формування рідкої фази при
температурах спікання. В якості добавки, формує рідку фазу, було запропоновано
використовувати фосфат натрію, що вводиться в кількості до 5% [16]. Добавка
знижує температуру спікання для отримання щільної кераміки приблизно на 50 0C.
В якості добавки, формує рідку фазу при спіканні, може бути також використано
фосфатне або силікатне скло [7]. Спікання ГАП з використанням добавки скла
Bioglass ® складу (в мол.%): P2O5 - 2,6; CaO - 26,9; Na2O - 24,0; SiO2 -46,1
дозволило не тільки підвищити механічні властивості кераміки, а й поліпшити її
біологічну поведінку. На поверхні такої кераміки при витримці в рідині, що
моделює плазму крові, кристалізується шар апатиту.
Для
щільної кераміки визначальними є такі характеристики, як міцність на вигин,
розтягнення, в'язкість руйнування. Межа міцності при вигині, стисканні і
розтягуванні знаходиться в діапазоні 38 - 250, 120 - 150 і 38-300 МПа [5],
відповідно. Розкид даних викликаний статистичними характером розподілу
міцності, впливом залишкової мікропористості, розміром зерна, домішками і т.д.
З збільшенням відношення Са / Р, міцність збільшується, досягаючи пікової
величини близько CaTP = 1,67, і різко зменшуючись при Са / Р> 1,67 [10].
Модуль
Вейбулла щільної кераміки знаходиться між 5 і 18, це означає, що вона веде себе
як типова тендітна кераміка. Коефіцієнт уповільненого зростання тріщини (п)
знаходиться в межах від 26 до 80 при випробуваннях в сухих умовах (в порівнянні
з п = 30 для кераміки з оксиду алюмінію). Однак, він знижується до величини
12-49 у вологому середовищі, показуючи високу чутливість до сповільненого росту
тріщини [1].
Модуль
Юнга щільної кераміки знаходиться на рівні 35 - 120 ГПа [10]. Його величина
залежить від залишкової пористості і присутності домішок. Модуль Юнга,
вимірюваний при вигині, дорівнює 44-88 ГПа. Твердість за Вікерс щільної
кераміки дорівнює 3-7 ГПа. Щільна ГАП кераміка виявляє суперпластічность при
температурі від 1000 до 1100 0C, з механізмом деформації заснованому на
прослизанні по межах зерен. Стійкість до зношування і коефіцієнт тертя щільної
кераміки порівнянні з таким у людської емалі. Значення тріщиностійкості (Ki0)
знаходиться на рівні 0,8 - 1,2 МПахм причому вона зменшується майже лінійно із
збільшенням пористості (Рис. 1.3). Питома робота руйнування лежить в діапазоні
від 2,3 до 20 Дж/м2.
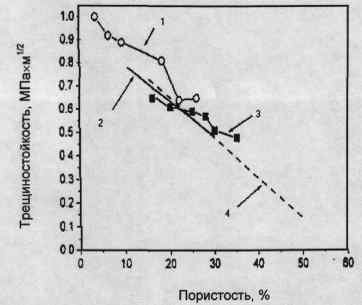
Рис.1.3
- Значення тріщиностійкості щільною гідроксіапатітовой кераміки
Згідно:
1 - DeWith et. al. /IJ. Mater. Sd. -
1981. - P. 1592,
2 - Shareefet. al. //J. Ceram. Tranc. -
1992. - P. 79,
3 - Shareefet. al. //J. Ceram. Tranc. -
1991. -P. 133,
4 - Matsuno et. al. //J. Chem. Lett. -
1992. - P. 2335.
Низькі значення KIC і модуля Вейбулла разом з високою сприйнятливістю до
сповільненого росту тріщини вказують на низьку надійність щільною ГАП
кераміки.Однак, штучні коріння зубів, вироблені з щільної кераміки, вивчалися
in vivo і в клінічних умовах. Приєднання ясен до імплантату з ГАП було
порівняно з фіксацією кореня природним сполучною речовиною. Також,
спостерігалися позитивні результати у зв'язуванні кістки з імплантатом. Ці
результати дуже важливі, тому що неадекватне ущільнення призводить до
надмірному рухливості зуба і в результаті до його втрати. На жаль, велика
частина з навантажених зубних імплантатів були зруйновані протягом року після
впровадження через недостатні механічних властивостей [21].
Одне з найбільш важливих застосувань щільної кераміки - підшкірні
пристрої для тривалого амбулаторного черевного діалізу, моніторинг тиску та
цукру в крові, або оптичне спостереження за внутрішніми тканинами тіла [1]. Це
відбувається, тому що щільна спеченная ГАП кераміка виявляє чудову
біосумісність з тканиною шкіри, набагато краще, ніж силіконова гума, широко
використовувана для тієї ж самої мети.
1.3.2 Пориста кераміка на основі гідроксиапатиту
У ряді випадків перевага може бути віддано пористої кераміці, що містить
взаємопроникні канальні пори. Така кераміка може бути використана для заповнення
кісткових дефектів, наприклад, верхній суглобової поверхні болипеберцовой
кістки [6] або в системі доставки лікарських препаратів [11]. Взаємопроникні
пори повинні мати діаметр не менше 100-135 мкм, щоб забезпечувати доступ крові
до контактних поверхонь [11], а також проростання та фіксацію кісткової тканини
[17]. Пори меншого розміру також необхідні, оскільки вони сприяють підвищенню
адсорбції протеїнів і адгезії остеогенних клітин. Таким чином, пориста кераміка
повинна мати бімодальне розподіл пор за розмірами.
Пористу кераміку отримують, в основному, методом вигоряючими добавок;
просоченням і подальшим випалюванням органічних (поліуретанових) губок, або
спінюванням при введенні пероксиду водню [6]. При цьому ступінь пористості,
наприклад, при використанні додецілбензолсульфоната натрію досягає до 50-60%, а
в разі гліцину або агар-агару - близько 80% [3]. З використанням вигоряючої
добавки (борошна) з розміром частинок 40 - 200 мкм, що вводиться в кількості 37
мас. %, Вдалося отримати ГАП кераміку з об'ємним вмістом пір до 46%. Розмір пор
досягав 100мкм, їх розподіл змінювався від бімодального до одномодальний в
залежності від температури спікання [18].
Для регулювання біологічного поведінки пористої кераміки, поверхня пір
може бути покрита шаром трьохкальцієвого фосфату. Для цієї мети вихідні
заготовки кераміки просочують розчином двозаміщений фосфату амонію з наступною
термообробкою при температурі 900 0C [19].
Важливе значення для процесу остеоінтеграції має форма пор. У роботі [10] було
показано можливість одержання методом вигоряючими добавок канальних пір
циліндричної форми діаметром до 500 мкм і довжиною більш 5 мм.
Пориста кераміка може бути отримана при фізіологічній температурі,
минаючи стадію спікання [5]. Міцність такого матеріалу може розглядатися як
певний нижній її межа. Процес отримання матеріалу моделює формування ГАП в
організмі, в умовах in vivo. Досліджували зразки кальцій-дефіцитного
гідроксиапатиту (КДГА) і карбонат-заміщеного гідроксиапатиту (KA), отриманих у
відповідність з наступними реакціями:
CaHPO4 + 3Ca4(РО4)2О = 2Ca9НРО4(РО4)5ОН + H2O (9)
(5 / S) NaHCO3 + 2CaHPO4 + 2Са4 (РО4)2О = 1,067 Са9, з75Мао, 586 (РО4)5,
(СОЗ) о, 586 (ОН) 1,961 + 5 / 16 (H2O) (10)
Синтезований порошок пресували під тиском 70 МПа і витримували у вологому
середовищі при 38 0C. Об'ємний вміст пір в матеріалах було 27-39%. Отримано
такі середні значення міцності матеріалів: при розтягуванні - 12-18 МПа для КГД
і 9-14 МПа для KA; при стисненні - 83-172 для КДГА і 57-80 для KA. Відмінність
властивостей матеріалів пояснено особливостями їх мікроструктури при
фізіологічних температурах. Рівень міцності високий, незважаючи на значний
вміст пір, форма і концентрація яких істотно впливаю на механічні властивості
[12].
Пориста кераміка хоча і має достатню міцність на стиск 2-100 МПа, але
мають межу міцності на вигин 2-11 МПа, що в два-три рази менше необхідних
значень, причому, зі збільшенням пористості міцність матеріалу сильно
знижується (рис. 1.4). У роботах [19] досліджено вплив пористості на міцність
при стисненні і модуль Юнга спеченою кераміки при 1100 0C на основі ГАП і ТКФ.
Встановлено, що міцність а і модуль E знижується зі збільшенням змісту пір P,
згідно співвідношенням In а = 6,4 -3,9 Р для ГАП і In а = 6,6 - 6,2 Р для ТКФ,
і In E = 4,6 - 4, OP для ГАП. Екстрапольовані значення міцності та модуля
пружності при нульовій пористості рівні, відповідно, 70 МПа і 9,2 ГПа - для ГА,
і 135 МПа і 21 ГПа - для ТКФ. Наведені значення міцності ГА істотно нижче, ніж
дані з інших джерел [1].
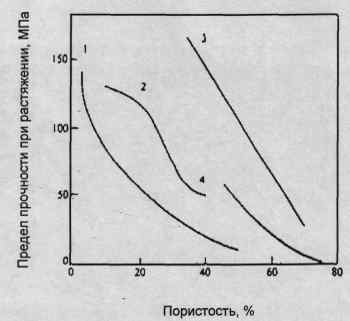
Рис. 1.4 - Залежність межі міцності на розрив від пористості згідно 1 -
Rao et. al. 1974, 2-Aokiet.al. 1976,
3 - Peelen et. al. 1977,
4 - Мопта et. al 1978.
Міцність поступово збільшується, коли кістка проростає у всередину мережі
пір імплантанта. За даними [21], міцність при вигині, для пористого
імплантанта, заповненого на 50-60% кісткової тканиною становить 40-60 МПа.
Залежність тріщиностійкості ГАП кераміки від розміру зерна немонотонний,
є максимум, який відповідає розміру зерна кераміки близько 0,4 мкм
[10].Максимальне значення міцності і тріщиностійкості становлять, відповідно,
135 МПа та 1,25 МПа-м1. Добавка фосфату натрію призводить до зростання зерна і
зниження тріщиностійкості до 0,95 МПа-м1 / 2.
Пористу кераміку з поліпшеними властивостями міцності можна виготовити із
застосуванням волокон. Волокнистий пористий матеріал, як відомо, показує
підвищену міцність завдяки зчепленню (з'єднанню) волокон, зміни траєкторії
тріщин і витягування волокон. Крім того, волоконний ГАП каркас може бути
укріплений ГАП - полімерним біодеградірующім кістковим речовиною. Існує багато
доповідей щодо виготовлення волокнистої, пористої кальцій-фосфатної кераміки.
Волокниста пориста структура може бути приготовлена кількома способами [10]:
Спікання / 3-Саз (РО4) 2 волокон з наступним перетворенням в пористий
каркас ГАП за допомогою обробки в розплавах солей;
спікання ГАП вусів або перетворення а-ТКФ при гідротермальних умовах;
Динамічним ущільненням ОКФ і / 3-кальцій метафосфатних волокон.
На жаль, механічні властивості не досягають необхідного рівня в
будь-якому випадку.
Пориста ГАП кераміка широко застосовується в медицині у формі блоків і
гранул.Медичне застосування пористої ГАП кераміки включає заміщення кісткових
дефектів, систему доставки лікарських препаратів і використання в стоматології
[1-5].
1.3.3 Пористі керамічні гранули з
гідроксиапатиту
.3.3.1 Методи гранулювання
Гранулювання - це сукупність фізико-хімічних і фізико-механічних
процесів, що забезпечують формування частинок заданих розмірів, форми,
структури та фізичних властивостей.
Для гранулювання порошків, в тому числі і ГАП, у вітчизняній і зарубіжній
практиці застосовують різні методи й апаратуру. Всі процеси гранулювання можна
класифікувати наступним чином [14]:
з рідкої фази диспергированием на краплі з подальшою кристалізацією при
зневодненні або охолодженні;
з твердої фази пресуванням з подальшим подрібненням брикетів до гранул
необхідного розміру;
з суміші рідкої та твердої фаз агломерацією порошків з подальшим
обливання агломератів і зміцненням зв'язку між частинками при видаленні рідкої
фази; - з газоподібної фази конденсацією (десублімації) з утворенням твердих
гранул;
з суміші рідкої і газоподібної фаз із здійсненням хімічної реакції;
з суміші рідкої, твердої і газоподібної фаз із здійсненням хімічної
реакції.
Утворення твердих частинок необхідного розміру при гранулюванні
відбувається або одночасно, або поступово. Тому розрізняють процеси
гранулювання, які відбуваються без зміни розмірів часток у часі, зі зміною
часток у часі, з утворенням нових частинок і ростом наявних частинок. У
залежності від вимог, що пред'являються до гранулометричному складу продукту,
одержувані при гранулюванні дрібні частинки або повертають у процес (ретурний
процес), або не повертають (безретурний процес).
Ефективність процесу гранулювання залежить від механізму
гранулообразованія, який, у свою чергу, визначається способом гранулювання та
його апаратурним оформленням. У зв'язку з цим методи гранулювання доцільно
класифікувати наступним чином:
Обливання (формування гранул, що досягається агломерацією чи нашарування
частинок);
Диспергування рідини у вільний об'єм або нейтральну середовищ (освіта і
кристалізація крапель рідини при охолодженні в повітрі, маслі і т.п.);
Пресування сухих порошків з отриманням брикетів, плиток і т.п., з
подальшим їх дробленням на гранули необхідного розміру;
Диспергування рідини на поверхню частинок в підвішеному стані
(Кристалізація тонких плівок на поверхні частинок);
Чешуірованіе (охолодження рідини на чужорідної поверхні);
Формування або екструзія (продавлювання пастоподібної маси через отвори);
Гідротермальний синтез.
Гранулювання методом окативанія використовує попереднє освіту агломератів
із рівномірно змочених частинок або в нашарування сухих частинок на змочені
ядра - центри гранулообразованія. Цей процес зумовлений дією
капілярно-адсорбційних сил зчеплення між частинками і наступним ущільненням
структури, викликаним силами взаємодії між частками в щільному динамічному
шарі, наприклад в грануляторі барабанного типу.
Гранулювання методом диспергування рідини в вільний обсяг полягає в
розбризкуванні рідини, наприклад безводного плаву грануліруемого речовини, на
краплі, наближено однорідні за розміром, і в подальшій їх кристалізації при
охолодженні в нейтральному середовищі. У якості нейтральної середовища
використовують воду, масло, рідкий азот і т.д. Зокрема, в роботі [13] метод
заснований на використанні сумішей суспензії ГАП в розчині пов'язує (хитозана)
і рідкого парафіну. Отриману суспензію диспергируют в рідкий парафін і
перемішують лопатевої мішалкою зі швидкістю 500об/мін, що призводить до
утворення гранул сферичної форми. Однак спосіб не позбавлений недоліків,
пов'язаних з використанням розплавленого парафіну.
Гранулювання сухих порошків методом пресування, тобто ущільнення під.
дією зовнішніх сил, засноване на формуванні щільної структури речовини, що
обумовлено міцними когезійним зв'язками між частинками при їх
стисненні.Отриманий в результаті ущільнення брикетів матеріал (плитка, стрічка)
дробиться і направляється на розсів для відбору кондиційної фракції, що є
готовим продуктом.Наприклад, метод ізостатичного пресування порошку ГАП при
тиску від 100 до 200 МПа, з подальшим подрібненням блоків дозволяє отримувати
гранули розміром від 200 до 500 мкм. Недоліком способу є нерегулярна геометрія
гранул [21].
У процесах гранулювання проявляються майже всі відомі види
фізико-механічних та фізико-хімічних зв'язків між частинками. Найбільш повна
характеристика різних міжчасткових зв'язків у процесі утворення гранул наведена
в роботі [7]. У ній розглянуті наступні сили, що діють на частинки при рості та
формуванні гранул; капілярні та поверхнево-активні сили на межі розділу твердої
і рідкої фаз; адгезійні сили, що виникають в адсорбованих шарах; сили притягання
між твердими частками (мономолекулярні сили Ван-дер-Ваальса і сили
електростатістіческого тяжіння); сили зв'язку, зумовлені утворенням
матеріальних містків, що виникають при спіканні, хімічної реакції, затвердінні
сполучного, плавленні і кристалізації розчиненої речовини при сушінні.
Для формування гранул з початкових частинок порошкоподібного матеріалу
необхідно забезпечити їх зближення на таку відстань, при якому виявляється дія
зазначених сил. У тому випадку, коли гранули можуть бути отримані без додавання
рідкої фази (сполучних рідин), застосовують "сухе" гранулювання
(наприклад, методом пресування). При цьому зчеплення забезпечується
ван-дер-ваальсівськими і електростатичними силами зв'язку.
При гранулюванні методом окативанія більш результативними виявляються
зв'язку між частинками, зумовлені капілярними силами, що пояснюється
використанням жидкофазного пов'язує і освітою кристалічних містків.
Розгляд видів зв'язків і зіставлення їх характеристик міцності мають
особливе значення при аналізі механізму та кінетики процесу гранулювання,
здійснюваного різними методами.
Найбільш доцільним видається безпосереднє вивчення впливу параметрів
технологічного процесу на властивості одержуваного продукту, так як встановити
апріорно закон освіти гранул, як правило, неможливо, оскільки він істотно
залежить саме від параметрів процесу і матеріалу.
Гідроксіапатітовие гранули в ряді країн випускаються в даний час в
промисловому масштабі. Як приклад можна навести гранули марок Interpore 200
(425-1000 мкм), Pro Osteon ® (1-9 мм), Osteogen ® (300-1000 мкм) [13].
.3.3.2 Застосування гранул ГА в медицині
У медичній практиці керамічні гранули застосовуються в таких областях:
. Реконструктивно-відновна хірургія;
. Система доставки лікарських препаратів.
У реконструктивно-відновної хірургії гранули використовуються при
лікуванні пародонту (локальний і генералізований пародонтит середнього та
важкого ступеня, ідіопатична патологія пародонта при інсуліннезалежному
цукровому діабеті), навколокореневих, фолікулярних та резидуальних кіст щелеп і
т.д. Наприклад, в клініці щелепно-лицевої хірургії і стоматології
Військово-медичної академії при проведенні операції цистектомії з видаленням
кіст щелеп і заповненням післяопераційної кісткової порожнини віддають перевагу
гранульованому ГАП [8].
Одне з важливих застосувань гідроксіапатітових гранул, і пористої
кераміки-система доставки лікарських препаратів. З літературних джерел
випливає, що підхід для вирішення цієї проблеми з використанням кераміки є
відносно новим, причому перші дослідження почалися ще в 1930 році, а
використання кераміки як основи для системи доставки ліків - тільки 1980 роках.
Результати перших клінічних випробувань були опубліковані в 1997 році [9].
Головним напрямком дослідження системи доставки лікарських препаратів є
вирішення проблеми підтримки постійної концентрації препарату в крові
реципієнта протягом заданого часу (пролонгована фармокінетіка). Це обумовлено
тим, що періодичність перорального прийому або парентерального введення
лікарських препаратів може спричинитися до перевищення допустимої дози
внаслідок кумулятивного накопичення препарату і, як наслідок, загальну
токсикацію (рис. 1.5) [14].
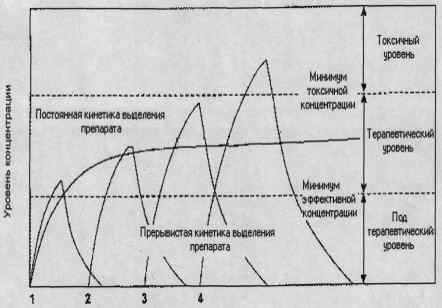
Кількість доз
Рис. 1.5 - Кінетика виділення препарату.
кістка кераміка кальцій гідроксиапатит
Використання гідроксіапатітовой кераміки як системи доставки дає
можливість керованого, локалізованого виділення препарату в специфічній області
людини, причому тривалість виділення досягає одного року [9]. У роботі [13]
показана можливість збільшення тривалості виділення в 2-3 рази лікарського
препарату за допомогою покриття гідроксіапатітових гранул полілактиду. Час
виділення контролювалося пористістю гранул і товщиною покриття.
Системи доставки препаратів із застосуванням кераміки можна класифікувати
наступним чином [9]:
. Гомогенні
Відпресований суміш порошку ліки і ГАП;
Пориста кераміка, гранули, просякнута розчином лікарського препарату.
. Гетерогенні
Керамічний резервуар, заповнений порошком або розчином (суспензією) ліки.
Ефективність виділення препарату залежить від біологічної активності
керамічного матеріалу. У зв'язку з цим системи доставки препаратів доцільно
також класифікувати наступним чином:
. Біорезорбіруемие (ТКФ);
. Інертні (оксид алюмінію);
. Остеокондуктивні (гидроксиапатіт).
Переваги і недоліки використання кераміки в системі доставки лікарських
препаратів наступні:
. Переваги:
Точкова, локальна терапія;
Постійна швидкість подачі препарату;
Мінімум побічних ефектів;
Висока ефективність.
. Недоліки :
Висока вартість;
Потреба в хірургічному втручанні.
Кінетика виділення препарату залежить від структури кераміки (рис. 1.6) і
описується такими характеристиками [13]:
. Поверхня.
Поверхня є одним з головних факторів, що впливають на змочування кераміки
рідиною. Змочування визначається крайовими кутами, де низькі кути (<90 °) і
високі кути (> 90) показові для змочування і не змочування,
відповідно.Збереження рідин в порах полегшено низькими крайовими кутами.
. Фазовий склад.
Вид, зміст і розподіл фаз у спеченою кераміці визначає її мікроструктуру,
і тим самим впливає на змочування кераміки.
. Площа поверхні.
Площа поверхні визначає сумарну поверхневу енергію. Тонкодисперсні
порошки та гранули мають велику площу поверхні для змочування, і тим самим
будуть поглинати більше рідини.
. Пористість.
Пористість кераміки визначає доступ рідини в мікроструктуру. Закриті пори
не грають ролі в системі доставки лікарських препаратів, в той час відкрита
пористість є визначальною. Зміст відкритих пор, їх розмір і форма визначають кінетику
і кількість поглинання і виділення лікарського препарату з керамічного носія.
Розмір пор впливає на капілярні сили. Малі пори володіють високими капілярними
силами в порівнянні з великими порами, що призводить до повільного виділенню
рідини [5].
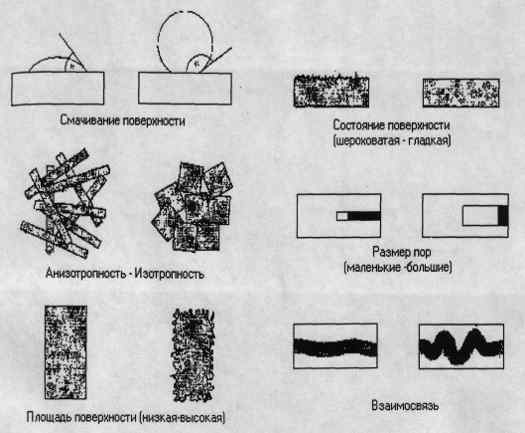
Рис. 1.6 - Характеристики, впливаючі на кінетику виділення препарату
.4 Композиційні
матеріали на основі гідроксиапатиту
Застосування ГАП кераміки в окремих областях медицини
неможливо через недостатність характеристик міцності, тому значні перспективи
для підвищення механічних властивостей кераміки має принцип формування
композиційних структур. Введенням відповідних добавок у кераміку можна
поліпшити механічні характеристики, але при цьому повинні зберігатися її біологічні
властивості і, в першу чергу, біосумісність з тканиною живого
організму.Композиційні матеріали на основі ГАП можуть бути розділені на дві
основні групи [7]:
. Армування кераміки дисперсними частинками,
дискретними і безперервними волокнами [11];
. Застосування волокон або дисперсних частинок
кераміки для зміцнення біосумісних полімерів [12].
Для зміцнення оксидних керамік в них вводять дисперсні
частинки частково стабілізованого діоксиду цирконію (ZrO2 (YiOs)), що зазнає
поліморфний перетворення з тетрагональної в моноклінну модифікацію під дією
механічних напруг. У роботах [10, 13] вивчали взаємодію ГАП з ZrOi і визначали
міцність на вигин, в'язкість руйнування при різному співвідношенні ГАП і ZrOa
(YaOa). Було встановлено, що міцність на вигин і в'язкість зростають зі
збільшенням кількості ZrOa-Матеріали, що містять 50% ZrOa, обпалені при 1400
0C, показали значення міцності на вигин, у два-три рази перевищують міцність
ГАП без добавок. Проте використання діоксиду цирконію для зміцнення ГАП
кераміки, як показано, обмежено через повної стабілізації діоксиду цирконію
кальцієм з ГА при температурі спікання [9]. Можливості армування ГАП-матриці
неорганічними волокнами, наприклад А1аОз або SiC, також лімітовані
неузгодженістю коефіцієнтів термічного розширення матриці і волокна, що
призводить до утворення розтягуючих напружень в матриці, які знижують міцність.
В [10] показана можливість підвищення міцності в 2 рази і трещеностойкості в 6
разів горячепрессованной ГАП-кераміки в результаті її армування дискретними
металевими волокнами (нержавіюча сталь, сплав хастеллой), що вводяться в
металеву матрицю в кількості до 20 об.%. Отримані композиційні матеріали, що
мають міцність до 224 МПа, тріщиностійкість 6,0-7,4 МПа-гпш і модуль нормальної
пружності до 142 ГПа. Однак, для кераміко-металевих імплантатів характерна
корозія і негативні реакції з тканинами.
Один з найбільш цікавих підходів для підвищення
міцності і зменшення крихкості ГАП-кераміки - виготовлення композитів ГАП -
полімер.
У роботах [10,13] розроблені композиційні матеріали на
основі поліетилену.Зі збільшенням змісту до 40% ГАП в композиті модуль Юнга
збільшується, і знаходиться на рівні 1-8 ГПа, що близько до природної кістки.
Проте поліетилен є інертним матеріалом і зменшує здатність вростання імплантанта
в кісткову тканину.
Існує декілька робіт [12,13], що концентруються на
вивченні ГАП - колаген композитів, які за хімічним складом схожі з природною
кісткою. Композити можуть бути виготовлені за допомогою змішування порошку ГАП
з розчином колагену і наступним затвердінням суміші під УФ - випромінюванням
або пресування суміші ГАП-колаген при температурі 40 0C і тиску 200 МПа. Однак
отримані матеріали мають низькі міцнісні характеристики, наприклад міцність при
розтягуванні дорівнює 6,5 МПа, а модуль Юнга 2 ГПа.
Таким чином, останні роки проводиться багато робіт для
створення нових композитів на основі кераміки, зміцненими частинками, волокнами
і металами для поліпшення механічних властивостей. Однак існує значна кількість
проблем, пов'язаних, наприклад, для ГАП-металевих композитів з корозією і
негативними реакціями з тканиною, тобто введення чужорідних матеріалів в
кераміку може призвести до зменшення біосумісності і може сприятиме розкладанню
ГАП з формуванням трехкальцевого фосфату (ТКФ). Присутність ТКФ в ГАП збільшує
його схильність до біодеградації і сприяє повільного зростання тріщин. Крім
того, процес розкладання може надавати безпосередньо негативний вплив на
ущільнення композитів через формування нової фази і випаровування води, що
надалі призводить до зменшення міцності. Інший небажаний ефект, пов'язаний з
великим зміцненням кераміки - збільшення модуля пружності матеріалу. У цьому
випадку невідповідність модуля пружності між імплантатом і кісткою стає дуже
великим, в результаті чого імплантат піддається великим навантаженням. Отже,
міцність прооперованої кістки знижується.
Можна сказати, що поки композити на основі ГАП не
знаходять широкого застосування через низку проблем, які перераховані вище.
Однак, вже зараз йдуть успішні роботи, особливо в напрямку отримання композитів
ГАП-полімер (ГАП-поліетилен [12,], ГА-колаген [16], ГАП-полілактид [11],
ГАП-поліметилметакрилат [19] і Д-р.)
1.5 Задачі
та мета досліджень
На основі зробленого літературного огляду, можна
зазначити, що першочерговим завданням при створенні біосумісних матеріалів на
основі ГАП є контроль фазового складу порошків та особливості структури
нанесених покритів ГАП на імплантати.
Тому, метою даної роботи було встановлення кількісного
фазового складу порошків ГАП у вихідному та напиленому стані фазовими
складовими: ТКФ (трикальційфосфат), CaO, та аморфної фази.
2.
МАТЕРІАЛИ ТА МЕТОДИКА ДОСЛІДЖЕННЯ
2.1 Одержання зразків
Вимоги до ГАП медичного призначення, найкраще задовольняються при
використанні рідкофазного хімічного синтезу шляхом взаємодії розчинних солей у
лужному середовищі. Порошки, отримані хімічним осадженням, мають більшу площу
поверхні та складаються з однорідних по хімічному і фазовому складу часток з
регульованими розмірами (починаючи з одиниць мікронів). При цьому хімічна
чистота синтезованого ГАП значно перевершує чистоту вихідних реактивів та
виключаються численні механічні операції, які забруднюють синтезований
матеріал.
Спосіб одержання порошку гідроксилапатиту марки Кергап включає синтез
методом хімічного осадження з водних розчинів нітрату кальцію та гідрофосфату
амонію, старіння, промивання, відділення і сушіння осаду, що утворився, з
наступним його подрібненням, обкатуванням, відсівом дрібної фракції та відпалом
отриманого порошку [13].
.2 Рентгенівська дифрактометрія
Дифрактометричне дослідження зразків проводили на дифрактометрі
рентгенівському загального призначення ( ДРОН-УМ1 ) (рис. 2.1).
ДРОН-УМ1 призначений для проведення широкого спектру рентгеноструктурних
досліджень різних кристалічних матеріалів у науково-дослідних установах і
лабораторіях, промислових підприємствах при наступних кліматичних умовах :
·
при температурі
навколишнього середовища від +10 0 до +35 0;
·
відносної
вологості 80 % при 25 0С;
·
атмосферному
тиску 84-107 КПа ( 630-800 мм. рт. ст.).

- джерело рентгенівського випромінювання ИРИС; 2 - керуючий
дифрактометричний комплекс КУД-1; 3 - захист.
Рис. 2.1 - Зовнішній вигляд дифрактометра ДРОН-УМ1
Склад апарату:
1. джерело рентгенівського випромінювання
ІРИС;
2. стійка дифрактометрична, у тому числі
гоніометр ГУР-8;
3. фільтр;
4. захист;
5. комплекс керуючий дифрактометричний
КУД-1;
6. трубка рентгенівська 2БСВ 24-Сu;
7. блок детектування сцинтиляційний БДС6-05;
. комплект змінних частин;
. комплект монтажних частин;
10. комплект запасних частин.
Будова і робота апарата.
В апараті ДРОН-УМ1 для проведення структурних досліджень кристалічних
матеріалів використовується дифракція рентгенівських променів, для яких кристал
є дифракційними ґратами. Дифракція рентгенівських променів від кристала
підкоряються закону Вульфа-Брега:
n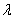 =2d (hkl) sinӨ (2.4)
=2d (hkl) sinӨ (2.4)
де:
n- порядок відбиття;
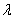 - довжина хвилі рентгенівського
випромінювання;міжплощинна відстань;
- довжина хвилі рентгенівського
випромінювання;міжплощинна відстань;
Ө - кут відбиття.
В апараті використовується монохроматичне випромінювання,
джерелом якого є рентгенівська трубка. Монохроматизація випромінювання
забезпечується застосуванням монохроматора на первинному й дифрагованому пучку.
Фокусуючи монохроматор служить для монохроматизації дифрагованого
рентгенівського випромінювання, що дозволяє звільнитися від власного
(недифрагованого) випромінювання зразка.
Схема фокусування по Брегу-Брентано
При такому фокусуванні (рис. 2.2) рентгенівське випромінювання від
джерела 1 , що перебуває на колі, що фокусується через систему щілин Соллера 2
і формуючу систему щілин 3, 4, що обмежують розходження рентгенівського пучка в
горизонтальному й вертикальному напрямках, попадає на досліджуваний зразок 5,
площина якого проходить через центр фокусуючого кола. Дифраговане
випромінювання від досліджуваного зразка через систему щілин Солера 6,
аналітичну щілину горизонтального розходження 7, що знаходиться на фокусуючому
колі і обмежуючу рентгенівський пучок у вертикальному напрямку щілину 8,
попадає в блок детектування, у якій кванти рентгенівського випромінювання
перетворюють в електричні імпульси.
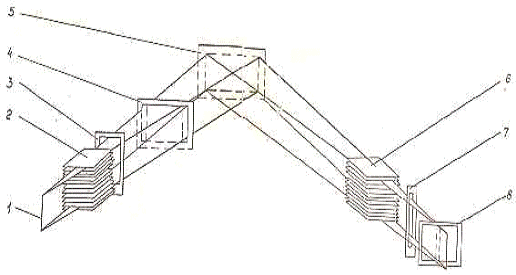
-фокус
рентгенівської трубки; 3,7-щілини вертикальні; 2,6-щілини Солера; 4,8-щілини
горизонтальні; 5-зразок
Рис. 2.2 - Схема фокусування апарату рентгенівського ДРОН-УМ1
Імпульси рентгенівського випромінювання з блоку детектування поступають в
блок реєстрації БР-1 керуючого комплексу КУ, підсилюються і подаються в одно
канальний дискримінатор, який може обмежувати імпульси, що відповідають енергії
квантів характеристичного випромінювання. Після дискримінатора імпульси можуть
бути направлені в модуль рахунку імпульсів рентгенівського випромінення
керуючого комплексу КУД. Обчислювальний комплекс ІСКРА забезпечує рахування і
реєстрацію імпульсів за обраний проміжок часу (метод таймера) або час, за який
набраний певну кількість імпульсів (метод набору постійного числа імпульсів).
У приладі передбачене автоматичне відкривання пучка рентгенівського
випромінювання за допомогою заслінки, що керує електромагнітом, що живляться
від комплексу КУД-1. Живлення рентгенівської трубки виробляється від джерела
рентгенівського випромінювання ИРИС-6.
Підготовка до роботи.
1. Перевірити готовність до роботи
складових частин апарата.
2. На джерело ИРИС установити програмні
перемикачі датчиків напруги й токи анода рентгенівської трубки в положення
відповідним значенням “00”кв, “00”ма.
3. Відрегулювати напір води в системі
водного охолодження.
4. Включити комплекс керуючий
дифрактометричний КУД-1.
5. Провести тренування рентгенівської
трубки.
6. Юстировка апарата. У ДРОН-УМ1
застосовується юстировка із плоским зразком по Бреггу-Брентано.
Установка гоніометра щодо трубки повинні забезпечувати виконання
наступних вимог:
нульова лінія (пряма минаюча через центри щілин обмежуючий первинний
пучок і вісь гоніометра) повинна перетинати вісь гоніометра під прямим кутом і
становити заданий кут із дзеркалом анода;
вертикальні осі й проекції фокуса й щілин повинні бути паралельні осі
гоніометра;
центр проекції фокуса повинен бути виведений на нульову лінію;
фокус рентгенівської трубки й щілина 7 повинні перебуває від осі
гоніометра на однаковій відстані рівному радіусу окружності гоніометра.
7.
Вибираємо режим роботи аналітичного каналу, що вибирають за допомогою кривій
амплітудного розподілу імпульсів, що надходять від блоку детектування для
дифракційного відбиття від зразка, у якості якого застосовують порошок  -кварцу.
-кварцу.
.
Перевірка правильності настроювання апарата - записують на стрічку самописного
приладу контрольну рентгенограму порошку  - кварцу
в інтервалі кутів 67-69 і порівнюють його з еталонної.
- кварцу
в інтервалі кутів 67-69 і порівнюють його з еталонної.
Робота
на апараті:
.
Включити апарат, дати йому прогрітися впродовж 1 години. Перевести у верхнє
положення тумблер автоматичного перекривання рентгенівського випромінювання,
включити захист.
.
Для автоматичної зйомки підготовляють апарат до роботи в автоматичному режимі.
Увести вихідні дані в пам'ять мікро ЕОМ із клавіатури.
.
При роботі з текстурною приставкою ГП-14, що служить для досліджень
текстурованих зразків полікристалічних матеріалів потрібно провести її
юстировку. Юстировка складається з наступних етапів:
а)
юстировка самої приставки;
б)
юстировка коліматора, що служить для зменшення висоти первинного пучка
рентгенівського випромінювання.
2.3 Методика обробки дифрактограм
Дифрактометричне дослідження проводили за допомогою дифрактометра
ДРОН-УМ1 в монохроматичному CuKα-випромінюванні. В якості
монохроматора використовували монокристал графіту, встановлений на
дифрагованому пучку.. Обробку даних дифрактометричного експерименту здійснювали
з використанням програми для повнопрофільного аналізу рентгенівських спектрів
від суміші полікристалічних фазових складових PowderCell 2.4.
3. ЕКСПЕРИМЕНТАЛЬНА ЧАСТИНА
.1 Аналіз
дифракційних картин гідроксилапатиту кальцію
Мінерали та синтетичні речовини зі структурним типом
апатиту утворюють великий клас сполук з загальним хімічним складом Me10(ZO4)6X2,
де Ме - 1ч3 валентний катіон (Ca, Pb, Cd, Sr, Ni, Eu, Al, Y, La, Ce, Na, K), Z
- 1ч3 валентний катіон (P, As, V, Cr, Si, C, Al, S, Re), Х - 1ч3 валентний
аніон (OH, F, Cl, Br, I, O, N, CO3) або вакансія [13]. Основним і найбільш
розповсюдженим представником сімейства апатитів є гідроксиапатит кальцію
Ca5(PO4)3(OH) (густина ρ = 3,173 г/cм3, масовий коефіцієнт поглинання μ
= 83,56 cм2/г) в якому
іони Ca2+ займають дві кристалографічні позиціі 4f і 6h (табл. 3.1) [14].
Таблиця 3.1- Позиційні параметри і теплові фактори Biso в структурі
гідроксиапатиту Ca5(PO4)3OH (пр. гр. Р63/т, z=2, a=0.93898 нм, c=0.68863 нм)
|
Іон
|
Позиція
|
x/a
|
y/b
|
z/c
|
Заселеність позиції
|
Biso·10-2, нм2
|
|
Ca2+
|
4f
|
0,3333
|
0,6667
|
0,9986
|
1,0
|
0,9410
|
|
Ca2+
|
6h
|
0,7530
|
0,7464
|
0,2500
|
1,0
|
0,8558
|
|
P
|
6h
|
0,6013
|
0,9699
|
0,2500
|
1,0
|
0,6162
|
|
O2-
|
6h
|
0,6711
|
0,1561
|
0,2500
|
1,0
|
0,9984
|
|
O2-
|
6h
|
0,4129
|
0,8778
|
0,2500
|
1,0
|
1,2527
|
|
O2-
|
12i
|
0,2580
|
0,3435
|
0,0703
|
1,0
|
1,5643
|
|
O2-
|
4e
|
0,0000
|
0,0000
|
0,3021
|
0,5
|
1,2881
|
|
H
|
4e
|
0,0000
|
0,0000
|
0,4600
|
0,5
|
3,3000
|
Унікальною властивістю гідроксиапатиту кальцію (далі ГАП) є
нестехіометричність його складу. Відношення Ca/P, яке для стехіометричного
складу дорівнює 5/3, використовується як степінь нестехіометричності. Його
значення міняється в інтервалі 1,5ч1,75 без зміни кристалічної структури
апатиту і залежить від методу одержання ГАП та від режимів його подальшої
термічної обробки, зокрема, нанесення біоактивного покриття методом
газотермічного напилення.
Одним з методів нанесення покриттів з гідроксиапатиту або аналогічних
біокерамічних матеріалів є метод плазмового напилення [15]. При плазмовому
напиленні в матеріалі, що формує покриття, під впливом нагрівання
високотемпературним газовим потоком можуть відбуватися фазові та структурні
перетворення, що змінюють його склад і властивості. Ступінь такого впливу
залежить як від умов напилення, так і від характеристик порошку [15]. Під час
процесу плазмового напилення висококристалічний синтезований ГАП порошок швидко
нагрівається до стану часткового розплавлення і напиляється при високій
швидкості на відносно холодну металеву основу, наприклад, титановий сплав. Зміна
одного з параметрів плазмового напилення, особливо теплових параметрів або
складу вихідного порошку ГАП, може змінити як фазовий склад, так і
кристалічність покриття з утворенням аморфної фази. Трикальцій фосфат (ТКФ) -
Са3(РО4)2 (α - чи β - модифікації) чи тетракальційфосфат (ТТКФ) - Са4Р2О4 і
навіть токсичний оксид кальцію (СаО) можуть спостерігатися в плазмових
покриттях. Ці фази, разом з аморфною складовою, мають менший опір ресорбції
аніж стехіометричний ГАП, що приводить до руйнування біопокриття.
Якість вихідних порошків відноситься до числа визначальних факторів у
технології плазмового нанесення покриттів, у тому числі і біокерамічних. Умови
формування покриттів пов'язані в основному з кінетичною і тепловою енергією
часток, тобто тим запасом енергії, що вони набувають у процесі взаємодії з
плазмовим струменем. Час перебування часток у зоні плазмового струменя
визначається швидкістю їхнього руху, що у свою чергу є функцією таких їхніх
властивостей, як розмір, форма та густина.
Плазмовий метод напилення біокерамічних покриттів є основним у
промисловому виробництві імплантантів з покриттями. Проте недоліком таких
стандартних технологій є втрата значної частини порошку біокераміки в процесі
напилення, що особливо суттєво при напиленні на поверхність малих об’єктів,
таких як зубні ендопротези. Основна причина цих втрат пов’язана з відносно
великим розміром площі напилення (круг діаметром 15-25 мм). Тому роботи з
нанесення біокерамичних покриттів проводили в ІЕС ім. О.Є. Патона з
використанням методу мікроплазмового напилення на установці МПН-004 [19].
Використання в якості плазмоутворюючогого газу аргону замість суміші Ar+H2
дозволяє знизити градієнт температури по перетині часток, уникнути небезпеки
їхнього перегріву і розкладання ГАП. Крім того, метод мікроплазмового напилення
за рахунок малого розміру площі напилення (круг діаметром 1-5 мм) дозволяє
здійснювати нанесення покриттів на вироби малих розмірів і заощаджувати
витратний матеріал.
В умовах мікроплазмового напилення важливого значення набуває плинність
порошку, від якої залежить можливість і стабільність його подачі в плазмовий
струмінь за рахунок власної ваги без застосування транспортуючого газу. До
властивостей, які можуть мати значення в умовах мікроплазмового напилення
покриттів варто також віднести морфологію і мікроструктуру часток порошку,
пікнометричну та насипну щільність порошку, фазовий склад матеріалу.
Для дослідження було обрано порошок, виготовлений фірмою
"Кергап" (Україна). Властивості і структура порошків багато в чому
визначаються методами їхнього одержання. До основних методів одержання ГАП
відносяться рідкофазні методи, твердофазний і гідротермальний синтези. Кожний з
них має свої переваги і недоліки. Технологічні властивості порошку представлені
- у табл. 3.2.
Порошок ГАП, одержаний фірмою "Кергап" має в основному
осколочну форму (рис. 3.1), однак завдяки операції обкатування кути багатьох
часток згладжені, що забезпечує його більш високу плинність (68-75 с/50г) та
насипну щільність (1,30 г/см3) (табл. 3.2). Пікнометрична щільність часток
дорівнює 3,08-3,10 г/см3. Мікротвердість часток - 5,40 ±0,16 ГПа.



а б
Рис. 3.1 - Зовнішній вигляд (а) часток порошку гідроксиапатиту Кергап (dч
= 63…80 мкм) і морфологія поверхні покриття з порошку Кергап (б).
Таблиця 3.2 - Розмір часток (dч), текучість (f), мікротвердість (Нμ),
насипна (ρн) та пікнометрична густина (ρп) порошку гідроксиапатиту фірми
Кергап
|
Параметри порошку
|
|
dч,мкм
|
f, с/50 г
|
ρн, г/см3
|
ρп, г/см3
|
Нμ, ГПа
|
Са/Р
|
|
63…80
|
70-80
|
1,23
|
3,08
|
5,40±0,16
|
1,67
|
|
≤63
|
68-75
|
1,30
|
3,10
|
|
1,66
|
Відповідно до наявних сертифікатів всі досліджені порошки задовольняють
вимогам ASTM F1185-88 ”Specification for Composition of Ceramic Hydroxylapatite
for Surgical Implants”по вмісту шкідливих домішок (менше 50 ppm). Відношення
Са/Р згідно даним РСМА склало для дослідженого порошку - 1,66-1,67.
Покриття наносили на абразивно оброблену, титанову основу на установці
МПН-004 з використанням аргону в якості плазмоутворюючого захисного газу.
Нанесення покриттів здійснювалося з використанням 9 режимів. В якості змінних
факторів були обрані: витрата порошку (G, г/хв), витрата плазмоутворюючого газу
(V, л/год), дистанція напилення (h, мм), сила струму (І, А), напруга (U, В)
(табл. 3.3). Постійними підтримувалися наступні параметри: розмір часток
порошку, витрата захисного газу (аргону), товщина титанового зразка (основи) і
спосіб підготовки його поверхні перед напиленням покриття.
Таблиця 3.3 - Режими мікроплазмового напилення порошків гідроксилапатиту
|
№
|
G, г/хв
|
V, л/год
|
h, мм
|
I, A
|
U, B
|
|
1
|
1,2
|
120
|
160
|
45
|
33
|
|
2
|
0,4
|
120
|
80
|
45
|
33…34
|
|
3
|
0,4
|
60
|
160
|
45
|
31
|
|
4
|
1,2
|
60
|
80
|
45
|
31
|
|
5
|
0,4
|
120
|
160
|
35
|
32…33
|
|
6
|
1,2
|
120
|
80
|
35
|
32…33
|
|
7
|
1,2
|
60
|
160
|
35
|
30
|
|
8
|
0,4
|
60
|
80
|
35
|
30
|
|
9
|
0,8
|
90
|
120
|
40
|
30…31
|
Плазмові покриття формуються з дискретних часток в результаті їхньої
деформації, розтікання та затвердіння при ударі об тверду поверхню. Залежно від
розміру частки і запасу теплової та кінетичної енергії, що вона здобуває під
впливом плазмового потоку, у шарі формуються різні структурні елементи. При
повнім розплавлюванні частки і утворенні сферичної краплі вона може
деформуватися на твердій поверхні в плоский диск, що має різну форму залежно
від змочування та інших умов формування. При високій швидкості розплавленої
частки може відбуватися розбризкування розплаву при зіткненні із твердою
поверхнею і утворення дрібних крапель. Частки можуть містити мікропори, що
утворюються при виділенні розчинених газів, а при неповнім розплавлюванні -
рідку оболонку і тверде ядро. При затвердінні та закріпленні на основі в обсязі
частки виникають напруги, які сприяють утворенню тріщин і т.п.
При дифрактометричному дослідженні мікроплазмових покриттів з
біокерамічних порошків визначали фазовий склад покриттів (відношення масових
часток фаз ГАП, ТКФ і аморфної складової в покриттях) та періоди кристалічних
ґраток. Проведення кількісного фазового аналізу покриттів на основі Са-ГАП
базується на використанні методу зовнішнього стандарту (α-Al2O3)
згідно рекомендаціям
ASTM F2024-00 ”Standard Practice for X-Ray Diffraction Determination of Phase
Content of Plasma-Sprayed Hydroxyapatite Coatings”. В основі даного
ASTM-стандарту використано дані роботи [121], де приведено корундові числа
(Reference Intensity Ratios - RIR) для Са-ГАП, b-ТСР і СаО (відповідно 1,276(1), 1,148(4) і 3,375(4)),
а також відносні інтенсивності окремих піків даних фаз. Основним недоліком, при
простому виконанні рекомендацій цього стандарту, є нехтування текстурою, яка
може появитися в досліджуваних зразках. Результати досліджень покриттів
одержаних нами [17], свідчили про наявність кристалічної текстури в основній
фазовій складовій - Ca5(PO4)3OH (рис. 3.2 б). Тому при аналізі отриманих
дифрактограм контролювалася наявність текстури уздовж різних кристалографічних
напрямків (встановлено, що в живій кістці формується текстура вздовж напрямку
[001]), що може впливати на протікання процесів ресорбції ГАП в умовах живого
організму [123]. В результаті, при повнопрофільному аналізі дифракційних
картин, ми проводили врахування текстури в напилених покриттях з використанням
моделі March-Dollase [14]. Поправка в інтенсивність любого максимуму hkl в цій
моделі здійснюється введенням ефективного множника повторюваності Мhkl згідно
виразу (2.5) приведеному в підрозділі (2.1):
m
Мhkl = ∑ (τ2·cos2φi +
τ-1·sin2φi)-3/2,
i=1
де τ - уточнюваний коефіцієнт текстури, m - кристалографічний
множник повторюваності даного сімейства еквівалентних площин {hkl}, φ
- найменше значення кута
між нормаллю до даної площини (hkl)і і заданим вектором текстури. Згідно виразу
(3.1) при відсутності текстури τ = 1, при 0 < τ
< 1 значення Мhkl
> 1 і інтенсивність максимуму hkl стає більшою в порівнянні з
нетекстурованим зразком, а при τ > 1 - значення Мhkl < 1.
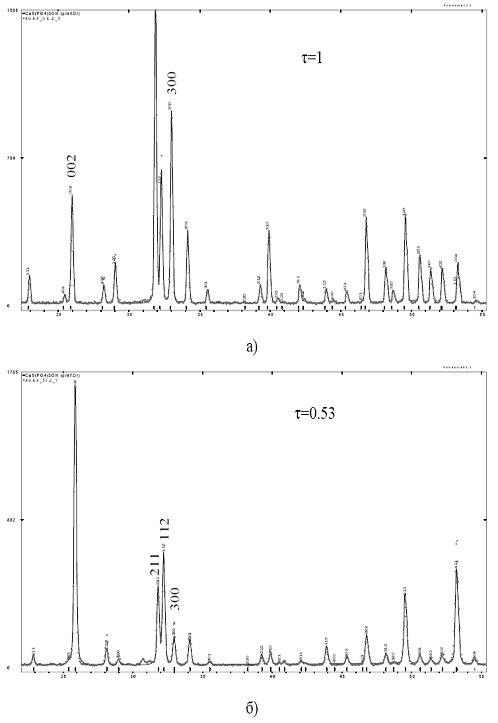
Рис. 3.2 - Фрагменти дифрактограм при повнопрофільному аналізі:
(а) - нетекстурованого зразка (τ=1, вихідний порошок);
(б) - покриття з текстурою вздовж напрямку 002 (τ=0,53,
режим 2).
Результати дифрактометричних даних показують, що зразки, приготовлені з
вихідних порошків методом компактування, не текстуровані (τ=1),
являють собою однофазний
кристалічний продукт Ca5(PO4)3OH (рис. 3.10, а). Параметри елементарної комірки
становлять: а=0,9418(1) нм, с=0,6881(1) нм і досить точно відповідають
значенням для стехіометричного складу (а=0,9418 нм, с=0,68780 нм) [13].
Аналіз отриманих результатів (табл. 3.4) свідчить, що в покриттях
текстура відсутня при використанні 5, 6 і 7 режимів напилення. В інших випадках
τ
змінюється в широких
межах від 0,48 до 0,74. Максимальний вміст гідроксиапатиту (98 мас. % )
отримано для покриттів на 2-ому і 8-ому режимах напилення, а мінімальне (88 %)
- на режимі 7.
Таблиця 3.4 - Періоди гратки (а, с), об’єм (V) элементарної комірки,
коефіцієнт текстури (τ) вздовж напрямку (001) фази Са5(РО4)3ОН та вміст (масс.
%) Са5(РО4)3ОН (G), Са3(РО4)2 (Т) і аморфної фази (А) в покритті на основі
порошку Кергап.
|
№ зразка по режиму
|
Фазовий склад
|
Структурні характеристики
ГАП
|
|
|
Коеф. текст.
|
Періоди гратки, нм
|
Об’єм гратки нм3
|
|
Г/T/A
|
τ
|
a
|
с
|
V
|
|
Порошок
|
100/0/0
|
1
|
0,9418(1)
|
0,6881(1)
|
0,5286
|
|
1
|
92/3/5
|
1
|
0,9403(2)
|
0,6887(1)
|
0,5273
|
|
2
|
98/2/0
|
0,53
|
0,9400(1)
|
0,6876(2)
|
0,5262
|
|
3
|
93/5/2
|
0,48
|
0,9386(4)
|
0,6885(2)
|
0,5252
|
|
4
|
96/4/0
|
0,61
|
0,9393(1)
|
0,6884(1)
|
0,5259
|
|
5
|
93/3/4
|
1
|
0,9400(1)
|
0,6888(1)
|
0,5271
|
|
6
|
94/3/3
|
1
|
0,9400(1)
|
0,6881(1)
|
0,5265
|
|
7
|
88/5/7
|
1
|
0,9394(3)
|
0,6886(2)
|
0,5262
|
|
8
|
98/2/0
|
0,69
|
0,9395(1)
|
0,6883(1)
|
0,5262
|
|
91
|
90/6/4
|
0,74
|
0,9395(1)
|
0,6886(1)
|
0,5263
|
Примітка: 1 - наявність слідів кристалічної фази СаО
На слідуючому етапі було проведено дослідження фазового складу мікроплазмових
покриттів ГАП залежно від товщини напиленого шару. Із цією метою на циліндричні
зразки титану діаметром 20 мм і товщиною 1 мм наносили покриття з порошку ГАП
різної товщини (від 60 до 350 мкм) при однакових технологічних параметрах:
режим №1 згідно табл. 3.4.
На одному зі зразків з товщиною покриття ~ 350 мкм був проведений
пошаровий дифрактометрический аналіз при послідовному видаленні механічним
шліфуванням шарів з кроком 50 мкм. Для дослідження впливу маси зразка на
фазовий склад були також нанесені покриття однакової товщини (~ 100 мкм) на
циліндричні зразки діаметром 20 мм і товщиною 1 мм та 5 мм.
При дослідженні топографії поверхні і мікроструктури покриття принципових
відмінностей виявлено не було: всі покриття формувалися з повністю розплавлених
часток і лише на самій поверхні в невеликій кількості зустрічалися частки
сферичної форми.
Аналіз результатів дифрактометричних досліджень дозволяє зробити
висновок, що фазовий склад покриття, а також характеристика текстури залежать
від товщини напиленого шару. Так, при товщинах до 100 мкм текстура в покритті
відсутня, або вона незначна (τ~0,9), а вміст аморфної фази становить від 7
до 9 мас. % (поз. 1, 2, 3, 7,8 табл. 3.11). При збільшенні товщини покриття
понад 100 мкм (поз. 4, 5 табл. 3.11) коефіцієнт текстури зменшується до 0,7, а
вміст аморфної фази - до 4...5 мас.%. При товщині покриття 360 мкм (поз. 6
табл. 11) ступінь текстури зростає (τ=0,34), а вміст аморфної фази знижується до
2 мас. %.
Відзначена тенденція впливу товщини покриття на текстуру і вміст аморфної
фази особливо чітко простежується при пошаровому аналізі покриття (табл. 3.5,
рис. 3.3). Так зі збільшенням товщини від 50 до 350 мкм ступінь текстури
безупинно зростає, а коефіцієнт текстури відповідно зменшується (у цьому
випадку від 0,72 до 0,34).
Характерно, що зазначена залежність спостерігається при нарощуванні
товщини до 200 мкм, а надалі ступінь текстури, вміст аморфної фази і фазовий
склад у цілому зберігається на одному рівні. Аналіз результатів також показав,
що маса зразка на структуру і фазовий склад напиленого покриття при однаковій
товщині покриття (табл. 3.5, поз. 3, 7, 8) практично не впливає.
Таблиця 3.5 - Коефіцієнт текстури (τ),
вміст (масс. %)
Са5(РО4)3ОН (G), Са3(РО4)2 (Т) і аморфної фази (А) у покритті різної товщини,
напиленого по режиму 1.
|
№
|
Розмір зразка
|
Товщина шару покриття, мкм
|
τ
|
G/T/A
|
|
Ш, мм
|
h, мм
|
|
|
|
|
1
|
20
|
1
|
80±20
|
0,85
|
66/25/9
|
|
2
|
20
|
1
|
90±20
|
1
|
86/5/9
|
|
3
|
20
|
1
|
110±30
|
1
|
75/17/8
|
|
4
|
20
|
1
|
120±25
|
0,71
|
76/20/4
|
|
5
|
20
|
1
|
135±25
|
0,70
|
78/17/5
|
|
6
|
20
|
1
|
360±25
|
0,34
|
93/5/2
|
|
7
|
20
|
3
|
80±25
|
0,93
|
73/20/7
|
|
8
|
20
|
5
|
100±10
|
0,92
|
72/19/9
|
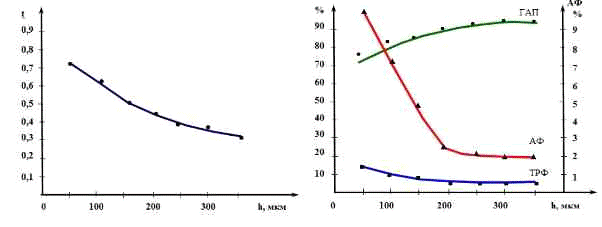
а б
Рис. 3.3 - Зміна коефіцієнта текстури τ (а), вмісту (масс. %) ГАП (G), ТКФ (T)
та аморфної фази (A) (б) по глибині покриття при пошаровому аналізі.
Таблиця 3.6 - Періоди гратки (а, с), об’єм (V) элементарної
комірки, коефіцієнт текстури (τ) вздовж напрямку (001) фази
Са5(РО4)3ОН та вміст (масс. %) ГАП (G), ТКФ (T) та аморфної фази (A) при
пошаровому аналізі мікроплазмового покриття
|
Тов- щина шару, мкм
|
Фазовий склад
|
Структурні характеристики
ГАП
|
|
|
Коеф. текст.
|
Періоди гратки, нм
|
Об’єм гратки нм3
|
|
Г/T/A
|
τ
|
a
|
с
|
V
|
|
350
|
93/5/2
|
0,34
|
0,9385(2)
|
0,6889(1)
|
0,5255
|
|
300
|
93/5/2
|
0,40
|
0,9393(1)
|
0,6887(2)
|
0,5263
|
|
250
|
93/5/2
|
0,42
|
0,9401(2)
|
0,6886(1)
|
0,5271
|
|
200
|
93/5/2
|
0,44
|
0,9402(1)
|
0,6886(2)
|
0,5271
|
|
150
|
90/6/4
|
0,50
|
0,9406(2)
|
0,6885(1)
|
0,5275
|
|
100
|
85/8/7
|
0,62
|
0,9404(1)
|
0,6893(3)
|
0,5279
|
|
501
|
78/12/10
|
0,72
|
0,9397(2)
|
0,6897(4)
|
0,5275
|
|
порошок
|
100/0/0
|
1
|
0,9420(1)
|
0,6880(1)
|
0,5287
|
Примітка: 1 - реєструються дифракційні лінії α-Ti
4. ЕКОНОМІЧНА ЧАСТИНА
4.1 Актуальність теми дослідження
У теперішній час інтенсивно розвиваються наукові дослідження, які
присвячені фазовим перетворенням в багатокомпонентних системах, завдяки чому
можна передбачити властивості матеріалів, визначити особливості поводження
системи при даній температурі і при даному складі [2].
Одним з напрямів в дослідженні нових матеріалів для медицини є синтез
гідроксилапатиту кальцію В даній роботі розглядаються системи CaO-P2O5, які
завдяки своїм біологічним властивостям [7] використовуються для пластики кісткової
тканини. В цій галузі медицини немає аналогу гідроксилапатиту кальцію і тому,
наукові дослідження цього матеріалу є актуальним питанням.
В роботі планується провести дослідження фазового складу зразків на
дифрактометрі ДРОН УМ - 1 і описати утворення біосумісних фаз (ГАП и β-ТКФ) в зразках, отриманих методом
синтезу з водних розчинів солей кальцію і фосфату. Нестехіометричність
структури має негативний вплив на біосумісність порошку [3]. Метою даної роботи
було виявлення температурних меж [4] та хімічного складу (Ca5(PO4)3(OH)), що
буде запобігати цьому явищу, що дає змогу заощадити кошти, завдяки зменшенню
кількості браку на виробництві.
4.2 Мета і задачі НДР
Мета роботи - проведення дослідження фазового складу порошків
гідроксилапатиту кальцію.
Задачі дослідження:
опрацювання літератури за темою дослідження;
одержання зразків для дослідження.
проведення зйомки зразків на дифрактометрі ДРОН УМ-1;
аналіз одержаних рентгенограм; узагальнення отриманих результатів і
приведення даних в інститут проблем матеріалознавства про отримані структурні
складові.
4.3 Розрахунок планової собівартості проведення
науково-дослідницької роботи
.3.1 Склад кошторису витрат на виконання НДР
Розрахунок планової вартості проведення НДР проводиться по наступним
статтям:
) Основна заробітна плата науково-виробничого персоналу;
) Додаткова заробітна плата науково-виробничого персоналу;
) Відрахування на соціальні заходи;
) Вартість матеріалів, які використовуються при виконанні
науково-дослідної роботи;
) Витрати на послуги сторонній організацій;
) Витрати на службові відрядження;
) Інші прямі невраховані витрати;
) Накладні витрати.
4.3.2 Розрахунок заробітної
платні науково-виробничого персоналу
Витрати за цією статтею складаються із планового фонду
заробітної плати науково та інженерно-технічних співробітників, робітників та
службовців відділів, лабораторій, що зайняті у даній НДР, основних виробничих
цехів експериментального виробництва, які виконують роботу по даній НДР.
Трудомісткість окремих робіт, розділених за категорією
виконавців, приведена у табл. 4.1.
Таблиця 4.1 - Трудомісткість робіт за категорією
виконавців
|
Етапи НДР
|
|
Трудомісткість, людо-дні
|
|
|
Відповідальний виконавець
теми, провідний науковий співробітник
|
Старший науковий
співробітник
|
Інженер- дослідник
|
Лаборант
|
|
Аналітичний огляд з теми та
обґрунтування недоліків дослідження
|
-
|
5
|
20
|
-
|
|
Розробка методик проведення
робіт
|
5
|
7
|
10
|
-
|
|
Підготовка обладнання
|
-
|
10
|
-
|
|
Підготовка зразків
|
-
|
10
|
15
|
-
|
|
Дифрактометричне
дослідження зразків
|
-
|
15
|
14
|
8
|
|
Обробка отриманих даних
|
6
|
15
|
21
|
-
|
|
Обговорення результатів
|
15
|
5
|
10
|
-
|
|
Оформлення НДР
|
-
|
-
|
11
|
-
|
|
РАЗОМ
|
26
|
67
|
110
|
8
|
|
|
|
|
|
|
|
|
|
Денна заробітна плата визначається, як відношення
місячної заробітної плати до "умовного" місяцю, який дорівнює 21,2
дні, при п'ятиденному робочому тижні.
Розрахунок основної заробітної плати ведеться по даним
про трудомісткість окремих етапів науково-дослідної роботи та денної заробітної
плати виконавців. Місячні оклади виконавців та денна з/п наведені у табл.. 4.2.
Таблиця 4.2 - Заробітна плата виконавців
|
Посада виконавця НДР
|
Трудомісткість, люд-днів
|
Місячний оклад, грн.
|
Денна заробітна плата, грн.
|
Заробітна плата за
виконавцями, грн
|
|
Відповідальний виконавець
теми, СНС
|
26
|
2700
|
127,4
|
3312,4
|
|
|
Інженер- дослідник
|
110
|
2100
|
99,5
|
10945
|
|
|
Лаборант механічних
досліджень
|
8
|
1500
|
70,1
|
560,8
|
|
|
Разом
|
|
|
|
22087,7
|
|
Основна заробітна плата визначається шляхом
перемноження трудомісткості на денну заробітну плату виконавців:
ОЗП = 127,4·26+108,5·67+99,5·110+70,1·8 = 22087,7 грн.
Додаткова заробітна плата складає 10% від основної:
ДЗП = 0,1·22087,7 = 2208,77 грн.
4.3.3 Відрахування на соціальні заходи
Відрахування на соціальні заходи складає 37,1% від суми ОЗП та ДЗП а
саме:
пенсійний фонд - 33,2%;
фонд соціального страхування - 1,4%;
фонд зайнятості - 1,6 %;
фонд страхування від нещасного випадку на виробництві та профзахворювань
-0,9%.
ОС = 0,371· (22087,7 +2208,77) = 9014 грн.
4.3.4 Вартість матеріалів, необхідних для
виконання науково-дослідницької роботи
Для виконання науково-дослідної роботи необхідно матеріали, які
комплектують виріб. Матеріали оцінюють по діючим оптовим цінам. Кількість
основних і допоміжних матеріалів, які витрачаються на виконання НДР, вартість
матеріалів та витрати на них приведені у табл. 4.3.
Таблиця 4.3 - Розрахунок вартості основних і допоміжних матеріалів:
|
Найменування матеріалів
|
Одиниці виміру
|
Ціна за одиницю, грн.
|
Кількість
|
Загальна вартість, грн.
|
|
Порошок Гідроксилапатит
кальцію
|
г
|
50
|
4
|
200
|
|
Катридж
|
шт.
|
110
|
1
|
110
|
|
Папір
|
пачка
|
23,5
|
1
|
23,5
|
|
|
Флешка
|
шт.
|
40
|
1
|
40
|
|
|
Усього
|
|
|
|
373,5
|
|
|
|
|
|
|
|
|
Витрати на транспорт (ТВ) приймаємо в розмірі 10% від
вартості матеріалів
(М.В):
ТВ = 373,5·0,1 = 37,35 грн.
Повна сума витрат на матеріали:
МВ = 373,5 + 37,35 = 410,85 грн.
4.3.5 Витрати на спеціальне
обладнання
Всі роботи виконуються на наявному обладнанні і
витрати на цю статтю не передбачались.
4.3.6 Витрати на відрядження
Службові відрядження на період виконання НДР не
планувались.
4.3.7 Інші прямі невраховані
витрати
До цієї статті витрат відносять: страхування окремих
співробітників, оренду приміщення, плату стороннім організаціям, відрахування у
ремонтний фонд та інші витрати, віднесені до цієї НДР за прямою ознакою.
Інші прямі витрати приймають за 10% від усіх врахованих прямих витрат за
темою:
ПНВ = 0,1·(22087,7 +2208,77 +9232,66 +410,85) = 3423,7
грн.
4.3.8 Накладні витрати
До складу накладних витрат входять:
заробітна плату адміністративного та управлінського
персоналу;
витрати на утримання виробничих приміщень
(освітлювання, опалення, вентиляція, електроенергія);
витрати на капітальний ремонт;
по охороні праці та інше.
Розмір накладних витрат визначається у процентах від
планового фонду заробітної плати (основної та додаткової) науково-виробничного
персоналу. Норматив накладних витрат дорівнює 20% основної заробітної плати.
Сума накладних витрат складає:
НР = 0,2·22087,7 = 4417,54 грн.
4.3.9 Складання планового
кошторису собівартості науково-дослідної роботи
Усі витрати, пов'язані з виконанням науково-дослідної
роботи приведені у табл. 4.4.
Таблиця 4.4 - Плановий кошторис витрат на виконання НДР:
„Кристалоструктурні характеристики фаз в біокерамічних порошках на основі
гідроксиапатиту кальцію”
|
Статті витрат
|
Сума
|
Обгрунтування
|
|
Грн.
|
У % від загального
|
|
|
Основна та додаткова
заробітна плата науково-виробничого персоналу
|
24296,47
|
59
|
За розрахунком
|
|
Відрахування на соціальне
страхування
|
9232,66
|
22
|
38% від заробітної плати
|
|
Матеріали
|
373,5
|
1
|
За розрахунком
|
|
Інші прямі невраховані
витрати за темою
|
3423,7
|
8
|
10% від суми попередніх
|
|
Накладні витрати
|
4417,54
|
10
|
20% від основної заробітної
плати
|
|
Усього
|
41743,87
|
100
|
|
4.4 Економічна ефективність
НДР
Дана НДР має в основному пошуковий характер, тому
оцінка економічної ефективності НДР проводиться за методикою бальної оцінки.
Бальна оцінка проводиться по найбільш важливим показникам:
) важливість розробки - К1;
) можливість використання результатів розробки - К2;
) теоретичне значення і рівень новизни досліджень -
КЗ;
) складність розробки - К4.
Шкала для оцінки важливості розробки К1:
Ініціативна робота, не є ні частиною комплексної програми, ні завданням
директивних органів - 1 бал.
Робота, яка виконується за договором з науково-технічною допомогаю - 3
бали.
Робота, яка є складовою частиною відомчої програми - 5 балів.
Робота, яка є складовою частиною комплексної програми - 8 балів.
Шкала для оцінки показника К2:
Результати розробки можуть бути використані в даній установі - 1 бал.
Результати розробки можуть бути використаними в одній організації - 3
бали.
Результати розробки можуть бути використаними в багатьох організаціях - 5
балів.
Результати розробки можуть бути використаними в масштабах галузі - 8
балів .
Результати розробки можуть бути використаними в багатьох організаціях
різних галузей - 10 балів.
Шкала для оцінки показника кз:
Аналіз, узагальнення та класифікація відомої інформації; подібні
результати, які були відомі в досліджуваній галузі - 2 бали.
Одержання нової інформації, яка доповнює уявлення про сутність
досліджуваних процесів, невідомих раніше в досліджуваній галузі - 3 бали.
Одержання нової інформації, яка частково дає уявлення про сутність
досліджуваних процесів - 5 балів.
Створення нових теорій та методик - 6 балів.
Одержання інформації, що слугує формуванню нових напрямків - 8 балів.
Шкала для оцінки показника К4:
Робота, яка виконується одним підрозділом, витрати до 200 грн. - 1 бал.
Робота, яка виконусться одним підрозділом, витрати від 200 до 1000 грн. -
3 бали.
Робота, яка виконуєгься одним підрозділом, витрати від 1000 до 5000 грн.
- 5 балів.
Робота, яка виконується багатьма підрозділами, витрати від 5000 до 10000
грн. - 7 балів.
Робота, яка виконується декількома організаціями, витрати більше 10000
грн. - 9 балів.
За важливістю розробки робота оцінюється як та, що
виконується за договором про науково-технічну допомогу, К1 = 5.
За можливістю використання розробка може бути
використана в багатьох організаціях, К2 = 5.
За оцінкою теоретичного значення та рівнем новизни,
отримана інформація доповнює уявлення про сутність процесів, що проходять, які
невідомі в досліджуваній області, К3 = 3.
За оцінкою показників складності, робота виконується
одним відділом, витрати перевищують 2000 грн., К4 = 5.
Загальна оцінка встановлюється шляхом помноження
вказаних коефіцієнтів:
Б=К1·К2·КЗ·К4 , (4.1)
Б=5·5·3·5=375
Умовний ефект на кожний бал складає 200грн. Загальний
ефект розробки:
Ео=500·К1·К2·К3·К4 , (4.2)
Ео=500·375=187500 грн.
Тоді річний умовний ефект розраховується за формулою:
Еус=500·Б - Еп·Вндр , (4.3)
де Еус - загальний умовний ефект, грн..;
Вндр - витрати на виконання НДР, грн.; Еп=0,25;
Еус=500·375 - 0,25·41743,87= 177064 грн.
Економічна ефективність НДР визначається коефіцієнтом
ефективності Ер, який характеризує частину майбутнього ефекту від розробки на
умовну одиницю витрат.
Ер=(Еус/Вндр)>1 , (4.4)
Ер=177064/41743,87=4,24
Проведені розрахунки підтверджують доцільність проведення роботи.
5. ОХОРОНА ПРАЦІ
5.1 Мета розділу
Згідно з Законом України «Про охорону праці» жодна науково-дослідна
робота не повинна виконуватися, якщо умови праці не відповідають чинним
нормативно-правовим актам про охорону праці.
Метою розділу є аналіз небезпечних та шкідливих виробничих факторів,
параметрів робочої зони, порівняння їх на відповідність стандартам, а також
розробка заходів та улаштування робочих місць для створення безпечної
діяльності працівників без шкоди для здоров’я. Дана науково-дослідна-робота
була виконана в умовах технологічної ділянки ІПМ НАН України. Дослідження були
проведені в лабораторії, робота в якій потребує обов'язкового дотримання правил
охорони праці, щоб запобігти виробничому травматизму і професійним
захворюванням. В процесі роботи присутні такі основні небезпечні та шкідливими
виробничі фактори: пари та гази, підвищений рівень електромагнітних
випромінювань, підвищене значення напруги в електричній мережі.
У ході даної роботи було проведено фазове дослідження зразка отриманого
ударно-відцентровим розпелнням. Експерименти проводилися на дифрактометрі
ДРОН-УМ1.
5.2 Аналіз небезпечних та
шкідливих виробничих чинників при виконанні НДР
Науково-дослідна робота виконується в лабораторії
рентгеноструктурного аналізу Інституту проблем матеріалознавства НАН України.
Було проведено вимірювання розмірів приміщення лабораторії та вікон:
розміри лабораторії - довжина (6 м), ширина (5 м), висота (3,5); розміри вікон
- ширина (1,1 м), висота (1,9 м).
Площа даної лабораторії 30 м2, а об’єм складає 105 м3 де
одночасно працює 3 людини. Відповідно площа приміщення на одну людину становить
10 м2, а об’єм - 35 м3. Що відповідає установленим санітарним нормам згідно
ДСанПіН 33.2.007-098. Схематичне зображення та розташування елементів
лабораторії, представлено на рис. 5.1.
Рис. 5.1 - Схематичне зображання лабораторії
- ИРИС-3 - 0,38 кВ; 2 - робочий стіл; 3 - тумба;
В лабораторії температура повітря 20-25 єС, відносна вологість повітря не
перевищує 0,2 м/с. Санітарно - гігієнічне нормування умов мікроклімату
здійснюється за ДСН 3.36.042-99 [18], які встановлюють оптимальні і допустимі
параметри мікроклімату залежно від загальних енерговитрат організму при
виконанні робіт і період року. За загальними затратами організму на виконання
робіт відповідно нормативу виділяють три категорії робіт: легкі роботи,
середньої тяжкості ті важкі роботи. В нашому випадку характер роботи легкий
(роботи, що виконуються сидячи і не потребують фізичного напруження,
затрачується 150 Ккал/год). Тому, згідно ДСН 3.36.042-99, мікроклімат в
приміщені відповідає встановленим вимогам.
ИРИС-3 живиться від мережі 380 В з частотою 50 Гц. При проведенні
експериментів можливе опромінення людини рентгенівським променями, які
проникають в організм, стають причиною променевої хвороби, здійснюють руйнівну
дії на шкіряний покрив, кістковий мозок, кінцівки та внутрішні органи.
Під час роботи установки ИРИС-3 відбувається іонізація повітря, з
утворенням озону і оксидів азоту. Це може впливати на органи дихання, тому в лабораторії
встановлені витяжки.
5.3 Виробниче освітлення
Для підвищення активності людини та її працездатності необхідні
оптимальні світлові умови. Необхідний рівень освітлення визначається ступінню
точності зорових робіт. По характеру роботи (проведення рентгеноструктурних
досліджень) приміщення відноситься до першої групи (ДБН 3.2.5.28 - 2006 р). Так
як найменший об’єкт дослідження становить 0,3-0,5 мм, то виконувана зорова
робота є роботою високої точності і відноситься до третього розряду зорових робіт
(ДБН 3.2.5.28 - 2006 р) [19].
Природне освітлення лабораторії є боковим одностороннім і здійснюється
через віконні прорізи в зовнішніх стінах будівлі.
Штучне освітлення здійснюється системою загального рівномірного
освітлення, яка складається з дев’яти світильників. В кожному з них встановлені
два газорозрядних джерела світла (люмінесцентні лампи денного світла ЛБ - 40) .
5.4 Аналіз іонізуючого випромінювання
При роботі на установці ИРИС-3 можливий вплив рентгенівського іонізуючого
опромінювання. Зміни, які відбуваються в організмі, залежно від величини
поглинутої ним енергії. При опроміненні відбувається іонізація молекул
організму людини. В організмі утворюються токсини, що призводить до порушення
біохімічних процесів.
Згідно з НРБ всі особи на яких можливий вплив іонізуючого випромінювання
поділяється на 3 категорії. В даному випадку це категорія А (персонал) - особи,
які постійно чи тимчасово працюють безпосередньо з джерелами іонізуючих
випромінювань .
При роботі на ИРИС -3 ліміт ефективної дози не перевищує 20 мЗв, тобто
відповідає нормам безпеки відповідно до НРБУ-97 .
В лабораторії для запобігання додаткового опромінення обмежують час
перебування біля ввімкнутої установки, яка знаходиться в кімнаті, стіни якої
пофарбовані спеціальною фарбою, також використовують захисні екрани та мідні
пластини на шляху розповсюдження рентгенівських променів.
5.5 Електробезпека
Електробезпека - це система організаційних та технічних заходів і
засобів, що забезпечують захист людей від шкідливого та небезпечного впливу
електричного струму, електричної дуги, електромагнітного поля і статичної
електрики.
Електричний струм, проходячи через тіло людини, зумовлює перетворення
поглинутої організмом електричної енергії в інший вид і спричиняє термічну,
електролітичну, механічну і біологічну дію.
Найбільш складною є біологічна дія, яка притаманна тільки живим
організмам. Термічний і електролітичний вплив властиві будь-яким провідникам.
Електричне обладнання, що встановлене в лабораторії, є потенційно
небезпечним для працюючих, оскільки органи відчуття людини не можуть на
відстані виявити електричну напругу.
Причинами ураження електричним струмом можуть бути:
. Доторкання до частин електроустановки, що випадково знаходяться під
струмом внаслідок замикання фази на корпус, ушкодження ізоляції або іншої
несправності.
. Потрапляння під напругу під час проведення ремонтних робіт на
вимкненому обладнанні за причиною помилкового включення або з причини
недотримання часу, необхідного для зняття електричних зарядів з високовольтних
шин, розрядки конденсаторів.
При розробці захисних заходів, вважають небезпечним струм у 25 мA, при
якому важко самостійно відірватися від провідника, а струм величиною 100 мA
може привести до смертельного результату. До напруги 42 В найбільш небезпечний
змінний струм, а більше 42 В вплив однаковий, як постійного, так і змінного
струму. Найбільш небезпечна частота - 50…60 Гц.
Відповідно до ПУЕ - 97, приміщення за небезпекою електротравм відноситься
до категорії приміщень з підвищеною небезпекою, оскільки в ньому можливе
одночасне доторкання до металевих заземлюючих предметів і корпусів
електроустановок, в результаті цього може бути ураження електричним струмом. За
характером середовища відноситься до нормальних - сухі приміщення, в котрих
відсутні ознаки жарких та запилених приміщень та приміщень з хімічно - активним
середовищем. Електроустановка, що використовується при виконанні даної роботи,
живиться напругою 380В і змінного струму частотою 65 кГц. Дана установка
підлягає заземленню[18].
У лабораторії, де проводилися дослідження, корпуси електроустаткування і
приладів під’єднанні до внутрішньої магістралі (контуру) заземлення болтовим
з‘єднанням. Розташування робочих місць таке, що виключається можливість дотику
до корпусів електроустаткування і приладів.
Рисунок 5.2 - Схема контурного заземлення
- заземлюючі пристрої; 2 - обладнання що заземлюється; 3 - внутрішня
магістраль (контур) заземлення; 4 - заземлюючі провідники; 5 - вертикальні
заземлювачі.
Кожний рік проводиться перевірка опорів і захисту електропроводок, а
також заземлення.
Рисунок 5.3 - Схема штучного заземлення.
5.6 Пожежна безпека
Небезпечними факторами пожежі і вибуху, які можуть призвести до травми,
отруєння, загиблі або матеріальних збитків є відкритий вогонь, іскри,
підвищення температури, токсичні продукти горіння, дим, низький вміст кисню,
обвалення будинків і споруд.
Основним напрямками забезпечення пожежної безпеки є усунення умов
виникнення пожежі та мінімізація її наслідків. Об’єкти повинні мати системи
пожежної безпеки, спрямовані на запобігання пожежі, дії на людей та матеріальні
цінності небезпечних факторів пожежі, в тому числі їх вторинних проявів. До
таких факторів, згідно ГОСТ 12.1.004-91 , належать:
. підвищена температура навколишнього середовища;
. токсичні продукти горіння і термічного розкладу речовин;
. знижена концентрація кисню
Вторинними проявами небезпечних факторів пожежі вважаються:
. радіоактивні та токсичні речовини і матеріали, викинуті із зруйнованих
апаратів та установок;
. електричний струм, пов’язаний с переходом напруги на струмопровідні
елементи будівельних конструкцій, апаратів в наслідок пошкодження ізоляції
. небезпечні фактори вибухів, пов’язаних з пожежами
Класифікація приміщення :
згідно з ОНТП 24-86 по пожежній небезпеці приміщення лабораторії можна
віднести до категорії „B” (пожежонебезпечна), оскільки в цьому приміщенні є
тверді горючі речовини (меблі папір та інше ).
відповідно до ДНАОП 0.00 - 1.32 - 01 аудиторія відноситься до класу П2-а
(простір у якому вибухонебезпечне середовище за нормальних умов експлуатації
відсутнє, а якщо воно виникає, то рідко і триває недовго).
У випадку виникнення пожежі на електроустановці, яка знаходиться під
напругою полум’я, котре виникає, гаситься не водою, а за допомогою
вуглекислотного чи вуглекислотноброметилового вогнегасників.
В лабораторії є вуглекислотний вогнегасник ОУ-2 (ГОСТ 111564-65), а на
сходових клітках і в коридорах ящики з піском, вогнегасники типу ВУ-8, пожежні
крани. В лабораторії є вуглекислотний вогнегасник ОУ-2 (ГОСТ 111564-65), а на
сходових клітках і в коридорах ящики з піском, вогнегасники типу ВУ-8, пожежні
крани.
Для пожежного зв’язку використовується телефон.
Евакуація з поверху де знаходиться робоче приміщення виконується згідно з
планом (рис. 5.4).
Рисунок 5.4 -План евакуації 3 поверху
5.7 Вимоги до умов праці під
час роботи на установці ИРИС-3
Обслуговування устаткування мусить проводитись у
відповідності до правил вимог безпеки при експлуатації електричного
устаткування, згідно ДСН 3.3.6 042-99
1)
До роботи на
обладнанні необхідно допускати працівників, що пройшли відповідні інструктажі
та ознайомлення з правилами охорони праці на такому устаткуванні.
2)
Оператори мусять
мати відповідний спеціальний одяг та засоби індивідуального захисту.
3)
Категорично
забороняється відчиняти шафи та пульти керування, провадити самостійно ремонтні
роботи та провадити ремонти під час роботи устаткування.
4)
Обслуговування
апарату повинно провадитися з урахуванням вказівок з монтажу, налагодження та
експлуатації, які наведені в технічному описі та в інструкції з техніки
безпеки.
5) Цей персонал проходить стажування на робочому місці протягом 6-11
днів.
ВИСНОВКИ
. Експериментально встановлено формування кристалічної текстури в
мікроплазмових покриттях гідроксил апатиту Ca5(PO4)3OH вздовж напрямку [002]
при товщина покриття більше 100 мкм.
. Фазовий склад покриття та характеристика його текстури залежать
від товщини напиленого шару. При збільшенні товщини покриття від 50 до 350 мкм
ступінь текстури зростає, а коефіцієнт текстури, відповідно, зменшується (від
0,72 до 0,34).
CONCLUSIONS
. Experimentally found formation of сrystalline texture in microplasma
coatings hydroxylapatite Ca5 (PO4) 3OH along the direction [002] in thickness
covering more than 100microns.
. Phase composition of coatings and characterization of its texture
depend on thethickness of the deposited layer. With increasing coating
thickness from 50 to 350microns degree of texture increases and the texture
coefficient, respectively, decreased(from 0.72 to 0.34).
Перелік посилань
1. Aoki H. Science and medical
applications of hydroxyapatite. - JAAS: Tokyo, 1991. - 137 p.
2. Williams D.F. The science and
applications of biomaterials // Advances in Materials Technology Monitor.
-1994. - № 2. - P. 1-38
3. Орловский В.П., Суханова Г.Е., Ежова
Ж.А., Родичева Г.В. Гидроксиапатитовая биокерамика // Ж. Всесоюзного хим. об-ва
им. Д.И. Менделеева. - 1991. - № 6. - С. 683-688
4. Hench L.L. Bioceramics and the future
// Ceramics and Society. Ed. P. Vincenzini. Tech: Faenza. -1995. - P. 101-120
5. Третьяков Ю.Д., Брылев О.А. Новые
поколения неорганических функциональных материалов // Ж. Росс. хим. об-ва им.
Д.И. Менделеева. - 2000. - №4. - С. 10-16
6. Doremus R.H. Review Bioceramics // J.
Mater. Sci. - 1992. - №3. - P. 285-296
7. Cao W. and Hench L.L. Bioactive
Materials //J. Ceramics Inter. - 1996. - №22. - P. 493-507
8. Саркисов П.Д., Михайленко Н.Ю.,
Батрак И.К., Строганова Е.Е., Шмелева И.Н. Калыщйфосфатные
стеклокристаллические покрытия для титановых имплантатов // В сб.: Проблемы
имплантологии в оториноларингологии. M.: Пресс-Соло, 2000.
9. Sarkisov P.D., Michailenko N.Yu.,
Stroganova Е.Е., Berchenko G.N., Kesian G.A. Glass-based bioactive calcium
phosphate materials // Proc. XIX Int. Congr. On Glass. Edinburg, 2001.
10. Suchanek W. and Yoshimura M.
Processing and properties of HA-based biomaterials for use as hard tissue
replacement implants // J. Mater. Res. Soc. - 1998. - №1. - P. 94-103
11. Hing K. A., Best S.M., Tanner K. A.
et. al. Quantification of bone ingrowth within bone derived porous
hydroxyapatite implants of varying density // J. Mater. Sci.: Mater. Med. -
1999. - №10/11.-P. 663-670
12. Krajewski A., Ravaglioli A., Roncari
E. et. al. Porous ceramic bodies for drug // J. Mater. Sci.: Mater. Med. -
2000. - №12. - P. 763-772
13. Paul W., Sharma C.P. Development of
porous spherical hydroxyapatite granules: application towards protein delivery
// J. Mater. ScL: Mater. Med. - 1999. - №7. - P. 383-388
14. Vaz L., Lopes A.B., Almeida M.
Porosity control of hydroxyapatite implants // J. Mater. ScL: Mater. Med. -
1999. - №10. - P. 239-242
15. Lio D. Fabrication of hydroxyapatite
ceramic with controlled porosity // J. Mater. Sci.: Mater. Med. - 1997. - №8. -
P. 227-232
16. Itokazu M., Esaki M., Yamamoto K.,
Tanemori T., Kasai T. Local drug delivery system using ceramics: vacuum method
for impregnating a chemotherapeutic agent into a porous hydroxyapatite block //
J. Mater. Sci.: Mater. Med. - 1999. - №4. - P. 249-252
17. Lu J.X., Flautre B., Anselme K. Role
of interconnections in porous bioceramics on bone recolonization in vitro and
in vivo Il J. Mater. Sci.: Mater. Med. - 1999. - №2. - P. 111-120
18. Yamamoto M., Tabata Y., Kawasaki H.,
Ikada Y. Promotion of fibrovascular tissue ingrowth into porous sponges by
basic fibroblast growth factor // J. Mater. Sci.: Mater. Med. - 2000. - №4.-P.
213-218
19. Weinlander M., Plenk H., Jr., Adar F.
and Holmes R. Bioceramics and the human body // Ed. A.Ravaglioli and
A.Krajewski. Elsevier, London. -1992. - P. 317
20. Самусев Р.П., Селин Ю.М. Анатомия
человека. - M.: Медицина, 1990. - 479 с.
21. Martin R.B. Bone as a ceramic
composite material // J. Mater. Sci. Forum. - 1999. - № 1. - P. 5-16