Активность нейтральных протеаз в тканях животных при зимней спячке и гипотермии
Активность
нейтральных протеаз в тканях животных при зимней спячке и гипотермии
СПИСОК СОКРАЩЕНИЙ
АКТГ - адренокортикотропный гормон
ГАМК - гамма-аминомаслянная кислота-
этиленгликоль тетрауксусная кислота
КП М - карбоксипептидаза М
ММП - матриксные металлопротеиназы-
N-метил-D-аспартат
ОАНП - общая активность нейтральных протеаз
ПОЛ - перекисное окисление липидов
ТIМП - тканевые ингибиторы металлопротеиназ
ФЛ - фосфолипиды
ХЛ - холестерин
ВВЕДЕНИЕ
Актуальность проблемы. Проблема адаптации
животных и человека к низким температурам является актуальной в связи с все
большим проникновением человека в полярные районы земли и освоением природных
ресурсов Севера и Сибири (Мешалкин, Верещагин, 1985).
Искусственная гипотермия с охлаждением тела до
20-24°С находит применение в хирургии при операциях на сердце и центральной
нервной системы. Она значительно снижает обмен веществ головного мозга, и,
следовательно, уменьшает потребность его в кислороде. Поэтому мозг в таких
условиях способен переносить более длительное обескровливание (вместо 3-5 минут
при нормальной температуре, до 15-20 мин при 25-28°С) (Sakurai et al., 2005).
В природе существует несколько различных типов
гипотермии, наиболее уникальной из которых является зимняя спячка (Эмирбеков,
Львова, 1985). Зимняя спячка - это эволюционно выработанная способность
животных приспосабливаться к низким температурам среды путем снижения
температуры тела, а, следовательно, метаболизма. У зимоспящих животных
температурный диапазон активности биохимических реакций более широкий (от 0 до
38°С) (Эмирбеков, Львова, 1985; Storey, Storey, 2000; Geiser, 2004).
У гипотермированных животных, как и у животных,
впадающих в зимнюю спячку, скорость метаболизма снижается по мере снижения
температуры (Kataoka, Yanase, 1998). Изменения, вызываемые гипотермией,
обнаруживаются во всех изучаемых органах, но вместе с тем установлено, что
различные органы по-разному реагируют на глубину и скорость охлаждения
(Рыжакова, 1997). Выраженность изменений находится в прямой зависимости от
глубины гипотермии (Бернштейн, 1971).
Согласно теории Хочачка (Hochachka, Somero,
2002) при гипотермии угнетаются процессы синтеза АТФ, наступает дефицит
энергии, что замедляет транспорт Са2+ из цитозоля в среду. Накапливаясь в
цитозоле, Са2+ нарушает метаболизм клетки. Незначительное (с 10-8 М в норме до
10-6 М) повышение Са2+ в цитозоле приводит к активации различных
протеолитических и липолитических ферментов в клетке, вследствие чего начинают
разрушаться клеточные мембраны (Иванов и др., 1999).
На протяжении многих лет считалось, что
основными протеолитическими ферментами клеток животных и человека являются
катепсины, осуществляющие деградацию белков в кислой среде. Вместе с тем
выявлены протеолитические ферменты с оптимумом действия в зоне нейтральных
значений рН. Среди последних особого внимания заслуживают тиоловые протеиназы -
кальпаины, активность которых в значительной мере зависит от присутствия в
среде ионов Са2+ (Сологуб, Пашковская, 1998). Ферменты этого семейства
участвуют в таких процессах как клеточная миграция, цитоскелетное
ремоделирование, клеточная дифференциация и апоптоз. Активация кальпаина
наблюдается также при таких патологических состояниях как мышечная дистрофия,
сердечная и церебральная ишемия, агрегация эритроцитов, нейродегенеративные
болезни, катаракта и болезнь Альцгеймера (Khorchid, Ikura, 2002).
В клетках нервной ткани животных и человека
имеется, связанная с миелином, Са2+ - активируемая нейтральная протеаза,
которая осуществляет расщепление основного белка до полипептидов с молекулярной
массой 6-17 килодальтон (кД). Так как основному белку миелина приписывается
важное значение в этиологии множественного склероза и близких ему заболеваний,
связанных с демиелинизацией, то изучение этой протеазы может содействовать расшифровке
механизмов возникновения патологических состояний (Сологуб, Пашковская, 1988).
Зависимость активности кальпаинов от Са2+ может
обеспечивать функционирование регуляторного механизма за счет изменения в
клетках уровня катиона и участия Са2+ - активируемых нейтральных протеаз в
ограниченном протеолизе, что в свою очередь ведет к изменению соотношения
активности ряда ферментов (Moldoveanu et al., 2002). Не исключено, что
образуемые в этом процессе фрагменты белковых молекул в свою очередь могут
служить вторичными мессенджерами и оказывать активирующее или ингибирующее
влияние на геном и клеточные ферменты (Kenyon et al., 2003).
В связи с этим, сравнительное изучение
активности нейтральных протеаз в различных тканях гетеротермов в динамике
зимней спячки, и гомойотермов при гипотермии, представляет значительный
интерес.
Цели и задачи исследования. Целью нашей работы
явилось сравнительное исследование активности нейтральных протеаз в тканях
гомойо- и гетеротермных животных в условиях искусственной и естественной
гипотермии.
Для достижения этой цели были поставлены
следующие задачи:
Исследовать общую активность нейтральных протеаз
в мозгу, печени и сердечной мышце в динамике зимней спячки сусликов.
Исследовать общую активность нейтральных протеаз
в мозгу, печени и сердечной мышце при 2-х месячной зимней спячки сусликов и в
ходе их индуцированного пробуждения.
Исследовать общую активность нейтральных протеаз
в мозгу, печени, сердечной мышце и сыворотке крови крыс при гипотермии разной
глубины и длительности.
Исследовать активность Са2+ - зависимой
нейтральной протеазы в мозгу, печени, сердечной мышце и сыворотке крови крыс
при гипотермии разной глубины и длительности.
Исследовать активность глицилглицин-дипептидазы
в мозгу и печени пробуждающихся и лишенных зимней спячки сусликов.
Исследовать температурную зависимость общей
активности нейтральных протеаз в печени в динамике зимней спячки и
индуцированном пробуждении сусликов при температуре тела 10, 20, 25, 30 и 37°С.
Основные положения, выносимые на защиту:
У контрольных крыс и у бодрствующих летом
сусликов в зависимости от тканевой локализации (мозг, печень, сердце)
наблюдается различие общей и Са2+-зависимой активности нейтральных протеаз.
В динамике зимней спячки сусликов суммарная
(общая) активность нейтральных протеаз претерпевает значительные колебания,
специфичные для разных тканей.
На этапах самосогревания сусликов, после
индуцированного пробуждения общая активность нейтральных протеаз не зависит от
температуры тела, особенно, при 20, 25 и 30ºС.
Активность глицилглицин-дипептидазы в тканях
пробуждающихся и лишенных зимней спячки сусликов отличается.
У крыс по мере снижения температуры тела
наблюдается падение активности нейтральных протеаз. Пролонгирование глубокой
гипотермии 20°С в течение 2 часов приводит к повышению активности исследуемых
ферментов по сравнению с данными при 20°С.
Научная новизна. В настоящей работе впервые в
сравнительном аспекте исследована активность нейтральных протеаз при
искусственной и естественной гипотермии у гомойотермных и гетеротермных
животных. Выявлены органно-тканевые особенности изменения нейтральных протеаз
при исследуемых состояниях животных.
Новыми являются данные об изменении общей
активности нейтральных протеаз в динамике зимней спячки и индуцированного
пробуждения после 2-х месячной зимней спячки сусликов.
Вперые исследована активность
глицилглицин-дипептидазы в тканях пробуждающихся и лишенных зимней спячки
сусликов.
Теоретическая и практическая значимость.
Изучение метаболизма при искусственном и естественном охлаждении организма в
сравнительном аспекте может приблизить нас к пониманию общих механизмов
резистентности гомойотермных животных к низкой температуре тела, а также для
понимания механизмов формирования патогенеза холодового повреждения. Решение
указанных теоретических проблем, может иметь большое практическое значение при
использовании метода гипотермии в медицинской практике. Материалы, полученные
при выполнении данной диссертационной работы, используются при чтении курса
«Энзимология», спецкурса «Кинетика ферментативных реакций», в учебном процессе
и на практических занятиях студентов по биохимии ДГУ и филиала ЮФУ в г.
Махачкале, в НИР.
Апробация работы. Материалы диссертации
докладывались на XII международной конференции студентов, аспирантов и молодых
ученых «Ломоносов-2005» (Москва, 2005), на X Республиканской
научно-практической конференции (Махачкала, 2005), на Международной научной
конференции (Махачкала, 2006), на 10-й Пущинской конференции молодых ученых
(Пущино, 2006), на V-й Международной научно-практической конференции (Тамбов,
2007), на совместном заседании кафедры биохимии и биофизики с НИИ биологии ДГУ
(3 февраля 2009, протокол №7), на заседании кафедры биохимии и микробиологии
Южного Федерального университета (21 марта 2009).
Публикации. По данной диссертационной работе
опубликовано 7 работ, в том числе две в рекомендуемых ВАК журналах.
белок протеаза гипотермия спячка
ГЛАВА 1. ОБЗОР ЛИТЕРАТУРЫ
.1 Протеолиз белков в клетке
К числу фундаментальных достижений биологии
последних двадцати лет относится признание протеолиза как особой формы
физиологической регуляции (Гомазков, 1996).
Протеолиз - ферментативный гидролиз белков и
пептидов, катализируется протеолитическими ферментами (пептид-гидролазами,
протеазами) и играет важную роль в регуляции обмена веществ в организме. С
протеолизом связаны такие фундаментальные процессы жизнедеятельности, как
внутриклеточный распад белков и регуляция их кругооборота, пищеварение,
оплодотворение, морфогенез, защитные реакции, адаптационные перестройки обмена.
Нарушение протеолиза и его регуляции лежит в основе развития многих
патологических состояний (Веремеенко и др., 1988).
Протеиназы - ферменты, осуществляющие гидролиз
пептидной связи в белках, включаются в функционирование белковой молекулы на
самых ранних этапах биосинтеза и сопровождают белки до конечной стадии их
жизненного цикла (полное расщепление, запуск апоптоза) (Ефременко,
Конторщикова, 2006).
Различают 2 типа протеолиза: приводящий к
полному расщеплению белковых молекул до отдельных аминокислот (тотальный) и
частичный, так называемый ограниченный протеолиз, при котором избирательно
гидролизуется одна или несколько пептидных связей в молекуле белка. Протеолиз
первого типа происходит в результате согласованного действия различных
протеолитических ферментов, тогда как реакции ограниченного протеолиза
катализируются отдельными специфическими протеазами (Соловьева и др., 1995).
Полный протеолиз осуществляется при внутриклеточном распаде белков под влиянием
тканевых протеаз (часто называемых катепсинами). Он протекает во многих случаях
внутри лизосом - клеточных органелл, содержащих набор гидролитических
ферментов. Путем полного протеолиза происходит удаление из организма аномальных
белков, образующихся в результате мутаций и ошибок биосинтеза. Полное расщепление
белковых молекул наблюдается также при различных морфогенетических превращениях
и адаптационных перестройках обмена. Под влиянием таких ферментов
желудочно-кишечного тракта, как пепсин, трипсин, химотрипсин и ряда других
пептидаз, происходит полный протеолиз белков пищи (Мосолов, 1971).
Ограниченный протеолиз белковых молекул имеет
первостепенное значение для регуляции обмена веществ в организме. Реакции
ограниченного протеолиза участвуют в процессе образования и инактивации
практически всех ферментов, гормонов и других биологически активных белков и
пептидов и, следовательно, в контроле активности основных биорегуляторов
(Furuno et al., 1990). Например, ограниченный протеолиз происходит при
превращении неактивных проферментов пепсиногена, трипсиногена и др. в
соответствующие активные протеазы, а также при образовании ферментов,
участвующих в свертывании крови, фибринолизе, активации системы комплемента,
ренин-ангиотензиновой и калликреин-кининовой систем и др. Эти системы организма
активируются в результате каскадного процесса, на каждом из стадий которого из
неактивного профермента путем ограниченного протеолиза образуется фермент,
катализирующий последующую реакцию (Goldberg, Dice, 1974). Примером роли
ограниченного протеолиза в биогенезе гормонов может служить специфический
гидролиз ряда пептидных связей в молекуле пропиомеланокортина, в результате
которого из этого полифункционального биосинтетического предшественника
образуются АКТГ, β-липотропин,
эндорфины, меланостимулирующие гормоны, из проинсулина - инсулин, из
проглюкагона - глюкагон. Таким же образом из своих неактивных предшественников
образуются факторы роста и другие регуляторные пептиды. При некоторых
эндокринных заболеваниях, например, наследственной проинсулиннемии, нарушен
ограниченный протеолиз проинсулина. Основным молекулярным механизмом
образования, инактивации и модификации, различных нейропептидов также является
ограниченный протеолиз, который тем самым играет существенную роль в реализации
таких нейрофизиологических процессов, как память, боль, поведенческие реакции и
другие (Веремеенко и др., 1988).
Ограниченный протеолиз представляет собой один
из основных механизмов посттрансляционной модификации - процессинга белков,
этапа, на котором из вновь синтезированных полипептидных цепей формируются
«зрелые» белковые молекулы. С помощью ограниченного протеолиза образуются
функционально активные белки и пептиды не только у высших, но и у простейших
организмов. Так, путем ограниченного протеолиза вирусного полипептида
получаются специфические белки различных вирусов, т.е. ограниченный протеолиз
является одним из важнейших механизмов репродукции вирусов и играет большую
роль в развитии вирусных инфекций (Wickner, 1999).
В организме различные белки имеют разную
продолжительность жизни: для одних белков она составляет минуты, для других -
многие сутки. Продолжительность жизни белков и скорость их кругооборота
определяются как скоростью их биосинтеза, так и скоростью их протеолиза.
Скорость протеолиза белков зависит от ряда факторов, в частности от их
взаимодействия с другими веществами: субстратами, коферментами,
аллостерическими эффекторами, а также от химических модификаций, которым белок
может подвергаться в клетке (гликолизирования, фосфорилирования и др.)
(Doherthy, Mayer, 1992).
При переходе организма из одного
физиологического состояния в другое (например, на определенных стадиях
эмбриогенеза), а также при голодании и некоторых стрессорных реакциях
наблюдается резкое усиление протеолиза тканевых белков. Локальное усиление
протеолиза белков межклеточного матрикса (коллагена, фибронектина, ламинина,
протеогликанов и др.) отмечается, например, в процессе разрушения хряща при
ревматоидном артрите, базальной мембраны при гломерулонефрите, а также при
инвазивном росте и метастазировании опухолей. Повышенный протеолиз этих белков,
а также эластина наблюдается в случае разрушения легочной ткани при эмфиземе
легкого, туберкулезе легких и др. Рассеянный склероз и ряд других заболеваний
нервной системы, сопровождающиеся демиелинизацией, связаны с усилением
протеолиза основного белка миелина. При мышечной дистрофии отмечают повышенный
протеолиз белков миофибрилл. Во всех случаях усиленный распад белков обусловлен
освобождением внутриклеточных протеаз и нарушением регуляции их активности
(Соловьева, 2000).
Изменение протеолиза белков при ряде других
заболеваний может быть вызвано синтезом дефектного белка - субстрата. Это
наблюдается при некоторых наследственных энзимопатиях, когда недостаточность
фермента может быть обусловлена синтезом белка - субстрата, обладающего
повышенной чувствительностью к действию протеаз (например, β-галактозидазы
при некоторых формах галактосиалидозы), или нарушением ограниченного протеолиза
биосинтетического предшественника ферментного белка и образованием вследствие
этого аномальной формы фермента (например, аномальной α-субъединицы
гексозаминидазы А при некоторых вариантах болезни Тея-Сакса).
Катализирующие гидролиз белков пептидгидролазы
(протеазы, пептидазы) представляют собой большую группу ферментов,
различающихся по своим физико-химическим свойствам, структуре и субстратной
специфичности. Эти ферменты имеют универсальное распространение и локализованы
в различных субклеточных структурах: ядре, лизосомах, митохондриях,
пластинчатом комплексе, микросомной и плазматической мембранах, цитозоле и др.
Различают две большие группы протеаз: эндопептидазы, расщепляющие в белках
внутренние пептидные связи, и экзопептидазы, которые гидролизуют связи на N- и
C-концевых участках пептидной цепи. По строению активного центра фермента и механизму
его действия выделяют 4 семейства эндопептидаз: аспартильные, сериновые,
цистеиновые и металлопротеазы.
Аспартильные протеиназы представляют собой
многочисленную группу ферментов, встречающихся в организмах животных, растений,
грибов и ретровирусов. Аспартильные протеазы представлены семейством пепсина.
Они включают пищеварительные ферменты типа пепсина и химозина, лизосомальный
катепсин D и ферменты процессинга белков, подобные ренину, некоторые протеазы
из грибов (пенициллопепсин, ризопуспепсин, эндотиапепсин), а также вирусные
протеазы вируса СПИДа (HIV) (ретропепсин). Почти все они, независимо от
источника, проявляют способность катализировать реакцию гидролиза пептидных
связей в кислой и слабокислой среде. Как правило, два остатка аспарагиновой кислоты
участвуют в кислотно-основном катализе в активном центре фермента. Вначале,
один аспартат акцептирует протон от H2O активного центра, который атакует
углерод карбонила пептидной связи. Одновременно, другой аспартат дает протон
кислороду карбонильной группы образующегося пептида (Кашпаров и др., 2000).
Среди протеолитических ферментов особый интерес
представляют наиболее распространенные в организме сериновые протеиназы, в том
числе локализованная в азурофильных гранулах нейтрофильных лейкоцитов человека
гранулоцитарная эластаза. Возрастание активности эластазы во внеклеточном
пространстве рассматривается как основное звено патогенеза многих заболеваний,
при которых происходит инфильтрация тканей активированными нейтрофилами,
наблюдаемая, прежде всего при воспалительных процессах. Попадая в кровеносное
русло, эластаза может разрушать белки протеолитических систем плазмы, тем
самым, нарушая процессы защиты и адаптации (Немкова, 1994).
К сериновым протеазам принадлежит трипсин,
химотрипсин, эластаза, подавляющее большинство протеаз плазмы крови (факторы
свертывания крови, фибринолиза, системы комплемента, кининовой системы), многие
внутриклеточные и бактериальные протеазы. Эти ферменты, хотя и отличаются своей
третичной структурой и специфичностью, но имеют одинаковую геометрию активного
центра и поэтому катализируют реакции по одному и тому же механизму. Три
аминокислотных остатка формируют домен-каталитическую триаду, обеспечивающую
проведение катализа (например, Гис 57, Асп 102 и Сер195 у химотрипсиногена).
Во время катализа происходит нуклеофильная атака
кислорода гидроксильного остатка серина протеазы на углерод карбонила
гидролизуемой пептидной связи. При этом образуется промежуточный ацилферментный
комплекс. Гидролиз возникающей при этом сложной эфирной связи приводит к
образованию второго продукта гидролиза (Дин, 1981).
К цистеиновым протеазам относятся многие
катепсины: B, H, L, ряд бактериальных и растительных ферментов, из которых
наиболее изучен папаин. Это группа гомологичных белков с однотипной трехмерной
структурой. Отличия в специфичности катепсинов обусловлены локальными
различиями в структуре субстрат - связывающей области. Цистеиновые протеазы по
механизму действия напоминают сериновые, однако ведущая роль в катализе
отводится цистеину. Во время катализа происходит передача протона SH-группы
цистеина на молекулу смежного гистидина, и атом серы обеспечивает нуклеофильную
атаку на углерод карбонила гидролизуемой пептидной связи. Возникающий тиоэфир,
связывающий новый С - конец пептида с тиолом цистеина - промежуточное звено
реакции (подобно ацилферментному комплексу в механизме катализа сериновыми
протеазами). Остатки Цис25 и Гис159 (в папаине) играют такую же роль, как
Сер195 и Гис57 в химотрипсине (Halang et al., 2000).
Лизосомальные цистеиновые протеиназы вовлечены в
процессы неопластической трансформации. Они деградируют многие белки и
компоненты внеклеточного матрикса и осуществляют деструкцию ткани. В процессе
иммунного ответа они участвуют в процессинге антигенов, а также могут
модифицировать белки плазматической мембраны. Эти протеиназы осуществляют
протеолиз короткоживущих белков, которые регулируют злокачественный рост
(Дилакян, 2000).
Матриксные металлопротеиназы относятся к
семейству цинковых металлопротеиназ, функция которых связана с обменом
соединительного матрикса в норме и при патологии. Известно более 20
представителей этого семейства, которые на основании специфичности можно
разделить на пять подсемейств: 1-колагеназы; 2-желатиназы; 3-стромелизины;
4-мембранный тип матриксных металлопротеиназ; 5-матриксные металлопротеиназы,
не относящиеся к известным подсемействам. Они играют основную роль в гидролизе
экстраклеточного матрикса благодаря своей способности разлагать практически все
его компоненты: коллагены всех типов, эластин, протеогликаны, ламинин и т.д.
Кроме того, металлопротеиназы могут участвовать в процессе канцерогенеза,
воздействуя на различные пути передачи сигнала в клетке, основные компоненты
соединительнотканного матрикса, на межклеточные взаимодействия, а также продуцируя
различные биологически активные молекулы (Клишо и др., 2005).
Металлопротеиназы относятся к энергозависимым
протеиназам. Энергозависимые протеиназы осуществляют селективный
внутриклеточный протеолиз - важный механизм контроля качества функциональных белков
и поддержания их необходимого уровня в клетках. Эти протеиназы выполняют две
основные функции: деструктивную (освобождают клетки от дефектных и мутантных
белков) и регуляторную (осуществляют деградацию ряда короткоживущих
регуляторных белков). Протеолитическая активность этих ферментов сопряжена с
гидролизом АТФ. Ферменты проявляют высокую селективность, поскольку производят
отбор субстратов - мишеней из общего пула внутриклеточных белков, большая часть
которых не должна повреждаться. При этом специфичность по отношению к
аминокислотам, образующим расщепляемую связь, у энергозависимых протеиназ
зачастую не выражена. Деградация белков - субстратов происходит по
процессивному механизму - без высвобождения высокомолекулярных промежуточных
продуктов (Ротанова, 2000).
Экзопептиды разделяют на аминопептидазы и
карбоксипептидазы, дипептидиламинопептидазы и дипептидилкарбоксипептидазы,
которые катализируют отщепление аминокислот или дипептидов от N- и С-конца
пептидной цепи соответственно, и дипептидазы, катализирующие гидролиз
дипептидов. Многие экзопептидазы являются металлоферментами.
Большинство протеаз синтезируются в виде
неактивных предшественников - проферментов: их активация происходит в
результате ограниченного протеолиза, протекающего либо аутокаталитически, либо
под действием определенных протеаз. Многие протеазы подвергаются аутолизу
(самоперевариванию), при этом часто теряют ферментативную активность. В
некоторых случаях (например, у Са2+ - зависимых нейтральных протеаз) на
определенных этапах аутолиза отмечают активацию ферментов (Klionsky, 2000).
Активность протеиназ зависит, как правило, от
скорости их образования из неактивных предшественников и инактивации
специфическими ингибиторами, которые присутствуют в клетках, тканях, в плазме
крови и составляют так называемый антипротеолитический потенциал. При
взаимодействии протеолитических ферментов и их ингибиторов сохраняется
определенное равновесие, которое может нарушаться при определенных
патологических условиях, что ведет к негативным последствиям для организма,
вплоть до развития критических состояний (Бенделик и др., 1999).
С помощью систем таких ингибиторов
осуществляются регуляция активности протеаз в физиологических условиях и
предохранение белков от их действия. Нарушение баланса между протеазами и
соответствующими ингибиторами часто приводит к развитию патологии. Многие
высокомолекулярные ингибиторы протеаз - белки с доменами, которые блокируют
активный центр фермента, затрудняя к нему доступ субстрата.
Ингибиторы протеолиза нашли широкое применение в
медицинской практике для лечения нарушений свертывания крови, фибринолиза, при
панкреатитах. Иммобилизованные ингибиторы применяются в стоматологии для
лечения воспалительных процессов в ротовой полости. Особое место в этом ряду
занимает использование ингибиторов протеолиза в лечении приобретенного
иммунодефицита человека. Оно позволило выявить не только положительные эффекты
влияния ингибиторов на течение заболевания, но и показать возможное побочное их
действие. Протеаза ВИЧ (HIV) выполняет важные функции в жизненном цикле вируса
и поскольку она обладает особым типом специфичности, не характерным для
большинства протеаз животных и человека (катализирует гидролиз пептидных связей
фен-про и тир-про, на которые редко действуют протеазы животных) были
синтезированы искусственные ингибиторы этой протеазы. Использование таких
ингибиторов совместно с аналогами нуклеотидов позволило значительно снизить
смертность от СПИДа, однако выявило ряд побочных эффектов в форме
липодистрофии, гипертриацилглицеролемии и повышения резистентности к инсулину
(Ефременко, Конторщикова, 2006).
Мировой опыт свидетельствует о высокой
информативности, точности, специфичности анализа активности протеолитических
ферментов при многочисленных патологических состояниях. В настоящее время
ведется разработка методов определения активности протеиназ в плазме крови для
применения в клинической практике. Известно, что по уровню активности протеиназ
(эластаза, катепсин G, B) можно предсказать развитие сепсиса до появления его
клинических признаков. Активность лейцинаминопептидазы используется для
дифференциальной диагностики заболеваний гепатобилиарной системы и костной
ткани, когда повышена активность щелочной фосфатазы. Активность панкреатической
эластазы повышается в крови при остром и хроническом панкреатитах раньше, чем
уровень других ферментов, на субклинической стадии (Ефременко, Конторщикова,
2006).
Для нормализации протеолиза пищевых белков при
некоторых желудочно-кишечных заболеваниях применяют препараты пепсина,
трипсина, химотрипсина; для лизиса сгустков фибрина при тромболитической
терапии используют плазмин (фибринолизин), стрептокиназу и др.; при лечении
гнойных ран, ожогов, пролежней, для протеолиза белков некротизированных тканей
применяют трипсин, химотрипсин и некоторые другие протеазы. При заболеваниях,
сопровождающихся усиленным протеолизом белков (например, при панкреатитах)
используют препараты ингибиторов протеаз: трасилол и др. (Бенделик и др.,
1999).
В целом, определение активности протеолитических
ферментов необходимо использовать в качестве чувствительного критерия для
контроля за безопасностью применения различных лекарственных средств (особенно
препаратов, содержащих протеолитические ферменты и их ингибиторы), и
эффективностью проводимых диагностических и лечебных программ.
В клетках живых организмов существует несколько
стратегий белкового распада. Главные протеазы клеток млекопитающих это
лизосомальные катепсины, кальпаины и протеасомы (Shringarpure et al, 2001).
Мембранно-связанные белки и белки клеточной поверхности в основном разрушаются
лизосомами (Doherty et al,2002), в то время как пул цитозольных белков (80-90%)
направляется для распада к протеасоме (Orlowski, Wilk, 2000).
Большая часть неспецифического белкового распада
имеет место в лизосомах (Громакова, Коноваленкова, 2003).
Лизосомы человека активно изучаются, прежде
всего, в медицинском аспекте. Этот интерес обусловлен двойственностью
потенциала лизосом. В норме они выполняют разнообразные функции, но могут быть
и «везикулами - самоубийцами», если в клетке происходит повреждение лизосомной
мембраны, изолирующей лизосомные ферменты. Связь лабилизации лизосом с
клеточным повреждением и гибелью установлена многочисленными исследованиями,
однако в настоящее время уже на молекулярно-биологическом уровне демонстрируется
их участие в процессах стимулируемого апоптоза (Guicciardi, 2004),
панкреонекроза и другой патологии (Пупышев, 2006).
Известно, что активность лизосомальных
ферментов, на долю которых приходится ~ 70% общей деградации белков, находится
под гормональным контролем. Показано участие инсулина, глюкагона, адреналина,
тиреоидных гормонов в регуляции лизосомного пути белковой деградации
(Табукашвили и др., 1991).
В печени глюкагон вызывает метаболическую
утилизацию некоторых аминокислот, а инсулин стимулирует их потребление. Это
показывает, что оба гормона влияют на аутофагию изменением внутриклеточного
пула аминокислот. Глюкокортикоиды стимулируют печеночный протеолиз, но,
предполагается, что этот эффект осуществляется благодаря увеличению синтеза протеина,
т.е. для аутофагии необходим синтез мембранных белков. Точно также,
тироксин-вызванный белковый распад в печени может осуществляться благодаря
увеличению концентрации лизосомных ферментов (Grinde, 1985).
Лизосомы - это органеллы, которые содержат огромное
количество гидролаз, способных разрушать большинство внутриклеточных и
внеклеточных макромолекул (Sahagian, Novikoff, 1994). Протеазы, способные к
деградации белков внутри лизосом, называются катепсинами (Bohley, Seglen,
1992). В общем, лизосомы ответственны за непрерывное обновление большинства
внутриклеточных белков (большей частью долгоживущих белков) в печени, почках и
других тканях.
Лизосомы стабильны при рН=7, в то время как при
рН=5 они становятся отчасти «рыхлыми». Время прохождения лизосомальных
ферментов от эндоплазматического ретикулума до лизосом приблизительно 2 часа.
Кроме того, лизосомальные ферменты имеют период полужизни в течение дня и могут
быть достаточно стойкими к распаду другими лизосомальными ферментами (Ahlberg
et al, 1985).
Лизосомные протеиназы участвуют в осуществлении
внутриклеточного распада белков и регуляции их кругооборота, а также реализации
сложнейших биологических процессов, таких, как рост и развитие организма,
морфогенез, метаморфоз. Эти процессы, реализуемые кооперативным взаимодействием
разных типов клеток, сопровождаются деструкцией ткани, которая происходит под
действием освобождающихся внутриклеточных ферментов. Среди них присутствуют как
лизосомные, так и другие протеиназы, которые секретируются в среду сразу после
их биосинтеза (Покровский, Тутельян, 1976).
Лизосомные протеиназы большинства клеток
представлены ферментами относящимися к аспартильным (катепсин Д), цистеиновым
(катепсины В, Н, L и некоторые другие) и сериновым (катепсин G, эластаза)
пептидгидролазам (Дин, 1981; Покровский, Тутельян, 1976). В лизосомах некоторых
клеток обнаружены и металлопротеиназы (эластаза макрофагов).
Лизосомные протеиназы секретируются из клеток
под влиянием ряда гормонов, витаминов, циклических нуклеотидов, иммунных
комплексов, многих токсинов и ряда других факторов (Vaes, 1985). Часть этих
ферментов (до 20%) секретируется в среду сразу после биосинтеза, не попадая в
лизосомы.
Существует несколько механизмов, с помощью
которых белки могут транспортироваться в лизосомы. Наиболее охарактеризованные
из них: везикулярное слияние (эндоцитоз и кринография), макроаутофагия,
микроаутофагия и направленный белковый транспорт через мембрану лизосом (Cuervo
et al, 1997).
Первичные лизосомы способны полностью разрушать
белковое содержимое некоторых видов внутриклеточных везикул после мембранного
слияния. Везикулы, содержащие секреторные белки, отделяются от аппарата Гольджи
и высвобождают свое белковое содержимое во внеклеточную среду после слияния
везикул с мембраной плазмы (Покровский, Тутельян, 1976). При определенных
условиях, когда требуется снижение белковой секреции, 20 - 70% этих везикул
сразу сливаются с лизосомами в процессе, называемым кринографией, после
которого секреторные белки полностью деградируются (Glaumann, 1989; Lenk et al,
1991). Таким способом переносятся к лизосомам короткоживущие белки (Ahlberg et
al, 1985; Маянская, Панин, 1981).
Достаточно хорошо охарактеризованным является
слияние лизосом с эндосомами - везикулами, содержащими некоторые
внутриклеточные белки (Mukherjee et al, 1997). В данном случае лизосомные белки
синтезируются в шероховатом эндоплазматическом ретикулуме, где они
гликолизируются путем переноса олигосахаридных остатков. На последующей стадии,
типичной для лизосомальных белков, терминальные маннозные остатки
фосфорилируются по С-6. Таким образом, лизосомальные белки в процессе
сортировки приобретают концевой остаток маннозо - 6 - фосфат. В мембранах
аппарата Гольджи имеются молекулы - рецепторы, специфичные для маннозо - 6 -
фосфат - остатков и за счет этого специфически узнающие и селективно
связывающие лизосомальные белки. Локальное накопление этих белков происходит с
помощью клатрина. Этот белок позволяет вырезать и транспортировать подходящие
мембранные фрагменты в составе транспортных везикул и эндолизосом, которые
затем созревают с образованием первичных лизосом (Короленко, 1983, 1990). В
заключение от маннозо - 6 - фосфата отщепляется фосфатная группа. Маннозо - 6 -
фосфат - рецепторы используются вторично в процессе рецикла. Снижение рН в
эндолизосомах приводит к диссоциации белков от рецепторов. Затем рецепторы с
помощью транспортных везикул переносятся обратно в аппарат Гольджи. В других
случаях рецептор не используется вторично в процессе рецикла, а доставляется к
лизосоме для деградации вместе с лигандом (Mukherjee et al, 1997; Koening,
Edwardson, 1997).
Большое количество внутриклеточных белков может
быть деградировано в лизосомах в ходе процесса, называемого макроаутофагией
(Mortimore, 1995). При этом участки цитоплазмы, включающие цитозольные белки,
также хорошо как и органеллы, окружаются мембраной, превращаясь в двумембранные
структуры, известные как аутофагосомы или аутофагические вакуоли. Белки внутри
аутофагосом далее полностью деградируются после слияния с лизосомой (Калахая и
др., 1984).
В таких органах как печень, макроаутофагия имеет
место для большей части внутриклеточного распада, особенно на ранних этапах
голодания (Grinde, 1985). Белковое фосфорилирование играет важную роль среди
механизмов, контролирующих макроаутофагию (Blommart, 1995). При определенных
условиях в таком процессе деградации показана селективность, несмотря на то,
что белки в изолированную цитоплазму захватываются неселективно. Например,
пероксисомальная аутофагия может активироваться при таких условиях, когда пероксисомы
не нужны длительное время. Слияние лизосом с аутофагосомой происходит по такому
же механизму, что и эндоцитозный и секреторный пути, что доказывает взаимосвязь
между этими процессами (Cuervo, Dice, 1998).
Второй процесс внутриклеточной белковой изоляции
лизосомами называется микроаутофагией. Во время микроаутофагии только небольшие
участки цитоплазмы захватываются небольшими инвагинациями на поверхности
лизосом. После интернализации этих везикул и распада окружающей их мембраны
цитоплазматические белки разрушаются внутри лизосом (Посохов и др.,1992). В
отличие от макроаутофагии, которая в основном активируется при условиях лишения
питательных веществ, микроаутофагия ответственна за продолжительный основной
распад долгоживущих белков (Mortimore et ll, 1988).
Третий механизм лизосомального распада
цитозольных белков происходит после транспорта через лизосомальную мембрану.
Этот путь был впервые описан в культуре человеческих фибробластов, а далее
охарактеризован в печени крысы. Приблизительно 30% цитозольных белков
разрушаются таким образом (Cuervo, Dice, 1995). Такой белковый транспорт схож
во многом с транспортом белков в другие клеточные компартменты (Schartz,
Dobberstein, 1996). Основные компоненты системы направления транспорта белков
через лизосомальную мембрану следующие: цитозольный шаперон 73 кД (hsр 73),
рецепторный белок на лизосомальной мембране (lgp 96) и внутрилизосомальная
форма цитозольного шаперона (lys - hsр 73). Для этого пути уже идентифицированы
несколько субстратов: рибонуклеаза А, глицероальдегид-3-фосфат дегидрогеназа,
альдолаза, некоторые субъединицы 20S протеасомы, факторы транскрипции такие как
c-fos и IkB, а также α-2-макроглобулин
- секреторный белок, который также локализуется в цитозоле гепатоцитов и
проксимальных трубчатых клетках печени (Cuervo, Dice, 1998).
Субстратный белок после взаимодействия с hsр 73
направляется к лизосомам, где после связывания и транспорта через лизосомальную
мембрану полностью разрушается в лизосомальном матриксе. Субстратные белки
содержат в своей последовательности мотив биохимически сходный с пентапептидом
KFERQ, который разрушается цитозольным шапероном 73 кД. Связывание hsр 73 с
этим участком субстратного белка приводит к продвижению комплекса к
лизосомальной мембране. Гликопротеин лизосомальной мембраны 96 кД (lgp 96 у
крыс или lamp 2 у людей и мышей) активен как рецептор для субстратного белка.
Связывание лизосомальной мембраны и захват в лизосомальный матрикс являются
временно ограниченными и прямо зависят от уровней лизосомального lgp 96 и hsр
73 (Cuervo, Dice, 1995).
Одним из наиболее изученных лизосомальных
ферментов является катепсин Д. Катепсин Д (3.4.23.5) - растворимая
аспарагиновая протеаза, основная функция которой, является расщепление белков и
пептидов внутри лизосом. Эта функция осуществляется каталитическим механизмом,
вызванным двумя аспартатными остатками, расположенными глубоко в активном
центре. Причины, по которым катепсин Д относится к семейству аспарагиновых
пептидаз А1 - это их общий каталитический механизм: низкое значение рН,
оптимальное для их функционирования и высокий уровень сходства как первичных,
так и третичных структур (Conner, 2002). Катепсин Д обнаруживается в лизосомах
большинства человеческих клеток (Fusek, Vetvicka, 1995).
Существует высокая степень сходства последовательностей
среди эукариотических членов семейства аспарагиновых пептидаз. Например, триады
Асп-Тре-Глу вокруг двух аспарагиновых остатков активной стороны фактически
идентичны. Очень схожими, но не идентичными являются последовательности активирующих
пептидов. Но сходность первичных структур выходит за пределы этих триад
(Baldwin et al., 1993). Длинные сегменты вокруг аспартатных триад высоко
консервативны. Позиции цистеиновых остатков, тирозина 75 и их окружения также
консервативны. Тирозин 75 локализован в, так называемом, подвижном участке, чья
подвижность частично покрывает активную сторону (Conner, 2002).
Пептидазы, относящиеся к семейству А1,
образованы двудольной структурой, и обе доли структурно схожи, что предполагает
наличие общего предшественника - димерной молекулы, состоящей из двух
идентичных субъединиц, которые генной дубликацией и генным слиянием
эволюционировали в мономерную двудольную структуру. Вторичная структура
образована большей частью β-структурой
с небольшими сегментами α-спиралей
(Metcalf, Fusek, 1993). Катепсин Д содержит глубокое активное углубление,
которое образовано стенами двух долей. На дне этого углубления локализованы 2
активных остатка аспарагиновой кислоты. Активная сторона углубления связывает
либо ингибитор, либо субстрат. Катепсин Д также имеет 3 дисульфида,
расположенные в очень консервативных местах, а также 1 дисульфид между
цистеиновыми остатками 27 и 96.
Особенностью этого фермента, как и всех
остальных аспарагиновых пептидаз является превращение новотранслированных
белков в зимогены, а затем последовательно в активные ферменты. Эти пептидазы
синтезируются как пре-про-ферменты (Conner, Richo, 1992). На первом
протеолитическом пострансляционном этапе происходит отщепление сигнальной «пре»
последовательности. Сигнальная последовательность состоит из 20 аминокислотных
остатков и удаляется внутри шероховатого эндоплазматического ретикулума.
Зимогены, образованные после первого пострансляционного процессинга,
направляются к месту их активации, где они полностью превращаются в активные
ферменты. Активация включает распад про-последовательности. Активирующий пептид
бывает обычно длиной 44 аминокислотных остатка. Активация происходит как
внутримолекулярно, так и внемолекулярно. Во время автоактивации, так
называемый, псеудокатепсин Д все еще сохраняет С-терминальную часть активного
пептида. Полная активация происходит только с участием других лизосомальных
ферментов (Fusek, Vetvicka, 2005).
Важной особенностью катепсина Д является его
специфическое ингибирование пепстатином А, который является нековалентным,
конкурентным и тесно-связывающим ингибитором (Abdel-Mequid, 1993).
Важной особенностью нормального клеточного цикла
катепсина Д является его строгая локализация в кислых компартментах лизосом и
различных прелизосомальных и эндосомальных везикулах. Существует, как минимум,
2 пути, по которому клетки направляют катепсин Д в эти компартменты. Во-первых,
маннозо-6-фосфат на концах олигосахаридов, прикрепленных во время
пострансляционной модификации, распознается двумя рецепторами, которые
транспортируют прокатепсин Д к лизосомам и другим кислым компартментам (Figura,
Hasilik, 1986). Существует 2 рецептора: катион-независимый маннозо-6-фосфат
рецептор, чья молекулярная масса близка к 300 кДа и катион-зависимый
маннозо-6-фосфат рецептор с молекулярной массой 46 кДа. Оба рецептора связывают
лизосомальные ферменты в сети аппарата Гольджи, образуют комплексы и затем
переносятся через клатрин-покрытые везикулы к прелизосомальным кислым
компартментам. При низком значении рН происходит высвобождение лизосомальных
ферментов от рецепторов, которые затем возвращаются к аппарату Гольджи, в то
время как лизосомальные ферменты продолжают направляться к лизосомам. Оба
рецептора присутствуют также и на поверхности мембраны плазмы (Zhu, Conner,
1994). Катион-независимый маннозо-6-фосфат рецептор способен связывать
внеклеточный прокатепсин Д и переносить внутрь клетки. На самом деле функция
этого рецептора более сложная. Кроме того, связывая и направляя лизосомальные
ферменты, он функционирует также как рецептор для инсулин-подобного фактора
роста II (Fusek, Vetvicka, 2005).
Второй путь направления катепсина Д к лизосомам
независим от маннозо-6-фосфата и полностью не изучен (Dittmer et al., 1999).
Определенная роль этого пути заключается во взаимодействии прокатепсина Д с
просапонинами. Эти две молекулы образуют комплексы и движутся к кислым
компартментам независимо от маннозо-6-фосфат рецептора. Предположено, что
N-терминальная часть псеудокатепсина Д (другими словами С-конец активирующего
пептида) может быть включена во взаимодействие между прокатепсином Д и
просапонином. Комплексы этих двух молекул обнаружены внеклеточно
(Gopalakrishnan et al., 2004).
Прокатепсин Д образуется после первого
протеолитического распада, включая удаление сигнального пептида сигнальными
пептидазами. Молекула прокатепсина Д имеет молекулярный вес 52 кД. Она состоит
из 392 аминокислотных остатков и при нормальных физиологических условиях
гликолизируется по двум остаткам аспарагина. Активирующий пептид длиной 44
аминокислотных остатка находится над углублением активной стороны (Koelsch et
al., 1994).
Прокатепсин Д транспортируется к лизосомам и в
кислой среде подвергается дальнейшему протеолитическому процессингу, где
активирующий пептид отщепляется (как автопротеолизом, так и протеолитическим
действием других, в основном, цистеиновых лизосомальных пептидаз), образуя
катепсин Д, содержащий одну цепь из 348 аминокислотных остатков. При других
физиологических условиях единственная цепь катепсина Д преобразуется в двуцепочечную
молекулу (у человека за счет отщепления маленького пептида длиной 7
аминокислотных остатков между положением 98 и 105) (Fusek et al., 1992). В
действительности тяжелые и легкие цепи обычно образуются смесью нескольких
микрогетерогенных цепей, которые различаются за счет незначительных изменений в
молекулярном весе. Эксперименты in vitro показали, что в результате
автопротеолиза прокатепсин Д превращается в так называемый псеудокатепсин Д,
который все еще содержит С-терминальную часть активирующего пептида (Fusek,
Vetvicka, 2005).
Основная функция катепсина Д - это
внутриклеточный катаболизм внутри лизосомального компартмента (Conner, 2002).
Катепсин Д также включается в процессинг антигенов, гормонов и нейропептидов
(Mohamadzadeh et al., 2004). Прокатепсин Д также принимает участие в
программированной клеточной смерти - апоптозе (Bidere et al., 2003; Takuma et
al., 2003; Emert-Sedlack et al., 2005). Увеличение экспрессии катепсина Д
наблюдается при заживлении ран, псориазе и опухолях кожи (Egberts et al.,
2004).
Хотя большая часть катепсина Д обнаружена в
растворимой части клеток человека, но 20% все же являются мембранно-связанными
(Diment et al., 1998).
Высокие концентрации прокатепсина Д были
обнаружены в грудном молоке человека (Vetvicka et al., 1993). В 80-е годы во
время исследования основных белков, секретируемых раковыми клетками груди линии
MCF7, было обнаружено, что основная масса белка - это молекулы с молекулярным
весом 52 кДа (Fusek, Vetvicka, 2005). Дальнейшее исследование показало, что эта
молекула соответствует прокатепсину Д, который секретируется в высоких
концентрациях из определенного типа раковых опухолей груди в присутствии
эстрогена. Двадцать пять лет спустя было засвидетельствовано, что прокатепсин Д
экспрессируется и секретируется во многих раковых клетках и во многих из них
добавление эстрогена и прогестерона увеличивало его экспрессию и секрецию
(Rochefort et al., 2000).
У клеток с эстроген-положительным рецептором
прокатепсин Д секретируется только после стимуляции эстрогеном, в то время как
существенная секреция происходит в клетках с эстроген-отрицательным рецептором.
В клетках с эстроген-положительным рецептором эстроген взаимодействует и
регулирует экспрессию прокатепсина Д на уровне промотера. Секретируемый
прокатепсин Д имеет способность к стимуляции роста и пролиферации раковой
клетки, то есть способствует метастазам раковых клеток (Vetvicka et al., 2002).
Катепсин Д может служить независимым
прогностическим фактором многих типов рака. Используя многоклеточные антитела
специфические для про-формы, было показано, что уровень прокатепсина Д
увеличивается в плазме пациентов с метастазом рака груди (Leto et al., 2004;
Loscha et al., 2004).
Общая экспрессия катепсина Д в раковых клетках
увеличивает концентрацию прокатепсина Д. Это в основном лежит в увеличении
насыщения маннозо-6-фосфат-рецепторного пути, также как и других альтернативных
путей. Эти клетки будут также направлять больше прокатепсина Д в лизосомы, что
ведет к увеличению протеолитической активности лизосомального компартмента. С
другой стороны, катепсин Д протеолитически активен при рН около 5.5 и трудно
обнаружить такое низкое значение рН внеклеточно в тканях опухоли (Meijer-van
Gelder et al., 2001; Laurent-Matha et al., 2005).
Роль сахаридных остатков, частично их возможное
взаимодействие с маннозо-6-фосфат-рецепторами, привлекает внимание
исследователей. В 1994 году было описано, что простое удаление сахаридных цепей
с использованием гликозидазы, не имеет эффекта на митогенные активности in
vitro. Было также протестировано добавление высоких концентраций
маннозо-6-фосфата, который может конкурировать за взаимодействие с рецепторами
и при этом не определяется никакой митогенной активности (Glondu et al., 2001).
Показано, что прокатепсин Д нормально взаимодействует in vitro с
маннозо-6-фосфат-рецептором и может быть поглощен этим рецептором. В некоторых
экспериментах in vivo были обнаружены различия в функционировании этих
рецепторов. Оказалось, что в определенных опухолях, рецептор функционирует
ненормально. Одна гипотеза заключается в том, что высокие концентрации
прокатепсина Д насыщают катион-независимый маннозо-6-фосфат-рецептор, что
приводит к снижению связывающих сторон как для маннозо-6-фосфат-связывающих
сторон, так и для инсулин-подобного фактора роста II. Как следствие этого,
недостаточное функционирование маннозо-6-фосфат-рецептора может быть причиной
смены функции маннозо-6-фосфат-рецептора и может помочь канцерогенезу (Vetvicka
et al., 2004). Результаты показали, что предотвращение гликолизирования с
помощью мутации на гликолизированной стороне прокатепсина Д не теряет его
митогенной и пролиферативной активности. Предположено, что ни связывание
маннозо-6-фосфата, ни сахарные остатки не влияют на развитие роста опухоли
(Vetvicka et al., 1999; Laurent-Matha et al., 2005).
Таким образом, функция прокатепсина Д состоит не
только в том, что он является предшественником гидролитического фермента в
лизосомах, но также и в том, что он включается во взаимодействие с другими
молекулами, которые имеют митогенный эффект на определенные ткани. Это
взаимодействие облегчается активирующим пептидом и оно может быть частью
нормального физиологического функционирования прокатепсина Д (Glondu et al.,
2001). Однако, становится опасно, когда раковые клетки начинают экспрессировать
и секретировать прокатепсин Д. Предположено, что прокатепсин Д, экспрессируемый
и секретируемый из первичных раковых клеток, вызывает рост как родительских,
так и окружающих клеток. Это приводит к более быстрому росту опухоли тканей и
также увеличивает риск образования метастазов (Антонов, 1991).
.2 Структура и функции нейтральных протеаз
Все нейтральные протеазы можно подразделить на
внутриклеточные и внеклеточные. К внутриклеточным нейтральным протеазам
относится Са2+- зависимая протеаза - кальпаин [3.4.22.17].
В 1964 году Гурофф впервые описал эту протеазу,
которая была окончательно выделена как фермент в 1978 году в растворимой
фракции мозга. С тех пор активность кальпаина была идентифицирована в различных
тканях и обнаружено его участие во многих клеточных процессах.
Кальпаины - это семейство цитозольных
цистеиновых протеиназ, чья ферментативная активность зависит от Са2+. Члены
этого семейства участвуют в таких процессах как клеточная миграция,
цитоскелетное ремоделирование, клеточная дифференциация и апоптоз. Активация
кальпаина наблюдается также при таких патологических состояниях как мышечная
дистрофия, сердечная и церебральная ишемия, агрегация эритроцитов,
нейродегенеративные болезни, катаракта и болезнь Альцгеймера (Khorchid, Ikura,
2002).
В условиях гипоксии кальпаин подвергается
гиперактивации, что непосредственно ведет к деструкции цитоскелета нейронов, а
в дальнейшем приводит к гибели клеток по механизму некроза или апоптоза
(Хансон, 1992).
Потенциальными субстратами кальпаинов являются
белки цитоскелета, некоторые мембранно - связанные ферменты, белки ядерного
матрикса, протеинкиназа С, рецепторы, фосфатазы, факторы транскрипции.
Ограниченный протеолиз определенных белков кальпаинами показывает необходимость
этого процесса для мембранного слияния. Активация Са2+ - зависимых нейтральных
протеаз при апоптозе предшествует морфологическим изменениям и фрагментации
хроматина в тимоцитах, подвергнутых облучению или действию дексометазона.
Ингибиторы кальпаина предотвращают фрагментацию ДНК и гибель клеток. Было
показано, что Са2+ - зависимая протеаза тимоцитов является обязательным
компонентом каскада протеолитических ферментов метилпреднизолон -
индуцированного апоптоза. Ингибиторы кальпаинов блокируют апоптоз HIV -
индуцированных Т-лимфоцитов и восстанавливают иммунный ответ этих клеток, что
предполагает потенциальное использование ингибиторов кальпаинов в терапии HIV
инфекций. Действие этой нейтральной протеазы практически необратимо, что,
по-видимому является одной из причин опасности длительного повышения уровня
Са2+ в цитозоле (Kуцый и др., 1999).
В ответ на увеличение концентрации Са2+
кальпаины могут осуществлять ограниченный протеолиз ферментов, изменяя тем
самым активность последних, увеличивать сродство рецепторов к лигандам,
изменять пластичность мембран клеток, расщеплять миофибриллярные белки и
нейтрофиламенты, вызывать деструкцию цитоскелетных компонентов клеток (Гусев,
1998).
Одной из важнейших функций кальпаинов является
изменение биологической активности различных белков путем ограниченного
протеолиза. В частности, таким образом, происходит активирование киназы
фосфорилазы b и инактивация гликогенсинтетазы в мышце кролика. Следовательно,
увеличение Са2+ в цитоплазме мышечных клеток, наблюдаемое при их сокращении,
ведет к повышению активности кальпаинов и тем самым содействует расщеплению
гликогена в этой ткани. С другой стороны, фосфатаза фосфорилазы превращается в
активную форму с более низкой молекулярной массой также с участием этих
ферментов (Croall, Demartino, 1991).
Основные функции кальпаинов мозга, очевидно,
связаны с ограниченным протеолизом определенных цитоплазматических и мембранных
белков, включая белки рецепторы и протеинкиназу С, а также белков цитоскелета
клетки, выполняющих важную роль в регуляции внутриклеточного метаболизма, и с
реализацией таких функций нейронов, как аксональный транспорт, трансмембранная
передача сигнала, долговременная память и др. (Seubert et al., 1988).
Ключевая роль кальпаинов в нервной системе
определяется в большей степени тем, что эти пептидгидролазы характеризуются
двойной системой контроля их активности; одной, общей для всех протеолитических
ферментов и обеспечиваемой специфическими эндогенными ингибиторами и
реактивными предшественниками ферментов, и другой - регулируемой концентрацией
эндогенного Са2+. Сочетание в первичной структуре Са2+ - зависимой нейтральной
протеазы протеолитического и Са2+ - связывающего доменов, по-видимому, дает
возможность строго регулировать активность фермента и включать его в обмен в
зоне локального повышения концентрации Са2+, определяя тем самым топографию и
временной контроль биологического процесса (Азарян, 1989).
Кальпаины изменяют активность и некоторых
протеинкиназ. Так одна из протеинкиназ, осуществляющая фосфорилирование белка
6S рибосом, активируется кальпаинами, а действие последних усиливается при
образовании комплексов инсулина с рецепторами на плазматических мембранах
клеток (Kenyon et al., 2003).
При наличии в нейтрофилах человека микромолярных
концентраций Са2+, и кальпаин, и протеинкиназа С ассоциируют с плазматическими
мембранами. Это связывание обуславливает активацию протеиназы, которая в свою
очередь осуществляет ограниченный протеолиз протеинкиназы с образованием
активной ее формы, не нуждающейся в Са2+ и фосфолипиде. Активированная таким
образом протеинкиназа диссоциирует с мембраны клеток и действует внутриклеточно
на белки. В отсутствие протеиназы кальций содействует связыванию протеинкиназы
С, однако превращение ее в независимую от кальция и фосфолипида форму не
происходит и фермент остается ассоциированным с мембраной (Chua et al., 2000).
Активирование кальпаина путем связывания его с мембраной наблюдается и в
эритроцитах (Иванов и др., 1999). Имеются данные и об изменениях агрегационных
свойств субъединиц цАМФ-зависимой протеинкиназы в клетках легкого новорожденных
мышей путем ограниченного протеолиза с участием кальпаина. Следует отметить,
образование в тромбоцитах человека Са2+-независимой протеинкиназы (молекулярная
масса 50 тыс. дальтон) из более высокомолекулярного, зависимого от этого иона
предшественника, также осуществляется при участии кальпаина (Chua et al.,
2000).
Кальпаин с помощью ограниченного протеолиза
активирует триптофангидроксилазу клеток печени животных, регулирующих биосинтез
серотонина, а также катализирует образование из предшественников кининов,
участвующих в воспалительных процессах. Из эритроцитов печени была выделена
протеиназа, которая расщепляет пируваткиназу, причем последняя
дефосфорилируется, и ее сродство к фосфоенолпировиноградной кислоте снижается
(Локшина, 1985).
Показано, что действие таких биологически
активных факторов, как полипептидные факторы роста, в частности эпидермальный
фактор роста, контролируется путем ограниченного протеолиза с помощью
кальпаинов. Имеются сообщения, что кальпаины могут принимать участие и в
ограниченном протеолизе факторов роста связанных с рецепторами (Сологуб,
Пашковская, 1988).
Кальпаины расщепляют различные белки, однако не
действуют на низкомолекулярные синтетические субстраты, обычно используемые при
определении активностей других протеиназ. Показано, что кальпаины мозга свиньи
и обезьяны гидролизуют некоторые нейропептиды и либерины. Из мышцы сердца
обезьяны выделен фермент этого типа, обладающий энкефалиназной активностью
(Панченко и др., 1999), а из скелетных мышц человека кальпаины, действующие на
нейротензин, динорфин, люлиберин, вещество Р и соматостатин. Кальпаины способны
расщеплять также казеин, гемоглобин, однако не действуют на альбумин сыворотки
крови. Интересно отметить, что фосфорилированные белки более чувствительны к
действию этих ферментов, чем неэстерифицированные их формы (Лишманов и др.,
1997).
Установлено, что связывание глутаминовой кислоты
со специфическими рецепторами плазматических мембран клеток гиппокампа крыс
значительно увеличивается в присутствии кальция, и вероятно, также обусловлено
действием кальпаина на эти рецепторы. Оно сопровождается расщеплением фодрина -
спектринподобного белка, локализованного на внутренней поверхности
плазматических мембран нервных клеток, и таким образом регулируется пластичность
мембран (Сологуб, Пашковская, 1998).
Наиболее охарактеризованными членами семейства
являются m-кальпаин и µ-кальпаин (соответственно, кальпаин II и I).
Микромолярные концентрации Са2+ активируют m-кальпаин, а для активации
µ-кальпаина требуются миллимолярные концентрации Са2+. Обе изоформы фермента
являются гетеродимерами, состоят из большой каталитической 70-80 кДа
субъединицы и малой, общей для обоих белков, регуляторной 29-30 кДа
субъединицы. Большая субъединица содержит 4 домена (dI-dIV), а малая 2 домена
(dV dVI) (Darrel et al., 2003).
Домен I действительно не является доменом, и
представляет собой единственную α
- спираль, состоящую из 10 аминокислотных остатков, которая заякоривается в
полость dVI. Эта спираль очень важна для стабилизации и активации некоторых
кальпаинов.
Домен II содержит в себе каталитическую сторону
и может быть разделен на 2 субдомена - dIIa и dIIb (Khorchid, Ikura, 2002).
Домен содержит остаток Cys в положении 115 (для µ- кальпаина) или 105 (для m -
кальпаина), остаток His в положении 272 или 262, остаток Asn в положении 296
или 286. Эти аминокислотные остатки образуют каталитическую триаду, характерную
для цистеиновых протеиназ таких как кальпаин или катепсины B, L и S. Замечено,
что активная сторона Cys расположена в dIIa, в то время как His и Asn, которые
образовывают остаток каталитической триады - в субдомене IIb. Каждый из
субдоменов связывает по одному атому Са2+ в пептидной петле, состоящей из 8
(домен IIa) или 9 (домен IIb) аминокислотных остатков. Гомологичная последовательность
домена II среди различных видов высока (85-93%) (Moldоveanu et al., 2002).
Домен III имеет последовательность, не
гомологичную другим полипептидным последовательностям. В связывании Са2+-
связывающих доменов молекулы кальпаина с каталитическим доменом II, участвует
домен III, связывая фосфолипиды и участвуя в электростатическом взаимодействии
(Hosfield et al., 2001). Анализ аминокислотной последовательности показал, что
этот домен также содержит 2 потенциальные Са2+ - связывающие последовательности
EF-руки, одна из некоторых находится между доменами II/III (остатки 329-341 для
µ-кальпаина; остатки 318-338 для m-кальпаина; в домене IIb кристаллографической
структуры m-кальпаина), а другая последовательность находится на границе III/IV
доменов (остатки 554-565 для µ-кальпаина; 541-552 для m-кальпаина; в домене IV
кристаллографической структуры m-кальпаина). Последовательность на границе
II/III доменов не имеет конформацию EF-руки в кристаллографической структуре
m-кальпаина крысы и человека и этот регион, возможно, не связывает Са2+ (Strobl
et al., 2000). Таким образом, домен III состоит из 8 нитей по типологии схож с
С-2 доменом, обнаруженным у различных белков, включая протеинкиназу С и
фосфолипазу С, который взаимодействует с Са2+ и фосфолипидами. Кислая петля
внутри домена III предположительно играет роль Са2+- способствующей активации
кальпаина (Khorchid, Ikura, 2002).
Домены dIV и dVI являются хорошо
охарактеризованными Са2+-связывающими доменами, каждый из которых содержит 5
мотивов EF-руки. Пятые мотивы этих доменов взаимодействуют между собой, образуя
гетеродимер. Каждый мотив EF-руки схож с таковым мотивом в кальмодулине (24-44%
идентичности у µ - кальпаина и 51-54% у m - кальпаина). Кальпаины представляют
собой семейство пента-EF-рук, т.е. содержащие 5 мотивов EF-руки и они уникальны
не только тем, что содержат определенное количество Са2+ - связывающих мотивов,
но также и тем, что первичная последовательность отличается от таковой у
кальмодулина.
Домен dV малой субъединицы содержит кластеры
остатков Gly на N-конце, которые участвуют в гидрофобной природе белка. Этот
домен не виден в рентгеновских лучах, что предполагает то, что этот домен имеет
очень гибкую структуру, которая не заякоривается с другими частями молекулы
кальпаина (Strobl et al., 2000).
Транслокация кальпаинов к мембране клетки и их
ограниченный протеолиз являются результатами активации кальпаина (Cuervo, Dice,
1998).
В 1981 году было открыто, что автолиз происходит
в присутствие Са2+ (Suzuki et al., 1981)
Хотя автолиз происходит быстро, он включает
несколько последовательных этапов: 1) для большой 80 кДа субъединицы µ -
кальпаина NH2-терминальных 14 аминокислотных остатка удаляются первыми и
образуется 78 кДа промежуточный продукт, затем удаляются дополнительно 12 аминокислотных
остатка с образованием 76 кДа автолитического фрагмента; 2) для большой 80 кДа
субъединицы m-кальпаина NH2-терминальных 9 аминокислотных остатков удаляются
первыми, затем еще 9 остатков с образованием 78 кДа автолитического фрагмента;
3) для малой 28 кДа субъединицы NH2-терминальных 26 аминокислотных остатков
удаляются с образованием фрагмента 26-27 кДа, от которого дополнительно
отделяются 37 остатков (до Gly-64) - образуется фрагмент 22-23 кДа и в
последнюю очередь отделяется еще более 28 аминокислотных остатков (до Ala-92) с
образованием 18 кДа автолитического фрагмента. Малая субъединица автолизируется
гораздо быстрее, чем большая субъединица в µ - кальпаине, в то время как в m -
кальпаине происходит все наоборот (Brown, Crawfold, 1993).
Эндогенным ингибитором кальпаина является
кальпастатин, чья молекулярная масса варьирует от 34 до 280-300 кДа. Хотя
гомологичная последовательность среди кальпастатинов не так высока, как у
кальпаинов, однако >65% аминокислотной последовательности идентична. Эта последовательность
уникальна и не гомологична другим полипептидам, включая цистатины, которые
ингибируют многие цистеиновые протеазы, но не кальпаины. Кальпастатин содержит
4 повторения, предельно гомологичные (23-36%), домены из 140 аминокислотных
остатков каждый, плюс NH2-терминальный домен, называемый доменом L, который
варьирует от 68-78 кДа, завися от размера этого домена L. Обнаружено, что все 4
домена - I,II, III и IV могут ингибировать протеолитическую активность и µ-, и
m-кальпаинов. Каждый из доменов состоит из субдоменов: А, В и С. Домен L
единственный, который не обладает активностью ингибитора. Способность отдельных
доменов ингибировать кальпаин можно расположить следующим образом: домен
I>домен IV>домен III>домен II (от более к менее эффективному)
(Kawasaki et al., 1989). Эффективное ингибирование кальпаинов кальпастатином
требует, чтобы кальпастатин связывался с молекулой кальпаина в трех местах:
Са2+- зависимое включение субдомена А кальпастатина с доменом IV в кальпаине,
субдомена С кальпастатина с доменом VI в кальпаине и субдомена В с участком
около активной стороны кальпаина (домен IIa или IIb или обоими).
Связывание кальпастатина, содержащего субдомены
А и В, с кальпаином предотвращает связывание кальпаина с мембранами,
предполагая, что связывание кальпаинов с мембранами осуществляется доменами IV
и VI, «кальмодулин-схожими» доменами в молекуле кальпаина, потому что субдомены
А и В кальпастатина связывают домены IV и VI, соответственно (Kawasaki et al.,
1993).
Присутствие Са2+ делает кальмодулин более
гидрофобной молекулой и Са2+ также может увеличивать гидрофобность
«кальмодулин-схожих» доменов кальпаинов.
Таким образом, из-за того, что наиболее
эффективное ингибирование кальпаинов с кальпастатином требует участия всех
субдоменов кальпастатина - А, В и С, то, возможно, что все три субдомена должны
связываться с кальпаином для максимального ингибирования (Kawasaki et al.,
1989).
Многообразие эффектов Са2+-зависимых нейтральных
протеиназ обеспечивается активацией ряда ключевых ферментов обмена, рецепторов,
а также расщеплением разнообразных белков (миофибриллярных, мембранных белков,
цитоскелета). Особенности действия и субклеточная локализация этих протеиназ в
местах клеточно-матриксных контактов предполагают определенные взаимоотношения
кальпаин-кальпастатиновой системы и компонентов внеклеточного матрикса (Строев
и др., 1997).
Карбоксипептидаза М (КП М, КФ 3.4.17.2) была
обнаружена Skidgel и соавторами в цитоплазматических мембранах периферических
тканей и мозга (Skidgel et al., 1984).
Фермент широко распространен в человеческой
плаценте, почках, легких (Skidgel et al., 1991), периферических нервах,
головном мозге (Nagae et al., 1992), желтом теле, гранулярных клетках растущих
и незрелых фолликулов (Yoshioka S. et al., 1998), эндотелиальных клетках
кровеносных сосудов, лейкоцитах (De Saint-Vis et al., 1995), Активность
карбоксипептидазы М в нервной ткани на порядок ниже, чем в плаценте, а в
периферических нервах выше, чем в головном мозге. В мозге фермент обнаружен в
клетках глиии, а также в комплексе с миелином и миелинформирующими клетками
(Nagae et al., 1992).
КП М является гликопротеином с Mr 62000 (Deddish
et al., 1990, Skidgel et al., 1986). Фермент представлен одной полипептидной
цепью и связан с плазматической мембраной при помощи остатка
гликозил-фосфатидилинозитола (Deddish et al., 1990, Skidgel et al., 1986). При
воздействии трипсина и фосфолипазы С КП М переходит в растворимую форму за счет
удаления остатка гликозил-фосфатидилинозитола (Deddish et al., 1990, Skidgel et
al., 1996). Этот процесс возможен и in vivo, так как фермент обнаружен в моче и
амниотической жидкости (Skidgel et al., 1996). При химическом
дегликозилировании образуется полипептид с Mr 48000, который состоит из 439
аминокислотных остатков (Skidgel et al., 1991).
Максимальная активность КП М отмечается при рН
7,0. В активном центре фермента находится ион Zn2+ (Skidgel et al., 1986). Ионы
Со2+ повышают активность КП М в 1,5 - 2 раза, причем степень активации
возрастает при снижении рН. Действие фермента ингибируется ионами Cd2+,
о-фенантролином, 2-меркаптометил-3-гуанидилэтилтиопропановой кислотой (Deddish
et al., 1990).
КП М отщепляет остатки только основных
аминокислот, причем в отсутствие ионов Со2+ предпочтительней отщепляет аргинин,
а в присутствии Со2+ - лизин. Фермент в большей степени проявляет эстеразную
активность, чем пептидазную (Deddish et al., 1990, Skidgel et al., 1986). In
vitro КП М отщепляет остатки аргинина и лизина с С-конца Met5-энкефалин-Arg6,
Met-энкефалин-Lys6, Leu5-энкефалин-Arg6, брадикинина, динорфина А1-13 (Skidgel
et al., 1986), фактора роста эпидермиса (Skidgel et al., 1996), анафилотоксинов
С3а, С4а и С5а, различных синтетических пептидов (Deddish et al., 1990, Skidgel
et al., 1984).
Считают, что карбоксипептидаза М участвует в
инактивации или модулировании активности пептидных гормонов до или после их
взаимодействия с рецепторами, вовлекается в процессы клеточного роста и
дифференциации. В связи с этим представляет интерес изучение активности КП М
при введении галоперидола и диазепама.
Каспазы (КФ 3.4.22) - это внутриклеточные
пептидгидролазы, имеющие активированный цистеин внутри высококонсервативного
активного сайта, включающего пентапептид QACXG, который определяет связывание
пептидного субстрата и его гидролиз после остатка аспарагиновой кислоты. В
настоящее время все известные каспазы пронумерованы согласно времени их
открытия (Мартынова, 2003).
Каспазы обнаружены во всех тканях млекопитающих,
где они выполняют различные физиологические функции. Для каждого типа клеток
характерны уникальные каспазозависимые сигнальные пути. Каспазы-3, -9 участвуют
в ремоделировании клеток и тканей, в дифференцировке и пролиферации
гемопоэтических клеток, в негативной селекции тимоцитов, в развитии мозга и
сердечной мышцы в эмбриональный период и регулируют активность ферментов
головного мозга, каспазы-3 - в противовирусной защите путем активации IL-16.
Изменение физиологического состояния клетки приводит к изменению мишеней
действия каспаз, например, при апоптозе каспазы активируют мембранносвязанные
факторы транскрипции, которые в живой клетке поддерживают гомеостаз холестерина
и активируются другими ферментами (Гуляева, 2003).
Каспаза синтезируется в клетке первоначально в
виде неактивного профермента, состоящего из N-концевого полипептида (так
называемого продомена), большой и малой субъединиц и связывающего региона между
ними (Мартынова, 2003).
Образование активных форм каспаз инициируется
протеолитическим расщеплением по связи Asp-Xaa во внутренних сайтах между
доменами, что приводит к последовательному высвобождению малой субъединицы,
связывающего региона, большой субъединицы и удалению продомена. Большая и малая
субъединицы из разных прокаспаз собираются в единый комплекс. Активная форма
каспазы - это тетрамер, в котором связь осуществляется двумя малыми
субъединицами, окруженными двумя большими субъединицами. Два каталитических
центра формируются аминокислотами большой и малой субъединиц (Куцый и др.,
1999).
Среди эффекторных каспаз каспаза 3 в нервной
ткани привлекает особое внимание, поскольку принято считать, что именно этот
фермент тесно связан с программируемой гибелью нейронов. Этот фермент
рассматривают как фермент, принадлежащий к группе апоптических каспаз,
передающих и реализующих сигнал к клеточной гибели (Гуляева, 2003).
Каспазы участвуют в изменении всех частей клетки
при апоптозе, что определяет его морфологические характеристики. Они расщепляют
структурные белки цитоскелета (актин, фодрин), фокальные киназы, что приводит к
потере адгезии клетки. Важно подчеркнуть, что каспазы расщепляют только
незначительную фракцию белков в клетке, что, однако, достаточно для ее полной
разборки на апоптические тельца. Каспазы обуславливают такой важный признак
апоптоза, как олигонуклеосомную фрагментацию ДНК, которая осуществляется
ДНК-фрагментирующими факторами, активированными каспазозависимыми
эндонуклеазами, а также при каспазозависимом расщеплении
поли(АДФ-рибоза)полимеразы и потере ферментов репликации и сплайсинга ДНК
(Уманский, 1996).
К внеклеточным нейтральным протеазам относятся
матриксные металлопротеазы (ММП) или матриксины, функция которых связана с
обменом белков межклеточного матрикса. Эти ферменты играют решающую роль при
развитии таких физиологических процессов, как морфогенез, резорбция и
ремоделирование тканей, миграция, адгезия, дифференцировка и пролиферация
клеток, а также при патологических состояниях (ревматический артрит,
гломерулонефрит, пародонтиты, изъязвление роговой оболочки глаз и др.). Кроме
того, исследования последних лет позволили открыть новые функции ММП в
опухолевой прогрессии: участие в выходе депонированных факторов роста,
расщепление некоторых биоактивных молекул с образованием веществ с новыми
биологическими свойствами, участие в канцерогенезе ряда опухолей, мощный
ангиогенный эффект, участие в поддержании жизнеспособности опухолевых клеток.
Все перечисленные свойства делают их ключевыми маркерами опухолевой прогрессии
(Клишо и др., 2005).
Семейство ММП обладает некоторыми общими
характерными чертами. В то же время на основании данных по структурной
организации и субстратной специфичности в семействе ММП выделены четыре
подсемейства: коллагеназы, желатиназы, стромелизины и остальные ММП, не
относящиеся к перечисленным подсемействам. ММП представленных подсемейств могут
различаться способом активации проферментов и особенностями взаимодействия с
эндогенными ингибиторами.
ММП синтезируются и секретируются целым рядом
клеток: фибробластами, эпителиальными клетками, фагоцитами, лимфоцитами и
онкогенно-трансформированными клетками. За способность этих ферментов
специфически гидролизовать все основные белки матрикса они были названы
металлопротеиназами или матриксинами. В настоящее время известно около 15-18
представителей этого семейства, охарактеризованных в различной степени. Все
члены семейства обладают общими характерными чертами: 1) содержат цинк в
активном центре и относятся к кальций-зависимым протеиназам, ингибируются
хелатными агентами; 2) каталитический домен содержит мотив HEXXHXXGXXH, три
остатка гистидина которого связывают атом цинка в активном центре; 3) обладают
сходной доменной структурой; 4) гидролизуют один или несколько компонентов
матрикса и базальных мембран; 5) секретируются в виде проферментов,
пропептидный домен содержит консервативную последовательность, которая отвечает
за активацию про-ММП; 6) проферменты активируются рядом протеиназ,
тиолмодифицирующими агентами и хаотропными реагентами; 7) ингибируются
специфическими тканевыми ингибиторами; 8) последовательности кДНК всех ММП
имеют высокую степень гомологии с кДНК коллагеназы; 9) промоторные участки
генов содержат несколько сходных регуляторных последовательностей (Соловьева и
др., 2000).
Активность ферментов в тканях зависит от уровня
их генов и от наличия активаторов и ингибиторов ферментов в окружающей среде.
ММП в обычных условиях содержатся в тканях в незначительных количествах. Эти
протеиназы относятся к «индуцируемым» ферментам, синтез которых на уровне
транскрипции контролируется рядом факторов: цитокинами, факторами роста,
химическими соединениями, факторами, действующими на поверхность клетки
(конканавалинА, фрагменты фибронектина и др.), факторами, тормозящими уровень
синтеза (глюкокортикоиды, эстроген, прогестерон и др.). Действие этих факторов
зависит от типа клеток и вида животного. Анализ промоторов показал, что они
содержат общие элементы, отвечающие за механизмы регуляции экспрессии генов
глюкокортикоидами, эстрогеном, прогестероном и др.
На пострансляционном уровне в физиологических
условиях известны два основных пути регуляции активности ферментов: 1)
активация зимогенов и 2) взаимодействие с эндогенными ингибиторами. Все
зимогены ММП содержат в пропептиде консервативную последовательность в
пропептиде, в которую входит остаток Cys. Рентгеноструктурные исследования
показали, что этот остаток образует координационную связь с атомом Zn2+ в
активном центре и локализован недалеко от С-конца пропептидных фрагментов ММП.
Активация проферментов in vivo может происходить с помощью протеиназ, а также
тиолмодифицирующих и хаотропных агентов. В обоих случаях активация,
по-видимому, происходит ступенчато и на конечном этапе участвуют ММП, уже
находящиеся в активной форме (Клишо и др., 2005).
Про-ММП активируется рядом протеолитических
ферментов. В большинстве случаев активация проферментов происходит ступенчато:
на первой ступени протеиназа-активатор атакует участок пептидной цепи,
локализованный в середине пропептида, в результате чего образуется
промежуточный продукт с незначительной активностью. На следующей ступени
остаток пропептида удаляется с помощью внутримолекулярной реакции или при действии
других активных форм ММП. Последовательность в гидролизуемом участке пропептида
определяет тип протеиназ, способных активировать данную ММП.
Активность ММП в физиологических условиях
регулируется специфическими тканевыми ингибиторами ММП-ТIMП. В настоящее время
хорошо изучены три ТIMП из различных тканей человека. Они связываются с про-ММП
и активными ММП стехиометрически, ингибируя, таким образом, как
автокаталитическую активацию латентных форм ММП, так и активные ферменты. ТIMП
различаются по их специфическому действию на ММП. Так, ТIMП-1 значительно лучше
ингибирует желатиназу В (ММП-9), в то время как ТIMП-2 подавляет активность
желатиназы А (ММП-2). Ингибиторы могут быть инактивированы с помощью ряда
протеиназ - трипсина, химотрипсина, стромелизина-3 и эластазы нейтрофилов.
В тканях ММП могут ингибироваться также α2-макроглобулином,
который способен нековалентно связываться с этими ферментами. До 95%
ингибированной коллагеназы в плазме крови находятся в комплексе с α2-макроглобулином.
Предполагается, что α2-макроглобулин
выступает основным регулятором коллагенолиза в физиологических жидкостях.
В нормальных физиологических условиях матриксины
играют центральную роль в процессах морфогенеза, ремоделирования и резорбции
тканей. Они принимают участие в деструкции матрикса при ряде заболеваний
(пародонтиты, хронические язвы роговой оболочки глаза, а также процессы инвазии
и метастазирования опухолей).
Матриксины в физиологических условиях
секретируются из клеток в очень незначительных количествах. Одной из характерных
особенностей синтеза этих ферментов является его способность к индукции, т.е.
синтез и секреция ММП могут контролироваться многими факторами (Винокурова и
др., 2002).
В процессах эмбрионального развития и
морфогенеза деструкция соединительно-тканного матрикса является центральной,
критической стадией. Экспериментально на мышах было показано, что на стадии
имплантации эмбриональных клеток в матку в них экспрессируются гены ММП-1,-2,-3
и особенно ММП-9, а также ТIMП-1. В клетках материнской ткани, окружающей
эмбрион, в течение 5-6 дней экспрессируется ген ТIMП-3 (ингибитора желатиназ),
но экспрессия и синтеза ТIMP-1 и -2 ни в материнских, ни в эмбриональных
клетках не наблюдалось. Определенное соотношение синтеза ММП и специфических
эндогенных ингибиторов обеспечивает внедрение эмбриона в стенку матки.
В период метаморфоза травоядные головастики
становятся плотоядными лягушками. Это превращение сопровождается целым каскадом
изменений в пищеварительном тракте. Клетки первичного эпителия подвергаются апоптозу,
происходит его замена вторичным складчатым эпителием. Высокий уровень
стромелизина-3 (ММП-11) был найден в кишечнике головастика в период
метаморфоза, который был индуцирован тиреоидным гормоном, а также в его хвосте,
но не при развитии задних конечностей. Предполагается, что тканевое
ремоделирование вызывается стромелизином-3 и, возможно, другими матриксинами,
что приводит к обширной гибели клеток в период метаморфоза. Ранее отмечалось
участие коллагеназы I типа в этих процессах (Соловьева, 2002).
Образование новых кровеносных сосудов -
необходимый этап в процессах развития организма, заживления ран и воспаления.
Процесс требует отделения эндотелиальных клеток от базальных мембран и их
миграции через соединительно-тканных барьер. Ряд факторов, стимулирующий
ангиогенез (фактор роста фибробластов, эндотелиальных фактор роста и др.),
стимулируют и продукцию ММП. ММП-1,-2,-3 и -9 были обнаружены в стимулированных
эндотелиальных клетках; уровень каждого фермента зависел от источника и вида
клеток. Действие ингибитора ММП, в том числе ТIMП-1, не инвазивный процесс
эндотелиальных клеток подтверждает участие ММП в ангиогенезе .
Участие ММП в опухолевой трансформации, а также
в процессах инвазии и метастазирования опухолей хорошо доказано in vitro и in
vivo. Несколько ММП было впервые клонировано из генов опухолевых клеток
(желатиназа А, желатиназа В, коллагеназа 3, матрилизин, стромелизин-1,
стромелизин-2, МТ-ММП-1, МТ-ММП-4), или кодирующая их последовательность была
обнаружена в генах метастатических опухолей (стромелизин-3). ММР были найдены в
опухолях человека, локализованных в опухолях человека, локализованных в легких,
желудке, прямой кишке, простате и др.
Полученные многочисленные данные свидетельствуют
о том, что увеличенная экспрессия ММП коррелирует с деструктивными изменениями
в матриксе и с туморогенным фенотипом клеток, а также зависит от вида опухоли и
ткани (Дилакян, 2000).
К первому, наиболее изученному подсемейству ММП
относятся коллагеназы. В настоящее время известны четыре представителя этого
семейства: интерстициальная коллагеназа, или коллагеназа I типа (ММП-1),
коллагеназа нейтрофилов (ММП-8), коллагеназа 3 (ММП-13), коллагеназа 4
(ММП-18). ММП-1 - первый тканевой фермент, который гидролизовал спиральную
область коллагена. В настоящее время известно, что ММП-1 синтезируется рядом
клеток: нормальными и трансформированными фибробластами, хондроцитами,
эпителиальными клетками, макрофагами. ММП-8 была открыта в нейтрофилах, за что
и получила свое название нейтрофильной коллагеназы. ММП-3 найдена в клетках
карциномы молочной железы, а также в клетках костной ткани грызунов. Свое
название коллагеназы получили за способность гидролизовать нативный коллаген в
спиральной области (Соловьева и др., 2002).
Желатиназы гидролизуют нефибриллярный коллаген
IV типа, образующий базальные мембраны; считается, что именно эти протеазы
инициируют инвазивные процессы. Группа желатиназ состоит из ММП-2 (желатиназа
А) и ММП-9 (желатиназа В). В гистологических препаратах опухолей ММП-2
обнаруживали, в основном, в инвазивном фронте рака. Другие исследователи
утверждают, что наиболее выраженную экспрессию ММП-2 наблюдали в клетках стромы
около продвигающихся краев опухоли. Основными продуцентами ММП-2 при опухолевом
росте могут быть опухолевые клетки или фибробласты окружающей ткани, однако их
роль в этом процессе точно не определена.
Группа стромелизинов состоит из ММП-3
(стромелизин-1), ММП-10 (стромелизин-2) и ММП-11 (стромелизин-3).
Матрилизин (ММП-7) - самая короткая
металлопротеиназа.
Мембранные ММП локализованы на поверхности
опухолевых клеток и отличаются от других ММП тем, что имеют трансмембранный
домен. В настоящее время известно 4 представителя этой группы, но наиболее
изучен один - ММП-14 (МТ1-ММП). МТ1-ММП была преимущественно обнаружена в
опухолевых тканях плоскоклеточной карциномы головы и шеи, в то время как
образцы нормальных тканей ее практически не содержали. МТ1-ММП может локально
гидролизовать компоненты тканевых барьеров. Одним из главных субстратов
является коллаген I типа - основной компонент экстраклеточного матрикса. Хотя
МТ1-ММП не может разлагать коллаген IV типа в базальной мембране, она связывает
и активирует про-ММП-2, одну из коллагеназ типа. Однако разложение
экстраклеточного матрикса - это не единственная функция МТ1-ММП. Этот фермент также
регулирует взаимодействие клеток с экстраклеточным матриксом, расщепляя
клеточные адгезивные молекулы, что, в конечном счете, способствует клеточному
перемещению (Клишо и др., 2005).
В настоящее время проводятся многочисленные
исследования по разработке ингибиторов ММП как перспективных лекарственных
препаратов.
В сыворотке крови к ферментам, активным в
нейтральном диапазоне рН, относятся карбоксипептидаза В, плазмин, калликреин.
Калликреин-кининовая система крови является
центральным звеном в комплексе гуморальных систем, регулирующих гомеостаз и
осуществляющих адаптивно-защитные реакции организма, активно участвующих в
снабжении органов и тканей кислородом при гипоксических состояниях. Ее
активация является неспецифической реакцией организма и носит, в основном,
защитный характер (Гельцер, Жилкова, 2005).
Плазмин обладает тромболитическим эффектом и
снижает свертываемость крови. В организме он присутствует в виде неактивного
предшественника - плазминогена, чья концентрация в плазме крови достигает 0.2 г/л
(Кузнецова и др., 2004).
Особую группу ферментов, осуществляющих
заключительные стадии гидролиза белков, составляют дипептидазы, относящиеся к
экзогидролазам. Дипептидазы ответственны за пополнение фонда свободных
аминокислот для метаболических потребностей организма и имеют особое значение
для нервной ткани. Одним из представителей данной группы ферментов, активность
которого максимальна при нейтральном значении рН, является
глицилглицин-дипептидаза (3.4.13.1). Конечным продуктом этого фермента является
глицин, входящий в состав многих белков и биологически активных соединений.
Есть группа аминокислот, которые вырабатываются в печени, такие аминокислоты
называют заменимыми. К ним относится и глицин. По последним сведениям он
способствует нормализации работы гипофиза, оказывает хорошее действие при
терапии мышечной дистрофии, гипогликемии (Gomeza et al., 2003).
Глицин также является нейромедиаторной
аминокислотой. Рецепторы к глицину имеются во многих участках головного мозга и
спинного мозга и оказывают «тормозное» воздействие на нейроны, уменьшают
выделение из нейронов «возбуждающих» аминокислот, таких, как глутаминовая
кислота, и повышают выделение ГАМК. Обладает некоторыми ноотропными свойствами,
улучшает память и ассоциативные процессы. Глицин обладает глицин- и
ГАМК-ергическим, альфа1-адреноблокирующим, антиоксидантным, антитоксическим
действием; регулирует деятельность глутаматных (NMDA) рецепторов (Li, Han,
2006).
Глицин относится к средствам, способствующим
нормализации работы сосудов головного мозга. Кроме того, он в организме может
связывать ядовитые вещества, при этом яды деактивируются. Встуапя во
взаимодействие с определенными веществами, глицин становится строительным
материалом для выработки протеинов, ферментов и гормонов, а также и иных необходимых
для организма веществ.
Глицин помогает доставить к клеткам достаточное
количество кислорода, тем самым он снимает излишнюю напряженность в клетке и
снижает активность нейромедиаторов.
Глицин - тормозной нейротрансмиттер
в механизмах острой церебральной ишемии (Gusev et al., 2000). Он служит
медиатором в некоторых случаях
<#"563914.files/image001.gif">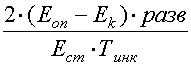 , где
, где
- активность фермента, мкмоль/гоп -
экстинкция опытного раствора
Ек - экстинкция контроля
Ест - экстинкция стандартного
раствора
Тинк - время инкубации, мин
Активность нейтральных протеаз
выражали в мкмоль образовавшегося тирозина в расчете на 1 г ткани.
.4.3 Определение активности
Са2+-зависимой нейтральной протеазы
Общую и Са2+-зависимую активность
нейтральных протеаз определяли по методу Baundry (1981) и Nilsson, Karlsson
(1986).
Гомогенаты тканей готовили на 50 мМ
Трис- HCl буфере, рН=7.4.
Субстрат: 1 % раствор казеина,
приготовленный в 0.1н растворе NaOH, нейтрализовали 0.2н раствором HCl.
Растворы: 1 мМ CaCl2 и 25мМ EGTA
также готовили на 50 мМ Трис- HCl буфере, рН=7.4.
. Для определения общей активности
нейтральных протеаз инкубационная смесь состояла:
.3 мл 1 % казеина
.5 мл 10% гомогената
.2 мл 1 мМ CaCl2
. Для определения Са2+-независимой
активности нейтральных протеаз инкубационная смесь состояла:
.3 мл 1 % казеина
.5 мл 10% гомогената
.2 мл 25мМ EGTA
Пробы инкубировали 1 час при 37°С.
Далее реакцию останавливали 1 мл 15% ТХУ. Пробы центрифугировали 15 мин при
3000 об/мин. 1 мл безбелкового центрифугата нейтрализовали 0.15 мл 10% раствора
NaOH и в нем определяли количество фолинположительных соединений по методу
Лоури. Оптическую плотность исследуемых образцов измеряли при λ=750 нм.
Значения активности для Са2+-активируемой нейтральной протеазы типа I
представляли собой разность оптических плотностей для общей и Са-независимой
активности.
Активность выражали в мкмоль
тирозина/100 мг белка за 1 час.
В качестве стандарта для построения
калибровочной кривой использовали тирозин.
.4.4 Определение активности
глицилглицин-дипептидазы
Активность глицилглицин дипептидазы
определяли нингидриновым методом Ли и Такахаши с модификациями (Рева и др.,
1982) в печени и в больших полушариях головного мозга бодрствовавших зимой и
пробуждающихся весной сусликов. Каждую выделенную ткань взвешивали и
гомогенизировали в холодном 0.25М растворе сахарозы в соотношении 1:9 (вес:
объем) в стеклянном гомогенизаторе с тефлоновым пестиком. В среду гомогенизации
добавляли 0.001М хлористый кобальт. Все операции проводили на холоду.
Инкубационная смесь содержала 0.4 мл
0.005М раствора глицил-глицина в фосфатном буфере рН 7.6 и 0.4 мл гомогената с
0.001М хлористым кобальтом. Инкубацию проб тканей проводили в ультротермостате
при 37ºС и 10ºС в течение
30 минут. Реакцию останавливали добавлением 0.4 мл 5% раствора ТХУ. В
контрольные пробы ТХУ добавляли перед внесением субстрата.
Пробы центрифугировали 15 минут при
3000 об/мин. В надосадочной жидкости определяли прирост глицина нингидриновым
методом.
Цветная реакция
В пробирку отбирали 0.4 мл
фильтрата, добавляли 1 мл нингидринового реактива, тщательно перемешивали
стеклянной палочкой для получения однородной смеси. Далее пробу помещали на 12
минут (точно!) в кипящую баню и после этого охлаждали холодной водой.
Интенсивность окраски измеряли на
КФК-2 при 570 нм против контрольных проб.
Активность фермента выражали в
мкмоль глицина, освободивщегося при гидролизе глицилглицина за 30 минут
инкубации при 37ºС и 10ºС (рН 7.6) в
расчете на 100 мг ткани и на мг белка.
Приготовление реактивов. 0,05М
фосфатный буфер рН 7.6
.2М раствор фосфата калия -5мл
.2М раствор гидроокиси калия -4.24мл
довести водой до 20мл и определить
рН -7.6
. 0,5 М цитратный буфер рН -5.5
.5М раствор лимонной кислоты -5.1 мл
.5 М раствор цитрата натрия -14.9мл
. 0,001 М СоСl2 *6Н2О (М.м =238г)
Взвесить 23.8 мг -СоСl2* 6Н2О и
добавить в 100 мл 0.25М раствора сахарозы.
. Нингидриновый реактив (готовить
непосредственно перед цветной реакцией)
мг нингидрина взвесить на торсионных
весах и растворить в 12 мл 0.5М раствора цитратного буфера рН 5.5 при
подогревании на водяной бане (400С). Раствор охладить и к нему добавить 24мл
глицерина. Реактив тщательно перемешать.
. 0.25М раствор сахарозы. 8.55г
сахарозы перенести в колбу на 100мл и растворить в небольшом количестве воды и
затем довести до 100мл.
2.4.5 Определение белка по методу
Лоури
Метод основан на образовании
окрашенных продуктов ароматических аминокислот (триптофан и тирозин) с
реактивом Фолина в сочетании с биуретовой реакцией на пептидные связи (Lowry et
al., 1951).
.4 мл исследуемого раствора
смешивали с 2 мл раствора С, перемешивали и оставляли при комнатной температуре
на 10 мин. Затем добавляли 0,2 мл реактива Фолина - Чокальтеу. Содержимое
пробирки тщательно перемешивали и через 30 минут колориметрировали при длине
волны 750 нм в кюветах с толщиной слоя жидкости 5 мм. Предварительно строили
калибровочный график по стандартному раствору альбумина и по нему определяли
содержание белка в опытной пробе.
.4.6 Исследование температурной
зависимости активности
нейтральных протеаз
Для изучения температурной
зависимости активности нейтральных протеаз пробы инкубировали при 10, 20, 30,
37 и 40ºС. Время
инкубации во всех случаях составляло 60 мин. Полученные результаты представлены
в Аррениусовских координатах : lg V - 1000/Т, где V - скорость реакции, Т -273+
температура инкубации.
На графиках в Аррениусовских
координатах вычисляли положение точки излома и энергии активации выше и ниже
излома.
Энергию активации определяли из
наклона прямой по следующей формуле:
=-R∙tgα
где R - газовая постоянная,
α - угол,
образуемый прямой с осью абсцисс (Мейланов, 1999).
2.5 Статистическая обработка
результатов исследования
Полученные данные подвергнуты
вариационно-статистической обработке по методу малой выборки (Кокунин, 1975).
При определении степени различия
средних арифметических двух сравниваемых вариационных рядов вычисляли
показатели существенности разницы t (коэффициента Стьюдента). Затем, на
основании t по таблице Стьюдента определяли вероятность различия Р. При
Р<0,05 различие оценивалось как достоверное (вероятность различия более
95%).
ГЛАВА 3. РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
.1 Активность нейтральных протеаз в
тканях суслика в динамике
зимней спячки
В клетках различных тканей животных
и человека обнаружены протеолитические ферменты с оптимумом действия в зоне
нейтральных значений рН. К таким ферментам относят Са2+ - зависимые нейтральные
протеазы и различные металлопротеазы, основная функция которых состоит в
ограниченном протеолизе белковых молекул. Субстратами данных ферментов являются
белки цитоскелета и ядерного матрикса, вещество Р, опиоидные пептиды,
нейромедиаторы, протеинкиназа С, фосфолипазы и др. (Гусев., 1998).
Протеолитические ферменты играют
значительную роль при адаптации клеточного метаболизма к изменяющимся условиям
окружающей среды, в осуществлении защитных функций организма (Cuninghaim,
1987).
Весьма своеобразным и интересным
приспособлением для переживания неблагоприятных условий является зимняя спячка,
наблюдающаяся у многих видов млекопитающих (Kortner, Geiser, 2000).
Уменьшение температуры тела при
зимней спячке может колебаться в очень широких пределах. Температура тела
гибернирующих сусликов поддерживается на несколько градусов выше температуры
окружающей среды (Carey et al., 2003). В динамике зимней спячки механизмы
терморегуляции сохраняются, но они поддерживают температуру тела на еще более
низком уровне. При этом биохимические процессы, работа органов и систем
организма гибернантов не тормозятся, а перестраиваются так, что даже при очень
низкой температуре тела поддерживается определенный гомеостаз (Карманова, 1995;
Woods, Storey, 2004).
Гибернация сопровождается
экстремальными изменениями в физиологии. Температура тела, уровень метаболизма,
сердечные ритмы и другие параметры деятельности организма падают во время
зимней спячки до уровня, который может быть летальным для гомойотермов, но не
для гибернантов. Кроме того, восстановление функций до, приблизительно,
нормального уровня происходит во время пробуждения со скоростью, которая может
затрагивать клеточные и системные регуляторные пути, типичные для негибернантов
(Carey et al., 2000; Terleky, Dice, 1993). В связи с этим, результаты,
полученные на зимоспящих, могут быть использованы и для выяснения механизмов
терморегуляции у гомойотермных организмов.
Нами исследована общая активность
нейтральных протеаз различных тканей в динамике зимней спячки сусликов.
Как видно из таблицы 1, у
бодрствующих сусликов (в июле) максимальная активность нейтральных протеаз
наблюдается в печени.
Высокая активность нейтральных
протеаз в печени может быть связана с тем, что печень в организме является
«биохимической лабораторией», где пересекаются все метаболические пути ,и
процессы распада и синтеза белков протекают наиболее интенсивно.
В сентябре, у бодрствующих сусликов,
в печени наблюдается незначительное повышение активности нейтральных протеаз.
Такие же незначительные колебания общей активности нейтральных протеаз печени
происходят и в остальные месяцы осени - перед началом спячки. Таким образом, в
печени бодрствующих (лето и осень) и готовящихся к спячке сусликов нет
серьезных изменений в общей активности нейтральных протеаз. Резкое, почти в 2
раза, снижение активности ферментов в печени, по сравнению с предыдущими
этапами исследования, выражено в 1-ый месяц спячки. Значительно, почти в 3
раза, возрастает активность нейтральных протеаз к третьему месяцу спячки и
перед пробуждением, относительно месяца спячки (табл. 1; рис. 1).
Естественно, что перед выходом из
спячки в печени происходит подготовка к синтезу новых белков, которому должен
предшествовать процесс пополнения пула аминокислот, за счет распада «старых»,
выполнивших свою функцию белков.
Таблица 1 Общая активность нейтральных протеаз в
тканях (мкмоль тирозина/г влажной ткани) и сыворотке крови (мкмоль тирозина /л)
сусликов (n=4-5)
|
Ткани
|
Бодрствующие
(июль) нормотермия 38°С
|
Бодрствующие
(сентябрь) нормотермия 38°С
|
Перед
спячкой (октябрь) tтº=16-19°С
|
Начало
спячки (ноябрь) tтº =10-13°С
|
1
месяц спячки tтº =5-8°С
|
2
месяц спячки tтº =3-4°С
|
3
месяц спячки tтº =5-8°С
|
Перед
пробуждением t тº =6-7°С
|
|
Мозг
|
3.3±0.5
|
5.9±1.0
p<0.05
|
4.6±0.2
p<0.05
|
1.3±0.2
p<0.01
|
-
|
0.7±0.02
p<0.001
|
5.2±0.8
p<0.05
|
6.0±0.6
p<0.05
|
|
Печень
|
10.2±1.0
|
13.2±0.2
|
10.9±0.9
|
13.4±0.2
|
6.9±0.4
p<0.05
|
11.5±0.5
|
18.1±1.6
p<0.05
|
18.7±1
p<0.01
|
|
Сердце
|
2.4±0.3
|
6.9±1.0
p<0.01
|
7.4±1.0
p<0.001
|
5.5±0.6
p<0.01
|
3.0±0.4
|
8.1±1.0
p<0.001
|
8.5±0.9
p<0.001
|
9.5±0.5
p<0.001
|
|
Кровь
|
1.3±0.2
|
2.9±0.2
p<0.01
|
3.8±0.3
p<0.001
|
2.5±0.3
p<0.01
|
|
|
|
|
P - значение достоверно относительно
бодрствующих сусликов (июль)
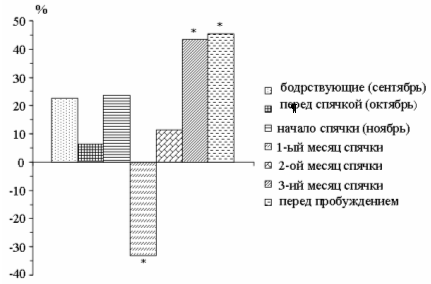
Рис. 1. Динамика изменения (в % по отношению к
контролю) активности нейтральных протеаз печени сусликов на разных этапах
зимней спячки. Здесь и далее: * - достоверность различий относительно
бодрствующих сусликов в июле
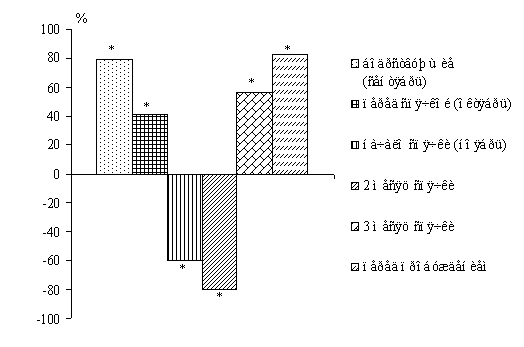
Рис. 2. Динамика изменения (в % по отношению к
контролю) активности нейтральных протеаз мозга сусликов на разных этапах зимней
спячки.
В мозгу бодрствующих (июль) сусликов общая
активность нейтральных протеаз составляет 1/3 часть от активности ферментов в
печени (табл.1). В сентябре общая активность нейтральных протеаз достоверно
повышается на 79% по сравнению с июлем (рис.2).
Общая активность нейтральных протеаз в мозгу
сусликов в октябре выше, чем летом (в июле), но начинает уменьшаться по
сравнению с бодрствующими сусликами в сентябре. В начале спячки (ноябрь)
уровень общей активности нейтральных протеаз снижен на 60%, а в 1-ый месяц
зимней спячки падает до нуля. Эти данные согласуются с тем, что в этот период в
головном мозгу происходит подавление синтеза и распада белков (Эмирбеков,
Львова, 1985; Жегунов и др., 1993; Storey, 2004).
Ко 2-му месяцу зимней спячки активность
ферментов начинает повышаться и составляет 20% от летнего контроля. Третий
месяц зимней спячки и пробуждение от нее характеризуются повышением общей
активности нейтральных протеаз в мозгу, по сравнению с таковой у бодрствующих
животных. Таким образом, перед зимней спячкой и при выходе из спячки общая
активность нейтральных протеаз в мозгу находится на одинаково повышенном уровне
(~ в 2 раза) по сравнению с летними бодрствующими животными.
По данным Фрерихс с сотр. (Frerichs et al.,
1998) скорость синтеза белков в мозге сусликов при гибернации составляет всего
0.04% от его уровня у активных животных. В большей степени синтетические
процессы в тканях гибернирующих сусликов сохраняются в коре почки,
поджелудочной железе и печени (Жегунов, 1990). Наиболее низкая скорость синтеза
белков при гибернации отмечается в тканях селезенки, мозга, мышц и легких (Жегунов,
Микулинский, 1987). Интенсивность синтеза белков при этом снижается не только
за счет уменьшения скорости этого процесса, но и за счет полного прекращения
синтеза некоторых индивидуальных белков (Storey, 2004).
Считают, что снижение интенсивности белкового
синтеза при гибернации связано с необходимостью экономить энергетические
ресурсы, когда уменьшается скорость кровотока, содержание субстратов и
потребление кислорода (Frerichs et al., 1998; Storey, 2004).
Выход из зимней спячки готовится заранее. Еще в
состоянии гибернации в нейронах гиппокампа активным образом идет синтез,
накопление и выход в цитоплазму РНК, резко повышается синтез белка (Гордон и
др., 1987). Интенсификацию синтеза белка в тканях пробужающихся сусликов можно
связать с общей для всех клеток необходимостью восполнения потерянных и
измененных во время зимней спячки функциональных и структурных белков или же
замены части энзимов на специфические изоформы, необходимые при данной
температуре.
Усиленный синтез в мозгу белков, в особенности
некоторых фракций, в первый период после пробуждения от зимней спячки носит
репаративный характер и связан с активацией всех жизненных процессов в
организме, а также с необходимостью восполнить количество белков, содержание
которых было уменьшено при зимней спячке. Наряду с ускорением синтеза
происходит и распад белковых молекул (Эмирбеков, Львова, 1985).
Процесс пробуждения от гибернации находится по
контролем ЦНС. При этом важную роль играют эндокринные железы, особенно
надпочечники, значительно активируется симпатическая нервная система.
Известно, что одними из субстратов нейтральных
протеаз являются энкефалины, которые, как и все регуляторные пептиды, обладают
широким спектром биологического действия. Для проявления широкого спектра
физиологических свойств энкефалинов одну из главных ролей играют нейтральные
протеазы, определяющие количество их активных форм в организме, а также
«качественный» состав секретируемых регуляторных пептидов.
Выделение из клетки активных энкефалинов,
которые мигрируют к клеткам-мишеням (через кровеносное русло или синаптическую
щель), где связываются со специфическими рецепторами, происходит при изменении
концентрации Са2+ (Лишманов и др., 1997). Выполняя в организме функции
нейромодуляторов, нейромедиаторов и гормонов, энкефалины влияют на многие
системы организма (Панченко и др., 1999).
Процесс синтеза новых, или модификация структуры
и функции имеющихся в клетке белков, может играть существенную роль в
приспособлении клеток гетеротермных животных к функционированию в различных
температурных условиях
При пробуждении сусликов от зимней спячки в их
тканях синтезируется большое количество белков, уже характерных для активных
животных. Появляются также специфические белки, которых нет у активных и спящих
животных.
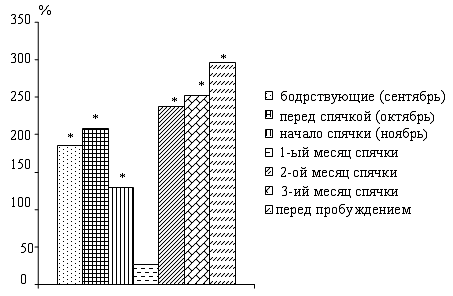
Рис. 3. Динамика изменения (в % по отношению к
контролю) активности нейтральных протеаз сердечной мышцы сусликов на разных
этапах зимней спячки.
Таким образом, процесс пробуждения сусликов
требует присутствия в клетках специфических белков, которые активно
синтезируются (Жегунов, Микулинский, 1987; Жегунов и др., 1991).
В сердечной мышце, в отличие от печеночной
ткани, уже в сентябре (бодрствование) общая активность нейтральных протеаз
повышается в 2.9 раз, а в октябре - в 3.1 раза (рис.3), по сравнению с июлем.
Учитывая, что в сентябре уже наступает сезон подготовки к зимней спячке, такое
существенное повышение общей активности нейтральных протеаз можно объяснить
ревизией белкового состава тканей, а также появлением новых пептидов (Croall,
Demartino, 1991; Chua et al., 2000), возможно, за счет реакций ограниченного
протеолиза.
В сердечной мышце такая высокая общая активность
нейтральных протеаз сохраняется до впадения в спячку (в 1-й месяц спячки
активность ферментов минимальная). По мере выхода из спячки общая активность
нейтральных протеаз вновь повышается. Можно предположить, что для сердечной
мышцы, в отличие от печени очень важна общая активность нейтральных протеаз не
только при подготовке, но и на всех этапах зимней спячки.
.2 Активность нейтральных протеаз в тканях
суслика в ходе
самосогревания после индуцированного пробуждения
Пробуждение зверьков после длительного состояния
зимней спячки можно рассматривать как процесс адаптации к новым условиям,
связанный с интенсификацией обмена веществ, возрастанием потребления кислорода
и повышением температуры тела. В связи с этим нам представлялось интересным
исследование изменения активности нейтральных протеаз на этапах самосогревания
сусликов при пробуждении от зимней спячки (табл. 2).
Нами обнаружено, что наиболее существенное
изменение общей активности ферментов в ходе индуцированного пробуждения
происходит в мозгу (рис. 4, 8). Повышение температуры тела с 3ºС
до 10ºС
приводит к повышению общей активности нейтральных протеаз в 4 раза. Дальнейшее
повышение температуры тела пробуждающихся животных до 20ºС
приводит к еще большему росту активности ферментов (в 6 раз), относительно
глубокой зимней спячки. Однако, согревание зверьков до 25 и 30ºС
не приводит к дальнейшим изменениям активности нейтральных протеаз. Полное
самосогревание животных до 37ºС
приводит к росту общей активности ферментов в 8 раз относительно зимней спячки.
Таблица 2. Общая активность нейтральных протеаз
в тканях (мкмоль тирозина/г влажной ткани) сусликов на этапах самосогревания
после индуцированногопробуждения (n=5); инкубация проб при 37°С
|
Ткани
|
Спячка
tº=3-4°С
|
Самосогревание
до температуры тела:
|
|
|
10ºС
|
20ºС
|
25ºС
|
30ºС
|
37ºС
|
|
Мозг
|
0.7±0.02
|
2.7±0.2
p<0.01
|
4.2±0.5
p<0.001
|
4.8±0.4
p<0.001
|
4.5±0.6
p<0.001
|
5.7±0.2
p<0.001
|
|
Печень
|
11.5±0.5
|
12.2±0.5
|
18.8±1.0
p<0.01
|
18.3±0.4
p<0.01
|
16.5±2.0
p<0.05
|
21.6±0.5
p<0.001
|
|
Сердце
|
8.1±1.0
|
8.2±0.3
|
10.3±1.4
|
10.2±1.0
|
10.2±1.1
|
9.4±0.9
|
- значение достоверно относительно данных при
спячке
Как было отмечено ранее, процесс пробуждения от
гибернации находится под контролем ЦНС, вследствие чего в мозгу происходят
весьма сложные биохимические изменения, которые приводят к такому значительному
росту активности протеолитических ферментов при повышении температуры тела.
Как видно из табл. 2 и рис. 5 в печени, также
как и в мозгу наблюдается повышение общей активности нейтральных протеаз по
мере повышения температуры тела пробуждающихся сусликов. При самосогревании до
20ºС
наблюдается повышение общей активности нейтральных протеаз на 63%. В интервале
от 20 до 30ºС достоверных
различий в изменении активности ферментов нет. Полное самосогревание животных
до 37ºС
приводит к повышению общей активности нейтральных протеаз на 88% относительно
зимней спячки.
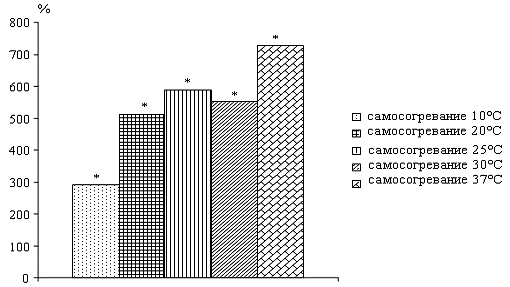
Рис. 4. Динамика (в % по отношению к контролю)
изменения активности нейтральной протеазы мозга сусликов по мере самосогревания
после 2-х месячной спячки (tт°=3-4°С). Здесь и далее:* - достоверность различий
относительно зимней спячки

Рис. 5. Динамика (в % по отношению к контролю)
изменения активности нейтральной протеазы печени сусликов по мере
самосогревания после 2-х месячной спячки (tт°=3-4°С).

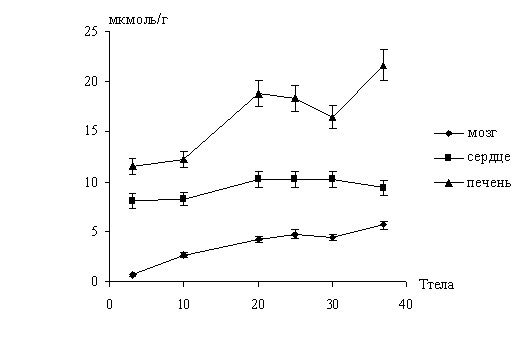
Рис. 7. Общая активность нейтральных протеаз в
тканях суслика на этапах самосогревания (tинкубации=37ºС).

Рис. 8. Общая активность нейтральных протеаз в
тканях суслика на этапах самосогревания (tинкубации соответствует температуре
тела животного).
В сердечной мышце достоверных изменений общей
активности нейтральных протез по мере самосогревания сусликов нет (рис. 6).
Так как инкубация проб при 37ºС
определяет «оптимальную» активность ферментов и не соответствует истинным
значениям при той же температуре тела животного, нами определена общая
активность нейтральных протеаз при температурах инкубации, соответствующих
температуре тела сусликов (рис. 8).
Так называемая «истинная» активность нейтральных
протеаз по мере повышения температуры тела в разных тканях повышается
по-разному. Наиболее равномерно этот процесс протекает в мозгу, а наиболее
выражена кривая зависимости общей активности нейтральных протеаз от температуры
тела в печени, т.е. по мере согревания суслика она в печени стремительно растет
и достигает наибольших значений по сравнению с мозгом и сердечной мышцей. Если
«оптимальная» активность нейтральных протеаз в сердечной мышце не зависит от
температуры тела (рис. 7), то «истинная» активность нейтральных протеаз, как
видно из рис. 8, значительно возрастает, особенно в интервале температур 25-37ºС.
Таким образом каждая ткань: мозг, печень и сердце неодинаково готовятся к
выходу из спячки.
Разная температурная зависимость активности
нейтральных протеаз в различных тканях свидетельствует о том, что в каждой ткани
зимоспящего животного существуют свои нейтральные протеазы, работающие в своем
режиме и со своими субстратами.
Таким образом, в ходе пробуждения от зимней
спячки в организме сусликов происходят изменения, направленные на поддержание
метаболизма при данном физиологическом состоянии.
.3 Активность нейтральных протеаз в тканях крыс
при гипотермии
Известно, что теплокровные животные в норме
регулируют температуру своего тела в жестких пределах, в отличие от
гетеротермных животных, адаптированных к изменениям температуры в широком
диапазоне. При попадании в неблагоприятные условия внешней среды у
гомойотермных животных возможен срыв регуляторных механизмов. Если
неблагоприятное воздействие связано с низкой температурой, тогда возникает
переохлаждение. Длительное и жесткое холодовое воздействие приводит к истощению
энергетических резервов организма (Эмирбеков, Львова, 1985). Глубокая
гипотермия является опасным для жизни гомойотермного организма состоянием и ее
пролонгирование увеличивает риск летального исхода (Жегунов и др., 1993).
Гипотермия снижает уровень метаболизма и таким образом уменьшает потребность в
кислороде. Гипотермия имеет свой благоприятный эффект за счет снижения уровня
метаболизма, но тем не менее не является нормальным физиологическим состоянием
и может вести к различным неблагоприятным последствиям (Sessler, 1997).
3.3.1 Протеолитическая активность нейтральных
протеаз при
гипотермии
Общая протеолитическая активность нейтральных
протеаз (субстрат казеин) в тканях крыс распределена примерно также, как и у
бодрствующих (летних) сусликов.
По нашим данным (табл. 3) максимальная
активность нейтральных протеаз наблюдается в печени, а минимальная - в
сыворотке крови. В мозгу общая активность нейтральных протеаз составляет 29.1%,
в сердечной мышце - 44.8%, а в сыворотке крови - 16.8% от уровня ее активности
в печени.
При умеренной гипотермии 30-33°С в печени и
сердечной мышце наблюдается общая тенденция к снижению активности нейтральных
протеаз. Достоверное снижение активности нейтральных протеаз при глубокой
гипотермии 18-20°С по достижении, наблюдается во всех исследуемых тканях также,
как и значительное повышение активности ферментов при пролонгировании глубокой
гипотермии в течение 2-х часов.
Таблица 3 Общая активность нейтральных протеаз в
тканях (мкмоль тирозина /г влажной ткани) и сыворотке крови (мкмоль тирозина
/л) крыс (n=6)
|
Ткани
|
Контроль
37°C
|
Гипотермия
30-33°С
|
Гипотермия
18-20°С
|
Пролонгирование
гип.20°С 2 часа
|
Гипертермия
42°С
|
Иммобилизация
1 час
|
|
мозг
|
4.5±0.5
|
3.3±0.4
|
1.8±0.2
Р1<0.001 Р2<0.001
|
8.9±0.4
Р1<0.001 Р2<0.001
|
3.1±0.4
|
4.0±0.4
|
|
сердце
|
7.0±0.2
|
3.0±0.5
Р1<0.001
|
3.4±0.2
Р1<0.001
|
12.0±0.4
Р1<0.001 Р2<0.001
|
3.1±0.6
Р1<0.001
|
7.0±0.6
|
|
печень
|
15.5±0.5
|
12.2±0.6
Р1<0.01
|
8.0±0.7
Р1<0.001 Р2<0.001
|
13.9±1.8
Р2<0.001
|
7.5±0.8
Р1<0.001
|
11.2±1
Р1<0.001
|
|
кровь
|
2.6±0.2
|
2.0±0.07
|
1.7±0.2
Р1<0.01
|
3.7±0.3
Р1<0.01 Р2<0.001
|
2.3±0.2
|
2.4±0.3
|
Р1 - значение достоверно относительно контроля-
значение достоверно относительно предыдущего этапа гипотермии
Рассматривая каждую ткань в отдельности, можно
отметить, что в мозгу (рис.9) при умеренной гипотермии 30-33°С происходит
незначительное снижение общей активности нейтральных протеаз.
При гипертермии 42 С снижение общей активности
нейтральных протеаз в мозгу также незначительно.
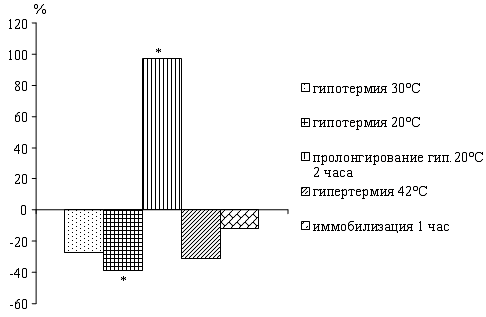
Рис. 9. Динамика изменения (в % по отношению к
контролю) общей активности нейтральных протеаз мозга крыс при разных
температурах тела. Здесь и далее: * - достоверность различий относительно
контроля
Длительная гипертермия возникает при максимальном
напряжении физиологических механизмов терморегуляции (Zee, 2002). Пребывание
организма в условиях гипертермического воздействия может приводить к
метаболическим и функциональным изменениям, которые, в свою очередь, могут
оказать негативное влияние на характер жизнедеятельности отдельных органов
(Инжеваткин и др., 2000; Фрадкин и др, 2002). Однако, при кратковременном
(15-20 минут) воздействии температуры: как низкой (30-33°С), так и высокой
(40-42°С) мы предполагаем неспецифическую реакцию на стресс, а не на
температурный фактор.
Анализ научной литературы показывает, что при
гипотермии обновление белков тормозится несравненно резче, чем обновление
веществ имеющих энергетическое значение. Так, при понижении температуры тела на
каждые 10°С скорость обновляемости белков мозга снижается примерно на 62%
(Mortensen, Dale, 1995).
Глубокая гипотермия 18-20°С приводит к снижению
общей активности нейтральных протеаз мозга и оно составляет 60% относительно
контроля.
Пролонгирование глубокой гипотермии 18-20°С в
течение 2 часов вызывает 5-кратное повышение общей активности исследуемых
ферментов в мозгу относительно предыдущего этапа охлаждения. Столь значительное
повышение общей активности нейтральных протеаз может быть связано с реакцией
организма на длительное воздействие холодового стресса.
К группе нейтральных эндопептидаз синаптической
фракции относятся металлопротеиназы, осуществляющие процессинг и деградацию
таких регуляторных пептидов, как вещество Р, энкефалины, нейротензин, динорфин
др.
Метаболическая деятельность ферментов мозга
входит в компенсаторный механизм, функционирующий при низкой температуре тела.
Молекулярные механизмы компенсации могут состоять в изменении физико-химических
констант, в изменении пропорций изоферментов, приспособленных к определенной
температуре (Эмирбеков и др., 1980).
Полученные нами данные, возможно, объясняются
данными, установленными другими авторами о возрастании образования и секреции
опиоидных пептидов в мозгу и увеличении их концентрации в крови при различных
видах стресса (Менджерицкий и др., 1995).
При низкой температуре тела теплокровного
животного в белках мозга модифицируются не только высшие структурные категории,
но и меняется их аминокислотный состав. Изменение аминокислотного состава,
видимо, связано как с изменением биосинтеза белков мозга, так и с активностью
протеолитических ферментов (Эмирбеков, Нурмагомедова, 1979).
Сердце, как наиболее адаптивный орган в первые
15-20 минут охлаждения реагирует двукратным снижением общей активности
нейтральных протеаз, которое поддерживается в течение часа глубокого охлаждения
(рис.10). При гипотермии 30-33°С происходит снижение общей активности
нейтральных протеаз на 56.7%, при гипотермии 18-20°С - на 50.6%, при
гипертермии 42ºС - на 55.9%
относительно контроля. Достоверных различий результатов при этих трех
состояниях нет. При дальнейшем (2-х часовом) воздействии холодового фактора
происходит повышение активности ферментов на 71%, по сравнению с контролем, а
относительно глубокой гипотермии по достижении, в 3.5 раза.
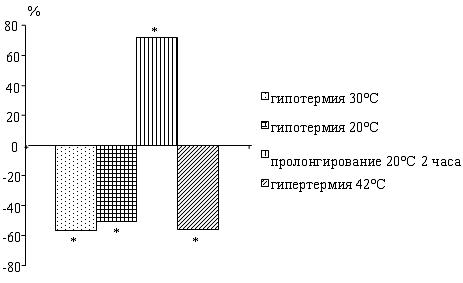
Рис 10. Динамика изменения (в % по отношению к
контролю) общей активности нейтральных протеаз сердечной мышцы крыс при разных
температурах тела.
Сопоставление активности эндогенной опиоидной
системы и степени устойчивости сердца к стрессорным повреждениям
свидетельствует о том, что любой фактор, вызывающий увеличение уровня опиоидных
нейропептидов в организме, повышает резистентность сердца к стрессорным,
холодовым и аритмогенным воздействиям (Лишманов и др., 1998).
Повышение активности нейтральных протеаз,
следовательно, и энкефалинов при пролонгировании глубокой гипотермии, возможно,
играет защитную роль и может вносить свой вклад в антиаритмический эффект, так
как известно, что энкефалины существенно уменьшают стрессорные повреждения
сердечной мышцы.
При умеренной гипотермии 30-33°С и глубокой
гипотермии 18-20°С в печени (рис. 11) крыс активность ферментов снижается на
21.3% и 48.4%, соответственно.
Максимальное снижение общей активности
нейтральных протеаз в печени наблюдается при гипертермии 42°С (на 51.7%).
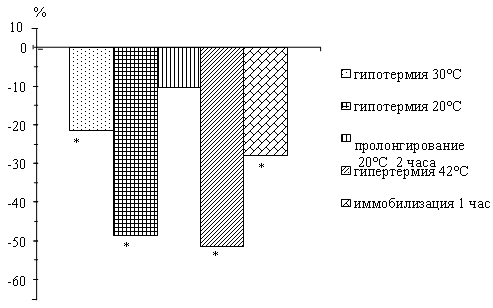
Рис 11. Динамика изменения (в % по отношению к
контролю) общей активности нейтральных протеаз печени крыс при разных
температурах тела.
Гипертермия рассматривается многими исследователями
как один из перспективных методов профилактики и терапии ряда заболеваний. При
гипертермическом воздействии особое значение приобретает состояние органов,
непосредственно участвующих в поддержании гомеостаза организма. Одним из таких
органов является печень (Инжеваткин и др., 2000).
При пролонгировании глубокой гипотермии
достоверных различий в изменении активности ферментов относительно контроля
нет, а относительно гипотермии 18-20ºС
активность нейтральных протеаз значительно повышается (на 75%).
В сыворотке крови к ферментам, активным в
нейтральном диапазоне рН, относятся карбоксипептидаза В, плазмин, калликреин.
Калликреин-кининовая система крови является
центральным звеном в комплексе гуморальных систем, регулирующих гомеостаз и
осуществляющих адаптивно-защитные реакции организма, активно участвующие в
снабжении органов и тканей кислородом при гипоксических состояниях. Ее
активация является неспецифической реакцией организма и носит, в основном,
защитный характер (Гельцер, Жилкова, 2005).
Плазмин обладает тромболитическим эффектом и
снижает свертываемость крови. В организме он присутствует в виде неактивного
предшественника - плазминогена, чья концентрация в плазме крови достигает 0.2
г/л (Кузнецова и др., 2004).
В наших исследованиях (рис. 12) в сыворотке
крови общая активность нейтральных протеаз достоверно изменяется только при
глубокой гипотермии по достижении и при ее пролонгировании. Глубокая гипотермия
приводит к снижению активности ферментов относительно контроля на 35%, а
длительное (2-х часовое) охлаждение вызывает повышение активности нейтральных
протеаз на 42%.
В качестве дополнительного контроля нами была
использована иммобилизация животных, которая, как оказалось, не влияет на общую
активность нейтральных протеаз в сердечной мышце. При этом в мозгу и сыворотке
крови отмечается незначительное снижение, а в печени оно достоверно.
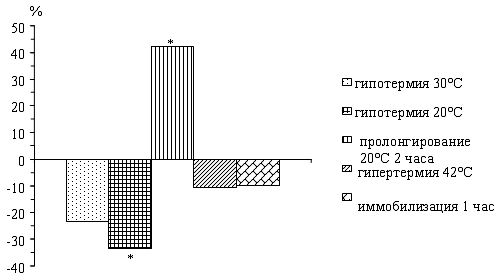
Рис 12. Динамика изменения (в % по отношению к
контролю) общей активности нейтральных протеаз сыворотки крови крыс при разных
температурах тела.
Повышение общей активности нейтральных протеаз
при пролонгировании глубокой гипотермии, возможно, связано с повышением
концентрации ионов Са2+ в клетке. Поддержание физиологических концентраций Са2+
в цитозоле можно считать важнейшей функцией клетки (Иванов и др., 1999).
Содержание Са2+ в межклеточной жидкости в 10-20
тысяч раз больше, чем в цитозоле и составляет около 10-8 М. Однако, при этом
ионы кальция играют ключевую роль в регуляции различных процессов
внутриклеточного метаболизма. (Siesjo, Bengtsson, 1989). Поэтому Са2+ постоянно
перемещается в клетку из межклеточной среды через определенные каналы в
клеточной мембране.
Известно, что при гипотермии угнетаются процессы
синтеза АТФ, наступает дефицит энергии и замедляется транспорт Са2+ из цитозоля
в межклеточную среду. Незначительное (с 10-8 М в норме до 10-6 М) повышение
Са2+ в цитозоле приводит к активации различных протеолитических и
липолитических ферментов в клетке (Hochachka, Somero, 2002).
Таким образом, полученные нами результаты
относительно повышения общей активности нейтральных протеаз при пролонгировании
глубокой гипотермии, возможно, коррелируют с накоплением ионов Са2+ и,
соответственно, с повышением активности Са2+ - зависимой нейтральной протеазы.
В связи с вышеприведенными данными значительный интерес представляет
исследование Са2+ - зависимой активности нейтральных протеаз ферментов
кальпаиновой системы.
.3.2 Автолитическая активность тканей мозга и
печени крыс при
гипотермических состояниях
Автолитической активность нейтральных протеаз
определена в мозгу и печени крыс в норме, при умеренной гипотермии 30ºС
по достижении, при пролонгировании умеренной гипотермии 30ºС
в течении трех часов и при пролонгировании глубокой гипотермии 20ºС
в течении двух часов. Активность автолиза измерялась при следующих температурах
инкубации: 10, 20, 30 и 37ºС.
Если протеолитическая активность подразумевает
распад экзогенного субстрата - казеина, то в данном случае происходит распад
внутриклеточных эндогенных белковых субстратов.
В мозгу контрольных (нормотермических животных)
активность автолиза наиболее выражена при 30ºС.
Охлаждение крыс до температуры тела 30ºС
не приводит к измению автолиза в мозгу и в печени. Пролонгирование этого
состояния в течение трех часов по-разному сказывается на температурной
зависимости автолиза в этих тканях. Так, в мозгу температурная зависимость
автолиза ниже, чем в норме, а в печени, наоборот картина температурной
зависимости представлена кривой, характеризующей высокую активность автолиза
при всех температурах инкубации.
Таким образом, можно говорить о тканевой
специфичности атакуемости эндогенных субстратов нейтральными протеазами мозга и
печени.
Результаты наших исследований показали, что в
норме максимальная автолитическая активность нейтральных протеаз также, как и
протеолитическая, наблюдается в печени при температуре инкубации 37ºС.
Общим с протеолитической активностью нейтральных протеаз также является то, что
при пролонгировании глубокой гипотермии 20ºС
в течении двух часов автолитическая активность повышается как в мозгу, так и в
печени крыс (в печени повышение достоверно).
Кроме того, наблюдается тканевая специфичность
активности автолиза: в печени контрольных крыс автолитическая активность при 37ºС
ниже, чем при гипотермических состояниях; в мозгу - при гипотермии 30ºС
по достижении и при пролонгировании глубокой гипотермии активность нейтральных
протеаз выше относительно контроля, а при пролонгировании умеренной гипотермии
- ниже. Можно сказать, что в печени при всех состояниях, за исключением
трехчасовой умеренной гипотермии 30ºС,
в промежутке от 10 до 20ºС
достоверных изменений нет.
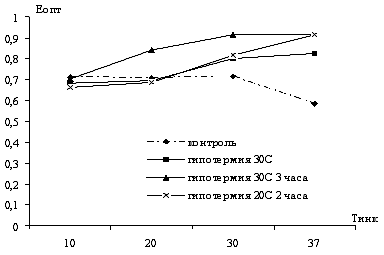
Рис. Температурная зависимость автолитической
активности нейтральных протеаз в печени крыс при гипотермии
При температуре инкубации 30ºС
изменения автолитической активности также недостоверны, за исключением
умеренной гипотермии в течение трех часов, где активность повышается на 28%.
При температуре инкубации 37ºС
при гипотермии 30ºС по
достижении, активность нейтральных протеаз повышается на 41%, при
пролонгировании умеренной гипотермии - на 56%, при пролонгировании глубокой
гипотермии также на 56%.
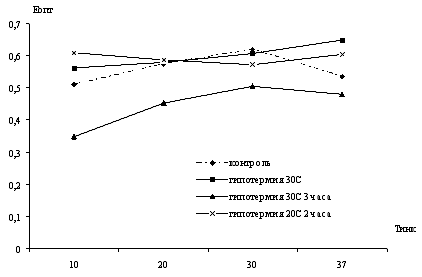
Рис. Температурная зависимость автолитической
активности нейтральных протеаз в мозгу крыс при гипотермии
В мозгу наблюдается совершенно иная картина. Уже
при температуре инкубации 10ºС
пролонгирование умеренной гипотермии вызывает снижение автолитической
активности нейтральных протеаз на 31%, гипотермия 30ºС
по достижении вызывает повышение. При температуре инкубации 20ºС
автолитическая активность при всех состояниях находится на одинаково повышенном
уровне относительно активности нейтральных протеаз при пролонгировании
умеренной гипотермии. При 30ºС
также нет достоверных изменений при всех этих состояниях.
Интересным является то, что характер кривых при
пролонгировании умеренной гипотермии схож как в мозгу, так и в печени.
Изменение автолитической активности в тканях
может быть связано либо с конформационными изменениями белковых субстратов и их
атакуемостью протеиназами, либо активацией самих нейтральных протеаз.
Известно, что в белках мозга гипотермических
животных наблюдаются характерные изменения в содержании амидных групп. Уже на
начальных этапах гипотермии изменяется соотношение лабильного и
прочносвязанного амидного азота, суммарных и водорастворимых белков мозга
(Эмирбеков, Львова, 1985).
Охлаждение организма приводит к модификации
белковых молекул мозга, которое выражается в изменении их аминокислотного
состава и высших структурных категорий (Эмирбеков и др., 1980).
.4 Са2+ - зависимая активность нейтральных
протеаз в тканях крыс
при гипотермии
Результаты исследования изменения активности
Са2+ - зависимой нейтральной протеазы представлены в таблице 4. Максимальная
активность ферментов кальпаиновой системы обнаруживается в сердце и составляет
52.4±2.7 мкМоль тирозина/мг белка (рис. 13).
Если принять контрольное значение активности
кальпаинов в сердечной мышце за 100%, то в мозгу, печени и сыворотке крови она
составляет 44, 62.5 и 20.6%, соответственно.

Рис. 13. Активность Са2+-зависимой нейтральной
протеазы в сердечной мышце крыс при разных температурах тела. Здесь и далее: *
- достоверность различий относительно контроля.
Таблица 4 Активность Са2+ -зависимой нейтральной
протеазы в тканях и сыворотке крови (мкмоль тирозина/мг белка) крыс (n=6)
|
Ткани
|
Контроль
37°C
|
Гипотермия
30-33°С
|
Гипотермия
18-20°С
|
Пролонгирование
гип.20°С 2 часа
|
Гипертермия
42°С
|
|
мозг
|
23.3±0.6
|
19.8±1.3
Р1<0.025
|
7.2±0.9
Р1<0.001 Р2<0.001
|
25.3±0.3
Р1<0.01 Р2<0.001
|
19.0±0.9
Р1<0.01
|
|
сердце
|
52.4±2.7
|
40.3±4.0
Р1<0.05
|
21.6±1.8
Р1<0.001 Р2<0.001
|
51.5±0.6
Р2<0.001
|
21.3±0.7
Р1<0.001
|
|
печень
|
32.8±2.1
|
26.6±0.8
Р1<0.05
|
14.4±1.3
Р1<0.001 Р2<0.001
|
32.0±0.4
Р2<0.001
|
18.5±0.4
Р1<0.001
|
|
кровь
|
10.8±0.6
|
7.7±0.4
Р1<0.01
|
8.5±0.4
Р1<0.01
|
8.6±0.09
Р1<0.05
|
7.0±0.4
Р1<0.01
|
- значение достоверно относительно контроля-
значение достоверно относительно предыдущего этапа гипотермии
Умеренная гипотермия 30-33°С вызывает снижение
активности ферментов относительно контроля на 23%.
Глубокая гипотермия 18-20°С приводит к
дальнейшему снижению активности кальпаинов в сердечной мышце крыс на 58.7%.
Гипертермия 42°С вызывает также снижение относительно контроля на 59%.
Пролонгирование глубокой гипотермии в течении
2-х часов приводит к повышению активности кальпаина сердечной мышцы на 138%,
относительно глубокой гипотермии.
В сердечной мышце выделена Са2+ - зависимая
нейтральная протеаза, обладающая энкефалиназной активностью. В то же время
известно, что энкефалины способны включаться в механизмы формирования и
регуляции ответа организма на чрезвычайные воздействия (Лишманов и др., 1992),
что, видимо, и происходит при 2х часовом пролонгировании глубокой гипотермии.
В мозгу активность кальпаинов составляет 23.28±0.6
мкмоль тирозина/мг белка.
Основные функции кальпаинов мозга, очевидно,
связаны с ограниченным протеолизом определенных цитоплазматических и мембранных
белков, включая белки рецепторы и протеинкиназу С, а также белков цитоскелета
клетки, выполняющих важную роль в регуляции внутриклеточного метаболизма.
Кальпаины мозга участвуют также в реализации таких функций нейронов, как
аксональный транспорт, трансмембранная передача сигнала, долговременная память
и др. (Seubert et al., 1988).
Ключевая роль кальпаинов в нервной системе
определяется в большей степени тем, что эти пептидгидролазы характеризуются
двойной системой контроля их активности; одной, общей для всех протеолитических
ферментов и обеспечиваемой специфическими эндогенными ингибиторами и реактивными
предшественниками ферментов, и другой - регулируемой концентрацией эндогенного
Са2+. Сочетание в первичной структуре Са2+ - зависимой нейтральной протеазы
протеолитического и Са2+ - связывающего доменов, по-видимому, дает возможность
строго регулировать активность фермента и включать его в обмен в зоне
локального повышения концентрации Са2+, определяя тем самым топографию и
временный контроль биологического процесса (Азарян, 1989).
При умеренной 30-33°С и глубокой 18-20°С
гипотермии, а также гипертермии 42°С активность кальпаинов мозга понижается на
15%, 69% и 19%, соответственно (рис. 14).
Пролонгирование глубокой гипотермии 18-20°С в
течение 2-х часов вызывает почти 3х кратное увеличение активности кальпаинов
относительно глубокой гипотермии.
Поскольку активация Са2+ - зависимых нейтральных
протеаз происходит при увеличении концентрации ионов Са2+ в примембранной
области до 100 и более мкмоль, то полученные нами результаты могут
свидетельствовать об ингибировании активности Са2+-АТФазы, с помощью которой
осуществляется перемещение каждого иона Са2+ из цитозоля в межклеточную среду
(Иванов и др., 1999).
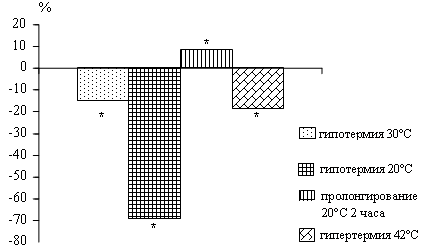
Рис. 14. Динамика изменения (в % по отношению к
контролю) активности Са2+- зависимой нейтральной протеазы в мозгу крыс при
разных температурах тела.
Са2+ - АТФаза необходима для снижения
внутриклеточного Са2+ до низких уровней, что достигается за счет энергии АТФ.
Этот насос обладает высоким сродством к Са2+, но довольно низкой транспортной
способностью (около 0.5 нМоль Са2+/мг белка в 1с). Фермент активируется
кальмодулином, а также кислыми фосфолипидами и ненасыщенными длинноцепочечными
жирными кислотами. Утверждается, что различные гормоны, такие как тироксин,
окситоцин и инсулин, ингибируют помпу в зависимости от ткани и
экспериментальных условий (Сарис, Карафоли, 2005).
Согласно литературным данным, при умеренной
активации Са2+ - зависимых нейтральных протеаз, осуществляющих ограниченный
протеолиз нейроспецифических белков цитоскелета нейронов (в том числе основного
структурного компонента синаптосомальных мембран - фодрина), происходит
демаскировка и увеличение количества NMDA-рецепторов глутамата, что
способствует развитию гипервозбуждения. Дальнейшее увеличение свободного Са2+ и
активация Са2+ - зависимых нейтральных протеаз может стать причиной деструкции
цитоскелета и последующей гибели нейронов (Менджерицкий и др., 1995).
Кроме того, при увеличении концентрации Са2+
происходит связывание глутаминовой кислоты специфическими рецепторами
плазматических мембран клеток гиппокампа крыс. Оно сопровождается расщеплением
фодрина - спектринподобного белка, локализованного на внутренней поверхности
плазматических мембран нервных клеток, и таким образом регулируется
пластичность мембран (Ivanov, 1997).
В печени крыс активность кальпаинов (Са2+ -
зависимых нейтральных протеаз) составляет 32.76±2.1 мкмоль тирозина/мг белка.
При умеренной 30-33°С, глубокой 18-20°С гипотермии, а также гипертермии 42°С
активность кальпаинов понижается относительно контроля на 19, 56 и 43 %, соответственно
(рис.15). Пролонгирование глубокой гипотермии в течение 2-х часов вызывает
повышение активности фермента на 122% относительно глубокой гипотермии, и не
изменяет ее по сравнению с контролем.
Кальпаины катализируют образование кининов,
участвующих в воспалительных процессах и с помощью ограниченного протеолиза
активируют триптофангидроксилазу клеток печени животных, регулирующую биосинтез
серотонина (Сологуб, Пашковская, 1988).
Согласно данным Демина и соавторов (1988),
сдвиги метаболизма серотонина в головном мозгу при принудительном охлаждении
организма крыс сопровождаются не повышением, а понижением функциональной
активности серотонинергических структур головного мозга.
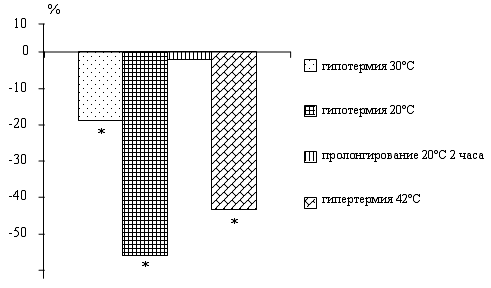
Рис. 15. Динамика изменения (в % по отношению к
контролю) Са2+- зависимой активности нейтральных протеаз в печени крыс при
разных температурах тела.
При умеренной 30-33°С, глубокой 18-20°С
гипотермии, пролонгировании глубокой гипотермии в течение 2-х часов, а также
гипертермии 42°С происходит падение активности кальпаинов сыворотки крови на 20
- 35% относительно контрольных данных (рис. 16).
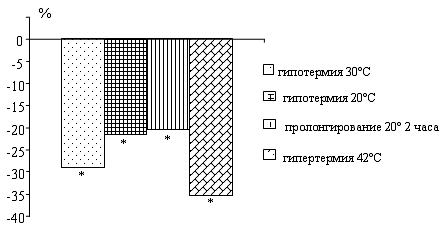
Рис. 16. Динамика изменения (в % по отношению к
контролю) Са2+- зависимой активности нейтральных протеаз в сыворотке крови крыс
при разных температурах тела.
Совпадение изменений содержания в крови Са2+ с
возникновением и ослаблением физиологических эффектов подтверждает
предположения о решающей роли этих ионов в угнетении и восстановлении
физиологических функций охлажденного организма. С физиологической точки зрения
особенно важным является тот факт, что резкую стимуляцию физиологических
функций у охлажденных животных вызывает весьма небольшое снижение содержания
Са2+ в крови. Имеются данные об индуцированном кальцием протеолизе спектрина и
некоторых других белков мембран эритроцитов животных (Иванов и др., 1999).
.5 Активность глицилглицин-дипептидазы в мозгу и
печени сусликов
Особую группу ферментов, осуществляющих
заключительные стадии гидролиза белков, составляют дипептидазы, относящиеся к
экзогидролазам. Дипептидазы ответственны за пополнение фонда свободных
аминокислот для метаболических потребностей организма и имеют особое значение
для нервной ткани. Одним из представителей данной группы ферментов, активность
которого максимальна при нейтральном значении рН, является
глицилглицин-дипептидаза (3.4.13.1).,обладающий строгой субстратной
специфичностью (Цыперович, Авдеев,1978). Конечным продуктом его работыявляется
глицин, входящий в состав многих белков и биологически активных соединений
(Gomeza et al., 2003). Функция глицилглицин-дипептидазы нервной ткани
заключается в регуляции уровня глицина в зависимости от ее метаболических
потребностей. Глицин также является нейромедиаторной аминокислотой. Рецепторы к
глицину имеются во многих участках головного мозга и спинного мозга и оказывают
«тормозное» воздействие на нейроны, уменьшают выделение из нейронов
«возбуждающих» аминокислот, таких, как глутаминовая кислота, и повышают
выделение ГАМК (Li, Han, 2006). Аминокислота глицин служит медиатором в
некоторых случаях постсинаптического торможения в спинном мозге. В головном
мозге большая плотность глициновых рецепторов обнаружена не только в структурах
ствола, но и в коре больших полушарий, стриатуме, ядрах гипоталамуса, проводниках
от лобной коры к гипоталамусу, мозжечке (Watanabe et al., 1992). Рецепторы
глицина и ГАМК составляют, вероятно, половину всех синаптических рецепторов
мозга. Пресинаптические нервные окончания имеют транспортную систему, которая
характеризуется высоким сродством к глицину, но не к какой либо другой
аминокислоте. Эта система возвращает глицин из синаптической щели.
Нами исследована активность
глицилглицин-дипептидазы в головном мозгу (больших полушариях) и печени
неспавших зимой и пробуждающихся весной сусликов. Так как, температура тела
пробуждающегося суслика 10ºС,
а неспавшего - 37ºС, то нами
были выбраны соответствующие температуры инкубации тканей.
Как видно из таблицы 5, при 10ºС,
температуре, при которой суслики обычно зимой находятся в торпидном состоянии,
активность глицилглицин-дипептидазы высокая, независимо от того спали зверьки
или нет.
В больших полушариях головного мозга суслика
активность фермента у неспавших зимой и пробуждающихся после спячки, не
отличается, хотя эта температура соответствует температуре тела пробуждающегося
суслика (для них она «истинная»).
Таблица 5 Активность глицилглицин-дипептидазы в
тканях суслика в мкмоль глицина на мг белка за 30 минут инкубации (n=4-5)
|
Состояние
животных
|
Температура
инкубации ткани
|
|
10ºС
|
37ºС
|
|
Неспавшие
зимой
|
Большие
полушария
|
|
5.8±0.57
|
8.5±0.62
Р1<0.01
|
|
Пробуждающиеся
после спячки (tтº =10°С)
|
5.2±0.25
|
6.9±0.5
|
|
Неспавшие
зимой
|
печень
|
|
4.2±0.20
|
17.3±0.75
Р1<0.001
|
|
Пробуждающиеся
после спячки (tтº =10°С)
|
6.5±0.50
|
7.8±0.45
Р2<0.001
|
Р1 - значение достоверно относительно инкубации
10ºС
Р2 - значение достоверно относительно неспавших
сусликов (инкубация 37ºС)
«Оптимальная» активность
глицилглицин-дипептидазы, измеренная при 37ºС
отличается незначительно в обеих сериях исследования (у неспавших сусликов она
выше на 23%, но р>0.05). У сусликов пробуждающихся после спячки разница
между «оптимальной» и «истинной» активностью фермента составляет 38%, а у
неспавших - 45%.
Таким образом, активность
глицилглицин-дипептидазы в больших полушариях головного мозга не зависит от
температуры инкубации как у сусликов переживших зиму в тепле и на пищевом
рационе и не уснувших, так и у тех, которые просыпались после зимней спячки, и
температура тела на момент исследования была 10ºС.
Низкую активность данного фермента в мозгу
пробуждающихся сусликов можно объяснить тем, что в физиологическом состоянии,
видимо, потребность в потенциально тормозном медиаторе предельно низка,
поскольку глицин может препятствовать выходу животных из спячки. Однако,
определенный уровень глицина в тканях уже необходим, так как глицин является
источником синтеза очень важных для организма биоорганических молекул.
В печеночной ткани полученные результаты
активности глицилглицин-дипептидазы для обеих групп животных отличаются. У пробуждающихся
сусликов «истинная» и «оптимальная» активность (при 37ºС)
отличаются лишь на 21% (р>0.05). Также как и в мозгу, здесь не соблюдается
температурная зависимость дипептидазной активности. У неспавших животных тем
пературная зависимость активности глицилглицин-дипептидазы в печени при 37ºС
выше, чем при 10ºС в 4.3
раза.
Сравнение «истинной» и «оптимальной» активности
глицилглицин-дипептидазы обеих групп животных показало, что в печени
пробуждающихся сусликов «истинная» активность выше на 61.5%, а «оптимальная»
активность в 2.2 раза ниже, чем у неспавших сусликов.
Высокую активность глицилглицин-дипептидазы в
печени при 37ºС можно объяснить
высокой скоростью обновления белков в этом органе. Кроме того, глицин,
образующийся из дипептида, включается во множество метаболических циклов
происходящих в печени. Вступая во взаимодействие с определенными веществами,
эта аминокислота становится строительным материалом для выработки протеинов,
ферментов, гормонов, а также иных, необходимых для организма, веществ (Gusev et
al., 2000). Глицин является «сырьем» для образования порфиринов и пуринов в
организме, связывает низкомолекулярные токсические продукты (альдегиды, кетоны)
(Лаврецкая, 1985).
3.6 Температурная зависимость активности
нейтральных протеаз
печени сусликов при зимней спячке и в ходе
индуцированного
пробуждения
Температура влияет не только на константы
скоростей биохимических реакций, но часто вызывает также существенный сдвиг их
равновесия. Это касается в особенности тех реакций, в которых происходит
обратимое образование нековалентных («слабых») связей (Yong, Sladen, 1996).
При той или иной температуре лишь небольшая доля
всех молекул обладает достаточной энергией, чтобы вступить в реакцию, и
повышение температуры приводит к существенному увеличению этой доли. Энергия
реакционноспособных молекул должна быть равна или больше некоторой минимальной
энергии активации для данной реакции (Хочачко, Сомеро, 1988).
Причиной низкой скорости большинства
органических реакций является высокий энергетический барьер, который должны
преодолеть молекулы прежде, чем вступить в реакцию. Наиболее высокая точка
энергетической кривой обычно соответствует энергетически неблагоприятному
переходному состоянию. Фермент снижает энергию активации и направляет реакцию
по другому пути (Кольман, Рем, 2004).
Таким образом, взаимоотношения между скоростью
реакции, сдвигом температуры и энергией активацией можно считать одним из
важнейших способов адаптации к температуре. В связи с этим нами исследована
температурная зависимость активности нейтральных протеаз в печени сусликов
бодрствующих, при зимней спячке и на этапах индуцированного пробуждения после
двухмесячной спячки (табл.6). Для исследования температурной зависимости
активности ферментов выбрана печень в связи с тем, что в этом органе активность
нейтральных протеаз максимальна, и при низких температурах инкубации полученные
данные в отличие от значений в мозгу не являяются отрацательными.
У бодрствующих сусликов (независимо от сезона
года - лето, осень), температурная зависимость активности нейтральных протеаз
печени в Аррениусовских координатах представлена прямой и имеет энергию
активации (Ea) 26.8 кДж/моль (рис. 17).
Таблица 6 Температурная зависимость активности
нейтральных протеаз печени (мкмоль тирозина/г влажной ткани) сусликов (n=4-5)
|
Состояние
животных
|
Температура
инкубации:
|
|
10ºС
|
20ºС
|
30ºС
|
37ºС
|
40ºС
|
|
Бодрствующие
(июль) нормотермия 38°С
|
1.5±0.01
|
2.3±0.1
|
2.7±0.2
|
3.3±0.5
|
3.5±0.4
|
|
Бодрствующие
(сентябрь) нормотермия 38°С
|
7.2±0.5
|
8.5±0.5
|
12.3±0.4
|
13.2±0.9
|
14.4±0.9
|
|
1
месяц спячки tтº =5-8°С
|
2.3±0.1
|
4.4±0.4
|
5.5±0.3
|
6.9±0.3
|
7.3±0.4
|
|
2
месяц спячки tтº =3-4°С
|
1.6±0.3
|
2.5±0.1
|
6.7±0.2
|
11.5±0.5
|
16.7±0.9
|
|
3
месяц спячки tтº =5-8°С
|
6.4±0.1
|
8.9±0.5
|
15.8±1.0
|
17.4±1.2
|
20.4±1.2
|
|
2
месяц спячки, самосогревание 10ºС
|
1.1±0.4
|
5.5±0.6
|
11.0±0.6
|
12.2±0.5
|
14.6±1.0
|
|
2
месяц спячки, самосогревание 20ºС
|
4.8±0.1
|
7.4±0.5
|
15.1±1.0
|
18.8±1.3
|
20.4±2.0
|
|
2
месяц спячки, самосогревание 25ºС
|
4.3±0.1
|
11.2±0.6
|
15.8±0.6
|
18.3±0.4
|
21.4±0.9
|
|
2
месяц спячки, самосогревание 30ºС
|
3.8±0.3
|
7.5±0.5
|
13.3±1.0
|
16.4±0.8
|
18.9±1.0
|
|
2
месяц спячки, самосогревание 37ºС
|
7.8±0.5
|
19.5±0.5
|
17.1±0.5
|
21.6±0.5
|
22.0±0.9
|
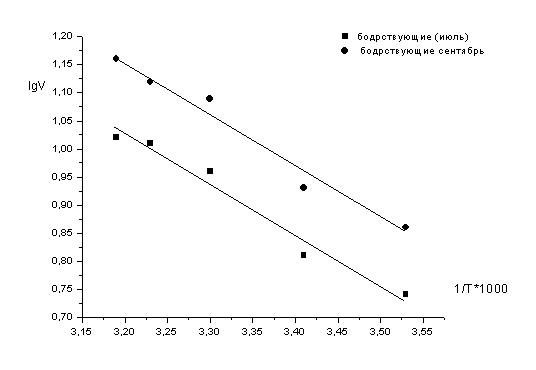
Рис. 17. Температурная зависимость активности
нейтральных протеаз печени бодрствующих сусликов.
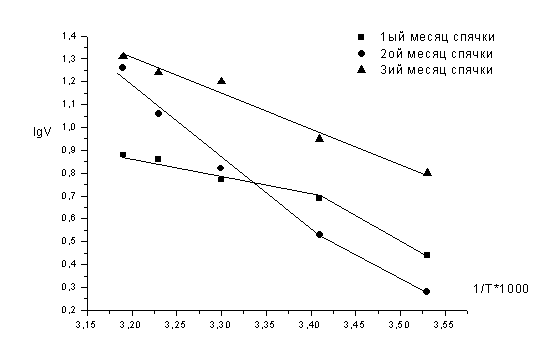
Рис. 18. Температурная зависимость активности
нейтральных протеаз печени сусликов в динамике зимней спячки.
Сравнение Аррениусовских кривых нейтральных
протеаз в печени крыс при глубокой спячке выявило, что независимо от
длительности гибернации (1 и 2 месяца) наблюдается излом при 20ºС,
а энергии активации выше и ниже точки излома меняются и соответственно равны:
после 1-го месяца спячки: 21 и 28.7 кДж/моль, а после 2-го месяца спячки: 66.9
и 34.4 кДж/моль.
К концу 3-го месяца спячки температурная
зависимость активности нейтральных протеаз печени суслика представлена прямой с
Еа= 32.5 кДж/моль.
Обращает на себя внимание тот факт, что энергия
активации после 2го месяца спячки увеличивается как выше, так и ниже точки
«перелома», что свидетельствует об увеличении температурной зависимости
фермента.
После 2-ого месяца мы исследовали активности
нейтральных протеаз печени суслика на этапах самосогревания после
индуцированного пробуждени.
Температурная зависимость общей активности
нейтральных протеаз, выраженная в Аррениусовских координатах, при температуре
тела 10ºС
имеет излом при 30ºС: Еа выше
точки излома составляет 23.9 кДж/моль, ниже - 86 кДж/моль (рис. 19).
При повышении температуры тела суслика до 25ºС
точка излома соответствует 20ºС.
При этом выше точки излома Еа=21 кДж/моль, ниже - 84 кДж/моль (рис. 21).
Графики температурной зависимости активности
нейтральных протеаз при температуре тела животного 20ºС,
30ºС
и 37ºС
имеют прямую с энергией активации 44, 59.3 и 38.2 кДж/моль, соответственно
(рис. 20, 22, 23).
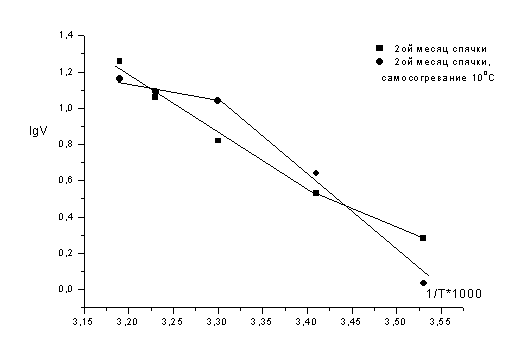
Рис. 19. Температурная зависимость общей активности
нейтральных протеаз печени сусликов после 2-го месяца спячки и дальнейшего
самосогревания до 10ºС.
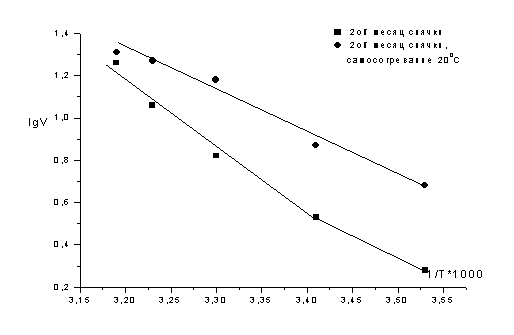
Рис. 20. Температурная зависимость общей
активности нейтральных протеаз печени сусликов после 2-го месяца спячки и
дальнейшего самосогревания до 20ºС.
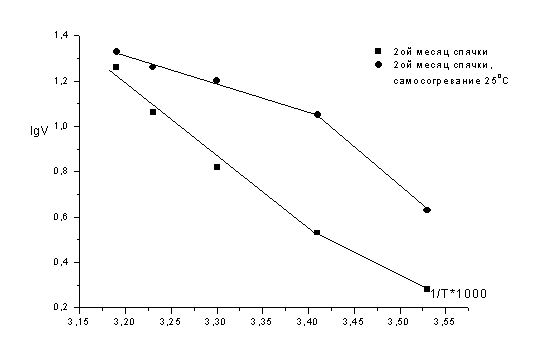
Рис. 21. Температурная зависимость общей
активности нейтральных протеаз печени сусликов после 2-го месяца спячки и
дальнейшего самосогревания до 25ºС.
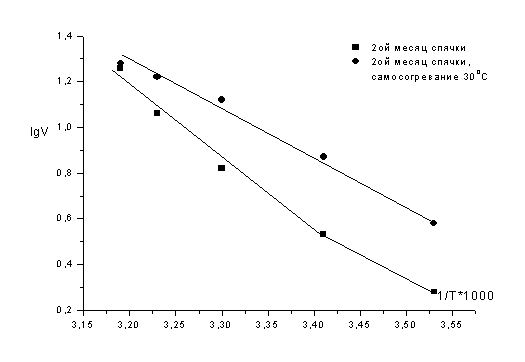
Рис. 22. Температурная зависимость общей
активности нейтральных протеаз печени сусликов после 2-го месяца спячки и
дальнейшего самосогревания до 30ºС.
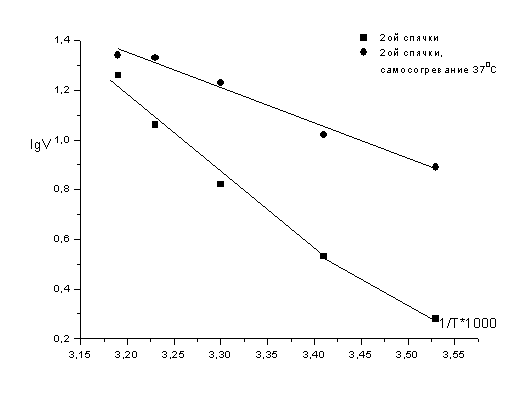
Рис. 23. Температурная зависимость общей
активности нейтральных протеаз печени сусликов после 2-го месяца спячки и
дальнейшего самосогревания до 37ºС.
Кроме того, обращает на себя внимание тот факт,
что характер Аррениусовских кривых у сусликов бодрствующих (лето и осень),
после 3-го месяца зимней спячки (t°=5-8°С), а также при самосогревании до 20°С,
30°С и 37°С, после индуцированного пробуждения, имеет общую закономерность.
После1-го и 2-го месяцев зимней спячки (когда температура тела максимально
снижена до -3-4°С) и на этапах последующего самосогревания (10°С, 25°С), резко
меняется характер и наклон Арениусовских кривых. Это может свидетельствовать
как о конформационных изменениях в молекуле белка, так и в его микроокружении.
Можно предположить, что в первом случае не изменяется характер молекул
фермента, а меняется лишь их число (к 3-му месяцу их число увеличивается).
Липидному составу мембран отводится важная роль
в устойчивости организма млекопитающих к действию низких температур
(Коломийцева и др., 2003). Имеются данные, что при зимней спячке у
млекопитающих увеличивается содержание ненасыщенных жирных кислот в
фосфолипидах различных органов и тканей. Вязкость липидов биологических мембран
регулируется рядом параметров, из которых важная роль принадлежит концентрации
холестерина.
Таким образом, учитывая, что при активации
кальпаинов происходит транслокация ферментов к мембране (Cuervo, Dice, 1998),
то их функционирование, как и других ферментов, связанных с мембраной, сильно
зависит от локальной вязкости микроокружения и изломы на Аррениусовских кривых,
возможно, вызваны фазовыми переходами мембранных липидов. Как мы видим, из
приведенных рисунков, при определенной «переломной» температуре наклон кривой
Аррениуса резко меняется, соответственно, меняется и энергия активации.
В основе всех этих температурных изменений
параметров активации и смещений точек излома, вероятно, лежит тот факт, что
ферментный белок «подвижен», т.е. имеет возможность изменять свою конформацию и
перемещаться к мембране во время катализа (Хочачка, Сомеро, 1988).
ЗАКЛЮЧЕНИЕ
Весьма своеобразным и интересным приспособлением
млекопитающих для переживания неблагоприятных условий является зимняя спячка.
(Kortner, Geiser, 2000). Уменьшение температуры тела при зимней спячке может
колебаться в очень широких пределах. Температура тела гибернирующих сусликов
поддерживается на несколько градусов выше температуры окружающей среды (Carey
et al., 2003). При этом биохимические процессы, работа органов и систем
организма гибернантов не тормозятся, а перестраиваются так, что даже при очень
низкой температуре тела поддерживается определенный гомеостаз (Карманова,
1995). Существенную роль в приспособлении клеток гетеротермных животных к
функционированию в различных температурных условиях может играть процесс
синтеза новых, или модификация структуры и функции имеющихся в клетке белков.
Особенности регуляции метаболизма у зимнеспящих связаны с повышением
регуляторной нагрузки продуктов деградаций белков - пептидов, аминокислот,
мочевины. (Горошинская и др., 1987). Значительную роль при адаптации клеточного
метаболизма к изменяющимся условиям окружающей среды и осуществлении защитных
функций организма играют протеолитические ферменты.
Результаты наших исследований показали, что у
сусликов в состоянии бодрствования и в динамике зимней спячки максимальная
активность нейтральных протеаз наблюдается в печени. Такая высокая активность
нейтральных протеаз, видимо, обусловлена функциональными и структурными
особенностями печени.
В динамике зимней спячки наблюдается следующая
закономерность в изменении общей активности нейтральных протеаз в тканях
сусликов: у бодрствующих животных (в сентябре) активность ферментов повышается
относительно бодрствующих в июле (в сердечной мышце и сыворотке крови повышение
достоверно); перед спячкой активность нейтральных протеаз постепенно снижается,
за исключением сердечной мышцы и сыворотки крови (в октябре общая активность
нейтральных протеаз в сыворотке крови выше относительно бодрствующих животных в
сентябре на 31%). В 1-ый месяц спячки общая активность нейтральных протеаз во
всех исследуемых тканях минимальна, в мозгу, она нулевая.
В состоянии гибернации резко замедляются
метаболические процессы, в том числе и синтез белка (Жегунов и др., 1993;
Storey, 2004). По данным Фрерихс с сотр. (Frerichs et al., 1998) скорость
синтеза белков в мозге сусликов при гибернации составляет всего 0.04% от его
уровня у активных животных. Интенсивность синтеза белков при этом снижается не
только за счет уменьшения скорости этого процесса, но и за счет полного
прекращения синтеза некоторых индивидуальных белков (Storey, 2004). Считают,
что снижение интенсивности белкового синтеза при гибернации связано с
необходимостью экономить энергетические ресурсы, когда уменьшается скорость
кровотока, содержание субстратов и потребление кислорода (Frerichs et al.,
1998; Storey, 2004).
По мере приближения выхода из спячки активность
начинает увеличиваться и достигает максимума в марте, перед пробуждением
(повышение в мозгу, печени и сердечной мышце составляет 82, 83 и 296%,
соответственно, относительно активности бодрствующих сусликов в июле).
Выход из спячки готовится заранее. Еще в
состоянии оцепенения в нейронах гиппокампа активным образом идет синтез,
накопление и выход в цитоплазму РНК. Резко повышается синтез белка (Гордон и
др., 1987).
Интенсификацию синтеза белка в тканях
пробужающихся сусликов можно связать с общей для всех клеток необходимостью
восполнения потерянных и измененнных во время зимней спячки функциональных и
структурных белков или же замены части энзимов на специфические изоформы,
необходимые при данной температуре (Жегунов, Микулинский, 1987).
В процессе пробуждения от гибернации в организме
происходят весьма сложные биохимические изменения, которые приводят к
значительному росту протеолитических ферментов при повышении температуры тела.
При индуцированном пробуждении общая активность
нейтральных протеаз тканей суслика по мере повышения температуры тела до 37°С
повышалась относительно торпидного состояния (t°=3-4°С) (в мозгу активность
повышается в 7 раз, в печени - на 88%, а в сердечной мышце - на 15%).
Достоверных различий в активности нейтральных протеаз в тканях сусликов от 20
до 30°С нет.
Характер Аррениусовских кривых температурной
зависимости активности нейтральных протеаз бодрствующих сусликов (лето и осень)
и после 1-го и 3-го месяцев спячки (t°=5-8°С) имеет слабо выраженную
температурную зависимость, что может говорить об изменении числа молекул
фермента. После 2-го месяца спячки (когда температура тела максимально снижена
- 3-4°С) и на этапах последующего самосогревания, резко меняется характер и
наклон Аррениусовских кривых. Это может свидетельствовать о конформационных
изменениях в молекуле фермента и его микроокружения. При определенной
«переломной» температуре наклон кривой Аррениуса (эта кривая связывает логарифм
скорости реакции с абсолютной температурой) резко меняется, что, возможно,
вызвано фазовыми переходами мембранных липидов. Вязкость липидов биологических
мембран регулируется рядом параметров, из которых важная роль принадлежит
концентрации холестерина. Состояние спячки характеризуется резким падением
количества холестерина (ХЛ) и общих фосфолипидов (ФЛ), падением величины
молярного отношения ХЛ/ФЛ, уменьшением количества фосфотидилхолина и
лизофофатидилхолина (Коломийцева и др., 2003).
У гипотермированных животных, как и у животных,
впадающих в зимнюю спячку, скорость метаболизма снижается по мере снижения
температуры тела (Kataoka, Yanase, 1998). Гипотермия вызывает существенные
изменения внутриклеточных структур и активности ферментных систем. Выраженность
этих изменений находится в прямой зависимости от глубины гипотермии. Изменения,
вызываемые гипотермией, обнаруживаются во всех изучаемых органах. Вместе с тем
установлено, что различные органы по-разному реагируют на глубину и скорость
охлаждения, т.е. в зависимости от конечной цели для каждого органа должен быть
определен свой «оптимум» охлаждения.
При умеренной, кратковременной гипотермии
30-33°С активность нейтральных протеаз снижается в сердечной мышце в 2 раза (на
57%), в печени на 21%, в мозгу на 28%, в сыворотке крови на 23%, однако
достоверно снижение только в сердце и печени.
Учитывая кратковременность воздействия и общую
реакцию всех тканей на умеренную гипотермию, нами проведена серия по
кратковременному воздействию гипертермии (42°С). При этом направленность и
выраженность изменений общей активности нейтральных протеаз при умеренной
гипотермии 30-33°С и гипертермии 42°С - совпадают, только в печени она снижена
более, чем в 2 раза.
Таким образом, можно полагать, что наблюдаемые
изменения общей активности нейтральных протеаз как при кратковременном снижении
температуры тела, так и его повышении являются результатом неспецифической
реакции на стресс.
Влияние температурного фактора, видимо,
сказывается при более длительном воздействии - глубоком охлаждении до 18-20°С.
Как видно из табл. 3 и рис. 9, при глубокой гипотермии наблюдается более чем в
2 раза снижение общей активности нейтральных протеаз в мозгу, в крови снижение
тоже достоверно, в отличие от умеренной гипотермии.
Гипотермия оказывает влияние на все органы,
системы органов и ткани животных, а степень воздействия зависит от глубины и
длительности охлаждения. (Sessler, 1997). Глубокая гипотермия защищает головной
и спинной мозг от гипоксии за счет снижения уровня метаболизма (Bashet, Guilmet,
2002). В последнее время доказано, что это свойство проявляется и при умеренной
гипотермии, т.е. при снижении температуры тела на 1-3°С, что может быть
использовано во время нейрохирургических и сосудистых операций (Sakurai et al.,
2005).
В компенсации температурных сдвигов метаболизма
при гипотермических состояниях на первое место выступают адаптивные изменения
каталитической активности ферментов. У строгих гомойотеров температуры тела в
норме поддерживается на определенном уровне, физико-химические свойства
ферментов соответствуют этому температурному уровню (38±4°С). Существенным
признаком адаптивности изменений их активности является способность
поддерживать функционально необходимую величину интенсивности определенных
метаболических реакций при более низких температурах (Демин и др., 1988).
Анализ научной литературы показывает, что при
гипотермии обновление белков тормозится несравненно резче, чем обновление
веществ имеющих энергетическое значение. Так, при понижении температуры тела на
каждые 10°С скорость обновляемости белков мозга снижается примерно на 62%
(Mortensen, Dale, 1995).
Можно утверждать, что полученные при глубокой
гипотермии результаты связаны с температурным фактором, так как нахождение
животных в холодовой камере в течение 1 часа (иммобилизационный стресс), не
влияет на общую активность нейтральных протеаз в тканях по сравнению с
контролем, за исключением печени, в которой активность ферментов снижена на
27%. Оказалось, что именно сердце и печень наиболее чувствительны к стрессам:
сердце к кратковременным, а печень - и к кратковременным, и к более длительным.
Главной причиной стрессорного повреждения сердца
является неадекватно сильная и стойкая активация симпатоадреналовой системы.
При действии на организм экстремальных факторов происходит возбуждение высших
вегетативных центров, детерминирующих активацию этой системы (Панин, 1983).
Стимуляция α-
и β-адренорецепторов
способствует избыточному поступлению в кардиомицеты ионов кальция и усилению
биосинтеза цАМФ.
Эти внутриклеточные мессенджеры обеспечивают
реализацию так называемой липидной триады, состоящей из активации ПОЛ,
фосфолипаз и свободных жирных кислот, оказывающих детергентное действие на
клеточные мембраны (Лишманов и др., 1997).
При пролонгировании глубокой гипотермии наблюдается
значительное повышение общей активности нейтральных протеаз, что, возможно,
коррелирует с накоплением ионов Са2+ и, соответственно, повышением активности
Са2+ - зависимой нейтральной протеазы. Для проверки этой гипотезы нами
исследована Са2+ - зависимая активность нейтральных протеаз ферментов
кальпаиновой системы, при тех же экспериментальных условиях. В данном случае
также происходит максимальное снижение активности фермента во всех исследуемых
тканях и сыворотке крови при глубокой гипотермии 18-20°С, относительно контроля
и повышение активности кальпаина при пролонгировании глубокой гипотермии в
течении 2-х часов, относительно предыдущего этапа охлаждения, за исключением
сыворотки крови, в которой между различными температурными воздействиями нет
достоверных различий. Возможно, это обусловлено тем, что содержание Са2+ в
крови считается наиболее постоянной величиной среди биохимических параметров.
Учитывая тесную взаимосвязь нейтральных протеаз
с регуляторными пептидами и, в частности - с энкефалинами, можно предположить,
что изменение общей активности нейтральных протеаз, при различных
физиологических состояниях (зимней спячке и гипотермии), является неотъемлемой
частью биологического действия этих пептидов, в определенной степени
объясняющей индивидуальные особенности их физиологических свойств в организме.
ВЫВОДЫ
. Общая активность нейтральных протеаз
бодрствующих сусликов, осенью, повышается в мозгу, печени и сердечной мышце. К
началу спячки активность ферментов в исследуемых тканях снижается и достигает
своего минимума к 1-му месяцу гибернации (в мозгу она в этот период
отсутствует). После 1-го месяца спячки активность ферментов в тканях начинает
увеличиваться и к моменту выхода из спячки максимально повышается относительно
бодрствующих и спящих сусликов.
. Индуцированное пробуждение в середине баута
2-го месяца спячки приводит к различным изменениям общей активности нейтральных
протеаз в тканях сусликов: в мозгу уже при температуре тела 10°С происходит
достоверное повышение активности ферментов в 4 раза, а в печени и сердце
изменений нет. Дальнейшее самосогревание сусликов до 20°С повышает активность
ферментов в мозгу в 6 раз, в печени - на 60%, а в сердце - на 27%. При
температурах тела 20, 25 и 30°С общая активность нейтральных протеаз как в мозгу,
так и в печени и сердце находится на одном уровне. Достижение температуры тела
37°С повышает активность ферментов в мозгу в 8 раз, а в печени - в 1.8 раз по
сравнению с торпидным состоянием. В сердечной мышце на всем протяжении
самосогревания от 3-4°С до 37°С отмечается лишь незначительное повышение общей
активности нейтральных протеаз.
. Умеренная гипотермия крыс (30-33ºС)
приводит к снижению общей протеолитической активности нейтральных протеаз в
мозгу, печени и сердечной мышце, наибольшее снижение (в 2.3 раза) в сердечной
мышце. Глубокая гипотермия (18-20ºС)
приводит к дальнейшему снижению активности ферментов во всех тканях, кроме
сердца, где активность фермента осталась на уровне умеренной гипотермии.
Пролонгирование глубокой гипотермии в течение 2-х часов вызывает многократное
повышение активности ферментов относительно глубокой гипотермии: в мозгу - в
4.5 раза, в сердце - в 4 раза, а в печени и сыворотке крови - в 2 раза.
Отмечено двукратное повышение активности нейтральных протеаз относительно контроля
во всех тканях, за исключением печени, где она не достигает уровня контроля.
. Температурная зависимость автолитической
активности нейтральных протеаз после трехчасовой умеренной гипотермии имеет
тканевую специфичность.
. Активность ферментов кальпаиновой системы
мозга, печени и сердечной мышцы крыс при умеренной (30-33ºС)
и глубокой (18-20ºС)
гипотермии соответствует изменениям общей активности нейтральных протеаз.
Пролонгирование глубокой гипотермии в течение 2-х часов приводит к повышению
активности фермента относительно предыдущего этапа охлаждения, но не
относительно контроля.
В сыворотке крови при изменении температуры тела
достоверных различий в активности кальпаинов нет.
. Температурная зависимость общей активности
нейтральных протеаз печени бодрствующих сусликов (независимо от сезона года)
представлена прямой с Еа=26.8 кДж/моль. При глубокой спячке, независимо от
длительности (1-ый и 2-ой месяцы), на Аррениусовских кривых имеется излом при
20ºС.
По мере самосогревания сусликов после индуцированного пробуждения (10ºС
и 25ºС),
точки изломов на Аррениусовских кривых меняются и, соответственно, меняются их
энергии активации. При самосогревании до 20ºС,
30ºС
и 37ºС
графики температурной зависимости общей активности нейтральных протеаз
представлены прямыми также, как и у бодрствующих сусликов.
. У пробуждающихся сусликов «истинная» и
«оптимальная» активность глицилглицин-дипептидазы как в мозгу, так и в печени
не отличается. В печени неспавших сусликов «оптимальная» активность фермента
(при 37ºС)
выше, чем «истинная» (при 10ºС)
в 4 раза.
СПИСОК ЛИТЕРАТУРЫ
1. Азарян
А.В. Пептидгидролазы нервной ткани и их биологические функции. - Ереван:
Айастан, 1989. - 208 с.
2. Алейникова
Т.Л., Рубцова Г.В. Биохимия. Руководство к практическим занятиям по биологической
химии. - М.: Высшая школа, 1988. - 239с.
. Антонов
В.К. Химия протеолиза. - Москва: Наука, 1991. - 503 с.
. Бадалян
Л.О., Скворцов И.А. Клиническая электронейромиография (руководство для врачей).
- Москва: Медицина, 1986. - 368 с.
. Бенделик
Е.К., Доценко В.Л., Немкова Е.А., Мошетова Л.К., Яровая Г.А. Общая
трипсиноподобная, эластазоподобная и антриптическая активность у пациентов с
контузией глаза // Вопросы мед. химии. - 1999. - №. 4. - С. 2-9.
. Бернштейн
В.А. Гипотермия и мозг // Успехи физиологических наук. - 1971. - Т. 2. - №2. -
С.49-67.
. Веремеенко
К.И., Голобородько О.П., Кизим А.И. Протеолиз в норме и патологии. - Киев,
1988. - 250 с.
. Винокурова
С.В., Дилакян Э.А., Гуреева Т.А., Киселева Н.П., Соловьева Н.И. Коллагеназы IV
типа и их эндогенные регуляторы при иммортализации и трансформации фиброластов.
- V симпозиум «Химия протеолитических ферментов». - Москва, 2002. - 89 с.
. Гельцер
Б.И., Жилкова Н.Н. Активность калликреин-кининовой системы у больных витамин
В12 - дефицитной анемией // Бюллетень СО РАМН. - 2005. - Т.113. - №3. -
С.131-134.
. Головина
Т.Н., Маликов У.М., Шортанова Т.Х., Демин Н.Н. Белки и РНК в системе
нейрон-нейроглия дорзального ядра шва головного мозга суслика в динамике зимней
спячки // Физиол. журн. СССР. - 1985. - Т.7. - № 8. - С.945-951.
. Гомазков
О.А. Современные тенденции в исследовании физиологически активных пептидов //
Успехи совр. биологии. - 1996. - Т.116. - № 1. - С. 60-68.
. Гордон
Р.Я., Богарова Л.С., Попов В.И., Корнаухов В.Н. Структурно - функциональные основы
метаболизма РНК в мозге зимнеспящих в период зимней спячки. В кн.: Механизмы
зимней спячки. - Пущино, 1987. - С.168-175.
. Горошинская
И.А., Ананян А.А., Могильницкая Г.В., Шугалей В.С. Биохимические показатели
холодового стресса и адаптации // Вопросы мед. химии. - 1987. - №. 4. - С.
62-65.
. Громакова
И.А., Коноваленкова О.А. Лизосомальный протеолиз: влияние возраста и инсулина
// Биохимия. - 2003. - Т.63. - № 7. - С.941-945.
. Гуляева
Н.В. Неапоптические функции каспазы 3 в нервной ткани // Биохимия. - 2003. -
Т.68. - № 11. - С. 1459-1470.
. Гусейнов
Г.О. Амидные группы белков мозга гомойотермных животных при гипотермии и зимней
спячке // Автореферат. Ростов-на-Дону, 1992. - 24 с.
. Демин
Н.Н., Шортанова Т.Х., Эмирбеков Э.З. Нейрохимия зимней спячки млекопитающих.-
Ленинград: Наука, 1988. - 136 с.
. Дилакян
Э.А. Цистеиновые протеиназы при неопластической трансформации. Симпозиум
«Структура и функция протеолитических ферментов» // Вопросы мед. химии. - 2000.
- Т.46. - № 5. - С. 490-491.
. Дилакян
Э.А. Цистеиновые протеиназы при неопластической трансформации // Вопросы мед.
химии. - 2000. - №. 5. - С. 13-14.
. Дин
Р. Процессы распада в клетке: пер. с английского. - Москва. - 1981 - 120 с.
. Жегунов
Г.Ф., Микулинский Ю.Е, Синтез белка в тканях зимоспящих животных при
пробуждении. Механизмы зимней спячки. - Пущино, 1987. - С.70-71.
. Жегунов
Г.Ф. Биохимические и ультраструктурные основы функциональной активности сердца
зимоспящих животных: Дис. …докт.биол.наук. - - Харьков, 1990. - 265 с.
. Жегунов
Г.Ф., Джордан М., Вонд Л. Синтез белков при искусственной гипотермии сусликов.
В кн.: Биохимические аспекты холодовых адаптаций. - Харьков, 1991. - С.57-62.
. Жегунов
Г.Ф., Вонг Л., Джордан М. Транспорт аминокислот и синтез белков у сусликов при
гибернации и искусственной гипотермии // Укр. биох. журнал. - 1993. - Т.65. -
№6. - С.25-29.
. Ефременко
Ю.Р., Конторщикова К.И. Протеолитические ферменты - как индикатор эффективности
лечения // Современные технологии в лабораторной диагностике. - 2006. - № 12. -
С. 63.
. Иванов
К.П., Арокина Н.К., Дидина С.Е., Волкова М.Ф. Содержание Са2+ в крови животных
и их устойчивость к холоду // Росс. физиол. журнал имени Сеченова. - 1999. - Т.
85. - №12. - С.1550-1559.
. Игнатьев
Д.А., Сухова Г.С., Сухов В.П. Анализ изменений частоты сердцебиений и
температуры суслика Citellus Undulatus в различных физиологических состояниях
// Общая биология. - 2001. - Т.62. - №1. - С. 66-77.
. Инжеваткин
Е.В., Савченко А.А., Альбрант А.И., Нефедов В.П. Исследование метаболических
изменений печени крыс в динамике восстановительного периода после
гипертермического воздействия // Вопросы мед.химии. - 2000. - №2. С.49-54.
. Исмаилов
И.А., Эмирбеков Э.З. Глутаминазная и глутаматдекарбоксилазная активность ткани
мозга при гипотермии и зимней спячке // Укр. биохим. журнал. - 1980. - Т.52. -
№6. - С.683-688.
. Калабухов
Н.И. Спячка млекопитающих. - М.: Наука, 1985. - 258 с.
. Калахая
Дж.В., Лоудена Дж.А. Лизосомы и лизосомные болезни накопления. - Москва:
Медицина, 1984. - 448 с.
. Карманова
И.Г. Физиология и генез зимней спячки // Журнал эвол. биох. и физиологии. -
1995. - №2. - С.216-223.
. Кашпаров
И.В., Попов М.Е., Румш Л.Д. Стереохимические особенности механизма
функционирования аспартильных протеиназ с нейтральным и слабощелочным оптимумом
рН // Вопросы мед. химии. - 2000. - №5. - С. 2-3.
. Кличханов
Н.К., Халилов Р.А., Мейланов И.С. Температурная зависимость активности АХЭ
синаптических мембран из мозга крыс при гипотермии // Бюл. экспер.биологии и
медициныю - 2000. - Т. 129. - № 3. - С. 326-328.
. Клишо
Е.В., Кондакова И.В., Чойнзонов Е.Л., Васильева О.С. Прогностическая значимость
протеаз у больных плоскоклеточными карциномами головы и шеи // Бюллетень СО
РАМН. - 2005. - Т.116. - № 2. - С. 82-91.
. Кокунин
В.А. Статистическая обработка данных при малом числе опытов // Укр. биохим.
журнал. - 1975. - Т. 47. - №6. - С. 776-790.
. Коломийцева
И.К., Перепелкина Н.И., Патрушев И.В., Попов В.И. Роль липидов в сборке
эндоплазматического ретикулума и диктосом нейрональных клеток коры головного
мозга якутского суслика Citellus undulatus при гибернации // Биохимия. - 2003.
- Т.68. - № 7. - С. 954-967.
. Кольман
Я., Рем К.-Г. Наглядная биохимия. - Москва: Мир, 2004. - 469 с.
. Короленко
Т.А. Биохимические аспекты лизосомотропизма. - Новосибирск: Наука, 1983. - 220
с.
. Короленко
Т.А. Катаболизм белка в лизосомах. - Новосибирск: Наука, 1990. - 189 с.
. Кочетов
Г.А. Практическое руководство по энзимологии. - М.: Высшая школа, 1980.
. Кузнецова
Н.А., Чирикова Т.С., Краюшкина Н.А., Зорина В.Н. Содержание плазмина, α1-антитрипсина
и α2-макроглобулина
в крови больных инфарктом миокарда и дискуляторной энцефалопатией до лечения //
Бюллетень сибирской медицины. - 2004. - №3. - С.86-89.
. Куцый
М.П., Кузнецова Е.А., Газиев А.И. Участие протеаз в апоптозе // Биохимия. -
1999. - Т.64. - № 2. - С. 149-163.
. Лаврецкая
Э.Ф. Фармакологическая регуляцияпсихических процессов. - Москва: Наука, 1985. -
279 с.
. Лишманов
Ю.Б., Маслов Л.Н., Ласукова Т.В. Роль опиоидной системы в адаптации организма и
защите сердца при стрессе // Успехи физиол. наук. - 1997. - Т.28. - № 1. -
С.75-95.
. Локшина
А.А. Реакции ограниченного протеолиза и их регуляторное значение // Успехи
биологической химии. - 1985. - Т.18. - № 6. - С. 162-184.
. Лишманов
Ю.Б., Маслов Л.Н., Халиулин И.Г., Барбараш Н.А. Роль энкефалинов в механизме
антиаритмических эффектов адаптации при острой ишемии миокарда // Вестник РАМН.
- 1998. - №3. - С.5-8.
. Мартынова
Е.А. Регуляция активности каспаз в апоптозе // Биоорганическая химия. - 2003. -
Т.29. - № 5. - С. 518-543.
. Маянская
Н.Н., Панин Л.Е. Лизосомы в условиях стресса // Успехи совр. биологии. - 1981.
- Т.92. - № 1(4). - С.64-80.
. Мейланов
И.С. Энзимология. - Махачкала: ИПЦ ДГУ, 1999. - 132 с.
. Менджерицкий
А.М., Лысенко А.В., Ускова Н.Н. Протеолитические процессы в мозге и сыворотке
крови крыс при гипокинезии и адаптивном влиянии дельта-сон индуцирующего
пептида // Биохимия. - 1995. - Т.60. - №4. - С.585-591.
. Мешалкин
Е.Н., Верещагин И.Г. Окклюзия в условиях неглубокой гипотермической защиты. -
Новосибирск: Наука, 1985. - 198 с.
. Мосолов
В.В. Протеолитические ферменты. - Москва, 1971. - 305 с.
. Немкова
Е.А. Гранулоцитарные сериновые протеиназы и их действие на калликреин -
кининовую систему плазмы крови человека: Автореф. …канд. биол. наук. - Москва,
1994. - 18 с.
. Нурмагомедова
П.М., Березин В.А., Эмирбеков Э.З., Рева А.Д. Влияние гипотермии на
субклеточное распределение и некоторые физико-химические свойства катепсина Д в
головном мозгу крыс // Укр. биохим. журн. - 1983. - Т.55. - №2.
. Палладин
А.В., Белик Я.В., Полякова Н.М. Белки головного мозга и их обмен. - Киев:
Наукова думка, 1972. - С.179-187.
. Панин
Л.Е. Биохимические механизмы стресса. - Новосибирск Наука, 1983. - 232с.
. Панченко
Л.Ф., Митюшина Н.В., Фирстова Н.В., Генгин М.Т. Метаболизм энкефалинов при
различных функциональных и патологических состояниях организма // Вопросы мед.
химии. - 1999. - №4. - С.35-44.
. Покровский
А.А. О ферментативных механизмах функционирования лизосом // Доклады АН СССР. -
1975. - Т.225. - № 3. - С. 689-692.
. Покровский
А.А., Тутельян В.А. Лизосомы. - Москва, 1976. - 378 с. 1982.
. Посохов
В.С., Розенберг О.Л., Хансон К.П. Модификация радиочувствительности лимфоцитов
тимуса крыс с помощью обогащенных холестерином аутолипосом // Бюл. эксп.
биологии и медицины. - 1992. - Т.13. - № 2. - С. 136-138.
. Пупышев
А.Б. Лизосомы человека: библиометрическая оценка актуальных направлений
исследований // Бюллетень СО РАМН. - 2006. - Т.119. - № 1. - С. 106-116.
. Рева
А.Д. ,Шаинская А.М.,Генгин М.Т., Лепехин Е.А. Выделение и свойства
глицилглицин-дипептидазы головного мозга крупного рогатого скота.//
Нейрохимия.-1982- Т.1, вып.2.-С.118-127.
. Ротанова
Т.В. Энергозависимый селективный внутриклеточный протеолиз // Вопросы мед.
химии. - 2000. - №. 5. - С. 4-5.
. Рыжакова
Д.И. Гипотермия в клинике и эксперименте. - Горький, 1997. - 117 с.
. Сарис
Н.-Е.Л., Карафоли Э. Роль митохондрий в перераспределении внутриклеточного
кальция: исторический обзор // Биохимия. - 2005. - Т.70. - №2. - С.231-239.
. Сологуб
Л.И., Пашковская И.С. Са2+ - активируемые нейтральные протеиназы клеток
человека и животных // Успехи современной биологии. - 1998. - Т.105. - № 2. -
С. 191-201.
. Соловьева
Н.И., Елисеева Ю.А., Локшина Л.А. Протеолитические ферменты и их биологические
функции // Вестник РАМН. - 1995. - № 2. - С. 3-9.
. Соловьева
Н.И. Матриксные металлопротеиназы: регуляция активности и роль в процессе
онкогенеза // Вопросы мед. химии. - 2000. - №. 5. - С. 12-13.
. Соловьева
Н.И., Винокурова С.В., Дилакян Э.А., Балаевская Т.О., Журбицкая В.А.
Коллагеназы I и IV типов и активатор плазминогена на разных стадиях
трансформации фибробластов. Симпозиум «Структура и функция протеолитических
ферментов» // Вопросы мед. химии. - 2000. - Т.46. - № 5. - С.514-515.
. Соловьева
Н.И. Матриксные металлопротеиназы и их роль в процессе онкогенеза // Вопросы
мед. химии. - 2002. - Т.48. - № 4. - С. 406.
. Степанян
Е.П., Меркурьева Р.П., Гуселевич Е.Л. Тканевое дыхание и аденозинтрифосфорная
активность у собак в условиях глубокой гипотермии // Бюл.экспер.биологии и
медицины. - 1963. - Т. 55. - № 3. - С. 45-48.
. Строев
Е.А., Кочуков М.Ю., Булаева Н.Н, Николаев В.В. Са2+ - зависимые протеиназы
щитовидной железы: регуляция тиреотропином // Доклады академии наук. - 1997. -
Т.335. - № 4. - С. 562-563.
. Табукашвили
Р.А., Ушаков И.Б., Антипов В.В. Роль лизосом в механизмах устойчивости и
адаптации. - Москва: Наука, 1991. - 320 с.
. Тутельян
В.А. Новые данные о ферментативной организации лизосом // Вестник АМН СССР. -
1978. - № 3. - С.22-29.
. Уманский
С.Р. Апоптоз: молекулярные и клеточные механизмы // Молекулярная биология. -
1996. - Т.30. - № 3. - С. 487-500.
. Фрадкин
С.З., Мавричев А.С., Коврикова З.С. Медико-техническое обеспечение общей
гипертермии в комплексном лечении злокачественных новообразований: Методические
рекомендации. - Минск: ГУИНН ОМР им. Н.Н. Александрова, 2002. - 32 с.
. Хансон
К.П. Программированная клеточная гибель (апоптоз): молекулярные механизмы и
роль в биологии и медицине // Вопросы мед. химии. - 1992. - Т.43. - №. 5. - С.
402-415.
. Хватова
Е.М., Семенова Т.С. Ферментативная характеристика мозга при гипотермии. -
Горький, 1979. - 190 с.
. Хочачка
П., Сомеро Дж. Биохимические адаптации. - Москва: Мир, 1988. - 568 с.
. Цыперович
А.С., Авдеев В.Г. Дипептидазы.//Успехи биологической химии. - 1978.- Т.19. - С.
61-82.
. Эмирбеков
Э.З., Мукаилов М.И. Глутаминсинтетазная, глутаминазная, аспартат- и
аланинаминотрансферазная активность головного мозга сусликов при зимней спячке
// Вопросы биохимии нервной системы. Махачкала, 1971. - Вып.1. - С.8-13.
. Эмирбеков
Э.З., Даудова Т.Н. Изменение активности некоторых ферментов азотистого обмена
мозга во время зимней спячки и пробуждения от нее // Механизмы зимней спячки
млекопитающих. Владивосток: ДНЦ АН СССР. - 1977. - С.78-81.
. Эмирбеков
Э.З., Нурмагомедова П.М. Пептидгидролазная активность тканей мозга при
гипотермии // Укр. биох. журнал. - 1979. - Т.51. - №6. - С.644-646.
. Эмирбеков
Э.З., Абдуллаев Р.А., Исмаилов И.А. Белки мозга теплокровного организма при
пониженных температурах тела. В кн.: Биохимия животных и человека. - Киев,
1980. - С.84-90
. Эмирбеков
Э.З., Львова С.П. Механизмы биохимических изменений при низких температурах
тела. - Издательство Ростовского университета, 1985. - 80 с.
88. Abdel-Meguid
S.S. Inhibition of aspartyl proteinases // Med. Res. Rev. - 1993. - Vol.13. -
PP.731-778.
. Ahlberg
J., Berkenstam A., Henell F., Glaumann H. Degradation of short and long
proteins in isolated rat liver lysosomes // J. Biol. Chem. - 1985. - Vol.260. -
№ 9. - PP.5847-5854.
. Baldwin
E.T., Bhat T.N., Gulnik S., Hosur M.V., Sowder R.C., Cachau R.E., Collins J.,
Silva A.M., Erickson J.W. Crystal structures of native and inhibited forms of
human cathepsin D: implications for lysosomal targeting and drug design //
Proc. Natl. Acad. Sci. USA. - 1993. - Vol. 90. - PP.6796-6800.
. Bashet
J., Guilmet
J. Защита мозга при
реконструктивных операциях на восходящей аорте // J.
Card. Surg.
- 2002. - Vol.17. - №2. - PP.115-124.
. Baudry
M., Bundman M.C., Smith E.K., Lynch G. Micromolar calcium stimulates
proteolysis and glutamate binding in rat brain synaptic membranes // Science. -
1981. - Vol. 212. - PP. 937-938.
. Bidere
N., Lorenzo H.K., Carmona S., Laforge M., Harper F., Dumont C., Senik A.
Cathepsin D trigger Bax activation? Resulting in selective apoptosis-inducing
factor (AIF) relocation in T lymphocytes entering the early commitment phase to
apoptosis // J. Biol. Chem. - 2003. - Vol. 278. - PP. 31401-31411.
. Blommart
E.F., Luiken J.J., Blommaart P.J. Woerkom V., Meijer A.J. Phosphorylation of
ribosomal protein in inhibitory for autophagy in isolated rat hepatocytes // J.
Biol. Chem. - 1995. - Vol.270. - PP.2320-2326.
. Bohley
P., Seglen P.O. Proteases and proteolysis in the lysosome // Experientia. -
1992. - Vol.48. - PP.151-157.
. Brown
N., Crawfold C. Structural modifications associated with the change in Ca2+
sensitivity on activation of m-calpain // FEBS Lett. - 1993. - V. 323. - PP.
65-68.
. Buck
C.L., Barnes B.M. Effects of ambient temperature on metabolic rate, respiratory
quotient, and torpor in an arctic hibernator // Am. J. Physiol. Regul. Integr.
Comp.Physiol. - 2000. - V.279. - PP. 255-262.
. Carey
H.V., Аndrews
M.T., martin S.L. Mammalian hibernation: cellular and molecular responses to
depressed metabolism and low temperature // Physiol. Rev. - 2003. - Vol.83. -
PP.1153-1158.
. Carey
H.V., Frank C.L., Aw T.Y. Cellular response to metabolic stress in hibernation
mammals. In: Life in the cold: 11th International hibernation symposium. -
Berlin: Springer-Verlag, 2000. - PP.339-346.
. Castillo
J., Davalas A., Naveiro J., Noya M. Neuroexcitatory amino acids and their
relation to infarct size and neurological deficit in ischemic stroke // Stroke.
- 1996. - №27. - PP.1060 - 1065.
. Chua
B.N., Guo K., Li P. Direct cleavage by the calcium - activated protease calpain
can lead to inactivation of caspases // The Journal of biological Chemistry. -
2000. - V.275. - №7. - PP.5131-5135.
. Conner
G.E. Cathepsin D. In: Handbook of proteolytic enzymes. - New York: academic
Press, 2002. - PP.746-751.
. Conner
G.E., Richo G. Isolation and characterization of a stable activation
intermediate of the lysosomal aspartyl protease cathepsin D // Biochemestry. -
1992. - Vol.31. - PP.1142-1147.
. Croall
D.E., Demartino G.N. Calcium-activated neutral protease (calpain) sistem:
Structure, function and regulation // Phiysiological Reviews. - 1991. - Vol.71.
- №3. - PP.2345-2354.
. Cuervo
A.M., Dice J.F. How do intracellular proteolytic systems change with age? //
Fronties in Bioscience - 1998. - № 3 - PP.25-43.
. Cuervo
A.M., Hayes S.A., Dice J.F. Molecular chaperones and intracellular protein
degradation with emphasis on a selective lysosomal pathway of proteolysis. In:
Molecular chaperones in the life cycle of proteins. - New York, 1997. -
PP.491-510.
. Cuninghaim
D.D., Loug G.L. Proteases in biological control. - NY.: Liss, 1987.
. Darrel
E.G., Thompson V.F., Li H., Wei W., Cong J. The calpain system // Physiol. Rev.
- 2003. - Vol.83. - PP.731-801.
. Deddish
P.A., Skidgel R.A., Kriho V.B., Li X.Y., Becker R.P., Erdos E.G.
Carboxypeptidase M in Madin-Darby canine kidney cells. Evidence that
carboxypeptidase M has a phosphatidylinositol glycan anchor // J. Biol. Chem. -
1990. - V. 265, № 25. - PР.
15083-15089.
. De
Saint-Vis B., Cupillard L., Pandrau-Garcia D., Ho S., Renard N., Grouard G.,
Duvert V., Thomas X., Galizzi J., Banchereau J. et al. Distribution of
carboxypeptidase M on lymphoid and myeloid cells parallels the other
zinc-dependent proteases CD10 and CD13. // Blood - 1995. - V. 86, № 3. - РР.1098-1105.
. Diment
S., Leech M.S., Stahl P.D. Cathepsin D is membrane-associated in macrophage
endosomes // J. Biol. Chem. - 1998. - Vol. 263. - PP. 6901-6907.
. Dittmer
F., Ulbrich E.J., Hafner A., Schmahl W., Meister T., Pohlmann R., von Figura K.
Alternative mechanisms for trafficking of lysosomal enzymes in
mannose-6-phosphate receptor-deficient mice are cell type-specific // J. Cell
Sci. - 1999. - Vol. 112. - PP.1591-1597.
. Doherty
F.S, Dawson S, Mayer R.J. The ubiquitin-proteasome pathway of intracellular
proteolysis // Essays Biochem. - 2002. - № 3. - PP.51-63.
. Doherty
F.S, Mayer R.J. Intracellular protein degradation. - New York: Oxford University
Press, 1992.
. Egbert
F., Heinrich M., Jensen J-M., Winoto-Morbach S., Pfeiffer S., Wickel M.,
Schunck M., Steude J., Saftig P., Proksch E., Schutze S. Cathepsin D is
involved in the regulation of transglutaminase 1 and epidermal differentiation
// J. of cell science. - 2004. - Vol. 117. - PP. 2295-2307.
. Emert-Sedlack
L., Shangary S., Rabinovitz A., Miranda M.B., Delach S.M., Johnson D.E.
Involvement of cathepsin D in chemotheraphy-induced cytochrome c release,
caspase activation, and cell death // Mol. Cancer Ther. - 2005. - Vol. 4. - PP.
733-742.
. Figura
K., Hasilik A. Lysosomal enzymes and their receptors // Annu. Rev. Biochem. -
1986. - Vol. 55. - PP. 167-193.
. Frerichs
K.U., Kennedy C., Sokoloff L., Hallenbeck J.M. Local cerebral blood flow during
hibernation, a model of natural tolerance to “cerebral ischemia” // Journ.
Cereb. Blood Flow-Metab. - 1994. - V.14. - PP.193-205.
. Frerichs
K.U., Smith C.B.,Brenner M., DeGracia D.J., Krause G.S., Marrone L., Dever
T.E., Hallenbeck J.M. Supression of protein synthesis in brain during
hibernation involves inhibition of protein initiation and elongationm // Proc.
Natl. Acad. Sci. USA. - 1998. - Vol.95. - PP.14511-14515.
. Fusek
M, Baudys M., Metcalf P. Purification and crystallization of human cathepsin D
// J. Mol. Biol. - 1992. - Vol. 226. - PP.555-557.
. Fusek
M, Vetvicka V. Cathepsin D. In: Aspartic proteinase: physiology and pathology.
- Boca Ratton: CRC Press, 1995. - PP. 143-184.
. Fusek
M, Vetvicka V. Dual role of cathepsin D: ligand and protease // Biomed. Paper.
- 2005. - Vol.149. - № 1. - PP.43-50.
. Furuno
K., Goodman M.N., Goldberg A.L. Role of different protelytic system in the
degradation of muscle proteins during denervation autophagy // J. Biol. Chem. -
1990. - Vol.265. - PP.8550-8557.
. Geiser
F. Metabolic rate and body temperature reduction during hibernation and daily
torpor // Annu. Rev. Physiol. - 2004. - V.66. - PP. 239-274.
. Glaumann
H. Crinography as a means for degradating excess secretory proteins in rat
liver. In: Current trends in the study of intracellular protein degradation. -
Spain, 1989. - PP.97-110.
. Glondu
M., Coopman P., Laurent-Matha V., Rocheford H., Liaudet-Coopman E. A mutated
cathepsin D devoid of its catalytic activity stimulates the growth of cancer
cells // Oncogene. - 2001. - Vol. 20. - PP. 6920-6929.
. Goldberg
A.L., Dice J.F. Intracellular protein degradation in mammalian and bacterial
cells // Annu Rev. Biochem. - 1974. - Vol.34. - PP.835-869.
. Gomeza
J, Ohno K, and Betz H. Glycine transporter isoforms in the mammalian central
nervous system: structures, functions and therapeutic promises // Curr Opin
Drug Discov Devel. - 2003. - №6. - PP. 675-682.
. Gopalakrishnan
M.M., Grosh H-W., Locatelli-Hoops S., Werth N., Smolenova E., Nettersheim M.,
Sandhoff K., Hasilik A. Purified recombinant human prosaponin forms oligomers
that bind procathepsin and affect its autoactivation // Biochem J. - Vol. 383.
- PP.507-515.
. Grinde
B. Autophagy and lysosomal proteolysis in the liver // Experientia. - 1985. -
Vol.41. - № 9. - PP.1089-1095.
. Guicciardi
M.E. Lysosomes in cell death // Oncogene. - 2004. - Vol.23. - № 16. -
PP.2881-2890.
. Gusev
E.I., Skvortsova V.I., Dambinova S.A., Raevskiy K.S., Alekseev A.A., Bashkatova
V.G., Kovalenko A.V., Kudrin V.S., Yakovleva E.V. Neuroprotective Effects of
Glycine for Therapy of Acute Ischaemic Stroke // Cerebrovasc Dis. - 2000. - №
10. - PP. 49-60.
. Halang
K.W., Lerch M.M., Brandt-Nedelev B. Role of cathepsin B in intracellular
trysinogen activation and the onset of acute pancreatist // J. Clin. Inset. -
2000. - V.106. - № 6. - PP.773-781.
. Hochachka
P.W., Somero G.N. Biochemical adaptation. Mechanism and process in
physiological evolution. - New York: Oxford University Press, 2002. - 467 p.
. Hosfield
C.M., Elce J.S., Davies P.L., Jia Z. Crystal structure of calpain reveals the
structural basis for Ca2+- dependent protease activity and a novel mode of
enzyme activation // EMBO J. - 2001. - V.18. - PP.6880-6889.
. Ivanov
K.P. Physiological problems and functional mechanisms of the thermoregulation
system // Ann. NY Acad. Sci. - 1997. - Vol.813. - PP.32-38.
. Kataoka
K., Yanase H. Mild hypothermia - a revived countermeasure against ischemic
neuronal damages. - Neuroscience Research. - 1998. - Vol. 32. - PP. 103-117.
. Kawasaki
H., Emori Y., Imajoh-Ohmi S., Minami Y., Suzuki K. Identification and
characterization of inhibitory sequences in four repeating domains of the
endogenous inhibitor for calcium dependent protease // J. Bochem. - 1989 -
V.106. - PP.274-281.
. Kawasaki
H., Emori Y., Suzuki K. Calpastatin has two distinct sites for interaction with
calpain - effect of calpastatin fragments on the binding of calpain to
membranes // Arch. Biochem. Biophys. - 1993. - V.305. - PP.467-472.
. Kenyon
G.D., Johnatan S. Association of mitochondrial calpain activation with
increased expression and aytolisis of calpain small subunit in an early stage
of apoptosis // Internetional Jounal of molecular medicine. - 2003. - V.12. -
№3. - PP.247-252.
. Khorchid
A., Ikura M. How calpain is activated by calcium // Nature structural biology.
- 2002. - V.2. - №4. - PP.239-241.
. Klionsky
D.S. Autophagy as a regulated pathway of cellular degradation // Science. -
2000. - Vol.290. - № 5497. - PP.1717-1721.
. Koelsch
G., Mares M., Metcalf P., Fusek M. Multiple functions of pro-parts of aspartic
proteinase zymogens // FEBS Lett. - Vol. 343. - PP.6-10.
. Koening
J.A., Edwardson J.M. Endocytosis and recycling of G protein-coupled receptors
// Trends pharmacol Sci. - 1997. - Vol.18. - PP.276-287.
. Kortner
G., Geiser F. The temporal organization of daily torpor and hibarnation:
circadion and circannual rhythms // Chronobiol. Int. - 2000. - Vol.17. -
PP.103-128.
. Lajtha
A., Sershen H. Changes in the rates of proteins synthesis in the brain of gold
fish at various temperature // Life sci. - 1975. - Vol. 17. - PP. 1816-1868.
. Laurent-Matha
V., Maruani-Herrman S., Prebois C., Beaujoin M., Glondu M., Noel A.,
Alvarez-Gonzales M.L., Blacher S., Coopman P., Baghdiguian S., Gilles C.,
Lancarek J., Freiss G., Vignon F., Liaudet-Coopman E. Catalytically inactive
human cathepsin D trigger fibroblast invasive growth // J. Cell Biol. - 2005. -
Vol. 168. - PP. 489-499.
. Lenk
S.E., Fisher D.L., Dunn W.A. Regulation of protein secretion by crinophagy in
perfused rat liver // Eur. J. Cell Biol. - 1991. - Vol.56. - PP.201-209.
. Leto
G., Tumminello F.M., Crescimanno M., Flandina C., Gebbia N. Cathepsin D
expression levels in nongynecological solid tumors: clinical and therapeutic
implications // Clin. Exp. Metastases. - 2004. - Vol. 21. - PP. 91-106.
. Li
Y.H., Han T.Z. Glycine binding sites of presynaptic NMDA receptors may
tonically regulate glutamate release in the visual cortex // J. Neurophysiol. -
2006. - № 8.
. Loscha
A., Schindl M., Kohlberger P., Lahodny J., Breitenecker G., Horvet R., Birner
P. Cathepsin D in ovarian cancer: prognostic value and correlation with p53
expression and microvessel density // Gynecologic oncology. - 2004. - Vol. 92.
- № 2. - PP. 545-552.
. Lowry
D.H., Rosebrough H.J., Farr A.L., Randall R.J. Protein measurement with the
Folinphenol reagent // J. Biol. Chem. - 1951. - V. 193. - №1. - P.265-275.
. Meijer-van
Gelder M.E., Look M.P., Bolt-de Vries J., Peters H.A., Klijn J.G., Foekens J.A.
Clonical relevance of biological factors in male breast cancer // Breast Cancer
Res. Treat. - 2001. - Vol. 68. - PP. 249-260.
. Meister
A. Biochemistry of the Amino Acids. - New York, 1957.
. Metcalf
P., Fusek M. Two crystal structures for cathepsin D: The lysosomal targeting
signal and active site // EMBO J. - 1993. - № 12. - PP.1293-1302.
. Mohamadzadeh
M., Mohamadzadeh H., Brammer M., Sestak K., Luftig R.B. Identification of
proteases employed by dendritic cells in the processing of protein purified
derivative (PPD) // J. Immune Based Ther Vaccines. - 2004. - Vol. 2. - PP.8-10.
. Moldoveanu
T., Hosfield C.M., Lim D., Elce J.S., Davies P.L. A Ca2+ switch aligns the
active site of calpain // Cell. - 2002. - V.108. - PP.649-660.
. Mortensen
B., Dole O. Effects of hypothermia on the elimination of ethanol, diazepam and
oxarepam in rat livar slice incubation // Аcta
Anasthesiol Scand. - 1995. - Vol. 39. - PP.199-204.
. Mortimore
G.E., Lardeux B.R., Adams C.E. Regulation of microauophagy and basal protein
turnover in rat liver. Effects of short-term starvation // J. Biol.Chem. -
1988. - Vol.263. - PP.2506-2512.
. Mortimore
G.E., Miotto G., Venerendo R., Kadowaki M. Autophagy // Biochemestry. - 1995. -
Vol.27. - PP.93-135.
. Mothet
J.P., Parent A.T., Wolosker H., Brady R.O., Jr., Linden D.J., Ferris C.D.,
Rogawski M.A., Snyder S.H. D-serine is an endogenous ligand for the glycine
site of the N-methyl-D-aspartate receptor // Proc Natl Acad Sci U S A. - 2000.
- Vol.97. - PP.4926-4931.
. Mukherjee
S., Ghosh R.N., Maxfield E.R. Endocytosis // Physiol. Rev. - 1997. - Vol. 77. -
PP.759-803.
. Nagae
A., Deddish P.A., Becker R.P., Anderson C.H., Abe M., Tan F., Skidgel R.A.,
Erdos E.G. Carboxypeptidase M in brain and peripheral nerves // J. Neurochem. -
1992. - V. 59, № 6. - PР.
2201-2212.
. Nilsson
E., Karlsson J.O. Characterization of brain calpains // J. Neurochem. - 1986. -
№ 4. - PP.1086-1090.
. Obrenovitch
T.P., Hardy A.M., Urenjak J. High extracellular glycine does not potentiate
N-methyl-D-aspartate-evoked depolarization in vivo // Brain Res. - 1997. - Vol.
746. - PP. 194.
. Orlowski
M, Wilk S. Catalytic activities of the 20S proteasome, a multicatalytic
proteinase complex // Arch. Biochem Biophys. - 2000. - № 383. - PP.1-16.
. Parsons
C. G., Danysz W., Hesselink M., Hartmann S., Lorenz B. Modulation of NMDA
receptors by glycine-introduction to some basic aspects and recept development
// Amino Acids. - 1998. - №14. - PP. 207-216.
. Peterson
SL. Anticonvulsant drug potentiation by glycine in maximal electroshock
seizures is mimicked by d-serine and antagonized by 7-chlorokynurenic acid //
Eur J Pharmacol - 1991. - № 199. - PP.341-348.
. Rocheford
H., Garcia M., Glondu M., Laurent V., Liaudet E., Rey J., Roger P. Cathepsin D
in breast cancer: mechanisms and clinical applications, a 1999 overview //
Clin. Chim. Acta. - 2000. - Vol. 291. - PP. 157-170.
. Sahagian
G.G., Novikoff P.M. Lysosomes in liver: biology and pathobiology. - New York:
Raven Press, 1994. - PP.275-291.
. Sakurai
T., Itoh K., Liu Y., Higashitsuji H., Simitomo Y., Sahamaki K., Fujta . Low
temperature protects mammalian cells from apoptosis initiated by various stimuli
in vitro // Exp. Cell res. - 2005. - Vol.309. - №2. - PP. 264-272.
. Scharts
G., Dobberstein B. Common principles of protein translocation across membranes
// Science. - 1996. - Vol.271. - PP.1519-1526.
. Sessler
D.I. Perioperative thermoregulation and heat balanse // Ann. NY Acad. Sci. -
1997. - №3. - PP.813-815.
. Seubert
P., Larson J., Oliver M., Jung M., Baundry M., Lynch G. Stimulation of NMDA
receptors induces proteolysis of spectrin in hippocampus // Brain Res. - 1988.
- V.460. - P.189-194.
. Shringarpure
R., Grune T., Davies K.J. Protein oxidation and 20S proteasome-dependent
proteolysis in mammalian cells // Cell Mol. Life Sci. - 2001. - V.58. -
PP.1442-1450.
. Siesjo
B.K., Bengtsson F. Calcium fluxes, calcium antagonist and calcium related
pathology // J.Cerebr. blood flow and metabol. - 1989. - Vol.9. - №2. -
PP.127-140.
. Skidgel
R.A., Johnson A.R., Erdos E.G. Hydrolisys of opioid hexapeptides by
carboxypeptidase N. Presence of carboxypeptidase in cell membranes // Biochem.
Pharmacol. - 1984. - V. 33, № 21. - PР.
3471-3478.
. Skidgel
R.A., Davis R.M., Tan F. Human carboxypeptidase M. Purification and
characterization of a membrane-bound carboxypeptidase that cleaves peptide
hormones // J. Biol. Chem. - 1989. - V. 264, № 4. - PР.
2236-2241.
. Skidgel
R.A., Tan F.L., Deddish P.A., Li X.Y. Structure, function and membrane
anchoring of carboxypeptidase M // Biomed. Biochim. Acta. - 1991. - V. 50, №
4-6. - PР.
815-820.
. Skidgel
R., McGwire G., Li X. Membrane anchoring and release of carboxypeptidase M:
implications for extracellular hydrolysis of peptide hormones. //
Immunopharmacology - 1996. - V. 32, № 1-3. - РР.
48-52.
. Storey
K.B. Metabolic regulation in mammalian hibernation: enzyme and protein
adaptation // Comp. biochem. Physiol. - 1997. - Vol. 118, # 4. - PP. 1115-1224.
. Storey
K.B., Storey J.M. Gene expression and protein adaptation in mammalian
hibernation. - Life in cold. - 2000. - PP. 303-313.
. Storey
K.B. Functional metabolism: regulation and adaptation // New York: Wiley-Liss,
2004. - 594 p.
. Strobl
S., Fernandez-Catalan C., Braun M., Huber R., Masumoto H., Nakagawa K., Irie
A., Sorimachi H., Bourenkow G., Bartunik H., Suzuki K., Bode H. The crystal structure
of calcium - free human m-calpain suggests an electrostatic switch mechanism
for activation by calcium // Proc. Natl. Acad. Sci. USA. - 2000. - V.97. -
PP.588-592.
. Suzuki
K., Tsuji S., Ishiura S., Kimura Y., Kubota S., Imahori K. Autolysis of calcium
- activated neutral protease of chicken skeletal muscle // J. Biochem. - 1981 -
V.90. - PP.1787-1793.
. Takuma
K., Kiriu M., Mori K., Lee E., Enomoto R., Baba A., Matsuda T. Roles of
cathepsins in reperfusion-induced apoptosis in cultured astrocytes //
Neurochem. Int. - 2003. - Vol. 42. - PP.153-159.
. Terlecky
S.R., Dice J.F. Polypeptide import and degradation by isolated lysosomes // J.
Biol. Chem. - 1993. - Vol.268. - PP.23490-23495.
. Vaes
G. Secretory processes. - London, 1985. - 256 p.
. Turecek
R., and Trussell L.O. Presynaptic glycine receptors enhance transmitter release
at a mammalian central synapse // Nature. - 2001. - Vol. 411. - PP. 587-590.
. Vetvicka
V., Benes P., Fusek M. Procathepsin D in breast cancer: What do we know?
Effects of ribozymes and other inhibitors // Cancer Gene Ther. - 2002. - Vol.
9. - PP.854-863.
. Vetvicka
V., Vagner J., Baudys M., Tang J., Foundling S.I., Fusek M. Human breast milk
contains procathepsin D-detection by specific antibodies // Biochem. Mol. Int.
- 1993. - Vol. 30. - PP.921-928.
. Vetvicka
V., Vetvickova J., Benes P. Role of enzymatically inactive procathepsin D in
lung cancer // Anticancer Res. - 2004. - Vol. 24. - PP. 2739-2743.
. Vetvicka
V., Vetvickova J., Fusek M. Anti-human procathepsin D activation peptide
antibodies inhibit breast cancer development // Breast. Cancer. Res. Treat. -
1999. - Vol. 57. - PP. 261-269.
194. Wang
L.C.H., Lee T.F. Torpor and hibernation in mammals: metabolic, physiological
and biochemical adaptations // Handbook of Physioly / eds. Fregly M.J.,
Blatteis C.M. - 1996. - №4. - РР.
507-531.
195. Watanabe
Y, Saito H, and Abe K. Effects of glycine and structurally related amino acids
on generation of long-term potentiation in rat hippocampal slices // Eur J
Pharmacol. - 1992. - Vol. 223. - PP. 179-184.
. Wickner
S. Posttranslation quality control: folding, refolding and degrading proteins
// Science. - 1999. - Vol.286. - PP.1888-1893.
. Williams
R. In: Biogenesis of natural compounds (Dernfeld R. ed.) - New York, 1963 -
PP.368-404.
. Woods
A.K, Storey K.B. Effects of hibernation on multicatalytic proteinase complex in
thirteen-lined proud squirrels, Spermophilus tridecemlineatus // Molecular and
cellular biochemistry. - 2004. - № 3. - PP.1-9.
. Yong
C.C.,Sladen R.N. Temperature monitoring // International anastesiology clinics
“Clinical Monitoring”. - 1996. - V.34. - №3. - PP.112-121.
. Zee
D.J. Heating the patient - a promising approach // Annals of Oncology. - 2002.
- Vol. 13. - PP.1173-1184.
. Zhu
Y., Conner G.E. Intermolecular association of lysosomal protein precursors
during biosynthesis // J. Cell Chem. - 1994. - Vol. 269. - PP. 3846-3851.