Возможность улучшения качества учебно-воспитательной работы на уроках химии путем экологизации содержания темы 'S-элементы'
Введение
S-элементы в природе
очень важны. Также важны и соединения S-
элементов. S- элементы очень
часто являются источником экологических проблем, в том числе по вине человека.
Тем не менее, в совокупности, эти факторы находят очень слабое отражение в учебно-воспитательной
работе в рамках естественной дисциплины. Поэтому цель работы - исследование
возможности усовершенствования учебно-воспитательного процесса на уроках химии
путем акцентирования внимания учащихся именно на этот круг проблемы. Гипотеза
состояла в предположении о том, что экологизация содержания темы: «S-
элементы» в рамках отведенного программой времени позволит как расширить
кругозор школьников, так и усилить воспитательный эффект изучения данной темы.
В работе решались следующие задачи:
1. Обзор литературы с целью установления места и
роли данной темы в комплексе учебно-методических источников.
. Анализ школьных учебников, пособий, задачников
и т.д. на предмет содержания в них сведений прикладного и экологического
характера;
. Обзор собственно экологических проблем,
связанных с наличием в природе и использованием своей жизнедеятельности
человеком S- элементов и их
соединений;
. Разработка и реализация собственных план -
конспектов уроков с учетом информации, полученной в результате литературного
поиска;
. Составление «банка» контрольных заданий к теме
(текущий, промежуточный контроль знаний);
Объект
исследования: учебно-воспитательный процесс с учениками 9-11 классов
гимназии №1 г. Нальчик;
Предмет исследования - возможность
улучшения качества учебно0воспитательной работы на уроках химии путем
экологизации содержания темы «S-элементы».
ГЛАВА
1. S-элементы в учебно-методической работе учителя
химии
Материал настоящей главы посвящен двум аспектам:
первый из них относится к роли и месту по объему и содержанию темы «S-элементы»
в современном школьном курсе химии. Этот вопрос важен по той причине, что
обычно содержание школьной программы по химии не успевает в достаточной мере
отразить все важные в практическом отношении (экологическом, прикладном) факты,
относящиеся к этой теме. То, что фактов и факторов множество, показано во
второй части обзора.
.1 S-элементы
в школьных программах, учебниках и другой методической литературы в школьном
курсе химии. Степень отражения прикладных и экологичеких аспектов.
S-элементы в
школьном курсе химии отражены следующим образом
8 класс
1. При изучении темы: «Периодический закон и
периодическая таблица Д.И. Менделеева» учащиеся изучают группы сходных
элементов. S-элементами
являются элементы I, II-А
групп.
. При изучении темы «Строение атома» изучается
строение атомов некоторых S-элементов.
Дается определение, что элементы, у которых на последнем энергетическом
подуровне располагаются S-электроны,
являются S-элементами.
9 класс
1. При изучении темы: «Щелочные и щелочноземельные
металлы», ученикам напоминают, что эти металлы они относятся к S-элементам.
Составляют электронные схемы строения щелочных и щелочноземельных металлов и
указывают то, что у этих элементов на последнем энергетическом уровне
располагаются S-электроны.
11 класс
1. При изучении темы: «Пространственное строение
молекул неорганических и органических веществ» изучаются модели молекул в том
числе и S-элементов.
. При изучении темы: «Химические свойства
металлов главных подгрупп» подчеркивается то, что металлы I,
II-A
групп являются S-элементами,
и химические свойства этих элементов изучают отдельно.
. При изучении темы: «Общая характеристика s-,
p-, d-,
f-элементов», они
изучают семейство S-элементов,
то что они проявляют сильные восстановительные свойства, т.е. легко отдают S-электроны
последнего энергетического уровня.
1.2 Экологическая проблематика темы:
«S-элементы
ПСХЭ» с точки зрения экологии
К блоку S-элементов
относятся 13 элементов, общим для которых является застраивание в их атомах s-подуровня
внешнего энергетического уровня.
|
Период
|
Группа
|
|
Главное квантовое число n
|
IA
|
IIА
|
|
1
|
H*
|
|
|
2
|
Li?
|
Ве
|
|
3
|
Na
|
Mg
|
|
4
|
K
|
Ca
|
|
5
|
RЬ
|
Sr
|
|
6
|
Сs
|
Ва
|
|
7
|
Fr
|
Rа
|
* −
необходимые элементы; ** − биогенные элементы
Элементы IА-группы
(Li, Nа,
К, Rb, Сs,
Fr) имеют на внешнем
энергетическом уровне по одному s-электрону,
а элементы IIА-группы
(Ве, Мg, Са, Ra,
Ва, Sr) - по два
электрона.
Химические свойства s-элементов
IА- и IIА-групп
сходны. s-Элементы легко
отдают валентные s-электроны,
т. е. они представляют собой сильные восстановители. Элементные вещества -
типичные металлы, обладающие блеском, высокой электрической проводимостью и
теплопроводностью, химически весьма активны.
s-Элементы
имеют малые значения энергии ионизации при относительно больших радиусах атомов
и ионов. Как правило, они образуют соединения с ионным типом связи, исключение
составляет водород, для которого в соединениях даже с самыми
электроотрицательными элементами (например, в воде) характерна преимущественно
ковалентная связь. Частично ковалентный характер связи в соединениях в
известной мере имеет место у лития, бериллия и магния.
Большинство природных соединений натрия, калия,
кальция, стронция растворимы в воде и слабых кислотах, и поэтому ноны этих
металлов могут мигрировать из водных растворов в организм растений, животных и
человека.
Водород, натрий, калий, магний, кальций -
жизненно необходимы для живых и растительных организмов.
.2.1Общая характеристика s-элементов
IА-группы
Щелочные металлы
В IA-группу входят s-элементы - щелочные
металлы, исключительно важные для нормальной жизнедеятельности животных и
человека. Наибольшее значение для живых организмов имеют макроэлементы натрий,
калий.
Как и многие другие биохимические процессы,
перенос ионов Na+ и К+ через клеточные мембраны сопряжен
с экзоэргонической реакцией гидролиза АТФ.
Натрий-калиевый градиент обусловливает
возникновение разности потенциалов на клеточной мембране. За счет энергии
гидролиза одной молекулы АТФ три иона Na+ выводятся из клетки, а два иона К+
поступают внутрь клетки (рис.1). Такой дисбаланс электрических зарядов и служит
причиной возникновения разности потенциалов на плазматической мембране, в
частности нервных волокон. При этом внутренняя сторона мембраны заряжена
отрицательно по отношению к внешней поверхности мембраны.
Изотонический раствор NaCl (0,9%) для инъекций
вводят подкожно, внутривенно и в клизмах при обезвоживании организма и при
интоксикациях, а также применяют для промывания ран, глаз, слизистой оболочки
носа, а также для растворения различных лекарственных препаратов.
Гипертонические растворы NaCl (3−5−10%)
применяют наружно в виде компрессов и примочек при лечении гнойных ран..
Применение таких компрессов способствует по законам осмоса отделению гноя из
ран и плазмолизу бактерий (антимикробное действие). 2-5%-ный раствор NaCl
назначают внутрь для промывания желудка при отравлении AgNО3,
который при этом превращается в малорастворимый и нетоксичный серебра хлорид:
+(р)
+ С1−(р) = AgCl (т)
Натрий водородкарбонат (натрий гидрокарбонат,
сода двууглекислая, сода питьевая) NaHCО3 используют при различных
заболеваниях, сопровождающихся повышенной кислотностью − ацидозом (диабет
и др.). Механизм снижения кислотности заключается во взаимодействии NaHCО3
с кислыми продуктами. При этом образуются натриевые соли органических
кислот, которые в значительной мере выводятся с мочой, и углерод диоксид,
покидающий организм с выдыхаемым воздухом:
NaHCO3 (p) + RCOOH (p) →RCOONa
) (p) + H2О
(ж)
+ CО2
(г)
Используют NаНСО3
и при повышенной кислотности желудочного сока, язвенной болезни желудка и
двенадцатиперстной кишки. При приеме NaHCO3
протекает реакция нейтрализации избыточной соляной кислоты:
3
(р) + НС1 (р) = NaCl (р) + Н20 (ж) + С02 (г)
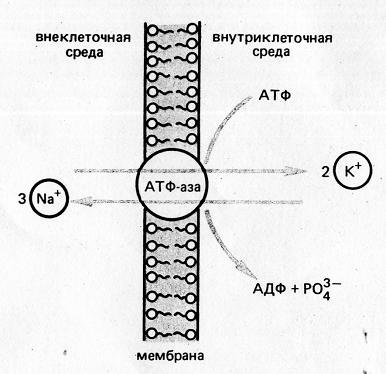
Рис. 1. Схема действия Na+-, К+
-АТФазы и возникновение разности потенциалов на клеточных мембранах
Следует иметь в виду, что применение NaHC03
вызывает ряд побочных эффектов. Выделяющийся при реакции углерод диоксид
раздражает рецепторы слизистой оболочки желудка и вызывает вторичное усиление
секреции, кроме того, он может способствовать перфорации стенки желудка при
язвенной болезни.
Слишком большая доза NaHC03 в результате
гидролиза приводит к алкалозу, что не менее вредно, чем ацидоз.
Растворы натрия водородкарбоната применяют в
виде полосканий, промываний при воспалительных заболеваниях глаз, слизистых
оболочек верхних дыхательных путей. Действие NaHC03 в качестве
антисептического средства основано на том, что в результате гидролиза,
протекающего в очень незначительной степени, водный раствор NaHC03 проявляет
слабощелочные свойства:
O3
+ Н20 → NaOH + Н2С03
При воздействии щелочей на микробные клетки
происходит осаждение клеточных белков и вследствие этого гибель
микроорганизмов.
Натрий сульфат (глауберова соль) Na2SO4
10H2O применяют в качестве слабительного средства. Эта соль
медленно всасывается из кишечника, что приводит к поддержанию повышенного
осмотического давления в полости кишечника в течение длительного времени. В
результате осмоса происходит накопление воды в кишечнике, содержимое его разжижается,
сокращения кишечника усиливаются, и каловые массы быстрее выводятся.
Натрий тетраборат Na2B407
10Н2О применяют наружно как антисептическое средство для полосканий,
спринцеваний, смазываний. Антисептическое действие Na2B407
10Н2О аналогично NaHC03 и связано с щелочной реакцией
среды водного раствора этой соли вследствие ее гидролиза, а также с
образованием борной кислоты:
2B407
+ 7Н20 ↔ 4Н3В03 + 2NaOH
Натрий гидроксид в виде 10%-ного раствора входит
в состав силамина, применяемого в ортопедической практике для отливки
огнеупорных моделей при изготовлении цельнолитых протезов из кобальтохромового
сплава.
Радиоактивный изотоп 24Na в качестве
метки применяют для определения скорости кровотока, кроме того, он используется
для лечения некоторых форм лейкемии.
Калий.
Содержание калия в организме человека массой 70 кг составляет примерно 160 г
(4090 ммоль) 0,23%. Калий является основным внутриклеточным катионом, составляя
2/3 от общего количества активных клеточных
катионов.
Из общего количества калия, содержащегося в
организме, 98% находится внутри клеток и лишь около 2% - во внеклеточной
жидкости. Калий распространен по всему организму. Его топография: печень,
почки, сердце, костная ткань, мышцы, кровь, мозг и т. д. Ионы калия К+ играют
важную роль в физиологических процессах сокращении мышц, нормальном
функционировании сердца, проведении нервных импульсов обменных реакциях. Ионы
К+ являются важными активаторами ферментов, находящихся внутри клетки.
Калий, как уже отмечалось выше, в большинстве
случаев является антагонистом натрия. Ионы Nа+
и К+ принимают участие в биокатализе, образуя смешанные комплексы типа фермент
- катион - субстрат.
Подтверждением того, что комплексообразование
калия с ферментами и субстратами играет важную роль в транспорте ионов, является
образование комплексов этих катионов с антибиотиком валиномицином. Уже давно
известно, что антибиотики, подобные валиномицину, Вызывают транспорт ионов
калия в митохондрии. Валиномицин образует прочный комплекс с нонами калия, в то
время как ион натрия связывается этим антибиотиком в очень незначительной
степени. Вследствие этого валиномицин можно рассматривать как биологическую
модель переносчика ионов калия через плазматические мембраны в клетку.
Взрослый человек обычно потребляет с пищей 2-3 г
калия в сутки. Концентрация ионов калия К+ во внеклеточных
жидкостях, включая плазму, составляет в норме 3,5-5,5 ммоль/л, а концентрация
внутриклеточного калия 115-125 ммоль/л.
При калиевом истощении применяют калий хлорид КСl
4-5 раз в день по 1 г.
Рубидий и цезий.
По содержанию в организме человека рубидий (10%) и цезий (I0%)
относятся к микроэлементам. Они постоянно содержатся в организме, но
биологическая роль их еще не выяснена. Являясь полным аналогом калия, рубидий
также накапливается во внутриклеточной жидкости и может в различных процессах
замещать эквивалентное количество калия. Синергист калия - рубидий активирует
многие те же самые ферменты, что и калий, пируватфосфокиназу,
альдегиддегидрогеназу и др.
Радиоактивные изотопы 137Cs
и 87Rb
используют в радиотерапии злокачественных опухолей, а также при изучении
метаболизма калия. Благодаря быстрому распаду их можно даже вводить в организм,
не опасаясь длительного вредного воздействия.
Франций.
Это радиоактивный химический элемент, полученный искусственным путем. Имеются
данные, что франций способен избирательно накапливаться в опухолях на самых
ранних стадиях их развития. Эти наблюдения могут оказаться полезными при
диагностике онкологических заболеваний.
Таким образом, из элементов IA-группы
физиологически активны Li, Rb, Cs, a Na и К - жизненно необходимы. Близость
физико-химических свойств Li и Na, обусловленная сходством электронного
строения их атомов, проявляется и в биологическом действии катионов (накопление
во внеклеточной жидкости, взаимозамещаемость). Аналогичный характер
биологического действия катионов элементов больших периодов - К+, Rb+, Cs+
(накопление во внутриклеточной жидкости, взаимозамещаемость) также обусловлен
сходством их электронного строения и физико-химических свойств. На этом основано
применение препаратов натрия и калия при отравлении солями лития и рубидия.
1.2.2 Общая характеристика
s-элементов ПА-группы
Щелочно-земельные металлы
|
Период
|
Группа
|
|
n
|
IIА
|
|
2
|
4Be
|
|
3
|
12Mg
|
|
4
|
20Ca
|
|
5
|
38Sr
|
|
6
|
56Ва
|
|
7
|
88Ra
|
Клетка
Во вторую группу периодической системы
входят бериллий, магний и щелочно-земельные металлы - кальций,
стронций, барий, радий, имеющие большое значение в жизнедеятельности.
Наиболее важными среди этих элементов для живых организмов являются
макроэлементы магний и кальций и микроэлементы стронций и барий. Магний входит
в состав многих ферментативных систем, а кальций является главным компонентом
костной ткани. Стронций оказывает влияние на процессы в костной ткани, а барий,
очевидно, играет определенную роль в функционировании органов зрения. Если о
биологической роли магния и кальция многое известно, то влияние микроэлементов
стронция, бария и радия на живые организмы изучено очень мало. В живых
организмах эти элементы находятся в степени окисления + 2.
В табл. 1 и 2 приведены некоторые свойства
s-элементов IIА-группы.
Атомы этих элементов имеют по два валентных электрона на s-подуровне внешнего
энергетического уровня, т. е. электронная формула валентной оболочки s-элементов
Таблица
1
Свойства атомов щелочно-земельных элементов
|
Характеристика
|
4Ве
|
12Mg
|
20Са
|
38Sr
|
26Ва
|
88Ra
|
|
Валентные
электроны
|
2s2
|
3s2
|
4s2
|
5s2
|
6s2
|
7s2
|
|
Молярная
масса, г/моль
|
9,0
|
24,3
|
40,1
|
87,6
|
137,3
|
226
|
|
Металлический
радиус атома, пм
|
133
|
160
|
197
|
215
|
221
|
235
|
|
Кристаллический
радиус иона Э2+, пм
|
34
|
74
|
104
|
120
|
138
|
144
|
|
Энергия
ионизации; кДж/моль
|
|
|
|
|
|
|
|
Э
→ Э+
|
899
|
738
|
590
|
549
|
503
|
509
|
|
Э+
→ Э2+
|
17
|
1450
|
114
|
106
|
965
|
979
|
Таблица
2
Свойства элементных веществ группы IIА
|
Характеристика
|
Be
|
Mg
|
Са
|
Sr
|
Ba
|
Ra
|
|
Плотность,
г/см3
|
1,85
|
1,74
|
1,54
|
2,63
|
3,76
|
6,00
|
|
Температура
плавления, К
|
1558
|
924
|
1123
|
1043
|
983
|
1233
|
|
Температура
кипения, к
|
3243
|
1380
|
1753
|
1653
|
1913
|
1413
|
|
Стандартный
электродный потенциал
|
|
|
|
|
|
|
|
(Э2+
+ 2e- = Э°), В
|
-1,85
|
-2,36
|
-2,87
|
-2,89
|
-2,91
|
-2,92
|
|
Координационное
число
|
4
|
6
|
6,8
|
6,8
|
6,9
|
6,8
|
В нормальном состоянии у атомов этих элементов
нет неспаренных электронов, но при переходе атомов в возбужденное состояние
один из s-валентных
электронов переходит на р-подуровень.
Это и обусловливает проявление степени окисления
+2. Например, атом магния в возбужденном состоянии имеет следующую электронную
формулу.
Степень окисления больше +2 элементы IIА-группы
не проявляют.
Несмотря на то, что число валентных электронов у
атомов s-элементов IIА-группы
одинаково, свойства магния и в особенности бериллия существенно отличаются от
свойств щелочноземельных металлов. Последнее прежде всего обусловлено
значительным различием радиусов их атомов и ионов.
Отличие свойств бериллия связано и с тем, что
его валентным электронам предшествует двухэлектронная оболочка. Кроме того,
химические свойства бериллия и магния отличаются от свойств щелочно-земельных
металлов вследствие того, что кальций, стронций, барий и радий имеют свободные
d-орбитали, близкие по энергии к ns-орбиталям.
Бериллий во многом сходен с алюминием
(диагональное сходство в периодической системе). Радиус атома и иона бериллия
значительно меньше в сравнении с другими s-элементами группы. Соответственно
энергия ионизации атома бериллия существенно выше, чем у остальных s-элементов IIА-группы.
В отличие от магния и щелочноземельных металлов бериллий является амфотерным
элементом, для него характерна в значительной степени ковалентная связь с
атомами других элементов. В обычных условиях бериллий образует не простые, а
комплексные ионы. В ряду Be+ - Mg2+ - Са2+- Sr2+
- Ва2+ прочность комплексов с кислородсодержащими и другими
лигандами уменьшается:

Способность иона Ве2+ образовывать
более прочные комплексы по сравнению с ионом Mg2+ с
кислородсодержащими лигандами, фторидами и другими, присутствующими в живых
организмах, обусловливает токсическое действие этого катиона.
Например, ион бериллия подавляет активность
многих ферментов, активируемых ионом Mg в результате замещения ионов магния в
его комплексах с ферментами, нуклеиновыми кислотами и другими биолигандами,
содержащими фосфатные группы:
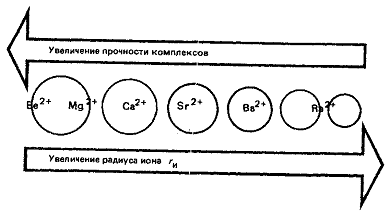
Высокопрочные тетраэдрические комплексы бериллия
(sр3
-гибридизация орбиталей) с фосфатами хорошо растворимы по сравнению с менее
прочными октаэдрическими комплексами магния (sр3d2
-гибридизация орбиталей). В результате реакции замещения введенный в организм
бериллий выводит из организмов в виде прочного комплекса фосфор (фосфатные
группы). В свою очередь, это приводит к уменьшению содержания кальция в
организме. Таким образом, в результате попадания бериллия в организм возникает
заболевание «бериллиевый рахит». Так как приведенная выше реакция является
обратимой, введение большого избытка солей магния приводит к смещению
равновесия влево (принцип Ле Шателье) и восстановлению активности фермента.
Магний и бериллий являются антагонистами, т. е.
добавление одного элемента приводит к вытеснению другого. Именно поэтому при
отравлении солями бериллия вводят избыток солей магния. Вследствие токсичности
соединения бериллия в медицинской практике в качестве лекарственных средств не
применяются.
Магний и бериллий существенно различаются
размерами атомов и ионов. Больший размер иона магния обусловливает и более
высокое координационное число этого иона, как правило, равное 6 в комплексных
соединениях с биолигандами. Химические связи иона магния с донорными атомами
кислорода и азота биолигандов имеют более ионный характер по сравнению со
связями иона бериллия. В отличие от всех остальных катионов IIА-группы,
для которых предпочтительнее координация с атомами кислорода, ионы Mg+
преимущественно координируются с атомами азота.
Комплексные соединения магния играют огромную
роль в жизнедеятельности растительных и животных организмов.
Так, например, ион Mg2+ является
комплексообразователем в пигменте зеленых растений − хлорофилле−
бионеорганическом соединении, играющем важную роль в процессе фотосинтеза:
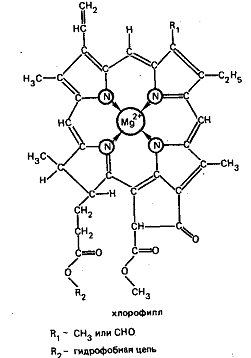
Во внутриклеточной жидкости, для которой
характерно содержание ионов Mg2+,
аденозинтрифосфат (АТФ) и аденозиндифосфат (АДФ) присутствуют в основном в виде
комплексов MgАТФ2- и
MgАДФ- :
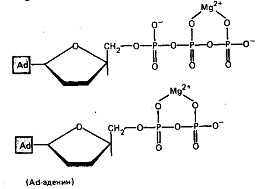
Реакции образования комплексов запишутся в виде:
2+
+ АТФ4- ↔MgATФ2-
Mg2- + АДФ3- ↔MgАДФ-
Во многих ферментативных реакциях, в которых АТФ
выполняет функцию донора фосфатной группы, активной формой АТФ является
комплекс МgАТФ2-.
Необходимо отметить, что от концентрации ионов Mg2+ зависит
устойчивость рибосом. Ион Mg2+ образует шестикоординационные
соединения регулярной структуры в отличие от большого по размеру иона Са2+.
Кальций проявляет координационные числа 6, 7 или
8 и образует несимметричные комплексы. Возможным следствием является различная
биологическая роль этих элементов в живых организмах. Способность ионов Са2+
образовывать комплексные соединения различного строения позволяет им
легко «приспосабливаться» к окружающим их донорным атомам биолигандов и служить
мостиками между лигандами. Очевидно, именно поэтому ион Са2+ гораздо
эффективнее по сравнению с ионом магния вступает в качестве мостика между двумя
лигандами во внеклеточном пространстве.
Интересно отметить, что ион Са2+ обычно
бывает антагонистом иона Mg2+ в биохимических процессах. Впрочем, в
этом нет ничего удивительного, поскольку физико-химические характеристики этих
элементов существенно различаются (= 148 кДж/моль, различные координационные
числа и т.д.). Так, ионы Са2+ подавляют активность многих ферментов,
активируемых ионами Mg2+, например аденозинтрифосфатазу.
Антагонизм ионов кальция и магния проявляется и
в том, что в отличие от магния ион кальция является внеклеточным катионом. При
длительном поступлении в организм избыточных количеств солей магния наблюдается
усиленное выделение кальция из костной ткани и некоторых белков.
Синергизм ионов магния и кальция наблюдают в
активации некоторых ферментов, однако в большинстве случаев ион Mg2+
является активатором внутриклеточных ферментов, а ион кальция - внеклеточных.
Гораздо ближе физико-химические свойства иона
магния и иона марганца Мn2+.
Вследствие этого последний часто выступает синергистом иона Mg2+.
Например, оба эти иона активируют такие ферменты, как различные фосфатазы и др.
Предполагается, что активация фермента лейцинаминопептидазы ионами Mg2+
и Мn2+
происходит. вследствие образования комплекса:
Н Н СОО-
.-С-С-N-С-R,
I I I 2N О Н
где М2+-Mg2+ или Mn2+.
Так как кальций по физико-химическим характеристикам
(радиус ионов, энергия ионизации, координационные числа) близок к стронцию и
барию, то, как правило, ионы этих элементов являются синергистами иона кальция.
Сходство в размерах ионов кальция и стронция приводит к наличию постоянной
примеси стронция в организме.
При избытке ионов Sr2+ возникает
эндемическая уровская болезнь. Это заболевание было обнаружено у населения,
проживающего у реки Уровы в Восточной Сибири. Характерными особенностями
болезни являются размягчение и искривление костей. Анализ почвы этой местности
показал повышенное содержание в ней стронция. Вследствие этого в костной ткани
происходило вытеснение ионов кальция ионами стронция, который не способен
выполнять функции ионов Са2+. Результатом этого процесса является
возникновение стронциевого рахита.
Токсичны и соли бария. Механизм действия этих
солей заключается в том, что ионы Ва2+, имея одинаковый радиус с
ионом К+, конкурируют с ним в биохимических процессах. В результате такой
взаимозамещаемости возникает гипокалиемия. Ионы бария могут проникать и в
костные ткани, вызывая эндемические заболевания (например, болезнь па-пинг).
Элементы ПА-группы, за исключением бериллия,
обладают выраженными металлическими свойствами. В виде простых веществ они
представляют собой серебристо-белые металлы с высокими температурами плавления.
По плотности, за исключением радия, они относятся к легким элементам.
Вследствие существенного различия в строении пространственных кристаллических
решеток многие физические свойства в ряду Be-Ra изменяются незакономерно
(плотность, температуры плавления и кипения).
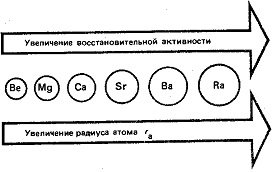
Элементы IIА-группы
- сильные восстановители, причем восстановительная активность с увеличением
радиуса атома в ряду Be-Ra закономерно возрастает. Подобно щелочным металлам,
они легко окисляются на воздухе, но при этом образуются оксиды ЭО, а не
пероксиды:
Как и щелочные металлы, кальций, стронций,
барий, радий вытесняют водород из воды даже при комнатной температуре. При этом
образуются гидроксиды Э(ОН)г. Активность взаимодействия с водой в ряду Са-Sr-Ва-Ra
существенно возрастает. В отличие от них бериллий не взаимодействует с водой,
так как его поверхность покрыта плотной оксидной пленкой. Магний медленно
взаимодействует с водой вследствие образования малорастворимого гидроксида
Mg(OH)2, покрывающего поверхность металла и затрудняющего дальнейшее протекание
реакции.
Среди оксидов элементов IIА-группы
в качестве лекарственного препарата применяют магний оксид MgO. Основные
свойства магния оксида и его нерастворимость в воде обуславливают его
применение в качестве антацидного средства при повышенной кислотности
желудочного сока:
(т) + 2НС1 (жел. сок) = MgCl2 (р) + Н20 (ж)
Магний оксид имеет преимущество перед натрий
водородкарбонатом NaНСОз,
так как при взаимодействии MgO с кислотой желудочного сока не происходит
выделение углерода диоксида. Поэтому при действии магния оксида не наблюдается
гиперсекреции. Образующийся при реакции магний хлорид, переходя в кишечник,
оказывает легкий послабляющий эффект (осмотическое действие).
Смесь магний оксида MgO (85%) и магний пероксида
Mg02 (15%) является препаратом, известным под названием «магний перекись». Этот
препарат применяют при желудочно-кишечных расстройствах. Эффект частично связан
с антацидньгм действием MgO, а частично - с бактерицидным действием
образующегося водородпероксида Н2О2 при растворении препарата в кислом
содержимом желудка:
O2 (т) + 2НС1 (жел.
сок) = Н202 (р) + MgCl2 (р)
Магний оксид входит и в состав цинкофосфатных
цементов (порошок «фосфат») и поликарбосиликатных цементов, которые применяют в
стоматологии в качестве постоянных пломбировочных материалов. Кроме того, MgO
входит в состав пломбировочного материала «цемент фосфат для фиксации несъемных
протезов». Этот материал быстро затвердевает, отличается прочностью, поэтому
его используют для фиксации одиночных коронок, мостов и несъемных протезов.
В основе стоматологического применения MgO, как
и других оксидов - ZnO, СаО, А120з, лежит реакция образования малорастворимых
фосфатов при перемешивании порошка фосфатных и поликарбосиликатных цементов с
жидкой фазой - НзР04∙xН20:
MgO (т) + 2Н3Р04 (р) = Mg3(P04)2 (т) + ЗН20 (ж)
Оксиды бериллия и магния не соединяются с водой,
в то время как оксиды щелочно-земельных металлов активно взаимодействуют с
водой, образуя гидроксиды:
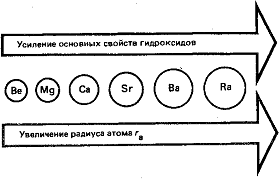
Основные свойства гидроксидов в ряду Ва-Ra
закономерно усиливаются с ростом радиуса атомов. Оксиды и гидроксиды всех
s-элементов ПА-группы, за исключением бериллия, проявляют только основные
свойства. Бериллий оксид и гидроксид - амфотерны, они могут взаимодействовать
как с кислотами
ВеО (т) + 2НС1 (р) = ВеС12 (р) + Н20 (ж)
Ве(ОН)2 (т) + 2НС1 (р) = ВеС12 (р) + 2Н20 (ж)
так и с щелочами:
ВеО (т)
+ 2NaOH (р) + Н2
0 (ж)
= Na2[Be(OH)4 ] (р)
Ве(ОН)2 (т) +2NaOH (р) = Na2[Be(OH)4] (р)
Амфотерность бериллия проявляется и в том, что в
отличие от остальных элементов этой группы он растворяется в щелочах:
(т) + 2NaOH (р) + 2Н20 (ж) = Na2[Be(OH)4] (р) +
Н2 (г)
Из гидроксидов s-элементов ПА-группы в
стоматологической практике используют кальций гидроксид, входящий в состав
цемента и пасты, применяемые в качестве пломбировочного материала для лечебных
прокладок.
Подобно щелочным металлам щелочно-земельные при
высокой температуре окисляются водородом до гидридов ЭН2. При нагревании
s-элементы ПА-группы взаимодействуют с азотом, фосфором, углеродом, галогенами
и другими неметаллами. В медицинской практике эти соединения, за исключением
галогенидов ЭГ2, не находят применения.
Многие соли элементов ПА-группы малорастворимы в
воде. Так, среди галогенидов малорастворимы CaF2, MgF2; практически
нерастворимы фосфаты магния и щелочно-земельных металлов Э3 (Р04)2, а из.
сульфатов хорошо растворимы только BeS04 и MgS04. С ростом порядкового номера
элемента растворимость этих солей обычно понижается. Такой характер изменения
растворимости солей играет важную роль в биологическом действии катионов этой
группы. Так, уменьшение растворимости кальция фосфата и карбоната по сравнению
с аналогичными соединениями магния является, по-видимому, одной из причин
формирования скелета всех живых организмов именно из этих соединений кальция.
В живых организмах из ионов кальция и
фосфат-ионов образовался кристаллический минерал гидроксилапатит Са10(Р04) 6
(ОН)2 - основное вещество костной и зубной тканей.
Хотя магний является макроэлементом, его
соединения не сыграли значительной роли в построении скелета. Очевидно, это
связано с лучшей растворимостью магния фосфата Mg3(P04)2 и основного карбоната
Mg(OH)2 ∙ 4MgC03 ∙ H20 по сравнению с кальцием фосфатом и
карбонатом.
Так как микроэлементы стронций и барий по
физико-химическим характеристикам (радиусы ионов, энергия ионизации,
координационные числа и т. д.) сходны с кальцием, то, попадая в больших
количествах в организм, они могут замещать ионы кальция в костной ткани. Такое
замещение имеет место вследствие того, что растворимость фосфатов
щелочно-земельных металлов уменьшается в ряду Са - Sr - Ва и равновесие:
SrX2 (р) + Са3(Р04)2 (т) ↔ Sr3(P04)2 (т) +
ЗСаХ2 (р)
где X = С1−, НСО3−
и др., смещается вправо
Как уже упоминалось, именно в результате
замещения ионов кальция в костной ткани на стронций возникает «стронциевый»
рахит - повышенная ломкость костей. Образование очень прочного и
малорастворимого бария фосфата Ваз(Р04)2 в костной ткани, нервных клетках и
мозговом веществе обусловливает токсичность иона Ва2+.
Однако следует отметить, что в активации
некоторых ферментов ионы бария и стронция являются синергистами кальция.
Многие соли кальция и магния находят применение
в медицине. Антацидным и легким слабительным действием обладает магний карбонат
основной Mg(OH)2∙4MgC03∙H20 (белая магнезия), механизм действия
которого аналогичен магния оксиду MgO.
Магний сульфат (горькая соль) MgS04∙7H2O
оказывает при парентеральном введении успокаивающее действие на центральную
нервную систему. В зависимости от дозы может наблюдаться седативный, снотворный
или наркотический эффект. Действие препарата основано на том, что ионы Mg2+
в зависимости от концентрации блокируют или обеспечивают нервно-мышечную
передачу, они понижают возбудимость дыхательного центра, а также угнетают
сосудо-двигательный центр, вследствие чего снижают артериальное давление.∙7H20
применяют и как слабительное. При пероральном приеме магния сульфата из-за
плохой его всасываемости, как и в случае Na2S04∙10H2O, в просвете
кишечника создается высокое осмотическое давление, что приводит к диффузии воды
в просвет кишечника. В результате этого происходит разжижение и увеличение
объема кишечного содержимого, что обусловливает акт дефекации.
В качестве адсорбирующего и обволакивающего
средства в медицине широко применяют силикатное производное Mg - тальк 2MgSi03∙Mg(HSi03)2.Это
соединение используют также в качестве компонента для приготовления
лекарственных форм - паст и таблеток.
Используют кальций хлорид при отравлении солями
магния, а также оксалат- и фторид-ионами. Применение препарата в первом случае
основано на взаимозамещаемости ионов кальция и магния в организме, а во втором
случае - на, образовании нетоксичных малорастворимых соединений кальция оксалата
и фторида:
Са2+ (р) + С202-
(р) = СаС204 (т)
Са2+ (р) + 2F-
(р) = CaF2
(т)
Антацидным и адсорбирующим действием обладает
кальций карбонат СаСОз. Его назначают внутрь при повышенной кислотности
желудка, так как он нейтрализует соляную кислоту:
СаСОз (т) + 2НС1 (жел. сок) = СаС12
(р) + Н20 (ж) + С02 (г)
Кальций сульфат (жженый гипс) СаSО4∙½Н2О
применяют для приготовления гипсовых повязок при переломах, а также в качестве
слепочного материала при протезировании зубов. Получают жженый гипс обжигом гипса
CaS04∙2H20
при температуре не выше 453 К:
CaS04•2Н20
= CaS04•1/2Н20
+ 3/2 Н20
При замешивании жженого гипса в небольшом
количестве воды происходит образование гипса. Этот процесс называется
схватыванием гипса:
CaS04∙½H20
(т) + 3/2H2O
(ж) = CaS04-2H20
(т)
Затвердевание гипсового теста сопровождается
некоторым увеличением объема, что способствует получению хороших слепков.
Находит применение в медицине и радиоактивный
изотоп 45Са. С помощью этого изотопа были изучены процессы
всасывания и распределения кальция в организме, отложения его в костях и
выведение при нормальной жизнедеятельности организма и различных патологиях.
Поскольку ионы бария и стронция обладают
токсическим действием, их соединения практически не применяются в медицине.
Исключение составляет барии сульфат, который не подвергается гидролизу и не
растворяется в соляной кислоте желудочного сока, вследствие чего и отсутствует
токсическое действие при приеме этого вещества внутрь. Применяют эту соль для
рентгеновской диагностики заболеваний пищеварительного тракта в качестве
контрастного вещества, так как BaS04
сильно поглощает рентгеновские лучи. Но следует учитывать, что отдельные люди
обладают повышенной чувствительностью к этому соединению.
Биологическая роль s-элементов
IIА-группы
Их применение в медицине бериллий постоянно
находится в растениях, а также в организмах животных. В последние годы
появились сообщения, что содержание бериллия в живых организмах составляет ~ 10-7%,т.
е. он является примесным ультрамикроэлементбм. Биологическая роль бериллия
изучена недостаточно. Известно, что соединения бериллия токсичны и вызывают ряд
заболеваний (бериллиевый рахит, бериллиоз и т.д.). Особенно токсичны летучие
соединения бериллия. Как уже было рассмотрено выше, отрицательное влияние иона
Ве2+ на физиологические процессы можно объяснить его химическими
свойствами (способностью образовывать прочные связи с биолигандами и хорошей
растворимостью фосфатов бериллия).
Магний
формально относится к макроэлементам. Общее содержание его в организме 0,027%
(около 20 г). Топография магния в организме человека такова: в наибольшей
степени магний концентрируется в дентине и эмали зубов, костной ткани.
Накапливается он также в поджелудочной железе, скелетных мышцах, почках, мозге,
печени и сердце (рис.). У взрослого человека суточная потребность в магнии
составляет около 0,7 г. Ион магния, так же как и ион калия, является
внутриклеточным катионом.
В биологических жидкостях и тканях организма
магний находится как в виде акваиона, так и в связанном с белками состоянии в
количестве < 10, т. е. по сущности это микроэлемент.
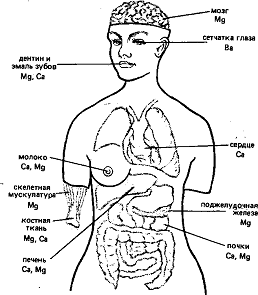
Рис. Топография s-элементов
ПА-группы в организме человека
Концентрация ионов магния внутри клеток примерно
в 2,5-3 раза выше, чем во внеклеточных жидкостях. Ионы магния играют важную
биологическую роль в организме человека. Вследствие меньшего радиуса иона и
большей энергии ионизации ион Mg2+ образует более прочные связи, чем
ион кальция, и поэтому является более активным катализатором ферментативных
процессов. Входя в состав различных ферментативных систем, ион магния является
их незаменимым компонентом и активатором (такие ферменты, как
карбоксипептидаза, холинэстераза и некоторые другие, являются специфическими
для иона магния).
Гидролиз АТФ, сопряженный с рядом ферментативных
реакций, в результате которых образуется гидрофосфат-ион НРО2- и выделяется
большое количество энергии, проходит при обязательном избытке ионов Mg2+.
Кальций относится к макроэлементам. Общее
содержание его в организме 1,4% .Кальций содержится в каждой клетке
человеческого организма. Основная масса кальция находится в костной и зубной
тканях (см. рис.). В среднем взрослый человек в сутки должен потреблять 1 г
кальция, хотя потребность в кальции составляет только 0,5 г. Это связано с тем,
что кальций, вводимый с пищей, только на 50% всасывается в кишечнике.
Сравнительно плохое всасывание является следствием образования в
желудочно-кишечном тракте труднорастворимых кальция фосфата Са3(Р04)2 и
кальциевых солей жирных кислот:
ЗСа2+ (р)+2Р043- (р) ↔
Са3(Р04)2 (т)
Са2+ (р) +2R-СООН (р) ↔
(RCOO)2Ca (т) + 2Н+ (р)
В организме концентрация ионов кальция
регулируется гормонами.
В костях и зубах взрослого человека около 1 кг
кальция находится в виде нерастворимого кристаллического минерала - гидроксилапатита
Са10(Р04) 6 (ОН)2, образование которого происходит при взаимодействии ионов
кальция с фосфат-ионами.
В крови и лимфе кальций находится как в
ионизированном, так и в неионизированном состоянии - в соединениях с белками,
углеводами и др. Механизм свертывания крови состоит из ряда этапов, многие из
которых зависят от наличия ионизированного Са2+. Ионы кальция
принимают активное участие в передаче нервных импульсов, сокращении мышц,
регулировании работы сердечной мышцы.
Концентрации ионов кальция Са2+
внутри и вне клетки соответственно составляют 10-6 и (2,25-2,8) 10-3
моль/л. Поскольку кальций практически не используется внутри клетки, он
выступает в качестве строительного материала в организме,в костях, зубах.
Скелет - основное хранилище кальция в организме.
Стронций
относится к примесным микроэлементам. Его содержание в организме 10-3%.
Концентрируется стронций главным образом в костях, частично замещая кальций.
Важную роль играет стронций в процессах костеобразования (остеогенеза). При
введении в организм радиоактивного изотопа 90Sr установлено, что он
в наибольшей степени накапливается в тех местах, где происходит интенсивный
остеогенез. Определение содержания стронция в плазме и эритроцитах используют
для диагностики и прогнозирования заболеваний лейкозом. Этот тест связан с тем,
что при лейкозах содержание стронция в плазме крови уменьшается, а в
эритроцитах увеличивается.
Образующийся при ядерных взрывах радиоактивный
изотоп 90Sr вызывает лучевую болезнь. Он поражает костную ткань, в
особенности костный мозг. Накопление 90Sr в атмосфере и организме
человека способствует развитию лейкемии и рака костей. Применение кислоты -
этилендиаминтетраацетата (ЭДТА) для удаления ионов 90Sr из организма
приводит к дополнительному вымыванию кальция из костей. Поэтому в настоящее
время в этих целях используют не кислоту, а ее комплекс Nа2СаЭДТА.
Вместе с тем радиоактивные изотопы 89Sr
и 90Sr применяют в лучевой терапии при лечении костных опухолей.
Барий
также является примесным микроэлементом. Общее содержание его в организме
составляет 1∙10-5%. Концентрируется барий преимущественно в
сетчатке глаза (см. рис.). Биологическая роль его пока не выяснена. Так как при
лейкозах содержание бария в эритроцитах и плазме крови увеличивается,
количественное определение бария может служить диагностическим тестом на
заболевание лейкозом. Как уже отмечалось, ионы бария являются токсичными для
организма.
Радий
относится к примесным микроэлементам. Общее содержание его в организме 10-11
-10-12%. Максимально допустимое содержание радия в организме
человека 1∙10-7 г. Концентрируется радий преимущественно в
костной ткани. Препараты радия 226Ra раньше применялись для лечения
злокачественных опухолей, однако в настоящее время они практически не
используются. Их заменили более дешевыми изотопами 60Со, l37Cs
и др.
экологический химия план урок
ГЛАВА 2.
Экспериментальная часть
2.1 Констатирующий срез знаний
учеников по теме: «Периодический закон Д.И. Менделеева и строение атомов»
Задача 1.
В какой группе и в каком периоде периодической системы элементов Д.И.
Менделеева находится элемент с порядковым номером 42?
Решение.
Расположение элементов в периодической системе в соответствии со строением их
атомов следующее: в первом периоде 2, во втором 8, в третьем 8. Третий период
заканчивается элементом с порядковым номером 18 (2 + 8 + 8 = 18). В четвертом
периоде 18 элементов, т.е. он заканчивается элементом с порядковым номером 36.
В пятом периоде также 18 элементов, поэтому элемент с порядковым номером 42
попадает в пятый период. Он занимает шестое место, следовательно, находится в
шестой группе. Этот элемент - молибден (Мо).
Задача 2.
Какой из элементов - литий или калий - обладает более выраженными
металлическими свойствами?
Решение.
Строение электронных оболочек атомов натрия и цезия можно представить следующим
образом:
Li −1s²2s¹ и
K −1s²2s²2p63s²3p64s¹
или
сокращенно
[He]s¹ и [Ar]s¹.
Как видим, у обоих атомов на внешнем
энергетическом уровне находится по одному электрону. Однако у атома калия
внешний электрон расположен дальше от ядра (на четвертом энергетическом уровне,
а у натрия - на втором) и, следовательно, легче отрывается. Поскольку
металлические свойства обусловлены способностью отдавать электроны, они сильнее
выражены у калия.
Задача 3.
Какие соединения с водородом образуют элементы главной подгруппы VI
группы? Назовите наиболее и наименее прочное из них.
Решение. Элементы
главной подгруппы УI группы - р-элементы. У них на внешнем электронном уровне
по 6 электронов: ns²np4.
Следовательно, в соединениях с водородом они проявляют степень окисления -2.
Формулы соединений: Н2O,H2S,
H2Se,H2Те,
Н2Ро. С ростом порядкового номера элемента (от кислорода к полонию)
увеличивается радиус атома, что обусловливает уменьшение прочности соединения с
водородом (от H2O
к H2Ро). Таким
образом, из названных соединений наиболее прочным является вода Н2O,
наименее прочным - Н2Ро.
Задача 4. Опишите
химические свойства элемента с порядковым номером 23 по его положению в
периодической системе.Решение. По периодической системе определяем, что
элемент с порядковым номером 23 находится в четвертом периоде и в побочной
подгруппе V группы. Этот
элемент - ванадий V.
Электронная формула ванадия V:
1s²2s22p63s²3p63d34s²
или
сокращенно [Аг] 3d34s².
По
электронной формуле заключаем, что ванадий - d-элемент.
Элемент может легко отдавать 2 электрона с 4-уровня, проявляя степень окисления
+2. При этом он образует оксид VO
и гидроксид V(OH)2,
проявляющие основные свойства. Газообразных водородных соединений ванадий не
образует, так как расположен в побочной подгруппе. Атом ванадия может также
отдавать электроны с d-подуровня
предпоследнего энергетического уровня (3 электрона) и, таким образом, проявляет
высшую степень окисления +5 (численно равную номеру группы, в которой
расположен элемент). Оксид, соответствующий высшей степени окисления, V2O5.
Этот оксид обладает кислотными свойствами. В качестве гидроксида ему
соответствует неустойчивая метаванадиевая кислота HVO3
(соли ее - ванадаты - устойчивые соединения).
Задача 5.
Элемент астат (изотоп 21185At)
был получен облучением изотопа висмута 20983Bi
α-частицами
(ядрами атома гелия). Напишите уравнение ядерной реакции полной и сокращенной
формах.
Решение. При
составлении уравнений ядерных реакций необходимо учитывать закон сохранения
массы веществ (массы электронов при этом не учитываются). Кроме того, заряды
всех частиц в левой и правой частях должны быть равны. В левой части записываем
взаимодействующие ядра, в правой - продукты реакции. Учитывая порядковые номера
и относительные массы атомов, записываем схему реакции: 20983Вi
+ 42α → 21185At
+ xОчевидно, частица х
должна иметь заряд 0 (так как 83 + 2 = 85) и атомную массу 209 + 4 - 211 = 2.
Частица с зарядом 0 - это нейтрон 10n,
следовательно, должно образоваться 2 нейтрона. Окончательный вид уравнения
2О983Вi
+ 42α
→
21185 At
+ 210n
или в сокращенной форме
209Bi(α,
2n)211At
Задача
6. Напишите
электронную формулу элемента, атом которого содержит на Зd-подуровне
один электрон. В каком периоде, группе и подгруппе он находится и как этот
элемент называется? Решение. В соответствии со шкалой энергии, 3d-подуровень
заполняется после заполнения подуровня 4s²:
1s²2s²2p63s²3p64s²3d¹
или
1s²2s²2p63s²3p63d¹4s²
Общее число электронов в атоме, которое
определяет порядковый номер элемента в периодической системе, - 21. Это скандий.
Из электронной формулы видно, что этот элемент находится в четвертом периоде,
третьей группе (три валентных электрона 3d¹4s²),
побочной
подгруппе (элемент d-семейства).
Мои уроки
Настоящая глава посвящена тому, как я провела
уроки. Первый урок я провела по традиционной методике, а второй с элементами
экологизации.
.2 Конспект урока по теме: «S-элементы
и их соединения»
Цель: характеризовать
общие свойства S-элементов
ПСХЭ
Задачи:
Образовательные:
1. характеризовать общие свойства s-элементов
и зависимость химических свойств соединений s-элементов
от свойств атомов;
. применять знания по общей химии для
характеристики элементов и их соединений.
Развивающие:
1. закрепить знания учащихся о распределении
электронов в атоме;
. формировать умения написания электронных
формул веществ;
. формировать умения определять вид ковалентной
связи.
Воспитательные: воспитывать
умение работать в сотрудничестве, оказывать взаимовыручку и взаимопомощь.
Ход урока:
. Организационный момент
Добрый день! Сегодня мы начинаем изучение новой
темы «S-элементы и их
соединения». Для лучшего понимания нового материала необходимо освежить
изученный ранее материал.
2. Актуализация знаний
№1. Изобразить схему строения атомов и электронную
формулу атомов углерода и кремния.
№2. Изобразить схему строения атомов и
электронную формулу атомов азота и аргона.
№3. Изобразить схему строения атомов и
электронную формулу атомов неона и хлора.
Остальные учащиеся выполняют самостоятельную работу
ВАРИАНТ 1
. Сколько
орбиталей в атоме водорода, на которых находятся электроны?
а) 1; б) 2; в) 3; г) 4.
2. Атом какого
химического элемента содержит три протона?
а) B; б) P; в) Al; г) Li.
3. Атом какого
химического элемента имеет заряд ядра +22?
а) Na; б) P; в) О; г) Ti.
4. Число
нейтронов в атоме марганца равно:
а) 25; б) 29; в) 30; г) 55.
5. Количество
неспаренных электронов в атоме серы равно:
а) 1; б) 2; в) 3; г) 4.
ВАРИАНТ 2
. Сколько
орбиталей в атоме гелия, на которых находятся электроны?
а) 1; б) 2; в) 3; г) 4.
2. Атом какого
химического элемента содержит десять электронов?
а) S; б) H; в) Ne; г) Li.
3. Атом какого
химического элемента имеет заряд ядра +35?
а) Ni; б) Pt; в) Br; г) Te.
4. Число
нейтронов в атоме цинка равно:
а) 65; б) 22; в) 30; г) 35.
5. Количество
неспаренных электронов в атоме хлора равно:
а) 1; б) 2; в) 3; г) 4.
ОТВЕТЫ
Вариант 1
- а, 2 - г, 3 - г, 4 - в, 5
- б.
Вариант 2
- а, 2 - в, 3 - в, 4 - г, 5
- а.
Ответы к заданию учащиеся сдают учителю.
Проверка индивидуального задания у учащихся,
работавших у доски.
Дополнительные вопросы:
Ø У каких элементов внешний
электронный слой завершен? Незавершен?
Ø Сколько электронов не хватает до
завершения внешнего электронного слоя?
3. Изучение нового материала
К s-элементам
относятся две группы Периодической системы: IА
и IIА.
В группу IА
входят 8 элементов: литий, калий, натрий, рубидий, цезий, франций, водород,
гелий. В группу IIА
входят 6 элементов: бериллий, магний, кальций, стронций, барий, радий.
Общим является застраивание в их атомах
электронами s-подуровня внешнего
энергетического уровня. (Т.Е. говорим о "семействе элементов".
ВСПОМИНАЕМ: "семейство элементов" определяется тем, какой подуровень
заполняется электронами в последнюю очередь.)
S-Элементы
расположены в IIА подгруппе
периодической системы Д.И. Менделеева (Это Берилий, Магний, Кальций, Стронций,
Барий, Радий). На внешнем электронном уровне у них имеется два электрона,
которые легко отдают атомы s-элементов,
превращаясь в двузарядные ионы. С увеличением числа валентных электронов на
энергеическом уровне энергия ионизации атомов увеличивается (Энергия ионизации
- это энергия, необходимая для отрыва наиболее слабо связанного электрона от
атома), а следовательно, восстановительные свойства атомов уменьшаются.
Входящие в состав этой группы кальций, стронций
и барий издавна получили название щелочно-земельных металлов. Такое название
связано с тем, что гидроксиды этих элементов обладают щелочными свойствами, а
их оксиды по тугоплавкости сходны с оксидами алюминия и тяжёлых металлов,
носивших прежде общее название земель.
Электронная формула внешней оболочки:

Элементы IIА
группы - металлы серебристо-белого цвета, легкие и довольно твёрдые. Они
непосредственно соединяются с кислородом, водородом, галогенами, серой, азотом,
фосфором и углеродом. На воздухе покрываются защитной плёнкой, которая состоит
из оксидов и частично нитридов и карбонатов.
В свободном виде эти металлы получают главным
образом электролизом их расплавленных солей. Радий выделяют обработкой урановых
руд. В воде катионы s-элементов
гидратированы и образуют аквакомплексы ([Ca(H2O)6]2+)
за счёт электростатического притяжения дипольных молекул воды. Поскольку
электронная оболочка ионов s-элементов
имеет устойчивую конфигурацию инетрного газа и лиганды (молекулы воды) мало
влияют на состояние электронов, все они в водных растворах бесцветны. Ионы s-элементов
в водных растворах могут образовывать комплексные соединения с органическими и
неорганическими лигандами, но устойчивость этих комплексов мала, так как s-элементы
образуют с лигандами связь, приближающуюся к ионной. Наименьшая устойчивость
комплексных соединений наблюдается у ионов с большим радиусом и малым зарядом.
У катионов IIА группы с
повышением заряда и уменьшением радиуса устойчивость комплексов увеличивается.
Соли элементов IIА
группы подвергаются гидролизу в том случае, когда соль образована сильным
основанием и слабой кислотой. При растворении такой соли в воде она полностью
диссоциирует. Образуется слабая кислота и гидроксид-ионы:
А- +НОН = НА + ОН-
Р-ры таких солей имеют елочную реакцию среды.
Гидролиз идёт по аниону.
Щелочноземельные металлы могут соединяться с
водородом, образуя гидриды, аналогичные гидридам щелочных металлов.
Замечательна склонность щелочноземельных металлов соединяться с азотом,
возрастающая по мере увеличения их атомной массы. Уже при комнатной температуре
щелочноземельные металлы медленно соединяются с азотом, образуя нитриды.
Говоря о том, сколь часто встречаются природе
атомы того, или иного элемента, обычно указывают его распространенность в
земной коре. Под земной корой понимают атмосферу, гидросферу и литосферу нашей
планеты. Так, в земной коре наиболее распространены четыре из этих тринадцати
элементов:
Na (w =2,63%), K (w = 2,41%), Mg (w
= 1,95%) и Ca (w = 3,38%).
Остальные встречаются значительно реже, а
франций вообще не встречается.
Берилий открыт в 1798 г. французским химиком Луи
Никола Вокленом. Большую работу по установлению состава соединений бериллия и
его минералов провёл русский химик И.В. Авдеев. Именно он доказал, что оксид
бериллия имеет состав BeO.
Магний. В 1695 году из минеральной воды
Эпсомского источника в Англии выделили соль, обладавшую горьким вкусом и
слабительным действием. Аптекари называли её горькой солью. Минерал эпсомит
имеет состав MgSO4·7H2O.
Латинское название элемента происходит от названия древнего города Магнезия в
Малой Азии, в окрестностях которого имеются залежи минерала магнезита. Впервые
магний был выделен в чистом виде сэром Хемфри Дэви в 1808 году. Большие
количества магния находятся в морской воде. Магнезиальные соли встречаются в
больших количествах в солевых отложениях самосадочных озёр. Месторождения
ископаемых солей карналлита осадочного происхождения известны во многих
странах.
Из-за высокой химической активности кальций в
свободном виде в природе не встречается. На долю кальция приходится 3,38% массы
земной коры. Новый элемент обнаружили в минерале стронцианите, найденном в 1764
году в свинцовом руднике близ шотландской деревни Строншиан, давшей
впоследствии название новому элементу. В свободном виде стронций не
встречается. Он входит в состав около 40 минералов. Из них наиболее важный -
целестин. Чаще всего стронций присутствует как примесь в различных кальциевых
минералах.
Барий был открыт в виде оксида BaO
в 1774 г. Карлом Шееле. Своё название получил от древнегреческого
"тяжёлый", так как его оксид (BaO)
был охарактеризован, как имеющий необычно высокую для таких веществ плотность.
В Российской Федерации радий впервые был получен в экспериментах известного
советского радиохимика В.Г. Хлопина. Название "радий" связано с
излучением ядер атомовради.
Реакции комплексообразования
соединений IIA
группы
Be + 2NaOH
+2H2O
= Na2[Be(OH)4]
+ H2(газ)
- тетрагидроксобериллат натрия.
BeF2
+ 2KF = K2[BeF4]
- тетрафторбериллат калия.
Be(OH)2 + 2NaOH = Na2[Be(OH)4]2+
+ 2CO32-
> [Be(CO3)2]2-
. Качественные реакции на ионы
магния, кальция, стронция, бария
Катионы магния, кальция, бария и стронция
относятся ко II
аналитической группе, которая характеризуется наличием группового реагента (NH4)2CO3,
осаждающего любой из приведённых катионов из его раствора.
Реакции обнаружения катиона магния Mg2+
Групповой реагент.
Карбонат аммония с раствором соли магния образует белый амфотерный осадок
основной соли (MgOH)2CO3,
растворимый в избытке NH4Cl
2MgCl2 + 2(NH4)2CO3
+ H2O = (MgOH)2CO3(осадок) + CO2(газ)
+ 4NH4Cl,
Mg2+ + 2CO32-
+ H2O = (MgOH)2CO3(осадок) + CO2(газ)
Реакции обнаружения катиона бария Ba2+
Групповой реагент.
Карбонат аммония осаждает катион бария из растворов его солей в виде белого
аморфного постепенно кристаллизирующегося осадка BaСО3
BaCl2 + (NH4)2CO3
= BaCO3(осадок) + 2NH4Cl,2+
+ CO32-
= BaCO3(осадок).
Осадок хорошо растворим в кислотах, в том числе
и слабых.
Обнаружение.
Дихромат калия K2Cr2O7
образует с раствором соли бария жёлтый осадок BaCrO4,
нерастворимый в уксусной кислоте, в отличие от хромата стронция:
2Ba2+ + Cr2O72-
+ H2O = 2BaCrO4(осадок) + 2H+.
Реакции обнаружения катиона кальция Ca2+
Групповой реагент.
Карбонат аммония осаждает из растворов солей
кальция аморфный белый осадок CaCO3,
который при нагревании переходит в кристаллический:
CaCl2 + (NH4)2CO3
= CaCO3(осадок) + 2NH4Cl,2+
+ CO32-
= CaCO3(осадок).
Осадок легко растворяется в минеральных и
уксусной кислотах.
Обнаружение.
Оксалат аммония образует с раствором соли кальция белый кристаллический осадок,
растворимый в соляной, но не растворимый в уксусной кислоте.
CaCl2 + (NH4)2C2O4
= CaC2O4(осадок) + 2NH4Cl,2+
+ C2O42-
= CaC2O4.
Аналогичный осадок дают ионы бария и стронция,
поэтому этой реакцией можно обнаружить кальций только при отсутствии этих двух
ионов.
Реакции обнаружения катиона стронция
Sr2+
Групповой реагент. Карбонат
аммония при взаимодействии с растворами солей стронция осаждает карбонат
стронция белого цвета, растворимый в уксусной, соляной и азотной
кислотах:
SrCl2
+ (NH4)2CO3 = SrCO3(осадок) + 2NH4Cl.
Обнаружение. Насыщенный
раствор гипса образует с ионами Sr2+ белый
осадок сульфата стронция:
Sr2+ + SO42- = SrSO4(осадок).
Однако при действии гипсовой воды
ион стронция даёт не обильный осадок, а только помутнение, появляющееся не
сразу из-за образования пересыщенного раствора. Появление осадка ускоряется
нагреванием.
Биологическая роль магния и кальция:
содержание в организме, суточная потребность, локализация в органах и тканях,
значение для организма
Биороль магния: Всего в
организме человека содержится около 40г магния, из них более половины находится
в костной ткани. Основная масса магния, находящегося вне костей, сосредоточена
внутри клеток. Ионы магний 2+ являются вторыми по содержанию внутриклеточными
катионами после ионов калия. Поэтому ионы магния играют важную роль в
поддержании осмотического давления внутри клеток. В организме человека и
животных ионы магния являются одними из основных активаторов ферментативных
процессов. Ионы магния, введённые подкожно или в кровь, вызывают угнетение
центральной нервной системы и приводят к наркотическому состоянию, понижению
кровяного давления и т.д. Топография магния в организме человека следующая:
дентин и эмаль зубов, кости скелета, поджелудочная железа, скелетные мышцы,
почки, мозг, печень и сердце. Суточная потребность в магнии взрослого человека
- около 10 мг на 1кг массы тела. Ионы магния тормозят выделение ацетилхолина,
способствуют выделению холестерина из организма, стимулируют перистальтику
кишок и желчеотделение, влияют на углеводно-фосфорный обмен и синтез белка.
Ионы магния являются антагонистами ионов кальция.
Кальция: Это один из
пяти (O, C, H, N, Ca) наиболее
распространённых элементов в организме человека (1,5%). Основная масса
имеющегося в организме кальция находится в костях и зубах. В составе плотного
матрикса кости входит термодинамически и кинетически устойчивая при pH 7,40 форма
фосфата кальция - гидроксифосфат кальция Ca5(PO4)3OH. Фракция
внекостного кальция, хотя она составляет всего 1% его общего содержания в
организме, очень важна из-за её воздействия на свёртываемость крови,
нервно-мышечную возбудимость и сердечную мышцу. Суточная потребность организма
в кальции 0,8-0,9 г. Ионы кальция принимают участие в передаче нервных
импульсов, сокращении мышц, регулировании работы сердца, свёртывании крови. Его
уменьшение в организме сопровождается возбуждением нервной системы. Ионы
кальция влияют на кислотно-основное равновесие, функцию эндокринных желёз. Находится
в антагонизме с ионами калия, натрия и магния.
4. Закрепление материала
Задание по группам:
-3 группа: На чем основано применение натрия
тетрабората Na2B4O7
* 10H2O
в качестве антисептического средства?
-6 группа: Почему при отравлении солями бериллия
добавляют избыток солей магния?
Два ученика работают у дополнительной доски с
этим же заданием для образца к самопроверке.
Вывод по теме урока.
Оценки за урок.
Домашнее задание:
§35-36, стр. 104-106, упр.7,8 ;задача 3
2.3 Конспект урока по теме: «S-элементы
и их соединения с элементами экологизации»
Цель: изучить
общую характеристику S-элементов
ПСХЭ
Задачи:
Образовательные:
1. изучить общую характеристику S-элементов
. раскрыть химизм действия важных лекарственных
препаратов, биологической роли s-элементов
. прогнозировать токсичность действия соединений
s-элементов.
Развивающие:
1.закрепить знания учащихся о распределении
электронов в атоме;
.формировать умения написания электронных формул
веществ;
.формировать умения определять вид ковалентной
связи.
Воспитательные: воспитывать
умение работать в сотрудничестве, оказывать взаимовыручку и взаимопомощь.
Ход урока:
1. Организационный
момент
Добрый день! Сегодня мы начинаем изучение новой
темы «S-элементы и их
соединения с элементами экологизации». Для лучшего понимания нового материала
необходимо освежить изученный ранее материал.
2. Актуализация
знаний
Задание учащимся у доски по карточкам.
(индивидуальное задание)
№1. Изобразить схему строения атомов и
электронную формулу атомов углерода и кремния.
№2. Изобразить схему строения атомов и
электронную формулу атомов азота и аргона.
№3. Изобразить схему строения атомов и
электронную формулу атомов неона и хлора.
Остальные учащиеся выполняют самостоятельную
работу
ВАРИАНТ 1
. Определите
элемент со схемой распределения электронов в атоме 2, 8, 4:
а) Mg; б) Si; в) Cl; г) S.
2.
Максимальное число электронов на третьем энергетическом уровне:
а) 14; б) 18; в) 8; г) 24.
3. Орбитали,
имеющие сферическую форму, называют:
а) s-орбиталями;
б) p-орбиталями;
в) d-орбиталями;
г) f-орбиталями.
4.
Максимальное число электронов на р-орбиталях:
а) 2; б) 6; в) 10; г) 14.
5. Укажите
химический элемент, атомы которого имеют электронную формулу
1s22s22p63s23p1:
а) Na; б)
P; в)
Al; г)
Ar.
ВАРИАНТ 2
. Определите
элемент со схемой распределения электронов в атоме 2, 8, 8:
а) Na; б) P; в) Al; г) Ar.
2.
Максимальное число электронов на четвертом энергетическом уровне:
а) 14; б) 32; в) 26; г) 18.
3. Орбитали,
имеющие гантелеобразную форму, называют:
а) s-орбиталями;
б) p-орбиталями;
в) d-орбиталями;
г) f-орбиталями.
.
Максимальное число электронов на s-орбиталях:
а) 2; б) 6; в) 10; г) 14.
5. Укажите
химический элемент, атомы которого имеют электронную формулу
1s22s22p63s23p5:
а) Mg; б)
P; в)
Cl; г)
Si.
ОТВЕТЫ
Вариант 1
- б, 2 - б, 3 - а, 4 - б,
5 - в.
Вариант 2
- г, 2 - б, 3 - б, 4 - а,
5 - в.
Ответы к заданию учащиеся сдают учителю.
Проверка индивидуального задания у учащихся,
работавших у доски.
Дополнительные вопросы:
Ø У каких элементов внешний
электронный слой завершен? Незавершен?
Ø Сколько электронов не хватает до
завершения внешнего электронного слоя?
3. Изучение нового материала
К s-элементам
относятся две группы Периодической системы: IА
и IIА.
В группу IА
входят 8 элементов: литий, калий, натрий, рубидий, цезий, франций, водород,
гелий. В группу IIА
входят 6 элементов: бериллий, магний, кальций, стронций, барий, радий.
Общим является застраивание в их атомах
электронами s-подуровня внешнего
энергетического уровня. (Т.Е. говорим о "семействе элементов".
ВСПОМИНАЕМ: "семейство элементов" определяется тем, какой подуровень
заполняется электронами в последнюю очередь.)
Биологическая роль натрия, калия,
кальция и магния
Вследствие очень легкой окисляемости щелочные
металлы встречаются в природе исключительно в виде соединений.
По содержанию в организме человека натрий
(0,08%) и калий (0,23%) относятся к макроэлементам, литий, рубидий и цезий - к
микроэлементам.
Натрий и калий относятся к жизненно необходимым
элементам, постоянно содержатся в организме, участвуют в обмене веществ.
Электронная формула внешней оболочки:

Натрий
Содержание натрия в организме человека массой 70
кг - около 60 г: 44% - во внеклеточной жидкости, 9% - во внутриклеточной.
Остальное количество натрия находится в костной ткани - место депонирования
иона Na+
в организме.
В организме человека натрий находится в виде его
растворимых солей: хлорида, фосфата, гидрокарбоната.
Распределен по всему организму:
в сыворотке крови, в спинномозговой жидкости, в
глазной жидкости, в пищеварительных соках, в желчи, в почках, в коже, в костной
ткани, в легких, в мозге.
Натрий является основным внеклеточным ионом.
Концентрация ионов Na+
внутри клетки примерно в 15 раз меньше, чем во внеклеточной жидкости.
Ионы натрия играют важную роль в обеспечении
постоянства внутренней среды человеческого организма, участвуют в поддержании
постоянного осмотического давления биожидкости (осмотического гомеостаза).
В виде противоионов в соединениях с фосфорной
кислотой (Na2HPO4
+ NaH2PO4)
органическими кислотами натрий обеспечивает кислотно-основное равновесие
организма.
Ионы натрия участвуют в регуляции водного обмена
и влияют на работу ферментов.
Вместе с ионами калия, магния, кальция, хлора
ионы натрия участвуют в передаче нервных импульсов. При изменении содержания
натрия в организме происходят нарушения функций нервной, сердечно-сосудистой
систем, гладких и скелетных мышц.
Натрия хлорид NaCl
- основной источник соляной кислоты для желудочного сока.
Ионы натрия принимают участие в формировании
разности потенциалов на мембране.
Препараты натрия, применяемые в медицине
Изотонический раствор - NaCl
(0,9%) - для инъекций вводят подкожно, внутривенно и в
клизмах при обезвоживании организма и при интоксикацях. Также применяют для
промывания ран, глаз, слизистой оболочки глаза, также для растворения различных
ЛП.
Гипертонические растворы - NaCl
(3-5-10%) - применяют наружно в виде компрессов и
примочек при лечении гнойных ран. По закону осмоса применение таких компрессов
способствует отделению гноя из ран и плазмолизу бактерий (антимикробное
действие).
2-5% р-р
NaCl
назначают
внутрь для промывания желудка при отравлении AgNO3.
Ag+(р)
+ Cl¯(р)
→ AgCl(т)
Натрия гидрокарбонат NaHCO3
используют при заболеваниях, сопровождающихся ацидозом.
Механизм
NaHCO3 + RCOOH → H2O
+ CO2 + RCOONa
RCOONa натриевые
соли органических кислот в значительной мере выводятся с мочой, CO2
- покидает организм с выдыхаемым воздухом.
NaHCO3
также используют при повышенной кислотности желудочного сока, язвенной болезни
желудка и двенадцатиперстной кишки.
NaHCO3 + HCl → H2O
+ NaCl + CO2
Имеет ряд побочных эффектов.
NaHCO3
применяют в виде полосканий, промывания при воспалительных заболеваниях глаз,
слизистых оболочек верхних дыхательных путей. В результате гидролиза NaHCO3
водный раствор имеет слабощелочные свойства. При воздействии щелочи на
микробные клетки происходит их гибель.
NaHCO3 + H2O →
NaOH + CO2 + H2O
Натрия сульфат Na2SO4*10H2O
- применяют в качестве слабительного средства. Соль медленно всасывается из
кишечника, что приводит к поддержанию повышенного осмотического давления в
полости кишечника. В результате осмоса происходит накопление воды в кишечнике,
содержимое его разжижается, сокращения кишечника усиливаются и каловые массы
быстрее выводятся.
Натрия тетраборат Na2B4O7*10H2O
- применяется наружно как антисептическое средство для полосканий,
спринцеваний, смазываний. Антисептическое действие аналогично NaHCO3,
связано со щелочной реакцией среды в результате гидролиза.
Na2B4O7
+ 7H2O
→
2NaOH + 4H3BO3
Радиоактивный изотоп 24Na
в качестве метки применяют для определения скорости кровотока, используют для
лечения некоторых форм лейкемии.
Калий
Содержание калия в организме человека массой 70
кг - около 160 г.: 2% - во внеклеточной жидкости, 98% - во внутриклеточной.
В организме человека калий находится: в крови, в
почках, в сердце, в костной ткани, в сердце,в мозге.
Калий является основным внутриклеточным ионом.
Концентрация ионов К+ внутри клетки примерно в 35 раз больше, чем во
внеклеточной жидкости. Ионы калия играют важную роль в физиологических
процессах - сокращении мышц, нормальном функционировании сердца, проведении
нервных импульсов, обменных реакциях. Являются важными активаторами
внутриклеточных ферментов.
Магний
Формально относится к макроэлементам. Общее
содержание в организме 0,027% (около 20 г). В наибольшей степени магний
концентрируется в дентине и эмали зубов, костной ткани. Накапливается в
поджелудочной железе, скелетных мышцах, почках, мозге, печени и сердце.
Является внутриклеточным катионом. Концентрация
ионов Mg2+
внутри клеток примерно в 2,5-3 раза выше, чем во внеклеточной жидкости.
Во внутриклеточной жидкости АТФ и АДФ
присутствуют, в основном, в виде комплексов MgАТФ
2- и MgАДФ 2-.
Во многих ферментативных реакциях активной
формой АТФ является комплекс MgАТФ
2-.
Препараты магния, применяемые в медицине
MgO
магния оксид - применяют в качестве антацидного
средства при повышенной кислотности желудочного сока.
MgO + HCl
→
H2O
+ MgCl2
MgCl2
- обладает легким послябляющим эффектом.
MgO
магния оксид (85%) и магния пероксид MgO2
(15%) "магний перекись". Применяют при
кишечных расстройствах.
MgSO4*7H2O
магния сульфат (горькая соль) - в зависимости от
дозы может обладать седативным, снотворным или наркотическим эффектом.
Применяют и как слабительное.
В качестве адсорбирующего и обволакивающего
средства применяют тальк силикатное производное
Mg2+
- 2 MgSiO3*
Mg(HSiO3)2.
Кальций
Относится к макроэлементам. Общее содержание в
организме - 1,4%.
Содержится в каждой клетке человеческого
организма. Основная масса - в костной и зубной тканях. В костях и зубах
взрослого человека около 1 г кальция находится в виде нерастворимого
кристаллического минерала ГИДРОКСИЛАПАТИТА - Ca10(PO4)6(OH)2.
Ионы кальция принимают активное участие в передаче нервных импульсов,
сокращении мышц, регулировании работы сердечной мышцы, механизмах свертывания
крови.
Препараты кальция, применяемые в медицине
Кальция хлорид CaCl2
- при
отравлении солями магния, также оксалат- и фторид- ионами. Применение препарата
в первом случае основано на взаимозамещаемости ионов кальция и магния в
организме, во втором - на образовании нетоксичных малорастворимых соединений.
Кальция карбонат CaCO3
- обладает антацидным и адсорбирующим действием, назначают внутрь при
повышенной кислотности желудочного сока.
Кальция сульфат CaSO4*1/2H2O
- жженый
гипс. Применяют для приготовления гипсовых повязок при переломах.
Токсичность бериллия и бария.
Водорастворимые соли бария очень ядовиты. При
остром отравлении поражаются миокард, нервная система, сосуды. Обладает
холинолитическим эффектом, вызывает гипокалиемию. При отравлении барийхлордва
повышается проницаемость сосудов, приводя к кровоизлияниям и отёкам. Поражение
нервной системы проявляется энцефалопатией, парезами, параличами. Барий
вытесняет из костей кальций и фосфор, что ведёт к остеопорозу. Обладает слабым
мутагенным действием.
Биологическая роль бериллия не выяснена. Все его
соединения ядовиты. Особенно токсичны летучие соединения и пыль, содержащая
бериллий и его соединения. Присутствие даже небольшого количества бериллия в окружающей
среде приводит к заболеванию - бериллозу. Ионы бериллия вытесняют ионы кальция
из костной ткани, вызывая её размягчение
Оценки за урок.
Домашнее задание: §5,6, стр.27-33.
Практическая работа №1
Задача 1. Марганец
получают электролизом водного раствора сульфата марганца (II)
с инертными электродами. Определите, какая масса марганца получена, если на
аноде собран кислород объемом 16,8л (нормальные условия). Учтите, что выход
кислорода количественный, а выход металла составляет 84% Решение.
Составляем уравнение электролиза раствора сульфата марганца (II) с инертными
электродами. В растворе соль диссоциирует на ионы:
MnSO4↔Mn²+
+ SO4²¯
Реакции на электродах:
катод (-) Мn²+
+ 2е¯
= Мn 2
анод (+) 2Н2O-4е¯
= 4Н+ + Î2 1
2Mn²+
+ 2H2O
электролиз__>
2Mn + 4H+
+ O2
или
2MnSO4 + 2H2O ýëåêòðîëèç_
> 2Mn + 2H2SO4 + O2
Îïðåäåëÿåì
êîëè÷åñòâî âåùåñòâà
êèñëîðîäà, ïîëó÷åííîãî
ïðè ýëåêòðîëèçå:
n(O2)=V(O2)/Vm;
n(O2)=16,8/22,4
ìîëü=0,75 ìîëü.
Èç óðàâíåíèÿ
ýëåêòðîëèçà ñëåäóåò:
n(Ìn)=n(O2)=2/1;
n(Ìn)=2n(Î2)
; n(Mn)=2∙0,75ìîëü=1,5ìîëü.
Ìàññà ìàðãàíöà
ñîñòàâëÿåò:
m(Ìn)=n(Ìn)
∙Ì (Ìn);
m(Ìn)=1,5∙55
ã=82,5 ã.
Ó÷èòûâàÿ
âûõîä ìåòàëëà,
íàõîäèì ìàññó
ðåàëüíî ïîëó÷åííîãî
ìàðãàíöà:
mp(Mn)=m(Mn)∙η(Mn)/100
; mp(Mn)=82,5∙84/100
ã = 69,Çã.
Çàäà÷à
2. Âàíàäèé
ïîëó÷àþò âîññòàíîâëåíèåì
îêñèäà âàíàäèÿ
(V) ìåòàëëè÷åñêèì
êàëüöèåì. Êàêóþ
ìàññó ìåòàëëà
ìîæíî ïîëó÷èòü
ïðè âîññòàíîâëåíèè
êîíöåíòðàòà
ìàññîé 400ã, ìàññîâàÿ
äîëÿ V2O5
â êîòîðîì ðàâíà
85%? Êàêóþ ìàññó
òåõíè÷åñêîãî
êàëüöèÿ íàäî âçÿòü
äëÿ âîññòàíîâëåíèÿ
òåõíè÷åñêîãî
êàëüöèÿ íàäî âçÿòü
äëÿ âîññòàíîâëåíèÿ,
åñëè òåõíè÷åñêèé
êàëüöèé ñîäåðæèò
ïðèìåñü îêñèäà
êàëüöèÿ? Ìàññîâàÿ
äîëÿ ÑàÎ â òåõíè÷åñêîì
ìåòàëëå ñîñòàâëÿåò
5%. Ðåøåíèå. Çàïèñûâàåì
óðàâíåíèå ðåàêöèè
ïîëó÷åíèÿ âàíàäèÿ
ìåòîäîì ìåòàëëîòåðìèè:
V2O5+5Ca=2V+5ÑàÎ
Îïðåäåëÿåì
ìàññó V2O5
â êîíöåíòðàòå:
m(V2O5)=mw(V2O5)
; m(V2O5)=400·0,85
ã =340 ã.
Ðàññ÷èòûâàåì
êîëè÷åñòâî âåùåñòâà
îêñèäà âàíàäèÿ
(V):
n (V2O5)=m(V2O5)/M(V2O5)
; n(V2O5)=340/182
ìîëü=1,87 ìîëü
Íà îñíîâàíèè
óðàâíåíèÿ ðåàêöèè
çàïèñûâàåì:
n(V2O5)/n(V)
= 1/2 ; n(V)=2n(V2O5);
n(V)=2·1,87
ìîëü=3,74 ìîëü.
Îïðåäåëÿåì
ìàññó ìåòàëëà,
êîòîðûé ìîæíî
ïîëó÷èòü:
m(V)=n(V)·M(V);
m(V)=3,74·51
ã=190,7 ã.
Èç óðàâíåíèÿ
ðåàêöèè ñëåäóåò,
÷òî
n(V2O5)/
n(Ñà)=1/5;
n(Ca)=5n(V2O5);
n(Ca)=5·1,87
ìîëü=9,35 ìîëü.
Ìàññà êàëüöèÿ,
êîòîðûé íàäî
âçÿòü äëÿ âîññòàíîâëåíèÿ,
ñîñòàâëÿåò:
m(Ñà)=n(Ñà)·Ì(Ñà);
m(Ñà)=9,35·40
ã=Ç74 ã.
Òåõíè÷åñêèé
êàëüöèé ñîäåðæèò
ïðèìåñü - îêñèä
êàëüöèÿ. Îïðåäåëÿåì
ìàññîâóþ äîëþ
êàëüöèÿ â òåõíè÷åñêîì
ìåòàëëå:
w(Ñà)=1−w(ÑàÎ);
w(Ñà)=1−0,05=0,95.
Íàõîäèì
ìàññó òåõíè÷åñêîãî
ìåòàëëà, íåîáõîäèìîãî
äëÿ îñóùåñòâëåíèÿ
ïðîöåññà:
m(òåõí.
ìåò.)=m(Ca)/w(Ca);
m(òåõí.
ìåò.)=474·0,95 ã=393,7 ã.
Çàäà÷à
3. Áàðèé
ïîëó÷àþò àëþìèíîòåðìè÷åñêèì
âîññòàíîâëåíèåì
îêñèäà áàðèÿ.
Êàêàÿ ìàññà áàðèÿ
áóäåò ïîëó÷åí
ïðè âçàèìîäåéñòâèè
îêñèäíîãî êîíöåíòðàòà
ìàññîé 600 ã (ìàññîâàÿ
äîëÿ ÂàÎ 91,8%) ñ òåõíè÷åñêèì
àëþìèíèåì ìàññîé
100ã (ìàññîâàÿ äîëÿ
àëþìèíèÿ 98,55%)? Ðåøåíèå.
Çàïèñûâàåì
óðàâíåíèå ðåàêöèè
âçàèìîäåéñòâèÿ
îêñèäà áàðèÿ
ñ àëþìèíèåì:
ÇÂàÎ+2À1=ÇÂà+À1203
Îïðåäåëÿåì
ìàññó è êîëè÷åñòâî
âåùåñòâà îêñèäà
áàðèÿ, âçÿòîãî
äëÿ ðåàêöèè:
m(ÂàÎ)=m(êîíöåíòðàòà)
w(ÂàÎ);
m(ÂàÎ)=600
0,918 ã=550,8 ã;
n(ÂàÎ)=m(ÂàÎ)/M(ÂàÎ);
n(BaO)=550,8/153
ìîëü=3á6 ìîëü.
Íàõîäèì
ìàññó àëþìèíèÿ,
êîòîðûé âçÿò
äëÿ ðåàêöèè, à åãî
êîëè÷åñòâî âåùåñòâà:
m(À1)=m(òåõí.
ìåò.)·w(AI);
m(À1)=100·0,9855
ã=98,55 ã;
n(AI)=m(AI)/M(AI);
n(AI)=98,55/27
ìîëü=3,65 ìîëü.
Âû÷èñëÿåì,
êàêîå êîëè÷åñòâî
âåùåñòâà àëþìèíèÿ
n'(AI)
ïîòðåáóåòñÿ äëÿ
ðåàêöèè ñ îêñèäîì
áàðèÿ êîëè÷åñòâîì
âåùåñòâà 3,6 ìîëü.
Èç óðàâíåíèÿ
ðåàêöèè ñëåäóåò:
n(ÂàÎ)/n'(AI)=3/2;
n'(AI)=2/3
n(BaO);
n'(AI)=2·3,6/3
ìîëü=2,4 ìîëü.
Ñëåäîâàòåëüíî,
àëþìèíèé âçÿò
äëÿ ðåàêöèè â èçáûòêå,,
Îïðåäåëÿåì êîëè÷åñòâî
âåùåñòâà è ìàññó
ïîëó÷åííîãî,
áàðèÿ. Íà îñíîâàíèè
óðàâíåíèÿ ðåàêöèè
çàïèñûâàåì:
n(Âà)=n(ÂàÎ);
n(Âà)=3,6
ìîëü;
m(Âà)=n(Âà)·M(Âà);
m(Âà)=3,6·137
ã=493,2 ã.
Çàäà÷à
4. Êàêóþ
ìàññó ãåêñàãèäðàòà
õëîðèäà êàëûöèÿ
ÑàÑ12 6Í2O
è
âîäû íàäî âçÿòü
äëÿ ïðèãîòîâëåíèÿ
ðàñòâîðà îáúåìîì
150 ìë ñ ìàññîâîé
äîëåé õëîðèäà
êàëüöèÿ 16%, è ïëîòíîñòüþ
1,14 ã/ìë?
Ðåøåíèå.
Îïðåäåëÿåì ìàññó
ðàñòâîðà, êîòîðûé
íåîáõîäèìî ïðèãîòîâèòü:
m=Vð;
m=150·1,14 ã=171
ã.
Íàõîäèì
ìàññó ÑàÑI2, êîòîðàÿ
íåîáõîäèìà äëÿ
ïðèãîòîâëåíèÿ
ðàñòâîðà:
m(ÑàÑI2)=mw(ÑàÑI2);
m(ÑàÑ12)=
171·0,16 ã=27,36 ã.
Êîëè÷åñòâî
âåùåñòâà õëîðèäà
êàëüöèÿ ñîñòàâëÿåò:
n(ÑàÑI2)=m(CaCI2)/M(CaCI2);
n(CaCI2)=27,36/111
ìîëü=0,2465 ìîëü
Èç ôîðìóëû
ãåêñàãèäðàòà
õëîðèäà êàëüöèÿ
ÑàÑ12 6Í2O
ñëåäóåò:
n(ÑàÑI2·6Í2Î)=n(ÑàÑI2);
n(ÑàÑ12
6Í2Î)=0,2465 ìîëü.
Ñëåäîâàòåëüíî,
ìàññà ãåêñàãèäðàòà
õëîðèäà êàëüöèÿ,
òðåáóåìîãî äëÿ
ïðèãîòîâëåíèÿ
ðàñòâîðà, ñîñòàâëÿåò:
m(ÑàÑI2
6Í2O)=n(ÑàÑI2
6Í2Î) M(ÑàÑI2
6H2O);
m(ÑàÑI2
6Í2O)=0,2465·219 ã=
54,0 ã.
Îïðåäåëÿåì
íåîáõîäèìóþ
ìàññó âîäû:
m(ÑàÑI2
6Í2Î)=m−m(CaCI2
6H2O);
m(Í2Î)=(171-54)
ã=117 ã.
Çàäà÷à
5. Èìååòñÿ
ñìåñü ïîðîøêîâ
æåëåçà, àëþìèíèÿ
è ìåäè ìàññîé
16 ã. Íà ïîëîâèíó
ñìåñè ïîäåéñòâîâàëè
èçáûòêîì êîíöåíòðèðîâàííîãî
ðàñòâîðà ãèäðîêñèäà
êàëèÿ, ïîëó÷èâ
ãàç îáúåìîì
3,36 ë. Ê äðóãîé ïîëîâèíå
ñìåñè äîáàâèëè
èçáûòîê ðàñòâîðà
ñîëÿíîé êèñëîòû.
Ïðè ýòîì âûäåëèëñÿ
ãàç îáúåìîì
4,48 ë. Îïðåäåëèòå
ìàññîâûå äîëè
ìåòàëëîâ â ñìåñè.
Îáúåìû ãàçîâ
ïðèâåäåíû ê íîðìàëüíûì
óñëîâèÿì.
Ðåøåíèå.
Ñ ðàñòâîðîì ãèäðîêñèäà
êàëèÿ âçàèìîäåéñòâóåò
òîëüêî îäèí êîìïîíåíò
ñìåñè - àëþìèíèé:
AI+ 2ÊÎÍ
+ 10Í2O= 2Ê[À1(ÎÍ)4(H2O)2]
+ 3Í2↓ (à)
Îïðåäåëÿåì
êîëè÷åñòâî âåùåñòâà
âîäîðîäà, êîòîðûé
âûäåëèëñÿ â äàííîé
ðåàêöèè:
na(H2)/
Vm; na(H2)=3,36/22,4
ìîëü=0,15 ìîëü
Èç óðàâíåíèÿ
ðåàêöèè (à) ñëåäóåò:
n(AI)/na(H2)=2/3;
n(AI)2/3
na(H2);
n(AI)=2·0,15/3
ìîëü = 0,1 ìîëü.
Ìàññà àëþìèíèÿ
â ïîëîâèíå èñõîäíîãî
îáðàçöà ìàññîé
8 ã ñîñòàâëÿåò:
m(AI)
= n(À1)· Ì(ÀI);
m(ÀI) =
0,1·27 ã = 2,7 ã.
Ñ ðàñòâîðîì
ñîëÿíîé êèñëîòû
âçàèìîäåéñòâóþò
àëþìèíèé è æåëåçî:
À1 + 6ÍÑI = 2AIÑ13
+ 3Í2↑ (á) Få
+ 2HÑI = FeCI2
+ Í2↑ (â)
Èç óðàâíåíèÿ
(á) ñëåäóåò:
n(AI)/ná(H2)=2/3;
ná(H2)=3/2
n(AI);
ná(H2)=3/2
· 0,1 ìîëü=0á15 ìîëü.
Îáúåì ýòîãî
âîäîðîäà ðàâåí:
Vá(Í2)=ná(Í2)
Vm;
Vá(Í2)=
0,15·22,4 ë= 3,36 ë.
Îáúåì âîäîðîäà,
âûäåëèâøèéñÿ
â ðåàêöèè (â), ñîñòàâëÿåò:
Vâ(Í2)
=V(H2)−
Vá(Í2);
V(Í2) = (4,48
- 3,36) ë = 1,12 ë,
ãäå V(Í2)
- îáúåì âîäîðîäà,
âûäåëèâøèéñÿ
ïðè äåéñòâèè
ñîëÿíîé êèñëîòû
íà ñìåñü ìåòàëëîâ
ìàññîé 8 ã, ò.å. îáúåì
âîäîðîäà, âûäåëèâøèéñÿ
â ðåàêöèÿõ (á) è
(â). Ðàññ÷èòûâàåì
êîëè÷åñòâî âåùåñòâà
âîäîðîäà, îáðàçîâàâøåãîñÿ
ïðè âçàèìîäåéñòâèè
æåëåçà ñ ñîëÿíîé
êèñëîòîé:
nâ(H2)=Vâ(H2)/Vm;
nâ(H2)=1,12/22,4
ìîëü=0,05 ìîëü
Íà îñíîâàíèè
óðàâíåíèÿ (â) çàïèøåì:
n(Fe)=nâ(H2);
n(Fe)=0,05 ìîëü.
Ìàññà æåëåçà
â ïîëîâèíå èñõîäíîãî
îáðàçöà ñìåñè
ñîñòàâëÿåò:
m(Fe)=n(Fe)
M(Fe);
m(Fe)=
0,05∙56 ã = 2,8 ã.
Îïðåäåëÿåì
ìàññó ìåäè â ïîëîâèíå
èñõîäíîãî îáðàçöà
ñìåñè ìåòàëëîâ:
m(Ñu)
= m(ñìåñè)
- m(ÀI) - m(Få);
m(Ñu)
= (8 - 2,7 - 2,8) ã = 2,5 ã.
Îïðåäåëÿåì
ìàññîâûå äîëè
ìåòàëëîâ â ñìåñè:
w(ÀI)
=
m(AI)/m(ñìåñè);
w(AI)=2,7/8=0,3375,
èëè 33,75%;
w(Fe)=m(Fe)/m(ñìåñè);
w(Fe)=2,8/8=
0,35, èëè 35%;
w(Ñu)
= m(Ñu)/m(ñìåñè);
w(Ñu)
=2,5/8 = 0,3125, èëè 31,25%.
Ðàçìåùåíî
íà Allbest.ru