Структура лекарственно-устойчивого туберкулеза в Минской области в 2008–2011 гг.
Структура
лекарственно-устойчивого туберкулеза в Минской области в 2008 - 2011 гг.
ОГЛАВЛЕНИЕ
ПЕРЕЧЕНЬ УСЛОВНЫХ ОБОЗНАЧЕНИЙ
ВВЕДЕНИЕ
.1 Особенности строения и функционирования
возбудителятуберкулеза
.2 Туберкулез как инфекционное заболевание
.2.1 Классификация ТБ
.2.2 Пути заражения ТБ
.2.3 Источник заражения ТБ
.2.4 Возможные исходы заражения
.3Методы выявления и подтверждения диагноза туберкулеза
.3.1 Инструментальные методы исследования
.3.2 Лучевые исследования
.3.3 Туберкулинодиагностика
.3.4 Лабораторные методы выявления микобактерий туберкулеза
.3.5 Микроскопическое исследование для
выявлениякислотоустойчивых МБТ
.3.6 Метод посева или культуральный метод выявления
M.tuberculosis
.3.7 Культуральная диагностика туберкулеза с помощью автоматизированной
системы BACTEC
.3.8 Методы исследования лекарственной чувствительности
микобактерий
.3.9 Серологические методы диагностики туберкулеза
.3.10 Иммунологические и молекулярно-биологические
исследования
.4 Лекарственная устойчивость
.5 Клинико-фармакологическая характеристика
противотуберкулезных препаратов
. МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
. РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
ВЫВОДЫ
ЛИТЕРАТУРА
ПЕРЕЧЕНЬ
УСЛОВНЫХ ОБОЗНАЧЕНИЙ
Антибактериальные препараты - АБП
Бактерия Кальметта-Герена - БЦЖ
Вирус иммунодефицита человека - ВИЧ
Всемирная организация здравоохранения - ВОЗ
Гидразиды изоникотиновой кислоты - ГИНК
Дезоксирибонуклеиновая кислота - ДНК
Изониазид - H / INF
Иммуноферментный анализ - ИФА
Кислотоустойчивые микобактерии - КУМ
Число колониеобразующих единиц - КОЕ
Лекарственная устойчивость - ЛУ
Лекарственная чувствительность - ЛЧ
Матричная РНК -мРНК
Микобактерии туберкулеза - МБТ
Множественная лекарственная устойчивость - МЛУ
Минимальная подавляющая концентрация - МПК
Мультидрагрезистентность - MDR
Никотинамидадениндинуклеотид - НАД
Полимеразная цепная реакция - ПЦР
Полиморфизм длин рестрикционных фрагментов - ПДРФ
Противотуберкулезные препараты - ПТП
Рибонуклеиновая кислота - РНК
Рифампицин - R /RIF
Синдром приобретенногоиммунодефицита - СПИД
Стрептомицин - S /SM
Транспортная РНК - тРНК
Туберкулез - ТБ
Этамбутол - Е / EMB
ВВЕДЕНИЕ
С конца 80-х годов XX века во всем мире отмечается повышение
заболеваемости туберкулезом (ТБ) (Balter,1999; Perelman,2000). Признанная во всем мире
стандартная контролируемая химиотерапия ТБ препаратами первого (основного) ряда
является эффективной при лечении случаев заболевания, вызываемых
чувствительными формами возбудителей. В противоположность этому устойчивость
микобактерий туберкулеза (МБТ) к наиболее активным препаратам (изониазид (H) и рифампицин (R)) - множественная лекарственная
устойчивость (МЛУ) - в значительном числе случаев предопределяет неудачный
исход терапии и высокую вероятность рецидива (Coates,1983; Mitchison,1986).
Даже среди впервые выявленных больных в 35-50% случаев имеется первичная
лекарственная устойчивость к одному и более препаратам, а среди хронических
больных практически у всех 100% (Манкеев, 2001).
Для лечения больных туберкулезом, выделяющих МЛУ-возбудителей, необходимо
не менее 3 (предпочтительно 4 или 5) лекарственных препаратов, к которым
является чувствительной данная бактериальная популяция.
Ухудшение эпидемиологических показателей сопровождается резким
нарастанием лекарственной устойчивости (ЛУ) МБТ и неблагоприятными изменениями
в ее структуре за счет преобладания мультирезистентных форм (Дорожковаи
др.,2000; Viljanenetal., 1998). Высокий уровень
мультирезистентности микобактерий туберкулеза приводит к снижению эффективности
лечения туберкулеза, что требует использования противотуберкулезных препаратов
(ПТП) второго ряда (Maranetra, 1999).
Повышение эффективности лечения впервые выявленных больных и пациентов
после неэффективного основного курса является актуальной задачей современной
фтизиатрии. Результативность химиотерапии во многом зависит от создания
эффективной концентрации препарата в зоне основной микобактериальной популяции
(Хоменко, 1996).
Целью работы является проведение мониторинга чувствительности штаммов Mycobacteriumtuberculosis,выделенных в период с 2008 по 2011
год в Минском областном противотуберкулезном диспансере, к противотуберкулезным
препаратам, используемым в клинической практике.
1.1 Особенности строения и функционирования
возбудителя туберкулеза
Микобактерии туберкулеза - факультативные внутриклеточные паразиты.
МБТ относятся к порядку Actinomycetalis, семейству бактерий Mycobacteriacae, роду Mycobacterium. Род Mycobacteriumнасчитывает свыше 100 видов,
большинство из которых являются сапротрофными микроорганизмами, широко
распространенными в окружающей среде (Кошечкин, Иванова, 2007).
Возбудитель туберкулеза занимает промежуточное положение между бактериями
и низшими грибами. Он был открыт немецким ученым Робертом Кохом 24 марта 1882
г. МБТ имеет форму слегка изогнутой палочки длиной 1-6 мкм и шириной 0,2-0,6
мкм (рис.1). Бактериальная клетка состоит из микрокапсулы, многослойной
оболочки, цитоплазматической мембраны, цитоплазмы с органеллами (гранулы,
вакуоли, рибосомы), ядерной субстанции. Клеточная стенка является барьером,
препятствующим проникновению лекарств внутрь клетки МБТ, ограничивает клетку
снаружи, обеспечивая механическую защиту. Биополимер пептидогликан, полисахарид
арабиногалактан, молекулы миколовых кислот, тесно связанные между собой,
образуют своеобразный каркас, составляющий основу клеточной стенки МБТ. В
клеточной стенке находятся специфические антигены, вызывающие у макроорганизма
развитие реакции гиперчувствительности замедленного типа и образование антител.
В ней же находится корд-фактор, состоящий из липидов и высокомолекулярныхкислот
(тригалоза-6,6-димиколат - производноемиколовой кислоты), определяющий
вирулентность МБТ.

Рис. 1 -Электронно-микроскопическое исследование МБТ (Ерохин и др.,
2008).
В состав цитоплазматической мембраны входят липопротеидные комплексы. С
ней связаны различные ферментные системы, в частности
окислительно-восстановительные. В бактериальной клетке мембрана является
основным осмотическим барьером. Путем инвагинации в цитоплазму она образует
мезосомы, имеющие важное значение в жизнедеятельности микробной клетки
(например, в синтезе клеточной стенки и др.).
Цитоплазма имеет гранулярные включения, основную часть которых составляют
рибосомы, где завершается синтез белка, есть и другие гранулярные структуры.
Ядерная субстанция ответственная за синтез белка и передачу
наследственных признаков. Основной способ размножения - деление клетки на две
дочерние. Носителем генетической информации кроме хромосомы могут быть и
плазмиды, которые благодаря малому размеру способны проникать из клетки в клетку.
Основными биохимическими компонентами МБТ являются туберкулопротеиды, липиды и
полисахариды. Белковая фракция - основной носитель антигенных свойств
микобактерий. Липидные фракции способны стимулировать специфическую
воспалительную реакцию макроорганизма с образованием элементов туберкулезной
гранулемы (эпителиоидных и гигантских клеток).
Туберкулез вызывают три вида бактерий: человеческий - M. tuberculosis, бычий- M.bovis, африканский
- M. africanum. В Беларуси и России почти у всех
больных выявляют M. tuberculosis. В Западной и Центральной Африке от
40 до 80% случаев легочного туберкулеза вызываются M. africanum, он
выделен и у обезьян. У крупного рогатого скота преобладает M. bovis. Однако животные могут болеть и туберкулезом,
вызванным человеческим видом. Заболеваемость крупного рогатого скота в личном
хозяйстве бактериовыделителей в пять раз выше, чем в семьях, где проживают
здоровые лица.
В настоящее время расшифрован геном МБТ, состоящий из 400 генов, 4111529
пар нуклеотидов с большой способностью к мутации (рис. 2). Известны гены,
определяющие лекарственную устойчивость, системы превращения
противотуберкулезных препаратов в безвредные вещества. Особенностью генома МБТ
является наличие генов, дублирующих функционирование ключевых ферментных систем,
т.е. процессы, на которые действует химиопрепарат, могут перестать быть
необходимыми клетке для ее жизнедеятельности. В настоящее время установлено
влияние генома МБТ на клинические особенности и течение туберкулеза. Так, при
туберкулезе, вызванном штаммами семействами Beijing, отмечаются более выраженная клиническая симптоматика
и более тяжелое течение, чем при наличии МБТ других (индивидуальных) генотипов
(Гельберги др., 2009).
На внешнем (цветном) кольце указан масштаб (каждая градация соответствует
106 пар нуклеотидов) и начало транскрипции (0). На первом (после масштабного)
кольце показаны позиции стабильных ДНК генов и прямых повторов; на втором -
кодирующие рамки; на третьем - инсерционные повторы; на четвертом - семейства
генов кислых белков; на пятом - гены белков, богатых глицином; на шестом -
множественные копии полиморфных повторов; в центре - содержание гуанина и
цитозина.
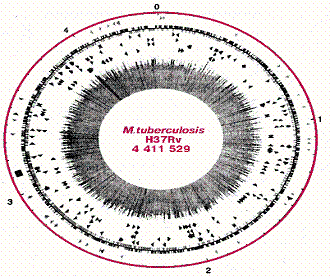
Рис. 2- Генетическая карта хромосомы M. tuberculosis H37Rv(Coleetal.,
1998).
Кроме МБТ существует много атипичных микобактерий, которые мало
вирулентны для человека. Однако у ослабленных людей, особенно
ВИЧ-инфицированных, они могут вызвать заболевания, называемые микобактериозами.
Клинически и рентгенологически они сходны с туберкулезом, но считаются
незаразными. Атипичные микобактерии, по Раньяну, делятся на четыре группы: Ι
- фотохромогенные,
образующие пигмент на свету; ΙΙ - скотохромогенные, образующие пигмент
в темноте; ΙΙΙ - нефотохромогенные, не образующие пигмента; ΙV - быстрорастущие. Чаще в патологии
человека имеют значение комплексы M. avium - intracellulare(ΙΙΙ
группа), M. kanssi(Ι группа), M. scrofulacum(ΙΙ группа), M. fortuitum(ΙV группа) и другие, хотя большинство микобактерий ΙV
группы относится
ксапротрофам. Атипичные микобактерии устойчивы к ряду противотуберкулезных
препаратов, поэтому лечение микобактериозов подчас затруднено. Микобактериоз,
как и туберкулез, считают ВИЧ- ассоциированной инфекцией, при которой могут
возникнуть распространенные, иногда генерализованные процессы.
Для микобактерий туберкулеза характерен полиморфизм: бывают зернистые,
ветвистые и другие формы. Особое значение имеют L-формы, у которых нарушено образование клеточной стенки,
снижена способность к размножению. Эта форма существования микобактерий в виде
«дремлющей» инфекции называется персистированием. В таком виде они могут
сохраняться годами, поддерживая противотуберкулезный иммунитет, но при
неблагоприятных для человека условиях способны переходить в обычные формы и
приводить к эндогенной реактивации туберкулезного процесса. Микобактерии
противотуберкулезной вакцины БЦЖ также могут переходить в L-формы. Отсутствие типичных МБТ в
мокроте больных не исключает наличия L-форм. Встречаются также ультрамелкие формы МБТ, проходящие через
бактериальные фильтры. В процессе химиотерапии их удельный вес возрастает.
Некоторые ученые придают им значение в этиологии саркоидоза(Гельберг и др.,
2009).
Морфология и размеры микобактериальных клеток, а также их способность к
кислотоустойчивому окрашиванию подвержены значительным колебаниям и во многом
зависят от возраста микроорганизма и особенно от условий его существования и
состава питательной среды (рис. 3).
Обычно в патологическом материале микобактерии туберкулеза наблюдаются
либо единично, в виде маленьких групп по 2-3 палочки, а иногда небольшими
группами, в которых палочки расположены беспорядочно (рис. 4) (Ерохин и др.,
2008).
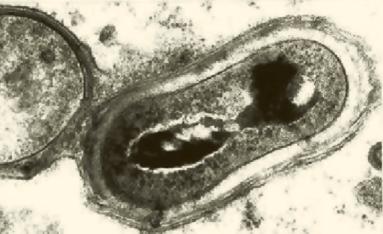
Рис. 3 - Измененная МБТ в макрофаге из туберкулезной гранулемы
(электронно-микроскопическое исследование) (Ерохин и др., 2008).
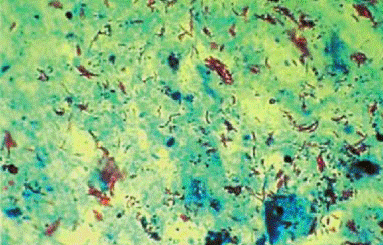
Рис. 4 - КУМ при окраске по Цилю-Нильсену. Увеличение ×1000(Ерохин и др., 2008).
Микобактерии (к которым относятся и микобактерии туберкулеза) являются
кислото-, щелоче- и спиртоустойчивыми и объединены общим признаком -
способностью стойко сохранять воспринятую окраску даже после воздействия кислот
и кислого спирта. Данное свойство имеет первостепенное значение для
микобактерий, так как на нем основаны практически все методы
микробиологического выявления и идентификации этих микроорганизмов. Способность
к кислотоустойчивому окрашиванию используется в клинической микобактериологии
при специфической окраске диагностического материала при микроскопии,
устойчивость к кислотам и щелочам - при селективной обработке диагностического
материала с целью элиминации нетуберкулезной микрофлоры перед посевом.
Необходимо отметить, что способность к кислотоустойчивому окрашиванию не
является исключительным свойством микобактерий туберкулеза: это свойство в той
или иной степени присуще и другим, в том числе сапрофитным микобактериям, а
также другим бактериям и живым объектам, например представителям родов Corinebacteriumи Nocardia, спорам B. cereus.
Способность микобактерий к кислотоустойчивому окрашиванию - это
устойчивость к обесцвечиванию кислым спиртом или минеральными кислотами в
высоких концентрациях (например, 25% серная кислота) после проведения окраски
микобактерий анилиновыми красителями (основным фуксином или аурамином О) в 5%
растворе фенола (то есть карболовым фуксином или карболовым аурамином).
Кислотоустойчивость микобактерий туберкулеза связана с большим содержанием
липидов в их цитоплазме, а также с целостностью их клеточной структуры и
определяется двумя важнейшими факторами: во-первых, наличием в цитоплазме
кислотоустойчивых липидов типа миколовой кислоты и ее производных (миколовая
кислота является единственным обладающим кислотоустойчивостью веществом у
микобактерий туберкулеза), а во-вторых - особыми свойствами клеточной оболочки,
затрудняющими обратный выход красителя при воздействии кислоты и алкоголя.
Таким образом, кислотоустойчивость микобактерий туберкулеза имеет
двойственную природу и обусловлена, во-первых, удержанием красителя внутри
бактериальной клетки и, во-вторых, связыванием красителя с остатками миколовых
кислот клеточной стенки. Связывание красителя с пептидогликолипидами клеточной
стенки увеличивает ее гидрофобность и способствует удержанию красителя в
цитоплазме, что определяет яркость окраски. Кислотоустойчивость выявляется с
помощью только специальных методов окраски с использованием карболовых
производных анилиновых красителей. Одним из таких методов является метод
окраски по Цилю-Нильсену(Ерохин и др., 2008).
МБТ хорошо переносят низкую температуру. Могут годами храниться в
холодильнике, оставаясь жизнеспособными. Установлено, что при длительном
нахождении при температуре -700С МБТ сохраняли 100% выживаемость и
биологические свойства. В темных сырых помещениях МБТ сохраняются несколько
месяцев, на белье, мебели и одежде, на рассеянном свету, в высохшей мокроте - в
течении месяца. На страницах книг МБТ могут оставаться жизнеспособными до трех
месяцев. Они погибают при кипячении, воздействии хлорсодержащих (хлорамин,
хлорная известь) препаратов, используемых для дезинфекции, а также под влиянием
ультрафиолетовых лучей, в частности, прямого солнечного света. В настоящее
время применяются новые дезинфекционные средства, не содержащие хлора (полидез,
септоцид, триацид и др.), действующие на МБТ. Из других физических факторов
губительное действие на микобактерии проявляет ультразвук.
Микобактерии туберкулеза являются факультативными аэробами, т.е. могут
существовать и при незначительном доступе воздуха. Размножаются они медленно.
Если время деления E. coliinvitroсоставляет около 20 минут, то
дляM.tuberculosisна плотных средах оно достигает 24 часов. Это свойство
патогенных микобактерий обуславливает, с одной стороны, длительные сроки их
микробиологической диагностики, а с другой - продолжительность развития
инфекциии длительность курсов химиотерапии.
Видимый рост на плотных питательных средах проявляется на 14-20 сутки
после посева материала; в жидких - на 6-8 сутки при посеве
лекарственно-чувствительных и на 12-14 сутки - устойчивых штаммов МБТ. Для их
нормального развития требуются сложные многокомпонентные питательные среды.
Рост наблюдается обычно в виде шероховатых (R-вариантов) колоний.
О наличии корд-фактора свидетельствует своеобразный рост в микроколониях.
Он характеризуется параллельным (склеенным) расположением бактериальных клеток
с формированием «жгутов, кос, веревок», их переплетений (Гельберги др., 2009).
1.2 Туберкулез как инфекционное заболевание
Туберкулез (ТБ) является инфекционным заболеванием, вызываемым
микобактериями туберкулезного комплекса. Микобактерии способны поражать любой
орган, однако чаще всего заболевание имеет легочную локализацию (рис. 5).
Туберкулез легких чаще других форм туберкулеза приводит к смерти пациента.
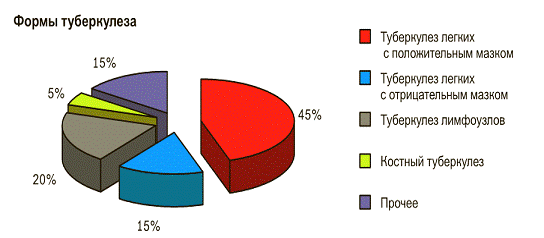
Рис. 5 - Формы туберкулеза (по данным Rieder, 1985).
1.2.1 Классификация ТБ
Согласно классификации, принятой в 1974 г., различают следующие формы
туберкулёза органов дыхания:
) первичный туберкулёзный комплекс;
) туберкулёз внутригрудных лимфатических узлов;
) диссеминированный туберкулёз лёгких;
) очаговый туберкулёз лёгких;
) туберкулома лёгких;
) кавернозный туберкулёз лёгких;
) инфильтративный туберкулёз лёгких;
) фибриозно-кавернозный туберкулёз лёгких;
) цирротический туберкулёз лёгких;
) туберкулёзный плеврит;
)туберкулёз верхних дыхательных путей, трахеи, бронхов;
)туберкулёз органов дыхания, комбинированный с пневмокониозами.
1.2.2 Пути заражения ТБ
Несмотря на то, что известны случаи энтеральногозаражения туберкулезом и
заражения через поврежденные кожные покровы и слизистые оболочки, основным
путем распространения инфекции является воздушно-капельный путь. Больные
туберкулезом с бактериовыделением образуют при кашле, разговоре или пении
аэрозоль с инфицирующим агентом - микобактерией туберкулеза в аэрозольном ядре
(рис. 6).
Образовавшиеся аэрозольные частицы имеют различные размеры. Наиболее
крупные быстро оседают. Частицы размером 5 мкм, содержащие в себе возбудитель
инфекции, могут сохраняться во взвешенном состоянии несколько часов. При
вдыхании они проникают в глубокие отделы легких через мелкие бронхи, и
содержащиеся в них микобактерии могут, внедрившись в легочную ткань, образовать
первичный очаг заболевания.
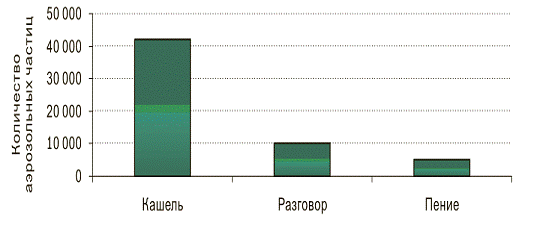
Рис. 6 - Образование аэрозоля при кашле, разговоре, пении (Loudon, 1968).
1.2.3 Источник заражения ТБ
Основной источник заражения ТБ- больной открытой формой туберкулеза, то
есть выделяющий туберкулезную инфекцию. Такие больные составляют от 50 до 75 %
среди всех впервые выявленных больных ТБ.Один бациллярный больной за год может
инфицировать около 10 человек. При средней продолжительности жизни такого
больного, в случае отсутствия лечения в течение двух лет, он инфицирует до 20
человек и более(Манкеев, 2001).
1.2.4 Возможные исходы заражения
В условиях нашей страны впервые заражаются ТБ, как правило, в детстве.
Большинство остается здоровыми, но инфицированными. Заражение в большинстве
случаев не приводит к заболеванию в связи с наличием у человека высокой степени
врожденной резистентности к ТБ. При обратном развитии образовавшегося
туберкулезного воспаления формируется петрификат. Инфицирование проявляет себя
появлением впервые в жизни положительной реакции на туберкулиновую пробу Манту.
При этом в организме формируется приобретенный иммунитет, поддерживаемый
пожизненно живой инфекцией. В этом положительная роль инфицирования.
Отрицательная роль его заключается в опасности активации инфекции в
петрификатах и развитии заболевания. Заболевание, развивающееся в результате
первичного инфицирования, называется первичным туберкулезом. Опасность
заболевания первичным ТБ сохраняется до завершения обратного развития
морфологических туберкулезных изменений с формированием петрификата. От момента
заражения до обратного развития изменений проходит не менее 3 лет, иногда этот
период затягивается до 5 лет. Считается, что заболевает первичным туберкулезом
около 5 % от числа инфицированных. Первичным туберкулезом преимущественно
болеют дети.
Заболевание, развивающееся в результате активации инфекции в петрификатах
или повторного заражения, называется вторичным. Такой туберкулез развивается
чаще у взрослых через годы и десятки лет после первичного заражения МБТ. При
этом на протяжении оставшейся жизни заболевает еще 5-10 %. В современных
неблагоприятных эпидемиологических условиях нередко вторичным ТБ заболевают и
дети старшего возраста, подростки. Преобладающее большинство заболевающих
туберкулезом среди населения в нашей стране составляют больные вторичным
туберкулезом.
Таким образом, наличие туберкулезной инфекции в организме является
обязательным, но далеко не единственным условием развития заболевания (Копылова
и др. , 2007).
1.3 Методы выявления и подтверждения диагноза туберкулеза
.3.1 Инструментальные методы исследования
Ведущее значение в инструментальной диагностике туберкулеза принадлежит
эндоскопическим исследованиям.
Бронхоскопическое обследование обязательно для больных с любым
патологическим процессом в легочной ткани и/или внутригрудных лимфатических
узлах, что обусловлено как ценностью визуального осмотра, так и возможностью
проведения в ходе исследования различных биопсий.
Показанием к прямой биопсии скусыванием или соскобом является
патологический процесс (бугорки, бляшки, инфильтраты) в трахее и бронхах I-III
порядка.
Катетер-биопсия - катетеризация мелких бронхов с аспирацией материала для
цитологического, гистологического и микробиологического исследований; ее
проводят при округлых образованиях в легочной ткани, полостях, инфильтратах,
реже - при диссеминациях. Информативность метода невысока (25-30%) (Кошечкин,
Иванова, 2006).
Браш-биопсия (щеточная) выполняется в аналогичных случаях с помощью
управляемой нейлоновой или капроновой щеточки через канал фибробронхоскопа и позволяет
получить материал высокого качества для цитологического исследования. Биопсии
следует подвергать наиболее дистально расположенные бронхи.
Трансбронхиальную пункцию внутригрудных лимфатических узлов через стенку
трахеи или бронхов проводят прямой, снабженной мандреном иглой длиной 50-55 см,
имеющей над рабочей частью ограничительную шайбу на расстоянии 2-2,5 см.
Эффективность метода зависит от степени гиперплазии лимфатических узлов
средостения (чем больше их размеры, тем результативнее пункция) и в целом
составляет несколько более 50%.
Трансбронхиальную биопсию легких проводят при помощи щипцов из
стандартного набора инструментов через фибробронхоскоп под местной анестезией с
одной стороны (чтобы избежать опасности двустороннего пневмоторакса). Процедура
проходит под контролем ощущений больного.
Для полноценного морфологического исследования необходимо не менее
четырех биоптатов. Эффективность метода достигает 80-85% (Кошечкин, Иванова,
2006).
Медиастиноскопия с биопсией лимфатических узлов средостения - безопасный,
надежный и эффективный метод, диагностическая эффективность которого составляет
более 90%, а количество осложнений - не более 2% (Кошечкин, Иванова, 2006).
Исследование производят с помощью ларингоскопа под интубационным наркозом.
Медиастиноплевроскопия позволяет биопсировать как лимфатические узлы
средостения, так и легочную ткань, но сложнее в техническом отношении.
Торакоскопическое исследование с биопсией легкого и плевры сочетает
высокую информативность и сравнительно малую инвазивность. Возможно
использование торакоскопа или фибробронхоскопа, но наибольшие возможности дает
использование современных видеоэндоскопических комплексов. Биопсия измененных
участков париетальной и висцеральной плевры проводится скусыванием щипцами с
коагуляцией дефекта в легком диатермокоагулятором. При биопсии легкого с
помощью щипцов из стандартного набор инструментов можно получить биоптат
объемом до 10 мм, а при использовании электрохирургической петли типа «овал»
или «серп» -3-9 см. Эффективность метода при этом превышает 90% (Кошечкин,
Иванова, 2006).
Несмотря на высокую результативность эндоскопических методов
исследования, в диагностике туберкулеза сохраняют значение и хирургические
методики биопсии, что связано с описываемыми ниже пределами морфологического
метода исследования.
Парастернальнаямедиастинотомия имеет некоторые преимущества перед
медиастиноскопией (лучше обзор, имеется возможность иссечения кусочка легочной
ткани, надежнее гемостаз и прочее), однако более травматична.
Открытая биопсия легкого является высокоэффективным методом диагностики и
заключается в иссечении кусочка легочной ткани при небольшой по протяженности
межреберной торакотомии. Но помимо несомненных достоинств (диагностическая
эффективность не менее 95%), открытая биопсия имеет и недостатки. Выполняемая
под интубационным наркозом, она приводит к усилению рестриктивных нарушений
функции внешнего дыхания, что повышает риск вмешательства. Отмечается и
довольно высокое (до 5%. и более) число осложнений (длительное накопление в плевральной
полости экссудата, развитие пневмоторакса, гемоторакса и проч.) (Кошечкин,
Иванова, 2006).
Трансторакальную биопсию проводят при локализации патологических
изменений в наружных (кортикальных) отделах легкого с помощью обычных тонких
игл (аспирационная биопсия), либо более толстых игл специальной конструкции,
позволяющих получить образцылегочной ткани и плевры не только для
цитологического, но и для гистологического исследования (трепанационная или
пункционная биопсия).
Обязательным методом исследования при наличии у больного жидкости в
плевральной полости является плевральная пункция.
При диагностике туберкулеза органов дыхания могут производиться также
биопсии иных органов (периферических лимфатических узлов, кожи, мягких тканей и
др.).
1.3.2 Лучевые исследования
По мере снижения распространенности туберкулеза и увеличения удельного
веса иных заболеваний органов дыхания выявились пределы рентгенологических
методов диагностики туберкулеза. Рентгенологические методы позволяют хорошо
выявить и детализировать структурные изменения в пораженном органе, но
определяемые скиалогические признаки не могут однозначно определить этиологию
процесса.
Для выявления лиц с подозрительными на туберкулез органов дыхания
изменениями при массовых обследованиях населения используют флюорографию
(фотографирование изображения с рентгеновского экрана на фотопленку). В
зависимости от аппарата получают кадры размером 70x70 или 100x100 мм. Метод
обладает высокой производительностью, однако имеет ряд технических ограничений
(в частности, недостаточно четко отображает патологические образования
небольших размеров). Поэтому точное установление диагноза туберкулеза на его
основании невозможно. Принципиально новые возможности открывает развитие
цифровой лучевой техники, позволяющей получить изображение высокого качества и
значительно снизить лучевую нагрузку. Преимуществом цифровой флюорографии перед
традиционной пленочной является широкий динамический диапазон и высокая
контрастная чувствительность, а также возможность компьютерной обработки
изображения, что позволяет надежно выявлять даже незначительные изменения в
биологических тканях различной плотности. Все это достигается при снижении
лучевой нагрузки на пациента в 10 и более раз по сравнению со стандартной
пленочной флюорографией и в 2-3 раза в сравнении с крупноформатной
рентгенографией. Эффективность метода определяется быстротой получения
изображения (несколько секунд), полным отсутствием брака изображения (при
пленочной флюорографии - 8-15%), исключением использования дорогостоящей
фотопленки, фотолабораторного оборудования и реактивов, надежностью архивации
результатов (Кошечкин, Иванова, 2007).
Рентгенография, проводимая в различных проекциях, является основным
первичным лучевым методом подтверждения диагноза туберкулеза органов дыхания.
Метод при соблюдении технических требований отличается высокой степенью
стандартизации, позволяет наглядно и быстро представлять и надежно архивировать
результаты исследования. Достоинством является и относительная дешевизна
исследования при высокой информативности. У части больных метод обеспечивает
получение информации, достаточной для установления диагноза. Для уточнения
характера выявленных при рентгенографии изменений применяется томография -
получение послойных отображений легочной ткани и органов средостения, что
позволяет уточнить структуру патологических изменений (Кошечкин, Иванова,
2007).
1.3.3 Туберкулинодиагностика
Туберкулинодиагностика является ценным методом, дополняющим клинический
диагноз туберкулеза. Она указывает на наличие специфической сенсибилизации
организма, обусловленной вирулентными МБТ или вакциной БЦЖ.
Для туберкулиновых проб применяют туберкулин. Впервые туберкулин был
выделен из продуктов жизнедеятельности микобактерий туберкулеза Р. Кохом в 1890
г. Он представляет собой водно-глицериновый экстракт из бульонной культуры
туберкулезных бактерий. Туберкулин не обладает полными антигенными свойствами,
т.е. не сенсибилизирует здоровый организм и не вызывает образования
противотуберкулезного иммунитета. Его действующим началом является
туберкулеопротеин. Главным термостабильным компонентом туберкулина считается
антиген А60. Туберкулин вызывает ответную реакцию только у людей,
предварительно сенсибилизированных МБТ или вакциной БЦЖ. На месте внутрикожного
введения туберкулина через 24-48 ч развивается специфическая аллергическая
реакция замедленного типа в виде формирования инфильтрата. Патоморфологически
инфильтрат характеризуется отеком всех слоев кожи с мононуклеарной и
гистиоцитарной реакцией. Эта реакция характеризует степень аллергии - изменение
чувствительности или реактивности организма на туберкулин, но не является мерой
иммунитета (Кошечкин, Иванова, 2007).
1.3.4 Лабораторные методы выявления микобактерий
туберкулеза
Лабораторная диагностика обеспечивает выполнение главной задачи
диагностики и лечения туберкулеза - выявление у больного МБТ. В лабораторную
диагностику на современном этапе входят следующие методики:
1) сбор и обработка диагностического материала;
) микроскопическая идентификация МБТ в выделяемых субстанциях или
тканях;
) культивирование;
) определение резистентности к препаратам;
) серологические исследования;
) использование новых молекулярно-биологических методов, включая
полимеразную цепную реакцию (ПЦР) и определение полиморфизма длин рестрикционных
фрагментов (ПДРФ) (Кошечкин, Иванова, 2007).
1.3.5 Микроскопическое исследование для выявления кислотоустойчивых
МБТ
Для микроскопического исследования мазок приготавливают непосредственно
из необработанного диагностического материала или осадка жидкого материала
(метод прямой микроскопии), либо из материала, подготовленного путем
гомогенизации, обеззараживания и центрифугирования (метод микроскопии мазка из
осадка). Метод микроскопии мазка из осадка более информативен, поскольку
обеспечивает обогащение материала за счет освобождения микробов из окружающей
их слизи и их осаждения при центрифугировании.
При подозрении на туберкулез органов дыхания необходимо исследовать не
менее трех проб мокроты, поскольку результативность микроскопической
диагностики повышается при исследовании второго мазка на 10-14%, а при
исследовании третьего мазка - еще на 5-8% (Перельман, 2001).
Отрицательный результат микроскопического исследования не исключает
диагноз туберкулеза, так как в мокроте большинства больных содержится меньше
микобактерий, чем может выявить микроскопия. Микроскопия мазка, окрашенного по
методу Циля-Нильсен, является наиболее распространенным методом выявления
кислотоустойчивых микобактерий (КУМ). Приготовление мазка включает фиксацию,
окраску фуксином (при нагревании и действии карболовой кислоты краситель
проникает в микробную клетку, особенно в клеточную стенку), обесцвечивание (в
25% растворе H2S04 или 3% растворе солянокислого спирта
обесцвечивается краситель, проникший в структуры, не обладающие достаточной
кислотоустойчивостью), контрастирующую окраску (метиленовым синим для придания
препарату контрастности).
Окрашенные по Цилю-Нильсен мазки исследуют с помощью светового микроскопа
(бинокулярного или оснащенного бинокулярной насадкой). Кислотоустойчивые
микобактерии туберкулеза (1-10 мкм в длину и 0,2-0,6 мкм в ширину) видны обычно
в виде тонких изящных палочек (иногда изогнутых или извитых) малиново-красного
цвета, содержащих различное количество гранул. Они располагаются поодиночке,
парами или в виде групп и хорошо выделяются на голубом фоне препарата.
Характерным считается расположение бактериальных клеток в виде римской цифры
«V». Внутри микробных клеток можно обнаружить более интенсивно окрашенные
участки, что делает их похожими на «бусы» (слабо окрашенные участки видны в
виде «полос»).
При выявлении измененных форм возбудителя (скопления кислотоустойчивых
зерен, округлые, L-трансформированные или ветвистые мицелиеподобные структуры)
положительный ответ об обнаружении кислотоустойчивых микроорганизмов должен
быть подтвержден дополнительными методами исследования, иначе результат должен
быть расценен как отрицательный.
Люминесцентная микроскопия основана на том, что специальные красители
(аурамин, родамин и др.) связываются с воскоподобными структурами
М.tuberculosis и окрашенные клетки при ультрафиолетовом облучении определенного
спектра начинают светиться оранжевым или ярко-красным светом на черном или
темно-зеленом фоне. Образующийся за счет свечения ореол увеличивает видимые
размеры клеток, поэтому люминесцентную микроскопию можно проводить при
увеличении 250х-450х, что увеличивает поле зрения и существенно сокращает
время, необходимое для просмотра мазка. Поиск микобактерий облегчает также
значительная резкость и контрастность картины, что особенно ценно при
исследовании олигобациллярного материала. По чувствительности люминесцентная
микроскопия, особенно в сочетании с методом обогащения диагностического
материала (микроскопия осадка), незначительно уступает методу посева, но
применение ее целесообразно в лабораториях, выполняющих большое число
исследований (50 и более ежедневно).
Во всех сомнительных случаях мазок, окрашенный люминесцентными
красителями, следует исследовать повторно, перекрасив его по Цилю-Нильсен.
Опыт фтизиатров всего мира доказал, что «золотым стандартом» диагностики
туберкулеза является сочетание культурального и микроскопического методов
исследования, которые остаются актуальными, несмотря на появление большого
числа альтернативных методов (Браженко, 2006).
1.3.6 Метод посева или культуральный метод выявления M.tuberculosis
Достоверно подтвердить туберкулезную природу заболевания и изучить
биологические свойства выделенного можно только при выделении культуры
M.tuberculosis. Культуральное исследование следует проводить во всех случаях
подозрения на туберкулез, используя не менее двух разных по составу питательные
среды (Левенштейна - Йенсена и Финна-П). Жидкие питательные среды используют
для нейтрализации рН посевного материала, при изучении лекарственной
чувствительности и т.д. (чаще используется среда Школьниковой).
При исследовании на плотных питательных средах ответ о выделении
кислотоустойчивых микобактерий дают при появлении характерных колоний не ранее
3-4 недель инкубации и только после подтверждения кислотоустойчивости выделенного
микроорганизма при микроскопииокрашенного по Цилю-Нильсен мазка из выросших
колоний. Величина КОЕ (число колониеобразующих единиц) высчитывается как
среднее из числа колоний, выросших на всех пробирках. Интенсивность роста
обозначают следующим образом:
+ 1-20 КОЕ «скудное» бактериовыделение;
++ 21-100 КОЕ «умеренное» бактериовыделение;
+++ > 100 КОЕ «обильное» бактериовыделение.
Затем изучают биологические свойства выросшей культуры, ее идентифицируют
и определяют принадлежность к комплексу M.tuberculosis, а также определяют
чувствительность к противотуберкулезным препаратам.
В качестве методов, альтернативных классическому культуральному
исследованию, возможно использование автоматизированных и
полуавтоматизированных систем ускоренной культуральной диагностики: ВАСТЕС,
MGIT (ручная и автоматическая), МВ/ВасТ. Все они используют жидкие питательные
среды и различаются по способу индикации роста микобактерий (Голышевская и др.,
2008).
1.3.7 Культуральная диагностика туберкулеза с помощью автоматизированной
системы BACTEC
Система ВАСТЕС 460 - радиометрический метод быстрого определения роста
МБТ путем регистрации уровня меченого СО2, образующегося в процессе
утилизации субстрата с пальмитиновой кислотой, содержащей радиоактивный 14С.
Для роста МБТ в данной системе используют флаконы с жидкой питательной средой,
которая представляет собой обогащенную среду Middlebrook 7H9, содержащую радиоактивный14С. При размножении
МБТ утилизируют 14С и выделяют 14СО2, в этом
случае учет идет по нарастанию 14СО2(Мишин, 2009).
Система ВАСТЕС MGIT
960 - индикаторные пробирки MGIT( M. GrowthIndicatorTube ) с той же средой Middltbrook 7H9, содержат в придонной части флюоресцирующий индикатор (
трис-4,7-дифенил-1,0-фенантролин рутениум хлорид пентагидрат), «погашенный»
высокими концентрациями О2. В процессе роста МБТ поглощают О2,
что сопровождается усилением свечения индикатора, интенсивность которого
оценивают при помощи трансиллюминатора.
Рост МБТ в системе ВАСТЕС регистрируют на 4-5-й день от момента посева
мокроты.
Культуральный метод и систему ВАСТЕС применяют также для определения
лекарственной устойчивости МБТ (Мишин, 2009).
При положительных данных бактериоскопическогоисследования рост МБТ
обнаруживали радиометрически на 7-10-й день и на 14-21-й дни при отрицательных
данных.
К недостаткам этого метода, ограничивающим возможность его широкого
применения, относятся:
· высокая себестоимость исследования;
· необходимость применения радиоактивных изотопов и
специального радиометрического оборудования, сложность работы с изотопной
технологией;
· необходимость дополнительного посева на плотную питательную
среду при возникновении проблем с идентификацией или интерпретацией результатов
(Бардисявичене, Сосновская, 1996).
туберкулез возбудитель заражение лекарственный
1.3.8 Методы исследования лекарственной
чувствительности микобактерий
Для определения лекарственной чувствительности (ЛЧ) МБТ должны
использоваться только стандартизованные методы исследования, что позволяет:
· правильно вести лечение пациентов;
· интерпретировать и сравнивать данные, полученные из различных
источников;
· проводить оценку уровней лекарственной устойчивости и
тенденций, наблюдаемых в разных регионах или странах.
В настоящее время нет единого универсального метода определения ЛЧ МБТ.
Имеются культуральные методы с использованием плотных и жидких питательных
сред, с полуавтоматической и автоматической детекцией роста микобактерий, а
также молекулярно-генетические экспрессные методы.
Все имеющиеся методы определения ЛЧ МБТ можно условно разделить на 2
категории:
· методы прямого определения ЛЧ МБТ;
· методы непрямого определения ЛЧ МБТ.
При использовании методов прямого определения ЛЧ МБТмокрота или другие
клинические материалы, предварительно обеззараженные и прошедшие гомогенизацию,
высеваются непосредственно на среды, содержащие и не содержащие соответствующий
препарат. Количество инокулята определяется в зависимости от количества КУМ,
определенного при микроскопии мазка.
Методы прямого определения ЛЧ имеют ряд недостатков:
) для исследования нельзя использовать образцы диагностического
материала, имеющие отрицательный результат микроскопии;
) при проведении данного исследования повышается риск
контаминации;
) может наблюдаться недостаточный рост культуры, не позволяющий
сделать достоверные выводы.
При использовании методов непрямого определения ЛЧ МБТпроводится
выделение микроорганизмов из клинических образцов при культивировании, а затем
на контрольную и содержащую препарат яичную или плотную агаровую среду
высевается гомогенная суспензия или культура, выросшая на бульоне.
В литературе описаны три основных классических микробиологических метода
непрямого определения ЛЧ МБТ:
) Метод пропорций, предложенный в 1963 г. Canetti, RistandGrosset
и детализированный в 1985 г. MiddlebrookandCohn;
) Метод коэффициента устойчивости, разработанный в 1961 г.
Mitchison и др.
) Метод абсолютных концентраций на плотных и жидких средах,
модифицированный в 1970 г. Meissener (Севастьянова, 2009).
В Беларуси наиболее распространенным и традиционно используемым методом
определения ЛЧ МБТ является непрямой метод абсолютных концентраций на плотной
яичной питательной среде Левенштейна-Йенсена. Остальные методы тестирования ЛЧ
МБТ являются альтернативными.
1.3.9
Серологические методы диагностики туберкулеза
Серологические методы изучения компонентов плазмы крови при туберкулезе
разрабатывались на протяжении всего XX столетия. Особый интерес исследователей
концентрировался на использовании серологических методов при изучении
внелегочных форм туберкулеза. Однако, в отличие от многих инфекционных
болезней,для которых серодиагностика оказалась эффективным инструментом, для
туберкулеза этот тип исследования не достиг достаточного уровня
чувствительности и специфичности, что определяло бы обоснованность его
использования в клинической практике.
Таким образом, пока эти методики не позволяют в значительной степени
повысить диагностическую и экономическую способность традиционных методов
обнаружения туберкулеза (микроскопия МБТ и культуральные методы выявления МБТ).
Однако в результате быстрого прогресса в разработке сложных
молекулярно-биологических методов, несомненно, в скором времени будет создан
новый, эффективный и дешевый серологический тест выявления туберкулеза
(Кошечкин, Иванова, 2006).
1.3.10 Иммунологические и молекулярно-биологические исследования
Определение противотуберкулезных антител для диагностикитуберкулеза было
начато еще в 20-е гг. XX века (лейкогглютинация, лейкоцитолиз, пассивная
гемагглютинация). С конца 70-х гг. развиваются методы иммуноферментного анализа
(ИФА), широко распространенные в клинической практике (например, для
диагностики вирусных гепатитов или ВИЧ-инфекции). В диагностике туберкулеза
серологические методы, в том числе ИФА, не оправдали всех возлагавшихся надежд,
поскольку не удалось обнаружить специфичных антигенов М. tuberculosis, на
которые у большинства больных вырабатываются соответствующие антитела.
Существующие иммуноферментные тест-системы обладают специфичностью на
уровне 90-94% (6-10% ложноположительных результатов у здоровых лиц или больных
нетуберкулезными заболеваниями), тогда как чувствительность (число
положительных результатов у больных активным туберкулезом) составляет, в
среднем, около 70% (Вишневская, 1998). Поэтому говорить о самостоятельном
значении данного метода для дифференциальной диагностики туберкулеза органов
дыхания пока не представляется возможным. Предложенные в последние годы для
определения противотуберкулезных антител иммунохроматографические тесты хотя и
отличаются простотой и быстротой выполнения, но обладают теми же недостатками,
что и традиционный ИФА.
Для определения антигенов М.tuberculosis используются аффинно очищенные
антисыворотки против микобактерий. Для определения антигенов в сыворотке крови
необходимо диссоциировать иммунные комплексы, но в плевральной и в спинномозговой
жидкости антигены можно определять методом непрямого твердофазового
иммуноферментного анализа. Главной проблемой является получение антител,
обеспечивающих достаточную специфичность и чувствительность исследования,
особенно при непосредственном использовании клинического диагностического
материала.
Молекулярно-генетические методы обнаружения М.tuberculosis основаны на
полимеразной цепной реакции (ПЦР). Принцип метода состоит в циклическом
повторении трех стадий реакции:
1) денатурации ДНК при нагревании;
2) гибридизации искусственно синтезированных олигонуклеотидов с
фланговыми участками цепей амплифицируемого фрагмента ДНК (так называемых
«праймеров» или «затравочных» фрагментов);
) синтеза (достройки) цепи фрагмента ДНК с помощью термостабильной
ДНК-полимеразы.
Многократное удвоение цепей ДНК (30-40 циклов) позволяет в течение
нескольких часов умножить (амплифицировать) специфический участок ДНК в
геометрической прогрессии, а затем идентифицировать его (при электрофорезе в
агарозном геле в присутствии красителя бромидэтидия синтезированный фрагмент
ДНК выявляется в виде светящейся под действием ультрафиолета полосы)
(Вишневская, 1998).
Высокая чувствительность (теоретически возможно определять единичные
М.tuberculosis в образце) и быстрота проведения анализа (1-2 дня) чрезвычайно
ценны для клинической практики. Метод эффективен в отношении возбудителей с
высокой антигенной изменчивостью (в том числе L-форм), определение которых
требует длительного культивирования и сложныхпитательных сред. Однако метод не
позволяет определять степень жизнеспособности выявляемых микобактерий.
Метод ПЦР перспективен для дифференциации М.tuberculosis и
нетуберкулезных микобактерий (в том числе и после культивирования микобактерий,
особенно на жидких питательных средах с использованием систем типа ВАСТЕС) и
для быстрого определения лекарственной устойчивости. Штаммовая идентификация
М.tuberculosis позволяет определять внутривидовые различия возбудителя
туберкулеза и представляет интерес для эпидемиологических исследований и определения
роли суперинфекции при рецидивах туберкулеза. Проблема специфичности ПЦР в
диагностике туберкулеза обусловлена высоким риском ложноположительных
результатов, поскольку продукты амплификации (фрагменты ДНК) легко могут
попасть в исследуемые образцы и служить матрицей для новых реакций. Это
определяет очень жесткие требования к технологии проведения анализов, в том
числе - раздельные помещения для каждой из трех стадий анализа. Проблема может
быть решена за счет инактивации загрязняющих молекул специальными реагентами и
совершенствования технологии подготовки клинических образцов (выделение ДНК на
микропористых частицах стекла, иммуномагнитная сепарации микобактерий и проч.).
Использование методов, основанных на амплификации фрагментов генома
микобактерий (ПЦР), допускается как дополнительный метод ускоренной
дифференциальной диагностики туберкулеза при обязательном параллельном
применении классических микробиологических методов (Вишневская, 1998).
1.4 Лекарственная устойчивость
Чувствительность микобактерий к ПТП определяется неспособностью штамма
расти в среде, содержащей препарат, при стандартных условиях постановки опыта.
Чувствительными к препарату считаются те штаммы микобактерий, на которые этот
препарат в критической концентрации оказывает бактерицидное или
бактериостатическое действие в соответствии с принятым критерием устойчивости.
Устойчивость (резистентность) определяется как снижение чувствительности
до такой степени, что данный штамм микобактерий способен размножаться при
воздействии на него препарата в критической или более высокой концентрации.
Наряду с понятиями «чувствительность» и «устойчивость» к ПТП в настоящее
время используются также термины, определяющие различные аспекты ЛУ.
Монорезистентность - штаммы МБТ резистентны только к одному из пяти ПТП
первого ряда (рифампицин, изониазид, этамбутол, пиразинамид, стрептомицин).
В случае наличия устойчивости к двум или более лекарственным препаратам
данный штамм микобактерий определяется как полирезистентный.
Особое место среди полирезистентных занимают микобактерии, у которых
обнаруживается ЛУ к двум основным ПТП (изониазиду и рифампицину): штаммы,
обладающие ЛУ одновременно к изониазиду и рифампицину, независимо от наличия
устойчивости к другим ПТП, обозначаются как штаммы с множественной
лекарственной устойчивостью. Им уделяется особое внимание, так как лечение
пациентов, у которых патологический процесс вызван такими штаммами, сопряжено с
большими трудностями. Оно длительное, дорогостоящее и требует использования
препаратов резервного ряда, многие из которых также дорогостоящи и могут
вызывать тяжелые побочные реакции. Кроме того, некоторые штаммы обладают
повышенной способностью к распространению и вызывают тяжелые прогрессирующие
формы заболевания, нередко приводящие к неблагоприятному исходу.
Наряду с перечисленными видами спектра ЛУ микобактерий в международной
практике принято различать первичную и приобретенную ЛУ.
Первичная ЛУ определяется как устойчивость, обнаруженная у микобактерий,
выделенных от пациента, который никогда не принимал ПТП или получал такое
лечение менее одного месяца. В данном случае подразумевается, что больной
заразился лекарственно-устойчивыми штаммами микобактерий. Первичная ЛУ
характеризует состояние микобактериальной популяции, циркулирующей на данной территории,
и ее показатели важны для оценки степени напряженности эпидемической ситуации.
Приобретенная (вторичная) ЛУ определяется как устойчивость микобактерий,
выявленных у больного туберкулезом, получавшего лечение ПТП в течение месяца и
более. Является косвенным показателем эффективности проводимой химиотерапии.
Уровень устойчивости штамма в целом выражается той максимальной
концентрацией препарата (количество микрограммов в 1 мл питательной среды), при
которой еще наблюдается размножение микобактерий (определяется по числу колоний
на плотных средах).
Лекарственно-устойчивые микроорганизмы способны размножаться при таком
содержании препарата и в такой среде, которые оказывают на чувствительные особи
бактериостатическое или бактерицидное действие (Голышевская, 2006).
1.5 Клинико-фармакологическая характеристика противотуберкулезных
препаратов
Группа
противотуберкулёзных препаратов включает ряд природных и полусинтетических
соединений, общим свойством которых является активность в отношении
микобактерий туберкулёза. Согласно общепринятой классификации,
противотуберкулёзные препараты разделяются на препараты I ряда
<mk:@MSITStore:F:\Танюша\Современная%20антимикробная%20химиотерапия.%20Руководство%20для%20врачей.%20Л.С.%20Страчунский,%20С.Н.%20Козлов.chm::/mac0201.shtml.htm>
(основные) и II ряда
<javascript:if(confirm('#"557489.files/image007.gif"> образуются бактерии с измененной РНК-полимеразой, теряющей
способность к формированию стойкого комплекса с молекулами антибиотика,
блокирующего действие фермента. Таким образом осуществляется механизм
устойчивости, связанный с изменением мишени для действия антибиотика. Далее
вступает в действие механизм селекции мутантных бактерий с измененной
«нечувствительной» РНК- полимеразой в условиях неадекватной химиотерапии, как
правило, и являющейся основной причиной развития ЛУ штаммов МБТ с высоким
порогом устойчивости.
Рифампицин (Rifampycin) -
полусинтетический дериват рифамицина-В. Препарат хорошо всасывается в
желудочно-кишечном тракте и равномерно распределяется в тканях и жидкостях
организма. Благодаря хорошему проникновению через тканевые барьеры, рифампицин
проникает в фагоциты и убивает внутриклеточно расположенные микобактерии. МПК
рифампицина для чувствительных микобактерий составляет 1мкг/мл. В зависимости
от локализации генной мутации возникает различный уровень ЛУ МБТ - отнизкой, с
МПК 1 - 2 мкг/мл, до средней устойчивости с МПК 16 - 20 мкг/мл и высокой
устойчивостью до 50 мкг/мл и более. Время полувыведения из крови составляет от
1 до 3 ч (Репин,2007).
Этамбутол (Ethambutol) -
синтетическийпрепарат, обладающий бактериостатическим свойством. МПК для
чувствительных штаммов МБТ составляет 0,5 - 2 мкг/мл, относительная
устойчивость с МПК 2 мкг/мл и больше, средняя устойчивость ΙΙ
степени - 5 мкг/мл и
больше и полная устойчивость ΙΙΙ степени - 16 мкг/мл и больше (Репин,
2007).
Механизм действия этамбутола основан на блокаде синтеза миколовой кислоты
и нарушении формирования бактериальной стенки вследствие ингибиции фермента
арабинозинтрансферазы и синтеза арабина, необходимого для соединения миколовой
кислоты с пептидогликаном бактериальной клетки.
Механизм устойчивости обусловлен спонтанной мутацией, ведущей к высокому
уровню экспрессии мутантного гена, благодаря которому обеспечивается синтез
арабина вопреки действию лекарственного препарата. Частота выявления мутантных
генов в устойчивых штаммах МБТ составляет 50% (Степашин и др., 1999). Порог
устойчивости МБТ также зависит от локализации генной мутации.
Суммарная частота ЛУ в клинических изоляторах - 15,5%, в том числе ЛУ к 2
мкг/мл - 9,2%, к 5 мкг/мл - 6,3% (Репин, 2007).
Пик концентрации препарата в крови после приема тест- дозы 25 мг/кг - 2 -
5 мкг/мл, что превышает порог ЛУ Ι и ΙΙ степени (Репин, 2007).
2. МАТЕРИАЛЫ
И МЕТОДЫ ИССЛЕДОВАНИЯ
За период 2008-2011 гг. было проведено 3979 посевов клинических изолятов
мокроты, полученных от пациентов, находившихся на лечении в Минском областном
противотуберкулезном диспансере с диагнозом туберкулеза легких, с целью
получения культур микобактерий туберкулеза.
Перед посевом клинического материала на питательную среду с целью
выделения культуры M.tuberculosis проводилась обработка материала
миколитическими разжижающими веществами с целью удаления белковых масс,
деконтаминация образца с целью удаления сопутствующей бактериальной флоры и
центрифугирование. Содержимое центрифужной пробирки использовалось для
микроскопии и посева на:
а) плотную яичную среду (Левенштейна-Йенсена);
б) агаровую среду ( Миддлбрук 7Н10);
в) систему бульонного культивирования (MGIT).
Затем проводилась инкубация, оценка и учет результатов посева
диагностического материала. Для гомогенизации и деконтаминации диагностического
материала использовались стандартные методы разжижения и деконтаминации:
обработка материала 10% трехзамещенным фосфорнокислым натрием.
Методика обработки:
. Исследуемый материал заливали равным объемом 10% трехзамещенного
фосфата натрия, плотно закрывали емкость и помещали ее на 10 минут на
встряхиватель.
. Пробирку с материалом, залитым деконтаминантом, помещали на 20
часов в термостат при 37 °C.
. После этого пробирки, не открывая, уравновешивали, помещали в
соответствующую центрифугу и центрифугировали при 3000 g в течение 15 минут. При
указанном режиме происходит осаждение 95% присутствующих в материале
микобактерий.
. Надосадочную жидкость отбирали стерильной пипеткой на 5-10 мл и
переносили ее в емкость с дезинфицирующим раствором, оставляя в каждой пробирке
1,2-1,5 мл осадка.
. Использованную пипетку опускали в емкость с дезинфицирующим
раствором.
. К осадку стерильно добавляли несколько капель 6% соляной кислоты
до получения нейтрального значения рН, определяемого индикаторной бумажной
полоской.
. Пробирку с осадком помещали в штатив в порядке регистрационных
номеров материала.
. Для снижения токсичного воздействия на микобактерии различных
остатков веществ (в том числе возможных химиопрепаратов) проводили еще одну
процедуру отмывки осадка 10-15 мл дистиллированной воды.
Супернатант удаляли, а осадок в объеме 0,8-1,0 мл готовили к
инокулированию и приготовлению мазка:
Реактивы
. Трехзамещенный фосфорнокислый натрий (Na3PO4).
. Кислота соляная (HCl) концентрированная.
. Бумага индикаторная универсальная.
Приготовление растворов
1. 100 г трехзамещенного фосфата натрия растворяли в 800 мл
дистиллированной воды и доводили объем раствора до 1 л.
. 6 мл концентрированной соляной кислоты добавляли к 94 мл
дистиллированной воды.
Первой ступенью идентификации является микроскопия всех выделенных
культур с окраской мазков по Цилю-Нильсену.
Реагенты
. Карболовый фуксин Циля 1 фл (100 мл)
. Солянокислый спирт (концентрат) 1 фл (10 мл)
. Метиленовый синий 1 фл (100мл)
Набор обеспечивает 200 исследований (при расходе 0,5 мл реагента на одно
исследование).
Подготовка к анализу
Предметные стекла перед проведением исследования тщательно мыли и
обезжиривали смесью для обезжиривания предметных стекол производства «АБРИС+».
Полученные мазки тщательно высушивали и затем фиксировали сухим жаром.
Фиксация достигается посредством несильного нагревания (примерно до 700С)
предметного стекла, которое для этого трижды провели над пламенемспиртовки
мазком вверх.
Приготовление рабочего растворасолянокислого спирта.
Для приготовления рабочего (3%) раствора солянокислого спирта, во флакон
емкостью 100 мл вносили концентрат солянокислого спирта (10 мл) и добавляли 90
мл этилового спирта (960). Раствор тщательно перемешивали.
Методика окраски:
. Помещали на мазок полоску фильтровальной бумаги и наносили на
фиксированный мазок несколько капель карбол-фуксинЦиля и подогревали над
пламенем спиртовки до появления паров. Эту температуру поддерживали в течение
1-2 минуты, не доводя до кипения. Охлаждали мазок до комнатной температуры.
. Сливали краску, удаляли фильтровальную бумагу и основательно промывали
в водопроводной воде.
. Обрабатывали рабочим раствором солянокислого спирта до полного
визуального обесцвечивания (1-3 минуты).
. Промывали в воде.
. Докрашивали (несколько капель) метиленовым синим 1-2 минуты.
. Основательно споласкивали в воде и высушивали фильтровальной бумагой.
Окрашенные мазки исследовали в масле, с иммерсионным объективом.
Выделение чистой культуры осуществляли традиционным способом _ посевом на
плотную питательную среду Левенштейна-Йенсена.
Реактивы
· Калий однозамещенный фосфорнокислый
KH2PO4.
· Магний лимоннокислый Mg3(C6H5O7)2
× 14H2O.
· Магний сернокислый MgSO4
× 7H2O.
· L-аспарагин C4H8N2O3
× H2O.
· Глицерин C3H8O3.
· Малахитовый зеленый C52H54O12N4.
· Вода дистиллированная.
Состав среды
) Приготовлениераствора минеральных солей:
· Калий однозамещенный фосфорнокислый
2,4 г
· Магний лимоннокислый 0,6 г
· Магний сернокислый 0,24 г
· L-аспарагин 3,6 г
· Глицерин 12,0 мл
· Вода дистиллированная 600 мл
Вышеперечисленные ингредиенты растворяли в теплой дистиллированной
воде вуказанной последовательности при слабом подогревании (не доводя до
кипения) наводяной бане. L-аспарагин растворяли отдельно и вносили последним.
Затем солевой раствор стерилизовали в автоклаве при 1 атм.
(121 °С) в течение 30 минут. Срок хранения раствора составляет 3-4 недели при
комнатной температуре.
)Приготовление раствора малахитового зеленого:
· Малахитовый зеленый 2 г
· Стерильная дистиллированная вода 100
мл
Взвешенный порошок малахитового зеленого растворяли в
стерильной теплой дистиллированной воде и помещали раствор втермостат на 2 часа
для большего растворения (часто помешивали, поскольку порошок растворяется
очень плохо). Затем профильтровывали растворчерез бумажный фильтр, разливали по
флаконам и стерилизовали при 1 атм. (121 °С) в течение 30 минут.
)Приготовление яичной массы.
Свежие диетические куриные яйца без трещин и дефектов
скорлупы тщательномыли в теплой проточной воде с помощью ручных щеток и
щелочного мыла.Далее яйца тщательно промывали в проточной воде и погружали в 70%
этиловыйспирт на 30 минут.
Тщательно мыли руки с мылом и щеткой. Затем в стерильном
боксе разбивали яйца стерильным ножом в стерильную посуду, доведя общий объем
яичной массы до 1 л.
Тщательно взбивали яичную массу стерильным венчиком при
минимальной скорости.
Приготовление среды
В большую стерильную емкость, соблюдая правила стерильности,
помещали следующие растворы:
. раствор минеральных солей 600 мл;
. гомогенизированную яичную массу 1000 мл.
Смесь тщательно перемешивали и профильтровывали через стерильный
марлевыйфильтр, имеющий не менее 4 слоев марли. Добавляли 20 мл раствора
малахитовогозеленого, тщательно перемешивали, избегая образования пены, и в
течение 15 минутразливали в пробирки приблизительно по 5 мл, следя за тем,
чтобы в растворе не сформировался осадок.
Свертывание среды:
Для свертывания среды использовали специальные
аппараты-свертыватели«АСПС». Пробирки с разлитой в них средой помещали в
специальные штативы сподобранным углом наклона для формирования косяка среды
высотой 8-10 см. Штативы устанавливали в свертыватель и проводили коагуляцию
при 82-83 °С в течение40 минут.
В работе использовался коммерческий набор для деконтаминации-разжижения
BBL™ Mycoprep™, в который входит: NaOH- 20.0г; Na3C6H5O7X2H2O(три
натрий цитрат)-14.5г;
Каждая ампула содержит NALC(C5H9NO3S) -
0.375г Буфер: Na2HPO4 - 2.37г; KH2PO4-2.27г.
Конечная pH=6.8
Процедура:
· Готовили BBL™ Mycoprep™ фосфатный буфер, путем растворения
одного пакета в 500 мл дистиллированной воды, автоклавировали при 1210С
15 минут;
· ослабив винтовую крышку флакона BBL™ Mycoprep™ реагента,
фиксировали ампулу внутри флакона и сламывали еесжатием. Слегка встряхивали для
растворения NALC;
· в ламинарном боксе, используя стерильную центрифужную
пробирку, переносили в нее равные количества исследуемого материала и NALC-
NaOH (по 10 мл);
· закрывали пробирку и перемешивали на вортекс-миксере;
· оставляли смесь при комнатной температуре на 15 минут;
· добавляли подготовленный фосфатный буфер до 50-мл отметки на
пробирке и смешивали. Центрифугировали в течение 15 минут при ускорении 3000 g;
· осторожно сливали надосадочную жидкость, добавляли малое
количество фосфатного буфера с рН=6.8 (от 0.5 до 2.0 мл) и ресуспендировали
осадок.
Техника посева и инкубации
Достоверная клиническая интерпретация результатов микробиологического
исследования достигается при обязательном соблюдении следующего правила:
микроскопическое и культуральное исследования должны производиться параллельно
только из одной и той же пробы диагностического материала.
· набирали стерильной мерной пипеткой 1,0 - 1,2 мл полученного
после обработки и нейтрализации осадка, оставив приблизительно 0,2 мл для
последующего приготовления мазка для микроскопии;
· вносили равные объемы набранного обработанного материала
(примерно по 0,5 - 0,6 мл) в 2 пробирки со средой Левенштейна-Йенсена, материал
же, обработанный при помощи NALC- NaOH засевали на косяки агараМиддлбрук 7Н10 и
в пробирки MGIT.
Остаток осадка забирали той же пипеткой и наносили на подготовленные и
пронумерованные предметные стекла 1-2 капли осадка для получения мазка;
подготовленные мазки оставляли сушиться на воздухе, после чего фиксировали их
троекратным проведением в пламени и окрашивали по Циль-Нильсену.
По завершении посева всех проб засеянные пробирки с плотными средами
перемещали в горизонтальные штативы - диваны и помещали в термостат при
температуре 37°С. При посеве на агары и в бульон Миддлбрук чашки Петри и
пробирки герметично упаковывали в автоклавные пакеты, пробки пробирок оставляли
слегка отпущенными.
Детекция роста микобактерий с помощью автоматизированной системы
бульонного культивирования BACTECMGIT 960
Посев диагностического материала в пробирки MGIT
Инокуляция осадка обработанного материала в индикаторные пробирки MGIT
проводили с помощью стерильной пипетки в условиях стерильности:
· снимали откручивающуюся крышку с пробирки MGIT;
· добавляли содержимое флакона с обогатительной добавкой OADC
(15 мл) во флакон с лиофилизированными антибиотиками PANTA;
· переносили 0,8 мл смеси PANTA /OADC в пробирку MGIT;
· вносили 0,5 мл осадка диагностического материала в пробирку
MGIT и параллельно производили посев 0,2-0,5 мл материала на плотную среду
Левенштейна-Йенсена;
· убедившись, что пробка плотно закручена, производили загрузку
пробирки в прибор ВАСТЕС 960 в соответствии с инструкцией по эксплуатации.
Инкубация пробирок в системе
1. Открывали один из ящиков прибора ВАСТЕС MGIT 960 и нажимали
появившуюся на экране кнопку «tubeenter» («Загрузка пробирки»). При этом
загорается лампа сканера для считывания штрих-кода с пробирки.
. Считывали сканером штрих-код пробирки с инокулятом и
устанавливали ее в гнездо, рекомендуемое прибором.
. Ежедневно проверяли показания прибора на предмет появления
положительных и отрицательных результатов.
. О положительном результате (рост микобактерий) свидетельствовал
красный сигнал положительного индикатора на соответствующем ящике и значок на
дисплее прибора.
. При появлении информации о положительном результате открывали
указанный ящик, нажимали появившуюся на экране кнопку «positive», извлекали
соответствующую пробирку из гнезда (вместо красной индикации, указывавшей
непосредственно на место «положительной» пробирки, появляется зеленая,
указывающая на освободившееся гнездо) и сканировали штрих-код.
. Пробирки, рост микобактерий в которых не зафиксирован прибором в
течение 42 дней, оценивались системой как отрицательные. Об отрицательном
результате (отсутствие роста микобактерий) свидетельствовал зеленый сигнал
отрицательного индикатора на соответствующем ящике и значок на дисплее прибора.
. При появлении информации об отрицательном результате открывали
указанный ящик, нажимали появившуюся на экране кнопку «negative», извлекали
указанную пробирку из гнезда и сканировали ее штрих-код.
Оценка результатов культивирования на автоматизированной системе
Положительный результат, свидетельствующий о росте культуры в
индикаторной пробирке, регистрировали с 4-го дня после инокуляции,
положительный сигнал в 1-3-е сутки может быть расценен как микробная
контаминация образца. Для подтверждения роста микобактерий, а также
идентификации МБТ в позитивной пробирке проводили следующие процедуры:удалив
позитивную или негативную пробирку из прибора, визуально оценивали прозрачность
бульонной среды для определения возможного роста микобактерий. Обычно рост
культуры МБТ проявляется в виде характерных придонно расположенных хлопьев,
которые при незначительном встряхивании поднимаются и распространяются по всей
среде, при этом жидкая среда сохраняет прозрачность. Помутнение среды в
позитивной пробирке свидетельствует о возможной контаминации посторонней
флорой.
Готовили мазок по методу Циля-Нильсена для выявления кислотоустойчивых
микобактерий.
Производили субкультивирование на плотной яичной среде для подтверждения
роста типичных колоний микобактерий.
Производили субкультивирование на среде Левенштейна-Йенсена, содержащей
1000 мкг/мл салицилата натрия или 500 мкг/мл паранитробензойной кислоты, для
дифференциации МБТ и нетуберкулезных микобактерий.
При необходимости, для того чтобы убедиться в отсутствии контаминации
позитивной емкости посторонней микробной флорой, готовили мазки с окраской по
Граму и производили пересев содержимого пробирки на чашку с кровянымагаром.
Наличие роста на чашке в результате инкубации в течение 24 часов при 37°С
свидетельствует о микробной контаминации материала.
Чувствительность выделенных штаммов к ряду ПТП (изониазид, рифампицин,
этамбутол (E), стрептомицин (S) и другие) определяли путем высева
чистых культур на плотную питательную среду Левенштейна-Йенсена, методом
абсолютных концентраций, регламентированного инструкцией по применению
«Организация определения лекарственной чувствительности микобактерий
туберкулеза» от 30.12.2002 г. (регистрационный номер 107-1102), разработанной в
ГУ «НИИ пульмонологии и фтизиатрии».
Определение лекарственной устойчивости микобактерий туберкулеза
кпротивотуберкулезным препаратам первого ряда
В нашей стране получило распространение определение лекарственной
устойчивости методом абсолютных концентраций на среде
Левенштейна-Йенсена.
Метод абсолютных концентраций
Метод позволяет исследовать любое количество микобактерий в
диагностическом материале, поскольку для определения лекарственной устойчивости
используются штаммы микобактерий, предварительно выделенные на питательных
средах. Так как сроки выделения возбудителя на питательных средах составляют не
менее 1 - 1,5 месяцев, результаты определения лекарственной устойчивости
указанным методом обычно получают не ранее, чем через 2 - 2,5 месяца после
посева материала. При определении лекарственной устойчивости микобактерий на плотных
средах культура считается чувствительной к той концентрации препарата, которая
содержится в среде, если число колоний микобактерий, выросших на одной пробирке
с препаратом, не превышает 20, а посевная доза соответствует 1-107
микробных тел. Культура расценивается как устойчивая к данной концентрации
препарата только при наличии в пробирке с этой концентрацией 20 колоний и более
при обильном росте в контрольной пробирке, не содержащей лекарственного
препарата.
Разведение противотуберкулезных препаратов и приготовление питательных
сред
В питательную среду Левенштейна-Йенсена, не содержащую крахмала (крахмал
адсорбирует лекарственные препараты), непосредственно перед свертыванием
добавляли рабочие разведения противотуберкулезных препаратов первого ряда в указанных
концентрациях. Для приготовления питательных сред с целью определения
лекарственной устойчивости микобактерий использовались химически чистые
субстанции противотуберкулезных препаратов (Sigma-Aldrich INC). Для
приготовления из химически чистой порошковидной формы препарата рабочих
растворов, содержащих необходимые для исследования концентрации активной
субстанции, расчеты производили с учетом процента активности
препарата.Активность препарата может варьировать от одной его серии к другой
серии. Сведения об активности приводятся на этикетках или упаковках
лекарственных препаратов. Взвешивание производили на электронных весах с
точностью до четвертого знака после запятой.
Определение лекарственной устойчивости методом абсолютных концентраций.
Непосредственно перед постановкой опыта по определению лекарственной
устойчивости убедились в том, что отобранные для исследования культуры
микобактерий не загрязнены посторонней микрофлорой. Проверенные и отобранные
для постановки опыта культуры микобактерий расставляли в штативе в порядке
номеров. При определении чувствительности микобактерий к противотуберкулезным
препаратам каждую серию приготовленной питательной среды с препаратами
проверяли, засевая на нее заведомо чувствительную культуру микобактерий туберкулеза
(справочный штамм лаборатории, H37Rv). Контрольную культуру засеяли так же, как
и испытуемые. Если среда с препаратами приготовлена правильно, то контрольная
культура не должна расти при тех концентрациях препаратов, при которых не
растут чувствительные к данному препарату штаммы. Появление роста контрольного
штамма в пробирке спрепаратом указывает на то, что при приготовлении среды с
препаратами допущена ошибка или на то, что неправильно приготовлена
бактериальная суспензия.
Процедура исследования:
· в полученную бактериальную суспензию внесили по 0,2 мл
суспензии в верхнюю 1/3 косяка во все пробирки с питательной средой,
приготовленной для определения устойчивости культуры данного номера, тщательно
сверяли номер культуры засеваемой суспензии с номерами, написанными на
пробирках. Во избежание ошибок все пробирки, подготовленные для засева одной
культуры, расставляли в одном ряду штатива;
· по завершении засева всех суспензий засеянные пробирки
перемещали в горизонтальные штативы-диваны и помещали в термостат при
температуре 37°С; при этом поверхность косяка питательной среды находилась в
горизонтальной плоскости, а наклон штатива исключал смачивание пробки
материалом засева;
· по истечении 3 суток инкубации засеянные пробирки переводили
в вертикальное положение;
· инкубирование проводили в течение 21 дня при обязательном
еженедельном просмотре.
Оценка результатов
Результат определения лекарственной устойчивости учитывали на 21 день
после посева. При скудном росте в контрольной пробирке все пробирки с препаратами
оставляли еще на 1,5недели в термостате до получения выраженного роста в
контроле, после чего выдавалиокончательный ответ. Культуру считали
чувствительной к данной концентрации препарата, если в пробирке со средой,
содержащей препарат, выросло менее 20 колоний при обильном росте в контрольной
пробирке. Культура считалась устойчивой к той концентрации препарата, которая
содержится в данной пробирке, если в пробирке со средой выросло более 20
колоний при обильном росте в контроле.
Исследования проводились по методу абсолютных концентраций на среде
Левенштейн-Йенсена со следующими концентрациями препаратов 1 ряда: стрептомицин
(Str) - 4 µг/мл, изониазид (Inh) - 0,2 µг/мл, рифампицин (Rif) - 40 µг/мл,
этамбутол (Emb) - 2 µг/мл. Одновременно те же штаммы тестировались на
агаремиддлбрук7Н10. Концентрации препаратов в агареМиддлбрук 7Н10 следующие:
Str-2,0µг/мл; Inh-0,2µг/мл; Rif-1,0µг/мл; Emb-5,0µг/мл.
3. РЕЗУЛЬТАТЫ
И ИХ ОБСУЖДЕНИЕ
Был проведен анализ частоты и структуры лекарственно-устойчивого
туберкулеза в 2008, 2009, 2010 и 2011гг. среди вновь выявленных больных
туберкулезом и контингентов бактериовыделителей, состоявших на учете в Минском
областном противотуберкулезном диспансере. За период 2008 - 2011гг.
бактериологической лабораторией Минского областного противотуберкулезного диспансера
было выполнено 3979 микробиологических исследований на определение
лекарственной устойчивости МБТ к ПТП. Из них ЛУ была подтверждена у 3252 (2008г
- 766 чел., 2009г - 800, 2010г - 849, 2011 - 837) больных туберкулезом.
На рисунке7 показано процентное соотношение всех типов резистентности
культур микобактерий туберкулеза, выделенных от больных в противотуберкулезном
диспансере в 2008-2011 гг.
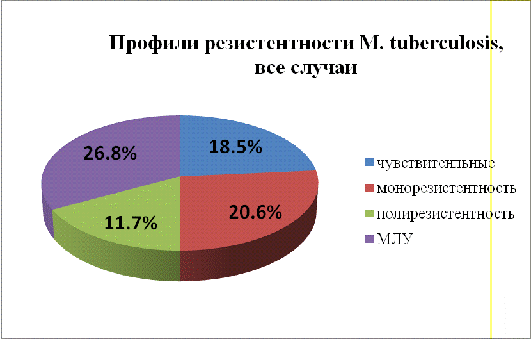
Рис.
7 -Распределение профилей резистентности среди штаммов M.tuberculosis
2008-2011гг.
Как
видно из рис.8, при рассмотрении общего количества штаммов резистентность
распределяется так: полностью чувствительные штаммы составляют 18,5%
всехизолятов, монорезистентные -20,6%, полирезистентные-11,7%, штаммы же с
множественной лекарственной устойчивостью составляют 26,8% всей исследованной
бактериальной популяции. Учитывая тот факт, что «дикие» штаммы M.tuberculosis,
циркулирующие в популяции, за исключением единичных мутантов отличаются полной
чувствительностью к противотуберкулезным препаратам, налицо постепенная смена
генотипа и фенотипа региональных микобактерий на резистентный тип.
В
таблице 2 те же профили резистентности представлены более подробно:
Таблица
2 - Профили резистентности ТБ штаммов, выделенных в диспансере, 2008-2011 гг.
|
Неопредел. сл.
|
Новые сл.
|
Леченные
|
Всего(n=3252)
|
|
N=17
|
%
|
N=978
|
%
|
N=2274
|
%
|
N=3252
|
%
|
|
Монорезистентность
|
|
|
INH
|
|
|
55
|
1.7
|
258
|
7.9
|
313
|
9.6
|
|
RIF
|
|
|
36
|
1.1
|
154
|
4.7
|
180
|
5.5
|
|
SM
|
7
|
0.2
|
105
|
3.2
|
332
|
10.2
|
444
|
13.7
|
|
EMB
|
|
|
23
|
0.7
|
110
|
3.4
|
133
|
4.1
|
|
Всего монорезист.
|
7
|
0.2
|
219
|
6.7
|
854
|
26.3
|
1080
|
33.2
|
|
Полирезистентн.
|
|
|
H+E
|
|
|
56
|
1.7
|
27
|
0.8
|
83
|
2.6
|
|
H+S
|
3
|
0.09
|
117
|
3.6
|
123
|
3.8
|
243
|
7.5
|
|
R+S
|
1
|
0.03
|
66
|
2.0
|
119
|
3.7
|
186
|
5.7
|
|
R+E
|
|
|
17
|
0.5
|
33
|
1.0
|
50
|
1.5
|
|
S+E
|
|
|
34
|
1.1
|
38
|
1.7
|
72
|
2.2
|
|
R+S+E
|
|
|
38
|
1.2
|
42
|
1.3
|
80
|
2.5
|
|
H+S+E
|
|
|
50
|
1.5
|
40
|
1.2
|
90
|
2.8
|
|
Всего полирезист.
|
4
|
0.1
|
378
|
11.9
|
422
|
12.8
|
804
|
24.7
|
|
MDR
|
|
|
H+R
|
|
|
70
|
2.2
|
228
|
7.0
|
298
|
9.2
|
|
H+R+E
|
|
|
44
|
1.4
|
116
|
3.6
|
160
|
4.9
|
|
H+R+S
|
5
|
0.2
|
151
|
4.6
|
377
|
11.6
|
533
|
16.4
|
|
H+R+E+S
|
1
|
0.03
|
116
|
3.6
|
304
|
9.3
|
421
|
12.9
|
|
Всего MDR
|
6
|
0.2
|
381
|
11.7
|
1025
|
31.5
|
1412
|
43.4
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Как видно из таблицы, региональные штаммы, резистентные к одному ПТП
составляют более 33% в общем количестве случаев, более 79% для ранее леченных
больных и до 21% у вновь выявленных случаев. Резистентные к
изониазидурифампицинусоставляют до 44% в общем количестве случаев, более 73%
для ранее леченных больных и 27% у вновь выявленных случаев. Полирезистентность
составила 25%, 48% у впервые выделенных больных и 52% у ранее леченых больных.
Хотя самые высокие показатели относятся к штаммам M.tuberculosis, выделенным от
ранее леченых пациентов и представляют собой вторичную резистентность, из
таблицы видно, что уровень первичной резистентности катастрофически велик.
Особенностью современной эпидемиологической ситуации по туберкулезу в
мире является резкое возрастание частоты первичной лекарственной устойчивости,
и Беларусь не является исключением. Среди факторов, способствующих
возникновению вторичной резистентности, на первом месте стоит
недисциплинированность и несознательность больных, по разным поводам
уклоняющихся от систематического приема противотуберкулезных препаратов.
Значительно реже лекарственная устойчивость развивается из-за плохой
переносимости отдельных препаратов, заставляющей прерывать их прием или
назначать менее действенные режимы лечения. Быстрое нарастание частоты
лекарственной устойчивости стало главной причиной недостаточной эффективности
современных режимов химиотерапии туберкулеза.
В таблице 3 показаны изменения в соотношении резистентности разных типов
по всем случаям за период с 2008 по 2011гг.
Таблица 3 - Временные изменения в профилях резистентности штаммов
M.tuberculosis, выделенных в 2008-2011
|
Годы
|
|
2008
|
2009
|
2010
|
2011
|
|
N=766
|
%
|
N=800
|
%
|
N=879
|
%
|
N=837
|
%
|
|
Монорезистентность
|
|
|
INF
|
67
|
7.0
|
73
|
7.3
|
89
|
8.5
|
84
|
8.3
|
|
RIF
|
37
|
3.8
|
50
|
5.0
|
48
|
4.6
|
55
|
5.5
|
|
SM
|
115
|
12.0
|
113
|
11.3
|
101
|
9.7
|
108
|
10.7
|
|
EMB
|
24
|
2.5
|
36
|
3.6
|
35
|
3.3
|
38
|
3.8
|
|
Всего монорезист.
|
243
|
25.3
|
272
|
27.2
|
273
|
26.1
|
285
|
28.3
|
|
Полирезистентность
|
|
|
H+E
|
21
|
2.2
|
19
|
1.9
|
20
|
1.9
|
25
|
2.5
|
|
H+S
|
73
|
7.6
|
52
|
5.2
|
58
|
5.5
|
57
|
5.7
|
|
H+E+S
|
17
|
1.8
|
16
|
1.6
|
29
|
2.8
|
28
|
2.8
|
|
R+E
|
17
|
1.8
|
10
|
1.0
|
13
|
1.2
|
10
|
1.0
|
|
R+S
|
52
|
5.4
|
37
|
3.7
|
45
|
4.3
|
51
|
5.1
|
|
R+E+S
|
28
|
2.9
|
16
|
1.6
|
17
|
1.6
|
19
|
1.9
|
|
E+S
|
17
|
1.8
|
16
|
1.6
|
19
|
1.8
|
20
|
2.0
|
|
Всего полирезист.
|
225
|
23.5
|
166
|
16.6
|
201
|
19.1
|
210
|
21
|
|
MDR
|
|
|
H+R
|
57
|
5.9
|
69
|
6.9
|
74
|
7.1
|
71
|
7.0
|
|
H+R+E
|
44
|
4.6
|
43
|
4.3
|
34
|
3.2
|
39
|
3.9
|
|
H+R+S
|
109
|
11.3
|
143
|
14.3
|
144
|
13.8
|
132
|
13.1
|
|
H+R+E+S
|
88
|
9.1
|
107
|
10.7
|
123
|
11.8
|
102
|
10.1
|
|
Всего MDR
|
298
|
30.9
|
362
|
36.2
|
375
|
35.9
|
344
|
34.1
|
По сравнению с 2008 годом (79.6%), общий уровень резистентного
туберкулеза повышался в 2009 году до 80.2%, в 2010 - 86.9%. В 2011 году общее
количество резистентных штаммов M.tuberculosis снизилось до 84%. Из них
резистентность к одному противотуберкулезному препарату (монорезистентность)
увеличилась с 25.3% в 2008 году до 28.3% в 2011году, а резистентность более чем
к одному противотуберкулезному препарату (полирезистентность) уменьшилась с
23.5% в 2008 году до 21% в 2011году. Резистентность как минимум к изониазиду и
рифампицину (мультирезистентность) по сравнению с 2008 годом (30.9%) в 2009
году достигла максимума (36.2%) и далее начала постепенно уменьшаться и в 2011
году составила 34.1%.
На рис.8 показано процентное соотношение между чувствительными и
резистентными штаммами, выделенными от ранее не леченных больных туберкулезом в
2008 - 2011гг.
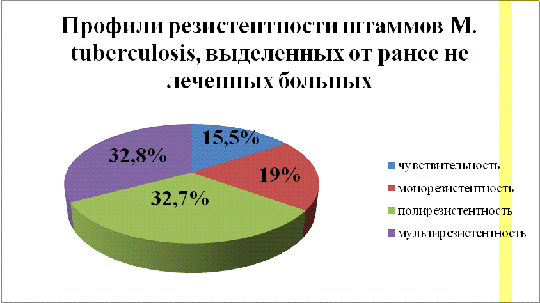
Как видно из рисунка, полностью чувствительные ко всем четырем
противотуберкулезным препаратам культуры встречаются в 15,5 % всех «новых»
случаев. Монорезистентные составили 19% , полирезистентные- 32,7%, 32,8 %
культур были мультирезистентными.
Распределение типов чувствительности - 15.5% на 84.5% свидетельствует о
высоком уровне первичной резистентности. Обычно на развитие резистентности
требуется от одного до полутора месяцев, за это время, при условии, что больной
получает неправильное лечение, популяция возбудителя в организме успевает
пройти селекцию и выживают только те микобактерии, которые успели мутировать.
Поэтому в данном случае мы можем иметь дело с неточностями в сборе первичных
эпидемиологических данных отбольных: многие из них по разным причинам скрывают
факты приема в прошлом какого-либо из противотуберкулезных препаратов. Другое
объяснение высокого уровня резистентности может заключаться в том, что
культуральное исследование проводится не перед началом лечения такого больного,
а минимум через один месяц после начала курса химиотерапии.
Результаты изменения профилейрезистентности в динамике с 2008 до 2011 гг.
по штаммам M.tuberculosis, выделенным от ранее не леченных больных,
представлены в таблице 4.
Таблица 4 - Профили резистентности штаммов M.tuberculosis, выделенных от
ранее не леченных больных, временное распределение
|
Годы
|
|
2008
|
2009
|
2010
|
2011
|
|
N=225
|
%
|
N=247
|
%
|
N=248
|
%
|
N=258
|
%
|
|
Монорезистентность
|
|
|
INF
|
12
|
5.3
|
12
|
4.9
|
14
|
5.6
|
17
|
6.6
|
|
RIF
|
6
|
2.7
|
8
|
3.2
|
10
|
4.0
|
12
|
4.7
|
|
SM
|
35
|
15.6
|
22
|
8.9
|
22
|
8.9
|
26
|
10.1
|
|
EMB
|
3
|
1.3
|
6
|
2.4
|
7
|
2.8
|
7
|
2.7
|
|
Всего монорезист.
|
56
|
24.9
|
48
|
19.4
|
53
|
21.3
|
62
|
24.1
|
|
Полирезистентность
|
|
|
H+E
|
13
|
5.8
|
16
|
6.5
|
13
|
5.2
|
14
|
5.4
|
|
H+S
|
30
|
13.3
|
34
|
13.8
|
26
|
10.5
|
27
|
10.5
|
|
H+E+S
|
11
|
4.9
|
10
|
4.1
|
17
|
6.8
|
12
|
4.7
|
|
R+E
|
5
|
2.2
|
5
|
2.0
|
4
|
1.6
|
3
|
1.2
|
|
R+S
|
14
|
6.2
|
18
|
7.3
|
16
|
6.5
|
18
|
7.0
|
|
R+E+S
|
11
|
4.9
|
10
|
4.1
|
8
|
3.2
|
9
|
3.5
|
|
E+S
|
8
|
3.6
|
7
|
2.8
|
8
|
3.2
|
11
|
4.3
|
|
Всего полирезист.
|
92
|
40.9
|
100
|
40.6
|
92
|
37.0
|
94
|
36.6
|
|
MDR
|
|
|
H+R
|
14
|
6.2
|
17
|
6.9
|
19
|
7.7
|
20
|
7.8
|
|
H+R+E
|
9
|
4.0
|
14
|
5.7
|
10
|
4.0
|
11
|
4.3
|
|
H+R+S
|
31
|
13.8
|
40
|
16.2
|
40
|
16.1
|
40
|
15.5
|
|
H+R+E+S
|
23
|
10.2
|
28
|
11.3
|
34
|
13.7
|
31
|
12.0
|
|
Всего MDR
|
77
|
34.2
|
99
|
40.1
|
103
|
41.5
|
102
|
39.6
|
Как видно из таблицы, учёт и анализ лекарственной устойчивости в Минской
области за период с 2008 по 2011 год выявил значительное увеличение удельного
веса общей (с 23.4% до 25.9%) и множественной лекарственной устойчивоcти (с 34.2% до 39.6%) по отношению ко
всем бактериовыделителям.
В мировой литературе указывается на редкость полирезистентных форм
туберкулеза, однако во многих странах Восточной Европы, странах СНГ в последнее
десятилетие происходит их рост. Это говорит о неэффективности имеющихся
программ по борьбе с туберкулезом, которые не создают условия для полного
излечения впервые выявленных больных.
На рис. 9 представлено процентное соотношение между типами резистентности
культур, выделенных от больных, получавших ранее лечение от туберкулеза.
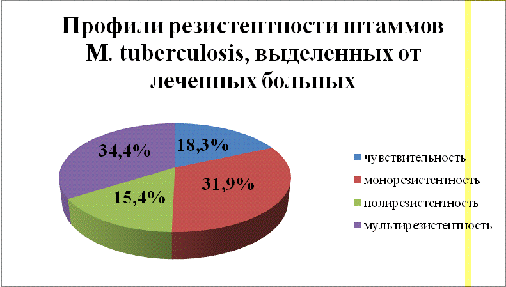
Рис. 9 - Распределение профилей резистентности среди
штаммовM.tuberculosis, выделенных от леченных больных, 2008-2011гг.
Как видно из рисунка, преобладает количество штаммов M.tuberculosis,
резистентных как минимум к изониазиду и рифампицину, то есть мультирезистентных
(34.4%). Монорезистентные штаммы M.tuberculosisу таких больных составляют 31.9%
от общего количества. Еще меньший процент отходит к полирезистентным штаммам.
Это свидетельствует о том, что вторичная резистентность, развивающаяся в
результате неправильного лечения, например, монотерапии, или преждевременного
прерывания курса химиотерапии, как правило, распространяется более, чем на один
противотуберкулезный препарат. В случае выделения от ранее леченного больного
чувствительной культуры, можно предположить недавнюю реинфекцию.
В таблице 5 показано изменение соотношения типов резистентности у ранее
леченных больных по годам с 2008 по 2011.
Таблица 5 - Профили резистентности штаммов M.tuberculosis, выделенных от
леченных больных, 2008 - 2011 гг.
|
Годы
|
|
2008
|
2009
|
2010
|
2011
|
|
N=541
|
%
|
N=553
|
%
|
N=601
|
%
|
N=579
|
%
|
|
Монорезистентность
|
|
|
INF
|
55
|
10.2
|
61
|
11.0
|
75
|
12.5
|
67
|
11.6
|
|
RIF
|
31
|
5.7
|
42
|
7.6
|
38
|
6.3
|
43
|
7.4
|
|
SM
|
80
|
14.8
|
91
|
16.5
|
79
|
13.1
|
82
|
14.1
|
|
EMB
|
21
|
3.9
|
30
|
5.4
|
28
|
4.7
|
31
|
15.3
|
|
Всего монорезист.
|
187
|
34.6
|
224
|
40.5
|
220
|
36.6
|
223
|
48.4
|
|
Полирезистентность
|
|
|
H+E
|
8
|
1.5
|
3
|
0.5
|
7
|
1.6
|
9
|
1.6
|
|
H+S
|
43
|
7.8
|
18
|
3.3
|
32
|
5.3
|
30
|
5.2
|
|
H+E+S
|
6
|
1.1
|
6
|
1.1
|
12
|
2.0
|
16
|
2.8
|
|
R+E
|
12
|
2.2
|
5
|
0.9
|
9
|
1.5
|
7
|
1.2
|
|
R+S
|
38
|
7.0
|
19
|
3.4
|
29
|
4.8
|
33
|
5.7
|
|
R+E+S
|
17
|
3.1
|
6
|
1.1
|
9
|
1.5
|
10
|
1.7
|
|
E+S
|
9
|
1.7
|
9
|
1.6
|
11
|
1.8
|
9
|
1.6
|
|
Всего полирезист.
|
133
|
24.5
|
66
|
11.9
|
109
|
18.5
|
114
|
19.8
|
|
MDR
|
|
|
H+R
|
43
|
7.9
|
52
|
9.4
|
55
|
9.1
|
51
|
8.8
|
|
H+R+E
|
35
|
6.5
|
29
|
5.2
|
24
|
4.0
|
28
|
4.8
|
|
H+R+S
|
78
|
14.4
|
103
|
18.6
|
104
|
17.3
|
92
|
15.9
|
65
|
12.0
|
79
|
14.3
|
89
|
14.8
|
71
|
12.3
|
|
Всего MDR
|
221
|
40.8
|
263
|
47.5
|
272
|
45.2
|
242
|
41.8
|
В таблице видно, что количество выделяемых резистентных культур всех
типов от таких больных снижалось с 70.6% в 2008 году до 69.2% в 2011 году.
Самый высокий уровень из всех типов резистентного туберкулеза имеет
мультирезистентный тип. Его показатели составили в 2008 году 40.8%, в 2009
показатель достиг своего пика 47.5%, в 2010 - 45.2%, затем, в 2011 снизился до
41.8%. Эти изменения можно объяснить тем, что определенная часть таких
больных-это хроники, среди которых отмечается высокий уровень смертности, с
другой стороны, каждый год определенная часть больных, в свое время неправильно
лечившихся или прервавших курс химиотерапии, обращается к врачам с рецидивом
болезни.
ВЫВОДЫ
1) За период 2008 - 2011гг среди региональных штаммов M.tuberculosis
в 81,7% доминировали резистентные. Монорезистентных было 30,7%,
полирезистентных - 28,8%, мультирезистентных - 40,6%. С 2008 по 2011 гг.
наблюдается тенденция к увеличению уровня общей резистентности M. tuberculosisвМнской
области.
) Таким образом, проведенный мониторинг частоты и структуры
лекарственно-устойчивого туберкулеза за период 2008-2011гг. показал, что в
современных эпидемиологических условиях у больных туберкулезом определяется
высокий уровень первичной множественной лекарственной устойчивости - до 10,2%.
Уровень вторичной МЛУ в 2011 г. составил 26,8%.
) За последние четыре года отмечена тенденция к утяжелению
структуры устойчивости за счет нарастания частоты множественной лекарственной
устойчивости к четырем препаратам с 20,1% в 2008 г. до 23,4% в 2011 г.
) На сегодняшний день показатели первичной и вторичной
резистентности остаются на тревожно высоком уровне, а их структура весьма
неблагоприятна
ЛИТЕРАТУРА
1. Бардисявичене
И. Сравнительная эффективность BACTEC 460 ТВ и ИФА в диагностике туберкулеза
легких. Проблемы ускоренной бактериологической диагностики туберкулеза / И.
Бардисявичене, А. Сосновская // Материалы научно-практической конференции -
Обнинск, 1996. - 35 с.
. Бондарев,
И.М. Лечение больных туберкулезом легких переносимыми дозами тубазида / И.М.
Бондарев // Проблемы туберкулеза. - 1972, №8 - С. 8-12.
. Браженко,
Н.А. Фтизиопульмонология: учеб. пособие для студ. высш. учеб.заведений / Н.А.
Браженко. - М.: Академия, 2006. - 368 с.
. Вишневская
Е.Б. Особенности выделения ДНК для ПЦР при туберкулезе внелегочных локализаций/
Е.Б. Вишневская// Проблемы туберкулеза. - 1998. - №5 - С. 23-26.
. Фтизиатрия:
учебное пособие / И.С. Гельберг [и др.]; Гриф МО Республики Беларусь. - Минск:
Вышэйшая школа, 2009. - 334 с.
. Голышевская,
В.И. Современное состояние микробиологической диагностики туберкулеза в России
/ В.И. Голышевская, Э.В. Севастьянова // Актуальные проблемы туберкулеза и
болезней легких: материалы научной сессии, посвященной 85-летию ЦНИИТ РАМН. - М.,
2006. - С. 17-18.
7. Люминесцентная микроскопия: Учебное пособие для проведения
курсов обучения: «Культуральные методы диагностики туберкулеза», «Выявление
туберкулеза методом микроскопии» / В.И. Голышевская [и др.]. - Тверь, 2008. -
36с.
. Дорожкова И.Р. Мониторинг лекарственной устойчивости возбудителя
туберкулеза в России за 1979-1998 гг. / И. Р. Дорожкова[и др.] // Проблемы
туберкулеза. - 2000, №5. - с. 19-22.
. Микробиологические методы диагностики туберкулеза / В.В. Ерохин
[и др.]. - Тверь: Триада, 2008. - 40 с.
. Копылова, И.Ф. Туберкулез органов дыхания у детей и подростков:
учебное пособие / И.Ф. Копылова, С.В. Смердин, М.Г. Вертячих. - Кемерово:
КемГМА, 2007. - 146 с.
. Кошечкин, В.А. Туберкулез: Tuberculosis: Учебное пособие / В.А.
Кошечкин, З.А. Иванова. - М.: РУДН, 2006. - 276 с.
. Кошечкин, В.А. Туберкулез / В.А. Кошечкин, З.А. Иванова. - М.:
Гэотар-Меиа, 2007. - 16 с.
. Манкеев С.М.Пролонгированные фторхинолоны. Новые возможности
лечения мультирезистентного туберкулеза/ С.М. Манкеев //Большой целевой журнал
о туберкулезе - 2001, №11. - 12 с.
. Мишин, В.Ю. Туберкулез легких с лекарственной устойчивостью
возбудителя / В.Ю. Мишин - Москва: ГЭОТАР Медиа, 2009. - С. 39-41.
. Перельман М.И.Проблемы туберкулеза / М.И. Перельман [и др.] //
Проблемы туберкулеза. - 2001, №5. - с. 5-7
. Репин Ю.М. Лекарственно-устойчивый туберкулез легких / Ю.М.
Репин. - Санкт-Петербург: Гиппократ, 2007. - 28 с.
. Севастьянова Э.В.Разработка критериев оценки качества и
эффективности микробиологических исследований в учреждениях
противотуберкулезной службы и общей лечебной сети / Э.В. Севастьянова [и др.]
// Проблемы туберкулеза и болезней легких. - 2009, № 3. - С. 55-60.
. Степаншин Ю.Г.Молекулярные механизмы устойчивости микобактерий
туберкулеза к лекарственным препаратам / Ю.Г. Степаншин [и др.] // РС ВИНИТИ. -
1999, №5. - С. 1- 6.
. Страчунский Л.С. Современная антимикробная химиотерапия.
Руководство для врачей / Л.С. Страчунский, С.Н. Козлов. - М.: Боргес, 2002. -
432 с.
. Хоменко А.Г.Эффективность химиотерапии туберкулеза легких с
лекарственно-устойчивыми микобактериями / А.Г. Хоменко [и др.] // Проблемы
туберкулеза. - 1996, № 6. - С.42-44.
21. Armstrong
A. Time concentration relationships of isoniazid with tubercle bacilli in vitro
/ A. Armstrong [et al.] // Am. Rev. Resp. Dis. - 1960, Vol. 81. - P. 498.
. Balter
M. AIDS now World's fourth biggest killer/ M Balter.// Science. - 1999, № 3. - Р. 1101-1102.
. Coates
A.R.The role of sensitivity tests in short-term chemotherapy / A.R. Coates [et
al.] // Bull In Union Tuberc. - 1983, № 58 (2). - Р. 111-114.
. ColeS.T.,Tuberculosis
/ S.T.Cole [et al.] // Nature. - 1998, Vol. 393. - P. 537-544.
. Herman
R.P.Isoniasid interaction with tyrosine as a possible mode in action if the
drug in mycobacteria / R.P.Herman [et al.] // Antimicr. Agents Chemother. -
1980, Vol. 17. - P. 170 - 178.
. Loudon
R.G.Tuberculosis / R.G. Loudon // Am. Rev. Resp. Dis. - 1968, Vol. 135. - P.
297-300
. MaranetraK.N.Quinolones
and multidrug-resistant tuberculosis. Chemotherapy / K.N.Maranetra, - 1999. -
№45, Suppl 2. - Р. 12-18.
. Mitchison
D.A.Influence of initial drug resistance on the response to short-course
chemotherapy of pulmonary tuberculosis / D.A. Mitchison//Am Rev Respir Dis. -
1986, Vol. 133. - P.423-430.
. PerelmanM.
J.Tuberculosis in Russia / M. J. Perelman // Am Rev Respir Dis. - 2000. - Vol.
4, 12 - P. 1097-1103.
30. Rieder
H.L.Tubercule / H.L. Rieder // Am. Rev. Resp. Dis. - 1985, Vol. 115. - P. 179-186
. ViljanenM.
K.Survey of drug-resistant tuberculosis in Northwestern Russia from 1984
through 1994 / M. K. Viljanen [et al.] // Eur J ClinMicrobiol Infect Dis. -
1998, Vol. 17. - P. 177-183.
. Yomans
A.The effect of the Anti-isoniazid substantle on the chemotherapeutic activity
if izoniazid in vivo / A. Yomans, G. Yomans // Am. Rev. Tuberc. a. Pulm. Dis. -
1956, Vol. 5. - P.764.