Создание РНК-аптамеров, способных связываться с аутоантителами, вырабатываемыми организмом человека при рассеянном склерозе
Дипломная
работа
Создание РНК-аптамеров, способных связываться с аутоантителами,
вырабатываемыми организмом человека при рассеянном склерозе
Содержание
Введение
1. Аптамеры к белковым
мишеням: методы отбора, свойства и
применение (обзор литературы)
1.1 Метод SELEX
1.2 Получение оцДНК- и
РНК-аптамеров
1.3 Модификация аптамеров
1.4 Анализ структуры
аптамеров
1.5 Применение аптамеров
1.5.1 Аптамеры в качестве
средств детекции белков
1.5.2 Аптамеры в качестве
терапевтических средств
2. Экспериментальная часть
2.1 Исходные материалы
2.2 Основные методы работы
2.3 Методики эксперимента
2.3.1 Твердофазный
фосфитамидный синтез комбинаторной библиотеки олигодезоксирибонуклеотидов
2.3.2 Деблокирование
олигодезоксирибонуклеотидов
2.3.3 Выделение олигодезоксирибонуклеотидов
2.3.4 Получение
2'-F-модифицированной РНК-библиотеки
2.3.5 Амплификация
2'-F-модифицированной РНК-библиотеки
2.3.6 SELEX, один раунд
2.3.7 “Негативный” SELEX
2.3.8 Введение
радиоактивной метки по 5'-концу 2'-F-пиримидинсодержащей РНК-библиотеки
2.3.9 Определение констант
диссоциации комплексов 2'-F-модифицированной РНК-библиотеки с поликлональными
аутоантителами
2.3.10 Хроматографическое
разделение 2'-F-модифицированной РНК-библиотеки после 10-го раунда SELEX по
сродству к поликлональным аутоантителам
2.3.11 Получение
плазмидной ДНК на основе вектора pUC18 и дцДНК-библиотеки фракций I, II и III
2.3.12 Приготовление
компетентных клеток
2.3.13 Трансформация
компетентных клеток плазмидной ДНК
2.3.14 Определение наличия
дцДНК-библиотеки в плазмидной ДНК трансформированных клеток
2.3.15 Выделение
плазмидной ДНК
2.3.16 Определение наличия
дцДНК-библиотеки в полученных плазмидных ДНК
2.3.17 Определение
нуклеотидной последовательности плазмидных ДНК
2.3.18 Поиск гомологичных
участков РНК-клонов фракций I, II и III 48
2.3.19 Компьютерное
моделирование вторичной структуры РНК-клонов фракций I, II и III
3. Получение аптамеров к
поликлональным аутоантителам, вырабатываемым организмом человека при рассеянном
склерозе (результаты и обсуждение)
3.1 Химико-ферментативный
синтез 2'-F-модифицированной РНК-библиотеки
3.2 Оптимизирование и
апробация методики отбора аптамеров к поликлональным аутоантителам
3.3 Изучение эффективности
связывания обогащенной 2'-F-модифицированной РНК-библиотеки с поликлональными
аутоантителами 60
3.4 Хроматографическое
разделение 2'-F-пиримидинсодержащей РНК-библиотеки после 10-го раунда отбора на
фракции по сродству к поликлональным аутоантителам
3.5 Клонирование и
секвенирование фракций 2'-F- пиримидинсодержащей РНК-библиотеки
3.6 Определение
гомологичных участков и компьютерное моделирование вторичной структуры
индивидуальных 2'-F-модифицированных РНК-аптамеров фракций I, II и III
Выводы
Список литературы
Список принятых сокращений
В настоящей работе использованы следующие сокращения:
А260 - оптическое поглощение раствора на длине волны 260 нм
о.е. - оптическая единица
НК - нуклеиновая кислота
ДНК - дезоксирибонуклеиновая кислота
кДНК - кодирующая дезоксирибонуклеиновая кислота
дцДНК - двуцепочечная дезоксирибонуклеиновая кислота
оцДНК - одноцепочечная дезоксирибонуклеиновая кислота
РНК - рибонуклеиновая кислота
АТ - антитела
IgG -
иммуноглобулины класса G
ОБМ - основный белок миелина
ВИЧ - вирус иммунодефицита человека
AMV -
вирус птичьего миелобластоза
РС - рассеянный склероз
е. а. - единица активности
LNA -
конформационно затрудненная нуклеиновая кислота
ATP -
аденозинтрифосфат
GTP -
гуанозинтрифосфат
CTP -
цитидинтрифосфат
UTP -
уридинтрифосфат
'-F-UTP - 2'-F-уридинтрифосфат
'-F-СTP - 2'-F-цитидинтрифосфат
dNTP -
дезоксирибонуклеозидтрифосфат
γ-[32P]-ATP - γ-[32P]-аденозинтрифосфат
N-MeIm - N-метилимидазол
IPTG -
изопропилтиогалактозид
X-Gal - 5-бром-4-хлор-3-индолил-β-D-галактопиранозид
BSA -
бычий сывороточный альбумин
DMF -
диметилформамид
DTT -
дитиотреит
THF -
тетрагидрофуран
Py -
пиридин
DCA -
дихлоруксусная кислота- нитрилтрехуксусная кислота
(2-[бис(карбоксиметил)амино]уксусная кислота)
CPG -
стекло с контролируемым размером пор
ПААГ - полиакриламидный гель
ПЦР - полимеразная цепная реакция
ОТ-ПЦР - обратная транскрипция с последующей полимеразной цепной реакцией
УФ - ультрафиолет
EDTA -
этилендиаминтетрауксусная кислота
Tрис -
трис(оксиметил)аминометан
SELEX
- systematic evolution of ligands by exponential enrichment (систематическая эволюция лигандов
при экспоненциальном обогащении)
Kd - константа диссоциации
ПЛУ - полилинкерный участок
Введение
Аптамеры
(от лат. aptus - подходящий, греч. meros - звено) -
синтетические однонитевые нуклеиновые кислоты или пептиды, способные связывать
свои молекулы-мишени с высокой аффинностью и специфичностью [1-3]. Исторически
первыми аптамерами были нуклеиновые кислоты [4, 5]. Метод получения
НК-аптамеров, предложенный в 1990 году, получил название SELEX
[5] (от англ. systematic evolution of ligands by exponential enrichment -
систематическая эволюция лигандов при экспоненциальном обогащении). На
сегодняшний день насчитывается более десятка различных методов отбора
НК-аптамеров. Большинство из них основано на методе SELEX [2, 5-8] ,
но существуют и другие подходы к получению аптамеров, например NECEEM
(nonequilibrium capillary electrophoresis of equilibrium mixtures)
[7, 9]. Наличие различных методов отбора НК-аптамеров позволяет получать
специфические лиганды к самым разнообразным молекулам-мишеням: ионам металлов [10],
малым органическим молекулам [11], нуклеиновым кислотам [12], белкам [8,
13-17], клеткам [18] и даже организмам [19]. Одним из широко исследуемых
классов мишеней для аптамеров являются белки. Благодаря своим свойствам
НК-аптамеры к белковым молекулам-мишеням рассматриваются как перспективные
инструменты детекции [20-22] и терапии [20, 23-26].
Весьма
привлекательными белковыми мишенями для аптамеров являются аутоантитела,
вырабатываемые организмом человека при рассеянном склерозе. Рассеянный склероз
- тяжелое хроническое аутоиммунное заболевание центральной нервной системы с
непредсказуемым, часто прогрессирующим течением [27]. При рассеянном склерозе
поражаются головной мозг, зрительные нервы, спинной мозг, что приводит к
нарушению соответствующих функций организма. Данное заболевание характеризуется
образованием хаотически рассеянных очагов демиелинизации, т.е. утраты миелина -
белково-липидной мембраны, покрывающей нервное волокно. Исследования последних
лет говорят о том, что при рассеянном склерозе нарабатываются аутоантитела,
обладающие функцией протеаз и разрушающие миелиновую оболочку нервных волокон
за счет деградации основного белка миелина (ОБМ) [28, 29]. В литературе
отсутствуют работы, посвященные отбору и исследованию аптамеров к данным
аутоантителам.
Целью
данной дипломной работы являлось получение РНК-аптамеров, устойчивых в
биологических средах, способных селективно и с высокой аффинностью связывать
аутоантитела человека, больного рассеянным склерозом.
Для
этого необходимо было решить следующие задачи:
провести
химико-ферментативный синтез модифицированной комбинаторной РНК-библиотеки;
оптимизировать и апробировать методику отбора модифицированных
РНК-аптамеров к поликлональным аутоантителам человека, больного рассеянным
склерозом;
исследовать эффективность связывания обогащенной модифицированной
РНК-библиотеки с поликлональными аутоантителами;
исследовать влияние обогащенной модифицированной РНК-библиотеки на
деградацию основного белка миелина аутоантителами;
провести клонирование и секвенирование обогащенной модифицированной
РНК-библиотеки;
провести анализ первичной и вторичной структуры полученных индивидуальных
модифицированных РНК-аптамеров.
Работа выполнялась совместно с Лабораторией ферментов репарации и Группой
взаимодействий биополимеров ИХБФМ СО РАН.
Секвенирование было проведено в ЦКП “Секвенирование ДНК” СО РАН.
Основные результаты получены лично дипломником.
1. Аптамеры к
белковым мишеням
аптамер
синтез аутоантитело
методы
отбора, свойства и применение (обзор литературы)
Исторически считалось, что молекулы ДНК и РНК способны лишь хранить и
передавать наследственную информацию. Однако открытие каталитической активности
РНК послужило толчком к поиску олигонуклеотидов, обладающих и другими
функциями. Так были найдены олигонуклеотиды, обладающие каталитической
активностью (ДНКзимы, рибозимы), модулирующие экспрессию генов (например, siРНК) и образующие прочные специфичные
комплексы (аптамеры).
НК-Аптамеры - синтетические одноцепочечные молекулы ДНК или РНК,
получаемые из пула случайных последовательностей в результате отбора по их
саособности к высокоэффективному и специфическому связыванию с
молекулами-мишенями. На сегодняшний день существуют различные методы получения
аптамеров, большинство из которых основано на методе SELEX.
1.1 Метод SELEX
Отбору
аптамеров in vitro к различным
молекулам-мишеням посвящено множество обзоров [2, 3, 8, 30]. Отбор аптамеров
проводят из комбинаторных библиотек олигонуклеотидов. Перед началом селекции
проводят дизайн комбинаторной библиотеки, представляющей собой рандомизированный
район, фланкированный двумя участками с фиксированной последовательностью (рис.
1).
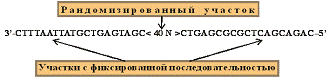
Рис.
1. Комбинаторная библиотека олигонуклеотидов.
При
дизайне комбинаторной библиотеки учитывают такие факторы, как тип библиотеки,
длина рандомизированного участка, свойства константных районов.
Рандомизированная часть комбинаторной библиотеки отвечает за формирование
разнообразных пространственных структур. Константные участки необходимы для
амплификации комбинаторной библиотеки. Чем больше длина рандомизированного
района, тем больше число разнообразных пространственных структур, которые
формирует библиотека. Однако рандомизированный район редко превышает 100 нт.
Во-первых, при химическом синтезе комбинаторной библиотеки, чем больше ее
длина, тем меньше конечный выход. Во-вторых, на первый раунд отбора берут от
сотен пмолей до нескольких нмолей комбинаторной библиотеки, что составляет
примерно от 1014 до 1016 разнообразных молекул. Это
колчество молекул соответствует комбинаторной библиотеке с рандомизированным
районом 25 нт (425 = 1015). Поэтому в случае протяженных
комбинаторных библиотек в отборе принимает участие то же количество
разнообразных молекул, что и в случае коротких комбинаторных библиотек. В
последние годы наиболее часто используют комбинаторные библиотеки с
рандомизированным районом длиной 30 - 40 нт.
Полученную
химическим синтезом комбинаторную библиотеку инкубируют с молекулой-мишенью
(рис. 2). Образовавшиеся комплексы отделяют от несвязавшихся молекул, разрушают
и амплифицируют связавшиеся с мишенью олигонуклеотиды, получая обогащенную
библиотеку.
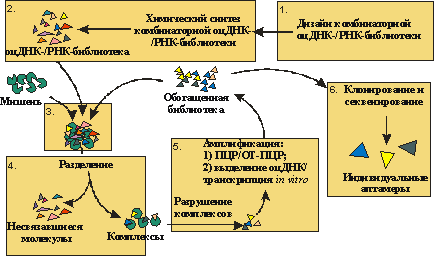
Рис.
2. Общая схема получения аптамеров. Каждый раунд отбора состоит из 1. дизайн
комбинаторной оцДНК- или РНК-библиотеки; 2. химический синтез комбинаторной
стадий: оцДНК- или РНК-библиотеки; 3. инкубирование комбинаторной библиотеки
олигонуклеотидов с молекулой-мишенью; 4. отделение комплексов комбинаторной
библиотеки с мишенью от несвязавшихся молекул; 5. разрушение комплексов
комбинаторной библиотеки с мишенью и амплификация связавшихся с мишенью
олигорибонуклеотидов; 6. клонирование и секвенирование обогащенной библиотеки
после последнего раунда отбора, определение нуклеотидных последовательностей
индивидуальных аптамеров.
Комбинаторная
библиотека проходит несколько раундов отбора до тех пор, пока сродство
обогащенной библиотеки к молекуле-мишени не достигнет максимума. Обычно для
этого требуется 4 - 20 раундов SELEX, что занимает от нескольких недель до нескольких
месяцев. Применение автоматических методов отбора аптамеров существенно
ускоряет этот процесс и позволяет проводить до 10 раундов отбора в день [31].
Обогащенную
дцДНК-библиотеку, полученную в последнем раунде SELEX, клонируют
и секвенируют. Последовательности индивидуальных клонов анализируют и
определяют оптимальную аптамерную последовательность (п. 1.4.).
С
тех пор, как впервые был предложен метод SELEX для отбора
аптамеров [4, 5], создано и апробировано более десятка его различных
модификаций. В табл. 1 приведены виды SELEX, использующиеся при отборе
аптамеров к белковым молекулам-мишеням.
Таблица
1. Виды отбора НК-аптамеров к белковым мишеням.
|
Название метода отбора
|
Особенности метода
|
Ссылка
|
|
Counter -SELEX
|
В ходе отбора комбинаторная библиотека поочередно
инкубируется с белком-мишенью и родственным ему белком. Амплифицируются
олигонуклеотиды, связывающиеся только с молекулой-мишенью.
|
[32-34]
|
|
Toggle-SELEX
|
В ходе отбора комбинаторная библиотека поочередно
инкубируется с несколькими молекулами-мишенями. Амплифицируются
олигонуклеотиды, связывающиеся со всеми молекулами-мишенями.
|
[35]
|
|
SELEX with structurally constrained
libraries
|
В отборе используется комбинаторная библиотека,
последовательность фиксированных участков которой формирует определенную
вторичную структуру. Такой же вторичной структурой будет обладать полученный
аптамер.
|
[5, 36]
|
|
Genomic SELEX или cDNA-SELEX
|
В отборе используется комбинаторная библиотека,
рандомизированный район которой заменен на геномную последовательность. В
качестве мишени используется белок того же организма, которому принадлежит
геномная последовательность. Метод позволяет выявить в геномной
последовательности сайты связывания белков.
|
[37]
|
|
Tailored SELEX
|
В отборе используется комбинаторная библиотека с короткими
константными участками (10 нт). Для амплификации связавшихся с мишенью
олигонуклеотидов проводится реакция лигирования участков с фиксированной
последовательностью к библиотеке. Метод используется для получения коротких
аптамеров.
|
[38, 39]
|
|
Blended SELEX
|
В отборе используется комбинаторная библиотека, включающая
какой-либо лиганд ненуклеотидной природы. Метод позволяет придать аптамеру
дополнительные свойства, помимо мишень-связывающих.
|
[40]
|
|
Covalent SELEX или Cross-linking SELEX
|
В отборе используется комбинаторная библиотека, которая
содержит активные группы, способные ковалентно связывать молекулу-мишень.
Таким же свойством будет обладать полученный аптамер.
|
[41, 42]
|
|
TECS-SELEX (target expressed on
cell surface-SELEX)
|
В качестве мишени используется экспрессирующаяся на
клеточной поверхности рекомбинантная или природная молекула-мишень.
|
[43]
|
|
EMSA-SELEX (еlectrophoretic mobility shift
assays-SELEX)
|
В ходе отбора для разделения комплексов олигонуклеотидов с
мишенью и несвязавшихся молекул используют гель-электрофорез.
|
[17, 44, 45]
|
|
CE-SELEX (capillary
electrophoresis-SELEX)
|
В ходе отбора для разделения комплексов олигонуклеотидов с
мишенью и несвязавшихся молекул используют капиллярный электрофорез.
|
[13, 46]
|
|
FluMag-SELEX
|
В ходе отбора мишень иммобилизуют на магнитных шариках. Для
разделения комплексов олигонуклеотидов с мишенью и несвязавшихся молекул
применяют магнитное поле.
|
[36, 47]
|
Как видно из табл. 1, выбор метода отбора определяется особенностями
мишени и свойствами, которыми должен обладать аптамер. Так, например, TECS-SELEX используется для отбора аптамеров к
мишеням-рецепторам, а Covalent SELEX применяют
для получения аптамеров, ковалентно связывающих молекулы-мишени.
Одной из важнейших стадий отбора аптамеров является стадия отделения
комплексов олигонуклеотидов с молекулами-мишенями от несвязавшихся молекул. Все
способы отделения комплексов от несвязавшихся молекул можно разделить на две
группы.
I. Методы, основанные на иммобилизации белка-мишени:
1.
ковалентная иммобилизация (белок ковалентно связывают с аффинным сорбентом,
например, N-гидроксисукцинимид-активированной сефарозой [40],
Ni-NTA аффинной смолой [48, 49] и др.);
.
нековалентная иммобилизация (белок иммобилизуют за счет сил адсорбции на
ПЦР-пробирке [16, 50], гидрофобных парамагнитных шариках [36, 51, 52],
магнитных шариках [36, 47, 53], нитроцеллюлозе [5, 54-57], стрептавидиновых
“шариках” в случае биотинилированных белков-мишеней [58], модифицированной
сефарозе [18, 59]. Иногда в белок-мишень вводят модификации, способствующие
лучшей адсорбции [47] ).
Для
отделения несвязавшихся молекул от иммобилизованных комплексов проводят отмывку
буфером. В случае использования магнитных шариков для разделения комплексов и
несвязавшихся молекул применяют магнитное поле.
II. Методы, не использующие иммобилизацию белка-мишени:
разделение
комплексов и несвязавшихся молекул методом электрофореза в геле [16, 45, 46,
57] или в капиллярах [14, 47, 60] в неденатурирующих условиях.
Каждый
метод разделения комплексов и несвязавшихся молекул имеет свои преимущества и
недостатки. Гель-электрофорез является самым доступным из вышеперечисленных
методов. Однако, при его использовании часть комплексов, а, следовательно, и
аптамерных последовательностей, остается в геле, то есть теряется. Электрофорез
в капиллярах позволяет использовать для отбора малое количество мишени -
десятки-сотни пмоль, но при этом необходимо учитывать электрофоретическую
подвижность мишени, ее адсорбционные свойства и др. Ковалентная иммобилизация
белка-мишени позволяет многократно использовать одну и ту же колонку для
отделения несвязавшихся молекул от комплексов. Однако метод обладает рядом
недостатков: 1) для иммобилизации необходимо большое количество белка-мишени;
2) в ходе отбора самые прочные комплексы комбинаторной библиотеки и мишени
могут оставаться неразрушенными, что приводит к потере искомых аптамерных
последовательностей; 3) в ходе иммобилизации белка-мишени существует
вероятность связывания его каталитического центра с носителем, что препятствует
отбору аптамеров-ингибиторов. Наиболее приемлемым из всех способов отделения
комплексов белков-мишеней с комбинаторной библиотекой от несвязавшихся молекул
является нековалентная иммобилизация. Инкубирование мишени с комбинаторной
библиотекой с последующей иммобилизацией на нитроцеллюлозных фильтрах
гарантирует доступность для связывания всей поверхности белка-мишени. Однако
доля элюируемых с фильтров олигонуклеотидов составляет 50-80%. Другим методом
нековалентной иммобилизации является адсорбция белка-мишени на парамагнитных
шариках или стенках ПЦР-пробирки. В первом случае для разрушения образовавшихся
комплексов мишени и комбинаторной библиотеки используют специальные элюенты. Во
втором случае для разрушения комплексов применяют термическую денатурацию, что
позволяет проводить образование комплексов олигонуклеотидов с белком-мишенью и
все реакции стадии амплификации в одной ПЦР-пробирке.
В
ходе отбора могут быть использованы последовательно несколько различных методов
отделения комплексов от несвязавшихся молекул, что позволяет выделить
последовательности с максимальным сродством к молекуле-мишени [57].
В
процессе SELEX олигонуклеотиды могут также связываться с молекулами
- “не мишенями”. Для исключения таких олигонуклеотидных последовательностей
применяют “негативный” SELEX [3]. Комбинаторную библиотеку инкубируют в условиях
образования комплекса с мишенью, но без белка-мишени. Несвязавшиеся молекулы
амплифицируют и используют в следующем раунде отбора. При этом “негативный” SELEX
может проводиться как до, так и после раунда отбора аптамера к молекуле-мишени.
Не менее важным, чем способ отделения комплексов от несвязавшихся
молекул, является выбор условий проведения отбора аптамеров к белковым мишеням.
Отбор должен проводиться в тех условиях, в которых впоследствии будет
использоваться аптамер. Так, например, для дальнейшего использования аптамера in vivo оптимальными будут считаться условия, наиболее
близкие к физиологическим.
Другим критическим моментом в процессе отбора как РНК- , так и
ДНК-аптамеров является стадия разрушения комплекса с целью отделения
олигонуклеотидов от молекулы мишени. Именно от нее зависит конечный результат
всего эксперимента. Если условия отделения будут слишком “мягкими”, самые
прочные комплексы аптамеров с молекулами-мишенями не разрушатся и
последовательности с наибольшим сродством к мишени будут утеряны. В слишком
“жестких” условиях есть вероятность разрушить молекулу-мишень или комбинаторную
библиотеку.
Следует
отметить важность чистоты и количества мишени. Если мишень содержит примеси, в
ходе отбора могут быть также получены аптамеры на молекулы, не являющиеся
мишенями. Малых количеств молекулы-мишени может быть недостаточно для того,
чтобы все способные связаться с мишенью олигонуклеотиды образовали комплекс,
что ведет к потере части аптамерных последовательностей. Слишком большие
количества мишени на конечных этапах SELEX снижают селективность
отбора, уменьшают конкуренцию между олигонуклеотидами за место связывания.
Поэтому для получения аптамеров с высокой аффинностью и селективностью в каждом
последующем раунде SELEX условия отбора ужесточают, проводя последовательное
повышение отношения концентрации мишени к концентрации олигонуклеотидов от 1:10
до 1:100 [1, 35].
.2 Получение
оцДНК- и РНК-аптамеров
Как
было ранее отмечено, аптамерами могут быть одноцепочечные молекулы ДНК или РНК.
В случае отбора оцДНК-аптамеров связавшиеся с мишенью молекулы ДНК
амплифицируют методом ПЦР с использованием праймеров, комплементарных
константным участкам комбинаторной библиотеки (рис. 2) [3, 9, 31]. Для
получения обогащенной оцДНК-библиотеки цепи полученной дцДНК необходимо
разделить. Для этого в одну из цепей дцДНК (чаще не в целевую) вводят
какой-либо объемный заместитель: биотин [4] или биотин-стрептавидиновый
комплекс [1, 46, 61], флуоресцентный краситель [62] или олигонуклеотид-олигоэтиленгликолевый
кэп [48, 63]. Положение целевой цепи в геле детектируют в УФ-свете [1, 4, 62],
по флуоресценции красителя [62] или, если в нее была введена радиоактивная
метка, методом радиоавтографии [46]. Систему биотин-стрептавидин применяют для
разделения цепей ДНК и в другом варианте. Биотинилированную по одной цепи дцДНК
инкубируют со стрептавидином, иммобилизованном на каком-либо носителе, с
последующей денатурацией и выделением целевой оцДНК промывкой [41, 54]. Другим
вариантом получения обогащенной оцДНК-библиотеки является введение в
5'-праймер, используемый для амплификации, модификаций, способствующих
деградации измененной цепи в соответствующих условиях. Примерами могут служить
введение уридина по 3'-концу праймера с последующим щелочным гидролизом
модифицированной последовательности [64] или введение по 5'-концу праймера
фосфатной группы с дальнейшей обработкой экзонуклеазой фага λ, которая расщепляет фосфорилированную цепь ДНК [65].
Проведение асимметричной ПЦР с избытком концентрации праймера, отвечающего
аптамерной последовательности оцДНК, тоже приводит к желаемому результату [67].
Полученная обогащенная оцДНК-библиотека участвует в следующем раунде отбора.
В
случае получения РНК-аптамеров синтезированную комбинаторную ДНК-библиотеку
переводят в дцДНК-форму с использованием фрагмента Кленова ДНК-полимеразы E.coli
и 5'-праймера для амплификации. Полученную дцДНК транскрибируют с помощью Т7
РНК-полимеразы. Для этого 5'-праймер для амплификации должен содержать
последовательность промотора Т7 РНК-полимеразы. Полученную РНК-библиотеку
используют в первом раунде отбора. Для получения обогащенной РНК-библиотеки
связавшиеся с мишенью молекулы РНК амплифицируют методом ОТ-ПЦР с
использованием праймеров, комплементарных константным участкам комбинаторной
библиотеки (рис. 2). ПЦР-продукт выделяют из реакционной смеси и используют в
качестве матрицы в реакции транскрипции in vitro.
Полученная обогащенная РНК-библиотека участвует в следующем раунде отбора [1,
3, 31].
Каждый
вид аптамеров - и ДНК, и РНК - имеет свои преимущества. ДНК-аптамеры в отличие
от РНК-аптамеров более стабильны в биологических средах [66]. Однако
РНК-аптамеры за счет 2'-OH группы способны образовывать большее количество
разнообразных вторичных структур (п. 1.4.). Повышение стабильности
РНК-аптамеров в биологических средах может быть достигнуто введением в
олигонуклеотидную цепь соответствующих модификаций (п. 1.3.).
.3
Модификация аптамеров
Существует
два альтернативных пути модификации аптамеров - до отбора [3, 67, 68] и после
него [3, 69]. При введении модификаций до первого раунда SELEX
важно, чтобы полученная модифицированная комбинаторная библиотека была
устойчива в условиях проведения отбора и участвовала в реакциях стадии
амплификации. Модификации, которые вводят в последовательность полученного
аптамера, не должны снижать его аффинность и специфичность к молекуле-мишени.
Для
введения модифицированных нуклеотидов в последовательность комбинаторной
библиотеки или полученного аптамера используют мутантные аналоги ДНК- или
РНК-полимераз, эффективно включающие модифицированные нуклеозидтрифосфаты в
олигонуклеотидную цепь, или подбирают условия, в которых природные полимеразы
будут эффективно включать модифицированные нуклеозидтрифосфаты.
На
данный момент существуют различные типы модификаций как комбинаторных
библиотек, так и индивидуальных аптамеров, удовлетворяющие вышеперечисленным
условиям.
Для
придания аптамерам новых свойств наиболее часто используют введение
заместителей по С5-положению пиримидиновых нуклеотидов исходной библиотеки [66,
70] (рис. 3).

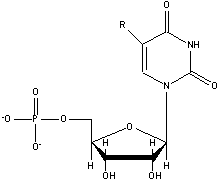
С5-модифицированный
цитидин С5-модифицированный уридин
Рис.
3. С5-Модифицированные пиримидиновые нуклеотиды.
Такие
модификации позволяют получить аптамеры к молекулам-мишеням, для которых отбор
аптамеров с использованием немодифицированной олигонуклеотидной библиотеки
невозможен. Так, несмотря на то, что олигонуклеотиды являются полианионами,
введение в состав исходной библиотеки олигонуклеотидов в С-5 положение
положительно заряженного заместителя позволяет получить аптамер к отрицательно
заряженным молекулам-мишеням [71]. Возможно также получение аптамеров,
ковалентно связывающихся с молекулой-мишенью. Для этого используют библиотеки
олигонуклеотидов, которые содержат фотоактивируемые группы, например, бром или
йод [72]. С-5-Модифицированные пиримидиновые нуклеозидтрифосфаты узнаются как
природными, так и мутантными полимеразами, что позволяет использовать их в
процессе отбора [73]. При сравнении сродства модифицированного и не
модифицированного аптамеров к одной и той же молекуле-мишени Kd комплексов белков с С5-модифицированными аптамерами может отличаться
от Kd комплексов тех же белков с немодифицированными
аптамерами как в большую, так и в меньшую сторону [66].
Для
повышения устойчивости аптамеров к эндонуклеазной деградации широко используют
введение модификаций по 2'-положению, таких как 2'-OCH3, 2'-NH2 или 2'-F
(рис. 4) [3, 66]. Модифицировать по 2'-положению можно как исходную, так и
обогащенную библиотеку олигонуклеотидов.


'-тионуклеозид
LNA



'-аминонуклеозид
2'-О-метилнуклеозид 2'-фторнуклеозид
Рис.
4. Модификации рибозного остатка пиримидиновых (Pyr)
нуклеозидов.
Аптамеры,
содержащие 2'-NH2-модифицированные
пиримидиновые нуклеотиды, более стабильны в сыворотке крови по сравнению с
немодифицированными РНК-аналогами [74], однако такая модификация снижает
термодинамическую стабильность дуплексной части как ДНК-, так и РНК-аптамеров [75].
2'-OCH3-Модифицированные
нуклеотиды широко используются для повышения нуклеолитической стабильности как
индивидуальных аптамеров [67], так и исходных олигонуклеотидных библиотек [76].
Их синтез дешевле, чем синтез 2'-NH2- и 2'-F-содержащих
нуклеотидов, а 2'-OCH3-модифицированные
аптамеры обладают высокой аффинностью и стабильностью в биологических средах.
Более того, 2'-O-метилированные рибонуклеотиды встречаются в природе в
рибосомальных и транспортных РНК млекопитающих [77]. Другой модификацией,
повышающей стабильность РНК-аптамеров в биологических средах, является замена
2'-OH группы на 2'-F [49, 67]. 2'-F-Модифицированные
пиримидиновые нуклеотиды были использованы для получения Macugen
- первого аптамера, прошедшего клиническую проверку [67], и anti-Factor IXa аптамера [78], который сейчас проходит клинические
испытания. 2'-F-Модифицированные олигорибонуклеотиды не токсичны in vivo [77]. LNA-содержащие олигонуклеотиды также можно отнести к
2'-модифицированным НК [79]. Они способны участвовать в реакции транскрипции и
ПЦР, их дуплексы отличаются высокой термостабильностью [79]. Введение LNA-нуклеотидов
существенно повышает стабильность модифицированных олигонуклеотидов в
биологических средах. Исследование токсичности LNA-содержащих
олигонуклеотидов пока не завершено [77]. Вышеупомянутые 2'-модифицированные
нуклеотиды могут быть включены в состав аптамеров как химическим [66, 80], так
и химико-ферментативным путем с использованием мутантных полимераз [66, 76] или
природных полимераз в соответствующих условиях [1, 66, 67, 74].
К
повышающим нуклеолитическую устойчивость олигонуклеотидов модификациям
относится также замена атома кислорода в 4'-положении на серу в пиримидиновых
нуклеотидах [80, 81] (рис. 4). С использованием 4'-тиомодифицированной
РНК-библиотеки был получен РНК-аптамер к α-тромбину, содержащий 4'-S-U и 4'-S-C, который был в 50 раз более устойчив к деградации
РНКазой A, чем немодифицированные РНК [81].
Весьма эффективно повышают устойчивость к нуклеазам модификации по
межнуклеозидной фосфатной группе (рис. 5).


'-фосфоротиоат
5'-α-P-боранофосфат
Рис.
5. Модификации межнуклеозидной фосфатной группы в молекулах аптамеров.
Боранофосфатные
межнуклеозидные мостики формируются природной Т7 РНК-полимеразой [82] или
AmpliTaq ДНК-полимеразой [83] c использованием 5'-α-P-боранонуклеозидтрифосфатов
в случае РНК- и ДНК-аптамеров, соответственно. Данная модификация значительно
повышает стабильность аптамера. Другой удачной модификацией аптамеров является
включение в их состав фосфоротиоатных межнуклеозидных мостиков [68, 84, 85].
Такие аптамеры являются высокоаффинными и существенно более устойчивыми к
деградации нуклеазами. Недостатком фосфоротиоатмодифицированных
олигонуклеотидов является их неспецифическое взаимодействие с белками in vivo [77].
По
аналогии с природными процессами, одним из эффективных способов защиты НК от
деградации экзонуклеазами является “кэпирование” (рис. 6). В качестве “кэпа” на
3'-конце олигонуклеотидов используют, например, концевую 3'-3' фосфодиэфирную
связь (“инвертированный” тимидин) [50, 86], или биотиновый “кэп” [50, 87]. В качестве
“кэпа” на 5'-конце используют полиэтиленгликоль [86] или тринуклеотидный “кэп”,
присоединенный к аптамеру 5'-5'-межнуклеотидной связью [88]. При этом наличие
“кэпа” не затрудняет связывание аптамера с молекулой-мишенью [86].


'-“Инвертированный”
тимидин 5'-Полиэтиленгликоль
Рис.
6. Варианты 3'- и 5'- “кэпов” аптамеров.
Шпигельмеры
(Spiegelmers) (“зеркальные” аналоги аптамеров, состоящие из L-нуклеотидов)
- единственный тип аптамеров, устойчивый к деградации и эндо-, и экзонуклеазами
[40]. Для отбора шпигельмеров используют комбинаторную библиотеку, состоящую из
природных нуклеотидов, но в ходе отбора комбинаторную библиотеку инкубируют с
белком-энантиомером белка-мишени. Полученные после отбора аптамеры синтезируют
химически с использованием L-аналогов мономеров.
.4 Анализ
структуры аптамеров
Для
определения нуклеотидных последовательностей аптамеров полученную в последнем
раунде SELEX обогащенную библиотеку в дцДНК-форме клонируют и
секвенируют [3, 4]. Для этого обогащенную дцДНК-библиотеку амплифицируют с
использованием праймеров, содержащих сайты рестрикции соответствующих
эндонуклеаз. Полученную дцДНК и вектор, содержащий в полилинкерном участке сайты
рестрикции соответствующих эндонуклеаз рестрикции, инкубируют с рестриктазами
для образования “липких” концов. Далее комбинаторную библиотеку и вектор
“сшивают” действием Т4 ДНК-лигазы. Полученную плазмидную ДНК используют для
трансформации компетентных клеток E.coli. После
наращивания клеточной массы полученных трансформированных колоний E.coli
плазмидную ДНК выделяют и секвенируют [3, 4, 16]. Обычно секвенируют порядка 30
-100 клонов [3, 4]. Полученные нуклеотидные последовательности анализируют с
использованием таких программых пакетов, как ClustulW
[89]
или MEME [90], и выявляют их гомологичные участки [3, 91]. Клоны,
обладающие масимально схожими нуклеотидными последовательностями, объединяют в
группы, проводят повторный анализ нуклеотидных последовательностей внутри
группы и выявляют консервативные участки. Именно консервативные участки
аптамеров отвечают за взаимодействие с мишенью. Ранее было показано, что
главную роль в связывании аптамера с мишенью играют неспаренные участки
олигонуклеотида, а часть аптамера, обладающая стабильной вторичной структурой,
служит для поддержания правильного расположения участков, узнающих мишень [9,
79]. Поэтому для всех полученных клонов проводят компьютерное моделирование
вторичной структуры, обычно используя программный пакет mfold [92]. В состав вторичной структуры олигонуклеотидов входят
так называемые шпилечные структуры (структура “стебель-петля”) [13, 93],
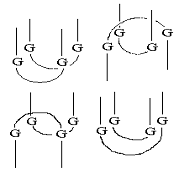
“псевдоузлы” [55, 93], в случае G-богатых последовательностей - “G-квадруплексы”
[33, 94, 95] (рис. 7)
При
этом для ДНК-аптамеров характерными являются G-квадруплексы
различных типов [95], а для РНК-аптамеров - G-квадруплексы [96],
псевдоузлы [93] и структуры типа стебель-петля [49].
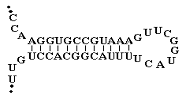
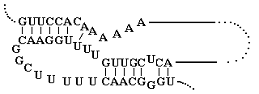
“Стебель-петля” “Псевдоузел”
“G-квадруплекс”
Рис. 7 Типы пространственной структуры олигонуклеотидов: “стебель-петля”,
“псевдоузел”, “G-квадруплекс”.
Для
каждого полученного клона измеряют константу диссоциации его комплекса с
мишенью, т.е. определяют его сродство к мишени. Для определения Kd часто применяют EMSA (анализ изменения электрофоретической подвижности)
[45, 93] или адсорбцию на нитроцеллюлозных фильтрах [6, 55] в случае
радиоактивно меченной комбинаторной библиотеки, а также поверхностный
плазмонный резонанс (SPR) [35, 49] и измерение флуоресценции с использованием
флуоресцентных зондов Beacon [41] для комбинаторной библиотеки без радиоактивной
метки. Обычно константы диссоциации комплексов белок-аптамер лежат в пределах
10-9 - 10-11 M [9, 35], что является
показателем большого сродства аптамера к молекуле-мишени. Также исследуют
влияние полученных клонов на молекулу-мишень. Большинство аптамеров являются
ингибиторами своих мишеней [35, 40], но существуют также аптамеры-активаторы [97,
98].
Из
полученных клонов выбирают те, которые обладают необходимыми свойствами
(например, аптамеры-ингибиторы), а также наибольшими сродством и специфичностью
к молекуле-мишени и дальше работают только с ними. Для того чтобы определить
мишень-связывающие участки аптамера, на комплекс аптамер-мишень действуют
нуклеазами и химическими реагентами, специфически расщепляющими одноцепочечные
и двуцепочечные участки олигонуклеотидов. Такой анализ структуры аптамера
называют футпринтингом [3, 35, 93], а полученную белок-связывающую часть
аптамера - “укороченным” аптамером. “Укороченные” аптамеры обычно обладают
практически таким же [55], а иногда даже большим сродством к молекуле-мишени
[36]. Получение “укороченного” аптамера позволяет также в дальнейшем снизить
затраты на его синтез. Введение точечных мутаций в последовательность
“укороченного” аптамера позволяет выявить влияние на взаимодействие с мишенью
отдельно взятого нуклеотида [36]. Завершающим этапом анализа структуры аптамера
является получение трехмерной структуры его комплекса с белком-мишенью. Для
этого применяют метод ковалентных сшивок [43], ЯМР [99], кристаллографию и
дифракцию рентгеновских лучей [3, 100].
Полученные
данные о структуре и свойствах выделенного аптамера позволяют найти ему
соответствующее практическое применение.
.5 Применение
аптамеров
Аптамеры
к белковым молекулам-мишеням широко применяются в различных областях
молекулярной биологии и медицины. Способность аптамеров образовывать с
молекулой-мишенью прочные комплексы позволяет использовать их в качестве
средств детекции [22, 23, 85, 101-103], для очистки белков [104, 105], для
исследования структуры белков и функций оцДНК и РНК в живой клетке [106-108], а
также в качестве потенциальных терапевтических средств [25, 26, 109, 110].
1.5.1
Аптамеры в качестве средств детекции белков
На данный момент существует несколько различных систем детекции белков на
основе аптамеров. Все их можно разделить на электрохимические, оптические и
гравиметрические методы анализа.
Детекция
белка электрохимическими методами основана на измерении разности
электропроводности системы до введения белка и после. Электрохимические системы
детекции бывают “односторонними” (single-site binding assay) [101, 111] и “двусторонними” (dual-site binding assay или sandwich assay) [85, 112]. Методы “одностороннего” анализа позволяют
детектировать белок-мишень непосредственно при его взаимодействии с аптамером.
Все они используют в качестве основы аптамеры, иммобилизованные на проводящей
подложке: электроде [101, 111, 113], полипирроле [114], кремниевой подложке [115]
или одностенной углеродной нанотрубке [116]. Для получения сигнала используют
молекулы-репортеры - доноры или акцепторы электронов, такие как метиленовый
синий [101, 114], гексацианоферраты 3+ /4+ [114], гексаамминорутенаты 3+ [117],
ферроцен [113]. При этом молекула-репортер изначально либо находится вблизи
проводящей подложки и сигнал наблюдается [101], либо удалена от него и сигнала
нет [113]. После взаимодействия аптамера с мишенью его конформация меняется
так, что происходит “переключение” - “выключение” или “включение” сигнала,
соответственно. С использованием “односторонних” методов анализа созданы
системы детекции α-тромбина человека [101, 111, 113, 116, 118],
тромбоцитарного фактора роста BB (PDGF-BB) [114, 115], иммуноглобулина Е [114],
лизоцима [117]. В случае “двусторонних” систем мишень детектируется по
образованию тройного комплекса антитело-белок-аптамер или
аптамер-белок-аптамер*, что повышает специфичность и чувствительность анализа.
В последнем случае аптамеры должны связывать белок-мишень в разных
неперекрывающихся участках. “Двусторонняя” система детекции состоит из
молекулы-“захватчика”, аптамера [119, 120] или антитела [85, 112, 121-123],
иммобилизованного на проводящей подложке, и молекулы-“детектора”, в качестве
которых зачастую выступают аптамеры, модифицированные наночастицами металлов [120,
123, 124], ферментами [121] и целыми системами амплификации по типу “катящегося
колеса” [122]. На основе “двусторонних” методов анализа созданы системы
детекции α-тромбина человека [85, 120, 123], тромбоцитарного
фактора роста BB (PDGF-BB) [112, 122], иммуноглобулина Е [121].
Оптические
системы детекции белковых молекул-мишеней делятся на флуоресцентные и
колориметрические методы анализа. Детекция флуоресценции используется довольно
часто ввиду наличия большого числа различных флуорофоров и тушителей и легкости
синтеза флуоресцентно меченых аптамеров. Такие аптамеры получили название
сигнальных аптамеров. Одним из самых распространенных методов детекции является
использование системы флуорофор-тушитель [125]. На данный момент такие системы
анализа считаются полуколичественными. Другой тип флуоресцентных методов
анализа основан на переносе энергии между флуоресцентными молекулами - донором
и акцептором (FRET - fluorescence resonance energy transfer) [126]. При образовании комплекса аптамер-мишень
происходит удалание или сближение донора и акцептора и появление или
исчезновение сигнала, соответственно. Недостатком данного метода является его
повышенная чувствительность, например, к природе красителя, длине спейсера,
взаимодействию краситель-краситель и др. В связи с этим метод трудно применим в
биологических средах из-за возрастания шумового сигнала. Использование
пиренильных производных аптамеров также применяется для детекции белковых
молекул-мишеней [127]. При связывании аптамера с белком-мишенью образуется
пиренильный эксимер и происходит смещение максимума испускания флуоресценции с
400 нм до 485 нм. Однако данный метод также трудно применим для исследования
сложных биологических проб из-за большого шумового сигнала. На основе
флуоресцентных аптасенсоров были созданы системы детекции Tat
белка ВИЧ [125],
α-тромбина человека [126],
тромбоцитарного фактора роста (PDGF) [127]. Колориметрические методы анализа
белков базируются на аптамер-зависимой агрегации наночастиц золота [128-130].
Для определения тромбоцитарного фактора роста (PDGF) было предложено ковалентно
иммобилизовать аптамер к PDGF на наночастицы золота [129]. При образовании
комплексов аптамеров с белком-мишенью в условиях низкой концентрации мишени
цвет раствора меняется от красного до розового. При средней концентрации белка
образуется комплекс молекул PDGF и аптамеров, иммобилизованных на наночастицах,
фиолетового цвета. В избытке белка раствор снова становится розовым из-за
образования отдельных наночастиц золота, покрытых молекулами PDGF. С
использованием ковалентно связанных с наночастицами аптамеров также была
создана система детекции тромбина [130]. После связывания аптамера с мишенью
происходит каталитическое увеличение размеров наночастиц золота в присутствии
HAuCl4 и NADH, за счет которого происходит усиление сигнала.
Аналогичная система с применением каталитического нанесения слоя серебра на
наночастицы золота была применена для детекции тромбоцитарного фактора роста BB (PDGF-BB) [131].
Возможно также использование и нековалентного взаимодействия аптамеров с
наночастицами золота [128]. Свободные молекулы аптамеров электростатически
связываются с наночастицами золота и предотвращают их агрегацию. При
образовании комплекса белок-аптамер свободные от аптамеров наночастицы
агрегируют под действием солей.
Гравиметрические
биосенсоры определяют концентрацию белка по изменению сигнала, зависящего от
массы пробы, связанной с их активной поверхностью. Их можно разделить на
сенсоры, использующие затухающие волны (поверхностный плазмонный резонанс (SPR),
акустические сенсоры (QCM, SAW)) и микромеханические кантиливерные сенсоры (cantilever-based sensors). SPR-аптасенсоры
детектируют изменение резонансного угла, возникающее при образовании комплекса
аптамер-мишень. С использованием SPR-метода были созданы сенсоры на Tat
белок ВИЧ-1 [132], прионовый белок (PrP) мыши [133] и фактор роста сосудистого
эндотелия (VEGF) [134]. Микрогравиметрические методы анализа с применением QCM-аптасенсоров
детектируют образование комплексов аптамер-мишень по изменению частоты
резонансных колебаний кварцевых кристаллов. Уже созданы детектирующие системы
такого типа для тромбина [135] и Tat белка ВИЧ-1 [132]. SAW-аптасенсоры
также используют пьезоэлектрические кварцевые кристаллы. К таким аптасенсорам
относятся системы детекции α-тромбина
человека и белка Rev [136], комплекса α-тромбина и антитромбина III человека [137]. В случае кантиливерных сенсоров
аптамер иммобилизуют на вершине кантиливера. При образовании комплекса
аптамер-мишень кантиливер отклоняется от своего первоначального положения, что
можно детектировать оптическими или электрохимическими методами. На основе
таких аптасенсоров возможна детекция Taq ДНК полимеразы [138] и
геликазы вируса гепатита С [139].
.5.2 Аптамеры
в качестве терапевтических средств
Аптамеры как терапевтические средства обладают рядом преимуществ по
сравнению с традиционными лекарственными средствами. По своей высокой
специфичности и сродству к мишеням аптамеры сравнимы с антителами, но
превосходят их по целому ряду характеристик, таких как лучшая способность
проникать через биологические мембраны из-за меньшего размера молекулы, низкая
иммуногенность, а также возможность химического или химико-ферментативного
синтеза в препаративных количествах. Действие аптамеров in vivo может быть пролонгировано или замедлено посредством
соответствующих модификаций. Все аптамеры, обладающие терапевтическим
действием, можно разделить по выполняемым ими функциям на несколько групп:
аптамеры-ингибиторы, аптамеры-приманки, регулируемые аптамеры, мультивалентные
аптамеры, аптамеры-доставщики. Рассмотрим каждую из указанных групп.
Аптамеры-ингибиторы
подавляют действие молекул-мишеней, образуя с ними прочные комплексы. Одним из
самых известных аптамеров-ингибиторов является Pegaptanib
(препарат Macugen) [67, 109]. Pegaptanib с высокой аффинностью
связывает фактор роста сосудистого эндотелия (VEGF). В 2004
году он прошел испытания FDA в качестве лекарственного препарата для лечения
возрастной дегенерации макулы и на данный момент проходит клинические испытания
в качестве лекарственного препарата для лечения диабетической ретинопатии. К
аптамерам-ингибиторам, которые проходят клинические испытания, также относятся
аптамеры к нуклеолину [140, 141], тромбину [142], фактору IXa [143, 144], фактору von Willebrand [143].
Высокий
уровень аутоантител к ДНК характерен для пациентов, страдающих таким
аутоиммунным заболеванием, как системная красная волчанка. В работе [18]
описано получение РНК-аптамера к моноклональному аутоантителу G
6-9, который ингибировал связывание ДНК с аутоантителом. Эти данные говорят о
возможности создания терапевтических препаратов на основе аптамеров к
аутоантителам.
Аптамеры-приманки
имитируют строение белок-узнающих сайтов природных НК, за счет чего образуют
комплексы с ДНК- и РНК- связывающими белками. Уже созданы аптамеры-приманки к
белкам семейства E2F [145,
146], Tat белку ВИЧ [147,
148], фактору транскрипции NF-kB [149,
150] и к аутоантителам человека больного
миастенией [151].
Регулируемые
аптамеры. Одной из проблем при создании лекарств является вопрос о длительности
терапевтического действия препарата. Именно в таких случаях используют
регулируемые аптамеры. Они состоят из двух компонентов: устойчивого в
биологических средах аптамера, обладающего терапевтическим действием, и
немодифицированного олигонуклеотида-модулятора, комплементарного части аптамерной
последовательности. Попадая в организм человека, олигонуклеотиды-модуляторы
деградируются нуклеазами, постепенно освобождая молекулы аптамеров, что
пролонгирует их терапевтическое действие. Таким аптамером является аптамер REG-1,
ингибирующий фактор коагуляции IXа [144]. Он уже прошел 1-ю и 2-ю фазы клинического
исследования. 1-я фаза была пройдена удачно, результаты 2-й фазы клинических
исследований пока не опубликованы.
Мультивалентные
аптамеры - ди-, три- или олигомеры одного или нескольких аптамеров. Обычно
такие конструкции создаются в случае известной структуры молекулы-мишени для
улучшения связывающих способностей аптамера [152, 153]. Методы создания
мультивалентных аптамеров основаны на использовании различных линкерных молекул
для соединения аптамеров в одну конструкцию, таких как
триэтиленгликольфосфатный линкер [154], фосфамидный линкер [153],
полиэтиленгликолевый линкер [98], или олигонуклеотидов-"скрепок"
[152, 155], комплементарных соответствующим линейным участкам аптамеров. Одним
из первых мультивалентных аптамеров является аптамер к цитотоксическому
Т-клеточному антигену 4 (CTLA-4) - рецептору Т-клеток [152]. Ингибирование CTLA-4
способствует Т-клеточной активации, и как следствие, антиопухолевому иммунному
ответу. Как показали эксперименты, тетрамер CTLA-4 аптамера
повышал иммунный ответ как в клеточной культуре, так и in vivo.
К мультивалентным аптамерам относятся также гибриды аптамеров к TAR
элементу ВИЧ и сайту инициации димеризации [154], тромбину [153, 156],
рецептору 4-1BB [155], рецептору OX40 [98].
Аптамеры,
используемые в качестве средств доставки. Мишень-направленная терапия - одна из
актуальных задач современной медицины. С использованием аптамеров к рецепторам,
экспрессирующимся определенными типами клеток, возможна адресная доставка
различных терапевтических средств, таких как токсины, химиотерапевтические
препараты, ферменты и многие другие. Весьма перспективным подходом является
использование аптамеров для доставки в клетки siRNA. Одним из
часто используемых в данном случае аптамеров является аптамер к PSMA,
простат-специфическому мембранному антигену, гиперэкспрессия которого
наблюдается в клетках рака простаты. Для создания химер аптамеров и siRNA
используют систему стрептавидин-биотин и дополнительных комплементарных (“stick”)
последовательностей. В первом случае биотинилированные 5'-конец аптамера и
5'-конец смысловой цепи siRNA связывает стрептавидиновый модуль. Во втором случае
на 3'-конец аптамера добавляется “stick”-последовательность, а одна
из цепей siRNA содержит комплементарную ей последовательность с
3'-конца. Первым способом были получены химеры PSMA-аптамера с siRNA,
направленными на гены Lamin A/C, GAPDH1
и GAPDH2 [157] а также Plk-1 и Bcl-2
[158]. Вторым способом был получен химер gp120 аптамера с
tat-rev siRNA [110]. Для всех
химер эксперименты показали аптамер-опосредованное проникновение siRNA
в клетки. Таким образом, использование аптамеров в качестве средств доставки
может позволить избежать попадания лекарственных средств в здоровые клетки и
этим существенно снизить токсичность препаратов для организма человека.
Как
видно из обзора литературных данных, создание аптамеров к белковым
молекулам-мишеням является перспективным способом решения самых разнообразных
задач в области молекулярной биологии, биотехнологии и медицины. Среди
белков-мишеней есть и антитела, и аутоантитела. На основе аптамера к IgE
человека уже создан электрохимический односторонний биосенсор [114]; к
аутоантителам человека, больного миастенией, создан аптамер-приманка [151];
получен аптамер-ингибитор моноклональных аутоантител G 6-9 к ДНК,
вырабатывающихся при системной красной волчанке [18]. Однако, отбор аптамеров к
аутоантителам, вырабатываемым организмом человека, больного рассеянным
склерозом, в литературе не описан. В то же время аптамеры, специфически
связывающие аутоантитела человека при рассеянном склерозе, могут послужить
основой для создания перспективных средств диагностики и терапии данного
заболевания.
2.
Экспериментальная часть
2.1 Исходные
материалы
В работе были использованы следующие реактивы и растворители: спермидин
гидрохлорид (CALBiochem, США), N-метилимидазол (N-MeIm), дитиотреит (DTT), акриламид, N,N'-метиленбисакриламид (Acros Organics, Бельгия), додецилсульфат натрия (Life Technologies, США), 5'-O-диметокситритил-N6-бензоилдезоксирибоаденозин-3'-N,N-диизопропил-(2-цианэтил)-фосфитамид (dA-CE), 5'-O-диметокситритил-N4-ацетилдезоксирибоцитидин-3'-N,N-диизопропил-(2-цианэтил)-фосфитамид
(dC-CE), 5'-O-диметокситритил-N2-изобутирилдезоксирибогуанозин-3'-N,N-диизопропил-(2-цианэтил)-фосфитамид (dG-CE), 5'-O-диметокситритилтимидин-3'-N,N-диизопропил-(2-цианэтил)-фосфитамид (dT-CE), полимерный носитель CPG с присоединенным 5'-O-диметокситритил-N4-ацетилдезоксирибоцитидином
(Glen Research, США), Твин 20, перхлорат натрия,
персульфат аммония, краситель “Stains-Аll”, полиэтиленгликоль 8000, хлорид
магния, этилтиотетразол, трис(гидроксиметил)аминометан (Sigma-Aldrich, США), тетрагидрофуран (THF), пиридин (Py) (Panreac, Испания), мочевина, 40%-ный водный метиламин (Merck, Германия), бромид этидия,
2,6-лутидин, ксиленцианол FF,
бромфеноловый синий, Тритон X-100
(Serva, Германия), дихлоруксусная кислота (DCA), N,N,N',N'-тетраметилэтилендиамин, хлорид калия (Fluka, Швейцария), триптон, дрожжевой
экстракт, агар, агароза LE 2
(Helicon, Россия), ампициллин (Gibco,
США), Na2EDTA (Amresco,
США), γ-[32P]-ATP (4000 Ки/моль, “Биосан”, Россия), 2'-F-UTP, 2'-F-СTP (НаноТех-С, Россия), ацетонитрил
(ос. ч.), диметилсульфоксид (ос. ч.), гидрокарбонат натрия (ос.ч.), карбонат
натрия (ос.ч.) и другие реактивы и растворители отечественного и импортного
производства. Безводные растворители готовили с использованием стандартных
методов. Изопропилтиогалактозид (IPTG)
(Сибэнзим, Россия) был любезно предоставлен д.б.н. Жарковым Д.О. (ИХБФМ СО
РАН). X-Gal (Kramel Biotech,
Великобритания) был любезно предоставлен Храповым Е.А. (ИХБФМ СО РАН).
Для ферментативных реакций использовали полинуклеотидкиназу фага Т4 (КФ
2.7.1.78), РНК-полимеразу фага Т7 (КФ 2.7.7.6), бактериальную щелочную
фосфатазу (КФ 3.1.3.1), обратную транскриптазу вируса птичьего миелобластоза
(КФ 2.7.7.49), ДНКазу I (КФ
3.1.4.5), фрагмент Кленова ДНК-полимеразы E.coli (КФ 2.7.7.7),
эндонуклеазы рестрикции BamHI,
HindIII, Pst I (КФ 3.1.4.30), ДНК-лигазу фага Т4 (КФ 6.5.1.1) (Fermentas, Литва), Taq ДНК-полимеразу (КФ 2.7.7.7) (“Биосан”, Россия).
Набор для секвенирования ДНК Big Dye Terminators v.3.1. Cycle Sequencing Kit был любезно предоставлен ЦКП
“Секвенирование ДНК” СО РАН.
Для измерения констант диссоциации комплексов аутоантител и 2'-F-РНК использовали нитроцеллюлозные
фильтры MF-MilliporeTM с размером пор 0.45 мкм (Millipore, Ирландия).
Олигодезоксирибонуклеотиды-праймеры dm 28, dm 28 long, dm 29, HindIII,
BamHI, seq 1, seq 2
(табл. 2) были синтезированы в ЛХРНК ИХБФМ СО РАН Мещаниновой М.И. на
синтезаторе ASM-800 («Биоссет», Россия) с
использованием протокола операций твердофазного фосфитамидного синтеза,
оптимизированного для данного прибора. Праймер M13 reverse
был любезно предоставлен к.б.н. Морозовым И.В. (ИХБФМ СО РАН).
Таблица 2. Олигодезоксирибонуклеотиды, использованные в работе
|
Олигонуклеотид
|
Последовательность олигонуклеотида
|
|
оцДНК-библиотека
|
5'-TCGCGCGAGTCGTCTG<40N>CCGCATCGTCCTCCC-3'
|
|
5'-праймер
dm 28
|
5'-TAATACGACTCACTATAGGGAGGACGATGCGG-3'
|
|
5'-праймер
dm 28 long
|
5'-GAAATTAATACGACTCACTATAGGGAGGACGATGCGG-3'
|
|
3'-праймер
dm 29
|
5'-TCGCGCGAGTCGTCTG-3'
|
|
5'-праймер
HindIII
|
5'-CCGAAGCTTGAAATAATACGACTCACTATAGGGAGGACGATGCGG-3'
|
|
3'-праймер
BamHI
|
5'-GCGGGATCCTCGCGCGAGTCGTCTG-3'
|
|
5'-праймер
seq 1
|
5'-CCCAGTCACGACGTTGTAAAACG-3'
|
|
3'-праймер
seq 2
|
5'-AGCGGATAACAATTTCACACAGG-3'
|
|
праймер M13 reverse
|
5'-CACACAGGAAACAGCTATGAC-3'
|
Цветами отмечены: ….. - промотор Т7 РНК-полимеразы; …- сайт рестрикции эндонуклеазы HindIII; … - сайт рестрикции эндонуклеазы BamHI.
Образцы крови для выделения поликлональных аутоантител были взяты у
больных, состоящих в областной общественной организации больных рассеянным
склерозом г. Новосибирска, и у больных, состоящих на учете при кафедре
неврологии и нейрохирургии НГМУ. Поликлональные аутоантитела класса G были выделены из 10 образцов
сыворотки крови больных рассеянным склерозом, хроматографически разделены на
фракции по сродству к основному белку миелина и иммобилизованы на BrCN-активированной сефарозе (Sigma-Aldrich, США) согласно протоколу (Pharmacia, Швеция) в Лаборатории ферментов
репарации ИХБФМ СО РАН Безугловой А.М. Пул поликлональных аутоантител хранили в
50 мМ Tрис-HCl, pH 7.5
при -20°С.
Для клонирования обогащенной 2'-F-модифицированной РНК-библиотеки использовали клетки E.coli штамма DH5α, любезно предоставленные д.б.н. Жарковым Д.О. (ИХБФМ СО
РАН), и вектор pUC18 (Fermentas, Литва).
.2 Основные
методы работы
Для приготовления буферных растворов и реакционных смесей использовали
бидистиллированную воду или воду, очищенную с использованием системы очистки
воды Simplicity System (Millipore, Ирландия), стерилизованную автоклавированием.
Для
измерения оптической плотности растворов олигонуклеотидов использовали NanoDrop
1000 (Thermo Fisher Scientific, США). Концентрации растворов рассчитывали, используя коэффициенты
молярного поглощения олигонуклеотидов при 260 нм, вычисленные с учетом
гипохромного эффекта по формуле [159]:
ε = 2·(
ε1,2 + ε2,3 + . . . + εn-1,n)
- ε2 - ε3 - . . .
- εn-1,
где
εi
- молярный коэффициент поглощения нуклеотида N,
εi-1,i -
молярный коэффициент поглощения для пары нуклеотидов.
Значения
молярных коэффициентов поглощения для 2'-F-рибонуклеотидов
принимали равными соответствующим молярным коэффициентам поглощения для
рибонуклеотидов. Массы полученных дцДНК-библиотеки и 2'-F-модифицированной
РНК-библиотеки определяли из соотношений 1 о.е. = 50 мкг и 1 о.е. = 40 мкг,
соответственно [54].
Аналитический
денатурирующий гель-электрофорез проводили в 12%-ном или 15%-ном ПААГ толщиной
0.4 мм в условиях: акриламид:N,N'-метиленбисакриламид (30:1), 7 М мочевина, 50 мМ
Трис-борат (pH 8.3), 0.1 мМ Na2EDTA,
при напряжении 50 B/см. Для нанесения олигонуклеотидных образцов на гель
использовали денатурирующий буфер (буфер А) следующего состава: 8 М мочевина,
0.025%-ный ксиленцианол FF и 0.025%-ный бромфеноловый синий. После проведения
электрофореза гель окрашивали раствором красителя “Stains-All”,
приготовленным из 50 мг красителя “Stains-All” и 100 мл
смеси формамид:вода (1:1). Полученные гели сушили в течение 1.5-2 ч с
использованием Gel Dryer FB GD45 (Fisher Biosciences, США).
Препаративный
денатурирующий гель-электрофорез проводили в 12%-ном или 15%-ном ПААГ толщиной
0.8 мм или 0.4 мм в условиях: акриламид:N,N'-метиленбисакриламид
(30:1), 7 М мочевина, 50 мМ Трис-борат (pH 8.3), 0.1 мМ Na2EDTA,
при напряжении 50 B/см. Для нанесения олигонуклеотидных образцов на гель
использовали буфер А. После проведения электрофореза гель помещали на пластину
для ТСХ (DC-Alufolien Kieselgel 60 F254, Merck, Германия) и визуализировали олигонуклеотиды в УФ-свете.
Нативный
гель-электрофорез проводили в 12%-ном или 15%-ном ПААГ толщиной 0.8 мм в
следующих условиях: акриламид:N,N'-метиленбисакриламид (30:1), 50 мМ Трис-борат (pH
8.3), 0.1 мМ Na2EDTA, при напряжении 50 В/см. Для нанесения
олигонуклеотидных образцов на гель использовали нативный буфер для нанесения
(буфер В): 0.05%-ный ксиленцианол FF и 0.05%-ный бромфеноловый
синий в 50%-ном глицерине. Визуализацию олигонуклеотидов проводили как описано
выше.
Электрофорез
вектора pUC18 проводили в 1%-ном агарозном геле толщиной ~4 мм с
использованием камеры MiniSub Cell GT (BioRad,
США) в следующих условиях: 1%-ная агароза, бромид этидия (0.5 мкг/мл), 25 мМ
Трис-борат (pH 8.3), 0.05 мМ Na2EDTA,
при напряжении 12 В/см. Для нанесения олигонуклеотидных образцов на гель
использовали нативный буфер для нанесения (буфер B). После
проведения электрофореза гель визуализировали в УФ-свете в системе
гель-детекции “Gel imager 2” (ООО “Компания
Хеликон”).
2.3. Методики
эксперимента
.3.1
Твердофазный фосфитамидный синтез комбинаторной библиотеки
олигодезоксирибонуклеотидов
Приготовление
растворов мономеров
Качество коммерческих препаратов фосфитамидов, используемых в работе,
проверяли методом ТСХ в системе этанол:хлористый метилен (5:95). Защищенные
дезоксирибофосфитамиды перед работой сушили над Р2О5 при
2-4 мм рт. ст. в течение 1 ч. Количество мономеров рассчитывали, исходя из
того, что на каждую стадию конденсации требуется 60 мкл 0.05 М раствора
мономера. Для синтеза константных участков комбинаторной оцДНК-библиотеки растворы
фосфитамидов готовили из расчета 0.05 г мономера на 1 мл абс. CH3CN. Для синтеза рандомизированного участка комбинаторной
оцДНК-библиотеки смешивали все четыре фосфитамида в одном флаконе из расчета
0.05 г dА-CE, 0.045 г dC-CE, 0.059 г dG-CE и 0.042 г dТ-CE на 1 мл абс. CH3CN. К готовым растворам фосфитамидов
добавляли молекулярные сита.
Синтез
комбинаторной оцДНК-библиотеки
Синтез вели на синтезаторе ASM-800
(“Биоссет”, Россия) в масштабе 0.4 мкмоль (реактор на 50 мкл) твердофазным
фосфитамидным методом согласно протоколу, приведенному в табл. 3.
Таблица 3. Протокол операций автоматического фосфитамидного синтеза
олигодезоксирибонуклеотидов
|
№п/п
|
Операция
|
Реагент
|
Кол-во мкл /эквивалентов
|
Время, сек
|
|
1.
|
Промывка
|
CH3CN
|
280
|
11.6
|
|
2.
|
Промывка
|
CH2Cl2
|
270
|
9.0
|
|
3.
|
Детритилирование
|
3% DCA
в CH2Cl2
|
325
|
120.0
|
|
4.
|
Промывка
|
CH3CN
|
270
|
10.8
|
|
5.
|
Промывка
|
CH3CN абс.
|
250
|
10.0
|
|
6.
|
Конденсация
|
0.05 М р-р мономера*, 0.25 M р-р этилтиотетразола в CH3CN абс.
|
50 / 12.5 50 / 31
|
250.0
|
|
7.
|
Промывка
|
CH3CN
|
60
|
1.2
|
|
8.
|
Кэпирование
|
CpB (16% N-MeIm в THF) CpA (Ac2O/2,6-лутидин/THF (1:1:8))
|
130 / 1268 100 / 525
|
24.2
|
|
9.
|
Промывка
|
CH3CN
|
30
|
31.8
|
|
10.
|
Окисление
|
0.02 М I2 в THF / Py / H2O
(90:1:9)
|
160 / 13
|
66.0
|
|
11.
|
Повторить п. 1-10
|
|
|
|
|
12.
|
Конец синтеза Повторить п. 1-4
|
|
|
|
*-в случае синтеза рандомизированного участка использовали раствор 4-х
фосфитамидов в абс. CH3CN.
2.3.2
Деблокирование олигодезоксирибонуклеотидов [160]
Полимер после синтеза (из одного реактора) сушили в вакууме мембранного
насоса DOA V130 BN (Waters, США) в течение 2 мин и переносили в
пробирку на 0.6 мл. К полимеру приливали 0.3 мл 40 %-ного водного метиламина и
выдерживали в течение 15 мин при 65°С и постоянном перемешивании
(термостатируемый шейкер Thermomixer compact (Eppendorf, Германия), 14000 об./мин). Затем
раствор выдерживали при -20°С в течение 15-20 мин и отделяли от полимера.
Полимер промывали 3х100 мкл смеси этанол:ацетонитрил:вода (1:1:1). Растворы
объединяли и упаривали до сухого остатка в вакуумном испарителе Speed-Vac (Eppendorf, Германия). Сухой остаток растворяли в 100 мкл воды и измеряли
оптическую плотность полученного раствора.
2.3.3
Выделение олигодезоксирибонуклеотидов
Выделение
олигодезоксирибонуклеотидов - праймеров
К реакционным смесям после синтеза и деблокирования олигонуклеотидов (п.
2.3.2.) добавляли равный объем денатурирующего буфера А и наносили на 15%-ный
ПААГ толщиной 0.8 мм из расчета 3-4 о.е. на карман. После проведения
электрофореза олигонуклеотиды в геле визуализировали в УФ-свете (п. 2.2).
Учасок геля, содержащий целевой олигонуклеотид, вырезали, заливали 1 мл 0.3 М NaClO4 и перемешивали при комнатной температуре в течение
нескольких часов (термостатируемый шейкер Thermomixer compact, Eppendorf, Германия, 400 об./мин). Элюат отбирали, гель промывали 1 мл того же
раствора. Объединенные элюаты обессоливали на картридже Alltech C 18 (США), промывая колонку сначала 0.05 М водным раствором NaClO4, затем 0.05 М NaClO4 в 50%-ном CH3CN.
Растворы олигонуклеотидов упаривали на испарителе SpeedVac (Eppendorf, Германия) до объема 0.1 мл.
Олигонуклеотидный материал осаждали добавлением 1 мл 2%-ного NaClO4 в ацетоне с последующим выдерживанием при -20°С в
течение 10-12 ч. Осадок отделяли центрифугированием (центрифуга MiniSpin, Eppendorf, Германия, 14500 об./мин, 10 мин,
20°С), супернатант отбирали, осадок промывали ацетоном и высушивали в течение 5
мин при 37°С.
Гомогенность выделенных олигонуклеотидов анализировали
гель-электрофорезом в 15%-ном денатурирующем ПААГ с последующим окрашиванием
геля раствором красителя “Stains-All”.
Выделение
комбинаторной библиотеки олигодезоксирибонуклеотидов
К реакционной смеси после синтеза и деблокирования библиотеки
олигонуклеотидов (п. 2.3.2.) добавляли равный объем денатурирующего буфера А и
наносили на 12%-ный ПААГ толщиной 0.8 мм из расчета 3-4 о.е. на карман. После
проведения электрофореза олигонуклеотиды в геле визуализировали в УФ-свете (п.
2.2). Участок геля, содержащий целевой олигонуклеотид, вырезали и заливали 1 мл
2 мМ Na2EDTA в 0.3 М CH3CO2Na (pH 7.8), перемешивали при комнатной температуре в течение
нескольких часов (термостатируемый шейкер Thermomixer compact, Eppendorf, Германия, 400 об./мин). Элюат отбирали, гель промывали 1 мл того же
раствора. Олигонуклеотидный материал осаждали добавлением 2,5-кратного избытка
(по объему) этанола с последующим выдерживанием при -20°С в течение 10-12 ч.
Осадок отделяли центрифугированием (центрифуга MiniSpin, Eppendorf, Германия, 14500 об./мин, 10 мин,
20°С), супернатант отбирали, осадок промывали 75%-ным этанолом и сушили при 2-4
мм. рт. ст. в течение 20 мин. Гомогенность выделенной библиотеки анализировали
гель-электрофорезом в 12%-ном денатурирующем ПААГ с последующим окрашиванием
геля раствором красителя “Stains-All”.
2.3.4
Получение 2'-F-модифицированной РНК-библиотеки
Синтез
дцДНК-библиотеки с использованием оцДНК-матрицы [54]
5'-Праймер dm 28 или dm 28 long (2 нмоль) и оцДНК-библиотеку (п. 2.3.3.) (1 нмоль)
предварительно инкубировали в буфере (90 мкл), содержащем 10 мM Tрис-HCl (pH 8.0) и 10 мM MgCl2, в течение 5 мин при 90°С (микротермостат “Модель
206”, ООО “БИС-Н”, Россия). Реакционную смесь охлаждали во льду в течение 5 мин
и добавляли в буфер (600 мкл), содержащий 10 мM Tрис-HCl (pH 7.5), 5 мM MgCl2, 7.5 мM DTT, 0.5 мM dGTP, 0.5 мM dATP, 0.5 мM dCTP, 0.5 мM dTTP, 50 е.а./мл фрагмента Кленова
ДНК-полимеразы E.coli. Реакционную смесь инкубировали при
37°С в течение 1 ч (суховоздушный термостат, Jouan, Франция). Для остановки реакции добавляли 12 мкл 100
мМ Na2EDTA (pH
8.3). Олигонуклеотидный материал осаждали добавлением 2,5-кратного избытка
этанола в присутствии 0.3 М CH3CO2Na (pH 7.8) с
последующим выдерживанием при -20°С в течение 10-12 ч. Осадок отделяли
центрифугированием (центрифуга MiniSpin, 14500 об./мин, 10 мин, 20°С), супернантант отбирали, осадок промывали
75%-ным этанолом и сушили при 2-4 мм. рт. ст. в течение 20 мин. Полученный
осадок растворяли в 18 мкл бидистиллированной воды. К раствору добавляли 2 мкл
буфера В и наносили на 12%-ный нативный ПААГ толщиной 0.8 мм. Олигонуклеотиды
визуализировали в УФ-свете (п. 2.2). Участок геля, содержащий дцДНК-библиотеку,
вырезали, заливали 1 мл 2 мМ Na2EDTA в 0.3 М CH3CO2Na (pH 7.8) и перемешивали при комнатной температуре в течение
нескольких часов (термостатируемый шейкер Thermomixer compact, 400 об./мин). Элюат отбирали, гель промывали 1 мл
того же раствора. Олигонуклеотидный материал осаждали добавлением 2,5-кратного
избытка этанола как описано выше. Осадок дцДНК-библиотеки растворяли в 20 мкл
буфера (10 мМ Tрис-HCl (pH
8.0) и 1 мМ Na2EDTA). Полученный раствор дцДНК-библиотеки использовали в
качестве матрицы в реакции транскрипции in vitro.
Транскрипция in vitro с использованием набора “TranscriptAid T7 high yield transcription kit” (Fermentas)
Реакцию синтеза 2'-F-РНК проводили в однократном буфере TranscriptAid™ (Fermentas) (20 мкл), содержащем 2 мкл
TranscriptAid™ смеси ферментов (Fermentas), 2 мкг дцДНК-библиотеки, по 2 мкл 100мМ ATP, GTP, CTP, UTP (Fermentas) при 37°С в течение 7 ч (суховоздушный термостат). По
окончании инкубации в реакционную смесь добавляли 10 мкл ДНКазы I, свободной от РНКаз, и инкубировали
в течение 15 мин при 37°С (суховоздушный термостат). Затем в реакционную смесь
добавляли 100 мМ Na2EDTA (pH 8.0) до концентрации 40 мкM в реакционной смеси и инкубировали при 65°С в течение 10 мин
(микротермостат “Модель 206”). К реакционной смеси добавили 50 мкл 3 М CH3CO2Na (pH 5.2) и последовательно
экстрагировали смесью фенол:хлороформ (1:1) (500 мкл) и хлороформом (500 мкл).
РНК-транскрипт осаждали добавлением 2.5-кратного избытка этанола с последующим
выдерживанием при -20°С в течение 10-12 ч. Осадок 2'-F-РНК отделяли центрифугированием (центрифуга Centrifuge 5415 R, Eppendorf,
Германия, 13000 об./мин, 10 мин, 4°С), промывали 75%-ным этанолом и сушили при
2-4 мм. рт. ст. в течение 20 мин. Полученный осадок РНК-транскрипта растворяли
в буфере А и проводили гель-электрофорез в 12%-ном ПААГ в денатурирующих
условиях. Олигонуклеотиды визуализировали в УФ-свете (п. 2.2). Участок геля,
содержащий 2'-F-модифицированную РНК-библиотеку,
вырезали, заливали 1 мл 0.3 М CH3CO2Na (pH 5.2),
перемешивали при комнатной температуре в течение нескольких часов
(термостатируемый шейкер Thermomixer compact, 400
об./мин), элюат отбирали, гель промывали 1 мл того же раствора.
Олигонуклеотидный материал осаждали этанолом как описано выше. Полученную 2'-F-модифицированную РНК-библиотеку
растворяли в бидистиллированной воде и хранили при -20°С.
Гомогенность выделенного транскрипта анализировали гель-электрофорезом в
12%-ном денатурирующем ПААГ с последующим окрашиванием геля раствором красителя
“Stains-All”.
Транскрипция
in vitro и выделение 2'-F-пиримидинсодержащего
РНК-транскрипта [54]
Реакцию синтеза 2'-F-РНК
проводили в буфере (500 мкл), содержащем 4% (масса/объем) полиэтиленгликоля
8000, 40 мM Tрис-HCl (pH 8.0), 12 мM MgCl2, 5 мM DTT, 1 мM спермидин гидрохлорид, 0.002% (по объему) Tритона X-100, 1 мM ATP, 1 мM GTP, 3 мМ 2'-F-CTP, 3 мM 2'-F-UTP, раствор 250 пмоль дцДНК-библиотеки
в буфере (10 мМ Tрис-HCl (pH 8.0), 1 мМ Na2EDTA), 3500 е.а./мл Т7 РНК-полимеразы,
при 37°С в течение 7 ч (суховоздушный термостат). По окончании инкубации в
реакционную смесь добавляли 10 мкл ДНКазы I, свободной от РНКаз, и инкубировали в течение 15 мин при
37°С (суховоздушный термостат). Затем в реакционную смесь добавляли 100 мМ Na2EDTA (pH
8.0) до концентрации 40 мкM в реакционной
смеси и инкубировали при 65°С в течение 10 мин (микротермостат “Модель 206”). К
реакционной смеси добавили 50 мкл 3 М CH3CO2Na (pH 5.2) и последовательно экстрагировали смесью фенол:хлороформ
(1:1) (500 мкл) и хлороформом (500 мкл). РНК-транскрипт осаждали добавлением
2.5-кратного избытка этанола с последующим выдерживанием при -20°С в течение
10-12 ч. Осадок 2'-F-РНК отделяли
центрифугированием (центрифуга Centrifuge 5415 R, Eppendorf, Германия, 13000 об./мин, 10 мин,
4°С), промывали 75%-ным этанолом и сушили при 2-4 мм. рт. ст. в течение 20 мин.
Полученный осадок РНК-транскрипта растворяли в буфере А и проводили
гель-электрофорез в 12%-ном ПААГ в денатурирующих условиях. Олигонуклеотиды
визуализировали в УФ-свете (п. 2.2). Участок геля, содержащий 2'-F-модифицированную РНК-библиотеку,
вырезали, заливали 1 мл 0.3 М CH3CO2Na (pH 5.2),
перемешивали при комнатной температуре в течение нескольких часов
(термостатируемый шейкер Thermomixer compact, 400
об./мин), элюат отбирали, гель промывали 1 мл того же раствора.
Олигонуклеотидный материал осаждали этанолом как описано выше. Полученную 2'-F-модифицированную РНК-библиотеку
растворяли в бидистиллированной воде и хранили при -20°С.
Гомогенность выделенного транскрипта анализировали гель-электрофорезом в
12%-ном денатурирующем ПААГ с последующим окрашиванием геля раствором красителя
“Stains-All”.
2.3.5
Амплификация 2'-F-модифицированной РНК-библиотеки (по оптимизированному
нами протоколу [54])
Обратная
транскрипция 2'-F-пиримидинсодержащей
РНК-библиотеки 2'-F-РНК (3 пмоль) и
3'-праймер dm 29 (100 пмоль) в 30 мкл
бидистиллированной воды предварительно инкубировали при 90°С в течение 2 мин
(микротермостат “Модель 206”) и охлаждали до комнатной температуры. Полученный
дуплекс 2'-F-РНК и 3'-праймера dm 29 использовали в реакции обратной
транскрипции. Синтез кДНК проводили в буфере (50 мкл), содержащем 50 мМ Tрис-HCl (pH
8.0), 8 мM MgCl2, 30 мМ KCl, 1
мМ DTT, 0.5 мМ dGTP, 0.5 мM dATP, 0.5 мM dCTP, 0.5 мM dTTP, 400 е.а./мл AMV RT, при 37°С в течение 30 мин, затем при 48°С в течение 30 мин
(термостатируемый шейкер, BIOER,
США).
Амплификация
кДНК, полученной в ходе обратной транскрипции
Реакционную смесь после обратной транскрипции использовали для
последующей амплификации. Реакционная смесь для ПЦР (1000 мкл) содержала 7.5 мМ
MgCl2, 1 мM dGTP, 1 мM dATP, 1 мM dCTP, 1 мM dTTP, 2 мкМ 3'-праймера dm 29, 2 мкМ 5'-праймера dm 28/ dm 28 long, 25 е.а./мл Taq ДНК-полимеразы, 10 мМ Tрис-HCl (pH 8.3), 50 мМ KCl. Реакционную смесь переносили в 10 ПЦР-пробирок на
0.5 мл по 100 мкл реакционной смеси в каждую и помещали в амплификатор Mastercycler gradient (Eppendorf, Германия).
Амплификацию проводили в следующих условиях: 93°С 3 мин, 93°С 30 сек,
63°С 1 мин, 72°С 1 мин, затем повтор еще 20 циклов, охлаждение до 4°С. Продукты
амплификации анализировали гель-электрофорезом в 12%-ном ПААГ в денатурирующих
условиях.
Очистка
ПЦР-продукта
Способ 1. ПЦР-продукт выделяли препаративным гель-электрофорезом в
12%-ном ПААГ в нативных условиях, используя гель толщиной 0.4 мм. Олигонуклеотиды
визуализировали в УФ-свете (п. 2.2). Участок геля, содержащий дцДНК-библиотеку,
вырезали, заливали 1 мл 2 мМ Na2EDTA в 0.3 М CH3CO2Na (pH 7.8), перемешивали при комнатной температуре в течение
нескольких часов (термостатируемый шейкер Thermomixer compact, 400 об./мин), элюат отбирали, гель промывали 1 мл
того же раствора. Олигонуклеотидный материал осаждали добавлением 2,5-кратного
избытка этанола с последующим выдерживанием при -20°С в течение 10-12 ч. Осадок
ПЦР-продукта отделяли центрифугированием (центрифуга MiniSpin, 14500 об./мин, 10 мин, 20°С),
супернантант отбирали, осадок промывали 75%-ным этанолом и сушили при 2-4 мм.
рт. ст. в течение 20 мин. Полученную дцДНК растворяли в буфере (10 мМ Tрис-HCl (pH
8.0), 1 мМ Na2EDTA) и хранили при -20°С.
Способ 2. ПЦР-продукт очищали от праймеров,
дезоксирибонуклеозидтрифосфатов и фермента с использованием набора “DNA clean & concentrator-25” (Zymo Research, США):
1. колонку Zymo-Spin помещали в пробирку на 2 мл;
2. к реакционной смеси (1000 мкл) после проведения ПЦР добавляли
2-кратный избыток (по объему) ДНК-связывающего буфера (Zymo Research), перемешивали, центрифугировали в
течение 15 сек при 14400 об./мин, 20°С (центрифуга MiniSpin);
. 800 мкл полученного раствора наносили на колонку и
центрифугировали в течение 30 сек при 14400 об./мин, 20°С;
. колонку промывали 2х200 мкл промывочного буфера (Zymo Research), центрифугировали в течение 30 сек
при 14400 об./мин, 20°С;
. колонку переносили в новую пробирку на 1.5 мл;
. элюировали олигонуклеотидный материал с колонки добавлением 30
мкл буфера (10 мМ Tрис-HCl (pH 8.0), 1 мМ Na2EDTA), центрифугировали в течение 30 сек
при 14400 об./мин, 20°С.
In vitro транскрипция
Полученную дцДНК-библиотеку далее использовали в реакции транскрипции in vitro как описано в п. 2.3.4. 2'-F-Модифицированную РНК-библиотеку очищали препаративным
гель-электрофорезом в 12%-ном ПААГ толщиной 0.4 мм в денатурирующих условиях.
Олигонуклеотиды визуализировали в УФ-свете (п. 2.2). Участок геля, содержащий
2'-F-модифицированную РНК-библиотеку,
вырезали, заливали 1 мл 0.3 М CH3CO2Na (pH 5.2),
перемешивали при комнатной температуре в течение нескольких часов
(термостатируемый шейкер Thermomixer compact, 400
об./мин), элюат отбирали, гель промывали 1 мл того же раствора.
Олигонуклеотидный материал осаждали этанолом как описано выше. 2'-F-РНК растворяли в бидистиллированной
воде и хранили при - 20°С.
2.3.6
SELEX, один раунд (по оптимизированному нами протоколу
[50])
Иммобилизация
аутоантител, образование комплексов аутоантител с 2'-F-модифицированной РНК-библиотекой
Поликлональные аутоантитела класса G (2.6 мг/мл, 0.7 мкл) в 50 мМ Tрис-HCl (pH 7.5), разбавляли 0.05 М NaHCO3/Na2CO3 (pH
9.6) до концентрации 10 мкг/мл. 100 мкл полученного раствора помещали в
ПЦР-пробирку и инкубировали при 4°С в течение 16-20 ч. Раствор несвязавшихся со
стенками пробирки антител удаляли. Иммобилизованные на стенках ПЦР-пробирки
антитела промывали 4х100 мкл промывочного буфера (50 мМ Tрис-HCl (pH
7.5), 200 мМ KCl, 0.05%-ный (по объему) Твин 20).
Далее в ПЦР-пробирку с иммобилизованными антителами добавляли 500 мкл
блокирующего буфера (50 мМ Tрис-HCl (pH 7.5), 200 мМ KCl,
0.1%-ный (масса к объему раствора) казеин) и инкубировали при комнатной
температуре 1 ч, после чего еще раз промывали антитела 500 мкл промывочного буфера.
'-F-Модифицированную РНК-библиотеку в
100 мкл буфера для связывания (50 мМ Tрис-HCl (pH 7.5), 200 мМ KCl)
инкубировали при 90°С в течение 3 мин (микротермостат “Модель 206”). Охлаждали
до комнатной температуры, помещали в ПЦР-пробирку с иммобилизованными
антителами и инкубировали при комнатной температуре 1 ч. Несвязавшиеся с
аутоантителами олигонуклеотиды удаляли. Комплекс иммобилизованных аутоантител с
2'-F-модифицированной РНК-библиотекой
промывали 500 мкл промывочного буфера.
Разрушение
комплексов аутоантител с 2'-F-модифицированной
РНК-библиотекой. Реакция обратной транскрипции
Вариант 1. В ПЦР-пробирку с иммобилизованными комплексами аутоантител и
2'-F- РНК добавляли 100 мкл 7 М мочевины,
200 мкл смеси Tрис-HCl (pH
8.0): фенол (1:5) и инкубировали при комнатной температуре в течение 30 мин.
Затем добавляли 50 мкл бидистиллированной воды и 100 мкл хлороформа,
центрифугировали (центрифуга MiniSpin, 14500 об./мин, 15 сек, 20°С) и отбирали водный слой. К нему добавляли
200 мкл смеси Tрис-HCl (pH
8.0): фенол (1:5), 100 мкл хлороформа и центрифугировали (центрифуга MiniSpin, 14500 об./мин, 15 сек, 20°С). К
отобранному водному слою добавляли 20 мкл 3М CH3CO2Na (pH 5.2). Олигонуклеотидный материал осаждали 2.5-кратным
избытком этанола (п. 2.3.4). Полученный осадок 2'-F-РНК растворяли в 20 мкл бидистиллированной воды. К раствору
добавляли 100 пмоль 3'-праймера dm 29,
инкубировали при 90°С в течение 2 мин (микротермостат “Модель 206”) и охлаждали
до комнатной температуры. Полученный дуплекс 2'-F-РНК и 3'-праймера dm 29 использовали в реакции обратной транскрипции. Синтез кДНК проводили в
буфере (50 мкл), содержащем 50 мМ Tрис-HCl (pH 8.0), 8 мM MgCl2, 30 мМ KCl, 1
мМ DTT, 0.5 мМ dGTP, 0.5 мM dATP, 0.5 мM dCTP, 0.5 мM dTTP, 400 е.а./мл AMV RT, при 37°С в течение 30 мин, затем при 48°С в течение 30 мин
(термостатируемый шейкер, BIOER).
Полученную кДНК использовали в ПЦР.
Вариант 2. В ПЦР-пробирку с иммобилизованными комплексами аутоантител и
2'-F- РНК добавляли буфер (100 мкл),
содержащий 50 мМ Tрис-HCl (pH 8.0), 8 мM MgCl2, 30 мМ KCl, 1
мМ DTT, 0.5 мМ dGTP, 0.5 мM dATP, 0.5 мM dCTP, 0.5 мM dTTP, 100 пмоль 3'-праймера dm 29, инкубировали при 90°С в течение
2 мин (микротермостат “Модель 206”) и охлаждали до комнатной температуры. К
полученной реакционной смеси добавляли обратную транскриптазу AMV до концентрации 400 е.а./мл и
инкубировали при 37°С в течение 30 мин, затем при 48°С в течение 30 мин
(термостатируемый шейкер, BIOER).
Полученную кДНК использовали в ПЦР.
Полимеразная
цепная реакция и реакция транскрипции in vitro
С использованием полученной кДНК (вариант 1 или 2) проводили ПЦР в буфере
(1000 мкл), содержащем 7.5 мМ MgCl2, 1 мM dGTP, 1 мM dATP, 1 мM dCTP, 1 мM dTTP, 2 мкМ 3'-праймера dm 29, 2 мкМ 5'-праймера dm 28 long, 25 е.а./мл Taq ДНК-полимеразы, 10 мМ Tрис-HCl (pH 8.3), 50 мМ KCl.
Реакционную смесь переносили в 10 ПЦР-пробирок на 0.5 мл по 100 мкл реакционной
смеси в каждую и помещали в амплификатор Mastercycler gradient.
Амплификацию проводили в следующих условиях: 93°С 3 мин, 93°С 30 сек,
63°С 1 мин, 72°С 1 мин, затем повтор еще 20 циклов, охлаждение до 4°С.
Очищенную таким образом дцДНК-библиотеку использовали в качестве матрицы
для реакции транскрипции in vitro (п. 2.3.4). Полученную при этом 2'-F-модифицированную РНК-библиотеку
растворяли в бидистиллированной воде и использовали для следующего раунда SELEX.
.3.7
“Негативный” SELEX
В ПЦР-пробирку на 0.5 мл помещали 100 мкл 0.05 М NaHCO3/Na2CO3 (pH
9.6) и инкубировали при 4°С в течение 16-20 ч. Буфер удаляли, ПЦР-пробирку
промывали 4х100 мкл промывочного буфера. Далее в ПЦР-пробирку добавляли 500 мкл
блокирующего буфера и инкубировали при комнатной температуре 1 ч, после чего
еще раз промывали пробирку 500 мкл промывочного буфера.
'-F-Модифицированную РНК-библиотеку в
100 мкл буфера для связывания инкубировали при 90°С в течение 3 мин
(микротермостат “Модель 206”). Затем охлаждали до комнатной температуры,
переносили в ПЦР-пробирку и инкубировали при комнатной температуре в течение
20-30 мин. Буфер с несвязавшимися олигонуклеотидами удаляли и использовали в
следующем раунде SELEX.
.3.8 Введение
радиоактивной метки по 5'-концу 2'-F-пиримидинсодержащей РНК-библиотеки
Дефосфорилирование. Реакцию дефосфорилирования 2'-F-модифицированной РНК-библиотеки
проводили в буфере (100 мкл), содержащем 0.01 М Tрис-HCl (pH 7.5), 0.01 M MgCl2, 160 пмоль 2'-F-РНК, 120 е.а./мл бактериальной щелочной фосфатазы, при 50°С в
течение 1 ч (термостатируемый шейкер, BIOER). Реакционную смесь последовательно экстрагировали смесью Tрис-HCl (pH
7.0):хлороформ:фенол (1:24:25) (100 мкл) и серным эфиром (100 мкл). Полученную
дефосфорилированную 2'-F-модифицированную
РНК-библиотеку осаждали добавлением 2.5-кратного избытка этанола в присутствии
0.3 М CH3CO2Na (pH 5.2) с последующим выдерживанием при
-20°С в течение 10-12 ч. Осадок 2'-F-РНК отделяли центрифугированием (центрифуга Centrifuge 5415 R, Eppendorf, 13000
об/мин, 4°С, 10мин), промывали 75%-ным этанолом, сушили при 2-4 мм. рт. ст. в
течение 20 мин и растворяли в бидистиллированной воде.
Введение радиоактивной метки. Введение радиоактивной метки по 5'-концу
2'-F-модифицированной РНК-библиотеки
проводили в буфере (20 мкл), содержащем 50 мМ Трис-HCl (pH
7.6), 10 мМ MgCl2, 5 мМ DTT,
0.1 мМ Na2EDTA, 0.1 мМ спермидин гидрохлорид, 0.1 мКи γ-[32P]-АТP, 10% (по объему) диметилсульфоксида, 500 е.а./мл
полинуклеотидкиназы фага Т4, в течение 2 ч при 37°С (термостатируемый шейкер, BIOER). Затем к реакционной смеси
добавляли 5 е.а. полинуклеотидкиназы фага Т4 и инкубировали еще 1 ч при 37°С.
После окончания инкубации к реакционной смеси добавляли равный объем
буфера А. [32P]-Меченую
РНК-библиотеку выделяли гель-электрофорезом в 12%-ном денатурирующем ПААГ.
Визуализацию 5'-[32P]-меченых
олигорибонуклеотидов в геле проводили с помощью радиоавтографии на
рентгеновскую пленку Agfa
(Бельгия). Полосу 2'-F-модифицированной
РНК-библиотеки вырезали из геля, элюировали 0.3 М CH3CO2Na (pH 5.2) и осаждали добавлением этанола как описано выше.
2.3.9
Определение констант диссоциации комплексов 2'-F-модифицированной
РНК-библиотеки с поликлональными аутоантителами [54, 161]
Определение области концентраций аутоантител для измерения Kd
Для определения области концентраций аутоантител, в которой происходит
диссоцияция их комплексов с исходной 2'-F-модифицированной РНК-библиотекой, готовили 12 проб
аутоантител (20 мкл каждая) в буфере для связывания состава 50 мМ Tрис-HCl (pH
7.5), 200 мМ KCl. Концентрации антител варьировали от
3 мкМ до 17 пМ путем трехкратного разбавления каждой последующей пробы. [32P]-Меченую 2'-F-пиримидинсодержащую РНК-библиотеку растворяли в буфере для
связывания до концентрации 13 нМ, инкубировали при 90°С в течение 2 мин
(микротермостат “Модель 206”) и охлаждали до комнатной температуры. Затем к
каждой пробе аутоантител добавляли 80 мкл раствора 2'-F-модифицированной РНК-библиотеки в буфере для связывания и
инкубировали при комнатной температуре в течение 14 ч. В качестве контроля
использовали пробу, содержащую 1 пмоль [32P]-меченой 2'-F-модифицированной
РНК-библиотеки в 100 мкл буфера для связывания.
Нитроцеллюлозные фильтры для радиоавтографии диаметром 2.5 см вырезали из
нитроцеллюлозных фильтров MF-MilliporeTM диаметром 9 см. Фильтры для нанесения
проб выдерживали в буфере для связывания в течение 12-14 ч при 4°С. Фильтры,
использующиеся для контроля, оставляли сухими. Перед нанесением пробы фильтры
промывали 3 мл буфера для связывания. Пробы (95 мкл) наносили на фильтр,
промывали 5 мл буфера для связывания и высушивали при комнатной температуре в
течение 10 мин. Контроль (95 мкл) наносили на сухой фильтр и высушивали при
комнатной температуре в течение 10 мин. Высушенные фильтры сканировали при
помощи фосфоримиджера Molecular Imager FX (BioRad, США). Для получения количественных характеристик
радиоавтографы нитроцеллюлозных фильтров переводили в цифровую форму в
программном пакете Quantity
one (BioRad, США). Долю комплексов олигонуклеотидов с белками
определяли как отношение интенсивности пятна комплексов к интенсивности пятна
свободных олигонуклеотидов. Полученные данные описывали приведенным ниже
уравнением, используя программу SigmaPlot 8.0:
f = С·(Kd + [140] + [P] - ((Kd + [140] + [P])2 - 4·[140]·[P])0.5)/(2·[140]),
где
[P] - концентрация белка; [140] - концентрация 2'-F-модифицированной
РНК-библиотеки; f - доля связавшихся олигонуклеотидов; Kd - константа диссоциации комплексов 2'-F-РНК с
антителами; С - константа эффективности связывания комплексов аутоантител и
олигонуклеотидов с нитроцеллюлозными фильтрами.
Используя
полученные данные, находили константу С. Отношение f/С давало fнорм
- нормированное значение доли
комплексов олигонуклеотидов с аутоантителами. Нормированные данные описывали
тем же уравнением, принимая С равной 1, и находили Kd.
Определение
Kd комплексов аутоантител с 2'-F-модифицированными
РНК-библиотеками
Определение
Kd проводили аналогичным образом. Пробы аутоантител
готовили с учетом полученных значений доли комплексов аутоантител и 2'-F-модифицированной
РНК-библиотеки в зависимости от концентрации аутоантител. Концентрации антител
для определения Kd комплексов аутоантител с исходной 2'-F-модифицированной
РНК-библиотекой были равны: 12000 нМ, 6000 нМ, 3000 нМ, 1000 нМ, 330 нМ, 110
нМ, 37 нМ, 4.1 нМ. Концентрации антител для определения Kd комплексов аутоантител с 2'-F-модифицированной
РНК-библиотекой после 6-го раунда отбора были равны: 1800 нМ, 600 нМ, 200 нМ,
66 нМ, 22 нМ, 7.4 нМ, 2.4 нМ, 0.8 нМ, 0.3 нМ. Концентрации антител для
определения Kd комплексов аутоантител с 2'-F-модифицированной
РНК-библиотекой после 10-го раунда отбора были равны: 600 нМ, 200 нМ, 66 нМ, 22
нМ, 7.4 нМ, 2.4 нМ, 0.8 нМ, 0.3 нМ. [32P]-Меченую 2'-F-пиримидинсодержащую
РНК-библиотеку растворяли в буфере для связывания из расчета (n+1)
пмоль РНК, где n - количество проб аутоантител. Комплексообразование,
мобилизацию на нитроцеллюлозных фильтрах и расчет Kd проводили
как указано выше.
2.3.10
Хроматографическое разделение 2'-F-модифицированной
РНК-библиотеки после 10-го раунда SELEX по сродству к поликлональным аутоантителам
Хроматографию проводили на хроматографе BioCAD Sprint (Perseptive Biosystems, США), измерение оптической
плотности вели при 260 нм. Колонку (9x30 мм) с иммобилизованным на BrCN-активированной сефарозе пулом поликлональных аутоантител предварительно
промывали 20 мМ Tрис-HCl (pH 7.5) со скоростью потока элюента, равной 0,2 мл/мин. На
колонку наносили 3.55 о.е. 2'-F-модифицированной
РНК-библиотеки после 10-го раунда SELEX (60 мкл) и промывали 20 мМ Tрис-HCl (pH 7.5) (фр. 1) для удаления несвязавшихся молекул 2'-F-РНК.
Окончание стадии промывки контролировали по изменению оптической плотности.
Далее проводили ступенчатую элюцию 2'-F-РНК растворами следующего состава, контролируя оптическую плотность
фракций: 0.1 М NaCl в 20 мМ Tрис-HCl, pH 7.5
(фр. 2); 0.3 М NaCl в 20 мМ Tрис-HCl, pH 7.5
(фр. 3); 0.5 М NaCl в 20 мМ Tрис-HCl, pH 7.5
(фр. 4); 1 М NaCl в 20 мМ Tрис-HCl, pH 7.5 (фр. 5); 2 М NaCl в 20 мМ Tрис-HCl, pH 7.5 (фр. 6); 3 М NaCl в 20 мМ Tрис-HCl, pH 7.5 (фр. 7); 1 М MgCl2 в 20 мМ Tрис-HCl, pH 7.5 (фр. 8); 2 М MgCl2 в 20 мМ Tрис-HCl, pH 7.5 (фр. 9); 3 М MgCl2 в 20 мМ Tрис-HCl, pH 7.5 (фр. 10) и 0.1 М глицином, pH 2.6 (фр. 11) (рис. 18). К фракции 11
2'-F-модифицированной РНК-библиотеки в 0.1 М глицине добавляли 1 М Tрис-HCl (pH
8.0) до pH ~7.5. Полученные фракции 2'-F-РНК
обессоливали и концентрировали на колонках Microcon YM-30 (Millipore, Ирландия), проводя следующие операции:
1. колонку Microcon YM-30 помещали в
пробирку на 1.5 мл;
2. 500 мкл олигонуклеотидной фракции наносили на колонку;
. центрифугировали пробу 8 мин при 14400 об./мин, 20°С (центрифуга
MiniSpin);
. переворачивали колонку и помещали ее в новую пробирку на 1.5 мл;
. центрифугировали пробу 3 мин при 3800 об./мин, 20°С;
. для повторной элюции олигонуклеотидного материала на колонку
наносили 10 мкл бидистиллированной воды, колонку переворачивали и помещали в
пробирку с 2'-F-РНК библиотекой (п. 5);
. центрифугировали 3 мин при 3800 об./мин, 20°С;
. каждую фракцию 2'-F-модифицированной РНК-библиотеки (п. 5,7) собирали
в одну пробирку на 1.5 мл.
Обессоленную фракцию 2 2'-F-модифицированной РНК-библиотеки разделили на
две части: фракцию I (основная часть
фракции 2) и фракцию II
(“конечная” часть фракции 2). Обессоленную фракцию 11 обозначили как фракцию III. Фракцию I осадили добавлением 2.5-кратного избытка (по объему) этанола
как описано в пункте 2.3.4. Осадок растворили в бидистиллированной воде и
хранили при - 20°С. Фракции II и III 2'-F-пиримидинсодержащей
РНК-библиотеки после обессоливания амплифицировали как описано в пункте 2.3.5.
с целью наработки необходимых количеств фракций 2'-F-РНК.
.3.11
Получение плазмидной ДНК на основе вектора pUC18 и дцДНК-библиотеки фракций I, II и III
Проверка
рестриктазной активности эндонуклеаз рестрикции BamHI и HindIII
Проверку рестриктазной аутивности вели на примере вектора pUC18. Реакции гидролиза проводили
отдельно для каждой рестриктазы в однократном буфере FastDigest (Fermentas) (10 мкл), содержащем 0.1 пкмоль pUC18, 200 е.а./мл рестриктазы BamHI или 200 е.а./мл рестриктазы HindIII при 37°С в течение 5 мин, а затем
при 80°С в течение 10 мин (термостатируемый шейкер, BIOER). Полученные реакционные смеси анализировали
электрофорезом в 1%-ном агарозном геле (п. 2.2.).
Получение
дцДНК-библиотеки фракций I, II и III методом ОТ-ПЦР “высокой точности” (high-fidelity)
Обратную транскрипцию фракций I, II и III (п. 2.3.10.) 2'-F-модифицированной РНК-библиотеки
проводили, как описано в п. 2.3.5, используя в качестве матрицы 20 пкмоль
2'-F-РНК. Реакционная смесь ПЦР высокой точности (1000 мкл) содержала 1 мМ MgCl2, 50 мкM dGTP, 50 мкM dATP, 50 мкM dCTP, 50 мкM dTTP, 2 мкМ 5'-праймера HindIII, 2 мкМ 5'-праймера BamHI, 25 е.а./мл Taq ДНК-полимеразы, 50 мкл реакционной смеси ОТ, 10 мМ Tрис-HCl (pH
8.3), 50 мМ KCl. Реакционную смесь переносили в 10
ПЦР-пробирок на 0.5 мл по 100 мкл реакционной смеси в каждую и помещали в
амплификатор Mastercycler gradient.
Амплификацию проводили в следующих условиях: 93°С 3 мин, 93°С 30 сек,
63°С 1 мин, 72°С 1 мин, затем повтор еще 20 циклов, охлаждение до 4°С.
ПЦР-продукт очищали с помощью набора “DNA clean & concentrator-25” как описано в п. 2.3.5.
Эндонуклеазное
расщепление вектора pUC18 и
дцДНК-библиотеки фракций I, II и III рестриктазами BamHI и HindIII
Полученную дцДНК-библиотеку каждой фракции подвергали эндонуклеазному
расщеплению рестриктазами BamHI
и HindIII. Реакцию гидролиза проводили в
однократном буфере FastDigest (Fermentas) (50 мкл), содержащем 55 пкмоль
дцДНК-библиотеки, 40 е.а./мл рестриктазы BamHI и 40 е.а./мл рестриктазы HindIII, в течение 2 ч 30 мин при 37°С (термостатируемый
шейкер, BIOER). Полученную дцДНК-библиотеку с
“липкими” концами очищали с помощью набора “DNA clean & concentrator-5” как описано в п. 2.3.5.
Вектор pUC18 также подвергали эндонуклеазному
расщеплению. Реакцию гидролиза проводили в однократном буфере FastDigest (Fermentas) (20 мкл), содержащем 1.5 пкмоль pUC18, 50 е.а./мл рестриктазы BamHI и 50 е.а./мл рестриктазы HindIII при 37°С в течение 10 мин, а затем
при 80°С в течение 10 мин (термостатируемый шейкер, BIOER). К реакционной смеси добавляли 150 ед. акт.
бактериальной щелочной фосфатазы и инкубировали при 60°С в течение 1 ч.
Полученный линеаризованный вектор очищали электрофорезом в 1%-ном агарозном
геле (п. 2.2.). Участок геля, содержащий линеаризованный вектор, вырезали,
измельчали скальпелем и проводили выделение вектора из геля на колонках GenEluteTM Minus EtBr Spin Columns (Sigma-Aldrich, США):
1) колонку GenEluteTM
Minus EtBr Spin Column помещали в пробирку на 1.5 мл;
2) на колонку наносили 100 мкл бидистиллированной воды и
центрифугировали 5 сек при 3500 об./мин, 20°С (центрифуга MiniSpin);
) помещали колонку в новую пробирку на 1.5 мл;
) переносили гель с вектором на колонку, центрифугировали 10 мин
при 14500 об./мин, 20°С.
Полученный при этом линеаризованный вектор осаждали добавлением
2.5-кратного избытка (по объему) этанола как описано в пункте 2.3.4. Осадок
растворяли в бидистиллированной воде и хранили при - 20°С.
Получение
плазмидной ДНК
Реакцию лигирования проводили в однократном буфере Tango (Fermentas) (20 мкл), содержащем 4 пкмоль
дцДНК-библиотеки с “липкими” концами, 0.2 пкмоль вектора pUC18, 0.5 мМ DTT, 1мМ ATP,
33 мМ Tрис-ацетат (pH 7.9), 10 мМ (CH3CO2)2Mg, 66 мМ CH3CO2K, 0.1
мг/мл BSA, 50 е.а./мл T4 ДНК-лигазы при 14°С в течение 14-16 ч (термостатируемый
шейкер, BIOER). Затем реакционную смесь в течение
5 мин инкубировали при 65°С и охлаждали до комнатной температуры. К реакционной
смеси добавляли 20 ед. акт. эндонуклеазы рестрикции PstI и инкубировали при 37°С в течение 30 мин. Полученную
реакционную смесь хранили при -20°С.
.3.12
Приготовление компетентных клеток
Компетентные клетки E.coli штамма DH5α готовили с использованием набора “ Z-Competent E.coli Transformation Kit ” (Zymo Research, США).
Среду LB готовили из расчета 10 г триптона, 5
г дрожжевого экстракта, 10 г NaCl
на 1 л воды и стерилизовали автоклавированием. В полученную среду LB (2 мл) вносили суспензию клеток E.coli и инкубировали 12-16 ч при 37°С и 250 об./мин в
термостатируемом шейкере Environmental Shaker - Incubator ES-20 (BIOSAN,
Латвия). Полученную суспензию клеток (0.5 мл) вносили в 50 мл среды ZymoBrothTM (Zymo Research) и инкубировали при 250 об./мин и
30°С на термостатируемом шейкере до достижения клеточной суспензией оптической
плотности D550 = 0.4-0.6 о.е./мл (Spectronic Genesys 5 Spectrophotometer, Milton Roy, США).
Полученную культуру переносили в пробирку для центрифугирования,
охлаждали во льду 20 мин и осаждали центрифугированием (центрифуга Centricon T-42K (Kontron Instruments, США) ротор A-16C,
3000 об./мин, 10 мин, 2°С). Супернатант сливали, края пробирки вытирали насухо.
Клетки суспензировали в 5 мл предварительно охлажденного до 0°С однократного
промывочного буфера (Zymo Research),
инкубировали во льду 20 мин и осаждали центрифугированием (центрифуга Centricon T-42K, Kontron Instruments, США, ротор A-16C,
3000 об./мин, 10 мин, 2°С). Супернатант сливали, края пробирки вытирали насухо.
Клетки ресуспензировали в 5 мл предварительно охлажденного до 0°С однократного
буфера Competent (Zymo Research). Клеточную суспензию расфасовывали
по 200 мкл в стерильные предварительно охлажденные до 0°С пробирки на 1.5 мл и
хранили при -70°С.
.3.13
Трансформация компетентных клеток плазмидной ДНК
Трансформацию компетентных клеток проводили согласно протоколу “Fast Transformation of Z-competentTM Cells” (Zymo Research). Перед трансформацией компетентные
клетки размораживали при 0°С. К 200 мкл суспензии компетентных клеток E.coli добавляли лигазную смесь (см. выше) (5 мкл) и
аккуратно перемешивали. Полученную суспензию клеток (50 мкл) высевали на
предварительно нагретую до 37°С чашку Петри с селективной средой LB, покрытой 10%-ным X-Gal в DMFабс. (40
мкл) и содержащей 1.5% агара, 100 мкг/мл ампициллина и 0.8 мМ IPTG, и инкубировали при 37°С в течение
16-18 ч. Индивидуальные колонии трансформированных клеток E.coli переносили на чашки Петри с селективной средой LB (по 4 колонии на чашку) и
инкубировали при 37°С в течение 16-18 ч.
2.3.14
Определение наличия дцДНК-библиотеки в плазмидной ДНК трансформированных клеток
[162]
Наличие дцДНК-библиотеки в плазмидной ДНК трансформированных клеток E.coli проверяли с помощью ПЦР. Для этого часть каждой
трансформированной колонии E.coli переносили в 5 мкл воды и
суспензировали. Для каждой колонии проводили ПЦР в буфере (100 мкл), содержащем
7.5 мМ MgCl2, 1 мM dGTP, 1 мM dATP, 1 мM dCTP, 1 мM dTTP, 2 мкМ 5'-праймера seq 1, 2 мкМ 3'-праймера seq 2, 25 е.а./мл Taq ДНК-полимеразы, 10 мМ Tрис-HCl (pH 8.3), 50 мМ KCl, 5 мкл клеточной суспензии. ПЦР-пробирки с
реакционными смесями помещали в амплификатор Mastercycler gradient.
Амплификацию проводили в следующих условиях: 94°С 1 мин, 94°С 15 сек,
55°С 1 мин, 72°С 2 мин, затем повтор еще 30 циклов, 72°С 2 мин, охлаждение до
4°С.
Полученные реакционные смеси анализировали гель-электрофорезом в 12%-ном
денатурирующем ПААГ с последующим окрашиванием геля раствором красителя “Stains-All”.
.3.15
Выделение плазмидной ДНК
Выделение плазмидной ДНК осуществляли с использованием набора QIAprep Spin Miniprep Kit (QIAGEN,
США). Селективную среду LB (3
мл), содержащую 100 мкг/мл ампициллина, инокулировали трансформированными
клетками E.coli и инкубировали 12-16 ч при 37°С и 250 об./мин в
термостатируемом шейкере Environmental Shaker - Incubator ES-20 (BIOSAN,
Латвия). Клетки осаждали центрифугированием (центрифуга MiniSpin, 3 мин, 8500 об./мин, 20°С).
Супернатант удаляли, клетки суспензировали в 250 мкл буфера P1 (QIAGEN). К полученной суспензии добавляли 250 мкл буфера P2 (QIAGEN), пробирку переворачивали несколько раз, пока
суспензия не приобрела однородный синий цвет. К полученной суспензии добавляли
350 мкл буфера N3 (QIAGEN), пробирку переворачивали несколько
раз до образования однородной белой взвеси в прозрачном растворе. Взвесь
осаждали центрифугированием (центрифуга MiniSpin, 10 мин, 13000 об./мин, 20°С) и отбирали
супернантант, содержащий плазмидную ДНК. Плазмидную ДНК очищали на колонках QIAprep Spin Column (QIAGEN):
) колонку помещали в пробирку на 2 мл, наносили супернантант и
центрифугировали в течение 45 сек при 13000 об./мин, 20°С (центрифуга MiniSpin);
) промывали колонку 750 мкл буфера PE (QIAGEN),
центрифугировали в течение 45 сек при 13000 об./мин, 20°С (центрифуга MiniSpin);
) очистив пробирку-премник, дополнительно центрифугировали колонку
в течение 1 мин при 13000 об./мин, 20°С (центрифуга MiniSpin);
) переносили колонку в новую пробирку на 1.5 мл, наносили на
колонку 50 мкл 10 мМ Tрис-HCl (pH 8.5), выдерживали при комнатной температуре в течение 1 мин,
центрифугировали 1 мин при 13000 об./мин, 20°С (центрифуга MiniSpin).
.3.16
Определение наличия дцДНК-библиотеки в полученных плазмидных ДНК
Наличие дцДНК-библиотеки в полученных плазмидных ДНК определяли с помощью
ПЦР, как описано в п. 2.3.14. В качестве матрицы использовали 0.2 пкмоль
выделенной плазмидной ДНК. Полученные реакционные смеси анализировали
гель-электрофорезом в 12%-ном денатурирующем ПААГ с последующим окрашиванием
геля раствором красителя “Stains-All”.
.3.17
Определение нуклеотидной последовательности плазмидных ДНК
Определение нуклеотидной последовательности полученных плазмид проводили
по методу Сенгера с использованием набора Big Dye Terminators v.3.1 Cycle Sequencing Kit (Applied Biosystems, США). Реакционная смесь (25 мкл)
содержала однократный буфер для секвенирования (Applied Biosystems), 1.5 мкл флуоресцентно меченых
дидезоксинуклеозидтрифосфатов Big Dye (Applied Biosystems), 250 фмоль плазмидной ДНК и 5
мкмоль праймера M13 reverse. ПЦР-пробирки с реакционными смесями
помещали в амплификатор Mastercycler gradient.
Амплификацию проводили в следующих условиях: 97°С 1 мин, 97°С 10 сек,
50°С 5 сек, 60°С 4 мин, затем повтор еще 30 циклов, 94°С 3 мин, охлаждение до
4°С.
Полученные реакционные смеси очищали различными способами:
Вариант 1. (с использованием набора IllustraTM AutoSeq G-50 Dye Terminator Removal Kit (GE Healthcare, Великобритания)):
) сорбент колонки суспензировали перемешиванием на вортексе REAX control (Heidolph, Германия);
) крышку колонки открывали на четверть оборота, отламывали
наконечник колонки, помещали ее в пробирку на 1.5 мл и центрифугировали в
течение 1 мин при 4600 об./мин, 20°С (центрифуга Centrifuge 5415 R (Eppendorf));
) переносили колонку в новую пробирку 1.5 мл;
) на колонку наносили реакционную смесь (25 мкл) и
центрифугировали в течение 1 мин при 4600 об./мин, 20°С (центрифуга Centrifuge 5415 R (Eppendorf)).
Полученную пробу упаривали досуха на вакуумном испарителе Concentrator 5301 (Eppendorf) в течение 20 мин при 45°С и
отдавали в ЦКП “Секвенирование ДНК” СО РАН.
Вариант 2. (осаждение с использованием изопропанола):
) к реакционным смесям добавляли равный объем бидистиллированной
воды, перемешивали и переносили в пробирки на 1.5 мл;
) в каждую пробирку добавляли 75 мкл 100%-ного изопропанола (осч),
перемешивали и оставляли при комнатной температуре на 25 мин;
) центрифугировали пробы в течение 25 мин при 13200 об/мин, 18°С
(центрифуга Centrifuge 5415 R (Eppendorf));
) отбирали супернантант, промывали осадок 250 мкл 75%-ного
этанола, центрифугировали пробы в течение 10 мин при 13200 об/мин, 18°С
(центрифуга Centrifuge 5415 R (Eppendorf));
) повторяли промывку 75%-ным этанолом, сушили пробы в течение 20
мин при 2-4 мм. рт. ст.
Полученные пробы были анализированы на секвенаторе ABI Prism 3130xl (Applied
Biosystems, Великобритания). Данные были
обработаны в программном пакете Sequence Scanner (Applied Biosystems).
2.3.18
Поиск гомологичных участков РНК-клонов фракций I, II и III [90]
Поиск гомологичных участков РНК-клонов фракций I, II и III был проведен с помощью программного
пакета MEME version 4.3.0.
2.3.19
Компьютерное моделирование вторичной структуры РНК-клонов фракций I, II и III [92]
Компьютерное моделирование вторичной структуры полученных РНК-клонов было
проведено на основе алгоритма минимизации свободной энергии с помощью
программного пакета mfold version 2.3.
Вычисления проводили для 22°С.
3. Получение
аптамеров к поликлональным аутоантителам, вырабатываемым организмом человека
при рассеянном склерозе (результаты и обсуждение)
Рассеянный
склероз (РС) - хроническое нейродегенеративное заболевание аутоиммунной
природы, представляющее собой острую медико-социальную проблему. При рассеянном
склерозе поражаются головной мозг, зрительные нервы, спинной мозг, что приводит
к нарушению соответствующих функций организма. Данное заболевание
характеризуется образованием хаотически рассеянных очагов демиелинизации, т.е.
утраты миелина - белково-липидной мембраны, покрывающей нервное волокно. Около
30% всех белков миелина составляют три изоформы так называемого основного белка
миедина (ОБМ), который является одним из основных аутоантигенов при РС. Ранее было
показано, что в деградации ОБМ могут принимать участие каталитические антитела
[28, 29, 163-167].
Целью
данной работы являлось получение РНК-аптамеров, устойчивых в биологических
средах, способных селективно и с высокой аффинностью связывать аутоантитела
человека, больного рассеянным склерозом.
НК-Аптамеры
- это одноцепочечные молекулы ДНК или РНК, способные селективно связывать свои
молекулы-мишени. Аптамеры часто называют синтетическими антителами, но они
превосходят их по многим параметрам: конформация аптамеров может изменяться при
взаимодействии с молекулой-мишенью, что повышает их сродство к мишени; в
отличие от антител аптамеры могут быть получены к любым молекулам-мишеням; по
сравнению с антителами, аптамеры химически более стабильны, неиммуногенны и
могут быть синтетически получены синтетически в чистом виде в препаративных
количествах.
Как
уже говорилось в обзоре литературы (п. 1.4.), РНК-аптамеры по сравнению с
ДНК-аптамерами способны образовывать большее количество разнообразных вторичных
структур. В свою очередь ДНК-аптамеры более стабильны в биологических средах.
Деградация ДНК нуклеазами в сыворотке крови занимает минуты, РНК - секунды [66].
Для повышения стабильности РНК-аптамеров в биологических средах могут быть
использованы различные модификации межнуклеозидной фосфатной группы и остатков
рибозы [8, 66] (п. 1.5.). Как следует из обзора литературы, одной из наиболее
часто применяемых при создании комбинаторных РНК-библиотек модификаций является
замена пиримидиновых нуклеотидов их 2'-F-модифицированными
аналогами. Такая модификация позволяет повысить устойчивость олигонуклеотидов к
деградации нуклеазами, не изменяя их специфичности [77]. Поэтому в качестве
исходной комбинаторной библиотеки для создания устойчивого в биологических
средах РНК-аптамера, способного высокоспецифично связывать аутоантитела
человека при РС, была выбрана 2'-F-пиримидинсодержащая РНК-библиотека.
В
рамках данной дипломной работы предстояло решить следующие задачи:
- провести химико-ферментативный синтез 2'-F-модифицированной РНК-библиотеки;
создать и апробировать методику отбора аптамеров к поликлональным
аутоантителам человека, больного рассеянным склерозом;
исследовать эффективность связывания обогащенной 2'-F-модифицированной РНК-библиотеки с
поликлональными аутоантителами;
изучить влияние обогащенной 2'-F-модифицированной РНК-библиотеки на протеолитическую активность
аутоантител;
провести пробное клонирование и секвенирование полученной обогащенной 2'-F-модифицированной РНК-библиотеки;
провести анализ первичной последовательности полученных РНК-клонов и
компьютерное моделирование их вторичной структуры.
3.1
Химико-ферментативный синтез 2'-F-модифицированной РНК-библиотеки
Как было ранее сказано в обзоре литературы, комбинаторную 2'-F-модифицированную РНК-библиотеку
получают химико-ферментативным путем, состоящим из 3-х этапов:
) химический синтез комбинаторной оцДНК-библиотеки;
) репликация оцДНК-библиотеки с использованием фрагмента Кленова
ДНК-полимеразы E.coli и 5'-праймера для амплификации,
содержащего последовательность промотора Т7 РНК-полимеразы;
) транскрипция in vitro дцДНК-библиотеки с использованием
2'-F-UTP и 2'-F-CTP.
В
данной работе в качестве исходной олигонуклеотидной библиотеки была выбрана, по
аналогии с литературными данными [168], оцДНК-библиотека с рандомизированным
районом длиной 40 нт и константными 5'- и 3'-участками длиной 16 нт и 15 нт,
соответственно (рис. 8). В качестве праймеров для амплификации комбинаторной
библиотеки были выбраны 3'-праймер dm 29 (16 нт), комплементарный
5'-фиксированному району оцДНК-библиотеки, и 5'-праймер dm 28
(32 нт), комплементарный 3'-фиксированному району оцДНК-библиотеки и содержащий
промоторную последовательность для Т7 РНК-полимеразы (помечена желтым цветом).
Протяженные природные дцДНК-матрицы транскрибируются РНК-полимеразами более
эффективно, нежели короткие синтетические дцДНК. Считается, что это связано с
наличием предпромоторного участка, облегчающего образование комплекса фермента
с матрицей. Для того, чтобы узнать, как влияет удлинение 5'-участка дцДНК-библиотеки
на количество получаемого транскрипта, был использован удлиненный 5'-праймер dm 28
long (37 нт), дополнительно содержащий 5 нуклеотидов перед
промоторной последовательностью (рис. 8).
5'-праймер dm 28
'-TAATACGACTCACTATAGGG AGG ACG ATG CGG-3' оцДНК-библиотека
'-CCC TCC TGC TAC GCC<40N>GTC TGC TG AGC GCG CT-5'
5'-TCG CGC GA GTCGTCTG-3'
'-праймер dm 29
'-праймер dm 28 long
'-GAAATTAATACGACTCACTATAG
GGA GGA CGA TGC GG - 3' оцДНК-библиотека
'- C CCT CCT GCT ACG CC <40N>G TCT GCT GAG CGC GCT - 5'
'-TC GCG CGA GTCGTCTG-3'
3'-праймер dm 29
Рис. 8. Система комбинаторной оцДНК-библиотеки с 5'- и 3'-праймерами.
На первом этапе работы была синтезирована комбинаторная оцДНК-библиотека.
Для этого был использован автоматический твердофазный фосфитамидный метод (рис.
9). Синтез вели на автоматическом синтезаторе ДНК/РНК ASM-800 (“Биоссет”, Россия) в масштабе 0.4 мкмоль
согласно протоколу, представленному в табл. 3 (п. 2.3.1.). Цикл присоединения
одного нуклеотидного звена занимал вместе с промывками 7-10 мин.
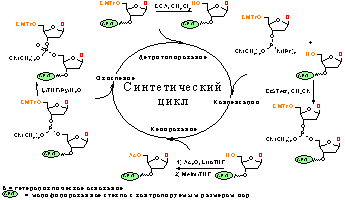
Рис.
9. Схема синтетического цикла фосфитамидного синтеза
олигодезоксирибонуклеотидов.
В
качестве полимерного носителя использовали модифицированное стекло с
контролируемым размером пор CPG-500 c присоединенным 5'-O-диметокситритил-N4-ацетилдезоксирибоцитидином (емкость по первому
присоединенному звену составляла 30-35 мкмоль/г). В качестве мономерных
синтонов были использованы коммерчески доступные 5',N-защищенные
дезоксирибонуклеозид-3'-фосфитамиды с лабильными защитными группами по
гетероциклическим основаниям: ацетильной для цитидина, бензоильной для
аденозина и изобутирильной для гуанозина.
Как
видно из рис. 9, синтетический цикл состоит из стадий детритилирования,
конденсации, кэпирования и окисления.
Стадия
детритилирования необходима для удаления диметокситритильной защитной группы с
5'-гидроксила растущей олигонуклеотидной цепи. Для этих целей была использована
обработка 3%-ным раствором дихлоруксусной кислоты в дихлорметане в течение двух
минут.
Наиболее
важной стадией синтетического цикла является стадия конденсации. В качестве
активирующего реагента обычно используют тетразол или его производные.
Показано, что использование 5-этилтио-1H-тетразола
вместо тетразола позволяет сократить время конденсации в несколько раз [169].
Концентрация для дезоксирибофосфитамидов в случае синтеза константных участков
составляла 0.05 М, а в случае синтеза рандомизированного района готовили
“общий” раствор четырех дезоксирибофосфитамидов в абс. CH3CN с
концентрациями 0.058 М dА-CE, 0.058 М dC-CE, 0.070 М dG-CE и 0.056 М dТ-CE.
При
синтезе целевого олигонуклеотида образуются побочные продукты - олигомеры с
длиной n-1, n-2 и т.д., что происходит из-за наличия
непрореагировавших 5’-гидроксильных групп, которые необходимо блокировать
(“кэпировать”) после каждой стадии конденсации. Для “кэпирования” нами были
использованы последовательно 16%
N-MeIm в THF и Ac2O:2,6-лутидин:THF
(1:1:8), что обеспечивает “кэпирование” с эффективностью 95-98% [170].
Заключительной стадией синтетического цикла является стадия окисления, в
ходе которой происходит превращение фосфиттриэфирных межнуклеозидных связей в
фосфотриэфирные. В случае неполного окисления межнуклеозидный фосфиттриэфир
подвергается расщеплению в кислотных условиях при удалении диметокситритильной
группы, что приводит к падению выхода целевого олигомера. Для окисления был
использован 0.02 М I2 в смеси THF/Py/H2O (90:1:9). После проведения необходимого числа
синтетических циклов и удаления 5’-концевой диметокситритильной группы получали
защищенную полимерсвязанную оцДНК-библиотеку. Защищенные полимерсвязанные
3'-праймер dm 29, 5'-праймер dm 28, 5'-праймер dm 28 long и оцДНК-библиотеку деблокировали (п. 2.3.2.) с
последующим выделением препаративным гель-электрофорезом (п. 2.3.3.).
Гомогенность полученных олигодезоксирибонуклеотидов подтверждали
электрофоретически (рис. 10).
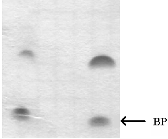
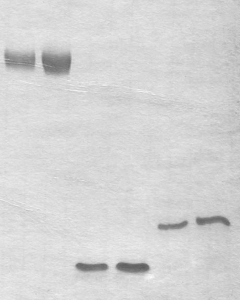
А) ДНК 5'-праймер Б) 3'-праймер
(1) (2) dm 28 dm 28 long (1) (2)
(1) (2) (1) (2)
Рис. 10. Электрофоретический анализ гомогенности: А) оцДНК-библиотеки
(ДНК), короткого и удлиненного 5'-праймеров в 15%-ном ПААГ в денатурирующих
условиях ((1) - 0.02 о.е., (2) - 0.04 о.е.); Б) 3'-праймера в 12%-ном ПААГ в
денатурирующих условиях ((1) - 0.01 о.е., (2) - 0.04 о.е.). Визуализация полос
олигонуклеотидов окрашиванием геля “Stains-All”.
На следующем этапе работы на основе оцДНК-библиотеки с помощью фрагмента
Кленова ДНК-полимеразы E.coli, 5'-праймеров dm 28 и dm 28 long,
было получено 24 мкг короткой дцДНК-библиотеки (дцДНК 1) и 20 мкг удлиненной
дцДНК-библиотеки (дцДНК 2).
Для того чтобы проверить, могут ли полученные дцДНК-библиотеки быть
субстратом для Т7 РНК-полимеразы, были проведены реакции транскрипции in vitro отдельно для каждой библиотеки с использованием
набора для транскрипции “TranscriptAid T7 high yield transcription kit” (Fermentas) (п. 2.3.4.). Использование данного набора позволяет эффективно
проводить транскрипцию с коротких дцДНК-матриц. После выделения было получено
0,93 нмоль и 1 нмоль РНК-библиотеки с дцДНК 1 и 2, соответственно (рис. 11).
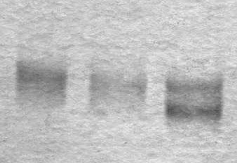
РНК 1 РНК 2 РНКконтроль
Рис. 11. Электрофоретический анализ РНК-транскриптов (РНК 1 и РНК 2)
после реакции транскрипции in vitro с дцДНК 1 и 2, соответственно, с помощью
“TranscriptAid T7 high yield transcription kit” в 12%-ном ПААГ в денатурирующих
условиях. В качестве контроля использовали 71-звенную комбинаторную
РНК-библиотеку со случайным районом 40 нт (РНКконтроль), любезно
предоставленную А.С. Приваловой.
Таким образом, было показано, что выбранная система оцДНК-библиотеки и
праймеров способна реплицироваться посредством фрагмента Кленова; полученные
дцДНК-библиотеки являются субстратом для Т7 РНК-полимеразы; длина 5'-участка
дцДНК-библиотеки не влияет на количество получаемого транскрипта.
На
третьем этапе работы для получения 2'-F-модифицированного транскрипта с
использованием Т7 РНК-полимеразы был выбран протокол [54], разработанный для
проведения реакции транскрипции in vitro с использованием 2'-F-модифицированных
пиримидинтрифосфатов. В качестве матрицы в реакции транскрипции in vitro была использована дцДНК 2. После выделения была
получена 2'-F-модифицированная РНК-библиотека (рис. 12) в
количестве 1 нмоль, что соответствует приведенным в протоколе данным. Поэтому
далее для получения 2'-F-модифицированного транскрипта мы придерживались
протокола [54].
оцДНК
дцДНК 2 2'-F-РНК
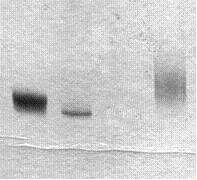
Рис.
12. Электрофоретический анализ РНК-транскрипта (2'-F-РНК) после
реакции транскрипции in vitro с
использованием дцДНК 2, 2'-F-UTP и 2'-F-CTP по протоколу [54]. В качестве контроля использованы
оцДНК-библиотека (оцДНК) и дцДНК 2. Электрофорез проведен в 12%-ном ПААГ в
денатурирующих условиях.
Таким образом, нами были получены в препаративных количествах праймеры
для амплификации комбинаторной библиотеки dm 29, dm 28
и dm 28 long, а также проведен химико-ферментативный синтез 2'-F-модифицированной РНК-библиотеки, что
позволило нам перейти к созданию методики отбора 2'-F-модифицированных РНК-аптамеров.
3.2.
Оптимизирование и апробация методики отбора аптамеров к поликлональным
аутоантителам
Один раунд отбора аптамеров состоит из нескольких стадий (п.1.1.) (рис.
2): образование комплекса мишени и комбинаторной библиотеки; отделение
комплексов от несвязавшихся молекул; разрушение комплексов мишени и комбинаторной
библиотеки; амплификация связавшихся с мишенью молекул комбинаторной
библиотеки. Поэтому для оптимизирования методики отбора 2'-F-модифицированных РНК-аптамеров
необходимо было решить следующие задачи:
1) апробировать все реакции стадии амплификации 2'-F-модифицированной РНК-библиотеки;
2) выбрать и апробировать метод разделения комплексов
молекул-мишеней с 2'-F-модифицированной
РНК-библиотекой и несвязавшихся молекул.
Стадия амплификации 2'-F-модифицированной
РНК-библиотеки включает несколько реакций: обратную транскрипцию, ПЦР,
транскрипцию in vitro.
Для
решения первой задачи была проведена реакция обратной транскрипции 2'-F-модифицированной
РНК-библиотеки в соответствии с протоколом [54] с использованием обратной
транскриптазы AMV. Полученную кДНК далее использовали в ПЦР. Одним из
варьируемых параметров ПЦР является температура отжига праймеров с кДНК. Обычно
температура отжига праймеров на 4-5 градусов ниже их температуры плавления с
кДНК [171]. Чем ниже температура отжига праймеров, тем больше вероятность
образования неспецифичного продукта. При помощи программы OligoAnalyzer 3.1 [172] нами были рассчитаны температуры плавления праймеров с кДНК.
Они составляют 72.7ºC и
68.5ºС для дуплексов кДНК c 5'-праймером и
3'-праймером, соответственно. Для подбора оптимального температурного режима
нами была проведена ПЦР в градиенте температур отжига праймеров от 43.1ºС до 63.2ºС. Пробы анализировали гель-электрофорезом в 12%-ном ПААГ в
денатурирующих условиях с последующим окрашиванием геля раствором красителя “Stains-All”
(рис. 13). В качестве контроля использовали реакционную смесь репликации
ДНК-библиотеки фрагментом Кленова с использованием 5'-праймера dm 28
long.
контроль
без матрицы реакционная смесь ПЦР
с dm 28 dm 28 long с dm 28
dm 28 long дцДНКконтр
60
55 49 45 43 60 55 49 45 43 63 60 55 49 45 43 63 60 55 49 45 43
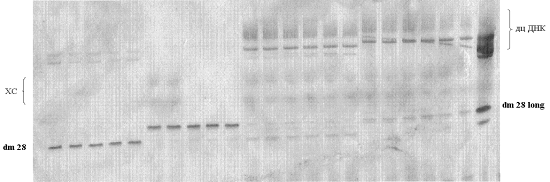
Рис.
13. Электрофоретический анализ реакционных смесей ПЦР в градиенте температур
отжига праймеров (слева направо): 63.2ºС (63), 60.1ºС (60), 55.1ºС (55), 49.7ºС (49), 45.3ºС (45), 43.1ºС (43). В качестве контроля использованы реакционные
смеси ПЦР, не содержащие матрицу, и реакционная смесь репликации ДНК-библиотеки
с использованием фрагмента Кленова и 5'-праймера dm 28 long.
Электрофорез был проведен в 12%-ном ПААГ в денатурирующих условиях.
Количество
ПЦР-продукта в реакционных смесях практически не зависело от температуры отжига
праймеров и составило 42 пмоль и 50 пмоль на 100 мкл реакционной смеси с
использованием 5'-праймеров dm 28 и dm 28 long, соответственно. Поэтому было решено проводить отжиг
праймеров при 63ºС для максимальной специфичности связывания праймеров
с ДНК-матрицей. После очистки было выделено 247,8 пмоль дцДНК 1 и 300 пмоль
дцДНК 2. С использованием полученных дцДНК были проведены реакции транскрипции in vitro с использованием 2'-F-модифицированных
пиримидинтрифосфатов отдельно для каждой дцДНК-библиотеки. После очистки
количество продукта составило 308 пмоль и 866 пмоль 2'-F-РНК с дцДНК 1
и дцДНК 2, соответственно. На основании полученных данных был сделан вывод, что
эффективность транскрипции in vitro с 2'-F-модифицированными
пиримидинтрифосфатами повышается при использовании в качестве матрицы
удлиненной дцДНК-библиотеки (дцДНК 2). Поэтому для амплификации 2'-F-модифицированной
РНК-библиотеки мы использовали 5'-праймер dm 28 long.
Таким
образом, были оптимизированы и апробированы все реакции стадии амплификации 2'-F-модифицированной
РНК-библиотеки, что позволило нам получить 2'-F-модифицированную
РНК-библиотеку в требуемых количествах и перейти к решению следующей задачи.
Как
ранее было отмечено в обзоре литературы, одной из важнейших стадий отбора
аптамеров является стадия отделения комплексов олигонуклеотидов с
молекулой-мишенью от несвязавшихся молекул (п. 1.1.). Способ отделения
комплексов от несвязавшихся молекул в первую очередь определяется свойствами
мишени. В качестве мишени для создания аптамеров нами были выбраны
поликлональные аутоантитела класса G, вырабатываемые организмом
человека, больного рассеянным склерозом. Использование в качестве мишени
поликлональных аутоантител повышает вероятность получить модифицированные
РНК-аптамеры, способные связывать аутоантитела к ОБМ у большинства больных
рассеянным склерозом. Поликлональные аутоантитела класса G
были выделены из 10 образцов сыворотки крови больных рассеянным склерозом и
хроматографически разделены на 2 фракции по сродству к ОБМ в Лаборатории
ферментов репарации ИХБФМ СО РАН Безугловой А.М. Для отбора РНК-аптамеров была
использована фракция аутоантител с меньшим сродством к ОБМ.
На
основе литературных данных в качестве метода разделения комплексов и
несвязавшихся молекул нами была выбрана нековалентная иммобилизация АТ на
стенках ПЦР-пробирки с последующей промывкой буфером (п. 1.1.). В этом случае
образование комплексов олигонуклеотидов с белком-мишенью и все реакции стадии
амплификации проводят в одной ПЦР-пробирке. Такой метод отбора гарантирует
наличие всех связавшихся с белком-мишенью олигонуклеотидов. Как и в случае
ковалентной иммобилизации мишени, при адсорбции антител возможно связывание их
активных центров со стенками ПЦР-пробирки. Однако те сайты, что были закрыты
для связывания с комбинаторной библиотекой в первом раунде, могут быть доступны
в следующем раунде отбора, при этом количество белка-мишени для одного раунда
отбора существенно меньше, чем в случае ковалентной иммобилизации мишени.
С
использованием данного подхода ранее был получен ДНК-аптамер к иммуноглобулину
C595 [17]. Нами было решено использовать этот подход для получения
РНК-аптамеров.
Иммобилизацию
поликлональных аутоантител класса G на стенках ПЦР-пробирки и связывание
с 2'-F-модифицированной РНК-библиотекой проводили по
аналогии с протоколом [50].
Для
получения РНК-аптамеров в процедуру SELEX, описанную в протоколе
[50], необходимо было добавить стадии обратной транскрипции и транскрипции, а
также подобрать условия разрушения комплексов антител со связавшимися 2'-F-модифицированными
олигорибонуклеотидами. Было апробировано два метода. Количество 2'-F-модифицированной
РНК-библиотеки в обоих случаях составило порядка 450 пмоль. В первом варианте
комплексы аутоантител с олигонуклеотидами разрушали добавлением 7 М мочевины с
последующей экстракцией смесью Tрис-HCl (pH 8.0): хлороформ:фенол (1:2:5) и осаждением этанолом.
Полученную 2'-F-модифицированную РНК-библиотеку использовали в
реакции обратной транскрипции [54]. Во втором случае комплексы 2'-F-РНК
и аутоантител разрушали инкубированием при 90ºС в течение 2 мин в присутствии 3'-праймера dm
29. Полученный дуплекс использовали в реакции обратной транскрипции. После
проведения всех реакций стадии амплификации было получено 226 пмоль и 233 пмоль
2'-F-РНК для 1-го и 2-го случаев, соответственно.
Поскольку второй вариант намного быстрее, далее мы придерживались его (рис.
14).
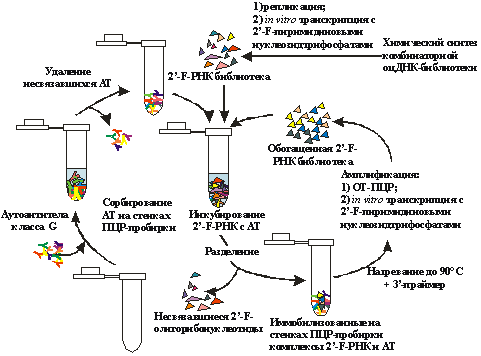
Рис.
14. Схема отбора 2'-F-модифицированных РНК-аптамеров к поликлональным
аутоантителам класса G , вырабатываемым организмом человека при рассеянном
склерозе.
Таким
образом, нами была разработана и апробирована методика отбора 2'-F-модифицированных
РНК-аптамеров к поликлональным аутоантителам человека, больного рассеянным
склерозом.
По разработанной методике первоначально было проведено минимальное
количество раундов отбора - 6 раундов. На первый раунд был взят 1 нмоль 2'-F-модифицированной РНК-библиотеки. Для
повышения аффинности полученной после 6-го раунда SELEX 2'-F-пиримидинсодержащей
РНК-библиотеки были проведены еще 4 раунда SELEX с ужесточением условий отбора. Для предотвращения
отбора аптамеров к какому-либо компоненту используемых буферов перед каждым
раундом отбора был проведен “негативный” SELEX (п. 2.3.7.). Время инкубирования 2'-F-РНК с ПЦР-пробиркой увеличивали от
20 мин до 35 мин с интервалом в 5 мин. Несвязавшиеся с компонентами буфера
молекулы 2'-F-модифицированной РНК-библиотеки
использовали в следующем раунде SELEX.
Время инкубирования 2'-F-РНК
с аутоантителами составило 60, 50, 40 и 30 мин для 7-го, 8-го, 9-го и 10-го
раундов SELEX, соответственно.
Для того чтобы узнать, позволяет ли данная методика обогащать
комбинаторную РНК-библиотеку последовательностями, обладающими сродством к
молекуле-мишени, были измерены константы диссоциации комплексов антител с
исходной 2'-F-модифицированной РНК-библиотекой и
2'-F-модифицированными РНК-библиотеками
после 6-го и после 10-го раундов SELEX
(п. 3.3.).
.3 Изучение
эффективности связывания обогащенной 2'-F-модифицированной РНК-библиотеки с
поликлональными аутоантителами
Измерение
констант диссоциации комплексов аутоантител с исходной и обогащенными 2'-F-модифицированными
РНК-библиотеками было проведено в соответствии с протоколами [54, 161] (п.
2.3.9.). Первоначально нами было проведено “пробное” измерение Kd комплексов аутоантител с исходной 2'-F-модифицированной
РНК-библиотекой согласно протоколу [54]. Исходя из полученных данных, была
определена область концентраций аутоантител, в которой происходит диссоциация
их комплекса с исходной 2'-F-модифицированный РНК-библиотекой, и проведено
повторное измерение Kd данного
комплекса. Аналогичным образом было проведено измерение Kd комплексов аутоантител с 2'-F-модифицированной
РНК-библиотекой после 6-го и после 10-го раундов отбора. Данные, использованные
для расчета Kd комплексов аутоантител и 2'-F-модифицированных
РНК-библиотек (табл. 4), описывали приведенным ниже уравнением [161]:
f = С·(Kd + [RNA] + [P] - ((Kd
+ [RNA] + [P])2 - 4·[RNA]·[P])0.5)/(2·[RNA]),
где
[P] - концентрация аутоантител; [RNA]
- концентрация 2'-F-модифицированной РНК-библиотеки; f -
доля связавшихся олигонуклеотидов; Kd - константа
диссоциации комплексов 2'-F-РНК с аутоантителами; С - константа эффективности
связывания комплексов аутоантител и 2'-F-олигорибонуклеотидов
с нитроцеллюлозными фильтрами.
Используя
полученные данные, находили константу С. Отношение f/С давало fнорм
- нормированное значение доли
комплексов 2'-F-РНК с аутоантителами. Нормированные данные описывали
тем же уравнением, принимая С равной 1, и находили Kd (табл.
5).
Таблица
4. Расчетные данные для измерения Kd комплексов аутоантител и
2'-F-модифицированных РНК-библиотек: 1) исходной; 2) после 6-го раунда отбора;
3) после 10-го раунда отбора.
)
2) 3)
|
[P],
нМ
|
f, %
|
fнорм, %
|
|
|
12000.0
|
36.6
|
100.7
|
|
|
6000.0
|
40.6
|
93.8
|
|
|
3000.0
|
34.1
|
85.7
|
|
|
1000.0
|
31.2
|
77.6
|
|
|
330.0
|
28.2
|
48.6
|
|
|
110.0
|
17.7
|
31.1
|
|
|
37.0
|
11.3
|
30.4
|
|
|
4.1
|
11.0
|
22.1
|
|
|
[P], нМ
|
f, %
|
fнорм, %
|
|
|
1800
|
60.0
|
68.2
|
|
|
600
|
86.6
|
98.4
|
|
|
200
|
93
|
121.1
|
|
|
66
|
29.9
|
37.9
|
|
|
22
|
4.3
|
5.4
|
|
|
7.4
|
4.2
|
5.3
|
|
|
2.4
|
2.5
|
3.2
|
|
|
0.8
|
2.2
|
2.9
|
|
|
0.3
|
2.1
|
2.7
|
|
|
[P], нМ
|
f, %
|
fнорм, %
|
|
600
|
86,3
|
87,7
|
|
200
|
110,0
|
111,7
|
|
66
|
85,9
|
87,2
|
|
22
|
69,4
|
70,5
|
|
7,4
|
30,9
|
31,4
|
|
2,4
|
25,6
|
26,0
|
|
0,8
|
17,8
|
18,1
|
|
0,3
|
3,5
|
3,6
|
|
|
|
|
|
|
|
Таблица 5. Kd комплексов
аутоантител с исходной 2'-F-модифицированной
РНК-библиотекой, библиотекой после 6-го и после 10-го раундов SELEX
|
2'-F-модифицированная
РНК-библиотека
|
С, %
|
Kd, нМ
|
|
Исходная
|
С = 36 ± 3
|
Kd = 256 ± 74
|
|
После 6-го раунда SELEX
|
С = 70 ± 10
|
Kd = 96 ± 39
|
|
После 10-го раунда SELEX
|
С = 98 ± 8
|
Kd = 6 ± 2
|
На основе приведенных в табл. 5 значений Kd можно сделать вывод, что данная
методика отбора 2'-F-модифицированных РНК-аптамеров позволяет обогащать
комбинаторную 2'-F-модифицированную РНК-библиотеку последовательностями,
обладающими сродством к аутоантителам человека, больного рассеянным склерозом.
Было исследовано влияние 2'-F-модифицированной РНК-библиотеки после 10-го раунда SELEX на реакцию деградации ОБМ аутоантителами,
вырабатываемыми организмом человека при рассеянном склерозе (рис. 15).
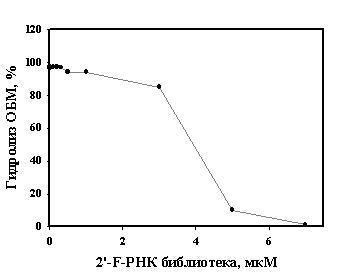
Рис.
15. Влияние 2'-F-модифицированной РНК-библиотеки после 10-го раунда SELEX
на протеолитическую активность аутоантител. Каждая реакционная смесь (12 мкл)
содержала 6 мкг ОБМ, 6 мкг аутоантител, 17 мМ Трис-HCl (pH 7.5), 17 мМ NaCl.
Концентрация 2'-F-РНК библиотеки составляла 0 мкМ, 0.1 мкМ, 0.3 мкМ, 0.5 мкМ, 1
мкМ, 3 мкМ, 5 мкМ и 7 мкМ. Реакцию деградации ОБМ проводили при 30°С в течение
24 ч. Реакционные смеси анализировали гель-электрофорезом в 12%-ном ПААГ с
последующим окрашиванием Coomassie Blue R-250. Данные получены в ЛФР ИХБФМ СО
РАН Безугловой А.М.
На
основании полученных данных можно сделать предварительный вывод, что
2'-F-модифицированная РНК-библиотека после 10-го раунда отбора содержит
олигонуклеотиды, ингибирующие протеазную активность патогенных аутоантител.
.4
Хроматографическое разделение 2'-F-пиримидинсодержащей РНК-библиотеки после
10-го раунда отбора на фракции по сродству к поликлональным аутоантителам
Для выделения фракции 2'-F-модифицированных олигорибонуклеотидов,
обладающей наибольшим сродством к патогенным аутоантителам и/или ингибирующей
активностью по отношению к аутоантителам, часть полученной после 10-го раунда отбора
2'-F-пиримидинсодержащей РНК-библиотеки
была амплифицирована до 3.55 о.е. и разделена хроматографически на колонке с
иммобилизованным на BrCN-активированной
сефарозе пулом поликлональных аутоантител. Цифрами I, II и III отмечены объединенные фракции 2'-F-модифицированной РНК-библиотеки
(рис. 16).
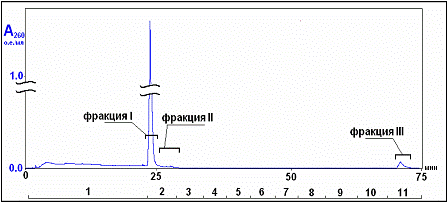
Рис. 16. Хроматографическое разделение 2'-F-модифицированной РНК-библиотеки после 10-го раунда SELEX по сродству к поликлональным
аутоантителам. На колонку наносили 3.55 о.е. 2'-F-РНК библиотеки в 60 мкл бидистиллированной воды и промывали
20 мМ Tрис-HCl, pH 7.5
(фр. 1). Далее проводили ступенчатую элюцию 2'-F-РНК растворами следующего состава: 0.1 М NaCl в 20 мМ Tрис-HCl, pH 7.5 (фр. 2); 0.3 М NaCl в 20 мМ Tрис-HCl, pH 7.5 (фр. 3); 0.5 М NaCl в 20 мМ Tрис-HCl, pH 7.5 (фр. 4); 1 М NaCl в 20 мМ Tрис-HCl, pH 7.5 (фр. 5); 2 М NaCl в 20 мМ Tрис-HCl, pH 7.5 (фр. 6); 3 М NaCl в 20 мМ Tрис-HCl, pH 7.5 (фр. 7); 1 М MgCl2 в 20 мМ Tрис-HCl, pH 7.5 (фр. 8); 2 М MgCl2 в 20 мМ Tрис-HCl, pH 7.5 (фр. 9); 3 М MgCl2 в 20 мМ Tрис-HCl, pH 7.5 (фр. 10); 0.1 М глицином, pH 2.6 (фр. 11). Цифрами I, II и III
отмечены объединенные фракции 2'-F-модифицированной
РНК-библиотеки.
Фракции I, II и III
2'-F-модифицированной РНК-библиотеки
после хроматографического разделения обессолили и сконцентрировали на колонках Microcon YM-30 (условия приведены в п. 2.3.10.). Количество 2'-F-РНК во фракции I составило 2,5 о.е. (4 нмоль).
Фракции II и III 2'-F-модифицированной
РНК-библиотеки амплифицировали как описано в п. 2.3.5., получив в среднем по
0.7 о.е. (1 нмоль) каждой фракции.
Было исследовано влияние каждой фракции 2'-F-модифицированной РНК-библиотеки на реакцию деградации ОБМ
аутоантителами, вырабатываемыми организмом человека при рассеянном склерозе (рис.
17).
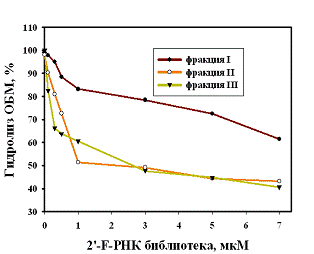
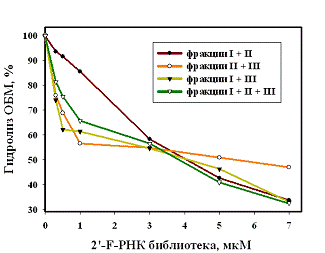
1)
2)
Рис. 17. Ингибирование протеазной активности аутоантител фракциями 2'-F-модифицированной РНК-библиотеки
после хроматографического разделения: 1) индивидуальными фракциями, 2)
комбинациями фракций. Каждая реакционная смесь (12 мкл) содержала 6 мкг ОБМ, 6
мкг аутоантител, 17 мМ Трис-HCl (pH 7.5), 17 мМ NaCl. Концентрация 2'-F-РНК
библиотеки в реакционных смесях для каждой фракции составила 0 мкМ, 0.1 мкМ,
0.3 мкМ, 0.5 мкМ, 1 мкМ, 3 мкМ, 5 мкМ и 7 мкМ. Реакцию деградации ОБМ проводили
при 30°С в течение 24 ч. Реакционные смеси анализировали гель-электрофорезом в
12%-ном ПААГ с последующим окрашиванием Coomassie Blue R-250. Данные получены в
ЛФР ИХБФМ СО РАН Безугловой А.М.
Исходя из полученных данных, можно сделать следующие выводы: ингибирующая
активность 2'-F-модифицированных
олигорибонуклеотидов не коррелирует с их сродством к поликлональным аутоантителам;
каждая фракция 2'-F-модифицированной
РНК-библиотеки ингибирует определенную группу поликлональных аутоантител,
вырабатываемых организмом человека при РС.
Для получения индивидуальных 2'-F-модифицированных РНК-аптамеров было проведено клонирование и
секвенирование полученных фракций 2'-F-модифицированной РНК-библиотеки.
3.5
Клонирование и секвенирование фракций 2'-F- пиримидинсодержащей РНК-библиотеки
Для проведения клонирования фракций I, II и III 2'-F-модифицированной РНК-библиотеки были использованы
олигонуклеотиды-праймеры, комплементарные 3'- и 5'-константным участкам
комбинаторной ДНК-библиотеки и содержащие сайты рестрикции эндонуклеаз
рестрикции HindIII и BamHI, соответственно (рис. 18).
'-праймер HindIII
'-CCGAAGCTTGAAATAATACGACTCACTATAGGGAGGACGATGC GG-3' кодирующая цепь дцДНК-библиотеки
'-CCC TCC TGCTACG CC<40N>GTC TGC TG AGC GCG CT-5'
транскрибируемая цепь дцДНК-библиотеки
'-GGGAGGACGATGCGG<40N>CAG ACG ACT CGCGCGA-3'
'-GTC TGC TGAGCC GGCTCCTAGGGCG-5'
'-праймер BamHI
Рис. 18. Система комбинаторной дцДНК-библиотеки с 5'-праймером HindIII и 3'-праймером BamHI. Цветом выделены: ….. - сайт рестрикции HindIII, ….. - сайт
рестрикции BamHI.
Фракции I, II и III
2'-F-модифицированной РНК-библиотеки
переводили в дцДНК-форму методом ОТ-ПЦР высокой точности с использованием
3'-праймера BamHI и 5'-праймера HindIII. Полученную дцДНК-библиотеку фракций
I, II и III
клонировали в векторе pUC18
по сайтам эндонуклеаз рестрикции BamHI
и HindIII (рис. 19).
5'-G TAA AAC GAC GGC CAG TGC CAA GCT TGC
ATG CCT GCA GGT CGA CTC TAG AGG ATC CCC GGG TAC CGA GCT CGA ATT CGT AAT CAT
GGT CAT AGC TGT TTC CTG - 3'
Рис. 19. Полилинкерный участок (ПЛУ) вектора pUC18. Цветами выделены: …
- сайт рестрикции эндонуклеазы HindIII,
… - сайт рестрикции эндонуклеазы BamHI, …
- сайт рестрикции эндонуклеазы PstI.
Жирным шрифтом отмечен ПЛУ вектора pUC18.
Предварительно была проведена проверка рестриктазной активности отдельно
каждой эндонуклеазы рестрикции. Для этого 0.2 мкг pUC18 инкубировали с 0.2 е.а. BamHI или HindIII
при 37°С в течение 5 мин с последующим инактивированием ферментов при 80°С в
течение 10 мин. Продукт реакции гидролиза анализировали электрофорезом в 1%-ном
агарозном геле (рис. 20).
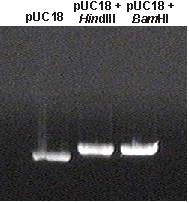
Рис. 20. Электофоретический анализ реакционных смесей гидролиза вектора pUC18 рестриктазами BamHI и HindIII в 1%-ном агарозном геле. В качестве контроля
использован вектор pUC18 (0.2 мкг).
Визуализацию полос олигонуклеотидов проводили с помощью системы
гель-документации “Gel imager 2” (“НПФ” Биоклон).
Из полученных данных можно сделать вывод, что 1 е. а. рестриктазы BamHI или HindIII достаточно, чтобы за 5 мин перевести в линейную форму
1 мкг pUC18. С учетом этого соотношения была
проведена реакция рестрикции ДНК вектора pUC18 и фракций I, II и III эндонуклеазами рестрикции BamHI и HindIII
с последующим лигированием полученных ДНК с “липкими” концами в соотношении
1:20. В полученную реакционную смесь добавляли эндонуклеазу рестрикции PstI для расщепления по ПЛУ молекул
вектора pUC18, не содержащих вставок дцДНК
фракций. Полученную реакционную смесь, содержащую плазмидную ДНК с вставкой
дцДНК фракций I, II или III,
использовали для трансформации компетентных клеток E.coli штамма DH5α
(п. 2.3.13.).
Для отбора колоний E.coli, содержащих плазмидную ДНК, был
использован метод фенотипической селекции. Поскольку вектор pUC18 содержит ген устойчивости к
ампициллину, полученную после трансформации суспензию клеток E.coli высевали на чашку Петри с селективным LB-агаром, содержащим 100 мкг/мл
ампициллина. В качестве контроля на две других чашки Петри с селективным LB-агаром высевали клетки E.coli, трансформированные вектором pUC18, и исходные компетентные клетки E.coli. Все чашки Петри инкубировали в суховоздушном
термостате при 37°С в течение 16-18 ч. В результате чашка Петри с
нетрансформированными клетками E.coli была пуста; чашка Петри с клетками E.coli, трансформированными вектором pUC18, содержала множество колоний
разной величины и окраски - от белой до синей; чашка Петри с клетками E.coli, трансформированными плазмидной ДНК с вставкой дцДНК
фракций I, II или III,
содержала несколько колоний разного размера белой или светло-голубой окраски.
Таким образом было показано, что трансформация клеток E.coli проходит
эффективно, а используемого количества антибиотика достаточно для проведения
фенотипической селекции.
Для
разделения разных колоний, трансформированных E.coli,
полученные колонии высевали на чашку Петри с селективным LB-агаром
(по 4 колонии на чашку). В качестве контроля на новую чашку Петри также переносили
одну колонию E.coli, трансформированную вектором pUC18. Для
выявления колоний E.coli, содержащих плазмидную ДНК с вставкой экзогенной ДНК,
обычно используют метод бело-голубой селекции [173]. Полилинкерный участок
вектора pUC18 расположен в гене lacZ, кодирующем
β-галактозидазу - фермент класса гидролаз,
катализирующий расщепление лактозы на галактозу и глюкозу. β-Галактозидаза расщепляет 5-бром-4-хлор-3-индолил-β-D-галактопиранозид (X-Gal)
на галактозу и 5-бром-4-хлорo-3-гидроксииндол, который в присутствии IPTG
окисляется до 5,5'-дибром-4,4'-дихлор-индиго (нерастворимый осадок синего
цвета). При встраивании экзогенной ДНК в вектор pUC18 по ПЛУ
сбивается рамка считывания β-галактозидазы,
и фермент не вырабатывается. Таким образом, колонии, содержащие вектор pUC18,
при выращивании на селективном LB-агаре с добавлением X-Gal и
IPTG приобретают синий цвет, а колонии, содержащие вектор pUC18
с вставкой экзогенной ДНК по ПЛУ, остаются белыми.
К
сожалению, применить метод бело-голубой селекции для полученных колоний
оказалось невозможным, поскольку колония-контроль была такого же
светло-голубого цвета, как и большинство полученных колоний. Это может быть
связано с тем, что длины ДНК фракций I, II и III
было недостаточно для того, чтобы сбить рамку считывания β-галактозидазы. Поэтому наличие плазмидной ДНК в
колонии клеток E.coli определяли методом ПЦР. Для этого были использованы
5'-праймер seq 1 и 3'-праймер seq 2,
комплементарные 3'- и 5'- константным районам вектора pUC18,
фланкирующим ПЛУ (рис. 21).
'-константный
район ПЛУ pUC18 5'-константный район ПЛУ pUC18
'-AAAGGGTCAGTGCTGCAACATTTTGC-5' 3'- GGACACACTTTAACAATAGGCGA-5'
5'-CCCAGTCACGACGTTGTAAAACG-3' 5'-CCTGTGTGAAATTGTTATCCGCT-3
'-праймер seq 1 3'-праймер seq 2
Рис. 21. Комплексы 5'-праймера seq 1 с 3'-константным районом, фланкирующим ПЛУ вектора pUC18, и 3'-праймера seq 2 с 5'-константным районом,
фланкирующим ПЛУ вектора pUC18.
В качестве примера на рис. 22 приведена электрофореграмма реакционных
смесей ПЦР для колоний клеток E.coli, трансформированных плазмидной ДНК,
содержащей дцДНК фракции I.
Фракция I
pUC18контр.
к1 к2 к3 к4 к5

Рис. 22. Электрофоретический анализ реакционных смесей ПЦР для колоний E.coli с плазмидной ДНК фракции I (фракция I, к1, к2, к3, к4, к5 - ПЦР-продукт соответствующих колоний
клеток E.coli). В качестве контроля использовали
ПЦР-продукт вектора pUC18 (pUC18 контр.). Визуализация полос
окрашиванием геля раствором красителя “Stains-All”.
Многокопийную плазмидную ДНК выделяли из индивидуальных колоний клеток E.coli с помощью набора QIAprep Spin Miniprep Kit (QIAGEN)
и проверяли наличие дцДНК фракций I, II и III повторно (рис. 23).
Фракция I

к3 к2 к1 pUC18контр.
Рис. 23. Электрофоретический анализ реакционных смесей ПЦР для плазмидных
ДНК, содержащих дцДНК фракции I (фракция I, к1, к2, к3 - ПЦР-продукт плазмидных
ДНК соответствующих колоний клеток E.coli). В качестве контроля использовали
ПЦР-продукт вектора pUC18 (pUC18 контр.). Визуализация полос окрашиванием геля
раствором красителя “Stains-All”.
Как видно из электрофореграмм на рис. 22 и рис. 23, полученные
ПЦР-продукты обладали меньшей электрофоретической подвижностью, чем контрольный
ПЦР-продукт, что связано с наличием вставки ДНК фракции I. Однако практически все ПЦР-продукты
обладают разной электрофоретической подвижностью, что может быть связано с
потерей части ДНК вставки, встраиванием в вектор pUC18 двух и более молекул ДНК фракций или рекомбинацией
двух и более молекул ДНК фракций в составе разных плазмидных ДНК.
Для определения нуклеотидной последовательности ДНК-клонов полученные
плазмидные ДНК секвенировали с использованием набора Big Dye Terminators v.3.1 Cycle Sequencing Kit (Applied Biosystems, США) в ЦКП “Секвенирование ДНК” СО
РАН. Нуклеотидные последовательности полученных клонов ДНК фракций I, II и III
приведены в табл. 6.
Таблица 6. Нуклеотидные последовательности ДНК-клонов фракций I, II и III
|
Плазмидная ДНК
|
Нуклеотидная последовательность
|
|
Фракция I
клон 1
|
5'-GGATCCTCGCGCGAGTCGTCTGCACGGTAGCGAGGTGCTCTCATTGGGAAGTTTG GGTTGAGACCGCATCGTCCTCCC- 3'
|
|
Фракция I клон 2
|
5'-GGATCCTCGCGCGAGTCGTCTGCCCAGGCTACACGCATGTTGATTCTGATGATCG CGCGAGTCGTCTGGCCACGGAGTTTAGGTTCCATGTTTCCGCTGTATGACGATCCGCATCGTCCTCCC- 3'
|
|
Фракция I клон 3
|
5'-GGATCCTCGCGCGAGTCGTCTGGGCAGCACCCGAACGAGAGCGCGAGACTGAGG ATTGCCCTCCGCATCGTCCTCCC- 3'
|
|
Фракция I клон 4
|
5'-GGATCCTCGCGCGAGTCGTCTGGCGGCAGGATCAGGAATTGATTAGAAGTTCTTA CTCCGTTCCGCATCGTCCTCCCTATAGTGAGTCGTATTAATTTCAGTCCTCACCGCATCGTCCGCATCGTCCTCCC- 3'
|
|
Фракция II клон 1
|
5'-GGATCCTCGCGCGAGTCGTCTGGCACGGGCAGGGGATACGAGTGACGTTGGCGT CAACACTACCGCATCGTCCTCCC- 3'
|
|
Фракция II клон 2
|
5'-GGATCCTCGCGCGAGTCGTCTGCAGGGGAGAGGATAATGTTCAGCTAGACCGGG CTTCAATCCCGCATCGTCCTCCC- 3'
|
|
Фракция II клон 3
|
5'-GGATCCTCGCGCGAGTCGTCTGCACACACAGGCAACAAACTGTGTCGCGCGAGT CGTCTGTGGGTAAACGAGGGTGGGGCAGAGATGTACTCAGAAAACACCGCATCGTCCTCCC- 3'
|
|
Фракция II клон 4
|
5'-GGATCCTCGCGCGAGTCGTCTGGCGACACGTGGCATGACGAGGTTAATCGCGCG AGTCGTCTGCACGATAGTGGTGAGGCCGGGGCATGTGTGGGTATGCTTAACCGCATCGTCCTCCC - 3'
|
|
Фракция II клон 5
|
5'-GGATCCTCGCGCGAGTCGTCTGCACACACAGGCAACAAACTGTGTCGCGCGAGT CGTCTGCAGGGTGAACAAGGGTGGGGCAGAGATGTACTCAGAAAACACCGCATCGTCCTCCC- 3'
|
|
Фракция III
клон 1
|
5'-GGATCCTCGCGCGAGTCGTCTGGCACGATCGCAGCATTTGGCAACACTGGTCGC GCGAGTCGTCTGGGCATAATGAGCCACAGGTTGGAAGTATTGCTTCACTTGGCCGCATCGTCCTCCC- 3'
|
|
Фракция III клон
2
|
5'- GGATCCTCGCGCGAGTCGTCTGGGGAGGGCGAGTCGTCTGGCTCGAGCTAGGCT GTGCATTCGCAACCACTCACATCGAACCGCATCGTCCTCCC- 3'
|
|
Фракция III
клон 3
|
5'- GGATCCTCGCGCGAGTCGTCTGGGCACGCGGAAAGACGACGAGCCGTGGCATCG TAGCTCAACCGCATCGTCCTCCC- 3'
|
|
Фракция III
клон 4
|
5'-GGATCCTCGCGCGAGTCGTCTGGGGATGAGCGTTGTTACACGCATCATCGCGCG AGTCGTCTGGGGAGGGGAGTAGCTTTTCCGATGGAGACTGAATGCTCCACCGCATCGTCCTCCC- 3'
|
|
Фракция III
клон 5
|
5'-GGATCCTCGCGCGAGTCGTCTGCACACACAGGCAACACCATGTGTCGCGCGAGT CGTCTGGCGGGGGCCGCGGCAGGCATGAACGATGCAACTCATCAGACCGCATCGTCCTCCC- 3'
|
|
Фракция III
клон 6
|
5'-GGATCCTCGCGCGAGTCGTCTGCGGGTAAACAAGGGTGGGGCAGAGATGTACT CAGAAAACACCGCATCGTCCTCCC- 3'
|
Цветами отмечены: … -
5'-константная часть ДНК-библиотеки, … -
3'-константная часть ДНК-библиотеки, … -
последовательность вектора pUC18,
… - 40N-участок ДНК-клонов.
При секвенировании клонированных фрагментов было обнаружено, что в ходе
трансформации клеток E.coli происходит рекомбинация двух молекул
ДНК фракций, что объясняет различия в электрофоретической подвижности
ПЦР-продуктов трансформированных колоний E.coli и полученных
плазмидных ДНК. Таким образом, нами были проведены клонирование и
секвенирование полученных фракций I, II и III 2'-F-модифицированной
РНК-библиотеки; были получены первичные последовательности 40N-участков ДНК-клонов фракций I, II и III.
3.6
Определение гомологичных участков и компьютерное моделирование вторичной
структуры индивидуальных 2'-F-модифицированных
РНК-аптамеров фракций I, II и III
Как
известно, аптамеры связывают молекулы-мишени за счет своей особой
пространственной структуры. Обычно участки аптамеров, отвечающие за связывание
мишени, встречаются в большинстве полученных клонов и обладают сложной
вторичной структурой (п. 1.4.). Определение гомологичных последовательностей в
полученных 40N-участках ДНК-клонов проводили в программном пакете MEME version 4.3.0 [90] как отдельно для клонов каждой
фракции (рис. 24), так и для клонов всех фракций (рис. 25).
|
Фракция I
Клон 1 CACGGTAGCGAGGTGCTCTCATTGGGAAGTTGGGTTGAGA
|
|
Клон 2 GCCACGGAGTTTAGGTTCCATGTTTCCGCTGTATGACGAT
|
|
Клон 3 GGCAGCACCCGAACGAGAGCGCGAGACTGAGGATTGCCCT
|
|
Клон 4 GCGGCAGGATCAGGAATTGATTAGAAGTTCTTACTCCGTT
|
|
Фракция II
Клон 1 GCACGGGCAGGGGATACGAGTGACGTTGGCGTCAACACTA
|
|
Клон 2 CAGGGGAGAGGATAATGTTCAGCTAGACCGGGCTTCAATC
|
|
Клон 3 TGGGTAAACGAGGGTGGGGCAGAGATGTACTCAGAAAACA
|
|
Клон 4 CACGATAGTGGTGAGGCCGGGGCATGTGTGGGTATGCTTAA
|
|
Клон 5 CAGGGTGAACAAGGGTGGGGCAGAGATGTACTCAGAAAACA
|
|
Фракция III Клон
1 GGCATAATGAGCCACAGGTTGGAAGTATTGCTTCACTTGG
|
|
Клон 2 GCTCGAGCTAGGCTGTGCATTCGCAACCACTCACATCGAA
|
|
Клон 4 GGGAGGGGAGTAGCTTTTCCGATGGAGACTGAATGCTCCA
|
|
Клон 5 GCGGGGGCCGCGGCAGGCATGAACGATGCAACTCATCAGA
|
|
Клон 6 CGGGTAAACAAGGGTGGGGCAGAGATGTACTCAGAAAACA
|
Рис. 24. Гомологичные последовательности 40N-участков ДНК-клонов фракций I, II и III, полученные в программном пакете MEME version 4.3.0 отдельно для каждой фракции.
|
Фракция I
Клон 1 CACGGTAGCGAGGTGCTCTCATTGGGAAGTTGGGTTGAGA
|
|
Клон 2 GCCACGGAGTTTAGGTTCCATGTTTCCGCTGTATGACGAT
|
|
Клон 3 GGCAGCACCCGAACGAGAGCGCGAGACTGAGGATTGCCCT
|
|
Клон 4 GCGGCAGGATCAGGAATTGATTAGAAGTTCTTACTCCGTT
|
|
Фракция II
Клон 1 GCACGGGCAGGGGATACGAGTGACGTTGGCGTCAACACTA
|
|
Клон 2 CAGGGGAGAGGATAATGTTCAGCTAGACCGGGCTTCAATC
|
|
Клон 3 TGGGTAAACGAGGGTGGGGCAGAGATGTACTCAGAAAACA
|
|
Клон 4 CACGATAGTGGTGAGGCCGGGGCATGTGTGGGTATGCTTAA
|
|
Клон 5 CAGGGTGAACAAGGGTGGGGCAGAGATGTACTCAGAAAACA
|
|
Фракция III Клон
1 GGCATAATGAGCCACAGGTTGGAAGTATTGCTTCACTTGG
|
|
Клон 2 GCTCGAGCTAGGCTGTGCATTCGCAACCACTCACATCGAA
|
|
Клон 3 GGCACGCGGAAAGACGACGAGCCGTGGCATCGTAGCTCAA
|
|
Клон 4 GGGAGGGGAGTAGCTTTTCCGATGGAGACTGAATGCTCCA
|
|
Клон 5 GCGGGGGCCGCGGCAGGCATGAACGATGCAACTCATCAGA
|
|
Клон 6 CGGGTAAACAAGGGTGGGGCAGAGATGTACTCAGAAAACA
|
Рис. 25. Гомологичные последовательности 40N-участков ДНК-клонов фракций I, II и III, полученные в программном пакете MEME version 4.3.0 для клонов всех фракций.
Как было показано ранее (п. 3.4.), все полученные фракции 2'-F-модифицированной РНК-библиотеки
различаются по сродству к поликлональным аутоантителам человека, больного РС.
Однако, как видно из рис. 24 и 25, как клоны одной фракции, так и клоны из
разных фракций обладают гомологичными участками нуклеотидной
последовательности. Три из указанных ДНК-клонов (фракция II, клон 3, клон 5 и фракция III, клон 6) обладают высокой
гомологичностью, а два ДНК-клона (фракция I, клон 2 и фракция III, клон 4) - более низкой гомологичностью нуклеотидных
последовательностей. Присутствие гомологичных участков в последовательностях полученных
клонов дает возможность предположить, что эти участки отвечают за связывание
поликлональных аутоантител человека, больного РС.
Для записи нуклеотидной последовательности индивидуальных 2'-F-модифицированных РНК-аптамеров
фракций I, II и III
проводили замену константных участков ДНК-библиотеки в последовательности
полученных ДНК-клонов на константные участки 2'-F-модифицированной РНК-библиотеки, замену тимидина на уридин и
всех пиримидиновых нуклеотидов на их 2'-F-модифицированные аналоги (табл. 7).
Ранее
было показано, что главную роль в связывании аптамера с мишенью играют
неспаренные участки олигонуклеотида, а часть аптамера, обладающая стабильной
вторичной структурой, служит для поддержания правильного расположения участков,
узнающих мишень. Для определения вторичной структуры полученных индивидуальных
2'-F-модифицированных РНК-аптамеров использовали
программный пакет mfold version 2.3 [92] (рис. 26, 27, 28). Цветом обозначена
вероятность нахождения нуклеотидной последовательности в одноцепочечном
состоянии (табл. 8). В полученных вторичных структурах индивидуальных 2'-F-модифицированных
РНК-аптамеров геометрическими фигурами выделены их гомологичные участки,
полученные отдельно для клонов каждой фракции .
Таблица
7. Нуклеотидная последовательность индивидуальных 2'-F-модифицированных
РНК-аптамеров фракций I, II и III
|
2'-F-РНК
|
Нуклеотидная последовательность
|
|
Фракция I
аптамер 1
|
5'-CAGACGACUCGCGCGAGUCGUCUGCACGGUAGCGAGGUGCUCUCAUUGGGAA GUUGGGUUGAGACCGCAUCGUCCUCCC- 3'
|
|
Фракция I аптамер 2
|
5'-CAGACGACUCGCGCGAGUCGUCUGGCCACGGAGUUUAGGUUCCAUGUUUCCG
CUGUAUGACGAUCCGCAUCGUCCUCCC- 3'
|
|
Фракция I аптамер 3
|
5'-CAGACGACUCGCGCGAGUCGUCUGGGCAGCACCCGAACGAGAGCGCGAGACU GAGGAUUGCCCUCCGCAUCGUCCUCCC- 3'
|
|
Фракция I аптамер 4
|
5'-CAGACGACUCGCGCGAGUCGUCUGGCGGCAGGAUCAGGAAUUGAUUAGAAG
UUCUUACUCCGUUCCGCAUCGUCCUCCC- 3'
|
|
Фракция II аптамер 1
|
5'-CAGACGACUCGCGCGAGUCGUCUGGCACGGGCAGGGGAUACGAGUGACGUUG
GCGUCAACACUACCGCAUCGUCCUCCC- 3'
|
|
Фракция II аптамер 2
|
5'-CAGACGACUCGCGCGAGUCGUCUGCAGGGGAGAGGAUAAUGUUCAGCUAGA
CCGGGCUUCAAUCCCGCAUCGUCCUCCC- 3'
|
|
Фракция II аптамер 3
|
5'-CAGACGACUCGCGCGAGUCGUCUGUGGGUAAACGAGGGUGGGGCAGAGAUG
UACUCAGAAAACACCGCAUCGUCCUCCC- 3'
|
|
Фракция II аптамер 4
|
5'-CAGACGACUCGCGCGAGUCGUCUGCACGAUAGUGGUGAGGCCGGGGCAUGUG
UGGGUAUGCUUAACCGCAUCGUCCUCCC- 3'
|
|
Фракция II аптамер 5
|
5'-CAGACGACUCGCGCGAGUCGUCUGCAGGGUGAACAAGGGUGGGGCAGAGAU
GUACUCAGAAAACACCGCAUCGUCCUCCC- 3'
|
|
Фракция III
аптамер 1
|
5'-CAGACGACUCGCGCGAGUCGUCUGGGCAUAAUGAGCCACAGGUUGGAAGUAU
UGCUUCACUUGGCCGCAUCGUCCUCCC- 3'
|
|
Фракция III аптамер
2
|
5'-CAGACGACUCGCGCGAGUCGUCUGGCUCGAGCUAGGCUGUGCAUUCGCAACC
ACUCACAUCGAACCGCAUCGUCCUCCC- 3'
|
|
Фракция III
аптамер 3
|
5'-CAGACGACUCGCGCGAGUCGUCUGGGCACGCGGAAAGACGACGAGCCGUGGC
AUCGUAGCUCAACCGCAUCGUCCUCCC- 3'
|
|
Фракция III
аптамер 4
|
5'-CAGACGACUCGCGCGAGUCGUCUGGGGAGGGGAGUAGCUUUUCCGAUGGAG
ACUGAAUGCUCCACCGCAUCGUCCUCCC- 3'
|
|
Фракция III
аптамер 5
|
5'-CAGACGACUCGCGCGAGUCGUCUGGCGGGGGCCGCGGCAGGCAUGAACGAUG
CAACUCAUCAGACCGCAUCGUCCUCCC- 3'
|
|
Фракция III
аптамер 6
|
5'-CAGACGACUCGCGCGAGUCGUCUGCGGGUAAACAAGGGUGGGGCAGAGAUG
UACUCAGAAAACACCGCAUCGUCCUCCC- 3'
|
Цветами отмечены: … -
5'-константный участок РНК-библиотеки, … -
3'-константный участок РНК-библиотеки, … - 40N-участок РНК-библиотеки, N - 2'-F-модифицированные
пиримидиновые нуклеотиды.
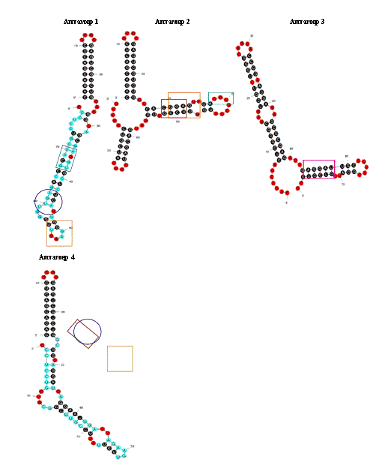
Рис. 26. Вторичные структуры 2'-F- модифицированных РНК-аптамеров фракции I, полученные компьютерным моделированием в программном пакете
mfold version 2.3. Условия моделирования:
22°C, 1М NaCl. Аптамер 1 dG = -38,99 ккал/моль, аптамер 2 dG = -38,54 ккал/моль, аптамер 3 dG = -43,59 ккал/моль, аптамер 4 dG = -41,08 ккал/моль.
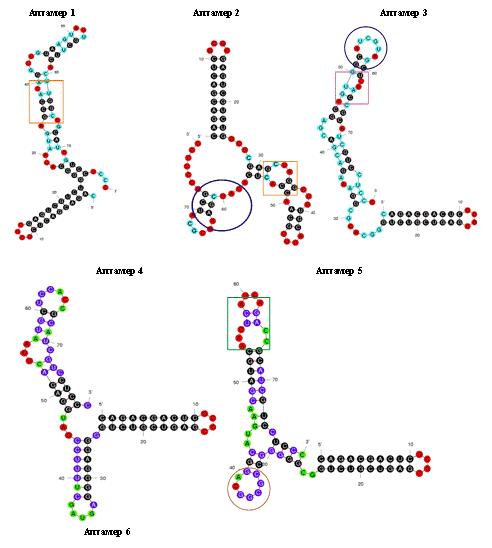
Рис. 27. Вторичные структуры 2'-F-модифицированных РНК-аптамеров фракции II, полученные в программном пакете mfold version 2.3. Условия моделирования: 22°C, 1М NaCl. Аптамер 1 dG = -42,43 ккал/моль, аптамер 2 dG = -41,17 ккал/моль, аптамер 3 dG = -40,75 ккал/моль, аптамер 4 dG = -42,03 ккал/моль, аптамер 5 dG = -36,37 ккал/моль.
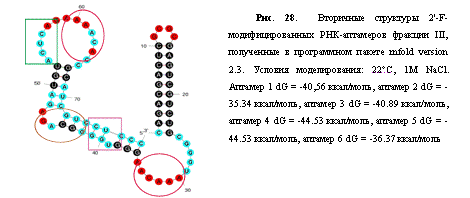
Таблица 8. Цветовая схема вероятности
нахождения нуклеотидной последовательности в одноцепочечном состоянии.

Как видно из рис. 26, 27, 28, все клоны обладают сложной вторичной
структурой, что коррелирует с литературными данными. Среди представленных
клонов встречаются олигонуклеотиды, обладающие схожей вторичной структурой:
фракция I, клон 2 и фракция III, клон 4, обладающие сходной
нуклеотидной последовательностью; фракция II, клон 5 и фракция III, клон 6, обладающие сходной нуклеотидной последовательностью; фракция I, клоны 3 и 4, не обладающие
сходством нуклеотидной последовательности. Полученный результат свидетельствует
о том, что, в случае клона 5, фракция II и клона 6, фракция III,
введение одного нуклеотида и замена одного нуклеотида в последовательности
привели к изменению сродства 2'-F-РНК
к мишени. Это дает возможность предположить, что участок вышеуказанных
изменений (петля с 25 по 37 нт) играет роль в связывании поликлональных
аутоантител человека, больного РС.
Для определения участков, важных для связывания аутоантител, гомологичные
участки, полученные отдельно для клонов каждой фракции, были выделены на
вторичных структурах 2'-F-модифицированных
РНК-аптамеров. При этом было выявлено, что часть полученных гомологичных
участков формирует схожие вторичные структуры в разных 2'-F-модифицированных РНК-аптамерах. Это
позволяет предположить, что данные гомологичные участки участвуют в связывании
поликлональных аутоантител человека, больного РС.
Таким образом, в данной работе впервые показана возможность получения 2'-F-пиримидинсодержащих РНК-аптамеров,
обладающих ингибирующей активностью по отношению к поликлональным аутоантителам
человека, больного рассеянным склерозом. В дальнейшем предполагается
синтезировать индивидуальные 2'-F-пиримидинсодержащие
РНК-аптамеры и изучить их мишень-связывающие и ингибирующие свойства, с целью
использования в будущем в качестве основы для создания перспективных средств
диагностики и лечения рассеянного склероза.
Выводы
. Оптимизирована и апробирована методика отбора 2'-F-модифицированных РНК-аптамеров к
поликлональным аутоантителам, вырабатываемым организмом человека при рассеянном
склерозе. Показано, что предложенная методика позволяет проводить обогащение
комбинаторной 2'-F-модифицированной
РНК-библиотеки последовательностями, обладающими повышенным сродством к
патогенным антителам.
. Исследовано влияние 2'-F-пиримидинсодержащей
РНК-библиотеки после 10-го раунда SELEX на протеазную активность аутоантител. Показано, что 2'-F-модифицированная РНК-библиотека
после 10-го раунда отбора ингибирует деградацию ОБМ аутоантителами.
. Проведено хроматографическое разделение 2'-F-модифицированной РНК-библиотеки после 10-го раунда SELEX на фракции по сродству к
поликлональным аутоантителам. Показано, что каждая фракция 2'-F-пиримидинсодержащей РНК-библиотеки
ингибирует протеазную активность аутоантител.
. Проведено клонирование и секвенирование полученных фракций 2'-F-пиримидинсодержащей РНК-библиотеки.
Проведен анализ нуклеотидных последовательностей полученных индивидуальных 2'-F-модифицированных РНК-аптамеров.
Показано, что полученные РНК-аптамеры обладают гомологичными нуклеотидными
последовательностями. Компьютерное моделирование вторичной структуры
индивидуальных 2'-F-модифицированных
РНК-аптамеров показало, что все они обладают сложной вторичной структурой.
Найдены гомологичные участки, обладающие схожей вторичной структурой.
Работа поддержана грантом Мэрии г. Новосибирска молодым ученым (№ 29-08,
2008-2009) и ГК ФАНИ № 02.522.12.2005.
Автор благодарит за помощь в выполнении данной работы к.х.н. Фокину А.А.,
д.х.н., проф. Невинского Г.А., асп. Безуглову А.М., д.б.н. Жаркова Д.О. и ЦКП
“Секвенирование ДНК” СО РАН.
Полученные результаты вошли в следующие публикации
. Тиванова А.С., Фокина А.А., Безуглова А.М., Невинский Г.А.,
Веньяминова А.Г. Аптамеры как перспективные инструменты бионанотехнологии для
лечения и диагностики рассеянного склероза. Тезисы. Сборник тезисов научной
конференции "Химическая биология - Фундаментальные проблемы бионанотехнологии"
(г. Новосибирск, Россия, 10-14 июня 2009 г). С. 96.
. Фокина А.А., Тиванова А.С., Безуглова А.М., Невинский Г.А.,
Веньяминова А.Г. Аптамеры как потенциальные средства диагностики и лечения
рассеянного склероза. Тезисы. Сборник тезисов научной конференции
"Медицинская геномика и протеомика" (г. Новосибирск, Россия, 9-13
сентября 2009 г). С. 108.
. Тиванова А.С., Фокина А.А., Безуглова А.М. Аптамеры как
перспективные средства доставки и лечения рассеянного склероза. Тезисы. Сборник
тезисов научной конференции “Санкт-Петербургские научные чтения-2009” (г.
Санкт-Петербург, Россия, 2-4 декабря 2009 г.). С. 123.
. Тиванова А.С., Безуглова А.М., Фокина А.А., Невинский Г.А.,
Веньяминова А.Г. Аптамеры как перспективные средства бионанотехнологии для диагностики
и лечения рассеянного склероза. Тезисы докладов и стендовых сообщений. XXII зимняя молодежная научная школа
"Перспективные направления физико-химической биологии и
биотехнологии" (г. Москва, Россия, 8-11 февраля 2010 г.). С.120.
. Тиванова А.С., Безуглова А.М., Фокина А.А. Аптамеры как
потенциальные средства диагностики и лечения рассеянного склероза. Материалы XLVIII Международной научной студенческой
конференции "Студент и научно-технический прогресс". Химия. (10-14
апреля 2010 г., Новосибирск). С.101.
. Тиванова А.С., Безуглова А.М., Фокина А.А. РНК-аптамеры как
перспективные средства диагностики и лечения рассеянного склероза. Материалы
Международного молодежного научного форума "Ломоносов-2010"/ Отв.
Ред. И.А. Алешковский, П.Н. Костылев, А.И. Андреев, А.В. Андриянов. - М.: МАКС
Пресс, 2010. (ISBN 978-5-317-03197-8) Номер статьи
58.980.15870.
Список литературы
1. Hoppe-Seyler,
F., Butz, K. Peptide aptamers: powerful new tools for molecular medicine // J.
Mol. Med. - 2000. - V. 78. - N 8. - P. 426-430.
. Stoltenburg,
R., Reinemann, C., Strehlitz, B. SELEX - a (r)evolutionary method to generate
high-affinity nucleic acid ligands // Biomol. Eng. - 2007. - V. 24. - N 4. - P.
381-403.
. Nucleic
Acid and Peptide Aptamers: Methods and Protocols // Methods in Molecular
Biology / Ed. G. Mayer. - University of Bonn, Germany: Humana Press, 2009. - V.
535. 408 p.
. Ellington,
A.D., Szostak, J.W. In vitro selection of RNA molecules that bind specific
ligands // Nature. - 1990. - V. 346. - N 6287. - P. 818-822.
. Tuerk,
C., Gold, L. Systematic evolution of ligands by exponential enrichment: RNA
ligands to bacteriophage T4 DNA polymerase // Science. - 1990. - V. 249. - N
4968. - P. 505-510.
. Yang,
Y., Yang, D., Schluesener, H.J., Zhang, Z. Advances in SELEX and application of
aptamers in the central nervous system // Biomol. Eng. - 2007. - V. 24. - N 6.
- P. 583-592.
. Gopinath,
S.C. Methods developed for SELEX // Anal. Bioanal. Chem. - 2007. - V. 387. - N
1. - P. 171-182.
8. Кульбачинский,
А.В. Методы отбора аптамеров к белковым мишеням // Усп. Биол. химии. - 2006. - Т. 46. - С. 193-224.
. Berezovski,
M., Musheev, M., Drabovich, A., Krylov, S.N. Non-SELEX selection of aptamers //
J. Am. Chem. Soc. - 2006. - V. 128. - N 5. - P. 1410-1411.
. Ciesiolka,
J., Gorski, J., Yarus, M. Selection of an RNA domain that binds Zn2+ // RNA. -
1995. - V. 1. - N 5. - P. 538-550.
. Mann,
D., Reinemann, C., Stoltenburg, R., Strehlitz, B. In vitro selection of DNA
aptamers binding ethanolamine // Biochem. Biophys. Res. Commun. - 2005. - V.
338. - N 4. - P. 1928-1934.
. Duconge,
F., Toulme, J.J. In vitro selection identifies key determinants for loop-loop
interactions: RNA aptamers selective for the TAR RNA element of HIV-1 // RNA. -
1999. - V. 5. - N 12. - P. 1605-1614.
. Mendonsa,
S.D., Bowser, M.T. In vitro selection of high-affinity DNA ligands for human
IgE using capillary electrophoresis // Anal. Chem. - 2004. - V. 76. - N 18. -
P. 5387-5392.
. Kubik,
M.F., Stephens, A.W., Schneider, D., Marlar, R.A., Tasset, D. High-affinity RNA
ligands to human alpha-thrombin // Nucleic Acids Res. - 1994. - V. 22. - N 13.
- P. 2619-2626.
. Beinoraviciute-Kellner,
R., Lipps, G., Krauss, G. In vitro selection of DNA binding sites for ABF1
protein from Saccharomyces cerevisiae // FEBS Lett. - 2005. - V. 579. - N 20. -
P. 4535-4540.
. Missailidis,
S., Thomaidou, D., Borbas, K.E., Price, M.R. Selection of aptamers with high
affinity and high specificity against C595, an anti-MUC1 IgG3 monoclonal
antibody, for antibody targeting // J. Immunol. Methods. - 2005. - V. 296. - N
1-2. - P. 45-62.
. Kim,
Y.M., Choi, K.H., Jang, Y.J., Yu, J., Jeong, S. Specific modulation of the
anti-DNA autoantibody-nucleic acids interaction by the high affinity RNA
aptamer // Biochem. Biophys. Res. Commun. - 2003. - V. 300. - N 2. - P.
516-523.
. Daniels,
D.A., Chen, H., Hicke, B.J., Swiderek, K.M., Gold, L. A tenascin-C aptamer
identified by tumor cell SELEX: systematic evolution of ligands by exponential
enrichment // Proc. Natl. Acad. Sci. U. S. A. - 2003. - V. 100. - N 26. - P.
15416-15421.
. Chen,
F., Zhou, J., Luo, F., Mohammed, A.B., Zhang, X.L. Aptamer from whole-bacterium
SELEX as new therapeutic reagent against virulent Mycobacterium tuberculosis //
Biochem. Biophys. Res. Commun. - 2007. - V. 357. - N 3. - P. 743-748.
. Famulok,
M., Hartig, J.S., Mayer, G. Functional aptamers and aptazymes in biotechnology,
diagnostics, and therapy // Chem. Rev. - 2007. - V. 107. - N 9. - P. 3715-3743.
. Tombelli,
S., Minunni, M., Mascini, M. Analytical applications of aptamers // Biosens.
Bioelectron. - 2005. - V. 20. - N 12. - P. 2424-2434.
. Tombelli,
S., Minunni, M., Mascini, M. Aptamers-based assays for diagnostics,
environmental and food analysis // Biomol. Eng. - 2007. - V. 24. - N 2. - P.
191-200.
. Yan,
A.C., Levy, M. Aptamers and aptamer targeted delivery // RNA Biol. - 2009. - V.
6. - N 3. - P. 316-320.
. Nimjee,
S.M., Rusconi, C.P., Harrington, R.A., Sullenger, B.A. The potential of
aptamers as anticoagulants // Trends. Cardiovasc. Med. - 2005. - V. 15. - N 1.
- P. 41-45.
. Nimjee,
S.M., Rusconi, C.P., Sullenger, B.A. Aptamers: an emerging class of
therapeutics // Annu. Rev. Med. - 2005. - V. 56. - P. 555-583.
. Thiel,
K.W., Giangrande, P.H. Therapeutic applications of DNA and RNA aptamers //
Oligonucleotides. - 2009. - V. 19. - N 3. - P. 209-222.
27. Гусев,
Е.И., Демина, Т.Л., Бойко, А.Н. Рассеянный склероз. - М.: Нефть и газ, - 1997.
- С. 2.
28. Ponomarenko,
N.A., Durova, O.M., Vorobiev, II, Aleksandrova, E.S., Telegin, G.B.,
Chamborant, O.G., Sidorik, L.L., Suchkov, S.V., Alekberova, Z.S., Gnuchev,
N.V., Gabibov, A.G. Catalytic antibodies in clinical and experimental
pathology: human and mouse models // J. Immunol. Methods. - 2002. - V. 269. - N
1-2. - P. 197-211.
. Saveliev,
A.N., Ivanen, D.R., Kulminskaya, A.A., Ershova, N.A., Kanyshkova, T.G., Buneva,
V.N., Mogelnitskii, A.S., Doronin, B.M., Favorova, O.O., Nevinsky, G.A.,
Neustroev, K.N. Amylolytic activity of IgM and IgG antibodies from patients
with multiple sclerosis // Immunol. Lett. - 2003. - V. 86. - N 3. - P. 291-297.
. Jayasena,
S.D. Aptamers: an emerging class of molecules that rival antibodies in
diagnostics // Clin. Chem. - 1999. - V. 45. - N 9. - P. 1628-1650.
. Cox,
J.C., Rudolph, P., Ellington, A.D. Automated RNA selection // Biotechnol. Prog.
- 1998. - V. 14. - N 6. - P. 845-850.
. Andreola,
M.L., Pileur, F., Calmels, C., Ventura, M., Tarrago-Litvak, L., Toulme, J.J.,
Litvak, S. DNA aptamers selected against the HIV-1 RNase H display in vitro
antiviral activity // Biochemistry. - 2001. - V. 40. - N 34. - P. 10087-10094.
. Chauveau,
F., Aissouni, Y., Hamm, J., Boutin, H., Libri, D., Duconge, F., Tavitian, B.
Binding of an aptamer to the N-terminal fragment of VCAM-1 // Bioorg. Med.
Chem. Lett. - 2007. - V. 17. - N 22. - P. 6119-6122.
. Kim,
S.J., Kim, M.Y., Lee, J.H., You, J.C., Jeong, S. Selection and stabilization of
the RNA aptamers against the human immunodeficiency virus type-1 nucleocapsid
protein // Biochem. Biophys. Res. Commun. - 2002. - V. 291. - N 4. - P.
925-931.
. White,
R., Rusconi, C., Scardino, E., Wolberg, A., Lawson, J., Hoffman, M., Sullenger,
B. Generation of species cross-reactive aptamers using "toggle" SELEX
// Mol. Ther. - 2001. - V. 4. - N 6. - P. 567-573.
. Hamm,
J. Characterisation of antibody-binding RNAs selected from structurally
constrained libraries // Nucleic Acids Res. - 1996. - V. 24. - N 12. - P.
2220-2227.
. Shtatland,
T., Gill, S.C., Javornik, B.E., Johansson, H.E., Singer, B.S., Uhlenbeck, O.C.,
Zichi, D.A., Gold, L. Interactions of Escherichia coli RNA with bacteriophage
MS2 coat protein: genomic SELEX // Nucleic Acids Res. - 2000. - V. 28. - N 21.
- e93.
. Jarosch,
F., Buchner, K., Klussmann, S. In vitro selection using a dual RNA library that
allows primerless selection // Nucleic Acids Res. - 2006. - V. 34. - N 12. -
e86.
. Vater,
A., Jarosch, F., Buchner, K., Klussmann, S. Short bioactive Spiegelmers to
migraine-associated calcitonin gene-related peptide rapidly identified by a
novel approach: tailored-SELEX // Nucleic Acids Res. - 2003. - V. 31. - N 21. -
e130.
. Naimuddin,
M., Kitamura, K., Kinoshita, Y., Honda-Takahashi, Y., Murakami, M., Ito, M.,
Yamamoto, K., Hanada, K., Husimi, Y., Nishigaki, K. Selection-by-function:
efficient enrichment of cathepsin E inhibitors from a DNA library // J. Mol.
Recognit. - 2007. - V. 20. - N 1. - P. 58-68.
. Jensen,
K.B., Atkinson, B.L., Willis, M.C., Koch, T.H., Gold, L. Using in vitro
selection to direct the covalent attachment of human immunodeficiency virus
type 1 Rev protein to high-affinity RNA ligands // Proc. Natl. Acad. Sci. U. S.
A. - 1995. - V. 92. - N 26. - P. 12220-12224.
. Tasset,
D.M., Kubik, M.F., Steiner, W. Oligonucleotide inhibitors of human thrombin
that bind distinct epitopes // J. Mol. Biol. - 1997. - V. 272. - N 5. - P.
688-698.
. Ohuchi,
S.P., Ohtsu, T., Nakamura, Y. Selection of RNA aptamers against recombinant
transforming growth factor-beta type III receptor displayed on cell surface //
Biochimie. - 2006. - V. 88. - N 7. - P. 897-904.
. Tsai,
R.Y., Reed, R.R. Identification of DNA recognition sequences and protein
interaction domains of the multiple-Zn-finger protein Roaz // Mol. Cell. Biol.
- 1998. - V. 18. - N 11. - P. 6447-6456.
. Green,
L.S., Jellinek, D., Jenison, R., Ostman, A., Heldin, C.H., Janjic, N.
Inhibitory DNA ligands to platelet-derived growth factor B-chain //
Biochemistry. - 1996. - V. 35. - N 45. - P. 14413-14424.
. Mendonsa,
S.D., Bowser, M.T. In vitro evolution of functional DNA using capillary
electrophoresis // J. Am. Chem. Soc. - 2004. - V. 126. - N 1. - P. 20-21.
. Stoltenburg,
R., Reinemann, C., Strehlitz, B. FluMag-SELEX as an advantageous method for DNA
aptamer selection // Anal. Bioanal. Chem. - 2005. - V. 383. - N 1. - P. 83-91.
. Miyakawa,
S., Nomura, Y., Sakamoto, T., Yamaguchi, Y., Kato, K., Yamazaki, S., Nakamura,
Y. Structural and molecular basis for hyperspecificity of RNA aptamer to human
immunoglobulin G // RNA. - 2008. - V. 14. - N 6. - P. 1154-1163.
. Shum,
K.T., Tanner, J.A. Differential inhibitory activities and stabilisation of DNA
aptamers against the SARS coronavirus helicase // Chembiochem. - 2008. - V. 9.
- N 18. - P. 3037-3045.
. Missailidis,
S. Targeting of antibodies using aptamers // Methods Mol. Biol. - 2004. - V.
248. - P. 547-555.
. Daniels,
D.A., Sohal, A.K., Rees, S., Grisshammer, R. Generation of RNA aptamers to the
G-protein-coupled receptor for neurotensin, NTS-1 // Anal. Biochem. - 2002. -
V. 305. - N 2. - P. 214-226.
. Chen,
S.S., Yang, Y.M., Barankiewicz, T.J. Selection of IgE-binding aptameric green
fluorescent protein (Ap-GFP) by the ribosome display (RD) platform // Biochem.
Biophys. Res. Commun. - 2008. - V. 374. - N 3. - P. 409-414.
. Murphy,
M.B., Fuller, S.T., Richardson, P.M., Doyle, S.A. An improved method for the in
vitro evolution of aptamers and applications in protein detection and
purification // Nucleic Acids Res. - 2003. - V. 31. - N 18. - e110.
. Fitzwater,
T., Polisky, B. A SELEX primer // Methods Enzymol. - 1996. - V. 267. - P.
275-301.
. Binkley,
J., Allen, P., Brown, D.M., Green, L., Tuerk, C., Gold, L. RNA ligands to human
nerve growth factor // Nucleic Acids Res. - 1995. - V. 23. - N 16. - P.
3198-3205.
. Yoshida,
Y., Sakai, N., Masuda, H., Furuichi, M., Nishikawa, F., Nishikawa, S., Mizuno,
H., Waga, I. Rabbit antibody detection with RNA aptamers // Anal. Biochem. -
2008. - V. 375. - N 2. - P. 217-222.
. Sakai,
N., Masuda, H., Akitomi, J., Yagi, H., Yoshida, Y., Horii, K., Furuichi, M.,
Waga, I. RNA aptamers specifically interact with the Fc region of mouse
immunoglobulin G // Nucleic Acids Symp. Ser. (Oxf). - 2008. - N 52. - P.
487-488.
. Cox,
J.C., Hayhurst, A., Hesselberth, J., Bayer, T.S., Georgiou, G., Ellington, A.D.
Automated selection of aptamers against protein targets translated in vitro:
from gene to aptamer // Nucleic Acids Res. - 2002. - V. 30. - N 20. - e108.
. Hwang,
B., Lee, S.W. Improvement of RNA aptamer activity against myasthenic
autoantibodies by extended sequence selection // Biochem. Biophys. Res. Commun.
- 2002. - V. 290. - N 2. - P. 656-662.
. Mosing,
R.K., Bowser, M.T. Isolating aptamers using capillary electrophoresis-SELEX
(CE-SELEX) // Methods Mol. Biol. - 2009. - V. 535. - P. 33-43.
. Morris,
K.N., Jensen, K.B., Julin, C.M., Weil, M., Gold, L. High affinity ligands from
in vitro selection: complex targets // Proc. Natl. Acad. Sci. U. S. A. - 1998.
- V. 95. - N 6. - P. 2902-2907.
. Stoltenburg,
R., Reinemann, C., Strehlitz, B. FluMag-SELEX as an advantageous method for DNA
aptamer selection // Anal. Bioanal. Chem. - 2005. - V. 383. - N 1. - P. 83-91.
. Williams,
K.P., Bartel, D.P. PCR product with strands of unequal length // Nucleic Acids
Res. - 1995. - V. 23. - N 20. - P. 4220-4221.
. Walder,
R.Y., Hayes, J.R., Walder, J.A. Use of PCR primers containing a 3'-terminal
ribose residue to prevent cross-contamination of amplified sequences // Nucleic
Acids Res. - 1993. - V. 21. - N 18. - P. 4339-4343.
. Fitter,
S., James, R. Deconvolution of a complex target using DNA aptamers // J. Biol.
Chem. - 2005. - V. 280. - N 40. - P. 34193-34201.
. Keefe,
A.D., Cload, S.T. SELEX with modified nucleotides // Curr. Opin. Chem. Biol. -
2008. - V. 12. - N 4. - P. 448-456.
. Ruckman,
J., Green, L.S., Beeson, J., Waugh, S., Gillette, W.L., Henninger, D.D.,
Claesson-Welsh, L., Janjic, N. 2'-Fluoropyrimidine RNA-based aptamers to the
165-amino acid form of vascular endothelial growth factor (VEGF165). Inhibition
of receptor binding and VEGF-induced vascular permeability through interactions
requiring the exon 7-encoded domain // J. Biol. Chem. - 1998. - V. 273. - N 32.
- P. 20556-20567.
. Kang,
J., Lee, M.S., Watowich, S.J., Gorenstein, D.G. Combinatorial selection of a
RNA thioaptamer that binds to Venezuelan equine encephalitis virus capsid
protein // FEBS Lett. - 2007. - V. 581. - N 13. - P. 2497-2502.
. Bonifacio,
L., Church, F.C., Jarstfer, M.B. Effect of locked-nucleic Acid on a
biologically active g-quadruplex. A structure-activity relationship of the
thrombin aptamer // Int. J. Mol. Sci. - 2008. - V. 9. - N 3. - P. 422-433.
. Latham,
J.A., Johnson, R., Toole, J.J. The application of a modified nucleotide in
aptamer selection: novel thrombin aptamers containing
5-(1-pentynyl)-2'-deoxyuridine // Nucleic Acids Res. - 1994. - V. 22. - N 14. -
P. 2817-2822.
. Vaish,
N.K., Larralde, R., Fraley, A.W., Szostak, J.W., McLaughlin, L.W. A novel,
modification-dependent ATP-binding aptamer selected from an RNA library
incorporating a cationic functionality // Biochemistry. - 2003. - V. 42. - N
29. - P. 8842-8851.
. Koch,
T.H., Smith, D., Tabacman, E., Zichi, D.A. Kinetic analysis of site-specific
photoaptamer-protein cross-linking // J. Mol. Biol. - 2004. - V. 336. - N 5. -
P. 1159-1173.
. Jager,
S., Rasched, G., Kornreich-Leshem, H., Engeser, M., Thum, O., Famulok, M. A
versatile toolbox for variable DNA functionalization at high density // J. Am.
Chem. Soc. - 2005. - V. 127. - N 43. - P. 15071-15082.
. Lin,
Y., Qiu, Q., Gill, S.C., Jayasena, S.D. Modified RNA sequence pools for in
vitro selection // Nucleic Acids Res. - 1994. - V. 22. - N 24. - P. 5229-5234.
. Aurup,
H., Tuschl, T., Benseler, F., Ludwig, J., Eckstein, F. Oligonucleotide duplexes
containing 2'-amino-2'-deoxycytidines: thermal stability and chemical
reactivity // Nucleic Acids Res. - 1994. - V. 22. - N 1. - P. 20-24.
. Burmeister,
P.E., Lewis, S.D., Silva, R.F., Preiss, J.R., Horwitz, L.R., Pendergrast, P.S.,
McCauley, T.G., Kurz, J.C., Epstein, D.M., Wilson, C., Keefe, A.D. Direct in
vitro selection of a 2'-O-methyl aptamer to VEGF // Chem. Biol. - 2005. - V.
12. - N 1. - P. 25-33.
. Behlke,
M.A. Chemical modification of siRNAs for in vivo use // Oligonucleotides. -
2008. - V. 18. - N 4. - P. 305-319.
. Tanaka,
K.A., Szlam, F., Rusconi, C.P., Levy, J.H. In-vitro evaluation of anti-factor
IXa aptamer on thrombin generation, clotting time, and viscoelastometry //
Thromb. Haemost. - 2009. - V. 101. - N 5. - P. 827-833.
. Schmidt,
K.S., Borkowski, S., Kurreck, J., Stephens, A.W., Bald, R., Hecht, M., Friebe,
M., Dinkelborg, L., Erdmann, V.A. Application of locked nucleic acids to
improve aptamer in vivo stability and targeting function // Nucleic Acids Res.
- 2004. - V. 32. - N 19. - P. 5757-5765.
. Takahashi,
M., Minakawa, N., Matsuda, A. Synthesis and properties of
2'-modified-4'-thioRNA // Nucleic Acids Symp. Ser. (Oxf). - 2008. - N 52. - P.
327-328.
. Kato,
Y., Minakawa, N., Komatsu, Y., Kamiya, H., Ogawa, N., Harashima, H., Matsuda,
A. New NTP analogs: the synthesis of 4'-thioUTP and 4'-thioCTP and their
utility for SELEX // Nucleic Acids Res. - 2005. - V. 33. - N 9. - P. 2942-2951.
. Lato,
S.M., Ozerova, N.D., He, K., Sergueeva, Z., Shaw, B.R., Burke, D.H.
Boron-containing aptamers to ATP // Nucleic Acids Res. - 2002. - V. 30. - N 6.
- P. 1401-1407.
. Porter,
K.W., Briley, J.D., Shaw, B.R. Direct PCR sequencing with boronated nucleotides
// Nucleic Acids Res. - 1997. - V. 25. - N 8. - P. 1611-1617.
. Andreola,
M.L., Calmels, C., Michel, J., Toulme, J.J., Litvak, S. Towards the selection
of phosphorothioate aptamers optimizing in vitro selection steps with
phosphorothioate nucleotides // Eur. J. Biochem. - 2000. - V. 267. - N 16. - P.
5032-5040.
. Kang,
Y., Feng, K.J., Chen, J.W., Jiang, J.H., Shen, G.L., Yu, R.Q. Electrochemical
detection of thrombin by sandwich approach using antibody and aptamer //
Bioelectrochemistry. - 2008. - V. 73. - N 1. - P. 76-81.
. Bozza,
M., Sheardy, R.D., Dilone, E., Scypinski, S., Galazka, M. Characterization of
the secondary structure and stability of an RNA aptamer that binds vascular
endothelial growth factor // Biochemistry. - 2006. - V. 45. - N 24. - P.
7639-7643.
. Chen,
C.H., Dellamaggiore, K.R., Ouellette, C.P., Sedano, C.D., Lizadjohry, M.,
Chernis, G.A., Gonzales, M., Baltasar, F.E., Fan, A.L., Myerowitz, R., Neufeld,
E.F. Aptamer-based endocytosis of a lysosomal enzyme // Proc. Natl. Acad. Sci.
U. S. A. - 2008. - V. 105. - N 41. - P. 15908-15913.
. Martino,
L., Virno, A., Randazzo, A., Virgilio, A., Esposito, V., Giancola, C., Bucci,
M., Cirino, G., Mayol, L. A new modified thrombin binding aptamer containing a
5'-5' inversion of polarity site // Nucleic Acids Res. - 2006. - V. 34. - N 22.
- P. 6653-6662.
. www.ebi.ac.uk/Tools/clustalw2
. Fitting
a mixture model by expectation maximization to discover motifs in biopolymers,
Menlo Park, 1994.: Second International Conference on Intelligent Systems for
Molecular Biology. - Menlo Park, California: AAAI Press, 1994. - P. 28-36.
. Wang,
Y., Khaing, Z.Z., Li, N., Hall, B., Schmidt, C.E., Ellington, A.D. Aptamer
antagonists of myelin-derived inhibitors promote axon growth // PLoS One. -
2010. - V. 5. - N 3. - e9726.
. Zuker,
M. Mfold web server for nucleic acid folding and hybridization prediction //
Nucleic Acids Res. - 2003. - V. 31. - N 13. - P. 3406-3415.
. Kim,
M.Y., Jeong, S. RNA aptamers that bind the nucleocapsid protein contain
pseudoknots // Mol. Cells. - 2003. - V. 16. - N 3. - P. 413-417.
. Peng,
C.G., Damha, M.J. G-quadruplex induced stabilization by
2'-deoxy-2'-fluoro-D-arabinonucleic acids (2'F-ANA) // Nucleic Acids Res. -
2007. - V. 35. - N 15. - P. 4977-4988.
. Montesarchio,
D. G-quadruplex forming oligonucleotides as finely tunable aptamers: towards
better DNA mimics // Nucleic Acids Symp. Ser. (Oxf). - 2008. - N 52. - P. 9-10.
. Matsugami,
A., Mashima, T., Nishikawa, F., Murakami, K., Nishikawa, S., Noda, K.,
Yokoyama, T., Katahira, M. Structural analysis of r(GGA)4 found in RNA aptamer
for bovine prion protein // Nucleic Acids Symp. Ser. (Oxf). - 2008. - N 52. -
P. 179-180.
. Cui,
Y., Rajasethupathy, P., Hess, G.P. Selection of stable RNA molecules that can
regulate the channel-opening equilibrium of the membrane-bound
gamma-aminobutyric acid receptor // Biochemistry. - 2004. - V. 43. - N 51. - P.
16442-16449.
. Dollins,
C.M., Nair, S., Boczkowski, D., Lee, J., Layzer, J.M., Gilboa, E., Sullenger,
B.A. Assembling OX40 aptamers on a molecular scaffold to create a
receptor-activating aptamer // Chem. Biol. - 2008. - V. 15. - N 7. - P.
675-682.
. Sakamoto,
T., Oguro, A., Kawai, G., Ohtsu, T., Nakamura, Y. NMR structures of double
loops of an RNA aptamer against mammalian initiation factor 4A // Nucleic Acids
Res. - 2005. - V. 33. - N 2. - P. 745-754.
. Forster,
C., Brauer, A.B., Brode, S., Schmidt, K.S., Perbandt, M., Meyer, A.,
Rypniewski, W., Betzel, C., Kurreck, J., Furste, J.P., Erdmann, V.A.
Comparative crystallization and preliminary X-ray diffraction studies of locked
nucleic acid and RNA stems of a tenascin C-binding aptamer // Acta.
Crystallogr. Sect. F. Struct. Biol. Cryst. Commun. - 2006. - V. 62. - Pt 7. -
P. 665-668.
. Xiao,
Y., Lubin, A.A., Heeger, A.J., Plaxco, K.W. Label-free electronic detection of
thrombin in blood serum by using an aptamer-based sensor // Angew. Chem. Int.
Ed. Engl. - 2005. - V. 44. - N 34. - P. 5456-5459.
. Kirby,
R., Cho, E.J., Gehrke, B., Bayer, T., Park, Y.S., Neikirk, D.P., McDevitt,
J.T., Ellington, A.D. Aptamer-based sensor arrays for the detection and
quantitation of proteins // Anal. Chem. - 2004. - V. 76. - N 14. - P.
4066-4075.
. Rajendran,
M., Ellington, A.D. Selecting nucleic acids for biosensor applications // Comb.
Chem. High Throughput Screen. - 2002. - V. 5. - N 4. - P. 263-270.
. Zhao,
Q., Li, X.F., Le, X.C. Aptamer-modified monolithic capillary chromatography for
protein separation and detection // Anal. Chem. - 2008. - V. 80. - N 10. - P.
3915-3920.
. Clark,
S.L., Remcho, V.T. Aptamers as analytical reagents // Electrophoresis. - 2002.
- V. 23. - N 9. - P. 1335-1340.
. Thomas,
M., Chedin, S., Carles, C., Riva, M., Famulok, M., Sentenac, A. Selective
targeting and inhibition of yeast RNA polymerase II by RNA aptamers // J. Biol.
Chem. - 1997. - V. 272. - N 44. - P. 27980-27986.
. Sevilimedu,
A., Shi, H., Lis, J.T. TFIIB aptamers inhibit transcription by perturbing PIC
formation at distinct stages // Nucleic Acids Res. - 2008. - V. 36. - N 9. - P.
3118-3127.
. Shi,
H., Hoffman, B.E., Lis, J.T. RNA aptamers as effective protein antagonists in a
multicellular organism // Proc. Natl. Acad. Sci. U. S. A. - 1999. - V. 96. - N
18. - P. 10033-10038.
. Ng,
E.W., Shima, D.T., Calias, P., Cunningham, E.T., Jr., Guyer, D.R., Adamis, A.P.
Pegaptanib, a targeted anti-VEGF aptamer for ocular vascular disease // Nat.
Rev. Drug. Discov. - 2006. - V. 5. - N 2. - P. 123-132.
. Zhou,
J., Swiderski, P., Li, H., Zhang, J., Neff, C.P., Akkina, R., Rossi, J.J.
Selection, characterization and application of new RNA HIV gp 120 aptamers for
facile delivery of Dicer substrate siRNAs into HIV infected cells // Nucleic
Acids Res. - 2009. - V. 37. - N 9. - P. 3094-3109.
. Le
Floch, F., Ho, H.A., Leclerc, M. Label-free electrochemical detection of
protein based on a ferrocene-bearing cationic polythiophene and aptamer //
Anal. Chem. - 2006. - V. 78. - N 13. - P. 4727-4731.
. Huang,
Y., Nie, X.M., Gan, S.L., Jiang, J.H., Shen, G.L., Yu, R.Q. Electrochemical
immunosensor of platelet-derived growth factor with aptamer-primed polymerase
amplification // Anal. Biochem. - 2008. - V. 382. - N 1. - P. 16-22.
. Radi,
A.E., Acero Sanchez, J.L., Baldrich, E., O'Sullivan, C.K. Reagentless,
reusable, ultrasensitive electrochemical molecular beacon aptasensor // J. Am.
Chem. Soc. - 2006. - V. 128. - N 1. - P. 117-124.
. Liao,
W., Randall, B.A., Alba, N.A., Cui, X.T. Conducting polymer-based impedimetric
aptamer biosensor for in situ detection // Anal. Bioanal. Chem. - 2008. - V.
392. - N 5. - P. 861-864.
. Liao,
W., Cui, X.T. Reagentless aptamer based impedance biosensor for monitoring a
neuro-inflammatory cytokine PDGF // Biosens. Bioelectron. - 2007. - V. 23. - N
2. - P. 218-224.
. So,
H.M., Won, K., Kim, Y.H., Kim, B.K., Ryu, B.H., Na, P.S., Kim, H., Lee, J.O.
Single-walled carbon nanotube biosensors using aptamers as molecular recognition
elements // J. Am. Chem. Soc. - 2005. - V. 127. - N 34. - P. 11906-11907.
. Cheng,
A.K., Ge, B., Yu, H.Z. Aptamer-based biosensors for label-free voltammetric
detection of lysozyme // Anal. Chem. - 2007. - V. 79. - N 14. - P. 5158-5164.
. Bang,
G.S., Cho, S., Kim, B.G. A novel electrochemical detection method for aptamer
biosensors // Biosens. Bioelectron. - 2005. - V. 21. - N 6. - P. 863-870.
. Deng,
C., Chen, J., Nie, Z., Wang, M., Chu, X., Chen, X., Xiao, X., Lei, C., Yao, S.
Impedimetric aptasensor with femtomolar sensitivity based on the enlargement of
surface-charged gold nanoparticles // Anal. Chem. - 2009. - V. 81. - N 2. - P.
739-745.
. Polsky,
R., Gill, R., Kaganovsky, L., Willner, I. Nucleic acid-functionalized Pt
nanoparticles: Catalytic labels for the amplified electrochemical detection of
biomolecules // Anal. Chem. - 2006. - V. 78. - N 7. - P. 2268-2271.
. Feng,
K., Kang, Y., Zhao, J.J., Liu, Y.L., Jiang, J.H., Shen, G.L., Yu, R.Q.
Electrochemical immunosensor with aptamer-based enzymatic amplification //
Anal. Biochem. - 2008. - V. 378. - N 1. - P. 38-42.
. Zhou,
L., Ou, L.J., Chu, X., Shen, G.L., Yu, R.Q. Aptamer-based rolling circle
amplification: a platform for electrochemical detection of protein // Anal.
Chem. - 2007. - V. 79. - N 19. - P. 7492-7500.
. He,
P., Shen, L., Cao, Y., Li, D. Ultrasensitive electrochemical detection of
proteins by amplification of aptamer-nanoparticle bio bar codes // Anal. Chem.
- 2007. - V. 79. - N 21. - P. 8024-8029.
. Li,
B., Wang, Y., Wei, H., Dong, S. Amplified electrochemical aptasensor taking
AuNPs based sandwich sensing platform as a model // Biosens. Bioelectron. -
2008. - V. 23. - N 7. - P. 965-970.
. Yamamoto,
R., Baba, T., Kumar, P.K. Molecular beacon aptamer fluoresces in the presence
of Tat protein of HIV-1 // Genes Cells. - 2000. - V. 5. - N 5. - P. 389-396.
. Levy,
M., Cater, S.F., Ellington, A.D. Quantum-dot aptamer beacons for the detection
of proteins // Chembiochem. - 2005. - V. 6. - N 12. - P. 2163-2166.
. Yang,
C.J., Jockusch, S., Vicens, M., Turro, N.J., Tan, W. Light-switching excimer
probes for rapid protein monitoring in complex biological fluids // Proc. Natl.
Acad. Sci. U. S. A. - 2005. - V. 102. - N 48. - P. 17278-17283.
. Wei,
H., Li, B., Li, J., Wang, E., Dong, S. Simple and sensitive aptamer-based
colorimetric sensing of protein using unmodified gold nanoparticle probes //
Chem. Commun. (Camb). - 2007. - N 36. - P. 3735-3737.
. Huang,
C.C., Huang, Y.F., Cao, Z., Tan, W., Chang, H.T. Aptamer-modified gold
nanoparticles for colorimetric determination of platelet-derived growth factors
and their receptors // Anal. Chem. - 2005. - V. 77. - N 17. - P. 5735-5741.
. Pavlov,
V., Xiao, Y., Shlyahovsky, B., Willner, I. Aptamer-functionalized Au
nanoparticles for the amplified optical detection of thrombin // J. Am. Chem.
Soc. - 2004. - V. 126. - N 38. - P. 11768-11769.
. Li,
Y.Y., Zhang, C., Li, B.S., Zhao, L.F., Li, X.B., Yang, W.J., Xu, S.Q.
Ultrasensitive densitometry detection of cytokines with nanoparticle-modified
aptamers // Clin. Chem. - 2007. - V. 53. - N 6. - P. 1061-1066.
. Tombelli,
S., Minunni, M., Luzi, E., Mascini, M. Aptamer-based biosensors for the
detection of HIV-1 Tat protein // Bioelectrochemistry. - 2005. - V. 67. - N 2.
- P. 135-141.
. Ogasawara,
D., Hachiya, N.S., Kaneko, K., Sode, K., Ikebukuro, K. Detection system based
on the conformational change in an aptamer and its application to simple
bound/free separation // Biosens. Bioelectron. - 2009. - V. 24. - N 5. - P.
1372-1376.
. Li,
Y., Lee, H.J., Corn, R.M. Detection of protein biomarkers using RNA aptamer
microarrays and enzymatically amplified surface plasmon resonance imaging //
Anal. Chem. - 2007. - V. 79. - N 3. - P. 1082-1088.
. Hianik,
T., Ostatna, V., Zajacova, Z., Stoikova, E., Evtugyn, G. Detection of
aptamer-protein interactions using QCM and electrochemical indicator methods //
Bioorg. Med. Chem. Lett. - 2005. - V. 15. - N 2. - P. 291-295.
. Gronewold,
T.M., Glass, S., Quandt, E., Famulok, M. Monitoring complex formation in the
blood-coagulation cascade using aptamer-coated SAW sensors // Biosens.
Bioelectron. - 2005. - V. 20. - N 10. - P. 2044-2052.
. Treitz,
G., Gronewold, T.M., Quandt, E., Zabe-Kuhn, M. Combination of a SAW-biosensor
with MALDI mass spectrometric analysis // Biosens. Bioelectron. - 2008. - V.
23. - N 10. - P. 1496-1502.
. Savran,
C.A., Knudsen, S.M., Ellington, A.D., Manalis, S.R. Micromechanical detection
of proteins using aptamer-based receptor molecules // Anal. Chem. - 2004. - V.
76. - N 11. - P. 3194-3198.
. Hwang,
K.S., Lee, S.M., Eom, K., Lee, J.H., Lee, Y.S., Park, J.H., Yoon, D.S., Kim,
T.S. Nanomechanical microcantilever operated in vibration modes with use of RNA
aptamer as receptor molecules for label-free detection of HCV helicase //
Biosens. Bioelectron. - 2007. - V. 23. - N 4. - P. 459-465.
. Soundararajan,
S., Wang, L., Sridharan, V., Chen, W., Courtenay-Luck, N., Jones, D., Spicer,
E.K., Fernandes, D.J. Plasma membrane nucleolin is a receptor for the
anticancer aptamer AS1411 in MV4-11 leukemia cells // Mol. Pharmacol. - 2009. -
V. 76. - N 5. - P. 984-991.
. Bates,
P.J., Kahlon, J.B., Thomas, S.D., Trent, J.O., Miller, D.M. Antiproliferative
activity of G-rich oligonucleotides correlates with protein binding // J. Biol.
Chem. - 1999. - V. 274. - N 37. - P. 26369-26377.
. Ikebukuro,
K., Okumura, Y., Sumikura, K., Karube, I. Novel strategy for DNA aptamers
inhibiting enzymatic activity using algorithm mimicking evolution // Nucleic
Acids Res. Suppl. - 2003. - N 3. - P. 205-206.
. Becker,
R.C., Oney, S., Becker, K.C., Sullenger, B. Antidote-controlled antithrombotic
therapy targeting factor IXa and von Willebrand factor // Ann. N. Y. Acad. Sci.
- 2009. - V. 1175. - P. 61-70.
. Rusconi,
C.P., Scardino, E., Layzer, J., Pitoc, G.A., Ortel, T.L., Monroe, D.,
Sullenger, B.A. RNA aptamers as reversible antagonists of coagulation factor
IXa // Nature. - 2002. - V. 419. - N 6902. - P. 90-94.
. Alexander,
J.H., Hafley, G., Harrington, R.A., Peterson, E.D., Ferguson, T.B., Jr.,
Lorenz, T.J., Goyal, A., Gibson, M., Mack, M.J., Gennevois, D., Califf, R.M.,
Kouchoukos, N.T. Efficacy and safety of edifoligide, an E2F transcription
factor decoy, for prevention of vein graft failure following coronary artery
bypass graft surgery: PREVENT IV: a randomized controlled trial // JAMA. -
2005. - V. 294. - N 19. - P. 2446-2454.
. Giangrande,
P.H., Zhang, J., Tanner, A., Eckhart, A.D., Rempel, R.E., Andrechek, E.R.,
Layzer, J.M., Keys, J.R., Hagen, P.O., Nevins, J.R., Koch, W.J., Sullenger,
B.A. Distinct roles of E2F proteins in vascular smooth muscle cell
proliferation and intimal hyperplasia // Proc. Natl. Acad. Sci. U. S. A. -
2007. - V. 104. - N 32. - P. 12988-12993.
. Yamamoto,
R., Katahira, M., Nishikawa, S., Baba, T., Taira, K., Kumar, P.K. A novel RNA
motif that binds efficiently and specifically to the Ttat protein of HIV and
inhibits the trans-activation by Tat of transcription in vitro and in vivo //
Genes Cells. - 2000. - V. 5. - N 5. - P. 371-388.
. Sullenger,
B.A., Gallardo, H.F., Ungers, G.E., Gilboa, E. Analysis of trans-acting
response decoy RNA-mediated inhibition of human immunodeficiency virus type 1
transactivation // J. Virol. - 1991. - V. 65. - N 12. - P. 6811-6816.
. Lebruska,
L.L., Maher, L.J., 3rd Selection and characterization of an RNA decoy for
transcription factor NF-kappa B // Biochemistry. - 1999. - V. 38. - N 10. - P.
3168-3174.
. Wurster,
S.E., Maher, L.J., 3rd Selection and characterization of anti-NF-kappaB p65 RNA
aptamers // RNA. - 2008. - V. 14. - N 6. - P. 1037-1047.
. Lee,
S.W., Sullenger, B.A. Isolation of a nuclease-resistant decoy RNA that
selectively blocks autoantibody binding to insulin receptors on human
lymphocytes // J. Exp. Med. - 1996. - V. 184. - N 2. - P. 315-324.
. Santulli-Marotto,
S., Nair, S.K., Rusconi, C., Sullenger, B., Gilboa, E. Multivalent RNA aptamers
that inhibit CTLA-4 and enhance tumor immunity // Cancer Res. - 2003. - V. 63.
- N 21. - P. 7483-7489.
. Kim,
Y., Cao, Z., Tan, W. Molecular assembly for high-performance bivalent nucleic
acid inhibitor // Proc. Natl. Acad. Sci. U. S. A. - 2008. - V. 105. - N 15. -
P. 5664-5669.
. Boucard,
D., Toulme, J.J., Di Primo, C. Bimodal loop-loop interactions increase the
affinity of RNA aptamers for HIV-1 RNA structures // Biochemistry. - 2006. - V.
45. - N 5. - P. 1518-1524.
. McNamara,
J.O., Kolonias, D., Pastor, F., Mittler, R.S., Chen, L., Giangrande, P.H.,
Sullenger, B., Gilboa, E. Multivalent 4-1BB binding aptamers costimulate CD8+ T
cells and inhibit tumor growth in mice // J. Clin. Invest. - 2008. - V. 118. -
N 1. - P. 376-386.
. Tian,
L., Heyduk, T. Bivalent ligands with long nanometer-scale flexible linkers //
Biochemistry. - 2009. - V. 48. - N 2. - P. 264-275.
. Chu,
T.C., Twu, K.Y., Ellington, A.D., Levy, M. Aptamer mediated siRNA delivery //
Nucleic Acids Res. - 2006. - V. 34. - N 10. - e73.
. McNamara,
J.O., 2nd, Andrechek, E.R., Wang, Y., Viles, K.D., Rempel, R.E., Gilboa, E.,
Sullenger, B.A., Giangrande, P.H. Cell type-specific delivery of siRNAs with
aptamer-siRNA chimeras // Nat. Biotechnol. - 2006. - V. 24. - N 8. - P.
1005-1015.
. Optical
properties of nucleic acids, absorption and circular dichroism spectra //
Handbook of Biochemistry and Molecular Biology: Nucleic Acids / Ed. P.N. Borer.
- Cleveland, OH: CRS Press, 1975. - V. 1.
. Reddy,
M.P., Hanna, N.B., Farooqui, F. Ultrafast cleavage and deprotection of
oligonucleotides synthesis and use of CAc derivatives //
Nucleosides, Nucleotides, Nucl. Acids. - 1997. - V. 16. - N 7-9. - P.
1589-1598.
. Hall,
K.B., Kranz, J.K. Nitrocellulose filter binding for determination of
dissociation constants // Methods Mol. Biol. - 1999. - V. 118. - P. 105-114.
. Gussow,
D., Clackson, T. Direct clone characterization from plaques and colonies by the
polymerase chain reaction // Nucleic Acids Res. - 1989. - V. 17. - N 10. - P.
4000.
. Ponomarenko,
N.A., Durova, O.M., Vorobiev, II, Belogurov, A.A., Jr., Kurkova, I.N.,
Petrenko, A.G., Telegin, G.B., Suchkov, S.V., Kiselev, S.L., Lagarkova, M.A.,
Govorun, V.M., Serebryakova, M.V., Avalle, B., Tornatore, P., Karavanov, A.,
Morse, H.C., 3rd, Thomas, D., Friboulet, A., Gabibov, A.G. Autoantibodies to
myelin basic protein catalyze site-specific degradation of their antigen //
Proc. Natl. Acad. Sci. U. S. A. - 2006. - V. 103. - N 2. - P. 281-286.
. Ponomarenko,
N.A., Durova, O.M., Vorobiev, II, Belogurov, A.A., Telegin, G.B., Suchkov,
S.V., Misikov, V.K., Morse, H.C., 3rd, Gabibov, A.G. Catalytic activity of
autoantibodies toward myelin basic protein correlates with the scores on the
multiple sclerosis expanded disability status scale // Immunol. Lett. - 2006. -
V. 103. - N 1. - P. 45-50.
. Belogurov,
A.A., Jr., Kurkova, I.N., Friboulet, A., Thomas, D., Misikov, V.K., Zakharova,
M.Y., Suchkov, S.V., Kotov, S.V., Alehin, A.I., Avalle, B., Souslova, E.A.,
Morse, H.C., 3rd, Gabibov, A.G., Ponomarenko, N.A. Recognition and degradation
of myelin basic protein peptides by serum autoantibodies: novel biomarker for
multiple sclerosis // J. Immunol. - 2008. - V. 180. - N 2. - P. 1258-1267.
. Polosukhina,
D.I., Kanyshkova, T.G., Doronin, B.M., Tyshkevich, O.B., Buneva, V.N., Boiko,
A.N., Gusev, E.I., Favorova, O.O., Nevinsky, G.A. Hydrolysis of myelin basic
protein by polyclonal catalytic IgGs from the sera of patients with multiple
sclerosis // J. Cell. Mol. Med. - 2004. - V. 8. - N 3. - P. 359-368.
. Polosukhina,
D.I., Kanyshkova, T.G., Doronin, B.M., Tyshkevich, O.B., Buneva, V.N., Boiko,
A.N., Gusev, E.I., Nevinsky, G.A., Favorova, O.O. Metal-dependent hydrolysis of
myelin basic protein by IgGs from the sera of patients with multiple sclerosis
// Immunol. Lett. - 2006. - V. 103. - N 1. - P. 75-81.
. Lupold,
S.E., Hicke, B.J., Lin, Y., Coffey, D.S. Identification and characterization of
nuclease-stabilized RNA molecules that bind human prostate cancer cells via the
prostate-specific membrane antigen // Cancer Res. - 2002. - V. 62. - N 14. - P.
4029-4033.
. Wincott,
F., DiRenzo, A., Shaffer, C., Grimm, S., Tracz, D., Workman, C., Sweedler, D.,
Gonzalez, C., Scaringe, S., Usman, N. Synthesis, deprotection, analysis and
purification of RNA and ribozymes // Nucleic Acids Res. - 1995. - V. 23. - N
14. - P. 2677-2684.
170. www.glenresearch.com
. PCR
primer design and reaction optimization // Molecular Biology Techniques Manual
/ Ed. V.E. Coyne, M.D. James, S.J. Reid, E.P. Rybicki. - University of Cape
Town, 2001. - режим доступа:
http://web.archive.org/web/20080822021839/www.mcb.uct.ac.za/pcroptim.htm
172. www.eu.idtdna.com/analyzer/applications/oligoanalyzer/Default.aspx
. Щелкунов, С.Н.
Генетическая инженерия: учеб.-справ. пособие. - Новосибирск: Сибирское
университетское издательство, 2004. - С. 118-119.